(Redirected from Sodium ethanoate)

|
|

|
|

|
|
| Names | |
|---|---|
| Preferred IUPAC name
Sodium acetate |
|
| Other names
Hot ice (sodium acetate trihydrate) |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
|
Beilstein Reference |
3595639 |
| ChEBI |
|
| ChEMBL |
|
| ChemSpider |
|
| DrugBank |
|
| ECHA InfoCard | 100.004.386 |
| EC Number |
|
| E number | E262 (preservatives) |
|
Gmelin Reference |
20502 |
| KEGG |
|
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
C2H3NaO2 |
| Molar mass | 82.034 g·mol−1 |
| Appearance | White deliquescent powder |
| Odor | Vinegar (acetic acid) odor when heated to decomposition[1] |
| Density | 1.528 g/cm3 (20 °C, anhydrous) 1.45 g/cm3 (20 °C, trihydrate)[2] |
| Melting point | 324 °C (615 °F; 597 K) (anhydrous) 58 °C (136 °F; 331 K) (trihydrate) |
| Boiling point | 881.4 °C (1,618.5 °F; 1,154.5 K) (anhydrous) 122 °C (252 °F; 395 K) (trihydrate) decomposes |
|
Solubility in water |
Anhydrous: 119 g/100 mL (0 °C) 123.3 g/100 mL (20 °C) 125.5 g/100 mL (30 °C) 137.2 g/100 mL (60 °C) 162.9 g/100 mL (100 °C) Trihydrate: 32.9 g/100 mL (-10 °C) 36.2 g/100 mL (0 °C) 46.4 g/100 mL (20 °C) 82 g/100 mL (50 °C)[3] |
| Solubility | Soluble in alcohol, hydrazine, SO2[4] |
| Solubility in methanol | 16 g/100 g (15 °C) 16.55 g/100 g (67.7 °C)[4] |
| Solubility in ethanol | Trihydrate: 5.3 g/100 mL |
| Solubility in acetone | 0.5 g/kg (15 °C)[4] |
| Acidity (pKa) | 51 (20 °C)[4] 4.75 (when mixed with CH3COOH as a buffer)[5] |
| Basicity (pKb) | 9.25 |
|
Magnetic susceptibility (χ) |
−37.6·10−6 cm3/mol |
|
Refractive index (nD) |
1.464 |
| Structure | |
|
Crystal structure |
Monoclinic |
| Thermochemistry | |
|
Heat capacity (C) |
100.83 J/mol·K (anhydrous)[6] 229 J/mol·K (trihydrate)[7] |
|
Std molar |
138.1 J/mol·K (anhydrous)[6] 262 J/mol·K (trihydrate)[2] |
|
Std enthalpy of |
−709.32 kJ/mol (anhydrous)[4] −1604 kJ/mol (trihydrate)[2] |
|
Gibbs free energy (ΔfG⦵) |
−607.7 kJ/mol (anhydrous)[4] |
| Pharmacology | |
|
ATC code |
B05XA08 (WHO) |
| Hazards | |
| Occupational safety and health (OHS/OSH): | |
|
Main hazards |
Irritant |
| NFPA 704 (fire diamond) |
1 1 0 |
| Flash point | >250 °C (482 °F; 523 K)[5] |
|
Autoignition |
600 °C (1,112 °F; 873 K)[5] |
| Lethal dose or concentration (LD, LC): | |
|
LD50 (median dose) |
3530 mg/kg (oral, rat) |
| Safety data sheet (SDS) | External MSDS |
| Related compounds | |
|
Other anions |
Sodium formate Sodium propionate |
|
Other cations |
Potassium acetate Calcium acetate |
|
Related compounds |
Sodium diacetate |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Sodium acetate, CH3COONa, also abbreviated NaOAc,[8] is the sodium salt of acetic acid. This colorless deliquescent salt has a wide range of uses.
Applications[edit]
Biotechnological[edit]
Sodium acetate is used as the carbon source for culturing bacteria. Sodium acetate is also useful for increasing yields of DNA isolation by ethanol precipitation.
Industrial[edit]
Sodium acetate is used in the textile industry to neutralize sulfuric acid waste streams and also as a photoresist while using aniline dyes. It is also a pickling agent in chrome tanning and helps to impede vulcanization of chloroprene in synthetic rubber production. In processing cotton for disposable cotton pads, sodium acetate is used to eliminate the buildup of static electricity.
Concrete longevity[edit]
Sodium acetate is used to mitigate water damage to concrete by acting as a concrete sealant, while also being environmentally benign and cheaper than the commonly used epoxy alternative for sealing concrete against water permeation.[9]
Food[edit]
Sodium acetate may be added to food as a seasoning, sometimes in the form of sodium diacetate, a one-to-one complex of sodium acetate and acetic acid,[10] given the E-number E262. It is often used to give potato chips a salt and vinegar flavour, and may be used as a substitute for vinegar itself on potato chips as it doesn’t add moisture to the final product.[11] Sodium acetate (anhydrous) is widely used as a shelf-life extending agent, pH control agent[12] It is safe to eat at low concentration.[13]
Buffer solution[edit]
A solution of sodium acetate (a basic salt of acetic acid) and acetic acid can act as a buffer to keep a relatively constant pH level. This is useful especially in biochemical applications where reactions are pH-dependent in a mildly acidic range (pH 4–6).
Heating pad[edit]
Sodium acetate is also used in heating pads, hand warmers, and hot ice. Sodium acetate trihydrate crystals melt at 58–58.4 °C (136.4–137.1 °F),[14][15] dissolving in their water of crystallization. When they are heated past the melting point and subsequently allowed to cool, the aqueous solution becomes supersaturated. This solution is capable of cooling to room temperature without forming crystals. By pressing on a metal disc within the heating pad, a nucleation center is formed, causing the solution to crystallize back into solid sodium acetate trihydrate. The bond-forming process of crystallization is exothermic.[16] The latent heat of fusion is about 264–289 kJ/kg.[14] Unlike some types of heat packs, such as those dependent upon irreversible chemical reactions, a sodium acetate heat pack can be easily reused by immersing the pack in boiling water for a few minutes, until the crystals are completely dissolved, and allowing the pack to slowly cool to room temperature.[17]
Preparation[edit]
A crystal of sodium acetate trihydrate (length 1.7 centimetres)
For laboratory use, sodium acetate is inexpensive and usually purchased instead of being synthesized. It is sometimes produced in a laboratory experiment by the reaction of acetic acid, commonly in the 5–8% solution known as vinegar, with sodium carbonate («washing soda»), sodium bicarbonate («baking soda»), or sodium hydroxide («lye», or «caustic soda»). Any of these reactions produce sodium acetate and water. When a sodium and carbonate ion-containing compound is used as the reactant, the carbonate anion from sodium bicarbonate or carbonate, reacts with the hydrogen from the carboxyl group (-COOH) in acetic acid, forming carbonic acid. Carbonic acid readily decomposes under normal conditions into gaseous carbon dioxide and water. This is the reaction taking place in the well-known «volcano» that occurs when the household products, baking soda and vinegar, are combined.
- CH3COOH + NaHCO3 → CH3COONa + H2CO
3 - H2CO
3 → CO
2 + H
2O
Industrially, sodium acetate trihydrate is prepared by reacting acetic acid with sodium hydroxide using water as the solvent.
- CH3COOH + NaOH → CH3COONa + H2O
Structure[edit]
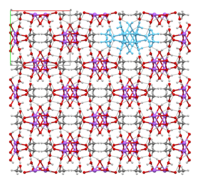
The crystal structure of anhydrous sodium acetate has been described as alternating sodium-carboxylate and methyl group layers.[18] Sodium acetate trihydrate’s structure consists of distorted octahedral coordination at sodium. Adjacent octahedra share edges to form one-dimensional chains. Hydrogen bonding in two dimensions between acetate ions and water of hydration links the chains into a three-dimensional network.[19][20]
| Degree of hydration | Na coordination | Strongly bonded aggregation | Weakly bonded aggregation |
|---|---|---|---|
| Anhydrous[18] | 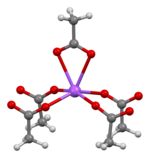
|
 2D sheet |
 sheets stacked with hydrophobic surfaces in contact |
| Trihydrate[19][20] | 
|
 1D chain |
 chains linked by hydrogen bonds (one chain highlighted in light blue) |
Reactions[edit]
Sodium acetate can be used to form an ester with an alkyl halide such as bromoethane:
- CH3COONa + BrCH2CH3 → CH3COOCH2CH3 + NaBr
Sodium acetate undergoes decarboxylation to form methane (CH4) under forcing conditions (pyrolysis in the presence of sodium hydroxide):
- CH3COONa + NaOH → CH4 + Na2CO3
Calcium oxide is the typical catalyst used for this reaction.
Cesium salts also catalyze this reaction.[citation needed]
References[edit]
- ^ «Sodium Acetate». International Chemical Safety Cards. National Institute of Occupational Safety and Health. 2018-09-18.
- ^ a b c «sodium acetate trihydrate». chemister.ru.
- ^ Seidell, Atherton; Linke, William F. (1952). Solubilities of Inorganic and Organic Compounds. Van Nostrand.
- ^ a b c d e f «sodium acetate». chemister.ru.
- ^ a b c Sigma-Aldrich Co., Sodium acetate. Retrieved on 2014-06-07.
- ^ a b Acetic acid, sodium salt in Linstrom, Peter J.; Mallard, William G. (eds.); NIST Chemistry WebBook, NIST Standard Reference Database Number 69, National Institute of Standards and Technology, Gaithersburg (MD) (retrieved 2014-05-25)
- ^ Acetic acid, sodium salt, hydrate (1:1:3) in Linstrom, Peter J.; Mallard, William G. (eds.); NIST Chemistry WebBook, NIST Standard Reference Database Number 69, National Institute of Standards and Technology, Gaithersburg (MD) (retrieved 2014-05-25)
- ^ Clayden, Jonathan; Greeves, Nick; Warren, Stuart; Wothers, Peter (2001). Organic Chemistry (1st ed.). Oxford University Press. ISBN 978-0-19-850346-0.
- ^ «Potato Chip Flavoring Boosts Longevity Of Concrete». Science Daily. 8 August 2007.
- ^ AG, Jungbunzlauer Suisse. «Sodium Diacetate – Jungbunzlauer». www.jungbunzlauer.com.
- ^ Austen, Ian (2018-06-09). «The Secret Story of Salt and Vinegar Chips: the Canada Letter». The New York Times. ISSN 0362-4331. Retrieved 2021-11-23.
- ^ «Food Additive «Sodium Acetate (Anhydrous)» | Products». Mitsubishi Chemical Corporation. Retrieved 16 September 2020.
- ^ Mohammadzadeh-Aghdash, Hossein; Sohrabi, Yousef; Mohammadi, Ali; Shanehbandi, Dariush; Dehghan, Parvin; Ezzati Nazhad Dolatabadi, Jafar (15 August 2018). «Safety assessment of sodium acetate, sodium diacetate and potassium sorbate food additives». Food Chemistry. 257: 211–215. doi:10.1016/j.foodchem.2018.03.020. ISSN 0308-8146. PMID 29622200. S2CID 4596295. Retrieved 16 September 2020.
- ^ a b Ibrahim Dincer and Marc A. Rosen. Thermal Energy Storage: Systems and Applications, page 155
- ^ Courty JM, Kierlik E, Les chaufferettes chimiques, Pour la Science, décembre 2008, pp. 108–110
- ^ «Crystallization of Supersaturated Sodium Acetate». Journal of Chemical Education. 2015-07-19.
- ^ «How do sodium acetate heat pads work?». HowStuffWorks. April 2000. Retrieved 2007-09-03.
- ^ a b Hsu, Leh-Yeh; Nordman, C. E. (1983). «Structures of two forms of sodium acetate, Na+.C2H3O2−«. Acta Crystallogr. C. 39 (6): 690–694. doi:10.1107/S0108270183005946.
- ^ a b Cameron, T. S.; Mannan, K. M.; Rahman, M. O. (1976). «The crystal structure of sodium acetate trihydrate». Acta Crystallogr. B. 32: 87–90. doi:10.1107/S0567740876002367.
- ^ a b Wei, K.-T.; Ward, D. L. (1977). «Sodium acetate trihydrate: a redetermination». Acta Crystallogr. B. 33 (2): 522–526. doi:10.1107/S0567740877003975.
External links[edit]
- Hot Ice – Instructions, Pictures, and Videos
- How Sodium Acetate heating pads work
- Lavars, Nick (2021-09-15). «Sodium acetate acts as a potential fountain of youth for aging bones». New Atlas. Retrieved 2021-09-16.
{{cite web}}: CS1 maint: url-status (link)
(Redirected from Sodium ethanoate)

|
|

|
|

|
|
| Names | |
|---|---|
| Preferred IUPAC name
Sodium acetate |
|
| Other names
Hot ice (sodium acetate trihydrate) |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
|
Beilstein Reference |
3595639 |
| ChEBI |
|
| ChEMBL |
|
| ChemSpider |
|
| DrugBank |
|
| ECHA InfoCard | 100.004.386 |
| EC Number |
|
| E number | E262 (preservatives) |
|
Gmelin Reference |
20502 |
| KEGG |
|
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
C2H3NaO2 |
| Molar mass | 82.034 g·mol−1 |
| Appearance | White deliquescent powder |
| Odor | Vinegar (acetic acid) odor when heated to decomposition[1] |
| Density | 1.528 g/cm3 (20 °C, anhydrous) 1.45 g/cm3 (20 °C, trihydrate)[2] |
| Melting point | 324 °C (615 °F; 597 K) (anhydrous) 58 °C (136 °F; 331 K) (trihydrate) |
| Boiling point | 881.4 °C (1,618.5 °F; 1,154.5 K) (anhydrous) 122 °C (252 °F; 395 K) (trihydrate) decomposes |
|
Solubility in water |
Anhydrous: 119 g/100 mL (0 °C) 123.3 g/100 mL (20 °C) 125.5 g/100 mL (30 °C) 137.2 g/100 mL (60 °C) 162.9 g/100 mL (100 °C) Trihydrate: 32.9 g/100 mL (-10 °C) 36.2 g/100 mL (0 °C) 46.4 g/100 mL (20 °C) 82 g/100 mL (50 °C)[3] |
| Solubility | Soluble in alcohol, hydrazine, SO2[4] |
| Solubility in methanol | 16 g/100 g (15 °C) 16.55 g/100 g (67.7 °C)[4] |
| Solubility in ethanol | Trihydrate: 5.3 g/100 mL |
| Solubility in acetone | 0.5 g/kg (15 °C)[4] |
| Acidity (pKa) | 51 (20 °C)[4] 4.75 (when mixed with CH3COOH as a buffer)[5] |
| Basicity (pKb) | 9.25 |
|
Magnetic susceptibility (χ) |
−37.6·10−6 cm3/mol |
|
Refractive index (nD) |
1.464 |
| Structure | |
|
Crystal structure |
Monoclinic |
| Thermochemistry | |
|
Heat capacity (C) |
100.83 J/mol·K (anhydrous)[6] 229 J/mol·K (trihydrate)[7] |
|
Std molar |
138.1 J/mol·K (anhydrous)[6] 262 J/mol·K (trihydrate)[2] |
|
Std enthalpy of |
−709.32 kJ/mol (anhydrous)[4] −1604 kJ/mol (trihydrate)[2] |
|
Gibbs free energy (ΔfG⦵) |
−607.7 kJ/mol (anhydrous)[4] |
| Pharmacology | |
|
ATC code |
B05XA08 (WHO) |
| Hazards | |
| Occupational safety and health (OHS/OSH): | |
|
Main hazards |
Irritant |
| NFPA 704 (fire diamond) |
1 1 0 |
| Flash point | >250 °C (482 °F; 523 K)[5] |
|
Autoignition |
600 °C (1,112 °F; 873 K)[5] |
| Lethal dose or concentration (LD, LC): | |
|
LD50 (median dose) |
3530 mg/kg (oral, rat) |
| Safety data sheet (SDS) | External MSDS |
| Related compounds | |
|
Other anions |
Sodium formate Sodium propionate |
|
Other cations |
Potassium acetate Calcium acetate |
|
Related compounds |
Sodium diacetate |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Sodium acetate, CH3COONa, also abbreviated NaOAc,[8] is the sodium salt of acetic acid. This colorless deliquescent salt has a wide range of uses.
Applications[edit]
Biotechnological[edit]
Sodium acetate is used as the carbon source for culturing bacteria. Sodium acetate is also useful for increasing yields of DNA isolation by ethanol precipitation.
Industrial[edit]
Sodium acetate is used in the textile industry to neutralize sulfuric acid waste streams and also as a photoresist while using aniline dyes. It is also a pickling agent in chrome tanning and helps to impede vulcanization of chloroprene in synthetic rubber production. In processing cotton for disposable cotton pads, sodium acetate is used to eliminate the buildup of static electricity.
Concrete longevity[edit]
Sodium acetate is used to mitigate water damage to concrete by acting as a concrete sealant, while also being environmentally benign and cheaper than the commonly used epoxy alternative for sealing concrete against water permeation.[9]
Food[edit]
Sodium acetate may be added to food as a seasoning, sometimes in the form of sodium diacetate, a one-to-one complex of sodium acetate and acetic acid,[10] given the E-number E262. It is often used to give potato chips a salt and vinegar flavour, and may be used as a substitute for vinegar itself on potato chips as it doesn’t add moisture to the final product.[11] Sodium acetate (anhydrous) is widely used as a shelf-life extending agent, pH control agent[12] It is safe to eat at low concentration.[13]
Buffer solution[edit]
A solution of sodium acetate (a basic salt of acetic acid) and acetic acid can act as a buffer to keep a relatively constant pH level. This is useful especially in biochemical applications where reactions are pH-dependent in a mildly acidic range (pH 4–6).
Heating pad[edit]
Sodium acetate is also used in heating pads, hand warmers, and hot ice. Sodium acetate trihydrate crystals melt at 58–58.4 °C (136.4–137.1 °F),[14][15] dissolving in their water of crystallization. When they are heated past the melting point and subsequently allowed to cool, the aqueous solution becomes supersaturated. This solution is capable of cooling to room temperature without forming crystals. By pressing on a metal disc within the heating pad, a nucleation center is formed, causing the solution to crystallize back into solid sodium acetate trihydrate. The bond-forming process of crystallization is exothermic.[16] The latent heat of fusion is about 264–289 kJ/kg.[14] Unlike some types of heat packs, such as those dependent upon irreversible chemical reactions, a sodium acetate heat pack can be easily reused by immersing the pack in boiling water for a few minutes, until the crystals are completely dissolved, and allowing the pack to slowly cool to room temperature.[17]
Preparation[edit]
A crystal of sodium acetate trihydrate (length 1.7 centimetres)
For laboratory use, sodium acetate is inexpensive and usually purchased instead of being synthesized. It is sometimes produced in a laboratory experiment by the reaction of acetic acid, commonly in the 5–8% solution known as vinegar, with sodium carbonate («washing soda»), sodium bicarbonate («baking soda»), or sodium hydroxide («lye», or «caustic soda»). Any of these reactions produce sodium acetate and water. When a sodium and carbonate ion-containing compound is used as the reactant, the carbonate anion from sodium bicarbonate or carbonate, reacts with the hydrogen from the carboxyl group (-COOH) in acetic acid, forming carbonic acid. Carbonic acid readily decomposes under normal conditions into gaseous carbon dioxide and water. This is the reaction taking place in the well-known «volcano» that occurs when the household products, baking soda and vinegar, are combined.
- CH3COOH + NaHCO3 → CH3COONa + H2CO
3 - H2CO
3 → CO
2 + H
2O
Industrially, sodium acetate trihydrate is prepared by reacting acetic acid with sodium hydroxide using water as the solvent.
- CH3COOH + NaOH → CH3COONa + H2O
Structure[edit]
The crystal structure of anhydrous sodium acetate has been described as alternating sodium-carboxylate and methyl group layers.[18] Sodium acetate trihydrate’s structure consists of distorted octahedral coordination at sodium. Adjacent octahedra share edges to form one-dimensional chains. Hydrogen bonding in two dimensions between acetate ions and water of hydration links the chains into a three-dimensional network.[19][20]
| Degree of hydration | Na coordination | Strongly bonded aggregation | Weakly bonded aggregation |
|---|---|---|---|
| Anhydrous[18] | 
|
 2D sheet |
 sheets stacked with hydrophobic surfaces in contact |
| Trihydrate[19][20] | 
|
 1D chain |
 chains linked by hydrogen bonds (one chain highlighted in light blue) |
Reactions[edit]
Sodium acetate can be used to form an ester with an alkyl halide such as bromoethane:
- CH3COONa + BrCH2CH3 → CH3COOCH2CH3 + NaBr
Sodium acetate undergoes decarboxylation to form methane (CH4) under forcing conditions (pyrolysis in the presence of sodium hydroxide):
- CH3COONa + NaOH → CH4 + Na2CO3
Calcium oxide is the typical catalyst used for this reaction.
Cesium salts also catalyze this reaction.[citation needed]
References[edit]
- ^ «Sodium Acetate». International Chemical Safety Cards. National Institute of Occupational Safety and Health. 2018-09-18.
- ^ a b c «sodium acetate trihydrate». chemister.ru.
- ^ Seidell, Atherton; Linke, William F. (1952). Solubilities of Inorganic and Organic Compounds. Van Nostrand.
- ^ a b c d e f «sodium acetate». chemister.ru.
- ^ a b c Sigma-Aldrich Co., Sodium acetate. Retrieved on 2014-06-07.
- ^ a b Acetic acid, sodium salt in Linstrom, Peter J.; Mallard, William G. (eds.); NIST Chemistry WebBook, NIST Standard Reference Database Number 69, National Institute of Standards and Technology, Gaithersburg (MD) (retrieved 2014-05-25)
- ^ Acetic acid, sodium salt, hydrate (1:1:3) in Linstrom, Peter J.; Mallard, William G. (eds.); NIST Chemistry WebBook, NIST Standard Reference Database Number 69, National Institute of Standards and Technology, Gaithersburg (MD) (retrieved 2014-05-25)
- ^ Clayden, Jonathan; Greeves, Nick; Warren, Stuart; Wothers, Peter (2001). Organic Chemistry (1st ed.). Oxford University Press. ISBN 978-0-19-850346-0.
- ^ «Potato Chip Flavoring Boosts Longevity Of Concrete». Science Daily. 8 August 2007.
- ^ AG, Jungbunzlauer Suisse. «Sodium Diacetate – Jungbunzlauer». www.jungbunzlauer.com.
- ^ Austen, Ian (2018-06-09). «The Secret Story of Salt and Vinegar Chips: the Canada Letter». The New York Times. ISSN 0362-4331. Retrieved 2021-11-23.
- ^ «Food Additive «Sodium Acetate (Anhydrous)» | Products». Mitsubishi Chemical Corporation. Retrieved 16 September 2020.
- ^ Mohammadzadeh-Aghdash, Hossein; Sohrabi, Yousef; Mohammadi, Ali; Shanehbandi, Dariush; Dehghan, Parvin; Ezzati Nazhad Dolatabadi, Jafar (15 August 2018). «Safety assessment of sodium acetate, sodium diacetate and potassium sorbate food additives». Food Chemistry. 257: 211–215. doi:10.1016/j.foodchem.2018.03.020. ISSN 0308-8146. PMID 29622200. S2CID 4596295. Retrieved 16 September 2020.
- ^ a b Ibrahim Dincer and Marc A. Rosen. Thermal Energy Storage: Systems and Applications, page 155
- ^ Courty JM, Kierlik E, Les chaufferettes chimiques, Pour la Science, décembre 2008, pp. 108–110
- ^ «Crystallization of Supersaturated Sodium Acetate». Journal of Chemical Education. 2015-07-19.
- ^ «How do sodium acetate heat pads work?». HowStuffWorks. April 2000. Retrieved 2007-09-03.
- ^ a b Hsu, Leh-Yeh; Nordman, C. E. (1983). «Structures of two forms of sodium acetate, Na+.C2H3O2−«. Acta Crystallogr. C. 39 (6): 690–694. doi:10.1107/S0108270183005946.
- ^ a b Cameron, T. S.; Mannan, K. M.; Rahman, M. O. (1976). «The crystal structure of sodium acetate trihydrate». Acta Crystallogr. B. 32: 87–90. doi:10.1107/S0567740876002367.
- ^ a b Wei, K.-T.; Ward, D. L. (1977). «Sodium acetate trihydrate: a redetermination». Acta Crystallogr. B. 33 (2): 522–526. doi:10.1107/S0567740877003975.
External links[edit]
- Hot Ice – Instructions, Pictures, and Videos
- How Sodium Acetate heating pads work
- Lavars, Nick (2021-09-15). «Sodium acetate acts as a potential fountain of youth for aging bones». New Atlas. Retrieved 2021-09-16.
{{cite web}}: CS1 maint: url-status (link)
| Ацетат натрия | |
 |
|
| Общие | |
|---|---|
| Систематическое наименование | sodium acetate (ИЮПАК) sodium ethanoate (систематическое) ацетат натрия натрия этаноат |
| Химическая формула | CH3COONa |
| Эмпирическая формула | C2H3O2Na |
| Физические свойства | |
| Состояние (ст. усл.) | белый гигроскопичный порошок |
| Молярная масса | 82.03 грамм/моль (безводная форма) 136.08 грамм/моль (тригидрат) г/моль |
| Плотность | 1,45 г/см³ |
| Термические свойства | |
| Температура разложения | 324 °C |
| Удельная теплота плавления | 264—289 к Дж/кг |
| Химические свойства | |
| Растворимость в воде | 76 г/100 мл |
Ацетат натрия CH3COONa, — натриевая соль уксусной кислоты, производится и широко применяется в промышленных масштабах.
Содержание
- 1 Область применения
- 2 Способы получения
- 3 Характерные реакции
- 4 Галерея
- 5 Примечания
- 6 См. также
- 7 Ссылки
Область применения
Ацетат натрия используется в текстильном производстве для нейтрализации отработанной серной кислоты в сточных водах и как фоторезист при использовании анилиновых красителей. Также используется при дублении солями хрома (для протравливания), и замедляет процесс вулканизации хлоропрена при производстве синтетических резин.
Ацетат натрия известен как пищевая добавка E262 и применяется как консервант.
В растворе ацетат натрия (будучи солью слабой кислоты) и уксусная кислота могут применяться как буфер, для сохранения относительно постоянного pH. Это особенно полезно в биохимии в pH-зависимых реакциях.
Ацетат натрия также используется в быту как составная химических грелок (англ. heating pad) или химических обогревателей (англ. Hand warmer), применяется как составная часть смеси «горячего льда» (англ. «hot ice»), при кристаллизации ацетата натрия выделяется тепло — это экзотермический процесс). При нагреве тригидрата ацетата натрия (имеющего точку плавления в 58 °C) до 100 °C (обычно ёмкость с ним кладут в кипящую воду), он расплавляется и переходит в водный раствор ацетата натрия. При охлаждении этого раствора ацетата натрия, он образует перенасыщенный раствор ацетата натрия в воде. Этот раствор прекрасно переохлаждается до комнатной температуры без образования твёрдой фазы, затем нажатием на металлический диск в ёмкости образуется центр кристаллизации, который, вырастая, заставляет перенасыщенный раствор переходить назад в твёрдую фазу тригидрата ацетата натрия. Этот процесс сопровождается значительным выделением тепла (экзотермическая реакция). [1][2][3] при этом процессе выделяется около 264—289 кДж/кг (Теплота фазового перехода).[4]. Также ацетат натрия используется в некоторых моделях космических скафандров, как источник тепла[источник?].
На этом свойстве основан довольно красивый опыт — «горячий лёд»
Способы получения
Ацетат натрия недорог и его легче приобрести в хим. магазинах, чем синтезировать в лабораторных условиях. В лабораторных условиях получается при взаимодействии уксусной кислоты, например, с карбонатом натрия, гидрокарбонатом натрия или гидроксидом натрия.
- CH3—COOH + Na+[HCO3]− → CH3—COO− Na+ + H2O + CO2
Это — хорошо известная реакция «гашения» пищевой соды и винного уксуса, происходящая в тесте. 84 грамма гидрокарбоната натрия реагируют с 750 граммами 8 % винного уксуса (или же с 86 граммами 70 % уксусной эссенции) с образованием 82 грамм ацетата натрия в растворе. Выпариванием воды можно получить чистый кристаллический ацетат натрия или его концентрированный раствор.
Характерные реакции
Ацетат натрия может быть использован для образования эфира с алкил галогенидами такими как бромэтан:
- H3C-COO− Na+ + NaBr
При сильном нагревании (более 324 °C) ацетат натрия разлагается на карбонат натрия и ацетон:
2СН3СOONa = Na2CO3 + CH3COCH3
Одновременно может проходить разложение до оксида натрия, ацетона и диоксида углерода:
2СН3СOONa = Na2O + CO2 + CH3COCH3
Галерея
-
Химический обогреватель, содержащий перенасыщенный раствор ацетата натрия, выделяющего тепло при фазовом переходе в кристаллическую форму тригидрата ацетата натрия.
-
Ацетат натрия
Примечания
- ↑ Crystallization of Supersaturated Sodium Acetate. Journal of Chemical Education. Архивировано из первоисточника 2 марта 2012. (англ.)
- ↑ «Fake» latent heat and supersaturation (англ.)
- ↑ How do sodium acetate heat pads work?. HowStuffWorks. Архивировано из первоисточника 2 марта 2012. Проверено 3 сентября 2007. (англ.)
- ↑ Thermal Energy Storage: Systems and Applications, By Ibrahim Dincer, Marc A. Rosen, p. 155 [1] (англ.)
См. также
- Уксусная кислота
- Ацетаты
- Пищевые добавки
Ссылки
- Video on how to make hot ice using sodium acetate (англ.)
- More information, videos, and pictures (англ.)
- Горячий лед из ацетата натрия (видео)
|
Растворимость кислот, оснований и солей в воде |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Химическое соединение
 |
|
 |
|
| Имена | |
|---|---|
| Название IUPAC Ацетат натрия | |
| Систематическое название IUPAC этаноат натрия | |
| Другие названия Горячий лед (тригидрат ацетата натрия) | |
| Идентификаторы | |
| Номер CAS |
|
| 3D-модель (JSmol ) |
|
| Ссылка Beilstein | 3595639 |
| ChEBI |
|
| ChEMBL |
|
| ChemSpider |
|
| ECHA InfoCard | 100.004.386 |
| Номер ЕС |
|
| Номер E | E262 (консерванты) |
| Ссылка на гмелин | 20502 |
| KEGG |
|
| PubChem CID |
|
| номер RTECS |
|
| UNII |
|
| CompTox Dashboard (EPA ) |
|
InChI
|
|
SMILES
|
|
| Свойства | |
| Химическая формула | C2H3NaO 2 |
| Мола r масса | 82,034 г · моль |
| Внешний вид | Белый расплывающийся порошок |
| Запах | Запах уксуса (уксусной кислоты) при нагревании до разложения |
| Плотность | 1,528 г / см (20 ° C, безводный). 1,45 г / см (20 ° C, тригидрат) |
| Температура плавления | 324 ° C (615 ° F; 597 K). (безводный). 58 ° C (136 ° F; 331 K). (тригидрат) |
| Точка кипения | 881,4 ° C (1618,5 ° F, 1154,5 K). (безводный). 122 ° C (252 ° F; 395 K). (тригидрат) разлагается |
| Растворимость в воде | Безводный:. 119 г / 100 мл (0 ° C). 123,3 г / 100 мл (20 ° C). 125,5 г / 100 мл (30 ° C). 137,2 г / 100 мл (60 ° C). 162,9 г / 100 мл (100 ° C). Тригидрат:. 32,9 г / 100 мл (-10 ° C). 36,2 г / 100 мл (0 ° C). 46,4 г / 100 мл (20 ° C). 82 г / 100 мл (50 ° C) |
| Растворимость | Растворим в спирте, гидразине, SO2 |
| Растворимость в метаноле | 16 г / 100 г (15 ° C). 16,55 г / 100 г (67,7 ° C) |
| Растворимость в этаноле | тригидрат:. 5,3 г / 100 мл |
| Растворимость в ацетоне | 0,5 г / кг (15 ° C) |
| Кислотность (pK a) | 24 (20 ° C). 4,75 CH3COOH |
| Основность (pK b) | 9,25 |
| Магнитная восприимчивость (χ) | -37,6 · 10 см / моль |
| Показатель преломления (nD) | 1,464 |
| Структура | |
| Кристаллическая структура | Моноклинная |
| Термохимия | |
| Теплоемкость (C) | 100,83 Дж / моль · K (безводный). 229 Дж / моль · K (тригидрат) |
| Стандартная молярная. энтропия (S 298) | 138,1 Дж / моль · K (безводный). 262 Дж / моль · K (тригидрат) |
| Стандартная энтальпия образования. (ΔfH298) | −709,32 кДж / моль (безводный). — 1604 кДж / моль (тригидрат) |
| свободная энергия Гиббса (ΔfG˚) | -607,7 кДж / моль (безводный) |
| Фармакология | |
| Код АТС | B05XA08 (ВОЗ ) |
| Опасности | |
| Основные опасности | Раздражающее |
| Паспорт безопасности | Внешний паспорт безопасности |
| NFPA 704 (огненный алмаз) |  1 1 0 1 1 0 |
| Температура вспышки | >250 ° С (482 ° F; 523 K) |
| самовоспламенение. температура | 600 ° C (1112 ° F; 873 K) |
| летальная доза или концентрация (LD, LC): | |
| LD50(средняя доза ) | 3530 мг / кг (перорально, крыса) |
| Родственные соединения | |
| Другие анионы | Формиат натрия. Пропионат натрия |
| Другие катионы | Ацетат калия. Ацетат кальция |
| Родственные соединения | диацетат натрия |
| Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки ink | |
Ацетат натрия, NaCH 3 COO, также сокращенно Na O Ac, это натрий соль из уксусной кислоты. Эта бесцветная расплывающаяся соль имеет широкий спектр применения.
Содержание
- 1 Области применения
- 1.1 Биотехнология
- 1.2 Промышленность
- 1.3 Долговечность бетона
- 1.4 Пища
- 1.5 Буферный раствор
- 1.6 Электрогрелка
- 2 Подготовка
- 3 Реакции
- 4 Ссылки
- 5 Внешние ссылки
Приложения
Биотехнология
Ацетат натрия используется в качестве источника углерода для культивирования бактерий. Ацетат натрия также полезен для увеличения выхода ДНК путем осаждения этанолом.
Промышленный
Ацетат натрия используется в текстильной промышленности для нейтрализации потоков отходов серной кислоты, а также в качестве фоторезиста при использовании анилиновых красителей. Он также травильный агент при дублении хрома и помогает препятствовать вулканизации хлоропрена при производстве синтетического каучука.. При обработке хлопка для изготовления одноразовых ватных дисков ацетат натрия используется для устранения накопления статического электричества.
Долговечность бетона
Ацетат натрия используется для уменьшения повреждения бетона водой, действуя как бетон герметик, при этом он экологически безопасен и дешевле чем обычно применяемая эпоксидная альтернатива для герметизации бетона от воды проникновение.
Пища
Ацетат натрия может добавляться в пищу в качестве приправы, иногда в форме диацетат натрия, взаимно однозначный комплекс ацетата натрия и уксусной кислоты, имеющий E-номер E262 . Его часто используют для придания картофельным чипсам вкуса соли и уксуса. Ацетат натрия (безводный) широко используется в качестве агента, продлевающего срок хранения, агента, регулирующего pH. При низкой концентрации безопасно есть.
Буферный раствор
Раствор ацетата натрия (основной соль уксусной кислоты) и уксусная кислота могут действовать как буфер для поддержания относительно постоянного уровня pH. Это особенно полезно в биохимических приложениях, где реакции зависят от pH в умеренно кислом диапазоне (pH 4–6).
Грелка

Ацетат натрия также используется в нагревании подушечки, грелки для рук и горячий лед. Кристаллы тригидрата ацетата натрия плавятся при 136,4 ° F / 58 ° C (до 137,12 ° F / 58,4 ° C), растворяясь в своей кристаллизационной воде. Когда их нагревают до температуры выше точки плавления и затем дают остыть, водный раствор становится перенасыщенным. Этот раствор может охлаждаться до комнатной температуры без образования кристаллов. При нажатии на металлический диск внутри грелки образуется центр зародышеобразования , в результате чего раствор снова кристаллизуется в твердый тригидрат ацетата натрия. Процесс кристаллизации с образованием связи экзотермический. Скрытая теплота плавления составляет около 264–289 кДж / кг. В отличие от некоторых типов тепловых пакетов, таких как те, которые зависят от необратимых химических реакций, тепловой пакет с ацетатом натрия можно легко повторно использовать, погрузив пакет в кипящую воду на несколько минут, пока кристаллы полностью не растворятся, и давая пакету медленно затвердеть. охладить до комнатной температуры.
Получение

Для лабораторного использования ацетат натрия стоит недорого и обычно приобретается вместо того, чтобы быть синтезированным. Иногда его получают в лабораторных экспериментах путем реакции уксусной кислоты, обычно в 5-8% растворе, известном как уксус, с карбонатом натрия (» стиральная сода »), бикарбонат натрия (« пищевая сода ») или гидроксид натрия (« щелочь »или« каустическая сода »). Любая из этих реакций дает ацетат натрия и воду. Когда соединение, содержащее натрий и карбонат-ион, используется в качестве реагента, карбонат-анион из бикарбоната или карбоната натрия реагирует с водородом из карбоксильной группы (-COOH) в уксусной кислоте с образованием угольной кислоты. Угольная кислота при нормальных условиях легко разлагается на газообразный диоксид углерода и воду. Это реакция, происходящая в известном «вулкане», когда смешиваются продукты для дома, пищевая сода и уксус.
- CH3COOH + NaHCO 3 → CH 3 COONa + H 2CO. 3
- H2CO. 3→ CO. 2+ H. 2O
Промышленно тригидрат ацетата натрия получают реакцией уксусная кислота с гидроксидом натрия с использованием воды в качестве растворителя.
- CH3COOH + NaOH → CH 3 COONa + H 2O
Реакции
Ацетат натрия можно использовать для образования сложного эфира с алкилгалогенидом, таким как бромэтан :
- CH3COONa + BrCH 2CH3→ CH3COOCH 2CH3 + NaBr
Ацетат натрия подвергается декарбоксилированию с образованием метана (CH 4) в принудительных условиях (пиролиз в присутствии гидроксида натрия):
- CH3COONa + NaOH → CH 4 + Na 2CO3
оксид кальция — типичный катализатор, используемый для этой реакции. Соли цезия также катализируют эту реакцию.
Ссылки
Внешние ссылки
| На Викискладе есть средства массовой информации, связанные с ацетатом натрия. |
- Горячий лед — инструкции, изображения и Видео
- Как работают грелки из ацетата натрия
Ацетилгалогениды и соли ацетат иона |
|||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| AcOH | He | ||||||||||||||||
| LiOAc | Be (OAc) 2. BeAcOH | AcOAc. ROAc | NH4OAc | AcOOH | FAc | Ne | |||||||||||
| NaOAc | Mg (OAc) 2 | Al (OAc) 3. ALSOL. Al (OAc) 2OH. Al2SO4(OAc) 4 | Si | P | S | ClAc | Ar | ||||||||||
| KOAc | Ca (OAc) 2 | Cr (OAc) 2. Cr (OAc) 3 | Mn (OAc) 2. Mn (OAc) 3 | Fe (OAc) 2. Fe (OAc) 3 | Co (OAc) 2,. | Ni (OAc) 2 | Cu (OAc) 2 | Zn ( OAc) 2 | Ge | Se | BrAc | Kr | |||||
| Y (OAc) 3 | Nb | Mo (OAc) 2 | Tc | .. | Rh2(OAc) 4 | Pd (OAc) 2 | AgOAc | Cd (OAc) 2 | In | . | Sb (OAc) 3 | Te | IAc | Xe | |||
| CsOAc | Ba (OAc) 2 | Hf | Ta | W | Re | Os | Ir | Pt (OAc) 2 | Au | ,. Hg (OAc) 2 | TlOAc. | Pb (OAc) 2. Pb (OAc) 4 | Bi (OAc) 3 | Po | At | Rn | |
| Fr | Ra | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
| ↓ | |||||||||||||||||
| Pr | Nd | Pm | Tb | Er | Tm | ||||||||||||
| Ac | Th | Па | UO2(OAc) 2 | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | № | Lr |
Содержание
- Область применения
- Способы получения
- Влияние на организм
- Галерея
Ацетат натрия CH3COONa, — натриевая соль уксусной кислоты, кристаллы со слабым солёным вкусом и уксусным запахом, производится и применяется в промышленных масштабах.
| Ацетат натрия | |
|---|---|
| Общие | |
| Систематическое наименование |
sodium acetate (ИЮПАК) sodium ethanoate (систематическое) ацетат натрия натрия этаноат |
| Хим. формула | C2H3O2Na |
| Рац. формула | CH3COONa |
| Физические свойства | |
| Состояние | белый гигроскопичный порошок |
| Молярная масса | 82.03 грамм/моль (безводная форма) 136.08 грамм/моль (тригидрат) г/моль |
| Плотность | 1,45 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 328 °C |
| • разложения | 324 °C |
| Удельная теплота плавления | 264—289 кДж/кг |
| Химические свойства | |
| Растворимость | |
| • в воде | 76 г/100 мл |
| Классификация | |
| Рег. номер CAS | 127-09-3 |
| PubChem | 517045 |
| Рег. номер EINECS | 204-823-8 |
| SMILES |
CC(=O)[O-].[Na+] |
| InChI |
1S/C2H4O2.Na/c1-2(3)4;/h1H3,(H,3,4);/q;+1/p-1 VMHLLURERBWHNL-UHFFFAOYSA-M |
| Кодекс Алиментариус | E262 |
| ChEBI | 32954 |
| ChemSpider | 29105 |
| Безопасность | |
| Токсичность | ирритант, малотоксичен |
| NFPA 704 |
Область применения
Ацетат натрия используется в текстильном производстве для нейтрализации отработанной серной кислоты в сточных водах и как фоторезист при использовании анилиновых красителей. Также используется при дублении солями хрома (для протравливания), и замедляет процесс вулканизации хлоропрена при производстве синтетических резин.
Ацетат натрия известен как пищевая добавка E262 и применяется как консервант.
Также ацетат натрия является источником углерода для бактерий, выращиваемых на питательной среде.
В растворе ацетат натрия (будучи солью слабой кислоты) и уксусная кислота могут применяться как буфер, для сохранения относительно постоянного pH. Это особенно полезно в биохимии в pH-зависимых реакциях.
Ацетат натрия также используется в быту как составная химических грелок (англ. heating pad) или химических обогревателей (англ. Hand warmer), применяется как составная часть смеси «горячего льда» (англ. «hot ice»), при кристаллизации ацетата натрия выделяется тепло — это экзотермический процесс. При нагреве тригидрата ацетата натрия (имеющего точку плавления в 58 °C) до 100 °C (обычно ёмкость с ним кладут в кипящую воду) он расплавляется (вернее, растворяется в собственной кристаллизационной воде) и переходит в водный раствор ацетата натрия. При охлаждении этого раствора образуется перенасыщенный раствор ацетата натрия в воде. Этот раствор прекрасно переохлаждается до комнатной температуры без образования твёрдой фазы, затем нажатием на металлический диск в ёмкости образуется центр кристаллизации, который, вырастая, заставляет перенасыщенный раствор переходить в твёрдую фазу тригидрата ацетата натрия. Этот процесс сопровождается значительным выделением тепла (экзотермическая реакция), теплота фазового перехода составляет 264-289 кДж/кг.
На этом свойстве основан довольно красивый химический опыт — «горячий лёд».
Способы получения
- В лабораторных условиях ацетат натрия образуется при взаимодействии уксусной кислоты, например, с карбонатом натрия, гидрокарбонатом натрия или гидроксидом натрия.
Влияние на организм
Ацетат натрия может всасываться в организм при проглатывании. Является ирритантом. LD50 25956 мг/кг. По другим данным из того же источника: LD50(крысы, орально): 3500 мг/кг, LD50(мыши, орально): 4960 мг/кг.
Галерея
-
Химический обогреватель c перенасыщенным раствором ацетата натрия
-
Ацетат натрия
| Ацетат натрия | |
|---|---|
 |
|
| Систематическое наименование |
sodium acetate (ИЮПАК) sodium ethanoate (систематическое) ацетат натрия натрия этаноат натрий уксуснокислый |
| Хим. формула | C2H3O2Na |
| Рац. формула | CH3COONa |
| Состояние | белый гигроскопичный порошок |
| Молярная масса | 82.03 грамм/моль (безводная форма) 136.08 грамм/моль (тригидрат) г/моль |
| Плотность | 1,45 г/см³ |
| Температура | |
| • плавления | 328 °C |
| • разложения | 324 °C |
| Удельная теплота плавления | 264—289 кДж/кг |
| Растворимость | |
| • в воде | 76 г/100 мл |
| Рег. номер CAS | 127-09-3 |
| PubChem | 517045 |
| Рег. номер EINECS | 204-823-8 |
| SMILES |
CC(=O)[O-].[Na+] |
| InChI |
1S/C2H4O2.Na/c1-2(3)4;/h1H3,(H,3,4);/q;+1/p-1 VMHLLURERBWHNL-UHFFFAOYSA-M |
| Кодекс Алиментариус | E262 |
| ChEBI | 32954 |
| ChemSpider | 29105 |
| Токсичность | ирритант, малотоксичен |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Ацетат натрия CH3COONa, — натриевая соль уксусной кислоты, кристаллы со слабым солёным вкусом и уксусным запахом, производится и применяется в промышленных масштабах.
Область применения
Ацетат натрия используется в текстильном производстве для нейтрализации отработанной серной кислоты в сточных водах и как фоторезист при использовании анилиновых красителей. Также используется при дублении солями хрома (для протравливания), и замедляет процесс вулканизации хлоропрена при производстве синтетических резин.
Ацетат натрия известен как пищевая добавка E262 и применяется как консервант.
Также ацетат натрия является источником углерода для бактерий, выращиваемых на питательной среде.
В растворе ацетат натрия (будучи солью слабой кислоты) и уксусная кислота могут применяться как буфер, для сохранения относительно постоянного pH. Это особенно полезно в биохимии в pH-зависимых реакциях.
Ацетат натрия также используется в быту как составная химических грелок (англ. heating pad) или химических обогревателей (англ. Hand warmer), применяется как составная часть смеси «горячего льда» (англ. «hot ice»), при кристаллизации ацетата натрия выделяется тепло — это экзотермический процесс. При нагреве тригидрата ацетата натрия (имеющего точку плавления в 58 °C) до 100 °C (обычно ёмкость с ним кладут в кипящую воду) он расплавляется (вернее, растворяется в собственной кристаллизационной воде) и переходит в водный раствор ацетата натрия. При охлаждении этого раствора образуется перенасыщенный раствор ацетата натрия в воде. Этот раствор прекрасно переохлаждается до комнатной температуры без образования твёрдой фазы, затем нажатием на металлический диск в ёмкости образуется центр кристаллизации, который, вырастая, заставляет перенасыщенный раствор переходить в твёрдую фазу тригидрата ацетата натрия. Этот процесс сопровождается значительным выделением тепла (экзотермическая реакция), теплота фазового перехода составляет 264-289 кДж/кг.
На этом свойстве основан довольно красивый химический опыт — «горячий лёд».
Способы получения
- В лабораторных условиях ацетат натрия образуется при взаимодействии уксусной кислоты, например, с карбонатом натрия, гидрокарбонатом натрия или гидроксидом натрия.
-
- CH3COOH + NaHCO3 ⟶ CH3COONa + H2O + CO2↑
Это — хорошо известная реакция «гашения» пищевой соды и винного уксуса, происходящая в тесте. 84 г гидрокарбоната натрия реагируют с 750 г 8%-го винного уксуса (или же с 86 г 70%-й уксусной эссенции) с образованием 82 г ацетата натрия в растворе. Выпариванием воды можно получить чистый кристаллический ацетат натрия. Для получения тригидрата ацетата натрия без выпаривания необходимо смешать 84 г гидрокарбоната натрия (пищевой соды) с 86 г 70%-ной уксусной кислоты и 10 г воды.
- Также ацетат натрия может быть получен и в ходе экзотермической реакции растворения металлического натрия в уксусной кислоте:
-
- 2CH3COOH + 2Na ⟶ 2CH3COONa + H2↑ + Q
Характерные реакции
Ацетат натрия может быть использован для образования сложного эфира по реакции с алкилгалогенидами, такими как, например, бромэтан:
-
- CH3COONa + CH3CH2Br → CH3COOC2H5 + NaBr
При сильном нагревании (более 324 °C) ацетат натрия разлагается на карбонат натрия и ацетон:
-
- 2CH3COONa → Na2CO3 + (CH3)2CO
Влияние на организм
Ацетат натрия может всасываться в организм при проглатывании. Является ирритантом. LD50 25956 мг/кг. По другим данным из того же источника: LD50(крысы, орально): 3500 мг/кг, LD50(мыши, орально): 4960 мг/кг.
<amp/>
|
Ацетат натрия |
|
|---|---|
| Названия: | натрия ацетат натрий уксуснокислый натрия этаноат пищевая добавка Е262 PubChem: 517045 |
| Формула: | NaCH3COO (безводный) NaCH3COO · 3H2O (тригидрат) |
| SMILES: | CC(=O)[O-].[Na+] |
| Молярная масса: | 82,034 г/моль (безводный) 136,078 г/моль (тригидрат) |
| Плотность: | 1,528 г/см3 (безводный) 1,45 г/см3 (тригидрат) |
| Сингония: | моноклинная (тригидрат) a=12,475 Å, b=10,407 Å, c=10,449 Åα=90°, β=112,65°, γ=90° |
| Формы: |
https://media.crystalls.info/w/uploads/media/Oblique_rhombic_prism.json
Наклонная ромбическая призма
https://media.crystalls.info/w/uploads/media/Trapezoidal_flat_prism.json
Трапециевидная плоская призма
https://media.crystalls.info/w/uploads/media/Needle.json
Игла |
| Цвет: | бесцветный |
| Температура плавления: | 328,2 °C601,35 K <br />622,76 °F <br />1082,43 °R <br /> (безводный) 58 °C331,15 K <br />136,4 °F <br />596,07 °R <br /> (тригидрат) |
| Температура разложения: | 120 °C393,15 K <br />248 °F <br />707,67 °R <br /> (тригидрат) |
| Показатель преломления: | 1,455 (тригидрат) |
| Магнитные свойства: | диамагнетик χ=-3,76 · 10-5см³/моль |
| Устойчивость: | очень быстро выветривается (около 15 минут) (тригидрат) |
| Прочность: | хрупок |
| Токсичность: | не токсичен ЛД50=3530мг/кг |
Описание
Органическое соединение, соль щелочного металла натрия и органической уксусной кислоты. Из водных растворов кристаллизуется в виде тригидрата.
Где приобрести
Можно приобрести в аптеке (как «солевая грелка», но встречается нечасто).
Методы получения
Взаимодействие пищевой соды, карбоната или гидроксида натрия и уксусной кислоты
Уравнение реакции:
Для получения 100,00 грамм тригидрата ацетата натрия требуется 61,73 грамм сода или 38,94 грамм карбоната или 29,39 грамм гидроксида натрия и 63,04 грамм 70% уксусной кислоты.
В емкость с кислотой небольшими порциями добавляют соответствующее соединение натрия и перемешивают до прекращения нагревания (осторожно, раствор может закипеть!), а в случае с карбонатом — до прекращения выделения углекислого газа. После завершения реакции раствор фильтруют и используют для выращивания кристаллов.
Взаимодействие сульфата натрия и ацетата кальция или свинца(II)
При использовании солей свинца сульфат натрия можно заменить на его хлорид.
Уравнение реакции:
Для получения 100,00 грамм тригидрата ацетата натрия требуется 118,38 грамм декагидрата сульфата натрия или 42,95 грамм хлорида натрия и 64,73 грамм моногидрата ацетата кальция или 139,38 грамм тригидрата ацетата свинца(II).
В емкость с раствором ацетата кальция или свинца(II) небольшими порциями при перемешивании вливают раствор соли натрия. Выпадает большое количество малорастворимого осадка. Его отделяют отстаиванием и выбрасывают, после чего оставшийся раствор тщательно фильтруют.
Влияние температуры
Способен образовывать переохлажденные растворы или расплавы, которые не будут кристаллизоваться самостоятельно и способны длительно время оставаться в таком состоянии. Лишь внешнее воздействие, например, касание или попадание пыли способно начать резкую кристаллизацию всего раствора с выделением большого количества тепла. Этот принцип используется в медицинских солевых грелках, а также опыте «Горячий лед».
Скорость остывания раствора влияет на форму кристаллов. При быстром охлаждении образуются нити, при более медленном — иглы и палочки, при испарении при комнатной температуре — призмы.
Условия хранения
Для хранения используют герметичную емкость, на дно которой наливают небольшое количество насыщенного раствора или помещают смоченную этим же раствором вату. В качестве альтернативного варианта помещают кристалл в ёмкость с маслом (аптечное вазелиновое, растительное) или гидрофобным растворителем (керосин, бензин, парафин). Также можно залить кристаллы акрилом или другим отвердевающим пластиком.
Растворимость
ТаблицаГрафик
| Температура | гр/100,00 гр воды |
гр/100,00 гр этанола |
гр/100,00 гр метанола |
гр/100,00 гр ацетона |
гр/100,00 гр этиленгликоля |
гр/100,00 гр муравьиной кислоты |
гр/100,00 гр уксусной кислоты |
гр/100,00 гр гидразина |
гр/100,00 гр диметилформамида |
||
|---|---|---|---|---|---|---|---|---|---|---|---|
| (безводный) | (тригидрат) | (безводный) | (тригидрат) | (безводный) | (тригидрат) | (тригидрат) | (тригидрат) | (тригидрат) | (тригидрат) | (тригидрат) | |
| 0°C273,15 K <br />32 °F <br />491,67 °R <br /> | 119 |
79 |
7,76 |
||||||||
| 10°C283,15 K <br />50 °F <br />509,67 °R <br /> | 121 |
~124 |
2,08 |
||||||||
| 15°C288,15 K <br />59 °F <br />518,67 °R <br /> | ~122 |
~147 |
~2,21 |
16 |
0,05 |
||||||
| 20°C293,15 K <br />68 °F <br />527,67 °R <br /> | ~123 |
~169 |
2,33 |
6 |
|||||||
| 25°C298,15 K <br />77 °F <br />536,67 °R <br /> | ~125 |
~192 |
5,3 |
7,8 |
29,03 |
10,46 |
1,5 |
||||
| 30°C303,15 K <br />86 °F <br />545,67 °R <br /> | 126 |
~214 |
|||||||||
| 40°C313,15 K <br />104 °F <br />563,67 °R <br /> | ~130 |
~259 |
|||||||||
| 50°C323,15 K <br />122 °F <br />581,67 °R <br /> | 134 |
304 |
|||||||||
| 60°C333,15 K <br />140 °F <br />599,67 °R <br /> | ~140 |
||||||||||
| 70°C343,15 K <br />158 °F <br />617,67 °R <br /> | 146 |
16,55 |
|||||||||
| 80°C353,15 K <br />176 °F <br />635,67 °R <br /> | 153 |
||||||||||
| 90°C363,15 K <br />194 °F <br />653,67 °R <br /> | 161 |
||||||||||
| 100°C373,15 K <br />212 °F <br />671,67 °R <br /> | 170 |
67,79 |
Плохо растворим в диэтиловом эфире.
Галерея
Видео
Источники
- Р.А.Кипер, Свойства веществ. Справочник
- Р.А.Кипер, Свойства веществ. Справочник
- Т.Кэмерон, Кристаллическая структура тригидрата ацетата натрия
- Простая наука, Эксперимент «Горячий лед»
- Блог Piece of Sciense
Навигация
Алф. указатель:
1-9
A-Z
А
Б
В
Г
Д
Е
Ж
З
И
К
Л
М
Н
О
П
Р
С
Т
У
Ф
Х
Ц
Ч
Щ
Э
Я
натрия ацетат
Синонимы:
натрий уксуснокислый
Внешний вид:
бесцветн. моноклинные кристаллы
Брутто-формула (система Хилла): C2H3NaO2
Формула в виде текста: CH3COONa
Молекулярная масса (в а.е.м.): 82,03
Температура плавления (в °C): 324
Растворимость (в г/100 г или характеристика):
ацетон: 0,05 (15°C)
вода: 119 (0°C)
вода: 121 (10°C)
вода: 123,5 (20°C)
вода: 126 (30°C)
вода: 129,5 (40°C)
вода: 134 (50°C)
вода: 139,5 (60°C)
вода: 146 (70°C)
вода: 153 (80°C)
вода: 161 (90°C)
вода: 170 (100°C)
вода: 180 (110°C)
вода: 191 (120°C)
вода: 193 (123°C)
диоксид серы: 0,073 (0°C)
диэтиловый эфир: плохо растворим
этанол: плохо растворим
Способы получения:
1. Реакцией едкого натра или карбоната натрия с уксусной кислотой.
Плотность:
1,528 (20°C, г/см3)
Показатель диссоциации:
pKa (1) = 24 (20 C, вода)
Стандартная энтальпия образования ΔH (298 К, кДж/моль):
-709,32 (т)
Стандартная энергия Гиббса образования ΔG (298 К, кДж/моль):
-607,7 (т)
Стандартная энтропия образования S (298 К, Дж/моль·K):
123,1 (т)
Стандартная мольная теплоемкость Cp (298 К, Дж/моль·K):
79,9 (т)
Энтальпия плавления ΔHпл (кДж/моль):
18
Применение:
Применяется в производстве красителей, мыл, уксусного ангидрида, ацетилхлорида, винилацетата, ацетатов меди и др., как протраву при крашении тканей и дублении кож, мочегонное в медицине, катализатор поликонденсации, компонент кислых закрепителей в фотографии, для получения буферных растворов, электролитов в гальванотехнике.
Дополнительная информация:
Гидролизуется водой. Растворяется в минеральных кислотах. С оксидом азота (IV) дает нитрит натрия и нитрат натрия и уксусный ангидрид; при нагревании с едким натром при 200 С — метан и карбонат натрия. С уксусной и муравьиной кислотами дает аддукты.
- «Краткий справочник по химии» под ред. Куриленко О.Д., Киев:Наукова думка, 1974 стр. 489
- «Справочник химика» т.2, Л.-М.: Химия, 1964 стр. 144-145
- «Справочник химика» т.3, Л.-М.: Химия, 1965 стр. 211, 290, 302
- «Химическая энциклопедия» т.3 М.: Советская энциклопедия, 1992 стр. 180
- Гордон А., Форд Р. «Спутник химика» М.: Мир, 1976 стр. 77
- Лурье Ю.Ю. «Справочник по аналитической химии» М.:Химия, 1979 стр. 78-79
- Рабинович В.А., Хавин З.Я. «Краткий химический справочник» Л.: Химия, 1977 стр. 83
Источники информации:
Алф. указатель:
1-9
A-Z
А
Б
В
Г
Д
Е
Ж
З
И
К
Л
М
Н
О
П
Р
С
Т
У
Ф
Х
Ц
Ч
Щ
Э
Я
Еще по теме:
- НАТРИЯ АЦЕТАТ — химическая энциклопедия
- Натрия ацетат — лекарственные препараты






