«Sputnik V» redirects here. For the Soviet satellite known as Sputnik 5, see Korabl-Sputnik 2.
Russian Ministry of Health image of Gam-COVID-Vac vials |
|
| Vaccine description | |
|---|---|
| Target | SARS-CoV-2 |
| Vaccine type | Viral vector |
| Clinical data | |
| Trade names |
|
| Other names |
|
| License data |
|
| Routes of administration |
Intramuscular |
| ATC code |
|
| Legal status | |
| Legal status |
Full list of Sputnik V vaccine authorizations |
| Identifiers | |
| DrugBank |
|
Sputnik V (Russian: Спутник V, the brand name from RDIF) or Gam-COVID-Vac (Russian: Гам-КОВИД-Вак, the name under which it is legally registered and produced[3]) is an adenovirus viral vector vaccine for COVID-19 developed by the Gamaleya Research Institute of Epidemiology and Microbiology in Russia. It is the world’s first registered combination vector vaccine for the prevention of COVID-19, having been registered on 11 August 2020 by the Russian Ministry of Health.[4][5]
Gam-COVID-Vac was initially approved for distribution in Russia and then in 59 other countries (as of April 2021) on the preliminary results of Phase I–II studies eventually published on 4 September 2020.[6] Approval in early August of Gam-COVID-Vac was met with criticism in mass media and discussions in the scientific community as to whether approval was justified in the absence of robust scientific research confirming safety and efficacy.[4][5][7][8][9] A large-scale Brazilian study from Dec. 2020 to May 2021 confirmed its effectiveness and safety, as of Oxford–AstraZeneca’s, i.e. above Sinopharm BIBP’s.[10]
Emergency mass-distribution of the vaccine began in December 2020 in countries including Russia, Argentina, Belarus, Hungary, Serbia, Pakistan (in limited quantities), the Philippines (in limited quantities), and the United Arab Emirates. The Sputnik V is currently registered and certified in 71 countries.[11] However, as of April 2022 less than 2.5% of the people vaccinated worldwide have taken a Sputnik V dose.[12] In early 2022, as a result of the 2022 Russian invasion of Ukraine, the United States and other countries placed RDIF on the list of sanctioned Russian entities and people,[13][14] significantly reducing Sputnik V future commercial prospects.[13][12]
The Gam-COVID-Vac vaccine itself is available in two forms: frozen (vaccine storage: below –18 °C) and liquid (vaccine storage: from +2 to +8 °C, produced a little). In addition to the main vaccine, vaccines and its derivatives were also registered: Gam-COVID-Vac-Lyo (Russian: Гам-КОВИД-Вак-Лио, no data on use), Sputnik Light (Russian: Спутник Лайт, used for revaccination, as well as vaccination of foreigners in Russia), Gam-COVID-Vac-M (Russian: Гам-КОВИД-Вак-М, for vaccination of adolescents 12–17 years old[15]).
Medical uses[edit]
The vaccine can be formulated in two ways: as a ready-to-use solution in water that is frozen at the common home-freezer storage temperature of −18 °C or 0 °F or lower, and as a freeze-dried (lyophlilized) powder, «Gam-COVID-Vac-Lyo», which can be stored at 2–8 °C or 36–46 °F. The freeze-dried powder must be reconstituted with sterile water before use.[16] The lyophilized formulation of Gam-COVID-Vac is similar to the smallpox vaccine, circumventing the need for continuous «colder chain» or cold-chain storage – as required for the Pfizer–BioNTech and Moderna vaccines – and allowing transportation to remote locations with reduced risk of vaccine spoilage.[17][18]
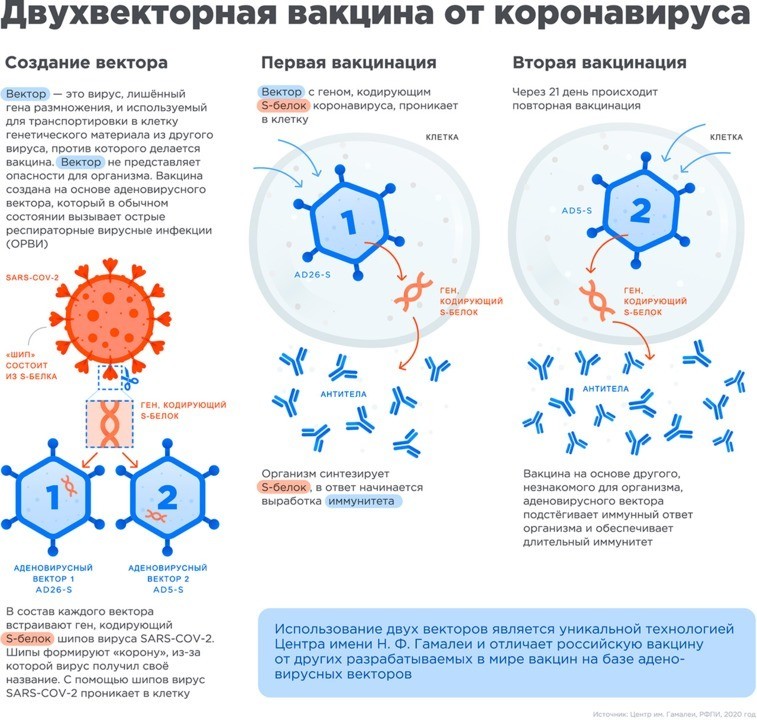
The first dose (based on Ad26) is administered on the first day, and the second dose (based on Ad5) is administered on the 21st day to boost immune response.[19][20][21] Both doses are administered into the deltoid muscle.
Sputnik Light is a registered single-dose vaccine consisting of only the first dose of Sputnik V. It is intended for areas with acute outbreaks and it will be used as a third (booster) dose for those who have received Sputnik V at least 6 months earlier.[22]
On August 11, 2021, the developers of the Sputnik V vaccine offered its ‘Sputnik Light’ (Ad26) vaccine to Pfizer for trial against the Delta variant.[23][24]
Effectiveness[edit]
The effectiveness of COVID-19 vaccines, or any other vaccine, is determined in a mass vaccination in a «real-world» setting (not in clinical trials). This is an assessment of how well the vaccine protects people from outcomes such as infection, symptomatic illness, hospitalization, and death. Effectiveness is evaluated outside of clinical trials, which by contrast, evaluate the efficacy of the vaccine.[25][26] A vaccine is generally considered effective if the estimate is ≥50% with a >30% lower limit of the 95% confidence interval.[27] Effectiveness is generally expected to slowly decrease over time.[28]
On 25 August, a preliminary version of a case-control study indicated an unadjusted effectiveness[25][26] of about 50% against symptomatic disease. The authors expected that adjusting for age and sex would increase the estimate, citing an increase from 66% to 81% when adjusting the data for effectiveness against hospitalization.[A]
A large-scale study in Buenos Aires from December 29, 2020, to May 15, 2021, with 663,602 participants aged 60 and older who received Spunik V, the Oxford–AstraZeneca vaccine, or the Sinopharm BIBP vaccine observed an overall efficacy of 98% (95% CI, 95–99%) against COVID-19-related deaths. The study noted that the three vaccines showed a similar effectiveness against death, and that the effectiveness against infection was similar to that of the Oxford-Astrazeneca vaccine and greater than that of the Sinopharm BIBP vaccine.[10]
| Doses | Severity of illness | Delta | Alpha |
|---|---|---|---|
| 1 | Symptomatic | Not reported | Not reported |
| Hospitalization | 35% (−21 to 65%)[A] | Not reported | |
| 2 | Asymptomatic | Not reported | 86% (84–87%)[B] |
| Symptomatic | Not reported | Not reported | |
| Hospitalization | 81% (68–88%)[C][A] | Not reported | |
| Death | Not reported | 98% (96–99%)[B] |
- ^ a b c Case-control study with 13,894 participants from 3 July 2021 to 9 August 2021 in Saint Petersburg. The study awaits peer review.[29][30][may be outdated as of December 2021]
- ^ a b 22 January to 10 June 2021 in Hungary.[31]
- ^ 14 to 55 days after the second dose, higher in women, 84% (), than in men, 76% (). Increases to 85% () 56 days or more after the second dose.
A large-scale study was conducted in Mexico and was published as a preprint, awaiting peer review (as of July 22, 2022).[32] The study, compared 793,487 adults vaccinated with different vaccines with 4,792,338 unvaccinated adults between December 24, 2020, and September 27, 2021.The results were as follows:
| Vaccine | Incidental infection effectiveness | Hospitalization effectiveness | Mortality effectiveness |
|---|---|---|---|
| Spikevax | 91.45% | 78% | 93.46% |
| Comirnaty | 80.34% | 84.26% | 89.83% |
| Sputnik V | 78.75% | 81.38% | 87.7% |
| Covishield | 80.79% | 80.23% | 86.81% |
| Janssen | 82.18% | 77.33% | 85.79% |
| CoronaVac | 71.93% | 73.76% | 80.38% |
| Convidecia | 70.5% | 72.31% | 79.93% |
Efficacy[edit]
The vaccine efficacy of a COVID-19 vaccine or any other vaccine is evaluated in controlled clinical trials. It is an estimate of how many people who received the vaccine got the disease compared to how many people who got a placebo had the same outcome. On 2 February 2021, an interim analysis from the Moscow trial was published in The Lancet reporting an efficacy of 91.6% (95% CI, 85.6–95.2%) after the second dose for all age groups, with no unusual side effects.[33] For the age group of 60 years and older, the reported efficacy was 91.8%.[34] On 12 May, a group of biostatisticians from Russia, the US, France, Italy and the Netherlands questioned the efficacy results in a correspondence in The Lancet, highlighting data discrepancies
, substandard reporting
, apparent errors and numerical inconsistencies
and a very unlikely homogeneity in vaccine efficacy across age groups.[35]
The authors responded by saying that they had provided the regulatory authorities with all the data necessary for obtaining approval, and that the data included with the paper were enough for readers to confirm the reported vaccine efficacy. They also addressed the protocol queries, and said numerical inconsistencies were «simple typing errors that were formally corrected».[36]
In June 2022 a group of biostatisticians from Australia and Singapore published a paper suggesting that the almost identical efficacy for every age group from the Lancet paper is very unlikely to occur in genuine experimental data.[37] The group called for a thorough investigation of the Lancet article, as well as the immediate release of anonymized individual patient data to an unbiased statistical expert, and suggested the Lancet article should be retracted. The Lancet Group recognized the concerns about the validity of data published in Lancet article and invited the authors of the article to respond to these latest questions.[38][39]
Adverse effects[edit]
Side effects are mostly mild and similar to other adenovirus vector vaccines such as the Oxford-AstraZeneca and the Janssen vaccines. However, unlike the Oxford-AstraZeneca and Janssen vaccines, and Pfizer, evidence does not suggest a risk of vaccine-induced immune thrombotic thrombocytopenia.[40]
Pharmacology[edit]
Gam-COVID-Vac is a viral vector vaccine based on two recombinant replication-defective human adenoviruses: Ad26 (serotype 26) and Ad5 (serotype 5) replicated in HEK 293 cells. The viruses contain the gene that encodes the full-length spike protein (S) of SARS-CoV-2 to stimulate an immune response.[6][19][41] Adenoviral vectors[42][43] for expression of the SARS-CoV-2 spike protein have also been used in two other COVID-19 vaccines. One is called Janssen COVID-19 vaccine, it utilizes the Ad26COV2 viral vector based on the human virus Ad26. For this vaccine, the cell line PER.C6[44][45] is used to replicate the vector. Another one called Oxford–AstraZeneca COVID‑19 vaccine, it uses chimpanzee adenovirus (ChAdOx1) as the vector. For both the Oxford-AstraZeneca COVID-19[45] and Gam-COVID-Vac vaccines the producer cells for the production of non-replicating adenoviral vectors were obtained from the HEK 293 cell line.[46] Each dose of Gam-COVID-Vac contains (1.0 ± 0.5) × 1011 virus particles.[34]
Both Ad26 and Ad5 were modified to remove the E1 gene to prevent replication outside the HEK 293 cells.[47] For the production of the vaccine, to propagate adenoviral vectors in which the E1 gene was deleted, HEK 293 cells are used, which express several adenoviral genes, including E1.[48][49] However, although rare, homologous recombination between the inserted cellular sequence and the vector sequence can restore the replication capacity to the vector,[50] with less than 100 replicating adenovirus particles per dose of the vaccine.[47]
Chemistry[edit]
The other ingredients (excipients) are the same, both quantitatively and qualitatively, in the two doses.[51][52]
- Tris(hydroxymethyl)aminomethane (buffer)
- Sodium chloride (salt)
- Sucrose (sugar)
- Magnesium chloride hexahydrate
- Disodium EDTA dihydrate (a chelation ligand; sequestrant)
- Polysorbate 80
- Ethanol 95%
- Water
No adjuvants[53] and no other components or ingredients should be included in the vaccine.[1]
Manufacturing[edit]
Pharmaceutical company União Quimica started production of Sputnik V in Brazil in January 2021[citation needed]
Large quantities of both adenoviruses are produced by HEK 293 cells that have the E1 gene necessary for viral replication.[48][49][50] Rarely, Ad5 can acquire the E1 gene from the HEK 293 cells, restoring its ability to replicate.[50] Gamaleya has set an acceptable limit of 5,000 replicating virus particles per vaccine dose, and quality control documents state that tested batches contain less than 100 replicating virus particles per dose.[47]
The production of the frozen liquid formulation was developed for large-scale use, it is cheaper and easier to manufacture. The production of the freeze-dried formulation takes much more time and resources, although it is more convenient for storage and transportation. It was developed with vaccine delivery to hard-to-reach regions of Russia in mind.[6]
According to Russian media, the mass production of the Gam-COVID-Vac was launched by 15 August. By that moment, the Russian Federation has already received applications from 20 countries for the supply of 1 billion doses of vaccine. Three facilities were able to produce about a million doses per month at each with a potential doubling of capacity by winter. By the end of 2020, Gamaleya Research Institute’s production, according to an interview with the organization’s spokesperson, was planned to produce 3–5 million doses.[54][55]
As of March 2021, the Russian Direct Investment Fund (RDIF) has licensed production in India, China, South Korea and Brazil. In the EU, RDIF has signed production agreements. By the end of March 2021 RDIF anticipates 33 million doses will have been manufactured in Russia, less than 5% of which will have been exported.[56]
An agreement for the production of over 100 million doses of vaccine in India was made with Dr. Reddy’s Laboratories, which on 11 January 2021 submitted mid-stage trial data to the Indian regulator and recommended moving onto late-stage trials.[57] The RDIF announced plans to sell 100 million doses to India, 35 million to Uzbekistan, and 32 million to Mexico, as well as 25 million each to Nepal and Egypt.[58] In India, the first dose of Sputnik V vaccine was administered on 14 May 2021 at Hyderabad.[59] Argentina became the first Latin American country to produce it.[60] Large-scale production started in June 2021.[61] As of 31 December 2021 277 million doses were manufactured, mostly (265 million) in Russia.[62]
On 28 February 2022, as a result of the 2022 Russian invasion of Ukraine, the United States placed RDIF and its chief executive on its list of sanctioned Russian entities and people.[63][14] The European Union, Ukraine, United Kingdom and Australia followed later in February and in March.[64] This significantly reduces vaccine’s future commercial prospects.[63][12]
Resale controversy[edit]
Under a resale arrangement, the Russian Direct Investment Fund (RDIF) offered Abu Dhabi-based firm, Aurugulf Health Investments the exclusive rights to sell the Sputnik V coronavirus vaccine. According to media reports, the vaccine was intended to be sold to a host of countries at huge premiums. As per documents reviewed by the Moscow Times, Emirati Sheikh Ahmed Dalmook al-Maktoum, a Dubai royal, worked as the middleman for reselling millions of Sputnik V vaccine doses to countries in dire need of COVID-19 vaccine at a higher premium.
Corporate registry data showed that one of the two entities controlling Aurugulf is Royal Group, a conglomerate headed by UAE national security advisor, Sheikh Tahnoon bin Zayed al-Nahyan. Acquired documents, interviews with officials and buyer data showed that countries like Pakistan, Guyana, which were on the receiving end of the vaccine from the UAE, were coerced to pay more than double the price advertised by Russia.[65]
The same deal was further used for reselling 1 million Sputnik V vaccine doses by the Emirati royal Sheikh Ahmed Dalmook al-Maktoum to Kenya for huge mark-ups. However, the deal eventually failed as Nairobi learnt of the first shipment consisting of 75,000 doses not coming directly from Russia.[66]
History[edit]
Package and Vial for the first dose
The Gam-COVID-Vac vaccine was developed by a cellular microbiologists team of the government-backed Gamaleya Research Institute of Epidemiology and Microbiology. The group was led by MD and RAS associate member Denis Logunov, who also worked on vaccines for the Ebolavirus and the MERS-coronavirus.[citation needed]
In May 2020, the Gamaleya Research Institute of Epidemiology and Microbiology announced that it had developed the vaccine without serious side effects. By August 2020, phases I and II of two clinical trials (involving 38 patients each) were completed. Only one of them used the formulation which later obtained marketing authorization under limited conditions.[67][68] This vaccine was given the trade name «Sputnik V», after the world’s first artificial satellite.[5][8][69]
During preclinical and clinical trials, 38 participants who received one or two doses of the Gam-COVID-Vac vaccine had produced antibodies against SARS-CoV-2’s spike protein, including potent neutralizing antibodies that inactivate viral particles.[4] On 11 August 2020, the Russian minister of Health Mikhail Murashko announced at a government briefing with the participation of President Vladimir Putin regulatory approval of the vaccine for widespread use. The state registration of the vaccine was carried out «conditionally» with post-marketing measures according to the decree of the Government of the Russian Federation. The registration certificate for the vaccine stated that it could not be used widely in Russia until 1 January 2021, and before that, it may be provided to «a small number of citizens from vulnerable groups», such as medical staff and the elderly, according to a Ministry of Health spokesperson.[5] The license under register number No. ЛП-006395 (LP-006395) was issued on 11 August by the Russian Ministry of Health. Although the announcement was made even before the vaccine candidate had been entered into Phase III trials, the practice of marketing authorization «on conditions» also exists in other countries.[70][71] On 26 August, certificate No. ЛП-006423 (LP-006423) was issued for the lyophilized formulation «Gam-COVID-Vac-Lyo».[4][5][8][72][6]
On 12 June 2021, developers announced that they had developed and tested a nasal vaccine for children aged 8 to 12, with no side effects found, and that they expected to release it on 15 September 2021.[73]
Clinical trials[edit]
Phase I–II[edit]
A phase I safety trial began on 18 June 2020.[4] On 4 September 2020, data on 76 participants in a phase I–II trial were published, indicating preliminary evidence of safety and an immune response.[6] The results were challenged by international vaccine scientists as being incomplete, suspicious, and unreliable when identical data were reported for many of the trial participants,[74] but the authors responded that there was a small sample size of nine, and the measured results of titration could only take discrete values (800, 1600, 3200, 6400). Coupled with the observation that values tended to reach a plateau after three to four weeks, they contend that it is not unlikely that several participants would show identical results for days 21 to 28.[75]
Phase III[edit]
Sputnik V, efficacy for different conditions. The error bars indicate the confidence interval containing the efficacy with 95% probability
In early November 2020, Israel Hadassah Medical Center director-general Prof. Zeev Rotstein stated that Hadassah’s branch in Moscow’s Skolkovo Innovation Center was collaborating on a phase III clinical trial.[76]
The ongoing phase III study is a randomised, double-blind, placebo-controlled, multi-centre clinical trial involving 40,000 volunteers in Moscow, and is scheduled to run until May 2021.[77] In 2020–2021, phase III clinical studies were also being conducted in Belarus,[78] UAE,[79] India[80] and Venezuela.[81]
On April 13, 2021, India’s health ministry said its drug regulator had found that safety and immunogenicity data from a local trial of Sputnik V coronavirus vaccine was comparable to that of a late-stage trial done in Russia.[82]
Variants[edit]
In May 2021, a study by researchers of the National University of Córdoba, Argentina, found that the vaccine produced antibodies capable of neutralizing the Gamma variant.[83]
A study in Argentina found that neutralization is maintained against Alpha and Lambda and reduced against Gamma. The degree of reduction, however, does not necessarily imply reduced protection.[84]
A small study of 12 serum samples found that antibodies from the vaccine effectively neutralize the Alpha variant, with moderately reduced neutralization against the E484K substitution (median 2.8 fold reduction). However, neutralization of the Beta variant was markedly reduced (median 6.1 fold reduction).[85]
[edit]
Full authorization
Emergency authorization
Authorization expired
Allowed for travel
Rejected
President Putin’s meeting with government members, on 11 August 2020 via videoconference, at which he announced a conditionally registered vaccine against COVID-19.[4][5]
In August 2020, British and American officials stated that the Gam-COVID-Vac vaccine would likely be rejected due to concerns that the normally rigorous process of vaccine clinical testing was not followed.[86]
As of December 2020, Belarus and Argentina granted emergency use authorization for the vector-based vaccine.[87] On 21 January 2021, Hungary became the first European Union country to register the shot for emergency use, as well as the United Arab Emirates in the Persian Gulf region.[88][89][90][91][92]
On 19 January 2021, the Russian authorities applied for the registration of Sputnik V in the European Union, according to the RDIF.[93] On 10 February, the European Medicines Agency (EMA) said that they had «not received an application for a rolling review or a marketing authorisation for the vaccine». The developers have only expressed their interest that the vaccine be considered for a rolling review, but EMA’s Human Medicines Committee (CHMP) and the COVID-19 EMA pandemic Task Force (COVID-ETF) need to give their agreement first before developers can submit their application for initiation of the rolling review process.[94] On 4 March 2021, the Committee for Medicinal Products for Human Use (CHMP) of the EMA started a rolling review of Sputnik V.[95] The EU applicant is R-Pharm Germany GmbH.[95] On 16 June, Reuters reported that approval of Sputnik V will be delayed at least until September because not all the necessary clinical data has been submitted by the deadline.[96] As of June 2021, Sputnik V is under rolling review process by EMA, but the marketing authorisation application was not submitted yet.[97]
Emergency use has also been authorized in Algeria, Bolivia, Serbia, the Palestinian territories,[57] and Mexico.[98]
On 25 January 2021, Iran approved the vaccine, with Foreign Minister Mohammad Javad Zarif saying the country hopes to begin purchases and start joint production of the shot «in the near future», after Supreme Leader Ayatollah Ali Khamenei banned the government from importing vaccines from the United States and United Kingdom.[99][100]
The Czech Republic is also considering buying Sputnik V, and Prime Minister Andrej Babis dismissed the minister of health, Jan Blatný, who was a loud opponent to the use of Sputnik V.[101][102][103]
On 4 March 2021, EMA’s human medicines committee (CHMP) has started a rolling review of Sputnik V (Gam-COVID-Vac), a COVID-19 vaccine developed by Russia’s Gamaleya National Centre of Epidemiology and Microbiology.[104] When asked about the prospect of Austria giving Sputnik V the approval (as some other European countries chose to do), EMA management board chair Christa Wirthumer-Hoche pointed to the fact there was not yet sufficient safety data about those who had already been given the vaccine. «We could have Sputnik V on the market in future, when we’ve examined the necessary data,» she said, adding that the vaccine needed to match up to European criteria on quality control and efficacy.[105]
On 18 March 2021, German regional leaders including State Premiers and the mayor of Berlin called for the swift approval of the Russian vaccine by the European Medicines Agency to counteract the acute shortages of effective vaccines in Europe. German medical experts have recommended its approval also, and consider the Sputnik Vaccine «clever» and «highly safe».[106]
On 19 March 2021, the Philippine Food and Drug Administration granted emergency use authorization for Sputnik V, the fourth COVID-19 vaccine to be given authorization. The Philippine government planned to buy 20 million doses of the vaccine.[107][108]
On 12 April 2021, India approved the use of Sputnik V vaccine for emergency use against COVID-19 based on strong immunogenicity data.[109][110]
As of 12 April 2021, 62 countries had granted Sputnik V emergency use authorization.[111]
On 27 April 2021, Bangladesh approved the use of Sputnik V vaccine for emergency use.[112]
On 30 April 2021, Turkey and Albania approved the use of Sputnik V vaccine for emergency use.[113][114]
Slovakia[edit]
On 1 March 2021, Slovakia bought 2 million doses of the Sputnik V vaccine. Slovakia received the first batch of 200,000, and expected to receive another 800,000 doses in March and April. Another 1 million doses were set to arrive in May and June.[115]
On 8 April, Slovakia’s drug regulator said that the Sputnik V vaccine it received did «not have the same characteristics and properties» as the version endorsed by The Lancet.[116] The Slovak State Institute for Drug Control stated that Sputnik V has not yet been approved for use, as the first 200,000 doses received on the 31st of March were different from the product currently being reviewed by the EMA as well as from the vaccine used in studies published in The Lancet. The producers have failed to reply to requests for documentation, and approximately 80% of the data was not supplied even after repeated requests. Due to the inconsistencies, it was not possible to review the safety and efficacy of the vaccine.[117][118] Russian Direct Investment Fund replied that Slovakian laboratory which tested the vaccine was not certified by the EU.
Slovak Prime Minister Igor Matovič resigned on 30 March, due to the political crisis started by the order of the Sputnik V vaccine.[119] On 6 April 2021, the RDIF asked to return the delivered first batch of the vaccine due to «multiple contract violations».[117][120]
On 29 April 2021, the Slovak Ministry of Health published the Sputnik V contract.[121] According to the contract, the RDIF as a seller is not liable for any adverse events following administering of the vaccine, nor its effectiveness.[121][122] According to the Slovak lawyers, the contract is explicitly disadvantageous for Slovakia.[122][123]
On 8 May 2021, the Russian Direct Investment Fund sent a letter to the Denník N newspaper requesting the removal of the statements of the drug regulator, calling them «unsubstantiated and false» and «fake news».[124][125] RDIF threatened the newspaper with legal action if they didn’t comply with the demand by 9 May.[126] The editors of Denník N refused to remove said statements.
After the samples were sent to the EU-certified laboratory in Hungary and it was stated that «the results were satisfactory»,[127] the Slovakian government approved the vaccine, and announced that vaccination with Sputnik V would begin in June 2021, despite the negative review by Slovakia’s drug regulator.[128][129] Vaccinations started on 7 June,[130] but without significant interest in the Sputnik V vaccine.[131][132] Slovakia has no plans to order new batches[131] and plans to sell or donate unused vaccines to Balkans countries.[133] The registrations for vaccination were closed on 30 June. In July 2021, 160,000 doses of the vaccine from the first batch of 200,000 were shipped back to Russia.[134] Temporary government approval for Sputnik V expired on 31 August 2021.[135][136] In total, 18,500 people have been vaccinated.[137]
Purchase of Sputnik V, which led to a political crisis and contributed to a fall of Igor Matovič’s Cabinet was investigated by Slovak Police Force with the investigation levered against Marek Krajčí. No violation of the law was found in October 2022.[138]
Brazil[edit]
On 26 April 2021, the Brazilian health regulator Anvisa rejected the use of Sputnik V, alleging a lack of consistent and reliable data and the presence of replicating adenovirus in the vaccine. RDIF and Sputnik V’s official Twitter account said the decision may be politically motivated, pointing to a recent report by the United States government that tried to persuade Brazil to reject the vaccine. Several Brazilian states in the North and Northeast regions had already signed contracts for the acquisition of more than 30 million doses.[139][140][141] Anvisa attributed its decision to a number of issues with the samples provided by Gamaleya for accreditation:[142][143][144]
- the adenovirus carrier in all samples was actually able to replicate in spite of manufacturer’s declaration it was incapacitated
- the methodology used by Gamaleya to check immune system response was unreliable and documentation provided made its verification impossible
- the procedure of registering adverse effects was insufficient
- Anvisa delegation was also not allowed into the Gamaleya laboratory for inspection
- all presented studies were performed on vaccine doses produced in laboratory, rather than in the manufacturing facility supplying vaccine for the mass market, which makes the results not representative
- Anvisa found issues in one of the factories in Russia that could impact sterility of the doses.[143]
On April 29, 2021, the developers of Sputnik V said that Anvisa admitted not testing Sputnik V and that they would sue Anvisa in Brazil for defamation. At a press conference, Anvisa officials said that Gamaleya’s own documents indicated multiple times the presence of replication-competent adenoviruses (RCAs) in ready vaccine batches and that the specifications accepted a level of RCAs 300 times greater than any other regulatory threshold. Anvisa presented the video of a meeting with representatives from Russia and Brazil where, when asked about the presence of RCAs, a representative from Russia reported problems with the cells and said that the vaccine could have been redeveloped, but it would take too long, so the developers instead chose to continue the research imposing an acceptable level of RCAs.[145][146] Virologist Angela Rasmussen described this problem as a quality control issue that is not important for healthy people because adenoviruses are not important pathogens, but added that it could produce serious adverse effects in immunocompromised individuals.[147] Medicinal chemist Derek Lowe commented that the presence of replicating adenoviruses is unlikely to cause any major problems, but it is a «completely unnecessary risk», that it certainly will harm some people, and that providing a product different from the one described in studies undermines the credibility of all manufacturing and quality control processes,[148] adding that some posts on the official Sputnik V Twitter account constitute «aggressive political marketing» and some make invalid claims regarding the performance of competing vaccines, such as the Pfizer-BioNTech vaccine.[149] Anvisa said that the import ban can be reversed if Gamaleya clarifies the issues. Adenovirus infections cause only mild colds in healthy individuals, but they can cause life-threatening illnesses in immunodeficient individuals.[47] The director of the Public Health Institute of Chile (ISP), Heriberto Garcia, said that the ISP would not necessarily reject the vaccine, even if it had replicating adenoviruses, because the risk of getting a common cold from the vaccine must be seen in light of the risk of contracting COVID-19 when not vaccinated. He also said that real-world data from Argentina and Mexico showed no adverse effects greater than those seen in people vaccinated with the Pfizer-BioNTech vaccine or CoronaVac.[150]
On June 4, Anvisa approved exceptional imports of Sputnik V, restricting it mainly to healthy adults and limiting it to only 1% of the population of 6 importing states, in order to manage risks through control and supervision of side effects. Anvisa said that the concern with replicating viruses has not been fully resolved, but that additional documents received indicate a substantially reduced acceptable amount. The new parameter would be in an FDA manual, which was not found. Anvisa also said that impurity and quality controls are insufficient and that the manufacturing plants must undergo corrections to meet WHO quality standards.[2][151][152] As of 16 June, the same import conditions were extended to a total of 13 states.[153] On August 5, the consortium of northeastern Brazilian states, corresponding to 7 of the 13 states, suspended the import of 37 million doses due to the restrictions imposed by Anvisa. These doses will supply Mexico, Argentina and Bolivia.[154]
Further development[edit]
Heterologous prime-boost vaccination[edit]
On 21 December 2020 the Russian Direct Investment Fund (RDIF), the Gamaleya National Center, AstraZeneca and R-Pharm signed an agreement aimed at the development and implementation of a clinical research program to assess the immunogenicity and safety of the combined use of one of the components of the Sputnik V vaccine developed by the Gamaleya Center, and one of the components of the Oxford–AstraZeneca vaccine.[155] The study program will last 6 months in several countries, and it is planned to involve 100 volunteers in each study program. On 9 February 2021, the Ministry of Health of the Republic of Azerbaijan allowed clinical studies in the country for the combined use of the Oxford–AstraZeneca vaccine and Sputnik Light, stating that the trials would begin before the end of February 2021.[156][157] On February 20, 2021, in the official Sputnik V Twitter account it was stated that clinical trials have already started.[158]
Society and culture[edit]
Economics[edit]
In Russia[edit]
Medical worker in Moscow with the vaccine
Vaccination of military personnel and civilian specialists of the Northern Fleet with the second component of the drug «Gam-COVID-Vac» («Sputnik V»)
The vaccine is free of charge to users in Russia and Kazakhstan. The cost per dose would be less than US$10 (US$20 for the required two doses) on international markets, much less than the cost of mRNA vaccines from other manufacturers. Kirill Dmitriev, head of the fund, told reporters that over 1 billion doses of the vaccine are expected to be produced in 2021 outside of Russia.[159][160]
The head of the Gamaleya Research Institute Alexander Ginzburg estimated that it would take 9–12 months to vaccinate the vast majority of the Russian population, assuming in-country resources were adequate.[161][162]
The commercial release of the Gam-COVID-Vac was first scheduled for September 2020. In October, Mikhail Murashko said that the Gam-COVID-Vac would be free for all Russian citizens after the launching of mass production.[163][164] Later on, the Russian Ministry of Health registered the maximum ex-factory price equal to 1,942 roubles for two components and included it into The National List of Essential medicines.[165] There were also suggestions to include the vaccine in the National Immunisation Calendar of Russia.[165]
In the beginning of December 2020, Russian authorities announced the start of a large-scale free of charge vaccination with Gam-COVID-Vac for Russian citizens: the immunization program was launched on 5 December 2020 (with 70 medical centers in Moscow providing vaccinations).[166]
Doctors and other medical workers, teachers, and social workers were given priority due to their highest risk of exposure to the disease.[167] Initially the vaccine was only offered to people over 60 years of age, later this restriction was lifted.[168]
Potential recipients were notified via text messaging, which said «You are working at an educational institution and have top-priority for the COVID-19 vaccine, free of charge». Patients were asked a few general health questions before receiving the vaccine.[169][170][171] People with certain underlying health conditions, pregnant women, and those who have had a respiratory illness for the past two weeks were barred from vaccination.[167] The vaccine vial was removed from medical centre’s freezer about 15 minutes before use.
In early December 2020, the Minister of Health, Mikhail Murashko, said that Russia had already vaccinated more than 100,000 high-risk people.[172] Forty thousand of those were volunteers in Sputnik V’s Phase 3 trials, another 60,000 nurses and doctors had also taken the vaccine.[173] The head of the Russian Direct Investment Fund, Kirill Dmitriev, said in an interview with the BBC that Russian medics expected to give about 2 million people coronavirus vaccinations in December 2020.[174]
Up to the beginning of December 2020, Generium (which is supervised by Pharmstandard) and Binnopharm (which is supervised by AFK Sistema) companies produced Gam-COVID-Vac on a large scale.
On 10 December, Deputy Prime Minister Tatyana Golikova announced that approximately 6.9 million doses of the Sputnik V vaccine would enter civilian circulation in Russia before the end of February 2021.[175] Moscow Mayor Sergei Sobyanin announced that the newly opened Moscow-based «R-Pharm» will become a leading manufacturer of Russia’s Sputnik V coronavirus vaccine. Working at full capacity, the factory will produce up to 10 million doses a month.[176]
As of March 2021, vaccination rates in Russia were below those of other developed nations.[177]
In May 2021 Sergei Sobyanin complained that only 1.3 million Moscow residents out of 12 million had received the first dose (10.2%). Only 9.5% of Russians had received a vaccine.[178] Forbes Russia established that Russia committed to export 205 millions of doses of «Sputnik V» to other countries, and as of May 16.3 millions (8%) were so far delivered.[179] A survey found that 62% of the Russian population felt hesitant, with 55% not afraid of getting sick and some willing to wait for CoviVac.[180]
In June 2021, with the increase in Delta variant cases, several Russian city governments introduced strict measures to overcome vaccine hesitancy, such as requiring vaccine QR codes from customers in cafes.[180]
Outside Russia[edit]
In dark green are the countries that approved Sputnik V vaccine against COVID-19 (w/disputed Crimea). In light green are the countries that have shown interest in obtaining the vaccine. Light blue indicates current or future producers and dark blue the country origin of vaccine design (Russia).
Russia is pursuing deals to supply its vaccine abroad.[181]
According to the Russian Direct Investment Fund, they had received orders for more than 1.2 billion doses of the vaccine as of December 2020. Over 50 countries had made requests for doses, with supplies for the global market being produced by partners in India, Brazil, China, South Korea, Hungary, and other countries.[182][183] In August 2020, according to the Russian authorities, there were at least 20 countries that wanted to obtain the vaccine.[184]
The Israeli Hadassah Medical Center signed a commercial memorandum of understanding to obtain 1.5–3 million doses.[185]
Argentina agreed to buy 25 million doses of Russia’s COVID-19 vaccine, subject to its clearing clinical trials;[186] the vaccine was registered and approved in Argentina in late December 2020.[187] The Brazilian state of Bahia signed an agreement to conduct Phase III clinical trials of the Sputnik V vaccine and planned to buy 50 million doses to market in northeastern Brazil.[188]
On 21 January 2021, Argentine president Alberto Fernández became the first Latin American leader to be inoculated with Sputnik V, shortly after it was approved for use in the country.[189][190] Two months after being vaccinated he developed fever and headache, and tested positive for COVID-19.[191] He was asymptomatic ten days later, was discharged from medical treatment subject to medical follow-up as usual for former COVID-19 patients, and resumed his normal activities.[192]
According to The New York Times sources, in February 2021, Israel agreed to finance a supply of the Sputnik V vaccine to Syria in order to secure the release of an Israeli civilian held in Syria.[193]
Due to the delay in shipping of doses from Italy and the European Union, San Marino imported doses of the Sputnik V vaccine (not approved by the EMA) and started a mass vaccination on 28 February of its healthcare workers.[194]
April 14, 2021, Armenia agreed with Russia on purchase of 1 million doses of coronavirus vaccines Sputnik V. This was the decision of Armenian health minister Anahit Avanesyan. The Armenian authorities have begun negotiations with Russia on the production of the Sputnik V coronavirus vaccine. Head of the Armenian Ministry of Health Anahit Avanesyan stated this at a press conference on March 12, 2021.[195]
Scientific assessment[edit]
On 11 August 2020, a World Health Organization (WHO) spokesperson said, «… prequalification of any vaccine includes the rigorous review and assessment of all required safety and efficacy data».[9] A WHO assistant director said, «You cannot use a vaccine or drugs or medicines without following through all of these stages, having complied with all of these stages».[196]
Francois Balloux, a geneticist at University College London, called the Russian government’s approval of Gam-COVID-Vac a «reckless and foolish decision».[4] Professor Paul Offit, the director of the Vaccine Education Center at Children’s Hospital of Philadelphia, characterized the announcement as a «political stunt», and stated that the untested vaccine could be very harmful.[9]
Stephen Griffin, Associate Professor in the School of Medicine, University of Leeds, said «that we can be cautiously optimistic that SARS-CoV2 vaccines targeting the spike protein are effective.» Moreover, as the Sputnik antigen is delivered via a different modality, namely using a disabled Adenovirus rather than formulated RNA, this provides flexibility in terms of perhaps one or other method providing better responses in certain age-groups, ethnicities, etc., plus the storage of this vaccine ought to be more straightforward.[197]
In November 2020, public health expert Talha Khan Burki said the quick approval of Gam-COVID-Vac by the Russian government was «cutting corners», and may harm public confidence if the vaccine proves to be unsafe or ineffective.[8] «There is a huge risk that confidence in vaccines would be damaged by a vaccine that received approval and was then shown to be harmful», said immunologist Peter Openshaw.[8]
Ian Jones, a professor of virology at the University of Reading, and Polly Roy, professor and Chair of Virology at The London School of Hygiene and Tropical Medicine, commenting on phase III results published in the Lancet in February 2021, said «The development of the Sputnik V vaccine has been criticised for unseemly haste, corner cutting, and an absence of transparency. But the outcome reported here is clear and the scientific principle of vaccination is demonstrated, which means another vaccine can now join the fight to reduce the incidence of COVID-19.»[198]
On 12 May 2021, a group of biostatisticians published an article in The Lancet about data discrepancies and substandard reporting of interim data of the Sputnik V phase-III trial. According to the article, the lack of transparency of the trial results raises serious concerns. Data inconsistencies were found, including a very low probability of homogeneity of vaccine efficacy across age groups.[35]
Two preliminary studies, one from Argentina and one from San Marino, found mostly mild adverse events and no vaccine-associated deaths.[40] Another study carried out in San Marino has concluded a high tolerability profile in the population aged ≥60 years in terms of short-term adverse events following immunization.[199]
An article published by the journal Nature on 6 July 2021 cited data released by the United Arab Emirates on some 81,000 individuals who had received Sputnik V, according to which the vaccine demonstrated an efficacy of 97.8% in preventing symptomatic COVID-19, and 100% efficacy in preventing severe complications. The figures echoed similar findings from unpublished data on 3.8 million Russians, according to which Sputnik V demonstrated an efficacy of 97.7%.[200]
A study published by the Journal of Medical Internet Research analyzed the dataset consisted of 11,515 self-reported Sputnik V vaccine adverse events posted on Telegram. Telegram users complained mostly about pain, fever, fatigue, and headache.[201]
Public opinion polls[edit]
An opinion poll of Canadians conducted by Léger in August 2020 found that a majority (68%) would not take the Russian vaccine if offered a free dose, compared to 14% who said they would take it.
When Americans were asked the same question, 59% would not take the Russian vaccine if offered a free dose, compared to 24% who said they would take it.[202][203] In June 2021, according to a poll conducted by Ost-Ausschuss der Deutschen Wirtschaft [de] (German Eastern Business Association), a majority (60%) of Germans would use the Russian vaccine Sputnik V if they had the opportunity to do so. With 71% approval, the values in East Germany are significantly higher, but with 58% of the respondents there is also a solid majority in West Germany. 38% of respondents, on the other hand, would not want to use Sputnik V.[204]
In July 2020, opinion polls suggested around 90% of the Russian population had doubts about the vaccine but by September this had dropped to around half the Russian population.[205] In May 2021, the Levada Center released a poll of 1,614 respondents from 50 regions which showed that 26% of Russians were prepared to be vaccinated with Sputnik V, while 62% were not prepared to be vaccinated. Ten percent of respondents had already been vaccinated.[206]
References[edit]
- ^ a b «Sputnik V». Russian drug reference. Medum.ru.
- ^ a b Mcgeever J, Paraguassu L (4 June 2021). «Brazil’s Anvisa approves Russian Sputnik V vaccine, with conditions». Reuters. Retrieved 5 June 2021.
- ^ Official data on the vaccine and its manufacturers on the website of the state registration of medicines of the Ministry of Health of Russia
- ^ a b c d e f g Callaway E (August 2020). «Russia’s fast-track coronavirus vaccine draws outrage over safety». Nature. 584 (7821): 334–335. doi:10.1038/d41586-020-02386-2. PMID 32782400.
This is a reckless and foolish decision. Mass vaccination with an improperly tested vaccine is unethical. Any problem with the Russian vaccination campaign would be disastrous, both through its negative effects on health, but also because it would further set back the acceptance of vaccines in the population.
- ^ a b c d e f Cohen J (11 August 2020). «Russia’s approval of a COVID-19 vaccine is less than meets the press release». Science. Retrieved 13 August 2020.
- ^ a b c d e Logunov DY, Dolzhikova IV, Zubkova OV, Tukhvatullin AI, Shcheblyakov DV, Dzharullaeva AS, et al. (September 2020). «Safety and immunogenicity of an rAd26 and rAd5 vector-based heterologous prime-boost COVID-19 vaccine in two formulations: two open, non-randomised phase 1/2 studies from Russia». Lancet. 396 (10255): 887–897. doi:10.1016/S0140-6736(20)31866-3. PMC 7471804. PMID 32896291.
- ^ Mahase E (August 2020). «Covid-19: Russia approves vaccine without large scale testing or published results». BMJ. 370: m3205. doi:10.1136/bmj.m3205. PMID 32816758.
- ^ a b c d e Burki TK (November 2020). «The Russian vaccine for COVID-19». The Lancet. Respiratory Medicine. 8 (11): e85–e86. doi:10.1016/S2213-2600(20)30402-1. PMC 7837053. PMID 32896274.
- ^ a b c Berkeley Jr L (11 August 2020). «Scientists worry whether Russia’s Sputnik V’ coronavirus vaccine is safe and effective». CNBC. Retrieved 11 August 2020.
- ^ a b Macchia A, Ferrante D, Angeleri P, Biscayart C, Mariani J, Esteban S, et al. (October 2021). «Evaluation of a COVID-19 Vaccine Campaign and SARS-CoV-2 Infection and Mortality Among Adults Aged 60 Years And Older in a Middle-Income Country». JAMA Network Open. 4 (10): e2130800. doi:10.1001/jamanetworkopen.2021.30800. PMC 8556631. PMID 34714342.
- ^ «Russia expects WHO approval of Sputnik V vaccine by end of 2021 — RDIF».
- ^ a b c Hoffman M (9 April 2022). «How Russia’s Ukraine invasion doomed the Sputnik V coronavirus vaccine». The Washington Post. Retrieved 3 May 2022.
- ^ a b Webster P (March 2022). «Russian COVID-19 vaccine in jeopardy after Ukraine invasion». Nature Medicine: d41591–022–00042-y. doi:10.1038/d41591-022-00042-y. PMID 35293390. S2CID 247475281.
- ^ a b «Treasury Prohibits Transactions with Central Bank of Russia and Imposes Sanctions on Key Sources of Russia’s Wealth». U.S. Department of the Treasury. Retrieved 25 April 2022.
- ^ According to Russian law, citizens aged 18 and over are considered adults and are vaccinated with the Gam-COVID-Vac vaccine.
- ^ Rinat S, Ivanova P (17 November 2020). «Russia focuses on freeze-dried vaccine doses as transport fix». Reuters. Moscow. Retrieved 16 March 2021.
- ^ Balakrishnan VS (October 2020). «The arrival of Sputnik V». The Lancet. Infectious Diseases. 20 (10): 1128. doi:10.1016/S1473-3099(20)30709-X. PMC 7511201. PMID 32979327.
- ^
Irfan U (11 December 2020). «Why staying cold is so important to a Covid-19 vaccine. The Moderna and Pfizer vaccines need to be stored at low temperatures. Are global health systems prepared?». Vox. Retrieved 27 December 2020. - ^ a b «An Open Study of the Safety, Tolerability and Immunogenicity of the Drug ‘Gam-COVID-Vac’ Vaccine Against COVID-19». ClinicalTrials.gov. 22 June 2020.
- ^
Sokolov A (12 December 2020). «Сколько хотят заработать на прививках от коронавируса». Vedomosti. Archived from the original on 12 August 2020. Retrieved 20 December 2020. - ^
«Нормативная документация ЛП-006395-110820» (PDF) (in Russian). Russian Ministry of Health. 2020. Archived from the original (PDF) on 10 February 2021. Retrieved 21 September 2020. - ^ «Russia launches Sputnik Light vaccine into wide circulation». reuters. Moscow. 29 June 2021. Retrieved 25 June 2021.
- ^ «RDIF offers Pfizer to start trial with Sputnik Light as booster». Sputnik Vaccine. Twitter. 11 August 2021. Retrieved 13 August 2021.
- ^ «Single dose vaccine, Sputnik Light, authorized for use in Russia». sputnikvaccine.com. 5 May 2021. Retrieved 13 August 2021.
- ^ a b «COVID-19 Vaccines are Effective». Center for Disease Control and Prevention. 29 June 2022. Retrieved 23 July 2022.
- ^ a b «Vaccine efficacy, effectiveness and protection». World Health Organization. 14 July 2022.
- ^ Krause P, Fleming TR, Longini I, Henao-Restrepo AM, Peto R (September 2020). «COVID-19 vaccine trials should seek worthwhile efficacy». Lancet. 396 (10253): 741–743. doi:10.1016/S0140-6736(20)31821-3. PMC 7832749. PMID 32861315.
WHO recommends that successful vaccines should show an estimated risk reduction of at least one-half, with sufficient precision to conclude that the true vaccine efficacy is greater than 30%. This means that the 95% CI for the trial result should exclude efficacy less than 30%. Current US Food and Drug Administration guidance includes this lower limit of 30% as a criterion for vaccine licensure.
- ^ Khoury DS, Cromer D, Reynaldi A, Schlub TE, Wheatley AK, Juno JA, et al. (July 2021). «Neutralizing antibody levels are highly predictive of immune protection from symptomatic SARS-CoV-2 infection». Nature Medicine. 27 (7): 1205–1211. doi:10.1038/s41591-021-01377-8. PMID 34002089. S2CID 234769053.
- ^ Dobrovidova O (26 August 2021). «Russia’s Sputnik V protects against severe COVID-19 from Delta variant, study shows». Science AAAS. Retrieved 28 August 2021.
- ^ Barchuk A, Cherkashin M, Bulina A, Berezina N, Rakova T, Kuplevatskaya D, Stanevich O, Skougarevskiy D, Okhotin A (26 August 2021). «Vaccine Effectiveness against Referral to Hospital and Severe Lung Injury Associated with COVID-19: A Population-Based Case-Control Study in St. Petersburg, Russia». medRxiv (Preprint). doi:10.1101/2021.08.18.21262065. S2CID 237267404.
- ^ Vokó Z, Kiss Z, Surján G, Surján O, Barcza Z, Pályi B, et al. (March 2022). «Nationwide effectiveness of five SARS-CoV-2 vaccines in Hungary-the HUN-VE study». Clinical Microbiology and Infection. 28 (3): 398–404. doi:10.1016/j.cmi.2021.11.011. PMC 8612758. PMID 34838783.
Table 2
- ^ Bello-Chavolla OY, Antonio-Villa NE, Valdés-Ferrer SI, Fermín-Martínez CA, Fernández-Chirino L, Ramírez-García D, et al. (5 April 2022). «Effectiveness of a nation-wide COVID-19 vaccination program in Mexico». medRxiv. doi:10.1101/2022.04.04.22273330. S2CID 247953615.
- ^ Jones I, Roy P (February 2021). «Sputnik V COVID-19 vaccine candidate appears safe and effective». Lancet. 397 (10275): 642–643. doi:10.1016/S0140-6736(21)00234-8. PMC 7906719. PMID 33545098.
- ^ a b Logunov DY, Dolzhikova IV, Shcheblyakov DV, Tukhvatulin AI, Zubkova OV, Dzharullaeva AS, et al. (February 2021). «Safety and efficacy of an rAd26 and rAd5 vector-based heterologous prime-boost COVID-19 vaccine: an interim analysis of a randomised controlled phase 3 trial in Russia». Lancet. 397 (10275): 671–681. doi:10.1016/s0140-6736(21)00234-8. PMC 7852454. PMID 33545094.
- ^ a b Bucci EM, Berkhof J, Gillibert A, Gopalakrishna G, Calogero RA, Bouter LM, et al. (May 2021). «Data discrepancies and substandard reporting of interim data of Sputnik V phase 3 trial». Lancet. 397 (10288): 1881–1883. doi:10.1016/S0140-6736(21)00899-0. PMID 33991475.
- ^ Logunov DY, Dolzhikova IV, Tukhvatullin AI, Shcheblyakov DV (October 2020). «Safety and efficacy of the Russian COVID-19 vaccine: more information needed — Authors’ reply». Lancet. 396 (10256): e54–e55. doi:10.1016/S0140-6736(20)31970-X. PMC 7503057. PMID 32971043.
- ^ Sheldrick KA, Meyerowitz-Katz G, Tucker-Kellogg G (20 June 2022). «Plausibility of Claimed Covid-19 Vaccine Efficacies by Age: A Simulation Study». American Journal of Therapeutics. 29 (5): e495–e499. doi:10.1097/MJT.0000000000001528. PMID 35723559. S2CID 249869225.
- ^ King A (23 June 2022). «New questions raised over Sputnik Covid vaccine results point to fraudulent practices». Chemistry World. Retrieved 18 July 2022.
- ^ «Sputnik Vaccine Efficacy Data Published In Lancet Are ‘Statistically Impossible’ — Health Policy Watch». 13 July 2022. Retrieved 18 July 2022.
- ^ a b Nogrady B (July 2021). «Mounting evidence suggests Sputnik COVID vaccine is safe and effective». Nature. 595 (7867): 339–340. Bibcode:2021Natur.595..339N. doi:10.1038/d41586-021-01813-2. PMID 34230663. S2CID 235757906.
- ^ «Coronavirus Vaccine Trials Advance in Race for Covid-19 Protection». Bloomberg.com. Bloomberg. Retrieved 10 August 2020.
- ^ Wold WS, Toth K (December 2013). «Adenovirus vectors for gene therapy, vaccination and cancer gene therapy». Current Gene Therapy. 13 (6): 421–433. doi:10.2174/1566523213666131125095046. PMC 4507798. PMID 24279313.
- ^ Zhang C, Zhou D (August 2016). «Adenoviral vector-based strategies against infectious disease and cancer». Human Vaccines & Immunotherapeutics. 12 (8): 2064–2074. doi:10.1080/21645515.2016.1165908. PMC 4994731. PMID 27105067.
- ^ Kirschweger G (January 2003). «Crucell: biopharmaceuticals—as human as they get». Molecular Therapy. 7 (1): 5–6. doi:10.1016/S1525-0016(02)00045-X. PMID 12613447.
- ^ a b Wadman M (5 June 2020). «Abortion opponents protest COVID-19 vaccines’ use of fetal cells». Science.
- ^ Tan E, Chin CS, Lim ZF, Ng SK (2021). «HEK293 Cell Line as a Platform to Produce Recombinant Proteins and Viral Vectors». Frontiers in Bioengineering and Biotechnology. 9: 796991. doi:10.3389/fbioe.2021.796991. PMC 8711270. PMID 34966729.
- ^ a b c d Moutinho S, Wadman M (30 April 2021). «Is Russia’s COVID-19 vaccine safe? Brazil’s veto of Sputnik V sparks lawsuit threat and confusion». Science. Retrieved 2 May 2021.
- ^ a b He TC, Zhou S, da Costa LT, Yu J, Kinzler KW, Vogelstein B (March 1998). «A simplified system for generating recombinant adenoviruses». Proceedings of the National Academy of Sciences of the United States of America. 95 (5): 2509–2514. Bibcode:1998PNAS…95.2509H. doi:10.1073/pnas.95.5.2509. PMC 19394. PMID 9482916.
- ^ a b Thomas P, Smart TG (2005). «HEK293 cell line: a vehicle for the expression of recombinant proteins». Journal of Pharmacological and Toxicological Methods. 51 (3): 187–200. doi:10.1016/j.vascn.2004.08.014. PMID 15862464.
- ^ a b c Kovesdi I, Hedley SJ (August 2010). «Adenoviral producer cells». Viruses. 2 (8): 1681–1703. doi:10.3390/v2081681. PMC 3185730. PMID 21994701.
- ^ Turner PJ, Ansotegui IJ, Campbell DE, Cardona V, Ebisawa M, El-Gamal Y, et al. (February 2021). «COVID-19 vaccine-associated anaphylaxis: A statement of the World Allergy Organization Anaphylaxis Committee». The World Allergy Organization Journal. 14 (2): 100517. doi:10.1016/j.waojou.2021.100517. PMC 7857113. PMID 33558825.
Tris (hydroxymethyl) aminomethane, sodium chloride, sucrose, magnesium chloride hexahydrate, Sodium EDTA, polysorbate 80, ethanol, water for injection
- ^ «ИНСТРУКЦИЯ ПО МЕДИЦИНСКОМУ ПРИМЕНЕНИЮ ЛЕКАРСТВЕННОГО ПРЕПАРАТА Гам-КОВИД-Вак, Комбинированная векторная вакцина для профилактики коронавирусной инфекции, вызываемой вирусом SARS-CoV-2» (PDF). МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ.
- ^ Pushparajah D, Jimenez S, Wong S, Alattas H, Nafissi N, Slavcev RA (March 2021). «Advances in gene-based vaccine platforms to address the COVID-19 pandemic». Advanced Drug Delivery Reviews. Elsevier. 170: 113–141. doi:10.1016/j.addr.2021.01.003. PMC 7789827. PMID 33422546.
Viral vector vaccines confer high gene transduction capabilities due to the natural ability of viruses to infect host cells. These vaccines do not require adjuvants due to the presence of viral components that stimulate the innate immune system.
- ^ «Голикова назвала сроки выпуска первых партий вакцин НИЦ Гамалеи и «Вектора»» [Golikova announced the timing of the release of the first batches of vaccines of the Research Center of Gamaleya and «Vector»] (in Russian). Interfax. 29 July 2020.
- ^
«Запущено производство российской антикоронавирусной вакцины» [Production of Russian anti-coronavirus vaccine launched] (in Russian). Vesti. 15 August 2020. Retrieved 21 September 2020. - ^ Foy H, Seddon M, Sciorilli SB (10 March 2021). «Russia seeks to make Sputnik V in Italy as overseas demand surges». Financial Times. Retrieved 10 March 2021.
- ^ a b Ahmed A, Kumar AM (11 January 2021). «Russia’s Sputnik V vaccine found safe in India mid-stage trial — Dr.Reddy’s». Reuters. Retrieved 26 January 2021.
- ^ «More Countries Line Up for Russia’s Sputnik V Coronavirus Vaccine». The Moscow Times. 13 November 2020.
- ^ «Dr Reddy’s Laboratories launches Sputnik V COVID-19 vaccine in India at Rs 995 per dose-India News, Firstpost». Firstpost. 14 May 2021. Retrieved 14 May 2021.
- ^ «In Latin American first, Argentina to produce Russia’s Sputnik V vaccine». France 24. 20 April 2021. Retrieved 2 July 2021.
- ^ «Laboratorios Richmond set to begin manufacturing Sputnik V second doses». Buenos Aires Times. 30 June 2021. Retrieved 2 July 2021.
- ^ «COVID-19 vaccine production, to December 31st, 2021». Global Commission for Post-Pandemic Policy. 12 January 2022. Retrieved 19 September 2021.
- ^ a b Webster P (March 2022). «Russian COVID-19 vaccine in jeopardy after Ukraine invasion». Nature Medicine: d41591–022–00042-y. doi:10.1038/d41591-022-00042-y. PMID 35293390. S2CID 247475281.
- ^ «RUSSIAN DIRECT INVESTMENT FUND». www.opensanctions.org. Retrieved 25 April 2022.
- ^ «A Royal Mark Up: How an Emirati Sheikh Resells Millions of Russian Vaccines to the Developing World». The Moscow Times. 9 July 2021. Retrieved 10 July 2021.
- ^ «Kenya’s Failed Sputnik V Deal Used Emirati Resale Scheme». The Moscow Times. 19 July 2021. Retrieved 19 July 2021.
- ^ «Russia plans to start producing coronavirus vaccine in September». Daily Sabah. 13 June 2020. Retrieved 10 August 2020.
- ^ Ermakov A (11 August 2020). «Вакцина от COVID-19 – в словах чиновников и документах разработчика» [Vaccine for COVID-19 — in the words of officials and developer documents] (in Russian). Fontanka.ru. Retrieved 21 September 2020.
- ^ Tétrault-Farber G, Soldatkin V (11 August 2020). «Russia becomes first country to approve a COVID-19 vaccine, says Putin». Reuters. Moscow. Retrieved 11 August 2020.
- ^ «About the vaccine to prevent the novel coronavirus infection COVID-19, «Gam-COVID-Vac», developed by the National Research Centre for Epidemiology and Microbiology named after academician N. F. Gamalei of the Ministry of Health of the Russian Federation». Federal Service for Surveillance in Healthcare. 12 August 2020. Retrieved 18 August 2020.
- ^
«Ministry of Health of the Russian Federation has issued a registration certification № ЛП-006395 dated 11 August 2020 for a vaccine to prevent the novel coronavirus infection COVID-19». Federal Service for Surveillance in Healthcare. 11 August 2020. Retrieved 21 September 2020. - ^ «Coronavirus: Putin says vaccine has been approved for use». BBC. 11 August 2020. Retrieved 11 August 2020.
- ^ Ivanova P (12 June 2021). «Russia tests COVID-19 vaccine as nasal spray for children». Reuters. Moscow. Retrieved 11 July 2021.
- ^ Ellyatt H (10 September 2020). «Scientists question ‘strange’ data in Russian coronavirus vaccine trial after ‘unlikely’ patterns». CNBC. Retrieved 10 September 2020.
- ^ Logunov DY, Dolzhikova IV, Tukhvatullin AI, Shcheblyakov DV (October 2020). «Safety and efficacy of the Russian COVID-19 vaccine: more information needed — Authors’ reply». Lancet. 396 (10256): e54–e55. doi:10.1016/S0140-6736(20)31970-X. PMC 7503057. PMID 32971043. S2CID 221805026.
- ^ «Hadassah bringing 1.5 million doses of Russian COVID-19 vaccine to Israel». The Jerusalem Post | JPost.com. Retrieved 19 November 2020.
- ^ «Clinical Trial of Efficacy, Safety, and Immunogenicity of Gam-COVID-Vac Vaccine Against COVID-19». National Library of Medicine. Retrieved 28 September 2020.
- ^ «Clinical Trial of Efficacy, Safety, and Immunogenicity of Gam-COVID-Vac Vaccine Against COVID-19 in Belarus». clinicaltrials.gov. December 2020. Retrieved 14 January 2021.
- ^ «UAE volunteers receive Russian Covid-19 vaccine». Khaleej Times. 10 January 2021.
- ^ Bharadwaj S (15 January 2021). «Dr Reddy’s gets DCGI nod for Covid-19 vaccine Sputnik V Phase III trials». The Times Of India.
- ^ Clinical trial number NCT04642339 for «Clinical Trial of the Immunogenicity, Safety, and Efficacy of the Gam-COVID-Vac Vaccine Against COVID-19 in Venezuela» at ClinicalTrials.gov
- ^ «India says its safety study of Sputnik V vaccine comparable to Russian trial». Reuters. 13 April 2021.
- ^ Rodríguez R, Caeiro JP, Juri H, Pizzi R, Gallego S, Blanco S, et al. (25 May 2021). Evaluacion de la respuesta de anticuerpos neutralizantes a la vacuna Sputnik V en una cohorte en Cordoba y evaluación de las propiedades neutralizantes de anticuerpos naturales y vacunales frente a la variante Manaos [Evaluation of the neutralizing antibody response to the Sputnik V vaccine in a cohort in Cordoba and evaluation of the neutralizing properties of natural and vaccine antibodies against the Manaus variant] (Technical report) (in Spanish). National University of Córdoba. Retrieved 22 June 2021.
- ^ «Coronavirus: la vacuna Sputnik V genera anticuerpos para las variantes que circulan en el país» [Coronavirus: the Sputnik V vaccine generates antibodies for the variants that circulate in the country]. La Nación (in Spanish). 30 June 2021. Retrieved 11 July 2021.
- ^ Ikegame S, Siddiquey MN, Hung CT, Haas G, Brambilla L, Oguntuyo KY, et al. (July 2021). «Neutralizing activity of Sputnik V vaccine sera against SARS-CoV-2 variants». Nature Communications. 12 (1): 4598. Bibcode:2021NatCo..12.4598I. doi:10.1038/s41467-021-24909-9. PMC 8313705. PMID 34312390.
- ^ Mullin J, Malnick E (1 August 2020). «Britain unlikely to use Russia’s ‘untrustworthy’ Covid vaccine». The Telegraph. Archived from the original on 19 August 2020. Retrieved 6 September 2020.
- ^ «Belarus registers Sputnik V vaccine, in first outside Russia – RDIF». Reuters. 21 December 2020. Retrieved 22 December 2020.
- ^ Turak N (21 January 2021). «Russia’s Sputnik vaccine gets its first approval in the EU, greenlight from UAE amid ongoing trials». CNBC.
- ^ «Coronavirus: Hungary first in EU to approve Russian vaccine». BBC News. 21 January 2021.
- ^ Walker S (21 January 2021). «Hungary breaks ranks with EU to license Russian vaccine». The Guardian.
- ^ «Hungary Becomes First in EU to Approve Russian Covid Vaccine». Bloomberg.com. 21 January 2021.
- ^ «COVID: Hungary fast-tracks Russian vaccine with EU approval in the works | DW | 21.01.2021». DW.COM.
- ^ «Russia files for Sputnik vaccine registration in EU». Euractiv.com. 20 January 2021.
- ^ «Clarification on Sputnik V vaccine in the EU approval process» (Press release). European Medicines Agency (EMA). 10 February 2021.
- ^ a b «EMA starts rolling review of the Sputnik V COVID-19 vaccine» (Press release). European Medicines Agency (EMA). 4 March 2021. Retrieved 4 March 2021.
- ^ Rinke A, Parodi E (16 June 2021). «EU approval of Russia’s Sputnik V vaccine delayed, sources say». Reuters. Berlin. Retrieved 16 June 2021.
- ^ «COVID-19 vaccines». European Medicines Agency. Retrieved 16 June 2021.
- ^ «Da la Cofepris autorización para que la vacuna Sputnik V se aplique en México». Diario de Yucatán (in Spanish). 2 February 2021.
- ^ «Iran approves Russia’s Sputnik V COVID-19 vaccine». Al Jazeera.
- ^ Reuters Staff (26 January 2021). «Iran approves Russian coronavirus vaccine Sputnik V». Reuters.
- ^ «Czech Republic turns to Russian vaccine amid soaring COVID cases». Al Jazeera. 28 February 2021. Retrieved 1 March 2021.
- ^ Muller R, Hovet J (7 April 2021). «Czech PM names fourth health minister amid Sputnik vaccine strife». Reuters. Retrieved 8 April 2021.
- ^ Šnajdrová T. «Arenberger má záznamy ve složkách StB. Byl jsem člen KSČ, spolupracovník StB ne, brání se nový ministr» [Arenberger has records in the StB files. I was a member of the Communist Party of the Czech Republic, but not an employee of the StB, the new minister is defending himself]. Refresher (in Czech). Retrieved 8 April 2021.
- ^ «EMA starts rolling review of the Sputnik V COVID-19 vaccine». www.ema.europa.eu. 4 March 2021.
- ^ «EU medical official warns of Sputnik jab ‘Russian roulette’«. www.france24.com. 8 March 2021.
- ^ «German leaders urge quick EU approval of Russia’s Sputnik V jab» thelocal.de. Retrieved 20 March 2021.
- ^ «Philippines grants emergency authorization for Russia’s Sputnik V vaccine». ABS-CBN News. 19 March 2021. Retrieved 19 March 2021.
- ^ «Russia’s Sputnik V approved for emergency use in PH». CNN Philippines. 19 March 2021. Retrieved 19 March 2021.
- ^ «Russia’s Covid vaccine Sputnik V gets nod from expert panel for emergency use in India: Report». The Indian Express. 12 April 2021.
- ^ Das KN (12 April 2021). «Indian panel gives emergency approval for Russia’s Sputnik V vaccine -sources». Reuters.
- ^ «SPUTNIK V VACCINE AUTHORIZED IN INDIA». sputnikvaccine.com. 12 April 2021. Retrieved 12 April 2021.
- ^ «Bangladesh approves emergency use of Russian vaccine Sputnik V». New Age. 27 April 2021. Retrieved 27 April 2021.
- ^ «Turkey OKs emergency use of Sputnik-V vaccine». Anadolu Agency. Retrieved 30 April 2021.
- ^ «Russian Direct Investment Fund». rdif.ru. Retrieved 7 May 2021.
- ^ «Sputnik V vaccines landed in Slovakia». The Slovak Spectator. 1 March 2021. Retrieved 2 March 2021.
- ^ Higgins A (8 April 2021). «Slovakia Claims a Bait-and-Switch With the Russian Vaccines it Ordered». The New York Times. ISSN 0362-4331. Archived from the original on 28 December 2021. Retrieved 11 April 2021.
- ^ a b «Russia calls on Slovakia to return Sputnik V doses after dispute». Reuters. 8 April 2021. Retrieved 12 April 2021.
- ^ «Výrobca Sputnika V nedodal kontrolórom väčšinu potrebných dát». domov.sme.sk (in Slovak). 8 April 2021. Retrieved 12 April 2021.
- ^ «Slovak Regulator Says Sputnik V It Got Differs From Vaccine In Reviews». RadioFreeEurope/RadioLiberty. Retrieved 8 April 2021.
- ^ «Russian Direct Investment Fund asks Slovakia to return batch of ‘Sputnik V’ vaccines». meduza.io. 8 April 2021. Retrieved 12 April 2021.
- ^ a b «964/2021 | Centrálny register zmlúv». www.crz.gov.sk. Retrieved 11 May 2021.
- ^ a b Osvaldová L (30 April 2021). «Zmluva o nákupe Sputnika je nevýhodná a môže vojsť do dejín ako ďalší amatérsky počin, hovoria právnici». Denník N (in Slovak). Retrieved 11 May 2021.
- ^ «Výhody jen pro Rusko, lži Matoviče. Slováci znají obsah smlouvy o Sputniku». iDNES.cz. 30 April 2021. Retrieved 11 May 2021.
- ^ «Matovič oznamuje očkovanie Sputnikom, Lengvarský o tom nevie» [Matovič announces vaccination with Sputnik, Lengvarský is unaware]. Denník N (in Slovak).
- ^ «List RDIF Denníku N». Archived from the original on 11 May 2021.
On the 8th of April Dennik N published an article by Veronika Folentová entitled «Čo píše v stanovisku štátny ústav o Sputniku? Vakcíny v rôznych krajinách spája len názov» dennikn.sk/2343450/co-pise-v-stanovisku-statny-ustav-o-sputniku-vakciny-v-roznych-krajinach-spaja-len-nazov/
The article referred to the number of incorrect and misleading statements made by the Slovak regulator – State Institute for Drug Control (SUKL), which used for incorrect testing not EU-certified laboratory. RDIF and the Gamaleya Institute repeatedly insisted that all these statements were false and incorrect and rejected the Slovak allegations as «fake news».
<…>
We are concerned that your article in its current form contains unsubstantiated and false statements made by SUKL earlier and now refuted by the certified lab.
<…>
Therefore, we ask you to either remove the article entirely or reflect our position by publishing the above mentioned comments in full by the end of the day on May 9, 2021, as it is absolutely critical for us and shows the reality of the situation as well as reflects the enormous efforts by RDIF and partners in fighting the pandemic. Otherwise, RDIF reserves all rights to protect its reputation and legitimate interests and be compensated for any caused harm, including by commencing court proceedings against Dennik N in any relevant jurisdiction. - ^ «Denník N Rejects Russia’s Demand to Withdraw Story on Sputnik Vaccine». Denník N. Archived from the original on 11 May 2021.
- ^ «Slovak health ministry says Sputnik V doses tested in Hungary satisfactory». Reuters. 9 May 2021. Retrieved 26 May 2021.
- ^ Hopková D. «Koronavírus: Sputnikom V by sa mohlo na Slovensku očkovať od júna». Aktuality.sk (in Slovak). Retrieved 26 May 2021.
- ^ Reuters Staff (12 May 2021). «Slovakia could start giving Sputnik shots in June, minister says». Reuters. Retrieved 26 May 2021.
- ^ Teraz.sk (5 June 2021). «Očkovanie vakcínou Sputnik V sa spúšťa v krajoch postupne». TERAZ.sk (in Slovak). Retrieved 16 June 2021.
- ^ a b «Slovakia has no plans to receive new batches of Sputnik V vaccine — minister». TASS. Retrieved 16 June 2021.
- ^ Teraz.sk (8 June 2021). «Na vakcínu Sputnik V aktuálne čaká 4423 ľudí». TERAZ.sk (in Slovak). Retrieved 16 June 2021.
- ^ Teraz.sk (16 June 2021). «Lengvarský: Zvyšné dávky Sputniku V by SR mohla predať či darovať». TERAZ.sk (in Slovak). Retrieved 16 June 2021.
- ^ «Slovakia sells most Sputnik V vaccine doses back to Russia». Reuters. 2 July 2021. Retrieved 8 July 2021.
- ^ «Povolenie na terapeutické použitie neregistrovaného lieku» (PDF). 1 March 2021. Retrieved 8 July 2021.
- ^ «Zmätky s vakcínami pokračujú. Aký Sputnik máme v skladoch?». Pravda.sk (in Slovak). 14 April 2021. Retrieved 8 July 2021.
- ^ «After low demand, Slovakia delivers its last doses of Sputnik V». euronews. 1 September 2021. Retrieved 2 September 2021.
- ^ «Kauzu Sputnik V, po ktorej padla Matovičova vláda, polícia uzavrela». Denník Štandard (in Slovak). Retrieved 11 October 2022.
- ^ «COVID: Brazil regulator rejects Russia’s Sputnik vaccine». Deutsche Welle. Reuters. 27 April 2021. Retrieved 27 April 2021.
- ^ Brito R, Ivanova P (27 April 2021). «Brazil health regulator rejects Russia’s Sputnik vaccine». Reuters. Retrieved 27 April 2021.
- ^ «Russia says Brazil refusal to import Sputnik V ‘Political’«. Al Jazeera. 27 April 2021. Retrieved 27 April 2021.
- ^ Brito R (26 April 2021). «Brazil health regulator rejects Russia’s Sputnik vaccine». Coronavirus. Retrieved 28 April 2021.
- ^ a b «Anvisa nega pedido de importação da vacina Sputnik V; entenda as razões». BBC News Brasil (in Brazilian Portuguese). Retrieved 28 April 2021.
- ^ Cunningham E, Dixon R. «Brazil rejects Russia’s Sputnik V coronavirus vaccine, citing safety concerns». The Washington Post. ISSN 0190-8286. Retrieved 28 April 2021.
- ^ Osborn A, Paraguassu L (29 April 2021). «Russian vaccine developer to sue Brazilian regulator for defamation». Reuters. Moscow, Brasília. Retrieved 29 April 2021.
- ^ Paraguassu L, Brito R (29 April 2021). «Anvisa rebate «grave acusação» de fabricantes da Sputnik e divulga documentos e vídeo de reunião» [Anvisa counters Sputnik manufacturers’ «serious accusation» and releases documents and meeting video] (in Brazilian Portuguese). Brasilia: Istoé Dinheiro. Reuters Brasil. Retrieved 29 April 2021.
- ^ «Brazil says Russian Covid vaccine carried live cold virus». France 24. Washington. Agence France-Presse. 28 April 2021. Retrieved 30 April 2021.
- ^ Lowe D (28 April 2021). «Brazil Rejects the Gamaleya Vaccine». In the Pipeline. Science Translational Medicine. Retrieved 30 April 2021.
- ^ Lowe D (28 April 2021). «Russian Vaccine Behavior». In the Pipeline. Science Translational Medicine. Retrieved 30 April 2021.
- ^ Laing A (30 April 2021). «Chilean regulator sees no clouds over Sputnik vaccine despite Brazilian rejection». Reuters. Retrieved 3 May 2021.
- ^ Alegretti L, Barifouse R (4 June 2021). «Covaxin e Sputnik V: O que muda na vacinação do Brasil com decisão da Anvisa» [Covaxin and Sputnik V: What changes in vaccination in Brazil after Anvisa’s decision]. BBC Brasil (in Portuguese). Retrieved 5 June 2021.
- ^ «Anvisa aprova, com restrições, a importação excepcional de doses da Covaxin e Sputnik V» [Anvisa approves import of doses of Covaxin and Sputnik V, with restrictions]. G1 (in Portuguese). Globo. 4 June 2021. Retrieved 4 June 2021.
- ^ «Anvisa autoriza importação excepcional da Sputnik V por mais 7 estados, também com restrições» [Anvisa authorizes exceptional import of Sputnik V for 7 more states, also with restrictions]. G1 (in Portuguese). Globo. 16 June 2021. Retrieved 16 June 2021.
- ^ «Brazil’s northeastern states drop plan to buy Russia’s COVID vaccine». Reuters. 5 August 2021. Retrieved 5 August 2021.
- ^ «RDIF, The Gamaleya National Center, AstraZeneca and R-Pharm sign an agreement to cooperate on COVID-19 vaccine development». The Russian Direct Investment Fund. 21 December 2020.
- ^ «Azerbaijan allowed for the first in the world to study a combination of «Sputnik V» vaccine and COVID-19 vaccine developed by «AstraZeneca» Company». MoH of Azerbaijan. 9 February 2021.
- ^ «Study in Adults to Determine the Safety and Immunogenicity of AZD1222, a Non-replicating ChAdOx1 Vector Vaccine, Given in Combination With rAd26-S, Recombinant Adenovirus Type 26 Component of Gam-COVID-Vac Vaccine, for the Prevention of COVID-19». ClinicalTrials.gov. U.S. National Library of Medicine. 14 January 2021. NCT04686773. Retrieved 9 February 2021.
- ^ «Sputnik V twitter account». 20 February 2021.
- ^ Litvinova D (24 November 2020). «Russian virus vaccine to cost less than $10 per dose abroad». Associated Press.
- ^ Osborn A, Nikolskaya P (24 November 2020). «Russia’s Sputnik COVID-19 vaccine to cost less than $20 per person internationally». The Globe and Mail. Retrieved 28 November 2020.
- ^ «Центр Гамалеи назвал сроки вакцинации большей части населения России». RBK. 4 September 2020. Retrieved 6 September 2020.
- ^ Sagdiev R, Ivanova P, Nikolskaya P, Swift R, Smout A (17 November 2020). Mason J, Macfie N (eds.). «Russia focuses on freeze-dried vaccine doses as transport fix». Reuters. Moscow. Retrieved 20 November 2020.
- ^ «Минздрав пообещал россиянам бесплатную вакцинацию от COVID-19» [Ministry of Health promised Russians free vaccination against COVID-19]. RBC.ru (in Russian). Retrieved 23 October 2020.
- ^ «В будущем вакцинация от COVID-19 будет проходить бесплатно» [In the future, vaccination against COVID-19 will be free of charge]. Russian Newspaper (in Russian). 11 October 2020. Retrieved 23 October 2020.
- ^ a b
«Минздрав зарегистрировал предельную отпускную цену на вакцину «Спутник V»» [The Ministry of Health registered the maximum selling price for the Sputnik V vaccine] (in Russian). RIA. 5 December 2020. Retrieved 21 September 2020. - ^ «Covid: Russia begins vaccinations in Moscow». BBC. 5 December 2020. Retrieved 11 December 2020.
- ^ a b Soldatkin V, Oziel C (5 December 2020). Char P (ed.). «Moscow rolls out Sputnik V COVID-19 vaccine to most exposed groups». Reuters.
- ^ «Russia approves Sputnik V COVID-19 vaccine for people over 60: media». Reuters. 26 December 2020.
- ^ «Covid: Russia begins vaccinations in Moscow». BBC News. 5 December 2020.
- ^ «Moscow delivers Russia’s Sputnik V coronavirus vaccine to clinics». The Guardian. Reuters. 5 December 2020.
- ^ «Coronavirus: Russia rolls out COVID vaccination in Moscow». Deutsche Welle. 5 December 2020.
- ^ Marrow A, Ostroukh A (2 December 2020). «Putin orders Russia to begin a large-scale voluntary COVID-19 vaccination program next week». The Globe and Mail. Retrieved 3 December 2020.
- ^ «COVID-19: Moscow opens Sputnik V clinics – but 100,000 have already had it». Sky News.
- ^
«Russia to vaccinate two million against COVID-19 in Dec – RDIF head to BBC». Reuters. 4 December 2020. Retrieved 21 September 2020. - ^
«About 6.9 mln doses of Sputnik V vaccine to enter circulation in Russia by end of February». TASS. 10 December 2020. Retrieved 21 September 2020. - ^
«Coronavirus in Russia: The Latest News». The Moscow Times. 22 December 2020. Retrieved 21 September 2020. - ^ Ritchie H, Ortiz-Ospina E, Beltekian D, Mathieu E, Hasell J, MacDonald B, et al. (5 March 2020). «Coronavirus (COVID-19) Vaccinations — Statistics and Research». Our World in Data. Retrieved 3 March 2021.
- ^ «Собянин заявил о минимальной доле привитых в Москве в сравнении с Европой». РБК (in Russian). Retrieved 25 May 2021.
- ^ «Дипломатический иммунитет: кто и в каком количестве покупает российскую вакцину». Forbes.ru (in Russian). Retrieved 25 May 2021.
- ^ a b Roth A (26 June 2021). «‘I don’t have a choice’: Russians scramble to get Covid vaccine amid new restrictions». The Guardian. Moscow. Retrieved 11 July 2021.
- ^ «Putin Battles to Sell Russia’s Vaccine in New Rift With West». Bloomberg.com. 31 December 2020. Retrieved 3 March 2021.
- ^ Rodgers J. «Facing Record COVID-19 Case Rise, Russia Rolls Out Sputnik V Vaccine». Forbes.
- ^ Arkhipov I, Kravchenko S (2 December 2020). «Putin Orders Start of Mass Covid-19 Shots Hours After U.K. News». Bloomberg News.
- ^ Meyer H, Arkhipov I. «Russia Defends First Covid-19 Vaccine as Safe Amid Skepticism». Bloomberg News. Retrieved 12 August 2020.
- ^ Jaffe-Hoffman M (12 November 2020). «Israel to receive Russia’s 92% effective COVID vaccine». The Jerusalem Post. Retrieved 19 November 2020.
- ^ «Argentina agrees to buy 25 million doses of Russia’s Covid-19 vaccine». www.batimes.com.ar. 3 November 2020.
- ^ «Argentina Approves Russian Vaccine With Plane Waiting in Moscow». Bloomberg.com. 23 December 2020.
- ^ Boadle A (24 October 2020). Wallis D (ed.). «Second Brazilian company to produce Russia’s Sputnik V COVID-19 vaccine». Reuters.
- ^ «Argentina’s president sits for Russian Covid jab». France 24. 21 January 2021.
- ^ Centenera M (21 January 2021). «Alberto Fernández, primer presidente de América Latina en vacunarse contra la covid-19 (in Spanish)». El País (in Spanish).
- ^ Rebaza C, Timm-Garcia J, Hu C (4 April 2021). «Argentina’s President tests positive for Covid-19 after vaccine». CNN.
- ^ «Alberto Fernández recibe el alta por COVID y retoma sus actividades» [Alberto Fernández is discharged from treatment for COVID and resumes his activities]. Perfil (in Spanish). 13 April 2021.
- ^ Kingsley P, Bergman R, Kramer AE (21 February 2021). «Israel Secretly Agrees to Fund Vaccines for Syria as Part of Prisoner Swap». The New York Times. ISSN 0362-4331. Archived from the original on 28 December 2021. Retrieved 3 March 2021.
- ^ Camparsi ML. «Vaccino Sputnik, a San Marino 400 dosi al giorno dal 1 marzo: «Sicurezza? Confortati dagli studi. Per ora lo diamo solo ai nostri cittadini» (in Italian). Il Fatto Quotidiano. Retrieved 1 March 2021.
- ^ «Армения приобретет миллион доз «Спутник V»«. rg.ru. 14 April 2021.
- ^ Nebehay S (11 August 2020). Shields M (ed.). «WHO says discussing new COVID-19 vaccine with Russia». Reuters. Geneva. Retrieved 11 August 2020.
- ^ Reuters Staff (2020-11-11). «Instant view-Russia says its Sputnik V COVID-19 vaccine is 92% effective»
- ^ Jones I, Roy P (February 2021). «Sputnik V COVID-19 vaccine candidate appears safe and effective». Lancet. 397 (10275): 642–643. doi:10.1016/S0140-6736(21)00191-4. PMC 7906719. PMID 33545098.
- ^ Montalti M, Soldà G, Di Valerio Z, Salussolia A, Lenzi J, Forcellini M, et al. (August 2021). «ROCCA observational study: Early results on safety of Sputnik V vaccine (Gam-COVID-Vac) in the Republic of San Marino using active surveillance». EClinicalMedicine. 38: 101027. doi:10.1016/j.eclinm.2021.101027. PMC 8413252. PMID 34505029.
- ^ Nogrady B, «Mounting evidence suggests Sputnik COVID vaccine is safe and effective» Nature, 595, 339–340 (2021)
- ^ Jarynowski A, Semenov A, Kamiński M, Belik V (18 May 2021) Mild Adverse Events of Sputnik V Vaccine in Russia: Social Media Content Analysis of Telegram via Deep Learning.Journal of Medical Internet Research, 23(11):e30529
- ^ Cyr E (24 August 2020). «Leger’s Weekly Survey» (PDF). leger360.com. Archived from the original (PDF) on 5 September 2020. Retrieved 5 September 2020.
- ^ «Leger’s Weekly Survey on Russian vaccine; saved copy on 5 38.com» (PDF).
- ^ «Klare Mehrheit wünscht engere Beziehungen zu Russland». Ost-Ausschuss der Deutschen Wirtschaft. 2 June 2021. Retrieved 7 July 2021.
- ^ Ullah Z, Chernova A (6 September 2020). «Putin’s vaccine meets opposition from frontline workers in Russia». CNN. Retrieved 6 September 2020.
- ^ «Majority of Russians Still Not Ready to Get Sputnik Vaccine – Poll». The Moscow Times. 12 May 2021. Retrieved 2 July 2021.
Further reading[edit]
- Corum J, Zimmer C (7 January 2021). «How Gamaleya’s Vaccine Works». The New York Times.
External links[edit]
Wikimedia Commons has media related to Sputnik V.
- Official website
«Sputnik V» redirects here. For the Soviet satellite known as Sputnik 5, see Korabl-Sputnik 2.

Russian Ministry of Health image of Gam-COVID-Vac vials |
|
| Vaccine description | |
|---|---|
| Target | SARS-CoV-2 |
| Vaccine type | Viral vector |
| Clinical data | |
| Trade names |
|
| Other names |
|
| License data |
|
| Routes of administration |
Intramuscular |
| ATC code |
|
| Legal status | |
| Legal status |
Full list of Sputnik V vaccine authorizations |
| Identifiers | |
| DrugBank |
|
Sputnik V (Russian: Спутник V, the brand name from RDIF) or Gam-COVID-Vac (Russian: Гам-КОВИД-Вак, the name under which it is legally registered and produced[3]) is an adenovirus viral vector vaccine for COVID-19 developed by the Gamaleya Research Institute of Epidemiology and Microbiology in Russia. It is the world’s first registered combination vector vaccine for the prevention of COVID-19, having been registered on 11 August 2020 by the Russian Ministry of Health.[4][5]
Gam-COVID-Vac was initially approved for distribution in Russia and then in 59 other countries (as of April 2021) on the preliminary results of Phase I–II studies eventually published on 4 September 2020.[6] Approval in early August of Gam-COVID-Vac was met with criticism in mass media and discussions in the scientific community as to whether approval was justified in the absence of robust scientific research confirming safety and efficacy.[4][5][7][8][9] A large-scale Brazilian study from Dec. 2020 to May 2021 confirmed its effectiveness and safety, as of Oxford–AstraZeneca’s, i.e. above Sinopharm BIBP’s.[10]
Emergency mass-distribution of the vaccine began in December 2020 in countries including Russia, Argentina, Belarus, Hungary, Serbia, Pakistan (in limited quantities), the Philippines (in limited quantities), and the United Arab Emirates. The Sputnik V is currently registered and certified in 71 countries.[11] However, as of April 2022 less than 2.5% of the people vaccinated worldwide have taken a Sputnik V dose.[12] In early 2022, as a result of the 2022 Russian invasion of Ukraine, the United States and other countries placed RDIF on the list of sanctioned Russian entities and people,[13][14] significantly reducing Sputnik V future commercial prospects.[13][12]
The Gam-COVID-Vac vaccine itself is available in two forms: frozen (vaccine storage: below –18 °C) and liquid (vaccine storage: from +2 to +8 °C, produced a little). In addition to the main vaccine, vaccines and its derivatives were also registered: Gam-COVID-Vac-Lyo (Russian: Гам-КОВИД-Вак-Лио, no data on use), Sputnik Light (Russian: Спутник Лайт, used for revaccination, as well as vaccination of foreigners in Russia), Gam-COVID-Vac-M (Russian: Гам-КОВИД-Вак-М, for vaccination of adolescents 12–17 years old[15]).
Medical uses[edit]
The vaccine can be formulated in two ways: as a ready-to-use solution in water that is frozen at the common home-freezer storage temperature of −18 °C or 0 °F or lower, and as a freeze-dried (lyophlilized) powder, «Gam-COVID-Vac-Lyo», which can be stored at 2–8 °C or 36–46 °F. The freeze-dried powder must be reconstituted with sterile water before use.[16] The lyophilized formulation of Gam-COVID-Vac is similar to the smallpox vaccine, circumventing the need for continuous «colder chain» or cold-chain storage – as required for the Pfizer–BioNTech and Moderna vaccines – and allowing transportation to remote locations with reduced risk of vaccine spoilage.[17][18]
The first dose (based on Ad26) is administered on the first day, and the second dose (based on Ad5) is administered on the 21st day to boost immune response.[19][20][21] Both doses are administered into the deltoid muscle.
Sputnik Light is a registered single-dose vaccine consisting of only the first dose of Sputnik V. It is intended for areas with acute outbreaks and it will be used as a third (booster) dose for those who have received Sputnik V at least 6 months earlier.[22]
On August 11, 2021, the developers of the Sputnik V vaccine offered its ‘Sputnik Light’ (Ad26) vaccine to Pfizer for trial against the Delta variant.[23][24]
Effectiveness[edit]
The effectiveness of COVID-19 vaccines, or any other vaccine, is determined in a mass vaccination in a «real-world» setting (not in clinical trials). This is an assessment of how well the vaccine protects people from outcomes such as infection, symptomatic illness, hospitalization, and death. Effectiveness is evaluated outside of clinical trials, which by contrast, evaluate the efficacy of the vaccine.[25][26] A vaccine is generally considered effective if the estimate is ≥50% with a >30% lower limit of the 95% confidence interval.[27] Effectiveness is generally expected to slowly decrease over time.[28]
On 25 August, a preliminary version of a case-control study indicated an unadjusted effectiveness[25][26] of about 50% against symptomatic disease. The authors expected that adjusting for age and sex would increase the estimate, citing an increase from 66% to 81% when adjusting the data for effectiveness against hospitalization.[A]
A large-scale study in Buenos Aires from December 29, 2020, to May 15, 2021, with 663,602 participants aged 60 and older who received Spunik V, the Oxford–AstraZeneca vaccine, or the Sinopharm BIBP vaccine observed an overall efficacy of 98% (95% CI, 95–99%) against COVID-19-related deaths. The study noted that the three vaccines showed a similar effectiveness against death, and that the effectiveness against infection was similar to that of the Oxford-Astrazeneca vaccine and greater than that of the Sinopharm BIBP vaccine.[10]
| Doses | Severity of illness | Delta | Alpha |
|---|---|---|---|
| 1 | Symptomatic | Not reported | Not reported |
| Hospitalization | 35% (−21 to 65%)[A] | Not reported | |
| 2 | Asymptomatic | Not reported | 86% (84–87%)[B] |
| Symptomatic | Not reported | Not reported | |
| Hospitalization | 81% (68–88%)[C][A] | Not reported | |
| Death | Not reported | 98% (96–99%)[B] |
- ^ a b c Case-control study with 13,894 participants from 3 July 2021 to 9 August 2021 in Saint Petersburg. The study awaits peer review.[29][30][may be outdated as of December 2021]
- ^ a b 22 January to 10 June 2021 in Hungary.[31]
- ^ 14 to 55 days after the second dose, higher in women, 84% (), than in men, 76% (). Increases to 85% () 56 days or more after the second dose.
A large-scale study was conducted in Mexico and was published as a preprint, awaiting peer review (as of July 22, 2022).[32] The study, compared 793,487 adults vaccinated with different vaccines with 4,792,338 unvaccinated adults between December 24, 2020, and September 27, 2021.The results were as follows:
| Vaccine | Incidental infection effectiveness | Hospitalization effectiveness | Mortality effectiveness |
|---|---|---|---|
| Spikevax | 91.45% | 78% | 93.46% |
| Comirnaty | 80.34% | 84.26% | 89.83% |
| Sputnik V | 78.75% | 81.38% | 87.7% |
| Covishield | 80.79% | 80.23% | 86.81% |
| Janssen | 82.18% | 77.33% | 85.79% |
| CoronaVac | 71.93% | 73.76% | 80.38% |
| Convidecia | 70.5% | 72.31% | 79.93% |
Efficacy[edit]
The vaccine efficacy of a COVID-19 vaccine or any other vaccine is evaluated in controlled clinical trials. It is an estimate of how many people who received the vaccine got the disease compared to how many people who got a placebo had the same outcome. On 2 February 2021, an interim analysis from the Moscow trial was published in The Lancet reporting an efficacy of 91.6% (95% CI, 85.6–95.2%) after the second dose for all age groups, with no unusual side effects.[33] For the age group of 60 years and older, the reported efficacy was 91.8%.[34] On 12 May, a group of biostatisticians from Russia, the US, France, Italy and the Netherlands questioned the efficacy results in a correspondence in The Lancet, highlighting data discrepancies
, substandard reporting
, apparent errors and numerical inconsistencies
and a very unlikely homogeneity in vaccine efficacy across age groups.[35]
The authors responded by saying that they had provided the regulatory authorities with all the data necessary for obtaining approval, and that the data included with the paper were enough for readers to confirm the reported vaccine efficacy. They also addressed the protocol queries, and said numerical inconsistencies were «simple typing errors that were formally corrected».[36]
In June 2022 a group of biostatisticians from Australia and Singapore published a paper suggesting that the almost identical efficacy for every age group from the Lancet paper is very unlikely to occur in genuine experimental data.[37] The group called for a thorough investigation of the Lancet article, as well as the immediate release of anonymized individual patient data to an unbiased statistical expert, and suggested the Lancet article should be retracted. The Lancet Group recognized the concerns about the validity of data published in Lancet article and invited the authors of the article to respond to these latest questions.[38][39]
Adverse effects[edit]
Side effects are mostly mild and similar to other adenovirus vector vaccines such as the Oxford-AstraZeneca and the Janssen vaccines. However, unlike the Oxford-AstraZeneca and Janssen vaccines, and Pfizer, evidence does not suggest a risk of vaccine-induced immune thrombotic thrombocytopenia.[40]
Pharmacology[edit]
Gam-COVID-Vac is a viral vector vaccine based on two recombinant replication-defective human adenoviruses: Ad26 (serotype 26) and Ad5 (serotype 5) replicated in HEK 293 cells. The viruses contain the gene that encodes the full-length spike protein (S) of SARS-CoV-2 to stimulate an immune response.[6][19][41] Adenoviral vectors[42][43] for expression of the SARS-CoV-2 spike protein have also been used in two other COVID-19 vaccines. One is called Janssen COVID-19 vaccine, it utilizes the Ad26COV2 viral vector based on the human virus Ad26. For this vaccine, the cell line PER.C6[44][45] is used to replicate the vector. Another one called Oxford–AstraZeneca COVID‑19 vaccine, it uses chimpanzee adenovirus (ChAdOx1) as the vector. For both the Oxford-AstraZeneca COVID-19[45] and Gam-COVID-Vac vaccines the producer cells for the production of non-replicating adenoviral vectors were obtained from the HEK 293 cell line.[46] Each dose of Gam-COVID-Vac contains (1.0 ± 0.5) × 1011 virus particles.[34]
Both Ad26 and Ad5 were modified to remove the E1 gene to prevent replication outside the HEK 293 cells.[47] For the production of the vaccine, to propagate adenoviral vectors in which the E1 gene was deleted, HEK 293 cells are used, which express several adenoviral genes, including E1.[48][49] However, although rare, homologous recombination between the inserted cellular sequence and the vector sequence can restore the replication capacity to the vector,[50] with less than 100 replicating adenovirus particles per dose of the vaccine.[47]
Chemistry[edit]
The other ingredients (excipients) are the same, both quantitatively and qualitatively, in the two doses.[51][52]
- Tris(hydroxymethyl)aminomethane (buffer)
- Sodium chloride (salt)
- Sucrose (sugar)
- Magnesium chloride hexahydrate
- Disodium EDTA dihydrate (a chelation ligand; sequestrant)
- Polysorbate 80
- Ethanol 95%
- Water
No adjuvants[53] and no other components or ingredients should be included in the vaccine.[1]
Manufacturing[edit]
Pharmaceutical company União Quimica started production of Sputnik V in Brazil in January 2021[citation needed]
Large quantities of both adenoviruses are produced by HEK 293 cells that have the E1 gene necessary for viral replication.[48][49][50] Rarely, Ad5 can acquire the E1 gene from the HEK 293 cells, restoring its ability to replicate.[50] Gamaleya has set an acceptable limit of 5,000 replicating virus particles per vaccine dose, and quality control documents state that tested batches contain less than 100 replicating virus particles per dose.[47]
The production of the frozen liquid formulation was developed for large-scale use, it is cheaper and easier to manufacture. The production of the freeze-dried formulation takes much more time and resources, although it is more convenient for storage and transportation. It was developed with vaccine delivery to hard-to-reach regions of Russia in mind.[6]
According to Russian media, the mass production of the Gam-COVID-Vac was launched by 15 August. By that moment, the Russian Federation has already received applications from 20 countries for the supply of 1 billion doses of vaccine. Three facilities were able to produce about a million doses per month at each with a potential doubling of capacity by winter. By the end of 2020, Gamaleya Research Institute’s production, according to an interview with the organization’s spokesperson, was planned to produce 3–5 million doses.[54][55]
As of March 2021, the Russian Direct Investment Fund (RDIF) has licensed production in India, China, South Korea and Brazil. In the EU, RDIF has signed production agreements. By the end of March 2021 RDIF anticipates 33 million doses will have been manufactured in Russia, less than 5% of which will have been exported.[56]
An agreement for the production of over 100 million doses of vaccine in India was made with Dr. Reddy’s Laboratories, which on 11 January 2021 submitted mid-stage trial data to the Indian regulator and recommended moving onto late-stage trials.[57] The RDIF announced plans to sell 100 million doses to India, 35 million to Uzbekistan, and 32 million to Mexico, as well as 25 million each to Nepal and Egypt.[58] In India, the first dose of Sputnik V vaccine was administered on 14 May 2021 at Hyderabad.[59] Argentina became the first Latin American country to produce it.[60] Large-scale production started in June 2021.[61] As of 31 December 2021 277 million doses were manufactured, mostly (265 million) in Russia.[62]
On 28 February 2022, as a result of the 2022 Russian invasion of Ukraine, the United States placed RDIF and its chief executive on its list of sanctioned Russian entities and people.[63][14] The European Union, Ukraine, United Kingdom and Australia followed later in February and in March.[64] This significantly reduces vaccine’s future commercial prospects.[63][12]
Resale controversy[edit]
Under a resale arrangement, the Russian Direct Investment Fund (RDIF) offered Abu Dhabi-based firm, Aurugulf Health Investments the exclusive rights to sell the Sputnik V coronavirus vaccine. According to media reports, the vaccine was intended to be sold to a host of countries at huge premiums. As per documents reviewed by the Moscow Times, Emirati Sheikh Ahmed Dalmook al-Maktoum, a Dubai royal, worked as the middleman for reselling millions of Sputnik V vaccine doses to countries in dire need of COVID-19 vaccine at a higher premium.
Corporate registry data showed that one of the two entities controlling Aurugulf is Royal Group, a conglomerate headed by UAE national security advisor, Sheikh Tahnoon bin Zayed al-Nahyan. Acquired documents, interviews with officials and buyer data showed that countries like Pakistan, Guyana, which were on the receiving end of the vaccine from the UAE, were coerced to pay more than double the price advertised by Russia.[65]
The same deal was further used for reselling 1 million Sputnik V vaccine doses by the Emirati royal Sheikh Ahmed Dalmook al-Maktoum to Kenya for huge mark-ups. However, the deal eventually failed as Nairobi learnt of the first shipment consisting of 75,000 doses not coming directly from Russia.[66]
History[edit]
Package and Vial for the first dose
The Gam-COVID-Vac vaccine was developed by a cellular microbiologists team of the government-backed Gamaleya Research Institute of Epidemiology and Microbiology. The group was led by MD and RAS associate member Denis Logunov, who also worked on vaccines for the Ebolavirus and the MERS-coronavirus.[citation needed]
In May 2020, the Gamaleya Research Institute of Epidemiology and Microbiology announced that it had developed the vaccine without serious side effects. By August 2020, phases I and II of two clinical trials (involving 38 patients each) were completed. Only one of them used the formulation which later obtained marketing authorization under limited conditions.[67][68] This vaccine was given the trade name «Sputnik V», after the world’s first artificial satellite.[5][8][69]
During preclinical and clinical trials, 38 participants who received one or two doses of the Gam-COVID-Vac vaccine had produced antibodies against SARS-CoV-2’s spike protein, including potent neutralizing antibodies that inactivate viral particles.[4] On 11 August 2020, the Russian minister of Health Mikhail Murashko announced at a government briefing with the participation of President Vladimir Putin regulatory approval of the vaccine for widespread use. The state registration of the vaccine was carried out «conditionally» with post-marketing measures according to the decree of the Government of the Russian Federation. The registration certificate for the vaccine stated that it could not be used widely in Russia until 1 January 2021, and before that, it may be provided to «a small number of citizens from vulnerable groups», such as medical staff and the elderly, according to a Ministry of Health spokesperson.[5] The license under register number No. ЛП-006395 (LP-006395) was issued on 11 August by the Russian Ministry of Health. Although the announcement was made even before the vaccine candidate had been entered into Phase III trials, the practice of marketing authorization «on conditions» also exists in other countries.[70][71] On 26 August, certificate No. ЛП-006423 (LP-006423) was issued for the lyophilized formulation «Gam-COVID-Vac-Lyo».[4][5][8][72][6]
On 12 June 2021, developers announced that they had developed and tested a nasal vaccine for children aged 8 to 12, with no side effects found, and that they expected to release it on 15 September 2021.[73]
Clinical trials[edit]
Phase I–II[edit]
A phase I safety trial began on 18 June 2020.[4] On 4 September 2020, data on 76 participants in a phase I–II trial were published, indicating preliminary evidence of safety and an immune response.[6] The results were challenged by international vaccine scientists as being incomplete, suspicious, and unreliable when identical data were reported for many of the trial participants,[74] but the authors responded that there was a small sample size of nine, and the measured results of titration could only take discrete values (800, 1600, 3200, 6400). Coupled with the observation that values tended to reach a plateau after three to four weeks, they contend that it is not unlikely that several participants would show identical results for days 21 to 28.[75]
Phase III[edit]
Sputnik V, efficacy for different conditions. The error bars indicate the confidence interval containing the efficacy with 95% probability
In early November 2020, Israel Hadassah Medical Center director-general Prof. Zeev Rotstein stated that Hadassah’s branch in Moscow’s Skolkovo Innovation Center was collaborating on a phase III clinical trial.[76]
The ongoing phase III study is a randomised, double-blind, placebo-controlled, multi-centre clinical trial involving 40,000 volunteers in Moscow, and is scheduled to run until May 2021.[77] In 2020–2021, phase III clinical studies were also being conducted in Belarus,[78] UAE,[79] India[80] and Venezuela.[81]
On April 13, 2021, India’s health ministry said its drug regulator had found that safety and immunogenicity data from a local trial of Sputnik V coronavirus vaccine was comparable to that of a late-stage trial done in Russia.[82]
Variants[edit]
In May 2021, a study by researchers of the National University of Córdoba, Argentina, found that the vaccine produced antibodies capable of neutralizing the Gamma variant.[83]
A study in Argentina found that neutralization is maintained against Alpha and Lambda and reduced against Gamma. The degree of reduction, however, does not necessarily imply reduced protection.[84]
A small study of 12 serum samples found that antibodies from the vaccine effectively neutralize the Alpha variant, with moderately reduced neutralization against the E484K substitution (median 2.8 fold reduction). However, neutralization of the Beta variant was markedly reduced (median 6.1 fold reduction).[85]
[edit]
Full authorization
Emergency authorization
Authorization expired
Allowed for travel
Rejected
President Putin’s meeting with government members, on 11 August 2020 via videoconference, at which he announced a conditionally registered vaccine against COVID-19.[4][5]
In August 2020, British and American officials stated that the Gam-COVID-Vac vaccine would likely be rejected due to concerns that the normally rigorous process of vaccine clinical testing was not followed.[86]
As of December 2020, Belarus and Argentina granted emergency use authorization for the vector-based vaccine.[87] On 21 January 2021, Hungary became the first European Union country to register the shot for emergency use, as well as the United Arab Emirates in the Persian Gulf region.[88][89][90][91][92]
On 19 January 2021, the Russian authorities applied for the registration of Sputnik V in the European Union, according to the RDIF.[93] On 10 February, the European Medicines Agency (EMA) said that they had «not received an application for a rolling review or a marketing authorisation for the vaccine». The developers have only expressed their interest that the vaccine be considered for a rolling review, but EMA’s Human Medicines Committee (CHMP) and the COVID-19 EMA pandemic Task Force (COVID-ETF) need to give their agreement first before developers can submit their application for initiation of the rolling review process.[94] On 4 March 2021, the Committee for Medicinal Products for Human Use (CHMP) of the EMA started a rolling review of Sputnik V.[95] The EU applicant is R-Pharm Germany GmbH.[95] On 16 June, Reuters reported that approval of Sputnik V will be delayed at least until September because not all the necessary clinical data has been submitted by the deadline.[96] As of June 2021, Sputnik V is under rolling review process by EMA, but the marketing authorisation application was not submitted yet.[97]
Emergency use has also been authorized in Algeria, Bolivia, Serbia, the Palestinian territories,[57] and Mexico.[98]
On 25 January 2021, Iran approved the vaccine, with Foreign Minister Mohammad Javad Zarif saying the country hopes to begin purchases and start joint production of the shot «in the near future», after Supreme Leader Ayatollah Ali Khamenei banned the government from importing vaccines from the United States and United Kingdom.[99][100]
The Czech Republic is also considering buying Sputnik V, and Prime Minister Andrej Babis dismissed the minister of health, Jan Blatný, who was a loud opponent to the use of Sputnik V.[101][102][103]
On 4 March 2021, EMA’s human medicines committee (CHMP) has started a rolling review of Sputnik V (Gam-COVID-Vac), a COVID-19 vaccine developed by Russia’s Gamaleya National Centre of Epidemiology and Microbiology.[104] When asked about the prospect of Austria giving Sputnik V the approval (as some other European countries chose to do), EMA management board chair Christa Wirthumer-Hoche pointed to the fact there was not yet sufficient safety data about those who had already been given the vaccine. «We could have Sputnik V on the market in future, when we’ve examined the necessary data,» she said, adding that the vaccine needed to match up to European criteria on quality control and efficacy.[105]
On 18 March 2021, German regional leaders including State Premiers and the mayor of Berlin called for the swift approval of the Russian vaccine by the European Medicines Agency to counteract the acute shortages of effective vaccines in Europe. German medical experts have recommended its approval also, and consider the Sputnik Vaccine «clever» and «highly safe».[106]
On 19 March 2021, the Philippine Food and Drug Administration granted emergency use authorization for Sputnik V, the fourth COVID-19 vaccine to be given authorization. The Philippine government planned to buy 20 million doses of the vaccine.[107][108]
On 12 April 2021, India approved the use of Sputnik V vaccine for emergency use against COVID-19 based on strong immunogenicity data.[109][110]
As of 12 April 2021, 62 countries had granted Sputnik V emergency use authorization.[111]
On 27 April 2021, Bangladesh approved the use of Sputnik V vaccine for emergency use.[112]
On 30 April 2021, Turkey and Albania approved the use of Sputnik V vaccine for emergency use.[113][114]
Slovakia[edit]
On 1 March 2021, Slovakia bought 2 million doses of the Sputnik V vaccine. Slovakia received the first batch of 200,000, and expected to receive another 800,000 doses in March and April. Another 1 million doses were set to arrive in May and June.[115]
On 8 April, Slovakia’s drug regulator said that the Sputnik V vaccine it received did «not have the same characteristics and properties» as the version endorsed by The Lancet.[116] The Slovak State Institute for Drug Control stated that Sputnik V has not yet been approved for use, as the first 200,000 doses received on the 31st of March were different from the product currently being reviewed by the EMA as well as from the vaccine used in studies published in The Lancet. The producers have failed to reply to requests for documentation, and approximately 80% of the data was not supplied even after repeated requests. Due to the inconsistencies, it was not possible to review the safety and efficacy of the vaccine.[117][118] Russian Direct Investment Fund replied that Slovakian laboratory which tested the vaccine was not certified by the EU.
Slovak Prime Minister Igor Matovič resigned on 30 March, due to the political crisis started by the order of the Sputnik V vaccine.[119] On 6 April 2021, the RDIF asked to return the delivered first batch of the vaccine due to «multiple contract violations».[117][120]
On 29 April 2021, the Slovak Ministry of Health published the Sputnik V contract.[121] According to the contract, the RDIF as a seller is not liable for any adverse events following administering of the vaccine, nor its effectiveness.[121][122] According to the Slovak lawyers, the contract is explicitly disadvantageous for Slovakia.[122][123]
On 8 May 2021, the Russian Direct Investment Fund sent a letter to the Denník N newspaper requesting the removal of the statements of the drug regulator, calling them «unsubstantiated and false» and «fake news».[124][125] RDIF threatened the newspaper with legal action if they didn’t comply with the demand by 9 May.[126] The editors of Denník N refused to remove said statements.
After the samples were sent to the EU-certified laboratory in Hungary and it was stated that «the results were satisfactory»,[127] the Slovakian government approved the vaccine, and announced that vaccination with Sputnik V would begin in June 2021, despite the negative review by Slovakia’s drug regulator.[128][129] Vaccinations started on 7 June,[130] but without significant interest in the Sputnik V vaccine.[131][132] Slovakia has no plans to order new batches[131] and plans to sell or donate unused vaccines to Balkans countries.[133] The registrations for vaccination were closed on 30 June. In July 2021, 160,000 doses of the vaccine from the first batch of 200,000 were shipped back to Russia.[134] Temporary government approval for Sputnik V expired on 31 August 2021.[135][136] In total, 18,500 people have been vaccinated.[137]
Purchase of Sputnik V, which led to a political crisis and contributed to a fall of Igor Matovič’s Cabinet was investigated by Slovak Police Force with the investigation levered against Marek Krajčí. No violation of the law was found in October 2022.[138]
Brazil[edit]
On 26 April 2021, the Brazilian health regulator Anvisa rejected the use of Sputnik V, alleging a lack of consistent and reliable data and the presence of replicating adenovirus in the vaccine. RDIF and Sputnik V’s official Twitter account said the decision may be politically motivated, pointing to a recent report by the United States government that tried to persuade Brazil to reject the vaccine. Several Brazilian states in the North and Northeast regions had already signed contracts for the acquisition of more than 30 million doses.[139][140][141] Anvisa attributed its decision to a number of issues with the samples provided by Gamaleya for accreditation:[142][143][144]
- the adenovirus carrier in all samples was actually able to replicate in spite of manufacturer’s declaration it was incapacitated
- the methodology used by Gamaleya to check immune system response was unreliable and documentation provided made its verification impossible
- the procedure of registering adverse effects was insufficient
- Anvisa delegation was also not allowed into the Gamaleya laboratory for inspection
- all presented studies were performed on vaccine doses produced in laboratory, rather than in the manufacturing facility supplying vaccine for the mass market, which makes the results not representative
- Anvisa found issues in one of the factories in Russia that could impact sterility of the doses.[143]
On April 29, 2021, the developers of Sputnik V said that Anvisa admitted not testing Sputnik V and that they would sue Anvisa in Brazil for defamation. At a press conference, Anvisa officials said that Gamaleya’s own documents indicated multiple times the presence of replication-competent adenoviruses (RCAs) in ready vaccine batches and that the specifications accepted a level of RCAs 300 times greater than any other regulatory threshold. Anvisa presented the video of a meeting with representatives from Russia and Brazil where, when asked about the presence of RCAs, a representative from Russia reported problems with the cells and said that the vaccine could have been redeveloped, but it would take too long, so the developers instead chose to continue the research imposing an acceptable level of RCAs.[145][146] Virologist Angela Rasmussen described this problem as a quality control issue that is not important for healthy people because adenoviruses are not important pathogens, but added that it could produce serious adverse effects in immunocompromised individuals.[147] Medicinal chemist Derek Lowe commented that the presence of replicating adenoviruses is unlikely to cause any major problems, but it is a «completely unnecessary risk», that it certainly will harm some people, and that providing a product different from the one described in studies undermines the credibility of all manufacturing and quality control processes,[148] adding that some posts on the official Sputnik V Twitter account constitute «aggressive political marketing» and some make invalid claims regarding the performance of competing vaccines, such as the Pfizer-BioNTech vaccine.[149] Anvisa said that the import ban can be reversed if Gamaleya clarifies the issues. Adenovirus infections cause only mild colds in healthy individuals, but they can cause life-threatening illnesses in immunodeficient individuals.[47] The director of the Public Health Institute of Chile (ISP), Heriberto Garcia, said that the ISP would not necessarily reject the vaccine, even if it had replicating adenoviruses, because the risk of getting a common cold from the vaccine must be seen in light of the risk of contracting COVID-19 when not vaccinated. He also said that real-world data from Argentina and Mexico showed no adverse effects greater than those seen in people vaccinated with the Pfizer-BioNTech vaccine or CoronaVac.[150]
On June 4, Anvisa approved exceptional imports of Sputnik V, restricting it mainly to healthy adults and limiting it to only 1% of the population of 6 importing states, in order to manage risks through control and supervision of side effects. Anvisa said that the concern with replicating viruses has not been fully resolved, but that additional documents received indicate a substantially reduced acceptable amount. The new parameter would be in an FDA manual, which was not found. Anvisa also said that impurity and quality controls are insufficient and that the manufacturing plants must undergo corrections to meet WHO quality standards.[2][151][152] As of 16 June, the same import conditions were extended to a total of 13 states.[153] On August 5, the consortium of northeastern Brazilian states, corresponding to 7 of the 13 states, suspended the import of 37 million doses due to the restrictions imposed by Anvisa. These doses will supply Mexico, Argentina and Bolivia.[154]
Further development[edit]
Heterologous prime-boost vaccination[edit]
On 21 December 2020 the Russian Direct Investment Fund (RDIF), the Gamaleya National Center, AstraZeneca and R-Pharm signed an agreement aimed at the development and implementation of a clinical research program to assess the immunogenicity and safety of the combined use of one of the components of the Sputnik V vaccine developed by the Gamaleya Center, and one of the components of the Oxford–AstraZeneca vaccine.[155] The study program will last 6 months in several countries, and it is planned to involve 100 volunteers in each study program. On 9 February 2021, the Ministry of Health of the Republic of Azerbaijan allowed clinical studies in the country for the combined use of the Oxford–AstraZeneca vaccine and Sputnik Light, stating that the trials would begin before the end of February 2021.[156][157] On February 20, 2021, in the official Sputnik V Twitter account it was stated that clinical trials have already started.[158]
Society and culture[edit]
Economics[edit]
In Russia[edit]
Medical worker in Moscow with the vaccine
Vaccination of military personnel and civilian specialists of the Northern Fleet with the second component of the drug «Gam-COVID-Vac» («Sputnik V»)
The vaccine is free of charge to users in Russia and Kazakhstan. The cost per dose would be less than US$10 (US$20 for the required two doses) on international markets, much less than the cost of mRNA vaccines from other manufacturers. Kirill Dmitriev, head of the fund, told reporters that over 1 billion doses of the vaccine are expected to be produced in 2021 outside of Russia.[159][160]
The head of the Gamaleya Research Institute Alexander Ginzburg estimated that it would take 9–12 months to vaccinate the vast majority of the Russian population, assuming in-country resources were adequate.[161][162]
The commercial release of the Gam-COVID-Vac was first scheduled for September 2020. In October, Mikhail Murashko said that the Gam-COVID-Vac would be free for all Russian citizens after the launching of mass production.[163][164] Later on, the Russian Ministry of Health registered the maximum ex-factory price equal to 1,942 roubles for two components and included it into The National List of Essential medicines.[165] There were also suggestions to include the vaccine in the National Immunisation Calendar of Russia.[165]
In the beginning of December 2020, Russian authorities announced the start of a large-scale free of charge vaccination with Gam-COVID-Vac for Russian citizens: the immunization program was launched on 5 December 2020 (with 70 medical centers in Moscow providing vaccinations).[166]
Doctors and other medical workers, teachers, and social workers were given priority due to their highest risk of exposure to the disease.[167] Initially the vaccine was only offered to people over 60 years of age, later this restriction was lifted.[168]
Potential recipients were notified via text messaging, which said «You are working at an educational institution and have top-priority for the COVID-19 vaccine, free of charge». Patients were asked a few general health questions before receiving the vaccine.[169][170][171] People with certain underlying health conditions, pregnant women, and those who have had a respiratory illness for the past two weeks were barred from vaccination.[167] The vaccine vial was removed from medical centre’s freezer about 15 minutes before use.
In early December 2020, the Minister of Health, Mikhail Murashko, said that Russia had already vaccinated more than 100,000 high-risk people.[172] Forty thousand of those were volunteers in Sputnik V’s Phase 3 trials, another 60,000 nurses and doctors had also taken the vaccine.[173] The head of the Russian Direct Investment Fund, Kirill Dmitriev, said in an interview with the BBC that Russian medics expected to give about 2 million people coronavirus vaccinations in December 2020.[174]
Up to the beginning of December 2020, Generium (which is supervised by Pharmstandard) and Binnopharm (which is supervised by AFK Sistema) companies produced Gam-COVID-Vac on a large scale.
On 10 December, Deputy Prime Minister Tatyana Golikova announced that approximately 6.9 million doses of the Sputnik V vaccine would enter civilian circulation in Russia before the end of February 2021.[175] Moscow Mayor Sergei Sobyanin announced that the newly opened Moscow-based «R-Pharm» will become a leading manufacturer of Russia’s Sputnik V coronavirus vaccine. Working at full capacity, the factory will produce up to 10 million doses a month.[176]
As of March 2021, vaccination rates in Russia were below those of other developed nations.[177]
In May 2021 Sergei Sobyanin complained that only 1.3 million Moscow residents out of 12 million had received the first dose (10.2%). Only 9.5% of Russians had received a vaccine.[178] Forbes Russia established that Russia committed to export 205 millions of doses of «Sputnik V» to other countries, and as of May 16.3 millions (8%) were so far delivered.[179] A survey found that 62% of the Russian population felt hesitant, with 55% not afraid of getting sick and some willing to wait for CoviVac.[180]
In June 2021, with the increase in Delta variant cases, several Russian city governments introduced strict measures to overcome vaccine hesitancy, such as requiring vaccine QR codes from customers in cafes.[180]
Outside Russia[edit]
In dark green are the countries that approved Sputnik V vaccine against COVID-19 (w/disputed Crimea). In light green are the countries that have shown interest in obtaining the vaccine. Light blue indicates current or future producers and dark blue the country origin of vaccine design (Russia).
Russia is pursuing deals to supply its vaccine abroad.[181]
According to the Russian Direct Investment Fund, they had received orders for more than 1.2 billion doses of the vaccine as of December 2020. Over 50 countries had made requests for doses, with supplies for the global market being produced by partners in India, Brazil, China, South Korea, Hungary, and other countries.[182][183] In August 2020, according to the Russian authorities, there were at least 20 countries that wanted to obtain the vaccine.[184]
The Israeli Hadassah Medical Center signed a commercial memorandum of understanding to obtain 1.5–3 million doses.[185]
Argentina agreed to buy 25 million doses of Russia’s COVID-19 vaccine, subject to its clearing clinical trials;[186] the vaccine was registered and approved in Argentina in late December 2020.[187] The Brazilian state of Bahia signed an agreement to conduct Phase III clinical trials of the Sputnik V vaccine and planned to buy 50 million doses to market in northeastern Brazil.[188]
On 21 January 2021, Argentine president Alberto Fernández became the first Latin American leader to be inoculated with Sputnik V, shortly after it was approved for use in the country.[189][190] Two months after being vaccinated he developed fever and headache, and tested positive for COVID-19.[191] He was asymptomatic ten days later, was discharged from medical treatment subject to medical follow-up as usual for former COVID-19 patients, and resumed his normal activities.[192]
According to The New York Times sources, in February 2021, Israel agreed to finance a supply of the Sputnik V vaccine to Syria in order to secure the release of an Israeli civilian held in Syria.[193]
Due to the delay in shipping of doses from Italy and the European Union, San Marino imported doses of the Sputnik V vaccine (not approved by the EMA) and started a mass vaccination on 28 February of its healthcare workers.[194]
April 14, 2021, Armenia agreed with Russia on purchase of 1 million doses of coronavirus vaccines Sputnik V. This was the decision of Armenian health minister Anahit Avanesyan. The Armenian authorities have begun negotiations with Russia on the production of the Sputnik V coronavirus vaccine. Head of the Armenian Ministry of Health Anahit Avanesyan stated this at a press conference on March 12, 2021.[195]
Scientific assessment[edit]
On 11 August 2020, a World Health Organization (WHO) spokesperson said, «… prequalification of any vaccine includes the rigorous review and assessment of all required safety and efficacy data».[9] A WHO assistant director said, «You cannot use a vaccine or drugs or medicines without following through all of these stages, having complied with all of these stages».[196]
Francois Balloux, a geneticist at University College London, called the Russian government’s approval of Gam-COVID-Vac a «reckless and foolish decision».[4] Professor Paul Offit, the director of the Vaccine Education Center at Children’s Hospital of Philadelphia, characterized the announcement as a «political stunt», and stated that the untested vaccine could be very harmful.[9]
Stephen Griffin, Associate Professor in the School of Medicine, University of Leeds, said «that we can be cautiously optimistic that SARS-CoV2 vaccines targeting the spike protein are effective.» Moreover, as the Sputnik antigen is delivered via a different modality, namely using a disabled Adenovirus rather than formulated RNA, this provides flexibility in terms of perhaps one or other method providing better responses in certain age-groups, ethnicities, etc., plus the storage of this vaccine ought to be more straightforward.[197]
In November 2020, public health expert Talha Khan Burki said the quick approval of Gam-COVID-Vac by the Russian government was «cutting corners», and may harm public confidence if the vaccine proves to be unsafe or ineffective.[8] «There is a huge risk that confidence in vaccines would be damaged by a vaccine that received approval and was then shown to be harmful», said immunologist Peter Openshaw.[8]
Ian Jones, a professor of virology at the University of Reading, and Polly Roy, professor and Chair of Virology at The London School of Hygiene and Tropical Medicine, commenting on phase III results published in the Lancet in February 2021, said «The development of the Sputnik V vaccine has been criticised for unseemly haste, corner cutting, and an absence of transparency. But the outcome reported here is clear and the scientific principle of vaccination is demonstrated, which means another vaccine can now join the fight to reduce the incidence of COVID-19.»[198]
On 12 May 2021, a group of biostatisticians published an article in The Lancet about data discrepancies and substandard reporting of interim data of the Sputnik V phase-III trial. According to the article, the lack of transparency of the trial results raises serious concerns. Data inconsistencies were found, including a very low probability of homogeneity of vaccine efficacy across age groups.[35]
Two preliminary studies, one from Argentina and one from San Marino, found mostly mild adverse events and no vaccine-associated deaths.[40] Another study carried out in San Marino has concluded a high tolerability profile in the population aged ≥60 years in terms of short-term adverse events following immunization.[199]
An article published by the journal Nature on 6 July 2021 cited data released by the United Arab Emirates on some 81,000 individuals who had received Sputnik V, according to which the vaccine demonstrated an efficacy of 97.8% in preventing symptomatic COVID-19, and 100% efficacy in preventing severe complications. The figures echoed similar findings from unpublished data on 3.8 million Russians, according to which Sputnik V demonstrated an efficacy of 97.7%.[200]
A study published by the Journal of Medical Internet Research analyzed the dataset consisted of 11,515 self-reported Sputnik V vaccine adverse events posted on Telegram. Telegram users complained mostly about pain, fever, fatigue, and headache.[201]
Public opinion polls[edit]
An opinion poll of Canadians conducted by Léger in August 2020 found that a majority (68%) would not take the Russian vaccine if offered a free dose, compared to 14% who said they would take it.
When Americans were asked the same question, 59% would not take the Russian vaccine if offered a free dose, compared to 24% who said they would take it.[202][203] In June 2021, according to a poll conducted by Ost-Ausschuss der Deutschen Wirtschaft [de] (German Eastern Business Association), a majority (60%) of Germans would use the Russian vaccine Sputnik V if they had the opportunity to do so. With 71% approval, the values in East Germany are significantly higher, but with 58% of the respondents there is also a solid majority in West Germany. 38% of respondents, on the other hand, would not want to use Sputnik V.[204]
In July 2020, opinion polls suggested around 90% of the Russian population had doubts about the vaccine but by September this had dropped to around half the Russian population.[205] In May 2021, the Levada Center released a poll of 1,614 respondents from 50 regions which showed that 26% of Russians were prepared to be vaccinated with Sputnik V, while 62% were not prepared to be vaccinated. Ten percent of respondents had already been vaccinated.[206]
References[edit]
- ^ a b «Sputnik V». Russian drug reference. Medum.ru.
- ^ a b Mcgeever J, Paraguassu L (4 June 2021). «Brazil’s Anvisa approves Russian Sputnik V vaccine, with conditions». Reuters. Retrieved 5 June 2021.
- ^ Official data on the vaccine and its manufacturers on the website of the state registration of medicines of the Ministry of Health of Russia
- ^ a b c d e f g Callaway E (August 2020). «Russia’s fast-track coronavirus vaccine draws outrage over safety». Nature. 584 (7821): 334–335. doi:10.1038/d41586-020-02386-2. PMID 32782400.
This is a reckless and foolish decision. Mass vaccination with an improperly tested vaccine is unethical. Any problem with the Russian vaccination campaign would be disastrous, both through its negative effects on health, but also because it would further set back the acceptance of vaccines in the population.
- ^ a b c d e f Cohen J (11 August 2020). «Russia’s approval of a COVID-19 vaccine is less than meets the press release». Science. Retrieved 13 August 2020.
- ^ a b c d e Logunov DY, Dolzhikova IV, Zubkova OV, Tukhvatullin AI, Shcheblyakov DV, Dzharullaeva AS, et al. (September 2020). «Safety and immunogenicity of an rAd26 and rAd5 vector-based heterologous prime-boost COVID-19 vaccine in two formulations: two open, non-randomised phase 1/2 studies from Russia». Lancet. 396 (10255): 887–897. doi:10.1016/S0140-6736(20)31866-3. PMC 7471804. PMID 32896291.
- ^ Mahase E (August 2020). «Covid-19: Russia approves vaccine without large scale testing or published results». BMJ. 370: m3205. doi:10.1136/bmj.m3205. PMID 32816758.
- ^ a b c d e Burki TK (November 2020). «The Russian vaccine for COVID-19». The Lancet. Respiratory Medicine. 8 (11): e85–e86. doi:10.1016/S2213-2600(20)30402-1. PMC 7837053. PMID 32896274.
- ^ a b c Berkeley Jr L (11 August 2020). «Scientists worry whether Russia’s Sputnik V’ coronavirus vaccine is safe and effective». CNBC. Retrieved 11 August 2020.
- ^ a b Macchia A, Ferrante D, Angeleri P, Biscayart C, Mariani J, Esteban S, et al. (October 2021). «Evaluation of a COVID-19 Vaccine Campaign and SARS-CoV-2 Infection and Mortality Among Adults Aged 60 Years And Older in a Middle-Income Country». JAMA Network Open. 4 (10): e2130800. doi:10.1001/jamanetworkopen.2021.30800. PMC 8556631. PMID 34714342.
- ^ «Russia expects WHO approval of Sputnik V vaccine by end of 2021 — RDIF».
- ^ a b c Hoffman M (9 April 2022). «How Russia’s Ukraine invasion doomed the Sputnik V coronavirus vaccine». The Washington Post. Retrieved 3 May 2022.
- ^ a b Webster P (March 2022). «Russian COVID-19 vaccine in jeopardy after Ukraine invasion». Nature Medicine: d41591–022–00042-y. doi:10.1038/d41591-022-00042-y. PMID 35293390. S2CID 247475281.
- ^ a b «Treasury Prohibits Transactions with Central Bank of Russia and Imposes Sanctions on Key Sources of Russia’s Wealth». U.S. Department of the Treasury. Retrieved 25 April 2022.
- ^ According to Russian law, citizens aged 18 and over are considered adults and are vaccinated with the Gam-COVID-Vac vaccine.
- ^ Rinat S, Ivanova P (17 November 2020). «Russia focuses on freeze-dried vaccine doses as transport fix». Reuters. Moscow. Retrieved 16 March 2021.
- ^ Balakrishnan VS (October 2020). «The arrival of Sputnik V». The Lancet. Infectious Diseases. 20 (10): 1128. doi:10.1016/S1473-3099(20)30709-X. PMC 7511201. PMID 32979327.
- ^
Irfan U (11 December 2020). «Why staying cold is so important to a Covid-19 vaccine. The Moderna and Pfizer vaccines need to be stored at low temperatures. Are global health systems prepared?». Vox. Retrieved 27 December 2020. - ^ a b «An Open Study of the Safety, Tolerability and Immunogenicity of the Drug ‘Gam-COVID-Vac’ Vaccine Against COVID-19». ClinicalTrials.gov. 22 June 2020.
- ^
Sokolov A (12 December 2020). «Сколько хотят заработать на прививках от коронавируса». Vedomosti. Archived from the original on 12 August 2020. Retrieved 20 December 2020. - ^
«Нормативная документация ЛП-006395-110820» (PDF) (in Russian). Russian Ministry of Health. 2020. Archived from the original (PDF) on 10 February 2021. Retrieved 21 September 2020. - ^ «Russia launches Sputnik Light vaccine into wide circulation». reuters. Moscow. 29 June 2021. Retrieved 25 June 2021.
- ^ «RDIF offers Pfizer to start trial with Sputnik Light as booster». Sputnik Vaccine. Twitter. 11 August 2021. Retrieved 13 August 2021.
- ^ «Single dose vaccine, Sputnik Light, authorized for use in Russia». sputnikvaccine.com. 5 May 2021. Retrieved 13 August 2021.
- ^ a b «COVID-19 Vaccines are Effective». Center for Disease Control and Prevention. 29 June 2022. Retrieved 23 July 2022.
- ^ a b «Vaccine efficacy, effectiveness and protection». World Health Organization. 14 July 2022.
- ^ Krause P, Fleming TR, Longini I, Henao-Restrepo AM, Peto R (September 2020). «COVID-19 vaccine trials should seek worthwhile efficacy». Lancet. 396 (10253): 741–743. doi:10.1016/S0140-6736(20)31821-3. PMC 7832749. PMID 32861315.
WHO recommends that successful vaccines should show an estimated risk reduction of at least one-half, with sufficient precision to conclude that the true vaccine efficacy is greater than 30%. This means that the 95% CI for the trial result should exclude efficacy less than 30%. Current US Food and Drug Administration guidance includes this lower limit of 30% as a criterion for vaccine licensure.
- ^ Khoury DS, Cromer D, Reynaldi A, Schlub TE, Wheatley AK, Juno JA, et al. (July 2021). «Neutralizing antibody levels are highly predictive of immune protection from symptomatic SARS-CoV-2 infection». Nature Medicine. 27 (7): 1205–1211. doi:10.1038/s41591-021-01377-8. PMID 34002089. S2CID 234769053.
- ^ Dobrovidova O (26 August 2021). «Russia’s Sputnik V protects against severe COVID-19 from Delta variant, study shows». Science AAAS. Retrieved 28 August 2021.
- ^ Barchuk A, Cherkashin M, Bulina A, Berezina N, Rakova T, Kuplevatskaya D, Stanevich O, Skougarevskiy D, Okhotin A (26 August 2021). «Vaccine Effectiveness against Referral to Hospital and Severe Lung Injury Associated with COVID-19: A Population-Based Case-Control Study in St. Petersburg, Russia». medRxiv (Preprint). doi:10.1101/2021.08.18.21262065. S2CID 237267404.
- ^ Vokó Z, Kiss Z, Surján G, Surján O, Barcza Z, Pályi B, et al. (March 2022). «Nationwide effectiveness of five SARS-CoV-2 vaccines in Hungary-the HUN-VE study». Clinical Microbiology and Infection. 28 (3): 398–404. doi:10.1016/j.cmi.2021.11.011. PMC 8612758. PMID 34838783.
Table 2
- ^ Bello-Chavolla OY, Antonio-Villa NE, Valdés-Ferrer SI, Fermín-Martínez CA, Fernández-Chirino L, Ramírez-García D, et al. (5 April 2022). «Effectiveness of a nation-wide COVID-19 vaccination program in Mexico». medRxiv. doi:10.1101/2022.04.04.22273330. S2CID 247953615.
- ^ Jones I, Roy P (February 2021). «Sputnik V COVID-19 vaccine candidate appears safe and effective». Lancet. 397 (10275): 642–643. doi:10.1016/S0140-6736(21)00234-8. PMC 7906719. PMID 33545098.
- ^ a b Logunov DY, Dolzhikova IV, Shcheblyakov DV, Tukhvatulin AI, Zubkova OV, Dzharullaeva AS, et al. (February 2021). «Safety and efficacy of an rAd26 and rAd5 vector-based heterologous prime-boost COVID-19 vaccine: an interim analysis of a randomised controlled phase 3 trial in Russia». Lancet. 397 (10275): 671–681. doi:10.1016/s0140-6736(21)00234-8. PMC 7852454. PMID 33545094.
- ^ a b Bucci EM, Berkhof J, Gillibert A, Gopalakrishna G, Calogero RA, Bouter LM, et al. (May 2021). «Data discrepancies and substandard reporting of interim data of Sputnik V phase 3 trial». Lancet. 397 (10288): 1881–1883. doi:10.1016/S0140-6736(21)00899-0. PMID 33991475.
- ^ Logunov DY, Dolzhikova IV, Tukhvatullin AI, Shcheblyakov DV (October 2020). «Safety and efficacy of the Russian COVID-19 vaccine: more information needed — Authors’ reply». Lancet. 396 (10256): e54–e55. doi:10.1016/S0140-6736(20)31970-X. PMC 7503057. PMID 32971043.
- ^ Sheldrick KA, Meyerowitz-Katz G, Tucker-Kellogg G (20 June 2022). «Plausibility of Claimed Covid-19 Vaccine Efficacies by Age: A Simulation Study». American Journal of Therapeutics. 29 (5): e495–e499. doi:10.1097/MJT.0000000000001528. PMID 35723559. S2CID 249869225.
- ^ King A (23 June 2022). «New questions raised over Sputnik Covid vaccine results point to fraudulent practices». Chemistry World. Retrieved 18 July 2022.
- ^ «Sputnik Vaccine Efficacy Data Published In Lancet Are ‘Statistically Impossible’ — Health Policy Watch». 13 July 2022. Retrieved 18 July 2022.
- ^ a b Nogrady B (July 2021). «Mounting evidence suggests Sputnik COVID vaccine is safe and effective». Nature. 595 (7867): 339–340. Bibcode:2021Natur.595..339N. doi:10.1038/d41586-021-01813-2. PMID 34230663. S2CID 235757906.
- ^ «Coronavirus Vaccine Trials Advance in Race for Covid-19 Protection». Bloomberg.com. Bloomberg. Retrieved 10 August 2020.
- ^ Wold WS, Toth K (December 2013). «Adenovirus vectors for gene therapy, vaccination and cancer gene therapy». Current Gene Therapy. 13 (6): 421–433. doi:10.2174/1566523213666131125095046. PMC 4507798. PMID 24279313.
- ^ Zhang C, Zhou D (August 2016). «Adenoviral vector-based strategies against infectious disease and cancer». Human Vaccines & Immunotherapeutics. 12 (8): 2064–2074. doi:10.1080/21645515.2016.1165908. PMC 4994731. PMID 27105067.
- ^ Kirschweger G (January 2003). «Crucell: biopharmaceuticals—as human as they get». Molecular Therapy. 7 (1): 5–6. doi:10.1016/S1525-0016(02)00045-X. PMID 12613447.
- ^ a b Wadman M (5 June 2020). «Abortion opponents protest COVID-19 vaccines’ use of fetal cells». Science.
- ^ Tan E, Chin CS, Lim ZF, Ng SK (2021). «HEK293 Cell Line as a Platform to Produce Recombinant Proteins and Viral Vectors». Frontiers in Bioengineering and Biotechnology. 9: 796991. doi:10.3389/fbioe.2021.796991. PMC 8711270. PMID 34966729.
- ^ a b c d Moutinho S, Wadman M (30 April 2021). «Is Russia’s COVID-19 vaccine safe? Brazil’s veto of Sputnik V sparks lawsuit threat and confusion». Science. Retrieved 2 May 2021.
- ^ a b He TC, Zhou S, da Costa LT, Yu J, Kinzler KW, Vogelstein B (March 1998). «A simplified system for generating recombinant adenoviruses». Proceedings of the National Academy of Sciences of the United States of America. 95 (5): 2509–2514. Bibcode:1998PNAS…95.2509H. doi:10.1073/pnas.95.5.2509. PMC 19394. PMID 9482916.
- ^ a b Thomas P, Smart TG (2005). «HEK293 cell line: a vehicle for the expression of recombinant proteins». Journal of Pharmacological and Toxicological Methods. 51 (3): 187–200. doi:10.1016/j.vascn.2004.08.014. PMID 15862464.
- ^ a b c Kovesdi I, Hedley SJ (August 2010). «Adenoviral producer cells». Viruses. 2 (8): 1681–1703. doi:10.3390/v2081681. PMC 3185730. PMID 21994701.
- ^ Turner PJ, Ansotegui IJ, Campbell DE, Cardona V, Ebisawa M, El-Gamal Y, et al. (February 2021). «COVID-19 vaccine-associated anaphylaxis: A statement of the World Allergy Organization Anaphylaxis Committee». The World Allergy Organization Journal. 14 (2): 100517. doi:10.1016/j.waojou.2021.100517. PMC 7857113. PMID 33558825.
Tris (hydroxymethyl) aminomethane, sodium chloride, sucrose, magnesium chloride hexahydrate, Sodium EDTA, polysorbate 80, ethanol, water for injection
- ^ «ИНСТРУКЦИЯ ПО МЕДИЦИНСКОМУ ПРИМЕНЕНИЮ ЛЕКАРСТВЕННОГО ПРЕПАРАТА Гам-КОВИД-Вак, Комбинированная векторная вакцина для профилактики коронавирусной инфекции, вызываемой вирусом SARS-CoV-2» (PDF). МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ.
- ^ Pushparajah D, Jimenez S, Wong S, Alattas H, Nafissi N, Slavcev RA (March 2021). «Advances in gene-based vaccine platforms to address the COVID-19 pandemic». Advanced Drug Delivery Reviews. Elsevier. 170: 113–141. doi:10.1016/j.addr.2021.01.003. PMC 7789827. PMID 33422546.
Viral vector vaccines confer high gene transduction capabilities due to the natural ability of viruses to infect host cells. These vaccines do not require adjuvants due to the presence of viral components that stimulate the innate immune system.
- ^ «Голикова назвала сроки выпуска первых партий вакцин НИЦ Гамалеи и «Вектора»» [Golikova announced the timing of the release of the first batches of vaccines of the Research Center of Gamaleya and «Vector»] (in Russian). Interfax. 29 July 2020.
- ^
«Запущено производство российской антикоронавирусной вакцины» [Production of Russian anti-coronavirus vaccine launched] (in Russian). Vesti. 15 August 2020. Retrieved 21 September 2020. - ^ Foy H, Seddon M, Sciorilli SB (10 March 2021). «Russia seeks to make Sputnik V in Italy as overseas demand surges». Financial Times. Retrieved 10 March 2021.
- ^ a b Ahmed A, Kumar AM (11 January 2021). «Russia’s Sputnik V vaccine found safe in India mid-stage trial — Dr.Reddy’s». Reuters. Retrieved 26 January 2021.
- ^ «More Countries Line Up for Russia’s Sputnik V Coronavirus Vaccine». The Moscow Times. 13 November 2020.
- ^ «Dr Reddy’s Laboratories launches Sputnik V COVID-19 vaccine in India at Rs 995 per dose-India News, Firstpost». Firstpost. 14 May 2021. Retrieved 14 May 2021.
- ^ «In Latin American first, Argentina to produce Russia’s Sputnik V vaccine». France 24. 20 April 2021. Retrieved 2 July 2021.
- ^ «Laboratorios Richmond set to begin manufacturing Sputnik V second doses». Buenos Aires Times. 30 June 2021. Retrieved 2 July 2021.
- ^ «COVID-19 vaccine production, to December 31st, 2021». Global Commission for Post-Pandemic Policy. 12 January 2022. Retrieved 19 September 2021.
- ^ a b Webster P (March 2022). «Russian COVID-19 vaccine in jeopardy after Ukraine invasion». Nature Medicine: d41591–022–00042-y. doi:10.1038/d41591-022-00042-y. PMID 35293390. S2CID 247475281.
- ^ «RUSSIAN DIRECT INVESTMENT FUND». www.opensanctions.org. Retrieved 25 April 2022.
- ^ «A Royal Mark Up: How an Emirati Sheikh Resells Millions of Russian Vaccines to the Developing World». The Moscow Times. 9 July 2021. Retrieved 10 July 2021.
- ^ «Kenya’s Failed Sputnik V Deal Used Emirati Resale Scheme». The Moscow Times. 19 July 2021. Retrieved 19 July 2021.
- ^ «Russia plans to start producing coronavirus vaccine in September». Daily Sabah. 13 June 2020. Retrieved 10 August 2020.
- ^ Ermakov A (11 August 2020). «Вакцина от COVID-19 – в словах чиновников и документах разработчика» [Vaccine for COVID-19 — in the words of officials and developer documents] (in Russian). Fontanka.ru. Retrieved 21 September 2020.
- ^ Tétrault-Farber G, Soldatkin V (11 August 2020). «Russia becomes first country to approve a COVID-19 vaccine, says Putin». Reuters. Moscow. Retrieved 11 August 2020.
- ^ «About the vaccine to prevent the novel coronavirus infection COVID-19, «Gam-COVID-Vac», developed by the National Research Centre for Epidemiology and Microbiology named after academician N. F. Gamalei of the Ministry of Health of the Russian Federation». Federal Service for Surveillance in Healthcare. 12 August 2020. Retrieved 18 August 2020.
- ^
«Ministry of Health of the Russian Federation has issued a registration certification № ЛП-006395 dated 11 August 2020 for a vaccine to prevent the novel coronavirus infection COVID-19». Federal Service for Surveillance in Healthcare. 11 August 2020. Retrieved 21 September 2020. - ^ «Coronavirus: Putin says vaccine has been approved for use». BBC. 11 August 2020. Retrieved 11 August 2020.
- ^ Ivanova P (12 June 2021). «Russia tests COVID-19 vaccine as nasal spray for children». Reuters. Moscow. Retrieved 11 July 2021.
- ^ Ellyatt H (10 September 2020). «Scientists question ‘strange’ data in Russian coronavirus vaccine trial after ‘unlikely’ patterns». CNBC. Retrieved 10 September 2020.
- ^ Logunov DY, Dolzhikova IV, Tukhvatullin AI, Shcheblyakov DV (October 2020). «Safety and efficacy of the Russian COVID-19 vaccine: more information needed — Authors’ reply». Lancet. 396 (10256): e54–e55. doi:10.1016/S0140-6736(20)31970-X. PMC 7503057. PMID 32971043. S2CID 221805026.
- ^ «Hadassah bringing 1.5 million doses of Russian COVID-19 vaccine to Israel». The Jerusalem Post | JPost.com. Retrieved 19 November 2020.
- ^ «Clinical Trial of Efficacy, Safety, and Immunogenicity of Gam-COVID-Vac Vaccine Against COVID-19». National Library of Medicine. Retrieved 28 September 2020.
- ^ «Clinical Trial of Efficacy, Safety, and Immunogenicity of Gam-COVID-Vac Vaccine Against COVID-19 in Belarus». clinicaltrials.gov. December 2020. Retrieved 14 January 2021.
- ^ «UAE volunteers receive Russian Covid-19 vaccine». Khaleej Times. 10 January 2021.
- ^ Bharadwaj S (15 January 2021). «Dr Reddy’s gets DCGI nod for Covid-19 vaccine Sputnik V Phase III trials». The Times Of India.
- ^ Clinical trial number NCT04642339 for «Clinical Trial of the Immunogenicity, Safety, and Efficacy of the Gam-COVID-Vac Vaccine Against COVID-19 in Venezuela» at ClinicalTrials.gov
- ^ «India says its safety study of Sputnik V vaccine comparable to Russian trial». Reuters. 13 April 2021.
- ^ Rodríguez R, Caeiro JP, Juri H, Pizzi R, Gallego S, Blanco S, et al. (25 May 2021). Evaluacion de la respuesta de anticuerpos neutralizantes a la vacuna Sputnik V en una cohorte en Cordoba y evaluación de las propiedades neutralizantes de anticuerpos naturales y vacunales frente a la variante Manaos [Evaluation of the neutralizing antibody response to the Sputnik V vaccine in a cohort in Cordoba and evaluation of the neutralizing properties of natural and vaccine antibodies against the Manaus variant] (Technical report) (in Spanish). National University of Córdoba. Retrieved 22 June 2021.
- ^ «Coronavirus: la vacuna Sputnik V genera anticuerpos para las variantes que circulan en el país» [Coronavirus: the Sputnik V vaccine generates antibodies for the variants that circulate in the country]. La Nación (in Spanish). 30 June 2021. Retrieved 11 July 2021.
- ^ Ikegame S, Siddiquey MN, Hung CT, Haas G, Brambilla L, Oguntuyo KY, et al. (July 2021). «Neutralizing activity of Sputnik V vaccine sera against SARS-CoV-2 variants». Nature Communications. 12 (1): 4598. Bibcode:2021NatCo..12.4598I. doi:10.1038/s41467-021-24909-9. PMC 8313705. PMID 34312390.
- ^ Mullin J, Malnick E (1 August 2020). «Britain unlikely to use Russia’s ‘untrustworthy’ Covid vaccine». The Telegraph. Archived from the original on 19 August 2020. Retrieved 6 September 2020.
- ^ «Belarus registers Sputnik V vaccine, in first outside Russia – RDIF». Reuters. 21 December 2020. Retrieved 22 December 2020.
- ^ Turak N (21 January 2021). «Russia’s Sputnik vaccine gets its first approval in the EU, greenlight from UAE amid ongoing trials». CNBC.
- ^ «Coronavirus: Hungary first in EU to approve Russian vaccine». BBC News. 21 January 2021.
- ^ Walker S (21 January 2021). «Hungary breaks ranks with EU to license Russian vaccine». The Guardian.
- ^ «Hungary Becomes First in EU to Approve Russian Covid Vaccine». Bloomberg.com. 21 January 2021.
- ^ «COVID: Hungary fast-tracks Russian vaccine with EU approval in the works | DW | 21.01.2021». DW.COM.
- ^ «Russia files for Sputnik vaccine registration in EU». Euractiv.com. 20 January 2021.
- ^ «Clarification on Sputnik V vaccine in the EU approval process» (Press release). European Medicines Agency (EMA). 10 February 2021.
- ^ a b «EMA starts rolling review of the Sputnik V COVID-19 vaccine» (Press release). European Medicines Agency (EMA). 4 March 2021. Retrieved 4 March 2021.
- ^ Rinke A, Parodi E (16 June 2021). «EU approval of Russia’s Sputnik V vaccine delayed, sources say». Reuters. Berlin. Retrieved 16 June 2021.
- ^ «COVID-19 vaccines». European Medicines Agency. Retrieved 16 June 2021.
- ^ «Da la Cofepris autorización para que la vacuna Sputnik V se aplique en México». Diario de Yucatán (in Spanish). 2 February 2021.
- ^ «Iran approves Russia’s Sputnik V COVID-19 vaccine». Al Jazeera.
- ^ Reuters Staff (26 January 2021). «Iran approves Russian coronavirus vaccine Sputnik V». Reuters.
- ^ «Czech Republic turns to Russian vaccine amid soaring COVID cases». Al Jazeera. 28 February 2021. Retrieved 1 March 2021.
- ^ Muller R, Hovet J (7 April 2021). «Czech PM names fourth health minister amid Sputnik vaccine strife». Reuters. Retrieved 8 April 2021.
- ^ Šnajdrová T. «Arenberger má záznamy ve složkách StB. Byl jsem člen KSČ, spolupracovník StB ne, brání se nový ministr» [Arenberger has records in the StB files. I was a member of the Communist Party of the Czech Republic, but not an employee of the StB, the new minister is defending himself]. Refresher (in Czech). Retrieved 8 April 2021.
- ^ «EMA starts rolling review of the Sputnik V COVID-19 vaccine». www.ema.europa.eu. 4 March 2021.
- ^ «EU medical official warns of Sputnik jab ‘Russian roulette’«. www.france24.com. 8 March 2021.
- ^ «German leaders urge quick EU approval of Russia’s Sputnik V jab» thelocal.de. Retrieved 20 March 2021.
- ^ «Philippines grants emergency authorization for Russia’s Sputnik V vaccine». ABS-CBN News. 19 March 2021. Retrieved 19 March 2021.
- ^ «Russia’s Sputnik V approved for emergency use in PH». CNN Philippines. 19 March 2021. Retrieved 19 March 2021.
- ^ «Russia’s Covid vaccine Sputnik V gets nod from expert panel for emergency use in India: Report». The Indian Express. 12 April 2021.
- ^ Das KN (12 April 2021). «Indian panel gives emergency approval for Russia’s Sputnik V vaccine -sources». Reuters.
- ^ «SPUTNIK V VACCINE AUTHORIZED IN INDIA». sputnikvaccine.com. 12 April 2021. Retrieved 12 April 2021.
- ^ «Bangladesh approves emergency use of Russian vaccine Sputnik V». New Age. 27 April 2021. Retrieved 27 April 2021.
- ^ «Turkey OKs emergency use of Sputnik-V vaccine». Anadolu Agency. Retrieved 30 April 2021.
- ^ «Russian Direct Investment Fund». rdif.ru. Retrieved 7 May 2021.
- ^ «Sputnik V vaccines landed in Slovakia». The Slovak Spectator. 1 March 2021. Retrieved 2 March 2021.
- ^ Higgins A (8 April 2021). «Slovakia Claims a Bait-and-Switch With the Russian Vaccines it Ordered». The New York Times. ISSN 0362-4331. Archived from the original on 28 December 2021. Retrieved 11 April 2021.
- ^ a b «Russia calls on Slovakia to return Sputnik V doses after dispute». Reuters. 8 April 2021. Retrieved 12 April 2021.
- ^ «Výrobca Sputnika V nedodal kontrolórom väčšinu potrebných dát». domov.sme.sk (in Slovak). 8 April 2021. Retrieved 12 April 2021.
- ^ «Slovak Regulator Says Sputnik V It Got Differs From Vaccine In Reviews». RadioFreeEurope/RadioLiberty. Retrieved 8 April 2021.
- ^ «Russian Direct Investment Fund asks Slovakia to return batch of ‘Sputnik V’ vaccines». meduza.io. 8 April 2021. Retrieved 12 April 2021.
- ^ a b «964/2021 | Centrálny register zmlúv». www.crz.gov.sk. Retrieved 11 May 2021.
- ^ a b Osvaldová L (30 April 2021). «Zmluva o nákupe Sputnika je nevýhodná a môže vojsť do dejín ako ďalší amatérsky počin, hovoria právnici». Denník N (in Slovak). Retrieved 11 May 2021.
- ^ «Výhody jen pro Rusko, lži Matoviče. Slováci znají obsah smlouvy o Sputniku». iDNES.cz. 30 April 2021. Retrieved 11 May 2021.
- ^ «Matovič oznamuje očkovanie Sputnikom, Lengvarský o tom nevie» [Matovič announces vaccination with Sputnik, Lengvarský is unaware]. Denník N (in Slovak).
- ^ «List RDIF Denníku N». Archived from the original on 11 May 2021.
On the 8th of April Dennik N published an article by Veronika Folentová entitled «Čo píše v stanovisku štátny ústav o Sputniku? Vakcíny v rôznych krajinách spája len názov» dennikn.sk/2343450/co-pise-v-stanovisku-statny-ustav-o-sputniku-vakciny-v-roznych-krajinach-spaja-len-nazov/
The article referred to the number of incorrect and misleading statements made by the Slovak regulator – State Institute for Drug Control (SUKL), which used for incorrect testing not EU-certified laboratory. RDIF and the Gamaleya Institute repeatedly insisted that all these statements were false and incorrect and rejected the Slovak allegations as «fake news».
<…>
We are concerned that your article in its current form contains unsubstantiated and false statements made by SUKL earlier and now refuted by the certified lab.
<…>
Therefore, we ask you to either remove the article entirely or reflect our position by publishing the above mentioned comments in full by the end of the day on May 9, 2021, as it is absolutely critical for us and shows the reality of the situation as well as reflects the enormous efforts by RDIF and partners in fighting the pandemic. Otherwise, RDIF reserves all rights to protect its reputation and legitimate interests and be compensated for any caused harm, including by commencing court proceedings against Dennik N in any relevant jurisdiction. - ^ «Denník N Rejects Russia’s Demand to Withdraw Story on Sputnik Vaccine». Denník N. Archived from the original on 11 May 2021.
- ^ «Slovak health ministry says Sputnik V doses tested in Hungary satisfactory». Reuters. 9 May 2021. Retrieved 26 May 2021.
- ^ Hopková D. «Koronavírus: Sputnikom V by sa mohlo na Slovensku očkovať od júna». Aktuality.sk (in Slovak). Retrieved 26 May 2021.
- ^ Reuters Staff (12 May 2021). «Slovakia could start giving Sputnik shots in June, minister says». Reuters. Retrieved 26 May 2021.
- ^ Teraz.sk (5 June 2021). «Očkovanie vakcínou Sputnik V sa spúšťa v krajoch postupne». TERAZ.sk (in Slovak). Retrieved 16 June 2021.
- ^ a b «Slovakia has no plans to receive new batches of Sputnik V vaccine — minister». TASS. Retrieved 16 June 2021.
- ^ Teraz.sk (8 June 2021). «Na vakcínu Sputnik V aktuálne čaká 4423 ľudí». TERAZ.sk (in Slovak). Retrieved 16 June 2021.
- ^ Teraz.sk (16 June 2021). «Lengvarský: Zvyšné dávky Sputniku V by SR mohla predať či darovať». TERAZ.sk (in Slovak). Retrieved 16 June 2021.
- ^ «Slovakia sells most Sputnik V vaccine doses back to Russia». Reuters. 2 July 2021. Retrieved 8 July 2021.
- ^ «Povolenie na terapeutické použitie neregistrovaného lieku» (PDF). 1 March 2021. Retrieved 8 July 2021.
- ^ «Zmätky s vakcínami pokračujú. Aký Sputnik máme v skladoch?». Pravda.sk (in Slovak). 14 April 2021. Retrieved 8 July 2021.
- ^ «After low demand, Slovakia delivers its last doses of Sputnik V». euronews. 1 September 2021. Retrieved 2 September 2021.
- ^ «Kauzu Sputnik V, po ktorej padla Matovičova vláda, polícia uzavrela». Denník Štandard (in Slovak). Retrieved 11 October 2022.
- ^ «COVID: Brazil regulator rejects Russia’s Sputnik vaccine». Deutsche Welle. Reuters. 27 April 2021. Retrieved 27 April 2021.
- ^ Brito R, Ivanova P (27 April 2021). «Brazil health regulator rejects Russia’s Sputnik vaccine». Reuters. Retrieved 27 April 2021.
- ^ «Russia says Brazil refusal to import Sputnik V ‘Political’«. Al Jazeera. 27 April 2021. Retrieved 27 April 2021.
- ^ Brito R (26 April 2021). «Brazil health regulator rejects Russia’s Sputnik vaccine». Coronavirus. Retrieved 28 April 2021.
- ^ a b «Anvisa nega pedido de importação da vacina Sputnik V; entenda as razões». BBC News Brasil (in Brazilian Portuguese). Retrieved 28 April 2021.
- ^ Cunningham E, Dixon R. «Brazil rejects Russia’s Sputnik V coronavirus vaccine, citing safety concerns». The Washington Post. ISSN 0190-8286. Retrieved 28 April 2021.
- ^ Osborn A, Paraguassu L (29 April 2021). «Russian vaccine developer to sue Brazilian regulator for defamation». Reuters. Moscow, Brasília. Retrieved 29 April 2021.
- ^ Paraguassu L, Brito R (29 April 2021). «Anvisa rebate «grave acusação» de fabricantes da Sputnik e divulga documentos e vídeo de reunião» [Anvisa counters Sputnik manufacturers’ «serious accusation» and releases documents and meeting video] (in Brazilian Portuguese). Brasilia: Istoé Dinheiro. Reuters Brasil. Retrieved 29 April 2021.
- ^ «Brazil says Russian Covid vaccine carried live cold virus». France 24. Washington. Agence France-Presse. 28 April 2021. Retrieved 30 April 2021.
- ^ Lowe D (28 April 2021). «Brazil Rejects the Gamaleya Vaccine». In the Pipeline. Science Translational Medicine. Retrieved 30 April 2021.
- ^ Lowe D (28 April 2021). «Russian Vaccine Behavior». In the Pipeline. Science Translational Medicine. Retrieved 30 April 2021.
- ^ Laing A (30 April 2021). «Chilean regulator sees no clouds over Sputnik vaccine despite Brazilian rejection». Reuters. Retrieved 3 May 2021.
- ^ Alegretti L, Barifouse R (4 June 2021). «Covaxin e Sputnik V: O que muda na vacinação do Brasil com decisão da Anvisa» [Covaxin and Sputnik V: What changes in vaccination in Brazil after Anvisa’s decision]. BBC Brasil (in Portuguese). Retrieved 5 June 2021.
- ^ «Anvisa aprova, com restrições, a importação excepcional de doses da Covaxin e Sputnik V» [Anvisa approves import of doses of Covaxin and Sputnik V, with restrictions]. G1 (in Portuguese). Globo. 4 June 2021. Retrieved 4 June 2021.
- ^ «Anvisa autoriza importação excepcional da Sputnik V por mais 7 estados, também com restrições» [Anvisa authorizes exceptional import of Sputnik V for 7 more states, also with restrictions]. G1 (in Portuguese). Globo. 16 June 2021. Retrieved 16 June 2021.
- ^ «Brazil’s northeastern states drop plan to buy Russia’s COVID vaccine». Reuters. 5 August 2021. Retrieved 5 August 2021.
- ^ «RDIF, The Gamaleya National Center, AstraZeneca and R-Pharm sign an agreement to cooperate on COVID-19 vaccine development». The Russian Direct Investment Fund. 21 December 2020.
- ^ «Azerbaijan allowed for the first in the world to study a combination of «Sputnik V» vaccine and COVID-19 vaccine developed by «AstraZeneca» Company». MoH of Azerbaijan. 9 February 2021.
- ^ «Study in Adults to Determine the Safety and Immunogenicity of AZD1222, a Non-replicating ChAdOx1 Vector Vaccine, Given in Combination With rAd26-S, Recombinant Adenovirus Type 26 Component of Gam-COVID-Vac Vaccine, for the Prevention of COVID-19». ClinicalTrials.gov. U.S. National Library of Medicine. 14 January 2021. NCT04686773. Retrieved 9 February 2021.
- ^ «Sputnik V twitter account». 20 February 2021.
- ^ Litvinova D (24 November 2020). «Russian virus vaccine to cost less than $10 per dose abroad». Associated Press.
- ^ Osborn A, Nikolskaya P (24 November 2020). «Russia’s Sputnik COVID-19 vaccine to cost less than $20 per person internationally». The Globe and Mail. Retrieved 28 November 2020.
- ^ «Центр Гамалеи назвал сроки вакцинации большей части населения России». RBK. 4 September 2020. Retrieved 6 September 2020.
- ^ Sagdiev R, Ivanova P, Nikolskaya P, Swift R, Smout A (17 November 2020). Mason J, Macfie N (eds.). «Russia focuses on freeze-dried vaccine doses as transport fix». Reuters. Moscow. Retrieved 20 November 2020.
- ^ «Минздрав пообещал россиянам бесплатную вакцинацию от COVID-19» [Ministry of Health promised Russians free vaccination against COVID-19]. RBC.ru (in Russian). Retrieved 23 October 2020.
- ^ «В будущем вакцинация от COVID-19 будет проходить бесплатно» [In the future, vaccination against COVID-19 will be free of charge]. Russian Newspaper (in Russian). 11 October 2020. Retrieved 23 October 2020.
- ^ a b
«Минздрав зарегистрировал предельную отпускную цену на вакцину «Спутник V»» [The Ministry of Health registered the maximum selling price for the Sputnik V vaccine] (in Russian). RIA. 5 December 2020. Retrieved 21 September 2020. - ^ «Covid: Russia begins vaccinations in Moscow». BBC. 5 December 2020. Retrieved 11 December 2020.
- ^ a b Soldatkin V, Oziel C (5 December 2020). Char P (ed.). «Moscow rolls out Sputnik V COVID-19 vaccine to most exposed groups». Reuters.
- ^ «Russia approves Sputnik V COVID-19 vaccine for people over 60: media». Reuters. 26 December 2020.
- ^ «Covid: Russia begins vaccinations in Moscow». BBC News. 5 December 2020.
- ^ «Moscow delivers Russia’s Sputnik V coronavirus vaccine to clinics». The Guardian. Reuters. 5 December 2020.
- ^ «Coronavirus: Russia rolls out COVID vaccination in Moscow». Deutsche Welle. 5 December 2020.
- ^ Marrow A, Ostroukh A (2 December 2020). «Putin orders Russia to begin a large-scale voluntary COVID-19 vaccination program next week». The Globe and Mail. Retrieved 3 December 2020.
- ^ «COVID-19: Moscow opens Sputnik V clinics – but 100,000 have already had it». Sky News.
- ^
«Russia to vaccinate two million against COVID-19 in Dec – RDIF head to BBC». Reuters. 4 December 2020. Retrieved 21 September 2020. - ^
«About 6.9 mln doses of Sputnik V vaccine to enter circulation in Russia by end of February». TASS. 10 December 2020. Retrieved 21 September 2020. - ^
«Coronavirus in Russia: The Latest News». The Moscow Times. 22 December 2020. Retrieved 21 September 2020. - ^ Ritchie H, Ortiz-Ospina E, Beltekian D, Mathieu E, Hasell J, MacDonald B, et al. (5 March 2020). «Coronavirus (COVID-19) Vaccinations — Statistics and Research». Our World in Data. Retrieved 3 March 2021.
- ^ «Собянин заявил о минимальной доле привитых в Москве в сравнении с Европой». РБК (in Russian). Retrieved 25 May 2021.
- ^ «Дипломатический иммунитет: кто и в каком количестве покупает российскую вакцину». Forbes.ru (in Russian). Retrieved 25 May 2021.
- ^ a b Roth A (26 June 2021). «‘I don’t have a choice’: Russians scramble to get Covid vaccine amid new restrictions». The Guardian. Moscow. Retrieved 11 July 2021.
- ^ «Putin Battles to Sell Russia’s Vaccine in New Rift With West». Bloomberg.com. 31 December 2020. Retrieved 3 March 2021.
- ^ Rodgers J. «Facing Record COVID-19 Case Rise, Russia Rolls Out Sputnik V Vaccine». Forbes.
- ^ Arkhipov I, Kravchenko S (2 December 2020). «Putin Orders Start of Mass Covid-19 Shots Hours After U.K. News». Bloomberg News.
- ^ Meyer H, Arkhipov I. «Russia Defends First Covid-19 Vaccine as Safe Amid Skepticism». Bloomberg News. Retrieved 12 August 2020.
- ^ Jaffe-Hoffman M (12 November 2020). «Israel to receive Russia’s 92% effective COVID vaccine». The Jerusalem Post. Retrieved 19 November 2020.
- ^ «Argentina agrees to buy 25 million doses of Russia’s Covid-19 vaccine». www.batimes.com.ar. 3 November 2020.
- ^ «Argentina Approves Russian Vaccine With Plane Waiting in Moscow». Bloomberg.com. 23 December 2020.
- ^ Boadle A (24 October 2020). Wallis D (ed.). «Second Brazilian company to produce Russia’s Sputnik V COVID-19 vaccine». Reuters.
- ^ «Argentina’s president sits for Russian Covid jab». France 24. 21 January 2021.
- ^ Centenera M (21 January 2021). «Alberto Fernández, primer presidente de América Latina en vacunarse contra la covid-19 (in Spanish)». El País (in Spanish).
- ^ Rebaza C, Timm-Garcia J, Hu C (4 April 2021). «Argentina’s President tests positive for Covid-19 after vaccine». CNN.
- ^ «Alberto Fernández recibe el alta por COVID y retoma sus actividades» [Alberto Fernández is discharged from treatment for COVID and resumes his activities]. Perfil (in Spanish). 13 April 2021.
- ^ Kingsley P, Bergman R, Kramer AE (21 February 2021). «Israel Secretly Agrees to Fund Vaccines for Syria as Part of Prisoner Swap». The New York Times. ISSN 0362-4331. Archived from the original on 28 December 2021. Retrieved 3 March 2021.
- ^ Camparsi ML. «Vaccino Sputnik, a San Marino 400 dosi al giorno dal 1 marzo: «Sicurezza? Confortati dagli studi. Per ora lo diamo solo ai nostri cittadini» (in Italian). Il Fatto Quotidiano. Retrieved 1 March 2021.
- ^ «Армения приобретет миллион доз «Спутник V»«. rg.ru. 14 April 2021.
- ^ Nebehay S (11 August 2020). Shields M (ed.). «WHO says discussing new COVID-19 vaccine with Russia». Reuters. Geneva. Retrieved 11 August 2020.
- ^ Reuters Staff (2020-11-11). «Instant view-Russia says its Sputnik V COVID-19 vaccine is 92% effective»
- ^ Jones I, Roy P (February 2021). «Sputnik V COVID-19 vaccine candidate appears safe and effective». Lancet. 397 (10275): 642–643. doi:10.1016/S0140-6736(21)00191-4. PMC 7906719. PMID 33545098.
- ^ Montalti M, Soldà G, Di Valerio Z, Salussolia A, Lenzi J, Forcellini M, et al. (August 2021). «ROCCA observational study: Early results on safety of Sputnik V vaccine (Gam-COVID-Vac) in the Republic of San Marino using active surveillance». EClinicalMedicine. 38: 101027. doi:10.1016/j.eclinm.2021.101027. PMC 8413252. PMID 34505029.
- ^ Nogrady B, «Mounting evidence suggests Sputnik COVID vaccine is safe and effective» Nature, 595, 339–340 (2021)
- ^ Jarynowski A, Semenov A, Kamiński M, Belik V (18 May 2021) Mild Adverse Events of Sputnik V Vaccine in Russia: Social Media Content Analysis of Telegram via Deep Learning.Journal of Medical Internet Research, 23(11):e30529
- ^ Cyr E (24 August 2020). «Leger’s Weekly Survey» (PDF). leger360.com. Archived from the original (PDF) on 5 September 2020. Retrieved 5 September 2020.
- ^ «Leger’s Weekly Survey on Russian vaccine; saved copy on 5 38.com» (PDF).
- ^ «Klare Mehrheit wünscht engere Beziehungen zu Russland». Ost-Ausschuss der Deutschen Wirtschaft. 2 June 2021. Retrieved 7 July 2021.
- ^ Ullah Z, Chernova A (6 September 2020). «Putin’s vaccine meets opposition from frontline workers in Russia». CNN. Retrieved 6 September 2020.
- ^ «Majority of Russians Still Not Ready to Get Sputnik Vaccine – Poll». The Moscow Times. 12 May 2021. Retrieved 2 July 2021.
Further reading[edit]
- Corum J, Zimmer C (7 January 2021). «How Gamaleya’s Vaccine Works». The New York Times.
External links[edit]
Wikimedia Commons has media related to Sputnik V.
- Official website
Гам-КОВИД-Вак — инструкция по применению
Синонимы, аналоги
Статьи
Комбинированная векторная вакцина для профилактики коронавирусной инфекции, вызываемой вирусом SARS-CoV-2
Данный лекарственный препарат зарегистрирован по процедуре регистрации препаратов, предназначенных для применения в условиях угрозы возникновения, возникновения и ликвидации чрезвычайных ситуаций. Инструкция подготовлена на основании ограниченного объема клинических данных по применению препарата и будет дополняться по мере поступления новых данных. Применение препарата возможно только в условиях медицинских организаций, имеющих право осуществлять вакцинопрофилактику населения в установленном законодательством порядке.
Регистрационный номер:
ЛП-006395
Торговое наименование:
Гам-КОВИД-Вак, Комбинированная векторная вакцина для профилактики коронавирусной инфекции, вызываемой вирусом SARS-CoV-2
Международное непатентованное или группировочное наименование:
Вакцина для профилактики новой коронавирусной инфекции (COV1D-19)
Лекарственная форма:
раствор для внутримышечного введения
Состав
Состав на 1 дозу (0,5 мл):
Компонент I содержит:
Действующее вещество: рекомбинантные аденовирусные частицы 26 серотипа, содержащие ген белка S вируса SARS-CoV-2, в количестве (1,0±0,5)×1011 частиц/доза.
Вспомогательные вещества: Трис(гидроксилметил)аминометан – 1,21 мг, натрия хлорид – 2,19 мг, сахароза – 25,0 мг, магния хлорида гексагидрат – 102,0 мкг, ЭДТАдинатриевая соль дигидрат – 19,0 мкг, полисорбат 80 – 250 мкг, этанол 95% – 2,5 мкл, вода для инъекций до 0,5 мл.
Компонент II содержит:
Действующее вещество: рекомбинантные аденовирусные частицы 5 серотипа, содержащие ген белка S вируса SARS-CoV-2, в количестве (1,0±0,5)×1011 частиц/доза.
Вспомогательные вещества: Трис(гидроксилметил)аминометан – 1,21 мг, натрия хлорид – 2,19 мг, сахароза – 25,0 мг, магния хлорида гексагидрат – 102,0 мкг, ЭДТАдинатриевая соль дигидрат – 19,0 мкг, полисорбат-80 – 250 мкг, этанол 95% – 2,5 мкл, вода для инъекций до 0,5 мл.
Описание:
Компонент I. Раствор замороженный. Представляет собой плотную затвердевшую беловатого цвета массу. После размораживания: однородный бесцветный или с желтоватым оттенком слегка опалесцирующий раствор.
Компонент II. Раствор замороженный. Представляет собой плотную затвердевшую беловатого цвета массу. После размораживания: однородный бесцветный или с желтоватым оттенком слегка опалесцирующий раствор.
Характеристика:
Вакцина получена биотехнологическим путем, при котором не используется патогенный для человека вирус SARS-CoV-2. Препарат состоит из двух компонентов: компонент I и компонент II. В состав компонента I входит рекомбинантный аденовирусный вектор на основе аденовируса человека 26 серотипа, несущий ген белка S-вируса SARS-CoV-2, в состав компонента II входит вектор на основе аденовируса человека 5 серотипа, несущий ген белка S вируса SARS-CoV-2.
Фармакотерапевтическая группа:
МИБП-вакцина.
Код ATX:
J07B
Фармакологические свойства
Вакцина индуцирует формирование гуморального и клеточного иммунитета в отношении коронавирусной инфекции, вызываемой вирусом SARS-CoV-2.
Иммунологическая эффективность
Иммунологические свойства и безопасность вакцины изучали в клиническом исследовании у взрослых здоровых добровольцев обоего пола в возрасте от 18 до 60 лет: 9 добровольцев получали компонент I, 9 – компонент II и 20 – в режиме прайм-буст. Иммуногенность оценивали по уровню специфических IgG-антител к белку S коронавируса SARS-CoV-2 и вируснейтрализущих антител, а также по образованию специфических Т-хелперных (CD4+) и цитотоксических (CD8+) лимфоцитов.
Оценку уровня специфических IgG проводили в сравнении с исходным уровнем антител (до иммунизации). У всех участников исследования, получавших препарат, образовались специфические антитела. На 42 сутки среднегеометрическое значение титра составило – 14 703, при 100% сероконверсии. Также на 42 сутки от начала вакцинации в сыворотке крови всех добровольцев детектированы вируснейтрализующие антитела к вирусу SARS-CoV-2 со средним титром 49,3.
Активность клеточного иммунитета оценивали в тесте лимфопролиферации СD4+ и CD8+, а также по приросту концентрации интерферона гамма в ответ на стимуляцию митогеном (гликопротеин S).
Иммунизация препаратом Гам-КОВИД-Вак, вызвала формирование напряженного антиген-специфического клеточного противоинфекционного иммунитета у 100% добровольцев (формирование антиген-специфичных клеток обоих популяций Т лимфоцитов: Т хелперных (CD4+) и Т киллерных (CD8+) и достоверному повышению секреции ИФНγ).
Защитный титр антител в настоящее время неизвестен. Продолжительность защиты неизвестна. Клинические исследования по изучению эпидемиологической эффективности не проводились.
Показания к применению:
Профилактика новой коронавирусной инфекции (COVID-19) у взрослых 18-60 лет
Противопоказания:
- Гиперчувствительность к какому-либо компоненту вакцины или вакцины, содержащей аналогичные компоненты;
- тяжелые аллергические реакции в анамнезе;
- острые инфекционные и неинфекционные заболевания, обострение хронических заболеваний – вакцинацию проводят через 2-4 недели после выздоровления или ремиссии. При нетяжелых ОРВИ, острых инфекционных заболеваниях ЖКТ-вакцинацию проводят после нормализации температуры;
- беременность и период грудного вскармливания;
- возраст до 18 лет (в связи с отсутствием данных об эффективности и безопасности)
Противопоказания для введения компонента II
- тяжелые поствакцинальные осложнения (анафилактический шок, тяжелые генерализованные аллергические реакции, судорожный синдром, температура выше 40 °С и т.д.) на введение компонента I вакцины;
С осторожностью
При хронических заболеваниях печени и почек, выраженных нарушениях функции эндокринной системы (сахарный диабет), тяжелых заболеваниях системы кроветворения, эпилепсии, инсультах и других заболеваниях ЦНС, заболеваниях сердечно-сосудистой системы (инфарктах миокарда в анамнезе, миокардитах, эндокардитах, перикардитах, ишемической болезни сердца), первичных и вторичных иммунодефицитах, аутоиммунных заболеваниях, заболеваниях легких, астме и ХОБЛ, у пациентов с диабетом и метаболическим синдромом, с аллергическими реакциями, атопией, экземой.
Места, где проводится вакцинация, должны быть оснащены средствами противошоковой терапии в соответствии с Приказом Министерства здравоохранения РФ от 20 декабря 2012 г. N 1079н «Об утверждении стандарта скорой медицинской помощи при анафилактическом шоке).
В день проведения вакцинации пациент должен быть осмотрен врачом: обязательным является общий осмотр и измерение температуры тела, в случае если температура превышает 37 °С, вакцинацию не проводят.
Применение при беременности и в период грудного вскармливания
Препарат противопоказан при беременности и в период грудного вскармливания, так как его эффективность и безопасность в этот период не изучались.
Способ применения и дозы
Вакцина предназначена только для внутримышечного введения. Строго запрещено внутривенное введение препарата. Вакцину вводят в дельтовидную мышцу (верхнюю треть наружной поверхности плеча). При невозможности введения в дельтовидную мышцу – препарат вводят в латеральную широкую мышцу бедра. Вакцинацию проводят в два этапа: вначале компонентом I, затем через 3 недели компонентом II.
Препарат вводят внутримышечно: вначале компонент I в дозе 0,5 мл, затем через 3 недели компонент II в дозе 0,5 мл.
Перед введением препарат (компонент) необходимо достать из холодильной камеры и выдержать при комнатной температуре до полного размораживания не более 30 минут; перед применением перемешать, осторожно покачивая флакон (ампулу). Не допускается резко встряхивать препарат.
Хранение вскрытого флакона (ампулы) не допускается!
Повторное замораживание препарата не допускается!
Не пригоден к применению препарат во флаконах и ампулах с нарушенной целостностью и маркировкой, при изменении физических свойств (мутность, окрашивание), при истекшем сроке годности, неправильном хранении.
После введения вакцины пациент должен находиться под наблюдением медицинских работников в течение 30 минут.
Информация для медицинских работников, выполняющих вакцинацию лекарственным препаратом: данный лекарственный препарат зарегистрирован по особой процедуре регистрации, в связи, с чем необходимо уведомлять Федеральную службу по надзору в сфере здравоохранения о каждом факте применения лекарственного препарата путем внесения информации в соответствующей раздел информационной системы ЕГИСЗ
Побочное действие
Нежелательные явления, характерные для применения вакцины, выявленные в рамках клинических исследований, а также исследований других вакцин на основе аналогичной технологической платформы, бывают преимущественно легкой или средней степени выраженности, могут развиваться в первые-вторые сутки после вакцинации и разрешаются в течение 3-х последующих дней. Чаще других могут развиться кратковременные общие (непродолжительный гриппоподобный синдром, характеризующийся ознобом, повышением температуры тела, артралгией, миалгией, астенией, общим недомоганием, головной болью) и местные (болезненность в месте инъекции, гиперемия, отечность) реакции). Рекомендуется назначение нестероидных противовоспалительных средств (НПВС) при повышении температуры после вакцинации. Реже отмечаются тошнота, диспепсия, снижение аппетита, иногда – увеличение регионарных лимфоузлов. У некоторых пациентов возможно развитие аллергических реакций, кратковременное повышение уровня печеночных трансаминаз, креатинина и креатинфосфокиназы в сыворотке крови.
В открытом клиническом исследовании безопасности, переносимости и иммуногенности препарата Гам-КОВИД-Вак нежелательные явления (НЯ) по частоте встречаемости могут быть расценены как встречающиеся часто и очень часто, определить более точно встречаемость нежелательных явлений не представляется возможным из-за ограниченности выборки участников исследования. После вакцинации были зарегистрированы следующие НЯ:
«Общие нарушения и реакции в месте введения»: относились: гипертермия, боль, отек, зуд в месте вакцинации, астения, боль, недомогание, пирексия, повышение температуры кожи в месте вакцинации, снижение аппетита. «Нарушения со стороны нервной системы»: головная боль, диарея. «Нарушения со стороны дыхательной системы, органов грудной клетки и средостения»: боль в ротоглотке, заложенность носа, першение в горле, ринорея.
«Лабораторные и инструментальные данные»; разнонаправленные отклонения показателей иммунологического статуса: повышение числа Т-лимфоцитов, увеличение процентного содержания лимфоцитов, снижение числа естественных клеток-киллеров, увеличение количества СD4-лимфоцитов, снижение количества СD4-лимфоцитов, повышение числа В-лимфоцитов, снижение числа В-лимфоцитов, повышение числа естественных клеток-киллеров, повышение количества СD8-лимфоцитов, повышение уровня иммуноглобулина Е (IgE) в крови, увеличение соотношения CD4/CD8, уменьшение соотношения CD4/CD8, повышение уровня иммуноглобулина A (IgA) в крови, уменьшение процентного содержания лимфоцитов CD8. Отклонения в общем анализе крови: увеличение процентного содержания лимфоцитов, снижение показателя гематокрита, увеличение числа лимфоцитов, повышение скорости оседания эритроцитов, повышение числа лейкоцитов, повышение числа моноцитов, повышение числа тромбоцитов, снижение числа нейтрофилов, снижение числа тромбоцитов. Отклонения в общем анализе мочи: эритроциты в моче. Большинство НЯ завершились выздоровлением без последствий (144 НЯ). На 42 день исследования не завершились 31 НЯ (исход был неизвестен для – НЯ и шел процесс выздоровления – 4 НЯ) – лабораторные отклонения иммунологических показателей, что не имеет клинического значения (не нуждается в проведении дополнительных диагностических процедур и назначения терапии).
Передозировка
О случаях передозировки не сообщалось.
Учитывая, что отпуск лекарственного препарата допускается только для лечебно-профилактических учреждений, а сама вакцинация проводится только квалифицированным медицинским персоналом, риск передозировки крайне низок.
Однако можно предположить, что при случайной передозировке возможно развитие указанных выше токсических и токсико-аллергических реакций в более тяжелой степени.
Специфических антидотов к препарату не существует.
Терапевтические мероприятия в данном случае будут включать симптоматическую терапию в соответствии с показаниями (жаропонижающие/ НПВС и десенсибилизирующие средства), кортикостероиды – парентерально при выраженном токсико-аллергическом синдроме). Режим назначения препаратов должен быть выбран согласно рекомендациям по применению и дозировкам данного лекарственного средства.
Взаимодействие с другими лекарственными средствами
Не изучалось.
Особые указания
У пациентов, получающих иммуносупрессивную терапию и пациентов с иммунодефицитом может не развиться достаточный иммунный ответ. Поэтому прием препаратов, угнетающих функцию иммунной системы, противопоказан как минимум за 1 месяц до и после вакцинации из-за риска снижения иммуногенности.
Влияние на способность управлять транспортными средствами, механизмами
Исследования по изучению влияния вакцины на способность управлять транспортными средствами и потенциально опасными механизмами не проводились.
Форма выпуска
Раствор для внутримышечного введения, компонент I – 0,5 мл/доза + компонент II – 0,5 мл/доза.
При производстве ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» Минздрава России (филиал «Медгамал» ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» Минздрава России): по 0,5 мл (1 доза) каждого компонента препарата во флаконы нейтрального стекла первого гидролитического класса (типа 2R, 4R), герметично укупоренных пробками из резины, обжатых алюминиевыми или алюмопластиковыми колпачками.
На флаконы наклеивают этикетку из бумаги писчей по ГОСТ 18510-87 или этикеточной по ГОСТ 7625-86, или этикетку из самоклеящегося материала по ТУ 13.96.17-001-90585582-2019 или аналогичного качества.
1 флакон компонента I с инструкцией по применению помещают в пачку картонную по ОСТ 64-071-89 или в пачку из картона коробочного марки хром-эрзац или А по ГОСТ 7973-89; 1 флакон компонента II с инструкцией по применению помещают в пачку картонную по ОСТ 64-071-89 или в пачку из картона коробочного марки хром-эрзац или А по ГОСТ 7973-89
При производстве АО «Биннофарм»:
По 0,5 мл (1 доза) каждого компонента препарата в ампулы по ISO 9187 или ТУ 9462-001-53908805-2006 из бесцветного стекла 1-го гидролитического класса вместимостью 1 мл с цветной точкой. На каждую ампулу наклеивают этикетку.
По 5 ампул каждого компонента препарата помещают в контурную ячейковую упаковку из пленки поливинилхлоридной.
По 1 контурной ячейковой упаковке вместе с инструкцией по применению помещают в пачку из картона по ГОСТ 33781-2016.
Условия хранения:
Хранить в защищенном от света месте, при температуре не выше минус 18°С. Не допускается хранение размороженного препарата более 30 минут! Хранить в недоступном для детей месте.
Условия транспортирования:
Транспортирование препарата при температуре не выше минус 18 °С. Применим способ транспортировки с сухим льдом.
Срок годности:
6 месяцев. Не применять по истечении срока годности.
Условия отпуска:
для лечебно-профилактических учреждений.
Производитель
Наименования и адреса производственных площадок производителя лекарственного препарата:
1) ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» Минздрава России (филиал «Медгамал» ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» Минздрава России), Россия, 123098, г. Москва, улица Гамалеи, д. 18. (все стадии производства):
2) АО «Биннофарм», Россия, 124460, г. Москва, г. Зеленоград, ул. Конструктора Гуськова, д. 3, стр. 1 (очистка, розлив (первичная упаковка), упаковка (вторичная потребительская упаковка)
Владелец регистрационного удостоверения/организация, принимающая претензии потребителя:
ФГБУ «Национальный исследовательский центр эпидемиологии и микробиологии имени почетного академика Н.Ф. Гамалеи» Министерства здравоохранения Российской Федерации (ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» Минздрава России).
Россия, 123098, г. Москва, улица Гамалеи, д. 18
Гам-КОВИД-Вак — цена, наличие в аптеках
Указана цена, по которой можно купить Гам-КОВИД-Вак в Москве. Точную цену в Вашем городе Вы получите после перехода в службу онлайн заказа лекарств:
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Состав вакцины
Состав Гам-КОВИД-Вак указан на одну дозу, которая составляет 0.5 мл.
Компонент 1 содержит:
- активное вещество: рекомбинантные аденовирусные частицы 26 серотипа, в которых содержится ген белка S вируса SARS-CoV-2, по 1 x 1011 частиц с погрешностью 0.5 x 1011 частиц;
- вспомогательные компоненты: магния хлорида гексагидрат (102 мкг), трис(гидроксиметил)аминометан (1.21 мг), сахароза (25 мг), хлорид натрия (2.19 мг), ЭДТА динатриевая соль дигидрат (19 мкг), вода для инъекции (до 0.5 мл), этанол 95% (2.5 мкл), полисорбат 80 (250 мкг).
Компонент 2 содержит:
- активное вещество: аденовирусные рекомбинантные частицы 5 серотипа, которые содержат ген белка S вируса SARS-CoV-2, по 1 x 1011 частиц в дозе с погрешностью 0.5 x 1011 частиц;
- вспомогательные вещества те же, что в первом компоненте.
В составе Гам-КОВИД-Вак-Лио содержится аналогичное количество активного компонента и вспомогательные элементы: магния хлорида гексагидрат (20.4 мкг), трис(гидроксиметил)аминометан (0.24 мг), сахароза (73.5 мг), хлорид натрия (1.4 мг), ЭДТА динатриевая соль дигидрат (3.8 мкг), полисорбат 80 (0.05 мг).
Производители
На данный момент известны следующие производители Гам-КОВИД-Вак:
- ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» Минздрава России;
- АО «Биннофарм»;
- АО «ГЕНЕРИУМ»;
- АО «Р-Фарм»;
- ЗАО «БИОКАД»;
- ЗАО «ЛЕККО»;
- ОАО «Фармстандарт-УфаВИТА».
Владельцем регистрационного удостоверения на производство вакцины Спутник V является ФГБУ «Национальный исследовательский центр микробиологии и эпидемиологии им. почетного академика Н.Ф. Гамалеи» Мин. здравоохранения РФ.
Когда вакцина зарегистрирована?
Вакцина от коронавируса Гам-КОВИД-Вак была зарегистрирована 11 августа 2020 года.
Форма выпуска
Препарат Гам-КОВИД-Вак (Спутник V) выпускают в форме раствора для внутримышечного введения из двух компонентов, по 0.5 мл раствора каждого компонента на 1 дозу.
Замороженный препарат
Оба компонента препарата в виде замороженного раствора — беловатая твердая плотная масса. После разморозки — однородный раствор, бесцветный или слегка желтоватый.
Производство ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи»:
- Препарат во флаконах, закрытых резиновой пробкой, обжатый алюмопластиковым колпаком. По 0.5 мл (1 доза) каждого компонента во флаконе. Флакон каждого компонента вместе с инструкцией помещен в пачку из картона.
Производство АО «Биннофарм»:
- Препарат в прозрачных ампулах с цветной точкой. По 0.5 мл (1 доза) каждого компонента в ампуле. По 5 ампул каждого компонента помещены в ячейковую контурную упаковку из поливинилхлоридной пленки, по 1 ячейковой упаковке вместе с инструкцией в картонной пачке.
Производство АО «ГЕНЕРИУМ» и ЗАО «ЛЕККО»:
- Препарат во флаконах, закрытых резиновой пробкой, обжатый алюмопластиковым колпаком с контролем первого вскрытия. По 3 мл (5 доз) каждого компонента во флаконе. Флакон каждого компонента вместе с инструкцией помещен в пачку из картона.
Производство ЗАО «БИОКАД»:
- Препарат во флаконах, закрытых резиновой пробкой, обжатый алюминиевым колпаком с пластиковой крышкой типа «flip-off». По 3 мл (5 доз) или по 0.5 мл (1 доза) каждого компонента во флаконе. Флакон 6R каждого компонента вместе с инструкцией помещен в пачку из картона. Флакон 2R каждого компонента в контурной ячейковой упаковке из ПВХ пленки вместе с инструкцией помещен в пачку из картона.
Производство ОАО «Фармстандарт-УфаВИТА»:
- Препарат в прозрачных ампулах. По 0.5 мл (1 доза) каждого компонента в ампуле. По 5 ампул каждого компонента помещены в ячейковую контурную упаковку из поливинилхлоридной пленки, по 1 ячейковой упаковке вместе с инструкцией в картонной пачке.
- Препарат во флаконах, закрытых резиновой пробкой, обжатый алюмопластиковым колпаком с контролем первого вскрытия. По 3 мл (5 доз) каждого компонента во флаконе. Флакон каждого компонента вместе с инструкцией помещен в пачку из картона.
Жидкий препарат
Оба компонента препарата в виде однородного раствора, бесцветного или слегка желтоватого оттенка.
Производство ОАО «Фармстандарт-УфаВИТА»:
- Препарат в прозрачных ампулах. По 0.5 мл (1 доза) каждого компонента в ампуле. По 5 ампул каждого компонента помещены в ячейковую контурную упаковку из поливинилхлоридной пленки, по 1 ячейковой упаковке вместе с инструкцией в картонной пачке.
Производство АО «ГЕНЕРИУМ» и ЗАО «ЛЕККО»:
- Препарат во флаконах, закрытых резиновой пробкой, обжатый алюмопластиковым колпаком с контролем первого вскрытия. По 3 мл (5 доз) каждого компонента во флаконе. Флакон каждого компонента в контурной ячейковой упаковке вместе с инструкцией помещен в пачку из картона.
Фармакологическое действие
Комбинированная векторная вакцина Гам-КОВИД-Вак применяется в качестве иммунологического средства.
Фармакодинамика и фармакокинетика
Согласно исследованиям препарата в институте Гамалеи вакцина способствует формированию клеточного и гуморального иммунитета по отношению к вирусной инфекции, ассоциированной SARS-CoV-2. Обладает иммунологической активностью. Безопасность и иммунологические свойства изучались в клинических исследованиях у взрослых пациентов обоих полов. Возраст испытываемых составлял от 18 до 60 лет. При этом 9 человек получали первый компонент и 9 — второй, 20 человек проходили вакцинацию в режиме прайм-буст.
Иммуногенность средства была оценена по уровню спец. антител к белку коронавируса и уровню нейтрализующих вирус антител. У всех пациентов, принимающих участие в исследовании в результате образовывались специфические агенты. Через 42 дня в сыворотке крови всех добровольцев были обнаружены антитела к вирусу.
В центре Гамалеи оценку уровня иммуноглобулинов проводили по сравнению с исходным уровнем до иммунизации. Степень активности клеточного иммунитета была оценена в тесте лимфопролиферации CD8+ и CD4+, по скорости прироста интерферонов гамма в ответ на стимуляцию гликопротеином S.
После проведения вакцинации Спутником V был сформирован напряженный ангитен-специфический клеточный противоинфекционный иммунитет у всех добровольцев. Формировались антиген-специфичные клетки Т-хелперов, Т-киллеров, наблюдалось повышение уровня ИФНγ.
На данный момент испытания вакцины Cпутник V продолжаются, а защитный титр антител достоверно неизвестен. Испытания должны выявить продолжительность защиты организма. Также, пока не проводились клинические исследования по изучению эпидемиологической эффективности средства.
Показания к применению
Применяют для профилактики новой коронавирусной инфекции COVID-19 у взрослых пациентов в возрасте от 18 до 60 лет.
Вакцина Спутник V, противопоказания
Были выявлены следующие противопоказания на Спутник Ви:
- сверхчувствительность к компонентам средства или к вакцинам, содержащим аналогические ингредиенты;
- наличие тяжелых аллергических реакций у пациента ранее;
- неинфекционные и инфекционные острые заболевания;
- обострение хронического заболевания (вакцинацию рекомендуется проводит не ранее, чем через 2-4 недели после полного выздоровления или достижения ремиссии);
- кормление грудью и беременность;
- возраст до 18 и более 60 лет.
Перед тем, как сделать прививку 2 компонентом нужно выяснить у пациента, не возникали ли тяжелые осложнения (аллергические реакции, анафилактический шок, судороги, повышение температуры выше 40 градусов) после инъекции 1 компонента.
Осторожность следует соблюдать:
- при хронических заболеваниях почек и печени;
- пациентам с сахарным диабетом и выраженными нарушениями работы эндокринной системы;
- при тяжелых заболеваниях системы кроветворения;
- больным эпилепсией;
- после инсульта или с другими заболеваниями центральной нервной системы;
- при патологиях сердечно-сосудистой системы, инфаркте в анамнезе, миокардите, перикардите, эндокардите, ишемической болезни;
- пациентам с первичным и вторичным иммунодефицитом;
- при аутоимунных заболеваниях;
- больным астмой, с заболеваниями легких, ХОБЛ;
- при метаболическом синдроме;
- пациентам с атопией, аллергическими реакциями, экземой.
В учреждении, где проводят вакцинацию должны быть в наличии средства противошоковой терапии. В день проведения прививки пациента необходимо осмотреть, измерить температуру. Нельзя делать укол, если у пациента температура выше 37 градусов.
Вакцина Спутник V, побочные эффекты
Побочные эффекты Гам-КОВИД-Вак были выявлены в рамках клинических испытаний и исследований прочих вакцин, разработанных по аналогичной технологии. Реакции бывают легкими или среднетяжелыми. Чаще всего возникают в 1-2 день после прививки и проходят в течение следующих 3 дней. Рекомендуют проводить симптоматические лечение, при необходимости принимать НПВС после вакцинации.
Обычно наблюдаются кратковременные общие и местные реакции:
- гриппоподобный синдром, озноб, рост температуры тела, миалгия, артралгия, общая слабость;
- астения, головные боли, недомогание;
- боли в месте инъекции, отечность и повышение температуры в месте укола.
Реже возникает:
- тошнота, несварение желудка, потеря аппетита;
- увеличение лимфоузлов, аллергические реакции;
- рост уровня ферментов печени, креатинина, трансаминаз, креатинфосфокиназы в крови.
В открытом клиническом исследовании безопасности вакцины не удалось точно определить встречаемость нежелательных реакций, так как выборка участников исследования была ограниченной.
Во время таких исследований выявили следующие побочные эффекты:
- боль, отек, зуд в месте введения вакцины;
- понос, боли в ротоглотке, заложенность носа и першение в горле, ринорея;
- рост уровня Т-лимфоцитов, CD4-лимфоцитов и процентного их содержания;
- снижение числа естественных «киллеров», СD8;
- отклонения в общем анализе мочи, наличие в ней эритроцитов.
Вакцина Гам-КОВИД-Вак (Спутник V), инструкция по применению
Прививка Спутник V от коронавируса проводится внутримышечно. Внутривенное ведение средства строго запрещено. Инъекцию производят в дельтовидную мышцу или в латеральную широкую мышцу бедра.
Лиофилизат необходимо растворить в 1,0 мл воды для инъекций. После чего флакон встряхивают, пока его содержимое полностью не растворится.
Перед введением готового препарата его достают из холодильной камеры и нагревают при комнатной температуре в течение получаса. Раствор перемешивают осторожно покачивая ампулу. Нельзя резко встряхивать средство.
Нельзя использовать препарат, если целостность флакона была нарушена, смазалась маркировка, вещество изменило свои физические свойства, изменился цвет, появились механические включения, истек срок годности.
Лекарственный препарат был зарегистрирован по особой процедуре, и при каждом применении вакцины необходимо уведомлять Федеральную службу по надзору в сфера здравоохранения. Информацию нужно вносить в соответствующий раздел инф. системы ЕГИСЗ.
Вакцинация проводится в 2 этапа. Вначале вводят компонент 1, затем через 3 недели — компонент 2.
Если дальнейшие инъекции были отложены по какой-либо причине, то можно хранить вскрытый флакон по 3 мл не более 2 часов при комнатной температуре.
Передозировка
Нет данных о передозировке Спутник Ви. Вакцина от ковида выпускается для использования в лечебно-профилактических учреждениях, процедура проводится только квалифицированными мед. персоналом и вероятность передозировки крайне мала.
Предполагается, что при случайной передозировке могут возникнуть токсические и токсико-аллергические реакции, указанные в пункте «побочные действия» в более тяжелой форме. Рекомендуется симптоматическая терапия, прием жаропонижающих препаратов и НПВС, кортикостероидов парентерально.
Взаимодействие
Неизвестно вступает ли вакцина от коронавируса Спутник V во взаимодействие с другими препаратами.
Условия продажи
Пока лекарство нельзя приобрести в аптеке самостоятельно.
Условия хранения векторной вакцины Гам-КОВИД-Вак
Раствор для внутримышечного введения хранят в защищенном от света месте при температуре не более 18 °C. Не допустимо хранение размороженного препарата для флаконов по 0,5 мл.
Для флаконов по 3,0 мл — средство можно хранить более 2 часов при комнатной температуре. Держать вакцину дальше от детей.
Срок годности
Срок хранения составляет пол года для всех лек. форм и обоих компонентов средства.
Особые указания
Пациенты, получающие иммуносупрессивную терапию или больные иммунодефицитом могут не получить достаточного иммунного ответа. Поэтому применение средств, угнетающих работу иммунной системы противопоказано за 30 дней до и 30 дней после вакцинации. Пренебрежение правилом может привести к снижению иммуногенности.
Неизвестно, влияет ли инъекция препарата на способность управлять транспортом и опасными механизмами.
Узнать подробности о лекарстве можно на официальном сайте института Гамалеи.
Аналоги
Совпадения по коду АТХ 4-го уровня:
В октябре 2020 года в РФ прошла регистрацию вторая вакцина под названием ЭпиВакКорона. Лекарство было разработано в новосибирском научном центре «Вектор» и представляет собой искусственно синтезированные короткие фрагменты вирусных пептидов, «обучающие» иммунную систему бороться с вирусом. Сейчас препарат также проходит третий этап клинических испытаний.
Также, в феврале 2021 года прошла регистрацию третья вакцина КовиВак исследовательского центра им. Чумакова, в ее состав включен цельный инактивированный вирус.
На данный момент сложно предугадать, какая из вакцин окажется наиболее эффективной.
Детям
Вакцина от ковида Спутник Ви не применяется в возрасте до 18 лет.
При беременности и лактации
Делать прививки нельзя беременным женщинам и во время грудного вскармливания.
Вакцина Спутник V, отзывы
Известно, что в Российской Федерации разработкой лекарства от новой коронавирусной инфекции занялся институт Гамалеи. Вакцина от коронавируса получила уже широко известное название «Спутник V». Перед тем, как проводить иммунизацию массово, лекарству необходимо пройти стадию клинических испытаний. И на данный момент средство проходит этот этап пострегистрационного исследования в Москве. Сделать прививку в тестовом режиме планируется 40 тысячам человек, четверть из них получат плацебо. Параллельно уже началась иммунизация мед. работников и врачей.
Сейчас среди скептически настроенного населения идут горячие споры об эффективности вакцины Спутник V, учитывая тот факт, что некоторые добровольцы, которым делали уколы Гам-КОВИД-Вак, заразились уже на следующий день после прививки. В общем известно около 20 подобных случаев. Это объясняется тем, что большинство заболевавших не успели получить второй укол и иммунитет у них выработаться тоже не успел. Ведь, как известно, устойчивость у вирусу развивается только на 42 день после проведения полного цикла вакцинации. Именно так объяснил данные инциденты директор Института трансляционной медицины и биотехнологии Сеченовского университета Минздрава РФ Вадим Тарасов, который подчеркивает высокую эффектность Спутник V.
Отзывы врачей о препарате в большинстве своем положительные. При этом медики подчеркивают, что вакцина не призвана защитить от болезни на все 100%, она также должна предотвратить развитие тяжелой формы заболевания и летальный исход. Допускается, что после применения лекарства болезнь будет просто протекать в легкой форме и без осложнений.
Интерес также вызывают отзывы привитых добровольцев, которые приняли участие в третьей фазе клинических испытаний. Рандомизированное двойное слепое плацебо-контролируемое клиническое исследование началось 26 августа 2020 года.
Некоторые интересуются, как правильно называть препарат, Спутник Ви или Спутник 5? Правильный ответ — Спутник Ви.
Отзывы добровольцев:
- «… Решила попробовать эту вакцину на себе. На второй день после первой инъекции начала болеть рука, а к вечеру третьего дня поднялась температура 37,5. На пятый день температура спала. После второго укола температура была выше, до 38 Градусов и ощущала я себя, как при гриппе. Через три дня все вроде прошло. Потом сдавала кровь на антитела, уровень IgG составил 11,3, непонятно почему так мало».
- «… Записался на вакцинацию как только узнал, что так можно. Во время прививки покалывало руку, а так не заметил каких-либо побочных реакций. Чувствую себя хорошо пока, вторая прививка тоже прошла нормально. Буду ждать теста на антитела«.
- «… После вакцинации ощущаю себя так, будто переболела гриппом, была высокая температура, головные боли и ломило суставы. Еще болел левый бок. Сбивала температуру 2 недели. К сожалению после болезни антител у меня нет, что странно«.
После прохождения последнего этапа планируется наладить массовое производство вакцины Спутник V и провести иммунизацию достаточного количества населения страны, чтобы сформировать коллективный иммунитет.
Вакцина Спутник V, цена, где купить вакцину Спутник V в Москве
На данный момент указать даже примерную стоимость Спутник Ви сложно. Есть сообщения о том, что предельная стоимость препарата составит не более 1942 рублей за оба компонента. Однако, пока Гам-КОВИД-Вак не появилась в свободной продаже, говорить о точной цене рано.
Активная вакцинация по всей России набирает обороты. Несмотря на то, что вопрос о прививках является добровольным, во многих регионах страны без сертификата вакцинации от коронавируса не пускают в общепиты и места отдыха. В связи с этим все больше россиян интересуются, какие отечественные вакцины есть, в чем их разница, и чем лучше привиться.
Гам-Ковид-Вак и Спутник V — одно и то же или нет
В августе 2020 году в Российской Федерации регистрацию прошёл препарат «Спутник V» созданный Центром имени Гамалеи. Позже в Сетях начало фигурировать название «Гам-Ковид-Вак». Многие так и не могут понять, эти две прививки — одно и то же или нет.
В связи с многочисленными обращениями граждан, Минздрав разъясняет: «Гам-Ковид-Вак» и «Спутник V» — это одна и та же вакцина, у которой есть медицинское и коммерческое названия. Всем знакомая и понятная фраза «Спутник V» является торговым наименованием «Гам-Ковид-Вак».
Как работает данная вакцина
Вакцина «Гам-Ковид-Вак» или «Спутник V» представляет собой не размножающиеся в организме человека обезвреженные частицы аденовируса. Их генетическая основа была удалена, а вместо неё в частицу вируса введён ген с кодом особого белка («шипа» коронавируса). Данный белок абсолютно безвреден для человека. Он помогает иммунитету правильно реагировать на вирус и вырабатывать к нему иммуноглобулины (в народе «антитела»), которые в дальнейшем формируют иммунитет и защищают от инфекции. Для полной защиты пациенту необходимо сделать две прививки с аденовирусами разных типов с интервалом 21 день. Первый этап запускает иммунный ответ, а второй разгоняет и усиливает его.
ПЦР-тест и прививка
Часто россияне спрашивают — нужно ли делать анализ на антитела или ПЦР на наличие коронавируса перед вакцинированием? Специалисты отвечают, что не нужно.
При подготовке к вакцинации после ранее перенесенной коронавирусной инфекции (спустя 6 месяцев) или при повторной вакцинации против СOVID-19 проведение лабораторных исследований на наличие иммуноглобулинов классов G и М к вирусу SARS-СoV-2 не обязательно.
При наличии положительного эпидемиологического анамнеза у вакцинируемого (контакт с больными с инфекционными заболеваниями в течение последних 14 дней), а также при наличии какого-либо симптома заболевания в течение последних 14 дней необходимо проведение ПЦР.
Какие противопоказания есть
Прививки от коронавируса делать можно большей части граждан. Но есть и те, которым вакцинация противопоказана. Причем у 4 разных отечественных препаратов список противопоказаний может незначительно отличаться.
При вакцинации препаратом «Гам-Ковид-Вак» стоит знать, что прививка запрещена:
- при наличие аллергической реакции на один из компонентов вакцины, тяжелые аллергические реакции в анамнезе;
- беременность и период грудного вскармливания;
- прививка запрещена лицам возрастом до 18 лет;
- не стоит прививаться при острых инфекционных и неинфекционных заболеваниях;
- при обострении хронических заболеваний прививку можно делать через 2-4 недели после выздоровления или ремиссии;
- при нетяжелых ОРВИ, острых инфекционных заболеваниях желудочно-кишечного тракта вакцинацию разрешается проводить после нормализации температуры.
В случае тяжелых поствакцинальных осложнений (анафилактический шок, тяжелые генерализованные аллергические реакции, судорожный синдром, температура выше 40°C) вводить второй компонент «Спутника V» («Гам-Ковид-Вак») нельзя.
Читайте также: Пирамида «Финико» закрылась: остановлен вывод средств, вернут ли деньги людям? Последние новости
Источник ftimes.ru
Пишу о том, что мне интересно. Чтобы не пропустить что нибудь важное, рекомендую подписаться на 9111.ру
Гам-КОВИД-Вак Комбинированная векторная вакцина для профилактики коронавирусной инфекции, вызываемой вирусом SARS-CoV-2
Гам-КОВИД-Вак Комбинированная векторная вакцина для профилактики коронавирусной инфекции, вызываемой вирусом SARS-CoV-2 (Gam-COVID-Vac Combined vector vaccine for the prevention of coronavirus infection caused by the SARS-CoV-2 virus) инструкция по применению
📜 Инструкция по применению Гам-КОВИД-Вак Комбинированная векторная вакцина для профилактики коронавирусной инфекции, вызываемой вирусом SARS-CoV-2
💊 Состав препарата Гам-КОВИД-Вак Комбинированная векторная вакцина для профилактики коронавирусной инфекции, вызываемой вирусом SARS-CoV-2
✅ Применение препарата Гам-КОВИД-Вак Комбинированная векторная вакцина для профилактики коронавирусной инфекции, вызываемой вирусом SARS-CoV-2
📅 Условия хранения Гам-КОВИД-Вак Комбинированная векторная вакцина для профилактики коронавирусной инфекции, вызываемой вирусом SARS-CoV-2
⏳ Срок годности Гам-КОВИД-Вак Комбинированная векторная вакцина для профилактики коронавирусной инфекции, вызываемой вирусом SARS-CoV-2
Описание лекарственного препарата
Гам-КОВИД-Вак Комбинированная векторная вакцина для профилактики коронавирусной инфекции, вызываемой вирусом SARS-CoV-2
(Gam-COVID-Vac Combined vector vaccine for the prevention of coronavirus infection caused by the SARS-CoV-2 virus)
Основано на официально утвержденной инструкции по применению препарата и подготовлено для электронного издания справочника Видаль 2020 года, дата обновления: 2022.04.15
Владелец регистрационного удостоверения:
Код ATX:
J07BX03
(Вакцины против COVID-19)
Лекарственные формы
|
|
Гам-КОВИД-Вак Комбинированная векторная вакцина для профилактики коронавирусной инфекции, вызываемой вирусом SARS-CoV-2 |
Р-р д/в/м введения, компонент I — 0.5 мл/доза (замороженный препарат): фл. 1 шт. рег. №: ЛП-006395 |
|
Р-р д/в/м введения, компонент II — 0.5 мл/доза (замороженный препарат): амп. 5 шт. рег. №: ЛП-006395 |
||
|
Р-р д/в/м введения, компонент II — 0.5 мл/доза (замороженный препарат): фл. 1 шт. рег. №: ЛП-006395 |
||
|
Р-р д/в/м введения, компонент I — 0.5 мл/доза (замороженный препарат): амп. 5 или 10 шт. рег. №: ЛП-006395 |
||
|
Р-р д/в/м введения, компонент II — 0.5 мл/доза (замороженный препарат): амп. 5 или 10 шт. рег. №: ЛП-006395 |
||
|
Р-р д/в/м введения, компонент I — 0.5 мл/1 доза (жидкий препарат): амп. 5 или 10 шт. рег. №: ЛП-006395 |
||
|
Р-р д/в/м введения, компонент II — 0.5 мл/1 доза (жидкий препарат): амп. 5 или 10 шт. рег. №: ЛП-006395 |
||
|
Р-р д/в/м введения, компонент I — 0.5 мл/доза (замороженный препарат): амп. 5 шт. рег. №: ЛП-006395 |
||
|
Р-р д/в/м введения, компонент II — 1.0 мл/2 дозы (замороженный препарат): амп. 5 или 10 шт. рег. №: ЛП-006395 |
||
|
Р-р д/в/м введения, компонент I — 1.0 мл/2 дозы (замороженный препарат): амп. 5 или 10 шт. рег. №: ЛП-006395 |
||
|
Р-р д/в/м введения, компонент II — 3.0 мл/5 доз (замороженный препарат): фл. 1 шт. рег. №: ЛП-006395 |
||
|
Р-р д/в/м введения, компонент I — 3.0 мл/5 доз (замороженный препарат): фл. 1 шт. рег. №: ЛП-006395 |
||
|
Р-р д/в/м введения, компонент I — 3.0 мл/5 доз (замороженный препарат): фл. 1 или 10 шт. рег. №: ЛП-006395 |
||
|
Р-р д/в/м введения, компонент II — 3.0 мл/5 доз (замороженный препарат): фл. 1 или 10 шт. рег. №: ЛП-006395 |
||
|
Р-р д/в/м введения, компонент I — 3.0 мл/5 доз (жидкий препарат): фл. 1 шт. рег. №: ЛП-006395 |
||
|
Р-р д/в/м введения, компонент II — 3.0 мл/5 доз (жидкий препарат): фл. 1 шт. рег. №: ЛП-006395 |
Раствор для в/м введения (компонент I* и компонент II).
Замороженный препарат
Компонент I*. Раствор замороженный — плотная затвердевшая беловатого цвета масса. После размораживания: однородный бесцветный или с желтоватым оттенком слегка опалесцирующий раствор.
| 1 доза (0.5 мл) | |
| рекомбинантные аденовирусные частицы 26 серотипа, содержащие ген белка S вируса SARS-CoV-2 | (1.0±0.5)×1011 частиц |
Вспомогательные вещества: трис(гидроксиметил)аминометан — 1.21 мг, натрия хлорид — 2.19 мг, сахароза — 25.0 мг, полисорбат 80 — 250.0 мкг, магния хлорида гексагидрат — 102.0 мкг, ЭДТА динатриевая соль дигидрат — 19.0 мкг, этанол 95% — 2.5 мкл, вода д/и — до 0.5 мл.
* Идентичен составу лекарственного препарата «Спутник Лайт Векторная вакцина для профилактики коронавирусной инфекции, вызываемой вирусом SARS-CoV-2» (номер регистрационного удостоверения ЛП-006993).
0.5 мл (1 доза компонента I) — флаконы (1) — пачки картонные.
0.5 мл (1 доза компонента I) — флаконы (5) — упаковки ячейковые контурные (1) — пачки картонные.
0.5 мл (1 доза компонента I) — флаконы (5) — упаковки ячейковые контурные (2) — пачки картонные.
0.5 мл (1 доза компонента I) — флаконы (типа 2R) (1, 2, 5, 10) — пачки картонные.
3.0 мл (5 доз компонента I) — флаконы (типа 10R) (1) — пачки картонные.
3.0 мл (5 доз компонента I) — флаконы (типа 10R) (10) — пачки картонные.
0.5 мл (1 доза компонента I) — флаконы (типа 2R) (1) — упаковки ячейковые контурные (1) — пачки картонные×.
3.0 мл (5 доз компонента I) — флаконы (типа 6R) (1) — пачки картонные×.
3.0 мл (5 доз компонента I) — флаконы (1) — пачки картонные с держателем.
0.5 мл (1 доза компонента I) — ампулы бесцветного стекла с цветной точкой (5) — упаковки ячейковые контурные (1) — пачки картонные.
0.5 мл (1 доза компонента I) — ампулы бесцветного стекла с цветной точкой (5) — упаковки ячейковые контурные (2) — пачки картонные.
0.5 мл (1 доза компонента I) — ампулы бесцветного стекла (5) — упаковки ячейковые контурные (1) — пачки картонные.
0.5 мл (1 доза компонента I) — ампулы бесцветного стекла (5) — упаковки ячейковые контурные (2) — пачки картонные.
1.0 мл (2 дозы компонента I) — ампулы бесцветного стекла (5) — упаковки ячейковые контурные (1) — пачки картонные.
1.0 мл (2 дозы компонента I) — ампулы бесцветного стекла (5) — упаковки ячейковые контурные (2) — пачки картонные.
Компонент II. Раствор замороженный — плотная затвердевшая беловатого цвета масса. После размораживания: однородный бесцветный или с желтоватым оттенком слегка опалесцирующий раствор.
| 1 доза (0.5 мл) | |
| рекомбинантные аденовирусные частицы 5 серотипа, содержащие ген белка S вируса SARS-CoV-2 | (1.0±0.5)×1011 частиц |
Вспомогательные вещества: трис(гидроксиметил)аминометан — 1.21 мг, натрия хлорид — 2.19 мг, сахароза — 25.0 мг, полисорбат 80 — 250.0 мкг, магния хлорида гексагидрат — 102.0 мкг, ЭДТА динатриевая соль дигидрат — 19.0 мкг, этанол 95% — 2.5 мкл, вода д/и — до 0.5 мл.
0.5 мл (1 доза компонента II) — флаконы (1) — пачки картонные.
0.5 мл (1 доза компонента II) — флаконы (5) — упаковки ячейковые контурные (1) — пачки картонные.
0.5 мл (1 доза компонента II) — флаконы (5) — упаковки ячейковые контурные (2) — пачки картонные.
3.0 мл (5 доз компонента II) — флаконы (типа 10R) (1) — пачки картонные.
3.0 мл (5 доз компонента II) — флаконы (типа 10R) (10) — пачки картонные.
0.5 мл (1 доза компонента II) — флаконы (типа 2R) (1) — упаковки ячейковые контурные (1) — пачки картонные×.
3.0 мл (5 доз компонента II) — флаконы (типа 6R) (1) — пачки картонные×.
3.0 мл (5 доз компонента II) — флаконы (1) — пачки картонные с держателем.
0.5 мл (1 доза компонента II) — ампулы бесцветного стекла с цветной точкой (5) — упаковки ячейковые контурные (1) — пачки картонные.
0.5 мл (1 доза компонента II) — ампулы бесцветного стекла с цветной точкой (5) — упаковки ячейковые контурные (2) — пачки картонные.
0.5 мл (1 доза компонента II) — ампулы бесцветного стекла (5) — упаковки ячейковые контурные (1) — пачки картонные.
0.5 мл (1 доза компонента II) — ампулы бесцветного стекла (5) — упаковки ячейковые контурные (2) — пачки картонные.
1.0 мл (2 дозы компонента II) — ампулы бесцветного стекла (5) — упаковки ячейковые контурные (1) — пачки картонные.
1.0 мл (2 дозы компонента II) — ампулы бесцветного стекла (5) — упаковки ячейковые контурные (2) — пачки картонные.
Жидкий препарат
Компонент I*. Однородный бесцветный или с желтоватым оттенком слегка опалесцирующий раствор.
| 1 доза (0.5 мл) | |
| рекомбинантные аденовирусные частицы 26 серотипа, содержащие ген белка S вируса SARS-CoV-2 | (1.0±0.5)×1011 частиц |
Вспомогательные вещества: трис(гидроксиметил)аминометан — 1.21 мг, натрия хлорид — 2.19 мг, сахароза — 25.0 мг, полисорбат 80 — 250.0 мкг, магния хлорида гексагидрат — 102.0 мкг, ЭДТА динатриевая соль дигидрат — 19.0 мкг, этанол 95% — 2.5 мкл, вода д/и — до 0.5 мл.
* Идентичен составу лекарственного препарата «Спутник Лайт Векторная вакцина для профилактики коронавирусной инфекции, вызываемой вирусом SARS-CoV-2» (номер регистрационного удостоверения ЛП-006993).
3.0 мл (5 доз компонента I) — флаконы (1) — пачки картонные с держателем.
3.0 мл (5 доз компонента I) — флаконы (1) — упаковки ячейковые контурные (1) — пачки картонные.
0.5 мл (1 доза компонента I) — ампулы бесцветного стекла (5) — упаковки ячейковые контурные (1) — пачки картонные.
0.5 мл (1 доза компонента I) — ампулы бесцветного стекла (5) — упаковки ячейковые контурные (2) — пачки картонные.
1.0 мл (2 дозы компонента I) — ампулы бесцветного стекла (5) — упаковки ячейковые контурные (1) — пачки картонные.
1.0 мл (2 дозы компонента I) — ампулы бесцветного стекла (5) — упаковки ячейковые контурные (2) — пачки картонные.
0.5 мл (1 доза компонента I) — флаконы (типа 2R) (1) — упаковки ячейковые контурные (1) — пачки картонные×.
3.0 мл (5 доз компонента I) — флаконы (типа 6R) (1) — пачки картонные×.
Компонент II. Однородный бесцветный или с желтоватым оттенком слегка опалесцирующий раствор.
| 1 доза (0.5 мл) | |
| рекомбинантные аденовирусные частицы 5 серотипа, содержащие ген белка S вируса SARS-CoV-2 | (1.0±0.5)×1011 частиц |
Вспомогательные вещества: трис(гидроксиметил)аминометан — 1.21 мг, натрия хлорид — 2.19 мг, сахароза — 25.0 мг, полисорбат 80 — 250.0 мкг, магния хлорида гексагидрат — 102.0 мкг, ЭДТА динатриевая соль дигидрат — 19.0 мкг, этанол 95% — 2.5 мкл, вода д/и — до 0.5 мл.
3.0 мл (5 доз компонента II) — флаконы (1) — пачки картонные с держателем.
3.0 мл (5 доз компонента II) — флаконы (1) — упаковки ячейковые контурные (1) — пачки картонные.
0.5 мл (1 доза компонента II) — ампулы бесцветного стекла (5) — упаковки ячейковые контурные (1) — пачки картонные.
0.5 мл (1 доза компонента II) — ампулы бесцветного стекла (5) — упаковки ячейковые контурные (2) — пачки картонные.
1.0 мл (2 дозы компонента II) — ампулы бесцветного стекла (5) — упаковки ячейковые контурные (1) — пачки картонные.
1.0 мл (2 дозы компонента II) — ампулы бесцветного стекла (5) — упаковки ячейковые контурные (2) — пачки картонные.
0.5 мл (1 доза компонента II) — флаконы (типа 2R) (1) — упаковки ячейковые контурные (1) — пачки картонные×.
3.0 мл (5 доз компонента II) — флаконы (типа 6R) (1) — пачки картонные×.
× На флаконы каждого компонента препарата наклеивают этикетку самоклеящуюся.
Фармакологическое действие
▼ Данный лекарственный препарат зарегистрирован по процедуре регистрации препаратов, предназначенных для применения в условиях угрозы возникновения, возникновения и ликвидации чрезвычайных ситуаций. Инструкция подготовлена на основании ограниченного объема клинических данных по применению препарата и будет дополняться по мере поступления новых данных. Применение препарата возможно только в условиях медицинских организаций, имеющих право осуществлять вакцинопрофилактику населения в установленном порядке.
Характеристика. Вакцина получена биотехнологическим путем, при котором не используется патогенный для человека вирус SARS-CoV-2. Препарат состоит из двух компонентов: компонент I и компонент II.
В состав компонента I входит рекомбинантный аденовирусный вектор на основе аденовируса человека 26 серотипа, несущий ген белка S вируса SARS-CoV-2, что соответствует составу лекарственного препарата «Спутник Лайт Векторная вакцина для профилактики коронавирусной инфекции, вызываемой вирусом SARS-CoV-2» (номер регистрационного удостоверения ЛП-006993).
В состав компонента II входит рекомбинантный аденовирусный вектор на основе аденовируса человека 5 серотипа, несущий ген белка S вируса SARS-CoV-2.
Вакцина индуцирует формирование гуморального и клеточного иммунитета в отношении коронавирусной инфекции, вызываемой вирусом SARS-CoV-2.
Иммунологическая эффективность
Иммунологические свойства и безопасность вакцины изучали в различных клинических исследованиях у взрослых добровольцев обоего пола в возрасте старше 18 лет.
Анализ иммуногенности показал, что вакцина формирует иммунный ответ у добровольцев: средний геометрический титр у добровольцев, иммунизированных Гам-КОВИД-Вак, на 42 день составил 9009.0, а на 180 день — 1708.0.
В группе Плацебо средний геометрический титр на 42 день составил 55.6, а на 180 день — 110.2. Сероконверсия к 42 дню наблюдается у 99.1% вакцинированных добровольцев и сохраняется к 180 дню у 93.9%.
У добровольцев на 42 сутки после вакцинации отмечается достоверное увеличение вируснейтрализующих антител в сыворотке крови, который сохраняется и на 180 день.
Иммунизация препаратом Гам-КОВИД-Вак формирует напряженный антиген-специфический клеточный противоинфекционный иммунитет практически у всех обследованных добровольцев (формирование антиген-специфичных клеток обеих популяций Т-лимфоцитов: Т-хелперных (CD4+) и Т-цитотоксических (CD8+) и достоверное повышение секреции ИФНγ).
Защитный титр антител в настоящее время неизвестен. Продолжительность защиты неизвестна.
По данным III фазы рандомизированного плацебо контролируемого клинического исследования эффективность вакцины составляет более 91% для дикого штамма (Ухань) и по результатам полученным через полгода в условиях доминирования штамма дельта — 70.5% от симптомов коронавирусной инфекции. Таким образом, иммунизация достоверно снижает вероятность заболевания. В отношении среднетяжелых, тяжелых и очень тяжелых случаев эффективность составляет более 88% в течении полугодового периода наблюдения
По результатам опубликованных данных применения вакцины за рубежом, в рамках клинической практики в Венгрии на ноябрь 2021 у 820560 вакцинированных, показана 85.7% эффективность векторной вакцины Спутник-V. Эффективность против смерти, связанной с COVID-19, варьировала от 95.4% до 100% в разных возрастных когортах, демонстрируя очень высокую и стойкую эффективность как в старшей, так и в младшей возрастных когортах.
У лиц с предсуществующим иммунитетом к коронавирусу отмечен выраженный рост титра антител на 10-й день (препаратом Спутник Лайт, соответствующего компоненту I препарата Гам-КОВИД-Вак), что может указывать на возможность применения препарата для вакцинации ранее переболевших COVID-19 после снижения титра антител с целью предотвращения повторных случаев заболевания. С учетом рекомендаций ВОЗ для достижения уровня коллективного иммунитета населения, следует проводить вакцинацию против новой коронавирусной инфекции COVID-19 по эпидемическим показаниям спустя 6 месяцев после перенесенного заболевания (в т.ч. у ранее вакцинированных лиц) или спустя 6 месяцев после предыдущей первичной вакцинации.
Показания препарата
Гам-КОВИД-Вак Комбинированная векторная вакцина для профилактики коронавирусной инфекции, вызываемой вирусом SARS-CoV-2
Профилактика новой коронавирусной инфекции (COVID-19) у взрослых старше 18 лет.
Режим дозирования
Вакцина предназначена только для внутримышечного введения. Строго запрещено внутривенное введение препарата. Вакцину вводят в дельтовидную мышцу (верхнюю треть наружной поверхности плеча). При невозможности введения в дельтовидную мышцу — препарат вводят в латеральную широкую мышцу бедра.
Вакцинацию проводят в два этапа: вначале компонентом I дозе 0.5 мл, затем, через 3 недели — компонентом II в дозе 0.5 мл.
Допускается, при необходимости, однократная вакцинация компонентом I в дозе 0.5 мл.
После введения вакцины пациент должен находиться под наблюдением медицинских работников в течение 30 минут.
Применение вакцины производства ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» Минздрава России (филиал «Медгамал» ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» Минздрава России) (флаконов) и АО «Биннофарм» (ампул) и АО «Р-Фарм» (флаконов)
Перед вакцинированием флакон или ампулу с компонентом I или II достают из морозильной камеры и выдерживают при комнатной температуре до полного размораживания. Остаток включений льда не допускается! Протирают флакон или ампулу снаружи салфеткой спиртовой для удаления влаги. Осторожно перемешивают содержимое покачиванием. Не допускается встряхивание флакона или ампулы!
Снимают защитную пластиковую накладку с флакона и обрабатывают резиновую пробку салфеткой спиртовой.
Вскрывают ампулу по цветной точке.
Используя одноразовый шприц с иглой, отбирают дозу 0.5 мл для введения пациенту.
Не допускается хранение размороженного препарата!
Повторное замораживание не допускается!
Применение вакцины производства АО «ГЕНЕРИУМ» (флаконы), ОАО «Фармстандарт- УфаВИТА» (флаконы, ампулы) и ЗАО «ЛЕККО» (флаконы)
Замороженный препарат
Внимание! Повторное замораживание флакона или ампулы с раствором не допускается! Суммарное время хранения размороженного раствора при комнатной температуре не должно превышать 2 часов. Неиспользованная вакцина подлежит уничтожению.
Перед вакцинированием флакон или ампулу с компонентом I или II достают из морозильной камеры и выдерживают при комнатной температуре до полного размораживания. Остаток включений льда не допускается! Протирают флакон или ампулу снаружи салфеткой спиртовой для удаления влаги. Осторожно перемешивают содержимое покачиванием. Не допускается встряхивание флакона или ампулы!
Снимают защитную пластиковую накладку с флакона и обрабатывают резиновую пробку салфеткой спиртовой. Ампулу вскрывают по кольцу и/или точке излома.
Используя одноразовый шприц с иглой, отбирают дозу 0.5 мл для введения пациенту. Для каждой инъекции необходимо использовать отдельный одноразовый стерильный шприц с иглой.
Внимание! Доза, вводимая пациенту, не должна превышать 0.5 мл!
Многодозовые флаконы
Если последующие инъекции по какой-либо причине откладываются, допускается хранение вскрытого или невскрытого флакона при комнатной температуре не более 2 часов.
Многодозовые ампулы
Содержимое ампулы рекомендуется использовать незамедлительно. Если последующие инъекции по какой-либо причине откладываются, допускается хранение вакцины при комнатной температуре: вскрытой ампулы, закрытой стерильной салфеткой, не более 1 часа; невскрытой ампулы — не более 2 часов.
ВНИМАНИЕ! Одна ампула содержит две дозы вакцины. Объем одной дозы составляет 0.5 мл. Одному пациенту вводить 1 дозу (0.5 мл).
Однодозовые ампулы
Содержимое ампулы рекомендуется использовать незамедлительно. Если последующие инъекции по какой-либо причине откладываются, допускается хранение невскрытой ампулы при комнатной температуре не более 2 часов
Жидкий препарат
Внимание! Замораживание флакона или ампулы с раствором не допускается! Неиспользованная вакцина подлежит уничтожению.
Перед вакцинированием флакон или ампулу с компонентом I или II достают из холодильника и выдерживают при комнатной температуре, допускается слегка нагреть препарат, например, подержав его в руках. Не следует нагревать препарат выше 37°С.
Снимают защитную пластиковую накладку с флакона и обрабатывают резиновую пробку салфеткой спиртовой.
Ампулу вскрывают по кольцу и/или точке излома.
Используя одноразовый шприц с иглой, отбирают дозу 0.5 мл для введения пациенту. Для каждой инъекции необходимо использовать отдельный одноразовый стерильный шприц с иглой.
Внимание! Доза, вводимая пациенту, не должна превышать 0.5 мл!
Многодозовые флаконы
Если последующие инъекции по какой- либо причине откладываются, допускается хранение вскрытого или невскрытого флакона при комнатной температуре не более 2 часов.
Однодозовые ампулы
Содержимое одной ампулы рекомендуется использовать незамедлительно. Если последующие инъекции по какой-либо причине откладываются, допускается хранение невскрытой ампулы при комнатной температуре не более 2 часов
Применение вакцины производства ЗАО «БИОКАД» (флаконов)
Перед вакцинированием флакон с компонентом I или II достают из морозильной камеры и выдерживают при комнатной температуре до полного размораживания. Остаток включений льда не допускается! Протирают флакон снаружи салфеткой спиртовой для удаления влаги. Осторожно перемешивают содержимое покачиванием. Не допускается встряхивание флакона!
Снимают защитную пластиковую накладку с флакона и обрабатывают резиновую пробку салфеткой спиртовой.
Используя одноразовый шприц с иглой, отбирают дозу 0.5 мл для введения пациенту.
Если последующие инъекции по какой-либо причине откладываются, допускается хранение вскрытого флакона по 3 мл не более 2 часов при комнатной температуре.
Не допускается хранение размороженного препарата во флаконах по 0.5 мл!
Повторное замораживание не допускается!
Внимание! К использованию непригоден препарат (жидкий и/или замороженный) с дефектами укупорочной системы и/или нарушенной маркировкой флакона или ампулы, при изменении физических свойств раствора (мутность, окрашивание), неправильном хранении и/или с истекшим сроком годности.
Применение вакцины производства АО «Р- Фарм». компонент I (флаконы) и ООО СПУТНИК ТЕХНОПОЛИС», компонент II (флаконы)
Внимание! К использованию непригоден препарат с дефектами укупорочной системы и/или нарушенной маркировкой флакона, при изменении физических свойств раствора (мутность, окрашивание), неправильном хранении и/или с истекшим сроком годности.
Многодозовые флаконы. Перед вакцинированием флакон с компонентом I или II достают из морозильной камеры и выдерживают при комнатной температуре до полного размораживания. Остаток включений льда не допускается! Протирают флакон снаружи салфеткой спиртовой для удаления влаги. Осторожно перемешивают содержимое покачиванием. Не допускается встряхивание флакона!
Снимают защитную пластиковую накладку с флакона и обрабатывают резиновую пробку салфеткой спиртовой. Используя одноразовый шприц с иглой, отбирают дозу 0.5 мл для введения пациенту.
Для каждой инъекции необходимо использовать отдельный одноразовый стерильный шприц с иглой.
Внимание! Доза, вводимая пациенту, не должна превышать 0. 5 мл!
Если последующие инъекции по какой- либо причине откладываются, допускается хранение вскрытого или невскрытого размороженного флакона при комнатной температуре не более 2 часов
Повторное замораживание не допускается!
Неиспользованная вакцина подлежит уничтожению.
▼ Информация для медицинских работников, выполняющих вакцинацию лекарственным препаратом: данный лекарственный препарат зарегистрирован по особой процедуре регистрации, в связи с чем необходимо уведомлять Федеральную службу по надзору в сфере здравоохранения о каждом факте применения лекарственного препарата, путем внесения информации в соответствующий раздел информационной системы ЕГИСЗ.
Побочное действие
Нежелательные явления, характерные для применения вакцины, выявленные в рамках клинических исследований, бывают преимущественно легкой или средней степени выраженности, могут развиваться в первые-вторые сутки после вакцинации и разрешаются в течение 3-х последующих дней.
Частота встречаемости определяется следующим образом: часто (>1/100, <1/10), нечасто (>1/1000, <1/100), редко (>1/10000, <1/1000), очень редко (>1/10000, включая единичные случаи.
Категории частоты были сформированы на основании клинических исследований препарата. Рекомендуется назначение нестероидных противовоспалительных средств (НПВС) при повышении температуры после вакцинации и антигистаминных средств при выраженной местной реакции.
В рамках проведенных клинических исследований и в рамках фармаконадзора были зарегистрированы следующие нежелательные реакции.
Общие нарушения и реакции в месте введения: часто — гипертермия, боль, отек, зуд в месте вакцинации, озноб, астения; нечасто — пирексия, снижение аппетита.
Желудочно-кишечные нарушения: очень редко — тошнота, рвота, диспепсия.
Со стороны дыхательной системы, органов грудной клетки и средостения: очень редко — заложенность носа, першение в горле, ринорея.
Со стороны кожи и подкожной клетчатки: очень редко — ангиоотек, крапивница и сыпь (эритематозная, папулезная).
Со стороны мышечной, скелетной и соединительной ткани: часто — миалгия, артралгия, скелетно-мышечная боль; нечасто — остеоартрит.
Со стороны иммунной системы: очень редко — анафилактический шок, анафилактическая реакция и гиперчувствительность.
Со стороны крови и лимфатической системы: очень редко — увеличение регионарных лимфоузлов.
Со стороны нервной системы: очень редко — головная боль; головокружения, обмороки; сообщается о единичных случаях воспалительной полиневропатии (причинно-следственная связь с лекарственным препаратом не установлена — частота данных событий в популяции имеет сезонный характер и может быть связана с различными причинами: провоцирующими факторами могут быть инфекционные заболевания вирусной и бактериальной этиологии, хирургические вмешательства, травматическое повреждение периферических нервов, любая вакцинация, аутоиммунные и системные заболевания).
Со стороны органа зрения: нечасто — фотофобия.
Лабораторные и инструментальные данные: разнонаправленные отклонения показателей иммунологического статуса — повышение числа Т-лимфоцитов, увеличение процентного содержания лимфоцитов, снижение числа естественных клеток-киллеров, увеличение количества CD4-лимфоцитов, снижение количества CD4-лимфоцитов, повышение числа B- лимфоцитов, снижение числа B-лимфоцитов, повышение числа естественных клеток-киллеров, повышение количества CD8-лимфоцитов, повышение уровня иммуноглобулина E (IgE) в крови, увеличение соотношения CD4/CD8, уменьшение соотношения CD4/CD8, повышение уровня иммуноглобулина A(IgA) в крови, уменьшение процентного содержания лимфоцитов CD8. Отклонения в общем анализе крови — увеличение процентного содержания лимфоцитов, снижение показателя гематокрита, увеличение числа лимфоцитов, повышение СОЭ, повышение числа лейкоцитов, повышение числа моноцитов, повышение числа тромбоцитов, снижение числа нейтрофилов, снижение числа тромбоцитов. Отклонение показателей биохимического анализа крови — повышение уровня печеночных трансаминаз, креатинина и креатинфосфокиназы в сыворотке крови. Отклонения в общем анализе мочи — эритроциты в моче. Большинство нежелательных явлений (НЯ) завершились выздоровлением без последствий. Лабораторные отклонения не имели клинического значения (не нуждались в проведении дополнительных диагностических процедур и назначении терапии).
Противопоказания к применению
- гиперчувствительность к какому-либо компоненту вакцины или вакцины, содержащей аналогичные компоненты;
- тяжелые аллергические реакции в анамнезе;
- острые инфекционные и неинфекционные заболевания, обострение хронических заболеваний — вакцинацию проводят через 2-4 недели после выздоровления или ремиссии. При нетяжелых ОРВИ, острых инфекционных заболеваниях ЖКТ- вакцинацию проводят после нормализации температуры;
- беременность;
- период грудного вскармливания;
- возраст до 18 лет (в связи с отсутствием данных об эффективности и безопасности).
Противопоказания для введения компонента II:
- тяжелые поствакцинальные осложнения (анафилактический шок, тяжелые генерализованные аллергические реакции, судорожный синдром, температура выше 40°С и т.д.) на введение компонента I вакцины.
С осторожностью
Применять вакцину с осторожностью при хронических заболеваниях печени и почек, эндокринных заболеваниях (выраженных нарушениях функции щитовидной железы и
сахарном диабете в стадии декомпенсации), тяжелых заболеваниях системы кроветворения, эпилепсии и других заболеваниях ЦНС, остром коронарном синдроме и остром нарушении мозгового кровообращения, миокардитах, эндокардитах, перикардитах.
Вследствие недостатка информации вакцинация может представлять риск для следующих групп пациентов:
- с аутоиммунными заболеваниями (стимуляция иммунной системы может привести к обострению заболевания, особенно следует с осторожностью относиться к пациентам с аутоиммунной патологией, имеющей тенденцию к развитию тяжелых и жизнеугрожающих состояний);
- со злокачественными новообразованиями.
Принятие решения о вакцинации должно основываться на оценке соотношения пользы и риска в каждой конкретной ситуации.
Категориям населения старше 60 лет, ранее не прошедшим иммунизацию от COVID-19, и не болевшим COVID-19, иммунокомпрометированным лицам независимо от возраста, для формирования иммунитета не рекомендовано применение одного компонента для иммунизации в связи со снижением функции иммунной системы, для формирования иммунного ответа показана полная вакцинация двухкомпонентной вакциной Гам-КОВИД-Вак.
Применение при беременности и кормлении грудью
По результатам исследований на животных, репродуктивная токсичность и тератогенность отсутствуют. Клинические исследования Гам-КОВИД-Вак при беременности не проводились. В связи с этим применять препарат Гам-КОВИД-Вак при беременности следует в тех случаях, когда ожидаемая польза для матери превышает потенциальный риск для плода с 22 недели беременности.
Клинические данные по применению препарата Гам-КОВИД-Вак у женщин, кормящих грудью, и младенцев отсутствуют. В настоящее время неизвестно, способны ли действующие вещества, входящие в состав вакцины, проникать в грудное молоко. Перед принятием решения о вакцинации кормящей женщины необходимо оценить риски и пользу данной вакцинации.
Применение при нарушениях функции печени
С осторожностью применять у пациентов с хроническими заболеваниями печени.
Применение при нарушениях функции почек
С осторожностью применять у пациентов с хроническими заболеваниями почек.
Применение у детей
Противопоказание: возраст до 18 лет (в связи с отсутствием данных об эффективности и безопасности.
Особые указания
У пациентов, получающих иммуносупрессивную терапию и пациентов с иммунодефицитом может не развиться достаточный иммунный ответ. Поэтому прием препаратов, угнетающих функцию иммунной системы, противопоказан в течение, как минимум, 1 месяца до и после вакцинации из-за риска снижения иммуногенности.
Подобно остальным вакцинам, защитный иммунный ответ может возникать не у всех вакцинируемых лиц.
При принятии врачом (медицинским работником) решения о необходимости одновременного введения Гам-КОВИД-Вак с другой вакциной, не допускается их смешивание в одном шприце и введение в один участок тела.
Влияние на способность к управлению транспортными средствами и механизмами
Исследования по изучению влияния вакцины на способность управлять транспортными средствами и потенциально опасными механизмами не проводились.
Передозировка
О случаях передозировки не сообщалось.
Учитывая, что отпуск лекарственного препарата допускается только для лечебно-профилактических учреждений, а сама вакцинация проводится только квалифицированным медицинским персоналом, риск передозировки крайне низок.
Однако можно предположить, что при случайной передозировке возможно развитие указанных выше токсических и токсико-аллергических реакций в более тяжелой степени.
Специфических антидотов к препарату не существует.
Терапевтические мероприятия в данном случае будут включать симптоматическую терапию в соответствии с показаниями (жаропонижающие/НПВС и десенсибилизирующие средства, кортикостероиды — парентерально при выраженном токсико-аллергическом синдроме). Режим назначения препаратов должен быть выбран согласно рекомендациям по применению и дозировкам данного лекарственного средства.
Лекарственное взаимодействие
Специальных исследований лекарственного взаимодействия не проводилось.
Взаимодействие с вакциной для профилактики гриппа изучено в доклинических исследованиях, показано отсутствие снижения иммуногенности как вакцины Гам-КОВИД-Вак (Комбинированная векторная вакцина для профилактики коронавирусной инфекции, вызываемой вирусом SARS-CoV-2), так и гриппозной вакцины в эксперименте при их одновременном введении. Ожидается отсутствие снижения иммуногенности для расщепленных, субъединичных и полимерсубъединичных гриппозных вакцин.
Не допускается смешивание вакцины Гам-КОВИД-Вак с другими вакцинами или иными лекарственными средствами в одном шприце, т.к. нет данных о фармацевтическом взаимодействии.
Условия хранения препарата Гам-КОВИД-Вак Комбинированная векторная вакцина для профилактики коронавирусной инфекции, вызываемой вирусом SARS-CoV-2
Замороженный препарат
Производственные площадки ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» Минздрава России (филиал «Медгамал» ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» Минздрава России), Россия, ЗАО «БИОКАД», Россия: Компонент I — 1 год. Компонент II — 1 год.
Производственные площадки АО «ГЕНЕРИУМ», Россия, ОАО «Фармстандарт-УфаВИТА», Россия: Компонент I — 9 месяцев. Компонент II — 9 месяцев.
Производственные площадки АО «Биннофарм», Россия, ЗАО «ЛЕККО», Россия: Компонент 1 — 6 месяцев. Компонент II — 6 месяцев.
Производственная площадка АО «Р-Фарм», Россия: Компонент 1-6 месяцев.
Производственная площадка ООО «СПУТНИК ТЕХНОПОЛИС», Россия: Компонент II — 6 месяцев.
Не применять по истечении срока годности.
Хранить в недоступном для детей месте.
Жидкий препарат
Производственные площадки АО «ГЕНЕРИУМ», Россия, ОАО «Фармстандарт-УфаВИТА», Россия: Компонент I — 6 месяцев. Компонент II — 6 месяцев.
Производственные площадки ЗАО «ЛЕККО», Россия, ЗАО «БИОКАД», Россия: Компонент I — 2 месяца. Компонент II — 2 месяца.
Не применять по истечении срока годности
Хранить в недоступном для детей месте.
Условия реализации
Для лечебно-профилактических учреждений.
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код
Правильное написание слова гамкать:
гамкать
Крутая NFT игра. Играй и зарабатывай!
Количество букв в слове: 7
Слово состоит из букв:
Г, А, М, К, А, Т, Ь
Правильный транслит слова: gamkat
Написание с не правильной раскладкой клавиатуры: ufvrfnm
Тест на правописание
Синонимы слова Гамкать
- Тявкать
- Лаять
|
Как пишется слово «заманчивый» через «е» или через «и»? Какое правило? Какая часть речи слово «заманчивый»? Как разобрать по составу слово «заманчивый»? Какой пример предложения со словом «заманчивый»? Чтобы быстро и правильно сориентироваться, в какой морфеме нужно проверить орфограмму, необходимо разобрать предложенное слово по составу. Думаю, понятно, что это имя прилагательное (заманчивый вид из окна). В составе этого прилагательного есть приставка «за-«, корень «ман-«, суффикс «-ч*в» и окончание «-ый». Орфограмма «гласная в суффиксе». Проверить её очень легко, потому что можно применить правило единообразного написания суффиксов: в суффиксе «-чив-« пишется всегда только буква и. И никак иначе нельзя писать этот суффикс. Кстати, этот суффикс в прилагательном имеет значение свойства постоянного. Таким образом, правильно пишем прилагательное — заманчивый, как и другие с таким же суффиксом, например, улыбчивый, застенчивый, забывчивый, придирчивый. Заманчивый образ нарисовало мое воображение. Заманчивая идея не давала мне покоя. Заманчивое предложение совершить восхождение на гору сделал мой друг. автор вопроса выбрал этот ответ лучшим sveta-leto 3 года назад Пример предложения: У него был заманч?вый бизнес. По правилам русского языка слово — заманч?вый — это прилагательное (какой? какая? какое? какие?) (что?) бизнес (какой?) заманч?вый, следовательно: бизнес — существительное, заманч?вый — прилагательное. Это слово правильно писать через «и», суффикс -чив- пишется всегда через «и», это надо запомнить, потому что в прилагательных с суффиксом -чив- буква «и» постоянная (она не проверяется и не меняется). Разбор слова по составу: за-ман-чив-ый (приставка-корень-суффикс-окончание). Прилагательные с суффиксом -чив- , которые для примера я напишу: Рядом ехал застенчИвый пассажир. Мой дедушка очень забывчИвый. Учитель по математике был придирчИвый. Мой парень всегда улыбчИвый. Rogneda 3 года назад Заманчивый или заманчевый пишется с буквой «и» или «е» можно понять, если выяснить морфемный состав слова. Прилагательное «заманчивый» образовано от однокоренного глагола с помощью суффикса: заманить — заманчивый. «Заманчивый» значит «привлекательный», «соблазнительный». Это прилагательное имеет следующий морфемный состав: за-ман-чив-вый — приставка/корень/суффикс/окончание. Поставив ударение, выясним, что гласный суффикса звучит неясно, отчего возникает сомнение в выборе буквы «и» или «е». Но суффикса -чев- нет в русском языке, а только -чив-, как и в составе слов: задумчивый взгляд; заносчивый вид; неусидчивый малыш. Слово «заманчивый» правильно пишется с буквой «и». Примеры Заманчивый вид открылся с балкона гостиницы. Менеджер сделал нам заманчивое предложение. Заманчивая реклама товара привлекла множество покупателей. Урания более года назад Слово «заманчивый» — это качественное прилагательное, отвечает на вопрос – какой? Чтобы правильно написать слово, нам потребуется разобрать его по морфемному составу. «Заман-» — корень, «-чив-» — суффикс; «-ый» — окончание. Основа слова — «зам«нчив-«. Убедившись, что корень слова «заман-», а не «заманч-», мы уверенно можем констатировать, что в слове имеется безударный суффикс «чив», который мы уже не перепутаем с суффиксом «-ив-». Ведь правописание суффиксов «-ев-» и «-и-в» зависит от ударения. А в прилага-тельных, образованных от глаголов, существует лишь безударный суффикс «-чив-» (нет такой морфемы — «-чев-»). Поэтому правильное написание слова – «заманчивый». Приведем пример предложения с этим прилагательным:
Чёрная Луна 3 года назад Слово «заманчивый» — это прилагательное мужского рода, единственного числа, которое отвечает на вопрос «какой?». В женском роде — «заманчивая» (какая?), в среднем роде — «заманчивое» (какое?), во множественном числе — «заманчивые» (какие?). Во всех случаях орфография определяется аналогично. Чтобы понять какую букву нужно писать «е» или «и», сделаем морфологический разбор слова «заманчивый», то есть разберем слово «заманчивый» по составу. За/ман/чив/ый — приставка/корень/суффикс/окончание мужского рода, основой слова будет «заманчив». Как мы видим, проблемная гласная находится в суффиксе -чив-. Поэтому правописание определить очень просто, пишем «и», поскольку суффикса -чев- не существует. Пример предложения со словом «заманчивый»: заманчивый аромат только что приготовленного кофе. Дублон 3 года назад Слово «заманчивый» прилагательным мужского рода и чтобы определить, как правильно пишется «заманчИвый» или «заманчЕвый», необходимо сделать морфемный разбор. За/ман/чив/ый, где имеются: приставка/корень/суффикс/окончание Стоит заметить, что в русском языке имеется суффикс «чив», а вот суффикса «чев» просто не бывает. Пишем правильно: заманЧИВый, также как и придирчивый, вспыльчивый, доверчивый, влюбчивый, вдумчивый… Этот заманчивый проект так и не покидал мои мысли еще целый год. Lucky Strike 2019 2 года назад Какая часть речи «заманчивый»? К нему подходит вопрос — какой? Это значит, что мы имеем дело с прилагательным. Чтобы понять, какую букву правильно писать — «е» или «и», нужно разобрать наше слово по составу. Оказывается, что та часть, к которой относится вопрос, будет суффиксом, а суффикса такого «-чев» в русском языке нет вообще. Следовательно, правильно — заманчивый: Антон 78 3 года назад Пишется заманчИвый — прилагательное. Так как суффикс -чив- а суффикса -чев- нет. За(привтавка) ман(корень) чив(суффикс) ый(окончание). Пример: Яхочу приобрести тот портфель, так как он заманчивый. Знаете ответ? |
Правильное написание слова – «гонишь»/«гонешь» – зависит от знания орфограммы No 25 и особенностей спряжения глаголов. Давайте вспомним правило и определим, как правильно пишется данное слово.
Как правильно пишется
Слово пишется с буквой «и» в окончании – гонишь.
Какое правило применяется
Неопределенная форма (инфинитив) указанного выше глагола – «гнать». Среди трех прочих слов-исключений из первого спряжения (держать, дышать, слышать) этот глагола имеет второй тип спряжения.
В нашем случае глагол имеет форму 2-го лица ед. числа: (ты) гонишь. Из правила – «Буквы «е» и «и» в окончаниях глаголов I и II спряжения» – известно, что у глаголов второго типа спряжения во 2 л. ед. числа пишется окончание «-ишь». Следовательно, интересующее нас слово тоже пишется с гласной «и» в окончании
– «гонишь».
Примеры предложений
- Куда ты теперь погонишь стадо коров?
- Сбавь скорость! Зачем так быстро гонишь?
Проверь себя: «По пьяни» или «по-пьяни» как пишется?
Как неправильно писать
Ошибка – писать в окончании глагола 2-го спряжения букву «е» – гонешь.
( 2 оценки, среднее 3 из 5 )
Некоторые местоименные прилагательные вызывают трудности при написании. Слово «многого» считается сложным именно из-за окончания, так как «многово» является распространенной орфографической ошибкой, которую допускают на регулярной основе.
Согласно морфологическому разбору местоименного прилагательного «многого», окончанием является -ого. Произносится данное слово через -В, но при этом пишется именно через -Г.
Правописание и теория русского языка
Перед гласными в окончаниях у прилагательных, местоимений и местоименных прилагательных в родительном падеже единственного числа пишется буква -Г, а произносится она как -В.
Правильно пишется
многого
Примеры:
— его, — доброго, — синего, — многого, — моего, — всего, — того, — западного, — сливового, — солнечного и так далее.
Все эти слова на письме в окончании имеют букву -Г, которая читается как -В. Слово «многого» не является исключением из данного правила, так как оно является местоименным прилагательным мужского рода родительного падежа.
Примеры в предложениях:
1. Вы мне многого не сказали.
2. Он был расстроен, так как хотел от руководителя многого.
3. Многого еще не было в этой истории.
4. В юном возрасте мне многого не хватало.
5. Многого не хватает в этой работе.
У данного правила нет исключений, поэтому слово «многого» абсолютно в любом контексте пишется с буквой -Г в окончании.
Дополнительно правописание слова «многого» можно проверить через правильное написание прилагательного, от которого оно образовано. Местоименное прилагательное образовано от прилагательного «многий», которое пишется через -Г. Поэтому «многого» тоже пишется с буквой -Г в окончании.
Post Views:
11 546
Безошибочное написание слова – «гонящий» или «гонющий» – зависит от знания и применения орфограммы № 50, в которой рассказывается о выборе гласных в суффиксах действительных причастий.
Как пишется правильно: «гонящий» или «гонющий»?
Безошибочный вариант написания – гонящий.
Какое правило применяется?
«Гонящий» – действительное причастие наст. вр., образованное от глагола несов. вида II спр. «гнать». Употребляется в значении – «тот, кто гонит кого(что)-либо».
Слово имеет славянские корни, образовано от древнерусского – «гънати» суффиксальным способом.
Написание буквы «я» в суффиксе обусловлено названной выше орфограммой. В ней сказано: если действ. причастие наст. вр. образовано от глагола, относящегося к II типу спряжения, то оно имеет суффиксы «-ащ-» или «-ящ-».
Причастие, которое нас интересует, образовалось от глагола II спр., следовательно, пишется с суффиксом «-ящ-» – гонящий.
Примеры предложений
Ветер, гонящий по небу серые облака, с каждой минутой усиливался.
Пастух, гонящий стадо, шел сзади и ежеминутно покрикивал на своих подопечных, а коровы, казалось, не обращали на него никакого внимания.
Как неправильно писать
Не следует писать следующим образом – гонющий.
Защищает ли «Спутник V» от штамма омикрон?
Штамм коронавируса омикрон быстро распространяется по планете. Он более заразен, чем другие варианты, в том числе и дельта. Поэтому многие люди интересуются, защищает ли «Спутник V» от омикрона.
Директор центра им. Гамалеи Александр Гинцбург заявил, что «Спутник V» против омикрона показывает достаточную эффективность (75%), а при ревакцинации «Спутником Лайт» эфективность увеличивается почти до 100%. Поэтому «Спутник V» не нужно модифицировать под новый штамм. Это объясняется тем, что в данном препарате структура S-белка динамичная и способна изгибаться в пространстве. Это способствует выработке в организме привитых людей широкого спектра нейтрализующих антител. Для полноценной защиты от омикрона» «Спутник V» применяют по обычной схеме — двукратная вакцинация с интервалом в 21 день, а затем введение бустерной дозы («Спутник Лайт») через 6 месяцев.
Тем временем иностранные мРНК-вакцины (Moderna, Pfizer/BioNTech) в настоящее время проходят модификацию под омикрон, так как их эффективность с приходом нового штамма значительно снизилась. В мРНК-вакцинах в молекуле S-белка пространственное расположение атомов фиксировано. И они достаточно эффективны против первоначального штамма коронавируса, который называют уханьским. Но при этом мРНК-вакцины хуже защищают от новых штаммов коронавируса.
Эффективность «Спутника V» против омикрона
Специалисты НИИЭМ им. Гамалеи совместно с сотрудниками Национального института инфекционных заболеваний им. Ладзаро Спалланцани (Италия) провели исследования эффективности «Спутника V» против штамма омикрон. Предварительные результаты опубликованы на платформе препринтов medRxiv⁸.
В ходе исследования выяснилось, что у людей, привитых «Спутником V», вырабатывается в два раза больше антител к омикрону, чем у тех, кто привился вакциной Pfizer. То есть «Спутника V» дает более сильный иммунный ответ на новый вариант коронавируса. А «Спутник Лайт» в качестве бустера (третья вакцина) значительно увеличивает вируснейтрализующую активность против штамма омикрон.
Описание вакцины Спутник V
Вакцину разработали сотрудники Национального исследовательского центра эпидемиологии и микробиологии им. Н. Ф. Гамалеи, и 11 августа 2020 года она прошла официальную регистрацию в Министерстве здравоохранения РФ.
У препарата два наименования:
- торговое — «Спутник V»;
- регистрационное — «Гам-Ковид-Вак».
Коммерческое название вакцина получила в честь первого советского космического спутника, запущенного в 1957 году — «Спутник-1». Буква V символизирует английское слово victory, которое переводится на русский язык как «победа». Таким «громким» названием создатели вакцины образно показали, что при разработке препарата использовали самые современные технологии, а его применение поможет победить коронавирусную инфекцию.
Первую и вторую фазы клинических испытаний «Гам-Ковид-Вак» завершили в августе 2020 года. В феврале 2021 года в авторитетном медицинском журнале The Lancet опубликовали итоги третьей фазы исследований препарата в России.
Производители вакцины
Сегодня производство «Спутника V» в России идет на 9 промышленных площадках — это гарантирует бесперебойные поставки препарата для населения РФ. Кроме того, российскую вакцину производят и во многих зарубежных странах:
- Казахстане;
- Республике Корея;
- Бразилии;
- Белоруссии;
- Аргентине;
- Индии;
- Сербии;
- Иране;
- Италии;
- Армении;
- Мексике;
- Вьетнаме;
- Узбекистане.
Производители вакцины в Бразилии не только покрывают потребности внутреннего рынка, но и направляют препарат в другие страны Латинской Америки.
Вне зависимости от того, где производят вакцину «Спутник V», упрепарата одинаковый состав и эффективность.
Применение
Люди старше 60 лет находятся в зоне риска, смертность среди них велика. Вакцину «Спутник V» успешно испытали на добровольцах. Поэтому Минздрав одобрил применение «Спутника V» для людей старше 60 лет.
В настоящее время проводятся исследования, направленные на изучение возможного тератогенного действия (нарушения эмбрионального развития) вакцины «Спутник V». Промежуточные результаты показывают, что препарат не оказывает на развитие плода негативного влияния. Поэтому применение вакцины «Спутник V» одобрено для беременных и кормящих женщин.
Прививаться ли беременным?
«Беременным женщинам прививаться нужно обязательно, так как для них ковид особенно опасен. Случаи гибели плода у больной матери не единичны, в то же время нет данных, говорящих о том, что «Спутник V» провоцирует выкидыши, скорее наоборот — вакцина защищает мать и дитя. Привитая кормящая мать через молоко передаст антитела младенцу и тем защитит его от коронавируса тоже».



Отличия «Спутника V» от других векторных вакцин
Векторные вакцины представляют собой отдельный класс препаратов для создания иммунной защиты. При их производстве используют относительно безопасные для человека неспособные к репликации вирусы, которые «доставляют» в организм один или несколько генов белков возбудителя инфекции.
Векторные вакцины отличаются высокой эффективностью и безопасностью, в том числе и в долгосрочной перспективе. Это подтвердили результаты свыше 250 клинических исследований, которые проводили на протяжении последних 20 лет.⁴
«Спутник V» создали на платформе аденовирусов — возбудителей обычных простудных заболеваний у людей. Свойства этих вирусов хорошо известны, поэтому реакции организма на их введение предсказуемы.
Разработка института им. Н. Ф. Гамалеи отличается от других векторных вакцин способом изготовления — в основе лежит принцип гетерогенного бустирования. На каждом из двух этапов людям вводят разные векторы. Такой вариант вакцинирования определяет более выраженный иммунный ответ и надежную защиту от инфекционного заболевания.
Суть вакцины «Спутника V»
Болезнетворные микроорганизмы, которые способны вызвать развитие заболевания, называются антигенами. При их попадании в организм иммунная система начинает образовывать защитные антитела. Она как солдаты-защитники атакует антигены и тем самым предотвращает возникновение заболевания, либо обеспечивает его легкое протекание.
Суть вакцины «Спутник V» заключается в том, что человеку вводится «программа» для выработки клетками антигена коронавируса. Она не вызовет развитие заболевания, но «обучит» иммунную систему распознавать и активно атаковать при встрече вирус SARS-CoV-2. Благодаря этому у вакцинированных людей значительно снижается риск развития тяжелых форм коронавирусной инфекции.
Эффективна ли вакцина «Спутник V»?
«Эффективность вакцины «Спутник V» высокая, хотя к ней были вопросы по поводу проведения клинических исследований. Но сейчас уже опубликованы результаты 1-2 фазы и промежуточной стадии 3-й фазы клинических испытаний, а также накопилось довольно много свидетельств из других стран, да и в России тоже. Люди, вакцинированные «Спутником V», практически не попадают в больницу с коронавирусом. Этого уже вполне достаточно для того чтобы считать эту вакцину достаточно эффективной. Среди тех, кто вакцинировался «Спутником V», госпитализированных с коронавирусом меньше 1%. Это единичные случаи среди людей, у которых нарушена иммунная система или им не повезло с формированием иммунитета. Может показаться, что таких сообщений много, но по сравнению с количеством вакцинированных, это доли процента. А антипрививочникам я бы посоветовал сходить на экскурсию в реанимацию ковидного госпиталя, где в ужасных мучениях лежат непривитые люди. Они хрипят, им не хватает воздуха. Тот, кто там побывал, испытал настоящий шок от увиденного».



Состав вакцины «Спутник V»
Действующее вещество вакцины — аденовирусный вектор. Он представляет собой аденовирус человека, неспособный к размножению, поскольку у него удалена часть генетического материала. Вместо удаленной части в него искусственно «встраивают» ген, который кодирует синтез S-белка коронавируса SARS-CoV-2.
«Спутник V» состоит из двух компонентов:
- компонент I — вектор на основе аденовируса серотипа 26 (Ad26);
- компонент II — вектор на основе аденовируса 5 серотипа (Ad5).
В качестве вспомогательных компонентов в состав вакцины входят:
- трис(гидроксиметил)аминометан — вспомогательный буферный раствор;
- натрия хлорид — соль для поддержания нужной осмолярности;
- сахароза — стабилизатор;
- ЭДТА динатриевая соль дигидрат — стабилизатор;
- полисорбат — стабилизатор;
- магния хлорид — консервант;
- этиловый спирт — консервант.²
Вакцина состоит из двух компонентов, которые необходимо ввести с разницей в 3 недели. В качестве первого препарата человек получает вектор Ad26, затем ему вводят вторую дозу с вектором Ad5. Вспомогательные вещества в обоих растворах остаются неизменными.
Принцип действия
Аденовирусный вектор в вакцине представляет собой «транспортное средство», которое доставляет генетический материал SARS-CoV-2 в клетки тела человека. В результате они начинают вырабатывать S-белок коронавируса — эта структура входит в состав оболочки вируса и образует его характерные «шипы».
Если человек, который получил прививку, в дальнейшем встретится с коронавирусом, выработанные антитела «распознают» уже знакомый S-белок и начнут «атаковать» его, а затем Т-лимфоциты будут уничтожать зараженные им клетки. Благодаря этому заболевание либо не разовьется совсем, либо будет протекать в легкой форме.
После введения первого компонента иммунная система начинает вырабатывать антитела не только к S-белку, но и к «вектору», к белкам аденовируса. Поэтому для повторного введения препарата нельзя использовать первоначальный аденовирусный компонент — иначе он может быть уничтожен антителами еще до момента внедрения в клетки. Для предотвращения такого развития событий производители вакцины «Спутник V» решили использовать два разных серологических типа аденовируса.
После введения второго компонента препарата «Спутник V» происходит формирование большего числа иммунных В-клеток памяти — они «запоминают» возбудителя заболевания и дают организму длительный иммунитет. Так, первая доза прививки помогает иммунной системе «ознакомиться» с вирусом, а вторая уже «обучает» ее активной защите.
Полноценный иммунный ответ формируется на 42-й день от момента начала вакцинации или через 21 день после введения второго компонента препарата.
Для определения поствакцинального иммунитета можно сделать тест ИФА на антитела к S-белкам коронавируса. Но следует внимательно подойти к сдаче анализа и не перепутать методы исследования. Существуют тест-системы, которые предназначены для обнаружения антител к N-белку коронавируса. Они позволяют выявить постинфекционный иммунитет — ответ, который сформировался после перенесенной болезни. У людей после вакцинации этот показатель, как правило, отрицательный, но это не означает отсутствие иммунитета к коронавирусу. Эту разницу в тест-системах необходимо учитывать при сдаче анализа.¹
Что происходит в организме после вакцинации?
«Принцип действия векторной вакцины «Спутник V» очень простой — он как бы имитирует заражение, заставляет клетку саму производить шиповидный белок коронавируса, поэтому активируются оба звена иммунитета — и гуморальное, и клеточное.
После проникновения в клетку аденовирус теряет оболочку, его ДНК идет в ядро клетки, но никуда не встраивается, а пользуется фабрикой клетки для производства в цитоплазме спайк-белка. Частично он встраивается в мембрану клетки, секретируется в межклеточную жидкость, частично разрушается и представляется на ее поверхности комплексом гистосовместимости. Место инъекции ни аденовирусный вектор, ни сам спайк-белок не покидают и в кровоток практически не попадают.
Секретируемый спайк-белок в межклеточном пространстве подбирают дендритные клетки и макрофаги. Они представляют его эпитопы В- и Т- лимфоцитам. В-клетки и сами могут связать антиген и поглотить его, а затем представить на поверхности. Т-хелперы узнают такие В-лимфоциты, связываются с ними и активируют их клональное размножение и дифференцировку. В результате образуются плазматические клетки, производящие антитела и В-клетки памяти. Отличительной особенностью векторных вакцин является активация клеточного иммунитета и образование Т-клеток памяти, причем как хелперов, так и киллеров. Этим векторные вакцины выгодно отличаются от инактивированных, где Т-клеточный ответ развивается значительно слабее.
В зависимости от степени активации иммунной системы образуется много или мало антител и клеток памяти. При встрече с антигеном клетки памяти способны быстро активироваться, размножиться и дать сильный ответ — на этом основан эффект буста, или усиления иммунного ответа при повторной встрече с антигеном. Поэтому переболевшие люди, уже имеющие клетки памяти, развивают более сильный ответ после вакцинации, чем не болевшие. Прививка выделяет и усиливает у них протективную составляющую из уже имеющегося иммунитета к ковиду».



Эффективность вакцины
Полный курс вакцинации «Гам-Ковид-Вак» дает высокий уровень защиты взрослых людей от новой коронавирусной инфекции. Результаты исследований сообщают, что эффективность этой российской вакцины достигает 97,6%⁴. По словам директора Национального исследовательского центра эпидемиологии и микробиологии им. Н.Ф. Гамалеи Александра Гинцбурга, эффективность «Спутника V» против штамма дельта составляет 83-94%, против штамма омикрон — 75%.
Сотрудниками НИЦЭМ им. Н. Ф. Гамалеи были проведены исследования, во время которых они изучали эффективность вакцины «Спутник V» против новых мутаций коронавирусной инфекции:
- английского — Alpha B. 1.1.7;
- южноафриканского — Beta B.1.351;
- бразильского — Gamma P.1;
- индийских — Delta B.1.617.2 и B.1.617.3;
- российских — B.1.1.141 и B.1.1.317;
- омикрона — B.1.1.529.
Результаты показали, что вакцинация «Спутником V» приводит к выработке достаточно высокого титра антител ко всем новым штаммам коронавируса. Эти выводы были опубликованы в международном журнале «Vaccines».6
Только «Спутник V». Альтернативы нет
«В России в качестве первой вакцины стоит выбирать только «Спутник V». Это единственная российская вакцина с опубликованными данными и доказанной эффективностью и безопасностью. Эффективность «КовиВака» не ясна. «ЭпиВакКорона» – неудачная вакцина, после нее не образуются нейтрализующие антитела. Переболевшим людям с высокими антителами вполне хватит вакцины «Спутник Лайт», с низкими лучше сделать «Спутник V».



Подготовка к вакцинации
Применение вакцины «Гам-Ковид-Вак» не требует какой-либо специальной подготовки. Желающим привиться не нужно сдавать кровь на антитела к коронавирусу или делать ПЦР-тест, чтобы исключить ковид. Самое главное условие — у человека должно быть хорошее общее самочувствие.
Влияние вакцины на организм человека — это всегда индивидуальная реакция. Поэтому непосредственно перед прививкой необходимо пройти осмотр врача — при отсутствии противопоказаний специалист даст разрешение на вакцинацию.
В инструкции к препарату указаны состояния, при которых следует отложить его введение или даже отказаться от прививки. К таким противопоказаниям относятся:
- повышенная индивидуальная чувствительность к любому из компонентов вакцины;
- тяжелые поствакцинальные осложнения во время предыдущего введения вакцины или ее компонентов (анафилактический шок, судороги, температура выше 40°С, отек или гиперемия в месте введения инъекции, тяжелая аллергическая реакция);
- указание на перенесенные ранее тяжелые аллергические реакции;
- острые неинфекционные и инфекционные заболевания (в период болезни и 2-4 недели после выздоровления);
- хронические заболевания в периоде обострения (и 2-4 недели после выздоровления);
Согласно данным производителей, вакцинация возможна спустя 2–4 недели после выздоровления при острых заболеваниях или при переходе хронических патологий в неактивную фазу. При легком течении острых респираторных и кишечных инфекций введение препарата допускается сразу после нормализации температуры тела.5
Возраст младше 18 лет также считается противопоказанием к вакцинации «Спутником V». Это связано с тем, что отсутствуют данные как об эффективности, так и о безопасности использования препарата у детей и подростков².
Вакцинация подростков
В конце ноября 2021 года НИЦЭМ им. Н. Ф. Гамалеи зарегистрировал вакцину для детей «Спутник М» — концентрация в ней снижена в 5 раз. Прививать подростков 12-17 планировали начать в конце декабря 2021 года, но вакцинация детей началась только в конце января 2022 года. Для этого нужно согласие родителей, а если подростку уже есть 15 лет, он может принять решение сделать прививку самостоятельно.
Также есть список заболеваний, при которых вакцину следует применять с большой осторожностью. Он включает в себя следующие патологии:
- эпилепсия;
- сахарный диабет в тяжелой форме;
- значительное нарушение функций щитовидной железы;
- злокачественные новообразования;
- аутоиммунные заболевания;
- тяжелые заболевания системы крови.
Перед введением второй дозы препарата необходимо также проконсультироваться с врачом — тяжелая реакция на первый раствор может стать противопоказанием для продолжения вакцинации «Спутником V».
На 17 января 2022 года Россия по доле вакцинированного населения стоит на 94 месте в мире (46,80% привитых людей).
Вакцинация у многих вызывает вопросы, и люди с недоверием относятся к новой разработке, поэтому некоторые покупают сертификаты. Выяснить точный процент поддельных сертификатов невозможно, однако директор НИЦЭМ им. Н. Ф. Гамалеи, Александр Гинцбург, заявил, что 80% тяжело перенесших болезнь людей купили документ о вакцинации.
Как проходит вакцинация
Непосредственно перед вакцинацией человеку измеряют артериальное давление и температуру тела, определяют сатурацию — насыщение крови кислородом. «Спутник V» вводят только внутримышечно. Инъекцию делают в дельтовидную мышцу — верхнюю треть наружной поверхности плеча.
При первой прививке вводят компонент I. Через 21 день необходимо снова посетить прививочный кабинет для второго этапа вакцинации — введения компонента II.
После выполнения прививки следует оставаться под наблюдением медицинских работников в течение 30 минут. Особенно важно соблюдать это условие людям, которые склонны к аллергическим реакциям.
Что нельзя делать после вакцинации
В течение 2–3 дней после вакцинации важно дать организму возможность отдохнуть — исключить высокие нагрузки и не подвергать его стрессовым ситуациям. Это создаст оптимальные условия для полноценного иммунного ответа, и эффект от прививки будет максимальным. После вакцины в течение 3 дней не рекомендуется:
- употреблять алкогольные напитки;
- принимать солнечные ванны или посещать солярий;
- мочить место инъекции;
- купаться в бассейне или открытом водоеме;
- проводить интенсивные физические тренировки.
Также после введения препарата важно полноценно питаться с достаточным количеством белковой пищи. Нельзя соблюдать строгую диету — отсутствие витаминов и полезных питательных веществ может препятствовать образованию антител.
Ревакцинация
Через некоторое время после прививки количество антител в крови начинает снижаться. Для его поддержания на достаточном для полноценной защиты уровне необходимо повторное введение вакцины — ревакцинация от коронавируса.
В соответствии с временными методическими рекомендациями Минздрава РФ, в настоящее время действует правило «экстренной ревакцинации». Поэтому повторное введение вакцины должно проводиться каждые 6 месяцев.
После того как будет достигнут коллективный иммунитет, то есть прививку получит не менее 60% взрослого населения страны и эпидемия пойдет на спад, начнут действовать правила «рутинной вакцинации». Тогда повторное введение вакцины будет проводиться один раз в год⁶.
После вакцинации «Спутником V» ревакцинацию выполняют препаратом «Спутник Лайт». Повторная иммунизация приводит к увеличению уровня антиген-специфических IgG антител более чем в 40 раз у 100% привитых людей⁴.
Побочные эффекты вакцины Спутник V
При проведении клинических испытаний выявили, что побочные эффекты после вакцинации «Спутником V» обычно отличаются легкой или среднетяжелой степенью выраженности. Они могут возникнуть в первые 48 часов после прививки, но в течение последующих 72 часов проходят самостоятельно.
Среди побочных эффектов от введения препарата чаще всего наблюдается развитие непродолжительного гриппоподобного синдрома с симптомами:
- общее недомогание;
- головная и мышечная боль;
- «ломота» в суставах;
- повышение температуры тела.
Этот синдром не требует лечения и не представляет опасности для человека. Для улучшения самочувствия при повышении температуры тела до 38,0 °С и выше следует принять жаропонижающее средство, например, парацетамол.
После прививки возможно развитие и местной реакции. Она проявляется болезненностью, отечностью и покраснением тканей в месте инъекции. Для устранения этих симптомов показан прием антигистаминных средств — препаратов с противоаллергическим действием.
К редким побочным эффектам, которые могут возникнуть после введения «Гам-Ковид-Вак», относятся:
- снижение аппетита;
- тошнота;
- увеличение лимфатических узлов;
- появление эритроцитов в моче.
Серьезных побочных эффектов после введения вакцины «Спутник V» во время клинических исследований не наблюдалось.
Риски и мифы
По данным Министерства здравоохранения РФ, при иммунизации «Спутником V» у пациентов регистрируются обычные поствакцинальные реакции — головная и мышечная боль, небольшое повышение температуры. Данные о тяжелых реакциях отсутствуют. Но несмотря на это, многие россияне относятся к препарату с опаской и отказываются от иммунизации.
Наибольшее опасение у людей вызывают следующие «мифы»:
1. Вакцинация вызывает бесплодие
Антипрививочники утверждают, что в состав шиповидного белка входит белок синцитин-1. Он необходим для нормального формирования плаценты. Однако в составе вакцины отсутствуют компоненты, которые могли бы вызвать образование антител к синцитину-1.
Что на самом деле. Чтобы утверждать, что «Спутник V» вызывает бесплодие, необходимо, чтобы женщины, прошедшие иммунизацию, на протяжении 1–2 лет безуспешно пытались забеременеть. А после этого прошли полный медицинский осмотр для выявления причины бесплодия, так как оно может быть обусловлено множеством иных причин.
2. Вакцина изменяет код ДНК
Да, в составе препарата присутствует вирусная ДНК. При помощи вектора она доставляется в клетки, которые начинают синтезировать S-белок. В ответ на его попадание в кровь иммунная система вырабатывает антитела. Через некоторое время «зараженные» клетки погибают и организм человека очищается от присутствия вирусной ДНК.
Что на самом деле. Мнение людей о высоком риске вакцины «Спутник V» во многом связано с недостаточной информированностью, верой в теорию конспиративного заговора, чипирования населения.
Где действует вакцина «Спутник V»
Применение препарата «Спутник V» для иммунизации населения одобрили в 69 странах, в которых проживает около 3,7 млрд человек. При этом вакцина доказала свою высокую эффективность и безопасность (табл. 1).
| Страна | Число вакцинированных | Эффективность после второй дозы | Эффективность против тяжелых случаев | Серьезные побочные реакции |
| Россия | 3 800 000 | 83,1% | 94,4% | нет |
| ОАЭ | 81 000 | 97,8% | 100% | нет |
| Бахрейн | 5 000 | 94,3% | 98,6% | нет |
| Аргентина | 5 000 000 | 100% | 100% | нет |
Россиян, получивших полный курс иммунизации против Covid-19, принимают без ПЦР-тестирования:
- Абхазия;
- Албания;
- Армения;
- Белоруссия;
- Босния и Герцеговина;
- Венгрия;
- Грузия;
- Египет;
- Иордания;
- Казахстан;
- Кипр;
- Ливан;
- Марокко;
- Мексика;
- Молдова;
- Монголия;
- Северная Македония;
- Словения;
- Таджикистан;
- Тунис;
- Турция;
- Узбекистан;
- Хорватия;
- Черногория.
С тестом ПЦР, сделанным не позднее чем за 72 часа до въезда в страну, россиян принимают:
- Азербайджан;
- Барбадос;
- Бахрейн;
- Венесуэла;
- Греция;
- Джибути;
- Зимбабве;
- Израиль;
- Индия;
- Иран;
- Катар;
- Кения;
- Маврикий;
- Мальдивы;
- ОАЭ;
- Сербия;
- Таиланд;
- Шри-Ланка.
Среди этих стран действует разный порядок въезда. Например, при посещении Таиланда или Индии турист предоставляет сертификат о вакцинации и результат ПЦР-теста, после чего он обязуется соблюдать временную изоляцию в течение 5–78 часов, до получения повторного отрицательного результата ПЦР-тестирования.
Вопросы и ответы о вакцине «Спутник V»
Все вакцины от коронавирусной инфекции в мире создавали в достаточно сжатые сроки. Поэтому несмотря на убедительные данные клинических исследований, которые подтверждают эффективность и безопасность российского препарата, вокруг «Спутника V» продолжаются дискуссии. Постараемся ответить на наиболее частые вопросы, которые пациенты задают врачам о вакцинации этим препаратом.
Нужно ли самоизолироваться после прививки Спутником V?
Вакцина не содержит в себе вируса, который мог бы привести к развитию заболевания COVID–19. Поэтому после прививки человек не может заразить им окружающих людей. Соответственно, самоизоляция ему не требуется.
Неоднократно слышал, что после прививки люди все равно заболевают. Зачем тогда ее делать?
В мире нет ни одной вакцины, которая смогла бы защитить от коронавирусной инфекции на 100%. Но данные исследований показывают, что заболеваемость среди людей, привитых «Спутником V», незначительная, и болезнь после вакцинации протекает в легкой форме, без развития осложнений.
На какой срок защищает «Спутник V» от коронавируса?
В настоящее время точно неизвестно, на какой именно срок препарат дает защиту от коронавируса. В крови сотрудников центра Н. Ф. Гамалеи, которых вакцинировали в марте 2020 года, антитела класса G (IgG) определялись спустя 9 месяцев после прививки. Важно отметить и тот факт, что их уровень был выше, чем у людей, которые переболели COVID-19.
Как часто необходимо делать ревакцинацию?
В соответствии с рекомендациями Министерства здравоохранения РФ, в условиях высокой заболеваемости повторное введение вакцины, то есть ревакцинацию, необходимо проводить каждые 6 месяцев. После того как иммунизацией будет охвачено 60–70% взрослых людей РФ, прививку станут выполнять в плановом порядке — один раз в год.³
Может ли второй этап вакцинации проводиться не через 21 день, а позже?
В соответствии с инструкцией к препарату, введение второго компонента «Гам-Ковид-Вак» проводят через 21 день после первой прививки. Но если человек по объективным причинам не может посетить прививочный кабинет, допускается проведение второго этапа позже. Также введение второго раствора переносят в случае развития у человека коронавируса в этот период.
Нужно ли делать ПЦР-тест перед вакцинацией?
Проведение ПЦР-теста необходимо только в случае, если в течение последних двух недель у человека был контакт с пациентом, инфицированным коронавирусом.
Нужно ли сдавать анализ на антитела перед прививкой?
Перед вакцинацией нет необходимости сдавать анализ крови на антитела к вирусу SARS-CoV-2, даже если в течение последних шести месяцев был перенесен Covid-19 или ранее была сделана прививка от этого заболевания.
Что делать, если после прививки поднялась температура?
Выработка антител после прививки может сопровождаться небольшим недомоганием и повышением температуры тела до 37,5 °C. Этот симптом — абсолютно нормальная реакция организма и не требует какого-либо лечения. Но если температура повышается до более высоких значений, следует принять жаропонижающее средство, например, парацетамол.
Есть ли разница между «Спутником V» и «Гам-Ковид-Вак»?
«Спутник V» и «Гам-Ковид-Вак» — это два названия одного и того же препарата. Первое из них — торговое, а второе — медицинское.
Оказывает ли «Спутник V» влияние на фертильную функцию?
Нет, данная вакцина не оказывает негативного влияния на репродуктивную функцию человека. Ее производство основывается на использовании аденовирусных векторов, безопасность которых подтверждена результатами многолетних научных исследований.
Защитит ли прививка от новых мутаций вируса?
«Спутник V» обеспечивает защиту от тяжелого течения от всех известных на сегодняшний день мутаций вируса. Вирус SARS-CoV-2 постоянно изменяется. Вакцинация приводит к образованию антител к S-белку, поэтому важны именно те мутации, которые затрагивают шиповидный белок и могут снижать связывание с ним антител, которые выработались на предыдущий вариант вируса. Однако нейтрализующие антитела вырабатываются именно к той части спайк-белка, которая участвует в связывании с рецептором и проникновением внутрь клетки. Поэтому, хотя ген спайка и мутирует, полное его изменение до неузнаваемости вряд ли произойдет, ведь он должен по-прежнему выполнять свою функцию и находить клеточный рецептор. Именно это мы и наблюдаем: вакцинальные антитела хуже узнают спайк-белок у новых вариантов COVID-19, но не теряют связывание полностью. Это значит, что просто повышения титра антител и увеличения количества клонов клеток памяти будет достаточно для защиты от новых мутантов, то есть поможет ревакцинация через несколько месяцев. Скорее всего, нам придется прививаться от ковида, как от гриппа — раз в год на протяжении нескольких лет».



Может ли вакцинация стать причиной положительного теста ПЦР?
ПЦР-тест направлен на выявление генетической информации самого вируса, а не на определение защитных антител. Поэтому прививка не может привести к положительному результату этого анализа.
Если прививка защищает от заражения, то зачем после нее следует носить маску?
Необходимо понимать, что вакцина защищает от тяжелого течения болезни, а не от инфицирования коронавирусом. Несоблюдения правил профилактики может стать причиной заражения даже привитого человека, также после вакцинации люди нередко становятся вирусоносителями и передают инфекцию окружающим людям.
Можно ли применять «Спутник V» для лечения коронавирусной инфекции?
Применение препарата «Спутник V» показано только с целью профилактики. В период любого острого заболевания, в том числе и Covid-19, его использование противопоказано.
Заключение
Вакцинация препаратом «Спутник V» — высокоэффективный способ защиты от заболевания ковидом. Прививка «обучает» иммунную систему бороться с ранее неизвестным для нее вирусом, дает естественную защиту организма. И даже если болезнь разовьется, она будет протекать в легкой форме — без госпитализации, проведения искусственной вентиляции легких и серьезных последствий.
Источники
- Спутник V. Википедия
- Инструкция по медицинскому применению лекарственного препарата Гам-Ковид-Вак, комбинированная векторная вакцина для профилактики коронавирусной инфекции, вызываемой вирусом SARS-CoV-2. Министерство здравоохранения Российской Федерации.
- Официальная информация о коронавирусе в России. Часто задаваемые вопросы.
- Спутник V. Официальный сайт.
- Пандемия COVID-19. Википедия
- Временные методические рекомендации «Порядок проведения вакцинации взрослого населения против COVID-19». https://minzdrav.gov.ru/news/2021/07/02/16927-utverzhdeny-vremennye-metodicheskie-rekomendatsii-poryadok-provedeniya-vaktsinatsii-vzroslogo-naseleniya-protiv-covid-19
- Gushchin VA, Dolzhikova IV, Shchetinin AM, Odintsova AS, Gintsburg AL. Neutralizing Activity of Sera from Sputnik V-Vaccinated People against Variants of Concern (VOC: B.1.1.7, B.1.351, P.1, B.1.617.2, B.1.617.3) and Moscow Endemic SARS-CoV-2 Variants.Vaccines. 2021; 9(7):779. https://doi.org/10.3390/vaccines9070779
- Lapa D, Grousova DM, Matusali G, Meschi S, Colavita F, Bettini A, Gramigna G, Francalancia M, Garbuglia AR, Girardi E, Puro V, Antinori A, Kovyrshina AV, Dolzhikova IV, Shcheblyakov DV, Tukhvatulin AI, Zubkova OV, Logunov DY, Naroditsky BS, Vaia F, Gintsburg AL. Retention of Neutralizing response against SARS-CoV-2 Omicron variant in Sputnik V vaccinated individuals. MedRxiv. 2022 Jan 20. doi: https://doi.org/10.1101/2022.01.15.22269335