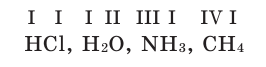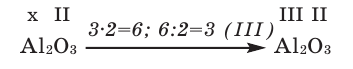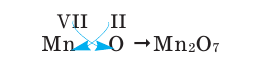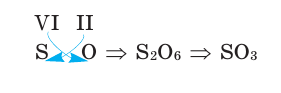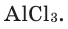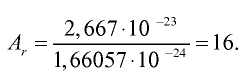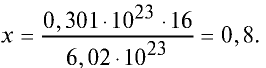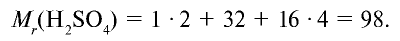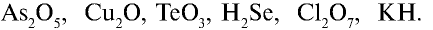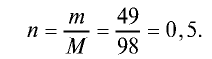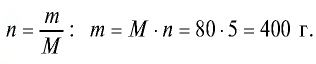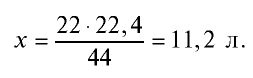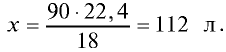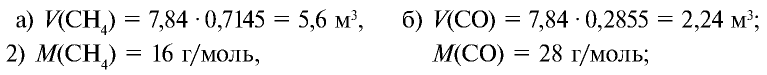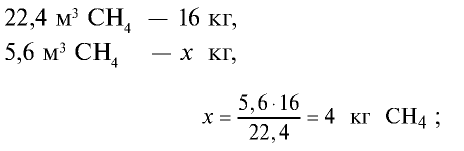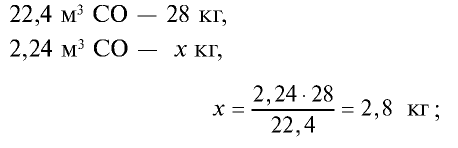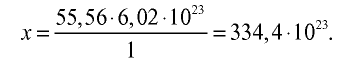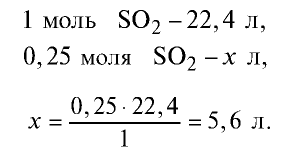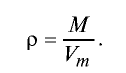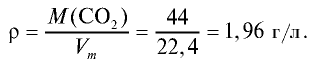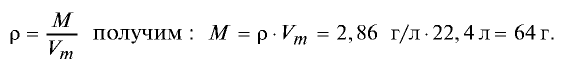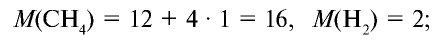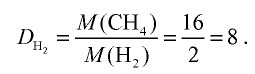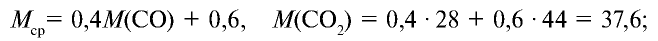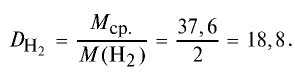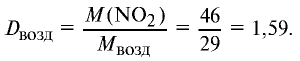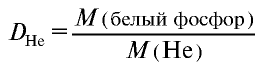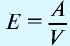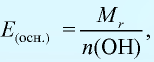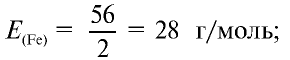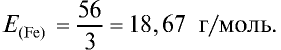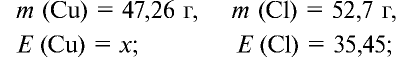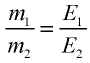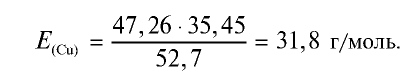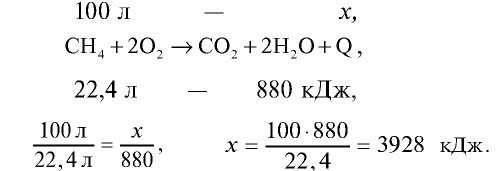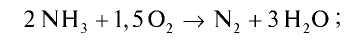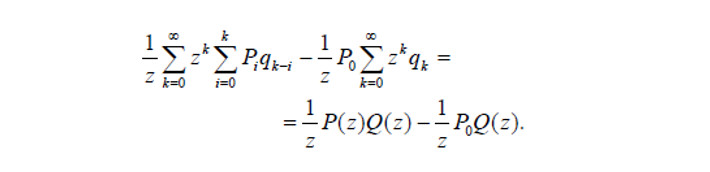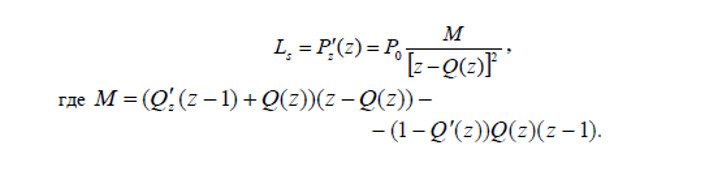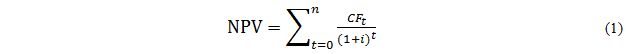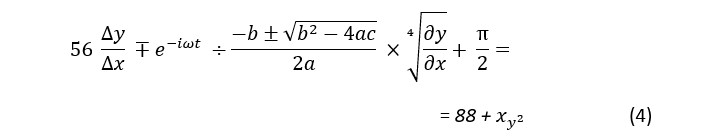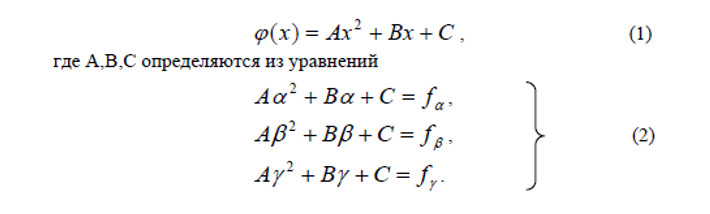-
-
Предмет:
Химия
-
Автор:
enzohorne282
-
Создано:
3 года назад
Ответы
Знаешь ответ? Добавь его сюда!
-
-
Математика2 минуты назад
Помогите пожалуйста с задачей.
-
Математика12 минут назад
12. Чи можна дати здачу 2 грн 25 коп. монетами: 1) по 25 коп.; 2) по 50 коп.?
-
Математика17 минут назад
Даю 50 балов срочно
1/4 часть равна 60 -
Математика17 минут назад
Срочно вирішити логарифм
log0,5(4 — ) + log0,5( — 1) = -1 -
Биология17 минут назад
почему я не могу спать ночью,вот не идёт у меня ночной сон,это не бессонница я думаю,я незнаю что делать,я пытаюсь наладить сон но все время засыпаю все позже и позже
Информация
Посетители, находящиеся в группе Гости, не могут оставлять комментарии к данной публикации.
Вы не можете общаться в чате, вы забанены.
Чтобы общаться в чате подтвердите вашу почту
Отправить письмо повторно
Вопросы без ответа
-
Математика2 часа назад
Помогите пожалуйста !!!!
Вычислите площадь плоской области D , ограниченной заданными линиями. 3x^2-2y=0; 2x-2y+1=0
-
Алгебра4 часа назад
При каком значении a система имеет бесконечно много решений?
{x+y-2z=7
{x+ay+4z=3
{2x+y+az=12a^2
Топ пользователей
-
Fedoseewa27
20458
-
Sofka
7417
-
vov4ik329
5115
-
DobriyChelovek
4631
-
olpopovich
3446
-
dobriykaban
2374
-
zlatikaziatik
2275
-
Udachnick
1867
-
Zowe
1683
-
NikitaAVGN
1210
Войти через Google
или
Запомнить меня
Забыли пароль?
У меня нет аккаунта, я хочу Зарегистрироваться
Выберите язык и регион
Русский
Россия
English
United States

How much to ban the user?
1 hour
1 day
Содержание:
Составление химических формул по валентности:
Пользуясь знаками представленных химических элементов, запишите химические формулы воды, поваренной соли, углекислого газа, серной кислоты. На чём основывается запись химических формул веществ?
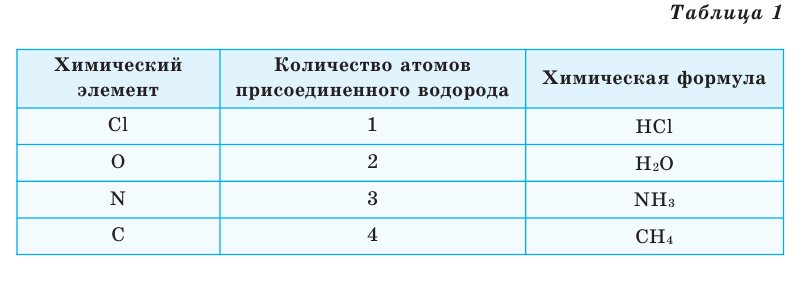
Химические формулы веществ можно вывести на основе различных химических опытов. Рассмотрим формулы водородных соединений некоторых элементов (таблица 1).
Из таблицы становится ясно, что атом хлора присоединяется с 1, атом кислорода — с 2, атом азота — с 3, а атом углерода — с 4 атомами водорода. Следовательно, химические элементы обладают разной способностью присоединять к себе атомы водорода. Для объяснения этого пользуются понятием «валентности». Свойство атомов химических элементов присоединять к себе определенное число атомов других химических элементов называют валентностью. Понятие валентности впервые было введено в 1852 году английским ученым Э.Франклендом.
Английский химик. В 1852 г. им было введено в науку понятие о соединительной силе атомов друг к другу. Данное свойство атомов впоследствии было названо валентностью.
Кислород в угарном газе в ионе гидроксония 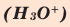
Валентность выражают римскими цифрами. Валентность водорода принята за единицу, и поэтому валентности других элементов берутся в сопоставлении с ним.
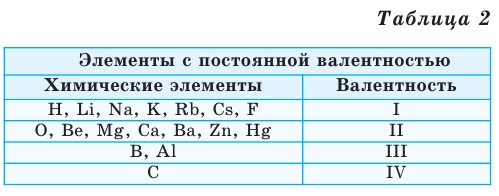
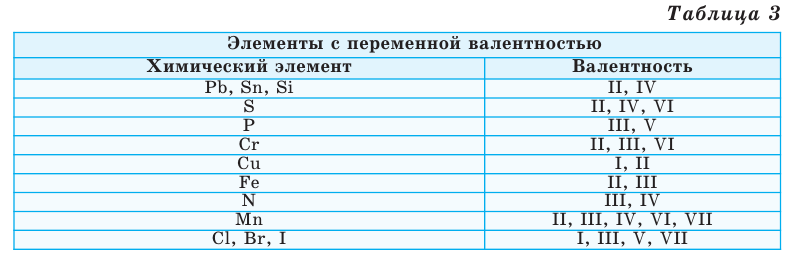
Валентность некоторых химических элементов остается неизменной во всех их химических соединениях, т.е. всегда обозначается одной и той же цифрой. Это элементы с постоянной валентностью (таблица 2).
Однако другая группа элементов в различных химических соединениях имеет различную валентность. Их называют элементами с переменной валентностью (таблица 3).
Зная валентность химических элементов, можно легко составить формулу бинарного (двухэлементного) соединения, образованного ими. Для этого следует записать химические знаки элементов, проставив над ними их валентность. Далее, определив наименьшее общее кратное чисел, выражающих валентность этих элементов, его делят на валентность каждого из них и находят их индексы. Например:
1) Определим валентность атома алюминия по кислороду в химическом соединении 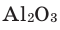
2) Составим химическую формулу соединения VII-валентного элемента марганца с кислородом:
3) Если при составлении формулы по валентности полученные индексы сократить до минимальных целых чисел, в таком случае можно, проведя эту операцию, получить простую формулу вещества (поделив VI и II на самый большой делитель — 2, можно получить формулу).
Химическая формула
Заполните таблицу. Как произносится химическая формула вещества?
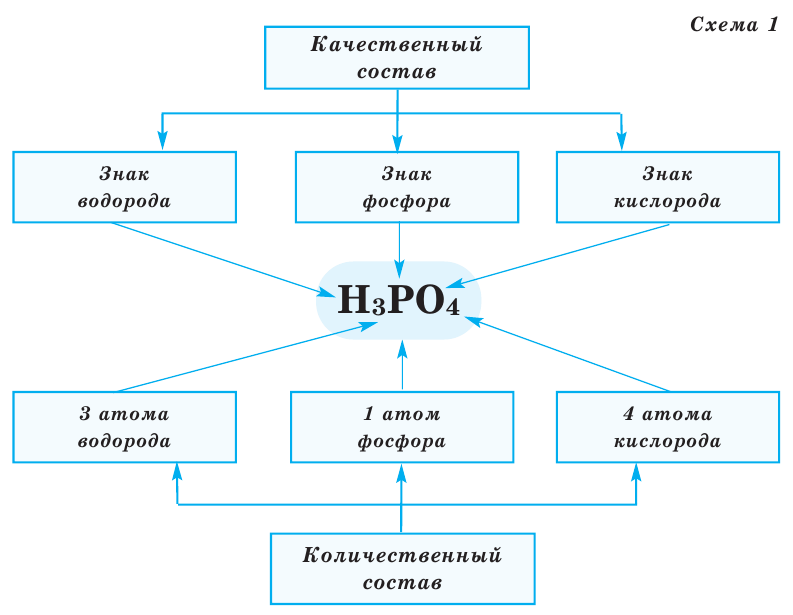
Все вещества имеют химическую формулу. Условное обозначение состава вещества при помощи химических знаков и индексов называют химической формулой. Химическая формула вещества выражает его количественный и качественный состав. Качественный состав вещества показывает, из атомов каких элементов оно состоит, а его количественный состав — число атомов элемента, содержащихся в его составе, т.е. в одной молекуле. Число, расположенное справа внизу у знака элемента и показывающее количество атомов, называется индексом (схема 1).
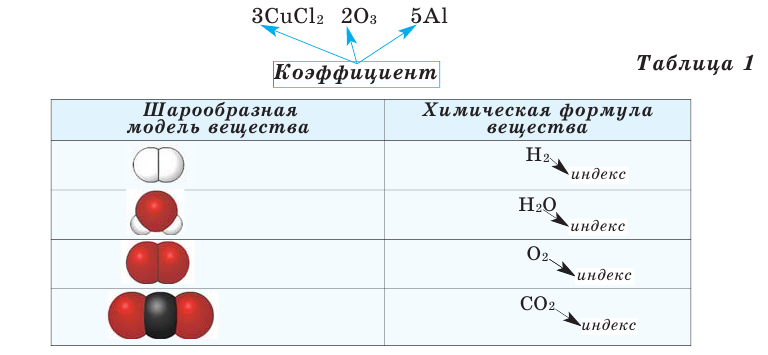
Число, стоящее перед химическими формулами и химическими знаками, называется коэффициентом.
На основе представленных в таблице 1 моделей молекул и химических формул водорода, кислорода, воды и углекислого газа можно определить число атомов в их составе (таблица 2).
Пользуясь краткими названиями химических элементов, можно прочитать формулы:
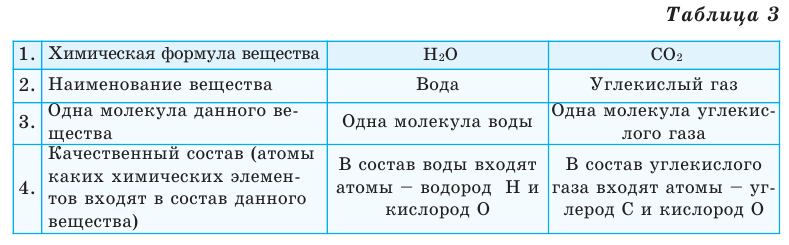
Выясним, какие сведения о веществе можно получить по его химической формуле (таблица 3).
Состав веществ определяют разными физико-химическими способами, методом анализа результатов химических опытов. Так, например, в результате разложения воды под воздействием постоянного электрического тока наблюдается превышение в два раза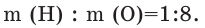
Французский химик. В период с 1799 по 1806 гг. исследовал составы различных оксидов, сульфидов и других веществ. В итоге им был открыт закон постоянства состава химических соединений.
Данный закон о постоянстве и неизменности состава и свойств веществ с молекулярным строением является одним из основных законов химии. Для большинства химических соединений немолекулярного строения закон постоянства состава не подходит.
Как известно, не все вещества имеют молекулярное строение. Целая группа веществ имеет немолекулярное строение. Как же составляются химические формулы этих веществ? Химические формулы веществ с немолекулярным строением составляются на основе количественного соотношения частиц элементов (атомов или ионов) в соединениях. Для определения этого соотношения выясняется, сколько частиц другого элемента окружает (соединяется) частицу элемента в кристалле вещества немолекулярного строения. Исследования физическими методами строения кристаллов вещества позволяют получить такие сведения. В результате таких исследований стало известно, что в кварце количественное соотношение между атомами кремния (Si) и кислорода (О) составляет 1:2. Значит, его формулу можно представить в виде: 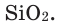
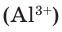

Начальные химические понятия и законы
Для овладения всесторонними знаниями о величинах атомов, а также их относительных и абсолютных массах требуется усвоить следующие важнейшие понятия.
Атом — это мельчайшая химически неделимая частица вещества.
Слово «атом» в переводе с древнегреческого языка означает ~ «неделимый».
В настоящее время доказано, что атом состоит из ряда более мелких частиц.
Химический элемент — это вид определенных атомов. Например, атомы кислорода означают элемент кислород (табл. 1).
Каждый химический элемент обозначается символом — первой буквой своего латинского названия или при необходимости первой и следующей за ней буквами. Например, Н (аш) — химический символ водорода, от латинского слова Hydrogenium («образующий воду»).
Будучи мельчайшими частицами, атомы обладают определенной массой. Так, абсолютная масса атома водорода составляет 0,00000000000000000000001674 г или 1,674•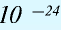

Относительная масса атома — это число, указывающее, во сколько раз масса атома химического элемента больше 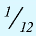
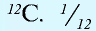
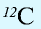

Относительная масса атома обозначается буквой Аг, где г — относительность (relative).
Количество вещества — величина, численно равная относительной атомной массе элемента, — выражается в г-молях (или молях).
В 1 моле любого вещества содержится 6,02•
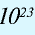
Таблица 1
Показатели некоторых химических элементов
| Химический элемент | Символ | Абсолютная масса атома, г | Абсолютная масса атома, 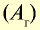 |
Число атомов в 1 моле |
| Водород | Н | 1,674•  |
1,008 | 6,02• |
| Кислород | О | 26,567• |
15,999 | 6,02• |
| Углерод | С |
19,993• |
12,011 | 6,02• |
Пример №1
Абсолютная масса атома кислорода равна 2,667•
Решение. Единица массы 1 атома равна 1,66057•
Ответ: 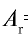
Пример №2
Какой будет масса (г) 0,301 • 
Решение. 6,02 •
Тогда, если 6,02 • 

Ответ: 0,8 г.
Определение химической формулы
- Химическая формула — это выражение состава молекулы вещества посредством химических символов и (при необходимости) индексов.
- По химической формуле можно определить качественный и количественный состав вещества.
Например: 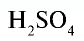
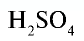
Точно так же можно найти абсолютную и относительную массы молекулы. Для нахождения абсолютной массы производится сложение абсолютных масс 2 атомов водорода, 1 атома серы и 4 атомов кислорода. Выполнение действий с такими малыми числами вызывает трудности, поэтому рассчитывают относительную массу молекулы (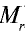
1 моль — значение, выраженное в граммах и численно равное относительной молекулярной массе вещества.
1 моль — количество вещества, содержащего столько структурных единиц (молекул, атомов, ионов, электронов), сколько атомов в 12 г изотопа углерода (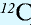
В 12 г углерода содержится 6,02•
Количество вещества обозначается буквой n и его значение выражается в молях.
Молярная масса вещества обозначается буквой М и выражается в г/молях (табл. 2).
Таблица 2
Показатели некоторых химических веществ
Валентность
1. Нахождение валентности элементов, входящих в состав вещества, по данным химическим формулам.
Свойство атомов элемента присоединять определенное число атомов другого элемента называется валентностью.
В качестве единицы измерения валентности принята валентность водорода.
Валентность атома водорода равна единице. Атом кислорода всегда двухвалентен.
Неизвестная валентность элемента определяется по водородным или кислородным соединениям, а также соединениям с каким-нибудь другим элементом, валентность которого известна.
Пример №3
Перепишите в тетрадь формулы следующих соединений и определите их валентность:
Решение.
1) 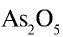
2) 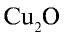
3) 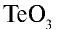
4) 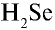
5) 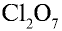
6) КН — 1•1 = 1, 1 : 1 =1. Калий одновалентен.
2. Составление формулы вещества, состоящего из двух элементов, валентности которых известны.
Пример №4
Составьте формулу оксида фосфора (V), зная, что фосфор пятивалентен, кислород двухвалентен.
Решение:
1) запишем символы фосфора и кислорода — РО;
2) запишем валентности элементов римскими цифрами над их символами — 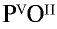
3) определим самое малое общее делимое чисел, выражающих валентности, то есть пяти и двух. Оно равно десяти;
4) чтобы найти число атомов элементов в формуле, разделим общее делимое на валентности элементов: фосфор — 10 : 5 = 2; кислород — 10:2 = 5. Следовательно, в соединении фосфор представлен двумя, а кислород — пятью атомами.
5) запишем найденные числа атомов в индексе химических символов — 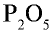
Пример №5
Определите валентность углерода в оксиде углерода (IV). Решение. Валентность кислорода в соединении равна двум, углерода — m. Если известны формула соединения и валентность (n) одного из элементов, валентность (m) второго можно определить по формуле
Например, валентность углерода в 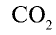
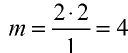
Количество вещества
Определение количества вещества, если известна его масса, или нахождение его массы, если известно количество вещества.
Пример №6
Вычислите количество вещества в 49 г серной кислоты.
Решение.
1) 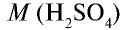
2) вычислим количество вещества n по формуле
Ответ: 0,5 моля.
Пример №7
Сколько граммов составляют 5 молей оксида меди(||)?
Решение.
1) М (СuО) = 64+ 16- 80 г/моль;
2) найдем массу вещества по формуле
Ответ: 5 молей СuО равны 400 г.
Закон Авогадро
В равных объемах различных газов при одинаковых условиях содержится одинаковое число молекул (закон Авогадро). 1 моль вещества в газообразном или парообразном состоянии при н.у. занимает объем 22,4 л, который называется молярным объемом (табл. 3).
Таблица 3
Молярные объемы некоторых газообразных веществ
Плотность газа определятся по формуле 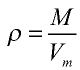
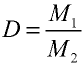
1. Определение объема газов.
Пример №8
Какой объем (л, ну) займут 22 г углекислого газа?
Решение:
1) 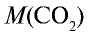
2) вычислим объем 22 г 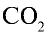
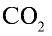
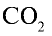
Ответ: 22 г 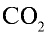
Определив количество вещества в 22 г углекислого газа, зная, что 1 моль любого газа занимает объем 22,4 л (н.у.), найдем
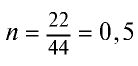
Если 1 моль газа занимает объем 22,4 л, то 0,5 моля — 11,2 л.
Пример №9
Каким будет объем 90 г воды, переведенной в газообразное (пар) состояние при 20°С ?
Решение. Жидкие и твердые вещества при переходе в газообразное состояние подчиняются тем же законам, что и газы. Поэтому:
1) М(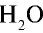
2) рассчитаем объем 90 г воды в газообразном состоянии с помощью пропорции:
18 г 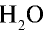
90г 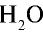
Ответ: объем 90 г водяного пара — 112 л.
Пример №10
Определите массу 7,84 м3 смеси, содержащей 71,45% метана и 28,55% оксида углерода (II).
Решение:
1) сколько метана и оксида углерода (II) содержится в 7,84 м3 смеси?
3)найдем массу 5,6 м3 СН4 с помощью пропорции: 22,4 м3 СН4 — 16 кг,
4) найдем массу 2,24 м3 СО с помощью пропорции: 22,4 м3 СО — 28 кг,
5) общая масса смеси газов: 4 кг + 2,8 кг = 6,8 кг.
Ответ: общая масса смеси газов — 6,8 кг.
Пример №11
Рассчитайте количество вещества и число молекул в 1 л воды при 20°С .
Решение:
1) найдем массу 1 л воды. Плотность воды — 1 г/см3. Отсюда т{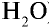
2) вычислим количество вещества в 1000 г воды:
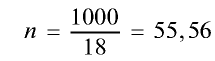
3) определим число молекул в 1 л (в 1000 г, или 55,56 моля) воды с помощью пропорции: в 1 моле воды — 6,02•
Ответ: в 1 л воды содержится 55,56 моля, 334,4 • 
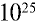
Пример №12
Какой объем (л,н.у.) займут 16 г оксида серы (IV)?
Решение:
1) найдем количество вещества в 16 г 
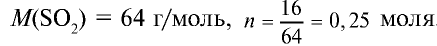
2) вычислим, какой объем займут 16 г (или 0,25 моля) 
Ответ: 16 г 
Вычисление плотности газов
Плотность газов определяется путем деления их молярной массы на молярный объем:
Пример №13
Рассчитайте плотность углекислого газа.
Решение:
Ответ: плотность углекислого газа — 1,96 г/л.
Пример 2. Рассчитайте молярную массу газа с плотностью р = 2,86 г/л.
Решение.
Из формулы
Ответ: молярная масса газа с плотностью 2,86 г/л —64 г.
Вычисление относительной плотности газов
Пример №14
Вычислите плотность метана относительно водорода.
Решение:
1) рассчитаем молекулярные массы метана и водорода:
2) определим плотность метана относительно водорода:
Ответ: плотность метана относительно водорода равна 8, или метан тяжелее водорода в 8 раз.
Пример №15
Определите относительную плотность газовой смеси, содержащей 40% угарного газа и 60 % углекислого газа.
Решение:
1) найдем среднюю молекулярную массу газовой смеси.
2) вычислим плотность газовой смеси относительно водорода:
Ответ: плотность газовой смеси относительно водорода равна 18,8. Пример 3. В процессе производства азотного удобрения на Ферганском производственном объединении «Азот» в качестве промежуточного вещества образуется оксид азота (IV). Найдите плотность оксида азота (IV) относительно воздуха.
Решение:
1) молекулярная масса оксида азота (IV)
M(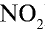
Средняя молекулярная масса воздуха — 29 г/моль;
2) вычислим плотность оксида азота (IV) относительно воздуха:
Ответ: плотность оксида азота (IV) относительно воздуха равна 1,59.
Пример №16
Плотность пара белого фосфора относительно гелия равна 31. Рассчитайте молекулярную массу белого фосфора.
Решение.
Из формулы
следует, что М(белый фосфор) = 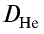
Ответ: молекулярная масса белого фосфора равна 124.
Закон эквивалентности
Химические элементы присоединяются друг к другу или замещаются в весовых количествах, пропорциональных своим эквивалентам (закон эквивалентности).
Эквивалентностью элемента называется количество этого элемента, присоединяющего или замещающего 1 моль или 1 г атомов водорода.
Отношение относительной атомной массы элемента к его валентноcти есть эквивалентность этого элемента:
Эквивалентность оксида выражается формулой: 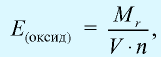

Эквивалентность оснований выражается формулой:
где 
Эквивалентность кислот выражается формулой: 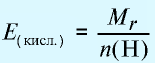

n(H) — число атомов водорода, замещаемых металлом, содержащимся в кислоте.
Эквивалентность солей выражается формулой: 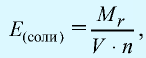

Пример №17
Определите эквивалентность железа в двух- и трехвалентных соединениях.
Решение:
1) найдем эквивалентность железа в двухвалентных соединениях:
2) найдем эквивалентность железа в трехвалентных соединениях:
Ответ: эквивалентность железа в двухвалентных соединениях равна 28, в трехвалентных соединениях — 18,67 г/моль.
Пример №18
47,26 г меди, соединяясь с 52,74 г хлора, образуют соль хлорид меди (II). Рассчитайте эквивалентность меди, зная, что эквивалентность хлора равна 35,45 г/моль.
Решение:
1) уточним условия задачи:
2) определим эквивалентность меди, пользуясь формулой
Ответ: эквивалентность меди равна 31,8 г/моль.
Энергетические явления в химических реакциях
Во всех химических реакциях происходит выделение или поглощение энергии.
Реакции, сопровождающиеся выделением теплоты, называются экзотермическими.
Реакции, сопровождающиеся поглощением теплоты, называются эндотермическими.
Количество теплоты, которое выделяется или поглощается при образовании из простых веществ 1 моля сложного вещества, называется теплотой образования вещества. Теплота разложения любого сложного вещества на простые вещества равна его теплоте образования и выражается противоположным знаком (закон Лавуазье и Лапласа).
Например: 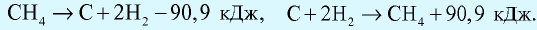
Пример №19
Для приготовления пищи в школьной столовой израсходовано 100 л метана (метан — основной компонент природного газа). Сколько тепла выделилось при сгорании 100 л метана? Тепловой эффект реакции горения метана равен + 880 кДж/моль.
Решение.
При полном сгорании 1 моля метана (22,4 л) выделяется 880 кДж тепла. Сколько тепла выделится при сгорании 100 л метана?
Ответ: при сгорании 100 л метана выделяется 3928 кДж.
Пример №20
Рассчитайте тепловой эффект реакции горения аммиака. Известно, что теплота испарения воды 241,88 кДж/моль, теплота образования 
Решение.
Запишем реакцию горения аммиака:
Найдем тепловой эффект реакции горения аммиака на основе закона Гесса. Для этого из суммы теплоты образования продуктов реакции вычтем сумму теплоты образования веществ, взятых в реакцию (примем, что теплота образования простых веществ равна нулю).
Ответ: 633,24 кДж.
Морфемный разбор слова:
Однокоренные слова к слову:
Как называется число которое пишется впереди перед формулами
Ключевые слова конспекта: химическая формула, индекс, коэффициент, качественный и количественный состав, формульная единица.
Химическая формула — это условная запись состава вещества посредством химических знаков и индексов.

Если требуется обозначить не одну, а несколько молекул (или отдельных атомов), то перед химической формулой (или знаком) ставят соответствующую цифру, которую называют коэффициентом. Например, три молекулы воды обозначаются 3Н2О, пять атомов железа — 5Fe. Индекс 1 в химических формулах и коэффициент 1 перед химическими символами и формулами не пишут.
Запись 5Н2О (пять-аш-два-о) следует понимать так: пять молекул воды образованы десятью атомами водорода и пятью атомами кислорода.
ЗАДАНИЕ. Обозначить, используя символы химических элементов
а) три молекулы азота
б) семь молекул сульфида железа
в) четыре атома серы
г) два атома кальция
д) семь молекул воды
е) четыре молекулы кислорода
ж) две молекулы сернистой кислотыОТВЕТ:
а) три молекулы азота — 3N2
б) семь молекул сульфида железа — 7FeS
в) четыре атома серы — S4
г) два атома кальция — Ca2
д) семь молекул воды — 7H2O
е) четыре молекулы кислорода — 4O2
ж) две молекулы сернистой кислоты — 2H2SO3Объяснение: коэффициенты показывают количество молекул, индексы — количество атомов. Формулы молекул простых веществ нужно запомнить. Одноатомные молекулы образуют инертные газы гелий He, неон Ne, аргон Ar и другие. Из двухатомных молекул состоят водород H2, кислород O2, азот N2, галогены F2, Cl2, Br2, I2. Три атома — в молекулах озона O3, четыре — в молекулах белого фосфора P4.
По химической формуле мы можем дать веществу название, определить его качественный и количественный состав, а также подсчитать его относительную молекулярную массу.Химическая формула показывает, из атомов каких элементов состоит вещество (то есть качественный состав вещества); и каково соотношение атомов этих элементов (то есть количественный состав вещества).
Формульная единица
Химические формулы веществ, имеющих немолекулярное строение, например FeS, не описывают состав молекулы; а только показывают соотношение элементов, образующих данное вещество.
Так, кристаллическая решётка поваренной соли — хлорида натрия состоит не из молекул, а из ионов. На каждый положительно заряженный ион натрия в ней приходится один отрицательно заряженный ион хлора. Получается, что отношение индексов в записи NaCl совпадает с отношением; в котором химические элементы соединяются между собой, образуя вещество. По отношению к веществам, имеющим немолекулярное строение, такую запись правильнее называть не формула, а формульная единица.
В таком случае величина Мr должна называться не относительной молекулярной массой, а относительной формульной массой. Тем не менее по традиции выражение «относительная молекулярная масса» используют и по отношению к веществам немолекулярного строения.
Конспект урока «Химическая формула. Индекс и коэффициент. Формульная единица«.
Источник
Как называется число которое пишется впереди перед формулами
2.Как называются вещества, состоящие из атомов одного вида?
3. Цвет фенолфталеина в щелочах?
4. Газ, поддерживающий горение?
5. Как называется наименьшая частица вещества, обуславливающая его свойства?
6. Объем одного моль газа?
7. Кто открыл закон сохранения массы веществ?
8. Газ, который используется для резки и сварки металлов?
9. Наименьшая неделимая частица элементов?
10. Самый распространенный элемент на Земле?
11. Как называются соли серной кислоты?
12.Кто открыл периодический закон?
13. Какого газа больше всего в составе атмосферы Земли?
14. Какая из кислот соленее серная или угольная?
15. Состав молекулы воды (формула воды)?
16. Какую валентность имеет кислород?
17. Формула азотной кислоты?
18. Самый легкий газ?
19. Как называется число, которое пишется впереди перед формулами?
20. Укажите бес кислотную кислоту: серная, соляная, азотная.
21. Вещества, изменяющие скорость химических реакций?
22. Сколько агрегатных состояний у воды?
23. Единица измерения количества вещества?
24. При какой температуре кипит чистая вода?
25. Газ, необходимый для дыхания?
28.Физические свойства алканов.
34.Взаимодействие с водой
41.Где используется пестициды?
42.Назовите виды пестицидов?
43.Как называются пестициды, используемые для удаления сорняковых растений?
44.Что такое инсектициды?
45. Почему пестициды не получили широкого распространения?
46.какие классы кислородсодержащих веществ вы изучили?
47.Какие органические вещества называются фенолами?
48. каковы физические свойства фенолов?
49. Расскажите о применении фенолов?
50.По каким признакам можно судить о наличии углерода?
51.Что образуется при нагревании оксида меди?
52.Как можно обнаружить отцепление галогена?
53.Почему водород образует воду голубого цвета?
54. От присутствия какого элемента пламя окрашивается в зелёный цвет?
55. Что знаешь о алкенах?
56. Физические свойства алкенов:
57.Химические свойства алкенов?
58. Строение алкенов
61.Какой качественной реакцией определяет ненасыщенные углеводороды? 62. Какая реакция называется полимеризацией?
63. Назовите общую формулу бензола?
69.на какие виды делятся химические связи?
70. Что мы, вообще, называем химией?
71. Разновидности ковалентной связи
73. Что мы называем металлической связью?
74.В чём сходство ковалентной связи с металлической?
75. Что такое диеновые углеводороды?
76. Назовите физические свойства диенов?
77.Что означает реакция полимеризация?
78.Перечислите представителей диенов?
79. Расскажите о значении хлорпрена?
80. Напишите общую формулу диенов?
81.Какова общая формула алканов?
82.Какова общая формула алкенов?
83.Назовите общую формулу алкадиенов?
84.Откуда происходит название «альдегид»?
85.Где применяется ацетон?
86. Какова общая формула альдегидов?
87.Что вы знаете о применении муравьиной и уксусной кислоты?
88.Что такое структурная формула?
89. Как пишется электронная формула?
90. Природные источники предельных углеводородов(метан)
91. Природный источник натурального каучука?
92. Стереорегулярная реакция
93. физические, химические свойства каучука?
94.Какие вещества называются спиртами?
95.Какие вещества называется простыми эфирами?
96. Что вы знаете о вредном воздействии метанола и эталона на организм человека?
97.Какме вещества относятся к многоатомным спиртам?
98. где применяется глицерин?
99.Чем отличается свойства фенолов от свойств спиртов?
100.Назовите отличительные химические свойства фенолов?
Источник
Тесты по химии с ответами.
В тестах всего 26 воросов. Дан вопрос и правильный ответ.
Тесты по школьной программе по химии
Как называются вещества, состоящие из атомов одного вида?
Цвет фенолфталеина в щелочах?
Газ, поддерживающий горение?
Как называется наименьшая частица вещества, обуславливающая его свойства?
Объем одного моль газа?
Кто открыл закон сохранения массы веществ?
Газ, который используется для резки и сварки металлов?
Наименьшая неделимая частица элементов?
Самый распространенный элемент на Земле?
Как называются соли серной кислоты?
Кто открыл периодический закон?
Какого газа больше всего в составе атмосферы Земли?
Какая из кислот солонее серная или угольная?
Состав молекулы воды (формула воды)?
Какую валентность имеет кислород?
Формула азотной кислоты?
Как называется число, которое пишется впереди перед формулами?
Укажите бескислотную кислоту: серная, соляная, азотная.
Вещества, изменяющие скорость химических реакций?
Сколько агрегатных состояний у воды?
Единица измерения количества вещества?
При какой температуре кипит чистая вода?
Газ, необходимый для дыхания?
Тест по химии
І. Раскройте сущность периодического закона Д. И.Менделеева в свете теории строения атома.
1.Укажите название элемента образующего амфотерные соединения:
2. Обозначьте элемент, который входит в состав главной подгруппы:
3. Определите чило электронов, которое может содержаться на f – подуровне электронной оболочки:
4. Установите соответствие между числом электронов на внешнем энергетическом уровне и названием химического элемента:
5. Установите последовательность возрастания заряда ядра элементов:
6. Установите соответствие между символом элемента и его названием:
б) Na, 2. азот ( нитроген),
7.Обозначьте элемены, которые могут проявлять валентность II:
8. Обозначьте элемент второй группы:
9. Определите молекулярную массу соединение CaCo3:
10. Выберите характеристику состава молекулы простого вещества:
а) состоит из атомов одного вида,
б) состоит из атомов разного вида,
в) содержит только два атома.
г) содержит только один атом.
11. Укажите число протонов в ядре атома под номером 20:
1. Обозначьте валентность углерода в органических соединениях:
2. Обозначьте гомологическую разницу в гомологическом ряду алканов:
3. Укажите молекулярную формулу метана:
4. Укажите возможные продукты горения метана:
5. Укажите свойства, характерные метану:
д) хорошая растворимость в воде.
6.Укажить возможные продукты при разложении метана:
а) водород молекулярный,
б) водород атоморный,
7. Характерной реакцией у метана является:
9. Укажите общую молекулярную формулу гомологческого ряда алканов:
10.Обозначьте соединения, с которыми реагирует метан:
11.Метан используют как сырье в процессах :
Источник
Как оформить формулы в научных работах
Формула — это символическая запись, представляющая собой математическое выражение, обозначение химического соединения (реакции) либо точное определение понятия или закона. В статье рассказываем, как оформляются формулы в научных работах.
Что такое формулы
Курсовые, дипломы, диссертации и другие виды научных и учебных текстов — это в большинстве случаев сложные исследовательские работы. Формулы позволяют в общей форме записать какие-либо равенства или взаимосвязь явлений.
Оформление формул регламентируется двумя ГОСТами:
В этих стандартах правила оформления относятся в целом к документам с научными исследованиями. Разделы, отвечающие за формулы, практически не отличаются по требованиям, но лучше уточнять в вузе или на кафедре, на какой из ГОСТов следует ориентироваться.
Нужна помощь в написании работы?
Написание учебной работы за 1 день от 100 рублей. Посмотрите отзывы наших клиентов и узнайте стоимость вашей работы.
Способы создания формул
Создание формул текстом
Простейшие формулы набираются как обычный текст.
Пример набора простой формулы как обычного текста
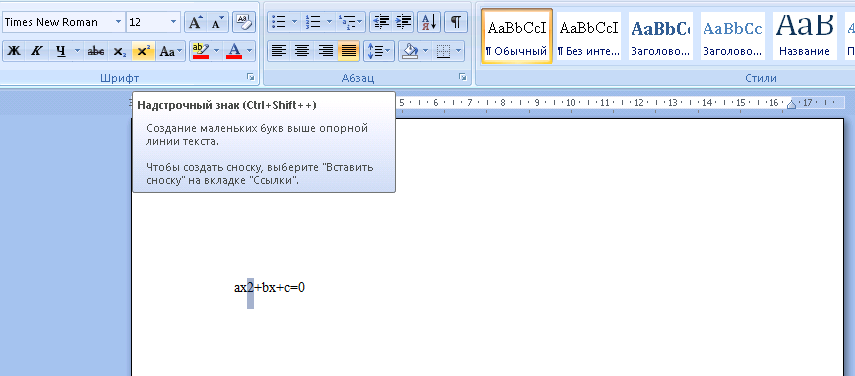
Возможности Word позволяют, к примеру, делать надстрочные и подстрочные символы.
Для этого символ выделяется, а затем нажимается формат “Надстрочный символ” в меню под выбором шрифта. Там же находится кнопка “Подстрочный символ”.
Оформление формулы с использованием надстрочного символа
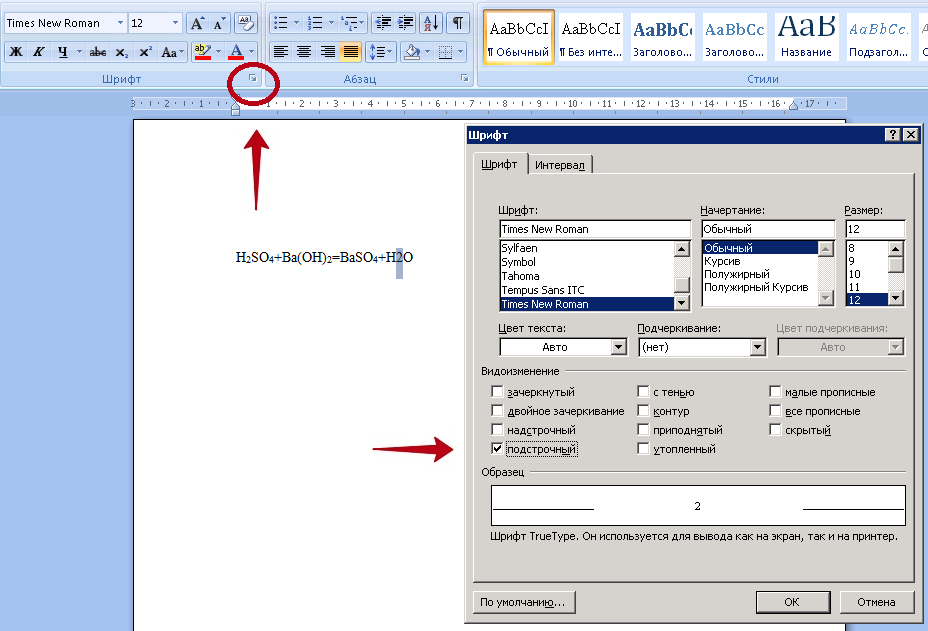
Если эти кнопки отсутствуют, можно сделать символ подстрочным или надстрочным через меню “Шрифт”.
Оформление формулы с использованием построчного символа
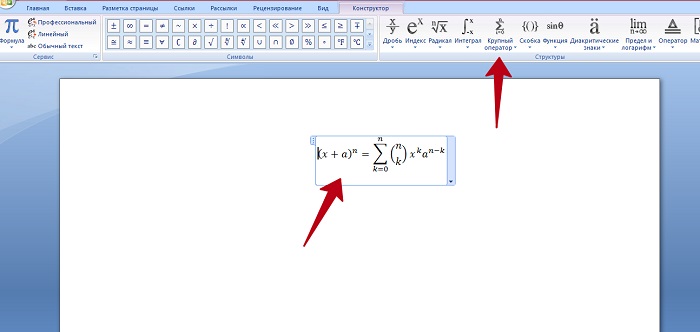
Создание формул в редакторе формул
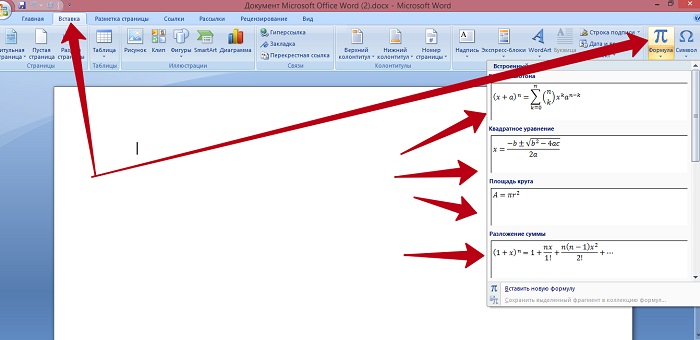
Встроенный редактор формул в Word позволяет использовать несколько готовых формул и создавать свои. Он запускается через меню “Вставка”.
Создание формул в редакторе формул
Затем выбирается готовая формула и при необходимости видоизменяется.
Выбор готовой формулы
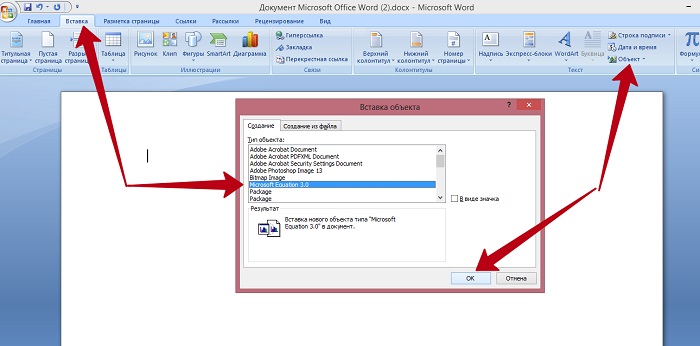
Создание формул в редакторе Microsoft Equation
Также есть возможность выбрать “Создать новую формулу” в редакторе Microsoft Equation, где она составляется с нуля.
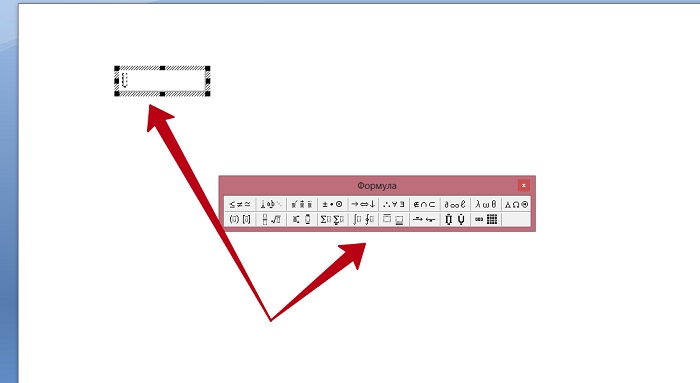
Пример работы в Microsoft Equation
После этого появляется поле для ввода формулы при помощи этого инструмента.
Создание новой формулы
Создание формул в виде изображений
В докладах или курсовых работах нередко используются скриншоты формул из учебников, если писать их вручную слишком сложно.
Иногда встречаются рукописные формулы, которые пишут на бумаге, сканируют и вставляют в документ как изображение. Например, так составляют формулы в рукописных версиях диссертаций.
Однако нельзя комбинировать в одной формуле напечатанные и написанные вручную символы.
Пример формулы в виде изображения
Общие правила оформления
Ссылки на формулы указываются в круглых скобках.
Пример оформления ссылок на формулы
Формула начинается на новой строчке, причем перед ней и после нее добавляется один отступ (пустая строка).
Пример оформления формул в тексте
Несколько формул подряд разделяются точкой с запятой, после завершающей ставится точка.
Пример оформления нескольких формул подряд
Правила переноса формул
Если формула занимает больше одной строки, ее придется перенести. После достижения предельной ширины страницы продолжение формулы автоматически опускается на строку вниз.
Чтобы перенос был правильным, его необходимо делать на математических знаках, причем на следующей строке знак нужно продублировать.
Поэтому для избежания автоматического переноса нажимается Enter в том месте формулы, где есть знак действия.
Пример переноса формулы с дублированным математическим знаком
Также перенос разрешен на знаке равенства.
Пример переноса на знаке равенства
Если в конце строки оказывается знак умножения, то он обязательно записывается крестиком, а не точкой.
Пример переноса на знаке умножения
В случае, когда в формуле присутствует большой числитель или знаменатель, его обозначают символом и расшифровывают сразу после формулы.
Пример оформления большого числителя
Правила нумерации формул
Формулы нумеруются арабскими цифрами, записанными в конце строки в круглых скобках.
Пример нумерации формул
Для высокой формулы номер размещают на уровне знака равенства и черты, разделяющей дробь.
Пример нумерации высокой формулы
В случае переноса формулы номер ставится на уровне окончания записи.
Пример нумерации при переносе формулы
Нумерацию, как правило, делают сквозной для всего документа, то есть (1), (2), (3) и т.д.
Пример сквозной нумерации
Также формулы могут нумероваться по разделам. В этом случае первая цифра — номер раздела, вторая — номер формулы.
Пример нумерации по разделам
В приложениях перед номером формулы добавляют букву, соответствующую приложению, а также точку. Например, в приложении Б шестая формула будет пронумерована как (Б.6).
Пример нумерации формулы в приложении
Обозначения и подписи к формулам
Подбор символов и знаков, которые используются в формуле, регламентируется нормативной базой дисциплины. К примеру, нельзя без особой необходимости обозначать объем как R, если в геометрии для таких случаев принято использовать букву V.
После формулы почти всегда требуются пояснения использованных символов. Переходом служит стандартное слово “где”. Все пояснения начинаются с новой строки и ставятся в том порядке, в котором символ появляется в формуле.
Пример пояснения использованный в формуле символов
Выводы
Формулы позволяют компактно выразить тождество или соотношение величин, поэтому всегда присутствуют во всех технических и многих гуманитарных документах.
Оформление формул в исследовательских и учебных работах регламентируется ГОСТами 7.32-2001 и 2.105-95.
Формулы можно создавать в Word, в специальных редакторах, вставлять в текст в виде изображений.
Умение корректно оформлять формулы пригодится каждому, кто составляет научные и студенческие работы. Также знание принципов оформления формул упрощает процесс чтения текстов, в которых они содержатся.
Источник
Как называется число которое пишется впереди перед формулами
2.Как называются вещества, состоящие из атомов одного вида?
3. Цвет фенолфталеина в щелочах?
4. Газ, поддерживающий горение?
5. Как называется наименьшая частица вещества, обуславливающая его свойства?
6. Объем одного моль газа?
7. Кто открыл закон сохранения массы веществ?
8. Газ, который используется для резки и сварки металлов?
9. Наименьшая неделимая частица элементов?
10. Самый распространенный элемент на Земле?
11. Как называются соли серной кислоты?
12.Кто открыл периодический закон?
13. Какого газа больше всего в составе атмосферы Земли?
14. Какая из кислот соленее серная или угольная?
15. Состав молекулы воды (формула воды)?
16. Какую валентность имеет кислород?
17. Формула азотной кислоты?
18. Самый легкий газ?
19. Как называется число, которое пишется впереди перед формулами?
20. Укажите бес кислотную кислоту: серная, соляная, азотная.
21. Вещества, изменяющие скорость химических реакций?
22. Сколько агрегатных состояний у воды?
23. Единица измерения количества вещества?
24. При какой температуре кипит чистая вода?
25. Газ, необходимый для дыхания?
28.Физические свойства алканов.
34.Взаимодействие с водой
41.Где используется пестициды?
42.Назовите виды пестицидов?
43.Как называются пестициды, используемые для удаления сорняковых растений?
44.Что такое инсектициды?
45. Почему пестициды не получили широкого распространения?
46.какие классы кислородсодержащих веществ вы изучили?
47.Какие органические вещества называются фенолами?
48. каковы физические свойства фенолов?
49. Расскажите о применении фенолов?
50.По каким признакам можно судить о наличии углерода?
51.Что образуется при нагревании оксида меди?
52.Как можно обнаружить отцепление галогена?
53.Почему водород образует воду голубого цвета?
54. От присутствия какого элемента пламя окрашивается в зелёный цвет?
55. Что знаешь о алкенах?
56. Физические свойства алкенов:
57.Химические свойства алкенов?
58. Строение алкенов
61.Какой качественной реакцией определяет ненасыщенные углеводороды? 62. Какая реакция называется полимеризацией?
63. Назовите общую формулу бензола?
69.на какие виды делятся химические связи?
70. Что мы, вообще, называем химией?
71. Разновидности ковалентной связи
73. Что мы называем металлической связью?
74.В чём сходство ковалентной связи с металлической?
75. Что такое диеновые углеводороды?
76. Назовите физические свойства диенов?
77.Что означает реакция полимеризация?
78.Перечислите представителей диенов?
79. Расскажите о значении хлорпрена?
80. Напишите общую формулу диенов?
81.Какова общая формула алканов?
82.Какова общая формула алкенов?
83.Назовите общую формулу алкадиенов?
84.Откуда происходит название «альдегид»?
85.Где применяется ацетон?
86. Какова общая формула альдегидов?
87.Что вы знаете о применении муравьиной и уксусной кислоты?
88.Что такое структурная формула?
89. Как пишется электронная формула?
90. Природные источники предельных углеводородов(метан)
91. Природный источник натурального каучука?
92. Стереорегулярная реакция
93. физические, химические свойства каучука?
94.Какие вещества называются спиртами?
95.Какие вещества называется простыми эфирами?
96. Что вы знаете о вредном воздействии метанола и эталона на организм человека?
97.Какме вещества относятся к многоатомным спиртам?
98. где применяется глицерин?
99.Чем отличается свойства фенолов от свойств спиртов?
100.Назовите отличительные химические свойства фенолов?
Источник
Теперь вы знаете какие однокоренные слова подходят к слову Как называется число которое пишется впереди перед формулами, а так же какой у него корень, приставка, суффикс и окончание. Вы можете дополнить список однокоренных слов к слову «Как называется число которое пишется впереди перед формулами», предложив свой вариант в комментариях ниже, а также выразить свое несогласие проведенным с морфемным разбором.
Тесты по химии с ответами.
В тестах всего 26 воросов. Дан вопрос и правильный ответ.
Тесты по школьной программе по химии
|
1 |
Жидкий метал? (Ртуть) |
|
|
2 |
Как называются вещества, состоящие из атомов одного вида? (Простые) |
|
|
3 |
Цвет фенолфталеина в щелочах? (Малиновый) |
|
|
4 |
Газ, поддерживающий горение? (Кислород) |
|
|
5 |
Как называется наименьшая частица вещества, обуславливающая его свойства? (Молекула) |
|
|
6 |
Объем одного моль газа? (22.4л) |
|
|
7 |
Кто открыл закон сохранения массы веществ? (Ломоносов) |
|
|
8 |
Газ, который используется для резки и сварки металлов? (Кислород) |
|
|
9 |
Наименьшая неделимая частица элементов? (Атом) |
|
|
10 |
Самый распространенный элемент на Земле? (Кислород) |
|
|
11 |
Как называются соли серной кислоты? (Сульфаты) |
|
|
12 |
Кто открыл периодический закон? (Менделеев) |
|
|
13 |
Какого газа больше всего в составе атмосферы Земли? (Азот) |
|
|
14 |
Какая из кислот солонее серная или угольная? (Серная) |
|
|
15 |
Состав молекулы воды (формула воды)? (Н2О) |
|
|
16 |
Какую валентность имеет кислород? (2) |
|
|
17 |
Формула азотной кислоты? (HNO-3) |
|
|
18 |
Самый легкий газ? (Водород) |
|
|
19 |
Как называется число, которое пишется впереди перед формулами? (Коэффициент) |
|
|
20 |
Укажите бескислотную кислоту: серная, соляная, азотная. (Соляная) |
|
|
21 |
Вещества, изменяющие скорость химических реакций? (Катализаторы) |
|
|
22 |
Сколько агрегатных состояний у воды? (Три) |
|
|
23 |
Единица измерения количества вещества? (Моль) |
|
|
24 |
При какой температуре кипит чистая вода? (100) |
|
|
25 |
Газ, необходимый для дыхания? (Кислород) |
|
|
26 |
Формула кислорода? (О-2) |
Тест по химии
І. Раскройте сущность периодического закона Д. И.Менделеева в свете теории строения атома.
1.Укажите название элемента образующего амфотерные соединения:
а) цинк,
б) фтор,
в) натрий.
2. Обозначьте элемент, который входит в состав главной подгруппы:
а) кальций,
б) железо,
в) медь,
г) ртуть.
3. Определите чило электронов, которое может содержаться на f – подуровне электронной оболочки:
а) 7,
б) 8,
в) 10,
г) 14.
4. Установите соответствие между числом электронов на внешнем энергетическом уровне и названием химического элемента:
а) 1, 1. калий,
б) 2, 2. хлор,
в) 3, 3. фосфор,
г) 5. 4. алюминий,
5. гелий.
5. Установите последовательность возрастания заряда ядра элементов:
а) калий,
б) натрий,
в) рубидий,
г) актиний.
6. Установите соответствие между символом элемента и его названием:
а)Al, 1.магний,
б) Na, 2. азот ( нитроген),
в) N, 3. ртуть,
г) Hg. 4. аллюминий,
5. натрий.
7.Обозначьте элемены, которые могут проявлять валентность II:
а) натрий,
б) кальций,
в) аллюминий.
г) магний,
д) багрий,
г) железо.
8. Обозначьте элемент второй группы:
а) литий,
б) углерод (карбон),
в) аллюминий,
г) барий.
9. Определите молекулярную массу соединение CaCo3:
а) 25,
б) 50,
в) 100.
г) 150.
10. Выберите характеристику состава молекулы простого вещества:
а) состоит из атомов одного вида,
б) состоит из атомов разного вида,
в) содержит только два атома.
г) содержит только один атом.
11. Укажите число протонов в ядре атома под номером 20:
а) 10,
б) 20.
в) 30. г) 40.
ІІ Метан. Охарактеризуйте строение молекул, свойства и применение.
1. Обозначьте валентность углерода в органических соединениях:
а) два,
б) три,
в) четыре,
г) пять.
2. Обозначьте гомологическую разницу в гомологическом ряду алканов:
а) СH2,
б) CH4,
в) СH,
г) СH3.
3. Укажите молекулярную формулу метана:
а) CH,
б) СH2,
в) СH3,
г) CH4.
4. Укажите возможные продукты горения метана:
а) кислород,
б) вода,
в) углекислый газ,
г) азот,
д) тепло,
г) озон.
5. Укажите свойства, характерные метану:
а) газообразный,
б) жидкость,
в) взрывоопасность,
г) легче воздуха,
д) хорошая растворимость в воде.
6.Укажить возможные продукты при разложении метана:
а) водород молекулярный,
б) водород атоморный,
в) сажа,
г) азот.
7. Характерной реакцией у метана является:
а) замещения,
б) присоединения,
в) обмена.
г)полимеризация.
8. По строению молекул метан является:
а) алкином,
б) алкеном,
в) алканом,
г) цикланам.
9. Укажите общую молекулярную формулу гомологческого ряда алканов:
а) Сu H2n+ 2,
б) Сu H2n – 2бб
в) Сu H2n,
г) Сu H2n – 4.
10.Обозначьте соединения, с которыми реагирует метан:
а) этан,
б) хлор,
в) вода,
г) медь.
11.Метан используют как сырье в процессах :
а) окисления,
б) восстановления,
в) полимеризации,
г) синтеза новіх веществ,
д) топлива.