Not to be confused with Aragon.
 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Argon | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Pronunciation | (AR-gon) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Appearance | colorless gas exhibiting a lilac/violet glow when placed in an electric field | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Standard atomic weight Ar°(Ar) |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Argon in the periodic table | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic number (Z) | 18 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Group | group 18 (noble gases) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Period | period 3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Block | p-block | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electron configuration | [Ne] 3s2 3p6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrons per shell | 2, 8, 8 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physical properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase at STP | gas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Melting point | 83.81 K (−189.34 °C, −308.81 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Boiling point | 87.302 K (−185.848 °C, −302.526 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Density (at STP) | 1.784 g/L | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| when liquid (at b.p.) | 1.3954 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Triple point | 83.8058 K, 68.89 kPa[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Critical point | 150.687 K, 4.863 MPa[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of fusion | 1.18 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of vaporization | 6.53 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar heat capacity | 20.85[3] J/(mol·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Vapor pressure
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidation states | 0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegativity | Pauling scale: no data | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ionization energies |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Covalent radius | 106±10 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waals radius | 188 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
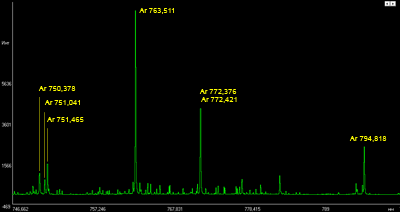
Spectral lines of argon |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Other properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Natural occurrence | primordial | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | face-centered cubic (fcc)
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Speed of sound | 323 m/s (gas, at 27 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermal conductivity | 17.72×10−3 W/(m⋅K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetic ordering | diamagnetic[4] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar magnetic susceptibility | −19.6×10−6 cm3/mol[5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS Number | 7440-37-1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| History | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Discovery and first isolation | Lord Rayleigh and William Ramsay (1894) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Main isotopes of argon
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| references |
Argon is a chemical element with the symbol Ar and atomic number 18. It is in group 18 of the periodic table and is a noble gas.[6] Argon is the third-most abundant gas in Earth’s atmosphere, at 0.934% (9340 ppmv). It is more than twice as abundant as water vapor (which averages about 4000 ppmv, but varies greatly), 23 times as abundant as carbon dioxide (400 ppmv), and more than 500 times as abundant as neon (18 ppmv). Argon is the most abundant noble gas in Earth’s crust, comprising 0.00015% of the crust.
Nearly all of the argon in Earth’s atmosphere is radiogenic argon-40, derived from the decay of potassium-40 in Earth’s crust. In the universe, argon-36 is by far the most common argon isotope, as it is the most easily produced by stellar nucleosynthesis in supernovas.
The name «argon» is derived from the Greek word ἀργόν, neuter singular form of ἀργός meaning ‘lazy’ or ‘inactive’, as a reference to the fact that the element undergoes almost no chemical reactions. The complete octet (eight electrons) in the outer atomic shell makes argon stable and resistant to bonding with other elements. Its triple point temperature of 83.8058 K is a defining fixed point in the International Temperature Scale of 1990.
Argon is extracted industrially by the fractional distillation of liquid air. Argon is mostly used as an inert shielding gas in welding and other high-temperature industrial processes where ordinarily unreactive substances become reactive; for example, an argon atmosphere is used in graphite electric furnaces to prevent the graphite from burning. Argon is also used in incandescent, fluorescent lighting, and other gas-discharge tubes. Argon makes a distinctive blue-green gas laser. Argon is also used in fluorescent glow starters.
Characteristics
A small piece of rapidly melting solid argon
Argon has approximately the same solubility in water as oxygen and is 2.5 times more soluble in water than nitrogen. Argon is colorless, odorless, nonflammable and nontoxic as a solid, liquid or gas.[7] Argon is chemically inert under most conditions and forms no confirmed stable compounds at room temperature.
Although argon is a noble gas, it can form some compounds under various extreme conditions. Argon fluorohydride (HArF), a compound of argon with fluorine and hydrogen that is stable below 17 K (−256.1 °C; −429.1 °F), has been demonstrated.[8][9] Although the neutral ground-state chemical compounds of argon are presently limited to HArF, argon can form clathrates with water when atoms of argon are trapped in a lattice of water molecules.[10] Ions, such as ArH+
, and excited-state complexes, such as ArF, have been demonstrated. Theoretical calculation predicts several more argon compounds that should be stable[11] but have not yet been synthesized.
History
A: test-tube, B: dilute alkali, C: U-shaped glass tube, D: platinum electrode
Argon (Greek ἀργόν, neuter singular form of ἀργός meaning «lazy» or «inactive») is named in reference to its chemical inactivity. This chemical property of this first noble gas to be discovered impressed the namers.[12][13] An unreactive gas was suspected to be a component of air by Henry Cavendish in 1785.[14]
Argon was first isolated from air in 1894 by Lord Rayleigh and Sir William Ramsay at University College London by removing oxygen, carbon dioxide, water, and nitrogen from a sample of clean air.[15][16][17] They first accomplished this by replicating an experiment of Henry Cavendish’s. They trapped a mixture of atmospheric air with additional oxygen in a test-tube (A) upside-down over a large quantity of dilute alkali solution (B), which in Cavendish’s original experiment was potassium hydroxide,[14] and conveyed a current through wires insulated by U-shaped glass tubes (CC) which sealed around the platinum wire electrodes, leaving the ends of the wires (DD) exposed to the gas and insulated from the alkali solution. The arc was powered by a battery of five Grove cells and a Ruhmkorff coil of medium size. The alkali absorbed the oxides of nitrogen produced by the arc and also carbon dioxide. They operated the arc until no more reduction of volume of the gas could be seen for at least an hour or two and the spectral lines of nitrogen disappeared when the gas was examined. The remaining oxygen was reacted with alkaline pyrogallate to leave behind an apparently non-reactive gas which they called argon.
Before isolating the gas, they had determined that nitrogen produced from chemical compounds was 0.5% lighter than nitrogen from the atmosphere. The difference was slight, but it was important enough to attract their attention for many months. They concluded that there was another gas in the air mixed in with the nitrogen.[18] Argon was also encountered in 1882 through independent research of H. F. Newall and W. N. Hartley.[19] Each observed new lines in the emission spectrum of air that did not match known elements.
Until 1957, the symbol for argon was «A», but now it is «Ar».[20]
Occurrence
Argon constitutes 0.934% by volume and 1.288% by mass of Earth’s atmosphere.[21] Air is the primary industrial source of purified argon products. Argon is isolated from air by fractionation, most commonly by cryogenic fractional distillation, a process that also produces purified nitrogen, oxygen, neon, krypton and xenon.[22] Earth’s crust and seawater contain 1.2 ppm and 0.45 ppm of argon, respectively.[23]
Isotopes
The main isotopes of argon found on Earth are 40
Ar (99.6%), 36
Ar (0.34%), and 38
Ar (0.06%). Naturally occurring 40
K, with a half-life of 1.25×109 years, decays to stable 40
Ar (11.2%) by electron capture or positron emission, and also to stable 40
Ca (88.8%) by beta decay. These properties and ratios are used to determine the age of rocks by K–Ar dating.[23][24]
In Earth’s atmosphere, 39
Ar is made by cosmic ray activity, primarily by neutron capture of 40
Ar followed by two-neutron emission. In the subsurface environment, it is also produced through neutron capture by 39
K, followed by proton emission. 37
Ar is created from the neutron capture by 40
Ca followed by an alpha particle emission as a result of subsurface nuclear explosions. It has a half-life of 35 days.[24]
Between locations in the Solar System, the isotopic composition of argon varies greatly. Where the major source of argon is the decay of 40
K in rocks, 40
Ar will be the dominant isotope, as it is on Earth. Argon produced directly by stellar nucleosynthesis is dominated by the alpha-process nuclide 36
Ar. Correspondingly, solar argon contains 84.6% 36
Ar (according to solar wind measurements),[25] and the ratio of the three isotopes 36Ar : 38Ar : 40Ar in the atmospheres of the outer planets is 8400 : 1600 : 1.[26] This contrasts with the low abundance of primordial 36
Ar in Earth’s atmosphere, which is only 31.5 ppmv (= 9340 ppmv × 0.337%), comparable with that of neon (18.18 ppmv) on Earth and with interplanetary gasses, measured by probes.
The atmospheres of Mars, Mercury and Titan (the largest moon of Saturn) contain argon, predominantly as 40
Ar, and its content may be as high as 1.93% (Mars).[27]
The predominance of radiogenic 40
Ar is the reason the standard atomic weight of terrestrial argon is greater than that of the next element, potassium, a fact that was puzzling when argon was discovered. Mendeleev positioned the elements on his periodic table in order of atomic weight, but the inertness of argon suggested a placement before the reactive alkali metal. Henry Moseley later solved this problem by showing that the periodic table is actually arranged in order of atomic number (see History of the periodic table).
Compounds
Argon’s complete octet of electrons indicates full s and p subshells. This full valence shell makes argon very stable and extremely resistant to bonding with other elements. Before 1962, argon and the other noble gases were considered to be chemically inert and unable to form compounds; however, compounds of the heavier noble gases have since been synthesized. The first argon compound with tungsten pentacarbonyl, W(CO)5Ar, was isolated in 1975. However, it was not widely recognised at that time.[28] In August 2000, another argon compound, argon fluorohydride (HArF), was formed by researchers at the University of Helsinki, by shining ultraviolet light onto frozen argon containing a small amount of hydrogen fluoride with caesium iodide. This discovery caused the recognition that argon could form weakly bound compounds, even though it was not the first.[9][29][30] It is stable up to 17 kelvins (−256 °C). The metastable ArCF2+
2 dication, which is valence-isoelectronic with carbonyl fluoride and phosgene, was observed in 2010.[31] Argon-36, in the form of argon hydride (argonium) ions, has been detected in interstellar medium associated with the Crab Nebula supernova; this was the first noble-gas molecule detected in outer space.[32][33]
Solid argon hydride (Ar(H2)2) has the same crystal structure as the MgZn2 Laves phase. It forms at pressures between 4.3 and 220 GPa, though Raman measurements suggest that the H2 molecules in Ar(H2)2 dissociate above 175 GPa.[34]
Production
Industrial
Argon is extracted industrially by the fractional distillation of liquid air in a cryogenic air separation unit; a process that separates liquid nitrogen, which boils at 77.3 K, from argon, which boils at 87.3 K, and liquid oxygen, which boils at 90.2 K. About 700,000 tonnes of argon are produced worldwide every year.[23][35]
In radioactive decays
40Ar, the most abundant isotope of argon, is produced by the decay of 40K with a half-life of 1.25×109 years by electron capture or positron emission. Because of this, it is used in potassium–argon dating to determine the age of rocks.
Applications
Cylinders containing argon gas for use in extinguishing fire without damaging server equipment
Argon has several desirable properties:
- Argon is a chemically inert gas.
- Argon is the cheapest alternative when nitrogen is not sufficiently inert.
- Argon has low thermal conductivity.
- Argon has electronic properties (ionization and/or the emission spectrum) desirable for some applications.
Other noble gases would be equally suitable for most of these applications, but argon is by far the cheapest. Argon is inexpensive, since it occurs naturally in air and is readily obtained as a byproduct of cryogenic air separation in the production of liquid oxygen and liquid nitrogen: the primary constituents of air are used on a large industrial scale. The other noble gases (except helium) are produced this way as well, but argon is the most plentiful by far. The bulk of argon applications arise simply because it is inert and relatively cheap.
Industrial processes
Argon is used in some high-temperature industrial processes where ordinarily non-reactive substances become reactive. For example, an argon atmosphere is used in graphite electric furnaces to prevent the graphite from burning.
For some of these processes, the presence of nitrogen or oxygen gases might cause defects within the material. Argon is used in some types of arc welding such as gas metal arc welding and gas tungsten arc welding, as well as in the processing of titanium and other reactive elements. An argon atmosphere is also used for growing crystals of silicon and germanium.
Argon is used in the poultry industry to asphyxiate birds, either for mass culling following disease outbreaks, or as a means of slaughter more humane than electric stunning. Argon is denser than air and displaces oxygen close to the ground during inert gas asphyxiation.[36][37] Its non-reactive nature makes it suitable in a food product, and since it replaces oxygen within the dead bird, argon also enhances shelf life.[38]
Argon is sometimes used for extinguishing fires where valuable equipment may be damaged by water or foam.[39]
Scientific research
Liquid argon is used as the target for neutrino experiments and direct dark matter searches. The interaction between the hypothetical WIMPs and an argon nucleus produces scintillation light that is detected by photomultiplier tubes. Two-phase detectors containing argon gas are used to detect the ionized electrons produced during the WIMP–nucleus scattering. As with most other liquefied noble gases, argon has a high scintillation light yield (about 51 photons/keV[40]), is transparent to its own scintillation light, and is relatively easy to purify. Compared to xenon, argon is cheaper and has a distinct scintillation time profile, which allows the separation of electronic recoils from nuclear recoils. On the other hand, its intrinsic beta-ray background is larger due to 39
Ar contamination, unless one uses argon from underground sources, which has much less 39
Ar contamination. Most of the argon in Earth’s atmosphere was produced by electron capture of long-lived 40
K (40
K + e− → 40
Ar + ν) present in natural potassium within Earth. The 39
Ar activity in the atmosphere is maintained by cosmogenic production through the knockout reaction 40
Ar(n,2n)39
Ar and similar reactions. The half-life of 39
Ar is only 269 years. As a result, the underground Ar, shielded by rock and water, has much less 39
Ar contamination.[41] Dark-matter detectors currently operating with liquid argon include DarkSide, WArP, ArDM, microCLEAN and DEAP. Neutrino experiments include ICARUS and MicroBooNE, both of which use high-purity liquid argon in a time projection chamber for fine grained three-dimensional imaging of neutrino interactions.
At Linköping University, Sweden, the inert gas is being utilized in a vacuum chamber in which plasma is introduced to ionize metallic films.[42] This process results in a film usable for manufacturing computer processors. The new process would eliminate the need for chemical baths and use of expensive, dangerous and rare materials.
Preservative
A sample of caesium is packed under argon to avoid reactions with air
Argon is used to displace oxygen- and moisture-containing air in packaging material to extend the shelf-lives of the contents (argon has the European food additive code E938). Aerial oxidation, hydrolysis, and other chemical reactions that degrade the products are retarded or prevented entirely. High-purity chemicals and pharmaceuticals are sometimes packed and sealed in argon.[43]
In winemaking, argon is used in a variety of activities to provide a barrier against oxygen at the liquid surface, which can spoil wine by fueling both microbial metabolism (as with acetic acid bacteria) and standard redox chemistry.
Argon is sometimes used as the propellant in aerosol cans.
Argon is also used as a preservative for such products as varnish, polyurethane, and paint, by displacing air to prepare a container for storage.[44]
Since 2002, the American National Archives stores important national documents such as the Declaration of Independence and the Constitution within argon-filled cases to inhibit their degradation. Argon is preferable to the helium that had been used in the preceding five decades, because helium gas escapes through the intermolecular pores in most containers and must be regularly replaced.[45]
Laboratory equipment
Gloveboxes are often filled with argon, which recirculates over scrubbers to maintain an oxygen-, nitrogen-, and moisture-free atmosphere
Argon may be used as the inert gas within Schlenk lines and gloveboxes. Argon is preferred to less expensive nitrogen in cases where nitrogen may react with the reagents or apparatus.
Argon may be used as the carrier gas in gas chromatography and in electrospray ionization mass spectrometry; it is the gas of choice for the plasma used in ICP spectroscopy. Argon is preferred for the sputter coating of specimens for scanning electron microscopy. Argon gas is also commonly used for sputter deposition of thin films as in microelectronics and for wafer cleaning in microfabrication.
Medical use
Cryosurgery procedures such as cryoablation use liquid argon to destroy tissue such as cancer cells. It is used in a procedure called «argon-enhanced coagulation», a form of argon plasma beam electrosurgery. The procedure carries a risk of producing gas embolism and has resulted in the death of at least one patient.[46]
Blue argon lasers are used in surgery to weld arteries, destroy tumors, and correct eye defects.[23]
Argon has also been used experimentally to replace nitrogen in the breathing or decompression mix known as Argox, to speed the elimination of dissolved nitrogen from the blood.[47]
Lighting
Incandescent lights are filled with argon, to preserve the filaments at high temperature from oxidation. It is used for the specific way it ionizes and emits light, such as in plasma globes and calorimetry in experimental particle physics. Gas-discharge lamps filled with pure argon provide lilac/violet light; with argon and some mercury, blue light. Argon is also used for blue and green argon-ion lasers.
Miscellaneous uses
Argon is used for thermal insulation in energy-efficient windows.[48] Argon is also used in technical scuba diving to inflate a dry suit because it is inert and has low thermal conductivity.[49]
Argon is used as a propellant in the development of the Variable Specific Impulse Magnetoplasma Rocket (VASIMR). Compressed argon gas is allowed to expand, to cool the seeker heads of some versions of the AIM-9 Sidewinder missile and other missiles that use cooled thermal seeker heads. The gas is stored at high pressure.[50]
Argon-39, with a half-life of 269 years, has been used for a number of applications, primarily ice core and ground water dating. Also, potassium–argon dating and related argon-argon dating are used to date sedimentary, metamorphic, and igneous rocks.[23]
Argon has been used by athletes as a doping agent to simulate hypoxic conditions. In 2014, the World Anti-Doping Agency (WADA) added argon and xenon to the list of prohibited substances and methods, although at this time there is no reliable test for abuse.[51]
Safety
Although argon is non-toxic, it is 38% more dense than air and therefore considered a dangerous asphyxiant in closed areas. It is difficult to detect because it is colorless, odorless, and tasteless. A 1994 incident, in which a man was asphyxiated after entering an argon-filled section of oil pipe under construction in Alaska, highlights the dangers of argon tank leakage in confined spaces and emphasizes the need for proper use, storage and handling.[52]
See also
- Industrial gas
- Oxygen–argon ratio, a ratio of two physically similar gases, which has importance in various sectors.
References
- ^ «Standard Atomic Weights: Argon». CIAAW. 2017.
- ^ a b Haynes, William M., ed. (2011). CRC Handbook of Chemistry and Physics (92nd ed.). Boca Raton, FL: CRC Press. p. 4.121. ISBN 1-4398-5511-0.
- ^ Shuen-Chen Hwang, Robert D. Lein, Daniel A. Morgan (2005). «Noble Gases». Kirk Othmer Encyclopedia of Chemical Technology. Wiley. pp. 343–383. doi:10.1002/0471238961.0701190508230114.a01.
- ^ Magnetic susceptibility of the elements and inorganic compounds, in Lide, D. R., ed. (2005). CRC Handbook of Chemistry and Physics (86th ed.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ^ Weast, Robert (1984). CRC, Handbook of Chemistry and Physics. Boca Raton, Florida: Chemical Rubber Company Publishing. pp. E110. ISBN 0-8493-0464-4.
- ^ In older versions of the periodic table, the noble gases were identified as Group VIIIA or as Group 0. See Group (periodic table).
- ^ «Material Safety Data Sheet Gaseous Argon». UIGI.com. Universal Industrial Gases, Inc. Retrieved 14 October 2013.
- ^
- ^ a b
Perkins, S. (26 August 2000). «HArF! Argon’s not so noble after all – researchers make argon fluorohydride». Science News. - ^
Belosludov, V. R.; Subbotin, O. S.; Krupskii, D. S.; Prokuda, O. V.; et al. (2006). «Microscopic model of clathrate compounds». Journal of Physics: Conference Series. 29 (1): 1–7. Bibcode:2006JPhCS..29….1B. doi:10.1088/1742-6596/29/1/001. - ^
Cohen, A.; Lundell, J.; Gerber, R. B. (2003). «First compounds with argon–carbon and argon–silicon chemical bonds». Journal of Chemical Physics. 119 (13): 6415. Bibcode:2003JChPh.119.6415C. doi:10.1063/1.1613631. S2CID 95850840. - ^
Hiebert, E. N. (1963). «In Noble-Gas Compounds». In Hyman, H. H. (ed.). Historical Remarks on the Discovery of Argon: The First Noble Gas. University of Chicago Press. pp. 3–20. - ^
Travers, M. W. (1928). The Discovery of the Rare Gases. Edward Arnold & Co. pp. 1–7. - ^ a b Cavendish, Henry (1785). «Experiments on Air». Philosophical Transactions of the Royal Society. 75: 372–384. Bibcode:1785RSPT…75..372C. doi:10.1098/rstl.1785.0023.
- ^
Lord Rayleigh; Ramsay, William (1894–1895). «Argon, a New Constituent of the Atmosphere». Proceedings of the Royal Society. 57 (1): 265–287. doi:10.1098/rspl.1894.0149. JSTOR 115394. - ^
Lord Rayleigh; Ramsay, William (1895). «VI. Argon: A New Constituent of the Atmosphere». Philosophical Transactions of the Royal Society A. 186: 187–241. Bibcode:1895RSPTA.186..187R. doi:10.1098/rsta.1895.0006. JSTOR 90645. - ^
Ramsay, W. (1904). «Nobel Lecture». The Nobel Foundation. - ^
«About Argon, the Inert; The New Element Supposedly Found in the Atmosphere». The New York Times. 3 March 1895. Retrieved 1 February 2009. - ^ Emsley, John (2003). Nature’s Building Blocks: An A-Z Guide to the Elements. Oxford University Press. p. 36. ISBN 0198503407. Retrieved 12 June 2020.
- ^
Holden, N. E. (12 March 2004). «History of the Origin of the Chemical Elements and Their Discoverers». National Nuclear Data Center. - ^
«Argon (Ar)». Encyclopædia Britannica. Retrieved 14 January 2014. - ^
«Argon, Ar». Etacude.com. Archived from the original on 7 October 2008. Retrieved 8 March 2007.{{cite web}}: CS1 maint: bot: original URL status unknown (link) - ^ a b c d e Emsley, J. (2001). Nature’s Building Blocks. Oxford University Press. pp. 44–45. ISBN 978-0-19-960563-7.
- ^ a b
«40Ar/39Ar dating and errors». Archived from the original on 9 May 2007. Retrieved 7 March 2007. - ^
Lodders, K. (2008). «The solar argon abundance». Astrophysical Journal. 674 (1): 607–611. arXiv:0710.4523. Bibcode:2008ApJ…674..607L. doi:10.1086/524725. S2CID 59150678. - ^ Cameron, A. G. W. (1973). «Elemental and isotopic abundances of the volatile elements in the outer planets». Space Science Reviews. 14 (3–4): 392–400. Bibcode:1973SSRv…14..392C. doi:10.1007/BF00214750. S2CID 119861943.
- ^ Mahaffy, P. R.; Webster, C. R.; Atreya, S. K.; Franz, H.; Wong, M.; Conrad, P. G.; Harpold, D.; Jones, J. J.; Leshin, L. A.; Manning, H.; Owen, T.; Pepin, R. O.; Squyres, S.; Trainer, M.; Kemppinen, O.; Bridges, N.; Johnson, J. R.; Minitti, M.; Cremers, D.; Bell, J. F.; Edgar, L.; Farmer, J.; Godber, A.; Wadhwa, M.; Wellington, D.; McEwan, I.; Newman, C.; Richardson, M.; Charpentier, A.; et al. (2013). «Abundance and Isotopic Composition of Gases in the Martian Atmosphere from the Curiosity Rover». Science. 341 (6143): 263–6. Bibcode:2013Sci…341..263M. doi:10.1126/science.1237966. PMID 23869014. S2CID 206548973.
- ^ Young, Nigel A. (March 2013). «Main group coordination chemistry at low temperatures: A review of matrix isolated Group 12 to Group 18 complexes». Coordination Chemistry Reviews. 257 (5–6): 956–1010. doi:10.1016/j.ccr.2012.10.013.
- ^ Kean, Sam (2011). «Chemistry Way, Way Below Zero». The Disappearing Spoon. Black Bay Books.
- ^
Bartlett, Neil (8 September 2003). «The Noble Gases». Chemical & Engineering News. 81 (36): 32–34. doi:10.1021/cen-v081n036.p032. - ^
Lockyear, JF; Douglas, K; Price, SD; Karwowska, M; et al. (2010). «Generation of the ArCF22+ Dication». Journal of Physical Chemistry Letters. 1: 358. doi:10.1021/jz900274p. - ^
Barlow, M. J.; et al. (2013). «Detection of a Noble Gas Molecular Ion, 36ArH+, in the Crab Nebula». Science. 342 (6164): 1343–1345. arXiv:1312.4843. Bibcode:2013Sci…342.1343B. doi:10.1126/science.1243582. PMID 24337290. S2CID 37578581. - ^ Quenqua, Douglas (13 December 2013). «Noble Molecules Found in Space». The New York Times. Archived from the original on 1 January 2022. Retrieved 13 December 2013.
- ^ Kleppe, Annette K.; Amboage, Mónica; Jephcoat, Andrew P. (2014). «New high-pressure van der Waals compound Kr(H2)4 discovered in the krypton-hydrogen binary system». Scientific Reports. 4: 4989. Bibcode:2014NatSR…4E4989K. doi:10.1038/srep04989.
- ^
«Periodic Table of Elements: Argon – Ar». Environmentalchemistry.com. Retrieved 12 September 2008. - ^
Fletcher, D. L. «Slaughter Technology» (PDF). Symposium: Recent Advances in Poultry Slaughter Technology. Archived from the original (PDF) on 24 July 2011. Retrieved 1 January 2010. - ^ Shields, Sara J.; Raj, A. B. M. (2010). «A Critical Review of Electrical Water-Bath Stun Systems for Poultry Slaughter and Recent Developments in Alternative Technologies». Journal of Applied Animal Welfare Science. 13 (4): 281–299. CiteSeerX 10.1.1.680.5115. doi:10.1080/10888705.2010.507119. ISSN 1088-8705. PMID 20865613. S2CID 11301328.
- ^ Fraqueza, M. J.; Barreto, A. S. (2009). «The effect on turkey meat shelf life of modified-atmosphere packaging with an argon mixture». Poultry Science. 88 (9): 1991–1998. doi:10.3382/ps.2008-00239. ISSN 0032-5791. PMID 19687286.
- ^ Su, Joseph Z.; Kim, Andrew K.; Crampton, George P.; Liu, Zhigang (2001). «Fire Suppression with Inert Gas Agents». Journal of Fire Protection Engineering. 11 (2): 72–87. doi:10.1106/X21V-YQKU-PMKP-XGTP. ISSN 1042-3915.
- ^
Gastler, Dan; Kearns, Ed; Hime, Andrew; Stonehill, Laura C.; et al. (2012). «Measurement of scintillation efficiency for nuclear recoils in liquid argon». Physical Review C. 85 (6): 065811. arXiv:1004.0373. Bibcode:2012PhRvC..85f5811G. doi:10.1103/PhysRevC.85.065811. S2CID 6876533. - ^
Xu, J.; Calaprice, F.; Galbiati, C.; Goretti, A.; Guray, G.; et al. (26 April 2012). «A Study of the Residual 39
Ar Content in Argon from Underground Sources». Astroparticle Physics. 66 (2015): 53–60. arXiv:1204.6011. Bibcode:2015APh….66…53X. doi:10.1016/j.astropartphys.2015.01.002. S2CID 117711599. - ^ «Plasma electrons can be used to produce metallic films». Phys.org. 7 May 2020. Retrieved 8 May 2020.
- ^ Ilouga PE, Winkler D, Kirchhoff C, Schierholz B, Wölcke J (November 2007). «Investigation of 3 industry-wide applied storage conditions for compound libraries». Journal of Biomolecular Screening. 12 (1): 21–32. doi:10.1177/1087057106295507. PMID 17099243.
- ^ Zawalick, Steven Scott «Method for preserving an oxygen sensitive liquid product» U.S. Patent 6,629,402 Issue date: 7 October 2003.
- ^
«Schedule for Renovation of the National Archives Building». Retrieved 7 July 2009. - ^
«Fatal Gas Embolism Caused by Overpressurization during Laparoscopic Use of Argon Enhanced Coagulation». MDSR. 24 June 1994. - ^
Pilmanis Andrew A.; Balldin U. I.; Webb James T.; Krause K. M. (2003). «Staged decompression to 3.5 psi using argon–oxygen and 100% oxygen breathing mixtures». Aviation, Space, and Environmental Medicine. 74 (12): 1243–1250. PMID 14692466. - ^
«Energy-Efficient Windows». FineHomebuilding.com. February 1998. Retrieved 1 August 2009. - ^ Nuckols M. L.; Giblo J.; Wood-Putnam J. L. (15–18 September 2008). «Thermal Characteristics of Diving Garments When Using Argon as a Suit Inflation Gas». Proceedings of the Oceans 08 MTS/IEEE Quebec, Canada Meeting. Archived from the original on 21 July 2009. Retrieved 2 March 2009.
{{cite journal}}: CS1 maint: unfit URL (link) - ^ «Description of Aim-9 Operation». planken.org. Archived from the original on 22 December 2008. Retrieved 1 February 2009.
- ^ «WADA amends Section S.2.1 of 2014 Prohibited List». 31 August 2014. Archived from the original on 27 April 2021. Retrieved 1 September 2014.
- ^
Alaska FACE Investigation 94AK012 (23 June 1994). «Welder’s Helper Asphyxiated in Argon-Inerted Pipe – Alaska (FACE AK-94-012)». State of Alaska Department of Public Health. Retrieved 29 January 2011.
Further reading
- Brown, T. L.; Bursten, B. E.; LeMay, H. E. (2006). J. Challice; N. Folchetti (eds.). Chemistry: The Central Science (10th ed.). Pearson Education. pp. 276& 289. ISBN 978-0-13-109686-8.
- Lide, D. R. (2005). «Properties of the Elements and Inorganic Compounds; Melting, boiling, triple, and critical temperatures of the elements». CRC Handbook of Chemistry and Physics (86th ed.). CRC Press. §4. ISBN 978-0-8493-0486-6. On triple point pressure at 69 kPa.
- Preston-Thomas, H. (1990). «The International Temperature Scale of 1990 (ITS-90)». Metrologia. 27 (1): 3–10. Bibcode:1990Metro..27….3P. doi:10.1088/0026-1394/27/1/002. S2CID 250785635. On triple point pressure at 83.8058 K.
External links
- Argon at The Periodic Table of Videos (University of Nottingham)
- USGS Periodic Table – Argon
- Diving applications: Why Argon?
Not to be confused with Aragon.
 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Argon | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Pronunciation | (AR-gon) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Appearance | colorless gas exhibiting a lilac/violet glow when placed in an electric field | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Standard atomic weight Ar°(Ar) |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Argon in the periodic table | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic number (Z) | 18 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Group | group 18 (noble gases) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Period | period 3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Block | p-block | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electron configuration | [Ne] 3s2 3p6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrons per shell | 2, 8, 8 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physical properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase at STP | gas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Melting point | 83.81 K (−189.34 °C, −308.81 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Boiling point | 87.302 K (−185.848 °C, −302.526 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Density (at STP) | 1.784 g/L | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| when liquid (at b.p.) | 1.3954 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Triple point | 83.8058 K, 68.89 kPa[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Critical point | 150.687 K, 4.863 MPa[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of fusion | 1.18 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of vaporization | 6.53 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar heat capacity | 20.85[3] J/(mol·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Vapor pressure
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidation states | 0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegativity | Pauling scale: no data | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ionization energies |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Covalent radius | 106±10 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waals radius | 188 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Spectral lines of argon |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Other properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Natural occurrence | primordial | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | face-centered cubic (fcc)
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Speed of sound | 323 m/s (gas, at 27 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermal conductivity | 17.72×10−3 W/(m⋅K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetic ordering | diamagnetic[4] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar magnetic susceptibility | −19.6×10−6 cm3/mol[5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS Number | 7440-37-1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| History | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Discovery and first isolation | Lord Rayleigh and William Ramsay (1894) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Main isotopes of argon
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| references |
Argon is a chemical element with the symbol Ar and atomic number 18. It is in group 18 of the periodic table and is a noble gas.[6] Argon is the third-most abundant gas in Earth’s atmosphere, at 0.934% (9340 ppmv). It is more than twice as abundant as water vapor (which averages about 4000 ppmv, but varies greatly), 23 times as abundant as carbon dioxide (400 ppmv), and more than 500 times as abundant as neon (18 ppmv). Argon is the most abundant noble gas in Earth’s crust, comprising 0.00015% of the crust.
Nearly all of the argon in Earth’s atmosphere is radiogenic argon-40, derived from the decay of potassium-40 in Earth’s crust. In the universe, argon-36 is by far the most common argon isotope, as it is the most easily produced by stellar nucleosynthesis in supernovas.
The name «argon» is derived from the Greek word ἀργόν, neuter singular form of ἀργός meaning ‘lazy’ or ‘inactive’, as a reference to the fact that the element undergoes almost no chemical reactions. The complete octet (eight electrons) in the outer atomic shell makes argon stable and resistant to bonding with other elements. Its triple point temperature of 83.8058 K is a defining fixed point in the International Temperature Scale of 1990.
Argon is extracted industrially by the fractional distillation of liquid air. Argon is mostly used as an inert shielding gas in welding and other high-temperature industrial processes where ordinarily unreactive substances become reactive; for example, an argon atmosphere is used in graphite electric furnaces to prevent the graphite from burning. Argon is also used in incandescent, fluorescent lighting, and other gas-discharge tubes. Argon makes a distinctive blue-green gas laser. Argon is also used in fluorescent glow starters.
Characteristics
A small piece of rapidly melting solid argon
Argon has approximately the same solubility in water as oxygen and is 2.5 times more soluble in water than nitrogen. Argon is colorless, odorless, nonflammable and nontoxic as a solid, liquid or gas.[7] Argon is chemically inert under most conditions and forms no confirmed stable compounds at room temperature.
Although argon is a noble gas, it can form some compounds under various extreme conditions. Argon fluorohydride (HArF), a compound of argon with fluorine and hydrogen that is stable below 17 K (−256.1 °C; −429.1 °F), has been demonstrated.[8][9] Although the neutral ground-state chemical compounds of argon are presently limited to HArF, argon can form clathrates with water when atoms of argon are trapped in a lattice of water molecules.[10] Ions, such as ArH+
, and excited-state complexes, such as ArF, have been demonstrated. Theoretical calculation predicts several more argon compounds that should be stable[11] but have not yet been synthesized.
History
A: test-tube, B: dilute alkali, C: U-shaped glass tube, D: platinum electrode
Argon (Greek ἀργόν, neuter singular form of ἀργός meaning «lazy» or «inactive») is named in reference to its chemical inactivity. This chemical property of this first noble gas to be discovered impressed the namers.[12][13] An unreactive gas was suspected to be a component of air by Henry Cavendish in 1785.[14]
Argon was first isolated from air in 1894 by Lord Rayleigh and Sir William Ramsay at University College London by removing oxygen, carbon dioxide, water, and nitrogen from a sample of clean air.[15][16][17] They first accomplished this by replicating an experiment of Henry Cavendish’s. They trapped a mixture of atmospheric air with additional oxygen in a test-tube (A) upside-down over a large quantity of dilute alkali solution (B), which in Cavendish’s original experiment was potassium hydroxide,[14] and conveyed a current through wires insulated by U-shaped glass tubes (CC) which sealed around the platinum wire electrodes, leaving the ends of the wires (DD) exposed to the gas and insulated from the alkali solution. The arc was powered by a battery of five Grove cells and a Ruhmkorff coil of medium size. The alkali absorbed the oxides of nitrogen produced by the arc and also carbon dioxide. They operated the arc until no more reduction of volume of the gas could be seen for at least an hour or two and the spectral lines of nitrogen disappeared when the gas was examined. The remaining oxygen was reacted with alkaline pyrogallate to leave behind an apparently non-reactive gas which they called argon.
Before isolating the gas, they had determined that nitrogen produced from chemical compounds was 0.5% lighter than nitrogen from the atmosphere. The difference was slight, but it was important enough to attract their attention for many months. They concluded that there was another gas in the air mixed in with the nitrogen.[18] Argon was also encountered in 1882 through independent research of H. F. Newall and W. N. Hartley.[19] Each observed new lines in the emission spectrum of air that did not match known elements.
Until 1957, the symbol for argon was «A», but now it is «Ar».[20]
Occurrence
Argon constitutes 0.934% by volume and 1.288% by mass of Earth’s atmosphere.[21] Air is the primary industrial source of purified argon products. Argon is isolated from air by fractionation, most commonly by cryogenic fractional distillation, a process that also produces purified nitrogen, oxygen, neon, krypton and xenon.[22] Earth’s crust and seawater contain 1.2 ppm and 0.45 ppm of argon, respectively.[23]
Isotopes
The main isotopes of argon found on Earth are 40
Ar (99.6%), 36
Ar (0.34%), and 38
Ar (0.06%). Naturally occurring 40
K, with a half-life of 1.25×109 years, decays to stable 40
Ar (11.2%) by electron capture or positron emission, and also to stable 40
Ca (88.8%) by beta decay. These properties and ratios are used to determine the age of rocks by K–Ar dating.[23][24]
In Earth’s atmosphere, 39
Ar is made by cosmic ray activity, primarily by neutron capture of 40
Ar followed by two-neutron emission. In the subsurface environment, it is also produced through neutron capture by 39
K, followed by proton emission. 37
Ar is created from the neutron capture by 40
Ca followed by an alpha particle emission as a result of subsurface nuclear explosions. It has a half-life of 35 days.[24]
Between locations in the Solar System, the isotopic composition of argon varies greatly. Where the major source of argon is the decay of 40
K in rocks, 40
Ar will be the dominant isotope, as it is on Earth. Argon produced directly by stellar nucleosynthesis is dominated by the alpha-process nuclide 36
Ar. Correspondingly, solar argon contains 84.6% 36
Ar (according to solar wind measurements),[25] and the ratio of the three isotopes 36Ar : 38Ar : 40Ar in the atmospheres of the outer planets is 8400 : 1600 : 1.[26] This contrasts with the low abundance of primordial 36
Ar in Earth’s atmosphere, which is only 31.5 ppmv (= 9340 ppmv × 0.337%), comparable with that of neon (18.18 ppmv) on Earth and with interplanetary gasses, measured by probes.
The atmospheres of Mars, Mercury and Titan (the largest moon of Saturn) contain argon, predominantly as 40
Ar, and its content may be as high as 1.93% (Mars).[27]
The predominance of radiogenic 40
Ar is the reason the standard atomic weight of terrestrial argon is greater than that of the next element, potassium, a fact that was puzzling when argon was discovered. Mendeleev positioned the elements on his periodic table in order of atomic weight, but the inertness of argon suggested a placement before the reactive alkali metal. Henry Moseley later solved this problem by showing that the periodic table is actually arranged in order of atomic number (see History of the periodic table).
Compounds
Argon’s complete octet of electrons indicates full s and p subshells. This full valence shell makes argon very stable and extremely resistant to bonding with other elements. Before 1962, argon and the other noble gases were considered to be chemically inert and unable to form compounds; however, compounds of the heavier noble gases have since been synthesized. The first argon compound with tungsten pentacarbonyl, W(CO)5Ar, was isolated in 1975. However, it was not widely recognised at that time.[28] In August 2000, another argon compound, argon fluorohydride (HArF), was formed by researchers at the University of Helsinki, by shining ultraviolet light onto frozen argon containing a small amount of hydrogen fluoride with caesium iodide. This discovery caused the recognition that argon could form weakly bound compounds, even though it was not the first.[9][29][30] It is stable up to 17 kelvins (−256 °C). The metastable ArCF2+
2 dication, which is valence-isoelectronic with carbonyl fluoride and phosgene, was observed in 2010.[31] Argon-36, in the form of argon hydride (argonium) ions, has been detected in interstellar medium associated with the Crab Nebula supernova; this was the first noble-gas molecule detected in outer space.[32][33]
Solid argon hydride (Ar(H2)2) has the same crystal structure as the MgZn2 Laves phase. It forms at pressures between 4.3 and 220 GPa, though Raman measurements suggest that the H2 molecules in Ar(H2)2 dissociate above 175 GPa.[34]
Production
Industrial
Argon is extracted industrially by the fractional distillation of liquid air in a cryogenic air separation unit; a process that separates liquid nitrogen, which boils at 77.3 K, from argon, which boils at 87.3 K, and liquid oxygen, which boils at 90.2 K. About 700,000 tonnes of argon are produced worldwide every year.[23][35]
In radioactive decays
40Ar, the most abundant isotope of argon, is produced by the decay of 40K with a half-life of 1.25×109 years by electron capture or positron emission. Because of this, it is used in potassium–argon dating to determine the age of rocks.
Applications
Cylinders containing argon gas for use in extinguishing fire without damaging server equipment
Argon has several desirable properties:
- Argon is a chemically inert gas.
- Argon is the cheapest alternative when nitrogen is not sufficiently inert.
- Argon has low thermal conductivity.
- Argon has electronic properties (ionization and/or the emission spectrum) desirable for some applications.
Other noble gases would be equally suitable for most of these applications, but argon is by far the cheapest. Argon is inexpensive, since it occurs naturally in air and is readily obtained as a byproduct of cryogenic air separation in the production of liquid oxygen and liquid nitrogen: the primary constituents of air are used on a large industrial scale. The other noble gases (except helium) are produced this way as well, but argon is the most plentiful by far. The bulk of argon applications arise simply because it is inert and relatively cheap.
Industrial processes
Argon is used in some high-temperature industrial processes where ordinarily non-reactive substances become reactive. For example, an argon atmosphere is used in graphite electric furnaces to prevent the graphite from burning.
For some of these processes, the presence of nitrogen or oxygen gases might cause defects within the material. Argon is used in some types of arc welding such as gas metal arc welding and gas tungsten arc welding, as well as in the processing of titanium and other reactive elements. An argon atmosphere is also used for growing crystals of silicon and germanium.
Argon is used in the poultry industry to asphyxiate birds, either for mass culling following disease outbreaks, or as a means of slaughter more humane than electric stunning. Argon is denser than air and displaces oxygen close to the ground during inert gas asphyxiation.[36][37] Its non-reactive nature makes it suitable in a food product, and since it replaces oxygen within the dead bird, argon also enhances shelf life.[38]
Argon is sometimes used for extinguishing fires where valuable equipment may be damaged by water or foam.[39]
Scientific research
Liquid argon is used as the target for neutrino experiments and direct dark matter searches. The interaction between the hypothetical WIMPs and an argon nucleus produces scintillation light that is detected by photomultiplier tubes. Two-phase detectors containing argon gas are used to detect the ionized electrons produced during the WIMP–nucleus scattering. As with most other liquefied noble gases, argon has a high scintillation light yield (about 51 photons/keV[40]), is transparent to its own scintillation light, and is relatively easy to purify. Compared to xenon, argon is cheaper and has a distinct scintillation time profile, which allows the separation of electronic recoils from nuclear recoils. On the other hand, its intrinsic beta-ray background is larger due to 39
Ar contamination, unless one uses argon from underground sources, which has much less 39
Ar contamination. Most of the argon in Earth’s atmosphere was produced by electron capture of long-lived 40
K (40
K + e− → 40
Ar + ν) present in natural potassium within Earth. The 39
Ar activity in the atmosphere is maintained by cosmogenic production through the knockout reaction 40
Ar(n,2n)39
Ar and similar reactions. The half-life of 39
Ar is only 269 years. As a result, the underground Ar, shielded by rock and water, has much less 39
Ar contamination.[41] Dark-matter detectors currently operating with liquid argon include DarkSide, WArP, ArDM, microCLEAN and DEAP. Neutrino experiments include ICARUS and MicroBooNE, both of which use high-purity liquid argon in a time projection chamber for fine grained three-dimensional imaging of neutrino interactions.
At Linköping University, Sweden, the inert gas is being utilized in a vacuum chamber in which plasma is introduced to ionize metallic films.[42] This process results in a film usable for manufacturing computer processors. The new process would eliminate the need for chemical baths and use of expensive, dangerous and rare materials.
Preservative
A sample of caesium is packed under argon to avoid reactions with air
Argon is used to displace oxygen- and moisture-containing air in packaging material to extend the shelf-lives of the contents (argon has the European food additive code E938). Aerial oxidation, hydrolysis, and other chemical reactions that degrade the products are retarded or prevented entirely. High-purity chemicals and pharmaceuticals are sometimes packed and sealed in argon.[43]
In winemaking, argon is used in a variety of activities to provide a barrier against oxygen at the liquid surface, which can spoil wine by fueling both microbial metabolism (as with acetic acid bacteria) and standard redox chemistry.
Argon is sometimes used as the propellant in aerosol cans.
Argon is also used as a preservative for such products as varnish, polyurethane, and paint, by displacing air to prepare a container for storage.[44]
Since 2002, the American National Archives stores important national documents such as the Declaration of Independence and the Constitution within argon-filled cases to inhibit their degradation. Argon is preferable to the helium that had been used in the preceding five decades, because helium gas escapes through the intermolecular pores in most containers and must be regularly replaced.[45]
Laboratory equipment
Gloveboxes are often filled with argon, which recirculates over scrubbers to maintain an oxygen-, nitrogen-, and moisture-free atmosphere
Argon may be used as the inert gas within Schlenk lines and gloveboxes. Argon is preferred to less expensive nitrogen in cases where nitrogen may react with the reagents or apparatus.
Argon may be used as the carrier gas in gas chromatography and in electrospray ionization mass spectrometry; it is the gas of choice for the plasma used in ICP spectroscopy. Argon is preferred for the sputter coating of specimens for scanning electron microscopy. Argon gas is also commonly used for sputter deposition of thin films as in microelectronics and for wafer cleaning in microfabrication.
Medical use
Cryosurgery procedures such as cryoablation use liquid argon to destroy tissue such as cancer cells. It is used in a procedure called «argon-enhanced coagulation», a form of argon plasma beam electrosurgery. The procedure carries a risk of producing gas embolism and has resulted in the death of at least one patient.[46]
Blue argon lasers are used in surgery to weld arteries, destroy tumors, and correct eye defects.[23]
Argon has also been used experimentally to replace nitrogen in the breathing or decompression mix known as Argox, to speed the elimination of dissolved nitrogen from the blood.[47]
Lighting
Incandescent lights are filled with argon, to preserve the filaments at high temperature from oxidation. It is used for the specific way it ionizes and emits light, such as in plasma globes and calorimetry in experimental particle physics. Gas-discharge lamps filled with pure argon provide lilac/violet light; with argon and some mercury, blue light. Argon is also used for blue and green argon-ion lasers.
Miscellaneous uses
Argon is used for thermal insulation in energy-efficient windows.[48] Argon is also used in technical scuba diving to inflate a dry suit because it is inert and has low thermal conductivity.[49]
Argon is used as a propellant in the development of the Variable Specific Impulse Magnetoplasma Rocket (VASIMR). Compressed argon gas is allowed to expand, to cool the seeker heads of some versions of the AIM-9 Sidewinder missile and other missiles that use cooled thermal seeker heads. The gas is stored at high pressure.[50]
Argon-39, with a half-life of 269 years, has been used for a number of applications, primarily ice core and ground water dating. Also, potassium–argon dating and related argon-argon dating are used to date sedimentary, metamorphic, and igneous rocks.[23]
Argon has been used by athletes as a doping agent to simulate hypoxic conditions. In 2014, the World Anti-Doping Agency (WADA) added argon and xenon to the list of prohibited substances and methods, although at this time there is no reliable test for abuse.[51]
Safety
Although argon is non-toxic, it is 38% more dense than air and therefore considered a dangerous asphyxiant in closed areas. It is difficult to detect because it is colorless, odorless, and tasteless. A 1994 incident, in which a man was asphyxiated after entering an argon-filled section of oil pipe under construction in Alaska, highlights the dangers of argon tank leakage in confined spaces and emphasizes the need for proper use, storage and handling.[52]
See also
- Industrial gas
- Oxygen–argon ratio, a ratio of two physically similar gases, which has importance in various sectors.
References
- ^ «Standard Atomic Weights: Argon». CIAAW. 2017.
- ^ a b Haynes, William M., ed. (2011). CRC Handbook of Chemistry and Physics (92nd ed.). Boca Raton, FL: CRC Press. p. 4.121. ISBN 1-4398-5511-0.
- ^ Shuen-Chen Hwang, Robert D. Lein, Daniel A. Morgan (2005). «Noble Gases». Kirk Othmer Encyclopedia of Chemical Technology. Wiley. pp. 343–383. doi:10.1002/0471238961.0701190508230114.a01.
- ^ Magnetic susceptibility of the elements and inorganic compounds, in Lide, D. R., ed. (2005). CRC Handbook of Chemistry and Physics (86th ed.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ^ Weast, Robert (1984). CRC, Handbook of Chemistry and Physics. Boca Raton, Florida: Chemical Rubber Company Publishing. pp. E110. ISBN 0-8493-0464-4.
- ^ In older versions of the periodic table, the noble gases were identified as Group VIIIA or as Group 0. See Group (periodic table).
- ^ «Material Safety Data Sheet Gaseous Argon». UIGI.com. Universal Industrial Gases, Inc. Retrieved 14 October 2013.
- ^
- ^ a b
Perkins, S. (26 August 2000). «HArF! Argon’s not so noble after all – researchers make argon fluorohydride». Science News. - ^
Belosludov, V. R.; Subbotin, O. S.; Krupskii, D. S.; Prokuda, O. V.; et al. (2006). «Microscopic model of clathrate compounds». Journal of Physics: Conference Series. 29 (1): 1–7. Bibcode:2006JPhCS..29….1B. doi:10.1088/1742-6596/29/1/001. - ^
Cohen, A.; Lundell, J.; Gerber, R. B. (2003). «First compounds with argon–carbon and argon–silicon chemical bonds». Journal of Chemical Physics. 119 (13): 6415. Bibcode:2003JChPh.119.6415C. doi:10.1063/1.1613631. S2CID 95850840. - ^
Hiebert, E. N. (1963). «In Noble-Gas Compounds». In Hyman, H. H. (ed.). Historical Remarks on the Discovery of Argon: The First Noble Gas. University of Chicago Press. pp. 3–20. - ^
Travers, M. W. (1928). The Discovery of the Rare Gases. Edward Arnold & Co. pp. 1–7. - ^ a b Cavendish, Henry (1785). «Experiments on Air». Philosophical Transactions of the Royal Society. 75: 372–384. Bibcode:1785RSPT…75..372C. doi:10.1098/rstl.1785.0023.
- ^
Lord Rayleigh; Ramsay, William (1894–1895). «Argon, a New Constituent of the Atmosphere». Proceedings of the Royal Society. 57 (1): 265–287. doi:10.1098/rspl.1894.0149. JSTOR 115394. - ^
Lord Rayleigh; Ramsay, William (1895). «VI. Argon: A New Constituent of the Atmosphere». Philosophical Transactions of the Royal Society A. 186: 187–241. Bibcode:1895RSPTA.186..187R. doi:10.1098/rsta.1895.0006. JSTOR 90645. - ^
Ramsay, W. (1904). «Nobel Lecture». The Nobel Foundation. - ^
«About Argon, the Inert; The New Element Supposedly Found in the Atmosphere». The New York Times. 3 March 1895. Retrieved 1 February 2009. - ^ Emsley, John (2003). Nature’s Building Blocks: An A-Z Guide to the Elements. Oxford University Press. p. 36. ISBN 0198503407. Retrieved 12 June 2020.
- ^
Holden, N. E. (12 March 2004). «History of the Origin of the Chemical Elements and Their Discoverers». National Nuclear Data Center. - ^
«Argon (Ar)». Encyclopædia Britannica. Retrieved 14 January 2014. - ^
«Argon, Ar». Etacude.com. Archived from the original on 7 October 2008. Retrieved 8 March 2007.{{cite web}}: CS1 maint: bot: original URL status unknown (link) - ^ a b c d e Emsley, J. (2001). Nature’s Building Blocks. Oxford University Press. pp. 44–45. ISBN 978-0-19-960563-7.
- ^ a b
«40Ar/39Ar dating and errors». Archived from the original on 9 May 2007. Retrieved 7 March 2007. - ^
Lodders, K. (2008). «The solar argon abundance». Astrophysical Journal. 674 (1): 607–611. arXiv:0710.4523. Bibcode:2008ApJ…674..607L. doi:10.1086/524725. S2CID 59150678. - ^ Cameron, A. G. W. (1973). «Elemental and isotopic abundances of the volatile elements in the outer planets». Space Science Reviews. 14 (3–4): 392–400. Bibcode:1973SSRv…14..392C. doi:10.1007/BF00214750. S2CID 119861943.
- ^ Mahaffy, P. R.; Webster, C. R.; Atreya, S. K.; Franz, H.; Wong, M.; Conrad, P. G.; Harpold, D.; Jones, J. J.; Leshin, L. A.; Manning, H.; Owen, T.; Pepin, R. O.; Squyres, S.; Trainer, M.; Kemppinen, O.; Bridges, N.; Johnson, J. R.; Minitti, M.; Cremers, D.; Bell, J. F.; Edgar, L.; Farmer, J.; Godber, A.; Wadhwa, M.; Wellington, D.; McEwan, I.; Newman, C.; Richardson, M.; Charpentier, A.; et al. (2013). «Abundance and Isotopic Composition of Gases in the Martian Atmosphere from the Curiosity Rover». Science. 341 (6143): 263–6. Bibcode:2013Sci…341..263M. doi:10.1126/science.1237966. PMID 23869014. S2CID 206548973.
- ^ Young, Nigel A. (March 2013). «Main group coordination chemistry at low temperatures: A review of matrix isolated Group 12 to Group 18 complexes». Coordination Chemistry Reviews. 257 (5–6): 956–1010. doi:10.1016/j.ccr.2012.10.013.
- ^ Kean, Sam (2011). «Chemistry Way, Way Below Zero». The Disappearing Spoon. Black Bay Books.
- ^
Bartlett, Neil (8 September 2003). «The Noble Gases». Chemical & Engineering News. 81 (36): 32–34. doi:10.1021/cen-v081n036.p032. - ^
Lockyear, JF; Douglas, K; Price, SD; Karwowska, M; et al. (2010). «Generation of the ArCF22+ Dication». Journal of Physical Chemistry Letters. 1: 358. doi:10.1021/jz900274p. - ^
Barlow, M. J.; et al. (2013). «Detection of a Noble Gas Molecular Ion, 36ArH+, in the Crab Nebula». Science. 342 (6164): 1343–1345. arXiv:1312.4843. Bibcode:2013Sci…342.1343B. doi:10.1126/science.1243582. PMID 24337290. S2CID 37578581. - ^ Quenqua, Douglas (13 December 2013). «Noble Molecules Found in Space». The New York Times. Archived from the original on 1 January 2022. Retrieved 13 December 2013.
- ^ Kleppe, Annette K.; Amboage, Mónica; Jephcoat, Andrew P. (2014). «New high-pressure van der Waals compound Kr(H2)4 discovered in the krypton-hydrogen binary system». Scientific Reports. 4: 4989. Bibcode:2014NatSR…4E4989K. doi:10.1038/srep04989.
- ^
«Periodic Table of Elements: Argon – Ar». Environmentalchemistry.com. Retrieved 12 September 2008. - ^
Fletcher, D. L. «Slaughter Technology» (PDF). Symposium: Recent Advances in Poultry Slaughter Technology. Archived from the original (PDF) on 24 July 2011. Retrieved 1 January 2010. - ^ Shields, Sara J.; Raj, A. B. M. (2010). «A Critical Review of Electrical Water-Bath Stun Systems for Poultry Slaughter and Recent Developments in Alternative Technologies». Journal of Applied Animal Welfare Science. 13 (4): 281–299. CiteSeerX 10.1.1.680.5115. doi:10.1080/10888705.2010.507119. ISSN 1088-8705. PMID 20865613. S2CID 11301328.
- ^ Fraqueza, M. J.; Barreto, A. S. (2009). «The effect on turkey meat shelf life of modified-atmosphere packaging with an argon mixture». Poultry Science. 88 (9): 1991–1998. doi:10.3382/ps.2008-00239. ISSN 0032-5791. PMID 19687286.
- ^ Su, Joseph Z.; Kim, Andrew K.; Crampton, George P.; Liu, Zhigang (2001). «Fire Suppression with Inert Gas Agents». Journal of Fire Protection Engineering. 11 (2): 72–87. doi:10.1106/X21V-YQKU-PMKP-XGTP. ISSN 1042-3915.
- ^
Gastler, Dan; Kearns, Ed; Hime, Andrew; Stonehill, Laura C.; et al. (2012). «Measurement of scintillation efficiency for nuclear recoils in liquid argon». Physical Review C. 85 (6): 065811. arXiv:1004.0373. Bibcode:2012PhRvC..85f5811G. doi:10.1103/PhysRevC.85.065811. S2CID 6876533. - ^
Xu, J.; Calaprice, F.; Galbiati, C.; Goretti, A.; Guray, G.; et al. (26 April 2012). «A Study of the Residual 39
Ar Content in Argon from Underground Sources». Astroparticle Physics. 66 (2015): 53–60. arXiv:1204.6011. Bibcode:2015APh….66…53X. doi:10.1016/j.astropartphys.2015.01.002. S2CID 117711599. - ^ «Plasma electrons can be used to produce metallic films». Phys.org. 7 May 2020. Retrieved 8 May 2020.
- ^ Ilouga PE, Winkler D, Kirchhoff C, Schierholz B, Wölcke J (November 2007). «Investigation of 3 industry-wide applied storage conditions for compound libraries». Journal of Biomolecular Screening. 12 (1): 21–32. doi:10.1177/1087057106295507. PMID 17099243.
- ^ Zawalick, Steven Scott «Method for preserving an oxygen sensitive liquid product» U.S. Patent 6,629,402 Issue date: 7 October 2003.
- ^
«Schedule for Renovation of the National Archives Building». Retrieved 7 July 2009. - ^
«Fatal Gas Embolism Caused by Overpressurization during Laparoscopic Use of Argon Enhanced Coagulation». MDSR. 24 June 1994. - ^
Pilmanis Andrew A.; Balldin U. I.; Webb James T.; Krause K. M. (2003). «Staged decompression to 3.5 psi using argon–oxygen and 100% oxygen breathing mixtures». Aviation, Space, and Environmental Medicine. 74 (12): 1243–1250. PMID 14692466. - ^
«Energy-Efficient Windows». FineHomebuilding.com. February 1998. Retrieved 1 August 2009. - ^ Nuckols M. L.; Giblo J.; Wood-Putnam J. L. (15–18 September 2008). «Thermal Characteristics of Diving Garments When Using Argon as a Suit Inflation Gas». Proceedings of the Oceans 08 MTS/IEEE Quebec, Canada Meeting. Archived from the original on 21 July 2009. Retrieved 2 March 2009.
{{cite journal}}: CS1 maint: unfit URL (link) - ^ «Description of Aim-9 Operation». planken.org. Archived from the original on 22 December 2008. Retrieved 1 February 2009.
- ^ «WADA amends Section S.2.1 of 2014 Prohibited List». 31 August 2014. Archived from the original on 27 April 2021. Retrieved 1 September 2014.
- ^
Alaska FACE Investigation 94AK012 (23 June 1994). «Welder’s Helper Asphyxiated in Argon-Inerted Pipe – Alaska (FACE AK-94-012)». State of Alaska Department of Public Health. Retrieved 29 January 2011.
Further reading
- Brown, T. L.; Bursten, B. E.; LeMay, H. E. (2006). J. Challice; N. Folchetti (eds.). Chemistry: The Central Science (10th ed.). Pearson Education. pp. 276& 289. ISBN 978-0-13-109686-8.
- Lide, D. R. (2005). «Properties of the Elements and Inorganic Compounds; Melting, boiling, triple, and critical temperatures of the elements». CRC Handbook of Chemistry and Physics (86th ed.). CRC Press. §4. ISBN 978-0-8493-0486-6. On triple point pressure at 69 kPa.
- Preston-Thomas, H. (1990). «The International Temperature Scale of 1990 (ITS-90)». Metrologia. 27 (1): 3–10. Bibcode:1990Metro..27….3P. doi:10.1088/0026-1394/27/1/002. S2CID 250785635. On triple point pressure at 83.8058 K.
External links
- Argon at The Periodic Table of Videos (University of Nottingham)
- USGS Periodic Table – Argon
- Diving applications: Why Argon?
- Аргон
- химический элемент периодической системы Д. И. Менделеева, инертный газ, атомный номер 18, атомная масса 39,948. Объемная концентрация аргона в воздухе 0,9325% об. или 1,2862% вес. Аргон тяжелее воздуха, плотность 1,78 кг/м3 при нулевой температуре и нормальном давлении. Температура кипения -185,85°C. Обладает низким потенциалом ионизации 15,7 В. С большинством элементов аргон не образует химических соединений, кроме некоторых гидридов. В металлах аргон, как в жидком, так и в твердом состоянии нерастворим. При обычных условиях — бесцветный, негорючий, неядовитый газ, без запаха и вкуса. Химическая формула — Ar.
Содержание
- История открытия
- Способы получения
- Применение
- Применение в сварке
- Вредность и опасность
- Хранение и транспортировка
- Характеристики аргона
- Коэффициенты перевода объема и массы Ar при Т=15°С и Р=0,1 МПа
- Коэффициенты перевода объема и массы Ar при Т=0°С и Р=0,1 МПа
- Аргон в баллоне
- Давление аргона в баллоне при различной температуре
На данный момент известны изотопы аргона с массовыми числами от 29 до 54, но в в земной атмосфере он представлен тремя стабильными изотопами:
- 40Ar (изотопная распространённость 99,600 %)
- 36Ar (изотопная распространённость 0,337 %)
- 38Ar (изотопная распространённость 0,063 %)
История открытия aргона
Аргон был открыт Джоном Уильямом Стреттом (John Strutt) и Сэром Уильямом Рамзаем (Sir William Ramsay) при исследовании азота, полученного из воздуха химическим путем. Несовпадение плотности этого газа при различных способах получения натолкнуло этих ученых на идею о присутствии в воздухе какого-то тяжелого инертного газа, который и был выделен ими в 1894 г. и назван argon, что с греческого переводится как «ленивый», «медлительный», «неактивный».
Способы получения аргона
Аргон получают как побочный продукт, при производстве кислорода и азота из воздуха методом низкотемпературной ректификации (см. получение аргона)
Применение аргона
Наиболее часто аргон применяют:
- как защитный газ при сварке;
- как плёнкообразующий газ при плазменной сварке и резке;
- для вытеснения кислорода и влаги из упаковки при хранении пищевых продуктов, что увеличивает срок их хранения (пищевая добавка Е938);
- как газ для тушения огня в некоторых системах пожаротушения.
Применение аргона в сварке
Аргон применяют в качестве защитной среды при сварке активных и редких металлов (титана, циркония и ниобия) и сплавов на их основе, алюминиевых и магниевых сплавов, а также хромоникелевых коррозионностойких жаропрочных сплавов, легированных сталей различных марок.
Для сварки черных металлов аргон обычно используются в смеси с другими газами — кислородом, гелием, двуокисью углерода или водородом.
Аргон, являясь более тяжелым, чем воздух, своей струей лучше защищает металл при сварке в нижнем положении. Растекаясь по поверхности свариваемого изделия, он защищает достаточно длительно довольно широкую и протяженную зону как расплавленного, так и нагретого при сварке металла.
Низкий ионизационный потенциал аргона помогает получить превосходный профиль сварочного шва и сохранять хорошую и устойчивую дугу от начала до конца. В тоже время, низкий потенциал ионизации является причиной и низкого напряжения на дуге, что снижает тепловую мощность дуги. Для более подробной информации рекомендуем статью о свойствах сварочной дуги в инертных газах — аргоне и гелии.
Применение аргона позволяет повысить температуру сварочной дуги, что улучшает проплавление сварного шва, увеличивая производительность сварки в целом. При этом проплавление приобретает «кинжальную» форму, что дает возможность выполнять однопроходную сварку в щелевую разделку металла больших толщин. При сварке в среде аргона (как и иных инертных газов) минимизируется выгорание активных легирующих элементов, что позволяет использовать более дешевые сварочные проволоки.
При TIG сварке аргон служит защитой не только для сварочной ванны от вредного воздействия воздуха, а также инертной защитой конца электрода.
Для дуговой сварки в целом аргон применяется гораздо чаще, чем гелий, однако при сварке листового алюминия толщиной менее 6 мм аргон рекомендуют смешивать с гелием, чтобы обеспечить нужную теплопроводность. В некоторых случаях аргонно-гелиевые смеси используют для зажигания дуги, после чего сварка происходит в присутствии гелия. Этот метод применяется для сварки толстолистового алюминия вольфрамовым электродом при постоянном токе.
Вредность и опасность аргона
Аргон не оказывает опасного воздействия на окружающую среду, но относится к асфиксантам (удушающий газ). Поскольку газообразный аргон тяжелее воздуха он может накапливаться в слабо проветриваемых помещениях у пола. При этом снижается содержание кислорода в воздухе, что вызывает кислородную недостаточность и удушье. Поэтому можно сделать вывод, что в больших количествах аргон вреден для организма человека.
Жидкий аргон – низкокипящая жидкость, которая может вызвать обморожение кожи и поражение слизистой оболочки глаз человека.
Хранение и транспортировка аргона
Газообразный и жидкий аргон поставляется по ГОСТ 10157. Хранят и транспортируют газообразный аргон в баллонах по ГОСТ 949 под давлением 15МПа.
Стальные баллоны должны соответствовать ГОСТ 949. Баллон окрашивается в серый цвет с зеленой полосой и зеленой надписью «АРГОН ЧИСТЫЙ».
Возможна транспортировка аргона в жидком виде в специальных цистернах или сосудах Дьюара с последующей его газификацией.
Характеристики аргона
Характеристики Ar представлены в таблицах ниже:
Коэффициенты перевода объема и массы Ar при Т=15°С и Р=0,1 МПа
| Масса, кг | Объем | |
|---|---|---|
|
Газ, м3 |
Жидкость, л |
|
|
1,669 |
1 |
1,197 |
|
1,394 |
0,835 |
1 |
|
1 |
0,599 |
0,717 |
Коэффициенты перевода объема и массы Ar при Т=0°С и Р=0,1 МПа
| Масса, кг |
Объем |
|
|---|---|---|
|
Газ, м3 |
Жидкость, л |
|
|
1,784 |
1 |
1,279 |
|
1,394 |
0,782 |
1 |
|
1 |
0,561 |
0,717 |
Аргон в баллоне
| Наименование |
Объем баллона, л |
Масса газа в баллоне, кг |
Объем газа (м3) при Т=15°С, Р=0,1 МПа |
|---|---|---|---|
|
Ar |
40 |
10,85 |
6,5 |
Благодаря этой таблице теперь можно легко дать ответы на вопросы, которые очень часто задают сварщики:
- Сколько литров в баллоне аргона?
Ответ: 40 литров - Сколько аргона в баллоне 40л?
Ответ: 6,5 м3 или 10,85 кг - Сколько весит баллон с аргоном 40 литров
Ответ:
58,5 кг — масса пустого баллона из углеродистой стали согласно ГОСТ 949;
10,85 — кг масса аргона в баллоне;
Итого: 58,5 + 10,85 = 69,35 кг вес баллона с аргоном.
Давление аргона в баллоне при различной температуре окружающей среды
| Температура окружающей среды | Давление в баллоне, МПа |
|---|---|
|
-40 |
10,5 |
|
-30 |
11,3 |
|
-20 |
12,2 |
|
-10 |
12,9 |
|
0 |
13,7 |
|
+10 |
14,6 |
|
+20 |
15,3 |
|
+30 |
16,0 |
https://ru.wikipedia.org/wiki/%D0%90%D1%80%D0%B3%D0%BE%D0%BD
Арго́н — химический элемент с атомным номером 18. Третий по распространённости элемент в атмосфере — 0,93 % по объёму.
| Аргон(Ar) | |
|---|---|
| Атомный номер | 18 |
| Внешний вид | 
|
| Свойства атома | |
| Атомная масса (молярная масса) |
39,948 а. е. м. (г/моль) |
| Радиус атома | 2- пм |
| Энергия ионизации (первый электрон) |
1519,6(15,75) кДж/моль (эВ) |
| Электронная конфигурация | [Ne] 3s2 3p6 |
| Химические свойства | |
| Ковалентный радиус | 98 пм |
| Радиус иона | n/a пм |
| Электроотрицательность (по Полингу) |
0,0 |
| Электродный потенциал | 0 |
| Степени окисления | n/a |
| Термодинамические свойства | |
| Плотность | (при -186 °C)1,40 г/см³ |
| Удельная теплоёмкость | 0,138 Дж/(K·моль) |
| Теплопроводность | 0,0177 Вт/(м·K) |
| Температура плавления | 83,8 K |
| Теплота плавления | n/a кДж/моль |
| Температура кипения | 87,3 K |
| Теплота испарения | 6,52 кДж/моль |
| Молярный объём | 24,2 см³/моль |
| Кристаллическая решётка | |
| Структура решётки | кубическая гранецентрированая |
| Период решётки | 5,260 Å |
| Отношение c/a | n/a |
| Температура Дебая | 85,00 K |
История
К открытию аргона привело обнаруженное в 1892 году английским физиком Лордом Джоном Рэлеем небольшое (всего на 0,13 %) превышение плотности азота, выделяемого из воздуха, над плотностью «химического» азота, возникающего при термическом разложении нитрита аммония NH4NO2.
Вместе с другим английским физиком Уильям Рамзаем, Лорд Джон Рэлей в 1894 году выделил из воздуха примесь более тяжёлого (по сравнению с азотом) газа, который отличался одноатомным составом молекул и практически полной химической недеятельностью. Известно единственное химическе соединение аргона HArF (Nature 406, 874, (2000)). Затем были открыты остальные инертные газы.
Происхождение названия
Именно из-за своей удивительной химической инертности новый газ и получил своё название (греч. αργός — неактивный).
Аргон в природе
Аргон распространён в природе только в свободном виде. В земной коре его содержание составляет 1,2•10-4 %, в морской воде — 0,45•10-4 %. В атмосферном воздухе содержится 0,93 % аргона по объёму (9,34 л в 1м3). Это значительно больше, чем содержание в воздухе всех остальных инертных газов вместе взятых. Воздух служит неиссякаемым источником для получения аргона.
Обращает на себя внимание преобладание в смеси природных нуклидов аргона самого тяжёлого — аргона-40. Это связано с тем, что 40Ar постоянно образуется за счёт распада радиоактивного калия-40. В 1 т калия за год при радиоактивном распаде калия-40 путём захвата орбитального электрона (так называемый электронный захват, или К-захват; на этот тип радиоактивного распада калия-40 приходится 12 % от всех актов распада этого природного радионуклида) образуется всего около 3100 атомов аргона-40. Но калий — один из самых распространённых на Земле элементов, да и время, прошедшее за долгую историю Земли, исчисляется миллиардами лет. Поэтому 40Ar накопился в земной атмосфере в значительных количествах.
Преобладание тяжёлого аргона-40 в природной смеси изотопов этого элемента приводит к тому, что атомная масса элемента аргона оказывается немного выше, чем следующего за ним в периодической системе элемента калия. Однако, когда Менделеев создавал свою знаменитую таблицу, проблема, как разместить калий и аргон, у него не возникала, так как аргон был открыт спустя почти 30 лет после открытия периодического закона, и в таблицу (в группу, которой тогда присвоили номер ноль) попал только в начале 20-го века. В настоящее время аргон, как и другие инертные газы, включают в восьмую группу периодической системы элементов.
Получение
В промышленности аргон получают как побочный продукт при крупномасштабном разделении воздуха на кислород и азот. При температуре -185,9°C аргон конденсируется, при -189,4°С — кристаллизуется.
Свойства
Аргон — одноатомный газ с температурой кипения (при нормальном давлении) –185,9° C (немного ниже, чем у кислорода, но немного выше, чем у азота). В 100 мл воды при 20° C растворяется 3,3 мл аргона, в некоторых органических растворителях аргон растворяется значительно лучше, чем в воде.
Как уже говорилось, химических соединений не образует. Однако со многими веществами, между молекулами которых действуют водородные связи (водой, фенолом, гидрохиноном и другими), образует соединения включения (клатраты), где атом аргона, как своего рода «гость», находится в полости, образованной в кристаллической решётке молекулами вещества-хозяина.
Применение
Аргон широко используют для создания инертной и защитной атмосферы, прежде всего при термической обработке легко окисляющихся металлов (аргоновая плавка, аргоновая сварка и другие). В атмосфере аргона получают кристаллы полупроводников и многие другие сверхчистые материалы. Аргоном часто заполняют электрические лампочки (для замедления испарения вольфрама со спирали). Это же его свойство используется в аргоновой сварке, которая позволяет соединять алюминиевые и дюралевые детали.
При пропускании электрического разряда через стеклянную трубку, заполненную аргоном, наблюдается сине-голубое свечение, что широко используется, например, в светящейся рекламе. В геохронологии по оределению соотношения изотопов 40Ar/40К устанавливают возраст минералов. Также аргон используется в аргоновых лазерах.
Ссылки
- Аргон на Webelements
- Аргон в Популярной библиотеке химических элементов
| H | He | |||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | |||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |
| Cs | Ba | * | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| Fr | Ra | ** | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Uub | Uut | Uuq | Uup | Uuh | Uus | Uuo | |
| * | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | |||
| ** | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr |
af:Argon
ar:أرغون (عنصر)
ast:Argón
bg:Аргон
bn:আর্গন
bs:Argon
ca:Argó
co:Argone
cs:Argon
cy:Argon
da:Argon
de:Argon
el:Αργό
en:Argon
eo:Argono
es:Argón
et:Argoon
fa:آرگون
fi:Argon
fr:Argon
gl:Argon (elemento)
he:ארגון (יסוד)
hr:Argon
hu:Argon
hy:Արգոն
id:Argon
io:Argono
is:Argon
it:Argon
ja:アルゴン
jbo:laznynavni
ko:아르곤
la:Argon
lb:Argon
lt:Argonas
lv:Argons
mi:Argon
mk:Аргон
ml:ആര്ഗണ്
ms:Argon
nds:Argon
nl:Argon
nn:Argon
no:Argon
oc:Argon
pl:Argon
pt:Árgon
ro:Argon
sh:Argon
simple:Argon
sk:Argón
sl:Argon
sq:Argoni
sr:Аргон
sv:Argon
th:อาร์กอน
tr:Argon
ug:Argon
uk:Аргон
uz:Argon
vi:Agon
zh:氩
|
Выделить Аргон и найти в:
|
|
|
- Страница 0 — краткая статья
- Страница 1 — энциклопедическая статья
- Разное — на страницах: 2 , 3 , 4 , 5
- Прошу вносить вашу информацию в «Аргон 1», чтобы сохранить ее
Комментарии читателей:
Авторы:
сотрудники компанииАналитические линии плазмообразующего газа (аргона) на фрагменте спектра образца углеродистой низколегированной стали
Аргон – элемент с атомной массой 39,944 и порядковым номером 18. Принадлежит к 8-ой группе главной подгруппы таблицы Менделеева, относится к благородным инертным одноатомным газам. Не обладает ни запахом, ни цветом, ни вкусом. Негорючий и невзрывоопасный.
История открытия Аргона
Впервые неизвестный до этого газ, при химических и физических экспериментах, обнаружил в 1785 году Генри Кавендиш — английский физик и химик. Но он не смог разгадать загадку и прекратил исследования. Позднее на записи Кавендиша обратил внимание Джеймс Максвелл.
И лишь спустя более ста лет, в 1894 году, химик Уильям Рамзай и физик Джон Уильям Стретт (Лорд Рэлей) сделали доклад об открытии нового элемента, который, за свою химическую неактивность, назвали аргоном. Это случилось в Оксфорде на собрании Британской ассоциации естествоиспытателей, физиков и химиков. Название нового газа произошло от греческого слова ἀργός, что в переводе означает — неактивный, медленный.
Спустя еще 10 лет, эти ученые получили Нобелевские премии за исследования газов, открытие аргона и других инертных газов в атмосфере.
Получение Аргона
Аргон — наиболее распространенный в воздухе инертный газ. В 1 м3 содержится примерно 0,09 см3 ксенона, 1,1 см3 криптона, 5,2 см3 гелия, 18,2 см3 неона, 9000 см3 аргона.
В атмосфере Земли аргон занимает третье место. На первом – азот, на втором — кислород. В процентном отношении это примерно 0,93% по объёму или 1.3% по массе. По этой причине он является самым легкодоступным и недорогим инертным газом.
Получение и промышленное производство этого газа происходит как выделение сопутствующего газа при добыче азота и кислорода из атмосферного воздуха. Наиболее простой метод — это глубокое охлаждение и ректификация с последующей доочисткой от примесей.
Кроме того, аргон получают при производстве аммиака. Доочистку аргона осуществляют по технологии гидрирования с платиновым катализатором или адсорбционным методом с использованием молекулярных сит или активного угля.
Применение Аргона
Основными потребителями аргона являются:
Металлургия. Применение аргона в современных технологических процессах выплавки стали — продувка расплава в ковше. Эта операция выполняет несколько функций: охлаждение металла, ускорение плавления вводимых в ковш лигатур и раскислителей, гомогенизация металла по химическому составу и температуре, очищение от неметаллических включений, образующихся от раскисляющих и легирующих добавок, углеродное раскисление металла и его обезуглероживание, удаление водорода и азота, ускорение десульфурации (удаление серы из расплава), вдувание раскисляющих и легирующих порошкообразных добавок.
В металлургии высококачественных сплавов аргон используется для защиты расплава от контакта с воздухом во время выплавки и разливки. Высокотемпературная обработка титана и его сплавов требует защитной аргоновой атмосферы. Незаменим аргон и в технологиях обработки таких редких металлов как цирконий, вольфрам, тантал, ниобий, бериллий, гафний и др.
Металлообрабатывающая промышленность. Основное использование аргона — создание защитной завесы при электродуговой (АРДЭС), контактной и лазерной сварке, термообработке. Аргон — плазмообразующий газ в установках сварки и резки активных, редких металлов, сплавов на их основе, например, алюминиевых и магниевых, нержавеющих, хромоникелевых, жаропрочных сплавов и легированных сталей.
Радиоэлектронная промышленность. Здесь аргон незаменим для создания инертной среды в установках плазменного напыления, заполнение колб электрических и люминесцентных ламп, электровакуумных приборов, газосветной рекламы. Например, сине-голубое свечение получается при заполнении трубок аргоном с парами ртути.
Пищевая промышленность. Благодаря своей химической нейтральности, аргон широко используют как пропеллтен («выталкивающий» газ) в аэрозольных упаковках, антифламинг (вещество снижающее образование пены) и «упаковочный» газ в пищевой промышленности.
Спектральный анализ и метрология. В данной сфере аргон наиболее часто используется как газ-носитель, инертная среда и плазмообразующий газ в контрольно-измерительных приборах, а также при производстве поверочных газовых смесей (ПГС) для различных газоанализаторов.
В данной сфере применения чистота аргона имеет ключевое значение. Даже при минимальных отклонениях качества аргона от соответствующих ГОСТов и ТУ, регламентированных для использования в конкретных приборах, изменяются условия работы и анализа, что приводит к серьезным искажениям результатов измерений, нарушению работоспособности оборудования, снижению качества продукции, снижению ресурса фильтров и, как следствие, серьезным экономическим убыткам.
Для предотвращения вышеописанного, могут использоваться специализированные фильтры, а также установки доочистки аргона (инертных газов) лабораторного или промышленного назначения.
Так как наша компания занимается разработкой и производством спектрометров, применение аргона в этих приборах мы решили рассмотреть более подробно. Ниже в статье этому будет посвящена отдельная глава.
Прочие сферы применения. Огнетушительные установки, заполнение стеклопакетов и поддув сухих гидрокостюмов водолазов для лучшей теплоизоляции, в медицине — очистка разрезов при хирургическом вмешательстве, в химической промышленности — инертная среда для нестабильных на воздухе соединений, а так же в прочих областях промышленности.
Продолжение >
Химический элемент с атомным номером 18
Химический элемент с атомным номером 18
 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Аргон | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Произношение | () | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешний вид | бесцветный газ, проявляющий лилово-лиловое свечение при помещении в электрическое поле | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Стандартный атомный вес A r, std (Ar) | [39,792, 39,963] условно: 39,95 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Аргон в периодической таблице | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Атомный номер (Z) | 18 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Группа | группа 18 (благородные газы) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Период | период 3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Блок | p-блок | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Категория элемента | Благородный газ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Конфигурация электронов | [Ne ] 3s 3p | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Электронов на оболочку | 2, 8, 8 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Физические свойства | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Фаза при STP | газ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Точка плавления | 83,81 K (-189,34 ° C, -308,81 ° F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Точка кипения | 87,302 K (-185,848 ° C, -302,526 ° F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Плотность (при STP) | 1,784 г / л | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| в жидком состоянии (при bp ) | 1,3954 г / см | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Тройная точка | 83,8058 K, 68,89 кПа | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Критическая точка | 150,687 K, 4,863 МПа | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Теплота плавления | 1,18 кДж / моль | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Теплота испарения | 6,53 кДж / моль | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Молярная теплоемкость | 20,85 Дж / (моль · К) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Давление пара
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Атомные свойства | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Степени окисления | 0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Электроотрицательность | Шкала Полинга: нет данных | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Энергии ионизации |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ковалентный радиус | 106 ± 10 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Радиус Ван-дер-Ваальса | 188 пм | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Прочие свойства | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Природное происхождение | первобытность | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Кристаллическая структура | грань -центрированный кубический (fcc)  |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Скорость звука | 323 м / с (газ, при 27 ° C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Теплопроводность | 17,72 × 10 Вт / ( м · К) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Магнитное упорядочение | диамагнитное | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Магнитная восприимчивость | −19,6 · 10 см / моль | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Номер CAS | 7440-37-1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| История | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Открытие и первая изоляция | Лорд Рэлей и Уильям Рамзи (1894) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Основные изотопы аргона | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| . Ar и. Ar содержание может достигать 2,07% и 4,3% соответственно в природных образцах.. Остаток в таких случаях — аргон, содержание которого может составлять всего 93,6%. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ссылки |
аргон — химический элемент с символом Arи атомным номером 18. Он находится в 18 группе таблицы Менделеева и является благородным газом. Аргон является третьим по содержанию газом в атмосфере Земли с 0,934% (9340 ppmv ). Его более чем в два раза больше, чем водяного пара (который в среднем составляет около 4000 ppmv, но сильно варьируется), в 23 раза больше, чем диоксида углерода (400 ppmv), и более 500 раз больше, чем неон (18 частей на миллион по объему). Аргон — самый распространенный благородный газ в земной коре, составляющий 0,00015% коры.
Почти весь аргон в атмосфере Земли является радиоактивным аргоном-40, полученным в результате распада калия-40. в земной коре. Во Вселенной аргон-36 на сегодняшний день является наиболее распространенным изотопом аргона , так как он наиболее легко образуется при звездном нуклеосинтезе в сверхновых.
Название «аргон» происходит от греческого слова ἀργόν, среднего единственного числа от ργός, означающего «ленивый» или «неактивный», как указание на тот факт, что элемент почти не вступает в химические реакции. Полный октет (восемь электронов) во внешней оболочке атома делает аргон стабильным и устойчивым к связыванию с другими элементами. Его тройная точка температура 83,8058 K является определяющей фиксированной точкой в Международной температурной шкале 1990 года.
Аргон получают промышленным способом путем фракционной перегонки из жидкий воздух. Аргон в основном используется в качестве инертного защитного газа при сварке и других высокотемпературных промышленных процессах, где обычно инертные вещества становятся реактивными; например, в электрических печах графита используется атмосфера аргона для предотвращения горения графита. Аргон также используется в лампах накаливания, люминесцентном освещении и других газоразрядных трубках. Аргон делает отличительный сине-зеленый газовый лазер. Аргон также используется в стартерах люминесцентного свечения.
Содержание
- 1 Характеристики
- 2 История
- 3 Возникновение
- 4 Изотопы
- 5 Соединения
- 6 Производство
- 6.1 Промышленное
- 6.2 При радиоактивных распадах
- 7 Области применения
- 7.1 Промышленные процессы
- 7.2 Научные исследования
- 7.3 Консервант
- 7.4 Лабораторное оборудование
- 7.5 Медицинское использование
- 7.6 Освещение
- 7.7 Разное использование
- 8 Безопасность
- 9 См. Также
- 10 Ссылки
- 11 Дополнительная литература
- 12 Внешние ссылки
Характеристики

Аргон имеет примерно такую же растворимость в вода в качестве кислорода и в 2,5 раза более растворима в воде, чем азот. Аргон не имеет цвета, запаха, негорючего вещества и нетоксичен как твердое вещество, жидкость или газ. Аргон химически инертен в большинстве условий и не образует подтвержденных стабильных соединений при комнатной температуре.
Хотя аргон является благородным газом, он может образовывать некоторые соединения в различных экстремальных условиях. Фторгидрид аргона (HArF), соединение аргона с фтором и водородом, которое стабильно ниже 17 К (-256,1 ° C; -429,1 ° F), был продемонстрирован. Хотя нейтральные химические соединения аргона в основном состоянии в настоящее время ограничиваются HArF, аргон может образовывать клатраты с водой, когда атомы аргона захватываются решеткой из молекул воды. Были продемонстрированы ионы, такие как ArH., и комплексы возбужденного состояния, такие как ArF. Теоретический расчет предсказывает еще несколько соединений аргона, которые должны быть стабильными, но еще не синтезированы.
История

Аргон (греч. ἀργόν, среднее единственное число of ἀργός, означающее «ленивый» или «неактивный») назван в связи с его химической неактивностью. Это химическое свойство этого первого обнаруженного благородного газа произвело впечатление на авторов названий. Генри Кавендиш в 1785 году предположил, что инертный газ является компонентом воздуха.
Аргон был впервые изолирован из воздуха в 1894 году лордом Рэли и сэром <520.>Уильям Рамзи в Университетском колледже Лондона путем удаления кислорода, диоксида углерода, воды и азота из образца чистой воздух. Они впервые достигли этого, повторив эксперимент Генри Кавендиша. Они захватили смесь атмосферного воздуха с дополнительным кислородом в пробирке (A) вверх ногами над большим количеством разбавленного раствора щелочи (B), который в первоначальном эксперименте Канвендиша был гидроксидом калия, и передали ток через провода, изолированные U-образными стеклянными трубками (CC), которые герметизированы вокруг электродов из платиновой проволоки, оставляя концы проводов (DD) открытыми для газа и изолированными от раствора щелочи. Дуга питалась от батареи из пяти ячеек Гроува и катушки Румкорфа среднего размера. Щелочь поглощала оксиды азота, образующиеся при дуге, а также диоксид углерода. Они включали дугу до тех пор, пока уменьшение объема газа не прекращалось в течение по крайней мере часа или двух, а спектральные линии азота не исчезали при исследовании газа. Оставшийся кислород прореагировал с щелочным пирогаллатом, оставив после себя явно неактивный газ, который они назвали аргоном.
Перед выделением газа они определили, что азот, полученный из химических соединений, на 0,5% легче, чем азот из атмосферы. Разница была небольшой, но достаточно важной, чтобы привлекать их внимание на многие месяцы. Они пришли к выводу, что в воздухе есть еще один газ, смешанный с азотом. Аргон также был обнаружен в 1882 году в результате независимых исследований Х. Ф. Ньюолла и У. Н. Хартли. Каждый наблюдал новые линии в спектре излучения воздуха, которые не соответствовали известным элементам.
До 1957 года символ аргона был «A», но теперь это «Ar».
Возникновение
Аргон составляет 0,934% по объему и 1,288% по массе атмосферы Земли, а воздух является основным промышленным источником продуктов очищенного аргона. Аргон выделяют из воздуха фракционированием, чаще всего с помощью криогенной фракционной перегонки, процесса, который также дает очищенный азот, кислород, неон, криптон и ксенон. Земная кора и морская вода содержат 1,2 и 0,45 промилле аргона, соответственно.
Изотопы
Основными изотопами аргона, обнаруженными на Земле, являются. Ar (99,6 %),. Ar (0,34%) и. Ar (0,06%). Встречающийся в природе. K, с периодом полураспада 1,25 × 10 лет, распадается до стабильного. Ar (11,2%) в результате захвата электронов или испускания позитронов, а также до стабильного. Ca (88,8%) посредством бета-распада. Эти свойства и соотношения используются для определения возраста горных пород с помощью датирования K – Ar.
В атмосфере Земли. Ar образуется в результате активности космических лучей в первую очередь нейтронным захватом. Ar с последующим испусканием двух нейтронов. В подповерхностной среде он также образуется за счет захвата нейтронов. К с последующим испусканием протонов.. Ar создается в результате захвата нейтронов. Ca с последующим выбросом альфа-частиц в результате подземных ядерных взрывов. Его период полураспада составляет 35 дней.
В разных местах в Солнечной системе изотопный состав аргона сильно различается. Если основным источником аргона является распад . K в горных породах,. Ar будет доминирующим изотопом, как и на Земле. В аргоне, образующемся непосредственно при звездном нуклеосинтезе, преобладает альфа-процесс нуклид. Ar. Соответственно, солнечный аргон содержит 84,6%. Ar (согласно измерениям солнечного ветра ), а соотношение трех изотопов Ar: Ar: Ar в атмосферах внешних планет составляет 8400: 1600: 1. Это контрастирует с низким содержанием первичного. Ar в атмосфере Земли, которое составляет всего 31,5 ppmv (= 9340 ppmv × 0,337%), что сравнимо с содержанием неона (18,18 ppmv) на Земле и с межпланетными газами. измерено зондами .
Атмосферы Марса, Меркурия и Титана (самый большой спутник Сатурна ) содержат аргон, преимущественно как. Ar, и его содержание может достигать 1,93% (Марс).
Преобладание радиогенного. Ar является причиной стандартной атомной массы земного аргона больше, чем у следующего элемента, калия, факт, который озадачил, когда аргон был открыт. Менделеев расположил элементы в своей таблице Менделеева в порядке атомного веса, но инертность аргона предполагала размещение элементов перед химически активным щелочным металлом. Генри Мозли позже решил эту проблему, показав, что периодическая таблица на самом деле организована в порядке атомного номера (см. История периодической таблицы ).
Соединения

Полный октет аргона электронов указывает на полные s- и p-подоболочки. Эта оболочка с полной валентностью делает аргон очень стабильным и чрезвычайно устойчивым к связыванию с другими элементами. До 1962 года аргон и другие благородные газы считались химически инертными и неспособными образовывать соединения; однако с тех пор были синтезированы соединения более тяжелых благородных газов. Первое соединение аргона с пентакарбонилом вольфрама, W (CO) 5 Ar, было выделено в 1975 году. Однако в то время оно не было широко признано. В августе 2000 года другое соединение аргона, фторгидрид аргона (HArF), было образовано исследователями из Университета Хельсинки, направив ультрафиолетовый свет на замороженный аргон, содержащий небольшое количество фтороводород с иодидом цезия. Это открытие вызвало осознание того, что аргон может образовывать слабосвязанные соединения, хотя и не первое. Он стабилен до 17 кельвин s (-256 ° C). метастабильный ArCF. 2дикатион, который является валентно- изоэлектронным с карбонилфторидом и фосгеном, наблюдался в 2010 году. Аргон-36 в форме ионов гидрида аргона (аргоний ) был обнаружен в межзвездной среде, связанной с Крабовидной туманностью сверхновая ; это была первая молекула благородного газа, обнаруженная в космическом пространстве.
Твердый аргон гидрид (Ar (H 2)2) имеет ту же кристаллическую структуру, что и MgZn 2Фаза Лавеса. Она образуется при давлениях от 4,3 до 220 ГПа, хотя измерения комбинационного рассеяния показывают, что молекулы H 2 в Ar (H 2)2диссоциируют выше 175 ГПа.
Производство
Промышленный
Аргон получают промышленным способом путем фракционной перегонки жидкого воздуха в криогенной блок разделения воздуха ; процесс, который отделяет жидкий азот, который кипит при 77,3 K, от аргона, который кипит при 87,3 K, и жидкого кислорода, который кипит при 90,2 K. Ежегодно во всем мире производится около 700 000 тонн аргона.
При радиоактивных распадах
Ar самый распространенный изотоп аргона образуется при распаде K с периодом полураспада 1,25 × 10 лет за счет захвата электрона или испускания позитрона. Из-за этого i t используется в калий-аргоновом датировании для определения возраста горных пород.
Области применения

Аргон обладает несколькими желательными свойствами:
- Аргон является химически инертным газом.
- Аргон — это дешевая альтернатива, когда азот недостаточно инертен.
- Аргон имеет низкую теплопроводность.
- Аргон обладает электронными свойствами (ионизацией и / или спектром излучения), желательными для некоторых приложений.
Другие благородные газы также подходят для большинства этих применений, но аргон, безусловно, самый дешевый. Аргон недорог, поскольку он естественным образом встречается в воздухе и легко получается как побочный продукт криогенного разделения воздуха при производстве жидкого кислорода и жидкости. азот : основные компоненты воздуха используются в крупных промышленных масштабах. Другие благородные газы (кроме гелия ) также производятся таким образом, но аргон, безусловно, является наиболее распространенным. Основная часть применений аргона возникает просто потому, что он инертен и относительно дешев.
Промышленные процессы
Аргон используется в некоторых высокотемпературных промышленных процессах, где обычно нереактивные вещества становятся реактивными. Например, в графитовых электрических печах используется атмосфера аргона для предотвращения горения графита.
Для некоторых из этих процессов присутствие азота или кислорода может вызвать дефекты в материале. Аргон используется в некоторых типах дуговой сварки, таких как дуговой сварке металлическим металлом и дуговой сварке вольфрамовым электродом, а также при обработке титана. и другие реактивные элементы. Атмосфера аргона также используется для выращивания кристаллов кремния и германия.
. Аргон используется в птицеводстве для удушения птиц либо для массового уничтожения после вспышек заболеваний, либо для массового уничтожения птиц. или как средство убоя более гуманное, чем электрическое оглушение. Аргон плотнее воздуха и вытесняет кислород вблизи земли во время удушения инертным газом. Его нереактивная природа делает его подходящим в пищевом продукте, а поскольку он заменяет кислород в мертвой птице, аргон также увеличивает срок хранения.
Аргон иногда используется для тушения пожаров, где ценно оборудование может быть повреждено водой или пеной.
Научные исследования
Жидкий аргон используется в качестве мишени для нейтринных экспериментов и прямого поиска темной материи. Взаимодействие между гипотетическими WIMP и ядром аргона дает сцинтилляционный свет, который обнаруживается фотоэлектронными умножителями. Двухфазные детекторы, содержащие газообразный аргон, используются для обнаружения ионизированных электронов, образующихся во время рассеяния WIMP-ядра. Как и большинство других сжиженных благородных газов, аргон имеет высокий выход сцинтилляционного света (около 51 фотона / кэВ), прозрачен для собственного сцинтилляционного света и относительно легко очищается. По сравнению с ксеноном, аргон дешевле и имеет отчетливый временной профиль сцинтилляции, что позволяет отделить отдачу электронов от отдачи ядер. С другой стороны, его собственный фон бета-излучения больше из-за загрязнения. Ar, если только не используется аргон из подземных источников, который имеет гораздо меньше загрязнения. Ar. Большая часть аргона в атмосфере Земли была произведена в результате электронного захвата долгоживущего. K (. K + e →. Ar + ν), присутствующего в природном калии на Земле. Активность. Ar в атмосфере поддерживается за счет космогенного образования посредством реакции выбивания. Ar (n, 2n). Ar и подобных реакций. Период полураспада. Ar составляет всего 269 лет. В результате подземный Ar, защищенный камнями и водой, имеет гораздо меньшее загрязнение. Ar. Детекторы темной материи, в настоящее время работающие с жидким аргоном, включают DarkSide, WArP, ArDM, microCLEAN и DEAP. Эксперименты с нейтрино включают ICARUS и MicroBooNE, оба из которых используют жидкий аргон высокой чистоты в проекционной камере для мелкозернистого трехмерного изображения взаимодействий нейтрино.
В университете Линчёпинга, Швеция, инертный газ используется в вакуумной камере, в которую вводится плазма для ионизации металлических пленок. В результате этого процесса получается пленка, которую можно использовать для производства компьютерных процессоров. Новый процесс устранит необходимость в химических ваннах и использовании дорогих, опасных и редких материалов.
Консервант

Аргон используется для вытеснения кислород- и влагосодержащего воздуха в упаковочном материале для увеличения срока службы. срок годности содержимого (аргон имеет европейский код пищевой добавки E938). Воздушное окисление, гидролиз и другие химические реакции, приводящие к разложению продуктов, замедляются или полностью предотвращаются. Химические вещества высокой чистоты и фармацевтические препараты иногда упаковываются и запечатываются в аргоне.
В виноделии аргон используется в различных сферах деятельности, чтобы создать барьер против кислорода на поверхности жидкости, который может портить вино, подпитывая как микробный метаболизм (как в случае уксуснокислых бактерий ), так и стандартный окислительно-восстановительный химический состав.
Аргон иногда используется в качестве пропеллента в аэрозольных баллонах.
Аргон также используется в качестве консерванта для таких продуктов, как лак, полиуретан и краска, вытесняя воздух для подготовки контейнера для хранения.
С 2002 года Американский национальный архив хранит важные национальные документы, такие как Декларация независимости и Конституция в заполненных аргоном ящиках, чтобы предотвратить их разрушение. Аргон предпочтительнее гелия, который использовался в предыдущие пять десятилетий, потому что газообразный гелий выходит через межмолекулярные поры в большинстве контейнеров и должен регулярно заменяться.
Лабораторное оборудование

В качестве инертного газа <141 может использоваться аргон.>внутри линий Шленка и перчаточных ящиков. Аргон предпочтительнее менее дорогого азота в тех случаях, когда азот может реагировать с реагентами или аппаратом.
аргон может использоваться в качестве газа-носителя в газовой хроматографии и в масс-спектрометрии с ионизацией электрораспылением ; это предпочтительный газ для плазмы, используемой в ICP спектроскопии. Аргон является предпочтительным для нанесения покрытия распылением образцов для растровой электронной микроскопии. Газ аргон также обычно используется для напыления тонких пленок, как в микроэлектронике, и для очистки пластин в микропроизводстве.
Медицинское использование
Криохирургия процедуры, такие как в качестве криоабляции используйте жидкий аргон для разрушения ткани, такой как раковые клетки. Он используется в процедуре, называемой «коагуляция с усилением аргона», форма плазменного луча аргона электрохирургия. Процедура сопряжена с риском возникновения газовой эмболии и привела к смерти как минимум одного пациента.
Голубые аргоновые лазеры используются в хирургии для сварки артерий, разрушать опухоли и исправлять дефекты глаз.
Аргон также экспериментально использовался для замены азота в дыхательной смеси или смеси для декомпрессии, известной как Argox, для ускорения удаления растворенного азота из крови.
Освещение

Лампы накаливания заполнены аргоном для сохранения нитей при высокой температуре из-за окисления. Он используется для определенного способа ионизации и излучения света, например, в плазменных шарах и калориметрии в экспериментальной физике элементарных частиц. Газоразрядные лампы, наполненные чистым аргоном, излучают сиреневый / фиолетовый свет; с аргоном и немного ртути, синий свет. Аргон также используется для синих и зеленых аргон-ионных лазеров.
Разное применение
Аргон используется для теплоизоляции в энергоэффективных окнах. Аргон также используется в техническом подводном плавании с аквалангом для надувания сухого костюма, потому что он инертен и имеет низкую теплопроводность.
Аргон используется в качестве топлива при разработке Магнитоплазменной Ракеты с переменным удельным импульсом (ВАСИМР). Сжатый газ аргон может расширяться для охлаждения головок ГСН некоторых версий ракеты AIM-9 Sidewinder и других ракет, в которых используются охлаждаемые головки ГСН. Газ хранится при высоком давлении..
Аргон-39, с периодом полураспада 269 лет, использовался для ряда применений, в основном ледяной керн и грунтовые воды. свидание. Кроме того, калий-аргоновое датирование и связанное с ним аргоно-аргоновое датирование используется для датировки осадочных, метаморфических и магматических пород..
Аргон использовался спортсменами в качестве допинга для имитации гипоксических состояний. В 2014 году Всемирное антидопинговое агентство (WADA) добавило аргон и ксенон в список запрещенных веществ и методов, хотя в настоящее время нет надежного теста на злоупотребление. 358>
Безопасность
Хотя аргон не токсичен, он на 38% плотнее, чем воздух, и поэтому считается опасным удушающим веществом в закрытых помещениях. Его трудно обнаружить, потому что он не имеет цвета, запаха и вкуса. Инцидент 1994 года, когда мужчина задохнулся после входа в заполненную аргоном секцию нефтепровода, строящуюся на Аляске, подчеркивает опасность утечки аргона из резервуара в замкнутом пространстве и подчеркивает необходимость правильного использования, хранения и обращения.
См. также
Химический портал
- Промышленный газ
- Отношение кислород-аргон, соотношение двух физически похожих газов, которое имеет важное значение в различные сектора.
.
Ссылки
Дополнительная литература
- Brown, TL; Bursten, B.E.; ЛеМэй, Х. Э. (2006). Дж. Чаллис; Н. Фолчетти (ред.). Химия: Центральная наука (10-е изд.). Пирсон Образование. стр. 276 и 289. ISBN 978-0-13-109686-8.
- Лиде, Д. Р. (2005). «Свойства элементов и неорганических соединений; плавление, кипение, тройные и критические температуры элементов». Справочник CRC по химии и физике (86-е изд.). CRC Нажмите. §4. ISBN 978-0-8493-0486-6.Давление тройной точки при 69 кПа.
- Престон-Томас, Х. (1990). «Международная температурная шкала 1990 г. (ITS-90)». Метрология. 27(1): 3–10. Bibcode : 1990Metro..27…. 3P. doi : 10.1088 / 0026-1394 / 27/1/002.При давлении тройной точки при 83,8058 К.
Внешние ссылки
- Аргон при Периодическая таблица видео (Университет Ноттингема)
- Периодическая таблица Геологической службы США — аргон
- Дайвинг-приложения: Почему аргон?