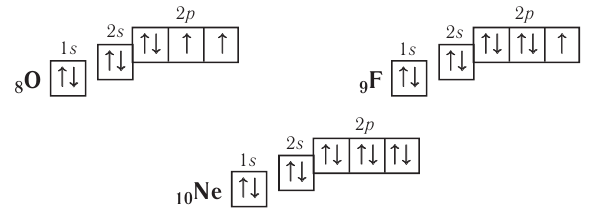
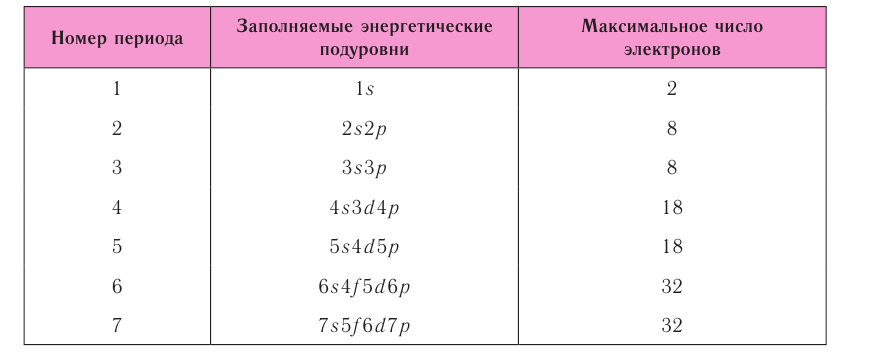
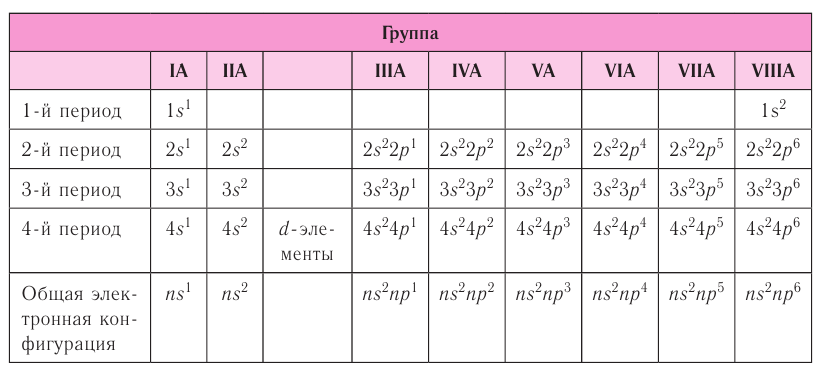
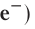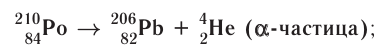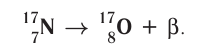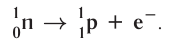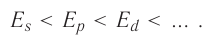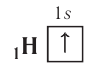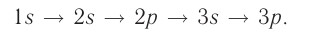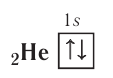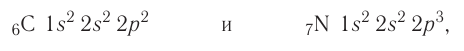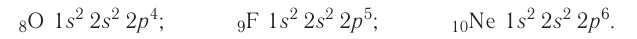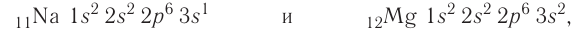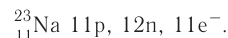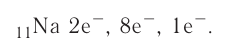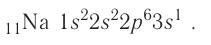| Atom | |
|---|---|

An illustration of the helium atom, depicting the nucleus (pink) and the electron cloud distribution (black). The nucleus (upper right) in helium-4 is in reality spherically symmetric and closely resembles the electron cloud, although for more complicated nuclei this is not always the case. The black bar is one angstrom (10−10 m or 100 pm). |
|
| Classification | |
| Smallest recognized division of a chemical element | |
| Properties | |
| Mass range | 1.67×10−27 to 4.52×10−25 kg |
| Electric charge | zero (neutral), or ion charge |
| Diameter range | 62 pm (He) to 520 pm (Cs) (data page) |
| Components | Electrons and a compact nucleus of protons and neutrons |
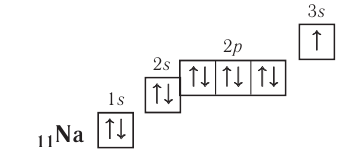
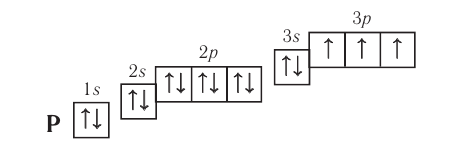
Every atom is composed of a nucleus and one or more electrons bound to the nucleus. The nucleus is made of one or more protons and a number of neutrons. Only the most common variety of hydrogen has no neutrons.
Every solid, liquid, gas, and plasma is composed of neutral or ionized atoms. Atoms are extremely small, typically around 100 picometers across. They are so small that accurately predicting their behavior using classical physics, as if they were tennis balls for example, is not possible due to quantum effects.
More than 99.94% of an atom’s mass is in the nucleus. The protons have a positive electric charge, the electrons have a negative electric charge, and the neutrons have no electric charge. If the number of protons and electrons are equal, then the atom is electrically neutral. If an atom has more or fewer electrons than protons, then it has an overall negative or positive charge, respectively – such atoms are called ions.
The electrons of an atom are attracted to the protons in an atomic nucleus by the electromagnetic force. The protons and neutrons in the nucleus are attracted to each other by the nuclear force. This force is usually stronger than the electromagnetic force that repels the positively charged protons from one another. Under certain circumstances, the repelling electromagnetic force becomes stronger than the nuclear force. In this case, the nucleus splits and leaves behind different elements. This is a form of nuclear decay.
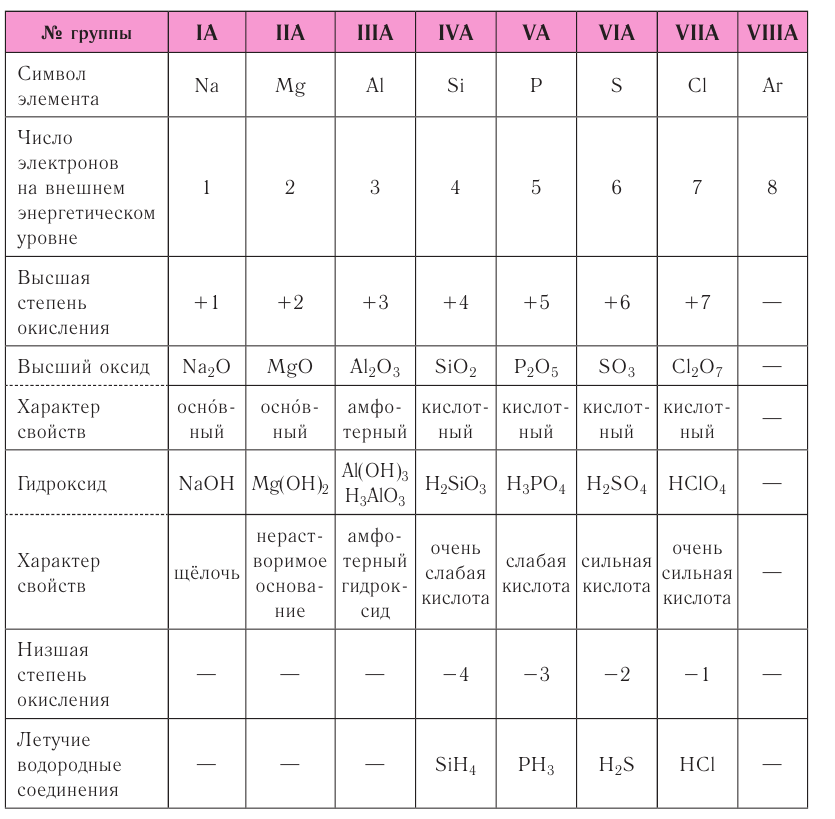
The number of protons in the nucleus is the atomic number and it defines to which chemical element the atom belongs. For example, any atom that contains 29 protons is copper. The number of neutrons defines the isotope of the element. For example, a copper atom with 34 neutrons is copper-63 (29+34), and with 36 neutrons is copper-65; natural copper is about 70% Cu-63 and the rest is Cu-65.
Atoms can attach to one or more other atoms by chemical bonds to form chemical compounds such as molecules or crystals. For example, New York City’s Statue of Liberty was originally made of pure copper, but over the years, the surface combined with oxygen, carbon and sulfur atoms to make a green patina on the copper. The ability of atoms to attach and detach is responsible for most of the physical changes observed in nature. Chemistry is the discipline that studies these changes.
History of atomic theory
In philosophy
The basic idea that matter is made up of tiny, indivisible particles is an old idea that appeared in many ancient cultures such as those of Greece and India. The word atom is derived from the ancient Greek word atomos,[a] which means «uncuttable». This ancient idea was based in philosophical reasoning rather than scientific reasoning. Modern atomic theory is not based on these old concepts.[1][2] In the early 19th century, the scientist John Dalton noticed that chemical elements seemed to combine with each other by basic units of weight, and he decided to use the word «atom» to refer to these units because he assumed that these were the fundamental units of matter. About a century later it was discovered that Dalton’s atoms are not actually indivisible, but the term stuck.
Dalton’s law of multiple proportions
Atoms and molecules as depicted in John Dalton’s A New System of Chemical Philosophy vol. 1 (1808)
In the early 1800s, the English chemist John Dalton compiled experimental data gathered by himself and other scientists and discovered a pattern now known as the «law of multiple proportions». He noticed that in chemical compounds which contain a particular chemical element, the content of that element in these compounds will differ in weight by ratios of small whole numbers. This pattern suggested to Dalton that each chemical element combines with other elements by a basic and consistent unit of weight, and he decided to call these units «atoms».
For example, there are two types of tin oxide: one is a black powder that is 88.1% tin and 11.9% oxygen, and the other is a white powder that is 78.7% tin and 21.3% oxygen. Adjusting these figures, in the black oxide there is about 13.5 g of oxygen for every 100 g of tin, and in the white oxide there is about 27 g of oxygen for every 100 g of tin. 13.5 and 27 form a ratio of 1:2. Dalton concluded that in these oxides, for every tin atom there are one or two oxygen atoms respectively (SnO and SnO2).[3][4]
Dalton also analyzed iron oxides. There is one type of iron oxide that is a black powder which is 78.1% iron and 21.9% oxygen; and there is another iron oxide that is a red powder which is 70.4% iron and 29.6% oxygen. Adjusting these figures, in the black oxide there is about 28 g of oxygen for every 100 g of iron, and in the red oxide there is about 42 g of oxygen for every 100 g of iron. 28 and 42 form a ratio of 2:3. In these respective oxides, for every two atoms of iron, there are two or three atoms of oxygen (Fe2O2 and Fe2O3).[b][5][6]
As a final example: nitrous oxide is 63.3% nitrogen and 36.7% oxygen, nitric oxide is 44.05% nitrogen and 55.95% oxygen, and nitrogen dioxide is 29.5% nitrogen and 70.5% oxygen. Adjusting these figures, in nitrous oxide there is 80 g of oxygen for every 140 g of nitrogen, in nitric oxide there is about 160 g of oxygen for every 140 g of nitrogen, and in nitrogen dioxide there is 320 g of oxygen for every 140 g of nitrogen. 80, 160, and 320 form a ratio of 1:2:4. The respective formulas for these oxides are N2O, NO, and NO2.[7][8]
Kinetic theory of gases
In 1738 Daniel Bernoulli[9] and a number of other scientists found that they could better explain the behavior of gases by describing them as collections of sub-microscopic particles and modelling their behavior using statistics and probability. Unlike Dalton’s atomic theory, the kinetic theory of gases describes not how gases react chemically with each other to form compounds, but how they behave physically: diffusion, viscosity, conductivity, pressure, etc.
Brownian motion
In 1827, botanist Robert Brown used a microscope to look at dust grains floating in water and discovered that they moved about erratically, a phenomenon that became known as «Brownian motion». This was thought to be caused by water molecules knocking the grains about. In 1905, Albert Einstein proved the reality of these molecules and their motions by producing the first statistical physics analysis of Brownian motion.[10][11][12] French physicist Jean Perrin used Einstein’s work to experimentally determine the mass and dimensions of molecules, thereby providing physical evidence for the particle nature of matter.[13]
Discovery of the electron
The Geiger–Marsden experiment:
Left: Expected results: alpha particles passing through the plum pudding model of the atom with negligible deflection.
Right: Observed results: a small portion of the particles were deflected by the concentrated positive charge of the nucleus.
In 1897, J. J. Thomson discovered that cathode rays are not electromagnetic waves but made of particles that are 1,800 times lighter than hydrogen (the lightest atom). Thomson concluded that these particles came from the atoms within the cathode — they were subatomic particles. He called these new particles corpuscles but they were later renamed electrons. Thomson also showed that electrons were identical to particles given off by photoelectric and radioactive materials.[14] It was quickly recognized that electrons are the particles that carry electric currents in metal wires.[15] Thomson concluded that these electrons emerged from the very atoms of the cathode in his instruments, which meant that atoms are not indivisible as Dalton thought.
Discovery of the nucleus
J. J. Thomson thought that the negatively-charged electrons were distributed throughout the atom in a sea of positive charge that was distributed across the whole volume of the atom.[16] This model is sometimes known as the plum pudding model.
Ernest Rutherford and his colleagues Hans Geiger and Ernest Marsden came to have doubts about the Thomson model after they encountered difficulties when they tried to build an instrument to measure the charge-to-mass ratio of alpha particles (these are positively-charged particles emitted by certain radioactive substances such as radium). The alpha particles were being scattered by the air in the detection chamber, which made the measurements unreliable. Thomson had encountered a similar problem in his work on cathode rays, which he solved by creating a near-perfect vacuum in his instruments. Rutherford didn’t think he’d run into this same problem because alpha particles are much heavier than electrons. According to Thomson’s model of the atom, the positive charge in the atom is not concentrated enough to produce an electric field strong enough to deflect an alpha particle, and the electrons are so lightweight they should be pushed aside effortlessly by the much heavier alpha particles. Yet there was scattering, so Rutherford and his colleagues decided to investigate this scattering carefully.[17]
Between 1908 and 1913, Rutherford and his colleagues performed a series of experiments in which they bombarded thin foils of metal with alpha particles. They spotted alpha particles being deflected by angles greater than 90°. To explain this, Rutherford proposed that the positive charge of the atom is not distributed throughout the atom’s volume as Thomson believed, but is concentrated in a tiny nucleus at the center. Only such an intense concentration of charge could produce an electric field strong enough to deflect the alpha particles as observed.[17]
Discovery of isotopes
While experimenting with the products of radioactive decay, in 1913 radiochemist Frederick Soddy discovered that there appeared to be more than one type of atom at each position on the periodic table.[18] The term isotope was coined by Margaret Todd as a suitable name for different atoms that belong to the same element. J. J. Thomson created a technique for isotope separation through his work on ionized gases, which subsequently led to the discovery of stable isotopes.[19]
Bohr model
The Bohr model of the atom, with an electron making instantaneous «quantum leaps» from one orbit to another with gain or loss of energy. This model of electrons in orbits is obsolete.
In 1913, the physicist Niels Bohr proposed a model in which the electrons of an atom were assumed to orbit the nucleus but could only do so in a finite set of orbits, and could jump between these orbits only in discrete changes of energy corresponding to absorption or radiation of a photon.[20] This quantization was used to explain why the electrons’ orbits are stable (given that normally, charges in acceleration, including circular motion, lose kinetic energy which is emitted as electromagnetic radiation, see synchrotron radiation) and why elements absorb and emit electromagnetic radiation in discrete spectra.[21]
Later in the same year Henry Moseley provided additional experimental evidence in favor of Niels Bohr’s theory. These results refined Ernest Rutherford’s and Antonius van den Broek’s model, which proposed that the atom contains in its nucleus a number of positive nuclear charges that is equal to its (atomic) number in the periodic table. Until these experiments, atomic number was not known to be a physical and experimental quantity. That it is equal to the atomic nuclear charge remains the accepted atomic model today.[22]
Chemical bonds between atoms were explained by Gilbert Newton Lewis in 1916, as the interactions between their constituent electrons.[23] As the chemical properties of the elements were known to largely repeat themselves according to the periodic law,[24] in 1919 the American chemist Irving Langmuir suggested that this could be explained if the electrons in an atom were connected or clustered in some manner. Groups of electrons were thought to occupy a set of electron shells about the nucleus.[25]
The Bohr model of the atom was the first complete physical model of the atom. It described the overall structure of the atom, how atoms bond to each other, and predicted the spectral lines of hydrogen. Bohr’s model was not perfect and was soon superseded by the more accurate Schrödinger model, but it was sufficient to evaporate any remaining doubts that matter is composed of atoms. For chemists, the idea of the atom had been a useful heuristic tool, but physicists had doubts as to whether matter really is made up of atoms as nobody had yet developed a complete physical model of the atom.
The Schrödinger model
The Stern–Gerlach experiment of 1922 provided further evidence of the quantum nature of atomic properties. When a beam of silver atoms was passed through a specially shaped magnetic field, the beam was split in a way correlated with the direction of an atom’s angular momentum, or spin. As this spin direction is initially random, the beam would be expected to deflect in a random direction. Instead, the beam was split into two directional components, corresponding to the atomic spin being oriented up or down with respect to the magnetic field.[26]
In 1925, Werner Heisenberg published the first consistent mathematical formulation of quantum mechanics (matrix mechanics).[22] One year earlier, Louis de Broglie had proposed the de Broglie hypothesis: that all particles behave like waves to some extent,[27] and in 1926 Erwin Schrödinger used this idea to develop the Schrödinger equation, a mathematical model of the atom (wave mechanics) that described the electrons as three-dimensional waveforms rather than point particles.[28]
A consequence of using waveforms to describe particles is that it is mathematically impossible to obtain precise values for both the position and momentum of a particle at a given point in time. This became known as the uncertainty principle, formulated by Werner Heisenberg in 1927.[22] In this concept, for a given accuracy in measuring a position one could only obtain a range of probable values for momentum, and vice versa.[29]
This model was able to explain observations of atomic behavior that previous models could not, such as certain structural and spectral patterns of atoms larger than hydrogen. Thus, the planetary model of the atom was discarded in favor of one that described atomic orbital zones around the nucleus where a given electron is most likely to be observed.[30][31]
Discovery of the neutron
The development of the mass spectrometer allowed the mass of atoms to be measured with increased accuracy. The device uses a magnet to bend the trajectory of a beam of ions, and the amount of deflection is determined by the ratio of an atom’s mass to its charge. The chemist Francis William Aston used this instrument to show that isotopes had different masses. The atomic mass of these isotopes varied by integer amounts, called the whole number rule.[32] The explanation for these different isotopes awaited the discovery of the neutron, an uncharged particle with a mass similar to the proton, by the physicist James Chadwick in 1932. Isotopes were then explained as elements with the same number of protons, but different numbers of neutrons within the nucleus.[33]
Fission, high-energy physics and condensed matter
In 1938, the German chemist Otto Hahn, a student of Rutherford, directed neutrons onto uranium atoms expecting to get transuranium elements. Instead, his chemical experiments showed barium as a product.[34][35] A year later, Lise Meitner and her nephew Otto Frisch verified that Hahn’s result were the first experimental nuclear fission.[36][37] In 1944, Hahn received the Nobel Prize in Chemistry. Despite Hahn’s efforts, the contributions of Meitner and Frisch were not recognized.[38]
In the 1950s, the development of improved particle accelerators and particle detectors allowed scientists to study the impacts of atoms moving at high energies.[39] Neutrons and protons were found to be hadrons, or composites of smaller particles called quarks. The standard model of particle physics was developed that so far has successfully explained the properties of the nucleus in terms of these sub-atomic particles and the forces that govern their interactions.[40]
Structure
Subatomic particles
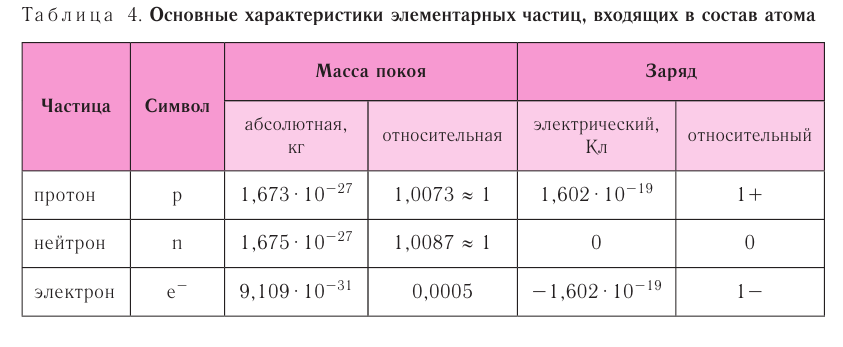
Though the word atom originally denoted a particle that cannot be cut into smaller particles, in modern scientific usage the atom is composed of various subatomic particles. The constituent particles of an atom are the electron, the proton and the neutron.
The electron is by far the least massive of these particles at 9.11×10−31 kg, with a negative electrical charge and a size that is too small to be measured using available techniques.[41] It was the lightest particle with a positive rest mass measured, until the discovery of neutrino mass. Under ordinary conditions, electrons are bound to the positively charged nucleus by the attraction created from opposite electric charges. If an atom has more or fewer electrons than its atomic number, then it becomes respectively negatively or positively charged as a whole; a charged atom is called an ion. Electrons have been known since the late 19th century, mostly thanks to J.J. Thomson; see history of subatomic physics for details.
Protons have a positive charge and a mass 1,836 times that of the electron, at 1.6726×10−27 kg. The number of protons in an atom is called its atomic number. Ernest Rutherford (1919) observed that nitrogen under alpha-particle bombardment ejects what appeared to be hydrogen nuclei. By 1920 he had accepted that the hydrogen nucleus is a distinct particle within the atom and named it proton.
Neutrons have no electrical charge and have a free mass of 1,839 times the mass of the electron, or 1.6749×10−27 kg.[42][43] Neutrons are the heaviest of the three constituent particles, but their mass can be reduced by the nuclear binding energy. Neutrons and protons (collectively known as nucleons) have comparable dimensions—on the order of 2.5×10−15 m—although the ‘surface’ of these particles is not sharply defined.[44] The neutron was discovered in 1932 by the English physicist James Chadwick.
In the Standard Model of physics, electrons are truly elementary particles with no internal structure, whereas protons and neutrons are composite particles composed of elementary particles called quarks. There are two types of quarks in atoms, each having a fractional electric charge. Protons are composed of two up quarks (each with charge +2/3) and one down quark (with a charge of −1/3). Neutrons consist of one up quark and two down quarks. This distinction accounts for the difference in mass and charge between the two particles.[45][46]
The quarks are held together by the strong interaction (or strong force), which is mediated by gluons. The protons and neutrons, in turn, are held to each other in the nucleus by the nuclear force, which is a residuum of the strong force that has somewhat different range-properties (see the article on the nuclear force for more). The gluon is a member of the family of gauge bosons, which are elementary particles that mediate physical forces.[45][46]
Nucleus
The binding energy needed for a nucleon to escape the nucleus, for various isotopes
All the bound protons and neutrons in an atom make up a tiny atomic nucleus, and are collectively called nucleons. The radius of a nucleus is approximately equal to ![{displaystyle 1.07{sqrt[{3}]{A}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a74a6ca6998768195969eef75ca046e8431c29d3)

Atoms of the same element have the same number of protons, called the atomic number. Within a single element, the number of neutrons may vary, determining the isotope of that element. The total number of protons and neutrons determine the nuclide. The number of neutrons relative to the protons determines the stability of the nucleus, with certain isotopes undergoing radioactive decay.[49]
The proton, the electron, and the neutron are classified as fermions. Fermions obey the Pauli exclusion principle which prohibits identical fermions, such as multiple protons, from occupying the same quantum state at the same time. Thus, every proton in the nucleus must occupy a quantum state different from all other protons, and the same applies to all neutrons of the nucleus and to all electrons of the electron cloud.[50]
A nucleus that has a different number of protons than neutrons can potentially drop to a lower energy state through a radioactive decay that causes the number of protons and neutrons to more closely match. As a result, atoms with matching numbers of protons and neutrons are more stable against decay, but with increasing atomic number, the mutual repulsion of the protons requires an increasing proportion of neutrons to maintain the stability of the nucleus.[50]
Illustration of a nuclear fusion process that forms a deuterium nucleus, consisting of a proton and a neutron, from two protons. A positron (e+)—an antimatter electron—is emitted along with an electron neutrino.
The number of protons and neutrons in the atomic nucleus can be modified, although this can require very high energies because of the strong force. Nuclear fusion occurs when multiple atomic particles join to form a heavier nucleus, such as through the energetic collision of two nuclei. For example, at the core of the Sun protons require energies of 3 to 10 keV to overcome their mutual repulsion—the coulomb barrier—and fuse together into a single nucleus.[51] Nuclear fission is the opposite process, causing a nucleus to split into two smaller nuclei—usually through radioactive decay. The nucleus can also be modified through bombardment by high energy subatomic particles or photons. If this modifies the number of protons in a nucleus, the atom changes to a different chemical element.[52][53]
If the mass of the nucleus following a fusion reaction is less than the sum of the masses of the separate particles, then the difference between these two values can be emitted as a type of usable energy (such as a gamma ray, or the kinetic energy of a beta particle), as described by Albert Einstein’s mass-energy equivalence formula, 


The fusion of two nuclei that create larger nuclei with lower atomic numbers than iron and nickel—a total nucleon number of about 60—is usually an exothermic process that releases more energy than is required to bring them together.[55] It is this energy-releasing process that makes nuclear fusion in stars a self-sustaining reaction. For heavier nuclei, the binding energy per nucleon in the nucleus begins to decrease. That means fusion processes producing nuclei that have atomic numbers higher than about 26, and atomic masses higher than about 60, is an endothermic process. These more massive nuclei can not undergo an energy-producing fusion reaction that can sustain the hydrostatic equilibrium of a star.[50]
Electron cloud
A potential well, showing, according to classical mechanics, the minimum energy V(x) needed to reach each position x. Classically, a particle with energy E is constrained to a range of positions between x1 and x2.
The electrons in an atom are attracted to the protons in the nucleus by the electromagnetic force. This force binds the electrons inside an electrostatic potential well surrounding the smaller nucleus, which means that an external source of energy is needed for the electron to escape. The closer an electron is to the nucleus, the greater the attractive force. Hence electrons bound near the center of the potential well require more energy to escape than those at greater separations.
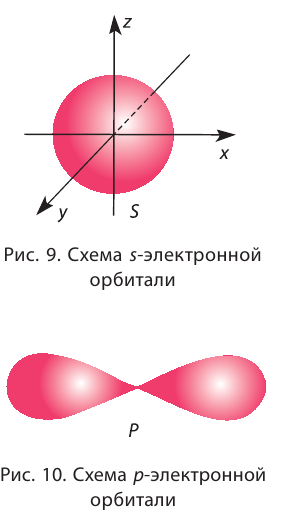
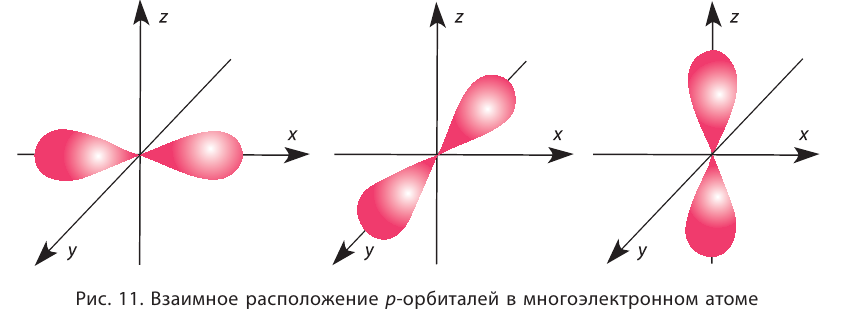
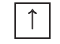
Electrons, like other particles, have properties of both a particle and a wave. The electron cloud is a region inside the potential well where each electron forms a type of three-dimensional standing wave—a wave form that does not move relative to the nucleus. This behavior is defined by an atomic orbital, a mathematical function that characterises the probability that an electron appears to be at a particular location when its position is measured.[56] Only a discrete (or quantized) set of these orbitals exist around the nucleus, as other possible wave patterns rapidly decay into a more stable form.[57] Orbitals can have one or more ring or node structures, and differ from each other in size, shape and orientation.[58]
3D views of some hydrogen-like atomic orbitals showing probability density and phase (g orbitals and higher are not shown)
Each atomic orbital corresponds to a particular energy level of the electron. The electron can change its state to a higher energy level by absorbing a photon with sufficient energy to boost it into the new quantum state. Likewise, through spontaneous emission, an electron in a higher energy state can drop to a lower energy state while radiating the excess energy as a photon. These characteristic energy values, defined by the differences in the energies of the quantum states, are responsible for atomic spectral lines.[57]
The amount of energy needed to remove or add an electron—the electron binding energy—is far less than the binding energy of nucleons. For example, it requires only 13.6 eV to strip a ground-state electron from a hydrogen atom,[59] compared to 2.23 million eV for splitting a deuterium nucleus.[60] Atoms are electrically neutral if they have an equal number of protons and electrons. Atoms that have either a deficit or a surplus of electrons are called ions. Electrons that are farthest from the nucleus may be transferred to other nearby atoms or shared between atoms. By this mechanism, atoms are able to bond into molecules and other types of chemical compounds like ionic and covalent network crystals.[61]
Properties
Nuclear properties
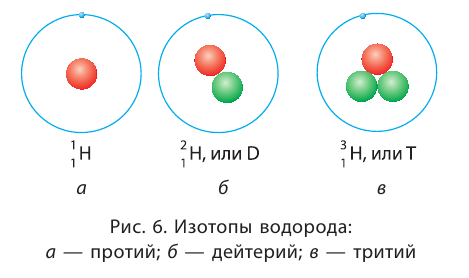
By definition, any two atoms with an identical number of protons in their nuclei belong to the same chemical element. Atoms with equal numbers of protons but a different number of neutrons are different isotopes of the same element. For example, all hydrogen atoms admit exactly one proton, but isotopes exist with no neutrons (hydrogen-1, by far the most common form,[62] also called protium), one neutron (deuterium), two neutrons (tritium) and more than two neutrons. The known elements form a set of atomic numbers, from the single-proton element hydrogen up to the 118-proton element oganesson.[63] All known isotopes of elements with atomic numbers greater than 82 are radioactive, although the radioactivity of element 83 (bismuth) is so slight as to be practically negligible.[64][65]
About 339 nuclides occur naturally on Earth,[66] of which 251 (about 74%) have not been observed to decay, and are referred to as «stable isotopes». Only 90 nuclides are stable theoretically, while another 161 (bringing the total to 251) have not been observed to decay, even though in theory it is energetically possible. These are also formally classified as «stable». An additional 35 radioactive nuclides have half-lives longer than 100 million years, and are long-lived enough to have been present since the birth of the Solar System. This collection of 286 nuclides are known as primordial nuclides. Finally, an additional 53 short-lived nuclides are known to occur naturally, as daughter products of primordial nuclide decay (such as radium from uranium), or as products of natural energetic processes on Earth, such as cosmic ray bombardment (for example, carbon-14).[67][note 1]
For 80 of the chemical elements, at least one stable isotope exists. As a rule, there is only a handful of stable isotopes for each of these elements, the average being 3.1 stable isotopes per element. Twenty-six «monoisotopic elements» have only a single stable isotope, while the largest number of stable isotopes observed for any element is ten, for the element tin. Elements 43, 61, and all elements numbered 83 or higher have no stable isotopes.[68]: 1–12
Stability of isotopes is affected by the ratio of protons to neutrons, and also by the presence of certain «magic numbers» of neutrons or protons that represent closed and filled quantum shells. These quantum shells correspond to a set of energy levels within the shell model of the nucleus; filled shells, such as the filled shell of 50 protons for tin, confers unusual stability on the nuclide. Of the 251 known stable nuclides, only four have both an odd number of protons and odd number of neutrons: hydrogen-2 (deuterium), lithium-6, boron-10, and nitrogen-14. (Tantalum-180m is odd-odd and observationally stable, but is predicted to decay with a very long half-life.) Also, only four naturally occurring, radioactive odd-odd nuclides have a half-life over a billion years: potassium-40, vanadium-50, lanthanum-138, and lutetium-176. Most odd-odd nuclei are highly unstable with respect to beta decay, because the decay products are even-even, and are therefore more strongly bound, due to nuclear pairing effects.[69]
Mass
The large majority of an atom’s mass comes from the protons and neutrons that make it up. The total number of these particles (called «nucleons») in a given atom is called the mass number. It is a positive integer and dimensionless (instead of having dimension of mass), because it expresses a count. An example of use of a mass number is «carbon-12,» which has 12 nucleons (six protons and six neutrons).
The actual mass of an atom at rest is often expressed in daltons (Da), also called the unified atomic mass unit (u). This unit is defined as a twelfth of the mass of a free neutral atom of carbon-12, which is approximately 1.66×10−27 kg.[70] Hydrogen-1 (the lightest isotope of hydrogen which is also the nuclide with the lowest mass) has an atomic weight of 1.007825 Da.[71] The value of this number is called the atomic mass. A given atom has an atomic mass approximately equal (within 1%) to its mass number times the atomic mass unit (for example the mass of a nitrogen-14 is roughly 14 Da), but this number will not be exactly an integer except (by definition) in the case of carbon-12.[72] The heaviest stable atom is lead-208,[64] with a mass of 207.9766521 Da.[73]
As even the most massive atoms are far too light to work with directly, chemists instead use the unit of moles. One mole of atoms of any element always has the same number of atoms (about 6.022×1023). This number was chosen so that if an element has an atomic mass of 1 u, a mole of atoms of that element has a mass close to one gram. Because of the definition of the unified atomic mass unit, each carbon-12 atom has an atomic mass of exactly 12 Da, and so a mole of carbon-12 atoms weighs exactly 0.012 kg.[70]
Shape and size
Atoms lack a well-defined outer boundary, so their dimensions are usually described in terms of an atomic radius. This is a measure of the distance out to which the electron cloud extends from the nucleus.[74] This assumes the atom to exhibit a spherical shape, which is only obeyed for atoms in vacuum or free space. Atomic radii may be derived from the distances between two nuclei when the two atoms are joined in a chemical bond. The radius varies with the location of an atom on the atomic chart, the type of chemical bond, the number of neighboring atoms (coordination number) and a quantum mechanical property known as spin.[75] On the periodic table of the elements, atom size tends to increase when moving down columns, but decrease when moving across rows (left to right).[76] Consequently, the smallest atom is helium with a radius of 32 pm, while one of the largest is caesium at 225 pm.[77]
When subjected to external forces, like electrical fields, the shape of an atom may deviate from spherical symmetry. The deformation depends on the field magnitude and the orbital type of outer shell electrons, as shown by group-theoretical considerations. Aspherical deviations might be elicited for instance in crystals, where large crystal-electrical fields may occur at low-symmetry lattice sites.[78][79] Significant ellipsoidal deformations have been shown to occur for sulfur ions[80] and chalcogen ions[81] in pyrite-type compounds.
Atomic dimensions are thousands of times smaller than the wavelengths of light (400–700 nm) so they cannot be viewed using an optical microscope, although individual atoms can be observed using a scanning tunneling microscope. To visualize the minuteness of the atom, consider that a typical human hair is about 1 million carbon atoms in width.[82] A single drop of water contains about 2 sextillion (2×1021) atoms of oxygen, and twice the number of hydrogen atoms.[83] A single carat diamond with a mass of 2×10−4 kg contains about 10 sextillion (1022) atoms of carbon.[note 2] If an apple were magnified to the size of the Earth, then the atoms in the apple would be approximately the size of the original apple.[84]
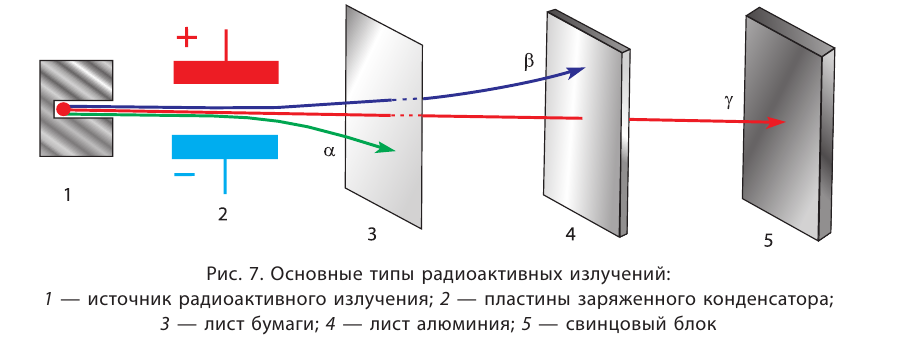
Radioactive decay
This diagram shows the half-life (T1⁄2) of various isotopes with Z protons and N neutrons.
Every element has one or more isotopes that have unstable nuclei that are subject to radioactive decay, causing the nucleus to emit particles or electromagnetic radiation. Radioactivity can occur when the radius of a nucleus is large compared with the radius of the strong force, which only acts over distances on the order of 1 fm.[85]
The most common forms of radioactive decay are:[86][87]
- Alpha decay: this process is caused when the nucleus emits an alpha particle, which is a helium nucleus consisting of two protons and two neutrons. The result of the emission is a new element with a lower atomic number.
- Beta decay (and electron capture): these processes are regulated by the weak force, and result from a transformation of a neutron into a proton, or a proton into a neutron. The neutron to proton transition is accompanied by the emission of an electron and an antineutrino, while proton to neutron transition (except in electron capture) causes the emission of a positron and a neutrino. The electron or positron emissions are called beta particles. Beta decay either increases or decreases the atomic number of the nucleus by one. Electron capture is more common than positron emission, because it requires less energy. In this type of decay, an electron is absorbed by the nucleus, rather than a positron emitted from the nucleus. A neutrino is still emitted in this process, and a proton changes to a neutron.
- Gamma decay: this process results from a change in the energy level of the nucleus to a lower state, resulting in the emission of electromagnetic radiation. The excited state of a nucleus which results in gamma emission usually occurs following the emission of an alpha or a beta particle. Thus, gamma decay usually follows alpha or beta decay.
Other more rare types of radioactive decay include ejection of neutrons or protons or clusters of nucleons from a nucleus, or more than one beta particle. An analog of gamma emission which allows excited nuclei to lose energy in a different way, is internal conversion—a process that produces high-speed electrons that are not beta rays, followed by production of high-energy photons that are not gamma rays. A few large nuclei explode into two or more charged fragments of varying masses plus several neutrons, in a decay called spontaneous nuclear fission.
Each radioactive isotope has a characteristic decay time period—the half-life—that is determined by the amount of time needed for half of a sample to decay. This is an exponential decay process that steadily decreases the proportion of the remaining isotope by 50% every half-life. Hence after two half-lives have passed only 25% of the isotope is present, and so forth.[85]
Magnetic moment
Elementary particles possess an intrinsic quantum mechanical property known as spin. This is analogous to the angular momentum of an object that is spinning around its center of mass, although strictly speaking these particles are believed to be point-like and cannot be said to be rotating. Spin is measured in units of the reduced Planck constant (ħ), with electrons, protons and neutrons all having spin 1⁄2 ħ, or «spin-1⁄2«. In an atom, electrons in motion around the nucleus possess orbital angular momentum in addition to their spin, while the nucleus itself possesses angular momentum due to its nuclear spin.[88]
The magnetic field produced by an atom—its magnetic moment—is determined by these various forms of angular momentum, just as a rotating charged object classically produces a magnetic field, but the most dominant contribution comes from electron spin. Due to the nature of electrons to obey the Pauli exclusion principle, in which no two electrons may be found in the same quantum state, bound electrons pair up with each other, with one member of each pair in a spin up state and the other in the opposite, spin down state. Thus these spins cancel each other out, reducing the total magnetic dipole moment to zero in some atoms with even number of electrons.[89]
In ferromagnetic elements such as iron, cobalt and nickel, an odd number of electrons leads to an unpaired electron and a net overall magnetic moment. The orbitals of neighboring atoms overlap and a lower energy state is achieved when the spins of unpaired electrons are aligned with each other, a spontaneous process known as an exchange interaction. When the magnetic moments of ferromagnetic atoms are lined up, the material can produce a measurable macroscopic field. Paramagnetic materials have atoms with magnetic moments that line up in random directions when no magnetic field is present, but the magnetic moments of the individual atoms line up in the presence of a field.[89][90]
The nucleus of an atom will have no spin when it has even numbers of both neutrons and protons, but for other cases of odd numbers, the nucleus may have a spin. Normally nuclei with spin are aligned in random directions because of thermal equilibrium, but for certain elements (such as xenon-129) it is possible to polarize a significant proportion of the nuclear spin states so that they are aligned in the same direction—a condition called hyperpolarization. This has important applications in magnetic resonance imaging.[91][92]
Energy levels
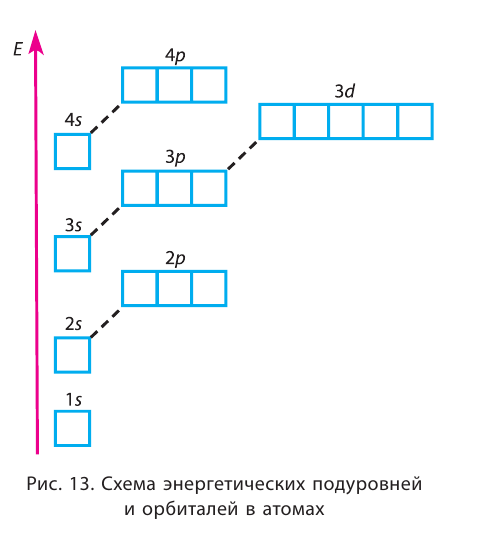
These electron’s energy levels (not to scale) are sufficient for ground states of atoms up to cadmium (5s2 4d10) inclusively. Do not forget that even the top of the diagram is lower than an unbound electron state.
The potential energy of an electron in an atom is negative relative to when the distance from the nucleus goes to infinity; its dependence on the electron’s position reaches the minimum inside the nucleus, roughly in inverse proportion to the distance. In the quantum-mechanical model, a bound electron can occupy only a set of states centered on the nucleus, and each state corresponds to a specific energy level; see time-independent Schrödinger equation for a theoretical explanation. An energy level can be measured by the amount of energy needed to unbind the electron from the atom, and is usually given in units of electronvolts (eV). The lowest energy state of a bound electron is called the ground state, i.e. stationary state, while an electron transition to a higher level results in an excited state.[93] The electron’s energy increases along with n because the (average) distance to the nucleus increases. Dependence of the energy on ℓ is caused not by the electrostatic potential of the nucleus, but by interaction between electrons.
For an electron to transition between two different states, e.g. ground state to first excited state, it must absorb or emit a photon at an energy matching the difference in the potential energy of those levels, according to the Niels Bohr model, what can be precisely calculated by the Schrödinger equation.
Electrons jump between orbitals in a particle-like fashion. For example, if a single photon strikes the electrons, only a single electron changes states in response to the photon; see Electron properties.
The energy of an emitted photon is proportional to its frequency, so these specific energy levels appear as distinct bands in the electromagnetic spectrum.[94] Each element has a characteristic spectrum that can depend on the nuclear charge, subshells filled by electrons, the electromagnetic interactions between the electrons and other factors.[95]
An example of absorption lines in a spectrum
When a continuous spectrum of energy is passed through a gas or plasma, some of the photons are absorbed by atoms, causing electrons to change their energy level. Those excited electrons that remain bound to their atom spontaneously emit this energy as a photon, traveling in a random direction, and so drop back to lower energy levels. Thus the atoms behave like a filter that forms a series of dark absorption bands in the energy output. (An observer viewing the atoms from a view that does not include the continuous spectrum in the background, instead sees a series of emission lines from the photons emitted by the atoms.) Spectroscopic measurements of the strength and width of atomic spectral lines allow the composition and physical properties of a substance to be determined.[96]
Close examination of the spectral lines reveals that some display a fine structure splitting. This occurs because of spin–orbit coupling, which is an interaction between the spin and motion of the outermost electron.[97] When an atom is in an external magnetic field, spectral lines become split into three or more components; a phenomenon called the Zeeman effect. This is caused by the interaction of the magnetic field with the magnetic moment of the atom and its electrons. Some atoms can have multiple electron configurations with the same energy level, which thus appear as a single spectral line. The interaction of the magnetic field with the atom shifts these electron configurations to slightly different energy levels, resulting in multiple spectral lines.[98] The presence of an external electric field can cause a comparable splitting and shifting of spectral lines by modifying the electron energy levels, a phenomenon called the Stark effect.[99]
If a bound electron is in an excited state, an interacting photon with the proper energy can cause stimulated emission of a photon with a matching energy level. For this to occur, the electron must drop to a lower energy state that has an energy difference matching the energy of the interacting photon. The emitted photon and the interacting photon then move off in parallel and with matching phases. That is, the wave patterns of the two photons are synchronized. This physical property is used to make lasers, which can emit a coherent beam of light energy in a narrow frequency band.[100]
Valence and bonding behavior
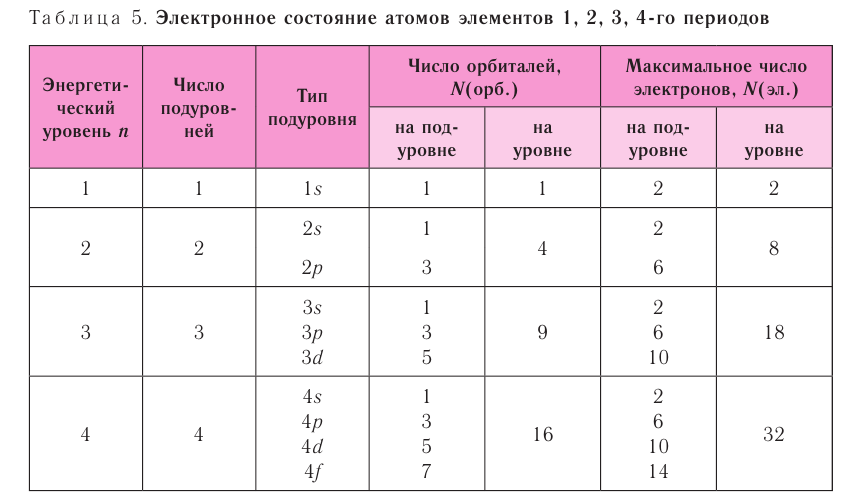
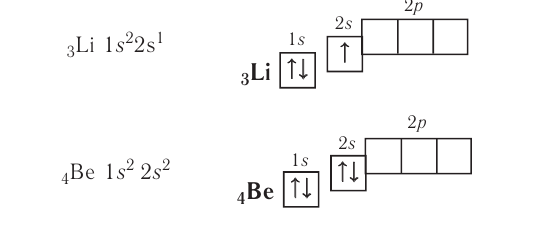
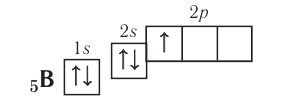
Valency is the combining power of an element. It is determined by the number of bonds it can form to other atoms or groups.[101] The outermost electron shell of an atom in its uncombined state is known as the valence shell, and the electrons in
that shell are called valence electrons. The number of valence electrons determines the bonding
behavior with other atoms. Atoms tend to chemically react with each other in a manner that fills (or empties) their outer valence shells.[102] For example, a transfer of a single electron between atoms is a useful approximation for bonds that form between atoms with one-electron more than a filled shell, and others that are one-electron short of a full shell, such as occurs in the compound sodium chloride and other chemical ionic salts. Many elements display multiple valences, or tendencies to share differing numbers of electrons in different compounds. Thus, chemical bonding between these elements takes many forms of electron-sharing that are more than simple electron transfers. Examples include the element carbon and the organic compounds.[103]
The chemical elements are often displayed in a periodic table that is laid out to display recurring chemical properties, and elements with the same number of valence electrons form a group that is aligned in the same column of the table. (The horizontal rows correspond to the filling of a quantum shell of electrons.) The elements at the far right of the table have their outer shell completely filled with electrons, which results in chemically inert elements known as the noble gases.[104][105]
States
Quantities of atoms are found in different states of matter that depend on the physical conditions, such as temperature and pressure. By varying the conditions, materials can transition between solids, liquids, gases and plasmas.[106] Within a state, a material can also exist in different allotropes. An example of this is solid carbon, which can exist as graphite or diamond.[107] Gaseous allotropes exist as well, such as dioxygen and ozone.
At temperatures close to absolute zero, atoms can form a Bose–Einstein condensate, at which point quantum mechanical effects, which are normally only observed at the atomic scale, become apparent on a macroscopic scale.[108][109] This super-cooled collection of atoms
then behaves as a single super atom, which may allow fundamental checks of quantum mechanical behavior.[110]
Identification
While atoms are too small to be seen, devices such as the scanning tunneling microscope (STM) enable their visualization at the surfaces of solids. The microscope uses the quantum tunneling phenomenon, which allows particles to pass through a barrier that would be insurmountable in the classical perspective. Electrons tunnel through the vacuum between two biased electrodes, providing a tunneling current that is exponentially dependent on their separation. One electrode is a sharp tip ideally ending with a single atom. At each point of the scan of the surface the tip’s height is adjusted so as to keep the tunneling current at a set value. How much the tip moves to and away from the surface is interpreted as the height profile. For low bias, the microscope images the averaged electron orbitals across closely packed energy levels—the local density of the electronic states near the Fermi level.[111][112] Because of the distances involved, both electrodes need to be extremely stable; only then periodicities can be observed that correspond to individual atoms. The method alone is not chemically specific, and cannot identify the atomic species present at the surface.
Atoms can be easily identified by their mass. If an atom is ionized by removing one of its electrons, its trajectory when it passes through a magnetic field will bend. The radius by which the trajectory of a moving ion is turned by the magnetic field is determined by the mass of the atom. The mass spectrometer uses this principle to measure the mass-to-charge ratio of ions. If a sample contains multiple isotopes, the mass spectrometer can determine the proportion of each isotope in the sample by measuring the intensity of the different beams of ions. Techniques to vaporize atoms include inductively coupled plasma atomic emission spectroscopy and inductively coupled plasma mass spectrometry, both of which use a plasma to vaporize samples for analysis.[113]
The atom-probe tomograph has sub-nanometer resolution in 3-D and can chemically identify individual atoms using time-of-flight mass spectrometry.[114]
Electron emission techniques such as X-ray photoelectron spectroscopy (XPS) and Auger electron spectroscopy (AES), which measure the binding energies of the core electrons, are used to identify the atomic species present in a sample in a non-destructive way. With proper focusing both can be made area-specific. Another such method is electron energy loss spectroscopy (EELS), which measures the energy loss of an electron beam within a transmission electron microscope when it interacts with a portion of a sample.
Spectra of excited states can be used to analyze the atomic composition of distant stars. Specific light wavelengths contained in the observed light from stars can be separated out and related to the quantized transitions in free gas atoms. These colors can be replicated using a gas-discharge lamp containing the same element.[115] Helium was discovered in this way in the spectrum of the Sun 23 years before it was found on Earth.[116]
Origin and current state
Baryonic matter forms about 4% of the total energy density of the observable universe, with an average density of about 0.25 particles/m3 (mostly protons and electrons).[117] Within a galaxy such as the Milky Way, particles have a much higher concentration, with the density of matter in the interstellar medium (ISM) ranging from 105 to 109 atoms/m3.[118] The Sun is believed to be inside the Local Bubble, so the density in the solar neighborhood is only about 103 atoms/m3.[119] Stars form from dense clouds in the ISM, and the evolutionary processes of stars result in the steady enrichment of the ISM with elements more massive than hydrogen and helium.
Up to 95% of the Milky Way’s baryonic matter are concentrated inside stars, where conditions are unfavorable for atomic matter. The total baryonic mass is about 10% of the mass of the galaxy;[120] the remainder of the mass is an unknown dark matter.[121] High temperature inside stars makes most «atoms» fully ionized, that is, separates all electrons from the nuclei. In stellar remnants—with exception of their surface layers—an immense pressure make electron shells impossible.
Formation
Periodic table showing the origin of each element. Elements from carbon up to sulfur may be made in small stars by the alpha process. Elements beyond iron are made in large stars with slow neutron capture (s-process). Elements heavier than iron may be made in neutron star mergers or supernovae after the r-process.
Electrons are thought to exist in the Universe since early stages of the Big Bang. Atomic nuclei forms in nucleosynthesis reactions. In about three minutes Big Bang nucleosynthesis produced most of the helium, lithium, and deuterium in the Universe, and perhaps some of the beryllium and boron.[122][123][124]
Ubiquitousness and stability of atoms relies on their binding energy, which means that an atom has a lower energy than an unbound system of the nucleus and electrons. Where the temperature is much higher than ionization potential, the matter exists in the form of plasma—a gas of positively charged ions (possibly, bare nuclei) and electrons. When the temperature drops below the ionization potential, atoms become statistically favorable. Atoms (complete with bound electrons) became to dominate over charged particles 380,000 years after the Big Bang—an epoch called recombination, when the expanding Universe cooled enough to allow electrons to become attached to nuclei.[125]
Since the Big Bang, which produced no carbon or heavier elements, atomic nuclei have been combined in stars through the process of nuclear fusion to produce more of the element helium, and (via the triple alpha process) the sequence of elements from carbon up to iron;[126] see stellar nucleosynthesis for details.
Isotopes such as lithium-6, as well as some beryllium and boron are generated in space through cosmic ray spallation.[127] This occurs when a high-energy proton strikes an atomic nucleus, causing large numbers of nucleons to be ejected.
Elements heavier than iron were produced in supernovae and colliding neutron stars through the r-process, and in AGB stars through the s-process, both of which involve the capture of neutrons by atomic nuclei.[128] Elements such as lead formed largely through the radioactive decay of heavier elements.[129]
Earth
Most of the atoms that make up the Earth and its inhabitants were present in their current form in the nebula that collapsed out of a molecular cloud to form the Solar System. The rest are the result of radioactive decay, and their relative proportion can be used to determine the age of the Earth through radiometric dating.[130][131] Most of the helium in the crust of the Earth (about 99% of the helium from gas wells, as shown by its lower abundance of helium-3) is a product of alpha decay.[132]
There are a few trace atoms on Earth that were not present at the beginning (i.e., not «primordial»), nor are results of radioactive decay. Carbon-14 is continuously generated by cosmic rays in the atmosphere.[133] Some atoms on Earth have been artificially generated either deliberately or as by-products of nuclear reactors or explosions.[134][135] Of the transuranic elements—those with atomic numbers greater than 92—only plutonium and neptunium occur naturally on Earth.[136][137] Transuranic elements have radioactive lifetimes shorter than the current age of the Earth[138] and thus identifiable quantities of these elements have long since decayed, with the exception of traces of plutonium-244 possibly deposited by cosmic dust.[130] Natural deposits of plutonium and neptunium are produced by neutron capture in uranium ore.[139]
The Earth contains approximately 1.33×1050 atoms.[140] Although small numbers of independent atoms of noble gases exist, such as argon, neon, and helium, 99% of the atmosphere is bound in the form of molecules, including carbon dioxide and diatomic oxygen and nitrogen. At the surface of the Earth, an overwhelming majority of atoms combine to form various compounds, including water, salt, silicates and oxides. Atoms can also combine to create materials that do not consist of discrete molecules, including crystals and liquid or solid metals.[141][142] This atomic matter forms networked arrangements that lack the particular type of small-scale interrupted order associated with molecular matter.[143]
Rare and theoretical forms
Superheavy elements
All nuclides with atomic numbers higher than 82 (lead) are known to be radioactive. No nuclide with an atomic number exceeding 92 (uranium) exists on Earth as a primordial nuclide, and heavier elements generally have shorter half-lives. Nevertheless, an «island of stability» encompassing relatively long-lived isotopes of superheavy elements[144] with atomic numbers 110 to 114 might exist.[145] Predictions for the half-life of the most stable nuclide on the island range from a few minutes to millions of years.[146] In any case, superheavy elements (with Z > 104) would not exist due to increasing Coulomb repulsion (which results in spontaneous fission with increasingly short half-lives) in the absence of any stabilizing effects.[147]
Exotic matter
Each particle of matter has a corresponding antimatter particle with the opposite electrical charge. Thus, the positron is a positively charged antielectron and the antiproton is a negatively charged equivalent of a proton. When a matter and corresponding antimatter particle meet, they annihilate each other. Because of this, along with an imbalance between the number of matter and antimatter particles, the latter are rare in the universe. The first causes of this imbalance are not yet fully understood, although theories of baryogenesis may offer an explanation. As a result, no antimatter atoms have been discovered in nature.[148][149] In 1996, the antimatter counterpart of the hydrogen atom (antihydrogen) was synthesized at the CERN laboratory in Geneva.[150][151]
Other exotic atoms have been created by replacing one of the protons, neutrons or electrons with other particles that have the same charge. For example, an electron can be replaced by a more massive muon, forming a muonic atom. These types of atoms can be used to test fundamental predictions of physics.[152][153][154]
See also
- History of quantum mechanics
- Infinite divisibility
- Outline of chemistry
- Motion
- Timeline of atomic and subatomic physics
- Nuclear model
- Radioactive isotope
Notes
- ^ For more recent updates see Brookhaven National Laboratory’s Interactive Chart of Nuclides ] Archived 25 July 2020 at the Wayback Machine.
- ^ A carat is 200 milligrams. By definition, carbon-12 has 0.012 kg per mole. The Avogadro constant defines 6×1023 atoms per mole.
- ^ a combination of the negative term «a-» and «τομή,» the term for «cut»
- ^ Iron(II) oxide’s formula is written here as «Fe2O2» rather than the more conventional «FeO» because this better illustrates the explanation.
References
- ^ Pullman, Bernard (1998). The Atom in the History of Human Thought. Oxford, England: Oxford University Press. pp. 31–33. ISBN 978-0-19-515040-7. Archived from the original on 5 February 2021. Retrieved 25 October 2020.
- ^ Melsen (1952). From Atomos to Atom, pp. 18-19
- ^ Dalton (1817). A New System of Chemical Philosophy vol. 2, p. 36
- ^ Melsen (1952). From Atomos to Atom, p. 137
- ^ Dalton (1817). A New System of Chemical Philosophy vol. 2, pp. 28
- ^ Millington (1906). John Dalton, p. 113
- ^ Dalton (1808). A New System of Chemical Philosophy vol. 1, pp. 316-319
- ^ Holbrow et al. (2010). Modern Introductory Physics, pp. 65-66
- ^ Bernoulli, Daniel (1738). Hydrodynamica, sive de viribus et motibus fluidorum commentarii (in Latin, source ETH-Bibliothek Zurich, Rar 5503). sumptibus Johannis Reinholdi Dulseckeri; Typis Joh. Deckeri, typographi Basiliensis. doi:10.3931/e-rara-3911.
- ^ Einstein, Albert (1905). «Über die von der molekularkinetischen Theorie der Wärme geforderte Bewegung von in ruhenden Flüssigkeiten suspendierten Teilchen» (PDF). Annalen der Physik (in German). 322 (8): 549–560. Bibcode:1905AnP…322..549E. doi:10.1002/andp.19053220806. Archived (PDF) from the original on 18 July 2007.
- ^ Mazo, Robert M. (2002). Brownian Motion: Fluctuations, Dynamics, and Applications. Oxford University Press. pp. 1–7. ISBN 978-0-19-851567-8. OCLC 48753074.
- ^ Lee, Y.K.; Hoon, K. (1995). «Brownian Motion». Imperial College. Archived from the original on 18 December 2007.
- ^ Patterson, G. (2007). «Jean Perrin and the triumph of the atomic doctrine». Endeavour. 31 (2): 50–53. doi:10.1016/j.endeavour.2007.05.003. PMID 17602746.
- ^ Thomson, J.J. (August 1901). «On bodies smaller than atoms». The Popular Science Monthly: 323–335. Archived from the original on 1 December 2016. Retrieved 21 June 2009.
- ^ «The Mechanism Of Conduction In Metals» Archived 25 October 2012 at the Wayback Machine, Think Quest.
- ^ Navarro (2012). A History of the Electron, p. 94
- ^ a b Heilbron (2003). Ernest Rutherford and the Explosion of Atoms, pp. 64-68
- ^ «Frederick Soddy, The Nobel Prize in Chemistry 1921». Nobel Foundation. Archived from the original on 9 April 2008. Retrieved 18 January 2008.
- ^ Thomson, Joseph John (1913). «Rays of positive electricity». Proceedings of the Royal Society. A. 89 (607): 1–20. Bibcode:1913RSPSA..89….1T. doi:10.1098/rspa.1913.0057. Archived from the original on 4 November 2016.
- ^ Stern, David P. (16 May 2005). «The Atomic Nucleus and Bohr’s Early Model of the Atom». NASA/Goddard Space Flight Center. Archived from the original on 20 August 2007.
- ^ Bohr, Niels (11 December 1922). «Niels Bohr, The Nobel Prize in Physics 1922, Nobel Lecture». Nobel Foundation. Archived from the original on 15 April 2008.
- ^ a b c Pais, Abraham (1986). Inward Bound: Of Matter and Forces in the Physical World. New York: Oxford University Press. pp. 228–230. ISBN 978-0-19-851971-3.
- ^ Lewis, Gilbert N. (1916). «The Atom and the Molecule». Journal of the American Chemical Society. 38 (4): 762–786. doi:10.1021/ja02261a002. S2CID 95865413. Archived (PDF) from the original on 25 August 2019.
- ^ Scerri, Eric R. (2007). The periodic table: its story and its significance. Oxford University Press US. pp. 205–226. ISBN 978-0-19-530573-9.
- ^ Langmuir, Irving (1919). «The Arrangement of Electrons in Atoms and Molecules». Journal of the American Chemical Society. 41 (6): 868–934. doi:10.1021/ja02227a002. Archived from the original on 21 June 2019.
- ^ Scully, Marlan O.; Lamb, Willis E.; Barut, Asim (1987). «On the theory of the Stern-Gerlach apparatus». Foundations of Physics. 17 (6): 575–583. Bibcode:1987FoPh…17..575S. doi:10.1007/BF01882788. S2CID 122529426.
- ^ McEvoy, J. P.; Zarate, Oscar (2004). Introducing Quantum Theory. Totem Books. pp. 110–114. ISBN 978-1-84046-577-8.
- ^ Kozłowski, Miroslaw (2019). «The Schrödinger equation A History».
- ^ Chad Orzel (16 September 2014). «What is the Heisenberg Uncertainty Principle?». TED-Ed. Archived from the original on 13 September 2015 – via YouTube.
- ^ Brown, Kevin (2007). «The Hydrogen Atom». MathPages. Archived from the original on 5 September 2012.
- ^ Harrison, David M. (2000). «The Development of Quantum Mechanics». University of Toronto. Archived from the original on 25 December 2007.
- ^ Aston, Francis W. (1920). «The constitution of atmospheric neon». Philosophical Magazine. 39 (6): 449–455. doi:10.1080/14786440408636058. Archived from the original on 27 April 2021. Retrieved 25 October 2020.
- ^ Chadwick, James (12 December 1935). «Nobel Lecture: The Neutron and Its Properties». Nobel Foundation. Archived from the original on 12 October 2007.
- ^ Bowden, Mary Ellen (1997). «Otto Hahn, Lise Meitner, and Fritz Strassmann». Chemical achievers : the human face of the chemical sciences. Philadelphia, PA: Chemical Heritage Foundation. pp. 76–80, 125. ISBN 978-0-941901-12-3.
- ^ «Otto Hahn, Lise Meitner, and Fritz Strassmann». Science History Institute. June 2016. Archived from the original on 21 March 2018.
- ^ Meitner, Lise; Frisch, Otto Robert (1939). «Disintegration of uranium by neutrons: a new type of nuclear reaction». Nature. 143 (3615): 239–240. Bibcode:1939Natur.143..239M. doi:10.1038/143239a0. S2CID 4113262.
- ^ Schroeder, M. «Lise Meitner – Zur 125. Wiederkehr Ihres Geburtstages» (in German). Archived from the original on 19 July 2011. Retrieved 4 June 2009.
- ^ Crawford, E.; Sime, Ruth Lewin; Walker, Mark (1997). «A Nobel tale of postwar injustice». Physics Today. 50 (9): 26–32. Bibcode:1997PhT….50i..26C. doi:10.1063/1.881933.
- ^ Kullander, Sven (28 August 2001). «Accelerators and Nobel Laureates». Nobel Foundation. Archived from the original on 13 April 2008.
- ^ «The Nobel Prize in Physics 1990». Nobel Foundation. 17 October 1990. Archived from the original on 14 May 2008.
- ^ Demtröder, Wolfgang (2002). Atoms, Molecules and Photons: An Introduction to Atomic- Molecular- and Quantum Physics (1st ed.). Springer. pp. 39–42. ISBN 978-3-540-20631-6. OCLC 181435713.
- ^ Woan, Graham (2000). The Cambridge Handbook of Physics. Cambridge University Press. p. 8. ISBN 978-0-521-57507-2. OCLC 224032426.
- ^ Mohr, P.J.; Taylor, B.N. and Newell, D.B. (2014), «The 2014 CODATA Recommended Values of the Fundamental Physical Constants» Archived 11 February 2012 at the Wayback Machine (Web Version 7.0). The database was developed by J. Baker, M. Douma, and S. Kotochigova. (2014). National Institute of Standards and Technology, Gaithersburg, Maryland 20899.
- ^ MacGregor, Malcolm H. (1992). The Enigmatic Electron. Oxford University Press. pp. 33–37. ISBN 978-0-19-521833-6. OCLC 223372888.
- ^ a b Particle Data Group (2002). «The Particle Adventure». Lawrence Berkeley Laboratory. Archived from the original on 4 January 2007.
- ^ a b Schombert, James (18 April 2006). «Elementary Particles». University of Oregon. Archived from the original on 30 August 2011.
- ^ Jevremovic, Tatjana (2005). Nuclear Principles in Engineering. Springer. p. 63. ISBN 978-0-387-23284-3. OCLC 228384008.
- ^ Pfeffer, Jeremy I.; Nir, Shlomo (2000). Modern Physics: An Introductory Text. Imperial College Press. pp. 330–336. ISBN 978-1-86094-250-1. OCLC 45900880.
- ^ Wenner, Jennifer M. (10 October 2007). «How Does Radioactive Decay Work?». Carleton College. Archived from the original on 11 May 2008.
- ^ a b c Raymond, David (7 April 2006). «Nuclear Binding Energies». New Mexico Tech. Archived from the original on 1 December 2002.
- ^ Mihos, Chris (23 July 2002). «Overcoming the Coulomb Barrier». Case Western Reserve University. Archived from the original on 12 September 2006.
- ^ Staff (30 March 2007). «ABC’s of Nuclear Science». Lawrence Berkeley National Laboratory. Archived from the original on 5 December 2006.
- ^ Makhijani, Arjun; Saleska, Scott (2 March 2001). «Basics of Nuclear Physics and Fission». Institute for Energy and Environmental Research. Archived from the original on 16 January 2007.
- ^ Shultis, J. Kenneth; Faw, Richard E. (2002). Fundamentals of Nuclear Science and Engineering. CRC Press. pp. 10–17. ISBN 978-0-8247-0834-4. OCLC 123346507.
- ^ Fewell, M.P. (1995). «The atomic nuclide with the highest mean binding energy». American Journal of Physics. 63 (7): 653–658. Bibcode:1995AmJPh..63..653F. doi:10.1119/1.17828.
- ^ Mulliken, Robert S. (1967). «Spectroscopy, Molecular Orbitals, and Chemical Bonding». Science. 157 (3784): 13–24. Bibcode:1967Sci…157…13M. doi:10.1126/science.157.3784.13. PMID 5338306.
- ^ a b Brucat, Philip J. (2008). «The Quantum Atom». University of Florida. Archived from the original on 7 December 2006.
- ^ Manthey, David (2001). «Atomic Orbitals». Orbital Central. Archived from the original on 10 January 2008.
- ^ Herter, Terry (2006). «Lecture 8: The Hydrogen Atom». Cornell University. Archived from the original on 22 February 2012.
- ^ Bell, R.E.; Elliott, L.G. (1950). «Gamma-Rays from the Reaction H1(n,γ)D2 and the Binding Energy of the Deuteron». Physical Review. 79 (2): 282–285. Bibcode:1950PhRv…79..282B. doi:10.1103/PhysRev.79.282.
- ^ Smirnov, Boris M. (2003). Physics of Atoms and Ions. Springer. pp. 249–272. ISBN 978-0-387-95550-6.
- ^ Matis, Howard S. (9 August 2000). «The Isotopes of Hydrogen». Guide to the Nuclear Wall Chart. Lawrence Berkeley National Lab. Archived from the original on 18 December 2007.
- ^ Weiss, Rick (17 October 2006). «Scientists Announce Creation of Atomic Element, the Heaviest Yet». Washington Post. Archived from the original on 20 August 2011.
- ^ a b Sills, Alan D. (2003). Earth Science the Easy Way. Barron’s Educational Series. pp. 131–134. ISBN 978-0-7641-2146-3. OCLC 51543743.
- ^ Dumé, Belle (23 April 2003). «Bismuth breaks half-life record for alpha decay». Physics World. Archived from the original on 14 December 2007.
- ^ Lindsay, Don (30 July 2000). «Radioactives Missing From The Earth». Don Lindsay Archive. Archived from the original on 28 April 2007.
- ^ Tuli, Jagdish K. (April 2005). «Nuclear Wallet Cards». National Nuclear Data Center, Brookhaven National Laboratory. Archived from the original on 3 October 2011.
- ^ CRC Handbook (2002).
- ^ Krane, K. (1988). Introductory Nuclear Physics. John Wiley & Sons. pp. 68. ISBN 978-0-471-85914-7.
- ^ a b Mills, Ian; Cvitaš, Tomislav; Homann, Klaus; Kallay, Nikola; Kuchitsu, Kozo (1993). Quantities, Units and Symbols in Physical Chemistry (2nd ed.). Oxford: International Union of Pure and Applied Chemistry, Commission on Physiochemical Symbols Terminology and Units, Blackwell Scientific Publications. p. 70. ISBN 978-0-632-03583-0. OCLC 27011505.
- ^ Chieh, Chung (22 January 2001). «Nuclide Stability». University of Waterloo. Archived from the original on 30 August 2007.
- ^ «Atomic Weights and Isotopic Compositions for All Elements». National Institute of Standards and Technology. Archived from the original on 31 December 2006. Retrieved 4 January 2007.
- ^ Audi, G.; Wapstra, A.H.; Thibault, C. (2003). «The Ame2003 atomic mass evaluation (II)» (PDF). Nuclear Physics A. 729 (1): 337–676. Bibcode:2003NuPhA.729..337A. doi:10.1016/j.nuclphysa.2003.11.003. Archived (PDF) from the original on 16 October 2005.
- ^ Ghosh, D.C.; Biswas, R. (2002). «Theoretical calculation of Absolute Radii of Atoms and Ions. Part 1. The Atomic Radii». Int. J. Mol. Sci. 3 (11): 87–113. doi:10.3390/i3020087.
- ^ Shannon, R.D. (1976). «Revised effective ionic radii and systematic studies of interatomic distances in halides and chalcogenides» (PDF). Acta Crystallographica A. 32 (5): 751–767. Bibcode:1976AcCrA..32..751S. doi:10.1107/S0567739476001551. Archived (PDF) from the original on 14 August 2020. Retrieved 25 August 2019.
- ^ Dong, Judy (1998). «Diameter of an Atom». The Physics Factbook. Archived from the original on 4 November 2007.
- ^ Zumdahl, Steven S. (2002). Introductory Chemistry: A Foundation (5th ed.). Houghton Mifflin. ISBN 978-0-618-34342-3. OCLC 173081482. Archived from the original on 4 March 2008.
- ^ Bethe, Hans (1929). «Termaufspaltung in Kristallen». Annalen der Physik. 3 (2): 133–208. Bibcode:1929AnP…395..133B. doi:10.1002/andp.19293950202.
- ^ Birkholz, Mario (1995). «Crystal-field induced dipoles in heteropolar crystals – I. concept». Z. Phys. B. 96 (3): 325–332. Bibcode:1995ZPhyB..96..325B. CiteSeerX 10.1.1.424.5632. doi:10.1007/BF01313054. S2CID 122527743.
- ^ Birkholz, M.; Rudert, R. (2008). «Interatomic distances in pyrite-structure disulfides – a case for ellipsoidal modeling of sulfur ions» (PDF). Physica Status Solidi B. 245 (9): 1858–1864. Bibcode:2008PSSBR.245.1858B. doi:10.1002/pssb.200879532. S2CID 97824066. Archived (PDF) from the original on 2 May 2021. Retrieved 2 May 2021.
- ^ Birkholz, M. (2014). «Modeling the Shape of Ions in Pyrite-Type Crystals». Crystals. 4 (3): 390–403. doi:10.3390/cryst4030390.
- ^ Staff (2007). «Small Miracles: Harnessing nanotechnology». Oregon State University. Archived from the original on 21 May 2011. – describes the width of a human hair as 105 nm and 10 carbon atoms as spanning 1 nm.
- ^ Padilla, Michael J.; Miaoulis, Ioannis; Cyr, Martha (2002). Prentice Hall Science Explorer: Chemical Building Blocks. Upper Saddle River, New Jersey: Prentice-Hall, Inc. p. 32. ISBN 978-0-13-054091-1. OCLC 47925884.
There are 2,000,000,000,000,000,000,000 (that’s 2 sextillion) atoms of oxygen in one drop of water—and twice as many atoms of hydrogen.
- ^ «The Feynman Lectures on Physics Vol. I Ch. 1: Atoms in Motion». Archived from the original on 30 July 2022. Retrieved 3 May 2022.
- ^ a b «Radioactivity». Splung.com. Archived from the original on 4 December 2007. Retrieved 19 December 2007.
- ^ L’Annunziata, Michael F. (2003). Handbook of Radioactivity Analysis. Academic Press. pp. 3–56. ISBN 978-0-12-436603-9. OCLC 16212955.
- ^ Firestone, Richard B. (22 May 2000). «Radioactive Decay Modes». Berkeley Laboratory. Archived from the original on 29 September 2006.
- ^ Hornak, J.P. (2006). «Chapter 3: Spin Physics». The Basics of NMR. Rochester Institute of Technology. Archived from the original on 3 February 2007.
- ^ a b Schroeder, Paul A. (25 February 2000). «Magnetic Properties». University of Georgia. Archived from the original on 29 April 2007.
- ^ Goebel, Greg (1 September 2007). «[4.3] Magnetic Properties of the Atom». Elementary Quantum Physics. In The Public Domain website. Archived from the original on 29 June 2011.
- ^ Yarris, Lynn (Spring 1997). «Talking Pictures». Berkeley Lab Research Review. Archived from the original on 13 January 2008.
- ^ Liang, Z.-P.; Haacke, E.M. (1999). Webster, J.G. (ed.). Encyclopedia of Electrical and Electronics Engineering: Magnetic Resonance Imaging. Vol. 2. John Wiley & Sons. pp. 412–426. ISBN 978-0-471-13946-1.
- ^ Zeghbroeck, Bart J. Van (1998). «Energy levels». Shippensburg University. Archived from the original on 15 January 2005.
- ^ Fowles, Grant R. (1989). Introduction to Modern Optics. Courier Dover Publications. pp. 227–233. ISBN 978-0-486-65957-2. OCLC 18834711.
- ^ Martin, W.C.; Wiese, W.L. (May 2007). «Atomic Spectroscopy: A Compendium of Basic Ideas, Notation, Data, and Formulas». National Institute of Standards and Technology. Archived from the original on 8 February 2007.
- ^ «Atomic Emission Spectra – Origin of Spectral Lines». Avogadro Web Site. Archived from the original on 28 February 2006. Retrieved 10 August 2006.
- ^ Fitzpatrick, Richard (16 February 2007). «Fine structure». University of Texas at Austin. Archived from the original on 27 September 2011.
- ^ Weiss, Michael (2001). «The Zeeman Effect». University of California-Riverside. Archived from the original on 2 February 2008.
- ^ Beyer, H.F.; Shevelko, V.P. (2003). Introduction to the Physics of Highly Charged Ions. CRC Press. pp. 232–236. ISBN 978-0-7503-0481-8. OCLC 47150433.
- ^ Watkins, Thayer. «Coherence in Stimulated Emission». San José State University. Archived from the original on 12 January 2008. Retrieved 23 December 2007.
- ^ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the «Gold Book») (1997). Online corrected version: (2006–) «valence». doi:10.1351/goldbook.V06588
- ^ Reusch, William (16 July 2007). «Virtual Textbook of Organic Chemistry». Michigan State University. Archived from the original on 29 October 2007.
- ^ «Covalent bonding – Single bonds». chemguide. 2000. Archived from the original on 1 November 2008.
- ^ Husted, Robert; et al. (11 December 2003). «Periodic Table of the Elements». Los Alamos National Laboratory. Archived from the original on 10 January 2008.
- ^ Baum, Rudy (2003). «It’s Elemental: The Periodic Table». Chemical & Engineering News. Archived from the original on 6 April 2011.
- ^ Goodstein, David L. (2002). States of Matter. Courier Dover Publications. pp. 436–438. ISBN 978-0-13-843557-8.
- ^ Brazhkin, Vadim V. (2006). «Metastable phases, phase transformations, and phase diagrams in physics and chemistry». Physics-Uspekhi. 49 (7): 719–724. Bibcode:2006PhyU…49..719B. doi:10.1070/PU2006v049n07ABEH006013. S2CID 93168446.
- ^ Myers, Richard (2003). The Basics of Chemistry. Greenwood Press. p. 85. ISBN 978-0-313-31664-7. OCLC 50164580.
- ^ Staff (9 October 2001). «Bose–Einstein Condensate: A New Form of Matter». National Institute of Standards and Technology. Archived from the original on 3 January 2008.
- ^ Colton, Imogen; Fyffe, Jeanette (3 February 1999). «Super Atoms from Bose–Einstein Condensation». The University of Melbourne. Archived from the original on 29 August 2007.
- ^ Jacox, Marilyn; Gadzuk, J. William (November 1997). «Scanning Tunneling Microscope». National Institute of Standards and Technology. Archived from the original on 7 January 2008.
- ^ «The Nobel Prize in Physics 1986». The Nobel Foundation. Archived from the original on 17 September 2008. Retrieved 11 January 2008. In particular, see the Nobel lecture by G. Binnig and H. Rohrer.
- ^ Jakubowski, N.; Moens, Luc; Vanhaecke, Frank (1998). «Sector field mass spectrometers in ICP-MS». Spectrochimica Acta Part B: Atomic Spectroscopy. 53 (13): 1739–1763. Bibcode:1998AcSpe..53.1739J. doi:10.1016/S0584-8547(98)00222-5.
- ^ Müller, Erwin W.; Panitz, John A.; McLane, S. Brooks (1968). «The Atom-Probe Field Ion Microscope». Review of Scientific Instruments. 39 (1): 83–86. Bibcode:1968RScI…39…83M. doi:10.1063/1.1683116.
- ^ Lochner, Jim; Gibb, Meredith; Newman, Phil (30 April 2007). «What Do Spectra Tell Us?». NASA/Goddard Space Flight Center. Archived from the original on 16 January 2008.
- ^ Winter, Mark (2007). «Helium». WebElements. Archived from the original on 30 December 2007.
- ^ Hinshaw, Gary (10 February 2006). «What is the Universe Made Of?». NASA/WMAP. Archived from the original on 31 December 2007.
- ^ Choppin, Gregory R.; Liljenzin, Jan-Olov; Rydberg, Jan (2001). Radiochemistry and Nuclear Chemistry. Elsevier. p. 441. ISBN 978-0-7506-7463-8. OCLC 162592180.
- ^ Davidsen, Arthur F. (1993). «Far-Ultraviolet Astronomy on the Astro-1 Space Shuttle Mission». Science. 259 (5093): 327–334. Bibcode:1993Sci…259..327D. doi:10.1126/science.259.5093.327. PMID 17832344. S2CID 28201406.
- ^ Lequeux, James (2005). The Interstellar Medium. Springer. p. 4. ISBN 978-3-540-21326-0. OCLC 133157789.
- ^ Smith, Nigel (6 January 2000). «The search for dark matter». Physics World. Archived from the original on 16 February 2008.
- ^ Croswell, Ken (1991). «Boron, bumps and the Big Bang: Was matter spread evenly when the Universe began? Perhaps not; the clues lie in the creation of the lighter elements such as boron and beryllium». New Scientist (1794): 42. Archived from the original on 7 February 2008.
- ^ Copi, Craig J.; Schramm, DN; Turner, MS (1995). «Big-Bang Nucleosynthesis and the Baryon Density of the Universe». Science (Submitted manuscript). 267 (5195): 192–199. arXiv:astro-ph/9407006. Bibcode:1995Sci…267..192C. doi:10.1126/science.7809624. PMID 7809624. S2CID 15613185. Archived from the original on 14 August 2019.
- ^ Hinshaw, Gary (15 December 2005). «Tests of the Big Bang: The Light Elements». NASA/WMAP. Archived from the original on 17 January 2008.
- ^ Abbott, Brian (30 May 2007). «Microwave (WMAP) All-Sky Survey». Hayden Planetarium. Archived from the original on 13 February 2013.
- ^ Hoyle, F. (1946). «The synthesis of the elements from hydrogen». Monthly Notices of the Royal Astronomical Society. 106 (5): 343–383. Bibcode:1946MNRAS.106..343H. doi:10.1093/mnras/106.5.343.
- ^ Knauth, D.C.; Knauth, D.C.; Lambert, David L.; Crane, P. (2000). «Newly synthesized lithium in the interstellar medium». Nature. 405 (6787): 656–658. Bibcode:2000Natur.405..656K. doi:10.1038/35015028. PMID 10864316. S2CID 4397202.
- ^ Mashnik, Stepan G. (2000). «On Solar System and Cosmic Rays Nucleosynthesis and Spallation Processes». arXiv:astro-ph/0008382.
- ^ Kansas Geological Survey (4 May 2005). «Age of the Earth». University of Kansas. Archived from the original on 5 July 2008.
- ^ a b Manuel (2001). Origin of Elements in the Solar System, pp. 407-430, 511-519
- ^ Dalrymple, G. Brent (2001). «The age of the Earth in the twentieth century: a problem (mostly) solved». Geological Society, London, Special Publications. 190 (1): 205–221. Bibcode:2001GSLSP.190..205D. doi:10.1144/GSL.SP.2001.190.01.14. S2CID 130092094. Archived from the original on 11 November 2007.
- ^ Anderson, Don L.; Foulger, G.R.; Meibom, Anders (2 September 2006). «Helium: Fundamental models». MantlePlumes.org. Archived from the original on 8 February 2007.
- ^ Pennicott, Katie (10 May 2001). «Carbon clock could show the wrong time». PhysicsWeb. Archived from the original on 15 December 2007.
- ^ Yarris, Lynn (27 July 2001). «New Superheavy Elements 118 and 116 Discovered at Berkeley Lab». Berkeley Lab. Archived from the original on 9 January 2008.
- ^ Diamond, H; et al. (1960). «Heavy Isotope Abundances in Mike Thermonuclear Device». Physical Review. 119 (6): 2000–2004. Bibcode:1960PhRv..119.2000D. doi:10.1103/PhysRev.119.2000.
- ^ Poston, John W. Sr. (23 March 1998). «Do transuranic elements such as plutonium ever occur naturally?». Scientific American. Archived from the original on 27 March 2015.
- ^ Keller, C. (1973). «Natural occurrence of lanthanides, actinides, and superheavy elements». Chemiker Zeitung. 97 (10): 522–530. OSTI 4353086.
- ^ Zaider, Marco; Rossi, Harald H. (2001). Radiation Science for Physicians and Public Health Workers. Springer. p. 17. ISBN 978-0-306-46403-4. OCLC 44110319.
- ^ «Oklo Fossil Reactors». Curtin University of Technology. Archived from the original on 18 December 2007. Retrieved 15 January 2008.
- ^ Weisenberger, Drew. «How many atoms are there in the world?». Jefferson Lab. Archived from the original on 22 October 2007. Retrieved 16 January 2008.
- ^ Pidwirny, Michael. «Fundamentals of Physical Geography». University of British Columbia Okanagan. Archived from the original on 21 January 2008. Retrieved 16 January 2008.
- ^ Anderson, Don L. (2002). «The inner inner core of Earth». Proceedings of the National Academy of Sciences. 99 (22): 13966–13968. Bibcode:2002PNAS…9913966A. doi:10.1073/pnas.232565899. PMC 137819. PMID 12391308.
- ^ Pauling, Linus (1960). The Nature of the Chemical Bond. Cornell University Press. pp. 5–10. ISBN 978-0-8014-0333-0. OCLC 17518275.
- ^ Anonymous (2 October 2001). «Second postcard from the island of stability». CERN Courier. Archived from the original on 3 February 2008.
- ^ Karpov, A. V.; Zagrebaev, V. I.; Palenzuela, Y. M.; et al. (2012). «Decay properties and stability of the heaviest elements» (PDF). International Journal of Modern Physics E. 21 (2): 1250013-1–1250013-20. Bibcode:2012IJMPE..2150013K. doi:10.1142/S0218301312500139. Archived (PDF) from the original on 3 December 2016. Retrieved 24 March 2020.
- ^ «Superheavy Element 114 Confirmed: A Stepping Stone to the Island of Stability». Berkeley Lab. 2009. Archived from the original on 20 July 2019. Retrieved 24 March 2020.
- ^ Möller, P. (2016). «The limits of the nuclear chart set by fission and alpha decay» (PDF). EPJ Web of Conferences. 131: 03002-1–03002-8. Bibcode:2016EPJWC.13103002M. doi:10.1051/epjconf/201613103002. Archived (PDF) from the original on 11 March 2020. Retrieved 24 March 2020.
- ^ Koppes, Steve (1 March 1999). «Fermilab Physicists Find New Matter-Antimatter Asymmetry». University of Chicago. Archived from the original on 19 July 2008.
- ^ Cromie, William J. (16 August 2001). «A lifetime of trillionths of a second: Scientists explore antimatter». Harvard University Gazette. Archived from the original on 3 September 2006.
- ^ Hijmans, Tom W. (2002). «Particle physics: Cold antihydrogen». Nature. 419 (6906): 439–440. Bibcode:2002Natur.419..439H. doi:10.1038/419439a. PMID 12368837.
- ^ Staff (30 October 2002). «Researchers ‘look inside’ antimatter». BBC News. Archived from the original on 22 February 2007.
- ^ Barrett, Roger (1990). «The Strange World of the Exotic Atom». New Scientist (1728): 77–115. Archived from the original on 21 December 2007.
- ^ Indelicato, Paul (2004). «Exotic Atoms». Physica Scripta. T112 (1): 20–26. arXiv:physics/0409058. Bibcode:2004PhST..112…20I. doi:10.1238/Physica.Topical.112a00020. S2CID 11134265. Archived from the original on 4 November 2018.
- ^ Ripin, Barrett H. (July 1998). «Recent Experiments on Exotic Atoms». American Physical Society. Archived from the original on 23 July 2012.
Bibliography
- Oliver Manuel (2001). Origin of Elements in the Solar System: Implications of Post-1957 Observations. Springer. ISBN 978-0-306-46562-8. OCLC 228374906.
- Andrew G. van Melsen (2004) [1952]. From Atomos to Atom: The History of the Concept Atom. Translated by Henry J. Koren. Dover Publications. ISBN 0-486-49584-1.
- J.P. Millington (1906). John Dalton. J. M. Dent & Co. (London); E. P. Dutton & Co. (New York).
- Charles H. Holbrow; James N. Lloyd; Joseph C. Amato; Enrique Galvez; M. Elizabeth Parks (2010). Modern Introductory Physics. Springer Science & Business Media. ISBN 978-0-387-79079-4.
- John Dalton (1808). A New System of Chemical Philosophy vol. 1.
- John Dalton (1817). A New System of Chemical Philosophy vol. 2.
- John L. Heilbron (2003). Ernest Rutherford and the Explosion of Atoms. Oxford University Press. ISBN 0-19-512378-6.
- Jaume Navarro (2012). A History of the Electron: J. J. and G. P. Thomson. Cambridge University Press. ISBN 978-1-107-00522-8.
Further reading
- Gangopadhyaya, Mrinalkanti (1981). Indian Atomism: History and Sources. Atlantic Highlands, New Jersey: Humanities Press. ISBN 978-0-391-02177-8. OCLC 10916778.
- Iannone, A. Pablo (2001). Dictionary of World Philosophy. Routledge. ISBN 978-0-415-17995-9. OCLC 44541769.
- King, Richard (1999). Indian philosophy: an introduction to Hindu and Buddhist thought. Edinburgh University Press. ISBN 978-0-7486-0954-3.
- McEvilley, Thomas (2002). The shape of ancient thought: comparative studies in Greek and Indian philosophies. Allworth Press. ISBN 978-1-58115-203-6.
- Siegfried, Robert (2002). From Elements to Atoms: A History of Chemical Composition. DIANE. ISBN 978-0-87169-924-4. OCLC 186607849.
- Teresi, Dick (2003). Lost Discoveries: The Ancient Roots of Modern Science. Simon & Schuster. pp. 213–214. ISBN 978-0-7432-4379-7. Archived from the original on 4 August 2020. Retrieved 25 October 2020.
- Wurtz, Charles Adolphe (1881). The Atomic Theory. New York: D. Appleton and company. ISBN 978-0-559-43636-9.
External links
- Sharp, Tim (8 August 2017). «What is an Atom?». Live Science.
- «Hitchhikers Guide to the Universe, Atoms and Atomic Structure». h2g2. BBC. 3 January 2006.
| Atom | |
|---|---|

An illustration of the helium atom, depicting the nucleus (pink) and the electron cloud distribution (black). The nucleus (upper right) in helium-4 is in reality spherically symmetric and closely resembles the electron cloud, although for more complicated nuclei this is not always the case. The black bar is one angstrom (10−10 m or 100 pm). |
|
| Classification | |
| Smallest recognized division of a chemical element | |
| Properties | |
| Mass range | 1.67×10−27 to 4.52×10−25 kg |
| Electric charge | zero (neutral), or ion charge |
| Diameter range | 62 pm (He) to 520 pm (Cs) (data page) |
| Components | Electrons and a compact nucleus of protons and neutrons |
Every atom is composed of a nucleus and one or more electrons bound to the nucleus. The nucleus is made of one or more protons and a number of neutrons. Only the most common variety of hydrogen has no neutrons.
Every solid, liquid, gas, and plasma is composed of neutral or ionized atoms. Atoms are extremely small, typically around 100 picometers across. They are so small that accurately predicting their behavior using classical physics, as if they were tennis balls for example, is not possible due to quantum effects.
More than 99.94% of an atom’s mass is in the nucleus. The protons have a positive electric charge, the electrons have a negative electric charge, and the neutrons have no electric charge. If the number of protons and electrons are equal, then the atom is electrically neutral. If an atom has more or fewer electrons than protons, then it has an overall negative or positive charge, respectively – such atoms are called ions.
The electrons of an atom are attracted to the protons in an atomic nucleus by the electromagnetic force. The protons and neutrons in the nucleus are attracted to each other by the nuclear force. This force is usually stronger than the electromagnetic force that repels the positively charged protons from one another. Under certain circumstances, the repelling electromagnetic force becomes stronger than the nuclear force. In this case, the nucleus splits and leaves behind different elements. This is a form of nuclear decay.
The number of protons in the nucleus is the atomic number and it defines to which chemical element the atom belongs. For example, any atom that contains 29 protons is copper. The number of neutrons defines the isotope of the element. For example, a copper atom with 34 neutrons is copper-63 (29+34), and with 36 neutrons is copper-65; natural copper is about 70% Cu-63 and the rest is Cu-65.
Atoms can attach to one or more other atoms by chemical bonds to form chemical compounds such as molecules or crystals. For example, New York City’s Statue of Liberty was originally made of pure copper, but over the years, the surface combined with oxygen, carbon and sulfur atoms to make a green patina on the copper. The ability of atoms to attach and detach is responsible for most of the physical changes observed in nature. Chemistry is the discipline that studies these changes.
History of atomic theory
In philosophy
The basic idea that matter is made up of tiny, indivisible particles is an old idea that appeared in many ancient cultures such as those of Greece and India. The word atom is derived from the ancient Greek word atomos,[a] which means «uncuttable». This ancient idea was based in philosophical reasoning rather than scientific reasoning. Modern atomic theory is not based on these old concepts.[1][2] In the early 19th century, the scientist John Dalton noticed that chemical elements seemed to combine with each other by basic units of weight, and he decided to use the word «atom» to refer to these units because he assumed that these were the fundamental units of matter. About a century later it was discovered that Dalton’s atoms are not actually indivisible, but the term stuck.
Dalton’s law of multiple proportions
Atoms and molecules as depicted in John Dalton’s A New System of Chemical Philosophy vol. 1 (1808)
In the early 1800s, the English chemist John Dalton compiled experimental data gathered by himself and other scientists and discovered a pattern now known as the «law of multiple proportions». He noticed that in chemical compounds which contain a particular chemical element, the content of that element in these compounds will differ in weight by ratios of small whole numbers. This pattern suggested to Dalton that each chemical element combines with other elements by a basic and consistent unit of weight, and he decided to call these units «atoms».
For example, there are two types of tin oxide: one is a black powder that is 88.1% tin and 11.9% oxygen, and the other is a white powder that is 78.7% tin and 21.3% oxygen. Adjusting these figures, in the black oxide there is about 13.5 g of oxygen for every 100 g of tin, and in the white oxide there is about 27 g of oxygen for every 100 g of tin. 13.5 and 27 form a ratio of 1:2. Dalton concluded that in these oxides, for every tin atom there are one or two oxygen atoms respectively (SnO and SnO2).[3][4]
Dalton also analyzed iron oxides. There is one type of iron oxide that is a black powder which is 78.1% iron and 21.9% oxygen; and there is another iron oxide that is a red powder which is 70.4% iron and 29.6% oxygen. Adjusting these figures, in the black oxide there is about 28 g of oxygen for every 100 g of iron, and in the red oxide there is about 42 g of oxygen for every 100 g of iron. 28 and 42 form a ratio of 2:3. In these respective oxides, for every two atoms of iron, there are two or three atoms of oxygen (Fe2O2 and Fe2O3).[b][5][6]
As a final example: nitrous oxide is 63.3% nitrogen and 36.7% oxygen, nitric oxide is 44.05% nitrogen and 55.95% oxygen, and nitrogen dioxide is 29.5% nitrogen and 70.5% oxygen. Adjusting these figures, in nitrous oxide there is 80 g of oxygen for every 140 g of nitrogen, in nitric oxide there is about 160 g of oxygen for every 140 g of nitrogen, and in nitrogen dioxide there is 320 g of oxygen for every 140 g of nitrogen. 80, 160, and 320 form a ratio of 1:2:4. The respective formulas for these oxides are N2O, NO, and NO2.[7][8]
Kinetic theory of gases
In 1738 Daniel Bernoulli[9] and a number of other scientists found that they could better explain the behavior of gases by describing them as collections of sub-microscopic particles and modelling their behavior using statistics and probability. Unlike Dalton’s atomic theory, the kinetic theory of gases describes not how gases react chemically with each other to form compounds, but how they behave physically: diffusion, viscosity, conductivity, pressure, etc.
Brownian motion
In 1827, botanist Robert Brown used a microscope to look at dust grains floating in water and discovered that they moved about erratically, a phenomenon that became known as «Brownian motion». This was thought to be caused by water molecules knocking the grains about. In 1905, Albert Einstein proved the reality of these molecules and their motions by producing the first statistical physics analysis of Brownian motion.[10][11][12] French physicist Jean Perrin used Einstein’s work to experimentally determine the mass and dimensions of molecules, thereby providing physical evidence for the particle nature of matter.[13]
Discovery of the electron
The Geiger–Marsden experiment:
Left: Expected results: alpha particles passing through the plum pudding model of the atom with negligible deflection.
Right: Observed results: a small portion of the particles were deflected by the concentrated positive charge of the nucleus.
In 1897, J. J. Thomson discovered that cathode rays are not electromagnetic waves but made of particles that are 1,800 times lighter than hydrogen (the lightest atom). Thomson concluded that these particles came from the atoms within the cathode — they were subatomic particles. He called these new particles corpuscles but they were later renamed electrons. Thomson also showed that electrons were identical to particles given off by photoelectric and radioactive materials.[14] It was quickly recognized that electrons are the particles that carry electric currents in metal wires.[15] Thomson concluded that these electrons emerged from the very atoms of the cathode in his instruments, which meant that atoms are not indivisible as Dalton thought.
Discovery of the nucleus
J. J. Thomson thought that the negatively-charged electrons were distributed throughout the atom in a sea of positive charge that was distributed across the whole volume of the atom.[16] This model is sometimes known as the plum pudding model.
Ernest Rutherford and his colleagues Hans Geiger and Ernest Marsden came to have doubts about the Thomson model after they encountered difficulties when they tried to build an instrument to measure the charge-to-mass ratio of alpha particles (these are positively-charged particles emitted by certain radioactive substances such as radium). The alpha particles were being scattered by the air in the detection chamber, which made the measurements unreliable. Thomson had encountered a similar problem in his work on cathode rays, which he solved by creating a near-perfect vacuum in his instruments. Rutherford didn’t think he’d run into this same problem because alpha particles are much heavier than electrons. According to Thomson’s model of the atom, the positive charge in the atom is not concentrated enough to produce an electric field strong enough to deflect an alpha particle, and the electrons are so lightweight they should be pushed aside effortlessly by the much heavier alpha particles. Yet there was scattering, so Rutherford and his colleagues decided to investigate this scattering carefully.[17]
Between 1908 and 1913, Rutherford and his colleagues performed a series of experiments in which they bombarded thin foils of metal with alpha particles. They spotted alpha particles being deflected by angles greater than 90°. To explain this, Rutherford proposed that the positive charge of the atom is not distributed throughout the atom’s volume as Thomson believed, but is concentrated in a tiny nucleus at the center. Only such an intense concentration of charge could produce an electric field strong enough to deflect the alpha particles as observed.[17]
Discovery of isotopes
While experimenting with the products of radioactive decay, in 1913 radiochemist Frederick Soddy discovered that there appeared to be more than one type of atom at each position on the periodic table.[18] The term isotope was coined by Margaret Todd as a suitable name for different atoms that belong to the same element. J. J. Thomson created a technique for isotope separation through his work on ionized gases, which subsequently led to the discovery of stable isotopes.[19]
Bohr model
The Bohr model of the atom, with an electron making instantaneous «quantum leaps» from one orbit to another with gain or loss of energy. This model of electrons in orbits is obsolete.
In 1913, the physicist Niels Bohr proposed a model in which the electrons of an atom were assumed to orbit the nucleus but could only do so in a finite set of orbits, and could jump between these orbits only in discrete changes of energy corresponding to absorption or radiation of a photon.[20] This quantization was used to explain why the electrons’ orbits are stable (given that normally, charges in acceleration, including circular motion, lose kinetic energy which is emitted as electromagnetic radiation, see synchrotron radiation) and why elements absorb and emit electromagnetic radiation in discrete spectra.[21]
Later in the same year Henry Moseley provided additional experimental evidence in favor of Niels Bohr’s theory. These results refined Ernest Rutherford’s and Antonius van den Broek’s model, which proposed that the atom contains in its nucleus a number of positive nuclear charges that is equal to its (atomic) number in the periodic table. Until these experiments, atomic number was not known to be a physical and experimental quantity. That it is equal to the atomic nuclear charge remains the accepted atomic model today.[22]
Chemical bonds between atoms were explained by Gilbert Newton Lewis in 1916, as the interactions between their constituent electrons.[23] As the chemical properties of the elements were known to largely repeat themselves according to the periodic law,[24] in 1919 the American chemist Irving Langmuir suggested that this could be explained if the electrons in an atom were connected or clustered in some manner. Groups of electrons were thought to occupy a set of electron shells about the nucleus.[25]
The Bohr model of the atom was the first complete physical model of the atom. It described the overall structure of the atom, how atoms bond to each other, and predicted the spectral lines of hydrogen. Bohr’s model was not perfect and was soon superseded by the more accurate Schrödinger model, but it was sufficient to evaporate any remaining doubts that matter is composed of atoms. For chemists, the idea of the atom had been a useful heuristic tool, but physicists had doubts as to whether matter really is made up of atoms as nobody had yet developed a complete physical model of the atom.
The Schrödinger model
The Stern–Gerlach experiment of 1922 provided further evidence of the quantum nature of atomic properties. When a beam of silver atoms was passed through a specially shaped magnetic field, the beam was split in a way correlated with the direction of an atom’s angular momentum, or spin. As this spin direction is initially random, the beam would be expected to deflect in a random direction. Instead, the beam was split into two directional components, corresponding to the atomic spin being oriented up or down with respect to the magnetic field.[26]
In 1925, Werner Heisenberg published the first consistent mathematical formulation of quantum mechanics (matrix mechanics).[22] One year earlier, Louis de Broglie had proposed the de Broglie hypothesis: that all particles behave like waves to some extent,[27] and in 1926 Erwin Schrödinger used this idea to develop the Schrödinger equation, a mathematical model of the atom (wave mechanics) that described the electrons as three-dimensional waveforms rather than point particles.[28]
A consequence of using waveforms to describe particles is that it is mathematically impossible to obtain precise values for both the position and momentum of a particle at a given point in time. This became known as the uncertainty principle, formulated by Werner Heisenberg in 1927.[22] In this concept, for a given accuracy in measuring a position one could only obtain a range of probable values for momentum, and vice versa.[29]
This model was able to explain observations of atomic behavior that previous models could not, such as certain structural and spectral patterns of atoms larger than hydrogen. Thus, the planetary model of the atom was discarded in favor of one that described atomic orbital zones around the nucleus where a given electron is most likely to be observed.[30][31]
Discovery of the neutron
The development of the mass spectrometer allowed the mass of atoms to be measured with increased accuracy. The device uses a magnet to bend the trajectory of a beam of ions, and the amount of deflection is determined by the ratio of an atom’s mass to its charge. The chemist Francis William Aston used this instrument to show that isotopes had different masses. The atomic mass of these isotopes varied by integer amounts, called the whole number rule.[32] The explanation for these different isotopes awaited the discovery of the neutron, an uncharged particle with a mass similar to the proton, by the physicist James Chadwick in 1932. Isotopes were then explained as elements with the same number of protons, but different numbers of neutrons within the nucleus.[33]
Fission, high-energy physics and condensed matter
In 1938, the German chemist Otto Hahn, a student of Rutherford, directed neutrons onto uranium atoms expecting to get transuranium elements. Instead, his chemical experiments showed barium as a product.[34][35] A year later, Lise Meitner and her nephew Otto Frisch verified that Hahn’s result were the first experimental nuclear fission.[36][37] In 1944, Hahn received the Nobel Prize in Chemistry. Despite Hahn’s efforts, the contributions of Meitner and Frisch were not recognized.[38]
In the 1950s, the development of improved particle accelerators and particle detectors allowed scientists to study the impacts of atoms moving at high energies.[39] Neutrons and protons were found to be hadrons, or composites of smaller particles called quarks. The standard model of particle physics was developed that so far has successfully explained the properties of the nucleus in terms of these sub-atomic particles and the forces that govern their interactions.[40]
Structure
Subatomic particles
Though the word atom originally denoted a particle that cannot be cut into smaller particles, in modern scientific usage the atom is composed of various subatomic particles. The constituent particles of an atom are the electron, the proton and the neutron.
The electron is by far the least massive of these particles at 9.11×10−31 kg, with a negative electrical charge and a size that is too small to be measured using available techniques.[41] It was the lightest particle with a positive rest mass measured, until the discovery of neutrino mass. Under ordinary conditions, electrons are bound to the positively charged nucleus by the attraction created from opposite electric charges. If an atom has more or fewer electrons than its atomic number, then it becomes respectively negatively or positively charged as a whole; a charged atom is called an ion. Electrons have been known since the late 19th century, mostly thanks to J.J. Thomson; see history of subatomic physics for details.
Protons have a positive charge and a mass 1,836 times that of the electron, at 1.6726×10−27 kg. The number of protons in an atom is called its atomic number. Ernest Rutherford (1919) observed that nitrogen under alpha-particle bombardment ejects what appeared to be hydrogen nuclei. By 1920 he had accepted that the hydrogen nucleus is a distinct particle within the atom and named it proton.
Neutrons have no electrical charge and have a free mass of 1,839 times the mass of the electron, or 1.6749×10−27 kg.[42][43] Neutrons are the heaviest of the three constituent particles, but their mass can be reduced by the nuclear binding energy. Neutrons and protons (collectively known as nucleons) have comparable dimensions—on the order of 2.5×10−15 m—although the ‘surface’ of these particles is not sharply defined.[44] The neutron was discovered in 1932 by the English physicist James Chadwick.
In the Standard Model of physics, electrons are truly elementary particles with no internal structure, whereas protons and neutrons are composite particles composed of elementary particles called quarks. There are two types of quarks in atoms, each having a fractional electric charge. Protons are composed of two up quarks (each with charge +2/3) and one down quark (with a charge of −1/3). Neutrons consist of one up quark and two down quarks. This distinction accounts for the difference in mass and charge between the two particles.[45][46]
The quarks are held together by the strong interaction (or strong force), which is mediated by gluons. The protons and neutrons, in turn, are held to each other in the nucleus by the nuclear force, which is a residuum of the strong force that has somewhat different range-properties (see the article on the nuclear force for more). The gluon is a member of the family of gauge bosons, which are elementary particles that mediate physical forces.[45][46]
Nucleus
The binding energy needed for a nucleon to escape the nucleus, for various isotopes
All the bound protons and neutrons in an atom make up a tiny atomic nucleus, and are collectively called nucleons. The radius of a nucleus is approximately equal to ![{displaystyle 1.07{sqrt[{3}]{A}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a74a6ca6998768195969eef75ca046e8431c29d3)

Atoms of the same element have the same number of protons, called the atomic number. Within a single element, the number of neutrons may vary, determining the isotope of that element. The total number of protons and neutrons determine the nuclide. The number of neutrons relative to the protons determines the stability of the nucleus, with certain isotopes undergoing radioactive decay.[49]
The proton, the electron, and the neutron are classified as fermions. Fermions obey the Pauli exclusion principle which prohibits identical fermions, such as multiple protons, from occupying the same quantum state at the same time. Thus, every proton in the nucleus must occupy a quantum state different from all other protons, and the same applies to all neutrons of the nucleus and to all electrons of the electron cloud.[50]
A nucleus that has a different number of protons than neutrons can potentially drop to a lower energy state through a radioactive decay that causes the number of protons and neutrons to more closely match. As a result, atoms with matching numbers of protons and neutrons are more stable against decay, but with increasing atomic number, the mutual repulsion of the protons requires an increasing proportion of neutrons to maintain the stability of the nucleus.[50]
Illustration of a nuclear fusion process that forms a deuterium nucleus, consisting of a proton and a neutron, from two protons. A positron (e+)—an antimatter electron—is emitted along with an electron neutrino.
The number of protons and neutrons in the atomic nucleus can be modified, although this can require very high energies because of the strong force. Nuclear fusion occurs when multiple atomic particles join to form a heavier nucleus, such as through the energetic collision of two nuclei. For example, at the core of the Sun protons require energies of 3 to 10 keV to overcome their mutual repulsion—the coulomb barrier—and fuse together into a single nucleus.[51] Nuclear fission is the opposite process, causing a nucleus to split into two smaller nuclei—usually through radioactive decay. The nucleus can also be modified through bombardment by high energy subatomic particles or photons. If this modifies the number of protons in a nucleus, the atom changes to a different chemical element.[52][53]
If the mass of the nucleus following a fusion reaction is less than the sum of the masses of the separate particles, then the difference between these two values can be emitted as a type of usable energy (such as a gamma ray, or the kinetic energy of a beta particle), as described by Albert Einstein’s mass-energy equivalence formula, 


The fusion of two nuclei that create larger nuclei with lower atomic numbers than iron and nickel—a total nucleon number of about 60—is usually an exothermic process that releases more energy than is required to bring them together.[55] It is this energy-releasing process that makes nuclear fusion in stars a self-sustaining reaction. For heavier nuclei, the binding energy per nucleon in the nucleus begins to decrease. That means fusion processes producing nuclei that have atomic numbers higher than about 26, and atomic masses higher than about 60, is an endothermic process. These more massive nuclei can not undergo an energy-producing fusion reaction that can sustain the hydrostatic equilibrium of a star.[50]
Electron cloud
A potential well, showing, according to classical mechanics, the minimum energy V(x) needed to reach each position x. Classically, a particle with energy E is constrained to a range of positions between x1 and x2.
The electrons in an atom are attracted to the protons in the nucleus by the electromagnetic force. This force binds the electrons inside an electrostatic potential well surrounding the smaller nucleus, which means that an external source of energy is needed for the electron to escape. The closer an electron is to the nucleus, the greater the attractive force. Hence electrons bound near the center of the potential well require more energy to escape than those at greater separations.
Electrons, like other particles, have properties of both a particle and a wave. The electron cloud is a region inside the potential well where each electron forms a type of three-dimensional standing wave—a wave form that does not move relative to the nucleus. This behavior is defined by an atomic orbital, a mathematical function that characterises the probability that an electron appears to be at a particular location when its position is measured.[56] Only a discrete (or quantized) set of these orbitals exist around the nucleus, as other possible wave patterns rapidly decay into a more stable form.[57] Orbitals can have one or more ring or node structures, and differ from each other in size, shape and orientation.[58]
3D views of some hydrogen-like atomic orbitals showing probability density and phase (g orbitals and higher are not shown)
Each atomic orbital corresponds to a particular energy level of the electron. The electron can change its state to a higher energy level by absorbing a photon with sufficient energy to boost it into the new quantum state. Likewise, through spontaneous emission, an electron in a higher energy state can drop to a lower energy state while radiating the excess energy as a photon. These characteristic energy values, defined by the differences in the energies of the quantum states, are responsible for atomic spectral lines.[57]
The amount of energy needed to remove or add an electron—the electron binding energy—is far less than the binding energy of nucleons. For example, it requires only 13.6 eV to strip a ground-state electron from a hydrogen atom,[59] compared to 2.23 million eV for splitting a deuterium nucleus.[60] Atoms are electrically neutral if they have an equal number of protons and electrons. Atoms that have either a deficit or a surplus of electrons are called ions. Electrons that are farthest from the nucleus may be transferred to other nearby atoms or shared between atoms. By this mechanism, atoms are able to bond into molecules and other types of chemical compounds like ionic and covalent network crystals.[61]
Properties
Nuclear properties
By definition, any two atoms with an identical number of protons in their nuclei belong to the same chemical element. Atoms with equal numbers of protons but a different number of neutrons are different isotopes of the same element. For example, all hydrogen atoms admit exactly one proton, but isotopes exist with no neutrons (hydrogen-1, by far the most common form,[62] also called protium), one neutron (deuterium), two neutrons (tritium) and more than two neutrons. The known elements form a set of atomic numbers, from the single-proton element hydrogen up to the 118-proton element oganesson.[63] All known isotopes of elements with atomic numbers greater than 82 are radioactive, although the radioactivity of element 83 (bismuth) is so slight as to be practically negligible.[64][65]
About 339 nuclides occur naturally on Earth,[66] of which 251 (about 74%) have not been observed to decay, and are referred to as «stable isotopes». Only 90 nuclides are stable theoretically, while another 161 (bringing the total to 251) have not been observed to decay, even though in theory it is energetically possible. These are also formally classified as «stable». An additional 35 radioactive nuclides have half-lives longer than 100 million years, and are long-lived enough to have been present since the birth of the Solar System. This collection of 286 nuclides are known as primordial nuclides. Finally, an additional 53 short-lived nuclides are known to occur naturally, as daughter products of primordial nuclide decay (such as radium from uranium), or as products of natural energetic processes on Earth, such as cosmic ray bombardment (for example, carbon-14).[67][note 1]
For 80 of the chemical elements, at least one stable isotope exists. As a rule, there is only a handful of stable isotopes for each of these elements, the average being 3.1 stable isotopes per element. Twenty-six «monoisotopic elements» have only a single stable isotope, while the largest number of stable isotopes observed for any element is ten, for the element tin. Elements 43, 61, and all elements numbered 83 or higher have no stable isotopes.[68]: 1–12
Stability of isotopes is affected by the ratio of protons to neutrons, and also by the presence of certain «magic numbers» of neutrons or protons that represent closed and filled quantum shells. These quantum shells correspond to a set of energy levels within the shell model of the nucleus; filled shells, such as the filled shell of 50 protons for tin, confers unusual stability on the nuclide. Of the 251 known stable nuclides, only four have both an odd number of protons and odd number of neutrons: hydrogen-2 (deuterium), lithium-6, boron-10, and nitrogen-14. (Tantalum-180m is odd-odd and observationally stable, but is predicted to decay with a very long half-life.) Also, only four naturally occurring, radioactive odd-odd nuclides have a half-life over a billion years: potassium-40, vanadium-50, lanthanum-138, and lutetium-176. Most odd-odd nuclei are highly unstable with respect to beta decay, because the decay products are even-even, and are therefore more strongly bound, due to nuclear pairing effects.[69]
Mass
The large majority of an atom’s mass comes from the protons and neutrons that make it up. The total number of these particles (called «nucleons») in a given atom is called the mass number. It is a positive integer and dimensionless (instead of having dimension of mass), because it expresses a count. An example of use of a mass number is «carbon-12,» which has 12 nucleons (six protons and six neutrons).
The actual mass of an atom at rest is often expressed in daltons (Da), also called the unified atomic mass unit (u). This unit is defined as a twelfth of the mass of a free neutral atom of carbon-12, which is approximately 1.66×10−27 kg.[70] Hydrogen-1 (the lightest isotope of hydrogen which is also the nuclide with the lowest mass) has an atomic weight of 1.007825 Da.[71] The value of this number is called the atomic mass. A given atom has an atomic mass approximately equal (within 1%) to its mass number times the atomic mass unit (for example the mass of a nitrogen-14 is roughly 14 Da), but this number will not be exactly an integer except (by definition) in the case of carbon-12.[72] The heaviest stable atom is lead-208,[64] with a mass of 207.9766521 Da.[73]
As even the most massive atoms are far too light to work with directly, chemists instead use the unit of moles. One mole of atoms of any element always has the same number of atoms (about 6.022×1023). This number was chosen so that if an element has an atomic mass of 1 u, a mole of atoms of that element has a mass close to one gram. Because of the definition of the unified atomic mass unit, each carbon-12 atom has an atomic mass of exactly 12 Da, and so a mole of carbon-12 atoms weighs exactly 0.012 kg.[70]
Shape and size
Atoms lack a well-defined outer boundary, so their dimensions are usually described in terms of an atomic radius. This is a measure of the distance out to which the electron cloud extends from the nucleus.[74] This assumes the atom to exhibit a spherical shape, which is only obeyed for atoms in vacuum or free space. Atomic radii may be derived from the distances between two nuclei when the two atoms are joined in a chemical bond. The radius varies with the location of an atom on the atomic chart, the type of chemical bond, the number of neighboring atoms (coordination number) and a quantum mechanical property known as spin.[75] On the periodic table of the elements, atom size tends to increase when moving down columns, but decrease when moving across rows (left to right).[76] Consequently, the smallest atom is helium with a radius of 32 pm, while one of the largest is caesium at 225 pm.[77]
When subjected to external forces, like electrical fields, the shape of an atom may deviate from spherical symmetry. The deformation depends on the field magnitude and the orbital type of outer shell electrons, as shown by group-theoretical considerations. Aspherical deviations might be elicited for instance in crystals, where large crystal-electrical fields may occur at low-symmetry lattice sites.[78][79] Significant ellipsoidal deformations have been shown to occur for sulfur ions[80] and chalcogen ions[81] in pyrite-type compounds.
Atomic dimensions are thousands of times smaller than the wavelengths of light (400–700 nm) so they cannot be viewed using an optical microscope, although individual atoms can be observed using a scanning tunneling microscope. To visualize the minuteness of the atom, consider that a typical human hair is about 1 million carbon atoms in width.[82] A single drop of water contains about 2 sextillion (2×1021) atoms of oxygen, and twice the number of hydrogen atoms.[83] A single carat diamond with a mass of 2×10−4 kg contains about 10 sextillion (1022) atoms of carbon.[note 2] If an apple were magnified to the size of the Earth, then the atoms in the apple would be approximately the size of the original apple.[84]
Radioactive decay
This diagram shows the half-life (T1⁄2) of various isotopes with Z protons and N neutrons.
Every element has one or more isotopes that have unstable nuclei that are subject to radioactive decay, causing the nucleus to emit particles or electromagnetic radiation. Radioactivity can occur when the radius of a nucleus is large compared with the radius of the strong force, which only acts over distances on the order of 1 fm.[85]
The most common forms of radioactive decay are:[86][87]
- Alpha decay: this process is caused when the nucleus emits an alpha particle, which is a helium nucleus consisting of two protons and two neutrons. The result of the emission is a new element with a lower atomic number.
- Beta decay (and electron capture): these processes are regulated by the weak force, and result from a transformation of a neutron into a proton, or a proton into a neutron. The neutron to proton transition is accompanied by the emission of an electron and an antineutrino, while proton to neutron transition (except in electron capture) causes the emission of a positron and a neutrino. The electron or positron emissions are called beta particles. Beta decay either increases or decreases the atomic number of the nucleus by one. Electron capture is more common than positron emission, because it requires less energy. In this type of decay, an electron is absorbed by the nucleus, rather than a positron emitted from the nucleus. A neutrino is still emitted in this process, and a proton changes to a neutron.
- Gamma decay: this process results from a change in the energy level of the nucleus to a lower state, resulting in the emission of electromagnetic radiation. The excited state of a nucleus which results in gamma emission usually occurs following the emission of an alpha or a beta particle. Thus, gamma decay usually follows alpha or beta decay.
Other more rare types of radioactive decay include ejection of neutrons or protons or clusters of nucleons from a nucleus, or more than one beta particle. An analog of gamma emission which allows excited nuclei to lose energy in a different way, is internal conversion—a process that produces high-speed electrons that are not beta rays, followed by production of high-energy photons that are not gamma rays. A few large nuclei explode into two or more charged fragments of varying masses plus several neutrons, in a decay called spontaneous nuclear fission.
Each radioactive isotope has a characteristic decay time period—the half-life—that is determined by the amount of time needed for half of a sample to decay. This is an exponential decay process that steadily decreases the proportion of the remaining isotope by 50% every half-life. Hence after two half-lives have passed only 25% of the isotope is present, and so forth.[85]
Magnetic moment
Elementary particles possess an intrinsic quantum mechanical property known as spin. This is analogous to the angular momentum of an object that is spinning around its center of mass, although strictly speaking these particles are believed to be point-like and cannot be said to be rotating. Spin is measured in units of the reduced Planck constant (ħ), with electrons, protons and neutrons all having spin 1⁄2 ħ, or «spin-1⁄2«. In an atom, electrons in motion around the nucleus possess orbital angular momentum in addition to their spin, while the nucleus itself possesses angular momentum due to its nuclear spin.[88]
The magnetic field produced by an atom—its magnetic moment—is determined by these various forms of angular momentum, just as a rotating charged object classically produces a magnetic field, but the most dominant contribution comes from electron spin. Due to the nature of electrons to obey the Pauli exclusion principle, in which no two electrons may be found in the same quantum state, bound electrons pair up with each other, with one member of each pair in a spin up state and the other in the opposite, spin down state. Thus these spins cancel each other out, reducing the total magnetic dipole moment to zero in some atoms with even number of electrons.[89]
In ferromagnetic elements such as iron, cobalt and nickel, an odd number of electrons leads to an unpaired electron and a net overall magnetic moment. The orbitals of neighboring atoms overlap and a lower energy state is achieved when the spins of unpaired electrons are aligned with each other, a spontaneous process known as an exchange interaction. When the magnetic moments of ferromagnetic atoms are lined up, the material can produce a measurable macroscopic field. Paramagnetic materials have atoms with magnetic moments that line up in random directions when no magnetic field is present, but the magnetic moments of the individual atoms line up in the presence of a field.[89][90]
The nucleus of an atom will have no spin when it has even numbers of both neutrons and protons, but for other cases of odd numbers, the nucleus may have a spin. Normally nuclei with spin are aligned in random directions because of thermal equilibrium, but for certain elements (such as xenon-129) it is possible to polarize a significant proportion of the nuclear spin states so that they are aligned in the same direction—a condition called hyperpolarization. This has important applications in magnetic resonance imaging.[91][92]
Energy levels
These electron’s energy levels (not to scale) are sufficient for ground states of atoms up to cadmium (5s2 4d10) inclusively. Do not forget that even the top of the diagram is lower than an unbound electron state.
The potential energy of an electron in an atom is negative relative to when the distance from the nucleus goes to infinity; its dependence on the electron’s position reaches the minimum inside the nucleus, roughly in inverse proportion to the distance. In the quantum-mechanical model, a bound electron can occupy only a set of states centered on the nucleus, and each state corresponds to a specific energy level; see time-independent Schrödinger equation for a theoretical explanation. An energy level can be measured by the amount of energy needed to unbind the electron from the atom, and is usually given in units of electronvolts (eV). The lowest energy state of a bound electron is called the ground state, i.e. stationary state, while an electron transition to a higher level results in an excited state.[93] The electron’s energy increases along with n because the (average) distance to the nucleus increases. Dependence of the energy on ℓ is caused not by the electrostatic potential of the nucleus, but by interaction between electrons.
For an electron to transition between two different states, e.g. ground state to first excited state, it must absorb or emit a photon at an energy matching the difference in the potential energy of those levels, according to the Niels Bohr model, what can be precisely calculated by the Schrödinger equation.
Electrons jump between orbitals in a particle-like fashion. For example, if a single photon strikes the electrons, only a single electron changes states in response to the photon; see Electron properties.
The energy of an emitted photon is proportional to its frequency, so these specific energy levels appear as distinct bands in the electromagnetic spectrum.[94] Each element has a characteristic spectrum that can depend on the nuclear charge, subshells filled by electrons, the electromagnetic interactions between the electrons and other factors.[95]
An example of absorption lines in a spectrum
When a continuous spectrum of energy is passed through a gas or plasma, some of the photons are absorbed by atoms, causing electrons to change their energy level. Those excited electrons that remain bound to their atom spontaneously emit this energy as a photon, traveling in a random direction, and so drop back to lower energy levels. Thus the atoms behave like a filter that forms a series of dark absorption bands in the energy output. (An observer viewing the atoms from a view that does not include the continuous spectrum in the background, instead sees a series of emission lines from the photons emitted by the atoms.) Spectroscopic measurements of the strength and width of atomic spectral lines allow the composition and physical properties of a substance to be determined.[96]
Close examination of the spectral lines reveals that some display a fine structure splitting. This occurs because of spin–orbit coupling, which is an interaction between the spin and motion of the outermost electron.[97] When an atom is in an external magnetic field, spectral lines become split into three or more components; a phenomenon called the Zeeman effect. This is caused by the interaction of the magnetic field with the magnetic moment of the atom and its electrons. Some atoms can have multiple electron configurations with the same energy level, which thus appear as a single spectral line. The interaction of the magnetic field with the atom shifts these electron configurations to slightly different energy levels, resulting in multiple spectral lines.[98] The presence of an external electric field can cause a comparable splitting and shifting of spectral lines by modifying the electron energy levels, a phenomenon called the Stark effect.[99]
If a bound electron is in an excited state, an interacting photon with the proper energy can cause stimulated emission of a photon with a matching energy level. For this to occur, the electron must drop to a lower energy state that has an energy difference matching the energy of the interacting photon. The emitted photon and the interacting photon then move off in parallel and with matching phases. That is, the wave patterns of the two photons are synchronized. This physical property is used to make lasers, which can emit a coherent beam of light energy in a narrow frequency band.[100]
Valence and bonding behavior
Valency is the combining power of an element. It is determined by the number of bonds it can form to other atoms or groups.[101] The outermost electron shell of an atom in its uncombined state is known as the valence shell, and the electrons in
that shell are called valence electrons. The number of valence electrons determines the bonding
behavior with other atoms. Atoms tend to chemically react with each other in a manner that fills (or empties) their outer valence shells.[102] For example, a transfer of a single electron between atoms is a useful approximation for bonds that form between atoms with one-electron more than a filled shell, and others that are one-electron short of a full shell, such as occurs in the compound sodium chloride and other chemical ionic salts. Many elements display multiple valences, or tendencies to share differing numbers of electrons in different compounds. Thus, chemical bonding between these elements takes many forms of electron-sharing that are more than simple electron transfers. Examples include the element carbon and the organic compounds.[103]
The chemical elements are often displayed in a periodic table that is laid out to display recurring chemical properties, and elements with the same number of valence electrons form a group that is aligned in the same column of the table. (The horizontal rows correspond to the filling of a quantum shell of electrons.) The elements at the far right of the table have their outer shell completely filled with electrons, which results in chemically inert elements known as the noble gases.[104][105]
States
Quantities of atoms are found in different states of matter that depend on the physical conditions, such as temperature and pressure. By varying the conditions, materials can transition between solids, liquids, gases and plasmas.[106] Within a state, a material can also exist in different allotropes. An example of this is solid carbon, which can exist as graphite or diamond.[107] Gaseous allotropes exist as well, such as dioxygen and ozone.
At temperatures close to absolute zero, atoms can form a Bose–Einstein condensate, at which point quantum mechanical effects, which are normally only observed at the atomic scale, become apparent on a macroscopic scale.[108][109] This super-cooled collection of atoms
then behaves as a single super atom, which may allow fundamental checks of quantum mechanical behavior.[110]
Identification
While atoms are too small to be seen, devices such as the scanning tunneling microscope (STM) enable their visualization at the surfaces of solids. The microscope uses the quantum tunneling phenomenon, which allows particles to pass through a barrier that would be insurmountable in the classical perspective. Electrons tunnel through the vacuum between two biased electrodes, providing a tunneling current that is exponentially dependent on their separation. One electrode is a sharp tip ideally ending with a single atom. At each point of the scan of the surface the tip’s height is adjusted so as to keep the tunneling current at a set value. How much the tip moves to and away from the surface is interpreted as the height profile. For low bias, the microscope images the averaged electron orbitals across closely packed energy levels—the local density of the electronic states near the Fermi level.[111][112] Because of the distances involved, both electrodes need to be extremely stable; only then periodicities can be observed that correspond to individual atoms. The method alone is not chemically specific, and cannot identify the atomic species present at the surface.
Atoms can be easily identified by their mass. If an atom is ionized by removing one of its electrons, its trajectory when it passes through a magnetic field will bend. The radius by which the trajectory of a moving ion is turned by the magnetic field is determined by the mass of the atom. The mass spectrometer uses this principle to measure the mass-to-charge ratio of ions. If a sample contains multiple isotopes, the mass spectrometer can determine the proportion of each isotope in the sample by measuring the intensity of the different beams of ions. Techniques to vaporize atoms include inductively coupled plasma atomic emission spectroscopy and inductively coupled plasma mass spectrometry, both of which use a plasma to vaporize samples for analysis.[113]
The atom-probe tomograph has sub-nanometer resolution in 3-D and can chemically identify individual atoms using time-of-flight mass spectrometry.[114]
Electron emission techniques such as X-ray photoelectron spectroscopy (XPS) and Auger electron spectroscopy (AES), which measure the binding energies of the core electrons, are used to identify the atomic species present in a sample in a non-destructive way. With proper focusing both can be made area-specific. Another such method is electron energy loss spectroscopy (EELS), which measures the energy loss of an electron beam within a transmission electron microscope when it interacts with a portion of a sample.
Spectra of excited states can be used to analyze the atomic composition of distant stars. Specific light wavelengths contained in the observed light from stars can be separated out and related to the quantized transitions in free gas atoms. These colors can be replicated using a gas-discharge lamp containing the same element.[115] Helium was discovered in this way in the spectrum of the Sun 23 years before it was found on Earth.[116]
Origin and current state
Baryonic matter forms about 4% of the total energy density of the observable universe, with an average density of about 0.25 particles/m3 (mostly protons and electrons).[117] Within a galaxy such as the Milky Way, particles have a much higher concentration, with the density of matter in the interstellar medium (ISM) ranging from 105 to 109 atoms/m3.[118] The Sun is believed to be inside the Local Bubble, so the density in the solar neighborhood is only about 103 atoms/m3.[119] Stars form from dense clouds in the ISM, and the evolutionary processes of stars result in the steady enrichment of the ISM with elements more massive than hydrogen and helium.
Up to 95% of the Milky Way’s baryonic matter are concentrated inside stars, where conditions are unfavorable for atomic matter. The total baryonic mass is about 10% of the mass of the galaxy;[120] the remainder of the mass is an unknown dark matter.[121] High temperature inside stars makes most «atoms» fully ionized, that is, separates all electrons from the nuclei. In stellar remnants—with exception of their surface layers—an immense pressure make electron shells impossible.
Formation
Periodic table showing the origin of each element. Elements from carbon up to sulfur may be made in small stars by the alpha process. Elements beyond iron are made in large stars with slow neutron capture (s-process). Elements heavier than iron may be made in neutron star mergers or supernovae after the r-process.
Electrons are thought to exist in the Universe since early stages of the Big Bang. Atomic nuclei forms in nucleosynthesis reactions. In about three minutes Big Bang nucleosynthesis produced most of the helium, lithium, and deuterium in the Universe, and perhaps some of the beryllium and boron.[122][123][124]
Ubiquitousness and stability of atoms relies on their binding energy, which means that an atom has a lower energy than an unbound system of the nucleus and electrons. Where the temperature is much higher than ionization potential, the matter exists in the form of plasma—a gas of positively charged ions (possibly, bare nuclei) and electrons. When the temperature drops below the ionization potential, atoms become statistically favorable. Atoms (complete with bound electrons) became to dominate over charged particles 380,000 years after the Big Bang—an epoch called recombination, when the expanding Universe cooled enough to allow electrons to become attached to nuclei.[125]
Since the Big Bang, which produced no carbon or heavier elements, atomic nuclei have been combined in stars through the process of nuclear fusion to produce more of the element helium, and (via the triple alpha process) the sequence of elements from carbon up to iron;[126] see stellar nucleosynthesis for details.
Isotopes such as lithium-6, as well as some beryllium and boron are generated in space through cosmic ray spallation.[127] This occurs when a high-energy proton strikes an atomic nucleus, causing large numbers of nucleons to be ejected.
Elements heavier than iron were produced in supernovae and colliding neutron stars through the r-process, and in AGB stars through the s-process, both of which involve the capture of neutrons by atomic nuclei.[128] Elements such as lead formed largely through the radioactive decay of heavier elements.[129]
Earth
Most of the atoms that make up the Earth and its inhabitants were present in their current form in the nebula that collapsed out of a molecular cloud to form the Solar System. The rest are the result of radioactive decay, and their relative proportion can be used to determine the age of the Earth through radiometric dating.[130][131] Most of the helium in the crust of the Earth (about 99% of the helium from gas wells, as shown by its lower abundance of helium-3) is a product of alpha decay.[132]
There are a few trace atoms on Earth that were not present at the beginning (i.e., not «primordial»), nor are results of radioactive decay. Carbon-14 is continuously generated by cosmic rays in the atmosphere.[133] Some atoms on Earth have been artificially generated either deliberately or as by-products of nuclear reactors or explosions.[134][135] Of the transuranic elements—those with atomic numbers greater than 92—only plutonium and neptunium occur naturally on Earth.[136][137] Transuranic elements have radioactive lifetimes shorter than the current age of the Earth[138] and thus identifiable quantities of these elements have long since decayed, with the exception of traces of plutonium-244 possibly deposited by cosmic dust.[130] Natural deposits of plutonium and neptunium are produced by neutron capture in uranium ore.[139]
The Earth contains approximately 1.33×1050 atoms.[140] Although small numbers of independent atoms of noble gases exist, such as argon, neon, and helium, 99% of the atmosphere is bound in the form of molecules, including carbon dioxide and diatomic oxygen and nitrogen. At the surface of the Earth, an overwhelming majority of atoms combine to form various compounds, including water, salt, silicates and oxides. Atoms can also combine to create materials that do not consist of discrete molecules, including crystals and liquid or solid metals.[141][142] This atomic matter forms networked arrangements that lack the particular type of small-scale interrupted order associated with molecular matter.[143]
Rare and theoretical forms
Superheavy elements
All nuclides with atomic numbers higher than 82 (lead) are known to be radioactive. No nuclide with an atomic number exceeding 92 (uranium) exists on Earth as a primordial nuclide, and heavier elements generally have shorter half-lives. Nevertheless, an «island of stability» encompassing relatively long-lived isotopes of superheavy elements[144] with atomic numbers 110 to 114 might exist.[145] Predictions for the half-life of the most stable nuclide on the island range from a few minutes to millions of years.[146] In any case, superheavy elements (with Z > 104) would not exist due to increasing Coulomb repulsion (which results in spontaneous fission with increasingly short half-lives) in the absence of any stabilizing effects.[147]
Exotic matter
Each particle of matter has a corresponding antimatter particle with the opposite electrical charge. Thus, the positron is a positively charged antielectron and the antiproton is a negatively charged equivalent of a proton. When a matter and corresponding antimatter particle meet, they annihilate each other. Because of this, along with an imbalance between the number of matter and antimatter particles, the latter are rare in the universe. The first causes of this imbalance are not yet fully understood, although theories of baryogenesis may offer an explanation. As a result, no antimatter atoms have been discovered in nature.[148][149] In 1996, the antimatter counterpart of the hydrogen atom (antihydrogen) was synthesized at the CERN laboratory in Geneva.[150][151]
Other exotic atoms have been created by replacing one of the protons, neutrons or electrons with other particles that have the same charge. For example, an electron can be replaced by a more massive muon, forming a muonic atom. These types of atoms can be used to test fundamental predictions of physics.[152][153][154]
See also
- History of quantum mechanics
- Infinite divisibility
- Outline of chemistry
- Motion
- Timeline of atomic and subatomic physics
- Nuclear model
- Radioactive isotope
Notes
- ^ For more recent updates see Brookhaven National Laboratory’s Interactive Chart of Nuclides ] Archived 25 July 2020 at the Wayback Machine.
- ^ A carat is 200 milligrams. By definition, carbon-12 has 0.012 kg per mole. The Avogadro constant defines 6×1023 atoms per mole.
- ^ a combination of the negative term «a-» and «τομή,» the term for «cut»
- ^ Iron(II) oxide’s formula is written here as «Fe2O2» rather than the more conventional «FeO» because this better illustrates the explanation.
References
- ^ Pullman, Bernard (1998). The Atom in the History of Human Thought. Oxford, England: Oxford University Press. pp. 31–33. ISBN 978-0-19-515040-7. Archived from the original on 5 February 2021. Retrieved 25 October 2020.
- ^ Melsen (1952). From Atomos to Atom, pp. 18-19
- ^ Dalton (1817). A New System of Chemical Philosophy vol. 2, p. 36
- ^ Melsen (1952). From Atomos to Atom, p. 137
- ^ Dalton (1817). A New System of Chemical Philosophy vol. 2, pp. 28
- ^ Millington (1906). John Dalton, p. 113
- ^ Dalton (1808). A New System of Chemical Philosophy vol. 1, pp. 316-319
- ^ Holbrow et al. (2010). Modern Introductory Physics, pp. 65-66
- ^ Bernoulli, Daniel (1738). Hydrodynamica, sive de viribus et motibus fluidorum commentarii (in Latin, source ETH-Bibliothek Zurich, Rar 5503). sumptibus Johannis Reinholdi Dulseckeri; Typis Joh. Deckeri, typographi Basiliensis. doi:10.3931/e-rara-3911.
- ^ Einstein, Albert (1905). «Über die von der molekularkinetischen Theorie der Wärme geforderte Bewegung von in ruhenden Flüssigkeiten suspendierten Teilchen» (PDF). Annalen der Physik (in German). 322 (8): 549–560. Bibcode:1905AnP…322..549E. doi:10.1002/andp.19053220806. Archived (PDF) from the original on 18 July 2007.
- ^ Mazo, Robert M. (2002). Brownian Motion: Fluctuations, Dynamics, and Applications. Oxford University Press. pp. 1–7. ISBN 978-0-19-851567-8. OCLC 48753074.
- ^ Lee, Y.K.; Hoon, K. (1995). «Brownian Motion». Imperial College. Archived from the original on 18 December 2007.
- ^ Patterson, G. (2007). «Jean Perrin and the triumph of the atomic doctrine». Endeavour. 31 (2): 50–53. doi:10.1016/j.endeavour.2007.05.003. PMID 17602746.
- ^ Thomson, J.J. (August 1901). «On bodies smaller than atoms». The Popular Science Monthly: 323–335. Archived from the original on 1 December 2016. Retrieved 21 June 2009.
- ^ «The Mechanism Of Conduction In Metals» Archived 25 October 2012 at the Wayback Machine, Think Quest.
- ^ Navarro (2012). A History of the Electron, p. 94
- ^ a b Heilbron (2003). Ernest Rutherford and the Explosion of Atoms, pp. 64-68
- ^ «Frederick Soddy, The Nobel Prize in Chemistry 1921». Nobel Foundation. Archived from the original on 9 April 2008. Retrieved 18 January 2008.
- ^ Thomson, Joseph John (1913). «Rays of positive electricity». Proceedings of the Royal Society. A. 89 (607): 1–20. Bibcode:1913RSPSA..89….1T. doi:10.1098/rspa.1913.0057. Archived from the original on 4 November 2016.
- ^ Stern, David P. (16 May 2005). «The Atomic Nucleus and Bohr’s Early Model of the Atom». NASA/Goddard Space Flight Center. Archived from the original on 20 August 2007.
- ^ Bohr, Niels (11 December 1922). «Niels Bohr, The Nobel Prize in Physics 1922, Nobel Lecture». Nobel Foundation. Archived from the original on 15 April 2008.
- ^ a b c Pais, Abraham (1986). Inward Bound: Of Matter and Forces in the Physical World. New York: Oxford University Press. pp. 228–230. ISBN 978-0-19-851971-3.
- ^ Lewis, Gilbert N. (1916). «The Atom and the Molecule». Journal of the American Chemical Society. 38 (4): 762–786. doi:10.1021/ja02261a002. S2CID 95865413. Archived (PDF) from the original on 25 August 2019.
- ^ Scerri, Eric R. (2007). The periodic table: its story and its significance. Oxford University Press US. pp. 205–226. ISBN 978-0-19-530573-9.
- ^ Langmuir, Irving (1919). «The Arrangement of Electrons in Atoms and Molecules». Journal of the American Chemical Society. 41 (6): 868–934. doi:10.1021/ja02227a002. Archived from the original on 21 June 2019.
- ^ Scully, Marlan O.; Lamb, Willis E.; Barut, Asim (1987). «On the theory of the Stern-Gerlach apparatus». Foundations of Physics. 17 (6): 575–583. Bibcode:1987FoPh…17..575S. doi:10.1007/BF01882788. S2CID 122529426.
- ^ McEvoy, J. P.; Zarate, Oscar (2004). Introducing Quantum Theory. Totem Books. pp. 110–114. ISBN 978-1-84046-577-8.
- ^ Kozłowski, Miroslaw (2019). «The Schrödinger equation A History».
- ^ Chad Orzel (16 September 2014). «What is the Heisenberg Uncertainty Principle?». TED-Ed. Archived from the original on 13 September 2015 – via YouTube.
- ^ Brown, Kevin (2007). «The Hydrogen Atom». MathPages. Archived from the original on 5 September 2012.
- ^ Harrison, David M. (2000). «The Development of Quantum Mechanics». University of Toronto. Archived from the original on 25 December 2007.
- ^ Aston, Francis W. (1920). «The constitution of atmospheric neon». Philosophical Magazine. 39 (6): 449–455. doi:10.1080/14786440408636058. Archived from the original on 27 April 2021. Retrieved 25 October 2020.
- ^ Chadwick, James (12 December 1935). «Nobel Lecture: The Neutron and Its Properties». Nobel Foundation. Archived from the original on 12 October 2007.
- ^ Bowden, Mary Ellen (1997). «Otto Hahn, Lise Meitner, and Fritz Strassmann». Chemical achievers : the human face of the chemical sciences. Philadelphia, PA: Chemical Heritage Foundation. pp. 76–80, 125. ISBN 978-0-941901-12-3.
- ^ «Otto Hahn, Lise Meitner, and Fritz Strassmann». Science History Institute. June 2016. Archived from the original on 21 March 2018.
- ^ Meitner, Lise; Frisch, Otto Robert (1939). «Disintegration of uranium by neutrons: a new type of nuclear reaction». Nature. 143 (3615): 239–240. Bibcode:1939Natur.143..239M. doi:10.1038/143239a0. S2CID 4113262.
- ^ Schroeder, M. «Lise Meitner – Zur 125. Wiederkehr Ihres Geburtstages» (in German). Archived from the original on 19 July 2011. Retrieved 4 June 2009.
- ^ Crawford, E.; Sime, Ruth Lewin; Walker, Mark (1997). «A Nobel tale of postwar injustice». Physics Today. 50 (9): 26–32. Bibcode:1997PhT….50i..26C. doi:10.1063/1.881933.
- ^ Kullander, Sven (28 August 2001). «Accelerators and Nobel Laureates». Nobel Foundation. Archived from the original on 13 April 2008.
- ^ «The Nobel Prize in Physics 1990». Nobel Foundation. 17 October 1990. Archived from the original on 14 May 2008.
- ^ Demtröder, Wolfgang (2002). Atoms, Molecules and Photons: An Introduction to Atomic- Molecular- and Quantum Physics (1st ed.). Springer. pp. 39–42. ISBN 978-3-540-20631-6. OCLC 181435713.
- ^ Woan, Graham (2000). The Cambridge Handbook of Physics. Cambridge University Press. p. 8. ISBN 978-0-521-57507-2. OCLC 224032426.
- ^ Mohr, P.J.; Taylor, B.N. and Newell, D.B. (2014), «The 2014 CODATA Recommended Values of the Fundamental Physical Constants» Archived 11 February 2012 at the Wayback Machine (Web Version 7.0). The database was developed by J. Baker, M. Douma, and S. Kotochigova. (2014). National Institute of Standards and Technology, Gaithersburg, Maryland 20899.
- ^ MacGregor, Malcolm H. (1992). The Enigmatic Electron. Oxford University Press. pp. 33–37. ISBN 978-0-19-521833-6. OCLC 223372888.
- ^ a b Particle Data Group (2002). «The Particle Adventure». Lawrence Berkeley Laboratory. Archived from the original on 4 January 2007.
- ^ a b Schombert, James (18 April 2006). «Elementary Particles». University of Oregon. Archived from the original on 30 August 2011.
- ^ Jevremovic, Tatjana (2005). Nuclear Principles in Engineering. Springer. p. 63. ISBN 978-0-387-23284-3. OCLC 228384008.
- ^ Pfeffer, Jeremy I.; Nir, Shlomo (2000). Modern Physics: An Introductory Text. Imperial College Press. pp. 330–336. ISBN 978-1-86094-250-1. OCLC 45900880.
- ^ Wenner, Jennifer M. (10 October 2007). «How Does Radioactive Decay Work?». Carleton College. Archived from the original on 11 May 2008.
- ^ a b c Raymond, David (7 April 2006). «Nuclear Binding Energies». New Mexico Tech. Archived from the original on 1 December 2002.
- ^ Mihos, Chris (23 July 2002). «Overcoming the Coulomb Barrier». Case Western Reserve University. Archived from the original on 12 September 2006.
- ^ Staff (30 March 2007). «ABC’s of Nuclear Science». Lawrence Berkeley National Laboratory. Archived from the original on 5 December 2006.
- ^ Makhijani, Arjun; Saleska, Scott (2 March 2001). «Basics of Nuclear Physics and Fission». Institute for Energy and Environmental Research. Archived from the original on 16 January 2007.
- ^ Shultis, J. Kenneth; Faw, Richard E. (2002). Fundamentals of Nuclear Science and Engineering. CRC Press. pp. 10–17. ISBN 978-0-8247-0834-4. OCLC 123346507.
- ^ Fewell, M.P. (1995). «The atomic nuclide with the highest mean binding energy». American Journal of Physics. 63 (7): 653–658. Bibcode:1995AmJPh..63..653F. doi:10.1119/1.17828.
- ^ Mulliken, Robert S. (1967). «Spectroscopy, Molecular Orbitals, and Chemical Bonding». Science. 157 (3784): 13–24. Bibcode:1967Sci…157…13M. doi:10.1126/science.157.3784.13. PMID 5338306.
- ^ a b Brucat, Philip J. (2008). «The Quantum Atom». University of Florida. Archived from the original on 7 December 2006.
- ^ Manthey, David (2001). «Atomic Orbitals». Orbital Central. Archived from the original on 10 January 2008.
- ^ Herter, Terry (2006). «Lecture 8: The Hydrogen Atom». Cornell University. Archived from the original on 22 February 2012.
- ^ Bell, R.E.; Elliott, L.G. (1950). «Gamma-Rays from the Reaction H1(n,γ)D2 and the Binding Energy of the Deuteron». Physical Review. 79 (2): 282–285. Bibcode:1950PhRv…79..282B. doi:10.1103/PhysRev.79.282.
- ^ Smirnov, Boris M. (2003). Physics of Atoms and Ions. Springer. pp. 249–272. ISBN 978-0-387-95550-6.
- ^ Matis, Howard S. (9 August 2000). «The Isotopes of Hydrogen». Guide to the Nuclear Wall Chart. Lawrence Berkeley National Lab. Archived from the original on 18 December 2007.
- ^ Weiss, Rick (17 October 2006). «Scientists Announce Creation of Atomic Element, the Heaviest Yet». Washington Post. Archived from the original on 20 August 2011.
- ^ a b Sills, Alan D. (2003). Earth Science the Easy Way. Barron’s Educational Series. pp. 131–134. ISBN 978-0-7641-2146-3. OCLC 51543743.
- ^ Dumé, Belle (23 April 2003). «Bismuth breaks half-life record for alpha decay». Physics World. Archived from the original on 14 December 2007.
- ^ Lindsay, Don (30 July 2000). «Radioactives Missing From The Earth». Don Lindsay Archive. Archived from the original on 28 April 2007.
- ^ Tuli, Jagdish K. (April 2005). «Nuclear Wallet Cards». National Nuclear Data Center, Brookhaven National Laboratory. Archived from the original on 3 October 2011.
- ^ CRC Handbook (2002).
- ^ Krane, K. (1988). Introductory Nuclear Physics. John Wiley & Sons. pp. 68. ISBN 978-0-471-85914-7.
- ^ a b Mills, Ian; Cvitaš, Tomislav; Homann, Klaus; Kallay, Nikola; Kuchitsu, Kozo (1993). Quantities, Units and Symbols in Physical Chemistry (2nd ed.). Oxford: International Union of Pure and Applied Chemistry, Commission on Physiochemical Symbols Terminology and Units, Blackwell Scientific Publications. p. 70. ISBN 978-0-632-03583-0. OCLC 27011505.
- ^ Chieh, Chung (22 January 2001). «Nuclide Stability». University of Waterloo. Archived from the original on 30 August 2007.
- ^ «Atomic Weights and Isotopic Compositions for All Elements». National Institute of Standards and Technology. Archived from the original on 31 December 2006. Retrieved 4 January 2007.
- ^ Audi, G.; Wapstra, A.H.; Thibault, C. (2003). «The Ame2003 atomic mass evaluation (II)» (PDF). Nuclear Physics A. 729 (1): 337–676. Bibcode:2003NuPhA.729..337A. doi:10.1016/j.nuclphysa.2003.11.003. Archived (PDF) from the original on 16 October 2005.
- ^ Ghosh, D.C.; Biswas, R. (2002). «Theoretical calculation of Absolute Radii of Atoms and Ions. Part 1. The Atomic Radii». Int. J. Mol. Sci. 3 (11): 87–113. doi:10.3390/i3020087.
- ^ Shannon, R.D. (1976). «Revised effective ionic radii and systematic studies of interatomic distances in halides and chalcogenides» (PDF). Acta Crystallographica A. 32 (5): 751–767. Bibcode:1976AcCrA..32..751S. doi:10.1107/S0567739476001551. Archived (PDF) from the original on 14 August 2020. Retrieved 25 August 2019.
- ^ Dong, Judy (1998). «Diameter of an Atom». The Physics Factbook. Archived from the original on 4 November 2007.
- ^ Zumdahl, Steven S. (2002). Introductory Chemistry: A Foundation (5th ed.). Houghton Mifflin. ISBN 978-0-618-34342-3. OCLC 173081482. Archived from the original on 4 March 2008.
- ^ Bethe, Hans (1929). «Termaufspaltung in Kristallen». Annalen der Physik. 3 (2): 133–208. Bibcode:1929AnP…395..133B. doi:10.1002/andp.19293950202.
- ^ Birkholz, Mario (1995). «Crystal-field induced dipoles in heteropolar crystals – I. concept». Z. Phys. B. 96 (3): 325–332. Bibcode:1995ZPhyB..96..325B. CiteSeerX 10.1.1.424.5632. doi:10.1007/BF01313054. S2CID 122527743.
- ^ Birkholz, M.; Rudert, R. (2008). «Interatomic distances in pyrite-structure disulfides – a case for ellipsoidal modeling of sulfur ions» (PDF). Physica Status Solidi B. 245 (9): 1858–1864. Bibcode:2008PSSBR.245.1858B. doi:10.1002/pssb.200879532. S2CID 97824066. Archived (PDF) from the original on 2 May 2021. Retrieved 2 May 2021.
- ^ Birkholz, M. (2014). «Modeling the Shape of Ions in Pyrite-Type Crystals». Crystals. 4 (3): 390–403. doi:10.3390/cryst4030390.
- ^ Staff (2007). «Small Miracles: Harnessing nanotechnology». Oregon State University. Archived from the original on 21 May 2011. – describes the width of a human hair as 105 nm and 10 carbon atoms as spanning 1 nm.
- ^ Padilla, Michael J.; Miaoulis, Ioannis; Cyr, Martha (2002). Prentice Hall Science Explorer: Chemical Building Blocks. Upper Saddle River, New Jersey: Prentice-Hall, Inc. p. 32. ISBN 978-0-13-054091-1. OCLC 47925884.
There are 2,000,000,000,000,000,000,000 (that’s 2 sextillion) atoms of oxygen in one drop of water—and twice as many atoms of hydrogen.
- ^ «The Feynman Lectures on Physics Vol. I Ch. 1: Atoms in Motion». Archived from the original on 30 July 2022. Retrieved 3 May 2022.
- ^ a b «Radioactivity». Splung.com. Archived from the original on 4 December 2007. Retrieved 19 December 2007.
- ^ L’Annunziata, Michael F. (2003). Handbook of Radioactivity Analysis. Academic Press. pp. 3–56. ISBN 978-0-12-436603-9. OCLC 16212955.
- ^ Firestone, Richard B. (22 May 2000). «Radioactive Decay Modes». Berkeley Laboratory. Archived from the original on 29 September 2006.
- ^ Hornak, J.P. (2006). «Chapter 3: Spin Physics». The Basics of NMR. Rochester Institute of Technology. Archived from the original on 3 February 2007.
- ^ a b Schroeder, Paul A. (25 February 2000). «Magnetic Properties». University of Georgia. Archived from the original on 29 April 2007.
- ^ Goebel, Greg (1 September 2007). «[4.3] Magnetic Properties of the Atom». Elementary Quantum Physics. In The Public Domain website. Archived from the original on 29 June 2011.
- ^ Yarris, Lynn (Spring 1997). «Talking Pictures». Berkeley Lab Research Review. Archived from the original on 13 January 2008.
- ^ Liang, Z.-P.; Haacke, E.M. (1999). Webster, J.G. (ed.). Encyclopedia of Electrical and Electronics Engineering: Magnetic Resonance Imaging. Vol. 2. John Wiley & Sons. pp. 412–426. ISBN 978-0-471-13946-1.
- ^ Zeghbroeck, Bart J. Van (1998). «Energy levels». Shippensburg University. Archived from the original on 15 January 2005.
- ^ Fowles, Grant R. (1989). Introduction to Modern Optics. Courier Dover Publications. pp. 227–233. ISBN 978-0-486-65957-2. OCLC 18834711.
- ^ Martin, W.C.; Wiese, W.L. (May 2007). «Atomic Spectroscopy: A Compendium of Basic Ideas, Notation, Data, and Formulas». National Institute of Standards and Technology. Archived from the original on 8 February 2007.
- ^ «Atomic Emission Spectra – Origin of Spectral Lines». Avogadro Web Site. Archived from the original on 28 February 2006. Retrieved 10 August 2006.
- ^ Fitzpatrick, Richard (16 February 2007). «Fine structure». University of Texas at Austin. Archived from the original on 27 September 2011.
- ^ Weiss, Michael (2001). «The Zeeman Effect». University of California-Riverside. Archived from the original on 2 February 2008.
- ^ Beyer, H.F.; Shevelko, V.P. (2003). Introduction to the Physics of Highly Charged Ions. CRC Press. pp. 232–236. ISBN 978-0-7503-0481-8. OCLC 47150433.
- ^ Watkins, Thayer. «Coherence in Stimulated Emission». San José State University. Archived from the original on 12 January 2008. Retrieved 23 December 2007.
- ^ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the «Gold Book») (1997). Online corrected version: (2006–) «valence». doi:10.1351/goldbook.V06588
- ^ Reusch, William (16 July 2007). «Virtual Textbook of Organic Chemistry». Michigan State University. Archived from the original on 29 October 2007.
- ^ «Covalent bonding – Single bonds». chemguide. 2000. Archived from the original on 1 November 2008.
- ^ Husted, Robert; et al. (11 December 2003). «Periodic Table of the Elements». Los Alamos National Laboratory. Archived from the original on 10 January 2008.
- ^ Baum, Rudy (2003). «It’s Elemental: The Periodic Table». Chemical & Engineering News. Archived from the original on 6 April 2011.
- ^ Goodstein, David L. (2002). States of Matter. Courier Dover Publications. pp. 436–438. ISBN 978-0-13-843557-8.
- ^ Brazhkin, Vadim V. (2006). «Metastable phases, phase transformations, and phase diagrams in physics and chemistry». Physics-Uspekhi. 49 (7): 719–724. Bibcode:2006PhyU…49..719B. doi:10.1070/PU2006v049n07ABEH006013. S2CID 93168446.
- ^ Myers, Richard (2003). The Basics of Chemistry. Greenwood Press. p. 85. ISBN 978-0-313-31664-7. OCLC 50164580.
- ^ Staff (9 October 2001). «Bose–Einstein Condensate: A New Form of Matter». National Institute of Standards and Technology. Archived from the original on 3 January 2008.
- ^ Colton, Imogen; Fyffe, Jeanette (3 February 1999). «Super Atoms from Bose–Einstein Condensation». The University of Melbourne. Archived from the original on 29 August 2007.
- ^ Jacox, Marilyn; Gadzuk, J. William (November 1997). «Scanning Tunneling Microscope». National Institute of Standards and Technology. Archived from the original on 7 January 2008.
- ^ «The Nobel Prize in Physics 1986». The Nobel Foundation. Archived from the original on 17 September 2008. Retrieved 11 January 2008. In particular, see the Nobel lecture by G. Binnig and H. Rohrer.
- ^ Jakubowski, N.; Moens, Luc; Vanhaecke, Frank (1998). «Sector field mass spectrometers in ICP-MS». Spectrochimica Acta Part B: Atomic Spectroscopy. 53 (13): 1739–1763. Bibcode:1998AcSpe..53.1739J. doi:10.1016/S0584-8547(98)00222-5.
- ^ Müller, Erwin W.; Panitz, John A.; McLane, S. Brooks (1968). «The Atom-Probe Field Ion Microscope». Review of Scientific Instruments. 39 (1): 83–86. Bibcode:1968RScI…39…83M. doi:10.1063/1.1683116.
- ^ Lochner, Jim; Gibb, Meredith; Newman, Phil (30 April 2007). «What Do Spectra Tell Us?». NASA/Goddard Space Flight Center. Archived from the original on 16 January 2008.
- ^ Winter, Mark (2007). «Helium». WebElements. Archived from the original on 30 December 2007.
- ^ Hinshaw, Gary (10 February 2006). «What is the Universe Made Of?». NASA/WMAP. Archived from the original on 31 December 2007.
- ^ Choppin, Gregory R.; Liljenzin, Jan-Olov; Rydberg, Jan (2001). Radiochemistry and Nuclear Chemistry. Elsevier. p. 441. ISBN 978-0-7506-7463-8. OCLC 162592180.
- ^ Davidsen, Arthur F. (1993). «Far-Ultraviolet Astronomy on the Astro-1 Space Shuttle Mission». Science. 259 (5093): 327–334. Bibcode:1993Sci…259..327D. doi:10.1126/science.259.5093.327. PMID 17832344. S2CID 28201406.
- ^ Lequeux, James (2005). The Interstellar Medium. Springer. p. 4. ISBN 978-3-540-21326-0. OCLC 133157789.
- ^ Smith, Nigel (6 January 2000). «The search for dark matter». Physics World. Archived from the original on 16 February 2008.
- ^ Croswell, Ken (1991). «Boron, bumps and the Big Bang: Was matter spread evenly when the Universe began? Perhaps not; the clues lie in the creation of the lighter elements such as boron and beryllium». New Scientist (1794): 42. Archived from the original on 7 February 2008.
- ^ Copi, Craig J.; Schramm, DN; Turner, MS (1995). «Big-Bang Nucleosynthesis and the Baryon Density of the Universe». Science (Submitted manuscript). 267 (5195): 192–199. arXiv:astro-ph/9407006. Bibcode:1995Sci…267..192C. doi:10.1126/science.7809624. PMID 7809624. S2CID 15613185. Archived from the original on 14 August 2019.
- ^ Hinshaw, Gary (15 December 2005). «Tests of the Big Bang: The Light Elements». NASA/WMAP. Archived from the original on 17 January 2008.
- ^ Abbott, Brian (30 May 2007). «Microwave (WMAP) All-Sky Survey». Hayden Planetarium. Archived from the original on 13 February 2013.
- ^ Hoyle, F. (1946). «The synthesis of the elements from hydrogen». Monthly Notices of the Royal Astronomical Society. 106 (5): 343–383. Bibcode:1946MNRAS.106..343H. doi:10.1093/mnras/106.5.343.
- ^ Knauth, D.C.; Knauth, D.C.; Lambert, David L.; Crane, P. (2000). «Newly synthesized lithium in the interstellar medium». Nature. 405 (6787): 656–658. Bibcode:2000Natur.405..656K. doi:10.1038/35015028. PMID 10864316. S2CID 4397202.
- ^ Mashnik, Stepan G. (2000). «On Solar System and Cosmic Rays Nucleosynthesis and Spallation Processes». arXiv:astro-ph/0008382.
- ^ Kansas Geological Survey (4 May 2005). «Age of the Earth». University of Kansas. Archived from the original on 5 July 2008.
- ^ a b Manuel (2001). Origin of Elements in the Solar System, pp. 407-430, 511-519
- ^ Dalrymple, G. Brent (2001). «The age of the Earth in the twentieth century: a problem (mostly) solved». Geological Society, London, Special Publications. 190 (1): 205–221. Bibcode:2001GSLSP.190..205D. doi:10.1144/GSL.SP.2001.190.01.14. S2CID 130092094. Archived from the original on 11 November 2007.
- ^ Anderson, Don L.; Foulger, G.R.; Meibom, Anders (2 September 2006). «Helium: Fundamental models». MantlePlumes.org. Archived from the original on 8 February 2007.
- ^ Pennicott, Katie (10 May 2001). «Carbon clock could show the wrong time». PhysicsWeb. Archived from the original on 15 December 2007.
- ^ Yarris, Lynn (27 July 2001). «New Superheavy Elements 118 and 116 Discovered at Berkeley Lab». Berkeley Lab. Archived from the original on 9 January 2008.
- ^ Diamond, H; et al. (1960). «Heavy Isotope Abundances in Mike Thermonuclear Device». Physical Review. 119 (6): 2000–2004. Bibcode:1960PhRv..119.2000D. doi:10.1103/PhysRev.119.2000.
- ^ Poston, John W. Sr. (23 March 1998). «Do transuranic elements such as plutonium ever occur naturally?». Scientific American. Archived from the original on 27 March 2015.
- ^ Keller, C. (1973). «Natural occurrence of lanthanides, actinides, and superheavy elements». Chemiker Zeitung. 97 (10): 522–530. OSTI 4353086.
- ^ Zaider, Marco; Rossi, Harald H. (2001). Radiation Science for Physicians and Public Health Workers. Springer. p. 17. ISBN 978-0-306-46403-4. OCLC 44110319.
- ^ «Oklo Fossil Reactors». Curtin University of Technology. Archived from the original on 18 December 2007. Retrieved 15 January 2008.
- ^ Weisenberger, Drew. «How many atoms are there in the world?». Jefferson Lab. Archived from the original on 22 October 2007. Retrieved 16 January 2008.
- ^ Pidwirny, Michael. «Fundamentals of Physical Geography». University of British Columbia Okanagan. Archived from the original on 21 January 2008. Retrieved 16 January 2008.
- ^ Anderson, Don L. (2002). «The inner inner core of Earth». Proceedings of the National Academy of Sciences. 99 (22): 13966–13968. Bibcode:2002PNAS…9913966A. doi:10.1073/pnas.232565899. PMC 137819. PMID 12391308.
- ^ Pauling, Linus (1960). The Nature of the Chemical Bond. Cornell University Press. pp. 5–10. ISBN 978-0-8014-0333-0. OCLC 17518275.
- ^ Anonymous (2 October 2001). «Second postcard from the island of stability». CERN Courier. Archived from the original on 3 February 2008.
- ^ Karpov, A. V.; Zagrebaev, V. I.; Palenzuela, Y. M.; et al. (2012). «Decay properties and stability of the heaviest elements» (PDF). International Journal of Modern Physics E. 21 (2): 1250013-1–1250013-20. Bibcode:2012IJMPE..2150013K. doi:10.1142/S0218301312500139. Archived (PDF) from the original on 3 December 2016. Retrieved 24 March 2020.
- ^ «Superheavy Element 114 Confirmed: A Stepping Stone to the Island of Stability». Berkeley Lab. 2009. Archived from the original on 20 July 2019. Retrieved 24 March 2020.
- ^ Möller, P. (2016). «The limits of the nuclear chart set by fission and alpha decay» (PDF). EPJ Web of Conferences. 131: 03002-1–03002-8. Bibcode:2016EPJWC.13103002M. doi:10.1051/epjconf/201613103002. Archived (PDF) from the original on 11 March 2020. Retrieved 24 March 2020.
- ^ Koppes, Steve (1 March 1999). «Fermilab Physicists Find New Matter-Antimatter Asymmetry». University of Chicago. Archived from the original on 19 July 2008.
- ^ Cromie, William J. (16 August 2001). «A lifetime of trillionths of a second: Scientists explore antimatter». Harvard University Gazette. Archived from the original on 3 September 2006.
- ^ Hijmans, Tom W. (2002). «Particle physics: Cold antihydrogen». Nature. 419 (6906): 439–440. Bibcode:2002Natur.419..439H. doi:10.1038/419439a. PMID 12368837.
- ^ Staff (30 October 2002). «Researchers ‘look inside’ antimatter». BBC News. Archived from the original on 22 February 2007.
- ^ Barrett, Roger (1990). «The Strange World of the Exotic Atom». New Scientist (1728): 77–115. Archived from the original on 21 December 2007.
- ^ Indelicato, Paul (2004). «Exotic Atoms». Physica Scripta. T112 (1): 20–26. arXiv:physics/0409058. Bibcode:2004PhST..112…20I. doi:10.1238/Physica.Topical.112a00020. S2CID 11134265. Archived from the original on 4 November 2018.
- ^ Ripin, Barrett H. (July 1998). «Recent Experiments on Exotic Atoms». American Physical Society. Archived from the original on 23 July 2012.
Bibliography
- Oliver Manuel (2001). Origin of Elements in the Solar System: Implications of Post-1957 Observations. Springer. ISBN 978-0-306-46562-8. OCLC 228374906.
- Andrew G. van Melsen (2004) [1952]. From Atomos to Atom: The History of the Concept Atom. Translated by Henry J. Koren. Dover Publications. ISBN 0-486-49584-1.
- J.P. Millington (1906). John Dalton. J. M. Dent & Co. (London); E. P. Dutton & Co. (New York).
- Charles H. Holbrow; James N. Lloyd; Joseph C. Amato; Enrique Galvez; M. Elizabeth Parks (2010). Modern Introductory Physics. Springer Science & Business Media. ISBN 978-0-387-79079-4.
- John Dalton (1808). A New System of Chemical Philosophy vol. 1.
- John Dalton (1817). A New System of Chemical Philosophy vol. 2.
- John L. Heilbron (2003). Ernest Rutherford and the Explosion of Atoms. Oxford University Press. ISBN 0-19-512378-6.
- Jaume Navarro (2012). A History of the Electron: J. J. and G. P. Thomson. Cambridge University Press. ISBN 978-1-107-00522-8.
Further reading
- Gangopadhyaya, Mrinalkanti (1981). Indian Atomism: History and Sources. Atlantic Highlands, New Jersey: Humanities Press. ISBN 978-0-391-02177-8. OCLC 10916778.
- Iannone, A. Pablo (2001). Dictionary of World Philosophy. Routledge. ISBN 978-0-415-17995-9. OCLC 44541769.
- King, Richard (1999). Indian philosophy: an introduction to Hindu and Buddhist thought. Edinburgh University Press. ISBN 978-0-7486-0954-3.
- McEvilley, Thomas (2002). The shape of ancient thought: comparative studies in Greek and Indian philosophies. Allworth Press. ISBN 978-1-58115-203-6.
- Siegfried, Robert (2002). From Elements to Atoms: A History of Chemical Composition. DIANE. ISBN 978-0-87169-924-4. OCLC 186607849.
- Teresi, Dick (2003). Lost Discoveries: The Ancient Roots of Modern Science. Simon & Schuster. pp. 213–214. ISBN 978-0-7432-4379-7. Archived from the original on 4 August 2020. Retrieved 25 October 2020.
- Wurtz, Charles Adolphe (1881). The Atomic Theory. New York: D. Appleton and company. ISBN 978-0-559-43636-9.
External links
- Sharp, Tim (8 August 2017). «What is an Atom?». Live Science.
- «Hitchhikers Guide to the Universe, Atoms and Atomic Structure». h2g2. BBC. 3 January 2006.
В уроке 1 «Атомы и химические элементы» из курса «Химия для чайников» рассмотрим, кто и когда высказал идею о том, что все вокруг состоит из атомов; также выясним, что из себя представляет химический элемент и каким образом обозначается.
Все, что нас окружает, мы сами, Земля, на которой мы живем, состоит из самых разнообразных веществ. А из чего состоят сами вещества? Ведь их можно дробить на более мелкие части, а те, в свою очередь, на еще более мелкие. Где предел такого деления? Что представляют собой частицы, которые дальше уже нельзя раздробить обычными способами? Над этими вопросами задумывались ученые еще в глубокой древности.
Атомное строение веществ
Первые представления об атомах как мельчайших, далее неделимых частицах веществ появились у философов Древней Греции еще за 400 лет до н. э. Они считали, что каждое вещество составлено из присущих только ему атомов, т. е. существуют атомы, например, мяса, песка, дерева, воды и т. д. Другими словами, сколько есть веществ, столько и видов атомов.
Доказательств существования атомов в то время, конечно, не было, и это учение было забыто почти на две тысячи лет. И только в самом начале XIX в. идея атомного строения веществ была возрождена английским ученым Дж. Дальтоном.
Согласно его теории все вещества состоят из очень маленьких частиц — атомов. В процессе химических превращений атомы не разрушаются и не возникают вновь, а только переходят из одних веществ в другие. Они являются как бы деталями конструктора, из которых можно собирать всевозможные изделия.
Атомы — мельчайшие, химически неделимые частицы.
Химические элементы
Общее число атомов во Вселенной невообразимо велико. Однако видов атомов сравнительно немного. Каждый такой определенный вид атомов называется химическим элементом.
Химический элемент — определенный вид атомов.
Позже, после изучения строения атома, вы узнаете более точное определение этого понятия.
Всего в настоящее время известно 118 химических элементов. Атомы одного и того же элемента имеют одинаковые размеры, практически одинаковое строение и массу. Атомы разных элементов различаются между собой, прежде всего, строением, размерами, массой и целым рядом других характеристик.
На заметку: Из 118 химических элементов в природе встречается только 92, а остальные 26 получены искусственно с помощью специальных физических методов.
Из атомов такого небольшого числа химических элементов построены все вещества, существующие в природе и полученные химиками в лабораториях. А это более 60 млн веществ. Все они представляют собой самые различные сочетания атомов тех или иных элементов. Так же, как из 33 букв алфавита составлены все слова русского языка, из атомов относительно небольшого числа элементов состоят все известные вещества.
Символы химических элементов
Каждый элемент имеет свое название и условное обозначение — химический символ (знак).
Химический символ (знак) — условное обозначение химического элемента с помощью букв его латинского названия.
Символы химических элементов состоят из одной или двух букв их латинских названий. Понятно, что вторая буква нужна, чтобы различать элементы, в названиях которых первая буква одинакова. Например, элемент углерод обозначается первой буквой С его латинского названия — Carboneum (карбонеум), а элемент медь — двумя первыми буквами Cu его латинского названия — Cuprum (купрум).
Современные символы и названия наиболее распространенных элементов, необходимые вам на начальном этапе изучения химии, приведены в таблице под спойлером.
Спойлер
| Название химического элемента | Химический знак элемента | Относительная атомная масса (округленная) |
| Азот | N | 14 |
| Алюминий | Al | 27 |
| Водород | H | 1 |
| Железо | Fe | 56 |
| Золото | Au | 197 |
| Калий | K | 39 |
| Кальций | Ca | 40 |
| Кислород | O | 16 |
| Кремний | Si | 28 |
| Магний | Mg | 24 |
| Медь | Cu | 64 |
| Натрий | Na | 23 |
| Ртуть | Hg | 201 |
| Свинец | Pb | 207 |
| Сера | S | 32 |
| Серебро | Ag | 108 |
| Углерод | C | 12 |
| Фосфор | P | 31 |
| Хлор | Cl | 35,5 |
| Цинк | Zn | 65 |
[свернуть]
Если вы хотите познакомиться с названиями и символами всех химических элементов, загляните сюда. Там представлена периодическая система элементов, о которой вы узнаете позже.
Распространенность химических элементов в природе крайне неравномерна. Самый распространенный элемент в земной коре (слое толщиной 16 км) — кислород О. Его содержание составляет 49,13 % от общего числа атомов всех элементов. Доли остальных элементов показаны на рис. 28.
В организме человека на долю атомов кислорода приходится 65 % от массы тела, в то время как доля атомов углерода — 18 %, водорода — 10 %, азота — 3 % (см. рис. 29).
Во всей нашей Галактике почти 92 % от общего числа всех атомов приходится на долю водорода Н, 7,9 % — на долю гелия He и только 0,10 % — на атомы всех остальных элементов. Именно эти два самых легких элемента составляют основу звездной материи.
Краткие выводы урока:
- Атомы — мельчайшие, химически неделимые частицы.
- При химических реакциях атомы не исчезают и не возникают из ничего, а только переходят из одних веществ в другие.
- Каждый отдельный вид атомов называется химическим элементом. Он имеет свое название и обозначение — химический символ (знак).
- Атомы разных химических элементов различаются массой, размерами и строением.
Надеюсь урок 1 «Атомы и химические элементы» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Содержание:
Строение атома:
Атом — наименьшая составная часть простых и сложных веществ. Говоря об атомах, мы подчёркивали, что это химически неделимые частицы, не исчезающие и не возникающие при химических реакциях.
В течение многих веков атом считался элементарной, т. е. далее неделимой частицей. И только открытия, сделанные физиками в XIX веке, дали весомые доказательства сложности строения атома. К этим открытиям относятся прежде всего: а) изучение электролиза, т. е. процесса разложения веществ электрическим током; б) открытие катодных лучей — потока отрицательно заряженных частиц, которые впоследствии получили название электроны; и, наконец, в) обнаружение явления радиоактивности, которое представляет собой самопроизвольный распад атомов одних элементов с образованием атомов других элементов.
Ядерная модель строения атома
В начале XX века на основе исследований многих учёных и прежде всего английского физика Э. Резерфорда была установлена принципиальная модель строения атома, получившая название ядерная (планетарная). Согласно этой модели атом состоит из положительно заряженного ядра и движущихся вокруг него отрицательно заряженных электронов. Почти вся масса атома (более 99,96 %) сосредоточена в его ядре. Диаметр ядра приблизительно в 100 000 раз меньше диаметра всего атома (порядка
Состав атомных ядер
Согласно современным представлениям ядра атомов состоят из двух видов частиц: протонов и нейтронов, имеющих общее название нуклоны (от лат. nucleus — ядро).
Протоны и нейтроны имеют практически одинаковую массу, равную примерно lu, т. е. одной атомной единице массы (см. § 4). Протон (его символ р) имеет заряд 1+, а нейтрон (символ n) электронейтрален.
Заряд электрона (символическое обозначение
В таблице 4 приведены основные характеристики элементарных частиц, входящих в состав атома.
Протоны и нейтроны удерживаются в ядре особыми силами, которые так и называются ядерные силы. Ядерные силы действуют только на очень малых расстояниях (порядка 10-13 см), но их величина в сотни и тысячи раз превышает силу отталкивания одноимённо заряженных протонов. Энергия связи нуклонов в ядрах атомов в миллион раз превышает энергию химической связи. Поэтому при химических реакциях ядра атомов не разрушаются, а происходит лишь перегруппировка атомов.
Число протонов (Z) в ядре атома носит название протонное число. Оно равно атомному номеру элемента и определяет его место в периодической системе. В этом заключается физический смысл атомного номера. Атомный номер определяет место элемента в периодической системе и поэтому его часто называют порядковым номером.
Заряд ядра определяется числом протонов, и поскольку атом в целом электроцентралей, то очевидно, что число протонов в его ядре равно числу электронов.
Общее число протонов (Z) и нейтронов (N) называется массовым (или нуклонным) числом (A):
A=Z + N.
Массовое число практически определяет массу атома в атомных единицах, так как масса электронов составляет ничтожную часть общей массы атома.
Заряд ядра атома (протонное число) и его массовое число указывают числовыми индексами слева от символа химического элемента 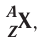
Вид атомов с определёнными значениями атомного номера и массового числа называется нуклидом.
Для обозначения нуклидов используют названия элементов или их символы, указывая массовые (нуклонные) числа: углерод-12, или 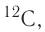
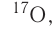
Изотопы
Большинство элементов существуют в виде нескольких нуклидов, которые отличаются друг от друга своими массовыми числами. Это объясняется тем, что в их ядрах при одном и том же числе протонов может находиться разное число нейтронов. Так, природный кислород (Z = 18), кроме атомов, в ядрах которых находится 8 нейтронов 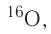
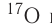
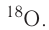
Изотопы — нуклиды, имеющие одинаковый атомный номер, но различные массовые числа.
Другими словами, изотопы — это нуклиды одного и того же элемента. Поэтому термин «изотопы» следует употреблять только во множественном числе. Изотопы любого элемента действительно занимают одно место в периодической системе, так как принадлежат одному и тому же элементу. Следовательно, и химические свойства изотопов данного элемента также будут практически одинаковы.
Теперь мы можем дать более точное определение химического элемента.
Химический элемент — это совокупность всех нуклидов, имеющих одинаковый атомный номер (т. е. одинаковый заряд ядра).
Названия и символы изотопов совпадают с названиями и символами соответствующих элементов.
Только изотопы водорода имеют собственные названия и символы: протий —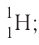
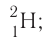
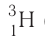
Так как большинство химических элементов в природе существует в виде смеси нуклидов, то относительная атомная масса данного элемента является средней величиной массовых чисел нуклидов с учётом доли каждого из них в природной смеси. Это объясняет тот факт, что относительные атомные массы большинства элементов не являются целочисленными величинами.
Например, углерод существует в природе в виде двух нуклидов —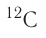
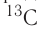
Явление радиоактивности
Все нуклиды делятся на два типа: стабильные и радиоактивные (радионуклиды). Стабильные нуклиды могут существовать без изменения состава ядер неограниченно долго. Поэтому большинство природных нуклидов, входящих в состав окружающих нас веществ, стабильны.
Устойчивому состоянию ядер атомов соответствуют определённые соотношения чисел протонов и нейтронов: для лёгких элементов (с атомными номерами от 1 до 20) — 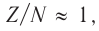
Радиоактивностью называется самопроизвольное превращение неустойчивых атомных ядер в другие ядра, сопровождающееся испусканием различных частиц.
Основными типами радиоактивных превращений являются (рис. 7):
1) а-распад:
а-частицы представляют собой ядра атомов нуклида 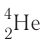
2) 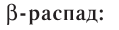
В данном случае 
Радиоактивный распад часто сопровождается испусканием 
Устойчивость радионуклида характеризуется периодом полураспада 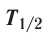
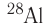
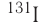
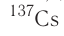
После открытия явления радиоактивности стало возможным искусственное превращение одних химических элементов в другие, синтез ядер элементов, которые не существуют на Земле. Так были получены элементы, находящиеся в периодической системе после урана U. Конечно, такие процессы, хотя и называются ядерными реакциями, не являются химическими реакциями, при которых атомы не исчезают и не возникают вновь.
Изучение радиоактивности привело к созданию ядерной энергетики и, к сожалению, ядерного оружия. Явление радиоактивности широко применяется в науке, медицине, промышленности и сельском хозяйстве. Вместе с тем перед человечеством возникли проблемы, связанные с вредным воздействием радиации на живые организмы. Поэтому использование ядерных процессов и радиоактивных веществ должно осуществляться в строго контролируемых условиях, с соблюдением строжайших мер безопасности.
Атом является электронейтральной микросистемой, состоящей из положительно заряженного ядра и отрицательно заряженных электронов.
Атомный номер химического элемента равен относительному заряду ядра его атома, числу протонов в ядре и числу электронов в атоме. Вид атомов с определёнными значениями атомного номера и массового числа называется нуклидом. Радиоактивность — самопроизвольное превращение неустойчивых атомных ядер в другие ядра, сопровождающееся испусканием различных частиц.
Состояние электрона в атоме
Химические свойства атомов проявляются только при химических реакциях. Так как состав ядер атомов при этом не меняется, то очевидно, что все изменения, происходящие с данным атомом в процессе химического превращения, являются результатом изменения его электронного состояния.
Большинство свойств атома определяется его электронным строением. Как оно влияет на конкретные свойства атома, на свойства веществ, в составе которых атом находится, можно понять, только правильно представляя состояние электрона в атоме.
Электронное облако
Основой современной теории строения атома являются законы и положения квантовой волновой механики — раздела физики, изучающего движение микрообъектов (электронов, протонов, нейтронов и других частиц).
Согласно квантово-механическим представлениям движущемуся электрону присуща двойственная природа. Он является частицей (имеет определённую массу, заряд), но его движение вблизи ядра имеет волновой характер (отсутствует определённая траектория движения, точное местоположение в пространстве и др.). Следовательно, микрообъекты, в том числе и электрон, обладают одновременно корпускулярными и волновыми свойствами.
Поскольку у движущегося электрона в атоме отсутствует траектория, то для описания такого движения используется вероятностный подход. Математически определяется не точное положение электрона в атоме, а вероятность его нахождения в той или иной области около ядерного пространства.
Состояние (в квантовой механике синоним слова движение) электрона в атоме описывается с помощью квантово-механической модели — электронного облака (рис. 8). Электрон движется возле ядра с огромной скоростью, при которой его отрицательный заряд как бы «размазывается» в пространстве. Получается, что ядро окружено трёхмерным электронным облаком. Плотность такого электронного облака оказывается различной в разных местах. В тех местах, где чаще находится электрон, образуется зона большей электронной плотности.
Поскольку существует вероятность нахождения электрона даже на относительно большом расстоянии от ядра, электронное облако не имеет определённых границ. Поэтому обычно его ограничивают условной поверхностью, которая охватывает примерно 90 % электронного облака. Такую область околоядерного пространства называют атомной электронной орбиталью или просто орбиталью.
Орбиталь — область околоядерного пространства, в которой наиболее вероятно нахождение данного электрона.
Орбитали, в зависимости от энергии электронов, имеют различные формы и размеры. Так, орбиталь единственного электрона атома водорода имеет сферическую (шарообразную) форму. Такие орбитали, имеющие шарообразную форму, обозначаются буквой s, а электроны, которые занимают эти орбитали, называются s-электронами (рис. 9).
Чем выше энергия электрона в атоме, тем слабее он притягивается к ядру, тем больше по размеру его орбиталь (электронное облако). Электронная плотность с увеличением размера орбитали уменьшается.
Орбитали в многоэлектронных атомах могут иметь и другие формы, например форму гантели («объёмной восьмёрки») (рис. 10). Такие орбитали обозначают буквой р, а электроны, которым они соответствуют, называют р-электронами.
Три р-орбитали располагаются (ориентируются) в околоядерном пространстве взаимно перпендикулярно вдоль каждой из трёх осей системы координат (рис. 11).
Более сложную форму имеют орбитали d-типа и f-типа.
Графически орбиталь изображают в виде клеточки (квантовой ячейки), а электрон — в виде стрелки. Так, орбиталь атома водорода с его единственным электроном можно изобразить следующим образом:
Кроме движения вокруг ядра, каждый электрон характеризуется собственным моментом движения, который называется спином. Упрощённо спин (от англ, spin — вращение) можно представить как вращение электрона вокруг собственной оси. Спиновое вращение электрона возможно только по часовой или против часовой стрелки. На одной орбитали может находиться не более двух электронов, имеющих противоположные (антипараллельные) спины. В этом случае два электрона называются спаренными:
Такое их состояние в атоме энергетически выгодно, в отличие от состояния с одинаковыми спинами:
Если на орбитали находится один электрон, то он является неспаренным.
Энергетические уровни
Электроны в атоме различаются своей энергией. Чем выше энергия электрона в атоме, тем дальше он находится от ядра, следовательно, тем больше размер электронного облака (орбитали). И наоборот, электроны, обладающие относительно небольшой энергией, находятся большую часть времени вблизи ядра, заслоняя (экранируя) его от других электронов, которые притягиваются к ядру слабее и находятся на большем удалении от него. Так образуются как бы оболочки из электронов с близкими значениями энергии. Можно сказать, что электроны с близкими значениями энергии составляют в атоме единый электронный слой, или энергетический уровень.
Энергетический уровень (электронный слой, электронная оболочка) — это совокупность электронов с близкими значениями энергий.
Число энергетических уровней в атоме, на которых находятся электроны, равно номеру периода, в котором располагается химический элемент в периодической системе. Каждый энергетический уровень обозначается своим номером: n = 1, 2, 3, 4, … , 
Число орбиталей 
На рисунке 12 приведена схема энергетических уровней и их электронной ёмкости.
Энергетические подуровни
Электроны одного и того же энергетического уровня могут немного различаться значениями энергии. Они образуют в пределах данного уровня энергетические подуровни. Следовательно, энергетический уровень представляет собой совокупность энергетических подуровней, несколько различающихся по энергиям. Они обозначаются буквами s, р, d, f … . Число подуровней, из которых состоит данный энергетический уровень, равно его номеру.
Первый энергетический уровень (n = 1) состоит из одного подуровня (s), второй (n = 2) — из двух
(s, р), третий (п = 3) — из трёх (s, р, d) и т. д. Каждый подуровень, в свою очередь, состоит из определённого числа атомных орбиталей. Так, s-подуровень состоит из одной орбитали, р-подуровень — из трёх, d-подуровень — из пяти орбиталей (рис. 13).
Из приведённой схемы видно, что s-подуровень каждого энергетического уровня обладает наименьшим запасом энергии:
Для того чтобы различать энергетические подуровни и орбитали разных энергетических уровней, их обозначают двумя знаками: 1s, 2р, 3s, 3d. Цифра соответствует номеру энергетического уровня, а буква — типу энергетического подуровня.
Обобщим сведения об электронном состоянии атомов элементов первых четырёх периодов в виде таблицы 5.
Движущемуся электрону в атоме присуща двойственная природа: он является частицей, имеющей волновой характер движения.
Электронное облако — это квантово-механическая модель движения электрона вокруг ядра.
Атомная орбиталь — область околоядерного пространства, в которой наиболее вероятно нахождение данного электрона.
На одной орбитали может находиться не более двух электронов, имеющих противоположные (антипараллельные) спины.
Совокупность электронов с близкими значениями энергий называется энергетическим уровнем (или, что то же самое, электронным слоем, электронной оболочкой).
Электронные конфигурации атомов
Общее число электронов в атоме определяется зарядом его ядра, т. е. протонным числом. Оно равно атомному номеру элемента. Электроны в зависимости от их энергии распределяются в атоме по энергетическим уровням и подуровням, каждый из которых состоит из определённого числа орбиталей.
Распределение электронов выражается с помощью электронных конфигураций атома. Например, у водорода, элемента с атомным номером 1, электронная конфигурация — 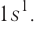
Схематически электронное строение атома изображается с помощью электронно-графической схемы, в которой орбитали представляются в виде клеточек, а электроны — в виде стрелок. Электронно-графическая схема атома водорода изображается так:
При составлении формул электронных конфигураций атомов необходимо соблюдать следующие правила. 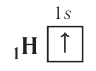
Поэтому орбитали в атомах элементов первых трёх периодов заполняются электронами в порядке увеличения их энергии:
Правило:
На каждой орбитали максимально может находиться не более двух электронов, причём с противоположными спинами.
Таким образом, у следующего за водородом гелия 
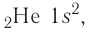
Поскольку на первом электронном слое могут находиться только два электрона, то этот слой в атоме гелия является завершённым и, следовательно, очень устойчивым.
У атомов элементов второго периода заполняется второй энергетический уровень, на котором может находиться не более 8 электронов. Сначала электроны заполняют 2s-орбиталь (у атомов лития и бериллия):
Поскольку 2.s-орбиталь заполнена, то пятый электрон у атома бора В занимает одну из трёх 2р-орбиталей. Электронная конфигурация атома бора —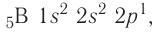
Обратите внимание, что подуровень 2р изображён вплотную к подуровню 2s, но несколько выше. Так подчёркивается его принадлежность к одному и тому же уровню (второму) и одновременно больший запас энергии.
Правило:
Оно устанавливает порядок заполнения орбиталей одного подуровня. Электроны сначала заполняют все пустые орбитали одного подуровня по одному, а если число электронов больше, чем число орбиталей, то по два.
Следовательно, электронные конфигурации атомов углерода и азота:
а их электронно-графические схемы:
Электронная конфигурация внешнего слоя 2.S2 2р6 соответствует его полному заполнению и поэтому является весьма устойчивой.
У атомов кислорода, фтора и неона число электронов увеличивается, и они вынуждены размещаться на р-орбиталях второго энергетического уровня по два:
Электронно-графические схемы атомов этих элементов:
Электронная конфигурация внешнего слоя 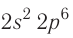
В атомах элементов третьего периода начинает формироваться третий электронный слой. Сначала заполняется электронами s-подуровень у натрия и магния:
а затем /7-подуровень у алюминия, кремния, хлора и аргона:
Электронно-графическая схема атома аргона:
В атоме аргона на внешнем электронном слое находится 8 электронов. Следовательно, он завершён, так как в атоме любого элемента на внешнем энергетическом уровне максимально может находиться не более 8 электронов.
Застраивание третьего электронного слоя этим не исчерпывается. В соответствии с формулой 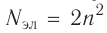
Только после этого начнёт заполняться электронами d-подуровень третьего, теперь уже предвнешнего, энергетического уровня.
Кроме электронных конфигураций и электронно-графических схем иногда используют и электронные схемы атомов, в которых указывают только число электронов на каждом энергетическом уровне (электронном слое):
С такими схемами вы познакомились ещё в 8-м классе.
Электронное строение атома определяется зарядом его ядра, который равен атомному номеру элемента в периодической системе.
Распределение электронов по энергетическим уровням, подуровням и орбиталям отображают с помощью электронных конфигураций и электронно-графических схем, а также электронных схем атомов.
На внешнем электронном слое в атоме любого элемента может находиться не более 8 электронов.
Периодический закон и периодическая система химических элементов
Вот уже четвёртый год вы изучаете химию и всё это время пользуетесь таблицей химических элементов, которая представляет собой графическое изображение периодической системы элементов. Периодическая система, в свою очередь, является выражением периодического закона, открытого русским химиком
Д. И. Менделеевым в 1869 году. С тех пор периодический закон — основа современной химии. Физический смысл периодического закона стал понятен только после создания теории строения атома. Но сама эта теория развивалась и развивается на основе периодического закона и периодической системы.
Согласно этой теории главной характеристикой атома является положительный заряд ядра. Заряд ядра определяет число электронов в атоме, его электронное строение и, следовательно, все свойства атомов данного элемента и его положение в периодической системе. Поэтому современная формулировка периодического закона такова:
Свойства атомов химических элементов, а также состав и свойства образуемых ими веществ, находятся в периодической зависимости от зарядов атомных ядер.
Структура периодической системы
Со структурой периодической системы в общих чертах вы уже знакомы. Все химические элементы в ней располагаются в порядке возрастания атомного номера, который поэтому имеет ещё одно название — порядковый номер. Численная величина атомного номера равна положительному заряду ядра атома соответствующего элемента.
В таблице семь горизонтальных рядов элементов, которые называются периодами, а также восемнадцать вертикальных столбцов — групп. Таким образом, каждый химический элемент имеет свой атомный (порядковый) номер, находится в определённом периоде и определённой группе.
Известно около 700 форм графического изображения периодической системы. Но принципиальный подход к построению таблиц единый — элементы располагаются в порядке возрастания зарядов ядер их атомов. По мере увеличения атомного номера происходит постепенная застройка электронной структуры атомов элементов в соответствии с принципами заполнения. Таким образом, структура периодической системы связана с электронной структурой элементов.
В зависимости от того, какой энергетический подуровень заполняется электронами последним, различают четыре типа (семейства) элементов:
- s-элементы — последним заполняется s-подуровень внешнего энергетического уровня;
- р-элементы — последним заполняется p-подуровень внешнего энергетического уровня;
- d-элементы — последним заполняется d-подуровень предвнешнего энергетического уровня;
- f-элементы — последним заполняется f-подуровень третьего снаружи уровня.
Периоды
Периодом в периодической системе называется последовательный ряд элементов, в атомах которых электронная конфигурация внешнего энергетического уровня изменяется от 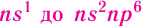
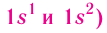
Таблица 6. Последовательность заполнения энергетических подуровней у элементов различных периодов
При этом номер периода совпадает с номером п внешнего энергетического уровня.
Другими словами, номер периода указывает на число энергетических уровней, на которых находятся электроны в атомах данного элемента. В этом заключается физический смысл номера периода.
Каждый из периодов (исключая первый) начинается типичным металлом (металл щелочной группы) и заканчивается благородным газом, которому предшествует неметалл, т. е. в периоде с увеличением заряда ядра атомов наблюдается постепенное изменение свойств от металлических к типично неметаллическим, что связывается с увеличением числа электронов на внешнем энергетическом уровне.
Первые три периода содержат только s- и p-элементы. Четвёртый, пятый и последующие периоды включают в свой состав также элементы, у атомов которых происходит заполнение d-подуровня предвнешнего энергетического уровня. У элементов шестого и седьмого периодов, помимо S-, р- и d-подуровней заполняются и f-подуровни третьего снаружи электронного слоя. f-Элементы
объединяются в семейства, называемые лантанидами (4f-элементы) и актинидами (5f-элементы), которые вынесены за пределы таблицы (см. форзац 1).
Группы
В вертикальных колонках, называемых группами, объединены элементы, атомы которых имеют сходное электронное строение. Всего в таблице 18 групп, пронумерованных арабскими цифрами. Кроме того, группы имеют традиционную нумерацию римскими цифрами от I до VIII с добавлением букв А или В. У атомов элементов групп А последними заполняются s- и р-подуровни внешних энергетических уровней (табл. 7). Элементы, у которых последними заполняются d-подуровни второго снаружи или f-подуровни третьего снаружи энергетического уровня, составляют группы В.
Таблица 7. Электронная конфигурация внешнего энергетического уровня у атомов элементов групп А (1—4-й периоды)
Атомы элементов групп А и В различаются своими химическими свойствами, однако им присуще и общее, что объединяет их в группы с одинаковыми римскими номерами (I, II и т. д.).
Номер группы (римскими цифрами), как правило, указывает число электронов в атоме, которые могут участвовать в образовании химических связей. В этом состоит физический смысл номера группы.
Электроны, которые принимают участие в образовании химических связей, называются валентными. У элементов групп А валентными являются электроны внешнего энергетического уровня, а у элементов групп В — ещё и электроны предпоследних уровней. Это основное различие между элементами групп А и В.
Сейчас мы можем дать более точное определение понятия группа.
Группа — вертикальный столбец элементов с одинаковым числом валентных электронов в атомах.
Таким образом, строгая периодичность расположения химических элементов в периодической системе полностью объясняется последовательным характером заполнения энергетических уровней и подуровней их атомов.
Главной характеристикой атома является положительный заряд ядра, который численно равен атомному номеру элемента. Каждый химический элемент имеет свой атомный (порядковый) номер, находится в определённом периоде и определённой группе. Горизонтальный ряд элементов, расположенных в порядке возрастания их атомных номеров, начинающийся щелочным металлом и заканчивающийся благородным газом, называется периодом. Вертикальный столбец элементов, атомы которых имеют одинаковое строение внешних электронных слоев, называется группой.
Периодичность изменения свойств атомов химических элементов и их соединений
Поскольку электронная конфигурация атомов химических элементов изменяется периодически с ростом заряда их ядер, все их свойства, определяемые электронным строением, закономерно изменяются по периодам и группам периодической системы. К таким свойствам относятся прежде всего различные характеристики атомов: атомные и ионные радиусы, электроотрицательность, степень окисления и др. Периодически изменяются также многие химические и физические свойства простых и сложных веществ, образованных элементами-аналогами.
Атомные и ионные радиусы
С точки зрения квантовой механики атом не имеет строго определённых границ, так как орбитали, на которых расположены его электроны, также не имеют точных размеров. О размерах атомов и ионов судят по экспериментальным данным о расстояниях между соседними атомами в молекулах или кристаллах. Условно форму атома или иона считают шарообразной, поэтому количественной характеристикой их размера служит радиус.
Различают атомные радиусы и ионные радиусы. При этом радиусы положительных ионов (катионов) всегда меньше радиусов атомов соответствующих элементов, так как они образованы в результате отдачи электронов. Радиусы отрицательных ионов (анионов) больше радиусов атомов, поскольку они образовались путём присоединения дополнительных электронов. Например, радиус атома натрия Na — 189 пм, а иона натрия 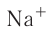
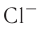
Как изменяются радиусы атомов в группе и в периоде с ростом атомного номера элементов? У элементов, находящихся в одной группе, при переходе сверху вниз от одного элемента к другому увеличивается число электронных слоёв и, следовательно, увеличивается радиус как атомов, так и ионов. Например, в группе щелочных металлов радиусы атомов: Li — 155 пм, Na — 189 пм, К — 236 пм, а ионов: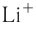
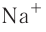
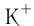
В периодах периодической системы по мере увеличения заряда ядра атомов увеличивается притяжение к нему электронов, находящихся на одном и том же электронном слое, что приводит к уменьшению радиуса атомов. Например, у элементов третьего периода атомные радиусы уменьшаются от натрия до хлора — от 189 пм до 99 пм.
Электроотрицательность
Проявление металлических или неметаллических свойств у атомов данного элемента связано прежде всего с их способностью терять или приобретать электроны. Отдача или присоединение электронов атомами обычно происходит в процессе их химического взаимодействия. Характеристикой атома, учитывающей его способность смещать к себе валентные электроны, является электроотрицательность. Она обозначается буквой греческого алфавита X (хи).
Электроотрицательность атома — условная величина, характеризующая его способность в химических соединениях смещать к себе электроны от других атомов.
Для практической оценки этой способности атомов введена условная относительная шкала электроотрицательностей. По этой шкале наиболее электроотрицательным среди элементов, способных образовывать химические соединения, является фтор F (X = 4,1), а наименее электроотрицательным — франций Fr (X = 0,86).
У элементов групп А в периодах с ростом атомного номера элементов электроотрицательность возрастает, а в группах, как правило, убывает.
По величине электроотрицательности можно определить принадлежность элемента к металлам или неметаллам. Все неметаллы обычно имеют значение электроотрицательности больше двух.
Они располагаются в правой верхней части периодической таблицы.
У металлов значение электроотрицательности меньше двух. Несколько элементов (В, Si, Ge, As,Те) со значением электроотрицательности, близким к 2, располагаются вдоль диагонали от бора В к астату At. Атомы этих элементов проявляют промежуточные свойства, поэтому их часто называют полуметаллами (рис. 14).
Периодичность изменения свойств соединений
Периодический характер изменения строения, физических и химических свойств присущ также простым и сложным веществам. Рассмотрим в качестве примера закономерности изменения некоторых свойств атомов и соединений элементов 3-го периода (табл. 8).
Таблица 8. Изменение свойств атомов элементов 3-го периода и их соединений
Как следует из таблицы, в периоде при переходе слева направо от одного элемента к другому происходит увеличение высшей степени окисления и понижение (по абсолютной величине) низшей степени окисления. Периоды начинаются щелочными металлами, которые образуют растворимые в воде основные оксиды и гидроксиды. При переходе от одного элемента к другому наблюдается ослабление основных и усиление кислотных свойств высших оксидов и гидроксидов.
Элементы, расположенные в одной группе, имеют одинаковое строение внешних электронных оболочек атомов и поэтому их атомы проявляют сходные химические свойства.
Такой характер изменения свойств в основном повторяется во всех периодах (кроме первого), следовательно, такое изменение свойств называется периодическим.
Таким образом, при последовательном увеличении зарядов атомных ядер периодически повторяется конфигурация внешних электронных оболочек и, как следствие, периодически повторяются химические свойства атомов элементов и их соединений. В этом заключается физический смысл периодического закона.
Атомные и ионные радиусы атомов элементов с ростом атомного номера уменьшаются в периодах слева направо и увеличиваются в группах сверху вниз. С увеличением атомного номера в пределах каждого периода электроотрицательность возрастает, а в группе — уменьшается, т. е. металлические свойства атомов элементов в периоде ослабевают, а в группе — усиливаются. Периодическое изменение свойств атомов химических элементов при увеличении положительного заряда ядер объясняется тем, что периодически повторяется строение внешних электронных слоёв атомов.
Характеристика химического элемента по его положению в периодической системе и строению атома
Периодический закон и отражающая его периодическая система элементов представляют собой как бы краткое обобщение химии элементов и их соединений. Таблица периодической системы содержит сведения, позволяющие описать строение атомов химических элементов, предсказать состав, строение и свойства образованных ими простых веществ и наиболее характерных соединений: оксидов, соответствующих им гидроксидов, солей, летучих водородных соединений и т. д. Именно поэтому таблица периодической системы является непременной составляющей любого учебного и справочного пособия по химии.
В описании любого элемента особую роль играет его атомный номер Z, с которым связано положение элемента в периодической системе. Атомный номер даёт возможность знать не только порядковый номер элемента в периодической системе, но и его место в периоде и группе, а также электронное строение его атомов.
Описание любого химического элемента необходимо проводить по определённому алгоритму, т. е. соблюдая строгую последовательность действий. В этой последовательности главными этапами являются следующие:
- а) общие сведения об элементе;
- б) определение положения элемента в периодической системе;
- в) характеристика состава атомов элемента;
- г) описание электронного строения атомов;
- д) состав и свойства простого вещества;
- е) состав и свойства кислородных и водородных соединений.
Составим более детальный алгоритм такого описания химического элемента.
1. Общие сведения об элементе:
- а) название химического элемента;
- б) его химический знак;
- в) относительная атомная масса.
2. Положение химического элемента в периодической системе:
- а) атомный номер;
- б) номер периода;
- в) номер группы и её тип: А или В.
3. Состав атома:
- а) заряд ядра атома;
- б) число протонов, электронов и нейтронов (для определённого нуклида).
4. Электронное строение атомов элемента:
- а) электронная схема атома;
- б) электронная конфигурация атома;
- в) электронно-графическая схема атома;
- г) электронная конфигурация внешнего энергетического уровня;
- д) электронный тип элемента (s-, р-d.-f-)
5. Состав и свойства простого вещества:
- а) металл — неметалл;
- б) формула простого вещества;
- в) агрегатное состояние при обычных условиях.
6. Степени окисления элемента в высших оксидах и летучих водородных соединениях. Электроотрицательность.
7. Формулы оксидов и соответствующих им гидроксидов. Характеристика кислотно-основных свойств этих соединений.
8. Формула летучего водородного соединения.
Охарактеризуем, согласно приведённому алгоритму, два химических элемента — натрий и фосфор.
Натрий
1. Название химического элемента — натрий, химический знак — Na, относительная атомная масса — 23.
2. Натрий — элемент с атомным номером 11, находится в 3-м периоде, в группе IA.
3. Заряд ядра атома натрия 11+, следовательно, в ядре находится 11 протонов, общее число электронов также 11. В ядре нуклида натрия 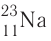
Кратко состав этого атома выражается так:
4. Электронная схема атома натрия:
Электронная конфигурация:
Электронно-графическая схема:
Электронная конфигурация внешнего энергетического уровня: 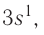
5. Так как на внешнем энергетическом уровне у натрия находится 1 электрон, то этот элемент относится к группе металлов. Простое вещество при обычных условиях — твёрдый металл. Формула простого вещества — Na.
6. Степень окисления в высшем оксиде +1. Летучих водородных соединений не образует. Электроотрицательность натрия 
7. Формула высшего оксида — 
8. Летучего водородного соединения не образует.
Следующий элемент — фосфор — проанализируем по тому же алгоритму, но более сжато.
Фосфор
1. Фосфор
2. Z = 15. Положение в периодической системе: 
3. Состав атома (нуклида
4. Электронная схема:
Электронная конфигурация: 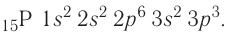
Электронная конфигурация внешнего энергетического уровня: 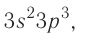
5. Фосфор — неметалл. При обычных условиях — твёрдое вещество; молекулярная формула —
6. Степени окисления:
а) в высших оксидах — +5;
б) в летучих водородных соединениях — —3.
Электроотрицательность:
7. Формула высшего оксида — 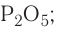
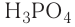
8. Летучее водородное соединение —
Периодический закон Д. И. Менделеева — один из наиболее общих и фундаментальных законов природы. Он является основой развития не только химии, но и всего естествознания в целом, позволяет раскрывать новые закономерности природы и проникать в их суть.
Периодическая система химических элементов представляет собой естественно-научную классификацию элементов по электронному строению их атомов, на основе которой строится изучение химии и решение её практических задач.
- Кислород как химический элемент
- Водород как химический элемент
- Вода в химии и её элементный состав, молекулярное строение, формула и молярная масса
- Железо как химический элемент
- Основные законы и понятия химии
- Место химии в системе наук
- Перспективы химического производства
- Типы химических реакций в химии
Атомно-молекулярное учение
Мы приступаем к изучению химии — мира молекул и атомов. В этой статье мы рассмотрим базисные понятия и разберемся с электронными
формулами элементов.
Атом (греч. а — отриц. частица + tomos — отдел, греч. atomos — неделимый) — электронейтральная частица вещества микроскопических
размеров и массы, состоящая из положительно заряженного ядра (протонов) и отрицательно заряженных электронов (электронные орбитали).
Описываемая модель атома называется «планетарной» и была предложена в 1913 году великими физиками: Нильсом Бором и Эрнестом Резерфордом

Протон (греч. protos — первый) — положительно заряженная (+1) элементарная частица, вместе с нейтронами образует ядра атомов
элементов. Нейтрон (лат. neuter — ни тот, ни другой) — нейтральная (0) элементарная частица, присутствующая в ядрах всех
химических элементов, кроме водорода.
Электрон (греч. elektron — янтарь) — стабильная элементарная частица с отрицательным электрическим зарядом (-1), заряд атома —
порядковый номер в таблице Менделеева — равен числу электронов (и, соответственно, протонов).
Запомните, что в невозбужденном состоянии атом содержит одинаковое число электронов и протонов. Так у кальция (порядковый номер 20)
в ядре находится 20 протонов, а вокруг ядра на электронных орбиталях 20 электронов.

Я еще раз подчеркну эту важную деталь. На данном этапе будет отлично, если вы запомните простое правило:
порядковый номер элемента = числу электронов. Это наиболее важно для практического применения и изучения следующей темы.
Электронная конфигурация атома
Электроны атома находятся в непрерывном движении вокруг ядра. Энергия электронов отличается друг от друга, в соответствии с этим
электроны занимают различные энергетические уровни.
Энергетические уровни подразделяются на несколько подуровней:
- Первый уровень
- Второй уровень
- Третий уровень
- Четвертый уровень
Состоит из s-подуровня: одной «1s» ячейки, в которой помещаются 2 электрона (заполненный электронами — 1s2)
Состоит из s-подуровня: одной «s» ячейки (2s2) и p-подуровня: трех «p» ячеек (2p6), на которых
помещается 6 электронов
Состоит из s-подуровня: одной «s» ячейки (3s2), p-подуровня: трех «p» ячеек (3p6) и d-подуровня:
пяти «d» ячеек (3d10), в которых помещается 10 электронов
Состоит из s-подуровня: одной «s» ячейки (4s2), p-подуровня: трех «p» ячеек (4p6), d-подуровня:
пяти «d» ячеек (4d10) и f-подуровня: семи «f» ячеек (4f14), на которых помещается 14
электронов

Зная теорию об энергетических уровнях и порядковый номер элемента из таблицы Менделеева, вы должны расположить определенное число
электронов, начиная от уровня с наименьшей энергией и заканчивая к уровнем с наибольшей. Чуть ниже вы увидите несколько примеров, а
также узнаете об исключении, которое только подтверждает данные правила.
Подуровни: «s», «p» и «d», которые мы только что обсудили, имеют в определенную конфигурацию в пространстве. По этим подуровням, или
атомным орбиталям, движутся электроны, создавая определенный «рисунок».
S-орбиталь похожа на сферу, p-орбиталь напоминает песочные часы, d-орбиталь — клеверный лист.

Правила заполнения электронных орбиталей и примеры
Существует ряд правил, которые применяют при составлении электронных конфигураций атомов:
- Сперва следует заполнить орбитали с наименьшей энергией, и только после переходить к энергетически более высоким
- На орбитали (в одной «ячейке») не может располагаться более двух электронов
- Орбитали заполняются электронами так: сначала в каждую ячейку помещают по одному электрону, после чего орбитали дополняются
еще одним электроном с противоположным направлением - Порядок заполнения орбиталей: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s
Должно быть, вы обратили внимание на некоторое несоответствие: после 3p подуровня следует переход к 4s, хотя логично было
бы заполнить до конца 4s подуровень. Однако природа распорядилась иначе.
Запомните, что, только заполнив 4s подуровень двумя электронами, можно переходить к 3d подуровню.
Без практики теория мертва, так что приступает к тренировке. Нам нужно составить электронную конфигурацию атомов углерода и
серы. Для начала определим их порядковый номер, который подскажет нам число их электронов. У углерода — 6, у серы — 16.
Теперь мы располагаем указанное количество электронов на энергетических уровнях, руководствуясь правилами заполнения.

Обращаю ваше особе внимание: на 2p-подуровне углерода мы расположили 2 электрона в разные ячейки, следуя одному из правил.
А на 3p-подуровне у серы электронов оказалось много, поэтому сначала мы расположили 3 электрона по отдельным ячейкам, а оставшимся
одним электроном дополнили первую ячейку.
Таким образом, электронные конфигурации наших элементов:
- Углерод — 1s22s22p2
- Серы — 1s22s22p63s23p4
Внешний уровень и валентные электроны
Количество электронов на внешнем (валентном) уровне — это число электронов на наивысшем энергетическом уровне, которого достигает элемент. Такие электроны называются валентными: они могут быть спаренными или неспаренными. Иногда
для наглядного представления конфигурацию внешнего уровня записывают отдельно:
- Углерод — 2s22p2 (4 валентных электрона)
- Сера -3s23p4 (6 валентных электронов)
Неспаренные валентные электроны способны к образованию химической связи. Их число соответствует количеству связей, которые данный атом может образовать с другими атомами. Таким образом неспаренные валентные электроны тесно связаны с валентностью — способностью атомов образовывать определенное число химических связей.

- Углерод — 2s22p2 (2 неспаренных валентных электрона)
- Сера -3s23p4 (2 неспаренных валентных электрона)
Тренировка
Потренируйтесь и сами составьте электронную конфигурацию для магния и скандия. Определите число электронов на внешнем (валентном) уровне и число неспаренных
электронов. Ниже будет дано наглядное объяснение этой задаче.

Запишем получившиеся электронные конфигурации магния и скандия:
- Магний — 1s22s22p63s2
- Скандий — 1s22s22p63s23p64s23d1
В целом несложная и интересная тема электронных конфигураций отягощена небольшим исключением — провалом электрона, которое только подтверждает общее
правило: любая система стремится занять наименее энергозатратное состояние.
Провал электрона
Провалом электрона называют переход электрона с внешнего, более высокого энергетического уровня, на предвнешний, энергетически более
низкий. Это связано с большей энергетической устойчивостью получающихся при этом электронных конфигураций.
Подобное явление характерно лишь для некоторых элементов: медь, хром, серебро, золото, молибден. Для примера выберем хром, и рассмотрим
две электронных конфигурации: первую «неправильную» (сделаем вид, будто мы не знаем про провал электрона) и вторую правильную, написанную
с учетом провала электрона.
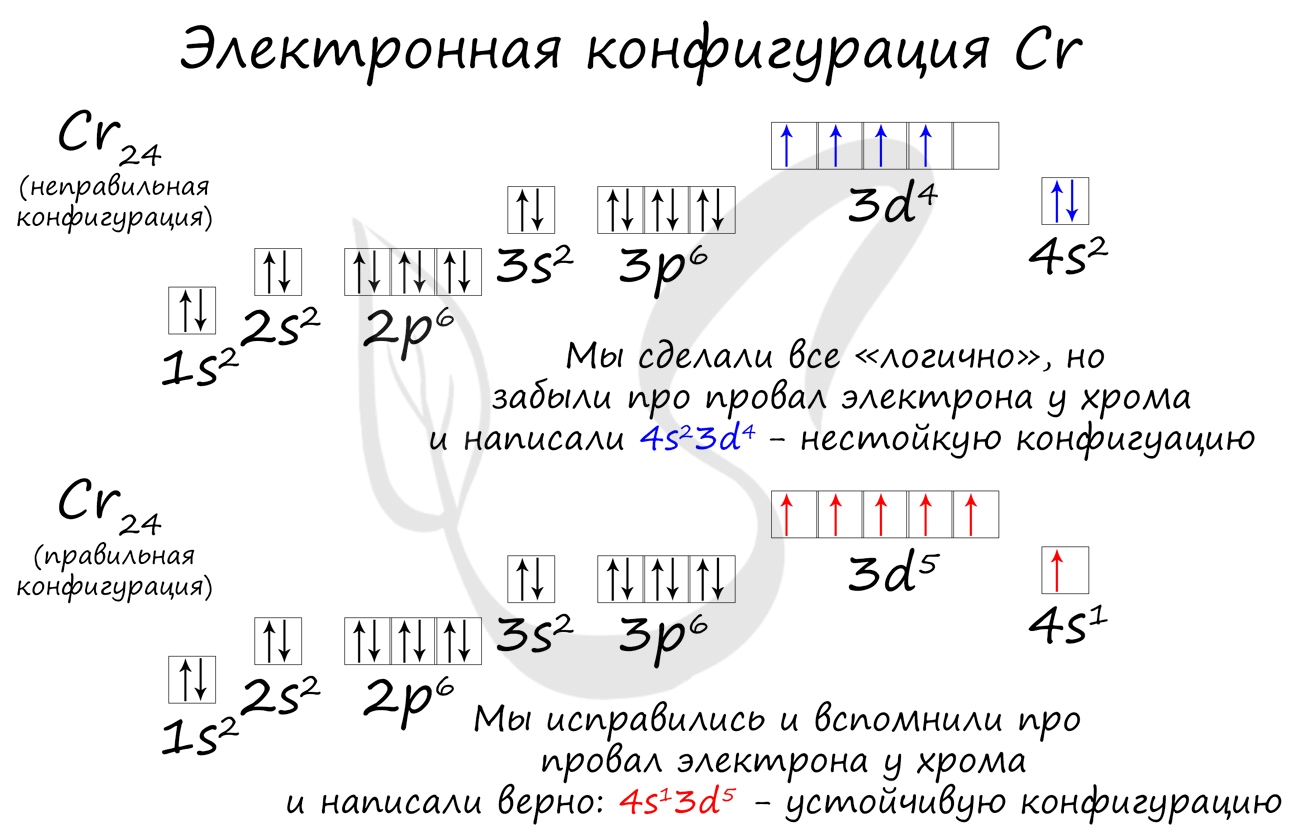
Теперь вы понимаете, что кроется под явлением провала электрона. Запишите электронные конфигурации хрома и меди самостоятельно еще раз и
сверьте с представленными ниже.

Основное и возбужденное состояние атома
Основное и возбужденное состояние атома отражаются на электронных конфигурациях. Возбужденное состояние связано с движением электронов
относительно атомных ядер. Говоря проще: при возбуждении пары электронов распариваются и занимают новые ячейки.
Возбужденное состояние является для атома нестабильным, поэтому долгое время в нем он пребывать не может. У некоторых атомов: азота,
кислорода , фтора — возбужденное состояние невозможно, так как отсутствуют свободные орбитали («ячейки») — электронам некуда перескакивать, к тому
же d-орбиталь у них отсутствует (они во втором периоде).
У серы возможно возбужденное состояние, так как она имеет свободную d-орбиталь, куда могут перескочить электроны. Четвертый энергетический
уровень отсутствует, поэтому, минуя 4s-подуровень, заполняем распаренными электронами 3d-подуровень.
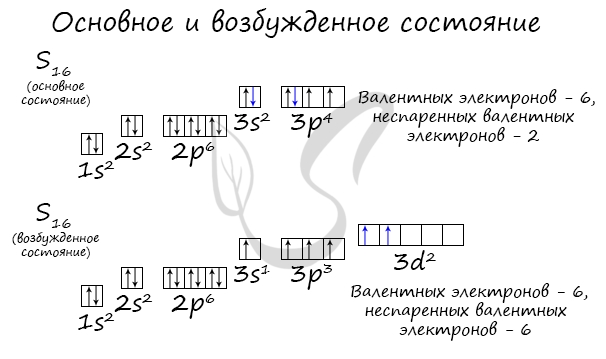
По мере изучения основ общей химии мы еще не раз вернемся к этой теме, однако хорошо, если вы уже сейчас запомните, что возбужденное состояние
связано с распаривание электронных пар.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Урок 4. Атомы, молекулы и ионы. Простые и сложные вещества. Химические элементы. Знаки химических элементов
Атомы, молекулы. Химические элементы. Знаки химических элементов. Вещества простые и сложные
C глубокой древности людей занимал вопрос о пределах делимости вещества. Древнегреческий учёный Демокрит высказал предположение о том, что материя состоит из мельчайших неделимых частиц, которые назвал атомами. Роберт Бойль объяснил сущность химической реакции исходя из идей об атомном строении вещества. Михаил Васильевич Ломоносов в своих трудах писал о том, что тела в природе состоят из карпускул (молекул), в состав которых входят элементы (атомы). Атомно-молекулярное учение окончательно было принято на съезде химиков в 1860 году.
• Атомы – мельчайшие химически неделимые частицы вещества.
• Молекулы – мельчайшие частицы многих веществ, состав и химические свойства которых такие же, как у данного вещества.
Вещества могут состоять из разных атомов, как молекула воды или из одинаковых атомов, как молекула кислорода. Молекулу воды можно разложить на более простые вещества, водород и кислород, а вот кислород на более простые вещества уже нельзя разложить.
Если вещество состоит из разных видов атомов, то такое вещество называется сложным. Если вещество состоит из атомов одного вида, то такое вещество называется простым.
В настоящее время известно 118 видов атомов. Определённый вид атомов называется химическим элементом. Названия химических элементов почти всегда совпадают с названиями соответствующих простых веществ. Поэтому важно различать, когда говорится о веществах, а когда об элементах. Медь входит в состав минерала малахит. Здесь речь идёт о химическом элементе, потому что в состав минерала в данном случае входят атомы меди. На Южном берегу озера Верхнее находится крупнейшее месторождение самородной меди. Здесь речь идёт о простом веществе.
Для обозначения химического элемента пытались использовать разную символику. Ещё алхимики в своих трактатах обозначали некоторые вещества символами, которыми потом стали обозначать соответствующие элементы. В 1814 году шведский химик Йенс Якоб Берцелиус предложил свою систему обозначения химических элементов, которой мы пользуемся до сих пор.
Для обозначения химического элемента используется заглавная буква соответствующего латинского названия химического элемента, а чтобы буквы не повторялись, иногда используют заглавную букву и строчную букву – одну из последующих в латинском названии: например, химическое вещество сера имеет латинское название Sulfur и обозначается буквой S. Так у химиков всего мира появился свой алфавит, каждая буква которого обозначает вид атома. Чтобы записать атом железа достаточно написать химический знак феррум – Fe. Если нужно записать несколько атомов железа, на помощь приходят коэффициенты – 6 Fe (6 атомов железа).
-
1
-
2
Атомы
- Состав и строение атомов
Атом — это мельчайшая химически неделимая частица вещества, а также наименьшая часть химического элемента, являющаяся носителем его свойств. Химически неделимая
означает, что атом в ходе химических реакций не делится на более мелкие части.
Атомы очень маленькие частицы, их размер находится в диапазоне от одного до пяти ангстрем (обозначается — Å.). Один ангстрем — это 10–10 метра.
Состав и строение атомов
Атомы состоят из ещё более мелких частиц.
В центре любого атома находится положительно заряженное ядро. В пространстве вокруг ядра находятся отрицательно заряженные частицы — электроны, которые образуют так называемое электронное облако
. Таким образом, атом состоит из положительно заряженного ядра и окружающего его отрицательно заряженного электронного облака.
Пример. Атом гелия состоит из ядра, в котором находятся два протона и два нейтрона, и двух электронов:
Ядро атома — это центральная часть атома, в которой сосредоточена основная его масса и весь положительный электрический заряд. Ядро атома состоит из протонов и нейтронов.
Протон — это частица, которая имеет положительный электрический заряд. Заряд протона в условных единицах равен +1. Символ протона — p+.
Нейтрон — это частица, не имеющая электрического заряда. Заряд нейтрона равен 0. Символ нейтрона — n0.
Протоны и нейтроны имеют общее название — нуклоны.
Ядра атомов имеют положительный заряд, так как состоят из протонов с положительным зарядом и нейтронов. По величине заряд равен количеству протонов в ядре и совпадает с порядковым номером элемента в периодической системе.
Электрон — это частица, которая имеет отрицательный электрический заряд. Заряд электрона в условных единицах равен -1. Символ электрона — e .
Протоны, нейтроны и электроны имеют общее название — элементарные частицы или субатомные частицы.
| Название | Символ | Заряд |
|---|---|---|
| Протон | p+ | +1 |
| Нейтрон | n0 | 0 |
| Электрон | e | -1 |
Заряд протона и электрона одинаковы по величине, но противоположны по знаку. Любой атом содержит равное число протонов и электронов, значит заряд ядра и суммарный заряд всех электронов атома одинаковы по величине, но противоположны по знаку. Следовательно, атомы являются электронейтральными частицами.