
|
|

|
|
| Identifiers | |
|---|---|
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChEBI |
|
| ChEMBL |
|
| ChemSpider |
|
| ECHA InfoCard | 100.028.937 |
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
KBr |
| Molar mass | 119.002 g/mol |
| Appearance | white solid |
| Odor | odorless |
| Density | 2.74 g/cm3 |
| Melting point | 734 °C (1,353 °F; 1,007 K) |
| Boiling point | 1,435 °C (2,615 °F; 1,708 K) |
|
Solubility in water |
535 g/L (0 °C) 678 g/L (25 °C) 1020 g/L (100 °C) |
| Solubility | very slightly soluble in diethyl ether |
| Solubility in glycerol | 217 g/L |
| Solubility in ethanol | 47.6 g/L (80 °C) |
|
Magnetic susceptibility (χ) |
−49.1·10−6 cm3/mol |
|
Refractive index (nD) |
1.559 |
| Structure | |
|
Crystal structure |
Sodium chloride(Face-centered cubic) |
|
Coordination geometry |
octahedral |
|
Dipole moment |
10.41 D (gas) |
| Pharmacology | |
|
ATCvet code |
QN03AX91 (WHO) |
| Hazards | |
| GHS labelling: | |
|
Pictograms |

|
|
Signal word |
Warning |
|
Hazard statements |
H319 |
|
Precautionary statements |
P280, P305+P351+P338, P337+P313[1] |
| NFPA 704 (fire diamond) |
[3] 1 0 0 |
| Lethal dose or concentration (LD, LC): | |
|
LD50 (median dose) |
3070 mg/kg (oral, rat)[2] |
| Related compounds | |
|
Other anions |
Potassium fluoride Potassium chloride Potassium iodide |
|
Other cations |
Lithium bromide Sodium bromide Rubidium bromide Caesium bromide Francium bromide |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Potassium bromide (KBr) is a salt, widely used as an anticonvulsant and a sedative in the late 19th and early 20th centuries, with over-the-counter use extending to 1975 in the US. Its action is due to the bromide ion (sodium bromide is equally effective). Potassium bromide is used as a veterinary drug, as an antiepileptic medication for dogs.
Under standard conditions, potassium bromide is a white crystalline powder. It is freely soluble in water; it is not soluble in acetonitrile. In a dilute aqueous solution, potassium bromide tastes sweet, at higher concentrations it tastes bitter, and tastes salty when the concentration is even higher. These effects are mainly due to the properties of the potassium ion—sodium bromide tastes salty at any concentration. In high concentration, potassium bromide strongly irritates the gastric mucous membrane, causing nausea and sometimes vomiting (a typical effect of all soluble potassium salts).[citation needed]
Chemical properties[edit]
Potassium bromide, a typical ionic salt, is fully dissociated and near pH 7 in aqueous solution. It serves as a source of bromide ions. This reaction is important for the manufacture of silver bromide for photographic film:
Aqueous bromide Br− also forms complexes when reacted with some metal halides such as copper(II) bromide:
Preparation[edit]
A traditional method for the manufacture of KBr is the reaction of potassium carbonate with an iron(III, II) bromide, Fe3Br8, made by treating scrap iron under water with excess bromine:[4]
Applications[edit]
Medical and veterinary[edit]
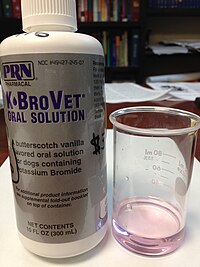
A bottle of PRN Pharmaceutical Company (Pensacola, FL) K•BroVet veterinary pharmaceutical potassium bromide oral solution (250 mg/mL). The product is intended to be used in dogs, primarily as an antiepileptic (to stop seizures).[5] The pink color of the solution is artificial; pure potassium bromide solutions are colorless
The anticonvulsant properties of potassium bromide were first noted by Sir Charles Locock at a meeting of the Royal Medical and Chirurgical Society in 1857. Bromide can be regarded as the first effective medication for epilepsy. At the time, it was commonly thought that epilepsy was caused by masturbation.[6] Locock noted that bromide calmed sexual excitement and thought this was responsible for his success in treating seizures. In the latter half of the 19th century, potassium bromide was used for the calming of seizure and nervous disorders on an enormous scale, with the use by single hospitals being as much as several tons a year (the dose for a given person being a few grams per day).[6] By the beginning of the 20th century the generic word had become so widely associated with being sedate that bromide came to mean a dull, sedate person or a boring platitude uttered by such a person.[7]
There was not a better epilepsy drug until phenobarbital in 1912. The British Army has historically been claimed to lace soldiers’ tea with bromide to quell sexual arousal but that is likely untrue as doing so would also diminish alertness in battle.[citation needed] Several other substances have also been named in anaphrodisiac myths.
Bromide compounds, especially sodium bromide, remained in over-the-counter sedatives and headache remedies (such as the original formulation of Bromo-Seltzer) in the US until 1975, when bromides were outlawed in all over-the-counter medicines, due to chronic toxicity.[8] Bromide’s exceedingly long half life in the body made it difficult to dose without side effects. Medical use of bromides in the US was discontinued at this time, as many better and shorter-acting sedatives were known by then.
Potassium bromide is used in veterinary medicine to treat epilepsy in dogs, either as first-line treatment or in addition to phenobarbital, when seizures are not adequately controlled with phenobarbital alone.[5] Use of bromide in cats is limited because it carries a substantial risk of causing lung inflammation (pneumonitis) in them. The use of bromide as a treatment drug for animals means that veterinary medical diagnostic laboratories are able as a matter of routine to measure serum levels of bromide on order of a veterinarian, whereas human medical diagnostic labs in the US do not measure bromide as a routine test.
Potassium bromide is not approved by the US Food and Drug Administration (FDA) for use in humans to control seizures. In Germany, it is still approved as an antiepileptic drug for humans, particularly children and adolescents.[9] These indications include severe forms of generalized tonic-clonic seizures, early-childhood-related tonic–clonic seizures, and also severe myoclonic seizures during childhood. Adults who have reacted positively to the drug during childhood/adolescence may continue treatment. Potassium bromide tablets are sold under the brand name Dibro-Be mono (Rx-only). The drug has almost complete bioavailability, but the bromide ion has a relatively long half life of 12 days in the blood,[6] making bromide salts difficult to adjust and dose. Bromide is not known to interfere with the absorption or excretion of any other anticonvulsant, though it does have strong interactions with chloride in the body, the normal body uptake and excretion of which strongly influences bromide’s excretion.[6]
The therapeutic index (ratio of effectiveness to toxicity) for bromide is small. As with other antiepileptics, sometimes even therapeutic doses (3 to 5 grams per day, taking 6 to 8 weeks to reach stable levels) may give rise to intoxication. Often indistinguishable from ‘expected’ side-effects, these include:
- Bromism These are central nervous system reactions. They may include:
- depression,
- lethargy, somnolence (from daytime sleepiness to coma)
- loss of appetite and cachexia, nausea/emesis with exicosis (loss of body fluid)
- loss of reflexes or pathologic reflexes
- clonic seizures
- tremor
- ataxia
- loss of neural sensitivity
- paresis
- cerebral edema with associated headache and papilledema of the eyes
- delirium: confusion, abnormal speech, loss of concentration and memory, aggressiveness
- psychosis
- Acne-form dermatitis and other forms of skin disease may also be seen, as well as mucous hypersecretion in the lungs. Asthma and rhinitis may worsen. Rarely, tongue disorder, aphthous stomatitis, bad breath, and constipation occur.
Optics[edit]
Potassium bromide is transparent from the near ultraviolet to long-wave infrared wavelengths (0.25-25 µm) and has no significant optical absorption lines in its high transmission region.
It is used widely as infrared optical windows and components for general spectroscopy because of its wide spectral range. In infrared spectroscopy, samples are analyzed by grinding with powdered potassium bromide and pressing into a disc. Alternatively, samples may be analyzed as a liquid film (neat, as a solution, or in a mull with Nujol) between two polished potassium bromide discs.[10]
Due to its high solubility and hygroscopic nature it must be kept in a dry environment. The refractive index is about 1.55 at 1.0 µm.
Photography[edit]
In addition to manufacture of silver bromide, potassium bromide is used as a restrainer in black and white developer formulas. It improves differentiation between exposed and unexposed crystals of silver halide, and thus reduces fog.[11]
References[edit]
- ^ «Potassium bromide 221864».
- ^ «ChemIDplus — Potassium bromide». chem.sis.nlm.nih.gov.
- ^ «Labchem MSDS, sec. 16, p. 6» (PDF).
- ^ «Potassium bromide». The Titi Tudorancea Bulletin.
- ^ a b K-BROVET 250- potassium bromide tablet, chewable drug label/data at Daily Med from U.S. National Library of Medicine, National Institutes of Health.
- ^ a b c d Goodman; Gilman (1970). «Chapter 10: Hypnotics and Sedatives». The Pharmacological Basis of Therapeutics (4th ed.). London: MacMillan. pp. 121–2.
- ^ Metcalf, Alan A. (2004). Predicting New Words – The Secrets of Their Success. Boston: Houghton Mifflin Harcourt. pp. 36–42. ISBN 978-0-618-13006-1. Retrieved 27 August 2017.
- ^ Adams, Samuel Hopkins (1905). The Great American Fraud. Press of the American Medical Association.
The Great American Fraud.
- ^ German leaflet
- ^ Reusch, W. «Infrared Spectroscopy». VirtualText of Organic Chemistry. Archived from the original on 27 October 2007. Retrieved 18 December 2007.
- ^ Anchell, Stephen; Troop, Bill (1998). The Film Developing Cookbook. Boston: Focal Press. p. 28.
External links[edit]
- Veterinary use note at Auburn University

|
|

|
|
| Identifiers | |
|---|---|
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChEBI |
|
| ChEMBL |
|
| ChemSpider |
|
| ECHA InfoCard | 100.028.937 |
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
KBr |
| Molar mass | 119.002 g/mol |
| Appearance | white solid |
| Odor | odorless |
| Density | 2.74 g/cm3 |
| Melting point | 734 °C (1,353 °F; 1,007 K) |
| Boiling point | 1,435 °C (2,615 °F; 1,708 K) |
|
Solubility in water |
535 g/L (0 °C) 678 g/L (25 °C) 1020 g/L (100 °C) |
| Solubility | very slightly soluble in diethyl ether |
| Solubility in glycerol | 217 g/L |
| Solubility in ethanol | 47.6 g/L (80 °C) |
|
Magnetic susceptibility (χ) |
−49.1·10−6 cm3/mol |
|
Refractive index (nD) |
1.559 |
| Structure | |
|
Crystal structure |
Sodium chloride(Face-centered cubic) |
|
Coordination geometry |
octahedral |
|
Dipole moment |
10.41 D (gas) |
| Pharmacology | |
|
ATCvet code |
QN03AX91 (WHO) |
| Hazards | |
| GHS labelling: | |
|
Pictograms |

|
|
Signal word |
Warning |
|
Hazard statements |
H319 |
|
Precautionary statements |
P280, P305+P351+P338, P337+P313[1] |
| NFPA 704 (fire diamond) |
[3] 1 0 0 |
| Lethal dose or concentration (LD, LC): | |
|
LD50 (median dose) |
3070 mg/kg (oral, rat)[2] |
| Related compounds | |
|
Other anions |
Potassium fluoride Potassium chloride Potassium iodide |
|
Other cations |
Lithium bromide Sodium bromide Rubidium bromide Caesium bromide Francium bromide |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Potassium bromide (KBr) is a salt, widely used as an anticonvulsant and a sedative in the late 19th and early 20th centuries, with over-the-counter use extending to 1975 in the US. Its action is due to the bromide ion (sodium bromide is equally effective). Potassium bromide is used as a veterinary drug, as an antiepileptic medication for dogs.
Under standard conditions, potassium bromide is a white crystalline powder. It is freely soluble in water; it is not soluble in acetonitrile. In a dilute aqueous solution, potassium bromide tastes sweet, at higher concentrations it tastes bitter, and tastes salty when the concentration is even higher. These effects are mainly due to the properties of the potassium ion—sodium bromide tastes salty at any concentration. In high concentration, potassium bromide strongly irritates the gastric mucous membrane, causing nausea and sometimes vomiting (a typical effect of all soluble potassium salts).[citation needed]
Chemical properties[edit]
Potassium bromide, a typical ionic salt, is fully dissociated and near pH 7 in aqueous solution. It serves as a source of bromide ions. This reaction is important for the manufacture of silver bromide for photographic film:
Aqueous bromide Br− also forms complexes when reacted with some metal halides such as copper(II) bromide:
Preparation[edit]
A traditional method for the manufacture of KBr is the reaction of potassium carbonate with an iron(III, II) bromide, Fe3Br8, made by treating scrap iron under water with excess bromine:[4]
Applications[edit]
Medical and veterinary[edit]
A bottle of PRN Pharmaceutical Company (Pensacola, FL) K•BroVet veterinary pharmaceutical potassium bromide oral solution (250 mg/mL). The product is intended to be used in dogs, primarily as an antiepileptic (to stop seizures).[5] The pink color of the solution is artificial; pure potassium bromide solutions are colorless
The anticonvulsant properties of potassium bromide were first noted by Sir Charles Locock at a meeting of the Royal Medical and Chirurgical Society in 1857. Bromide can be regarded as the first effective medication for epilepsy. At the time, it was commonly thought that epilepsy was caused by masturbation.[6] Locock noted that bromide calmed sexual excitement and thought this was responsible for his success in treating seizures. In the latter half of the 19th century, potassium bromide was used for the calming of seizure and nervous disorders on an enormous scale, with the use by single hospitals being as much as several tons a year (the dose for a given person being a few grams per day).[6] By the beginning of the 20th century the generic word had become so widely associated with being sedate that bromide came to mean a dull, sedate person or a boring platitude uttered by such a person.[7]
There was not a better epilepsy drug until phenobarbital in 1912. The British Army has historically been claimed to lace soldiers’ tea with bromide to quell sexual arousal but that is likely untrue as doing so would also diminish alertness in battle.[citation needed] Several other substances have also been named in anaphrodisiac myths.
Bromide compounds, especially sodium bromide, remained in over-the-counter sedatives and headache remedies (such as the original formulation of Bromo-Seltzer) in the US until 1975, when bromides were outlawed in all over-the-counter medicines, due to chronic toxicity.[8] Bromide’s exceedingly long half life in the body made it difficult to dose without side effects. Medical use of bromides in the US was discontinued at this time, as many better and shorter-acting sedatives were known by then.
Potassium bromide is used in veterinary medicine to treat epilepsy in dogs, either as first-line treatment or in addition to phenobarbital, when seizures are not adequately controlled with phenobarbital alone.[5] Use of bromide in cats is limited because it carries a substantial risk of causing lung inflammation (pneumonitis) in them. The use of bromide as a treatment drug for animals means that veterinary medical diagnostic laboratories are able as a matter of routine to measure serum levels of bromide on order of a veterinarian, whereas human medical diagnostic labs in the US do not measure bromide as a routine test.
Potassium bromide is not approved by the US Food and Drug Administration (FDA) for use in humans to control seizures. In Germany, it is still approved as an antiepileptic drug for humans, particularly children and adolescents.[9] These indications include severe forms of generalized tonic-clonic seizures, early-childhood-related tonic–clonic seizures, and also severe myoclonic seizures during childhood. Adults who have reacted positively to the drug during childhood/adolescence may continue treatment. Potassium bromide tablets are sold under the brand name Dibro-Be mono (Rx-only). The drug has almost complete bioavailability, but the bromide ion has a relatively long half life of 12 days in the blood,[6] making bromide salts difficult to adjust and dose. Bromide is not known to interfere with the absorption or excretion of any other anticonvulsant, though it does have strong interactions with chloride in the body, the normal body uptake and excretion of which strongly influences bromide’s excretion.[6]
The therapeutic index (ratio of effectiveness to toxicity) for bromide is small. As with other antiepileptics, sometimes even therapeutic doses (3 to 5 grams per day, taking 6 to 8 weeks to reach stable levels) may give rise to intoxication. Often indistinguishable from ‘expected’ side-effects, these include:
- Bromism These are central nervous system reactions. They may include:
- depression,
- lethargy, somnolence (from daytime sleepiness to coma)
- loss of appetite and cachexia, nausea/emesis with exicosis (loss of body fluid)
- loss of reflexes or pathologic reflexes
- clonic seizures
- tremor
- ataxia
- loss of neural sensitivity
- paresis
- cerebral edema with associated headache and papilledema of the eyes
- delirium: confusion, abnormal speech, loss of concentration and memory, aggressiveness
- psychosis
- Acne-form dermatitis and other forms of skin disease may also be seen, as well as mucous hypersecretion in the lungs. Asthma and rhinitis may worsen. Rarely, tongue disorder, aphthous stomatitis, bad breath, and constipation occur.
Optics[edit]
Potassium bromide is transparent from the near ultraviolet to long-wave infrared wavelengths (0.25-25 µm) and has no significant optical absorption lines in its high transmission region.
It is used widely as infrared optical windows and components for general spectroscopy because of its wide spectral range. In infrared spectroscopy, samples are analyzed by grinding with powdered potassium bromide and pressing into a disc. Alternatively, samples may be analyzed as a liquid film (neat, as a solution, or in a mull with Nujol) between two polished potassium bromide discs.[10]
Due to its high solubility and hygroscopic nature it must be kept in a dry environment. The refractive index is about 1.55 at 1.0 µm.
Photography[edit]
In addition to manufacture of silver bromide, potassium bromide is used as a restrainer in black and white developer formulas. It improves differentiation between exposed and unexposed crystals of silver halide, and thus reduces fog.[11]
References[edit]
- ^ «Potassium bromide 221864».
- ^ «ChemIDplus — Potassium bromide». chem.sis.nlm.nih.gov.
- ^ «Labchem MSDS, sec. 16, p. 6» (PDF).
- ^ «Potassium bromide». The Titi Tudorancea Bulletin.
- ^ a b K-BROVET 250- potassium bromide tablet, chewable drug label/data at Daily Med from U.S. National Library of Medicine, National Institutes of Health.
- ^ a b c d Goodman; Gilman (1970). «Chapter 10: Hypnotics and Sedatives». The Pharmacological Basis of Therapeutics (4th ed.). London: MacMillan. pp. 121–2.
- ^ Metcalf, Alan A. (2004). Predicting New Words – The Secrets of Their Success. Boston: Houghton Mifflin Harcourt. pp. 36–42. ISBN 978-0-618-13006-1. Retrieved 27 August 2017.
- ^ Adams, Samuel Hopkins (1905). The Great American Fraud. Press of the American Medical Association.
The Great American Fraud.
- ^ German leaflet
- ^ Reusch, W. «Infrared Spectroscopy». VirtualText of Organic Chemistry. Archived from the original on 27 October 2007. Retrieved 18 December 2007.
- ^ Anchell, Stephen; Troop, Bill (1998). The Film Developing Cookbook. Boston: Focal Press. p. 28.
External links[edit]
- Veterinary use note at Auburn University
| Бромид калия | |
 |
|
 |
|
| Общие | |
|---|---|
| Систематическое наименование | Бромид калия |
| Химическая формула | KBr |
| Физические свойства | |
| Состояние (ст. усл.) | бесцветные кристаллы |
| Отн. молек. масса | 119 а. е. м. |
| Молярная масса | 119,01 г/моль |
| Плотность | 2,75 г/см³ |
| Термические свойства | |
| Температура плавления | 734 °C |
| Температура кипения | 1435 °C |
| Классификация | |
| Рег. номер CAS | 7758-02-3 |
Броми́д ка́лия (калий бромистый) — бесцветное кристаллическое вещество, калиевая соль бромоводородной кислоты. Химическая формула — KBr.
Содержание
- 1 Получение
- 2 Физико-химические свойства
- 2.1 Термодинамические величины
- 2.2 Растворимость
- 3 Химические свойства
- 3.1 Бромирующий агент
- 4 Применение
- 5 Физиологическое действие
- 6 Внешние ссылки
- 7 Примечания
- 8 Литература
- 9 См. также
Получение
Для промышленных нужд бромид калия получают с помощью взаимодействия карбоната калия со смешанным бромидом железа (II, III) Fe3Br8[1]:
В лабораторных условиях можно получать бромид калия с помощью взаимодействия гидроксида калия, брома и аммиака:
Физико-химические свойства
Дипольный момент молекулы составляет 9,1 Дебая.
Термодинамические величины
| Свойство | Значение |
|---|---|
| Стандартная энтальпия образования (298 К) | -392,5 кДж/моль |
| Энтропия образования (298 К) | 95,85 Дж/(моль·К) |
| Теплоёмкость (298 К) | 52,07 Дж/(моль·К) |
| Энтальпия плавления | 29 кДж/моль[2] |
Растворимость
| Растворитель | Температура, °C | Растворимость, г/100 г растворителя |
|---|---|---|
| Ацетон | 20 | 0,03 |
| Вода | 0 | 53,5 |
| Вода | 10 | 59,5 |
| Вода | 20 | 65,2 |
| Вода | 25 | 68,1 |
| Вода | 30 | 70,9 |
| Вода | 40 | 75,8 |
| Вода | 60 | 85,5 |
| Вода | 80 | 94,6 |
| Вода | 100 | 103,3[3] |
| Вода | 150 | 127,3[3] |
| Вода | 200 | 153,2[3] |
| Глицерин | 25 | 17,8 |
| Метанол | 20 | 2,1 |
| Этанол | 20 | 0,46 |
| Этанол | 55 | 0,54 |
Химические свойства
Бромид калия является типичной ионной солью. При растворении в воде подвергается полной диссоциации, при этом не подвергается гидролизу, так как соль образована сильным основанием (гидроксид калия) и сильной кислотой (бромоводородная кислота).
В растворах могут протекать обычные обменные реакции:
С некоторыми бромидами в концентрированных растворах могут образовываться комплексные соединения:
Бромирующий агент
- Используется для селективного транс-бромирования кратных связей алкенов и алкинов в присутствии диацетокси йодбензола в системе дихлорметан-вода[4]. Для цис-бромирования применяют систему церий-аммоний нитрат—бромид калия[5].
- Для монобромирования дезактивированных производных анилина применяют окислительное бромирование бромидом калия и перборатом натрия[6].
Применение
- Используют как источник бромид-ионов для получения бромида серебра, который используется для изготовления фото- и киноплёнок.
- Бромид калия облегчает приступы аллергии, вызванные дрозофилами[7].
Приставка для ИК-спектрофотометра для изучения спектров жидких веществ в таблетах из бромида калия
- Для изучения ИК-спектров жидких веществ часто применяют технологию помещения вещества между пластинками из бромида калия (так называемую «таблетку»). Бромид калия не поглощает ИК-излучение в достаточно широком интервале длин волн (от 0,25 мкм до 25 мкм), что позволяет использовать его для этих целей. Также для изготовления таблеток для измерения инфракрасных спектров поглощения иногда применяют фторид кальция.
Физиологическое действие
Широко используется как противосудорожное и седативное вещество в конце 19 и начале 20 веков. Его действие основанно на физиологическом влиянии бромид-иона (бромид натрия менее эффективен). KBr в настоящее время используется в качестве ветеринарного препарата, как противосудорожное лекарство для собак и кошек.
В разбавленных водных растворах бромид калия придаёт раствору сладкий вкус, при более высоких концентрациях раствор обладает горьким вкусом (эти эффекты обусловлены главным образом действием иона калия).
При высокой концентрации бромид калия сильно раздражает слизистую оболочку желудка, что приводит к тошноте и рвоте.
Смертельная доза LD50 равна 3070 мг/кг.
Внешние ссылки
- Инфракрасная спектроскопия (англ.)
Примечания
- ↑ Бромид калия на сайте Chemport.ru
- ↑ Рабинович В.А., Хавин З.Я. «Краткий химический справочник» Л.: Химия, 1977
- ↑ 1 2 3 При повышенном давлении.
- ↑ Efficient Bromination of Alkenes and Alkynes Using Potassium Bromide and Diacetoxy Iodobenzene. Synthetic Communications, V. 39, Issue 2, PP. 220-227 (англ.)
- ↑ An efficient bromination of alkenes using cerium(IV) ammonium nitrate (CAN) and potassium bromide. Tetrahedron V. 57, Issue 34, PP. 7417-742 (англ.)
- ↑ Mild and regioselective oxidative bromination of anilines using potassium bromide and sodium perborate. Tetrahedron Letters. — V. 41, Issue 13, PP. 2083-2085 (англ.)
- ↑ Potassium bromide, an anticonvulsant, is effective at alleviating seizures in the Drosophila bang-sensitive mutant bang senseless. Brain Research. — V. 1020, Issues 1-2, PP. 45-52 (англ.)
Литература
- Рабинович В.А., Хавин З.Я. «Краткий химический справочник». Л.: Химия, 1977.
- Некрасов Б.В. «Основы общей химии». В 2-ух томах., М.:Химия, 1973.
См. также
- Бромид натрия
- Инфракрасная спектроскопия
|
Растворимость кислот, оснований и солей в воде |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
Соединения калия |
|---|
|
Азид калия (KN3) • Амид калия (KNH2) • Ацесульфам (C4H4KNO4S) • Ацетат калия (CH3COOK) • Ацетиленид калия (K2C2) • Бензоат тригидрат калия (Брутто-формула:C7H11KO5) • Бромат калия (KBrO3) • Бромид калия (KBr) • Гексагидроксоплатинат(IV) калия (K2[Pt(OH)6]) • Гексагидроксостибат калия (K[Sb(OH)6]) • Гексанитрокобальтат(III) калия (K3[Co(NO3)6]) • Гексаоксибензол калия (C6(OK)6) • Гексафторогерманат калия (K2[GeF6]) • Гексафторокупрат(III) калия (K3CuF6) • Гексафторомолибдат(III) калия (K3MoF6) • Гексафтороплатинат(V) калия (K[PtF6]) • Гексафторосиликат(IV) калия (K2[SiF6]) • Гексафторфосфат калия (KPF6) • Гексахлоропалладат(IV) калия (K2[PdCl6]) • Гексахлороплатинат(IV) калия (K2[PtCl6]) • Гексахлоростаннат(IV) калия (K2[SnCl6]) • Гексахлорплатинат калия (K2PtCl6) • Гексацианоферрат(II) калия (K4[Fe(CN)6]) • Гексацианоферрат(II) тригидрат калия (K4[Fe(CN)6]•3H2O) • Гексацианоферрат(III) калия (K3[Fe(CN)6]) • Гептафторониобат(V) калия (K2[NbF7]) • Гидрид калия (KH) • Гидрокарбонат калия (KHCO3) • Гидроксид калия (KOH) • Гидроортофосфат калия (K2HPO4) • Гидросульфат калия (KHSO4) • Гидросульфид калия (KHS) • Гидросульфит калия (KHSO3) • Гидрофторид калия (KHF2) • Дигидроарсенат калия (KH2AsO4) • Дигидроортофосфат калия (KH2PO4) • Динитрамид калия (KN(NO2)2) • Дисульфат калия (K2S2O7) • Дисульфит калия (K2S2O5) • Дисульфонатнитроксил калия ((KO3S)2NO) • Дитионат калия (K2S2O6) • Дихлородиамминпалладий ([Pd(NH3)2]Cl2) • Дихромат калия (K2Cr2O7) • Дицианоаргентат(I) калия (K[Ag(СN)2]) • Дицианоаурат(I) калия (K[Au(СN)2]) • Иодат калия (KIO3) • Иодид калия (KI) • Карбонат калия (K2CO3) • Манганат калия (K2MnO4) • Метаванадат калия (KVO3) • Метасиликат калия (K2SiO3) • Метафосфат калия (KPO3) • Надпероксид калия (KO2 или K2O4) • Нитрат калия (KNO3) • Нитрит калия (KNO2) • Озонид калия (KO3) • Оксалат калия (K2C2O4) • Оксалат моногидрат калия (K2C2O4•H2O) • Оксид калия (K2O) • Октахлоромолибдат калия (K4Mo2Cl8) • Ортофосфат калия (K3PO4) • Пербромат калия (KBrO4) • Периодат калия (KIO4) • Перманганат калия (KMnO4) • Пероксид калия (K2O2) • Пероксодикарбонат калия (К2С2О6) • Пероксомоносульфат калия (K2SO5) • Пероксодисульфат калия (K2S2O6(O2)) • Перренат калия (KReO4) • Перхлорат калия (KClO4) • Полисульфиды калия (K2Sn) • Политионаты калия (K2SnO6) • Сегнетова соль (NaKC4H4O6) • Соль Джонсона (K[I(I)2]•H2O) • Соль Цейзе (K[Pt(C2H4)Cl3]•H2O) • Сорбат калия (C6H7KO2) • Сульфат гидрат калия-гадолиния • Сульфат гидрат калия-кальция (K2Ca(SO4)2•H2O) • Сульфат калия (K2SO4) • Сульфат калия-кальция (K2Ca(SO4)2) • Сульфат хрома(III)-калия (KCr(SO4)2) Сульфид калия (K2S) • Сульфит дигидрат калия (K2SO3•2H2O) • Сульфит калия (K2SO3) • Тетрагидроалюминат калия (KAlH4) • Тетрагидроксодиоксоосмат(VI) калия (K2[OsO2(OH)4]) • Тетрагидроортотеллурат калия (K2H4TeO6) • Тетраиодомеркурат(II) калия (K2[HgI4]) • Тетранитроплатинат(II) калия (K2[Pt(NO2)4]) • Тетраоксорутенат(VI) калия (K2RuO4) • Тетрапероксохромат(V) калия (K3CrO8) • Тетрасиликат калия (K2Si4O9•H2O) • Тетрахлоромолибдат(III) калия (KMoCl4) • Тетрахлоропалладат(II) калия (K2[PdCl4]) • Тетрахлороплатинат(II) калия (K2[PtCl4]) • Тетрахлороферрат(III) калия (K[FeCl4]) • Тетрахлорплатинат калия (K2PtCl4) • Тетрацианоникколат(II) калия (K2[Ni(CN)4]) • Тетрацианоплатинат(II) калия (K2[Pt(CN)4]) • Тиосульфат калия (K2SO3S) • Тиоцианат калия (KSCN) • Феррат калия (K2FeO4) • Феррооксалат калия (K3[Fe(C2O4)3]) • Формиат калия (HCOOK) Фталимид калия • Фторид калия (KF) • Фторсульфит калия (KSO2F) • Хлорат калия (KClO3) • Хлорид калия (KCl) • Хлорид-триэтилалюминий калия ((C2H5)3Al•KCl) • Хромат калия (K2CrO4) • Хромит калия (KCrO2) • Цианат калия (KOCN) • Цианид калия (KCN) • Цианоаурат калия (K[Au(CN)2] • Этилксантогенат калия (C2H5OC(S)SK) • |
Содержание
- Структурная формула
- Русское название
- Английское название
- Латинское название вещества Калия бромид
- Брутто формула
- Фармакологическая группа вещества Калия бромид
- Нозологическая классификация
- Код CAS
- Фармакологическое действие
- Характеристика
- Фармакология
- Применение вещества Калия бромид
- Противопоказания
- Побочные действия вещества Калия бромид
- Взаимодействие
- Передозировка
- Способ применения и дозы
- Особые указания
- Торговые названия с действующим веществом Калия бромид
Структурная формула
Русское название
Калия бромид
Английское название
Potassium bromide
Латинское название вещества Калия бромид
Kalii bromidum (род. Kalii bromidi)
Фармакологическая группа вещества Калия бромид
Фармакологическое действие
—
седативное.
Характеристика
Бесцветные или белые блестящие кристаллы, или мелкокристаллический порошок соленого вкуса. Растворим в воде (1:1,7), мало — в этаноле.
Фармакология
Концентрирует и усиливает процессы торможения в коре головного мозга, восстанавливает равновесие между процессами возбуждения и торможения в ЦНС. Обладает противосудорожной активностью.
Хорошо всасывается из ЖКТ. Распределяется главным образом экстрацеллюлярно. Концентрация в плазме уменьшается в 2 раза приблизительно в течение 12 дней. Выводится в основном почками в течение длительного времени, а также кишечником, потовыми и молочными железами. Кумулирует.
Применение вещества Калия бромид
Неврастения, невроз, истерия, повышенная раздражительность, бессонница, начальные формы гипертензии, эпилепсия, хорея.
Противопоказания
Гиперчувствительность, депрессия, гипотензия, анемия, дыхательная недостаточность, выраженный атеросклероз, печеночная и/или почечная недостаточность.
Побочные действия вещества Калия бромид
Явления бромизма: общая вялость, заторможенность, слабость, сонливость, замедление речи, ухудшение зрения, слуха, атаксия, апатия, ослабление памяти, раздражение и воспаление слизистых оболочек (насморк, кашель, бронхит, конъюнктивит, диарея), кожная сыпь (acne bromica); брадикардия; гастроэнтероколит, гастралгия, аллергические реакции.
Взаимодействие
Совместим с калия йодидом.
Передозировка
Симптомы: явления бромизма (хроническое отравление).
Лечение: отмена препарата и ускорение его выведения с мочой путем назначения натрия хлорида (10–20 г/сут), больших количеств воды (3–5 л/сут) и мочегонных средств.
Способ применения и дозы
Внутрь, до еды. Взрослым по 0,1–1 г 3–4 раза в сутки. Детям до 1 года — 0,05–0,1 г, до 2 лет — 0,15 г, 3–4 лет — 0,2 г, 5–6 лет — 0,25 г, 7–9 лет — 0,3 г, 10–14 лет — 0,4–0,5 г.
Эпилепсия — взрослым по 1–2 г, с постепенным увеличением дозы каждую неделю на 1–2 г до 6–8 г /сут.
Особые указания
Ограничение потребления поваренной соли усиливает терапевтический эффект. Во время лечения необходимо регулярное опорожнение кишечника, полоскание рта и частое мытье кожи (прием ванны, душа).
Торговые названия с действующим веществом Калия бромид
| Бромид калия | |
|---|---|
 |
|
 |
|
| Общие | |
| Систематическое наименование (b) |
Бромид калия |
| Хим. формула (b) | KBr |
| Физические свойства | |
| Состояние (b) | бесцветные кристаллы |
| Молярная масса (b) | 119,01 г/моль (b) |
| Плотность (b) | 2,75 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления (b) | 734 °C |
| • кипения (b) | 1435 °C |
| Химические свойства | |
| Растворимость (b) | |
| • в воде | 65,220, 94,680 г/100 мл |
| Классификация | |
| Рег. номер CAS (b) | 7758-02-3 |
| PubChem (b) | 253877 |
| Рег. номер EINECS (b) | 231-830-3 |
| SMILES (b) |
[K+].[Br-] |
| InChI (b) |
InChI=1S/BrH.K/h1H;/q;+1/p-1 IOLCXVTUBQKXJR-UHFFFAOYSA-M |
| RTECS (b) | TS7650000 |
| ChEBI | 32030 |
| ChemSpider (b) | 22854 |
| Безопасность | |
| Токсичность (b) | малотоксичен |
| Краткие характер. опасности (b) (H) |
H319 |
| Меры предостор. (b) (P) |
P305+P351+P338, P337+P313 |
| Сигнальное слово | осторожно |
| Пиктограммы СГС (b) | |
| NFPA 704 (b) |
 0 1 0 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Броми́д ка́лия (калий бромистый) — неорганическое соединение (b) , калиевая (b) соль бромоводородной кислоты (b) с химической формулой KBr. Имеет вид бесцветного кристаллического (b) вещества.
Получение
В промышленности
- Для промышленных нужд бромид калия получают с помощью взаимодействия карбоната калия (b) со смешанным бромидом железа (II, III) (b) Fe3Br8[1]:
В лаборатории
- В лабораторных условиях можно получать бромид калия с помощью взаимодействия гидроксида калия (b) , брома (b) и аммиака (b) :
- Прямой синтез при комнатной температуре:
- Замещение бромом (b) менее активного галогена (иода (b) ):
- Термическое разложение при температуре выше 434°С бромата калия (b) :
Физические свойства
Выглядит как бесцветные кристаллы, имеющие кристаллическую решётку кубического типа, аналогичную хлориду натрия (b) (a = 0,6596 нм, z = 4, пространственная группа Fm3m). При нагреве до 298 °C и под давлением 1,7 ГПа кристаллическая решётка переходит в другую кубическую модификацию типа хлорида цезия (b) . Имеет температуру плавления 734 °C, кипит при 1435 °C. Плотность составляет 2,75 г/см3[2].
Дипольный момент (b) молекулы составляет 9,1 Дебая (b) .
Термодинамические величины
| Свойство | Значение |
|---|---|
| Стандартная энтальпия образования (b) (298 К) | -392,5 кДж/моль |
| Энтропия образования (b) (298 К) | 95,85 Дж/(моль·К) |
| Теплоёмкость (b) (298 К) | 52,07 Дж/(моль·К) |
| Энтальпия плавления | 29 кДж/моль[3] |
Растворимость
| Растворитель | Температура, °C | Растворимость, г/100 г растворителя |
|---|---|---|
| Ацетон (b) | 20 | 0,03 |
| Вода (b) | 0 | 53,5 |
| Вода | 10 | 59,5 |
| Вода | 20 | 65,2 |
| Вода | 25 | 68,1 |
| Вода | 30 | 70,9 |
| Вода | 40 | 75,8 |
| Вода | 60 | 85,5 |
| Вода | 80 | 94,6 |
| Вода | 100 | 103,3[4] |
| Вода | 150 | 127,3[4] |
| Вода | 200 | 153,2[4] |
| Глицерин (b) | 25 | 17,8 |
| Метанол (b) | 20 | 2,1 |
| Этанол (b) | 20 | 0,46 |
| Этанол | 55 | 0,54 |
Химические свойства
Бромид калия является типичной ионной солью (b) . При растворении в воде подвергается полной диссоциации (b) , при этом не гидролизуется (b) , поскольку образован сильным основанием (гидроксид калия (b) ) и сильной кислотой (бромоводородная кислота (b) ). Не образует кристаллогидратов. Не растворяется в концентрированной бромоводородной кислоте.
- Бром вытесняется более активными галогенами:
- В растворах могут протекать обычные обменные реакции:
- Проявляет восстановительные свойства:
- (конц. , кип.)
- (разб. )
- (конц. , кип.)
- С некоторыми бромидами в концентрированных растворах могут образовываться комплексные соединения (b) :
- Электролиз в горячем растворе:
Бромирующий агент
- Используется для селективного транс-бромирования кратных связей алкенов (b) и алкинов (b) в присутствии диацетокси йодбензола в системе дихлорметан (b) -вода[5]. Для цис-бромирования применяют систему церий-аммоний нитрат—бромид калия[6].
- Для монобромирования дезактивированных производных анилина (b) применяют окислительное бромирование бромидом калия и перборатом натрия[7].
Применение
- Используют как источник бромид-ионов для получения бромида серебра, который используется для изготовления фото (b) — и киноплёнок (b) .
- Применяется в составе фотографических проявителей (b) в качестве антивуалирующего вещества. По сравнению с другими антивуалентами практически не поднимает контраст изображения[8].
- Для изучения ИК-спектров (b) жидких веществ часто применяют технологию помещения вещества между пластинками из бромида калия (так называемую «таблетку»). Бромид калия не поглощает ИК-излучение в достаточно широком интервале длин волн (от 0,25 мкм до 25 мкм), что позволяет использовать его для этих целей.
Физиологическое действие
Широко использовалось как противосудорожное (b) и седативное (b) вещество в конце XIX и начале XX веков. Его действие основано на физиологическом влиянии бромид-иона (бромид натрия (b) менее эффективен). В настоящее время бромид калия применяется в качестве ветеринарного препарата — как противосудорожное лекарство для собак и кошек.
В разбавленных водных растворах бромид калия придаёт раствору сладкий вкус, при более высоких концентрациях раствор обладает горьким вкусом (эти эффекты обусловлены главным образом действием иона калия).
При высокой концентрации бромид калия сильно раздражает слизистую оболочку желудка (b) , что приводит к тошноте и рвоте.
Смертельная доза LD50 (b) равна 3070 мг/кг.
Ссылки
- Инфракрасная спектроскопия (англ.)
Примечания
- ↑ Бромид калия на сайте Chemport.ru. Дата обращения: 7 мая 2009. Архивировано 31 июля 2013 года.
- ↑ Ксензенко, 1990.
- ↑ Рабинович В. А., Хавин З. Я. «Краткий химический справочник» Л.: Химия, 1977
- 1 2 3 При повышенном давлении.
- ↑ Efficient Bromination of Alkenes and Alkynes Using Potassium Bromide and Diacetoxy Iodobenzene. Synthetic Communications, V. 39, Issue 2, PP. 220—227 (англ.)
- ↑ An efficient bromination of alkenes using cerium(IV) ammonium nitrate (CAN) and potassium bromide. Tetrahedron V. 57, Issue 34, PP. 7417-742 (недоступная ссылка) (англ.)
- ↑ Mild and regioselective oxidative bromination of anilines using potassium bromide and sodium perborate. Tetrahedron Letters. — V. 41, Issue 13, PP. 2083—2085 (недоступная ссылка) (англ.)
- ↑ Гурлев, 1988, с. 265—266.
Литература
- Гурлев Д.С. Справочник по фотографии (обработка фотоматериалов). — К.: Тэхника, 1988.
- Ксензенко В. И., Стасиневич Д. С. Калия бромид // Химическая энциклопедия (b) : в 5 т. / Гл. ред. И. Л. Кнунянц (b) . — М.: Советская энциклопедия (b) , 1990. — Т. 2: Даффа — Меди. — 671 с. — 100 000 экз. — ISBN 5-85270-035-5.
- Лидин Р. А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. 3-е изд., испр. / Р. А. Лидин, В. А. Молочко, Л. Л. Андреева; Под ред. Р. А. Лидина. — М.: Химия, 200. 480 с.: ил.
- Некрасов Б. В. «Основы общей химии». В 2 томах. М.: Химия, 1973.
- Рабинович В. А., Хавин З. Я. «Краткий химический справочник». Л.: Химия, 1977.
Бромид калия
Поиск химических веществ по названиям или формулам.
Категории веществ
|
Справочник содержит названия веществ и описания химических формул (в т.ч. структурные формулы и скелетные формулы). Введите часть названия или формулу для поиска: Языки: По умолчанию | Все возможные | Из списка | Бромид калия
Брутто-формула: Категории: PubChem CID: 253877 Названия Русский:
English:
German:
Ελληνικά:
Español:
French:
Italiano:
日本語:
Português:
中文:
Варианты формулы:
|

Содержание
- Получение
- В промышленности
- В лаборатории
- Растворимость
- Химические свойства
- Бромирующий агент
- Применение
- Физиологическое действие
Бромид калия — неорганическое соединение, калиевая соль бромоводородной кислоты с химической формулой KBr. Имеет вид бесцветного кристаллического вещества.
| Бромид калия | |
|---|---|
| Общие | |
| Систематическое наименование |
Бромид калия |
| Хим. формула | KBr |
| Физические свойства | |
| Состояние | бесцветные кристаллы |
| Молярная масса | 119,01 г/моль |
| Плотность | 2,75 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 734 °C |
| • кипения | 1435 °C |
| Химические свойства | |
| Растворимость | |
| • в воде | 65,220, 94,680 г/100 мл |
| Классификация | |
| Рег. номер CAS | 7758-02-3 |
| PubChem | 253877 |
| Рег. номер EINECS | 231-830-3 |
| SMILES |
[K+].[Br-] |
| InChI |
1S/BrH.K/h1H;/q;+1/p-1 IOLCXVTUBQKXJR-UHFFFAOYSA-M |
| RTECS | TS7650000 |
| ChEBI | 32030 |
| ChemSpider | 22854 |
| Безопасность | |
| Токсичность | малотоксичен |
| Пиктограммы ECB |  |
| NFPA 704 |
Получение
В промышленности
- Для промышленных нужд бромид калия получают с помощью взаимодействия карбоната калия со смешанным бромидом железа (II, III) Fe3Br8:
В лаборатории
- В лабораторных условиях можно получать бромид калия с помощью взаимодействия гидроксида калия, брома и аммиака:
- Прямой синтез при комнатной температуре:
- Замещение бромом менее активного галогена (иода):
- Термическое разложение при температуре выше 434°С бромата калия:
-
Свойство
ЗначениеСтандартная энтальпия образования (298 К)
-392,5 кДж/мольЭнтропия образования (298 К)
95,85 Дж/(моль·К)Теплоёмкость (298 К)
52,07 Дж/(моль·К)Энтальпия плавления
29 кДж/мольРастворимость
Растворитель Температура, °C Растворимость,
г/100 г растворителяАцетон 20 0,03 Вода 0 53,5 Вода 10 59,5 Вода 20 65,2 Вода 25 68,1 Вода 30 70,9 Вода 40 75,8 Вода 60 85,5 Вода 80 94,6 Вода 100 103,3 Вода 150 127,3 Вода 200 153,2 Глицерин 25 17,8 Метанол 20 2,1 Этанол 20 0,46 Этанол 55 0,54 Химические свойства
Бромид калия является типичной ионной солью. При растворении в воде подвергается полной диссоциации, при этом не гидролизуется, поскольку образован сильным основанием (гидроксид калия) и сильной кислотой (бромоводородная кислота). Не образует кристаллогидратов. Не растворяется в концентрированной бромоводородной кислоте.
- Бром вытесняется более активными галогенами:
- В растворах могут протекать обычные обменные реакции:
- Проявляет восстановительные свойства:
-
(конц.
, кип.)
(разб.
)
(конц.
, кип.)
- С некоторыми бромидами в концентрированных растворах могут образовываться комплексные соединения:
- Электролиз в горячем растворе:
Бромирующий агент
- Используется для селективного транс-бромирования кратных связей алкенов и алкинов в присутствии диацетокси йодбензола в системе дихлорметан-вода. Для цис-бромирования применяют систему церий-аммоний нитрат—бромид калия.
- Для монобромирования дезактивированных производных анилина применяют окислительное бромирование бромидом калия и перборатом натрия.
Применение
- Используют как источник бромид-ионов для получения бромида серебра, который используется для изготовления фото- и киноплёнок.
- Применяется в составе фотографических проявителей в качестве антивуалирующего вещества. По сравнению с другими антивуалентами практически не поднимает контраст изображения.
- Для изучения ИК-спектров жидких веществ часто применяют технологию помещения вещества между пластинками из бромида калия (так называемую «таблетку»). Бромид калия не поглощает ИК-излучение в достаточно широком интервале длин волн, что позволяет использовать его для этих целей.
Физиологическое действие
Широко используется как противосудорожное и седативное вещество в конце 19 и начале 20 веков. Его действие основано на физиологическом влиянии бромид-иона (бромид натрия менее эффективен). KBr в настоящее время используется в качестве ветеринарного препарата, как противосудорожное лекарство для собак и кошек.
В разбавленных водных растворах бромид калия придаёт раствору сладкий вкус, при более высоких концентрациях раствор обладает горьким вкусом (эти эффекты обусловлены главным образом действием иона калия).
При высокой концентрации бромид калия сильно раздражает слизистую оболочку желудка, что приводит к тошноте и рвоте.
Смертельная доза LD50 равна 3070 мг/кг.
Химическое название
Калиевая соль бромоводородной кислоты
Химические свойства
Согласно фармакопее, бромистый калий – это калиевая соль бромоводородной кислоты. По внешнему виду, это белые или бесцветные кристаллы, мелкий кристаллический порошок, на вкус соленый (сладкий в разбавленном растворе, горький – в концентрированном). Формула Бромида Калия достаточно простая: BrK. Судя по формуле, химическая связь в бромиде калия ионная. Вещество, при попадании в воду подвергается реакции диссоциации (не гидролиза), мало растворимо в этиловом спирте. Молекулярная масса хим. соединения = 119 грамм на моль. Если подробно описать механизм растворения в воде Бромида Калия, то можно отметить, что вещество подвергается полной диссоциации в связи с тем, что соль была образована сильной кислотой и сильным основанием.
Средство используется в качестве источника бромид-ионов, чтобы получить бромид серебра, который применяется при изготовлении кино- и фото пленки. С помощью Бромида Калия проводят ИК-спектроскопию жидких веществ. В медицине лекарство используют в качестве седативного и противосудорожного препарата (на данный момент активнее применяется в ветеринарии).
В каких продуктах содержится Калий?
Дефицит вещества в организме может привести к судорогам, мышечной слабость, сухости кожи и нездоровом виде волос, возникают проблемы с сердцем, сердечные приступы. Калий содержится в продуктах пчеловодства, яблочном уксусе, в бобовых культурах, картофеле, бананах, моркови, ржаном хлебе, дынях, сухофруктах и орехах. Суточная потребность для человека – 2 грамма. Бромид Калия не влияет на содержание калия в организме, он всего лишь оказывает успокаивающее действием на нервную систему.
Фармакологическое действие
Седативное.
Фармакодинамика и фармакокинетика
Лекарство усиливает процессы торможения в коре головного мозга, стабилизирует работу центральной нервной системы. Оказывает противосудорожное действие.
Соединение хорошо усваивается в пищеварительном тракте, связывается с белками плазмы. Выводится медленно, за 12 суток плазменная концентрация средства уменьшается в два раза. Экскретируется бромистый калий с помощью почек и кишечника, молочными и потовыми железами. Лекарство обладает способностью накапливаться в организме.
Показания к применению
Средство показано к приему:
- при неврастении, неврозах, бессоннице;
- пациентам с повышенной раздражительностью, истерией;
- при эпилепсии, хорее;
- на начальных этапах развития артериальной гипертензии.
Противопоказания
Бромид Калия противопоказан: при депрессии, аллергии на средство, пониженном артериальном давлении, атеросклерозе, при дыхательной, почечной или печеночной недостаточности.
Побочные действия
Во время лечения лекарством может возникнуть бромизм:
- заторможенность, общая слабость и вялость;
- замедленная речь, снижение слуха и зрения, апатия;
- атаксия, раздражение, апатия, провалы в памяти;
- высыпания на коже, воспалительные процессы на слизистой (ринит, бронхит, кашель, диарея, воспаление конъюнктивы), гастралгия, прочие аллергические реакции.
Бромид Калия, инструкция по применению (Способ и дозировка)
Сейчас препараты Бромида Калия применяются редко. Чаще всего средство выпускают в таблетированной форме для перорального приема или в виде раствора.
Дозировка для взрослого варьирует от 100 мг до 1 грамма, 3 или 4 раза в день.
Передозировка
При передозировке Бромида Калия усиливаются проявления бромизма. Показан прием хлорида натрия, по 10-20 грамм в сутки, салуретики, обильное питье. Летальная доза препарата составляет порядка 3 грамм на кг веса.
Взаимодействие
Лекарственное средство хорошо сочетается с йодидом калия.
Хлорид натрия (поваренная соль) ускоряет выведение лекарства с помощью почек.
Вещество усиливает эффекты от приема барбитуратов.
Особые указания
Во время лечения Бромидом Калия рекомендуется полоскать рот, регулярно опорожнять кишечник, часто принимать ванну или душ.
Для усиления эффекта от препарата можно ограничить потребление поваренной соли.
Инъекционное введение средства недопустимо. Может развиться сердечная недостаточность, нарушение проводимости миокарда.
Детям
Необходимо скорректировать дозировку.
Препараты, в которых содержится (Аналоги)
Торговое название вещества: Калия Бромид. Вещество содержится в сиропе Пертуссин и Пертуссин-Ч, Амтерсол, таблетках Адонис-Бром.
Отзывы
Отзывы оставляют в основном на сиропы от кашля, в состав которых входит это лекарство. Пациенты отмечаю низкую стоимость и эффективность препаратов.
Цена, где купить
Купить Бромид Калия в аптеке в чистом виде практически не возможно. Лекарство можно приобрести в таблетированной форме для применения в ветеринарной практике. Стоимость сиропа Амтерсол составляет порядка 40 рублей за 100 г флакон.



![{displaystyle {ce {2 KBr_{(aq)}{}+ CuBr2_{(aq)}-> K2[CuBr3]_{(aq)}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/733a7b020fbe4782cb5ab44b48be1442c745e608)




![mathsf{2KBr + CuBr_2 rightarrow K_2[CuBr_4]}](https://dic.academic.ru/dic.nsf/ruwiki/b5b836aa45ae02ac739a5bb29b38adde.png)

