The standard enthalpy of reaction (denoted 

For a generic chemical reaction
the standard enthalpy of reaction 

In this equation, 



Standard states can be defined at any temperature and pressure, so both the standard temperature and pressure must always be specified. Most values of standard thermochemical data are tabulated at either (25°C, 1 bar) or (25°C, 1 atm). [2]
For ions in aqueous solution, the standard state is often chosen such that the aqueous H+ ion at a concentration of exactly 1 mole/liter has a standard enthalpy of formation equal to zero, which makes possible the tabulation of standard enthalpies for cations and anions at the same standard concentration. This convention is consistent with the use of the standard hydrogen electrode in the field of electrochemistry. However, there are other common choices in certain fields, including a standard concentration for H+ of exactly 1 mole/(kg solvent) (widely used in chemical engineering) and 
Introduction[edit]
Two initial thermodynamic systems, each isolated in their separate states of internal thermodynamic equilibrium, can, by a thermodynamic operation, be coalesced into a single new final isolated thermodynamic system. If the initial systems differ in chemical constitution, then the eventual thermodynamic equilibrium of the final system can be the result of chemical reaction. Alternatively, an isolated thermodynamic system, in the absence of some catalyst, can be in a metastable equilibrium; introduction of a catalyst, or some other thermodynamic operation, such as release of a spark, can trigger a chemical reaction. The chemical reaction will, in general, transform some chemical potential energy into thermal energy. If the joint system is kept isolated, then its internal energy remains unchanged. Such thermal energy manifests itself, however, in changes in the non-chemical state variables (such as temperature, pressure, volume) of the joint systems, as well as the changes in the mole numbers of the chemical constituents that describe the chemical reaction.
Internal energy is defined with respect to some standard state. Subject to suitable thermodynamic operations, the chemical constituents of the final system can be brought to their respective standard states, along with transfer of energy as heat or through thermodynamic work, which can be measured or calculated from measurements of non-chemical state variables. Accordingly, the calculation of standard enthalpy of reaction is the most established way of quantifying the conversion of chemical potential energy into thermal energy.
Enthalpy of reaction for standard conditions defined and measured[edit]
The standard enthalpy of a reaction is defined so as to depend simply upon the standard conditions that are specified for it, not simply on the conditions under which the reactions actually occur. There are two general conditions under which thermochemical measurements are actually made.[3]
- (a) Constant volume and temperature: heat
, where
(sometimes written as
) is the internal energy of the system
- (b) Constant pressure and temperature: heat
, where
is the enthalpy of the system
The magnitudes of the heat effects in these two conditions are different. In the first case the volume of the system is kept constant during the course of the measurement by carrying out the reaction in a closed and rigid container, and as there is no change in the volume no work is involved. From the first law of thermodynamics, 


The thermal change that occurs in a chemical reaction is only due to the difference between the sum of internal energy of the products and the sum of the internal energy of reactants. We have
This also signifies that the amount of heat absorbed at constant volume could be identified with the change in the thermodynamic quantity internal energy.
At constant pressure on the other hand, the system is either kept open to the atmosphere or confined within a container on which a constant external pressure is exerted and under these conditions the volume of the system changes.
The thermal change at a constant pressure not only involves the change in the internal energy of the system but also the work performed either in expansion or contraction of the system. In general the first law requires that
(work)
If 
Assuming that the change in state variables is due solely to a chemical reaction, we have
As enthalpy or heat content is defined by 
By convention, the enthalpy of each element in its standard state is assigned a value of zero.[4] If pure preparations of compounds or ions are not possible, then special further conventions are defined. Regardless, if each reactant and product can be prepared in its respective standard state, then the contribution of each species is equal to its molar enthalpy of formation multiplied by its stoichiometric coefficient in the reaction, and the enthalpy of reaction at constant (standard) pressure 
As shown above, at constant pressure the heat of the reaction is exactly equal to the enthalpy change, 
Variation with temperature or pressure[edit]
The variation of the enthalpy of reaction with temperature is given by Kirchhoff’s Law of Thermochemistry, which states that the temperature derivative of ΔH for a chemical reaction is given by the difference in heat capacity (at constant pressure) between products and reactants:
.
Integration of this equation permits the evaluation of the heat of reaction at one temperature from measurements at another temperature.[5][6]
Pressure variation effects and corrections due to mixing are generally minimal unless a reaction involves non-ideal gases and/or solutes, or is carried out at extremely high pressures. The enthalpy of mixing for a solution of ideal gases is exactly zero; the same is true for a reaction where the reactants and products are pure, unmixed components. Contributions to reaction enthalpies due to concentration variations for solutes in solution generally must be experimentally determined on a case by case basis, but would be exactly zero for ideal solutions since no change in the solution’s average intermolecular forces as a function of concentration is possible in an ideal solution.
Subcategories[edit]
In each case the word standard implies that all reactants and products are in their standard states.
- Standard enthalpy of combustion is the enthalpy change when one mole of an organic compound reacts with molecular oxygen (O2) to form carbon dioxide and liquid water. For example, the standard enthalpy of combustion of ethane gas refers to the reaction C2H6 (g) + (7/2) O2 (g) → 2 CO2 (g) + 3 H2O (l).
- Standard enthalpy of formation is the enthalpy change when one mole of any compound is formed from its constituent elements in their standard states. The enthalpy of formation of one mole of ethane gas refers to the reaction 2 C (graphite) + 3 H2 (g) → C2H6 (g).
- Standard enthalpy of hydrogenation is defined as the enthalpy change observed when one mole of an unsaturated compound reacts with an excess of hydrogen to become fully saturated. The hydrogenation of one mole of acetylene yields ethane as a product and is described by the equation C2H2 (g) + 2 H2 (g) → C2H6 (g).
- Standard enthalpy of neutralization is the change in enthalpy that occurs when an acid and base undergo a neutralization reaction to form one mole of water. For example in aqueous solution, the standard enthalpy of neutralization of hydrochloric acid and the base magnesium hydroxide refers to the reaction HCl (aq) + 1/2 Mg(OH)2 → 1/2 MgCl2 (aq) + H2O(l).
Evaluation of reaction enthalpies[edit]
There are several methods of determining the values of reaction enthalpies, involving either measurements on the reaction of interest or calculations from data for related reactions.
For reactions which go rapidly to completion, it is often possible to measure the heat of reaction directly using a calorimeter. One large class of reactions for which such measurements are common is the combustion of organic compounds by reaction with molecular oxygen (O2) to form carbon dioxide and water (H2O). The heat of combustion can be measured with a so-called bomb calorimeter, in which the heat released by combustion at high temperature is lost to the surroundings as the system returns to its initial temperature.[7][8] Since enthalpy is a state function, its value is the same for any path between given initial and final states, so that the measured ΔH is the same as if the temperature stayed constant during the combustion.[9]
For reactions which are incomplete, the equilibrium constant can be determined as a function of temperature. The enthalpy of reaction is then found from the van ‘t Hoff equation as 


It is also possible to evaluate the enthalpy of one reaction from the enthalpies of a number of other reactions whose sum is the reaction of interest, and these not need be formation reactions. This method is based on Hess’s law, which states that the enthalpy change is the same for a chemical reaction which occurs as a single reaction or in several steps. If the enthalpies for each step can be measured, then their sum gives the enthalpy of the overall single reaction. [11]
Finally the reaction enthalpy may be estimated using bond energies for the bonds which are broken and formed in the reaction of interest. This method is only approximate, however, because a reported bond energy is only an average value for different molecules with bonds between the same elements.[12]
References[edit]
- ^ Petrucci, Ralph H.; Harwood, William S.; Herring, F. Geoffrey (2002). General Chemistry (8th ed.). Prentice Hall. p. 247. ISBN 0-13-014329-4.
- ^ Tinoco, Ignacio Jr.; Sauer, Kenneth; Wang, James C. (1995). Physical Chemistry: Principles and Applications in Biological Sciences (3rd ed.). Prentice-Hall. p. 125. ISBN 0-13-186545-5.
- ^ a b c d Tinoco, Ignacio Jr.; Sauer, Kenneth; Wang, James C. (1995). Physical Chemistry: Principles and Applications in Biological Sciences (3rd ed.). Prentice-Hall. p. 44. ISBN 0-13-186545-5.
- ^ a b Tinoco, Ignacio Jr.; Sauer, Kenneth; Wang, James C. (1995). Physical Chemistry: Principles and Applications in Biological Sciences (3rd ed.). Prentice-Hall. p. 48. ISBN 0-13-186545-5.
- ^ Laidler K.J. and Meiser J.H., «Physical Chemistry» (Benjamin/Cummings 1982), p.62
- ^ Atkins P. and de Paula J., «Atkins’ Physical Chemistry» (8th edn, W.H. Freeman 2006), p.56
- ^ Petrucci, Ralph H.; Harwood, William S.; Herring, F. Geoffrey (2002). General Chemistry (8th ed.). Prentice Hall. pp. 227–229. ISBN 0-13-014329-4.
- ^ Engel, Thomas; Reid, Philip (2006). Physical Chemistry. Pearson Benjamin Cummings. pp. 72–73. ISBN 0-8053-3842-X.
- ^ Engel and Reid p.65
- ^ Chang, Raymond; Thoman, Jr., John W. (2014). Physical Chemistry for the Chemical Sciences. University Science Books. pp. 356–360.
- ^ Petrucci, Harwood and Herring, pages 241–243
- ^ Petrucci, Harwood and Herring, pages 422–423
The standard enthalpy of reaction (denoted 

For a generic chemical reaction
the standard enthalpy of reaction 

In this equation, 



Standard states can be defined at any temperature and pressure, so both the standard temperature and pressure must always be specified. Most values of standard thermochemical data are tabulated at either (25°C, 1 bar) or (25°C, 1 atm). [2]
For ions in aqueous solution, the standard state is often chosen such that the aqueous H+ ion at a concentration of exactly 1 mole/liter has a standard enthalpy of formation equal to zero, which makes possible the tabulation of standard enthalpies for cations and anions at the same standard concentration. This convention is consistent with the use of the standard hydrogen electrode in the field of electrochemistry. However, there are other common choices in certain fields, including a standard concentration for H+ of exactly 1 mole/(kg solvent) (widely used in chemical engineering) and 
Introduction[edit]
Two initial thermodynamic systems, each isolated in their separate states of internal thermodynamic equilibrium, can, by a thermodynamic operation, be coalesced into a single new final isolated thermodynamic system. If the initial systems differ in chemical constitution, then the eventual thermodynamic equilibrium of the final system can be the result of chemical reaction. Alternatively, an isolated thermodynamic system, in the absence of some catalyst, can be in a metastable equilibrium; introduction of a catalyst, or some other thermodynamic operation, such as release of a spark, can trigger a chemical reaction. The chemical reaction will, in general, transform some chemical potential energy into thermal energy. If the joint system is kept isolated, then its internal energy remains unchanged. Such thermal energy manifests itself, however, in changes in the non-chemical state variables (such as temperature, pressure, volume) of the joint systems, as well as the changes in the mole numbers of the chemical constituents that describe the chemical reaction.
Internal energy is defined with respect to some standard state. Subject to suitable thermodynamic operations, the chemical constituents of the final system can be brought to their respective standard states, along with transfer of energy as heat or through thermodynamic work, which can be measured or calculated from measurements of non-chemical state variables. Accordingly, the calculation of standard enthalpy of reaction is the most established way of quantifying the conversion of chemical potential energy into thermal energy.
Enthalpy of reaction for standard conditions defined and measured[edit]
The standard enthalpy of a reaction is defined so as to depend simply upon the standard conditions that are specified for it, not simply on the conditions under which the reactions actually occur. There are two general conditions under which thermochemical measurements are actually made.[3]
- (a) Constant volume and temperature: heat
, where
(sometimes written as
) is the internal energy of the system
- (b) Constant pressure and temperature: heat
, where
is the enthalpy of the system
The magnitudes of the heat effects in these two conditions are different. In the first case the volume of the system is kept constant during the course of the measurement by carrying out the reaction in a closed and rigid container, and as there is no change in the volume no work is involved. From the first law of thermodynamics, 


The thermal change that occurs in a chemical reaction is only due to the difference between the sum of internal energy of the products and the sum of the internal energy of reactants. We have
This also signifies that the amount of heat absorbed at constant volume could be identified with the change in the thermodynamic quantity internal energy.
At constant pressure on the other hand, the system is either kept open to the atmosphere or confined within a container on which a constant external pressure is exerted and under these conditions the volume of the system changes.
The thermal change at a constant pressure not only involves the change in the internal energy of the system but also the work performed either in expansion or contraction of the system. In general the first law requires that
(work)
If 
Assuming that the change in state variables is due solely to a chemical reaction, we have
As enthalpy or heat content is defined by 
By convention, the enthalpy of each element in its standard state is assigned a value of zero.[4] If pure preparations of compounds or ions are not possible, then special further conventions are defined. Regardless, if each reactant and product can be prepared in its respective standard state, then the contribution of each species is equal to its molar enthalpy of formation multiplied by its stoichiometric coefficient in the reaction, and the enthalpy of reaction at constant (standard) pressure 
As shown above, at constant pressure the heat of the reaction is exactly equal to the enthalpy change, 
Variation with temperature or pressure[edit]
The variation of the enthalpy of reaction with temperature is given by Kirchhoff’s Law of Thermochemistry, which states that the temperature derivative of ΔH for a chemical reaction is given by the difference in heat capacity (at constant pressure) between products and reactants:
.
Integration of this equation permits the evaluation of the heat of reaction at one temperature from measurements at another temperature.[5][6]
Pressure variation effects and corrections due to mixing are generally minimal unless a reaction involves non-ideal gases and/or solutes, or is carried out at extremely high pressures. The enthalpy of mixing for a solution of ideal gases is exactly zero; the same is true for a reaction where the reactants and products are pure, unmixed components. Contributions to reaction enthalpies due to concentration variations for solutes in solution generally must be experimentally determined on a case by case basis, but would be exactly zero for ideal solutions since no change in the solution’s average intermolecular forces as a function of concentration is possible in an ideal solution.
Subcategories[edit]
In each case the word standard implies that all reactants and products are in their standard states.
- Standard enthalpy of combustion is the enthalpy change when one mole of an organic compound reacts with molecular oxygen (O2) to form carbon dioxide and liquid water. For example, the standard enthalpy of combustion of ethane gas refers to the reaction C2H6 (g) + (7/2) O2 (g) → 2 CO2 (g) + 3 H2O (l).
- Standard enthalpy of formation is the enthalpy change when one mole of any compound is formed from its constituent elements in their standard states. The enthalpy of formation of one mole of ethane gas refers to the reaction 2 C (graphite) + 3 H2 (g) → C2H6 (g).
- Standard enthalpy of hydrogenation is defined as the enthalpy change observed when one mole of an unsaturated compound reacts with an excess of hydrogen to become fully saturated. The hydrogenation of one mole of acetylene yields ethane as a product and is described by the equation C2H2 (g) + 2 H2 (g) → C2H6 (g).
- Standard enthalpy of neutralization is the change in enthalpy that occurs when an acid and base undergo a neutralization reaction to form one mole of water. For example in aqueous solution, the standard enthalpy of neutralization of hydrochloric acid and the base magnesium hydroxide refers to the reaction HCl (aq) + 1/2 Mg(OH)2 → 1/2 MgCl2 (aq) + H2O(l).
Evaluation of reaction enthalpies[edit]
There are several methods of determining the values of reaction enthalpies, involving either measurements on the reaction of interest or calculations from data for related reactions.
For reactions which go rapidly to completion, it is often possible to measure the heat of reaction directly using a calorimeter. One large class of reactions for which such measurements are common is the combustion of organic compounds by reaction with molecular oxygen (O2) to form carbon dioxide and water (H2O). The heat of combustion can be measured with a so-called bomb calorimeter, in which the heat released by combustion at high temperature is lost to the surroundings as the system returns to its initial temperature.[7][8] Since enthalpy is a state function, its value is the same for any path between given initial and final states, so that the measured ΔH is the same as if the temperature stayed constant during the combustion.[9]
For reactions which are incomplete, the equilibrium constant can be determined as a function of temperature. The enthalpy of reaction is then found from the van ‘t Hoff equation as 


It is also possible to evaluate the enthalpy of one reaction from the enthalpies of a number of other reactions whose sum is the reaction of interest, and these not need be formation reactions. This method is based on Hess’s law, which states that the enthalpy change is the same for a chemical reaction which occurs as a single reaction or in several steps. If the enthalpies for each step can be measured, then their sum gives the enthalpy of the overall single reaction. [11]
Finally the reaction enthalpy may be estimated using bond energies for the bonds which are broken and formed in the reaction of interest. This method is only approximate, however, because a reported bond energy is only an average value for different molecules with bonds between the same elements.[12]
References[edit]
- ^ Petrucci, Ralph H.; Harwood, William S.; Herring, F. Geoffrey (2002). General Chemistry (8th ed.). Prentice Hall. p. 247. ISBN 0-13-014329-4.
- ^ Tinoco, Ignacio Jr.; Sauer, Kenneth; Wang, James C. (1995). Physical Chemistry: Principles and Applications in Biological Sciences (3rd ed.). Prentice-Hall. p. 125. ISBN 0-13-186545-5.
- ^ a b c d Tinoco, Ignacio Jr.; Sauer, Kenneth; Wang, James C. (1995). Physical Chemistry: Principles and Applications in Biological Sciences (3rd ed.). Prentice-Hall. p. 44. ISBN 0-13-186545-5.
- ^ a b Tinoco, Ignacio Jr.; Sauer, Kenneth; Wang, James C. (1995). Physical Chemistry: Principles and Applications in Biological Sciences (3rd ed.). Prentice-Hall. p. 48. ISBN 0-13-186545-5.
- ^ Laidler K.J. and Meiser J.H., «Physical Chemistry» (Benjamin/Cummings 1982), p.62
- ^ Atkins P. and de Paula J., «Atkins’ Physical Chemistry» (8th edn, W.H. Freeman 2006), p.56
- ^ Petrucci, Ralph H.; Harwood, William S.; Herring, F. Geoffrey (2002). General Chemistry (8th ed.). Prentice Hall. pp. 227–229. ISBN 0-13-014329-4.
- ^ Engel, Thomas; Reid, Philip (2006). Physical Chemistry. Pearson Benjamin Cummings. pp. 72–73. ISBN 0-8053-3842-X.
- ^ Engel and Reid p.65
- ^ Chang, Raymond; Thoman, Jr., John W. (2014). Physical Chemistry for the Chemical Sciences. University Science Books. pp. 356–360.
- ^ Petrucci, Harwood and Herring, pages 241–243
- ^ Petrucci, Harwood and Herring, pages 422–423
Дельта — буква, знак и его происхождение, применение в науке
В данной статье поговорим о знаке Дельта — что он из себя представляет, в каких сферах применяется и для чего вообще используется. Также вы узнаете, как выглядит знак и как его можно вставить в текст в такой программе, какой является Ворд из Майкрософт Оффис.
Знак Дельта применяется во многих сферах жизнедеятельности, к примеру, в физике, текстовых редакторах, формулах и других сферах. Чаще всего именно при печати учебной литературы, докладов и других видов документов применяют знак дельта, который имеется в разных версиях ВОРД от Виндовс и других приложениях для создания документов текстового формата на ПК.
О происхождения знака
Появление символа связано с греческими языком, но сама буква появилась от стародревнего финийского языка, в котором именовалась – далет, что обозначало («вход в дверь»). Выглядела «далет» как перевернутый влево равнобедренный треугольник. В греческом алфавите, была такая буква. Позже эта буква дала начало всем известной буквы латинского набора – D , которая и поныне есть во многих алфавитных рядах разных государств мира, к примеру, английский алфавит ее содержит.
Буква, которая служит аналогом в русском алфавите – Д, а вот символ везде одинаков и изображается, как геометрическая фигура, а именно треугольник с равными сторонами (Δ). Эта версия является заглавной, прописная версия выглядит немного иначе, представляя собой кружок с хвостиком, похожий на обозначение в физике плотности (δ).
Где применяется данный символ?
Кроме использования в правописании греков, символ начали активно применять в математике, геометрии, алгебре, физике, химии и географии.
Поговорим отдельно о применении дельта в каждых научных сферах:
- География. Дельта подразумевает в географическом смысле начальную часть реки, океана или моря, имеет смысловое, нежели символическое, буквенное понятие и восприятие. Почему именно область впадения реки принято так называть? Все просто, дело в форме данной области, если сделать снимок сверху, то отток реки будет иметь форму правильного треугольника, а символ дельта, как раз представляет собой такой геометрический объект. Ярчайшим представителем с выраженной дельтой является река Нил (Египет), которая впадает в Средиземное море, а также Амазонка с ее впадением в океан Атлантики.
- Применение в математике, алгебре, геометрии. Очень часто знак применяют в математической сфере для таких целей, как: 1) Приращение аргумента подразумевает под дельтой измененную переменную. К примеру, сложим 5 и 4 в итоге получим число 9. Дельтой будет являться увеличение 5 на 4. 2) Применение в теории вероятности по системе Лапласа. Такой метод преподают в ВУЗах, а не школах и в нем используют такой знак. 3) А также символ применяется при обозначении прямой и обратной матриц. 4) Дельта, буква, применяемая в написании формул (как письменным методом, так и через компьютер);
- Также в математике применяют прописную версию дельта. А именно, такой символ обозначает производную от числа. Обозначение выглядит следующим образом — δy/δx. 2) Используется для описания бесконечной функции-дельта. Бесконечная функция возможна, если все значения аргумента равны нулю. 3) При помощи δ еще обозначают символику Кронекера, символ равен всегда 1, при условии того, что все его индексы равны, либо нулевые при заданных условиях.
- Физика, астрономия, космогония. Граничащие меж собой научные дисциплины, все особо важные и по-своему интересные, в каждой из дисциплин можно встретить знак дельта. В физике связь всех производных осуществляется при помощи формул с интеграцией. К примеру, формула скорости, которая выглядит следующим образом — δS к δt , является отношением одной части к другой. В данном случае расстояние, которое преодолел объект, соотносится со временем, затраченном на преодоление. Вторая производная – это ускорение, где тоже важна взаимосвязь одной составляющей формулы к другой. В космологии и астрономии применяют формулы, расчеты с данным символом, только в прописном варианте.
Как ввести в «Ворд»?
Для вставки символа заходим в верхние меню редактора и ищем колонку «Вставка», наводим на колонку курсором мыши без нажатия правой кнопки. Высвечивается несколько наименования разделов, необходимо нажать на «Символ» , где можно путем перелистывания за счет колеса мыши искать необходимый знак, либо в строке поиска выбрать категорию (статистические или математические) и найти знак. Прописной или заглавный символ высветится в рабочей области окна вставки , вам только стоит нажать правой кнопкой мыши «вставить» или «окей».
Отзывы и Комментарии
Зарегистрируйтесь
Пройдите легкую процедуру регистрации, чтобы получить свой личный кабинет
Напишите первую статью
Все новые публикации отображаются на главной странице
Получайте постоянный доход
Мы платим не за объем, а за то, насколько ваши тексты интересны читателям
Содержание
- Знак дельта в Word и Excel
- Вставка в Word
- Вставка в Excel
- Знак дельта на Mac
- Как написать дельта на клавиатуре
- Вставка дельты через меню “Символ”
- Вставка дельты с помощью специального кода
- Где найти дельту?
- Метод 1: «Символ»
- Метод 2: «Код знака»
- Вставка в Word
- Вставка в Excel
- Знак дельта на Mac
- Вставка знака “дельта” в Microsoft Word
- Вставка знака “дельта” в Microsoft Word
- Вставка дельты через меню “Символ”
- Вставка дельты с помощью специального кода
- Дельта — буква, знак и его происхождение, применение в науке
- О происхождения знака
- Где применяется данный символ?
- Как ввести в «Ворд»?
- Вставка знака “дельта” в Microsoft Word
- Вставка дельти через меню “Символ”
- Вставка дельти за допомогою спеціального коду
- Символы “альфа”, “бета”, “гамма” и “омега” на компьютере: способы вставки в текст
- Вставка символа
- Копирование и вставка
- Сочетание клавиш
- Используем Unicode
- Как поставить знак дельта на клавиатуре?
- Как сделать значок Дельта?
- Как поставить знак треугольника?
- Как вставить символ дельта в Эксель?
- Что такое дельта в математике?
- Как выглядит символ дельта?
- Как пишется буква дельта?
- Как сделать пустой символ?
- Как в ворде сделать знак угла?
- Как в повер поинт вставить символ?
- Как поставить символ галочки в Excel?
- Как набрать знак в Excel?
- Что такое дельта в финансах?
- Что такое дельта определение?
- Что такое дельта реки?
Знак дельта в Word и Excel
Дельта — четвертая буква греческого алфавита. Символ верхнего регистра выглядит как треугольник — « Δ », а нижнего так « δ ». Рассмотрим способы печати знака в документе Ворд и в ячейках табличного редактора Excel.
В математике знак часто обозначает разницу между значениями температур или другими переменными. Например, начальное напряжение U1=220В, а конечное — U2=120В.
ΔU=U2–U1=220В-120В=100В
Вставка в Word
Рассмотрим 3 способа:
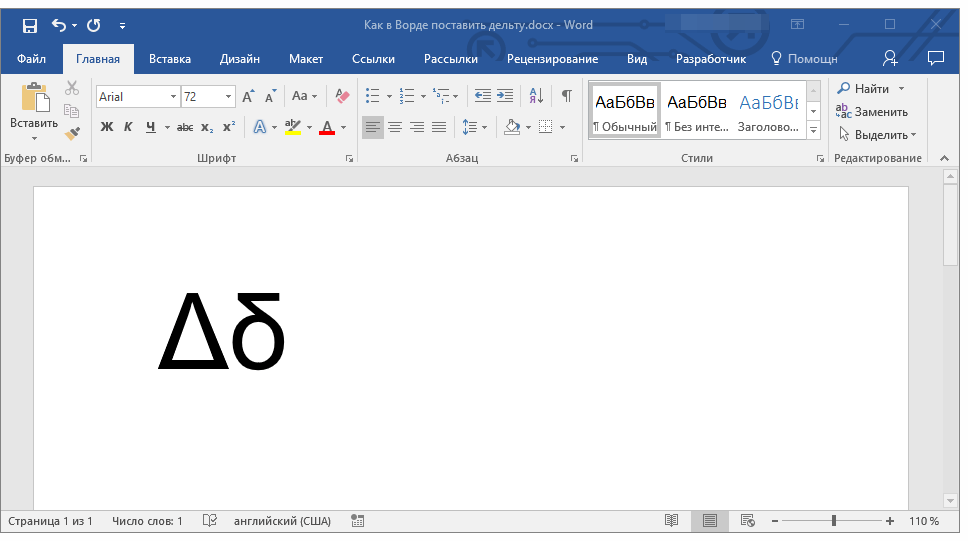
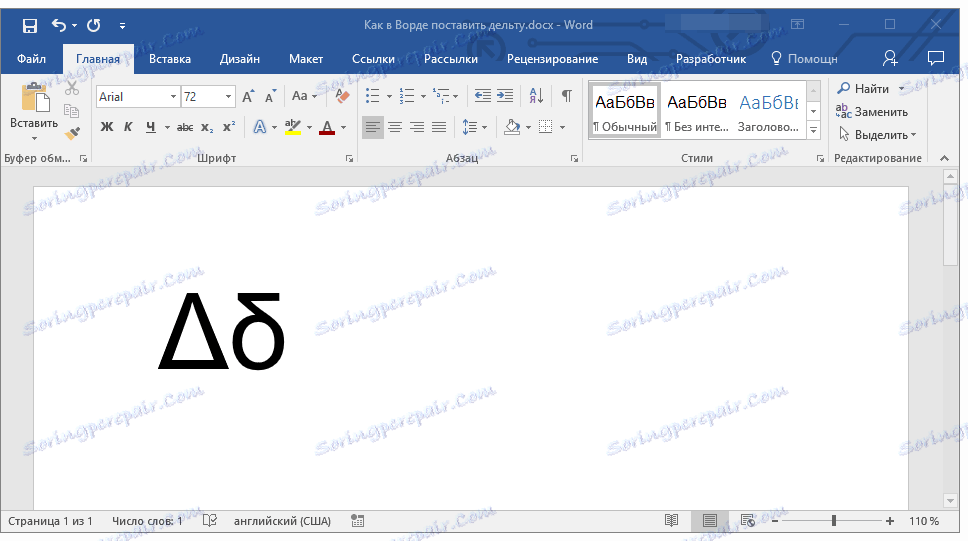
Напечатайте вместо знака английскую букву « D ». Выделите её и в верхнем меню на вкладке «Главная» установите шрифт «Symbol». Буква автоматически превратится в дельту.
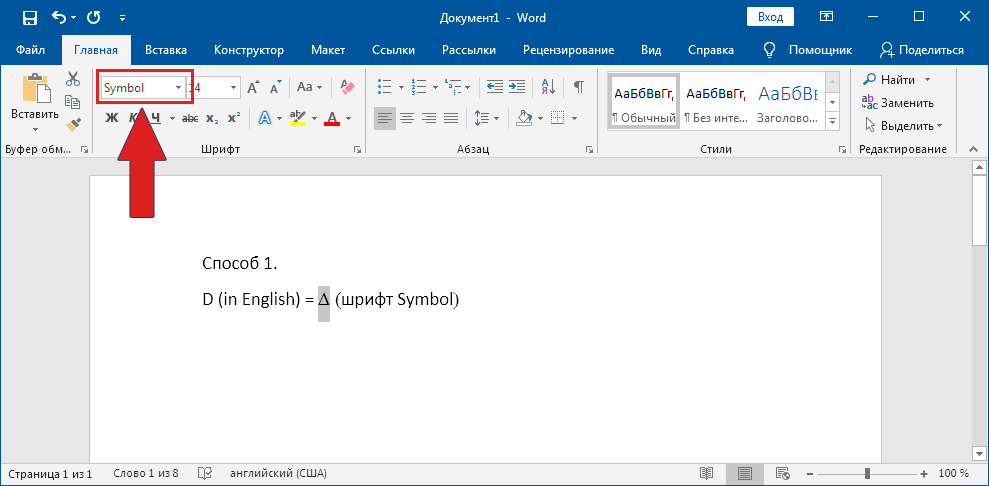
0 3 9 4 ➟ Alt + X = Δ
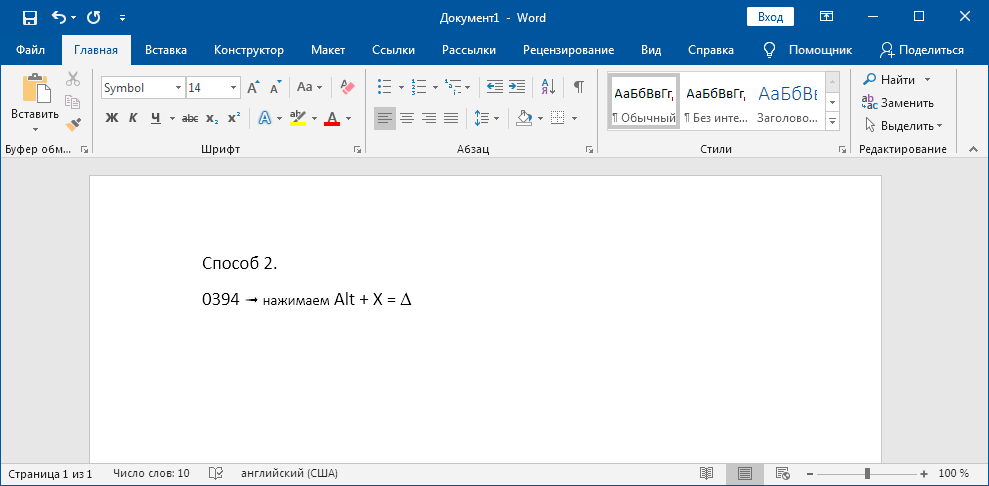
На полноценной клавиатуре с правым цифровым блоком клавиш можно воспользоваться следующим методом. Зажимаем Alt и набираем « 916 ». Вводить цифры надо именно на правом цифровом блоке.
Вставка в Excel
Предыдущие способы не походят в полной мере для применения в таблицах Excel. Например, конвертация буквы «D» в знак дельты может применяться только если в ячейке не будет других символов. Поэтому, самый лучший способ — воспользоваться вставкой.
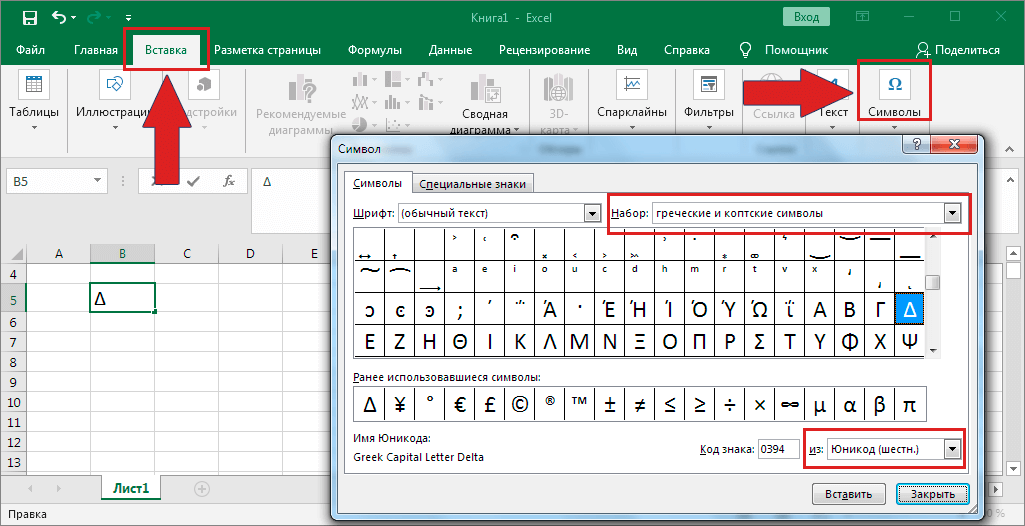
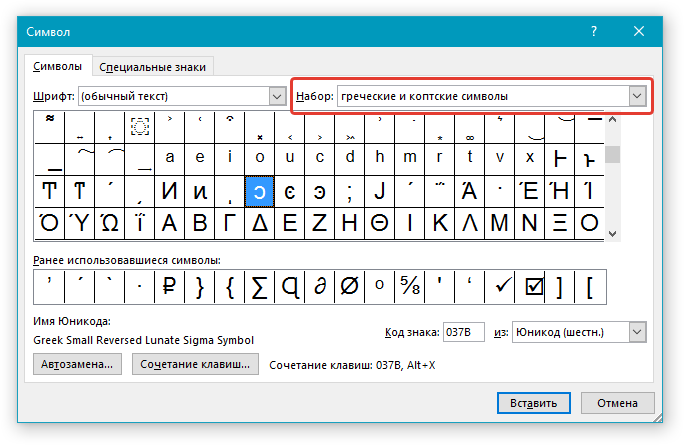
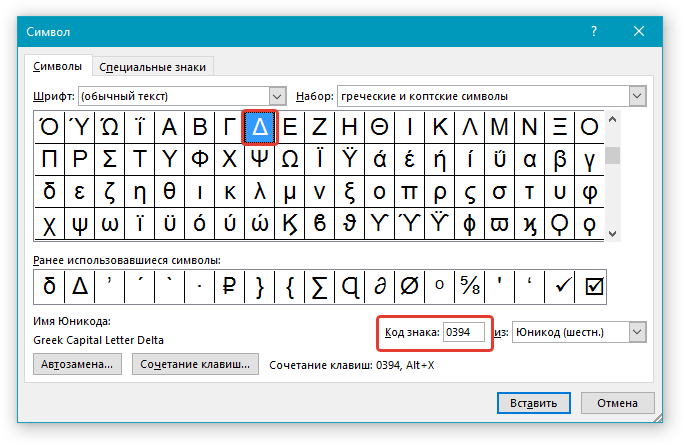
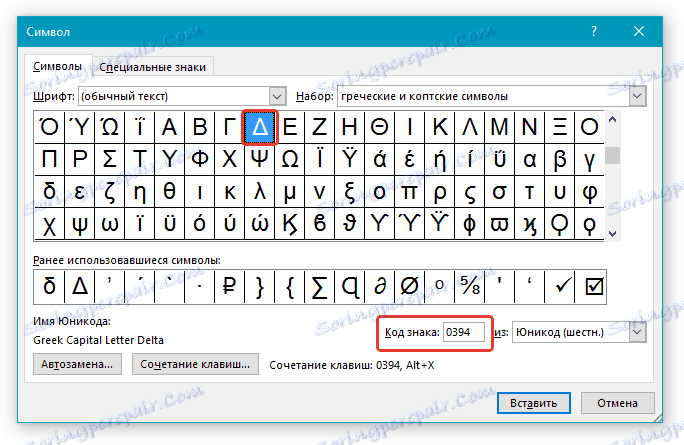
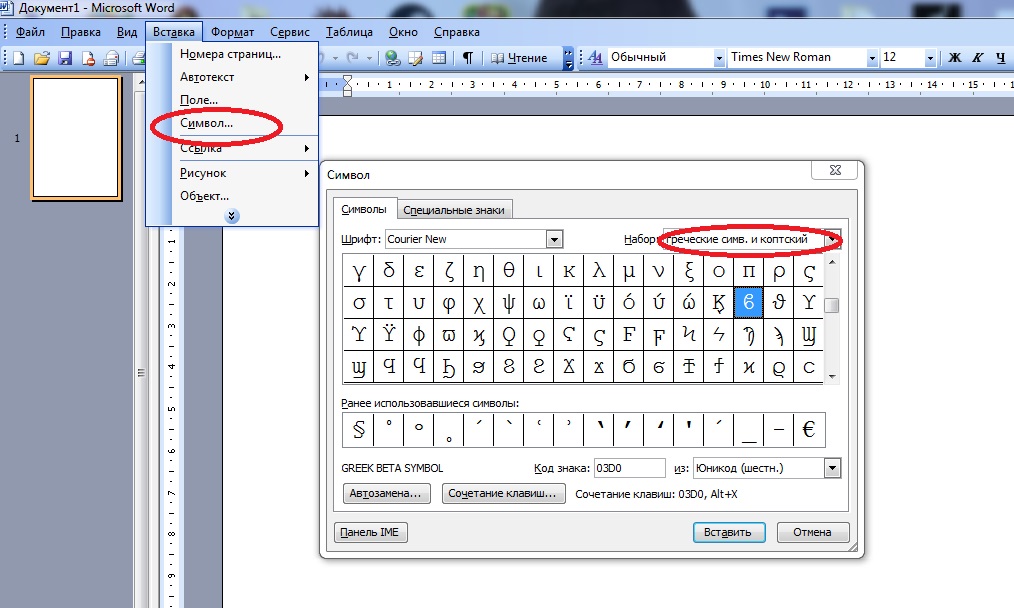
В верхнем меню на вкладке «Вставка» выбираем пункт «Символ». В открывшемся окне указываем набор — «греческие и коптские символы». Здесь будет нужный знак.
Если нет возможности выбора набора, то внизу окна в поле «из:» установите значение «Юникод (шестн.)»
Знак дельта на Mac
Полезные советы или нет — ждём обратную связь в комментариях.
Источник
Как написать дельта на клавиатуре
Когда возникает необходимость поставить какой-нибудь символ в документе MS Word, далеко не все пользователи знают, где его искать. Первый делом взгляд падает на клавиатуру, на которой не так уж много знаков и символов. Но, что делать в случае, если вам нужно поставить символ дельта в Ворде? На клавиатуре ведь его нет! Где же тогда его искать, как его напечатать в документе?
Если вы пользуетесь Word далеко не в первый раз, наверняка, знаете о разделе “Символы”, который есть в этой программе. Именно там можно найти огромный набор всевозможных знаков и символов, что называется, на все случаи жизни. Там же мы будем искать и знак дельты.
Вставка дельты через меню “Символ”
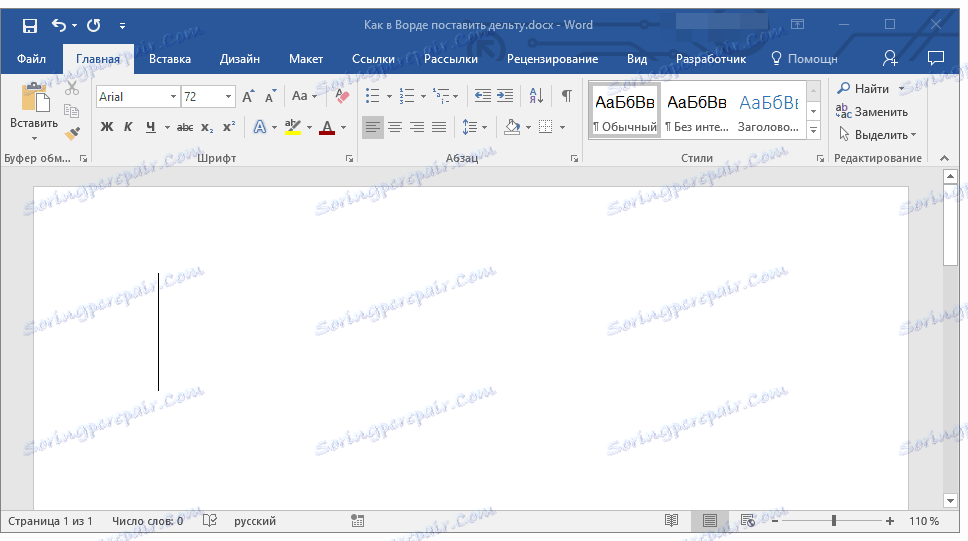
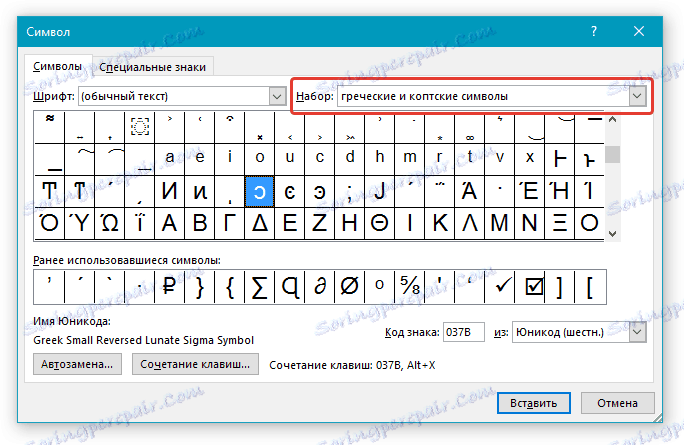
1. Откройте документ и кликните в том месте, где нужно поставить символ дельты.
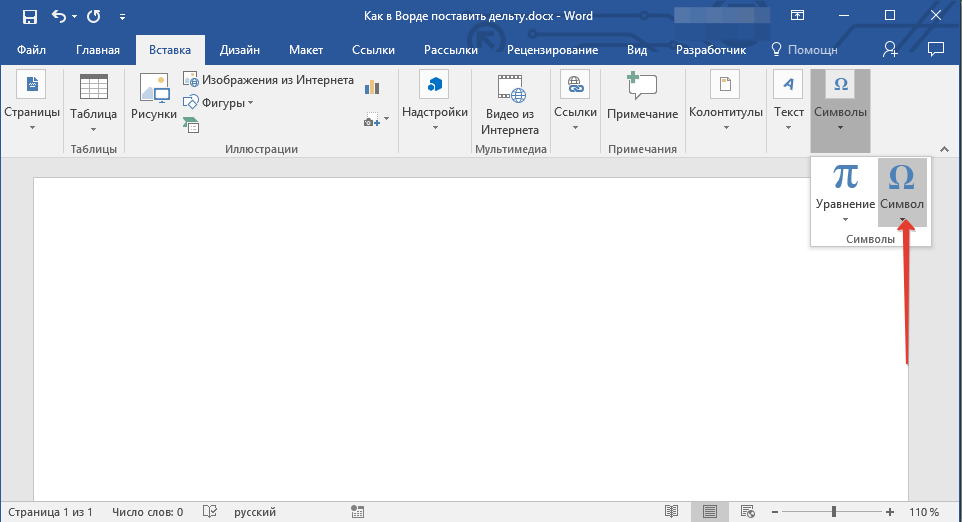
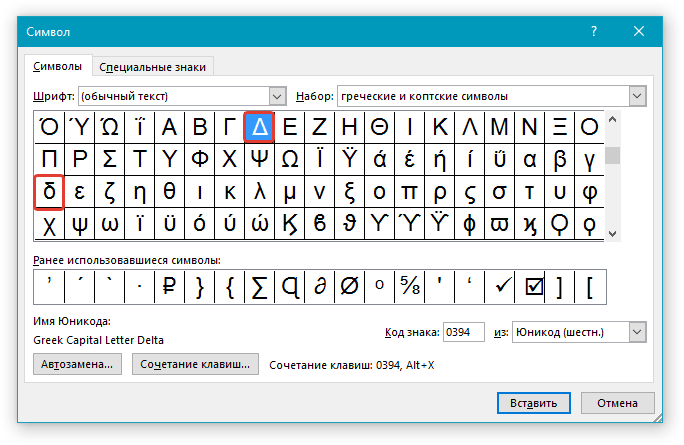
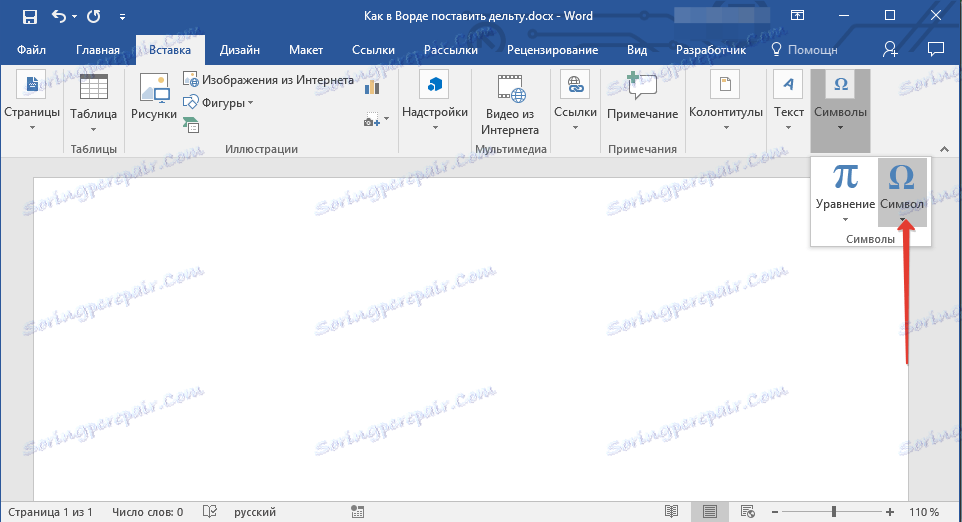
2. Перейдите во вкладку “Вставка”. Нажмите в группе “Символы” кнопку “Символ”.
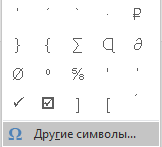
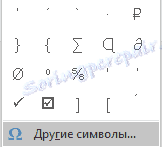
3. В выпадающем меню выберите пункт “Другие символы”.
4. В открывшемся окне вы увидите довольно большой список символов, в котором также можно найти и тот, что вам нужен.
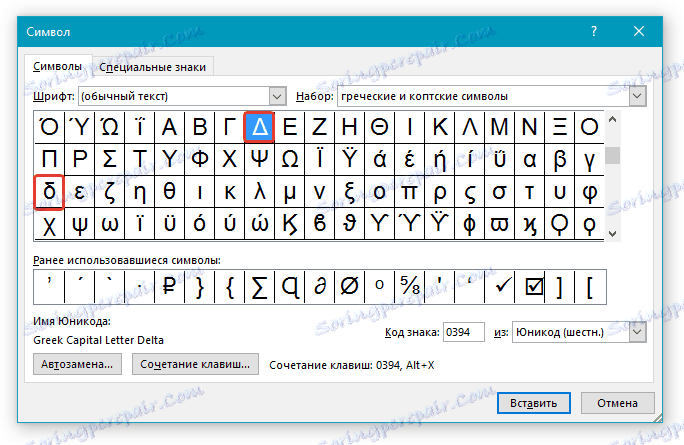
5. Дельта — это греческий символ, следовательно, чтобы быстрее найти его в списке, выберите соответствующий набор из выпадающего меню: “Греческие и коптские символы”.
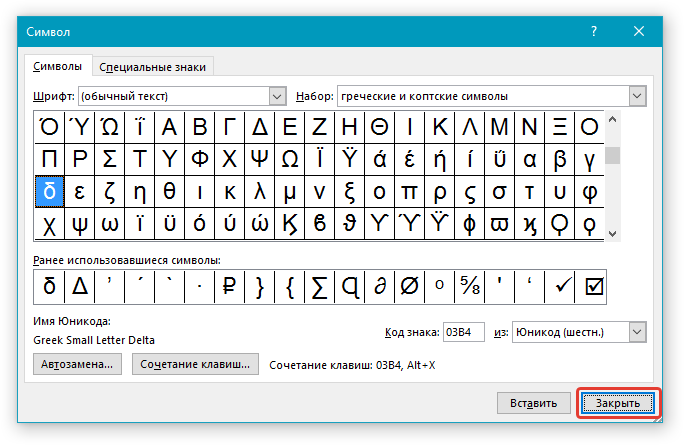
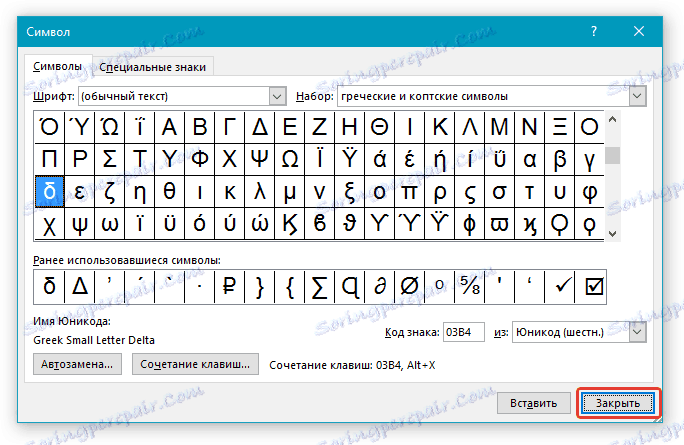
6. В появившемся списке символов вы найдете знак “Дельта”, причем, там будет как большая буква, так и маленькая. Выбери ту, которая вам нужна, нажмите кнопку “Вставить”.
7. Нажмите “Закрыть” для закрытия диалогового окна.
8. Знак дельта будет вставлен в документ.
Вставка дельты с помощью специального кода
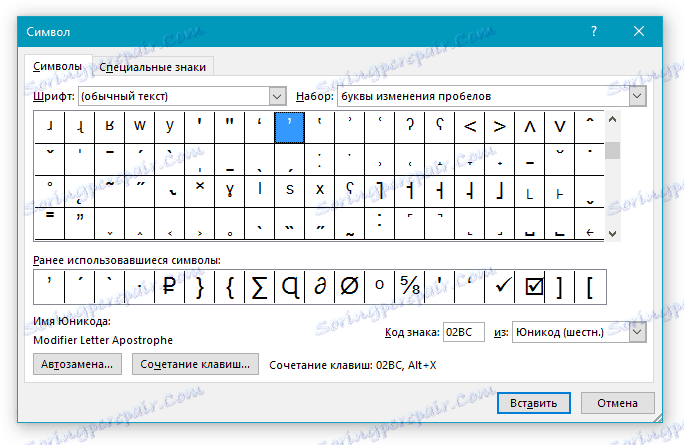
Практически у каждого символа и знака, представленного во встроенном наборе символов программы, есть свой код. Если вы узнаете и запомните этот код, вам больше не понадобится открывать окно “Символ”, искать там подходящий знак и добавлять его в документ. И все же, узнать код знака дельта можно именно в этом окне.
1. Установите курсор в том месте, где нужно поставить знак дельты.
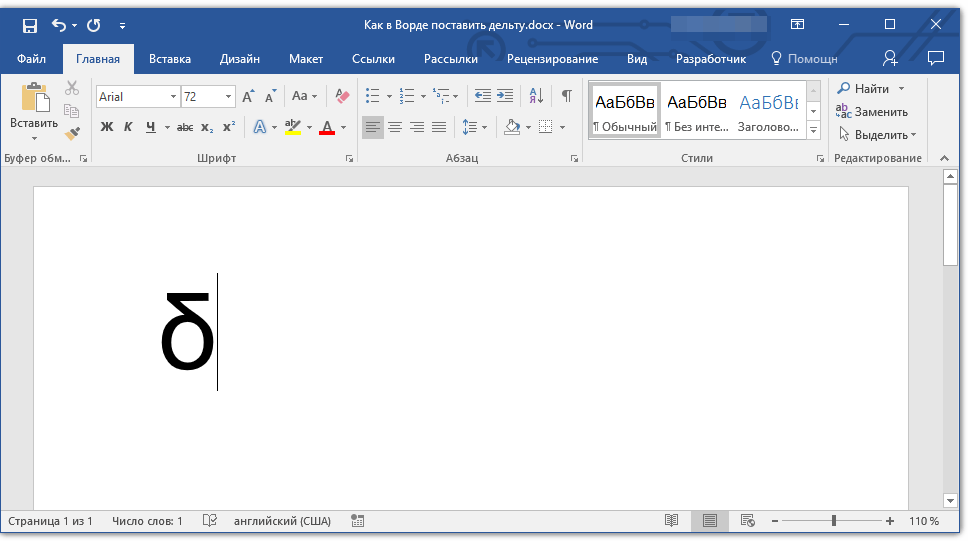
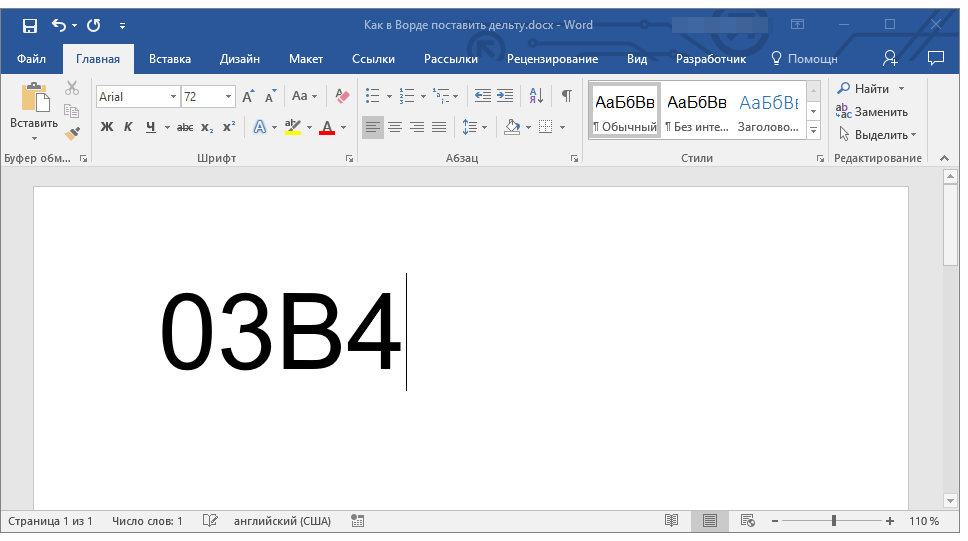
2. Введите код “0394” без кавычек для вставки большой буквы “Дельта”. Для вставки маленькой буквы введите в английской раскладке “03B4” без кавычек.
3. Нажмите клавиши “ALT+X”, чтобы преобразовать введенный код в знак.
4. В выбранном вами месте появится знак большой или маленькой дельты, в зависимости от того, какой код вы ввели.
Вот так просто можно поставить дельту в Ворде. Если вам часто приходится вставлять в документы различные знаки и символы, рекомендуем изучить тот набор, что встроен в программу. При необходимости, вы можете записать себе коды наиболее часто используемых символов, чтобы быстро вводить их и не тратить время на поиски.
Отблагодарите автора, поделитесь статьей в социальных сетях.
При написании математических формул и уравнений в Ворде, пользователь часто прибегает к обычным символам, которые расположены на клавиатуре. Допустим, что нужно вставить знак дельта в Ворде, и обычная клавиатура уже не спасет. Решение проблемы существует, где находится знак и как его поставить, рассмотрим в статье.
Где найти дельту?
Раздел «Символ» известен своим огромным количеством разнообразных иероглифов и символов. В нашем случае, дельта тоже прячется здесь, как и многие другие знаки. А вот и вспомогательные шаги, которые приведут к знаку:
Метод 1: «Символ»
Метод 2: «Код знака»
Данный метод подойдет пользователю с феноменальной памятью. Можно поставить дельту с помощью кода знака.
Установите курсор на место, где должен стоять знак дельты и напишете 0394, затем нажмите «Alt +X», где Х это английская буква. Результат на лицо, все довольно легко.
Дельта — четвертая буква греческого алфавита. Символ верхнего регистра выглядит как треугольник — « Δ », а нижнего так « δ ». Рассмотрим способы печати знака в документе Ворд и в ячейках табличного редактора Excel.
В математике знак часто обозначает разницу между значениями температур или другими переменными. Например, начальное напряжение U1=220В, а конечное — U2=120В.
ΔU=U2–U1=220В-120В=100В
Вставка в Word
Рассмотрим 3 способа:
Напечатайте вместо знака английскую букву « D ». Выделите её и в верхнем меню на вкладке «Главная» установите шрифт «Symbol». Буква автоматически превратится в дельту.
0 3 9 4 ➟ Alt + X = Δ
На полноценной клавиатуре с правым цифровым блоком клавиш можно воспользоваться следующим методом. Зажимаем Alt и набираем « 916 ». Вводить цифры надо именно на правом цифровом блоке.
Вставка в Excel
Предыдущие способы не походят в полной мере для применения в таблицах Excel. Например, конвертация буквы «D» в знак дельты может применяться только если в ячейке не будет других символов. Поэтому, самый лучший способ — воспользоваться вставкой.
В верхнем меню на вкладке «Вставка» выбираем пункт «Символ». В открывшемся окне указываем набор — «греческие и коптские символы». Здесь будет нужный знак.
Если нет возможности выбора набора, то внизу окна в поле «из:» установите значение «Юникод (шестн.)»
Знак дельта на Mac
Полезные советы или нет — ждём обратную связь в комментариях.
Источник
Вставка знака “дельта” в Microsoft Word
Вставка знака “дельта” в Microsoft Word
Когда возникает необходимость поставить какой-нибудь символ в документе MS Word, далеко не все пользователи знают, где его искать. Первый делом взгляд падает на клавиатуру, на которой не так уж много знаков и символов. Но, что делать в случае, если вам нужно поставить символ дельта в Ворде? На клавиатуре ведь его нет! Где же тогда его искать, как его напечатать в документе?
Если вы пользуетесь Word далеко не в первый раз, наверняка, знаете о разделе “Символы”, который есть в этой программе. Именно там можно найти огромный набор всевозможных знаков и символов, что называется, на все случаи жизни. Там же мы будем искать и знак дельты.
Вставка дельты через меню “Символ”
1. Откройте документ и кликните в том месте, где нужно поставить символ дельты.
2. Перейдите во вкладку “Вставка”. Нажмите в группе “Символы” кнопку “Символ”.
3. В выпадающем меню выберите пункт “Другие символы”.
4. В открывшемся окне вы увидите довольно большой список символов, в котором также можно найти и тот, что вам нужен.
5. Дельта — это греческий символ, следовательно, чтобы быстрее найти его в списке, выберите соответствующий набор из выпадающего меню: “Греческие и коптские символы”.
6. В появившемся списке символов вы найдете знак “Дельта”, причем, там будет как большая буква, так и маленькая. Выбери ту, которая вам нужна, нажмите кнопку “Вставить”.
7. Нажмите “Закрыть” для закрытия диалогового окна.
8. Знак дельта будет вставлен в документ.
Вставка дельты с помощью специального кода
Практически у каждого символа и знака, представленного во встроенном наборе символов программы, есть свой код. Если вы узнаете и запомните этот код, вам больше не понадобится открывать окно “Символ”, искать там подходящий знак и добавлять его в документ. И все же, узнать код знака дельта можно именно в этом окне.
1. Установите курсор в том месте, где нужно поставить знак дельты.
2. Введите код “0394” без кавычек для вставки большой буквы “Дельта”. Для вставки маленькой буквы введите в английской раскладке “03B4” без кавычек.
3. Нажмите клавиши “ALT+X”, чтобы преобразовать введенный код в знак.
4. В выбранном вами месте появится знак большой или маленькой дельты, в зависимости от того, какой код вы ввели.
Вот так просто можно поставить дельту в Ворде. Если вам часто приходится вставлять в документы различные знаки и символы, рекомендуем изучить тот набор, что встроен в программу. При необходимости, вы можете записать себе коды наиболее часто используемых символов, чтобы быстро вводить их и не тратить время на поиски.
Отблагодарите автора, поделитесь статьей в социальных сетях.
Дельта — буква, знак и его происхождение, применение в науке
В данной статье поговорим о знаке Дельта – что он из себя представляет, в каких сферах применяется и для чего вообще используется. Также вы узнаете, как выглядит знак и как его можно вставить в текст в такой программе, какой является Ворд из Майкрософт Оффис.
Знак Дельта применяется во многих сферах жизнедеятельности, к примеру, в физике, текстовых редакторах, формулах и других сферах. Чаще всего именно при печати учебной литературы, докладов и других видов документов применяют знак дельта, который имеется в разных версиях ВОРД от Виндовс и других приложениях для создания документов текстового формата на ПК.
О происхождения знака
Буква, которая служит аналогом в русском алфавите – Д, а вот символ везде одинаков и изображается, как геометрическая фигура, а именно треугольник с равными сторонами (Δ). Эта версия является заглавной, прописная версия выглядит немного иначе, представляя собой кружок с хвостиком, похожий на обозначение в физике плотности (δ).
Где применяется данный символ?
Кроме использования в правописании греков, символ начали активно применять в математике, геометрии, алгебре, физике, химии и географии.
Поговорим отдельно о применении дельта в каждых научных сферах:
Как ввести в «Ворд»?
Вставка знака “дельта” в Microsoft Word
Коли виникає необхідність поставити який-небудь символ в документі MS Word, далеко не всі користувачі знають, де його шукати. Перший справою погляд падає на клавіатуру, на якій не так вже й багато знаків і символів. Але, що робити в разі, якщо вам потрібно поставити символ дельта в Ворді? На клавіатурі адже його немає! Де ж тоді його шукати, як його надрукувати в документі?
Якщо ви користуєтеся Word далеко не в перший раз, напевно, знаєте про розділ “Символи”, який є в цій програмі. Саме там можна знайти величезний набір всіляких знаків і символів, що називається, на всі випадки життя. Там же ми будемо шукати і знак дельти.
Вставка дельти через меню “Символ”
1. Відкрийте документ і натисніть в тому місці, де потрібно поставити символ дельти.
2. Перейдіть у вкладку “Вставка”. Натисніть в групі “Символи” кнопку “Символ”.
3. У випадаючому меню виберіть пункт “Інші символи”.
4. У вікні, ви побачите досить великий список символів, в якому також можна знайти і той, що вам потрібен.
5. Дельта – це грецький символ, отже, щоб швидше знайти його в списку, виберіть відповідний набір з меню, що випадає: “Грецькі і коптські символи”.
6. У списку символів ви знайдете знак “Дельта”, причому, там буде як велика буква, так і маленька. Вибери ту, яка вам потрібна, натисніть кнопку “Вставити”.
7. Натисніть “Закрити” для закриття діалогового вікна.
8. Знак дельта буде вставлений в документ.
Вставка дельти за допомогою спеціального коду
Практично у кожного символу і знака, представленого у вбудованому наборі символів програми, є свій код. Якщо ви дізнаєтеся і запам’ятайте цей код, вам більше не знадобиться відкривати вікно “Символ”, шукати там відповідний знак і додавати його в документ. І все ж, дізнатися код знака дельта можна саме в цьому вікні.
1. Встановіть курсор в тому місці, де потрібно поставити знак дельти.
2. Введіть код “0394” без лапок для вставки великої літери “Дельта”. Для вставки маленької літери введіть в англійській розкладці “03B4” без лапок.
3. Натисніть клавіші “ALT + X”, щоб перетворити введений код в знак.
4. В обраному вами місці з’явиться знак великої або маленької дельти, в залежності від того, який код ви ввели.
Ось так просто можна поставити дельту в Ворді. Якщо вам часто доводиться вставляти в документи різні знаки і символи, рекомендуємо вивчити той набір, що вбудований в програму. При необхідності, ви можете записати собі коди найбільш часто використовуваних символів, щоб швидко вводити їх і не витрачати час на пошуки.
Символы “альфа”, “бета”, “гамма” и “омега” на компьютере: способы вставки в текст
Во время работы с текстом на компьютере, даже у продвинутых пользователей, нередко возникают разнообразные проблемы. К примеру, если необходимо напечатать буквы греческого алфавита. Они зачастую используются в математике, химии, физике и прочих точных науках.
К сожалению, на клавиатуре нет символа «альфа» и иных знаков греческого алфавита. Тем не менее, вставить их все равно можно. Но как? Давайте постараемся найти ответ на этот вопрос. Даже начинающие юзеры смогут без труда освоить набор «греческого» на ПК. Предложенные методы будут рассмотрены на примере работы с MS Word.
Вставка символа
Символы «альфа», «омега» и другие обозначения греческого алфавита найти не получится ни на одной современной клавиатуре. Тем не менее, вставить их в текст не составит особого труда.
Первый вариант развития событий – это работа со вставкой специальных символов. Подобная функция есть во всех версиях «Ворда».
Чтобы вставить любой специальный символ, которого нет на клавиатурной панели, рекомендуется сделать следующее:
Это только один из возможных методов решения поставленной задачи. Юзеры способны отыскать не только символы «альфа», «бета», «гамма», но и другие составляющие греческого алфавита в указанном пункте меню «Ворда». Это очень удобно.
Копирование и вставка
Следующий прием используется крайне редко, но о нем все равно рекомендуется помнить. Можно отыскать специальный символ в каком-нибудь готовом тексте, а затем скопировать его в свой документ.
Инструкция по применению подобного метода сводится к следующим манипуляциям:
Подобный метод, как мы уже говорили, почти не встречается на практике. Поэтому надеяться на него не следует. Символ «альфа» отыскать в готовом тексте в Сети бывает не так просто. Зато в любой момент юзер может самостоятельно напечатать его.
Сочетание клавиш
Как именно? Если не считать специальную вставку в «Ворде», существует еще два решения поставленной задачи. Символы «альфа», «омега» и другие могут быть вставлены при помощи ASCII-кодов. Основной проблемой является поиск информации о цифирных обозначениях специальных символов.
Руководство по использованию ASCII-кодов в Word для печати греческого алфавита имеет следующую интерпретацию:
Важно! При наборе специализированного кода клавиша Alt должна быть нажата. Перед началом операции придется включить Num Lock и использовать соответствующую часть клавиатуры для печати.
Вот несколько ASCII-кодов для греческих значков (строчных):
Теперь основные греческие символы напечатать не составит никакого труда. Даже школьник справится с поставленной задачей.
Используем Unicode
Символ «альфа» на клавиатуре обнаружить не получится. Зато при желании пользователь может воспользоваться Unicode для печати соответствующего символа. Это довольно распространенный прием, но знают о нем не все.
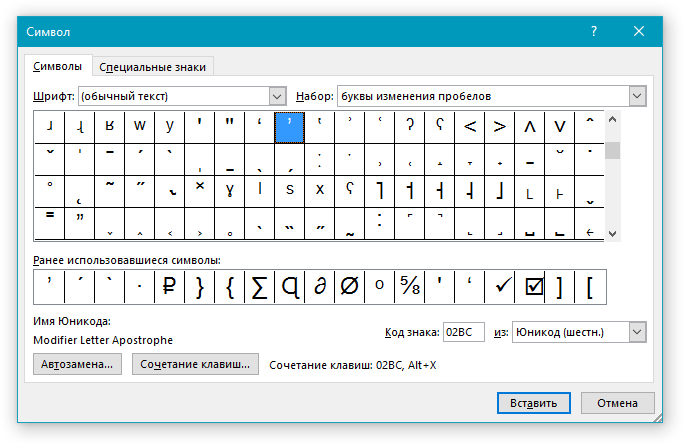
Для работы с Unicode потребуется:
Описанные манипуляции приведут к печати символа «альфа» или любого другого знака. Все зависит от указанного шестнадцатеричного кода.
Вот Unicode, используемые для некоторых строчных греческих букв:
Источник
Как поставить знак дельта на клавиатуре?
Напечатайте вместо знака английскую букву «D». Выделите её и в верхнем меню на вкладке «Главная» установите шрифт «Symbol». Буква автоматически превратится в дельту. В любом месте документа введите «0394» и нажмите горячие клавиши Alt и X. Цифры преобразуются в символ.
Как сделать значок Дельта?
Вставка дельты с помощью специального кода
Как поставить знак треугольника?
Многие пишут, что в роли треугольника можно вставить букву дельта. Для этого идем в «Вставка → Символ → Другие символы» и напротив текста «Код знака:» вводим в поле цифры 0394 и нажимаем «Вставить». Для быстрого ввода пишем в Ворде 0394 и нажимаем клавиши Altl+X.
Как вставить символ дельта в Эксель?
Поместите курсор в ячейку, в которую вы хотите вставить символ дельты, щелкните Вставить > Символ для отображения Символ Диалог. В Символ диалоговое окно, выберите манометры из шрифт выпадающий список, выберите Греческий и коптский из Подмножество раскрывающийся список, затем выберите символ дельты.
Что такое дельта в математике?
Верхний регистр дельта (Δ) часто означает «изменение» или «изменение» в математике. Например, если переменная «x» обозначает движение объекта, то «Δx» означает «изменение в движении». Ученые часто используют это математическое значение дельты в физике, химии и технике, и оно часто встречается в словесных задачах.
Как выглядит символ дельта?
Дельта — четвертая буква греческого алфавита. Символ верхнего регистра выглядит как треугольник — «Δ», а нижнего так «δ».
Как пишется буква дельта?
Δ, δ (название: де́льта, греч. δέλτα) — 4-я буква греческого алфавита. В системе греческой алфавитной записи чисел имеет числовое значение 4.
Как сделать пустой символ?
Зажимаете клавишу Alt, не отпуская её, справа на цифровой клавиатуре набираете код «255», отпускайте. Полученный невидимый символ копируйте любым удобным способом.
Как в ворде сделать знак угла?
Нажмите клавиши ALT+0176. Примечание: Для этого способа требуется цифровая клавиатура с 10 клавишами. На клавиатуре нет знака градуса, но это не мешает его быстро ставить в текстовом редакторе Word°.
Как в повер поинт вставить символ?
Поместите курсор в то место в файле, куда вы хотите вставить символ. Перейдите на вкладку «>Символ». Выберите символ или выберите «Другие символы». Используйте прокрутку вверх или вниз, чтобы найти символ, который вы хотите вставить.
Как поставить символ галочки в Excel?
Вставьте отметку или отметку с помощью функции символа
Как набрать знак в Excel?
Чтобы вставить специфический символ, можно воспользоваться ленточной командой Вставка – Символы – Символ. Там выбрать нужный элемент и сделать на нём двойной клик. Если вы используете символ, которого нет на клавиатуре, можно воспользоваться функциями Excel.
Что такое дельта в финансах?
(от греч. delta) — изменение цены опциона на будущую покупку или продажу акций, обусловленное изменением текущих цен акций.
Что такое дельта определение?
Дельта реки — низменность в низовьях реки, сложенная речными наносами. Дельта — четвёртая буква греческого алфавита. … Дельта — обозначение конечной разности при изменении какого-то параметра. Дельта-функция — физико-математическая функция.
Что такое дельта реки?
Де́льта — как правило, район устья реки, где река впадает в озеро, море или океан, разветвляясь на множество рукавов и протоков. Дельта, находящаяся не у устья реки, а, например, в среднем или верхнем её течении, называется внутренняя дельта. Дельты зачастую представляют собой особую миниэкосистему в бассейне реки.
Источник
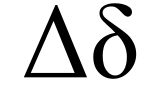 |
|||
| Греческий алфавит | |||
|---|---|---|---|
| Αα | Альфа | Νν | Ню |
| Ββ | Бета | Ξξ | Кси |
| Γγ | Гамма | Οο | Омикрон |
| Δδ | Дельта | Ππ | Пи |
| Εε | Эпсилон | Ρρ | Ро |
| Ζζ | Дзета | Σσς | Сигма |
| Ηη | Эта | Ττ | Тау |
| Θθ | Тета | Υυ | Ипсилон |
| Ιι | Йота | Φφ | Фи |
| Κκ | Каппа | Χχ | Хи |
| Λλ | Лямбда | Ψψ | Пси |
| Μμ | Мю | Ωω | Омега |
| История | |||
| Архаические локальные варианты |
|||
| Лигатуры (ϛ, ϗ, ȣ) · Диакритики | |||
| Цифры: |
|||
| В других языках | |||
| Бактрийский · Коптский · Албанский | |||
| Научные символы | |||
|
|
У этого термина существуют и другие значения, см. Дельта.
Δ, δ (название: де́льта, греч. δέλτα) — 4-я буква греческого алфавита. В системе греческой алфавитной записи чисел имеет числовое значение 4. Происходит от финикийской буквы — далет, название которой означало «дверь» или «вход в палатку». От буквы «дельта» произошли латинская буква D и кириллическая Д. В древнегреческом языке дельта произносилась как взрывной «д», в современном греческом произносится как [ð] (английское th в слове this).
Использование
Прописная буква Δ используется как символ для обозначения:
- изменения или различия между значениями переменных (например, температуры: ΔT), обычно макроскопического;
- Дифференциального оператора Лапласа в русской традиции (в отличие от западной, где в ходу обозначение
);
- любой из дельта-частиц в физике элементарных частиц;
- в электронике существует ΔΣ-модуляция;
- 4-й квадры в соционике.
- Плотность заряжания во внутренней баллистике
Строчная буква δ используется как символ для обозначения:
- микроскопического изменения значения переменной, точнее — обозначение неполного дифференциала (или вариации), в отличие от полного, обычно обозначаемого латинской буквой d;
- символа Кронекера в точных науках;
- дельта-функции Дирака в математике;
- отклонения в инженерной механике;
- в астрономии
- четвёртая по яркости звезда в созвездии;
- одна из двух небесных координат — склонение
- химический сдвиг (ядерный магнитный резонанс).
- удаления при читке корректуры (используется ещё с классических времён).
Также с греческой буквой сходны другие символы, употребляемые в математике:
- Оператор набла ∇. Ввёл этот оператор и придумал для него символ в виде перевёрнутой греческой буквы Δ (дельта), назвав символ словом «атлед» (слово «дельта», прочитанное наоборот) В. Р. Гамильтон (позднее британские учёные, в том числе О. Хевисайд, стали называть этот символ «на́бла» из-за сходства с остовом древнеассирийского музыкального инструмента наблы, а оператор получил название оператора Гамильтона, или оператора набл).
- Обозначение частной производной
.
- Для обозначения частичного условного заряда в химии (например в молекуле воды: Hδ+—Oδ-—Hδ+).
См. также
- Набла































 );
); .
.