|
||
|
||
| Names | ||
|---|---|---|
Other names
|
||
| Identifiers | ||
|
CAS Number |
|
|
|
3D model (JSmol) |
|
|
| 3DMet |
|
|
|
Beilstein Reference |
1900390 | |
| ChEBI |
|
|
| ChEMBL |
|
|
| ChemSpider |
|
|
| ECHA InfoCard | 100.004.271 |
|
| EC Number |
|
|
| E number | E290 (preservatives) | |
|
Gmelin Reference |
989 | |
| KEGG |
|
|
| MeSH | Carbon+dioxide | |
|
PubChem CID |
|
|
| RTECS number |
|
|
| UNII |
|
|
| UN number | 1013 (gas), 1845 (solid) | |
|
CompTox Dashboard (EPA) |
|
|
|
InChI
|
||
|
SMILES
|
||
| Properties | ||
|
Chemical formula |
CO2 | |
| Molar mass | 44.009 g·mol−1 | |
| Appearance | Colorless gas | |
| Odor |
|
|
| Density |
|
|
| Critical point (T, P) | 304.128(15) K[2] (30.978(15) °C), 7.3773(30) MPa[2] (72.808(30) atm) | |
|
Sublimation |
194.6855(30) K (−78.4645(30) °C) at 1 atm (0.101325 MPa) | |
|
Solubility in water |
1.45 g/L at 25 °C (77 °F), 100 kPa (0.99 atm) | |
| Vapor pressure | 5.7292(30) MPa, 56.54(30) atm (20 °C (293.15 K)) | |
| Acidity (pKa) | 6.35, 10.33 | |
|
Magnetic susceptibility (χ) |
−20.5·10−6 cm3/mol | |
| Thermal conductivity | 0.01662 W·m−1·K−1 (300 K (27 °C; 80 °F))[3] | |
|
Refractive index (nD) |
1.00045 | |
| Viscosity |
|
|
|
Dipole moment |
0 D | |
| Structure | ||
|
Crystal structure |
Trigonal | |
|
Molecular shape |
Linear | |
| Thermochemistry | ||
|
Heat capacity (C) |
37.135 J/K·mol | |
|
Std molar |
214 J·mol−1·K−1 | |
|
Std enthalpy of |
−393.5 kJ·mol−1 | |
| Pharmacology | ||
|
ATC code |
V03AN02 (WHO) | |
| Hazards | ||
| NFPA 704 (fire diamond) |
[7][8] 2 0 0 SA |
|
| Lethal dose or concentration (LD, LC): | ||
|
LCLo (lowest published) |
90,000 ppm (human, 5 min)[6] | |
| NIOSH (US health exposure limits): | ||
|
PEL (Permissible) |
TWA 5000 ppm (9000 mg/m3)[5] | |
|
REL (Recommended) |
TWA 5000 ppm (9000 mg/m3), ST 30,000 ppm (54,000 mg/m3)[5] | |
|
IDLH (Immediate danger) |
40,000 ppm[5] | |
| Safety data sheet (SDS) | Sigma-Aldrich | |
| Related compounds | ||
|
Other anions |
|
|
|
Other cations |
|
|
|
Related carbon oxides |
|
|
|
Related compounds |
|
|
| Supplementary data page | ||
| Carbon dioxide (data page) | ||
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Carbon dioxide (chemical formula CO2) is a chemical compound made up of molecules that each have one carbon atom covalently double bonded to two oxygen atoms. It is found in the gas state at room temperature. In the air, carbon dioxide is transparent to visible light but absorbs infrared radiation, acting as a greenhouse gas. It is a trace gas in Earth’s atmosphere at 421 parts per million (ppm), or about 0.04% by volume (as of May 2022), having risen from pre-industrial levels of 280 ppm.[9][10] Burning fossil fuels is the primary cause of these increased CO2 concentrations and also the primary cause of climate change.[11] Carbon dioxide is soluble in water and is found in groundwater, lakes, ice caps, and seawater. When carbon dioxide dissolves in water, it forms carbonic acid (H2CO3), which causes ocean acidification as atmospheric CO2 levels increase.[12]
As the source of available carbon in the carbon cycle, atmospheric CO2 is the primary carbon source for life on Earth. Its concentration in Earth’s pre-industrial atmosphere since late in the Precambrian has been regulated by organisms and geological phenomena. Plants, algae and cyanobacteria use energy from sunlight to synthesize carbohydrates from carbon dioxide and water in a process called photosynthesis, which produces oxygen as a waste product.[13] In turn, oxygen is consumed and CO2 is released as waste by all aerobic organisms when they metabolize organic compounds to produce energy by respiration.[14] CO2 is released from organic materials when they decay or combust, such as in forest fires. Since plants require CO2 for photosynthesis, and humans and animals depend on plants for food, CO2 is necessary for the survival of life on earth.
Carbon dioxide is 53% more dense than dry air, but is long lived and thoroughly mixes in the atmosphere. About half of excess CO2 emissions to the atmosphere are absorbed by land and ocean carbon sinks.[15] These sinks can become saturated and are volatile, as decay and wildfires result in the CO2 being released back into the atmosphere.[16] CO2 is eventually sequestered (stored for the long term) in rocks and organic deposits like coal, petroleum and natural gas. Sequestered CO2 is released into the atmosphere through burning fossil fuels or naturally by volcanoes, hot springs, geysers, and when carbonate rocks dissolve in water or react with acids.
CO2 is a versatile industrial material, used, for example, as an inert gas in welding and fire extinguishers, as a pressurizing gas in air guns and oil recovery, and as a supercritical fluid solvent in decaffeination of coffee and supercritical drying.[17] It is a byproduct of fermentation of sugars in bread, beer and wine making, and is added to carbonated beverages like seltzer and beer for effervescence. It has a sharp and acidic odor and generates the taste of soda water in the mouth,[18] but at normally encountered concentrations it is odorless.[1]
Chemical and physical properties
Structure, bonding and molecular vibrations
The symmetry of a carbon dioxide molecule is linear and centrosymmetric at its equilibrium geometry. The length of the carbon-oxygen bond in carbon dioxide is 116.3 pm, noticeably shorter than the roughly 140-pm length of a typical single C–O bond, and shorter than most other C–O multiply-bonded functional groups such as carbonyls.[19] Since it is centrosymmetric, the molecule has no electric dipole moment.
Stretching and bending oscillations of the CO2 carbon dioxide molecule. Upper left: symmetric stretching. Upper right: antisymmetric stretching. Lower line: degenerate pair of bending modes.
As a linear triatomic molecule, CO2 has four vibrational modes as shown in the diagram. In the symmetric and the antisymmetric stretching modes, the atoms move along the axis of the molecule. There are two bending modes, which are degenerate, meaning that they have the same frequency and same energy, because of the symmetry of the molecule. When a molecule touches a surface or touches another molecule, the two bending modes can differ in frequency because the interaction is different for the two modes. Some of the vibrational modes are observed in the infrared (IR) spectrum: the antisymmetric stretching mode at wavenumber 2349 cm−1 (wavelength 4.25 μm) and the degenerate pair of bending modes at 667 cm−1 (wavelength 15 μm). The symmetric stretching mode does not create an electric dipole so is not observed in IR spectroscopy, but it is detected in by Raman spectroscopy at 1388 cm−1 (wavelength 7.2 μm).[20]
In the gas phase, carbon dioxide molecules undergo significant vibrational motions and do not keep a fixed structure. However, in a Coulomb explosion imaging experiment, an instantaneous image of the molecular structure can be deduced. Such an experiment[21] has been performed for carbon dioxide.
The result of this experiment, and the conclusion of theoretical calculations[22] based on an ab initio potential energy surface of the molecule, is that none of the
molecules in the gas phase are ever exactly linear. This counter-intuitive result is trivially due to
the fact that the nuclear motion volume element vanishes for linear geometries.[22]
This is so for all molecules (except diatomics!).
In aqueous solution
Carbon dioxide is soluble in water, in which it reversibly forms H2CO3 (carbonic acid), which is a weak acid since its ionization in water is incomplete.
The hydration equilibrium constant of carbonic acid is, at 25 °C:
Hence, the majority of the carbon dioxide is not converted into carbonic acid, but remains as CO2 molecules, not affecting the pH.
The relative concentrations of CO2, H2CO3, and the deprotonated forms HCO−3 (bicarbonate) and CO2−3(carbonate) depend on the pH. As shown in a Bjerrum plot, in neutral or slightly alkaline water (pH > 6.5), the bicarbonate form predominates (>50%) becoming the most prevalent (>95%) at the pH of seawater. In very alkaline water (pH > 10.4), the predominant (>50%) form is carbonate. The oceans, being mildly alkaline with typical pH = 8.2–8.5, contain about 120 mg of bicarbonate per liter.
Being diprotic, carbonic acid has two acid dissociation constants, the first one for the dissociation into the bicarbonate (also called hydrogen carbonate) ion (HCO−3):
- Ka1 = 2.5×10−4 mol/L; pKa1 = 3.6 at 25 °C.[19]
This is the true first acid dissociation constant, defined as
where the denominator includes only covalently bound H2CO3 and does not include hydrated CO2(aq). The much smaller and often-quoted value near 4.16×10−7 is an apparent value calculated on the (incorrect) assumption that all dissolved CO2 is present as carbonic acid, so that
Since most of the dissolved CO2remains as CO2 molecules, Ka1(apparent) has a much larger denominator and a much smaller value than the true Ka1.[23]
The bicarbonate ion is an amphoteric species that can act as an acid or as a base, depending on pH of the solution. At high pH, it dissociates significantly into the carbonate ion (CO2−3):
- Ka2 = 4.69×10−11 mol/L; pKa2 = 10.329
In organisms carbonic acid production is catalysed by the enzyme, carbonic anhydrase.
Chemical reactions of CO2
CO2 is a potent electrophile having an electrophilic reactivity that is comparable to benzaldehyde or strong α,β-unsaturated carbonyl compounds. However, unlike electrophiles of similar reactivity, the reactions of nucleophiles with CO2 are thermodynamically less favored and are often found to be highly reversible.[24] Only very strong nucleophiles, like the carbanions provided by Grignard reagents and organolithium compounds react with CO2 to give carboxylates:
- where M = Li or Mg Br and R = alkyl or aryl.
In metal carbon dioxide complexes, CO2 serves as a ligand, which can facilitate the conversion of CO2 to other chemicals.[25]
The reduction of CO2 to CO is ordinarily a difficult and slow reaction:
Photoautotrophs (i.e. plants and cyanobacteria) use the energy contained in sunlight to photosynthesize simple sugars from CO2 absorbed from the air and water:
The redox potential for this reaction near pH 7 is about −0.53 V versus the standard hydrogen electrode. The nickel-containing enzyme carbon monoxide dehydrogenase catalyses this process.[26]
Physical properties
Pellets of «dry ice», a common form of solid carbon dioxide
Carbon dioxide is colorless. At low concentrations the gas is odorless; however, at sufficiently high concentrations, it has a sharp, acidic odor.[1] At standard temperature and pressure, the density of carbon dioxide is around 1.98 kg/m3, about 1.53 times that of air.[27]
Carbon dioxide has no liquid state at pressures below 0.51795(10) MPa[2] (5.11177(99) atm). At a pressure of 1 atm (0.101325 MPa), the gas deposits directly to a solid at temperatures below 194.6855(30) K[2] (−78.4645(30) °C) and the solid sublimes directly to a gas above this temperature. In its solid state, carbon dioxide is commonly called dry ice.
Pressure–temperature phase diagram of carbon dioxide. Note that it is a log-lin chart.
Liquid carbon dioxide forms only at pressures above 0.51795(10) MPa[2] (5.11177(99) atm); the triple point of carbon dioxide is 216.592(3) K[2] (−56.558(3) °C) at 0.51795(10) MPa[2] (5.11177(99) atm) (see phase diagram). The critical point is 304.128(15) K[2] (30.978(15) °C) at 7.3773(30) MPa[2] (72.808(30) atm). Another form of solid carbon dioxide observed at high pressure is an amorphous glass-like solid.[28] This form of glass, called carbonia, is produced by supercooling heated CO2 at extreme pressures (40–48 GPa, or about 400,000 atmospheres) in a diamond anvil. This discovery confirmed the theory that carbon dioxide could exist in a glass state similar to other members of its elemental family, like silicon dioxide (silica glass) and germanium dioxide. Unlike silica and germania glasses, however, carbonia glass is not stable at normal pressures and reverts to gas when pressure is released.
At temperatures and pressures above the critical point, carbon dioxide behaves as a supercritical fluid known as supercritical carbon dioxide.
Table of thermal and physical properties of saturated liquid carbon dioxide:[29][30]
| Temperature (°C) | Density (kg/m^3) | Specific heat (kJ/kg K) | Kinematic viscosity (m^2/s) | Conductivity (W/m K) | Thermal diffusivity (m^2/s) | Prandtl Number | Bulk modulus (K^-1) |
| -50 | 1156.34 | 1.84 | 1.19E-07 | 0.0855 | 4.02E-08 | 2.96 | — |
| -40 | 1117.77 | 1.88 | 1.18E-07 | 0.1011 | 4.81E-08 | 2.46 | — |
| -30 | 1076.76 | 1.97 | 1.17E-07 | 0.1116 | 5.27E-08 | 2.22 | — |
| -20 | 1032.39 | 2.05 | 1.15E-07 | 0.1151 | 5.45E-08 | 2.12 | — |
| -10 | 983.38 | 2.18 | 1.13E-07 | 0.1099 | 5.13E-08 | 2.2 | — |
| 0 | 926.99 | 2.47 | 1.08E-07 | 0.1045 | 4.58E-08 | 2.38 | — |
| 10 | 860.03 | 3.14 | 1.01E-07 | 0.0971 | 3.61E-08 | 2.8 | — |
| 20 | 772.57 | 5 | 9.10E-08 | 0.0872 | 2.22E-08 | 4.1 | 1.40E-02 |
| 30 | 597.81 | 36.4 | 8.00E-08 | 0.0703 | 0.279E-08 | 28.7 | — |
Table of thermal and physical properties of carbon dioxide (CO2) at atmospheric pressure:[29][30]
| Temperature (K) | Density (kg/m^3) | Specific heat (kJ/kg °C) | Dynamic viscosity (kg/m s) | Kinematic viscosity (m^2/s) | Thermal conductivity (W/m °C) | Thermal diffusivity (m^2/s) | Prandtl Number |
| 220 | 2.4733 | 0.783 | 1.11E-05 | 4.49E-06 | 0.010805 | 5.92E-06 | 0.818 |
| 250 | 2.1657 | 0.804 | 1.26E-05 | 5.81E-06 | 0.012884 | 7.40E-06 | 0.793 |
| 300 | 1.7973 | 0.871 | 1.50E-05 | 8.32E-06 | 0.016572 | 1.06E-05 | 0.77 |
| 350 | 1.5362 | 0.9 | 1.72E-05 | 1.12E-05 | 0.02047 | 1.48E-05 | 0.755 |
| 400 | 1.3424 | 0.942 | 1.93E-05 | 1.44E-05 | 0.02461 | 1.95E-05 | 0.738 |
| 450 | 1.1918 | 0.98 | 2.13E-05 | 1.79E-05 | 0.02897 | 2.48E-05 | 0.721 |
| 500 | 1.0732 | 1.013 | 2.33E-05 | 2.17E-05 | 0.03352 | 3.08E-05 | 0.702 |
| 550 | 0.9739 | 1.047 | 2.51E-05 | 2.57E-05 | 0.03821 | 3.75E-05 | 0.685 |
| 600 | 0.8938 | 1.076 | 2.68E-05 | 3.00E-05 | 0.04311 | 4.48E-05 | 0.668 |
| 650 | 0.8143 | 1.1 | 2.88E-05 | 3.54E-05 | 0.0445 | 4.97E-05 | 0.712 |
| 700 | 0.7564 | 1.13E+00 | 3.05E-05 | 4.03E-05 | 0.0481 | 5.63E-05 | 0.717 |
| 750 | 0.7057 | 1.15 | 3.21E-05 | 4.55E-05 | 0.0517 | 6.37E-05 | 0.714 |
| 800 | 0.6614 | 1.17E+00 | 3.37E-05 | 5.10E-05 | 0.0551 | 7.12E-05 | 0.716 |
Biological role
Carbon dioxide is an end product of cellular respiration in organisms that obtain energy by breaking down sugars, fats and amino acids with oxygen as part of their metabolism. This includes all plants, algae and animals and aerobic fungi and bacteria. In vertebrates, the carbon dioxide travels in the blood from the body’s tissues to the skin (e.g., amphibians) or the gills (e.g., fish), from where it dissolves in the water, or to the lungs from where it is exhaled. During active photosynthesis, plants can absorb more carbon dioxide from the atmosphere than they release in respiration.
Photosynthesis and carbon fixation
Carbon fixation is a biochemical process by which atmospheric carbon dioxide is incorporated by plants, algae and (cyanobacteria) into energy-rich organic molecules such as glucose, thus creating their own food by photosynthesis. Photosynthesis uses carbon dioxide and water to produce sugars from which other organic compounds can be constructed, and oxygen is produced as a by-product.
Ribulose-1,5-bisphosphate carboxylase oxygenase, commonly abbreviated to RuBisCO, is the enzyme involved in the first major step of carbon fixation, the production of two molecules of 3-phosphoglycerate from CO2 and ribulose bisphosphate, as shown in the diagram at left.
RuBisCO is thought to be the single most abundant protein on Earth.[31]
Phototrophs use the products of their photosynthesis as internal food sources and as raw material for the biosynthesis of more complex organic molecules, such as polysaccharides, nucleic acids and proteins. These are used for their own growth, and also as the basis of the food chains and webs that feed other organisms, including animals such as ourselves. Some important phototrophs, the coccolithophores synthesise hard calcium carbonate scales.[32] A globally significant species of coccolithophore is Emiliania huxleyi whose calcite scales have formed the basis of many sedimentary rocks such as limestone, where what was previously atmospheric carbon can remain fixed for geological timescales.
Overview of photosynthesis and respiration. Carbon dioxide (at right), together with water, form oxygen and organic compounds (at left) by photosynthesis, which can be respired to water and (CO2).
Plants can grow as much as 50 percent faster in concentrations of 1,000 ppm CO2 when compared with ambient conditions, though this assumes no change in climate and no limitation on other nutrients.[33] Elevated CO2 levels cause increased growth reflected in the harvestable yield of crops, with wheat, rice and soybean all showing increases in yield of 12–14% under elevated CO2 in FACE experiments.[34][35]
Increased atmospheric CO2 concentrations result in fewer stomata developing on plants[36] which leads to reduced water usage and increased water-use efficiency.[37] Studies using FACE have shown that CO2 enrichment leads to decreased concentrations of micronutrients in crop plants.[38] This may have knock-on effects on other parts of ecosystems as herbivores will need to eat more food to gain the same amount of protein.[39]
The concentration of secondary metabolites such as phenylpropanoids and flavonoids can also be altered in plants exposed to high concentrations of CO2.[40][41]
Plants also emit CO2 during respiration, and so the majority of plants and algae, which use C3 photosynthesis, are only net absorbers during the day. Though a growing forest will absorb many tons of CO2 each year, a mature forest will produce as much CO2 from respiration and decomposition of dead specimens (e.g., fallen branches) as is used in photosynthesis in growing plants.[42] Contrary to the long-standing view that they are carbon neutral, mature forests can continue to accumulate carbon[43] and remain valuable carbon sinks, helping to maintain the carbon balance of Earth’s atmosphere. Additionally, and crucially to life on earth, photosynthesis by phytoplankton consumes dissolved CO2 in the upper ocean and thereby promotes the absorption of CO2 from the atmosphere.[44]
Toxicity
Symptoms of carbon dioxide toxicity, by increasing volume percent in air[45]
Carbon dioxide content in fresh air (averaged between sea-level and 10 kPa level, i.e., about 30 km (19 mi) altitude) varies between 0.036% (360 ppm) and 0.041% (412 ppm), depending on the location.[46][clarification needed]
CO2 is an asphyxiant gas and not classified as toxic or harmful in accordance with Globally Harmonized System of Classification and Labelling of Chemicals standards of United Nations Economic Commission for Europe by using the OECD Guidelines for the Testing of Chemicals. In concentrations up to 1% (10,000 ppm), it will make some people feel drowsy and give the lungs a stuffy feeling.[45] Concentrations of 7% to 10% (70,000 to 100,000 ppm) may cause suffocation, even in the presence of sufficient oxygen, manifesting as dizziness, headache, visual and hearing dysfunction, and unconsciousness within a few minutes to an hour.[47] The physiological effects of acute carbon dioxide exposure are grouped together under the term hypercapnia, a subset of asphyxiation.
Because it is heavier than air, in locations where the gas seeps from the ground (due to sub-surface volcanic or geothermal activity) in relatively high concentrations, without the dispersing effects of wind, it can collect in sheltered/pocketed locations below average ground level, causing animals located therein to be suffocated. Carrion feeders attracted to the carcasses are then also killed. Children have been killed in the same way near the city of Goma by CO2 emissions from the nearby volcano Mount Nyiragongo.[48] The Swahili term for this phenomenon is mazuku.
Adaptation to increased concentrations of CO2 occurs in humans, including modified breathing and kidney bicarbonate production, in order to balance the effects of blood acidification (acidosis). Several studies suggested that 2.0 percent inspired concentrations could be used for closed air spaces (e.g. a submarine) since the adaptation is physiological and reversible, as deterioration in performance or in normal physical activity does not happen at this level of exposure for five days.[49][50] Yet, other studies show a decrease in cognitive function even at much lower levels.[51][52] Also, with ongoing respiratory acidosis, adaptation or compensatory mechanisms will be unable to reverse such condition.
Below 1%
There are few studies of the health effects of long-term continuous CO2 exposure on humans and animals at levels below 1%. Occupational CO2 exposure limits have been set in the United States at 0.5% (5000 ppm) for an eight-hour period.[53] At this CO2 concentration, International Space Station crew experienced headaches, lethargy, mental slowness, emotional irritation, and sleep disruption.[54] Studies in animals at 0.5% CO2 have demonstrated kidney calcification and bone loss after eight weeks of exposure.[55] A study of humans exposed in 2.5 hour sessions demonstrated significant negative effects on cognitive abilities at concentrations as low as 0.1% (1000 ppm) CO2 likely due to CO2 induced increases in cerebral blood flow.[51] Another study observed a decline in basic activity level and information usage at 1000 ppm, when compared to 500 ppm.[52] However a review of the literature found that most studies on the phenomenon of carbon dioxide induced cognitive impairment to have a small effect on high-level decision making and most of the studies were confounded by inadequate study designs, environmental comfort, uncertainties in exposure doses and differing cognitive assessments used.[56] Similarly a study on the effects of the concentration of CO2 in motorcycle helmets has been criticized for having dubious methodology in not noting the self-reports of motorcycle riders and taking measurements using mannequins. Further when normal motorcycle conditions were achieved (such as highway or city speeds) or the visor was raised the concentration of CO2 declined to safe levels (0.2%).[57][58]
Ventilation
Poor ventilation is one of the main causes of excessive CO2 concentrations in closed spaces, leading to poor indoor air quality. Carbon dioxide differential above outdoor concentrations at steady state conditions (when the occupancy and ventilation system operation are sufficiently long that CO2 concentration has stabilized) are sometimes used to estimate ventilation rates per person.[citation needed] Higher CO2 concentrations are associated with occupant health, comfort and performance degradation.[59][60] ASHRAE Standard 62.1–2007 ventilation rates may result in indoor concentrations up to 2,100 ppm above ambient outdoor conditions. Thus if the outdoor concentration is 400 ppm, indoor concentrations may reach 2,500 ppm with ventilation rates that meet this industry consensus standard. Concentrations in poorly ventilated spaces can be found even higher than this (range of 3,000 or 4,000 ppm).
Miners, who are particularly vulnerable to gas exposure due to insufficient ventilation, referred to mixtures of carbon dioxide and nitrogen as «blackdamp», «choke damp» or «stythe». Before more effective technologies were developed, miners would frequently monitor for dangerous levels of blackdamp and other gases in mine shafts by bringing a caged canary with them as they worked. The canary is more sensitive to asphyxiant gases than humans, and as it became unconscious would stop singing and fall off its perch. The Davy lamp could also detect high levels of blackdamp (which sinks, and collects near the floor) by burning less brightly, while methane, another suffocating gas and explosion risk, would make the lamp burn more brightly.
In February 2020, three people died from suffocation at a party in Moscow when dry ice (frozen CO2) was added to a swimming pool to cool it down.[61] A similar accident occurred in 2018 when a woman died from CO2 fumes emanating from the large amount of dry ice she was transporting in her car.[62]
Outdoor areas with elevated concentrations
Local concentrations of carbon dioxide can reach high values near strong sources, especially those that are isolated by surrounding terrain. At the Bossoleto hot spring near Rapolano Terme in Tuscany, Italy, situated in a bowl-shaped depression about 100 m (330 ft) in diameter, concentrations of CO2 rise to above 75% overnight, sufficient to kill insects and small animals. After sunrise the gas is dispersed by convection.[63] High concentrations of CO2 produced by disturbance of deep lake water saturated with CO2 are thought to have caused 37 fatalities at Lake Monoun, Cameroon in 1984 and 1700 casualties at Lake Nyos, Cameroon in 1986.[64]
Human physiology
Content
| Blood compartment | (kPa) | (mm Hg) | |
|---|---|---|---|
| Venous blood carbon dioxide | 5.5–6.8 | 41–51[65] | 41–51[65] |
| Alveolar pulmonary gas pressures |
4.8 | 36 | 36 |
| Arterial blood carbon dioxide | 4.7–6.0 | 35–45[65] | 35–45[65] |
The body produces approximately 2.3 pounds (1.0 kg) of carbon dioxide per day per person,[66] containing 0.63 pounds (290 g) of carbon. In humans, this carbon dioxide is carried through the venous system and is breathed out through the lungs, resulting in lower concentrations in the arteries. The carbon dioxide content of the blood is often given as the partial pressure, which is the pressure which carbon dioxide would have had if it alone occupied the volume.[67] In humans, the blood carbon dioxide contents is shown in the adjacent table.
Transport in the blood
CO2 is carried in blood in three different ways. (Exact percentages vary between arterial and venous blood).
- Majority (about 70% to 80%) is converted to bicarbonate ions HCO−3 by the enzyme carbonic anhydrase in the red blood cells,[68] by the reaction CO2 + H2O → H2CO3 → H+ + HCO−3.
- 5–10% is dissolved in blood plasma[68]
- 5–10% is bound to hemoglobin as carbamino compounds[68]
Hemoglobin, the main oxygen-carrying molecule in red blood cells, carries both oxygen and carbon dioxide. However, the CO2 bound to hemoglobin does not bind to the same site as oxygen. Instead, it combines with the N-terminal groups on the four globin chains. However, because of allosteric effects on the hemoglobin molecule, the binding of CO2 decreases the amount of oxygen that is bound for a given partial pressure of oxygen. This is known as the Haldane Effect, and is important in the transport of carbon dioxide from the tissues to the lungs. Conversely, a rise in the partial pressure of CO2 or a lower pH will cause offloading of oxygen from hemoglobin, which is known as the Bohr effect.
Regulation of respiration
Carbon dioxide is one of the mediators of local autoregulation of blood supply. If its concentration is high, the capillaries expand to allow a greater blood flow to that tissue.[69]
Bicarbonate ions are crucial for regulating blood pH. A person’s breathing rate influences the level of CO2 in their blood. Breathing that is too slow or shallow causes respiratory acidosis, while breathing that is too rapid leads to hyperventilation, which can cause respiratory alkalosis.[70]
Although the body requires oxygen for metabolism, low oxygen levels normally do not stimulate breathing. Rather, breathing is stimulated by higher carbon dioxide levels. As a result, breathing low-pressure air or a gas mixture with no oxygen at all (such as pure nitrogen) can lead to loss of consciousness without ever experiencing air hunger. This is especially perilous for high-altitude fighter pilots. It is also why flight attendants instruct passengers, in case of loss of cabin pressure, to apply the oxygen mask to themselves first before helping others; otherwise, one risks losing consciousness.[68]
The respiratory centers try to maintain an arterial CO2 pressure of 40 mm Hg. With intentional hyperventilation, the CO2 content of arterial blood may be lowered to 10–20 mm Hg (the oxygen content of the blood is little affected), and the respiratory drive is diminished. This is why one can hold one’s breath longer after hyperventilating than without hyperventilating. This carries the risk that unconsciousness may result before the need to breathe becomes overwhelming, which is why hyperventilation is particularly dangerous before free diving.[71]
Concentrations and role in the environment
Atmosphere
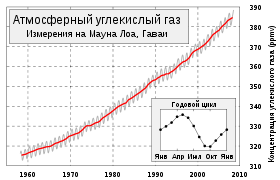
Atmospheric CO2 concentrations measured at Mauna Loa Observatory from 1958 to 2022 (also called the Keeling Curve). Carbon dioxide concentrations have varied widely over the Earth’s 4.54 billion year history. However, in 2013 the daily mean concentration of CO2 in the atmosphere surpassed 400 parts per million (ppmv)[72] — this level has never been reached since the mid-Pliocene, 2 to 4 million years ago.[73]
Carbon dioxide in Earth’s atmosphere is a trace gas that plays an integral part in the greenhouse effect, carbon cycle, photosynthesis and oceanic carbon cycle. It is one of several greenhouse gases in Earth’s atmosphere that are contributing to climate change due to increasing emissions of greenhouse gases from human activities. The current global average concentration of CO2 in the atmosphere is 421 ppm as of May 2022.[74] This is an increase of 50% since the start of the Industrial Revolution, up from 280 ppm during the 10,000 years prior to the mid-18th century.[75][74][76] The increase is due to human activity.[77] Burning fossil fuels is the main cause of these increased CO2 concentrations and also the main cause of climate change.[78] Other large anthropogenic sources include cement production, deforestation, and biomass burning.
While transparent to visible light, carbon dioxide is a greenhouse gas, absorbing and emitting infrared radiation at its two infrared-active vibrational frequencies. CO2 absorbs and emits infrared radiation at wavelengths of 4.26 μm (2,347 cm−1) (asymmetric stretching vibrational mode) and 14.99 μm (667 cm−1) (bending vibrational mode). It plays a significant role in influencing Earth’s surface temperature through the greenhouse effect.[79] Light emission from the Earth’s surface is most intense in the infrared region between 200 and 2500 cm−1,[80] as opposed to light emission from the much hotter Sun which is most intense in the visible region. Absorption of infrared light at the vibrational frequencies of atmospheric CO2 traps energy near the surface, warming the surface and the lower atmosphere. Less energy reaches the upper atmosphere, which is therefore cooler because of this absorption.[81]
Increases in atmospheric concentrations of CO2 and other long-lived greenhouse gases such as methane, nitrous oxide and ozone increase the absorption and emission of infrared radiation by the atmosphere, causing the observed rise in average global temperature and ocean acidification. Another direct effect is the CO2 fertilization effect. These changes cause a range of indirect effects of climate change on the physical environment, ecosystems and human societies. Carbon dioxide exerts a larger overall warming influence than all of the other greenhouse gases combined.[76] It has an atmospheric lifetime that increases with the cumulative amount of fossil carbon extracted and burned, due to the imbalance that this activity has imposed on Earth’s fast carbon cycle.[82] This means that some fraction (a projected 20-35%) of the fossil carbon transferred thus far will persist in the atmosphere as elevated CO2 levels for many thousands of years after these carbon transfer activities begin to subside.[83][84][85] The carbon cycle is a biogeochemical cycle in which carbon is exchanged between the Earth’s oceans, soil, rocks and the biosphere. Plants and other photoautotrophs use solar energy to produce carbohydrate from atmospheric carbon dioxide and water by photosynthesis. Almost all other organisms depend on carbohydrate derived from photosynthesis as their primary source of energy and carbon compounds.
The present atmospheric concentration of CO2 is the highest for 14 million years.[86] Concentrations of CO2 in the atmosphere were as high as 4,000 ppm during the Cambrian period about 500 million years ago, when the concentration was 20 times greater than today, and as low as 180 ppm during the Quaternary glaciation of the last two million years.[75] Reconstructed temperature records for the last 420 million years indicate that atmospheric CO2 concentrations peaked at ~2,000 ppm during the Devonian (~400 Ma) period, and again in the Triassic (220–200 Ma) period and was four times current levels during the Jurassic period (201-145 Ma).[87][88]
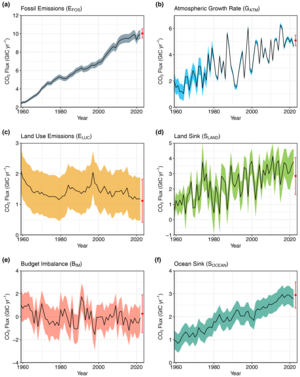
Annual CO2 flows from anthropogenic sources (left) into Earth’s atmosphere, land, and ocean sinks (right) since the 1960s. Units in equivalent gigatonnes carbon per year.[89]
Oceans
Ocean acidification
Carbon dioxide dissolves in the ocean to form carbonic acid (H2CO3), bicarbonate (HCO3−) and carbonate (CO32−). There is about fifty times as much carbon dioxide dissolved in the oceans as exists in the atmosphere. The oceans act as an enormous carbon sink, and have taken up about a third of CO2 emitted by human activity.[90]
Pterapod shell dissolved in seawater adjusted to an ocean chemistry projected for the year 2100
Changes in ocean chemistry can have extensive direct and indirect effects on organisms and their habitats. One of the most important repercussions of increasing ocean acidity relates to the production of shells out of calcium carbonate (CaCO
3).[92] This process is called calcification and is important to the biology and survival of a wide range of marine organisms. Calcification involves the precipitation of dissolved ions into solid CaCO
3 structures, structures for many marine organisms, such as coccolithophores, foraminifera, crustaceans, mollusks, etc. After they are formed, these CaCO
3 structures are vulnerable to dissolution unless the surrounding seawater contains saturating concentrations of carbonate ions (CO32−).
Given the current pH of the ocean (around 8.14), of the extra carbon dioxide added into the ocean, very little remains as dissolved carbon dioxide. The majority dissociates into additional bicarbonate and free hydrogen ions. The increase in hydrogen is larger than the increase in bicarbonate,[93] creating an imbalance in the reaction HCO3− ⇌ CO32− + H+. To maintain chemical equilibrium, some of the carbonate ions already in the ocean combine with some of the hydrogen ions to make further bicarbonate. Thus the ocean’s concentration of carbonate ions is reduced, removing an essential building block for marine organisms to build shells, or calcify: Ca2+ + CO32− ⇌ CaCO3.
Hydrothermal vents
Carbon dioxide is also introduced into the oceans through hydrothermal vents. The Champagne hydrothermal vent, found at the Northwest Eifuku volcano in the Mariana Trench, produces almost pure liquid carbon dioxide, one of only two known sites in the world as of 2004, the other being in the Okinawa Trough.[94] The finding of a submarine lake of liquid carbon dioxide in the Okinawa Trough was reported in 2006.[95]
Production
Biological processes
Carbon dioxide is a by-product of the fermentation of sugar in the brewing of beer, whisky and other alcoholic beverages and in the production of bioethanol. Yeast metabolizes sugar to produce CO2 and ethanol, also known as alcohol, as follows:
All aerobic organisms produce CO2 when they oxidize carbohydrates, fatty acids, and proteins. The large number of reactions involved are exceedingly complex and not described easily. Refer to (cellular respiration, anaerobic respiration and photosynthesis). The equation for the respiration of glucose and other monosaccharides is:
Anaerobic organisms decompose organic material producing methane and carbon dioxide together with traces of other compounds.[96] Regardless of the type of organic material, the production of gases follows well defined kinetic pattern. Carbon dioxide comprises about 40–45% of the gas that emanates from decomposition in landfills (termed «landfill gas»). Most of the remaining 50–55% is methane.[97]
Industrial processes
Carbon dioxide can be obtained by distillation from air, but the method is inefficient. Industrially, carbon dioxide is predominantly an unrecovered waste product, produced by several methods which may be practiced at various scales.[98]
Combustion
The combustion of all carbon-based fuels, such as methane (natural gas), petroleum distillates (gasoline, diesel, kerosene, propane), coal, wood and generic organic matter produces carbon dioxide and, except in the case of pure carbon, water. As an example, the chemical reaction between methane and oxygen:
Iron is reduced from its oxides with coke in a blast furnace, producing pig iron and carbon dioxide:[99]
By-product from hydrogen production
Carbon dioxide is a byproduct of the industrial production of hydrogen by steam reforming and the water gas shift reaction in ammonia production. These processes begin with the reaction of water and natural gas (mainly methane).[100] This is a major source of food-grade carbon dioxide for use in carbonation of beer and soft drinks, and is also used for stunning animals such as poultry. In the summer of 2018 a shortage of carbon dioxide for these purposes arose in Europe due to the temporary shut-down of several ammonia plants for maintenance.[101]
Thermal decomposition of limestone
It is produced by thermal decomposition of limestone, CaCO3 by heating (calcining) at about 850 °C (1,560 °F), in the manufacture of quicklime (calcium oxide, CaO), a compound that has many industrial uses:
Acids liberate CO2 from most metal carbonates. Consequently, it may be obtained directly from natural carbon dioxide springs, where it is produced by the action of acidified water on limestone or dolomite. The reaction between hydrochloric acid and calcium carbonate (limestone or chalk) is shown below:
The carbonic acid (H2CO3) then decomposes to water and CO2:
Such reactions are accompanied by foaming or bubbling, or both, as the gas is released. They have widespread uses in industry because they can be used to neutralize waste acid streams.
Commercial uses
Carbon dioxide is used by the food industry, the oil industry, and the chemical industry.[98]
The compound has varied commercial uses but one of its greatest uses as a chemical is in the production of carbonated beverages; it provides the sparkle in carbonated beverages such as soda water, beer and sparkling wine.
Precursor to chemicals
|
This section needs expansion. You can help by adding to it. (July 2014) |
In the chemical industry, carbon dioxide is mainly consumed as an ingredient in the production of urea, with a smaller fraction being used to produce methanol and a range of other products.[102] Some carboxylic acid derivatives such as sodium salicylate are prepared using CO2 by the Kolbe–Schmitt reaction.[103]
In addition to conventional processes using CO2 for chemical production, electrochemical methods are also being explored at a research level. In particular, the use of renewable energy for production of fuels from CO2 (such as methanol) is attractive as this could result in fuels that could be easily transported and used within conventional combustion technologies but have no net CO2 emissions.[104]
Agriculture
Plants require carbon dioxide to conduct photosynthesis. The atmospheres of greenhouses may (if of large size, must) be enriched with additional CO2 to sustain and increase the rate of plant growth.[105][106] At very high concentrations (100 times atmospheric concentration, or greater), carbon dioxide can be toxic to animal life, so raising the concentration to 10,000 ppm (1%) or higher for several hours will eliminate pests such as whiteflies and spider mites in a greenhouse.[107]
Foods
Carbon dioxide bubbles in a soft drink
Carbon dioxide is a food additive used as a propellant and acidity regulator in the food industry. It is approved for usage in the EU[108] (listed as E number E290), US[109] and Australia and New Zealand[110] (listed by its INS number 290).
A candy called Pop Rocks is pressurized with carbon dioxide gas[111] at about 4,000 kPa (40 bar; 580 psi). When placed in the mouth, it dissolves (just like other hard candy) and releases the gas bubbles with an audible pop.
Leavening agents cause dough to rise by producing carbon dioxide.[112] Baker’s yeast produces carbon dioxide by fermentation of sugars within the dough, while chemical leaveners such as baking powder and baking soda release carbon dioxide when heated or if exposed to acids.
Beverages
Carbon dioxide is used to produce carbonated soft drinks and soda water. Traditionally, the carbonation of beer and sparkling wine came about through natural fermentation, but many manufacturers carbonate these drinks with carbon dioxide recovered from the fermentation process. In the case of bottled and kegged beer, the most common method used is carbonation with recycled carbon dioxide. With the exception of British real ale, draught beer is usually transferred from kegs in a cold room or cellar to dispensing taps on the bar using pressurized carbon dioxide, sometimes mixed with nitrogen.
The taste of soda water (and related taste sensations in other carbonated beverages) is an effect of the dissolved carbon dioxide rather than the bursting bubbles of the gas. Carbonic anhydrase 4 converts to carbonic acid leading to a sour taste, and also the dissolved carbon dioxide induces a somatosensory response.[113]
Winemaking
Dry ice used to preserve grapes after harvest
Carbon dioxide in the form of dry ice is often used during the cold soak phase in winemaking to cool clusters of grapes quickly after picking to help prevent spontaneous fermentation by wild yeast. The main advantage of using dry ice over water ice is that it cools the grapes without adding any additional water that might decrease the sugar concentration in the grape must, and thus the alcohol concentration in the finished wine. Carbon dioxide is also used to create a hypoxic environment for carbonic maceration, the process used to produce Beaujolais wine.
Carbon dioxide is sometimes used to top up wine bottles or other storage vessels such as barrels to prevent oxidation, though it has the problem that it can dissolve into the wine, making a previously still wine slightly fizzy. For this reason, other gases such as nitrogen or argon are preferred for this process by professional wine makers.
Stunning animals
Carbon dioxide is often used to «stun» animals before slaughter.[114] «Stunning» may be a misnomer, as the animals are not knocked out immediately and may suffer distress.[115][116]
Inert gas
Carbon dioxide is one of the most commonly used compressed gases for pneumatic (pressurized gas) systems in portable pressure tools. Carbon dioxide is also used as an atmosphere for welding, although in the welding arc, it reacts to oxidize most metals. Use in the automotive industry is common despite significant evidence that welds made in carbon dioxide are more brittle than those made in more inert atmospheres.[citation needed] When used for MIG welding, CO2 use is sometimes referred to as MAG welding, for Metal Active Gas, as CO2 can react at these high temperatures. It tends to produce a hotter puddle than truly inert atmospheres, improving the flow characteristics. Although, this may be due to atmospheric reactions occurring at the puddle site. This is usually the opposite of the desired effect when welding, as it tends to embrittle the site, but may not be a problem for general mild steel welding, where ultimate ductility is not a major concern.
Carbon dioxide is used in many consumer products that require pressurized gas because it is inexpensive and nonflammable, and because it undergoes a phase transition from gas to liquid at room temperature at an attainable pressure of approximately 60 bar (870 psi; 59 atm), allowing far more carbon dioxide to fit in a given container than otherwise would. Life jackets often contain canisters of pressured carbon dioxide for quick inflation. Aluminium capsules of CO2 are also sold as supplies of compressed gas for air guns, paintball markers/guns, inflating bicycle tires, and for making carbonated water. High concentrations of carbon dioxide can also be used to kill pests. Liquid carbon dioxide is used in supercritical drying of some food products and technological materials, in the preparation of specimens for scanning electron microscopy[117] and in the decaffeination of coffee beans.
Fire extinguisher
Use of a CO2 fire extinguisher
Carbon dioxide can be used to extinguish flames by flooding the environment around the flame with the gas. It does not itself react to extinguish the flame, but starves the flame of oxygen by displacing it. Some fire extinguishers, especially those designed for electrical fires, contain liquid carbon dioxide under pressure. Carbon dioxide extinguishers work well on small flammable liquid and electrical fires, but not on ordinary combustible fires, because they do not cool the burning substances significantly, and when the carbon dioxide disperses, they can catch fire upon exposure to atmospheric oxygen. They are mainly used in server rooms.[118]
Carbon dioxide has also been widely used as an extinguishing agent in fixed fire-protection systems for local application of specific hazards and total flooding of a protected space.[119] International Maritime Organization standards recognize carbon-dioxide systems for fire protection of ship holds and engine rooms. Carbon-dioxide-based fire-protection systems have been linked to several deaths, because it can cause suffocation in sufficiently high concentrations. A review of CO2 systems identified 51 incidents between 1975 and the date of the report (2000), causing 72 deaths and 145 injuries.[120]
Supercritical CO2 as solvent
Liquid carbon dioxide is a good solvent for many lipophilic organic compounds and is used to remove caffeine from coffee.[17] Carbon dioxide has attracted attention in the pharmaceutical and other chemical processing industries as a less toxic alternative to more traditional solvents such as organochlorides. It is also used by some dry cleaners for this reason. It is used in the preparation of some aerogels because of the properties of supercritical carbon dioxide.
Medical and pharmacological uses
In medicine, up to 5% carbon dioxide (130 times atmospheric concentration) is added to oxygen for stimulation of breathing after apnea and to stabilize the O2/CO2 balance in blood.
Carbon dioxide can be mixed with up to 50% oxygen, forming an inhalable gas; this is known as Carbogen and has a variety of medical and research uses.
Another medical use are the mofette, dry spas that use carbon dioxide from post-volcanic discharge for therapeutic purposes.
Energy
Supercritical CO2 is used as the working fluid in the Allam power cycle engine.
Fossil fuel recovery
Carbon dioxide is used in enhanced oil recovery where it is injected into or adjacent to producing oil wells, usually under supercritical conditions, when it becomes miscible with the oil. This approach can increase original oil recovery by reducing residual oil saturation by 7–23% additional to primary extraction.[121] It acts as both a pressurizing agent and, when dissolved into the underground crude oil, significantly reduces its viscosity, and changing surface chemistry enabling the oil to flow more rapidly through the reservoir to the removal well.[122] In mature oil fields, extensive pipe networks are used to carry the carbon dioxide to the injection points.
In enhanced coal bed methane recovery, carbon dioxide would be pumped into the coal seam to displace methane, as opposed to current methods which primarily rely on the removal of water (to reduce pressure) to make the coal seam release its trapped methane.[123]
Bio transformation into fuel
It has been proposed that CO2 from power generation be bubbled into ponds to stimulate growth of algae that could then be converted into biodiesel fuel.[124] A strain of the cyanobacterium Synechococcus elongatus has been genetically engineered to produce the fuels isobutyraldehyde and isobutanol from CO2 using photosynthesis.[125]
Researchers have developed a process called electrolysis, using enzymes isolated from bacteria to power the chemical reactions which convert CO2 into fuels.[126][127][128]
Refrigerant
Comparison of the pressure–temperature phase diagrams of carbon dioxide (red) and water (blue) as a log-lin chart with phase transitions points at 1 atmosphere
Liquid and solid carbon dioxide are important refrigerants, especially in the food industry, where they are employed during the transportation and storage of ice cream and other frozen foods. Solid carbon dioxide is called «dry ice» and is used for small shipments where refrigeration equipment is not practical. Solid carbon dioxide is always below −78.5 °C (−109.3 °F) at regular atmospheric pressure, regardless of the air temperature.
Liquid carbon dioxide (industry nomenclature R744 or R-744) was used as a refrigerant prior to the use[citation needed] of dichlorodifluoromethane (R12, a chlorofluorocarbon (CFC) compound). CO2 might enjoy a renaissance because one of the main substitutes to CFCs, 1,1,1,2-tetrafluoroethane (R134a, a hydrofluorocarbon (HFC) compound) contributes to climate change more than CO2 does. CO2 physical properties are highly favorable for cooling, refrigeration, and heating purposes, having a high volumetric cooling capacity. Due to the need to operate at pressures of up to 130 bars (1,900 psi; 13,000 kPa), CO2 systems require highly mechanically resistant reservoirs and components that have already been developed for mass production in many sectors. In automobile air conditioning, in more than 90% of all driving conditions for latitudes higher than 50°, CO2 (R744) operates more efficiently than systems using HFCs (e.g., R134a). Its environmental advantages (GWP of 1, non-ozone depleting, non-toxic, non-flammable) could make it the future working fluid to replace current HFCs in cars, supermarkets, and heat pump water heaters, among others. Coca-Cola has fielded CO2-based beverage coolers and the U.S. Army is interested in CO2 refrigeration and heating technology.[129][130]
Minor uses
Carbon dioxide is the lasing medium in a carbon-dioxide laser, which is one of the earliest type of lasers.
Carbon dioxide can be used as a means of controlling the pH of swimming pools,[131] by continuously adding gas to the water, thus keeping the pH from rising. Among the advantages of this is the avoidance of handling (more hazardous) acids. Similarly, it is also used in the maintaining reef aquaria, where it is commonly used in calcium reactors to temporarily lower the pH of water being passed over calcium carbonate in order to allow the calcium carbonate to dissolve into the water more freely, where it is used by some corals to build their skeleton.
Used as the primary coolant in the British advanced gas-cooled reactor for nuclear power generation.
Carbon dioxide induction is commonly used for the euthanasia of laboratory research animals. Methods to administer CO2 include placing animals directly into a closed, prefilled chamber containing CO2, or exposure to a gradually increasing concentration of CO2. The American Veterinary Medical Association’s 2020 guidelines for carbon dioxide induction state that a displacement rate of 30–70% of the chamber or cage volume per minute is optimal for the humane euthanasia of small rodents.[132]: 5, 31 Percentages of CO2 vary for different species, based on identified optimal percentages to minimize distress.[132]: 22
Carbon dioxide is also used in several related cleaning and surface-preparation techniques.
History of discovery
Carbon dioxide was the first gas to be described as a discrete substance. In about 1640,[133] the Flemish chemist Jan Baptist van Helmont observed that when he burned charcoal in a closed vessel, the mass of the resulting ash was much less than that of the original charcoal. His interpretation was that the rest of the charcoal had been transmuted into an invisible substance he termed a «gas» or «wild spirit» (spiritus sylvestris).[134]
The properties of carbon dioxide were further studied in the 1750s by the Scottish physician Joseph Black. He found that limestone (calcium carbonate) could be heated or treated with acids to yield a gas he called «fixed air». He observed that the fixed air was denser than air and supported neither flame nor animal life. Black also found that when bubbled through limewater (a saturated aqueous solution of calcium hydroxide), it would precipitate calcium carbonate. He used this phenomenon to illustrate that carbon dioxide is produced by animal respiration and microbial fermentation. In 1772, English chemist Joseph Priestley published a paper entitled Impregnating Water with Fixed Air in which he described a process of dripping sulfuric acid (or oil of vitriol as Priestley knew it) on chalk in order to produce carbon dioxide, and forcing the gas to dissolve by agitating a bowl of water in contact with the gas.[135]
Carbon dioxide was first liquefied (at elevated pressures) in 1823 by Humphry Davy and Michael Faraday.[136] The earliest description of solid carbon dioxide (dry ice) was given by the French inventor Adrien-Jean-Pierre Thilorier, who in 1835 opened a pressurized container of liquid carbon dioxide, only to find that the cooling produced by the rapid evaporation of the liquid yielded a «snow» of solid CO2.[137][138]
See also
- Arterial blood gas
- Bosch reaction
- Carbon dioxide removal – Removal of atmospheric carbon dioxide (from the atmosphere)
- List of least carbon efficient power stations
- List of countries by carbon dioxide emissions
- Meromictic lake – Permanently stratified lake with layers of water that do not intermix
- Gilbert Plass – Canadian physicist (early work on CO2 and climate change)
- Sabatier reaction – Methanation process of carbon dioxide with hydrogen
- NASA’s Orbiting Carbon Observatory 2
- Greenhouse Gases Observing Satellite – Earth observation satellite
- Soil gas
References
- ^ a b c «Carbon Dioxide» (PDF). Air Products. Archived from the original (PDF) on 29 July 2020. Retrieved 28 April 2017.
- ^ a b c d e f g h i Span R, Wagner W (1 November 1996). «A New Equation of State for Carbon Dioxide Covering the Fluid Region from the Triple‐Point Temperature to 1100 K at Pressures up to 800 MPa». Journal of Physical and Chemical Reference Data. 25 (6): 1519. Bibcode:1996JPCRD..25.1509S. doi:10.1063/1.555991.
- ^ Touloukian YS, Liley PE, Saxena SC (1970). «Thermophysical properties of matter — the TPRC data series». Thermal Conductivity — Nonmetallic Liquids and Gases. Data book. 3.
- ^ Schäfer M, Richter M, Span R (2015). «Measurements of the viscosity of carbon dioxide at temperatures from (253.15 to 473.15) K with pressures up to 1.2 MPa». The Journal of Chemical Thermodynamics. 89: 7–15. doi:10.1016/j.jct.2015.04.015.
- ^ a b c NIOSH Pocket Guide to Chemical Hazards. «#0103». National Institute for Occupational Safety and Health (NIOSH).
- ^ «Carbon dioxide». Immediately Dangerous to Life or Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ^ «Safety Data Sheet – Carbon Dioxide Gas – version 0.03 11/11» (PDF). AirGas.com. 12 February 2018. Archived (PDF) from the original on 4 August 2018. Retrieved 4 August 2018.
- ^ «Carbon dioxide, refrigerated liquid» (PDF). Praxair. p. 9. Archived from the original (PDF) on 29 July 2018. Retrieved 26 July 2018.
- ^ Eggleton T (2013). A Short Introduction to Climate Change. Cambridge University Press. p. 52. ISBN 9781107618763. Archived from the original on 23 July 2021. Retrieved 9 November 2020.
- ^ «Carbon dioxide now more than 50% higher than pre-industrial levels | National Oceanic and Atmospheric Administration». www.noaa.gov. Retrieved 14 June 2022.
- ^ IPCC (2022) Summary for policy makers in Climate Change 2022: Mitigation of Climate Change. Contribution of Working Group III to the Sixth Assessment Report of the Intergovernmental Panel on Climate Change, Cambridge University Press, Cambridge, United Kingdom and New York, NY, USA
- ^ Ocean Acidification: A National Strategy to Meet the Challenges of a Changing Ocean. Washington, DC: National Academies Press. 22 April 2010. doi:10.17226/12904. ISBN 978-0-309-15359-1. Archived from the original on 5 February 2016. Retrieved 29 February 2016.
- ^ Kaufman DG, Franz CM (1996). Biosphere 2000: protecting our global environment. Kendall/Hunt Pub. Co. ISBN 978-0-7872-0460-0.
- ^ «Food Factories». www.legacyproject.org. Archived from the original on 12 August 2017. Retrieved 10 October 2011.
- ^ IPCC (2021). «Summary for Policymakers» (PDF). Climate Change 2021: The Physical Science Basis. p. 20. Archived (PDF) from the original on 10 October 2022.
- ^ Myles, Allen (September 2020). «The Oxford Principles for Net Zero Aligned Carbon Offsetting» (PDF). Archived (PDF) from the original on 2 October 2020. Retrieved 10 December 2021.
- ^ a b Tsotsas E, Mujumdar AS (2011). Modern drying technology. Vol. 3: Product quality and formulation. John Wiley & Sons. ISBN 978-3-527-31558-1. Archived from the original on 21 March 2020. Retrieved 3 December 2019.
- ^ Spritzler F (3 November 2019). «Carbonated (Sparkling) Water: Good or Bad?». healthline.com. Archived from the original on 10 May 2020.
- ^ a b Greenwood NN, Earnshaw A (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. pp. 305–314. ISBN 978-0-08-037941-8.
- ^ Atkins P, de Paula J (2006). Physical Chemistry (8th ed.). W.H. Freeman. pp. 461, 464. ISBN 978-0-7167-8759-4.
- ^ Siegmann B, Werner U, Lutz HO, Mann R (2002). «Complete Coulomb fragmentation of CO2 in collisions with 5.9 MeV u−1 Xe18+ and Xe43+«. J Phys B Atom Mol Opt Phys. 35 (17): 3755. Bibcode:2002JPhB…35.3755S. doi:10.1088/0953-4075/35/17/311. S2CID 250782825.
- ^ a b
Jensen P, Spanner M, Bunker PR (2020). «The CO2 molecule is never linear−». J Mol Struct. 1212: 128087. Bibcode:2020JMoSt121228087J. doi:10.1016/j.molstruc.2020.128087. hdl:2142/107329. S2CID 216318907. - ^ Jolly WL (1984). Modern Inorganic Chemistry. McGraw-Hill. p. 196. ISBN 978-0-07-032760-3.
- ^ Li Z, Mayer RJ, Ofial AR, Mayr H (May 2020). «From Carbodiimides to Carbon Dioxide: Quantification of the Electrophilic Reactivities of Heteroallenes». Journal of the American Chemical Society. 142 (18): 8383–8402. doi:10.1021/jacs.0c01960. PMID 32338511. S2CID 216557447.
- ^ Aresta M, ed. (2010). Carbon Dioxide as a Chemical Feedstock. Weinheim: Wiley-VCH. ISBN 978-3-527-32475-0.
- ^ Finn C, Schnittger S, Yellowlees LJ, Love JB (February 2012). «Molecular approaches to the electrochemical reduction of carbon dioxide» (PDF). Chemical Communications. 48 (10): 1392–1399. doi:10.1039/c1cc15393e. hdl:20.500.11820/b530915d-451c-493c-8251-da2ea2f50912. PMID 22116300. S2CID 14356014. Archived (PDF) from the original on 19 April 2021. Retrieved 6 December 2019.
- ^ «Gases – Densities». Engineering Toolbox. Archived from the original on 2 March 2006. Retrieved 21 November 2020.
- ^ Santoro M, Gorelli FA, Bini R, Ruocco G, Scandolo S, Crichton WA (June 2006). «Amorphous silica-like carbon dioxide». Nature. 441 (7095): 857–860. Bibcode:2006Natur.441..857S. doi:10.1038/nature04879. PMID 16778885. S2CID 4363092.
- ^ a b Holman, Jack P. (2002). Heat Transfer (9th ed.). New York, NY: McGraw-Hill Companies, Inc. pp. 600–606. ISBN 9780072406559.
- ^ a b Incropera 1 Dewitt 2 Bergman 3 Lavigne 4, Frank P. 1 David P. 2 Theodore L. 3 Adrienne S. 4 (2007). Fundamentals of Heat and Mass Transfer (6th ed.). Hoboken, NJ: John Wiley and Sons, Inc. pp. 941–950. ISBN 9780471457282.
- ^ Dhingra A, Portis AR, Daniell H (April 2004). «Enhanced translation of a chloroplast-expressed RbcS gene restores small subunit levels and photosynthesis in nuclear RbcS antisense plants». Proceedings of the National Academy of Sciences of the United States of America. 101 (16): 6315–6320. Bibcode:2004PNAS..101.6315D. doi:10.1073/pnas.0400981101. PMC 395966. PMID 15067115.
(Rubisco) is the most prevalent enzyme on this planet, accounting for 30–50% of total soluble protein in the chloroplast
- ^ Falkowski P, Knoll AH (1 January 2007). Evolution of primary producers in the sea. Elsevier, Academic Press. ISBN 978-0-12-370518-1. OCLC 845654016.
- ^ Blom TJ, Straver WA, Ingratta FJ, Khosla S, Brown W (December 2002). «Carbon Dioxide In Greenhouses». Archived from the original on 29 April 2019. Retrieved 12 June 2007.
- ^ Ainsworth EA (2008). «Rice production in a changing climate: a meta-analysis of responses to elevated carbon dioxide and elevated ozone concentration» (PDF). Global Change Biology. 14 (7): 1642–1650. Bibcode:2008GCBio..14.1642A. doi:10.1111/j.1365-2486.2008.01594.x. S2CID 19200429. Archived from the original (PDF) on 19 July 2011.
- ^ Long SP, Ainsworth EA, Leakey AD, Nösberger J, Ort DR (June 2006). «Food for thought: lower-than-expected crop yield stimulation with rising CO2 concentrations» (PDF). Science. 312 (5782): 1918–1921. Bibcode:2006Sci…312.1918L. CiteSeerX 10.1.1.542.5784. doi:10.1126/science.1114722. PMID 16809532. S2CID 2232629. Archived (PDF) from the original on 20 October 2016. Retrieved 27 October 2017.
- ^ Woodward F, Kelly C (1995). «The influence of CO2 concentration on stomatal density». New Phytologist. 131 (3): 311–327. doi:10.1111/j.1469-8137.1995.tb03067.x.
- ^ Drake BG, Gonzalez-Meler MA, Long SP (June 1997). «MORE EFFICIENT PLANTS: A Consequence of Rising Atmospheric CO2?». Annual Review of Plant Physiology and Plant Molecular Biology. 48 (1): 609–639. doi:10.1146/annurev.arplant.48.1.609. PMID 15012276. S2CID 33415877.
- ^ Loladze I (2002). «Rising atmospheric CO2 and human nutrition: toward globally imbalanced plant stoichiometry?». Trends in Ecology & Evolution. 17 (10): 457–461. doi:10.1016/S0169-5347(02)02587-9. S2CID 16074723.
- ^ Coviella CE, Trumble JT (1999). «Effects of Elevated Atmospheric Carbon Dioxide on Insect-Plant Interactions». Conservation Biology. 13 (4): 700–712. doi:10.1046/j.1523-1739.1999.98267.x. JSTOR 2641685. S2CID 52262618.
- ^ Davey MP, Harmens H, Ashenden TW, Edwards R, Baxter R (2007). «Species-specific effects of elevated CO2 on resource allocation in Plantago maritima and Armeria maritima«. Biochemical Systematics and Ecology. 35 (3): 121–129. doi:10.1016/j.bse.2006.09.004.
- ^ Davey MP, Bryant DN, Cummins I, Ashenden TW, Gates P, Baxter R, Edwards R (August 2004). «Effects of elevated CO2 on the vasculature and phenolic secondary metabolism of Plantago maritima». Phytochemistry. 65 (15): 2197–2204. doi:10.1016/j.phytochem.2004.06.016. PMID 15587703.
- ^ «Global Environment Division Greenhouse Gas Assessment Handbook – A Practical Guidance Document for the Assessment of Project-level Greenhouse Gas Emissions». World Bank. Archived from the original on 3 June 2016. Retrieved 10 November 2007.
- ^ Luyssaert S, Schulze ED, Börner A, Knohl A, Hessenmöller D, Law BE, et al. (September 2008). «Old-growth forests as global carbon sinks» (PDF). Nature. 455 (7210): 213–215. Bibcode:2008Natur.455..213L. doi:10.1038/nature07276. PMID 18784722. S2CID 4424430.
- ^ Falkowski P, Scholes RJ, Boyle E, Canadell J, Canfield D, Elser J, et al. (October 2000). «The global carbon cycle: a test of our knowledge of earth as a system». Science. 290 (5490): 291–296. Bibcode:2000Sci…290..291F. doi:10.1126/science.290.5490.291. PMID 11030643. S2CID 1779934.
- ^ a b Friedman D. «Toxicity of Carbon Dioxide Gas Exposure, CO2 Poisoning Symptoms, Carbon Dioxide Exposure Limits, and Links to Toxic Gas Testing Procedures». InspectAPedia. Archived from the original on 28 September 2009.
- ^ «CarbonTracker CT2011_oi (Graphical map of CO2)». esrl.noaa.gov. Archived from the original on 13 February 2021. Retrieved 20 April 2007.
- ^ «Carbon Dioxide as a Fire Suppressant: Examining the Risks». U.S. Environmental Protection Agency. Archived from the original on 2 October 2015.
- ^ «Volcano Under the City». A NOVA Production by Bonne Pioche and Greenspace for WGBH/Boston. Public Broadcasting System. 1 November 2005. Archived from the original on 5 April 2011..
- ^ Glatte Jr HA, Motsay GJ, Welch BE (1967). Carbon Dioxide Tolerance Studies (Report). Brooks AFB, TX School of Aerospace Medicine Technical Report. SAM-TR-67-77. Archived from the original on 9 May 2008. Retrieved 2 May 2008.
{{cite report}}: CS1 maint: unfit URL (link) - ^ Lambertsen CJ (1971). Carbon Dioxide Tolerance and Toxicity (Report). IFEM Report. Environmental Biomedical Stress Data Center, Institute for Environmental Medicine, University of Pennsylvania Medical Center. No. 2-71. Archived from the original on 24 July 2011. Retrieved 2 May 2008.
{{cite report}}: CS1 maint: unfit URL (link) - ^ a b Satish U, Mendell MJ, Shekhar K, Hotchi T, Sullivan D, Streufert S, Fisk WJ (December 2012). «Is CO2 an indoor pollutant? Direct effects of low-to-moderate CO2 concentrations on human decision-making performance» (PDF). Environmental Health Perspectives. 120 (12): 1671–1677. doi:10.1289/ehp.1104789. PMC 3548274. PMID 23008272. Archived from the original (PDF) on 5 March 2016. Retrieved 11 December 2014.
- ^ a b Allen JG, MacNaughton P, Satish U, Santanam S, Vallarino J, Spengler JD (June 2016). «Associations of Cognitive Function Scores with Carbon Dioxide, Ventilation, and Volatile Organic Compound Exposures in Office Workers: A Controlled Exposure Study of Green and Conventional Office Environments». Environmental Health Perspectives. 124 (6): 805–812. doi:10.1289/ehp.1510037. PMC 4892924. PMID 26502459.
- ^ «Exposure Limits for Carbon Dioxide Gas – CO2 Limits». InspectAPedia.com. Archived from the original on 16 September 2018. Retrieved 19 October 2014.
- ^ Law J, Watkins S, Alexander D (2010). In-Flight Carbon Dioxide Exposures and Related Symptoms: Associations, Susceptibility and Operational Implications (PDF) (Report). NASA Technical Report. TP–2010–216126. Archived from the original (PDF) on 27 June 2011. Retrieved 26 August 2014.
- ^ Schaefer KE, Douglas WH, Messier AA, Shea ML, Gohman PA (1979). «Effect of prolonged exposure to 0.5% CO2 on kidney calcification and ultrastructure of lungs». Undersea Biomedical Research. 6 (Suppl): S155–S161. PMID 505623. Archived from the original on 19 October 2014. Retrieved 19 October 2014.
- ^ Du B, Tandoc MC, Mack ML, Siegel JA (November 2020). «Indoor CO2 concentrations and cognitive function: A critical review». Indoor Air. 30 (6): 1067–1082. doi:10.1111/ina.12706. PMID 32557862. S2CID 219915861.
- ^ Kaplan L (4 June 2019). «Ask the doc: Does my helmet make me stupid? — RevZilla». www.revzilla.com. Archived from the original on 22 May 2021. Retrieved 22 May 2021.
- ^ Brühwiler PA, Stämpfli R, Huber R, Camenzind M (September 2005). «CO2 and O2 concentrations in integral motorcycle helmets». Applied Ergonomics. 36 (5): 625–633. doi:10.1016/j.apergo.2005.01.018. PMID 15893291.
- ^ Allen JG, MacNaughton P, Satish U, Santanam S, Vallarino J, Spengler JD (June 2016). «Associations of Cognitive Function Scores with Carbon Dioxide, Ventilation, and Volatile Organic Compound Exposures in Office Workers: A Controlled Exposure Study of Green and Conventional Office Environments». Environmental Health Perspectives. 124 (6): 805–812. doi:10.1289/ehp.1510037. PMC 4892924. PMID 26502459.
- ^ Romm J (26 October 2015). «Exclusive: Elevated CO2 Levels Directly Affect Human Cognition, New Harvard Study Shows». ThinkProgress. Archived from the original on 9 October 2019. Retrieved 14 October 2019.
- ^ «Three die in dry-ice incident at Moscow pool party». BBC News. 29 February 2020. Archived from the original on 29 February 2020.
The victims were connected to Instagram influencer Yekaterina Didenko.
- ^ Rettner R (2 August 2018). «A Woman Died from Dry Ice Fumes. Here’s How It Can Happen». livescience.com. Archived from the original on 22 May 2021. Retrieved 22 May 2021.
- ^ van Gardingen PR, Grace J, Jeffree CE, Byari SH, Miglietta F, Raschi A, Bettarini I (1997). «Long-term effects of enhanced CO2 concentrations on leaf gas exchange: research opportunities using CO2 springs». In Raschi A, Miglietta F, Tognetti R, van Gardingen PR (eds.). Plant responses to elevated CO2: Evidence from natural springs. Cambridge: Cambridge University Press. pp. 69–86. ISBN 978-0-521-58203-2.
- ^ Martini M (1997). «CO2 emissions in volcanic areas: case histories and hazards». In Raschi A, Miglietta F, Tognetti R, van Gardingen PR (eds.). Plant responses to elevated CO2: Evidence from natural springs. Cambridge: Cambridge University Press. pp. 69–86. ISBN 978-0-521-58203-2.
- ^ a b c d «ABG (Arterial Blood Gas)». Brookside Associates. Archived from the original on 12 August 2017. Retrieved 2 January 2017.
- ^ «How much carbon dioxide do humans contribute through breathing?». EPA.gov. Archived from the original on 2 February 2011. Retrieved 30 April 2009.
- ^ Henrickson C (2005). Chemistry. Cliffs Notes. ISBN 978-0-7645-7419-1.
- ^ a b c d «Carbon dioxide». solarnavigator.net. Archived from the original on 14 September 2008. Retrieved 12 October 2007.
- ^ Battisti-Charbonney, A.; Fisher, J.; Duffin, J. (15 June 2011). «The cerebrovascular response to carbon dioxide in humans». J. Physiol. 589 (12): 3039–3048. doi:10.1113/jphysiol.2011.206052. PMC 3139085. PMID 21521758.
- ^ Patel, S.; Miao, J.H.; Yetiskul, E.; Anokhin, A.; Majmunder, S.H. (2022). «Physiology, Carbon Dioxide Retention». National Library of Medicine. National Center for Biotechnology Information, NIH. PMID 29494063. Retrieved 20 August 2022.
- ^ Wilmshurst, Peter (1998). «ABC of oxygen». BMJ. 317 (7164): 996–999. doi:10.1136/bmj.317.7164.996. PMC 1114047. PMID 9765173.
- ^ Showstack, Randy (2013). «Carbon dioxide tops 400 ppm at Mauna Loa, Hawaii». Eos, Transactions American Geophysical Union. 94 (21): 192. Bibcode:2013EOSTr..94Q.192S. doi:10.1002/2013eo210004. ISSN 0096-3941.
- ^ Montaigne, Fen. «Son of Climate Science Pioneer Ponders A Sobering Milestone». Yale Environment 360. Yale School of Forestry & Environmental Studies. Archived from the original on 8 June 2013. Retrieved 14 May 2013.
- ^ a b «Carbon dioxide now more than 50% higher than pre-industrial levels | National Oceanic and Atmospheric Administration». www.noaa.gov. Retrieved 14 June 2022.
- ^ a b Eggleton, Tony (2013). A Short Introduction to Climate Change. Cambridge University Press. p. 52. ISBN 9781107618763.
- ^ a b «The NOAA Annual Greenhouse Gas Index (AGGI) – An Introduction». NOAA Global Monitoring Laboratory/Earth System Research Laboratories. Archived from the original on 27 November 2020. Retrieved 18 December 2020.
- ^ Etheridge, D.M.; L.P. Steele; R.L. Langenfelds; R.J. Francey; J.-M. Barnola; V.I. Morgan (1996). «Natural and anthropogenic changes in atmospheric CO2 over the last 1000 years from air in Antarctic ice and firn». Journal of Geophysical Research. 101 (D2): 4115–28. Bibcode:1996JGR…101.4115E. doi:10.1029/95JD03410. ISSN 0148-0227.
- ^ IPCC (2022) Summary for policy makers in Climate Change 2022: Mitigation of Climate Change. Contribution of Working Group III to the Sixth Assessment Report of the Intergovernmental Panel on Climate Change, Cambridge University Press, Cambridge, United Kingdom and New York, NY, USA
- ^ Petty, G.W. (2004). «A First Course in Atmospheric Radiation». Eos Transactions. 85 (36): 229–51. Bibcode:2004EOSTr..85..341P. doi:10.1029/2004EO360007.
- ^ Atkins P, de Paula J (2006). Atkins’ Physical Chemistry (8th ed.). W. H. Freeman. p. 462. ISBN 978-0-7167-8759-4.
- ^ «Carbon Dioxide Absorbs and Re-emits Infrared Radiation». UCAR Center for Science Education. 2012. Archived from the original on 21 September 2017. Retrieved 9 September 2017.
- ^ Archer D (15 March 2005). «How long will global warming last?». RealClimate. Archived from the original on 4 March 2021. Retrieved 5 March 2021.
- ^ Archer D (2009). «Atmospheric lifetime of fossil fuel carbon dioxide». Annual Review of Earth and Planetary Sciences. 37 (1): 117–34. Bibcode:2009AREPS..37..117A. doi:10.1146/annurev.earth.031208.100206. hdl:2268/12933. Archived from the original on 24 February 2021. Retrieved 7 March 2021.
- ^ Joos F, Roth R, Fuglestvedt JS, Peters GP, Enting IG, Von Bloh W, et al. (2013). «Carbon dioxide and climate impulse response functions for the computation of greenhouse gas metrics: A multi-model analysis». Atmospheric Chemistry and Physics. 13 (5): 2793–2825. doi:10.5194/acpd-12-19799-2012. Archived from the original on 22 July 2020. Retrieved 7 March 2021.
- ^ «Figure 8.SM.4» (PDF). Intergovernmental Panel on Climate Change Fifth Assessment Report. p. 8SM-16. Archived (PDF) from the original on 24 March 2021. Retrieved 7 March 2021.
- ^ Zhang, Yi Ge; et al. (28 October 2013). «A 40-million-year history of atmospheric CO2«. Philosophical Transactions of the Royal Society A. 371 (2001): 20130096. Bibcode:2013RSPTA.37130096Z. doi:10.1098/rsta.2013.0096. PMID 24043869.
- ^ «Climate and CO2 in the Atmosphere». Archived from the original on 6 October 2018. Retrieved 10 October 2007.
- ^ Berner RA, Kothavala Z (2001). «GEOCARB III: A revised model of atmospheric CO2 over Phanerozoic Time» (PDF). American Journal of Science. 301 (2): 182–204. Bibcode:2001AmJS..301..182B. CiteSeerX 10.1.1.393.582. doi:10.2475/ajs.301.2.182. Archived (PDF) from the original on 4 September 2011. Retrieved 15 February 2008.
- ^ Friedlingstein P, Jones MW, O’sullivan M, Andrew RM, Hauck J, Peters GP, et al. (2019). «Global Carbon Budget 2019». Earth System Science Data. 11 (4): 1783–1838. Bibcode:2019ESSD…11.1783F. doi:10.5194/essd-11-1783-2019..
- ^ Doney SC, Levine NM (29 November 2006). «How Long Can the Ocean Slow Global Warming?». Oceanus. Archived from the original on 4 January 2008. Retrieved 21 November 2007.
- ^ Jacobson, M. Z. (2005). «Studying ocean acidification with conservative, stable numerical schemes for nonequilibrium air-ocean exchange and ocean equilibrium chemistry». Journal of Geophysical Research: Atmospheres. 110: D07302. Bibcode:2005JGRD..11007302J. doi:10.1029/2004JD005220.
- ^ a b «Ocean acidification due to increasing atmospheric carbon dioxide». The Royal Society.
- ^ Mitchell, Mark J.; Jensen, Oliver E.; Cliffe, K. Andrew; Maroto-Valer, M. Mercedes (8 May 2010). «A model of carbon dioxide dissolution and mineral carbonation kinetics». Proceedings of the Royal Society A: Mathematical, Physical and Engineering Sciences. 466 (2117): 1265–1290. doi:10.1098/rspa.2009.0349.
- ^ Lupton J, Lilley M, Butterfield D, Evans L, Embley R, Olson E, et al. (2004). «Liquid Carbon Dioxide Venting at the Champagne Hydrothermal Site, NW Eifuku Volcano, Mariana Arc». American Geophysical Union. 2004 (Fall Meeting). V43F–08. Bibcode:2004AGUFM.V43F..08L.
- ^ Inagaki F, Kuypers MM, Tsunogai U, Ishibashi J, Nakamura K, Treude T, et al. (September 2006). «Microbial community in a sediment-hosted CO2 lake of the southern Okinawa Trough hydrothermal system». Proceedings of the National Academy of Sciences of the United States of America. 103 (38): 14164–14169. Bibcode:2006PNAS..10314164I. doi:10.1073/pnas.0606083103. PMC 1599929. PMID 16959888. Videos can be downloaded at «Supporting Information». Archived from the original on 19 October 2018.
- ^ «Collecting and using biogas from landfills». U.S. Energy Information Administration. 11 January 2017. Archived from the original on 11 July 2018. Retrieved 22 November 2015.
- ^ «Facts About Landfill Gas» (PDF). U.S. Environmental Protection Agency. January 2000. Archived (PDF) from the original on 23 September 2015. Retrieved 4 September 2015.
- ^ a b Pierantozzi R (2001). «Carbon Dioxide». Kirk-Othmer Encyclopedia of Chemical Technology. Wiley. doi:10.1002/0471238961.0301180216090518.a01.pub2. ISBN 978-0-471-23896-6.
- ^
Strassburger J (1969). Blast Furnace Theory and Practice. New York: American Institute of Mining, Metallurgical, and Petroleum Engineers. ISBN 978-0-677-10420-1. - ^ Topham S (2000). «Carbon Dioxide». Ullmann’s Encyclopedia of Industrial Chemistry. doi:10.1002/14356007.a05_165. ISBN 3527306730.
- ^ «CO2 shortage: Food industry calls for government action». BBC. 21 June 2018. Archived from the original on 23 May 2021. Retrieved 24 June 2018.
- ^ «IPCC Special Report on Carbon dioxide Capture and Storage» (PDF). The Intergovernmental Panel on Climate Change. Archived from the original (PDF) on 24 September 2015. Retrieved 4 September 2015.
- ^ Morrison RT, Boyd RN (1983). Organic Chemistry (4th ed.). Allyn and Bacon. pp. 976–977. ISBN 978-0-205-05838-9.
- ^ Badwal SP, Giddey SS, Munnings C, Bhatt AI, Hollenkamp AF (24 September 2014). «Emerging electrochemical energy conversion and storage technologies». Frontiers in Chemistry. 2: 79. Bibcode:2014FrCh….2…79B. doi:10.3389/fchem.2014.00079. PMC 4174133. PMID 25309898.
- ^ Whiting D, Roll M, Vickerman L (August 2010). «Plant Growth Factors: Photosynthesis, Respiration, and Transpiration». CMG GardenNotes. Colorado Master Gardener Program. Archived from the original on 2 September 2014. Retrieved 10 October 2011.
- ^ Waggoner PE (February 1994). «Carbon dioxide». How Much Land Can Ten Billion People Spare for Nature?. Archived from the original on 12 October 2011. Retrieved 10 October 2011.
- ^ Stafford N (August 2007). «Future crops: the other greenhouse effect». Nature. 448 (7153): 526–528. Bibcode:2007Natur.448..526S. doi:10.1038/448526a. PMID 17671477. S2CID 9845813.
- ^ UK Food Standards Agency: «Current EU approved additives and their E Numbers». Archived from the original on 7 October 2010. Retrieved 27 October 2011.
- ^ US Food and Drug Administration: «Food Additive Status List». Food and Drug Administration. Archived from the original on 4 November 2017. Retrieved 13 June 2015.
- ^ Australia New Zealand Food Standards Code«Standard 1.2.4 – Labelling of ingredients». Archived from the original on 19 January 2012. Retrieved 27 October 2011.
- ^ Futurific Leading Indicators Magazine. Vol. 1. CRAES LLC. ISBN 978-0-9847670-1-4. Archived from the original on 15 August 2021. Retrieved 9 November 2020.
- ^ Vijay GP (25 September 2015). Indian Breads: A Comprehensive Guide to Traditional and Innovative Indian Breads. Westland. ISBN 978-93-85724-46-6.
- ^ «Scientists Discover Protein Receptor For Carbonation Taste». ScienceDaily. 16 October 2009. Archived from the original on 29 March 2020. Retrieved 29 March 2020.
- ^ Coghlan A (3 February 2018). «A more humane way of slaughtering chickens might get EU approval». New Scientist. Archived from the original on 24 June 2018. Retrieved 24 June 2018.
- ^ «What is CO2 stunning?». RSPCA. Archived from the original on 9 April 2014.
- ^ Campbell A (10 March 2018). «Humane execution and the fear of the tumbril». New Scientist. Archived from the original on 24 June 2018. Retrieved 24 June 2018.
- ^ Nordestgaard BG, Rostgaard J (February 1985). «Critical-point drying versus freeze drying for scanning electron microscopy: a quantitative and qualitative study on isolated hepatocytes». Journal of Microscopy. 137 (Pt 2): 189–207. doi:10.1111/j.1365-2818.1985.tb02577.x. PMID 3989858. S2CID 32065173.
- ^ «Types of Fire Extinguishers». The Fire Safety Advice Centre. Archived from the original on 28 June 2021. Retrieved 28 June 2021.
- ^ National Fire Protection Association Code 12.
- ^ Carbon Dioxide as a Fire Suppressant: Examining the Risks, US EPA. 2000.
- ^ «Appendix A: CO2 for use in enhanced oil recovery (EOR)». Accelerating the uptake of CCS: industrial use of captured carbon dioxide. Global CCS Institute. 20 December 2011. Archived from the original on 28 April 2017. Retrieved 2 January 2017.
- ^ Austell JM (2005). «CO2 for Enhanced Oil Recovery Needs – Enhanced Fiscal Incentives». Exploration & Production: The Oil & Gas Review. Archived from the original on 7 February 2012. Retrieved 28 September 2007.
- ^ «Enhanced coal bed methane recovery». ETH Zurich. 31 August 2006. Archived from the original on 6 July 2011.
- ^ Clayton M (11 January 2006). «Algae – like a breath mint for smokestacks». The Christian Science Monitor. Archived from the original on 14 September 2008. Retrieved 11 October 2007.
- ^ Atsumi S, Higashide W, Liao JC (December 2009). «Direct photosynthetic recycling of carbon dioxide to isobutyraldehyde». Nature Biotechnology. 27 (12): 1177–1180. doi:10.1038/nbt.1586. PMID 19915552. S2CID 1492698.
- ^ Cobb S, Badiani V, Dharani A, Wagner A, Zacarias S, Oliveira AR, et al. (28 February 2022). «Fast CO2 hydration kinetics impair heterogeneous but improve enzymatic CO2 reduction catalysis». Nature Chemistry. 14 (4): 417–424. Bibcode:2022NatCh..14..417C. doi:10.1038/s41557-021-00880-2. ISSN 1755-4349. PMC 7612589. PMID 35228690. S2CID 247160910.
- ^ Edwardes Moore E, Cobb SJ, Coito AM, Oliveira AR, Pereira IA, Reisner E (January 2022). «Understanding the local chemical environment of bioelectrocatalysis». Proceedings of the National Academy of Sciences of the United States of America. 119 (4): e2114097119. Bibcode:2022PNAS..11914097E. doi:10.1073/pnas.2114097119. PMC 8795565. PMID 35058361.
- ^ «Clean Way To Turn CO2 Into Fuel Inspired by Nature». Applied Sciences from Technology Networks. 1 March 2022. Retrieved 2 March 2022.
- ^ «The Coca-Cola Company Announces Adoption of HFC-Free Insulation in Refrigeration Units to Combat Global Warming». The Coca-Cola Company. 5 June 2006. Archived from the original on 1 November 2013. Retrieved 11 October 2007.
- ^ «Modine reinforces its CO2 research efforts». R744.com. 28 June 2007. Archived from the original on 10 February 2008.
- ^ TCE, the Chemical Engineer. Institution of Chemical Engineers. 1990. Archived from the original on 17 August 2021. Retrieved 2 June 2020.
- ^ a b «AVMA guidelines for the euthanasia of animals: 2020 Edition» (PDF). American Veterinary Medical Association. 2020. Archived (PDF) from the original on 1 February 2014. Retrieved 13 August 2021.
- ^ Harris D (September 1910). «The Pioneer in the Hygiene of Ventilation». The Lancet. 176 (4542): 906–908. doi:10.1016/S0140-6736(00)52420-9. Archived from the original on 17 March 2020. Retrieved 6 December 2019.
- ^ Almqvist E (2003). History of industrial gases. Springer. p. 93. ISBN 978-0-306-47277-0.
- ^ Priestley J, Hey W (1772). «Observations on Different Kinds of Air». Philosophical Transactions. 62: 147–264. doi:10.1098/rstl.1772.0021. S2CID 186210131. Archived from the original on 7 June 2010. Retrieved 11 October 2007.
- ^ Davy H (1823). «On the Application of Liquids Formed by the Condensation of Gases as Mechanical Agents». Philosophical Transactions. 113: 199–205. doi:10.1098/rstl.1823.0020. JSTOR 107649.
- ^ Thilorier AJ (1835). «Solidification de l’Acide carbonique». Comptes Rendus. 1: 194–196. Archived from the original on 2 September 2017. Retrieved 1 September 2017.
- ^ Thilorier AJ (1836). «Solidification of carbonic acid». The London and Edinburgh Philosophical Magazine. 8 (48): 446–447. doi:10.1080/14786443608648911. Archived from the original on 2 May 2016. Retrieved 15 November 2015.
External links
- Current global map of carbon dioxide concentration
- CDC – NIOSH Pocket Guide to Chemical Hazards – Carbon Dioxide
- Trends in Atmospheric Carbon Dioxide (NOAA)

|
||
|
||
| Names | ||
|---|---|---|
Other names
|
||
| Identifiers | ||
|
CAS Number |
|
|
|
3D model (JSmol) |
|
|
| 3DMet |
|
|
|
Beilstein Reference |
1900390 | |
| ChEBI |
|
|
| ChEMBL |
|
|
| ChemSpider |
|
|
| ECHA InfoCard | 100.004.271 |
|
| EC Number |
|
|
| E number | E290 (preservatives) | |
|
Gmelin Reference |
989 | |
| KEGG |
|
|
| MeSH | Carbon+dioxide | |
|
PubChem CID |
|
|
| RTECS number |
|
|
| UNII |
|
|
| UN number | 1013 (gas), 1845 (solid) | |
|
CompTox Dashboard (EPA) |
|
|
|
InChI
|
||
|
SMILES
|
||
| Properties | ||
|
Chemical formula |
CO2 | |
| Molar mass | 44.009 g·mol−1 | |
| Appearance | Colorless gas | |
| Odor |
|
|
| Density |
|
|
| Critical point (T, P) | 304.128(15) K[2] (30.978(15) °C), 7.3773(30) MPa[2] (72.808(30) atm) | |
|
Sublimation |
194.6855(30) K (−78.4645(30) °C) at 1 atm (0.101325 MPa) | |
|
Solubility in water |
1.45 g/L at 25 °C (77 °F), 100 kPa (0.99 atm) | |
| Vapor pressure | 5.7292(30) MPa, 56.54(30) atm (20 °C (293.15 K)) | |
| Acidity (pKa) | 6.35, 10.33 | |
|
Magnetic susceptibility (χ) |
−20.5·10−6 cm3/mol | |
| Thermal conductivity | 0.01662 W·m−1·K−1 (300 K (27 °C; 80 °F))[3] | |
|
Refractive index (nD) |
1.00045 | |
| Viscosity |
|
|
|
Dipole moment |
0 D | |
| Structure | ||
|
Crystal structure |
Trigonal | |
|
Molecular shape |
Linear | |
| Thermochemistry | ||
|
Heat capacity (C) |
37.135 J/K·mol | |
|
Std molar |
214 J·mol−1·K−1 | |
|
Std enthalpy of |
−393.5 kJ·mol−1 | |
| Pharmacology | ||
|
ATC code |
V03AN02 (WHO) | |
| Hazards | ||
| NFPA 704 (fire diamond) |
[7][8] 2 0 0 SA |
|
| Lethal dose or concentration (LD, LC): | ||
|
LCLo (lowest published) |
90,000 ppm (human, 5 min)[6] | |
| NIOSH (US health exposure limits): | ||
|
PEL (Permissible) |
TWA 5000 ppm (9000 mg/m3)[5] | |
|
REL (Recommended) |
TWA 5000 ppm (9000 mg/m3), ST 30,000 ppm (54,000 mg/m3)[5] | |
|
IDLH (Immediate danger) |
40,000 ppm[5] | |
| Safety data sheet (SDS) | Sigma-Aldrich | |
| Related compounds | ||
|
Other anions |
|
|
|
Other cations |
|
|
|
Related carbon oxides |
|
|
|
Related compounds |
|
|
| Supplementary data page | ||
| Carbon dioxide (data page) | ||
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Carbon dioxide (chemical formula CO2) is a chemical compound made up of molecules that each have one carbon atom covalently double bonded to two oxygen atoms. It is found in the gas state at room temperature. In the air, carbon dioxide is transparent to visible light but absorbs infrared radiation, acting as a greenhouse gas. It is a trace gas in Earth’s atmosphere at 421 parts per million (ppm), or about 0.04% by volume (as of May 2022), having risen from pre-industrial levels of 280 ppm.[9][10] Burning fossil fuels is the primary cause of these increased CO2 concentrations and also the primary cause of climate change.[11] Carbon dioxide is soluble in water and is found in groundwater, lakes, ice caps, and seawater. When carbon dioxide dissolves in water, it forms carbonic acid (H2CO3), which causes ocean acidification as atmospheric CO2 levels increase.[12]
As the source of available carbon in the carbon cycle, atmospheric CO2 is the primary carbon source for life on Earth. Its concentration in Earth’s pre-industrial atmosphere since late in the Precambrian has been regulated by organisms and geological phenomena. Plants, algae and cyanobacteria use energy from sunlight to synthesize carbohydrates from carbon dioxide and water in a process called photosynthesis, which produces oxygen as a waste product.[13] In turn, oxygen is consumed and CO2 is released as waste by all aerobic organisms when they metabolize organic compounds to produce energy by respiration.[14] CO2 is released from organic materials when they decay or combust, such as in forest fires. Since plants require CO2 for photosynthesis, and humans and animals depend on plants for food, CO2 is necessary for the survival of life on earth.
Carbon dioxide is 53% more dense than dry air, but is long lived and thoroughly mixes in the atmosphere. About half of excess CO2 emissions to the atmosphere are absorbed by land and ocean carbon sinks.[15] These sinks can become saturated and are volatile, as decay and wildfires result in the CO2 being released back into the atmosphere.[16] CO2 is eventually sequestered (stored for the long term) in rocks and organic deposits like coal, petroleum and natural gas. Sequestered CO2 is released into the atmosphere through burning fossil fuels or naturally by volcanoes, hot springs, geysers, and when carbonate rocks dissolve in water or react with acids.
CO2 is a versatile industrial material, used, for example, as an inert gas in welding and fire extinguishers, as a pressurizing gas in air guns and oil recovery, and as a supercritical fluid solvent in decaffeination of coffee and supercritical drying.[17] It is a byproduct of fermentation of sugars in bread, beer and wine making, and is added to carbonated beverages like seltzer and beer for effervescence. It has a sharp and acidic odor and generates the taste of soda water in the mouth,[18] but at normally encountered concentrations it is odorless.[1]
Chemical and physical properties
Structure, bonding and molecular vibrations
The symmetry of a carbon dioxide molecule is linear and centrosymmetric at its equilibrium geometry. The length of the carbon-oxygen bond in carbon dioxide is 116.3 pm, noticeably shorter than the roughly 140-pm length of a typical single C–O bond, and shorter than most other C–O multiply-bonded functional groups such as carbonyls.[19] Since it is centrosymmetric, the molecule has no electric dipole moment.
Stretching and bending oscillations of the CO2 carbon dioxide molecule. Upper left: symmetric stretching. Upper right: antisymmetric stretching. Lower line: degenerate pair of bending modes.
As a linear triatomic molecule, CO2 has four vibrational modes as shown in the diagram. In the symmetric and the antisymmetric stretching modes, the atoms move along the axis of the molecule. There are two bending modes, which are degenerate, meaning that they have the same frequency and same energy, because of the symmetry of the molecule. When a molecule touches a surface or touches another molecule, the two bending modes can differ in frequency because the interaction is different for the two modes. Some of the vibrational modes are observed in the infrared (IR) spectrum: the antisymmetric stretching mode at wavenumber 2349 cm−1 (wavelength 4.25 μm) and the degenerate pair of bending modes at 667 cm−1 (wavelength 15 μm). The symmetric stretching mode does not create an electric dipole so is not observed in IR spectroscopy, but it is detected in by Raman spectroscopy at 1388 cm−1 (wavelength 7.2 μm).[20]
In the gas phase, carbon dioxide molecules undergo significant vibrational motions and do not keep a fixed structure. However, in a Coulomb explosion imaging experiment, an instantaneous image of the molecular structure can be deduced. Such an experiment[21] has been performed for carbon dioxide.
The result of this experiment, and the conclusion of theoretical calculations[22] based on an ab initio potential energy surface of the molecule, is that none of the
molecules in the gas phase are ever exactly linear. This counter-intuitive result is trivially due to
the fact that the nuclear motion volume element vanishes for linear geometries.[22]
This is so for all molecules (except diatomics!).
In aqueous solution
Carbon dioxide is soluble in water, in which it reversibly forms H2CO3 (carbonic acid), which is a weak acid since its ionization in water is incomplete.
The hydration equilibrium constant of carbonic acid is, at 25 °C:
Hence, the majority of the carbon dioxide is not converted into carbonic acid, but remains as CO2 molecules, not affecting the pH.
The relative concentrations of CO2, H2CO3, and the deprotonated forms HCO−3 (bicarbonate) and CO2−3(carbonate) depend on the pH. As shown in a Bjerrum plot, in neutral or slightly alkaline water (pH > 6.5), the bicarbonate form predominates (>50%) becoming the most prevalent (>95%) at the pH of seawater. In very alkaline water (pH > 10.4), the predominant (>50%) form is carbonate. The oceans, being mildly alkaline with typical pH = 8.2–8.5, contain about 120 mg of bicarbonate per liter.
Being diprotic, carbonic acid has two acid dissociation constants, the first one for the dissociation into the bicarbonate (also called hydrogen carbonate) ion (HCO−3):
- Ka1 = 2.5×10−4 mol/L; pKa1 = 3.6 at 25 °C.[19]
This is the true first acid dissociation constant, defined as
where the denominator includes only covalently bound H2CO3 and does not include hydrated CO2(aq). The much smaller and often-quoted value near 4.16×10−7 is an apparent value calculated on the (incorrect) assumption that all dissolved CO2 is present as carbonic acid, so that
Since most of the dissolved CO2remains as CO2 molecules, Ka1(apparent) has a much larger denominator and a much smaller value than the true Ka1.[23]
The bicarbonate ion is an amphoteric species that can act as an acid or as a base, depending on pH of the solution. At high pH, it dissociates significantly into the carbonate ion (CO2−3):
- Ka2 = 4.69×10−11 mol/L; pKa2 = 10.329
In organisms carbonic acid production is catalysed by the enzyme, carbonic anhydrase.
Chemical reactions of CO2
CO2 is a potent electrophile having an electrophilic reactivity that is comparable to benzaldehyde or strong α,β-unsaturated carbonyl compounds. However, unlike electrophiles of similar reactivity, the reactions of nucleophiles with CO2 are thermodynamically less favored and are often found to be highly reversible.[24] Only very strong nucleophiles, like the carbanions provided by Grignard reagents and organolithium compounds react with CO2 to give carboxylates:
- where M = Li or Mg Br and R = alkyl or aryl.
In metal carbon dioxide complexes, CO2 serves as a ligand, which can facilitate the conversion of CO2 to other chemicals.[25]
The reduction of CO2 to CO is ordinarily a difficult and slow reaction:
Photoautotrophs (i.e. plants and cyanobacteria) use the energy contained in sunlight to photosynthesize simple sugars from CO2 absorbed from the air and water:
The redox potential for this reaction near pH 7 is about −0.53 V versus the standard hydrogen electrode. The nickel-containing enzyme carbon monoxide dehydrogenase catalyses this process.[26]
Physical properties
Pellets of «dry ice», a common form of solid carbon dioxide
Carbon dioxide is colorless. At low concentrations the gas is odorless; however, at sufficiently high concentrations, it has a sharp, acidic odor.[1] At standard temperature and pressure, the density of carbon dioxide is around 1.98 kg/m3, about 1.53 times that of air.[27]
Carbon dioxide has no liquid state at pressures below 0.51795(10) MPa[2] (5.11177(99) atm). At a pressure of 1 atm (0.101325 MPa), the gas deposits directly to a solid at temperatures below 194.6855(30) K[2] (−78.4645(30) °C) and the solid sublimes directly to a gas above this temperature. In its solid state, carbon dioxide is commonly called dry ice.
Pressure–temperature phase diagram of carbon dioxide. Note that it is a log-lin chart.
Liquid carbon dioxide forms only at pressures above 0.51795(10) MPa[2] (5.11177(99) atm); the triple point of carbon dioxide is 216.592(3) K[2] (−56.558(3) °C) at 0.51795(10) MPa[2] (5.11177(99) atm) (see phase diagram). The critical point is 304.128(15) K[2] (30.978(15) °C) at 7.3773(30) MPa[2] (72.808(30) atm). Another form of solid carbon dioxide observed at high pressure is an amorphous glass-like solid.[28] This form of glass, called carbonia, is produced by supercooling heated CO2 at extreme pressures (40–48 GPa, or about 400,000 atmospheres) in a diamond anvil. This discovery confirmed the theory that carbon dioxide could exist in a glass state similar to other members of its elemental family, like silicon dioxide (silica glass) and germanium dioxide. Unlike silica and germania glasses, however, carbonia glass is not stable at normal pressures and reverts to gas when pressure is released.
At temperatures and pressures above the critical point, carbon dioxide behaves as a supercritical fluid known as supercritical carbon dioxide.
Table of thermal and physical properties of saturated liquid carbon dioxide:[29][30]
| Temperature (°C) | Density (kg/m^3) | Specific heat (kJ/kg K) | Kinematic viscosity (m^2/s) | Conductivity (W/m K) | Thermal diffusivity (m^2/s) | Prandtl Number | Bulk modulus (K^-1) |
| -50 | 1156.34 | 1.84 | 1.19E-07 | 0.0855 | 4.02E-08 | 2.96 | — |
| -40 | 1117.77 | 1.88 | 1.18E-07 | 0.1011 | 4.81E-08 | 2.46 | — |
| -30 | 1076.76 | 1.97 | 1.17E-07 | 0.1116 | 5.27E-08 | 2.22 | — |
| -20 | 1032.39 | 2.05 | 1.15E-07 | 0.1151 | 5.45E-08 | 2.12 | — |
| -10 | 983.38 | 2.18 | 1.13E-07 | 0.1099 | 5.13E-08 | 2.2 | — |
| 0 | 926.99 | 2.47 | 1.08E-07 | 0.1045 | 4.58E-08 | 2.38 | — |
| 10 | 860.03 | 3.14 | 1.01E-07 | 0.0971 | 3.61E-08 | 2.8 | — |
| 20 | 772.57 | 5 | 9.10E-08 | 0.0872 | 2.22E-08 | 4.1 | 1.40E-02 |
| 30 | 597.81 | 36.4 | 8.00E-08 | 0.0703 | 0.279E-08 | 28.7 | — |
Table of thermal and physical properties of carbon dioxide (CO2) at atmospheric pressure:[29][30]
| Temperature (K) | Density (kg/m^3) | Specific heat (kJ/kg °C) | Dynamic viscosity (kg/m s) | Kinematic viscosity (m^2/s) | Thermal conductivity (W/m °C) | Thermal diffusivity (m^2/s) | Prandtl Number |
| 220 | 2.4733 | 0.783 | 1.11E-05 | 4.49E-06 | 0.010805 | 5.92E-06 | 0.818 |
| 250 | 2.1657 | 0.804 | 1.26E-05 | 5.81E-06 | 0.012884 | 7.40E-06 | 0.793 |
| 300 | 1.7973 | 0.871 | 1.50E-05 | 8.32E-06 | 0.016572 | 1.06E-05 | 0.77 |
| 350 | 1.5362 | 0.9 | 1.72E-05 | 1.12E-05 | 0.02047 | 1.48E-05 | 0.755 |
| 400 | 1.3424 | 0.942 | 1.93E-05 | 1.44E-05 | 0.02461 | 1.95E-05 | 0.738 |
| 450 | 1.1918 | 0.98 | 2.13E-05 | 1.79E-05 | 0.02897 | 2.48E-05 | 0.721 |
| 500 | 1.0732 | 1.013 | 2.33E-05 | 2.17E-05 | 0.03352 | 3.08E-05 | 0.702 |
| 550 | 0.9739 | 1.047 | 2.51E-05 | 2.57E-05 | 0.03821 | 3.75E-05 | 0.685 |
| 600 | 0.8938 | 1.076 | 2.68E-05 | 3.00E-05 | 0.04311 | 4.48E-05 | 0.668 |
| 650 | 0.8143 | 1.1 | 2.88E-05 | 3.54E-05 | 0.0445 | 4.97E-05 | 0.712 |
| 700 | 0.7564 | 1.13E+00 | 3.05E-05 | 4.03E-05 | 0.0481 | 5.63E-05 | 0.717 |
| 750 | 0.7057 | 1.15 | 3.21E-05 | 4.55E-05 | 0.0517 | 6.37E-05 | 0.714 |
| 800 | 0.6614 | 1.17E+00 | 3.37E-05 | 5.10E-05 | 0.0551 | 7.12E-05 | 0.716 |
Biological role
Carbon dioxide is an end product of cellular respiration in organisms that obtain energy by breaking down sugars, fats and amino acids with oxygen as part of their metabolism. This includes all plants, algae and animals and aerobic fungi and bacteria. In vertebrates, the carbon dioxide travels in the blood from the body’s tissues to the skin (e.g., amphibians) or the gills (e.g., fish), from where it dissolves in the water, or to the lungs from where it is exhaled. During active photosynthesis, plants can absorb more carbon dioxide from the atmosphere than they release in respiration.
Photosynthesis and carbon fixation
Carbon fixation is a biochemical process by which atmospheric carbon dioxide is incorporated by plants, algae and (cyanobacteria) into energy-rich organic molecules such as glucose, thus creating their own food by photosynthesis. Photosynthesis uses carbon dioxide and water to produce sugars from which other organic compounds can be constructed, and oxygen is produced as a by-product.
Ribulose-1,5-bisphosphate carboxylase oxygenase, commonly abbreviated to RuBisCO, is the enzyme involved in the first major step of carbon fixation, the production of two molecules of 3-phosphoglycerate from CO2 and ribulose bisphosphate, as shown in the diagram at left.
RuBisCO is thought to be the single most abundant protein on Earth.[31]
Phototrophs use the products of their photosynthesis as internal food sources and as raw material for the biosynthesis of more complex organic molecules, such as polysaccharides, nucleic acids and proteins. These are used for their own growth, and also as the basis of the food chains and webs that feed other organisms, including animals such as ourselves. Some important phototrophs, the coccolithophores synthesise hard calcium carbonate scales.[32] A globally significant species of coccolithophore is Emiliania huxleyi whose calcite scales have formed the basis of many sedimentary rocks such as limestone, where what was previously atmospheric carbon can remain fixed for geological timescales.
Overview of photosynthesis and respiration. Carbon dioxide (at right), together with water, form oxygen and organic compounds (at left) by photosynthesis, which can be respired to water and (CO2).
Plants can grow as much as 50 percent faster in concentrations of 1,000 ppm CO2 when compared with ambient conditions, though this assumes no change in climate and no limitation on other nutrients.[33] Elevated CO2 levels cause increased growth reflected in the harvestable yield of crops, with wheat, rice and soybean all showing increases in yield of 12–14% under elevated CO2 in FACE experiments.[34][35]
Increased atmospheric CO2 concentrations result in fewer stomata developing on plants[36] which leads to reduced water usage and increased water-use efficiency.[37] Studies using FACE have shown that CO2 enrichment leads to decreased concentrations of micronutrients in crop plants.[38] This may have knock-on effects on other parts of ecosystems as herbivores will need to eat more food to gain the same amount of protein.[39]
The concentration of secondary metabolites such as phenylpropanoids and flavonoids can also be altered in plants exposed to high concentrations of CO2.[40][41]
Plants also emit CO2 during respiration, and so the majority of plants and algae, which use C3 photosynthesis, are only net absorbers during the day. Though a growing forest will absorb many tons of CO2 each year, a mature forest will produce as much CO2 from respiration and decomposition of dead specimens (e.g., fallen branches) as is used in photosynthesis in growing plants.[42] Contrary to the long-standing view that they are carbon neutral, mature forests can continue to accumulate carbon[43] and remain valuable carbon sinks, helping to maintain the carbon balance of Earth’s atmosphere. Additionally, and crucially to life on earth, photosynthesis by phytoplankton consumes dissolved CO2 in the upper ocean and thereby promotes the absorption of CO2 from the atmosphere.[44]
Toxicity
Symptoms of carbon dioxide toxicity, by increasing volume percent in air[45]
Carbon dioxide content in fresh air (averaged between sea-level and 10 kPa level, i.e., about 30 km (19 mi) altitude) varies between 0.036% (360 ppm) and 0.041% (412 ppm), depending on the location.[46][clarification needed]
CO2 is an asphyxiant gas and not classified as toxic or harmful in accordance with Globally Harmonized System of Classification and Labelling of Chemicals standards of United Nations Economic Commission for Europe by using the OECD Guidelines for the Testing of Chemicals. In concentrations up to 1% (10,000 ppm), it will make some people feel drowsy and give the lungs a stuffy feeling.[45] Concentrations of 7% to 10% (70,000 to 100,000 ppm) may cause suffocation, even in the presence of sufficient oxygen, manifesting as dizziness, headache, visual and hearing dysfunction, and unconsciousness within a few minutes to an hour.[47] The physiological effects of acute carbon dioxide exposure are grouped together under the term hypercapnia, a subset of asphyxiation.
Because it is heavier than air, in locations where the gas seeps from the ground (due to sub-surface volcanic or geothermal activity) in relatively high concentrations, without the dispersing effects of wind, it can collect in sheltered/pocketed locations below average ground level, causing animals located therein to be suffocated. Carrion feeders attracted to the carcasses are then also killed. Children have been killed in the same way near the city of Goma by CO2 emissions from the nearby volcano Mount Nyiragongo.[48] The Swahili term for this phenomenon is mazuku.
Adaptation to increased concentrations of CO2 occurs in humans, including modified breathing and kidney bicarbonate production, in order to balance the effects of blood acidification (acidosis). Several studies suggested that 2.0 percent inspired concentrations could be used for closed air spaces (e.g. a submarine) since the adaptation is physiological and reversible, as deterioration in performance or in normal physical activity does not happen at this level of exposure for five days.[49][50] Yet, other studies show a decrease in cognitive function even at much lower levels.[51][52] Also, with ongoing respiratory acidosis, adaptation or compensatory mechanisms will be unable to reverse such condition.
Below 1%
There are few studies of the health effects of long-term continuous CO2 exposure on humans and animals at levels below 1%. Occupational CO2 exposure limits have been set in the United States at 0.5% (5000 ppm) for an eight-hour period.[53] At this CO2 concentration, International Space Station crew experienced headaches, lethargy, mental slowness, emotional irritation, and sleep disruption.[54] Studies in animals at 0.5% CO2 have demonstrated kidney calcification and bone loss after eight weeks of exposure.[55] A study of humans exposed in 2.5 hour sessions demonstrated significant negative effects on cognitive abilities at concentrations as low as 0.1% (1000 ppm) CO2 likely due to CO2 induced increases in cerebral blood flow.[51] Another study observed a decline in basic activity level and information usage at 1000 ppm, when compared to 500 ppm.[52] However a review of the literature found that most studies on the phenomenon of carbon dioxide induced cognitive impairment to have a small effect on high-level decision making and most of the studies were confounded by inadequate study designs, environmental comfort, uncertainties in exposure doses and differing cognitive assessments used.[56] Similarly a study on the effects of the concentration of CO2 in motorcycle helmets has been criticized for having dubious methodology in not noting the self-reports of motorcycle riders and taking measurements using mannequins. Further when normal motorcycle conditions were achieved (such as highway or city speeds) or the visor was raised the concentration of CO2 declined to safe levels (0.2%).[57][58]
Ventilation
Poor ventilation is one of the main causes of excessive CO2 concentrations in closed spaces, leading to poor indoor air quality. Carbon dioxide differential above outdoor concentrations at steady state conditions (when the occupancy and ventilation system operation are sufficiently long that CO2 concentration has stabilized) are sometimes used to estimate ventilation rates per person.[citation needed] Higher CO2 concentrations are associated with occupant health, comfort and performance degradation.[59][60] ASHRAE Standard 62.1–2007 ventilation rates may result in indoor concentrations up to 2,100 ppm above ambient outdoor conditions. Thus if the outdoor concentration is 400 ppm, indoor concentrations may reach 2,500 ppm with ventilation rates that meet this industry consensus standard. Concentrations in poorly ventilated spaces can be found even higher than this (range of 3,000 or 4,000 ppm).
Miners, who are particularly vulnerable to gas exposure due to insufficient ventilation, referred to mixtures of carbon dioxide and nitrogen as «blackdamp», «choke damp» or «stythe». Before more effective technologies were developed, miners would frequently monitor for dangerous levels of blackdamp and other gases in mine shafts by bringing a caged canary with them as they worked. The canary is more sensitive to asphyxiant gases than humans, and as it became unconscious would stop singing and fall off its perch. The Davy lamp could also detect high levels of blackdamp (which sinks, and collects near the floor) by burning less brightly, while methane, another suffocating gas and explosion risk, would make the lamp burn more brightly.
In February 2020, three people died from suffocation at a party in Moscow when dry ice (frozen CO2) was added to a swimming pool to cool it down.[61] A similar accident occurred in 2018 when a woman died from CO2 fumes emanating from the large amount of dry ice she was transporting in her car.[62]
Outdoor areas with elevated concentrations
Local concentrations of carbon dioxide can reach high values near strong sources, especially those that are isolated by surrounding terrain. At the Bossoleto hot spring near Rapolano Terme in Tuscany, Italy, situated in a bowl-shaped depression about 100 m (330 ft) in diameter, concentrations of CO2 rise to above 75% overnight, sufficient to kill insects and small animals. After sunrise the gas is dispersed by convection.[63] High concentrations of CO2 produced by disturbance of deep lake water saturated with CO2 are thought to have caused 37 fatalities at Lake Monoun, Cameroon in 1984 and 1700 casualties at Lake Nyos, Cameroon in 1986.[64]
Human physiology
Content
| Blood compartment | (kPa) | (mm Hg) | |
|---|---|---|---|
| Venous blood carbon dioxide | 5.5–6.8 | 41–51[65] | 41–51[65] |
| Alveolar pulmonary gas pressures |
4.8 | 36 | 36 |
| Arterial blood carbon dioxide | 4.7–6.0 | 35–45[65] | 35–45[65] |
The body produces approximately 2.3 pounds (1.0 kg) of carbon dioxide per day per person,[66] containing 0.63 pounds (290 g) of carbon. In humans, this carbon dioxide is carried through the venous system and is breathed out through the lungs, resulting in lower concentrations in the arteries. The carbon dioxide content of the blood is often given as the partial pressure, which is the pressure which carbon dioxide would have had if it alone occupied the volume.[67] In humans, the blood carbon dioxide contents is shown in the adjacent table.
Transport in the blood
CO2 is carried in blood in three different ways. (Exact percentages vary between arterial and venous blood).
- Majority (about 70% to 80%) is converted to bicarbonate ions HCO−3 by the enzyme carbonic anhydrase in the red blood cells,[68] by the reaction CO2 + H2O → H2CO3 → H+ + HCO−3.
- 5–10% is dissolved in blood plasma[68]
- 5–10% is bound to hemoglobin as carbamino compounds[68]
Hemoglobin, the main oxygen-carrying molecule in red blood cells, carries both oxygen and carbon dioxide. However, the CO2 bound to hemoglobin does not bind to the same site as oxygen. Instead, it combines with the N-terminal groups on the four globin chains. However, because of allosteric effects on the hemoglobin molecule, the binding of CO2 decreases the amount of oxygen that is bound for a given partial pressure of oxygen. This is known as the Haldane Effect, and is important in the transport of carbon dioxide from the tissues to the lungs. Conversely, a rise in the partial pressure of CO2 or a lower pH will cause offloading of oxygen from hemoglobin, which is known as the Bohr effect.
Regulation of respiration
Carbon dioxide is one of the mediators of local autoregulation of blood supply. If its concentration is high, the capillaries expand to allow a greater blood flow to that tissue.[69]
Bicarbonate ions are crucial for regulating blood pH. A person’s breathing rate influences the level of CO2 in their blood. Breathing that is too slow or shallow causes respiratory acidosis, while breathing that is too rapid leads to hyperventilation, which can cause respiratory alkalosis.[70]
Although the body requires oxygen for metabolism, low oxygen levels normally do not stimulate breathing. Rather, breathing is stimulated by higher carbon dioxide levels. As a result, breathing low-pressure air or a gas mixture with no oxygen at all (such as pure nitrogen) can lead to loss of consciousness without ever experiencing air hunger. This is especially perilous for high-altitude fighter pilots. It is also why flight attendants instruct passengers, in case of loss of cabin pressure, to apply the oxygen mask to themselves first before helping others; otherwise, one risks losing consciousness.[68]
The respiratory centers try to maintain an arterial CO2 pressure of 40 mm Hg. With intentional hyperventilation, the CO2 content of arterial blood may be lowered to 10–20 mm Hg (the oxygen content of the blood is little affected), and the respiratory drive is diminished. This is why one can hold one’s breath longer after hyperventilating than without hyperventilating. This carries the risk that unconsciousness may result before the need to breathe becomes overwhelming, which is why hyperventilation is particularly dangerous before free diving.[71]
Concentrations and role in the environment
Atmosphere
Atmospheric CO2 concentrations measured at Mauna Loa Observatory from 1958 to 2022 (also called the Keeling Curve). Carbon dioxide concentrations have varied widely over the Earth’s 4.54 billion year history. However, in 2013 the daily mean concentration of CO2 in the atmosphere surpassed 400 parts per million (ppmv)[72] — this level has never been reached since the mid-Pliocene, 2 to 4 million years ago.[73]
Carbon dioxide in Earth’s atmosphere is a trace gas that plays an integral part in the greenhouse effect, carbon cycle, photosynthesis and oceanic carbon cycle. It is one of several greenhouse gases in Earth’s atmosphere that are contributing to climate change due to increasing emissions of greenhouse gases from human activities. The current global average concentration of CO2 in the atmosphere is 421 ppm as of May 2022.[74] This is an increase of 50% since the start of the Industrial Revolution, up from 280 ppm during the 10,000 years prior to the mid-18th century.[75][74][76] The increase is due to human activity.[77] Burning fossil fuels is the main cause of these increased CO2 concentrations and also the main cause of climate change.[78] Other large anthropogenic sources include cement production, deforestation, and biomass burning.
While transparent to visible light, carbon dioxide is a greenhouse gas, absorbing and emitting infrared radiation at its two infrared-active vibrational frequencies. CO2 absorbs and emits infrared radiation at wavelengths of 4.26 μm (2,347 cm−1) (asymmetric stretching vibrational mode) and 14.99 μm (667 cm−1) (bending vibrational mode). It plays a significant role in influencing Earth’s surface temperature through the greenhouse effect.[79] Light emission from the Earth’s surface is most intense in the infrared region between 200 and 2500 cm−1,[80] as opposed to light emission from the much hotter Sun which is most intense in the visible region. Absorption of infrared light at the vibrational frequencies of atmospheric CO2 traps energy near the surface, warming the surface and the lower atmosphere. Less energy reaches the upper atmosphere, which is therefore cooler because of this absorption.[81]
Increases in atmospheric concentrations of CO2 and other long-lived greenhouse gases such as methane, nitrous oxide and ozone increase the absorption and emission of infrared radiation by the atmosphere, causing the observed rise in average global temperature and ocean acidification. Another direct effect is the CO2 fertilization effect. These changes cause a range of indirect effects of climate change on the physical environment, ecosystems and human societies. Carbon dioxide exerts a larger overall warming influence than all of the other greenhouse gases combined.[76] It has an atmospheric lifetime that increases with the cumulative amount of fossil carbon extracted and burned, due to the imbalance that this activity has imposed on Earth’s fast carbon cycle.[82] This means that some fraction (a projected 20-35%) of the fossil carbon transferred thus far will persist in the atmosphere as elevated CO2 levels for many thousands of years after these carbon transfer activities begin to subside.[83][84][85] The carbon cycle is a biogeochemical cycle in which carbon is exchanged between the Earth’s oceans, soil, rocks and the biosphere. Plants and other photoautotrophs use solar energy to produce carbohydrate from atmospheric carbon dioxide and water by photosynthesis. Almost all other organisms depend on carbohydrate derived from photosynthesis as their primary source of energy and carbon compounds.
The present atmospheric concentration of CO2 is the highest for 14 million years.[86] Concentrations of CO2 in the atmosphere were as high as 4,000 ppm during the Cambrian period about 500 million years ago, when the concentration was 20 times greater than today, and as low as 180 ppm during the Quaternary glaciation of the last two million years.[75] Reconstructed temperature records for the last 420 million years indicate that atmospheric CO2 concentrations peaked at ~2,000 ppm during the Devonian (~400 Ma) period, and again in the Triassic (220–200 Ma) period and was four times current levels during the Jurassic period (201-145 Ma).[87][88]
Annual CO2 flows from anthropogenic sources (left) into Earth’s atmosphere, land, and ocean sinks (right) since the 1960s. Units in equivalent gigatonnes carbon per year.[89]
Oceans
Ocean acidification
Carbon dioxide dissolves in the ocean to form carbonic acid (H2CO3), bicarbonate (HCO3−) and carbonate (CO32−). There is about fifty times as much carbon dioxide dissolved in the oceans as exists in the atmosphere. The oceans act as an enormous carbon sink, and have taken up about a third of CO2 emitted by human activity.[90]
Pterapod shell dissolved in seawater adjusted to an ocean chemistry projected for the year 2100
Changes in ocean chemistry can have extensive direct and indirect effects on organisms and their habitats. One of the most important repercussions of increasing ocean acidity relates to the production of shells out of calcium carbonate (CaCO
3).[92] This process is called calcification and is important to the biology and survival of a wide range of marine organisms. Calcification involves the precipitation of dissolved ions into solid CaCO
3 structures, structures for many marine organisms, such as coccolithophores, foraminifera, crustaceans, mollusks, etc. After they are formed, these CaCO
3 structures are vulnerable to dissolution unless the surrounding seawater contains saturating concentrations of carbonate ions (CO32−).
Given the current pH of the ocean (around 8.14), of the extra carbon dioxide added into the ocean, very little remains as dissolved carbon dioxide. The majority dissociates into additional bicarbonate and free hydrogen ions. The increase in hydrogen is larger than the increase in bicarbonate,[93] creating an imbalance in the reaction HCO3− ⇌ CO32− + H+. To maintain chemical equilibrium, some of the carbonate ions already in the ocean combine with some of the hydrogen ions to make further bicarbonate. Thus the ocean’s concentration of carbonate ions is reduced, removing an essential building block for marine organisms to build shells, or calcify: Ca2+ + CO32− ⇌ CaCO3.
Hydrothermal vents
Carbon dioxide is also introduced into the oceans through hydrothermal vents. The Champagne hydrothermal vent, found at the Northwest Eifuku volcano in the Mariana Trench, produces almost pure liquid carbon dioxide, one of only two known sites in the world as of 2004, the other being in the Okinawa Trough.[94] The finding of a submarine lake of liquid carbon dioxide in the Okinawa Trough was reported in 2006.[95]
Production
Biological processes
Carbon dioxide is a by-product of the fermentation of sugar in the brewing of beer, whisky and other alcoholic beverages and in the production of bioethanol. Yeast metabolizes sugar to produce CO2 and ethanol, also known as alcohol, as follows:
All aerobic organisms produce CO2 when they oxidize carbohydrates, fatty acids, and proteins. The large number of reactions involved are exceedingly complex and not described easily. Refer to (cellular respiration, anaerobic respiration and photosynthesis). The equation for the respiration of glucose and other monosaccharides is:
Anaerobic organisms decompose organic material producing methane and carbon dioxide together with traces of other compounds.[96] Regardless of the type of organic material, the production of gases follows well defined kinetic pattern. Carbon dioxide comprises about 40–45% of the gas that emanates from decomposition in landfills (termed «landfill gas»). Most of the remaining 50–55% is methane.[97]
Industrial processes
Carbon dioxide can be obtained by distillation from air, but the method is inefficient. Industrially, carbon dioxide is predominantly an unrecovered waste product, produced by several methods which may be practiced at various scales.[98]
Combustion
The combustion of all carbon-based fuels, such as methane (natural gas), petroleum distillates (gasoline, diesel, kerosene, propane), coal, wood and generic organic matter produces carbon dioxide and, except in the case of pure carbon, water. As an example, the chemical reaction between methane and oxygen:
Iron is reduced from its oxides with coke in a blast furnace, producing pig iron and carbon dioxide:[99]
By-product from hydrogen production
Carbon dioxide is a byproduct of the industrial production of hydrogen by steam reforming and the water gas shift reaction in ammonia production. These processes begin with the reaction of water and natural gas (mainly methane).[100] This is a major source of food-grade carbon dioxide for use in carbonation of beer and soft drinks, and is also used for stunning animals such as poultry. In the summer of 2018 a shortage of carbon dioxide for these purposes arose in Europe due to the temporary shut-down of several ammonia plants for maintenance.[101]
Thermal decomposition of limestone
It is produced by thermal decomposition of limestone, CaCO3 by heating (calcining) at about 850 °C (1,560 °F), in the manufacture of quicklime (calcium oxide, CaO), a compound that has many industrial uses:
Acids liberate CO2 from most metal carbonates. Consequently, it may be obtained directly from natural carbon dioxide springs, where it is produced by the action of acidified water on limestone or dolomite. The reaction between hydrochloric acid and calcium carbonate (limestone or chalk) is shown below:
The carbonic acid (H2CO3) then decomposes to water and CO2:
Such reactions are accompanied by foaming or bubbling, or both, as the gas is released. They have widespread uses in industry because they can be used to neutralize waste acid streams.
Commercial uses
Carbon dioxide is used by the food industry, the oil industry, and the chemical industry.[98]
The compound has varied commercial uses but one of its greatest uses as a chemical is in the production of carbonated beverages; it provides the sparkle in carbonated beverages such as soda water, beer and sparkling wine.
Precursor to chemicals
|
This section needs expansion. You can help by adding to it. (July 2014) |
In the chemical industry, carbon dioxide is mainly consumed as an ingredient in the production of urea, with a smaller fraction being used to produce methanol and a range of other products.[102] Some carboxylic acid derivatives such as sodium salicylate are prepared using CO2 by the Kolbe–Schmitt reaction.[103]
In addition to conventional processes using CO2 for chemical production, electrochemical methods are also being explored at a research level. In particular, the use of renewable energy for production of fuels from CO2 (such as methanol) is attractive as this could result in fuels that could be easily transported and used within conventional combustion technologies but have no net CO2 emissions.[104]
Agriculture
Plants require carbon dioxide to conduct photosynthesis. The atmospheres of greenhouses may (if of large size, must) be enriched with additional CO2 to sustain and increase the rate of plant growth.[105][106] At very high concentrations (100 times atmospheric concentration, or greater), carbon dioxide can be toxic to animal life, so raising the concentration to 10,000 ppm (1%) or higher for several hours will eliminate pests such as whiteflies and spider mites in a greenhouse.[107]
Foods
Carbon dioxide bubbles in a soft drink
Carbon dioxide is a food additive used as a propellant and acidity regulator in the food industry. It is approved for usage in the EU[108] (listed as E number E290), US[109] and Australia and New Zealand[110] (listed by its INS number 290).
A candy called Pop Rocks is pressurized with carbon dioxide gas[111] at about 4,000 kPa (40 bar; 580 psi). When placed in the mouth, it dissolves (just like other hard candy) and releases the gas bubbles with an audible pop.
Leavening agents cause dough to rise by producing carbon dioxide.[112] Baker’s yeast produces carbon dioxide by fermentation of sugars within the dough, while chemical leaveners such as baking powder and baking soda release carbon dioxide when heated or if exposed to acids.
Beverages
Carbon dioxide is used to produce carbonated soft drinks and soda water. Traditionally, the carbonation of beer and sparkling wine came about through natural fermentation, but many manufacturers carbonate these drinks with carbon dioxide recovered from the fermentation process. In the case of bottled and kegged beer, the most common method used is carbonation with recycled carbon dioxide. With the exception of British real ale, draught beer is usually transferred from kegs in a cold room or cellar to dispensing taps on the bar using pressurized carbon dioxide, sometimes mixed with nitrogen.
The taste of soda water (and related taste sensations in other carbonated beverages) is an effect of the dissolved carbon dioxide rather than the bursting bubbles of the gas. Carbonic anhydrase 4 converts to carbonic acid leading to a sour taste, and also the dissolved carbon dioxide induces a somatosensory response.[113]
Winemaking
Dry ice used to preserve grapes after harvest
Carbon dioxide in the form of dry ice is often used during the cold soak phase in winemaking to cool clusters of grapes quickly after picking to help prevent spontaneous fermentation by wild yeast. The main advantage of using dry ice over water ice is that it cools the grapes without adding any additional water that might decrease the sugar concentration in the grape must, and thus the alcohol concentration in the finished wine. Carbon dioxide is also used to create a hypoxic environment for carbonic maceration, the process used to produce Beaujolais wine.
Carbon dioxide is sometimes used to top up wine bottles or other storage vessels such as barrels to prevent oxidation, though it has the problem that it can dissolve into the wine, making a previously still wine slightly fizzy. For this reason, other gases such as nitrogen or argon are preferred for this process by professional wine makers.
Stunning animals
Carbon dioxide is often used to «stun» animals before slaughter.[114] «Stunning» may be a misnomer, as the animals are not knocked out immediately and may suffer distress.[115][116]
Inert gas
Carbon dioxide is one of the most commonly used compressed gases for pneumatic (pressurized gas) systems in portable pressure tools. Carbon dioxide is also used as an atmosphere for welding, although in the welding arc, it reacts to oxidize most metals. Use in the automotive industry is common despite significant evidence that welds made in carbon dioxide are more brittle than those made in more inert atmospheres.[citation needed] When used for MIG welding, CO2 use is sometimes referred to as MAG welding, for Metal Active Gas, as CO2 can react at these high temperatures. It tends to produce a hotter puddle than truly inert atmospheres, improving the flow characteristics. Although, this may be due to atmospheric reactions occurring at the puddle site. This is usually the opposite of the desired effect when welding, as it tends to embrittle the site, but may not be a problem for general mild steel welding, where ultimate ductility is not a major concern.
Carbon dioxide is used in many consumer products that require pressurized gas because it is inexpensive and nonflammable, and because it undergoes a phase transition from gas to liquid at room temperature at an attainable pressure of approximately 60 bar (870 psi; 59 atm), allowing far more carbon dioxide to fit in a given container than otherwise would. Life jackets often contain canisters of pressured carbon dioxide for quick inflation. Aluminium capsules of CO2 are also sold as supplies of compressed gas for air guns, paintball markers/guns, inflating bicycle tires, and for making carbonated water. High concentrations of carbon dioxide can also be used to kill pests. Liquid carbon dioxide is used in supercritical drying of some food products and technological materials, in the preparation of specimens for scanning electron microscopy[117] and in the decaffeination of coffee beans.
Fire extinguisher
Use of a CO2 fire extinguisher
Carbon dioxide can be used to extinguish flames by flooding the environment around the flame with the gas. It does not itself react to extinguish the flame, but starves the flame of oxygen by displacing it. Some fire extinguishers, especially those designed for electrical fires, contain liquid carbon dioxide under pressure. Carbon dioxide extinguishers work well on small flammable liquid and electrical fires, but not on ordinary combustible fires, because they do not cool the burning substances significantly, and when the carbon dioxide disperses, they can catch fire upon exposure to atmospheric oxygen. They are mainly used in server rooms.[118]
Carbon dioxide has also been widely used as an extinguishing agent in fixed fire-protection systems for local application of specific hazards and total flooding of a protected space.[119] International Maritime Organization standards recognize carbon-dioxide systems for fire protection of ship holds and engine rooms. Carbon-dioxide-based fire-protection systems have been linked to several deaths, because it can cause suffocation in sufficiently high concentrations. A review of CO2 systems identified 51 incidents between 1975 and the date of the report (2000), causing 72 deaths and 145 injuries.[120]
Supercritical CO2 as solvent
Liquid carbon dioxide is a good solvent for many lipophilic organic compounds and is used to remove caffeine from coffee.[17] Carbon dioxide has attracted attention in the pharmaceutical and other chemical processing industries as a less toxic alternative to more traditional solvents such as organochlorides. It is also used by some dry cleaners for this reason. It is used in the preparation of some aerogels because of the properties of supercritical carbon dioxide.
Medical and pharmacological uses
In medicine, up to 5% carbon dioxide (130 times atmospheric concentration) is added to oxygen for stimulation of breathing after apnea and to stabilize the O2/CO2 balance in blood.
Carbon dioxide can be mixed with up to 50% oxygen, forming an inhalable gas; this is known as Carbogen and has a variety of medical and research uses.
Another medical use are the mofette, dry spas that use carbon dioxide from post-volcanic discharge for therapeutic purposes.
Energy
Supercritical CO2 is used as the working fluid in the Allam power cycle engine.
Fossil fuel recovery
Carbon dioxide is used in enhanced oil recovery where it is injected into or adjacent to producing oil wells, usually under supercritical conditions, when it becomes miscible with the oil. This approach can increase original oil recovery by reducing residual oil saturation by 7–23% additional to primary extraction.[121] It acts as both a pressurizing agent and, when dissolved into the underground crude oil, significantly reduces its viscosity, and changing surface chemistry enabling the oil to flow more rapidly through the reservoir to the removal well.[122] In mature oil fields, extensive pipe networks are used to carry the carbon dioxide to the injection points.
In enhanced coal bed methane recovery, carbon dioxide would be pumped into the coal seam to displace methane, as opposed to current methods which primarily rely on the removal of water (to reduce pressure) to make the coal seam release its trapped methane.[123]
Bio transformation into fuel
It has been proposed that CO2 from power generation be bubbled into ponds to stimulate growth of algae that could then be converted into biodiesel fuel.[124] A strain of the cyanobacterium Synechococcus elongatus has been genetically engineered to produce the fuels isobutyraldehyde and isobutanol from CO2 using photosynthesis.[125]
Researchers have developed a process called electrolysis, using enzymes isolated from bacteria to power the chemical reactions which convert CO2 into fuels.[126][127][128]
Refrigerant
Comparison of the pressure–temperature phase diagrams of carbon dioxide (red) and water (blue) as a log-lin chart with phase transitions points at 1 atmosphere
Liquid and solid carbon dioxide are important refrigerants, especially in the food industry, where they are employed during the transportation and storage of ice cream and other frozen foods. Solid carbon dioxide is called «dry ice» and is used for small shipments where refrigeration equipment is not practical. Solid carbon dioxide is always below −78.5 °C (−109.3 °F) at regular atmospheric pressure, regardless of the air temperature.
Liquid carbon dioxide (industry nomenclature R744 or R-744) was used as a refrigerant prior to the use[citation needed] of dichlorodifluoromethane (R12, a chlorofluorocarbon (CFC) compound). CO2 might enjoy a renaissance because one of the main substitutes to CFCs, 1,1,1,2-tetrafluoroethane (R134a, a hydrofluorocarbon (HFC) compound) contributes to climate change more than CO2 does. CO2 physical properties are highly favorable for cooling, refrigeration, and heating purposes, having a high volumetric cooling capacity. Due to the need to operate at pressures of up to 130 bars (1,900 psi; 13,000 kPa), CO2 systems require highly mechanically resistant reservoirs and components that have already been developed for mass production in many sectors. In automobile air conditioning, in more than 90% of all driving conditions for latitudes higher than 50°, CO2 (R744) operates more efficiently than systems using HFCs (e.g., R134a). Its environmental advantages (GWP of 1, non-ozone depleting, non-toxic, non-flammable) could make it the future working fluid to replace current HFCs in cars, supermarkets, and heat pump water heaters, among others. Coca-Cola has fielded CO2-based beverage coolers and the U.S. Army is interested in CO2 refrigeration and heating technology.[129][130]
Minor uses
Carbon dioxide is the lasing medium in a carbon-dioxide laser, which is one of the earliest type of lasers.
Carbon dioxide can be used as a means of controlling the pH of swimming pools,[131] by continuously adding gas to the water, thus keeping the pH from rising. Among the advantages of this is the avoidance of handling (more hazardous) acids. Similarly, it is also used in the maintaining reef aquaria, where it is commonly used in calcium reactors to temporarily lower the pH of water being passed over calcium carbonate in order to allow the calcium carbonate to dissolve into the water more freely, where it is used by some corals to build their skeleton.
Used as the primary coolant in the British advanced gas-cooled reactor for nuclear power generation.
Carbon dioxide induction is commonly used for the euthanasia of laboratory research animals. Methods to administer CO2 include placing animals directly into a closed, prefilled chamber containing CO2, or exposure to a gradually increasing concentration of CO2. The American Veterinary Medical Association’s 2020 guidelines for carbon dioxide induction state that a displacement rate of 30–70% of the chamber or cage volume per minute is optimal for the humane euthanasia of small rodents.[132]: 5, 31 Percentages of CO2 vary for different species, based on identified optimal percentages to minimize distress.[132]: 22
Carbon dioxide is also used in several related cleaning and surface-preparation techniques.
History of discovery
Carbon dioxide was the first gas to be described as a discrete substance. In about 1640,[133] the Flemish chemist Jan Baptist van Helmont observed that when he burned charcoal in a closed vessel, the mass of the resulting ash was much less than that of the original charcoal. His interpretation was that the rest of the charcoal had been transmuted into an invisible substance he termed a «gas» or «wild spirit» (spiritus sylvestris).[134]
The properties of carbon dioxide were further studied in the 1750s by the Scottish physician Joseph Black. He found that limestone (calcium carbonate) could be heated or treated with acids to yield a gas he called «fixed air». He observed that the fixed air was denser than air and supported neither flame nor animal life. Black also found that when bubbled through limewater (a saturated aqueous solution of calcium hydroxide), it would precipitate calcium carbonate. He used this phenomenon to illustrate that carbon dioxide is produced by animal respiration and microbial fermentation. In 1772, English chemist Joseph Priestley published a paper entitled Impregnating Water with Fixed Air in which he described a process of dripping sulfuric acid (or oil of vitriol as Priestley knew it) on chalk in order to produce carbon dioxide, and forcing the gas to dissolve by agitating a bowl of water in contact with the gas.[135]
Carbon dioxide was first liquefied (at elevated pressures) in 1823 by Humphry Davy and Michael Faraday.[136] The earliest description of solid carbon dioxide (dry ice) was given by the French inventor Adrien-Jean-Pierre Thilorier, who in 1835 opened a pressurized container of liquid carbon dioxide, only to find that the cooling produced by the rapid evaporation of the liquid yielded a «snow» of solid CO2.[137][138]
See also
- Arterial blood gas
- Bosch reaction
- Carbon dioxide removal – Removal of atmospheric carbon dioxide (from the atmosphere)
- List of least carbon efficient power stations
- List of countries by carbon dioxide emissions
- Meromictic lake – Permanently stratified lake with layers of water that do not intermix
- Gilbert Plass – Canadian physicist (early work on CO2 and climate change)
- Sabatier reaction – Methanation process of carbon dioxide with hydrogen
- NASA’s Orbiting Carbon Observatory 2
- Greenhouse Gases Observing Satellite – Earth observation satellite
- Soil gas
References
- ^ a b c «Carbon Dioxide» (PDF). Air Products. Archived from the original (PDF) on 29 July 2020. Retrieved 28 April 2017.
- ^ a b c d e f g h i Span R, Wagner W (1 November 1996). «A New Equation of State for Carbon Dioxide Covering the Fluid Region from the Triple‐Point Temperature to 1100 K at Pressures up to 800 MPa». Journal of Physical and Chemical Reference Data. 25 (6): 1519. Bibcode:1996JPCRD..25.1509S. doi:10.1063/1.555991.
- ^ Touloukian YS, Liley PE, Saxena SC (1970). «Thermophysical properties of matter — the TPRC data series». Thermal Conductivity — Nonmetallic Liquids and Gases. Data book. 3.
- ^ Schäfer M, Richter M, Span R (2015). «Measurements of the viscosity of carbon dioxide at temperatures from (253.15 to 473.15) K with pressures up to 1.2 MPa». The Journal of Chemical Thermodynamics. 89: 7–15. doi:10.1016/j.jct.2015.04.015.
- ^ a b c NIOSH Pocket Guide to Chemical Hazards. «#0103». National Institute for Occupational Safety and Health (NIOSH).
- ^ «Carbon dioxide». Immediately Dangerous to Life or Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ^ «Safety Data Sheet – Carbon Dioxide Gas – version 0.03 11/11» (PDF). AirGas.com. 12 February 2018. Archived (PDF) from the original on 4 August 2018. Retrieved 4 August 2018.
- ^ «Carbon dioxide, refrigerated liquid» (PDF). Praxair. p. 9. Archived from the original (PDF) on 29 July 2018. Retrieved 26 July 2018.
- ^ Eggleton T (2013). A Short Introduction to Climate Change. Cambridge University Press. p. 52. ISBN 9781107618763. Archived from the original on 23 July 2021. Retrieved 9 November 2020.
- ^ «Carbon dioxide now more than 50% higher than pre-industrial levels | National Oceanic and Atmospheric Administration». www.noaa.gov. Retrieved 14 June 2022.
- ^ IPCC (2022) Summary for policy makers in Climate Change 2022: Mitigation of Climate Change. Contribution of Working Group III to the Sixth Assessment Report of the Intergovernmental Panel on Climate Change, Cambridge University Press, Cambridge, United Kingdom and New York, NY, USA
- ^ Ocean Acidification: A National Strategy to Meet the Challenges of a Changing Ocean. Washington, DC: National Academies Press. 22 April 2010. doi:10.17226/12904. ISBN 978-0-309-15359-1. Archived from the original on 5 February 2016. Retrieved 29 February 2016.
- ^ Kaufman DG, Franz CM (1996). Biosphere 2000: protecting our global environment. Kendall/Hunt Pub. Co. ISBN 978-0-7872-0460-0.
- ^ «Food Factories». www.legacyproject.org. Archived from the original on 12 August 2017. Retrieved 10 October 2011.
- ^ IPCC (2021). «Summary for Policymakers» (PDF). Climate Change 2021: The Physical Science Basis. p. 20. Archived (PDF) from the original on 10 October 2022.
- ^ Myles, Allen (September 2020). «The Oxford Principles for Net Zero Aligned Carbon Offsetting» (PDF). Archived (PDF) from the original on 2 October 2020. Retrieved 10 December 2021.
- ^ a b Tsotsas E, Mujumdar AS (2011). Modern drying technology. Vol. 3: Product quality and formulation. John Wiley & Sons. ISBN 978-3-527-31558-1. Archived from the original on 21 March 2020. Retrieved 3 December 2019.
- ^ Spritzler F (3 November 2019). «Carbonated (Sparkling) Water: Good or Bad?». healthline.com. Archived from the original on 10 May 2020.
- ^ a b Greenwood NN, Earnshaw A (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. pp. 305–314. ISBN 978-0-08-037941-8.
- ^ Atkins P, de Paula J (2006). Physical Chemistry (8th ed.). W.H. Freeman. pp. 461, 464. ISBN 978-0-7167-8759-4.
- ^ Siegmann B, Werner U, Lutz HO, Mann R (2002). «Complete Coulomb fragmentation of CO2 in collisions with 5.9 MeV u−1 Xe18+ and Xe43+«. J Phys B Atom Mol Opt Phys. 35 (17): 3755. Bibcode:2002JPhB…35.3755S. doi:10.1088/0953-4075/35/17/311. S2CID 250782825.
- ^ a b
Jensen P, Spanner M, Bunker PR (2020). «The CO2 molecule is never linear−». J Mol Struct. 1212: 128087. Bibcode:2020JMoSt121228087J. doi:10.1016/j.molstruc.2020.128087. hdl:2142/107329. S2CID 216318907. - ^ Jolly WL (1984). Modern Inorganic Chemistry. McGraw-Hill. p. 196. ISBN 978-0-07-032760-3.
- ^ Li Z, Mayer RJ, Ofial AR, Mayr H (May 2020). «From Carbodiimides to Carbon Dioxide: Quantification of the Electrophilic Reactivities of Heteroallenes». Journal of the American Chemical Society. 142 (18): 8383–8402. doi:10.1021/jacs.0c01960. PMID 32338511. S2CID 216557447.
- ^ Aresta M, ed. (2010). Carbon Dioxide as a Chemical Feedstock. Weinheim: Wiley-VCH. ISBN 978-3-527-32475-0.
- ^ Finn C, Schnittger S, Yellowlees LJ, Love JB (February 2012). «Molecular approaches to the electrochemical reduction of carbon dioxide» (PDF). Chemical Communications. 48 (10): 1392–1399. doi:10.1039/c1cc15393e. hdl:20.500.11820/b530915d-451c-493c-8251-da2ea2f50912. PMID 22116300. S2CID 14356014. Archived (PDF) from the original on 19 April 2021. Retrieved 6 December 2019.
- ^ «Gases – Densities». Engineering Toolbox. Archived from the original on 2 March 2006. Retrieved 21 November 2020.
- ^ Santoro M, Gorelli FA, Bini R, Ruocco G, Scandolo S, Crichton WA (June 2006). «Amorphous silica-like carbon dioxide». Nature. 441 (7095): 857–860. Bibcode:2006Natur.441..857S. doi:10.1038/nature04879. PMID 16778885. S2CID 4363092.
- ^ a b Holman, Jack P. (2002). Heat Transfer (9th ed.). New York, NY: McGraw-Hill Companies, Inc. pp. 600–606. ISBN 9780072406559.
- ^ a b Incropera 1 Dewitt 2 Bergman 3 Lavigne 4, Frank P. 1 David P. 2 Theodore L. 3 Adrienne S. 4 (2007). Fundamentals of Heat and Mass Transfer (6th ed.). Hoboken, NJ: John Wiley and Sons, Inc. pp. 941–950. ISBN 9780471457282.
- ^ Dhingra A, Portis AR, Daniell H (April 2004). «Enhanced translation of a chloroplast-expressed RbcS gene restores small subunit levels and photosynthesis in nuclear RbcS antisense plants». Proceedings of the National Academy of Sciences of the United States of America. 101 (16): 6315–6320. Bibcode:2004PNAS..101.6315D. doi:10.1073/pnas.0400981101. PMC 395966. PMID 15067115.
(Rubisco) is the most prevalent enzyme on this planet, accounting for 30–50% of total soluble protein in the chloroplast
- ^ Falkowski P, Knoll AH (1 January 2007). Evolution of primary producers in the sea. Elsevier, Academic Press. ISBN 978-0-12-370518-1. OCLC 845654016.
- ^ Blom TJ, Straver WA, Ingratta FJ, Khosla S, Brown W (December 2002). «Carbon Dioxide In Greenhouses». Archived from the original on 29 April 2019. Retrieved 12 June 2007.
- ^ Ainsworth EA (2008). «Rice production in a changing climate: a meta-analysis of responses to elevated carbon dioxide and elevated ozone concentration» (PDF). Global Change Biology. 14 (7): 1642–1650. Bibcode:2008GCBio..14.1642A. doi:10.1111/j.1365-2486.2008.01594.x. S2CID 19200429. Archived from the original (PDF) on 19 July 2011.
- ^ Long SP, Ainsworth EA, Leakey AD, Nösberger J, Ort DR (June 2006). «Food for thought: lower-than-expected crop yield stimulation with rising CO2 concentrations» (PDF). Science. 312 (5782): 1918–1921. Bibcode:2006Sci…312.1918L. CiteSeerX 10.1.1.542.5784. doi:10.1126/science.1114722. PMID 16809532. S2CID 2232629. Archived (PDF) from the original on 20 October 2016. Retrieved 27 October 2017.
- ^ Woodward F, Kelly C (1995). «The influence of CO2 concentration on stomatal density». New Phytologist. 131 (3): 311–327. doi:10.1111/j.1469-8137.1995.tb03067.x.
- ^ Drake BG, Gonzalez-Meler MA, Long SP (June 1997). «MORE EFFICIENT PLANTS: A Consequence of Rising Atmospheric CO2?». Annual Review of Plant Physiology and Plant Molecular Biology. 48 (1): 609–639. doi:10.1146/annurev.arplant.48.1.609. PMID 15012276. S2CID 33415877.
- ^ Loladze I (2002). «Rising atmospheric CO2 and human nutrition: toward globally imbalanced plant stoichiometry?». Trends in Ecology & Evolution. 17 (10): 457–461. doi:10.1016/S0169-5347(02)02587-9. S2CID 16074723.
- ^ Coviella CE, Trumble JT (1999). «Effects of Elevated Atmospheric Carbon Dioxide on Insect-Plant Interactions». Conservation Biology. 13 (4): 700–712. doi:10.1046/j.1523-1739.1999.98267.x. JSTOR 2641685. S2CID 52262618.
- ^ Davey MP, Harmens H, Ashenden TW, Edwards R, Baxter R (2007). «Species-specific effects of elevated CO2 on resource allocation in Plantago maritima and Armeria maritima«. Biochemical Systematics and Ecology. 35 (3): 121–129. doi:10.1016/j.bse.2006.09.004.
- ^ Davey MP, Bryant DN, Cummins I, Ashenden TW, Gates P, Baxter R, Edwards R (August 2004). «Effects of elevated CO2 on the vasculature and phenolic secondary metabolism of Plantago maritima». Phytochemistry. 65 (15): 2197–2204. doi:10.1016/j.phytochem.2004.06.016. PMID 15587703.
- ^ «Global Environment Division Greenhouse Gas Assessment Handbook – A Practical Guidance Document for the Assessment of Project-level Greenhouse Gas Emissions». World Bank. Archived from the original on 3 June 2016. Retrieved 10 November 2007.
- ^ Luyssaert S, Schulze ED, Börner A, Knohl A, Hessenmöller D, Law BE, et al. (September 2008). «Old-growth forests as global carbon sinks» (PDF). Nature. 455 (7210): 213–215. Bibcode:2008Natur.455..213L. doi:10.1038/nature07276. PMID 18784722. S2CID 4424430.
- ^ Falkowski P, Scholes RJ, Boyle E, Canadell J, Canfield D, Elser J, et al. (October 2000). «The global carbon cycle: a test of our knowledge of earth as a system». Science. 290 (5490): 291–296. Bibcode:2000Sci…290..291F. doi:10.1126/science.290.5490.291. PMID 11030643. S2CID 1779934.
- ^ a b Friedman D. «Toxicity of Carbon Dioxide Gas Exposure, CO2 Poisoning Symptoms, Carbon Dioxide Exposure Limits, and Links to Toxic Gas Testing Procedures». InspectAPedia. Archived from the original on 28 September 2009.
- ^ «CarbonTracker CT2011_oi (Graphical map of CO2)». esrl.noaa.gov. Archived from the original on 13 February 2021. Retrieved 20 April 2007.
- ^ «Carbon Dioxide as a Fire Suppressant: Examining the Risks». U.S. Environmental Protection Agency. Archived from the original on 2 October 2015.
- ^ «Volcano Under the City». A NOVA Production by Bonne Pioche and Greenspace for WGBH/Boston. Public Broadcasting System. 1 November 2005. Archived from the original on 5 April 2011..
- ^ Glatte Jr HA, Motsay GJ, Welch BE (1967). Carbon Dioxide Tolerance Studies (Report). Brooks AFB, TX School of Aerospace Medicine Technical Report. SAM-TR-67-77. Archived from the original on 9 May 2008. Retrieved 2 May 2008.
{{cite report}}: CS1 maint: unfit URL (link) - ^ Lambertsen CJ (1971). Carbon Dioxide Tolerance and Toxicity (Report). IFEM Report. Environmental Biomedical Stress Data Center, Institute for Environmental Medicine, University of Pennsylvania Medical Center. No. 2-71. Archived from the original on 24 July 2011. Retrieved 2 May 2008.
{{cite report}}: CS1 maint: unfit URL (link) - ^ a b Satish U, Mendell MJ, Shekhar K, Hotchi T, Sullivan D, Streufert S, Fisk WJ (December 2012). «Is CO2 an indoor pollutant? Direct effects of low-to-moderate CO2 concentrations on human decision-making performance» (PDF). Environmental Health Perspectives. 120 (12): 1671–1677. doi:10.1289/ehp.1104789. PMC 3548274. PMID 23008272. Archived from the original (PDF) on 5 March 2016. Retrieved 11 December 2014.
- ^ a b Allen JG, MacNaughton P, Satish U, Santanam S, Vallarino J, Spengler JD (June 2016). «Associations of Cognitive Function Scores with Carbon Dioxide, Ventilation, and Volatile Organic Compound Exposures in Office Workers: A Controlled Exposure Study of Green and Conventional Office Environments». Environmental Health Perspectives. 124 (6): 805–812. doi:10.1289/ehp.1510037. PMC 4892924. PMID 26502459.
- ^ «Exposure Limits for Carbon Dioxide Gas – CO2 Limits». InspectAPedia.com. Archived from the original on 16 September 2018. Retrieved 19 October 2014.
- ^ Law J, Watkins S, Alexander D (2010). In-Flight Carbon Dioxide Exposures and Related Symptoms: Associations, Susceptibility and Operational Implications (PDF) (Report). NASA Technical Report. TP–2010–216126. Archived from the original (PDF) on 27 June 2011. Retrieved 26 August 2014.
- ^ Schaefer KE, Douglas WH, Messier AA, Shea ML, Gohman PA (1979). «Effect of prolonged exposure to 0.5% CO2 on kidney calcification and ultrastructure of lungs». Undersea Biomedical Research. 6 (Suppl): S155–S161. PMID 505623. Archived from the original on 19 October 2014. Retrieved 19 October 2014.
- ^ Du B, Tandoc MC, Mack ML, Siegel JA (November 2020). «Indoor CO2 concentrations and cognitive function: A critical review». Indoor Air. 30 (6): 1067–1082. doi:10.1111/ina.12706. PMID 32557862. S2CID 219915861.
- ^ Kaplan L (4 June 2019). «Ask the doc: Does my helmet make me stupid? — RevZilla». www.revzilla.com. Archived from the original on 22 May 2021. Retrieved 22 May 2021.
- ^ Brühwiler PA, Stämpfli R, Huber R, Camenzind M (September 2005). «CO2 and O2 concentrations in integral motorcycle helmets». Applied Ergonomics. 36 (5): 625–633. doi:10.1016/j.apergo.2005.01.018. PMID 15893291.
- ^ Allen JG, MacNaughton P, Satish U, Santanam S, Vallarino J, Spengler JD (June 2016). «Associations of Cognitive Function Scores with Carbon Dioxide, Ventilation, and Volatile Organic Compound Exposures in Office Workers: A Controlled Exposure Study of Green and Conventional Office Environments». Environmental Health Perspectives. 124 (6): 805–812. doi:10.1289/ehp.1510037. PMC 4892924. PMID 26502459.
- ^ Romm J (26 October 2015). «Exclusive: Elevated CO2 Levels Directly Affect Human Cognition, New Harvard Study Shows». ThinkProgress. Archived from the original on 9 October 2019. Retrieved 14 October 2019.
- ^ «Three die in dry-ice incident at Moscow pool party». BBC News. 29 February 2020. Archived from the original on 29 February 2020.
The victims were connected to Instagram influencer Yekaterina Didenko.
- ^ Rettner R (2 August 2018). «A Woman Died from Dry Ice Fumes. Here’s How It Can Happen». livescience.com. Archived from the original on 22 May 2021. Retrieved 22 May 2021.
- ^ van Gardingen PR, Grace J, Jeffree CE, Byari SH, Miglietta F, Raschi A, Bettarini I (1997). «Long-term effects of enhanced CO2 concentrations on leaf gas exchange: research opportunities using CO2 springs». In Raschi A, Miglietta F, Tognetti R, van Gardingen PR (eds.). Plant responses to elevated CO2: Evidence from natural springs. Cambridge: Cambridge University Press. pp. 69–86. ISBN 978-0-521-58203-2.
- ^ Martini M (1997). «CO2 emissions in volcanic areas: case histories and hazards». In Raschi A, Miglietta F, Tognetti R, van Gardingen PR (eds.). Plant responses to elevated CO2: Evidence from natural springs. Cambridge: Cambridge University Press. pp. 69–86. ISBN 978-0-521-58203-2.
- ^ a b c d «ABG (Arterial Blood Gas)». Brookside Associates. Archived from the original on 12 August 2017. Retrieved 2 January 2017.
- ^ «How much carbon dioxide do humans contribute through breathing?». EPA.gov. Archived from the original on 2 February 2011. Retrieved 30 April 2009.
- ^ Henrickson C (2005). Chemistry. Cliffs Notes. ISBN 978-0-7645-7419-1.
- ^ a b c d «Carbon dioxide». solarnavigator.net. Archived from the original on 14 September 2008. Retrieved 12 October 2007.
- ^ Battisti-Charbonney, A.; Fisher, J.; Duffin, J. (15 June 2011). «The cerebrovascular response to carbon dioxide in humans». J. Physiol. 589 (12): 3039–3048. doi:10.1113/jphysiol.2011.206052. PMC 3139085. PMID 21521758.
- ^ Patel, S.; Miao, J.H.; Yetiskul, E.; Anokhin, A.; Majmunder, S.H. (2022). «Physiology, Carbon Dioxide Retention». National Library of Medicine. National Center for Biotechnology Information, NIH. PMID 29494063. Retrieved 20 August 2022.
- ^ Wilmshurst, Peter (1998). «ABC of oxygen». BMJ. 317 (7164): 996–999. doi:10.1136/bmj.317.7164.996. PMC 1114047. PMID 9765173.
- ^ Showstack, Randy (2013). «Carbon dioxide tops 400 ppm at Mauna Loa, Hawaii». Eos, Transactions American Geophysical Union. 94 (21): 192. Bibcode:2013EOSTr..94Q.192S. doi:10.1002/2013eo210004. ISSN 0096-3941.
- ^ Montaigne, Fen. «Son of Climate Science Pioneer Ponders A Sobering Milestone». Yale Environment 360. Yale School of Forestry & Environmental Studies. Archived from the original on 8 June 2013. Retrieved 14 May 2013.
- ^ a b «Carbon dioxide now more than 50% higher than pre-industrial levels | National Oceanic and Atmospheric Administration». www.noaa.gov. Retrieved 14 June 2022.
- ^ a b Eggleton, Tony (2013). A Short Introduction to Climate Change. Cambridge University Press. p. 52. ISBN 9781107618763.
- ^ a b «The NOAA Annual Greenhouse Gas Index (AGGI) – An Introduction». NOAA Global Monitoring Laboratory/Earth System Research Laboratories. Archived from the original on 27 November 2020. Retrieved 18 December 2020.
- ^ Etheridge, D.M.; L.P. Steele; R.L. Langenfelds; R.J. Francey; J.-M. Barnola; V.I. Morgan (1996). «Natural and anthropogenic changes in atmospheric CO2 over the last 1000 years from air in Antarctic ice and firn». Journal of Geophysical Research. 101 (D2): 4115–28. Bibcode:1996JGR…101.4115E. doi:10.1029/95JD03410. ISSN 0148-0227.
- ^ IPCC (2022) Summary for policy makers in Climate Change 2022: Mitigation of Climate Change. Contribution of Working Group III to the Sixth Assessment Report of the Intergovernmental Panel on Climate Change, Cambridge University Press, Cambridge, United Kingdom and New York, NY, USA
- ^ Petty, G.W. (2004). «A First Course in Atmospheric Radiation». Eos Transactions. 85 (36): 229–51. Bibcode:2004EOSTr..85..341P. doi:10.1029/2004EO360007.
- ^ Atkins P, de Paula J (2006). Atkins’ Physical Chemistry (8th ed.). W. H. Freeman. p. 462. ISBN 978-0-7167-8759-4.
- ^ «Carbon Dioxide Absorbs and Re-emits Infrared Radiation». UCAR Center for Science Education. 2012. Archived from the original on 21 September 2017. Retrieved 9 September 2017.
- ^ Archer D (15 March 2005). «How long will global warming last?». RealClimate. Archived from the original on 4 March 2021. Retrieved 5 March 2021.
- ^ Archer D (2009). «Atmospheric lifetime of fossil fuel carbon dioxide». Annual Review of Earth and Planetary Sciences. 37 (1): 117–34. Bibcode:2009AREPS..37..117A. doi:10.1146/annurev.earth.031208.100206. hdl:2268/12933. Archived from the original on 24 February 2021. Retrieved 7 March 2021.
- ^ Joos F, Roth R, Fuglestvedt JS, Peters GP, Enting IG, Von Bloh W, et al. (2013). «Carbon dioxide and climate impulse response functions for the computation of greenhouse gas metrics: A multi-model analysis». Atmospheric Chemistry and Physics. 13 (5): 2793–2825. doi:10.5194/acpd-12-19799-2012. Archived from the original on 22 July 2020. Retrieved 7 March 2021.
- ^ «Figure 8.SM.4» (PDF). Intergovernmental Panel on Climate Change Fifth Assessment Report. p. 8SM-16. Archived (PDF) from the original on 24 March 2021. Retrieved 7 March 2021.
- ^ Zhang, Yi Ge; et al. (28 October 2013). «A 40-million-year history of atmospheric CO2«. Philosophical Transactions of the Royal Society A. 371 (2001): 20130096. Bibcode:2013RSPTA.37130096Z. doi:10.1098/rsta.2013.0096. PMID 24043869.
- ^ «Climate and CO2 in the Atmosphere». Archived from the original on 6 October 2018. Retrieved 10 October 2007.
- ^ Berner RA, Kothavala Z (2001). «GEOCARB III: A revised model of atmospheric CO2 over Phanerozoic Time» (PDF). American Journal of Science. 301 (2): 182–204. Bibcode:2001AmJS..301..182B. CiteSeerX 10.1.1.393.582. doi:10.2475/ajs.301.2.182. Archived (PDF) from the original on 4 September 2011. Retrieved 15 February 2008.
- ^ Friedlingstein P, Jones MW, O’sullivan M, Andrew RM, Hauck J, Peters GP, et al. (2019). «Global Carbon Budget 2019». Earth System Science Data. 11 (4): 1783–1838. Bibcode:2019ESSD…11.1783F. doi:10.5194/essd-11-1783-2019..
- ^ Doney SC, Levine NM (29 November 2006). «How Long Can the Ocean Slow Global Warming?». Oceanus. Archived from the original on 4 January 2008. Retrieved 21 November 2007.
- ^ Jacobson, M. Z. (2005). «Studying ocean acidification with conservative, stable numerical schemes for nonequilibrium air-ocean exchange and ocean equilibrium chemistry». Journal of Geophysical Research: Atmospheres. 110: D07302. Bibcode:2005JGRD..11007302J. doi:10.1029/2004JD005220.
- ^ a b «Ocean acidification due to increasing atmospheric carbon dioxide». The Royal Society.
- ^ Mitchell, Mark J.; Jensen, Oliver E.; Cliffe, K. Andrew; Maroto-Valer, M. Mercedes (8 May 2010). «A model of carbon dioxide dissolution and mineral carbonation kinetics». Proceedings of the Royal Society A: Mathematical, Physical and Engineering Sciences. 466 (2117): 1265–1290. doi:10.1098/rspa.2009.0349.
- ^ Lupton J, Lilley M, Butterfield D, Evans L, Embley R, Olson E, et al. (2004). «Liquid Carbon Dioxide Venting at the Champagne Hydrothermal Site, NW Eifuku Volcano, Mariana Arc». American Geophysical Union. 2004 (Fall Meeting). V43F–08. Bibcode:2004AGUFM.V43F..08L.
- ^ Inagaki F, Kuypers MM, Tsunogai U, Ishibashi J, Nakamura K, Treude T, et al. (September 2006). «Microbial community in a sediment-hosted CO2 lake of the southern Okinawa Trough hydrothermal system». Proceedings of the National Academy of Sciences of the United States of America. 103 (38): 14164–14169. Bibcode:2006PNAS..10314164I. doi:10.1073/pnas.0606083103. PMC 1599929. PMID 16959888. Videos can be downloaded at «Supporting Information». Archived from the original on 19 October 2018.
- ^ «Collecting and using biogas from landfills». U.S. Energy Information Administration. 11 January 2017. Archived from the original on 11 July 2018. Retrieved 22 November 2015.
- ^ «Facts About Landfill Gas» (PDF). U.S. Environmental Protection Agency. January 2000. Archived (PDF) from the original on 23 September 2015. Retrieved 4 September 2015.
- ^ a b Pierantozzi R (2001). «Carbon Dioxide». Kirk-Othmer Encyclopedia of Chemical Technology. Wiley. doi:10.1002/0471238961.0301180216090518.a01.pub2. ISBN 978-0-471-23896-6.
- ^
Strassburger J (1969). Blast Furnace Theory and Practice. New York: American Institute of Mining, Metallurgical, and Petroleum Engineers. ISBN 978-0-677-10420-1. - ^ Topham S (2000). «Carbon Dioxide». Ullmann’s Encyclopedia of Industrial Chemistry. doi:10.1002/14356007.a05_165. ISBN 3527306730.
- ^ «CO2 shortage: Food industry calls for government action». BBC. 21 June 2018. Archived from the original on 23 May 2021. Retrieved 24 June 2018.
- ^ «IPCC Special Report on Carbon dioxide Capture and Storage» (PDF). The Intergovernmental Panel on Climate Change. Archived from the original (PDF) on 24 September 2015. Retrieved 4 September 2015.
- ^ Morrison RT, Boyd RN (1983). Organic Chemistry (4th ed.). Allyn and Bacon. pp. 976–977. ISBN 978-0-205-05838-9.
- ^ Badwal SP, Giddey SS, Munnings C, Bhatt AI, Hollenkamp AF (24 September 2014). «Emerging electrochemical energy conversion and storage technologies». Frontiers in Chemistry. 2: 79. Bibcode:2014FrCh….2…79B. doi:10.3389/fchem.2014.00079. PMC 4174133. PMID 25309898.
- ^ Whiting D, Roll M, Vickerman L (August 2010). «Plant Growth Factors: Photosynthesis, Respiration, and Transpiration». CMG GardenNotes. Colorado Master Gardener Program. Archived from the original on 2 September 2014. Retrieved 10 October 2011.
- ^ Waggoner PE (February 1994). «Carbon dioxide». How Much Land Can Ten Billion People Spare for Nature?. Archived from the original on 12 October 2011. Retrieved 10 October 2011.
- ^ Stafford N (August 2007). «Future crops: the other greenhouse effect». Nature. 448 (7153): 526–528. Bibcode:2007Natur.448..526S. doi:10.1038/448526a. PMID 17671477. S2CID 9845813.
- ^ UK Food Standards Agency: «Current EU approved additives and their E Numbers». Archived from the original on 7 October 2010. Retrieved 27 October 2011.
- ^ US Food and Drug Administration: «Food Additive Status List». Food and Drug Administration. Archived from the original on 4 November 2017. Retrieved 13 June 2015.
- ^ Australia New Zealand Food Standards Code«Standard 1.2.4 – Labelling of ingredients». Archived from the original on 19 January 2012. Retrieved 27 October 2011.
- ^ Futurific Leading Indicators Magazine. Vol. 1. CRAES LLC. ISBN 978-0-9847670-1-4. Archived from the original on 15 August 2021. Retrieved 9 November 2020.
- ^ Vijay GP (25 September 2015). Indian Breads: A Comprehensive Guide to Traditional and Innovative Indian Breads. Westland. ISBN 978-93-85724-46-6.
- ^ «Scientists Discover Protein Receptor For Carbonation Taste». ScienceDaily. 16 October 2009. Archived from the original on 29 March 2020. Retrieved 29 March 2020.
- ^ Coghlan A (3 February 2018). «A more humane way of slaughtering chickens might get EU approval». New Scientist. Archived from the original on 24 June 2018. Retrieved 24 June 2018.
- ^ «What is CO2 stunning?». RSPCA. Archived from the original on 9 April 2014.
- ^ Campbell A (10 March 2018). «Humane execution and the fear of the tumbril». New Scientist. Archived from the original on 24 June 2018. Retrieved 24 June 2018.
- ^ Nordestgaard BG, Rostgaard J (February 1985). «Critical-point drying versus freeze drying for scanning electron microscopy: a quantitative and qualitative study on isolated hepatocytes». Journal of Microscopy. 137 (Pt 2): 189–207. doi:10.1111/j.1365-2818.1985.tb02577.x. PMID 3989858. S2CID 32065173.
- ^ «Types of Fire Extinguishers». The Fire Safety Advice Centre. Archived from the original on 28 June 2021. Retrieved 28 June 2021.
- ^ National Fire Protection Association Code 12.
- ^ Carbon Dioxide as a Fire Suppressant: Examining the Risks, US EPA. 2000.
- ^ «Appendix A: CO2 for use in enhanced oil recovery (EOR)». Accelerating the uptake of CCS: industrial use of captured carbon dioxide. Global CCS Institute. 20 December 2011. Archived from the original on 28 April 2017. Retrieved 2 January 2017.
- ^ Austell JM (2005). «CO2 for Enhanced Oil Recovery Needs – Enhanced Fiscal Incentives». Exploration & Production: The Oil & Gas Review. Archived from the original on 7 February 2012. Retrieved 28 September 2007.
- ^ «Enhanced coal bed methane recovery». ETH Zurich. 31 August 2006. Archived from the original on 6 July 2011.
- ^ Clayton M (11 January 2006). «Algae – like a breath mint for smokestacks». The Christian Science Monitor. Archived from the original on 14 September 2008. Retrieved 11 October 2007.
- ^ Atsumi S, Higashide W, Liao JC (December 2009). «Direct photosynthetic recycling of carbon dioxide to isobutyraldehyde». Nature Biotechnology. 27 (12): 1177–1180. doi:10.1038/nbt.1586. PMID 19915552. S2CID 1492698.
- ^ Cobb S, Badiani V, Dharani A, Wagner A, Zacarias S, Oliveira AR, et al. (28 February 2022). «Fast CO2 hydration kinetics impair heterogeneous but improve enzymatic CO2 reduction catalysis». Nature Chemistry. 14 (4): 417–424. Bibcode:2022NatCh..14..417C. doi:10.1038/s41557-021-00880-2. ISSN 1755-4349. PMC 7612589. PMID 35228690. S2CID 247160910.
- ^ Edwardes Moore E, Cobb SJ, Coito AM, Oliveira AR, Pereira IA, Reisner E (January 2022). «Understanding the local chemical environment of bioelectrocatalysis». Proceedings of the National Academy of Sciences of the United States of America. 119 (4): e2114097119. Bibcode:2022PNAS..11914097E. doi:10.1073/pnas.2114097119. PMC 8795565. PMID 35058361.
- ^ «Clean Way To Turn CO2 Into Fuel Inspired by Nature». Applied Sciences from Technology Networks. 1 March 2022. Retrieved 2 March 2022.
- ^ «The Coca-Cola Company Announces Adoption of HFC-Free Insulation in Refrigeration Units to Combat Global Warming». The Coca-Cola Company. 5 June 2006. Archived from the original on 1 November 2013. Retrieved 11 October 2007.
- ^ «Modine reinforces its CO2 research efforts». R744.com. 28 June 2007. Archived from the original on 10 February 2008.
- ^ TCE, the Chemical Engineer. Institution of Chemical Engineers. 1990. Archived from the original on 17 August 2021. Retrieved 2 June 2020.
- ^ a b «AVMA guidelines for the euthanasia of animals: 2020 Edition» (PDF). American Veterinary Medical Association. 2020. Archived (PDF) from the original on 1 February 2014. Retrieved 13 August 2021.
- ^ Harris D (September 1910). «The Pioneer in the Hygiene of Ventilation». The Lancet. 176 (4542): 906–908. doi:10.1016/S0140-6736(00)52420-9. Archived from the original on 17 March 2020. Retrieved 6 December 2019.
- ^ Almqvist E (2003). History of industrial gases. Springer. p. 93. ISBN 978-0-306-47277-0.
- ^ Priestley J, Hey W (1772). «Observations on Different Kinds of Air». Philosophical Transactions. 62: 147–264. doi:10.1098/rstl.1772.0021. S2CID 186210131. Archived from the original on 7 June 2010. Retrieved 11 October 2007.
- ^ Davy H (1823). «On the Application of Liquids Formed by the Condensation of Gases as Mechanical Agents». Philosophical Transactions. 113: 199–205. doi:10.1098/rstl.1823.0020. JSTOR 107649.
- ^ Thilorier AJ (1835). «Solidification de l’Acide carbonique». Comptes Rendus. 1: 194–196. Archived from the original on 2 September 2017. Retrieved 1 September 2017.
- ^ Thilorier AJ (1836). «Solidification of carbonic acid». The London and Edinburgh Philosophical Magazine. 8 (48): 446–447. doi:10.1080/14786443608648911. Archived from the original on 2 May 2016. Retrieved 15 November 2015.
External links
- Current global map of carbon dioxide concentration
- CDC – NIOSH Pocket Guide to Chemical Hazards – Carbon Dioxide
- Trends in Atmospheric Carbon Dioxide (NOAA)
| Оксид углерода (IV) | |
|---|---|
_   |
|
| Другие названия | углекислый газ, двуокись углерода, сухой лёд(твердый) |
| Формула | CO2 |
| Молярная масса | 44,0095(14) г/моль |
| В твердом виде | сухой лёд |
| Вид | бесцветный газ |
| Номер CAS | [124-38-9] |
| Свойства | |
| Плотность и фазовое состояние | 1,9769 кг/м³, при н.у.; 771 кг/м³, жидкий; 1512 кг/м³, твёрдый |
| Растворимость в воде | 1,45 кг/м³ |
| Удельная теплоемкость | 0,846 кДж/(кг*С) при 27 °C |
| Удельная теплота плавления | 25,13 кДж/моль |
| Точка плавления | −57 °C (216 K), под давлением |
| Точка кипения | −78 °C (195 K), возгоняется |
| Константа диссоциации кислоты (pKa) | 6,35 и 10,33 |
| Вязкость | 0,07 пз при −78 °C |
| Строение | |
| Форма молекулы | линейная |
| Кристаллическая решётка | молекулярная |
| Дипольный момент | ноль |
| Техника безопасности | |
| MSDS | External MSDS |
| Главные опасности | удушающее, раздражающее |
| NFPA 704 | |
| R-phrases | R: As, Fb [источник не указан 1315 дней] |
| S-phrases | S9, S23, S36 (ж) [источник не указан 1315 дней] |
| RTECS number | FF6400000 |
| Страница дополнительных сведений | |
| Структура и свойства | n, εr, и т. д. |
| Спектр | УФ, ИК, ЯМР, Масс-спектроскопия |
| Родственные соединения | |
| Оксиды | CO C3O2 стандартных условиях (25 °C, 100 кПа) Infobox disclaimer and references |
Оксид углерода(IV) (углекислый газ, диоксид углерода, двуокись углерода, угольный ангидрид) — CO2, бесцветный газ (в нормальных условиях), без запаха, со слегка кисловатым вкусом.
Концентрация углекислого газа в атмосфере Земли составляет в среднем 0,0395 %.[1]
Не следует путать с Диоксином.
Плотность при нормальных условиях 1,97 кг/м³. При атмосферном давлении диоксид углерода не существует в жидком состоянии, переходя непосредственно из твёрдого состояния в газообразное. Твёрдый диоксид углерода называют сухим льдом. При повышенном давлении и обычных температурах углекислый газ переходит в жидкость, что используется для его хранения.
Углекислый газ легко пропускает ультрафиолетовые лучи и лучи видимой части спектра, которые поступают на Землю от Солнца и обогревают её. В то же время он поглощает испускаемые Землёй инфракрасные лучи и является одним из парниковых газов, вследствие чего принимает участие в процессе глобального потепления. Постоянный рост уровня содержания этого газа в атмосфере наблюдается с начала индустриальной эпохи.
Содержание
- 1 Свойства
- 1.1 Физические
- 1.2 Химические
- 1.3 Биологические
- 2 Получение
- 3 Применение
- 4 Методы регистрации
- 5 Углекислый газ в природе
- 6 Токсичность
- 7 Интересные факты
- 8 См. также
- 9 Примечания
- 10 Литература
- 11 Ссылки
Свойства
Физические
Оксид углерода (IV) – углекислый газ, газ без цвета и запаха, тяжелее воздуха, растворим в воде, при сильном охлаждении кристаллизуется в виде белой снегообразной массы – «сухого льда». При атмосферном давлении он не плавится, а испаряется, температура сублимации -78 °С. Углекислый газ образуется при гниении и горении органических веществ. Содержится в воздухе и минеральных источниках, выделяется при дыхании животных и растений. Мало растворим в воде (1 объем углекислого газа в одном объеме воды при 15 °С).
Химические
По химическим свойствам диоксид углерода относится к кислотным оксидам. При растворении в воде образует угольную кислоту. Реагирует со щёлочами с образованием карбонатов и гидрокарбонатов. Вступает в реакции электрофильного замещения (например, с фенолом ) и нуклеофильного присоединения (например, с магнийорганическими соединениями).
Биологические
Диоксид углерода играет одну из главных ролей в живой природе, участвуя во многих процессах метаболизма живой клетки. Диоксид углерода получается в результате множества окислительных реакций у животных, и выделяется в атмосферу с дыханием. Углекислый газ атмосферы — основной источник углерода для растений. Однако, ошибкой будет утверждение, что животные только выделяют углекислый газ, а растения — только поглощают его. Растения поглощают углекислый газ в процессе фотосинтеза, а без освещения они тоже его выделяют.
Диоксид углерода не токсичен[источник не указан 60 дней], но не поддерживает дыхание. Большая концентрация в воздухе вызывает удушье (см. Гиперкапния). Однако недостаток углекислого газа тоже опасен (см. Гипокапния)[источник не указан 60 дней].
Углекислый газ в организмах животных имеет и физиологическое значение, например, участвует в регуляции сосудистого тонуса (см. Артериолы).
Получение
В промышленных количествах углекислота выделяется из дымовых газов, или как побочный продукт химических процессов, например, при разложении природных карбонатов (известняк, доломит) или при производстве алкоголя. Смесь полученных газов, промывают раствором карбоната калия, которые поглощают углекислый газ, переходя в гидрокарбонат. Раствор гидрокарбоната при нагревании или при пониженном давлении разлагается, высвобождая углекислоту. В современных установках получения углекислого газа вместо гидрокарбоната, чаще применяется водный раствор моноэтаноламина, который при определённых условиях способен абсорбировать СО₂, содержащийся в дымовом газе, а при нагреве отдавать его, таким образом, отделяется готовый продукт от других веществ.
Также углекислый газ получают на установках разделения воздуха, как побочный продукт получения чистого кислорода, азота и аргона.
В лабораторных условиях небольшие количества получают взаимодействием карбонатов и гидрокарбонатов с кислотами, например мрамора, мела или соды с соляной кислотой. Использование реакции серной кислоты с мелом или мрамором приводит к образованию малорастворимого сульфата кальция, который мешает реакции, и который удаляется значительным избытком кислоты.
Для приготовления напитков может быть использована реакция пищевой соды с лимонной кислотой или с кислым лимонным соком. Именно в таком виде появились первые газированные напитки. Их изготовлением и продажей занимались аптекари.
Применение
В пищевой промышленности углекислота используется как консервант и разрыхлитель, обозначается на упаковке кодом Е290.
Жидкая углекислота широко применяется в системах пожаротушения, в огнетушителях и для производства газированной воды и лимонада.
Углекислый газ используется в качестве защитной среды при сварке проволокой, но при высоких температурах происходит его диссоциация с выделением кислорода. Выделяющийся кислород окисляет металл. В связи с этим приходится в сварочную проволоку вводить раскислители, такие как марганец и кремний. Другим следствием влияния кислорода, также связанного с окислением, является резкое снижение поверхностного натяжения, что приводит, среди прочего, к более интенсивному разбрызгиванию металла, чем при сварке в аргоне или гелии.
Углекислота в баллончиках применяется в пневматическом оружии (в газобаллонной пневматике) и в качестве источника энергии для двигателей в авиамоделировании, а также для накачивания шин/камер велосипедных колес.[источник не указан 85 дней].
Когда углекислота применяется в газовой фазе, то для хранения она используется под давлением, как сжиженный газ, в виде жидкой фазы. Хранение углекислоты в баллоне в сжиженном состоянии намного выгоднее, чем в виде газа. Углекислота имеет сравнительно низкую критическую температуру 31°С. Когда в 40-литровый баллон с нормальным давлением 100 кгс/сm² залито 30 кг сжиженного углекислого газа, то при температуре 31°С в баллоне будет только жидкая фаза с давлением 100 кгс/сm². Если температура будет выше, то следует уменьшить заполнение баллона или использовать баллоны с более высоким рабочим давлением. Если углекислота будет охлаждаться, то при температуре 21°С при нормальном заполнении в баллоне появиться газовая фаза.
Твёрдая углекислота — «сухой лёд» — используется в качестве хладагента в лабораторных исследованиях, в розничной торговле и т.д.
Методы регистрации
Измерение парциального давления углекислого газа требуется в технологических процессах, в медицинских применениях — анализ дыхательных смесей при искусственной вентиляции лёгких и в замкнутых системах жизнеобеспечения. Анализ концентрации CO2 в атмосфере используется для экологических и научных исследований, для изучения парникового эффекта. Углекислый газ регистрируют с помощью газоанализаторов основанных на принципе инфракрасной спектроскопии и других газоизмерительных систем. Медицинский газоанализатор для регистрации содержания углекислоты в выдыхаемом воздухе называется капнограф.
Углекислый газ в природе
Изменения концентрации атмосферного углекислого газа (кривая Килинга). Измерения в обсерватории на горе Мауна-Лоа, Гавайи.
Ежегодные колебания концентрации атмосферной углекислоты на планете определяются, главным образом, растительностью средних (40—70°) широт Северного полушария.
Вегетация в тропиках практически не зависит от сезона, сухой пояс пустынь 20—30° (обоих полушарий) дает малый вклад в круговорот углекислоты, а полосы суши, наиболее покрытые растительностью, расположены на Земле асимметрично (в Южном полушарии в средних широтах находится океан).
Поэтому с марта по сентябрь вследствие фотосинтеза содержание СО2 в атмосфере падает, а с октября по февраль — повышается. Вклад в зимний прирост дают как окисление древесины (гетеротрофное дыхание растений, гниение, разложение гумуса, лесные пожары), так и сжигание ископаемых топлив (угля, нефти, газа), заметно увеличивающееся в зимний сезон[2].
Большое количество углекислоты растворено в океане.
Углекислый газ составляет значительную часть атмосфер некоторых планет Солнечной системы: Венеры, Марса.
Токсичность
Углекислый газ является тяжелым, по сравнению с воздухом, газом без цвета и запаха. Воздействие его повышенных концентраций на живые организмы относит его к удушающим газам (англ.)русск.. Незначительные повышения концентрации до 2-4% в непроветриваемых помещениях приводят к развитию сонливости и слабости. Опасными концентрациями считаются уровни 7-10%, при которых развивается удушье, проявляющее себя в головной боли, головокружении, расстройстве слуха и в потери сознания в течение периода времени от нескольких минут до одного часа.[3] Отравление этим газом не приводит к долговременным последствиям и после его завершения происходит полное восстановление организма.[4]
Интересные факты
- Подземное животное голый землекоп отличается терпимостью к большим (смертельным для других животных) концентрациям углекислого газа.[5]
- Бо́льшая, по сравнению с человеком, чувствительность других животных к изменениям концентрации этого газа использовалась в качестве естественного детектора опасных концентраций этого газа. Повышенная чувствительность к углекислоте канареек использовалась шахтерами для определения начала скопления этого газа под землей.
- В результате обычного функционирования организма каждого человека в среднем в течение одного дня образуется 1 кг углекислого газа (300 гр углерода).[6]
См. также
- Выхлопные газы
Примечания
- ↑ Trends in Carbon Dioxide
- ↑ А. В. Бялко. Растения убыстряют рост. «Природа». No 10, 1996. (по Keeling C.D., Whorf Т.P., Wahlen M., van der Plicht J. // Nature. 1995. V. 375, № 6533. P.666-670)
- ↑ (англ.) Carbon Dioxide as a Fire Suppressant: Examining the Risks, U.S. Environmental Protection Agency:.
- ↑ (англ.) Glatte Jr H. A., Motsay G. J., Welch B. E. (1967). «Carbon Dioxide Tolerance Studies». Brooks AFB, TX School of Aerospace Medicine Technical Report SAM-TR-67-77. Проверено 2008-05-02.
- ↑ А. Шиндер. Животное, не чувствующее боли. 2000-Аспекты-Проблемы № 26(420), 27 июня-3 июля 2008
- ↑ (англ.) How much carbon dioxide do humans contribute through breathing?.(недоступная ссылка — история) Проверено 30 апреля 2009.
Литература
- Вукалович М.П., Алтунин В.В., Теплофизические свойства двуокиси углерода, Атомиздат, Москва, 1965. 456 с.
- Тезиков А.Д., Производство и применение сухого льда, Госторгиздат, Москва, 1960. 86 с.
- Гродник М.Г., Величанский А.Я., Проектирование и эксплуатация углеслотных установок, ″Пищевая промышленность″, Москва, 1966. 275 с.
- Талянкер Ю.Е., Особенности хранения баллонов со сжиженным газом, Журнал «Сварочное производство», №11, 1972, Москва.
Ссылки
- International Chemical Safety Card 0021 (англ.)
- CID 280 с сайта PubChem (англ.)
- CO2 Диоксид углерода, свойства, применение (англ.)
- Фазовая диаграмма (давление-температура)для диоксида углерода
- Molview from bluerhinos.co.uk Диоксид углерода в 3D
- Dry Ice information (англ.)
- Trends in Atmospheric Carbon Dioxide (NOAA)
- Phase Diagram of Carbon Dioxide(англ.)
- Experiment 071 — Triple Point Phase Transition for Carbon Dioxide
- CO2 как природный рефрежерант — FAQs (англ.)
- Великобритания разрабатывает метод сохранения двуокиси углерода
- Он-лайн калькулятор свойств CO2 (англ.)
|
Климат, Климатология |
|
|---|---|
| Изменение климата | Палеоклиматология • Эль-Ниньо • Геохимический цикл углерода • Протерозойское оледенение, Ледниковый период, Малый ледниковый период • Термальный максимум (Позднепалеоценовый термальный максимум, Последний ледниковый максимум) • Ледники • Теплооборот |
| Глобальное потепление | Вырубка лесов • Противодействие изменению климата • Глобальная климатическая модель • Глобальное похолодание • Глобальное затемнение • Озоновая дыра • Парниковый эффект • Диоксид углерода • Парниковые газы • Межправительственная группа экспертов по изменению климата • Рамочная конвенция ООН об изменении климата (Киотский протокол) • Пик нефти • Возобновляемая энергия • Температурный тренд • Повышение уровня моря • Копенгагенский консенус |
| |
||
|---|---|---|
| Оксиды | CO2 · CO |  |
| Экзотические оксиды | Карбонилы металлов · Угольная кислота · Гидрокарбонаты · Карбонаты · Дикарбонаты · Трикарбонаты |
Составная часть атмосферы, основное сырье для процесса фотосинтеза зеленых растений, продукт жизнедеятельности живых организмов.
По систематической международной номенклатуре (IUPAC) вещество с формулой СО2 получило название – Оксид углерода(IV). Тривиальные (общепринятые названия) – двуокись или диоксид углерода, угольный ангидрид (солеобразующий оксид, обладающий кислотными свойствами).
Формула углекислого газа
СО2
Молекула углекислого газа образована двумя атомами кислорода и атомом углерода. Структурная формула – О=С=О. Валентность углерода равна 4. Степень окисления – (+4). Тип связи – ковалентная полярная.
Получение углекислого газа
Природные источники углекислого газа
Углекислый газ образуется при медленном окислении в процессах дыхания, брожения, гниения органических веществ. Выделяется при разложении природных карбонатов, сгорании топлива, образовании дымовых газов. Содержится в воздухе, минеральных источниках.
В сутки организм человека выделяет 1 кг СО2. В воздухе содержится 0,03% углекислого газа.
Лабораторные способы получения
В лаборатории газ можно получить взаимодействием соляной кислоты с мелом, мрамором, содой. Собирается газ методом вытеснения воздуха.
CaCO3 + 2HCl → CaCl2+ H2O + CO2,
NaHCO3+ HCl → NaCl + H2O + CO2.
Промышленные способы получения
- Обжиг известняка: CaCO3 → CaO + CO2.
- Как побочный продут разделения воздуха при получении кислорода, азота, аргона.
Свойства углекислого газа
Физические свойства
Вещество нетоксичное, негорючее.
| Свойство | Описание |
|---|---|
| Агрегатное состояние при н.у. | Газ |
| Цвет | Бесцветный |
| Запах | Без запаха |
| Температура плавления | -750оC |
| Температура кипения | -56,50оC |
| Растворимость в воде | Растворяется частично. При t +150оC в 1 литре воды может раствориться 1,7 л углекислого газа |
| Плотность | 1,977 г/л |
| Молярная масса | 44г/моль |
Вещество в твердом агрегатном состоянии называется «сухим льдом».
Высокую концентрацию диоксида углерода можно определить органолептически – во рту, на языке появляется кисловатый привкус. Повышенное содержание опасно для организма – вызывает удушье.
Химические свойства
- Качественная реакция: при взаимодействии углекислого газа с известковым молочком (гидроксидом кальция) образуется карбонат кальция – осадок белого цвета.
CO2 + Ca(OH)2 = CaCO3↓ + H2O.
- CO2, как кислотный оксид, реагирует с водой с образованием угольной кислоты. Эта кислота – соединение нестойкое, легко распадается на углекислый газ и воду. Тип реакции – реакция соединения, обратимая.
CO2 + H2O ↔ H2CO3.
-
При нагревании распадается на оксид углерода(II) и воду: 2CO2 = 2CO + O2.
-
Взаимодействует с основными оксидами, с образованием солей:
CaO + CO2 = CaCO3; Al2O3 + 3CO2 = Al2(CO3)3.
Тип реакции – реакция соединения.
- Взаимодействует со щелочами, с образованием кислых и средних солей:
CO2 + NaOH = NaHCO3;
CO2 + 2NaOH = Na2CO3 + H2O.
Средняя соль образуется при избытке щелочи. Кислая соль образуется при отношении количеств вещества оксида и щелочи – 1:1.
- При температуре реагирует с активными металлами:
CO2 + 2Mg = C + 2MgO
Углекислый газ в основном проявляет восстановительные свойства, но при взаимодействии с активными металлами является окислителем.
- Вступает в реакции взаимодействия с простыми веществами:
CO2 + 4H2 = CH4 + 2H2O (условия протекания реакции – высокая температура, катализатор Cu2O).
Применение углекислого газа
В пищевой промышленности:
- используется при производстве минеральной воды и газированных напитков;
- как пищевая добавка (Е290), повышает сроки хранения продуктов;
- в качестве разрыхлителя придает легкость и пышность кондитерским изделиям;
- как хладогент;
- для удаления из кофе кофеина.
В авиамоделировании используется как источник энергии для двигателей; применяется в пневматическом оружии; как заправка для углекислотных огнетушителей. Используется в качестве защитной среды при сварке.
Находит углекислый газ применение и в медицине – используется для криоабляции новообразований, служит стимулятором глубокого дыхания.
В химической промышленности газ используется в синтезе химических веществ, производстве солей угольной кислоты, процессах осушки и очистки полимеров, волокон растительного и животного происхождения. Применяется для очистки сточных вод, повышает проводимость сверхчистой воды.
Примеры решения задач
Задача 1
Найти массовую долю углерода в углекислом газе.
Решение
М(СО2) = 12+2х16 = 44 г/моль.
Аr(С) = 12 г/моль.
W(С) = 12/44 = 0,27 или 27%
Ответ: массовая доля углерода в углекислом газе равна 27%.
Задача 2
Вычислить объем углекислого газа, выделившегося при взаимодействии соляной кислоты с мрамором массой 100 г.
Решение
300 г — х л
CaCO3 + 2HCl → CaCl2+ H2O + CO2
1 моль — 1 моль
100 г/моль — 22,4 л/моль
100 г — 22,4 л
х(СО2) = 300х22,4/100 = 67, 2 (л).
Ответ: Объем углекислого газа равен 67, 2 л.
Тест по теме «Углекислый газ»
| Диоксид углерода | ||
|---|---|---|
|
||
 |
||
| Общие | ||
| Систематическое наименование |
Оксид углерода(IV) | |
| Традиционные названия |
углекислый газ диоксид углерода углекислота двуокись углерода сухой лёд (в твёрдом состоянии) |
|
| Хим. формула | CO2 | |
| Рац. формула | CO2 | |
| Физические свойства | ||
| Состояние | Газообразное | |
| Молярная масса | 44,01 г/моль | |
| Плотность |
газ (0 °C): 1,9768 кг/м3 жидкость (0 °С, 35,5 ат): 925 кг/м3 тв. (−78,5 °C): 1560 кг/м3 г/см³ |
|
| Динамическая вязкость | 8,5⋅10−5 Па·с (10 °C, 5,7 МПа) | |
| Энергия ионизации | 2,2E−18 Дж | |
| Скорость звука в веществе | 269 м/с | |
| Термические свойства | ||
| Температура | ||
| • сублимации | −78,5 °C | |
| Тройная точка | −56,6 °C, 0,52 МПа [1] | |
| Критическая точка | 31 °C, 7,38 МПа | |
| Критическая плотность | 467 кг/м3 см³/моль | |
| Уд. теплоёмк. | 849 Дж/(кг·К) | |
| Теплопроводность | 0,0166 Вт/(м·K) | |
| Энтальпия | ||
| • образования | -394 кДж/моль | |
| • плавления | 9,02 кДж/моль | |
| • кипения | 16,7 кДж/моль | |
| • сублимации | 26 кДж/моль | |
| Удельная теплота испарения | 379,5 кДж/кг | |
| Удельная теплота плавления | 205 кДж/кг | |
| Давление пара | 5 724 862,5 Па | |
| Химические свойства | ||
| Растворимость | ||
| • в воде | 1,48 кг/м3 г/100 мл | |
| Классификация | ||
| Рег. номер CAS | 124-38-9 | |
| PubChem | 280 | |
| Рег. номер EINECS | 204-696-9 | |
| SMILES |
C(=O)=O |
|
| InChI |
InChI=1S/CO2/c2-1-3 CURLTUGMZLYLDI-UHFFFAOYSA-N |
|
| Кодекс Алиментариус | E290 | |
| RTECS | FF6400000 | |
| ChEBI | 16526 | |
| Номер ООН | 1013 | |
| ChemSpider | 274 | |
| Безопасность | ||
| Предельная концентрация |
9 г/м3 (5000 ppm) долговременное воздействие, 54 г/м3 (30 000 ppm) кратковременное воздействие (<15 мин.) [2] |
|
| ЛД50 | LC50: 90 000мг/м3*5 мин. (человек, ингаляция)[3] | |
| Токсичность | Нетоксичен. Опасен лишь в очень больших количествах (обладает удушающим действием). Негорюч. | |
| Фразы безопасности (S) | S9, S23, S36 | |
| NFPA 704 |
0 1 0 SA |
|
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | ||
Диокси́д углеро́да или двуо́кись углеро́да (также оксид углерода (IV), углеки́слый газ, у́гольный ангидри́д, углекислота́[4], химическая формула — CO2) — химическое соединение, представляющее собой кислотный оксид углерода, состоящий из одного атома углерода и двух атомов кислорода.
При нормальных условиях, диоксид углерода — это бесцветный газ, почти без запаха (в больших концентрациях с кисловатым «содовым» запахом).
Плотность при нормальных условиях — 1,98 кг/м3 (в 1,5 раза тяжелее воздуха). При атмосферном давлении диоксид углерода не существует в жидком состоянии, переходя непосредственно из твёрдого состояния в газообразное (возгонка). Твёрдый диоксид углерода называют сухим льдом. При повышенном давлении и обычных температурах углекислый газ переходит в жидкость, что используется для его хранения.
Концентрация углекислого газа в атмосфере Земли составляет в среднем 0,04 %[5]. Углекислый газ легко пропускает излучение в ультрафиолетовой и видимой частях спектра, которое поступает на Землю от Солнца и обогревает её. В то же время он поглощает испускаемое Землёй инфракрасное излучение и является одним из парниковых газов, вследствие чего должен участвовать в процессе глобального потепления[6]. Изначально, до появления жизни, углекислый газ составлял основу атмосферы Земли и его уровень снижался от десятков процентов до долей одного в результате процесса фотосинтеза. Постоянный рост содержания этого газа в атмосфере наблюдается с начала индустриальной эпохи. Деятельность человека, прежде всего сжигание ископаемого топлива, увеличила его долю в атмосфере Земли примерно с 280 ppm (частей на миллион) в начале индустриализации до 407,8 ppm в 2018 году[7][8]. Рост содержания углекислого газа выше, до определённой концентрации, приводит к появлению облаков из углекислоты, что ведёт к похолоданию[9][нет в источнике]. Оба эти явления объясняют, почему температурные условия существования жизни на Земле относительно стабильны в течение миллиардов лет.[источник не указан 462 дня]
История
Двуокись углерода была одним из первых газов, получивших название. В XVII веке фламандский химик Йохан Баптиста ван Гельмонт заметил, что масса древесного угля уменьшалась, когда он сжигался, потому что масса оставшейся золы была меньше массы используемого древесного угля. Его интерпретация заключалась в том, что остальная часть древесного угля превратилась в невидимое вещество, которое он назвал газом или spiritus sylvestre («лесной дух»)[10].
Свойства углекислого газа более тщательно изучил шотландский врач Джозеф Блэк. В 1754 году он обнаружил, что при смешивании растворов карбоната кальция с кислотами выделяется газ, который он назвал неподвижным воздухом[11]. Он понял, что он тяжелее воздуха и не поддерживает процессы горения. Когда этот газ вводили в раствор гидроксида кальция, он мог образовывать осадок. С помощью этого явления он показал, что углекислый газ содержится в дыхании млекопитающих и выделяется в результате микробиологической ферментации. Его работа доказала, что газы могут участвовать в химических реакциях, и внесла свой вклад в дело теории флогистона[12].
Джозефу Пристли удалось создать первую газированную воду в 1772 году, переведя серную кислоту в известковый раствор и растворив полученный диоксид углерода в стакане с водой[13]. Однако Уильям Браунригг[en] обнаружил связь между углекислым газом и угольной кислотой гораздо раньше. В 1823 году Гэмфри Дэви и Майкл Фарадей сжижали углекислый газ, увеличив давление[14]. Первое описание твёрдого углекислого газа принадлежит Адриену Тилорье, который открыл в 1834 году герметичный контейнер с жидким углекислым газом и обнаружил, что при самопроизвольном испарении происходит охлаждение, с образованием в результате твёрдого СО2[15].
Нахождение в природе
Углекислый газ содержится в атмосфере, гидросфере, литосфере и биосфере. Обмен углерода между ними происходит в основном за счёт двуокиси углерода. В 2015 году в атмосфере содержалось примерно около 830 гигатонн (830 миллиардов тонн) углерода в форме двуокиси углерода[16]. Гидросфера содержит около 38 тератонн углерода в виде физически растворённого диоксида углерода, а также растворённых гидрокарбонатов и карбонатов. Литосфера содержит самую большую долю химически связанного диоксида углерода. Карбонатные породы, такие как кальцит и доломит, содержат около 60 петатонн углерода[17]. Кроме того, большие количества углерода хранятся в районах вечной мерзлоты, таких как тундры арктических и полярных антарктических регионов, в бореальных хвойных лесах или высоких горах и на болотах[18][19][20].
Свойства
Физические
Фазовая диаграмма диоксида углерода. В области давлений ниже давления в тройной точке на диаграмме имеется только линия сублимации, то есть твёрдый и жидкий диоксид углерода сосуществовать не могут. Это объясняет, почему при атмосферном давлении сухой лёд не плавясь возгоняется и превращается сразу в углекислый газ
Диоксид углерода (IV) (углекислый газ) — бесцветный газ, при малых концентрациях в воздухе не имеет запаха, при больших концентрациях имеет характерный кисловатый запах газированной воды. Тяжелее воздуха приблизительно в 1,5 раза.
Молекула углекислого газа линейна, расстояние от центра центрального атома углерода до центров двух атомов кислорода 116,3 пм.
При температуре −78,3 °С кристаллизуется в виде белой снегообразной массы — «сухого льда». Сухой лёд при атмосферном давлении не плавится, а испаряется, не переходя в жидкое состояние, температура сублимации −78 °С. Жидкий углекислый газ можно получить при повышении давления. Так, при температуре 20 °С и давлении свыше 6 МПа (~60 атм) газ сгущается в бесцветную жидкость. В тлеющем электрическом разряде светится характерным бело-зелёным светом.
Негорюч, но в его атмосфере может поддерживаться горение активных металлов, например, щелочных металлов и щёлочноземельных — магния, кальция, бария.
Углекислый газ образуется при гниении и горении органических веществ. Содержится в воздухе и минеральных источниках, выделяется при дыхании животных и растений. Растворим в воде (0,738 объёмов углекислого газа в одном объёме воды при 15 °С).
Химические
По химическим свойствам диоксид углерода относится к кислотным оксидам. При растворении в воде образует нестойкую угольную кислоту. Реагирует со щелочами с образованием её солей — карбонатов и гидрокарбонатов. Вступает в реакции электрофильного замещения (например, с фенолом) и нуклеофильного присоединения (например, с магнийорганическими соединениями).
Оксид углерода(IV) останавливает горение, вытесняя кислород из зоны реакции. В нём горят только некоторые активные металлы[21]:
.
Взаимодействие с оксидом активного металла:
.
При растворении в воде образует равновесную смесь раствора диоксида углерода и угольной кислоты, причём равновесие сильно сдвинуто в сторону разложения кислоты:
.
Реагирует со щелочами с образованием карбонатов и гидрокарбонатов:
(качественная реакция на углекислый газ),
.
Биологические

Во вдыхаемом человеком воздухе углекислый газ практически отсутствует, а в выдыхаемом воздухе его содержится около 4 % (объёмных)
Организм человека выделяет приблизительно 1 кг углекислого газа в сутки[22].
Этот углекислый газ переносится от тканей, где он образуется в качестве одного из конечных продуктов метаболизма, по венозной системе и затем выделяется с выдыхаемым воздухом через лёгкие. Таким образом, содержание углекислого газа в крови велико в венозной системе, уменьшается в капиллярной сети лёгких, и мало в артериальной крови. Содержание углекислого газа в пробе крови часто выражают в терминах парциального давления, то есть давления, которое бы имел содержащийся в пробе крови в данном количестве углекислый газ, если бы весь объём пробы крови занимал только он[23].
Содержание углекислого газа в крови человека приблизительно таково:
-
Референтные значения или средние значения парциального давления углекислого газа в крови (pCO2)
Единицы измерения Газ венозной крови Альвеолярный лёгочный газ Газ артериальной крови кПа 5,5[24]—6,8[24] 4,8 4,7[24]—6,0[24] мм рт. ст. 41—51 36 35[25]—45[25]
Углекислый газ транспортируется в крови тремя различными способами (точное соотношение каждого из этих трёх способов транспортировки зависит от того, является ли кровь артериальной или венозной).
- Бо́льшая часть углекислого газа (от 70 % до 80 %) преобразуется ферментом карбоангидразой эритроцитов в ионы гидрокарбоната[26] при помощи реакции
.
- Около 5—10 % углекислого газа растворено в плазме крови[26].
- Около 5—10 % углекислого газа связано с гемоглобином в виде карбаминосоединений (карбогемоглобин)[26].
Гемоглобин, основной кислород-транспортирующий белок эритроцитов крови, способен транспортировать как кислород, так и углекислый газ. Однако углекислый газ связывается с гемоглобином в ином месте, чем кислород. Он связывается с N-терминальными концами цепей глобина, а не с гемом. Однако благодаря аллостерическим эффектам, которые приводят к изменению конфигурации молекулы гемоглобина при связывании, связывание углекислого газа понижает способность кислорода к связыванию с ним же, при данном парциальном давлении кислорода, и наоборот — связывание кислорода с гемоглобином понижает способность углекислого газа к связыванию с ним же, при данном парциальном давлении углекислого газа. Помимо этого, способность гемоглобина к преимущественному связыванию с кислородом или с углекислым газом зависит также и от pH среды. Эти особенности очень важны для успешного захвата и транспорта кислорода из лёгких в ткани и его успешного высвобождения в тканях, а также для успешного захвата и транспорта углекислого газа из тканей в лёгкие и его высвобождения там.
Углекислый газ является одним из важнейших медиаторов ауторегуляции кровотока. Он является мощным вазодилататором. Соответственно, если уровень углекислого газа в ткани или в крови повышается (например, вследствие интенсивного метаболизма — вызванного, скажем, физической нагрузкой, воспалением, повреждением тканей, или вследствие затруднения кровотока, ишемии ткани), то капилляры расширяются, что приводит к увеличению кровотока и соответственно к увеличению доставки к тканям кислорода и транспорта из тканей накопившейся углекислоты. Кроме того, углекислый газ в определённых концентрациях (повышенных, но ещё не достигающих токсических значений) оказывает положительное инотропное и хронотропное действие на миокард и повышает его чувствительность к адреналину, что приводит к увеличению силы и частоты сердечных сокращений, величины сердечного выброса и, как следствие, ударного и минутного объёма крови. Это также способствует коррекции тканевой гипоксии и гиперкапнии (повышенного уровня углекислоты)[источник не указан 989 дней].
Ионы гидрокарбоната очень важны для регуляции pH крови и поддержания нормального кислотно-щелочного равновесия. Частота дыхания влияет на содержание углекислого газа в крови. Слабое или замедленное дыхание вызывает респираторный ацидоз, в то время как учащённое и чрезмерно глубокое дыхание приводит к гипервентиляции и развитию респираторного алкалоза.
Кроме того, углекислый газ также важен в регуляции дыхания. Хотя организм человека требует кислорода для обеспечения метаболизма, низкое содержание кислорода в крови или в тканях обычно не стимулирует дыхание (вернее, стимулирующее влияние нехватки кислорода на дыхание слишком слабо и «включается» поздно, при очень низких уровнях кислорода в крови, при которых человек нередко уже теряет сознание). В норме дыхание стимулируется повышением уровня углекислого газа в крови. Дыхательный центр гораздо более чувствителен к повышению уровня углекислого газа, чем к нехватке кислорода. Как следствие этого, дыхание сильно разрежённым воздухом (с низким парциальным давлением кислорода) или газовой смесью, вообще не содержащей кислорода (например, 100 % азотом или 100 % закисью азота) может быстро привести к потере сознания без возникновения ощущения нехватки воздуха (поскольку уровень углекислоты в крови не повышается, ибо ничто не препятствует её выдыханию). Это особенно опасно для пилотов военных самолётов, летающих на больших высотах (в случае аварийной разгерметизации кабины пилоты могут быстро потерять сознание). Эта особенность системы регуляции дыхания также является причиной того, почему в самолётах стюардессы инструктируют пассажиров в случае разгерметизации салона самолёта в первую очередь надевать кислородную маску самим, прежде чем пытаться помочь кому-либо ещё — делая это, помогающий рискует быстро потерять сознание сам, причём даже не ощущая до последнего момента какого-либо дискомфорта и потребности в кислороде[26].

Датчик содержания углекислого газа в помещении
Углекислый газ накапливается в помещении при недостаточной вентиляции. При содержании его в воздухе выше 1000 ppm, то есть 0,1% объёмной концентрации, человек ощущает вялость, затруднённое дыхание («духота»). Превышением по санитарным нормативам считается уровень выше 1400 ppm. При таком показателе уже трудно выполнять работу, трудно нормально засыпать. При уровне более 3000 ppm (0,3%) человек испытывает тошноту, учащается пульс[27]. Углекислый газ при концентрации его в воздухе 7-10% (70,000-100,000 ppm) может привести к удушью и потере сознания даже при присутствии достаточного количества кислорода[28].
Дыхательный центр человека пытается поддерживать парциальное давление углекислого газа в артериальной крови не выше 50 мм ртутного столба. При сознательной гипервентиляции содержание углекислого газа в артериальной крови может снизиться до 10—20 мм ртутного столба, при этом содержание кислорода в крови практически не изменится или увеличится незначительно, а потребность сделать очередной вдох уменьшится как следствие уменьшения стимулирующего влияния углекислого газа на активность дыхательного центра. Это является причиной того, почему после некоторого периода сознательной гипервентиляции легче задержать дыхание надолго, чем без предшествующей гипервентиляции. Такая сознательная гипервентиляция с последующей задержкой дыхания может привести к потере сознания до того, как человек ощутит потребность сделать вдох. В безопасной обстановке такая потеря сознания ничем особенным не грозит (потеряв сознание, человек потеряет и контроль над собой, перестанет задерживать дыхание и сделает вдох, дыхание, а вместе с ним и снабжение мозга кислородом восстановятся, а затем восстановится и сознание). Однако в других ситуациях, например, перед нырянием, это может быть опасным (потеря сознания и потребность сделать вдох наступят на глубине, и в отсутствие сознательного контроля в дыхательные пути попадёт вода, что может привести к утоплению)[источник не указан 1924 дня]. Именно поэтому гипервентиляция перед нырянием опасна и не рекомендуется.
Получение
- В промышленных количествах углекислота выделяется из дымовых газов, или как побочный продукт химических процессов, например, при разложении природных карбонатов[29] (известняк, доломит) или при производстве алкоголя (спиртовое брожение). Смесь полученных газов промывают раствором карбоната калия, которые поглощают углекислый газ, переходя в гидрокарбонат. Раствор гидрокарбоната при нагревании или при пониженном давлении разлагается, высвобождая углекислоту. В современных установках получения углекислого газа вместо гидрокарбоната чаще применяется водный раствор моноэтаноламина, который при определённых условиях способен абсорбировать
, содержащийся в дымовом газе, а при нагреве отдавать его; таким образом отделяется готовый продукт от других веществ.
- Также углекислый газ получают на установках разделения воздуха как побочный продукт получения чистого кислорода, азота и аргона.

В лабораторных условиях небольшие количества получают взаимодействием карбонатов и гидрокарбонатов с кислотами, например мрамора, мела или соды с соляной кислотой, используя, например, аппарат Киппа[29]:
.
Использование реакции серной кислоты с мелом или мрамором приводит к образованию малорастворимого сульфата кальция, который замедляет реакцию, и который удаляется значительным избытком кислоты с образованием кислого сульфата кальция.
Для приготовления сухих напитков может быть использована реакция пищевой соды с лимонной кислотой или с кислым лимонным соком. Именно в таком виде появились первые газированные напитки. Их изготовлением и продажей занимались аптекари.
Также для получения углекислого газа применяется экзотермическая реакция горения углерода в кислороде[29]:
.
Применение
-
-
-
Бытовой баллончик со сжиженным углекислым газом
В пищевой промышленности углекислота используется как консервант и разрыхлитель, обозначается на упаковке кодом Е290.
В криохирургии используется как одно из основных веществ для криоабляции новообразований.
Жидкая углекислота широко применяется в системах пожаротушения и в огнетушителях. Автоматические углекислотные установки для пожаротушения различаются по системам пуска, которые бывают пневматическими, механическими или электрическими.
При сооружении московского метро в XX веке жидкая углекислота использовалась для заморозки грунта.
Устройство для подачи углекислого газа в аквариум может включать в себя резервуар с газом. Простейший и наиболее распространённый метод получения углекислого газа основан на конструкции для изготовления алкогольного напитка браги. При брожении выделяемый углекислый газ вполне может обеспечить подкормку аквариумных растений[30].
Углекислый газ используется для газирования лимонада, газированной воды и других напитков. Углекислый газ используется также в качестве защитной среды при сварке проволокой, но при высоких температурах происходит его распад с выделением кислорода. Выделяющийся кислород окисляет металл. В связи с этим приходится в сварочную проволоку вводить раскислители, такие как марганец и кремний. Другим следствием влияния кислорода, также связанного с окислением, является резкое снижение поверхностного натяжения, что приводит, среди прочего, к более интенсивному разбрызгиванию металла, чем при сварке в инертной среде.
Углекислота в баллончиках применяется в пневматическом оружии (в газобаллонной пневматике) и в качестве источника энергии для двигателей в авиамоделировании.
Хранение углекислоты в стальном баллоне в сжиженном состоянии выгоднее, чем в виде газа. Углекислота имеет сравнительно низкую критическую температуру +31 °С. В стандартный 40-литровый баллон заливают около 20 кг сжиженного углекислого газа, и при комнатной температуре в баллоне будет находиться жидкая фаза, а давление составит примерно 6 МПа (60 кгс/см2). Если температура будет выше +31 °С, то углекислота перейдёт в сверхкритическое состояние с давлением выше 7,36 МПа. Стандартное рабочее давление для обычного 40-литрового баллона составляет 15 МПа (150 кгс/см2), однако он должен безопасно выдерживать давление в 1,5 раза выше, то есть 22,5 МПа, — таким образом, работа с подобными баллонами может считаться вполне безопасной.
Твёрдая углекислота — «сухой лёд» — используется в качестве хладагента в лабораторных исследованиях, в розничной торговле, при ремонте оборудования (например: охлаждение одной из сопрягаемых деталей при их посадке внатяжку) и так далее. Для сжижения углекислого газа и получения сухого льда применяются углекислотные установки.
Методы регистрации
Измерение парциального давления углекислого газа требуется в технологических процессах, в медицинских применениях — анализ дыхательных смесей при искусственной вентиляции лёгких и в замкнутых системах жизнеобеспечения. Анализ концентрации СО2 в атмосфере используется для экологических и научных исследований, для изучения парникового эффекта.
Углекислый газ регистрируют с помощью газоанализаторов основанных на принципе инфракрасной спектроскопии и других газоизмерительных систем. Медицинский газоанализатор для регистрации содержания углекислоты в выдыхаемом воздухе называется капнограф. Для измерения низких концентраций СО2 (а также CO) в технологических газах или в атмосферном воздухе можно использовать газохроматографический метод с метанатором и регистрацией на пламенно-ионизационном детекторе[31].
Ежегодные колебания концентрации атмосферной углекислоты на планете определяются, главным образом, растительностью средних (40—70°) широт Северного полушария.
Вегетация в тропиках практически не зависит от сезона, сухой пояс пустынь 20—30° (обоих полушарий) даёт малый вклад в круговорот углекислоты, а полосы суши, наиболее покрытые растительностью, расположены на Земле асимметрично (в Южном полушарии в средних широтах находится океан).
Поэтому с марта по сентябрь вследствие фотосинтеза содержание СО2 в атмосфере падает, а с октября по февраль — повышается. Вклад в зимний прирост дают как окисление древесины (гетеротрофное дыхание растений, гниение, разложение гумуса, лесные пожары), так и сжигание ископаемого топлива (угля, нефти, газа), заметно увеличивающееся в зимний сезон[32].
Большое количество углекислоты растворено в океане.
Углекислый газ составляет значительную часть атмосфер некоторых планет Солнечной системы: Венеры, Марса.
Физиологическое действие
Углекислый газ[33] нетоксичен, однако при вдыхании его повышенных концентраций в воздухе по воздействию на воздуходышащие живые организмы его относят к удушающим газам (англ.) (рус..
В соответствии с ГОСТом 12.1.007-76 диоксид углерода относится к вредным веществам IV класса опасности[34][35].
Растворённый в крови углекислый газ активирует дыхательный центр мозга в физиологических и несколько повышенных концентрациях. Незначительные повышения концентрации, вплоть до 0,2−0,4 % (2000−4000 ppm), в помещениях приводят к развитию у людей сонливости и слабости. В значительно более высоких концентрациях он приводит к снижению или устранению рефлекторного респираторного раздражителя, сначала к угнетению дыхания и, наконец, к остановке дыхания[36]. От 5 % углекислого газа во вдыхаемом воздухе возникают головные боли и головокружение, при более высоких концентрациях учащённое сердцебиение (тахикардия), повышение артериального давления, одышка и потеря сознания, так называемая углекислотная анестезия. Концентрация углекислого газа свыше 8 % приводит к отравлению с последующим смертельным исходом в течение 30-60 минут[37][38]. Накопление углекислого газа в крови называется гиперкапнией.
Для помещений нормальным является уровень CO2 около 600 ppm (частей на миллион). Повышенные концентрации углекислого газа снижают когнитивные способности людей. Уже при 1200 ppm расширяются кровеносные сосуды в мозге, снижается активность нейронов и уменьшается объём коммуникации между регионами мозга[39]. В школьных классах типичной является концентрация 2000−2500, а общий разброс значений — от 1000 до 6000, это вызывает обеспокоенность у исследователей[40], поскольку выявлено снижение результатов учеников, выполняющих тестовые задания в душных помещениях[41].
| Влияние на взрослых здоровых людей | Концентрация углекислого газа, ppm |
|---|---|
| Нормальный уровень на открытом воздухе | 350—450 |
| Приемлемые уровни | <600 |
| Жалобы на несвежий воздух | >1200 |
| Общая вялость | 1000—2500 |
| Максимально допустимая концентрация в течение 8 часового рабочего дня | 5000 |
| Лёгкое отравление, учащается пульс и частота дыхания, тошнота и рвота | 30 000 |
| Добавляется головная боль и лёгкое нарушение сознания | 50 000 |
| Потеря сознания, в дальнейшем — отравление с последующим смертельным исходом | 100 000 |
Вдыхание воздуха с повышенной концентрацией этого газа не приводит к долговременным расстройствам здоровья. После удаления пострадавшего из атмосферы с высокой концентрацией углекислого газа быстро наступает полное восстановление здоровья и самочувствия[42].
Рекомендуемая ПДК в воздухе рабочей зоны для диоксида углерода составляет 9000 мг/м3[43].
В культуре
- CO2 — песня DJ Smash и Artik & Asti.
См. также
- Углекислый газ в атмосфере Земли
- Угольная кислота
- Выхлопные газы
- Лимнологическая катастрофа
- Глобальное потепление
- Торговля эмиссионными квотами
Примечания
- ↑ Carbon Dioxide - Thermophysical Properties. Дата обращения: 23 ноября 2018. Архивировано 24 ноября 2018 года.
- ↑ Carbon dioxide: Immediately Dangerous to Life or Health Concentrations (IDLH). Дата обращения: 7 марта 2020. Архивировано 20 апреля 2018 года.
- ↑ name=https://docs.cntd.ru_ГОСТ (недоступная ссылка) 12.1.007-76. Система стандартов безопасности труда. Вредные вещества. Классификация и общие требования
- ↑ Раков Э. Г., Углерода диоксид, 2016.
- ↑ Trends in Atmospheric Carbon Dioxide (англ.). National Oceanic and Atmospheric Administration. Дата обращения: 24 сентября 2013. Архивировано 5 февраля 2018 года.
- ↑ Jochem Marotzke; Martin Stratmann. Die Zukunft des Klimas : neue Erkenntnisse, neue Herausforderungen : ein Report der Max-Planck-Gesellschaft (нем.). — München: C. H. Beck, 2015. — S. 9—22. — ISBN 978-3-406-66968-2, 3-406-66968-9.
- ↑ Eggleton, R. A. A short introduction to climate change (англ.). — Cambridge: CUP, 2012. — 240 p. — ISBN 978-1-139-52435-3, 1-139-52435-6, 978-1-139-62739-9, 1-139-62739-2, 978-1-283-94302-4, 1-283-94302-6, 978-1-139-62794-8, 1-139-62794-5, 1-139-62705-8, 978-1-139-62705-4. Архивная копия от 21 апреля 2020 на Wayback Machine
- ↑ Treibhausgas-Konzentration erreicht neuen Rekordwert (нем.). klimareporter°. Дата обращения: 22 сентября 2020. Архивировано 21 октября 2020 года.
- ↑ Chen Zhou, Mark D. Zelinka & Stephen A. Klein. Impact of decadal cloud variations on the Earth’s energy budget (англ.). Nature Geoscience. Дата обращения: 4 декабря 2019. Архивировано 13 октября 2019 года.
- ↑ Brock, William H. 1936-. Viewegs Geschichte der Chemie. — Braunschweig. — С. 35. — XII, 472 S с. — ISBN 978-3-528-06645-1, 3-528-06645-8, 3-540-67033-5, 978-3-540-67033-9.
- ↑ Brock, William H. 1936-. Viewegs Geschichte der Chemie. — Braunschweig. — С. 50. — XII, 472 S с. — ISBN 978-3-528-06645-1, 3-528-06645-8, 3-540-67033-5, 978-3-540-67033-9.
- ↑ Brock, William H. 1936-. Viewegs Geschichte der Chemie. — Braunschweig. — С. 72. — XII, 472 S с. — ISBN 978-3-528-06645-1, 3-528-06645-8, 3-540-67033-5, 978-3-540-67033-9.
- ↑ Joseph Priestley. XIX. Observations on different kinds of air. // Philosophical Transactions of the Royal Society of London. — 1772-01-01. — Т. 62. — С. 147–264. — doi:10.1098/rstl.1772.0021. Архивировано 12 октября 2020 года.
- ↑ XVIII. On the application of liquids formed by the condensation of gases as mechanical agents (EN) // Philosophical Transactions of the Royal Society of London. — 1823-12-31. — Т. 113. — С. 199–205. — ISSN 2053-9223 0261-0523, 2053-9223. — doi:10.1098/rstl.1823.0020.
- ↑ Joost Mertens. Du côté d’un chimiste nommé Thilorier // L’Année balzacienne. — 2003. — Т. 4, вып. 1. — С. 251. — ISSN 0084-6473. — doi:10.3917/balz.004.0251.
- ↑ Die Zukunft des Klimas : neue Erkenntnisse, neue Herausforderungen : ein Report der Max-Planck-Gesellschaft. — München: C.H. Beck, 2015. — С. 125. — 123-136 с. — ISBN 978-3-406-66968-2, 3-406-66968-9.
- ↑ Kappas, M. (Martin). Klimatologie : Klimaforschung im 21. Jahrhundert - Herausforderung für Natur- und Sozialwissenschaften. — Heidelberg: Spektrum Akademischer Verlag, 2009. — С. 159. — 1 online resource с. — ISBN 978-3-8274-2242-2, 3-8274-2242-6.
- ↑ Permafrost - Auf dünnem Eis (нем.). Deutschlandfunk. Дата обращения: 22 сентября 2020. Архивировано 22 октября 2020 года.
- ↑ International Permafrost Association Country Reports (англ.). International Permafrost Association. Дата обращения: 22 сентября 2020. Архивировано 31 августа 2020 года.
- ↑ NABU - Moore und Klimawandel (нем.). NABU - Naturschutzbund Deutschland e.V.. Дата обращения: 22 сентября 2020. Архивировано 20 января 2021 года.
- ↑ Егоров А. С. Репетитор по химии — Ростов-на-Дону: «Феникс», 2009.
- ↑ 7. How much carbon dioxide do humans contribute through breathing?. Frequent Questions — Emissions (англ.). US EPA. Дата обращения: 4 декабря 2019. Архивировано 2 февраля 2011 года.
- ↑ Charles Henrickson. Chemistry (англ.). — Cliffs Notes, 2005. — ISBN 0-7645-7419-1.
- ↑ 1 2 3 4 Пересчитано из значений в мм. рт. ст. с использованием коэффициента пересчёта 0,133322 кПа/мм. рт. ст.
- ↑ 1 2 Таблица референсных значений. Юго-Западный медицинский центр при Университете Далласа.
- ↑ 1 2 3 4 Carbon dioxide. solarnavigator.net. Дата обращения: 12 октября 2007. Архивировано из оригинала 14 сентября 2008 года.
- ↑ Допустимое содержание СО2 в помещениях
- ↑ Carbon Dioxide as a Fire Suppressant: Examining the Risks, U.S. Environmental Protection Agency.
- ↑ 1 2 3 Glinka, Nikolaj Leonidovič (1882-1965). Obŝaâ himiâ. — Izd. 27-e ster. — Leningrad: «Himiâ», 1988. — 702, [2] s. с. — ISBN 5724500035, 9785724500036.
- ↑ Большая Энциклопедия Нефти и Газа.
- ↑ ГОСТ 31371.6-2008 (ИСО 6974-6:2002). Газ природный. Определение состава методом газовой хроматографии с оценкой неопределённости. Часть 6. Определение водорода, гелия, кислорода, азота, диоксида углерода и углеводородов C1 — C8 с использованием трёх капиллярных колонок. Docs.cntd.ru. — М.: Стандартинформ, 2009.. Дата обращения: 4 декабря 2019. Архивировано 4 декабря 2019 года.
- ↑ Бялко А. В. Растения убыстряют рост // Природа. — 1996. — № 10. (по Keeling C.D., Whorf Т.P., Wahlen M., van der Plicht J. // Nature. 1995. V. 375, № 6533. P.666-670)
- ↑ Carbon dioxide poisoning: a literature review of an often forgotten cause of intoxication in the emergency department. Дата обращения: 3 марта 2020. Архивировано 1 ноября 2020 года.
- ↑ name=https://docs.cntd.ru_ГОСТ (недоступная ссылка) 12.1.005-76. Воздух рабочей зоны. Общие санитарно-гигиенические требования
- ↑ name=https://docs.cntd.ru_ГОСТ (недоступная ссылка) 8050-85 Двуокись углерода
- ↑ Rauchvergiftungen/Vergiftungen durch Gase (TK). web.archive.org (4 июня 2010). Дата обращения: 22 сентября 2020.
- ↑ Deutsches Rotes Kreuz. Vergiftungen und Hilfe bei Erbrechen - Erste Hilfe (нем.). DRK e.V. (17 июня 2020). Дата обращения: 22 сентября 2020. Архивировано 23 октября 2020 года.
- ↑ Carbon Dioxide - Life and Death. web.archive.org (22 мая 2013). Дата обращения: 22 сентября 2020.
- ↑ Greenwood, Veronique. Is Conference Room Air Making You Dumber? : [англ.] // The New York Times : газ. — 2019. — 6 May.
- ↑ Ventilation rates and carbon dioxide concentrations in schools. — In: Ventilation with Outdoor Air : [англ.] // Berkeley Lab : [сайт]. — 2019.
- ↑ Сорокин, Андрей. «Глобальное потепление отупляет. От этого уже страдают школьники и офисные работники» // Republic : [сайт]. — 2020. — 7 января.
- ↑ (англ.) Glatte Jr H. A., Motsay G. J., Welch B. E. Carbon Dioxide Tolerance Studies (англ.) // Brooks AFB, TX School of Aerospace Medicine Technical Report. — 1967. — Vol. SAM—TR—67—77. Архивировано 9 мая 2008 года.
- ↑ name=https://docs.cntd.ru_ПДК (недоступная ссылка) вредных веществ в воздухе рабочих помещений
Литература
- Вукалович М. П., Алтунин В. В. Теплофизические свойства двуокиси углерода. — М.: Атомиздат, 1965. — 456 с.
- Гродник М. Г., Величанский А. Я. Проектирование и эксплуатация углекислотных установок. — М.: Пищевая промышленность, 1966. — 275 с.
- Раков Э. Г. Углерода диоксид // Большая российская энциклопедия. — М.: Большая российская энциклопедия, 2016. — Т. 32. — С. 662—663.
- Тезиков А. Д. Производство и применение сухого льда. — М.: Госторгиздат, 1960. — 128 с.
- Талянкер Ю. Е. Особенности хранения баллонов со сжиженным газом // Сварочное производство. — 1972. — № 11.
Ссылки
- International Chemical Safety Card 0021 Архивная копия от 13 февраля 2008 на Wayback Machine (англ.)
- CID 280 Архивная копия от 18 января 2012 на Wayback Machine — PubChem (англ.)
- CO2 Диоксид углерода, свойства, применение Архивная копия от 13 февраля 2021 на Wayback Machine (англ.)
- Фазовая диаграмма (давление-температура) для диоксида углерода
- Диоксид углерода в 3D
- Dry Ice information Архивная копия от 3 апреля 2004 на Wayback Machine (англ.)
- Phase Diagram of Carbon Dioxide (англ.)
- Experiment 071 — Triple Point Phase Transition for Carbon Dioxide
- CO2 как природный рефрежерант — FAQs (англ.)
- Великобритания разрабатывает метод сохранения двуокиси углерода
- Онлайн калькулятор свойств CO2 Архивная копия от 30 сентября 2011 на Wayback Machine (англ.)
| п • <abbr title=»Обсуждение этого шаблона»>о</abbr> • р Оксиды | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H2O | ||||||||||||||||
| Li2O LiCoO2 Li3PaO4 Li5PuO6 Ba2LiNpO6 LiAlO2 Li3NpO4 Li2NpO4 Li5NpO6 LiNbO3 |
BeO | B2O3 | С3О2 C12O9 CO C12O12 C4O6 CO2 |
N2O NO N2O3 N4O6 NO2 N2O4 N2O5 |
O | F | ||||||||||
| Na2O NaPaO3 NaAlO2 Na2PtO3 |
MgO | AlO Al2O3 NaAlO2 LiAlO2 AlO(OH) |
SiO SiO2 |
P4O P4O2 P2O3 P4O8 P2O5 |
S2O SO SO2 SO3 |
Cl2O ClO2 Cl2O6 Cl2O7 |
||||||||||
| K2O K2PtO3 KPaO3 |
CaO Ca3OSiO4 CaTiO3 |
Sc2O3 | TiO Ti2O3 TiO2 TiOSO4 CaTiO3 BaTiO3 |
VO V2O3 V3O5 VO2 V2O5 |
FeCr2O4 CrO Cr2O3 CrO2 CrO3 MgCr2O4 |
MnO Mn3O4 Mn2O3 MnO(OH) Mn5O8 MnO2 MnO3 Mn2O7 |
FeCr2O4 FeO Fe3O4 Fe2O3 |
CoFe2O4 CoO Co3O4 CoO(OH) Co2O3 CoO2 |
NiO NiFe2O4 Ni3O4 NiO(OH) Ni2O3 |
Cu2O CuO CuFe2O4 Cu2O3 CuO2 |
ZnO | Ga2O Ga2O3 |
GeO GeO2 |
As2O3 As2O4 As2O5 |
SeOCl2 SeOBr2 SeO2 Se2O5 SeO3 |
Br2O Br2O3 BrO2 |
| Rb2O RbPaO3 Rb4O6 |
SrO | Y2O3 YOF YOCl |
ZrO(OH)2 ZrO2 ZrOS Zr2О3Сl2 |
NbO Nb2O3 NbO2 Nb2O5 Nb2O3(SO4)2 LiNbO3 |
Mo2O3 Mo4O11 MoO2 Mo2O5 MoO3 |
TcO2 Tc2O7 |
Ru2O3 RuO2 Ru2O5 RuO4 |
RhO Rh2O3 RhO2 |
PdO Pd2O3 PdO2 |
Ag2O Ag2O2 |
Cd2O CdO |
In2O InO In2O3 |
SnO SnO2 |
Sb2O3 Sb2O4 Hg2Sb2O7 Sb2O5 |
TeO2 TeO3 |
I2O4 I4O9 I2O5 |
| Cs2O Cs2ReCl5O |
BaO BaPaO3 BaTiO3 BaPtO3 |
HfO(OH)2 HfO2 |
Ta2O TaO TaO2 Ta2O5 |
WO2Br2 WO2 WO2Cl2 WOBr4 WOF4 WOCl4 WO3 |
Re2O ReO Re2O3 ReO2 Re2O5 ReO3 Re2O7 |
OsO Os2O3 OsO2 OsO4 |
Ir2O3 IrO2 |
PtO Pt3O4 Pt2O3 PtO2 K2PtO3 Na2PtO3 PtO3 |
Au2O AuO Au2O3 |
Hg2O HgO (Hg3O2)SO4 Hg2O(CN)2 Hg2Sb2O7 Hg3O2Cl2 Hg5O4Cl2 |
Tl2O Tl2O3 |
Pb2O PbO Pb3O4 Pb2O3 PbO2 |
BiO Bi2O3 Bi2O4 Bi2O5 |
PoO PoO2 PoO3 |
At | |
| Fr | Ra | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | |
| ↓ | ||||||||||||||||
| La2O2S La2O3 |
Ce2O3 CeO2 |
PrO Pr2O2S Pr2O3 Pr6O11 PrO2 |
NdO Nd2O2S Nd2O3 NdHO |
Pm2O3 | SmO Sm2O3 |
EuO Eu3O4 Eu2O3 EuO(OH) Eu2O2S |
Gd2O3 | Tb | Dy2O3 | Ho2O3 Ho2O2S |
Er2O3 | Tm2O3 | YbO Yb2O3 |
Lu2O2S Lu2O3 LuO(OH) |
||
| Ac2O3 | UO2 UO3 U3O8 |
PaO PaO2 Pa2O5 PaOS |
ThO2 | NpO NpO2 Np2O5 Np3O8 NpO3 |
PuO Pu2O3 PuO2 PuO3 PuO2F2 |
AmO2 | Cm2O3 CmO2 |
Bk2O3 | Cf2O3 | Es | Fm | Md | No | Lr |
Эта страница в последний раз была отредактирована 28 ноября 2022 в 13:18.
Как только страница обновилась в Википедии она обновляется в Вики 2.
Обычно почти сразу, изредка в течении часа.
Химическое соединение с формулой CO2
 |
||
|
||
| Наименования | ||
|---|---|---|
Другие наименования
|
||
| Идентификаторы | ||
| Номер CAS |
|
|
| 3D-модель (JSmol ) |
|
|
| 3DMet |
|
|
| Ссылка Beilstein | 1900390 | |
| ChEBI |
|
|
| ChEMBL |
|
|
| ChemSpider |
|
|
| ECHA InfoCard | 100.004.271 |
|
| ЕС |
|
|
| Номер E | E290 (консерванты) | |
| Ссылка Гмелина | 989 | |
| KEGG |
|
|
| MeSH | Углерод + диоксид | |
| PubChem CID |
|
|
| номер RTECS |
|
|
| UNII |
|
|
| Номер ООН | 1013 (газ), 1845 (твердый) | |
| Па нель управления CompTox (EPA ) |
|
|
InChI
|
||
УЛЫБАЕТСЯ
|
||
| Свойства | ||
| Химическая формула | CO2 | |
| Молярная масса | 44 009 г · моль | |
| Внешний вид | Бесцветный газ | |
| Запах |
|
|
| Плотность |
|
|
| точка плавления | -56,6 ° C; -69,8 ° F; 216,6 K (тройная точка при 5,1 атм) | |
| Критическая точка (T, P) | 31,1 ° C (304,2 K), 7,38 мегапаскалей (73,8 бар) | |
| Условия сублимации. | -78,5 ° C; -109,2 ° F; 194,7 К (1 атм) | |
| Растворимость в воде | 1,45 г / л при 25 ° C (77 ° F), 100 кПа | |
| Давление пара | 5,73 МПа (20 ° C) | |
| Кислотность (pK a) | 6,35, 10,33 | |
| Магнитная восприимчивость (χ) | -20,5 · 10 см / моль | |
| Теплопроводность | 0,01662 Вт · м · K (300 K) | |
| Показатель преломления (nD) | 1.00045 | |
| Вязкость |
|
|
| Дипольный момент | 0 D | |
| Структура | ||
| Кристаллическая структура | Тригональная | |
| Молекулярная форма | Линейная | |
| Термохимия | ||
| Теплоемкость ( C) | 37,135 Дж / К · моль | |
| Станд. Моляр. энтропия (S 298) | 214 Дж · моль · K | |
| Стандартная энтальпия образования. (ΔfH298) | -393,5 кДж · моль | |
| Фармакология | ||
| Код АТС | V03AN02 (ВОЗ ) | |
| Опасности | ||
| Паспорт безопасности | См.: страница данных. Sigma-Aldrich | |
| NFPA 704 (огненный алмаз) |  0 2 0 SA 0 2 0 SA |
|
| Смертельная доза или концентраци я (LD, LC): | ||
| LCLo(самая низкая опубликованная ) | 90000 частей на миллион (человек, 5 мин) | |
| NIOSH (пределы воздействия на здоровье США): | ||
| ПЕЛ (Пермь выпускается) | TWA 5000 ppm (9000 мг / м) | |
| REL (рекомендуется) | TWA 5000 ppm (9000 мг / м), ST 30 000 ppm (54000 мг / м) | |
| IDLH (Непосредственная опасность) | 40,000 ppm | |
| Родственные соединения | ||
| Другие анионы |
|
|
| Прочие катионы |
|
|
| Связанные углерода оксиды |
|
|
| Связанные |
|
|
| Страница дополнительных данных | ||
| Структура и. свойства | Показатель преломления (n),. Диэлектрическая проницаемость (εr) и т. д. | |
| Термодинамические. данные | Фазовое поведение. твердое тело — жидкость — газ | |
| Спектральные данные | UV, IR, ЯМР, MS | |
| Если не указаны данные, данные приведены для материалов в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | ||
| Ссылки на ink | ||
Углерод диоксид (химическая форма ula CO. 2) представляет собой бесцветный газ с плотностью примерно на 53% выше, чем у сухого воздуха. Молекулы двуокиси углерода состоят из атома углерода , ковалентно двойной связи с двумя кислородом атомы. Он естественным образом примеси в атмосфере Земли в виде газовых примесей. Текущая деятельность составляет около 0,04% (412 ppm ) по объему, увеличившись с доиндустриальных уровней 280 ppm. Природные источники включают вулканы, горячие источники и гейзеры, и он выделен от карбонатных пород путем растворения в вода и кислоты. Углекислый газ растворим в воде, он естественным образом встречается в подземных водах, реках и озерах, ледяных шапках, ледниках и морская вода. Он присутствует в месторождениях нефти и природного газа. Двуокись углерода имеет резкий и кислый запах и создает во рту привкус газированной воды. Однако запах при обычных веществх он не имеет запаха.
Как источник доступного углерода в углеродном цикле, атмосферный диоксид углерода является основным источником углерода для жизнь на Земле и ее источник в доиндустриальной атмосфере Земли с конца докембрия регулировалась фотосинтетическими организмами и геологическими явлениями. Растения, водоросли и цианобактерии используют легкую энергию для фотосинтеза углеводов из диоксида углерода воды, причем кислород образуется как отходы.
CO. 2 производится всеми аэробными организмами, когда они метаболизируют органические соединения для производства энергии дыхание. Он возвращается в воду через жабры рыб и в воздух через легкие дышащих воздухом наземных животных, включая человека. Углекислый газ образуется в процессе распада материалов и брожения сахаров в хлебе, пиве и вине. изготовление. Получение путем сжигания древесины и других материалов и ископаемого топлива, такого как уголь, торф, нефть и природный газ. Это нежелательный побочный продукт во многих крупномасштабных процессах окисления, например, при производстве акриловой кислоты (более 5 миллионов тонн в год).
Это универсальный промышленный материал, используемый, например, в качестве газа под давлением в пневматических пистолетах и нефтедобыче, в качестве химического сырья и в качестве в качестве газа жидкого растворителя в сверхкритическом состоянии при декофеинизации кофе и сверхкритическая сушка. Его добавляют в питьевую воду и газированные напитки, включая пиво и игристое вино для придания шипучести. Замороженная твердая форма CO. 2, известная как сухой лед, используется в качестве хладагента и в качестве абразива при струйной очистке сухим льдом. Это сырье для синтеза топлива и химикатов.
Двуокись углерода наиболее значительным долгоживущим парниковым газом в атмосфере Земли. После промышленной революции антропогенные выбросы — в первую очередь от использования ископаемого топлива и обезлесения — быстро увеличили его концентрацию в атмосфере, что привело к глобальному потеп. Углекислый газ также вызывает закисление океана, потому что он растворяется в воде с образованием угольной кислоты.
Содержание
- 1 Предпосылки
- 2 Химические и физические свойства
- 2.1 Структура и связь
- 2.2 В водном растворе
- 2.3 Химические реакции CO 2
- 2.4 Физические свойства
- 3 Выделение и производство
- 4 Области применения
- 4.1 Прекурсор химических веществ
- 4.2 Пищевые продукты
- 4.2.1 Напитки
- 4.2.2 Виноделие
- 4.2.3 Оглушение животных
- 4.3 Инертный газ
- 4.4 Огнетушитель
- 4.5 Сверхкритический CO 2 в качестве растворителя
- 4.6 Сельское хозяйство
- 4.7 Использование в медицине и фармакологии
- 4.8 Энергия
- 4.8.1 Восстановление ископаемого топлива
- 4.8.2 Биопревращение в топливо
- 4.9 Хладагент
- 4.10 Незначительное использование
- 5 В атмосфере Земли
- 6 В океанах
- 7 Би роль
- 7.1 Фотосинтез и связывание углерода
- 7.2 Токсичность
- 7.2.1 Н иже 1%
- 7.2.2 Вентиляция
- 7.3 Физиология человека
- 7.3. 1 Содержание
- 7.3.2 Транспорт в крови
- 7.3.3 Повторная регуляция дыхания
- 8 См. также
- 9 Ссылки
- 10 Дополнительная литература
- 11 Внешние ссылки
Предпосылки

Диоксид углерода был первым газом быть описанным как дискретное вещество. Примерно в 1640 году фламандский химик Ян Баптист ван Гельмонт заметил, что когда он сжигал древесный уголь в закрытом сосуде, образовавшейся золы был намного меньше, чем у оригинального древесного угля. Его интерпретация заключалась в том, что остальная часть древесного угля была преобразована в невидимое вещество, которое он назвал «газом» или «диким духом» (spiritus sylvestris).
Свойства углекислого газа были изучены в 1750-х годах. шотландский врач Джозеф Блэк. Он обнаружил, что известняк (карбонат кальция ) можно нагреть или обработать кислотами, чтобы получить газ, который он назвал «неподвижным воздухом». Он заметил, что неподвижный воздух был плотнее воздуха и не поддерживал ни пламя, ни жизнь животных. Блэк также обнаружил, что при барботировании через известковую воду (насыщенный водный раствор гидроксида кальция ) он осаждает карбонат кальция. Он использовал это явление, чтобы проиллюстрировать, что углекислый газ образует эффект в результате дыхания животных и микробной ферментации. В 1772 году английский химик Джозеф Пристли опубликовал статью, озаглавленную «Пропитка воды фиксированным воздухом», в которой он описал процесс капания серной кислоты (или купоросного масла, как знал Пристли) на мел. для образования диоксида углерода и принуждения газа к растворению емкости с водой, контактирующей с газом.
Впервые диоксид углерода был сжижен (при повышенном давлении) в 1823 году Хамфри Дэви и Майкл Фарадей. Самое раннее описание твердого диоксида углерода (сухой лед ) было дано французским изобретателем Адрианом-Жан-Пьером Тилорье, который в 1835 году открыл контейнер с жидким диоксидом углерода под давлением только для того, чтобы создание, что охлаждение, вызванное быстрым испарением жидкости, привело к образованию «снега» твердого CO. 2.
Химические и физические свойства
Структура и связь
Молекула диоксида углерода линейна и центросимметричный в состоянии равновесия. Длина связи углерод-кислород составляет 116,3 пм, что заметно короче, чем длина связи одинарной связи CO, и даже короче, чем у других других CO многосвязные функциональные группы. Она центросимметрична, молекула не имеет электрических дипольных.

Как линейная трехатомная молекула, CO 2 имеет четыре колебательные моды, как показано на диаграмме. Однако симметричная мода растяжения не создает диполь и поэтому не наблюдается в ИК-спектре. Две изгибные моды являются вырожденными, что означает, что они соответствуют только одной частоте. Следовательно, в ИК-спектре наблюдаются только две колебательные полосы — антисимметричная мода растяжения при волновом числе 2349 см и пара вырожденных изгибных мод при 667 см (длина волны 15 мкм). Существует также симметричная мода растяжения на 1388 см, которая наблюдается только в рамановском спектре .
. В результате двух мод изгиба молекула является строго линейной только тогда, когда величина изгиба равна нулю. Это было доказано как теорией, так и экспериментами по визуализации кулоновского взрыва. что на самом деле это никогда не верно для обоих режимов одновременно. В газовой фазе диоксида углерода одна из молекул не является линейной из-за колебательных движений. Однако геометрия молекулы по-прежнему описывается как линейная, которая представляет средние положения атомов, соответствующей минимальной потенциальной энергии. То же верно и для других «линейных» молекул.
В водном растворе
Двуокись углерода растворима в воде, в которой он обратимо образует H. 2CO. 3(угольную кислоту ), которая слабая кислота, так как ее ионизация в воде неполная.
- CO. 2+ H. 2O ⇌ H. 2CO. 3
Константа равновесия гидратации угольной кислоты равна K h = [H 2 CO 3] [CO 2 (водн.)] = 1,70 × 10 — 3 { displaystyle K _ { mathrm {h}} = { frac { rm {[H_ {2} CO_ {3}]}} { rm {[CO_ {2} (водн.)] }}} = 1,70 умножить на 10 ^ {- 3}}![K _ { mathrm {h}} = { frac { rm {[H_ {2} CO_ {3}]}} { rm {[CO_ {2} (водн.)]} }} = 1,70 tim es 10 ^ {- 3}](https://wikimedia.org/api/rest_v1/media/math/render/svg/880be9280cefa51b14dc80f037e4296c81a15e6b)
Относительные концентрации CO. 2, H. 2CO. 3и депротонированных форм HCO. 3(бикарбоната ) и CO. 3(карбоната ) зависят на pH. Как показано на графике Бьерма, нейтральная или слабощелочная (pH>6,5) преобладает бикарбонатная форма воды (>50%), становясь наиболее распространенной (>95%) при pH морской воды. В очень щелочной воде (pH>10,4) преобладающая (>50%) форма представляет собой карбонат. Океаны, содержат около 120 мг бикарбоната на литр, будучи умеренно щелочным типичным pH = 8,2–8,5.
Будучи дипротонной, угольная кислота имеет две константы кислотной диссоциации, первая из которых предназначена для диссоциации на бикарбонатный (также называемый гидрокарбонатным) ион (HCO 3):
- H2CO3⇌ HCO 3 + H
- Ka1= 2,5 × 10 моль / л; pK a1 = 3,6 при 25 ° C.
Это истинная первая константа диссоциации кислоты, определяемая как K a 1 = [HCO 3 -] [H +] [H 2 CO 3 ] { displaystyle K_ {a1} = { frac { rm {[HCO_ {3} ^ {-}] [H ^ {+}]}} { rm {[H_ {2} CO_ {3}]} }}}![K_ {a1} = { frac { rm {[HCO_ {3} ^ {-}] [H ^ {+}]}} { rm {[H_ {2} CO_ {3 }]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/81950791f8b36374241d6fa82828522bd875668a)
![K _ { mathrm {a1}} { rm {(кажущееся)}} = { frac { rm {[HCO_ {3} ^ { -}] [H ^ {+}]}} { rm {[H_ {2} CO_ {3}] + [CO_ {2} (aq)]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d4cac9482fd21cb58444f2621f245d7b1d835485)
Ион бикарбоната представляет собой амфотерный вид, который может действовать как кислота или как основание, в зависимости от pH раствора. При высоком pH он значительно диссоциирует на карбонат ион (CO 3):
- HCO 3 ⇌ CO 3 + H
- Ka2= 4,69 × 10 моль / л; pK a2 = 10,329
В организме происходит образование угольной кислоты катализатором ферментом, карбоангидразой.
Химические реакции CO 2
CO. 2 являются сильнодействующими электрофил, обладающий электрофильной реакционной способностью, сравнимой с бензальдегидом или сильными α, β-ненасыщенными карбонильными соединениями. В отличие от электрофилов с аналогичной реакционной способностью, нуклеофилов с CO. 2 термодинамически менее предпочтительны и часто оказываются в высокой степени обратимыми. Только очень сильные нуклеофилы, такие как карбанионы, защищаемые реактивами Гриньяра и литийорганическими соединениями, реагируют с CO. 2 образованием карбоксилатов :
- МИСТЕР. + CO. 2 → RCO. 2M
- , где M = Li или Mg Br и R = алкил или арил.
In диоксид углерода металла комплексов, CO. 2 служит лигандом , который может превращать CO. 2 в другие химические вещества.
Восстановление CO. 2 на CO обычно сложной и медленной реакцией:
- CO. 2 + 2 e + 2H → CO + H 2O
Фотоавтотрофы (т. е. растения и цианобактерии ) используют энергию, содержащаяся в солнечном свете для фотосинтеза простых сахаров из CO. 2, поглощенных из воздуха и воды:
- n CO. 2 + n H. 2O → (CH. 2O). n+ n O. 2
окислительно-восстановительный потенциал для этой реакции pH 7 составляет около -0,53 В по сравнению со стандартным водородным электродом . Никельсодержащий фермент дегидрогеназа монооксида углерода катализирует этот процесс.
Физические свойства

Диоксид углерода бесцветен При стандартной температуре и давлении плотность диоксида углерода составляет около 1,98. кг / м3, что примерно в 1,67 раза больше плотности воздуха.
Двуокись углерода не имеет жидкого состояния при давлениих ниже 5,1 стандарт. атмосферы (520 кПа). При давлении 1 атмосфера (близкое к среднему давлению на уровне моря) газ осаждается непосредственно в твердое тело при температурех ниже -78,5 ° C (-109,3 ° F; 194,7 K), а твердое вещество возгоняется непосредственно в газе с температурой выше −78,5 ° C. В твердом состоянии диоксида углерода обычно называют сухим льдом.

Жидкий диоксид углерода образуется только при давлениях выше 5,1 банкомат; тройная точка диоксида углерода составляет около 5,1 бар (517 кПа ) при 217 К (см. Фазовую диаграмму). Критическая точка составляет 7,38 МПа при 31,1 ° C. Другой вид твердого диоксида углерода, наблюдаемой при высоком давлении, является аморфное стеклообразное твердое вещество. Эта форма стекла, называемая карбония, производится путем переохлаждения нагретого CO. 2 при экстремальном давлении (40–48 ГПа или около 400000 атмосфер) в алмазная наковальня. Это открытие подтвердило теорию о том, что диоксид углерода может существовать в стеклянном состоянии, аналогичном другим членам его элементного семейства, таким как кремний (кварцевое стекло ) и диоксид германия. Однако, в отличие от кварцевых и германиевых стекол, карбониевое стекло нестабильно при нормальном давлении и превращается в газ при сбросе давления.
При температурах и давлениях выше критической точки диоксид углерода ведет себя как сверхкритический флюид, известный как сверхкритический диоксид углерода.
Изоляция и производство
Диоксид углерода можно получить перегонкой из воздуха, но этот метод неэффективен. В промышленности двуокись углерода представляет собой преимущественно неизвлекаемые отходы, производимые несколькими способами, которые могут применяться в различных масштабах.
сжигание всех углеродных топлив, такие как метан (природный газ ), нефтяные дистилляты (бензин, дизельное топливо, керосин, пропан ), уголь, древесина и обычные органические вещества образуют двуокись углерода и, за исключением чистого углерода, воду. Например, химическая реакция между метаном и кислородом:
- CH. 4+ 2 O. 2→ CO. 2+ 2 H. 2O
Она производится термическим разложением известняка CaCO. 3при нагревании (прокаливание ) при температуре около 850 ° C (1560 ° F) при производстве негашеной извести (оксид кальция, CaO), соединения, которое имеет множество промышленных применений:
- CaCO. 3→ CaO + CO. 2
Железо восстанавливается из оксидов с помощью кокса в доменной печи, производя чугун и диоксид углерода:
Диоксид углерода является побочным продуктом промышленного производства водорода посредством парового риформинга и реакции конверсии водяного газа в производстве аммиака. Эти процессы начинаются с реакции воды и природного газа (в основном метана). Это основной источник углекислого газа пищевого качества для использования при газировании пива и безалкогольных напитков, а также используется для оглушения животных, таких как домашняя птица. Летом 2018 года в Европе возник дефицит углекислого газа для этих целей из-за временной остановки нескольких аммиачных заводов на техническое обслуживание.
Кислоты высвобождают CO. 2 из большинства карбонатов металлов. Следовательно, он может быть получен непосредственно из природных источников двуокиси углерода источников, где он образуется под действием подкисленной воды на известняк или доломит. Реакция между соляной кислотой и карбонатом кальция (известняком или мелом) показана ниже:
- CaCO. 3+ 2 HCl → CaCl. 2+ H. 2CO. 3
угольная кислота (H. 2CO. 3) затем разлагается на воду и CO. 2:
- H. 2CO. 3→ CO. 2+ H. 2O
Такие реакции сопровождаются вспениванием или выделением пузырьков, или и тем, и другим, когда выделяется газ. Они широко используются в промышленности, так как могут использоваться для нейтрализации отработанных кислотных потоков.
Двуокись углерода является побочным продуктом ферментации сахара при пивоварении пива, виски и другие алкогольные напитки и при производстве биоэтанола. Дрожжи метаболизируют сахар с образованием CO. 2 и этанола, также известного как алкоголь, следующим образом:
- C. 6H. 12O. 6→ 2 CO. 2+ 2 C. 2H. 5OH
Все аэробные организмы производят CO. 2, когда они окисляют углеводы, жирные кислоты и белки. Большое количество вовлеченных реакций чрезвычайно сложны и нелегко описать. См. (клеточное дыхание, анаэробное дыхание и фотосинтез ). Уравнение для дыхания глюкозы и других моносахаридов :
- C. 6H. 12O. 6+ 6 O. 2→ 6 CO. 2+ 6 H. 2O
Анаэробные организмы разлагают органический материал с образованием метана и двуокись углерода вместе со следами других соединений. Независимо от типа органического материала образование газов следует четко определенной кинетической схеме. Двуокись углерода составляет около 40–45% газа, который выделяется при разложении на свалках (называемый «свалочный газ »). Большая часть остальных 50–55% приходится на метан.
Области применения
Двуокись углерода используется в пищевой, нефтяной и химической промышленности. Соединение имеет разнообразное коммерческое использование, но одно из самых больших его применений в качестве химического вещества — производство газированных напитков; он придает блеск газированным напиткам, таким как газированная вода, пиво и игристое вино.
Прекурсор химических веществ
В химической промышленности диоксид углерода в основном используется в качестве ингредиента при производстве мочевины, при этом меньшая фракция используется для производства метанол и ряд других товаров. Некоторые производные карбоновых кислот, такие как салицилат натрия, получают с использованием CO. 2 по реакции Кольбе-Шмитта.
В дополнение к обычным процессам с использованием CO. 2 для химического производства, электрохимического методы также изучаются на исследовательском уровне. В частности, использование возобновляемых источников энергии для производства топлива из CO. 2 (например, метанола) является привлекательным, поскольку это может привести к получению топлива, которое можно было бы легко транспортировать и использовать в традиционных технологиях сжигания, но не содержало бы чистого CO. 2.
Пищевые продукты

Двуокись углерода — это пищевая добавка, используемая в качестве пропеллента и регулятора кислотности в пищевой промышленности. Он одобрен для использования в ЕС (обозначен как E номер E290), США, Австралии и Новой Зеландии (перечислен под своим номером INS 290).
Конфета под названием Pop Rocks находится под давлением углекислого газа примерно 4 × 10 Па (40 бар, 580 фунтов на квадратный дюйм). При помещении в рот он растворяется (как и другие леденцы) и выпускает пузырьки газа с слышимым хлопком.
Разрыхлители заставляют тесто подниматься, выделяя углекислый газ. Пекарские дрожжи производят углекислый газ путем ферментации сахаров в тесте, а химические закваски, такие как разрыхлитель и пищевая сода выделяет двуокись углерода при нагревании или при воздействии кислот.
Напитки
Двуокись углерода используется для производства газированных безалкогольных напитков и газированная вода. Традиционно карбонизация пива и игристого вина происходила путем естественной ферментации, но многие производители карбонизируют эти напитки углекислым газом, полученным в процессе ферментации. В случае пива в бутылках и кегах наиболее распространенным методом является карбонизация переработанным углекислым газом. За исключением британского настоящего эля, разливное пиво обычно переносится из бочонков в холодильной камере или погребе в разливные краны на баре с помощью углекислого газа под давлением, иногда смешанного с азотом.
Вкус газированной воды (и связанные с ним вкусовые ощущения в других газированных напитках) — это результат растворенного углекислого газа, а не лопнувших пузырьков газа. Карбоангидраза 4 преобразуется в угольную кислоту, что приводит к кислому вкусу, а также растворенный диоксид углерода вызывает соматосенсорный ответ.
Виноделие

Двуокись углерода в форме сухого льда часто используется на этапе виноделия для охлаждения грозди винограда сразу после сбора, чтобы предотвратить спонтанное брожение дикими дрожжами. Основное преимущество использования сухого льда над водяным льдом заключается в том, что он охлаждает виноград без добавления какой-либо дополнительной воды, которая может снизить концентрацию сахара в виноградном сусле, и, следовательно, концентрация алкоголя в готовом вине. Двуокись углерода также используется для создания гипоксической среды для угольной мацерации, процесса, используемого для производства вина Божоле.
Двуокись углерода иногда используется для наполнения винных бутылок или других емкостей для хранения, таких как бочки, для предотвращения окисления, хотя у него есть проблема, заключающаяся в том, что он может растворяться в вине, делая ранее перегонный куб вино слегка газированное. По этой причине профессиональные виноделы предпочитают другие газы, такие как азот или аргон.
Оглушающие животные
Углекислый газ часто используется для «оглушения» животных перед забоем. Термин «оглушение» может быть неправильным, поскольку животные не вырубаются сразу и могут страдать.
Инертный газ
Это один из наиболее часто используемых сжатых газов для пневматики (сжатый газ) системы в переносных инструментах под давлением. Двуокись углерода также используется в качестве атмосферы для сварки, хотя в сварочной дуге он реагирует на окисление большинства металлов. Использование в автомобильной промышленности является обычным явлением, несмотря на значительные доказательства того, что сварные швы, выполненные в диоксиде углерода, более хрупкие, чем сварные швы, выполненные в более инертной атмосфере. Он используется в качестве сварочного газа в первую очередь потому, что он намного дешевле, чем более инертные газы, такие как аргон или гелий. При использовании для MIG-сварки использование CO. 2 иногда называют MAG-сваркой для металлического активного газа, поскольку CO. 2 может реагировать при таких высоких температурах. Обычно это приводит к образованию более горячей лужи, чем в действительно инертной атмосфере, что улучшает характеристики потока. Хотя это может быть связано с атмосферными реакциями, происходящими на месте лужи. Обычно это противоположно желаемому эффекту при сварке, так как это приводит к охрупчиванию участка, но может не быть проблемой для обычной сварки низкоуглеродистой стали, где предельная пластичность не является серьезной проблемой.
Он используется во многих потребительских товарах, для которых требуется сжатый газ, потому что он недорогой и негорючий, а также потому, что он претерпевает фазовый переход из газа в жидкость при комнатной температуре и достижимом давлении примерно 60 бар (870 фунтов на квадратный дюйм, 59 атм), позволяя гораздо большему количеству углекислого газа поместиться в данный контейнер, чем в противном случае. Спасательные жилеты часто содержат баллончики с углекислым газом под давлением для быстрого надувания. Алюминиевые капсулы CO. 2 также продаются в качестве запаса сжатого газа для пневматических пистолетов, маркеров / ружей для пейнтбола, накачивания велосипедных шин и для изготовления газированная вода. Быстрое испарение жидкой двуокиси углерода используется для взрывных работ на угольных шахтах. Высокие концентрации углекислого газа также можно использовать для уничтожения вредителей. Жидкий диоксид углерода используется в сверхкритической сушке некоторых пищевых продуктов и технологических материалов, при подготовке образцов для сканирующей электронной микроскопии и в декафеинизации из <468.>кофе в зернах.
Огнетушитель

Для тушения пламени можно использовать углекислый газ, затопив окружающую среду вокруг пламени газом. Сам по себе он не реагирует на гашение пламени, но лишает пламя кислорода, вытесняя его. Некоторые огнетушители, особенно предназначенные для электрических пожаров, содержат жидкий углекислый газ под давлением. Огнетушители с углекислым газом хорошо работают при небольших горючих жидкостях и электрических пожарах, но не при обычных горючих пожарах, потому что, хотя они исключают кислород, они не охлаждают значительно горящие вещества, а когда углекислый газ рассеивается, они могут загореться при воздействии атмосферного кислород. Их желательность при электрическом пожаре проистекает из того факта, что, в отличие от методов на основе воды или других химических веществ, углекислый газ не вызывает коротких замыканий, что приводит к еще большему повреждению оборудования. Поскольку это газ, также легко автоматически распределять большие объемы газа в помещениях ИТ-инфраструктуры, где непосредственно возгорание может быть труднодоступным, поскольку он находится за дверями стойки и внутри шкафов. Углекислый газ также широко используется в качестве огнетушащего вещества в стационарных системах противопожарной защиты для локального применения особых опасностей и полного затопления защищенного пространства. Стандарты Международной морской организации также признают системы углекислого газа для противопожарной защиты судов. трюмы и машинные отделения. Системы противопожарной защиты на основе двуокиси углерода были связаны с несколькими смертельными случаями, поскольку в достаточно высоких концентрациях они могут вызвать удушье. Обзор систем CO. 2 выявил 51 инцидент между 1975 и датой отчета (2000), в результате чего 72 человека погибли и 145 были ранены.
Сверхкритический CO 2 в качестве растворителя
Жидкий диоксид углерода является хорошим растворителем для многих липофильных органических соединений и используется для удаления кофеина из кофе. Углекислый газ привлек внимание в фармацевтической и других отраслях химической промышленности как менее токсичная альтернатива более традиционным растворителям, таким как хлорорганические соединения. По этой причине он также используется некоторыми химчистками (см. зеленая химия ). It is used in the preparation of some aerogels because of the properties of supercritical carbon dioxide.
Agriculture
Plants require carbon dioxide to conduct photosynthesis. The atmospheres of greenhouses may (if of large size, must) be enriched with additional CO. 2 to sustain and increase the rate of plant growth. At very high concentrations (100 times atmospheric concentration, or greater), carbon dioxide can be toxic to animal life, so raising the concentration to 10,000 ppm (1%) or higher for several hours will eliminate pests such as whiteflies and spider mites in a greenhouse.
Medical and pharmacological uses
In medicine, up to 5% carbon dioxide (130 times atmospheric concentration) is added to oxygen for stimulation of breathing after apnea and to stabilize the O. 2/CO. 2balance in blood.
Carbon dioxide can be mixed with up to 50% oxygen, forming an inhalable gas; this is known as Carbogen and has a variety of medical and research uses.
Energy
Fossil fuel recovery
Carbon dioxide is used in enhanced oil recovery where it is injected into or adjacent to producing oil wells, usually under сверхкритические условия, когда становится смешиваемым с маслом. Этот подход может увеличить исходную нефтеотдачу за счет снижения остаточной нефтенасыщенности на 7–23% в дополнение к первичной добыче. Он действует как агент, повышающий давление, и, будучи растворенным в подземной сырой нефти, значительно снижает ее вязкость и изменяет химический состав поверхности, позволяя нефти быстрее проходить через пласт к скважине для удаления. На зрелых месторождениях нефти используются разветвленные трубопроводные сети для транспортировки углекислого газа к точкам закачки.
В улучшенном извлечении метана из угольных пластов диоксид углерода будет закачиваться в угольный пласт для вытеснения метана, в отличие от существующих методов, которые в первую очередь основаны на удалении воды (для снижения давления) чтобы заставить угольный пласт высвободить захваченный метан.
Биопревращение в топливо
Было предложено, чтобы CO. 2 от выработки электроэнергии подавался в пруды, чтобы стимулировать рост водорослей, которые могут затем преобразовать в биодизельное топливо. Штамм цианобактерии Synechococcus elongatus был генетически модифицирован для производства топлива изобутиральдегид и изобутанол из CO. 2 с помощью фотосинтеза..
Хладагент

Жидкий и твердый диоксид углерода важны хладагенты, особенно в пищевой промышленности, где они используются при транспортировке и хранении мороженого и других замороженных продуктов. Твердый диоксид углерода называется «сухим льдом» и используется для небольших грузов, где холодильное оборудование нецелесообразно. Твердый диоксид углерода всегда ниже −78,5 ° C (−109,3 ° F) при обычном атмосферном давлении, независимо от температуры воздуха.
Жидкий диоксид углерода (промышленная номенклатура R744 или R-744) использовался в качестве хладагента до открытия R-12 и может пережить возрождение из-за того, что R134a способствует изменению климата больше, чем CO. 2. Его физические свойства очень подходят для целей охлаждения, охлаждения и нагрева, имея высокую объемную охлаждающую способность. Из-за необходимости работать при давлениях до 130 бар (1880 psi ), системы CO. 2 требуют высокопрочных компонентов, которые уже были разработаны для массового производства во многих странах. секторов. В автомобильном кондиционировании воздуха более чем в 90% всех условий движения на широтах выше 50 ° R744 работает более эффективно, чем системы, использующие R134a. Его экологические преимущества (GWP из 1, не разрушающий озоновый слой, нетоксичный, невоспламеняющийся) могут сделать его будущей рабочей жидкостью для замены существующих ГФУ в автомобилях, супермаркетах и водонагревателях с тепловыми насосами, среди прочего. другие. Coca-Cola представила охладители напитков на основе CO. 2 и США. Армия интересуется технологией охлаждения и обогрева CO. 2.
Ожидается, что мировая автомобильная промышленность примет решение о выборе хладагента нового поколения для автомобильного кондиционирования воздуха. CO. 2 — один из обсуждаемых вариантов. (См. Экологичное автомобильное кондиционирование воздуха использует )
Минор

Углекислый газ является лазерной средой в углекислый лазер, который одним из самых ранних
Углекислый газ можно использовать в средствах контроля pH плавательных бассейнов путем непрерывного добавления газа в воду, тем самым предотвращая повышение pH. Точно так же он также используется при содержании рифовых аквариумов, где он обычно используется в кальциевые реакторы для временного понижения pH воды, пропускаемой через карбонат кальция Чтобы использовать карбонату кальция более свободно растворяться в воде там, где он используется для построения их скелета, используется
Используется в качестве теплоносителя первого контура в воде усовершенствованного реактора с газовым охлаждением для производства ядерной энергии.
Углеродный диоксид xide индукция обычно используется для эвтаназии лабораторных животных. Способы введения CO. 2 включают в себя помещение животных непосредственно в закрытую, содержащую CO. 2, или постепенно увеличивающую среду CO. 2. В 2013 году Американская ветеринарная медицинская ассоциация выпустила новое руководство по индукции углекислого газа, в котором говорится, что скорость вытеснения от 30% до 70% объема газовой камеры в минуту является оптимальной для гуманной эвтаназии мелких грызунов. Однако есть возражения против практики использования диоксида углерода для этого на том основании, что это жестоко.
Диоксид углерода также используется в нескольких связанных методх очистки и подготовки поверхности.
В атмосфере Земли

Углекислый газ в атмосфере Земли — это следовой газ, в настоящее время (начало 2020 г.) имеющий глобальную среднюю концентрацию 412 частей на миллион по объему (или 622 частей на миллион по массе). Концентрации углекислого газа в атмосфере незначительно колеблются в зависимости от, падая в течение Северного полушария весной и летом, когда растения потребляют газ, и повышаются в течение периода северной осени и зимы, когда растения уходят в спячку или разлагаются. Концентрации также существуют в зависимости от региона, наиболее сильно у земли с гораздо меньшими вариациями на высоте. В городских районах обычно выше, а в городских районах достигается 10-кратного фонового уровня.

Концентрация углекислого газа выросла из-за деятельности человека. Сжигание ископаемого топлива и обезлесение привело к концентрации углекислого газа в атмосфере примерно на 43% с начала эпохи индустриализации . Большая часть углекислого газа в результате деятельности человека выделяется при сжигании угля и других ископаемых видов топлива. Другая деятельность человека, включая вырубку лесов, сжигание биомассы и производство цемента, также производит углекислый газ. Человеческая деятельность выбрасывает около 29 миллиардов тонн углекислого газа в год, а вулканы — от 0,2 до 0,3 миллиарда тонн. Человеческая деятельность привела к тому, что CO. 2 поднялся выше уровня, невиданных за сотни тысяч лет. В настоящее время около половины углекислого газа, выделяемого в результате сжигания ископаемого топлива, остается в атмосфере и не поглощается растительностью и океанами.
Хотя прозрачный для видимый свет, углекислый газ — это парниковый газ, поглощающий и испускающий инфракрасное излучение на своих двух активных инфракрасных частотах колебаний (см. Раздел «Структура и связь »над). Световое излучение земной поверхности наиболее интенсивно в инфракрасной области между 200 и 2500 см, отличие от наиболее интенсивно в инфракрасной области. Поглощение инфракрасного света на частотах атмосферного углекислого газа улавливает энергию у поверхности, нагревая поверхность и нижние слои атмосферы. Меньше энергии демонстрирует верхних слоев атмосферы, которая из-за этого становится более прохладными. Повышение уровня в атмосфере CO. 2 и других долгоживущих парниковых газов, как метан, закись азота и озон, соответственно усилило их поглощение и испускание инфракрасного излучения, что привело к повышению средней глобальной температуры с середины 20 века. Увеличивает срок службы в атмосфере, оказывает большее влияние на общее потепление, чем все эти другие газы вместе взятые, и, что он имеет длительный срок службы в атмосфере (от сотен до тысяч лет).

Увеличение углекислого газа не только приводит к повышению глобальной температуры поверхности, но повышение глобальной температуры также приводит к повышению концентрации углекислого газа. обратная связь для изменений, вызванных другими процессами, такими как орбитальные циклы. Пятьсот миллионов лет назад углекислого газа было в 20 раз выше, чем сегодня, уменьшаясь до 4–5 раз в юрского периода, а затем медленно снижаясь с особенно быстрым снижением произошедшие 49 лет назад.
Местные концентрации углекислого газа достигли высоких показателей сильных источников, тех, которые изолированы окружающую среду На горячих источниках Босолето около Раполано Терме в Тоскане, Италия, расположен в чашеобразной впадине около 100 м (330 футов) в диаметре, содержит CO. 2 за ночь повышаются до более 75%, что достаточно для уничтожения насекомых и мелких животных. После восхода солнца газ рассеивается конвекцией. Считается, что высокие уровни CO. 2, образовавшиеся в результате нарушения водоемов глубокого озера, насыщенного CO. 2, стали причиной 37 погибших в озере Монун, Камерун в 1984 и 1700 лет. жертвы на озере Ниос, Камерун в 1986 году.
В океанах

Двуокись углерода растворяется в океане с образованием угольной кислоты (H2CO3), бикарбоната (HCO 3) и карбоната (CO 3). В океане растворено примерно в пятьдесят раз больше углекислого газа, чем в атмосфере. Окианы как огромный поглотитель углерода и поглощают около трети CO. 2, выбрасываемого в результате деятельности человека.
Углекислого газа в атмосфере увеличивает, Повышенное поглощение углекислого газа вызывает ощутимое снижение pH океанов, что называется закислением океана. Это снижение pH влияет на биологические системы в океанах, в первую очередь на океанические кальцифицирующие организмы. Эти эффекты охватывают пищевую цепочку от автотрофов до гетеротрофов и включают такие организмы, как кокколитофориды, кораллы, фораминиферы, иглокожие, ракообразные и моллюски. При нормальных условиях карбонат кальция стабилен в поверхностных водах, так как карбонат-ион находится в перенасыщающей концентрации. Однако, когда уровень pH в океане падает, его структура становится уязвимыми, и карбонат становится недонасыщенным. Кораллы, кокколитофоридные водоросли, кораллиновые водоросли, фораминиферы, моллюски и pteropods испытывают меньшую кальцификацию или повышенное растворение при воздействии повышенного содержания CO. 2.
. Глубокие геотермальные жерл, увеличивающиеся до глубины 393 К, показывают только глубокие геотермальные воды, и, следовательно, скорость из воздуха снижается с повышением температуры океана.
Большая часть CO. 2, поглощаемого океаном, что составляет около 30% от общего количества, выбрасываемого в атмосферу, образует угольную кислоту в равновесии с бикарбонатом. Некоторые из этих химических веществ потребляются фотосинтезирующими организмами, которые удаляют из круговорота. Повышенное содержание CO. 2 в атмосфере привело к снижению щелочности морской воды, и есть опасения, что это может отрицательно повлиять на организмы, живущие в воде. В частности, с уменьшением щелочности уменьшается доступность карбонатов для образования раковин, хотя есть свидетельства увеличения производства некоторых видов приточного содержания CO. 2.
NOAA заявляет в своем документе «Состояние научный бюллетень по подкислению океана », который:. «Океаны поглотили около 50% углекислого газа (CO. 2), выделяющегося при сжигании ископаемого топлива, что привело к химическим реакциям это более низкое значение pH океана. Это к увеличению содержания водорода (кислоты) примерно на 30% из начала индустриальной эпохи в результате процесса, известного как «подкисление океана». Растущее число испытаний на испытания на морские организмы, в том числе:
- Скорость, с кораллы-строители рифов производят свои скелеты, уменьшается, в то время как производство разновидностей медуз увеличивается.
- Способность морских водорослей и свободно плавающего зоопланктона поддерживать защитные оболочки снижается.
- Выживаемость личинок морских видов, включая промысловую рыбу и моллюсков, снижается ».
Кроме того, Межправительственная группа экспертов по изменению климата (МГЭИК) пишет в своем «Изменение климата 2007: сводный доклад»:. «Освоение антропогенного углерода с 1750 года привел к, что океан стал более кислым со средним снижением pH на 0,1 единицы. Повышение концентрации CO. 2 в атмосфере к дальнейшему подкислению… В то время как влияние наблюдаемого закисления океана на морскую биосферу еще не подтверждено документально, ожидается, что прогрессирующее закисление океанов неожидетное воздействие на морские ракушечные организмы (например, кораллы) и зависимые от них виды ».
Некоторые морские кальцифицирующие организмы (включая коралловые рифы) были выделены крупными исследовательскими агентствами, включая NOAA, комиссию OSPAR, NANOOS и IPCC, поскольку их исследования показывают, что следует ожидать, что закисление океана может вызвать негативное воздействие.
Двуокись углерода также попадает в океаны через гидротермальные источники. Гидротермальный источник Шампань, обнаруженный на северо-западе вулкана Эйфуку в Марианской впадине, производит почти чистый жидкий углекислый газ, одно из двух известных мест в мире по состоянию на 2004 год, другое находится в Окинавском желобе. Обнаружение подводного жидкого озера О двуокиси углерода в Окинавском желобе сообщалось в 2006 году.
Биологическая роль
Углекислый газ является конечным продуктом клеточного дыхания в организме, которые получают энергию за счет расщепления сахаров, жиры и аминокислоты с кислородом как часть их метаболизма. Сюда входят все растения, водоросли и животные, а также аэробные грибы и бактерии. У позвоночных углекислый газ перемещается с кровью из тканей тела в кожу (например, земноводные ) или в жабры (например, рыбы ), от где он растворяется в воде или в легкие, откуда он выдыхается. Во время активного фотосинтеза растения могут поглощать из атмосферы больше углекислого газа, чем выделяются при дыхании.
Фотосинтез и фиксация углерода


Фиксация углерода — это биохимический процесс, посредством которого атмосферный углекислый газ включается в растения, водоросли и (цианобактерии ) в богатые энергией органические молекулы, такие как глюкоза, таким образом создавая себе пищу путем фотосинтеза.. Фотосинтез использует двуокись углерода и воду для производства сахаров, из других источников органические соединения, а кислород образует как побочный товар.
Рибулозо-1,5-бисфосфаткарбоксилаза-оксигеназа, обычно сокращенно RuBisCO, представляет собой фермент, участвующий в первой основной стадии фиксации углерода, в производстве двух молекул 3 -фосфоглицерат из CO. 2 и рибулозобисфосфат, как показано на диаграмме слева.
RuBisCO считается самым распространенным белком на Земле.
Фототрофы используют продукты своего фотосинтеза в качестве внутренних источников питания и сырья для биосинтеза более сложные органические молекулы, такие как полисахариды, нуклеиновые кислоты и белки. Они используются для собственного роста, а также в качестве цепей пищевых цепей и сетей, питающих другие организмы, включая таких животных, как мы. Некоторые важные фототрофы, кокколитофориды, синтезируют твердую чешуйку карбоната кальция. Глобально значимым видом кокколитофорид является Emiliania huxleyi, чьи чешуйки кальцита сформировали основу многих осадочных пород, таких как известняк, где что ранее атмосферный углерод может оставаться фиксированным в геологических масштабах времени.
При использовании 1000 ppm CO. 2 растения могут расти на 50 процентов быстрее по сравнению с окружающими условиями, хотя это предполагает отсутствие изменений и отсутствие ограничений на другие питательные вещества. Повышенные уровни CO. 2 вызывают повышенный рост, отражающийся в урожайности сельскохозяйственных культур, причем пшеница, рис и соя демонстрируют увеличение урожайности на 12–14% при повышенном CO. 2 в экспериментах FACE.
Повышенные концентрации CO. 2 в атмосфере приводят к уменьшению расхода воды и повышению эффективности водопользования. Использование с использованием FACE продемонстрировало, что обогащение CO. 2 приводит к концентрации концентраций питательных микроэлементов в образовании. Это может иметь косвенные последствия для других частей экосистем, поскольку травоядным нужно будет больше пищи, чтобы получить такое же количество белка.
Концентрация вторичных метаболитов такие как фенилпропаноиды и флавоноиды также могут изменяться в растениях, подвергающихся воздействию высоких концентраций CO. 2.
Растения также выделяют CO. 2 во время дыхания, и поэтому большинство растений и водорослей, которые используют C3-фотосинтез, днем служат только чистые поглотители. Хотя растущий лес будет поглощать много тонн CO. 2 каждый год, зрелый лес будет производить столько же CO. 2 в результате дыхания и разложения мертвых особей (например, упавших веток), сколько используется в фотосинтезе растущих растений.. Вопреки давно устоявшемуся мнению, что они углеродно-нейтральные, зрелые леса могут продолжать накапливать углерод и оставаться ценными поглотителями углерода, помогая поддерживать углеродный баланс атмосферы Земли. Кроме того, что крайне важно для жизни на Земле, фотосинтез фитопланктона потребляет растворенный CO. 2 в верхних слоях океана и тем самым способствует поглощению CO. 2 из атмосферы.
Токсичность

Содержание углекислого газа в свежем воздухе (усредненное между уровнем моря и уровнем 10 кПа, т. е. на высоте около 30 км (19 миль)) варьируется от 0,036% (360 частей на миллион) до 0,041% (412 частей на миллион), в зависимости от местоположения.
CO. 2 представляет собой удушающий газ и не классифицируется как токсичный или вредный в соответствии с согласованной на глобальном уровне системой стандартов классификации и маркировки химических веществ из Европейской экономической комиссии Организации Объединенных Наций с использованием Руководства ОЭСР по тестированию химических веществ. В концентрациях до 1% (10 000 ppm) он вызывает у некоторых людей сонливость и ощущение заложенности в легких. Концентрации от 7% до 10% (от 70 000 до 100 000 частей на миллион) могут вызвать удушье даже при наличии достаточного количества кислорода, проявляясь в виде головокружения, головной боли, нарушения функции зрения и слуха и потери сознания в течение от нескольких минут до часа. Физиологические эффекты острого воздействия углекислого газа сгруппированы вместе под термином гиперкапния, подмножество удушья.
, потому что он тяжелее воздуха в местах, где газ просачивается из-под земли (из-за к подповерхностной вулканической или геотермальной активности) в относительно высоких концентрациях, без рассеивающего воздействия ветра, он может накапливаться в защищенных / карманных местах ниже среднего уровня земли, вызывая удушение находящихся там животных. Затем убивают тех, кто поедает падаль, привлеченных к тушам. Таким же образом погибли дети недалеко от города Гома из-за выбросов CO. 2 из соседнего вулкана Mt. Ньирагонго. На языке суахили это явление обозначается как «мазуку ».

У людей происходит адаптация к повышенным концентрациям CO. 2, включая измененное дыхание и выработку бикарбоната в почках, чтобы сбалансировать эффекты закисления крови (ацидоз ). Несколько исследований показали, что 2,0% вдыхаемой концентрации можно использовать для закрытых воздушных пространств (например, подводная лодка ), поскольку адаптация является физиологической и обратимой, поскольку ухудшение работоспособности или нормальной физической активности не происходит на этом уровне выдержка в течение пяти дней. Тем не менее, другие исследования показывают снижение когнитивной функции даже на гораздо более низких уровнях. Кроме того, при продолжающемся респираторном ацидозе адаптационные или компенсаторные механизмы не смогут изменить это состояние..
Ниже 1%
Существует мало исследований воздействия на здоровье длительного длительного воздействия CO. 2 воздействие на людей и животных на уровнях ниже 1%. Пределы воздействия CO. 2 на рабочем месте были установлены в США на уровне 0,5% (5000 частей на миллион) в течение восьмичасового периода. При такой концентрации CO. 2 экипаж Международной космической станции испытывал головные боли, летаргию, замедленное умственное развитие, эмоциональное раздражение и нарушение сна. Исследования на животных при 0,5% CO. 2 продемонстрировали кальцификацию почек и потерю костной массы после восьми недель воздействия. Исследование людей, подвергшихся воздействию в течение 2,5-часовых сеансов, продемонстрировало значительные отрицательные эффекты на когнитивные способности при таких низких концентрациях, как 0,1% (1000 ppm) CO. 2, вероятно, из-за индуцированного CO. 2 увеличения церебрального кровотока. В другом исследовании наблюдалось снижение базового уровня активности и использования информации при 1000 ppm по сравнению с 500 ppm.
Вентиляция

Плохо вентиляция — одна из основных причин чрезмерной концентрации CO. 2 в закрытых помещениях. Дифференциал углекислого газа выше наружных концентраций в устойчивых условиях (когда рабочая среда и система вентиляции достаточно продолжительны, чтобы концентрация CO. 2 стабилизировалась) иногда используется для оценки интенсивности вентиляции на человека. Более высокие концентрации CO. 2 связаны со здоровьем людей, их комфортом и ухудшением рабочих характеристик. ASHRAE Нормы вентиляции по стандарту 62.1–2007 могут привести к концентрациям в помещении на 2100 ppm выше окружающих условий снаружи. Таким образом, если концентрация на открытом воздухе составляет 400 частей на миллион, концентрация в помещении может достигать 2500 частей на миллион при скорости вентиляции, соответствующей данному отраслевому стандарту. Концентрации в плохо вентилируемых помещениях могут быть даже выше (диапазон от 3000 до 4000).
Шахтеры, которые особенно уязвимы для воздействия газа из-за недостаточной вентиляции, называли смеси углекислого газа и азота «blackdamp », «дроссельной заслонкой» или «стилусом». До того, как были разработаны более эффективные технологии, горняки часто отслеживали опасные уровни черной влаги и других газов в шахтных стволах, принося с собой в клетку канарейку во время работы. Канарейка более чувствительна к удушающим газам, чем люди, и когда она теряла сознание, перестала петь и падала с насеста. лампа Дэви может также обнаруживать высокие уровни черной влаги (которая тонет и собирается у пола) за счет менее яркого горения, в то время как метан, другой удушающий газ и опасность взрыва, может вызвать лампы горят ярче.
В феврале 2020 года три человека умерли от удушья на вечеринке в Москве, когда в бассейн добавили сухой лед (замороженный CO2) для его охлаждения.
Физиология человека
Содержание
| кПа | мм рт.ст. | |
|---|---|---|
| Венозный углекислый газ в крови | 5,5–6,8 | 41–51 |
| Альвеолярное легочное. давление газа | 4,8 | 36 |
| Углекислый газ артериальной крови | 4,7–6,0 | 35–45 |
Организм вырабатывает приблизительно 2,3 фунта (1,0 кг) углекислого газа в день на человека, содержащего 0,63 фунта (290 г) углерода. У людей этот углекислый газ переносится через венозную систему и выдыхается через легкие, что приводит к более низким концентрациям в артериях. Содержание углекислого газа в крови часто выражается как парциальное давление, которое представляет собой давление, которое имел бы двуокись углерода, если бы она одна занимала весь объем. У людей содержание углекислого газа в крови показано в соседней таблице:
Транспорт в крови
CO. 2 переносится кровью тремя различными путями. (Точные проценты варьируются в зависимости от того, артериальная это кровь или венозная).
- Большая его часть (примерно от 70% до 80%) превращается в ионы бикарбоната HCO. 3ферментом карбоангидраза в красных кровяных тельцах по реакции CO. 2 + H. 2O → H. 2CO. 3→ H. + HCO. 3.
- 5–10% растворено в плазме
- 5–10% связано с гемоглобин в виде карбамино соединений
Гемоглобин, основная молекула, переносящая кислород в красных кровяных тельцах, переносит как кислород, так и углекислый газ. Однако CO. 2, связанный с гемоглобином, не связывается с тем же участком, что и кислород. Вместо этого он соединяется с N-концевыми группами на четырех цепях глобина. Однако из-за аллостерического воздействия на молекулу гемоглобина связывание CO. 2 снижает количество кислорода, связанного при заданном парциальном давлении кислорода. Это известно как эффект Холдейна и играет важную роль в транспортировке углекислого газа из тканей в легкие. И наоборот, повышение парциального давления CO. 2 или более низкое значение pH вызовут выгрузку кислорода из гемоглобина, что известно как эффект Бора.
Регулирование дыхания
Двуокись углерода. является одним из медиаторов локальной ауторегуляции кровоснабжения. Если его концентрация высока, капилляры расширяются, обеспечивая больший приток крови к этой ткани.
Ионы бикарбоната имеют решающее значение для регулирования pH крови. Частота дыхания человека влияет на уровень CO. 2 в его крови. Слишком медленное или поверхностное дыхание вызывает респираторный ацидоз, в то время как слишком быстрое дыхание приводит к гипервентиляции, которая может вызвать респираторный алкалоз.
Хотя организму требуется кислород для метаболизм, низкий уровень кислорода обычно не стимулирует дыхание. Скорее, дыхание стимулируется повышенным уровнем углекислого газа. В результате вдыхание воздуха низкого давления или газовой смеси без кислорода (например, чистого азота) может привести к потере сознания без чувства голода . Это особенно опасно для летчиков-высотников. Именно поэтому бортпроводники инструктируют пассажиров в случае потери давления в салоне, прежде чем помогать другим, надеть на себя кислородную маску ; в противном случае существует риск потери сознания.
Дыхательные центры пытаются поддерживать артериальное давление CO. 2 на уровне 40 мм рт. При преднамеренной гипервентиляции содержание CO. 2 в артериальной крови может быть снижено до 10–20 мм рт. Ст. (Содержание кислорода в крови мало затронуто), а дыхательная активность снижается. Вот почему после гипервентиляции можно задерживать дыхание дольше, чем без гипервентиляции. Это сопряжено с риском потери сознания до того, как потребность дышать станет непреодолимой, поэтому гипервентиляция особенно опасна перед фридайвингом.
См. Также
Химический портал
- Газ артериальной крови
- Реакция Боша
- Газ в бутылках — Вещества, которые находятся в газообразном состоянии при стандартной температуре и давлении, сжимаются и хранятся в газе цилиндры
- Датчик углекислого газа
- Улавливание углерода — Улавливание и долгосрочное хранение атмосферного углекислого газа
- Пещера собак — Пещера недалеко от Неаполя, Италия
- Стандарты выбросов
- В помещении Качество воздуха — Качество воздуха внутри и вокруг зданий и сооружений
- Идентичность Кая — Идентичность в отношении антропогенных выбросов углекислого газа
- Озеро Киву — Меромиктическое озеро в Восточноафриканской рифтовой долине
- Список электростанций с наименьшей углеродной эффективностью
- Список стран по выбросам углекислого газа
- Меромиктическое озеро — постоянно стратифицированное озеро со слоями воды, которые не смешиваются
- pCO2 — Парциальное давление углекислого газ а, часто используется в отношении крови
- Гилберт Пласс (ранние работы по CO. 2 и изменению климата e)
- Реакция Сабатье — Процесс метанирования диоксида углерода водородом
- НАСА Орбитальная углеродная обсерватория 2
- Спутник для наблюдения за парниковыми газами
Ссылки
Далее чтение
Внешние ссылки
- Международной картой химической безопасности 0021
- [1] от Amerigas.
- CDC — Карманный справочник NIOSH по химическим опасностям — Двуокись углерода
- CO. 2 Свойства, использование, применение двуокиси углерода
- Информация о сухом льде
- Тенденции изменения двуокиси углерода в атмосфере (NOAA)
- «Боевой газ, который экономит» Живет «. Popular Science, июнь 1942 г., стр. 53–57.
- Реакции, термохимия, использование и функции диоксида углерода
- Диоксид углерода — часть первая и Диоксид углерода — Часть вторая в Периодическая таблица видео (Университет Ноттингема)
| Диоксид углерода | |
 |
|
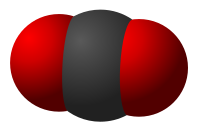 |
|
| |
|
| Общие | |
|---|---|
| Систематическое наименование |
Диоксид углерода |
| Традиционные названия | углекислый газ, углекислота, двуокись углерода, сухой лёд (в твёрдом состоянии) |
| Хим. формула | CO2 |
| Физические свойства | |
| Состояние | бесцветный газ |
| Молярная масса | 44,01 г/моль |
| Плотность |
газ (0 °C): 1,9768 кг/м³ жидкость (0 °С, 35,5 ат): 925 кг/м³ тв. (−78,5 °C): 1560 кг/м³ |
| Динамическая вязкость | 8,5·10−5 Па·с (10°C, 5,7 МПа) |
| Энергия ионизации | 13,77 ± 0,01 эВ[1] |
| Термические свойства | |
| Т. субл. | −78,5 °C |
| Тройная точка | −56,6 °C, 0,52 МПа |
| Кр. точка | 31,1 °C, 7,38 МПа |
| Уд. теплоёмк. | 846 Дж/(кг·К) |
| Удельная теплота плавления | 25,13 кДж/моль |
| Давление пара | 56,5 ± 0,1 атм[1] |
| Химические свойства | |
| Растворимость в воде | 1,45 кг/м³ |
| Классификация | |
| Рег. номер CAS | 124-38-9 |
| PubChem | 280 |
| Рег. номер EINECS | 204-696-9 |
| SMILES |
C(=O)=O |
| InChI |
1S/CO2/c2-1-3 CURLTUGMZLYLDI-UHFFFAOYSA-N |
| Кодекс Алиментариус | E290 |
| RTECS | FF6400000 |
| ChEBI | 16526 |
| Номер ООН | 1013 |
| ChemSpider | 274 |
| Безопасность | |
| ПДК | 9 000 мг/м3 |
| ЛД50 | LC50: 90 000 мг/м3*5 мин (человек, ингаляция) |
| Токсичность | Нетоксичен. Опасен лишь в очень больших количествах (обладает удушающим действием). Негорюч. |
| S-фразы | S9, S23, S36 |
| NFPA 704 |
0 1 0 SA |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. |
Диокси́д углеро́да или двуо́кись углеро́да (также углеки́слый газ, углекислотá, окси́д углеро́да(IV), у́гольный ангидри́д) — бесцветный газ (в нормальных условиях), почти без запаха (в больших концентрациях с кисловатым «содовым» запахом), с химической формулой CO2.
Плотность при нормальных условиях 1,98 кг/м³ (в 1,5 раза тяжелее воздуха). При атмосферном давлении диоксид углерода не существует в жидком состоянии, переходя непосредственно из твёрдого состояния в газообразное (возгонка). Твёрдый диоксид углерода называют сухим льдом. При повышенном давлении и обычных температурах углекислый газ переходит в жидкость, что используется для его хранения.
Концентрация углекислого газа в атмосфере Земли составляет в среднем 0,04 %[2]. Углекислый газ легко пропускает излучение в ультрафиолетовой и видимой частях спектра, которое поступают на Землю от Солнца и обогревает её. В то же время он поглощает испускаемое Землёй инфракрасное излучение и является одним из парниковых газов, вследствие чего принимает участие в процессе глобального потепления. Постоянный рост уровня содержания этого газа в атмосфере наблюдается с начала индустриальной эпохи.
Содержание
- 1 Свойства
- 1.1 Физические
- 1.2 Химические
- 1.3 Биологические
- 2 Получение
- 3 Применение
- 4 Методы регистрации
- 5 Углекислый газ в природе
- 6 Физиологическое действие
- 7 См. также
- 8 Примечания
- 9 Литература
- 10 Ссылки
Свойства
Физические
Оксид углерода (IV) — углекислый газ, бесцветный газ, при малых концентрациях в воздухе не имеет запаха, при больших концентрациях имеет характерный кисловатый запах газированной воды. Тяжелее воздуха приблизительно в 1,5 раза.
Молекула углекислого газа линейна, расстояние от центра центрального атома углерода до центров двух атомов кислорода 116,3 пм.
При температуре −78,3 °С кристаллизуется в виде белой снегообразной массы — «сухого льда». Сухой лёд при атмосферном давлении не плавится, а испаряется, не переходя в жидкое состояние, температура сублимации −78 °С. Жидкий углекислый газ можно получить при повышении давления. Так, при температуре 20 °С и давлении свыше 6 МПа (~60 атм) газ сгущается в бесцветную жидкость.
Негорюч, но в его атмосфере может поддерживаться горение активных металлов, например, щелочных металлов и щелочноземельных — магния, кальция, бария.
Углекислый газ образуется при гниении и горении органических веществ. Содержится в воздухе и минеральных источниках, выделяется при дыхании животных и растений. Растворим в воде (0,738 объёмов углекислого газа в одном объёме воды при 15 °С).
Химические
По химическим свойствам диоксид углерода относится к кислотным оксидам. При растворении в воде образует угольную кислоту. Реагирует со щёлочами с образованием карбонатов и гидрокарбонатов. Вступает в реакции электрофильного замещения (например, с фенолом) и нуклеофильного присоединения (например, с магнийорганическими соединениями).
Оксид углерода(IV) не поддерживает горения. В нём горят только некоторые активные металлы:[3]:
Взаимодействие с оксидом активного металла:
При растворении в воде образует равновесную смесь раствора диоксида углерода и угольной кислоты, причём равновесие сильно сдвинуто в сторону разложения кислоты:
Реагирует со щёлочами с образованием карбонатов и гидрокарбонатов:
(качественная реакция на углекислый газ)
Биологические
Организм человека выделяет приблизительно 1 кг углекислого газа в сутки[4].
Этот углекислый газ переносится от тканей, где он образуется в качестве одного из конечных продуктов метаболизма, по венозной системе и затем выделяется с выдыхаемым воздухом через лёгкие. Таким образом, содержание углекислого газа в крови велико в венозной системе, уменьшается в капиллярной сети лёгких, и мало в артериальной крови. Содержание углекислого газа в пробе крови часто выражают в терминах парциального давления, то есть давления, которое бы имел содержащийся в пробе крови в данном количестве углекислый газ, если бы весь объём пробы крови занимал только он[5].
Содержание углекислого газа в крови человека приблизительно таково:
-
Референтные значения или средние значения парциального давления углекислого газа в крови (pCO2)
Единицы измерения Газ венозной крови Альвеолярный лёгочный газ Газ артериальной крови кПа 5,5[6]—6,8[6] 4,8 4,7[6]—6,0[6] мм рт. ст. 41—51 36 35[7]—45[7]
Углекислый газ транспортируется в крови тремя различными способами (точное соотношение каждого из этих трёх способов транспортировки зависит от того, является ли кровь артериальной или венозной).
- Бо́льшая часть углекислого газа (от 70 % до 80 %) преобразуется ферментом карбоангидразой эритроцитов в ионы гидрокарбоната[8] при помощи реакции CO₂ + H₂O → H₂CO₃ → H⁺ + HCO₃⁻.
- Около 5—10 % углекислого газа растворено в плазме крови[8].
- Около 5—10 % углекислого газа связано с гемоглобином в виде карбаминосоединений (карбогемоглобин)[8].
Гемоглобин, основной кислород-транспортирующий белок эритроцитов крови, способен транспортировать как кислород, так и углекислый газ. Однако углекислый газ связывается с гемоглобином в ином месте, чем кислород. Он связывается с N-терминальными концами цепей глобина, а не с гемом. Однако благодаря аллостерическим эффектам, которые приводят к изменению конфигурации молекулы гемоглобина при связывании, связывание углекислого газа понижает способность кислорода к связыванию с ним же, при данном парциальном давлении кислорода, и наоборот — связывание кислорода с гемоглобином понижает способность углекислого газа к связыванию с ним же, при данном парциальном давлении углекислого газа. Помимо этого, способность гемоглобина к преимущественному связыванию с кислородом или с углекислым газом зависит также и от pH среды. Эти особенности очень важны для успешного захвата и транспорта кислорода из лёгких в ткани и его успешного высвобождения в тканях, а также для успешного захвата и транспорта углекислого газа из тканей в лёгкие и его высвобождения там.
Углекислый газ является одним из важнейших медиаторов ауторегуляции кровотока. Он является мощным вазодилататором. Соответственно, если уровень углекислого газа в ткани или в крови повышается (например, вследствие интенсивного метаболизма — вызванного, скажем, физической нагрузкой, воспалением, повреждением тканей, или вследствие затруднения кровотока, ишемии ткани), то капилляры расширяются, что приводит к увеличению кровотока и соответственно к увеличению доставки к тканям кислорода и транспорта из тканей накопившейся углекислоты. Кроме того, углекислый газ в определённых концентрациях (повышенных, но ещё не достигающих токсических значений) оказывает положительное инотропное и хронотропное действие на миокард и повышает его чувствительность к адреналину, что приводит к увеличению силы и частоты сердечных сокращений, величины сердечного выброса и, как следствие, ударного и минутного объёма крови. Это также способствует коррекции тканевой гипоксии и гиперкапнии (повышенного уровня углекислоты).
Ионы гидрокарбоната очень важны для регуляции pH крови и поддержания нормального кислотно-щелочного равновесия. Частота дыхания влияет на содержание углекислого газа в крови. Слабое или замедленное дыхание вызывает респираторный ацидоз, в то время как учащённое и чрезмерно глубокое дыхание приводит к гипервентиляции и развитию респираторного алкалоза.
Кроме того, углекислый газ также важен в регуляции дыхания. Хотя наш организм требует кислорода для обеспечения метаболизма, низкое содержание кислорода в крови или в тканях обычно не стимулирует дыхание (вернее, стимулирующее влияние нехватки кислорода на дыхание слишком слабо и «включается» поздно, при очень низких уровнях кислорода в крови, при которых человек нередко уже теряет сознание). В норме дыхание стимулируется повышением уровня углекислого газа в крови. Дыхательный центр гораздо более чувствителен к повышению уровня углекислого газа, чем к нехватке кислорода. Как следствие этого, дыхание сильно разрежённым воздухом (с низким парциальным давлением кислорода) или газовой смесью, вообще не содержащей кислорода (например, 100 % азотом или 100 % закисью азота) может быстро привести к потере сознания без возникновения ощущения нехватки воздуха (поскольку уровень углекислоты в крови не повышается, ибо ничто не препятствует её выдыханию). Это особенно опасно для пилотов военных самолётов, летающих на больших высотах (в случае аварийной разгерметизации кабины пилоты могут быстро потерять сознание). Эта особенность системы регуляции дыхания также является причиной того, почему в самолётах стюардессы инструктируют пассажиров в случае разгерметизации салона самолёта в первую очередь надевать кислородную маску самим, прежде чем пытаться помочь кому-либо ещё — делая это, помогающий рискует быстро потерять сознание сам, причём даже не ощущая до последнего момента какого-либо дискомфорта и потребности в кислороде[8].
Дыхательный центр человека пытается поддерживать парциальное давление углекислого газа в артериальной крови не выше 40 мм ртутного столба. При сознательной гипервентиляции содержание углекислого газа в артериальной крови может снизиться до 10-20 мм ртутного столба, при этом содержание кислорода в крови практически не изменится или увеличится незначительно, а потребность сделать очередной вдох уменьшится как следствие уменьшения стимулирующего влияния углекислого газа на активность дыхательного центра. Это является причиной того, почему после некоторого периода сознательной гипервентиляции легче задержать дыхание надолго, чем без предшествующей гипервентиляции. Такая сознательная гипервентиляция с последующей задержкой дыхания может привести к потере сознания до того, как человек ощутит потребность сделать вдох. В безопасной обстановке такая потеря сознания ничем особенным не грозит (потеряв сознание, человек потеряет и контроль над собой, перестанет задерживать дыхание и сделает вдох, дыхание, а вместе с ним и снабжение мозга кислородом восстановится, а затем восстановится и сознание). Однако в других ситуациях, например, перед нырянием, это может быть опасным (потеря сознания и потребность сделать вдох наступят на глубине, и в отсутствие сознательного контроля в дыхательные пути попадёт вода, что может привести к утоплению)[источник не указан 391 день]. Именно поэтому гипервентиляция перед нырянием опасна и не рекомендуется.
Получение
В промышленных количествах углекислота выделяется из дымовых газов, или как побочный продукт химических процессов, например, при разложении природных карбонатов[9] (известняк, доломит) или при производстве алкоголя (спиртовое брожение). Смесь полученных газов промывают раствором карбоната калия, которые поглощают углекислый газ, переходя в гидрокарбонат. Раствор гидрокарбоната при нагревании или при пониженном давлении разлагается, высвобождая углекислоту. В современных установках получения углекислого газа вместо гидрокарбоната чаще применяется водный раствор моноэтаноламина, который при определённых условиях способен абсорбировать СО2, содержащийся в дымовом газе, а при нагреве отдавать его; таким образом отделяется готовый продукт от других веществ.
Также углекислый газ получают на установках разделения воздуха как побочный продукт получения чистого кислорода, азота и аргона.
В лабораторных условиях небольшие количества получают взаимодействием карбонатов и гидрокарбонатов с кислотами, например мрамора, мела или соды с соляной кислотой, используя, например, аппарат Киппа.[9]

Использование реакции серной кислоты с мелом или мрамором приводит к образованию малорастворимого сульфата кальция, который мешает реакции, и который удаляется значительным избытком кислоты.
Для приготовления напитков может быть использована реакция пищевой соды с лимонной кислотой или с кислым лимонным соком. Именно в таком виде появились первые газированные напитки. Их изготовлением и продажей занимались аптекари.
Применение
В пищевой промышленности углекислота используется как консервант и разрыхлитель, обозначается на упаковке кодом Е290.
В криохирургии используется как одно из основных веществ для криоабляции новообразований.
Жидкая углекислота широко применяется в системах пожаротушения и в огнетушителях. Автоматические углекислотные установки для пожаротушения различаются по системам пуска, которые бывают пневматическими, механическими или электрическими.
Устройство для подачи углекислого газа в аквариум может включать в себя резервуар с газом. Простейший и наиболее распространенный метод получения углекислого газа основан на конструкции для изготовления алкогольного напитка браги. При брожении, выделяемый углекислый газ вполне может обеспечить подкормку аквариумных растений[10]
Углекислый газ используется для газирования лимонада и газированной воды. Углекислый газ используется также в качестве защитной среды при сварке проволокой, но при высоких температурах происходит его распад с выделением кислорода. Выделяющийся кислород окисляет металл. В связи с этим приходится в сварочную проволоку вводить раскислители, такие как марганец и кремний. Другим следствием влияния кислорода, также связанного с окислением, является резкое снижение поверхностного натяжения, что приводит, среди прочего, к более интенсивному разбрызгиванию металла, чем при сварке в инертной среде.
Углекислота в баллончиках применяется в пневматическом оружии (в газобаллонной пневматике) и в качестве источника энергии для двигателей в авиамоделировании.
Хранение углекислоты в стальном баллоне в сжиженном состоянии выгоднее, чем в виде газа. Углекислота имеет сравнительно низкую критическую температуру +31 °С. В стандартный 40-литровый баллон заливают около 30 кг сжиженного углекислого газа, и при комнатной температуре в баллоне будет находиться жидкая фаза, а давление составит примерно 6 МПа (60 кгс/см²). Если температура будет выше +31 °С, то углекислота перейдёт в сверхкритическое состояние с давлением выше 7,36 МПа. Стандартное рабочее давление для обычного 40-литрового баллона составляет 15 МПа (150 кгс/см²), однако он должен безопасно выдерживать давление в 1,5 раза выше, то есть 22,5 МПа, — таким образом, работа с подобными баллонами может считаться вполне безопасной.
Твёрдая углекислота — «сухой лёд» — используется в качестве хладагента в лабораторных исследованиях, в розничной торговле, при ремонте оборудования (например: охлаждение одной из сопрягаемых деталей при посадке внатяг) и т. д. Для сжижения углекислого газа и получения сухого льда применяются углекислотные установки.
Методы регистрации
Измерение парциального давления углекислого газа требуется в технологических процессах, в медицинских применениях — анализ дыхательных смесей при искусственной вентиляции лёгких и в замкнутых системах жизнеобеспечения. Анализ концентрации CO₂ в атмосфере используется для экологических и научных исследований, для изучения парникового эффекта.
Углекислый газ регистрируют с помощью газоанализаторов основанных на принципе инфракрасной спектроскопии и других газоизмерительных систем. Медицинский газоанализатор для регистрации содержания углекислоты в выдыхаемом воздухе называется капнограф. Для измерения низких концентраций CO₂ (а также CO) в технологических газах или в атмосферном воздухе можно использовать газохроматографический метод с метанатором и регистрацией на пламенно-ионизационном детекторе[11].
Углекислый газ в природе
Ежегодные колебания концентрации атмосферной углекислоты на планете определяются, главным образом, растительностью средних (40—70°) широт Северного полушария.
Вегетация в тропиках практически не зависит от сезона, сухой пояс пустынь 20—30° (обоих полушарий) даёт малый вклад в круговорот углекислоты, а полосы суши, наиболее покрытые растительностью, расположены на Земле асимметрично (в Южном полушарии в средних широтах находится океан).
Поэтому с марта по сентябрь вследствие фотосинтеза содержание СО2 в атмосфере падает, а с октября по февраль — повышается. Вклад в зимний прирост дают как окисление древесины (гетеротрофное дыхание растений, гниение, разложение гумуса, лесные пожары), так и сжигание ископаемого топлива (угля, нефти, газа), заметно увеличивающееся в зимний сезон[12].
Большое количество углекислоты растворено в океане.
Углекислый газ составляет значительную часть атмосфер некоторых планет Солнечной системы: Венеры, Марса.
Физиологическое действие
Углекислый газ нетоксичен, но при вдыхании его повышенных концентраций в воздухе по воздействию на воздуходышащие живые организмы его относят к удушающим газам (англ.)русск.. По ГОСТу (ГОСТ 8050-85) углекислота относится к 4-му классу опасности.
Незначительные повышения концентрации, вплоть до 2—4 %, в помещениях приводят к развитию у людей сонливости и слабости. Опасными для здоровья концентрациями считаются концентрации около 7—10 %, при которых развиваются симптомы удушья, проявляющиеся в виде головной боли, головокружения, расстройстве слуха и в потере сознания (симптомы, сходные с симптомами высотной болезни), эти симптомы развиваются, в зависимости от концентрации, в течение времени от нескольких минут до одного часа.
При вдыхании воздуха с очень высокими концентрациями газа смерть наступает очень быстро от удушья, вызванного гипоксией[13].
Несмотря на то, что даже концентрация 5—7 % CO₂ в воздухе несмертельна, но при концентрации 0,1 % (такое содержание углекислого газа иногда наблюдается в воздухе мегаполисов), люди начинают чувствовать слабость, сонливость. Это показывает, что даже при высоком уровне кислорода, большая концентрация CO₂ существенно влияет на самочувствие человека.
Вдыхание воздуха с повышенной концентрацией этого газа не приводит к долговременным расстройствам здоровья. После удаления пострадавшего из атмосферы с высокой концентрацией углекислого газа быстро наступает полное восстановление здоровья и самочувствия[14].
См. также
- Выхлопные газы
- Лимнологическая катастрофа
Примечания
- ↑ 1 2 http://www.cdc.gov/niosh/npg/npgd0103.html
- ↑ Trends in Atmospheric Carbon Dioxide (англ.). National Oceanic and Atmospheric Administration. Проверено 24 сентября 2013.
- ↑ А. С. Егоров. Репетитор по химии — Ростов-на-Дону: «Феникс», 2009.
- ↑ How much carbon dioxide do humans contribute through breathing?. Проверено 30 апреля 2009. Архивировано 2 февраля 2011 года.
- ↑ Charles Henrickson. Chemistry. — Cliffs Notes, 2005. — ISBN 0-7645-7419-1.
- ↑ 1 2 3 4 Пересчитано из значений в мм. рт. ст. с использованием коэффициента пересчёта 0,133322 кПа/мм. рт. ст.
- ↑ 1 2 Таблица референсных значений. Юго-Западный медицинский центр при Университете Далласа.
- ↑ 1 2 3 4 Carbon dioxide. solarnavigator.net. Проверено 12 октября 2007.
- ↑ 1 2 Glinka, Nikolaj Leonidovič (1882-1965). Obŝaâ himiâ. — Izd. 27-e ster. — Leningrad: «Himiâ», 1988. — 702, [2] s. с. — ISBN 5724500035, 9785724500036.
- ↑ Большая Энциклопедия Нефти и Газа.
- ↑ ГОСТ 31371.6-2008 (ИСО 6974-6:2002). Газ природный. ОПРЕДЕЛЕНИЕ СОСТАВА МЕТОДОМ ГАЗОВОЙ ХРОМАТОГРАФИИ С ОЦЕНКОЙ НЕОПРЕДЕЛЕННОСТИ. Часть 6. ОПРЕДЕЛЕНИЕ ВОДОРОДА, ГЕЛИЯ, КИСЛОРОДА, АЗОТА, ДИОКСИДА УГЛЕРОДА И УГЛЕВОДОРОДОВ C1 — C8 С ИСПОЛЬЗОВАНИЕМ ТРЕХ КАПИЛЛЯРНЫХ КОЛОНОК.
- ↑ А. В. Бялко. Растения убыстряют рост. «Природа». No 10, 1996. (по Keeling C.D., Whorf Т.P., Wahlen M., van der Plicht J. // Nature. 1995. V. 375, № 6533. P.666-670)
- ↑ (англ.) Carbon Dioxide as a Fire Suppressant: Examining the Risks, U.S. Environmental Protection Agency:.
- ↑ (англ.) Glatte Jr H. A., Motsay G. J., Welch B. E. (1967). «Carbon Dioxide Tolerance Studies». Brooks AFB, TX School of Aerospace Medicine Technical Report SAM-TR-67-77. Проверено 2008-05-02.
Литература
- Вукалович М. П., Алтунин В. В. Теплофизические свойства двуокиси углерода. — М.: Атомиздат, 1965. — 456 с.
- Тезиков А. Д. Производство и применение сухого льда. — М.: Госторгиздат, 1960. — 86 с.
- Гродник М. Г., Величанский А. Я. Проектирование и эксплуатация углеслотных установок. — М.: Пищевая промышленность, 1966. — 275 с.
- Талянкер Ю. Е. Особенности хранения баллонов со сжиженным газом // Сварочное производство. — 1972. — № 11.
Ссылки
- International Chemical Safety Card 0021 (англ.)
- CID 280 — PubChem (англ.)
- CO2 Диоксид углерода, свойства, применение (англ.)
- Фазовая диаграмма (давление-температура) для диоксида углерода
- Диоксид углерода в 3D (недоступная ссылка)
- Dry Ice information (англ.)
- Phase Diagram of Carbon Dioxide (англ.)
- Experiment 071 — Triple Point Phase Transition for Carbon Dioxide (недоступная ссылка)
- CO2 как природный рефрежерант — FAQs (англ.)
- Великобритания разрабатывает метод сохранения двуокиси углерода
- Онлайн калькулятор свойств CO2 (англ.)
Толковый словарь русского языка. Поиск по слову, типу, синониму, антониму и описанию. Словарь ударений.
Найдено определений: 4
углерода диоксид
ЭНЦИКЛОПЕДИЧЕСКИЙ СЛОВАРЬ
Углеро́да диокси́д (углекислый газ), СО2, бесцветный газ со слегка кисловатым запахом и вкусом, плотность 1,98 г/л. Охлаждая диоксид углерода при обычном давлении, получают твердую снегообразную массу («сухой лёд») с tвозг — 78,50°C. Растворимость: 0,88 объёма газа в 1 объёме воды при 20°C; в водном растворе в присутствии щелочей образует соли угольной кислоты. Диоксид углерода входит в состав атмосферы Земли (в среднем 0,03% по объёму). Как продукт полного окисления углерода поступает в воздух при сжигании топлива и при дыхании (см. Парниковый эффект). Главный источник углерода растений, усваивающих диоксид углерода при фотосинтезе. Диоксид углерода получают при обжиге известняка, окислении углеводородных топлив. Применяют в производстве соды, при газировании вод, в огнетушителях.
* * *
УГЛЕРОДА ДИОКСИД — УГЛЕРО́ДА ДИОКСИ́Д (угольный ангидрид, углекислый газ), СО2, бесцветный газ со слегка кисловатым запахом и вкусом, плотность 1,98 г/л. Охлаждая углерода диоксид при обычном давлении, получают твердую снегообразную массу («сухой лед») с tвозг 78,50 °С. Растворимость 0,88 объема газа в 1 объеме воды при 20 °С; в водном растворе в присутствии щелочей образует соли угольной кислоты. Углерода диоксид входит в состав атмосферы Земли (в среднем 0,03% по объему). Как продукт полного окисления углерода поступает в воздух при сжигании топлива и при дыхании (см. Парниковый эффект (см. ПАРНИКОВЫЙ ЭФФЕКТ)). Главный источник углерода растений, усваивающих углерода диоксид при фотосинтезе. Углерода диоксид получают при обжиге известняка, окислении углеводородных топлив. Применяют в производстве соды, при газировании воды, в огнетушителях.
БОЛЬШОЙ ЭНЦИКЛОПЕДИЧЕСКИЙ СЛОВАРЬ
УГЛЕРОДА ДИОКСИД (угольный ангидрид — углекислый газ), СО2, бесцветный газ со слегка кисловатым запахом и вкусом, плотность 1,98 г/л. Охлаждая углерода диоксид при обычном давлении, получают твердую снегообразную массу («сухой лед») с tвозг 78,50 .С. Растворимость 0,88 объема газа в 1 объеме воды при 20 .С; в водном растворе в присутствии щелочей образует соли угольной кислоты. Углерода диоксид входит в состав атмосферы Земли (в среднем 0,03% по объему). Как продукт полного окисления углерода поступает в воздух при сжигании топлива и при дыхании (см. Парниковый эффект). Главный источник углерода растений, усваивающих углерода диоксид при фотосинтезе. Углерода диоксид получают при обжиге известняка, окислении углеводородных топлив. Применяют в производстве соды, при газировании воды, в огнетушителях.
ЭНЦИКЛОПЕДИЯ КОЛЬЕРА
УГЛЕРОДА ДИОКСИД (оксид углерода(IV), ангидрид угольной кислоты, углекислый газ) CO2, хорошо известный пузырящийся ингредиент газированных безалкогольных напитков. Человек знал о целебных свойствах «шипучей воды» из природных источников с незапамятных времен, но только в 19 в. научился получать ее сам. Тогда же было идентифицировано вещество, делающее воду шипучей, — углекислый газ. Впервые для целей карбонизации этот газ был получен в 1887 в ходе реакции между измельченным мрамором и серной кислотой; его выделяли и из природных источников. Позже СО2 стали получать в промышленных масштабах сжиганием кокса, прокаливанием известняка и брожением спирта. Более четверти века диоксид углерода хранили в стальных баллонах под давлением и использовали почти исключительно для газирования напитков. В 1923 как коммерческий продукт стали производить твердый СО2 (сухой лед), а примерно в 1940 — жидкий, который разливали в специальные герметичные цистерны под высоким давлением.
Физические свойства. При обычных температуре и давлении диоксид углерода — бесцветный, обладающий слегка кисловатым вкусом и запахом газ. Он на 50% тяжелее воздуха, поэтому его можно переливать из одной емкости в другую. СО2 — продукт большинства процессов горения и при достаточно больших количествах может гасить пламя, вытесняя из воздуха кислород. При увеличении концентрации СО2 в плохо проветриваемом помещении содержание кислорода в воздухе уменьшается настолько, что человек может задохнуться. СО2 растворяется во многих жидкостях; растворимость зависит от свойств жидкости, температуры и давления паров СО2. Способность диоксида углерода растворяться в воде и определяет его широкое использование в производстве безалкогольных напитков. СО2 прекрасно растворяется в органических растворителях, например в спирте, ацетоне и бензоле. При повышении давления и охлаждении диоксид углерода легко сжижается и находится в жидком состоянии при температурах от +31 до -57° С (в зависимости от давления). Ниже -57° С переходит в твердое состояние (сухой лед). Давление, необходимое для сжижения, зависит от температуры: при +21° С оно составляет 60 атм, а при -18° С всего 20 атм. Жидкий СО2 хранят в герметичных емкостях под соответствующим давлением. При переходе в атмосферу часть его превращается в газ, а некоторое количество — в «углеродный снег», при этом его температура понижается до -84° С. Поглощая тепло из окружающей среды, сухой лед переходит в газообразное состояние, минуя жидкую фазу, — сублимирует. Для уменьшения сублимационных потерь его хранят и транспортируют в герметичных контейнерах, достаточно прочных, чтобы выдержать увеличение давления при повышении температуры.
Химические свойства. СО2 — малоактивное соединение. При растворении в воде образует слабую угольную кислоту, окрашивающую лакмусовую бумажку в красный цвет. Угольная кислота улучшает вкусовые качества газированных напитков и предотвращает рост бактерий. Реагируя со щелочными и щелочноземельными металлами, а также с аммиаком, СО2 образует карбонаты и бикарбонаты.
См. также УГЛЕРОД. Распространенность в природе и получение. СО2 образуется при сжигании углеродсодержащих веществ, спиртовом брожении, гниении растительных и животных остатков; он высвобождается при дыхании животных, его выделяют растения в темноте. На свету, напротив, растения поглощают СО2 и выделяют кислород, что поддерживает природный баланс кислорода и углекислого газа в воздухе, которым мы дышим. Содержание СО2 в нем не превышает 0,03% (по объему). Известно пять основных способов получения СО2: сжигание углеродсодержащих веществ (кокса, природного газа, жидкого топлива); образование в качестве побочного продукта при синтезе аммиака; прокаливание известняка; брожение; откачка из скважин. В последних двух случаях получается практически чистый диоксид углерода, а при сжигании углеродсодержащих веществ или прокаливании известняка образуется смесь СО2 с азотом и следами других газов. Эту смесь пропускают через раствор, поглощающий только СО2. Затем раствор нагревают и получают практически чистый СО2, который отделяют от оставшихся примесей. От паров воды избавляются вымораживанием и химической сушкой. Очищенный СО2 сжижают, охлаждая его при высоком давлении, и хранят в больших емкостях. Для получения сухого льда жидкий СО2 подают в закрытую камеру гидравлического пресса, где понижают давление до атмосферного. При резком снижении давления из СО2 образуются рыхлый снег и очень холодный газ. Снег прессуют и получают сухой лед. Газообразный СО2 откачивают, сжижают и возвращают в резервуар для хранения.
ПРИМЕНЕНИЕ
Получение низких температур. В жидком и твердом виде СО2 применяется в основном как хладагент. Сухой лед — компактный материал, удобный в обращении и позволяющий создавать разные температурные режимы. При той же массе он превосходит обычный лед по хладоемкости более чем в два раза, занимая вдвое меньший объем. Сухой лед используется при хранении пищевых продуктов. Им охлаждают шампанское, безалкогольные напитки и мороженое. Он широко применяется при «холодном измельчении» термочувствительных материалов (мясных продуктов, смол, полимеров, красителей, инсектицидов, красок, приправ); при галтовке (очистке от заусенцев) штампованных изделий из резины и пластика; при низкотемпературных испытаниях летательных аппаратов и электронных устройств в специальных камерах; для «холодного смешивания» полуфабрикатов кексов и тортов, чтобы при выпечке они сохраняли однородность; для быстрого охлаждения контейнеров с транспортируемыми продуктами обдуванием их струей измельченного сухого льда; при закалке легированных и нержавеющих сталей, алюминия и т.д. с целью улучшения их физических свойств; для плотной посадки деталей машин при их сборке; для охлаждения резцов при обработке высокопрочных стальных заготовок.
Карбонизация. Основное применение газообразного СО2 — карбонизация воды и безалкогольных напитков. Вначале воду и сироп смешивают в нужных пропорциях, а затем под давлением насыщают смесь газообразным СО2. Карбонизация пива и вин обычно происходит в результате протекающих в них химических реакций. Применения, основанные на инертности. СО2 применяется как антиоксидант при долговременном хранении многих пищевых продуктов: сыра, мяса, сухого молока, орехов, растворимых чая, кофе, какао и т.д. Как вещество, подавляющее горение, СО2 используют при хранении и транспортировке горючих материалов, например ракетного топлива, масел, бензина, красок, лаков, растворителей. Он используется как защитная среда при электросварке углеродистых сталей с целью получения однородного прочного шва, при этом сварочные работы оказываются дешевле, чем при использовании инертных газов. СО2 — одно из наиболее эффективных средств тушения пожаров, возникающих при воспламенении горючих жидкостей и электрических пробоях. Выпускают разные углекислотные огнетушители: от портативных емкостью не более 2 кг до стационарных установок автоматической подачи с общей емкостью баллонов до 45 кг или газовых резервуаров низкого давления емкостью до 60 т СО2. Жидкий СО2, находящийся в таких огнетушителях под давлением, при выпуске образует смесь из снега и холодного газа; последний обладает большей плотностью, чем воздух, и вытесняет его из зоны горения. Эффект усиливается еще и охлаждающим действием снега, который, испаряясь, переходит в газообразный СО2.
Химические аспекты. Диоксид углерода применяется в производстве аспирина, свинцовых белил, мочевины, перборатов, химически чистых карбонатов. Угольная кислота, образующаяся при растворении СО2 в воде, — недорогой реагент для нейтрализации щелочей. В литейном производстве при помощи диоксида углерода отверждают песочные формы благодаря взаимодействию CO2 с силикатом натрия, смешанным с песком. Это позволяет получать более качественные отливки. Огнеупорный кирпич, которым выложены печи для выплавки стали, стекла и алюминия, после обработки диоксидом углерода становится более прочным. СО2 используется также в городских системах умягчения воды с помощью натронной извести.
Создание повышенного давления. СО2 применяют для опрессовки и проверки на течь различных емкостей, а также для калибровки манометров, клапанов, свечей зажигания. Им наполняют портативные контейнеры для накачивания спасательных поясов и надувных лодок. Смесь диоксида углерода и закиси азота долгое время применяли для создания давления в аэрозольных баллончиках. СО2 нагнетают под давлением в герметичные емкости с эфиром (в устройствах для быстрого запуска двигателей), растворителями, красками, инсектицидами для последующего распыления этих веществ.
Применение в медицине. В небольших количествах СО2 добавляют к кислороду (для стимуляции дыхания) и при анестезии. В высоких концентрациях его применяют для гуманного умерщвления животных.
ЛИТЕРАТУРА
Реми Г. Курс неорганической химии, т. 1. М., 1972 Некрасов Б.В. Основы общей химии. М., 1973
ИЛЛЮСТРИРОВАННЫЙ ЭНЦИКЛОПЕДИЧЕСКИЙ СЛОВАРЬ
УГЛЕРОДА ДИОКСИД (углекислый газ), CO2, газ, ниже — 78,5°C существует в твердом виде (так называемый сухой лед). Углерода диоксид содержится в воздухе (0,03% по объему), водах рек, морей и минеральных источников. Образуется при гниении и горении органических веществ, сжигании топлива, при дыхании живых организмов, он ассимилируется растениями и играет важную роль в фотосинтезе. Углерода диоксид используют в производстве сахара, пива, газированных вод и шипучих вин, мочевины, соды, для тушения пожаров и др.; сухой лед — хладагент. При концентрациях 2,5-5% токсичен, поэтому возможны тяжелые отравления углерода диоксидом при очистке бродильных чанов и винных бочек, в овощехранилищах и погребах с проросшими и гниющими овощами, в горных выработках и др. Углерода диоксид — один из основных загрязнителей атмосферы, выбросы составляют ~2´104 млн. т в год. Увеличение содержания в атмосфере углерода диоксида приводит к усилению парникового эффекта.
ПОЛЕЗНЫЕ СЕРВИСЫ




![{displaystyle K_{mathrm {h} }={frac {{ce {[H2CO3]}}}{{ce {[CO2_{(aq)}]}}}}=1.70times 10^{-3}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7b01be634ec0c3d83cbf3aa2c71bbd51b9ce0e26)

![{displaystyle K_{mathrm {a1} }={frac {{ce {[HCO3- ][H+]}}}{{ce {[H2CO3]}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f6013fac05dba06751345e4d824c525ed2c43b12)
![{displaystyle K_{mathrm {a1} }{rm {(apparent)}}={frac {{ce {[HCO3- ][H+]}}}{{ce {[H2CO3] + [CO2_{(aq)}]}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3ae2fa07440c037d6054ce4e7ef95c15c59264e7)