Опубликовано 2 года назад по предмету
Химия
от alexeyverbovsky
-
Ответ
Ответ дан
BrawlStars103020Ну 2H это коэффиниент
H2 это формула молекулы водорода
2H это 2 атома водорода
-
Ответ
Ответ дан
nikolaygrВідповідь:
в молекуле Н2 атомы соединены между собой химической связью
2Н- атомы разделены
Пояснення:
Не тот ответ, который вам нужен?
Найди нужный
Самые новые вопросы
Математика — 2 года назад
Сколько здесь прямоугольников
История — 3 года назад
Какое управление было в древнейшем риме? как звали первого и последнего из царей рима?
Литература — 3 года назад
Уроки французского ответе на вопрос : расскажите о герое по следующему примерному плану: 1.почему мальчик оказался в райцентре ? 2.как он чувствовал себя на новом месте? 3.почему он не убежал в деревню? 4.какие отношения сложились у него с товарищами? 5.почему он ввязался в игру за деньги? 6.как характеризуют его отношения с учительницей ? ответе на эти вопросы пожалуйста ! сочините сочинение пожалуйста
Русский язык — 3 года назад
Помогите решить тест по русскому языку тест по русскому языку «местоимение. разряды местоимений» для 6 класса
1. укажите личное местоимение:
1) некто
2) вас
3) ни с кем
4) собой
2. укажите относительное местоимение:
1) кто-либо
2) некоторый
3) кто
4) нам
3. укажите вопросительное местоимение:
1) кем-нибудь
2) кем
3) себе
4) никакой
4. укажите определительное местоимение:
1) наш
2) который
3) некий
4) каждый
5. укажите возвратное местоимение:
1) свой
2) чей
3) сам
4) себя
6. найдите указательное местоимение:
1) твой
2) какой
3) тот
4) их
7. найдите притяжательное местоимение:
1) самый
2) моего
3) иной
4) ничей
8. укажите неопределённое местоимение:
1) весь
2) какой-нибудь
3) любой
4) этот
9. укажите вопросительное местоимение:
1) сколько
2) кое-что
3) она
4) нами
10. в каком варианте ответа выделенное слово является притяжательным местоимением?
1) увидел их
2) её нет дома
3) её тетрадь
4) их не спросили
Русский язык — 3 года назад
Переделай союзное предложение в предложение с бессоюзной связью.
1. океан с гулом ходил за стеной чёрными горами, и вьюга крепко свистала в отяжелевших снастях, а пароход весь дрожал.
2. множество темноватых тучек, с неясно обрисованными краями, расползались по бледно-голубому небу, а довольно крепкий ветер мчался сухой непрерывной струёй, не разгоняя зноя
3. поезд ушёл быстро, и его огни скоро исчезли, а через минуту уже не было слышно шума
Русский язык — 3 года назад
помогите прошу!перепиши предложения, расставляя недостающие знаки препинания. объясни, что соединяет союз и. если в предложении один союз и, то во втором выпадающем списке отметь «прочерк».пример:«я шёл пешком и,/поражённый прелестью природы/, часто останавливался».союз и соединяет однородные члены.ночь уже ложилась на горы (1) и туман сырой (2) и холодный начал бродить по ущельям.союз и соединяет:1) части сложного предложенияоднородные члены,2) однородные членычасти сложного предложения—.поэт — трубач зовущий войско в битву (1) и прежде всех идущий в битву сам (ю. янонис).союз и соединяет:1) части сложного предложенияоднородные члены,2)
Физика — 3 года назад
Вокруг прямого проводника с током (смотри рисунок) существует магнитное поле. определи направление линий этого магнитного поля в точках a и b.обрати внимание, что точки a и b находятся с разных сторон от проводника (точка a — снизу, а точка b — сверху). рисунок ниже выбери и отметь правильный ответ среди предложенных.1. в точке a — «от нас», в точке b — «к нам» 2. в точке a — «к нам», в точке b — «от нас» 3. в обеих точках «от нас»4. в обеих точках «к нам»контрольная работа по физике.прошу,не наугад важно
Информация
Посетители, находящиеся в группе Гости, не могут оставлять комментарии к данной публикации.
Что ты хочешь узнать на сайте Знания ком?
Задай вопрос
Все предметы
Математика
Литература
Алгебра
Русский язык
Геометрия
Английский язык
Химия
Физика
Биология
История
Обществознание
Окружающий мир
География
Українська мова
Информатика
Українська література
Қазақ тiлi
Экономика
Музыка
Право
Беларуская мова
Французский язык
Немецкий язык
МХК
ОБЖ
Психология
Оʻzbek tili
Кыргыз тили
Астрономия
Физкультура и спорт
Другие предметы
Моле́кула водоро́да — простейшая молекула, состоящая из двух атомов водорода. В её состав входят два ядра атомов водорода и два электрона. Вследствие взаимодействия между электронами и ядрами образуется ковалентная химическая связь. Кроме основной изотопной модификации H2, существуют разновидности, в которых один или оба атома протия заменены другими изотопами водорода — дейтерием или тритием: HD, HT, D2, DT, T2. Симметричность или несимметричность молекулы имеет значение при её вращении.
Содержание
- 1 Модели молекулы водорода
- 2 Гамильтониан
- 3 Волновые функции
- 4 Энергия электронных состояний
- 5 Зависимость энергии основного состояния от расстояния между ядрами
- 5.1 Ковалентная связь
- 5.2 Насыщение ковалентной связи
- 6 Движение ядер в молекуле водорода
- 6.1 Вращение
- 6.2 Колебания атомов
- 7 Пара- и ортоводород
- 8 Характеристики молекулы водорода
- 9 См. также
- 10 Примечания
- 11 Литература
Модели молекулы водорода
Рис.1.Модель водорода по Бору и осевая проекция электронного кольца
Н.Бор ещё в 1913 году дал описание модели молекулы водорода[1]. Согласно Бору, два внешних электрона, образующих молекулу, вращаются по одной и той же орбите вокруг линии, проходящей через ядра обоих атомов, и удерживают последние на определённом расстоянии друг от друга (рис.1). Боровская модель химической связи давала чёткую картину образования молекулярного водорода — динамическое равновесие системы, содержащей два протона, удерживающихся на определённом расстоянии друг от друга (d), притяжением кольца из двух электронов. При этом модель Н.Бора отражала кулоновскую электронную корреляцию — оба электрона за счёт электростатического отталкивания находятся в диаметрально противоположных точках электронного кольца вокруг линии, проходящей через ядра обоих атомов молекулы водорода.
Также как и боровская модель атома, боровская модель молекулы водорода не отражала и не могла отражать волновую природу электрона и статистическую интерпретацию волновой функции. Здесь уместно дополнить боровскую модель молекулы водорода достижениями квантовой механики, аналогично боровской модели атома. В этом случае гипотетическое кольцо электронов в модели молекулы водорода трансформируется в геометрическое место расположения плотности вероятности нахождения связывающих электронов. Электронную пару следует представлять электронным облаком в форме кольца, баранки, тора. При этом предполагается, что электроны в торе удалены друг от друга на максимально возможное расстояние, а электронная плотность в молекуле водорода имеет минимум — «кулоновскую дырку» на линии, соединяющей ядра молекулы водорода. Наиболее вероятный радиус электронного тора (re) определяется боровским радиусом a0 и межъядерным расстоянием (d)
re2 = a02 — (d/2)2; re = 0,377 Å.
Рис.2.Контурная карта электронной плотности для молекулы водорода[2]
В теории молекулярных орбиталей, разработанной в 1927—1932 г.г. Ф.Хундом, Р.Малликеном и др., модель молекулы водорода описывали контурными картами электронной плотности (рис.2).
Карта строится как разность между электронной плотностью молекулы и несвязанных атомов. Сплошные линии контурной карты отражают области увеличения электронной плотности (в единицах заряда электрона). Пунктирные — области её уменьшения в молекуле по сравнению с электронной плотностью несвязанных атомов водорода, сближенных на равновесное расстояние.[2]
Поскольку в теории молекулярных орбиталей учитывается лишь фермиевская корреляция электронов, поэтому электронная плотность в молекуле водорода сконцентрирована на линии, соединяющей ядра молекулы (см. рис.2).
Рис.3.Модель молекулы водорода в теории валентных связей
Квантово-механическую теорию ковалентной связи в молекуле водорода разработали в 1927 году Вальтер Гайтлер и Фриц Лондон. Выполненный ими расчёт волновых функций явился основой теории валентных связей. В этой теории модель молекулы водорода описывали перекрыванием атомных орбиталей атомов водорода (1S типа). Схема перекрывания электронных облаков, образующих сигма-связь молекулы водорода, совпадает с линией соединения атомных центров молекулы (рис.3).
Расчёт молекулы водорода в основном сводится к определению интеграла перекрытия атомных орбиталей.
Гамильтониан
Гамильтониан молекулы водорода H2 записывается в виде
-
-
-
-
-
-
-
-
-
,
-
-
-
-
-
-
-
-
-
где M — масса протона, m — масса электрона, 

В адиабатическом приближении задача нахождения энергетических состояний молекулы водорода разбивается на два этапа. На первом этапе рассматривается только электронная подсистема, а ядра считаются зафиксированными в точках 

Гамильтониан электронной подсистемы имеет вид
,
Гамильтониан молекулы водорода симметричен относительно переменных 

Волновые функции
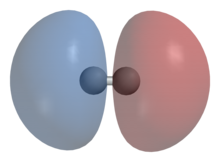
Схематическое изображение симметричной волновой функции молекулы водорода и образования ковалентной связи
Схематическое изображение антисимметричной волновой функции молекулы водорода
Исходя из принципа тождественности частиц и учитывая то, что электроны являются фермионами, волновая функция молекулы водорода должна быть антисимметричной относительно перестановки электронов. Независимость гамильтониана от спиновых переменных позволяет выбрать её в виде произведения двух функций, одна из которых зависит только от координат и называется координатной волновой функцией, а вторая зависит только от спинов и называется спиновой функцией.
Существуют два возможных типа спиновых функций для двух электронов: с параллельными спинами и с антипараллельными спинами. Функции с параллельными спинами симметричны относительно перестановки электронов и образуют триплетные состояния, в которых суммарный спин равен единице. Функции с антипараллельными спинами образуют синглетные состояния с нулевым суммарным спином (см. Мультиплетность, Состояние (квантовая механика)). Они антисимметричны относительно перестановки электронов.
Поскольку волновая функция электрона должна быть антисимметричной относительно перестановки, она может быть произведением либо
- симметричной координатной функции на антисимметричную спиновую функцию, либо
- антисимметричной координатной функции на симметричную спиновую функцию.
Симметричную и антисимметричную координатные функции основного состояния в нулевом приближении теории возмущений можно построить исходя из волновых функций основного состояния атома водорода 
Первый член каждой из приведенных волновых функций отвечает локализации электрона, пронумерованного индексом 1 на атоме с индексом 1 и электрона, пронумерованного индексом 2 на атоме с индексом 2. Второй член отвечает ситуации, когда первый электрон принадлежит второму атому, а второй — первому. При смене нумерации электронов первая (симметричная) функция не меняется, вторая (антисимметричная) — меняет знак.
Энергия электронных состояний
Энергия электронных состояний находится усреднением гамильтониана на волновых функциях
.
Для двух возможных волновых функций основного состояния она приобретает вид
,
где 


,

,

-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
.
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
Энергия молекулы водорода состоит из удвоенной энергии атома водорода, энергии кулоновского отталкивания между ядрами и членов, определяющих взаимодействие электронов между собой и с другим ядром. В зависимости от спинового состояния в формуле для 
Величина 

Зависимость энергии основного состояния от расстояния между ядрами
Ковалентная связь
Энергия взаимодействия атомов в молекуле водорода для синглетного(сплошная линия) и триплетного (пунктирная линия) состояний
Обменный интеграл для молеклы водорода в определённом диапазоне расстояний между атомами отрицательный. Вследствие этого, для синглетных состояний он обеспечивает дополнительное притягивание между ядрами атомов, а для триплетных — дополнительное отталкивание. Дополнительное притягивание обусловливает появление минимума электронной энергии на расстоянии приблизительно в 1,5 радиуса Бора (что соответствует приблизительно 75 пм). Этот минимум возникает только для синглетного состояния, то есть для антипараллельных спинов. Таким образом устанавливается ковалентная связь между атомами. Электроны двух атомов водорода «спариваются».
Насыщение ковалентной связи
Для параллельных спинов, то есть для триплетного состояния, дополнительный положительный вклад в энергию приводит к тому, что атому отталкиваются на любом расстоянии. Этим объясняется насыщение ковалентной связи. Молекула водорода может состоять только из двух атомов. Третий атом водорода не может образовать связь с молекулой потому, что его спин непременно будет параллельным одному из спинов электронов в составе молекулы. Параллельность спинов приводит к отталкиванию между ядрами на любом расстоянии.
Необходимо отметить, что на больших расстояниях между атомами они притягиваются в любых состояниях благодаря Ван-дер-Ваальсовому взаимодействию, которое, однако, намного слабее ковалентной связи. Ван-дер-Ваальсово взаимодействие не учитывается в приведенной теории, поскольку требует рассмотрения возбуждённых состояний высших, чем 1s-орбиталь.
Движение ядер в молекуле водорода
Гамильтониан, описывающий относительное движение двух ядер в молекуле водорода имеет вид
,
где 


Вращение
Оператор углового момента коммутирует с гамильтонианом, поэтому собственные функции гамильтониана можно выбрать общими с собственными функциями оператора углового момента, то есть сферические гармоники:
.
Вклад вращения в энергию молекулы равен
.
Этот вклад мал, потому, что массы ядер намного больше, чем массы электронов. Он зависит от расстояния между ядрами R. При колебаниях ядер это расстояние меняется, поэтому вращательное движение, строго говоря, невозможно отделить от колебательного. Однако при малых l и при малых энергиях колебательного движения можно считать, что R равняется определённому среднему значению.
Вращательные уровни вырождены относительно магнитного квантового числа ml. Кратность вырождения 2l+1.
Колебания атомов
Вблизи минимума функцию 
,
где
Таким образом, задача об энергетических состояниях колебания ядер сводится к задаче квантового гармонического осциллятора. Следовательно, для низших колебательных и вращательных уровней энергия молекулы водорода равна
,
где 
Низшая энергия колебания 
При больших значениях квантовых чисел n и l колебательное и вращательное движение разделить невозможно.
Таким образом, энергию молекулы при малых квантовых числах можно записать в виде трёх слагаемых — электронного, колебательного и вращательного:
Малым параметром задачи является отношение массы электрона к массе протона. Электронное слагаемое не зависит от этого отношения, колебательное пропорционально 

.
Следовательно, электронный уровень расщепляется на несколько колебательных, каждый из которых, в свою очередь, расщепляется на вращательные. Поскольку энергии вращательных уровней близки, то в оптических спектрах они сливаются в полосы — образуется полосатый спектр, который наблюдается для молекулы HD. Для симметричной молекулы H2 переходы между орбитальными и колебательными уровнями запрещены правилами отбора, поэтому молекулярный протий не поглощает в инфракрасной области.
Пара- и ортоводород
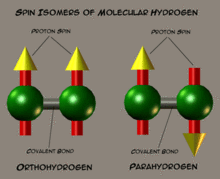
Схематическое изображене спиновых изомеров водорода
Ядра атомов водорода, входящие в состав молекулы, являются протонами — фермионами со спином 1/2. По правилам сложения спинов ядерный спин молекулы может быть 0 или 1. Молекулы водорода с суммарным ядерным спином 0 называют параводородом, а молекулы с суммарным ядерным спином 1 и тремя возможными проекциями (−1, 0, 1) называют ортоводородом. В состоянии термодинамического равновесия при комнатной температуре отношение между ортоводородом и параводородом составляет 3:1. Однако при низких температурах в состоянии термодинамического равновесия молекулы параводорода доминируют благодаря разным вращательным свойствам: параводород является симметричным ротатором, ортоводород — несимметричным ротатором. Переход ортоводорода в параводород — медленный процесс, и состояние термодинамического равновесия при низких температурах устанавливается долго.
Характеристики молекулы водорода
Межъядерные расстояния и энергии диссоциации молекул водорода, его изотопов и молекулярного иона водорода[3]
| Молекула | Межъядерное расстояние,Å | Энергия диссоциации, Эв |
|---|---|---|
| H2 | 0,7416 | 4,477 |
| HD | 0,7414 | 4,512 |
| D2 | 0,7416 | 4,555 |
| DT | 0,7416 | 4,570 |
| T2 | 0,7416 | 4,588 |
| HT | 0,7416 | 4,524 |
| H2+ | 1,06 | 2,648 |
Константы реакции диссоциации молекулярного водорода (Kp) и степень превращения (α) в зависимости от абсолютной температуры[4]:
| T, к | 2000 | 3000 | 4000 | 5000 | 6000 | 8000 |
|---|---|---|---|---|---|---|
| Кр | 2,62 · 10-6 | 2,47 · 10-2 | 2,52 | 4,09 · 10 | 2,62 · 102 | 2,70 · 103 |
| α | 8,10 · 10-4 | 7,83 · 10-2 | 0,621 | 0,954 | 0,992 | 0,999 |
См. также
- Молекулярный ион водорода
- Рекомбинация (химия)
- Боровская модель химической связи
- Кулоновская электронная корреляция
- Статистическая интерпретация волновой функции
- Теория молекулярных орбиталей
- Теория валентных связей
Примечания
- ↑ Бор Н. Избранные научные труды (статьи 1909-1925 г.г). — М.: Наука, 1973. — Т. 1. — С. 133. — 584 с.
- ↑ 1 2 Химический энциклопедический словарь / гл. редактор И. Л. Кнунянц. — М.: Советская энциклопедия, 1983. — С. 646. — 792 с.
- ↑ Справочник химика. — 2-е изд., перераб. и доп. — М.-Л.: ГНТИ Химической литературы, 1962. — Т. 1. — С. 338. — 1072 с.
- ↑ Справочник химика. — 2-е изд., перераб. и доп. — М.-Л.: ГНТИ Химической литературы, 1964. — Т. 3. — С. 24. — 1008 с.
Литература
- Білий М. У. Атомна фізика. — Київ: Вища школа, 1973. (укр.)
- Федорченко А. М. Теоретична фізика. Квантова механіка, термодинаміка і статистична фізика. Т.2. — Київ: Вища школа, 1993.
- Юхновський І. Р. Основи квантової механіки. — Київ: Либідь, 2002.
- Ландау Л. Д., Лившиц Е. М. Теоретическая физика. т. ІІІ. Квантовая механика. Нерелятивистская теория. — М.: Наука, 1974.

-
-
Предмет:
Химия
-
Автор:
jakemosley983
-
Создано:
3 года назад
Ответы
Знаешь ответ? Добавь его сюда!
-
-
Русский язык14 минут назад
Какое предложение правильное
-
Русский язык19 минут назад
Найдите и исправьте ошибки:
-
Химия24 минут назад
Помогите пожалуйста даю 100 баллов(задание на скрине)
-
Математика29 минут назад
ДОПОМОЖІТЬ ВИРІШИТИ ЛОГАРИФМ
lg ( — 1) + lg ( — 3) = lg (1,5 — 3) -
История29 минут назад
Міні твірна тему: як жили скіфійці: від 1 лиця: ДАЮ 100 БАЛОВ!
Информация
Посетители, находящиеся в группе Гости, не могут оставлять комментарии к данной публикации.
Вы не можете общаться в чате, вы забанены.
Чтобы общаться в чате подтвердите вашу почту
Отправить письмо повторно
Вопросы без ответа
-
Математика3 часа назад
Помогите пожалуйста !!!!
Вычислите площадь плоской области D , ограниченной заданными линиями. 3x^2-2y=0; 2x-2y+1=0
-
Алгебра5 часов назад
При каком значении a система имеет бесконечно много решений?
{x+y-2z=7
{x+ay+4z=3
{2x+y+az=12a^2
Топ пользователей
-
Fedoseewa27
20458
-
Sofka
7417
-
vov4ik329
5115
-
DobriyChelovek
4631
-
olpopovich
3446
-
dobriykaban
2374
-
zlatikaziatik
2275
-
Udachnick
1867
-
Zowe
1683
-
NikitaAVGN
1210
Войти через Google
или
Запомнить меня
Забыли пароль?
У меня нет аккаунта, я хочу Зарегистрироваться
Выберите язык и регион
Русский
Россия
English
United States

How much to ban the user?
1 hour
1 day
Предмет: Химия,
автор: Shapka99
Ответы
Автор ответа: ARSENIJGASOV
0
Ответ:
2H
Объяснение:
1 атом это просто H
2 этому это 1 умноженный на 2 то есть 2H
andrdys:
2 это просто два.
ARSENIJGASOV:
Ну да просто 2. Просто я не знал как объяснить получше
Предыдущий вопрос
Следующий вопрос
Интересные вопросы
Предмет: Литература,
автор: Dingoo47
4.Определи основную мысль текста.
Текст-*вверх дном* Жуль верн.
(Простите что мало баллов)
3 года назад
Предмет: Химия,
автор: Crach13
7. MgCO3 + HCl → MgCl₂ + H₂CO3
3 года назад
Предмет: Русский язык,
автор: nikitapanfik
1)Как в 21 веке люди хранят память о войне?»2)Что вам известно о движении «Бессмертный полк?»
3 года назад
Предмет: Химия,
автор: BellaNow
При взаимодействии одноатомного спирта, содержащего 37,5% углерода, 50% кислорода, с органической кислотой образуется вещество, плотность паров которого по аргону равна 2,15. Определите молекулярную формулу каждого из веществ, участвующих в реакции и дайте им название
5 лет назад
Предмет: Русский язык,
автор: zoleg0122
Подскажи пжл как делать.
5 лет назад





 ,
, ,
,
 .
. ,
, ,
,![Q(R) = e^2 int psi^2_{1s}(|mathbf{r}_1 - mathbf{R}_1|) psi^2_{1s}(|mathbf{r}_2 - mathbf{R}_2|)
left[ frac{1}{|mathbf{r}_1 -mathbf{r}_2|} - frac{1}{|mathbf{r}_1 -mathbf{R}_2|} - frac{1}{|mathbf{r}_2 -mathbf{R}_1|} right] dV_1 dV_2](https://dic.academic.ru/dic.nsf/ruwiki/ce29ae941f494f67c708c8edbd1ba74e.png) ,
,
![left. - frac{1}{|mathbf{r}_1 -mathbf{R}_2|} - frac{1}{|mathbf{r}_2 -mathbf{R}_1|} right] dV_1 dV_2](https://dic.academic.ru/dic.nsf/ruwiki/69cccb624a5622f849040c7dc9ec31f7.png) .
.
 ,
, .
. .
. ,
,
 ,
,
 .
.