| Гидроксид натрия | |
 |
|
 |
|
| Общие | |
|---|---|
| Традиционные названия | едкий натр, каустик, каустическая сода, едкая щелочь |
| Химическая формула | NaOH |
| Физические свойства | |
| Молярная масса | 39,997 г/моль |
| Плотность | 1,59 г/см³ |
| Термические свойства | |
| Температура плавления | 323 °C |
| Температура кипения | 1403 °C |
| Химические свойства | |
| Растворимость в воде | 108,7 г/100 мл |
| Безопасность | |
| Токсичность |
0 3 1 ALK |
Гидроксид натрия (лат. Natrii hydroxidum; другие названия — каустическая сода, каустик, едкий натр, едкая щёлочь) — самая распространённая щёлочь, химическая формула NaOH. В год в мире производится и потребляется более 57 миллионов тонн едкого натра.
Интересна история тривиальных названий как гидроксида натрия, так и других щелочей, название «едкая щёлочь» обусловлено свойством разъедать кожу, бумагу, и другие органические вещества, вызывая сильные ожоги. До XVII века щёлочью (фр. alkali) называли также карбонаты натрия и калия. В 1736 французский учёный А. Л. Дюамель дю Монсо впервые различил эти вещества: гидроксид натрия стали называть каустической содой, карбонат натрия — кальцинированной содой (по растению Salsola Soda, из золы которого её добывали), а карбонат калия — поташем. В настоящее время содой принято называть натриевые соли угольной кислоты. В английском и французском языках слово sodium означает натрий, potassium — калий.
Содержание
- 1 Физические свойства
- 2 Химические свойства
- 3 Качественное определение ионов натрия
- 4 Методы получения
- 4.1 Химические методы получения гидроксида натрия
- 4.1.1 Известковый метод
- 4.1.2 Ферритный метод
- 4.2 Электрохимические методы получения гидроксида натрия
- 4.2.1 Диафрагменный метод
- 4.2.2 Мембранный метод
- 4.2.3 Ртутный метод с жидким катодом
- 4.2.4 Лабораторные методы получения
- 4.1 Химические методы получения гидроксида натрия
- 5 Рынок каустической соды
- 6 Применение
- 7 Меры предосторожности при обращении с гидроксидом натрия
- 8 Литература
Физические свойства
Гидрат окиси натрия NaOH — белое твердое вещество. Если оставить кусок едкого натра на воздухе, то он вскоре расплывается, так как притягивает влагу из воздуха. Едкий натр хорошо растворяется в воде, при этом выделяется большое количество теплоты. Раствор едкого натра мылок на ощупь.
Термодинамика растворов
ΔH0 растворения для бесконечно разбавленного водного раствора −44,45 кДж/моль.
Из водных растворов при 12,3—61,8 °C кристаллизуется моногидрат (сингония ромбическая), температура плавления 65,1 °C; плотность 1,829 г/см³; ΔH0обр −425,6 кДж/моль), в интервале от −28 до −24 °C — гептагидрат, от −24 до −17,7 °C — пентагидрат, от −17,7 до −5,4 °C — тетрагидрат (α-модификация), от −5,4 до 12,3 °C. Растворимость в метаноле 23,6 г/л (t = 28 °C), в этаноле 14,7 г/л (t = 28 °C). NaOH·3,5Н2О (температура плавления 15,5 °C);
Химические свойства
Гидроксид натрия (едкая щёлочь) — сильное химическое основание (к сильным основаниям относят гидроксиды, молекулы которых полностью диссоциируют в воде), к ним относят гидроксиды щелочных и щёлочно-земельных металлов подгрупп Iа и IIа периодической системы Д. И. Менделеева, KOH (едкое кали), Ba(OH)2 (едкий барит), LiOH, RbOH, CsOH. Щёлочность (основность) определяется валентностью металла, радиусом внешней электронной оболочки и электрохимической активностью: чем больше радиус электронной оболочки (увеличивается с порядковым номером), тем легче металл отдает электроны, и тем выше его электрохимическая активность и тем левее располагается элемент в электрохимическом ряду активности металлов, в котором за ноль принята активность водорода.
Водные растворы NaOH имеют сильную щелочную реакцию (pH 1%-раствора = 13). Основными методами определения щелочей в растворах являются реакции на гидроксид-ион (OH−), (c фенолфталеином — малиновое окрашивание и метиловым оранжевым (метилоранжем) — жёлтое окрашивание). Чем больше гидроксид-ионов находится в растворе, тем сильнее щёлочь и тем интенсивнее окраска индикатора.
Гидроксид натрия вступает в реакции:
1.Нейтрализации с различными веществами в любых агрегатных состояниях, от растворов и газов до твёрдых веществ:
- c кислотами — с образованием солей и воды:
NaOH + HCl → NaCl + H2O
(1) H2S + 2NaOH = Na2S + 2H2O (при избытке NaOH)
(2) H2S + NaOH = NaHS + H2O (кислая соль, при отношении 1:1)
(в целом такую реакцию можно представить простым ионным уравнением, реакция протекает с выделением тепла (экзотермическая реакция): OH− + H3O+ → 2H2O.)
- с амфотерными оксидами которые обладают как основными, так и кислотными свойствами, и способностью реагировать с щелочами, как с твёрдыми при сплавлении:
ZnO + 2NaOH → Na2ZnO2 + H2O
так и с растворами:
ZnO + 2NaOH(раствор) + H2O → Na2[Zn(OH)4](раствор)
(Образующийся анион называется тетрагидроксоцинкат-ионом, а соль, которую можно выделить из раствора — тетрагидроксоцинкатом натрия. В аналогичные реакции гидроксид натрия вступает и c другими амфотерными оксидами.)
- С амфотерными гидроксидами:
Al(OH)3 + 3NaOH = Na3[Al(OH)6]
2. Обмена с солями в растворе:
2NaOH +CuSO4 → Cu (OH)2↓ + Na2SO4,
2Na+ + 2OH− + Cu2+ + SO42− → Cu(OH)2↓+ Na2SO4
Гидроксид натрия используется для осаждения гидроксидов металлов. К примеру, так получают гелеобразный гидроксид алюминия, действуя гидроксидом натрия на сульфат алюминия в водном растворе, при этом избегая избытка щёлочи и растворения осадка. Его и используют, в частности, для очистки воды от мелких взвесей.
6NaOH + Al2(SO4)3 → 2Al(OH)3↓ + 3Na2SO4.
6Na+ + 6OH− + 2Al3+ + SO42− → 2Al(OH)3↓ + 3Na2SO4.
3. С неметаллами:
например, с фосфором — с образованием гипофосфита натрия:
4Р + 3NaOH + 3Н2О → РН3 + 3NaH2РО2.
3S + 6NaOH → 2Na2S + Na2SO3 + 3H2O
- с галогенами:
2NaOH + Cl2 → NaClO + NaCl + H2O(дисмутация хлора)
2Na+ + 2OH− + 2Cl− → 2Na+ + 2O2− + 2H+ + 2Cl− → NaClO + NaCl + H2O
6NaOH + 3I2 → NaIO3 + 5NaI + 3H2O
4. С металлами: Гидроксид натрия вступает в реакцию с алюминием, цинком, титаном. Он не реагирует с железом и медью (металлами, которые имеют низкий электрохимический потенциал). Алюминий легко растворяется в едкой щёлочи с образованием хорошо растворимого комплекса — тетрагидроксиалюмината натрия и водорода:
2Al0 + 2NaOH + 6H2O → 3H2↑ + 2Na[Al(OH)4]
2Al0 + 2Na+ + 8OH− + 6H+ → 3H2↑ + 2Na+[Al3+(OH)−4]−
5. С эфирами, амидами и алкилгалогенидами (гидролиз):
Гидролиз эфиров
с жирами (омыление), такая реакция необратима, так как получающаяся кислота со щёлочью образует мыло и глицерин. Глицерин впоследствии извлекается из подмыльных щёлоков путём вакуум-выпарки и дополнительной дистилляционной очистки полученных продуктов. Этот способ получения мыла был известен на Ближнем Востоке с VII века:
(C17H35COO)3C3H5 + 3NaOH → C3H5(OH)3 + 3C17H35COONa
В результате взаимодействия жиров с гидроксидом натрия получают твёрдые мыла (они используются для производства кускового мыла), а с гидроксидом калия либо твёрдые, либо жидкие мыла, в зависимости от состава жира.
6. С многоатомными спиртами — с образованием алкоголятов:
HO-CH2-CH2ОН + 2NaOH → NaO-CH2-CH2-ONa + 2Н2O
7. Со стеклом: в результате длительного воздействия горячей гидроокиси натрия поверхность стекла становится матовой (выщелачивание силикатов):
SiO2 + 4NaOH → (2Na2O)·SiO2 + 2H2O.
Качественное определение ионов натрия
Ионы натрия придают пламени жёлтую окраску
- По цвету пламени горелки — ионы натрия придают пламени жёлтую окраску
- С использованием специфических реакций на ионы натрия
| Реагент | Фторид аммония | Нитрит цезия-калия-висмута | Ацетат магния | Ацетат цинка | Пикро-
лоновая кислота |
Диокси-
винная кислота |
Бромбензол-
сульфокислота |
Ацетат уранила-цинка |
|---|---|---|---|---|---|---|---|---|
| Цвет осадка | белый | бледно-жёлтый | жёлто-зелёный | желто-зелёный | белый | белый | бледно-жёлтый | зеленовато-жёлтый |
Методы получения
Гидроксид натрия может получаться в промышленности химическими и электрохимическими методами.
Химические методы получения гидроксида натрия
К химическим методам получения гидроксида натрия относятся известковый и ферритный.
Химические методы получения гидроксида натрия имеют существенные недостатки: расходуется большое количество энергоносителей, получаемый едкий натр сильно загрязнен примесями.
В настоящее время эти методы почти полностью вытеснены электрохимическими методами производства.
Известковый метод
Известковый метод получения гидроксида натрия заключается во взаимодействии раствора соды с известковым молоком при температуре около 80°С. Этот процесс называется каустификацией; он проходит по реакции:
Na2CО3 + Са (ОН)2 = 2NaOH + CaCО3
В результате реакции получается раствор гидроксида натрия и осадок карбоната кальция. Карбонат кальция отделяется от раствора, который упаривается до получения расплавленного продукта, содержащего около 92 % масс. NaOH. Затем NaOH плавят и разливают в железные барабаны, где он застывает.
Ферритный метод
Ферритный метод получения гидроксида натрия состоит из двух этапов:
- Na2CО3 + Fe2О3 = 2NaFeО2 + CО2
- 2NaFeО2 + xH2О = 2NaOH + Fe2O3*xH2О
Реакция 1 представляет собой процесс спекания кальцинированной соды с окисью железа при температуре 1100—1200°С. При этом образуется спек — феррит натрия и выделяется двуокись углерода. Далее спек обрабатывают (выщелачивают) водой по реакции 2; получается раствор гидроксида натрия и осадок Fe2O3*xH2О, который после отделения его от раствора возвращается в процесс. Получаемый раствор щелочи содержит около 400 г/л NaOH. Его упаривают до получения продукта, содержащего около 92 % масс. NaOH, а затем получают твердый продукт в виде гранул или хлопьев.
Электрохимические методы получения гидроксида натрия
Электрохимически гидроксид натрия получают электролизом растворов галита (минерала, состоящего в основном из поваренной соли NaCl) с одновременным получением водорода и хлора. Этот процесс можно представить суммарной формулой:
- 2NaCl + 2H2О ±2е— → H2↑ + Cl2↑ + 2NaOH
Едкая щёлочь и хлор вырабатываются тремя электрохимическими методами. Два из них — электролиз с твёрдым катодом (диафрагменный и мембранный методы), третий — электролиз с жидким ртутным катодом (ртутный метод).
В мировой производственной практике используются все три метода получения хлора и каустика с явной тенденцией к увеличению доли мембранного электролиза.
| Показатель на 1 тонну NaOH | Ртутный метод | Диафрагменный метод | Мембранный метод |
|---|---|---|---|
| Выход хлора % | 99 | 96 | 98,5 |
| Электроэнергия (кВт·ч) | 3 150 | 3 260 | 2 520 |
| Концентрация NaOH | 50 | 12 | 35 |
| Чистота хлора | 99,2 | 98 | 99,3 |
| Чистота водорода | 99,9 | 99,9 | 99,9 |
| Массовая доля O2 в хлоре, % | 0,1 | 1—2 | 0,3 |
| Массовая доля Cl− в NaOH, % | 0,003 | 1—1,2 | 0,005 |
В России приблизительно 35 % от всего выпускаемого каустика вырабатывается электролизом с ртутным катодом и 65 % — электролизом с твёрдым катодом (диафрагменный и мембранный методы).
Диафрагменный метод
Схема старинного диафрагменного электролизера для получения хлора и щелоков: А — анод, В — изоляторы, С — катод, D — пространство заполненное газами (над анодом — хлор, над катодом — водород), М — диафрагма
Наиболее простым, из электрохимических методов, в плане организации процесса и конструкционных материалов для электролизера, является диафрагменный метод получения гидроксида натрия.
Раствор соли в диафрагменном электролизере непрерывно подается в анодное пространство и протекает через, как правило, нанесённую на стальную катодную сетку асбестовую диафрагму, в которую, иногда, добавляют небольшое количество полимерных волокон.
Во многих конструкциях электролизеров катод полностью погружен под слой анолита (электролита из анодного пространства), а выделяющийся на катодной сетке водород отводится из под катода при помощи газоотводных труб, не проникая через диафрагму в анодное пространство благодаря противотоку.
Противоток — очень важная особенность устройства диафрагменного электролизера. Именно благодаря противоточному потоку направленному из анодного пространства в катодное через пористую диафрагму становится возможным раздельное получение щелоков и хлора. Противоточный поток рассчитывается так, чтобы противодействовать диффузии и миграции OH— ионов в анодное пространство. Если величина противотока недостаточна, тогда в анодном пространстве в больших количествах начинает образовываться гипохлорит-ион (ClO—), который, затем, может окисляться на аноде до хлорат-иона ClO3—. Образование хлорат-иона серьезно снижает выход по току хлора и является основным побочным процессом в этом методе получения гидроксида натрия. Так же вредит и выделение кислорода, которое к тому же, ведет к разрушению анодов и, если они из углеродных материалов, попадания в хлор примесей фосгена.
- Анод:
- 2Cl− — 2е− → Cl2↑ — основной процесс
- 2H2O — 2e— → O2↑+4H+
- 6СlО— + 3Н2О — 6е— → 2СlО3— + 4Сl— + 1,5O2↑ + 6Н+
- Катод:
- 2H2O + 2e− → H2↑ + 2OH− — основной процесс
- СlО— + Н2О + 2е— → Сl— + 2ОН—
- СlО3— + 3Н2O + 6е— → Сl— + 6OН—
В качестве анода в диафрагменных электролизерах может использоваться графитовый или угольный электроды. На сегодня их в основном заменили титановые аноды с окисно-рутениево-титановым покрытием (аноды ОРТА) или другие малорасходуемые.
На следующей стадии электролитический щёлок упаривают и доводят содержание в нём NaOH до товарной концентрации 42—50 % масс. в соответствии со стандартом.
Поваренная соль, сульфат натрия и другие примеси при повышении их концентрации в растворе выше их предела растворимости выпадают в осадок. Раствор едкой щёлочи декантируют от осадка и передают в качестве готового продукта на склад или продолжают стадию упаривания для получения твёрдого продукта, с последующим плавлением, чешуированием или грануляцией.
Обратную, то есть кристаллизовавшуюся в осадок поваренную соль возвращают назад в процесс, приготавливая из неё так называемый обратный рассол. От неё, во избежание накапливания примесей в растворах, перед приготовлением обратного рассола отделяют примеси.
Убыль анолита восполняют добавкой свежего рассола, получаемого подземным выщелачиванием соляных пластов, минеральных рассолов типа бишофита, предварительно очищенного от примесей или растворением галита. Свежий рассол перед смешиванием его с обратным рассолом очищают от механических взвесей и значительной части ионов кальция и магния.
Полученный хлор отделяется от паров воды, компримируется и подаётся либо на производство хлорсодержащих продуктов, либо на сжижение.
Благодаря относительной простоте и дешевизне диафрагменный метод получения гидроксида натрия до сих пор широко используется в промышленности.
Мембранный метод
Мембранный метод производства гидроксида натрия наиболее энергоэффективен, однако сложен в организации и эксплуатации.
С точки зрения электрохимических процессов мембранный метод подобен диафрагменному, но анодное и катодное пространства полностью разделены непроницаемой для анионов катионообменной мембраной. Благодаря этому свойству становится возможным получение более чистых, чем в случае с диафрагменного метода, щелоков. Поэтому в мембранном электролизере, в отличие от диафрагменного, не один поток, а два.
В анодное пространство поступает, как и в диафрагменном методе, поток раствора соли. А в катодное — деионизированная вода. Из катодного пространства вытекает поток обедненного анолита, содержащего так же примеси гипохлорит- и хлорат-ионов и хлор, а из анодного — щелока и водород, практически не содержащие примесей и близкие к товарной концентрации, что уменьшает затраты энергии на их упаривание и очистку.
Щелочь, получаемая с помощью мембранного электролиза, практически не уступает по качеству получаемой при помощи метода с использованием ртутного катода и постепенно заменяет щелочь, получаемую ртутным методом.
Однако, питающий раствор соли (как свежий так и оборотный) и вода предварительно максимально очищается от любых примесей. Такая тщательная очистка определяется высокой стоимость полимерных катионообменных мембран и их уязвимость к примесям в питающем растворе.
Кроме того, ограниченная геометрическая форма а также низкая механическая прочность и термическая стойкость ионообменных мембран во многом определяют сравнительно сложные конструкции установок мембранного электролиза. По той же причине мембранные установки требуют наиболее сложных систем автоматического контроля и управления.
- Схема мембранного электролизера.
Ртутный метод с жидким катодом
В ряду электрохимических методов получения щелоков самым эффективным способом является электролиз с ртутным катодом. Щелока, полученные при электролизе с жидким ртутным катодом, значительно чище полученных диафрагменным способом (Для некоторых производств это критично. Например, в производстве искусственных волокон можно применять только высокочистый каустик.), а по сравнению с мембранным методом организация процесса при получении щелочи ртутным методом гораздо проще.
- Схема ртутного электролизера.
Установка для ртутного электролиза состоит из электролизёра, разлагателя амальгамы и ртутного насоса, объединённых между собой ртутепроводящими коммуникациями.
Катодом электролизёра служит поток ртути, прокачиваемой насосом. Аноды — графитовые, угольные или малоизнашивающиеся (ОРТА, ТДМА или другие). Вместе с ртутью через электролизёр непрерывно течёт поток питающего поваренной соли.
На аноде происходит окисление ионов хлора из электролита, и выделяется хлор:
- 2Cl− — 2е− → Cl20↑ — основной процесс
- 2H2O — 2e— → O2↑+4H+
- 6СlО— + 3Н2О — 6е— → 2СlО3— + 4Сl— + 1,5O2↑ + 6Н+
Хлор и анолит отводится из электролизёра. Анолит, выходящий из электролизера, донасыщают свежим галитом, извлекают из него примеси, внесённые с ним, а также вымываемые из анодов и конструкционных материалов, и возвращают на электролиз. Перед донасыщением из анолита извлекают растворённый в нём хлор.
На катоде восстанавливаются ионы натрия, которые образуют слабый раствор натрия в ртути (амальгаму натрия):
- Na+ + е = Na0
- nNa+ + nHg− = Na + Hg
Амальгама непрерывно перетекает из электролизёра в разлагатель амальгамы. В разлагатель также непрерывно подаётся высоко очищенная вода. В нём амальгама натрия в результате самопроизвольного химического процесса почти полностью разлагается водой с образованием ртути, раствора каустика и водорода:
- Na + Hg + Н2O = NaOH + 1/2Н2↑ + Hg
Полученный таким образом раствор каустика, являющийся товарным продуктом, практически не содержит примесей. Ртуть почти полностью освобождается от натрия и возвращается в электролизер. Водород отводится на очистку.
Однако, полная очистка раствора щелочи от остатков ртути практически не возможна[источник не указан 108 дней], поэтому этот метод сопряжен с утечками металлической ртути и её паров.
Растущие требования к экологической безопасности производств и дороговизна металлической ртути ведут к постепенному вытеснению ртутного метода методами получения щелочи с твердым катодом, в особенности мембранным методом.
Лабораторные методы получения
В лаборатории гидроксид натрия иногда получают химическими способами, но чаще используется небольшой электролизер диафрагменного или мембранного типа.
Рынок каустической соды
Мировое производство натра едкого, 2005 год
| Производитель | Объём производства, млн.тонн | Доля в мировом производстве |
|---|---|---|
| DOW | 6.363 | 11.1 |
| Occidental Chemical Company | 2.552 | 4.4 |
| Formosa Plastics | 2.016 | 3.5 |
| PPG | 1.684 | 2.9 |
| Bayer | 1.507 | 2.6 |
| Solvay | 1.252 | 2.2 |
| Akzo Nobel | 1.157 | 2.0 |
| Tosoh | 1.110 | 1.9 |
| Arkema | 1.049 | 1.8 |
| Olin | 0.970 | 1.7 |
| Россия | 1.290 | 2.24 |
| Китай | 9.138 | 15.88 |
| Другие | 27.559 | 47,87 |
| Всего: | 57,541 | 100 |
В России согласно ГОСТ 2263-79 производятся следующие марки натра едкого:
ТР — твёрдый ртутный (чешуированный);
ТД — твёрдый диафрагменный (плавленый);
РР — раствор ртутный;
РХ — раствор химический;
РД — раствор диафрагменный.
| Наименование показателя | ТР ОКП 21 3211 0400 | ТД ОКП 21 3212 0200 | РР ОКП 21 3211 0100 | РХ 1 сорт ОКП 21 3221 0530 | РХ 2 сорт ОКП 21 3221 0540 | РД Высший сорт ОКП 21 3212 0320 | РД Первый сорт ОКП 21 3212 0330 |
|---|---|---|---|---|---|---|---|
| Внешний вид | Чешуированная масса белого цвета. Допускается слабая окраска | Плавленая масса белого цвета. Допускается слабая окраска | Бесцветная прозрачная жидкость | Бесцветная или окрашенная жидкость. Допускается выкристаллизованный осадок | Бесцветная или окрашенная жидкость. Допускается выкристаллизованный осадок | Бесцветная или окрашенная жидкость. Допускается выкристаллизованный осадок | Бесцветная или окрашенная жидкость. Допускается выкристаллизованный осадок |
| Массовая доля гидроксида натрия, %, не менее | 98,5 | 94,0 | 42,0 | 45,5 | 43,0 | 46,0 | 44,0 |
Показатели российского рынка жидкого натра едкого в 2005—2006 г.
| Наименование предприятия | 2005 г. тыс.тонн | 2006 г. тыс.тонн | доля в 2005 г.% | доля в 2006 г.% |
|---|---|---|---|---|
| ОАО «Каустик», Стерлитамак | 239 | 249 | 20 | 20 |
| ОАО «Каустик», Волгоград | 210 | 216 | 18 | 18 |
| ОАО «Саянскхимпласт» | 129 | 111 | 11 | 9 |
| ООО «Усольехимпром» | 84 | 99 | 7 | 8 |
| ОАО «Сибур-Нефтехим» | 87 | 92 | 7 | 8 |
| ОАО «Химпром», Чебоксары | 82 | 92 | 7 | 8 |
| ВОАО «Химпром», Волгоград | 87 | 90 | 7 | 7 |
| ЗАО «Илимхимпром» | 70 | 84 | 6 | 7 |
| ОАО «КЧХК» | 81 | 79 | 7 | 6 |
| НАК «АЗОТ» | 73 | 61 | 6 | 5 |
| ОАО «Химпром», Кемерово | 42 | 44 | 4 | 4 |
| Итого: | 1184 | 1217 | 100 | 100 |
Показатели российского рынка твердого натра едкого в 2005—2006 г.
| Наименование предприятия | 2005 г. тонн | 2006 г. тонн | доля в 2005 г.% | доля в 2006 г.% |
|---|---|---|---|---|
| ОАО «Каустик», Волгоград | 67504 | 63510 | 62 | 60 |
| ОАО «Каустик», Стерлитамак | 34105 | 34761 | 31 | 33 |
| ОАО «Сибур-Нефтехим» | 1279 | 833 | 1 | 1 |
| ВОАО «Химпром», Волгоград | 5768 | 7115 | 5 | 7 |
| Итого: | 108565 | 106219 | 100 | 100 |
Применение
Биодизельное топливо
Получение биодизеля
Едкий натр применяется во множестве отраслей промышленности и для бытовых нужд:
- Каустик применяется в целлюлозно-бумажной промышленности для делигнификации (сульфатный процесс) целлюлозы, в производстве бумаги, картона, искусственных волокон, древесно-волоконных плит.
- Для омыления жиров при производстве мыла, шампуня и других моющих средств. В древности во время стирки в воду добавляли золу, и, по-видимому, хозяйки обратили внимание, что если зола содержит жир, попавший в очаг во время приготовления пищи, то посуда хорошо моется. О профессии мыловара (сапонариуса) впервые упоминает примерно в 385 г. н. э. Теодор Присцианус. Арабы варили мыло из масел и соды с VII века, сегодня мыла производятся тем же способом, что и 10 веков назад. В настоящее время продукты на основе гидроксида натрия (с добавлением гидроксида калия, нагретые до 50-60 градусов Цельсия, применяются в сфере промышленной мойки для очистки изделий из нержавеющей стали от жира и других масляных веществ, а также остатков механической обработки.
- В химических отраслях промышленности — для нейтрализации кислот и кислотных окислов, как реагент или катализатор в химических реакциях, в химическом анализе для титрования, для травления алюминия и в производстве чистых металлов, в нефтепереработке — для производства масел.
- Для изготовления биодизельного топлива — получаемого из растительных масел и используемого для замены обычного дизельного топлива. Для получения биодизеля к девяти массовым единицам растительного масла добавляется одна массовая единица спирта (то есть соблюдается соотношение 9 :1), а также щелочной катализатор (NaOH). Полученный эфир (главным образом линолевой кислоты) отличается хорошей воспламеняемостью, обеспечиваемой высоким цетановым числом. Цетановое число условная количественная характеристика самовоспламеняемости дизельных топлив в цилиндре двигателя (аналог октанового числа для бензинов). Если для минерального дизтоплива характерен показатель в 50-52 %, то метиловый эфир уже изначально соответствует 56-58 % цетана. Сырьем для производства биодизеля могут быть различные растительные масла: рапсовое, соевое и другие, кроме тех, в составе которых высокое содержание пальмитиновой кислоты (пальмовое масло). При его производстве в процессе этерификации также образуется глицерин который используется в пищевой, косметической и бумажной промышленности, либо перерабатывается в эпихлоргидрин по методу Solvay.
- В качестве агента для растворения засоров канализационных труб, в виде сухих гранул или в составе гелей. Гидроксид натрия дезагрегирует засор и способствует лёгкому продвижению его далее по трубе.
- В гражданской обороне для дегазации и нейтрализации отравляющих веществ, в том числе зарина, в ребризерах (изолирующих дыхательных аппаратах (ИДА), для очистки выдыхаемого воздуха от углекислого газа.
- Гидроксид натрия также используется в сочетании с цинком для фокуса. Медную монету кипятят в растворе гидроксида натрия в присутствии гранул металлического цинка, через 45 секунд, цвет копейки станет серебристым. После этого копейку вынимают из раствора и нагревают в пламени горелки, где она, практически моментально становится «золотой». Причины этих изменений заключается в следующем: ионы цинка вступают в реакцию с гидроксидом натрия (в недостатке) с образованием Zn (OH)42− — который при нагревании разлагается до металлического цинка и осаждается на поверхность монеты. А при нагревании цинк и медь образуют золотистый сплав — латунь.
- Гидроксид натрия также используется для мойки пресс-форм автопокрышек.
- Гидроксид натрия также используется для нелегального производства метамфетаминов и других наркотических средств.
- В приготовлении пищи: для мытья и очистки фруктов и овощей от кожицы, в производстве шоколада и какао, напитков, мороженого, окрашивания карамели, для размягчения маслин и придания им чёрной окраски, при производстве хлебобулочных изделий. Зарегистрирован в качестве пищевой добавки E524.
Некоторые блюда готовятся с применением каустика:- Лютефиск — скандинавское блюдо из рыбы — сушёная треска вымачивается 5-6 дней в едкой щёлочи и приобретает мягкую, желеобразную консистенцию.
- Брецель — немецкие крендели — перед выпечкой их обрабатывают в растворе едкой щёлочи, которая способствует образованию уникальной хрустящей корочки.
- В косметологии для удаления ороговевших участков кожи: бородавок, папиллом.
Меры предосторожности при обращении с гидроксидом натрия
Химический ожог в результате действия раствора гидроксида натрия. Фотография сделана через 44 часа после воздействия.
Гидроксид натрия — едкое и коррозионноактивное вещество. Оно относится к веществам второго класса опасности. Поэтому при работе с ним требуется соблюдать осторожность. При попадании на кожу, слизистые оболочки и в глаза образуются серьёзные химические ожоги. Попадание в глаза вызывает необратимые изменения зрительного нерва (атрофию), и, как следствие, потерю зрения[источник не указан 261 день]. При контакте слизистых поверхностей с едкой щёлочью необходимо промыть поражённый участок струей воды, а при попадании на кожу слабым раствором уксусной кислоты. При работе с едким натрием рекомендуется следующие защитные средства: химические брызгозащитные очки для защиты глаз, резиновые перчатки или перчатки с прорезиненной поверхностью для защиты рук, для защиты тела — химически-стойкая одежда пропитанная винилом или прорезиненные костюмы.
ПДК гидроксида натрия в воздухе 0,5 мг/м³.
Литература
- Общая химическая технология . Под ред. И. П. Мухленова. Учебник для химико-технологических специальностей вузов. — М.: Высшая школа.
- Основы общей химии, т. 3, Б. В. Некрасов. — М.: Химия, 1970.
- Общая химическая технология. Фурмер И. Э., Зайцев В. Н. — М.: Высшая школа, 1978.
- Приказ Минздрава РФ от 28 марта 2003 г. N 126 «Об утверждении Перечня вредных производственных факторов, при воздействии которых в профилактических целях рекомендуется употребление молока или других равноценных пищевых продуктов».
- Постановление Главного государственного санитарного врача РФ от 4 апреля 2003 г. N 32 «О введении в действие Санитарных правил по организации грузовых перевозок на железнодорожном транспорте. СП 2.5.1250-03».
- Федеральный закон от 21.07.1997 N 116-ФЗ «О промышленной безопасности опасных производственных объектов» (с изменениями на 18 декабря 2006 года).
- Приказ МПР РФ от 2 декабря 2002 г. N 786 «Об утверждении федерального классификационного каталога отходов» (с изм. и доп. от 30 июля 2003 г.).
- Постановление Госкомтруда СССР от 25.10.1974 N 298/П-22 «Об утверждении списка производств, цехов, профессий и должностей с вредными условиями труда, работа в которых дает право на дополнительный отпуск и сокращённый рабочий день» (с изменениями на 29 мая 1991 года).
- Постановление Минтруда России от 22.07.1999 N 26 «Об утверждении типовых отраслевых норм бесплатной выдачи специальной одежды, специальной обуви и других средств индивидуальной защиты работникам химических производств».
- Постановление Главного государственного санитарного врача РФ от 30.05.2003 N 116 О введении в действие ГН 2.1.6.1339-03 «Ориентировочные безопасные уровни воздействия (ОБУВ) загрязняющих веществ в атмосферном воздухе населённых мест».(с изменениями на 3 ноября 2005 года).
|
Растворимость кислот, оснований и солей в воде |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
Соединения натрия |
|---|
|
Азид натрия (NaN3) • Альгинат натрия • Алюминат натрия (NaAlO2) • Амид натрия (NaNH2) • Арсенат натрия (Na3AsO4) • Бензилнатрий (NaCH2C6H5) • Бензоат натрия (NaC6H5CO2) • Борогидрид натрия (NaBH4) • Бромат натрия (NaBrO3) • Бромид натрия (NaBr) • Висмутат натрия (NaBiO3) • Вольфрамат натрия (Na2WO4) • Гексагидроксостаннат(IV) натрия (Na2[Sn(OH)6]) • Гексагидроксохромат (III) натрия (Na3[Сr(OH)6]) • Гексанитрокобальтат(III) натрия (Na3[Co(NO2)6]) • Гексафтороалюминат натрия (Na3[AlF6]) • Гексафторосиликат натрия (Na2[SiF6]) • Гексафторостибат натрия (Na[SbF6]) • Гексафторофосфат(V) натрия (Na[PF6]) • Гексахлороиридат(III) натрия (Na3[IrCl6]) • Гексахлорородат(III) натрия (Na3[RhCl6]) • Германат натрия (Na2GeO3) • Гидрид натрия (NaH) • Гидрокарбонат натрия (NaHCO3) • Гидроксид натрия (NaOH) • Гидросульфат натрия (NaHSO4) • Гидросульфид натрия (NaHS) • Гидросульфит натрия (NaHSO3) • Гидрофосфат натрия (Na2HPO4) • Гипонитрит натрия (Na2N2O2) • Гипофосфит натрия (Na(PH2O2)) • Гипохлорит натрия (NaOCl) • Глутамат натрия (C5H8NNaO4) • Дигидропирофосфат натрия (Na2H2P2O7) • Дигидроортопериодат натрия (Na3H2IO6) • Дигидрофосфат натрия (NaH2PO4) • Диоксоферрат(III) натрия (NaFeO2) • Дитионат натрия (Na2S2O6) • Дитионит натрия (Na2S2O4) • Дихромат натрия (Na2Cr2O7) • Диэтилдитиокарбамат натрия (C5H10NS2Na) • Инозинат натрия (C10H11N2Na2O8P) • Иодат натрия (NaIO3) • Иодид натрия (NaI) • Карбонат натрия (Na2CO3) • Лаурилсульфат натрия (C12H25SO4Na) • Метаарсенит натрия (NaAsO2) • Метаборат натрия (NaBO2) • Метаванадат натрия (NaVO3) • Метадисульфит натрия (Na2S2O5) • Метасиликат натрия (Na2SiO3) • Метафосфат натрия (NaPO3) • Надпероксид натрия (NaO2) • Нитрат натрия (NaNO3) • Нитрид натрия (Na3N) • Нитрит натрия (NaNO2) • Нонагидридоренат(VII) натрия (Na2[ReH9]) • Оксид натрия (Na2O) • Ортованадат натрия (Na3VO4) • Ортосиликат натрия (Na4SiO4) • Ортотеллурат натрия (Na6TeO6) • Ортофосфат натрия (Na3PO4) • Пентаборат натрия (NaB5O8) • Периодат натрия (NaIO4) • Перманганат натрия (NaMnO4) • Пероксид натрия (Na2O2) • Перосмат натрия (Na2[OsO2(OH)4]) • Пиросульфат натрия (Na2S2O7) • Пирофосфат натрия (Na4P2O7) • Полисульфид натрия (Na2Sn) • Сегнетова соль (KNaC4H4O6•4H2O) • Селенат натрия (Na2SeO4) • Селенид натрия (Na2Se) • Селенит натрия (Na2SeO3) • Тиоантимонат натрия (Na3[SbS4]•9H2O) • Сульфат натрия (Na2SO4) • Сульфид натрия (Na2S) • Сульфит натрия (Na2SO3) • Тартрат натрия (Na2C4H4O6) • Теллурит натрия (Na2TeO3) • Теллурид натрия (Na2Te) • Тетраборат натрия (Na2B4O7) • Тетрагидроксоцинкат(II) натрия (Na2[Zn(OH)4]) • Тетраоксоманганат(V) натрия (Na3MnO4) • Тетратиоарсенат натрия (Na3[AsS4]) • Тиосульфат натрия (Na2S2O3) • Тиоцианат натрия (NaSCN) • Тритиостибат натрия (Na3[SbS3]) • Трифосфат натрия (Na5P3O10) • Фенилнатрий (NaC6H5) • Формиат натрия (HCOONa) • Фосфид натрия (Na3P) • Фосфит натрия (Na2(PHO2)) • Фторид натрия (NaF) • Хлорид натрия (NaCl) • Хлорат натрия (NaClO3) • Хлорит натрия (NaClO2) • Цианат натрия (NaNCO) • Этилнатрий (NaC2H5) |

|
|

|
|
| Names | |
|---|---|
| IUPAC name
Sodium hydroxide[3] |
|
Other names
|
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChEBI |
|
| ChemSpider |
|
| ECHA InfoCard | 100.013.805 |
| EC Number |
|
| E number | E524 (acidity regulators, …) |
|
Gmelin Reference |
68430 |
| KEGG |
|
| MeSH | Sodium+Hydroxide |
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
| UN number | 1824, 1823 |
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
NaOH |
| Molar mass | 39.9971 g/mol |
| Appearance | White, hard (when pure), opaque crystals |
| Odor | odorless |
| Density | 2.13 g/cm3[4] |
| Melting point | 323 °C (613 °F; 596 K)[4] |
| Boiling point | 1,388 °C (2,530 °F; 1,661 K)[4] |
|
Solubility in water |
418 g/L (0 °C) 1000 g/L (25 °C)[4] 3370 g/L (100 °C) |
| Solubility | soluble in glycerol, negligible in ammonia, insoluble in ether, slowly soluble in propylene glycol |
| Solubility in methanol | 238 g/L |
| Solubility in ethanol | <<139 g/L |
| Vapor pressure | <2.4 kPa (at 20 °C) |
| Acidity (pKa) | 15.7 |
|
Magnetic susceptibility (χ) |
−15.8·10−6 cm3/mol (aq.)[5] |
|
Refractive index (nD) |
1.3576 |
| Structure[6] | |
|
Crystal structure |
Orthorhombic, oS8 |
|
Space group |
Cmcm, No. 63 |
|
Lattice constant |
a = 0.34013 nm, b = 1.1378 nm, c = 0.33984 nm |
|
Formula units (Z) |
4 |
| Thermochemistry[7] | |
|
Heat capacity (C) |
59.5 J/(mol·K) |
|
Std molar |
64.4 J/(mol·K) |
|
Std enthalpy of |
−425.8 kJ/mol |
|
Gibbs free energy (ΔfG⦵) |
-379.7 kJ/mol |
| Hazards | |
| GHS labelling: | |
|
Pictograms |

|
|
Signal word |
Danger |
|
Hazard statements |
H290, H314 |
|
Precautionary statements |
P280, P305+P351+P338, P310 |
| NFPA 704 (fire diamond) |
3 0 1 ALK |
| Lethal dose or concentration (LD, LC): | |
|
LD50 (median dose) |
40 mg/kg (mouse, intraperitoneal)[9] |
|
LDLo (lowest published) |
500 mg/kg (rabbit, oral)[10] |
| NIOSH (US health exposure limits): | |
|
PEL (Permissible) |
TWA 2 mg/m3[8] |
|
REL (Recommended) |
C 2 mg/m3[8] |
|
IDLH (Immediate danger) |
10 mg/m3[8] |
| Safety data sheet (SDS) | External SDS |
| Related compounds | |
|
Other anions |
|
|
Other cations |
|
|
Related compounds |
Sodium deuteroxide |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Sodium hydroxide, also known as lye and caustic soda,[1][2] is an inorganic compound with the formula NaOH. It is a white solid ionic compound consisting of sodium cations Na+ and hydroxide anions OH−.
Sodium hydroxide is a highly caustic base and alkali that decomposes proteins at ordinary ambient temperatures and may cause severe chemical burns. It is highly soluble in water, and readily absorbs moisture and carbon dioxide from the air. It forms a series of hydrates NaOH·nH2O.[11] The monohydrate NaOH·H2O crystallizes from water solutions between 12.3 and 61.8 °C. The commercially available «sodium hydroxide» is often this monohydrate, and published data may refer to it instead of the anhydrous compound.
As one of the simplest hydroxides, sodium hydroxide is frequently used alongside neutral water and acidic hydrochloric acid to demonstrate the pH scale to chemistry students.[12]
Sodium hydroxide is used in many industries: in the manufacture of pulp and paper, textiles, drinking water, soaps and detergents, and as a drain cleaner. Worldwide production in 2004 was approximately 60 million tons, while demand was 51 million tons.[13]
Properties[edit]
Physical properties[edit]
Pure sodium hydroxide is a colorless crystalline solid that melts at 318 °C (604 °F) without decomposition, and with a boiling point of 1,388 °C (2,530 °F). It is highly soluble in water, with a lower solubility in polar solvents such as ethanol and methanol.[14] NaOH is insoluble in ether and other non-polar solvents.
Similar to the hydration of sulfuric acid, dissolution of solid sodium hydroxide in water is a highly exothermic reaction[15] where a large amount of heat is liberated, posing a threat to safety through the possibility of splashing. The resulting solution is usually colorless and odorless. As with other alkaline solutions, it feels slippery with skin contact due to the process of saponification that occurs between NaOH and natural skin oils.
Viscosity[edit]
Concentrated (50%) aqueous solutions of sodium hydroxide have a characteristic viscosity, 78 mPa·s, that is much greater than that of water (1.0 mPa·s) and near that of olive oil (85 mPa·s) at room temperature. The viscosity of aqueous NaOH, as with any liquid chemical, is inversely related to its service temperature, i.e., its viscosity decreases as temperature increases, and vice versa. The viscosity of sodium hydroxide solutions plays a direct role in its application as well as its storage.[14]
Hydrates[edit]
Sodium hydroxide can form several hydrates NaOH·nH2O, which result in a complex solubility diagram that was described in detail by S. U. Pickering in 1893.[16] The known hydrates and the approximate ranges of temperature and concentration (mass percent of NaOH) of their saturated water solutions are:[11]
- Heptahydrate, NaOH·7H2O: from −28 °C (18.8%) to −24 °C (22.2%).[16]
- Pentahydrate, NaOH·5H2O: from −24 °C (22.2%) to −17.7 (24.8%).[16]
- Tetrahydrate, NaOH·4H2O, α form: from −17.7 (24.8%) to +5.4 °C (32.5%).[16][17]
- Tetrahydrate, NaOH·4H2O, β form: metastable.[16][17]
- Trihemihydrate, NaOH·3.5H2O: from +5.4 °C (32.5%) to +15.38 °C (38.8%) and then to +5.0 °C (45.7%).[16][11]
- Trihydrate, NaOH·3H2O: metastable.[16]
- Dihydrate, NaOH·2H2O: from +5.0 °C (45.7%) to +12.3 °C (51%).[16][11]
- Monohydrate, NaOH·H2O: from +12.3 °C (51%) to 65.10 °C (69%) then to 62.63 °C (73.1%).[16][18]
Early reports refer to hydrates with n = 0.5 or n = 2/3, but later careful investigations failed to confirm their existence.[18]
The only hydrates with stable melting points are NaOH·H2O (65.10 °C) and NaOH·3.5H2O (15.38 °C). The other hydrates, except the metastable ones NaOH·3H2O and NaOH·4H2O (β) can be crystallized from solutions of the proper composition, as listed above. However, solutions of NaOH can be easily supercooled by many degrees, which allows the formation of hydrates (including the metastable ones) from solutions with different concentrations.[11][18]
For example, when a solution of NaOH and water with 1:2 mole ratio (52.6% NaOH by mass) is cooled, the monohydrate normally starts to crystallize (at about 22 °C) before the dihydrate. However, the solution can easily be supercooled down to −15 °C, at which point it may quickly crystallize as the dihydrate. When heated, the solid dihydrate might melt directly into a solution at 13.35 °C; however, once the temperature exceeds 12.58 °C. it often decomposes into solid monohydrate and a liquid solution. Even the n = 3.5 hydrate is difficult to crystallize, because the solution supercools so much that other hydrates become more stable.[11]
A hot water solution containing 73.1% (mass) of NaOH is a eutectic that solidifies at about 62.63 °C as an intimate mix of anhydrous and monohydrate crystals.[19][18]
A second stable eutectic composition is 45.4% (mass) of NaOH, that solidifies at about 4.9 °C into a mixture of crystals of the dihydrate and of the 3.5-hydrate.[11]
The third stable eutectic has 18.4% (mass) of NaOH. It solidifies at about −28.7 °C as a mixture of water ice and the heptahydrate NaOH·7H2O.[16][20]
When solutions with less than 18.4% NaOH are cooled, water ice crystallizes first, leaving the NaOH in solution.[16]
The α form of the tetrahydrate has density 1.33 g/cm3. It melts congruously at 7.55 °C into a liquid with 35.7% NaOH and density 1.392 g/cm3, and therefore floats on it like ice on water. However, at about 4.9 °C it may instead melt incongruously into a mixture of solid NaOH·3.5H2O and a liquid solution.[17]
The β form of the tetrahydrate is metastable, and often transforms spontaneously to the α form when cooled below −20 °C.[17] Once initiated, the exothermic transformation is complete in a few minutes, with a 6.5% increase in volume of the solid. The β form can be crystallized from supercooled solutions at −26 °C, and melts partially at −1.83 °C.[17]
The «sodium hydroxide» of commerce is often the monohydrate (density 1.829 g/cm3). Physical data in technical literature may refer to this form, rather than the anhydrous compound.
Crystal structure[edit]
NaOH and its monohydrate form orthorhombic crystals with the space groups Cmcm (oS8) and Pbca (oP24), respectively. The monohydrate cell dimensions are a = 1.1825, b = 0.6213, c = 0.6069 nm. The atoms are arranged in a hydrargillite-like layer structure, with each sodium atom surrounded by six oxygen atoms, three each from hydroxide ions and three from water molecules. The hydrogen atoms of the hydroxyls form strong bonds with oxygen atoms within each O layer. Adjacent O layers are held together by hydrogen bonds between water molecules.[21]
Chemical properties[edit]
Reaction with acids[edit]
Sodium hydroxide reacts with protic acids to produce water and the corresponding salts. For example, when sodium hydroxide reacts with hydrochloric acid, sodium chloride is formed:
- NaOH(aq) + HCl(aq) → NaCl(aq) + H2O(l)
In general, such neutralization reactions are represented by one simple net ionic equation:
- OH−(aq) + H+(aq) → H2O(l)
This type of reaction with a strong acid releases heat, and hence is exothermic. Such acid–base reactions can also be used for titrations. However, sodium hydroxide is not used as a primary standard because it is hygroscopic and absorbs carbon dioxide from air.
Reaction with acidic oxides[edit]
Sodium hydroxide also reacts with acidic oxides, such as sulfur dioxide. Such reactions are often used to «scrub» harmful acidic gases (like SO2 and H2S) produced in the burning of coal and thus prevent their release into the atmosphere. For example,
- 2 NaOH + SO2 → Na2SO3 + H2O
Reaction with metals and oxides[edit]
Glass reacts slowly with aqueous sodium hydroxide solutions at ambient temperatures to form soluble silicates. Because of this, glass joints and stopcocks exposed to sodium hydroxide have a tendency to «freeze». Flasks and glass-lined chemical reactors are damaged by long exposure to hot sodium hydroxide, which also frosts the glass. Sodium hydroxide does not attack iron at room temperatures, since iron does not have amphoteric properties (i.e., it only dissolves in acid, not base).
Nevertheless, at high temperatures (e.g. above 500 °C), iron can react endothermically with sodium hydroxide to form iron(III) oxide, sodium metal, and hydrogen gas.[22] This is due to the lower enthalpy of formation of iron(III) oxide (−824.2 kJ/mol) compared to sodium hydroxide (-500 kJ/mol) and positive entropy change of reaction, which imply spontaneity at high temperatures (ΔST > ΔH, ΔG < 0) and non-spontaneity at low temperatures (ΔST < ΔH, ΔG > 0). Consider the following reaction between molten sodium hydroxide and finely divided iron filings:
- 4 Fe + 6 NaOH → 2 Fe2O3 + 6 Na + 3 H2
A few transition metals, however, may react vigorously with sodium hydroxide under milder conditions.
In 1986, an aluminium road tanker in the UK was mistakenly used to transport 25% sodium hydroxide solution,[23] causing pressurization of the contents and damage to the tanker. The pressurization was due to the hydrogen gas which is produced in the reaction between sodium hydroxide and aluminium:
- 2 Al + 2 NaOH + 6 H2O → 2 Na[Al(OH)4] + 3 H2
Precipitant[edit]
Unlike sodium hydroxide, which is soluble, the hydroxides of most transition metals are insoluble, and therefore sodium hydroxide can be used to precipitate transition metal hydroxides. The following colours are observed:
- Copper — blue
- Iron(II) — green
- Iron(III) — yellow / brown
Zinc and lead salts dissolve in excess sodium hydroxide to give a clear solution of Na2ZnO2 or Na2PbO2.
Aluminium hydroxide is used as a gelatinous flocculant to filter out particulate matter in water treatment. Aluminium hydroxide is prepared at the treatment plant from aluminium sulfate by reacting it with sodium hydroxide or bicarbonate.
- Al2(SO4)3 + 6 NaOH → 2 Al(OH)3 + 3 Na2SO4
- Al2(SO4)3 + 6 NaHCO3 → 2 Al(OH)3 + 3 Na2SO4 + 6 CO2
Saponification[edit]
Sodium hydroxide can be used for the base-driven hydrolysis of esters (as in saponification), amides and alkyl halides.[14] However, the limited solubility of sodium hydroxide in organic solvents means that the more soluble potassium hydroxide (KOH) is often preferred. Touching a sodium hydroxide solution with bare hands, while not recommended, produces a slippery feeling. This happens because oils on the skin such as sebum are converted to soap.
Despite solubility in propylene glycol it is unlikely to replace water in saponification due to propylene glycol’s primary reaction with fat before reaction between sodium hydroxide and fat.
| Mass fraction of NaOH (wt%) | 4 | 10 | 20 | 30 | 40 | 50 |
|---|---|---|---|---|---|---|
| Molar concentration of NaOH (M) | 1.04 | 2.77 | 6.09 | 9.95 | 14.30 | 19.05 |
| Mass concentration of NaOH (g/L) | 41.7 | 110.9 | 243.8 | 398.3 | 572.0 | 762.2 |
| Density of solution (g/mL) | 1.043 | 1.109 | 1.219 | 1.328 | 1.430 | 1.524 |
Production[edit]
Sodium hydroxide is industrially produced as a 50% solution by variations of the electrolytic chloralkali process.[24] Chlorine gas is also produced in this process.[24] Solid sodium hydroxide is obtained from this solution by the evaporation of water. Solid sodium hydroxide is most commonly sold as flakes, prills, and cast blocks.[13]
In 2004, world production was estimated at 60 million dry tonnes of sodium hydroxide, and demand was estimated at 51 million tonnes.[13] In 1998, total world production was around 45 million tonnes. North America and Asia each contributed around 14 million tonnes, while Europe produced around 10 million tonnes. In the United States, the major producer of sodium hydroxide is Olin, which has annual production around 5.7 million tonnes from sites at Freeport, Texas, and Plaquemine, Louisiana, St Gabriel, Louisiana, McIntosh, Alabama, Charleston, Tennessee, Niagara Falls, New York, and Becancour, Canada. Other major US producers include Oxychem, Westlake, Shintek and Formosa. All of these companies use the chloralkali process.[25]
Historically, sodium hydroxide was produced by treating sodium carbonate with calcium hydroxide in a metathesis reaction which takes advantage of the fact that sodium hydroxide is soluble, while calcium carbonate is not. This process was called causticizing.[26]
- Ca(OH)2(aq) + Na2CO3(s) → CaCO3(s) + 2 NaOH(aq)
This process was superseded by the Solvay process in the late 19th century, which was in turn supplanted by the Leblanc process and then chloralkali process which is in use today.
Sodium hydroxide is also produced by combining pure sodium metal with water. The byproducts are hydrogen gas and heat, often resulting in a flame.
- 2 Na(s) + 2 H2O(l) → 2 NaOH(aq) + H2
This reaction is commonly used for demonstrating the reactivity of alkali metals in academic environments; however, it is not commercially viable, as the isolation of sodium metal is typically performed by reduction or electrolysis of sodium compounds including sodium hydroxide.
Uses[edit]
Sodium hydroxide is a popular strong base used in industry. Sodium hydroxide is used in the manufacture of sodium salts and detergents, pH regulation, and organic synthesis. In bulk, it is most often handled as an aqueous solution,[27] since solutions are cheaper and easier to handle.
Sodium hydroxide is used in many scenarios where it is desirable to increase the alkalinity of a mixture, or to neutralize acids.
For example, in the petroleum industry, sodium hydroxide is used as an additive in drilling mud to increase alkalinity in bentonite mud systems, to increase the mud viscosity, and to neutralize any acid gas (such as hydrogen sulfide and carbon dioxide) which may be encountered in the geological formation as drilling progresses.
Another use is in Salt spray testing where pH needs to be regulated. Sodium hydroxide is used with hydrochloric acid to balance pH. The resultant salt, NaCl, is the corrosive agent used in the standard neutral pH salt spray test.
Poor quality crude oil can be treated with sodium hydroxide to remove sulfurous impurities in a process known as caustic washing. As above, sodium hydroxide reacts with weak acids such as hydrogen sulfide and mercaptans to yield non-volatile sodium salts, which can be removed. The waste which is formed is toxic and difficult to deal with, and the process is banned in many countries because of this. In 2006, Trafigura used the process and then dumped the waste in Ivory Coast.[28][29]
Other common uses of sodium hydroxide include:
- for making soaps and detergents. Sodium hydroxide is used for hard bar soap, while potassium hydroxide is used for liquid soaps.[30][31] Sodium hydroxide is used more often than potassium hydroxide because it is cheaper and a smaller quantity is needed.
- as drain cleaners that contain sodium hydroxide convert fats and grease that can clog pipes into soap, which dissolves in water (see cleaning agent).
- for making artificial textile fibres (such as Rayon).
- in the manufacture of paper. Around 56% of sodium hydroxide produced is used by industry, 25% of which is used in the paper industry (see chemical pulping).
- in purifying bauxite ore from which aluminium metal is extracted. This is known as Bayer process (see dissolving amphoteric metals and compounds).
- in de-greasing metals, oil refining, and making dyes and bleaches.
- in water treatment plants for pH regulation.
- to treat bagels and pretzel dough, giving the distinctive shiny finish.
Chemical pulping[edit]
Sodium hydroxide is also widely used in pulping of wood for making paper or regenerated fibers. Along with sodium sulfide, sodium hydroxide is a key component of the white liquor solution used to separate lignin from cellulose fibers in the kraft process. It also plays a key role in several later stages of the process of bleaching the brown pulp resulting from the pulping process. These stages include oxygen delignification, oxidative extraction, and simple extraction, all of which require a strong alkaline environment with a pH > 10.5 at the end of the stages.
Tissue digestion[edit]
In a similar fashion, sodium hydroxide is used to digest tissues, as in a process that was used with farm animals at one time. This process involved placing a carcass into a sealed chamber, then adding a mixture of sodium hydroxide and water (which breaks the chemical bonds that keep the flesh intact). This eventually turns the body into a liquid with a dark brown color,[32][33] and the only solids that remain are bone hulls, which can be crushed between one’s fingertips.[34]
Sodium hydroxide is frequently used in the process of decomposing roadkill dumped in landfills by animal disposal contractors.[33] Due to its availability and low cost, it has been used by criminals to dispose of corpses. Italian serial killer Leonarda Cianciulli used this chemical to turn dead bodies into soap.[35] In Mexico, a man who worked for drug cartels admitted disposing of over 300 bodies with it.[36]
Sodium hydroxide is a dangerous chemical due to its ability to hydrolyze protein. If a dilute solution is spilled on the skin, burns may result if the area is not washed thoroughly and for several minutes with running water. Splashes in the eye can be more serious and can lead to blindness.[37]
Dissolving amphoteric metals and compounds[edit]
Strong bases attack aluminium. Sodium hydroxide reacts with aluminium and water to release hydrogen gas. The aluminium takes the oxygen atom from sodium hydroxide, which in turn takes the oxygen atom from the water, and releases the two hydrogen atoms. The reaction thus produces hydrogen gas and sodium aluminate. In this reaction, sodium hydroxide acts as an agent to make the solution alkaline, which aluminium can dissolve in.
- 2 Al + 2 NaOH + 2 H2O → 2 NaAlO2 + 3 H2
Sodium aluminate is an inorganic chemical that is used as an effective source of aluminium hydroxide for many industrial and technical applications. Pure sodium aluminate (anhydrous) is a white crystalline solid having a formula variously given as NaAlO2, Na3AlO3, Na[Al(OH)4], Na2O·Al2O3 or Na2Al2O4. Formation of sodium tetrahydroxoaluminate(III) or hydrated sodium aluminate is given by:[38]
- 2 Al + 2 NaOH + 6 H2O → 2 Na[Al(OH)4] + 3 H2
This reaction can be useful in etching, removing anodizing, or converting a polished surface to a satin-like finish, but without further passivation such as anodizing or alodining the surface may become degraded, either under normal use or in severe atmospheric conditions.
In the Bayer process, sodium hydroxide is used in the refining of alumina containing ores (bauxite) to produce alumina (aluminium oxide) which is the raw material used to produce aluminium metal via the electrolytic Hall-Héroult process. Since the alumina is amphoteric, it dissolves in the sodium hydroxide, leaving impurities less soluble at high pH such as iron oxides behind in the form of a highly alkaline red mud.
Other amphoteric metals are zinc and lead which dissolve in concentrated sodium hydroxide solutions to give sodium zincate and sodium plumbate respectively.
Esterification and transesterification reagent[edit]
Sodium hydroxide is traditionally used in soap making (cold process soap, saponification).[39] It was made in the nineteenth century for a hard surface rather than liquid product because it was easier to store and transport.
For the manufacture of biodiesel, sodium hydroxide is used as a catalyst for the transesterification of methanol and triglycerides. This only works with anhydrous sodium hydroxide, because combined with water the fat would turn into soap, which would be tainted with methanol. NaOH is used more often than potassium hydroxide because it is cheaper and a smaller quantity is needed. Due to production costs, NaOH, which is produced using common salt is cheaper than potassium hydroxide.[40]
Food preparation[edit]
Food uses of sodium hydroxide include washing or chemical peeling of fruits and vegetables, chocolate and cocoa processing, caramel coloring production, poultry scalding, soft drink processing, and thickening ice cream.[41] Olives are often soaked in sodium hydroxide for softening; Pretzels and German lye rolls are glazed with a sodium hydroxide solution before baking to make them crisp. Owing to the difficulty in obtaining food grade sodium hydroxide in small quantities for home use, sodium carbonate is often used in place of sodium hydroxide.[42] It is known as E number E524.
Specific foods processed with sodium hydroxide include:
- German pretzels are poached in a boiling sodium carbonate solution or cold sodium hydroxide solution before baking, which contributes to their unique crust.
- Lye-water is an essential ingredient in the crust of the traditional baked Chinese moon cakes.
- Most yellow coloured Chinese noodles are made with lye-water but are commonly mistaken for containing egg.
- One variety of zongzi uses lye water to impart a sweet flavor.
- Sodium hydroxide is also the chemical that causes gelling of egg whites in the production of Century eggs.
- Some methods of preparing olives involve subjecting them to a lye-based brine.[43]
- The Filipino dessert (Filipino: kakanin) called kutsinta uses a small quantity of lye water to help give the rice flour batter a jelly like consistency. A similar process is also used in the kakanin known as pitsi-pitsi or pichi-pichi except that the mixture uses grated cassava instead of rice flour.
- The Norwegian dish known as lutefisk (Norwegian: lutfisk, lit. ‘lye fish’).
- Bagels are often boiled in a lye solution before baking, contributing to their shiny crust.
- Hominy is dried maize (corn) kernels reconstituted by soaking in lye-water. These expand considerably in size and may be further processed by frying to make corn nuts or by drying and grinding to make grits. Hominy is used to create Masa, a popular flour used in Mexican cuisine to make Corn tortillas and tamales. Nixtamal is similar, but uses calcium hydroxide instead of sodium hydroxide.
Cleaning agent[edit]
Sodium hydroxide is frequently used as an industrial cleaning agent where it is often called «caustic». It is added to water, heated, and then used to clean process equipment, storage tanks, etc. It can dissolve grease, oils, fats and protein-based deposits. It is also used for cleaning waste discharge pipes under sinks and drains in domestic properties. Surfactants can be added to the sodium hydroxide solution in order to stabilize dissolved substances and thus prevent redeposition. A sodium hydroxide soak solution is used as a powerful degreaser on stainless steel and glass bakeware. It is also a common ingredient in oven cleaners.
A common use of sodium hydroxide is in the production of parts washer detergents. Parts washer detergents based on sodium hydroxide are some of the most aggressive parts washer cleaning chemicals. The sodium hydroxide-based detergents include surfactants, rust inhibitors and defoamers. A parts washer heats water and the detergent in a closed cabinet and then sprays the heated sodium hydroxide and hot water at pressure against dirty parts for degreasing applications. Sodium hydroxide used in this manner replaced many solvent-based systems in the early 1990s[citation needed] when trichloroethane was outlawed by the Montreal Protocol. Water and sodium hydroxide detergent-based parts washers are considered to be an environmental improvement over the solvent-based cleaning methods.
Paint stripping with caustic soda
Sodium hydroxide is used in the home as a type of drain opener to unblock clogged drains, usually in the form of a dry crystal or as a thick liquid gel. The alkali dissolves greases to produce water soluble products. It also hydrolyzes proteins, such as those found in hair, which may block water pipes. These reactions are sped by the heat generated when sodium hydroxide and the other chemical components of the cleaner dissolve in water. Such alkaline drain cleaners and their acidic versions are highly corrosive and should be handled with great caution.
Relaxer[edit]
Sodium hydroxide is used in some relaxers to straighten hair. However, because of the high incidence and intensity of chemical burns, manufacturers of chemical relaxers use other alkaline chemicals in preparations available to consumers. Sodium hydroxide relaxers are still available, but they are used mostly by professionals.
Paint stripper[edit]
A solution of sodium hydroxide in water was traditionally used as the most common paint stripper on wooden objects. Its use has become less common, because it can damage the wood surface, raising the grain and staining the colour.
Water treatment[edit]
Sodium hydroxide is sometimes used during water purification to raise the pH of water supplies. Increased pH makes the water less corrosive to plumbing and reduces the amount of lead, copper and other toxic metals that can dissolve into drinking water.[44][45]
Historical uses[edit]
Sodium hydroxide has been used for detection of carbon monoxide poisoning, with blood samples of such patients turning to a vermilion color upon the addition of a few drops of sodium hydroxide.[46] Today, carbon monoxide poisoning can be detected by CO oximetry.
In cement mixes, mortars, concrete, grouts[edit]
Sodium hydroxide is used in some cement mix plasticisers. This helps homogenise cement mixes, preventing segregation of sands and cement, decreases the amount of water required in a mix and increases workability of the cement product, be it mortar, render or concrete.
Experimental[edit]
Flavonoids[edit]
See: Sodium hydroxide test for flavonoids
Summer-winter heat storage[edit]
After decades of research,[47][48] EMPA researchers and others[49][50] are experimenting with concentrated sodium hydroxide (NaOH) as the thermal storage or seasonal reservoir medium for power plants and domestic space-heating. If water is added to solid or concentrated sodium hydroxide (NaOH), heat is released. The dilution is exothermic – chemical energy is released in the form of heat. Conversely, by applying heat energy into a dilute sodium hydroxide solution the water will evaporate so that the solution becomes more concentrated and thus stores the supplied heat as latent chemical energy.[51]
Neutron moderator[edit]
Seaborg Technologies is working on a reactor design in which NaOH is used as a neutron moderator,[52]
Safety[edit]
Chemical burns caused by sodium hydroxide solution photographed 44 hours after exposure.
Like other corrosive acids and alkalis, drops of sodium hydroxide solutions can readily decompose proteins and lipids in living tissues via amide hydrolysis and ester hydrolysis, which consequently cause chemical burns and may induce permanent blindness upon contact with eyes.[1][2] Solid alkali can also express its corrosive nature if there is water, such as water vapor. Thus, protective equipment, like rubber gloves, safety clothing and eye protection, should always be used when handling this chemical or its solutions. The standard first aid measures for alkali spills on the skin is, as for other corrosives, irrigation with large quantities of water. Washing is continued for at least ten to fifteen minutes.
Moreover, dissolution of sodium hydroxide is highly exothermic, and the resulting heat may cause heat burns or ignite flammables. It also produces heat when reacted with acids.
Sodium hydroxide is also mildly corrosive to glass, which can cause damage to glazing or cause ground glass joints to bind.[53] Sodium hydroxide is corrosive to several metals, like aluminium which reacts with the alkali to produce flammable hydrogen gas on contact.[54]
Storage[edit]
Two industrial fiberglass barrels of caustic-soda
Careful storage is needed when handling sodium hydroxide for use, especially bulk volumes. Following proper NaOH storage guidelines and maintaining worker/environment safety is always recommended given the chemical’s burn hazard.
Sodium hydroxide is often stored in bottles for small-scale laboratory use, within intermediate bulk containers (medium volume containers) for cargo handling and transport, or within large stationary storage tanks with volumes up to 100,000 gallons for manufacturing or waste water plants with extensive NaOH use. Common materials that are compatible with sodium hydroxide and often utilized for NaOH storage include: polyethylene (HDPE, usual, XLPE, less common), carbon steel, polyvinyl chloride (PVC), stainless steel, and fiberglass reinforced plastic (FRP, with a resistant liner).[14]
Sodium hydroxide must be stored in airtight containers to preserve its normality as it will absorb water from the atmosphere.
History[edit]
Sodium hydroxide was first prepared by soap makers.[55]: p45 A procedure for making sodium hydroxide appeared as part of a recipe for making soap in an Arab book of the late 13th century: Al-mukhtara’ fi funun min al-suna’ (Inventions from the Various Industrial Arts), which was compiled by al-Muzaffar Yusuf ibn ‘Umar ibn ‘Ali ibn Rasul (d. 1295), a king of Yemen.[56][57] The recipe called for passing water repeatedly through a mixture of alkali (Arabic: al-qily, where qily is ash from saltwort plants, which are rich in sodium; hence alkali was impure sodium carbonate)[58] and quicklime (calcium oxide, CaO), whereby a solution of sodium hydroxide was obtained. European soap makers also followed this recipe. When in 1791 the French chemist and surgeon Nicolas Leblanc (1742–1806) patented a process for mass-producing sodium carbonate, natural «soda ash» (impure sodium carbonate that was obtained from the ashes of plants that are rich in sodium)[55]: p36 was replaced by this artificial version.[55]: p46 However, by the 20th century, the electrolysis of sodium chloride had become the primary method for producing sodium hydroxide.[59]
See also[edit]
- Acid and base
- HAZMAT Class 8 Corrosive Substances
- List of cleaning agents
References[edit]
- ^ a b c «Material Safety Datasheet» (PDF). certified-lye.com.
- ^ a b c «Material Safety Datasheet 2» (PDF). hillbrothers.com. Archived from the original (PDF) on 2012-08-03. Retrieved 2012-05-20.
- ^ a b «Sodium Hydroxide – Compound Summary». Retrieved June 12, 2012.
- ^ a b c d Haynes, p. 4.90
- ^ Haynes, p. 4.135
- ^ Jacobs, H.; Kockelkorn, J. and Tacke, Th. (1985). «Hydroxide des Natriums, Kaliums und Rubidiums: Einkristallzüchtung und röntgenographische Strukturbestimmung an der bei Raumtemperatur stabilen Modifikation». Z. Anorg. Allg. Chem. 531 (12): 119–124. doi:10.1002/zaac.19855311217.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ Haynes, p. 5.13
- ^ a b c NIOSH Pocket Guide to Chemical Hazards. «#0565». National Institute for Occupational Safety and Health (NIOSH).
- ^ Michael Chambers. «ChemIDplus – 1310-73-2 – HEMHJVSKTPXQMS-UHFFFAOYSA-M – Sodium hydroxide [NF<nowiki»></nowiki»> – Similar structures search, synonyms, formulas, resource links, and other chemical information.»]. nih.gov.
- ^ «Sodium hydroxide». Immediately Dangerous to Life or Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ^ a b c d e f g Siemens, P. R.; Giauque, William F. (1969). «Entropies of the hydrates of sodium hydroxide. II. Low-temperature heat capacities and heats of fusion of NaOH·2H2O and NaOH·3.5H2O». Journal of Physical Chemistry. 73 (1): 149–157. doi:10.1021/j100721a024.
- ^ «Examples of Common Laboratory Chemicals and their Hazard Class». Archived from the original on 2018-01-10. Retrieved 2018-01-09.
- ^ a b c Cetin Kurt, Jürgen Bittner. «Sodium Hydroxide». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a24_345.pub2.
- ^ a b c d «Sodium Hydroxide Storage Tanks & Specifications». Protank. 2018-09-08. Retrieved 2018-11-21.
- ^ «Exothermic vs. Endothermic: Chemistry’s Give and Take». Discovery Express.
- ^ a b c d e f g h i j k Umfreville Pickering, Spencer (1893). «LXI.—The hydrates of sodium, potassium, and lithium hydroxides». Journal of the Chemical Society, Transactions. 63: 890–909. doi:10.1039/CT8936300890.
- ^ a b c d e Mraw, S. C.; Giauque, W. F. (1974). «Entropies of the hydrates of sodium hydroxide. III. Low-temperature heat capacities and heats of fusion of the α and β crystalline forms of sodium hydroxide tetrahydrate». Journal of Physical Chemistry. 78 (17): 1701–1709. doi:10.1021/j100610a005.
- ^ a b c d Murch, L. E.; Giauque, W. F. (1962). «The thermodynamic properties of sodium hydroxide and its monohydrate. Heat capacities to low temperatures. Heats of solution». Journal of Physical Chemistry. 66 (10): 2052–2059. doi:10.1021/j100816a052.
- ^ Brodale, G. E.; Giauque, W. F. (1962). «The freezing point-solubility curve of aqueous sodium hydroxide in the region near the anhydrous-monohydrate eutectic». Journal of Physical Chemistry. 66 (10): 2051. doi:10.1021/j100816a051.
- ^ M. Conde Engineering: «Solid-Liquid Equilibrium (SLE) and Vapour-Liquid Equilibrium (VLE) of Aqueous NaOH». Online report, accessed on 2017-04-29.
- ^ Jacobs, H. and Metzner, U. (1991). «Ungewöhnliche H-Brückenbindungen in Natriumhydroxidmonohydrat: Röntgen- und Neutronenbeugung an NaOH·H<sub»>2</sub»>O bzw. NaOD·D<sub»>2</sub»>O». Zeitschrift für anorganische und allgemeine Chemie. 597 (1): 97–106. doi:10.1002/zaac.19915970113.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ 祖恩, 许 (1992), 钾素,钾肥溯源[J]
- ^ Stamell, Jim (2001), EXCEL HSC Chemistry, Pascal Press, p. 199, ISBN 978-1-74125-299-6
- ^ a b Fengmin Du, David M Warsinger, Tamanna I Urmi, Gregory P Thiel, Amit Kumar, John H Lienhard (2018). «Sodium hydroxide production from seawater desalination brine: process design and energy efficiency». Environmental Science & Technology. 52 (10): 5949–5958. Bibcode:2018EnST…52.5949D. doi:10.1021/acs.est.8b01195. hdl:1721.1/123096. PMID 29669210.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ Kirk-Othmer Encyclopedia of Chemical Technology[permanent dead link], 5th edition, John Wiley & Sons.
- ^ Deming, Horace G. (1925). General Chemistry: An Elementary Survey Emphasizing Industrial Applications of Fundamental Principles (2nd ed.). New York: John Wiley & Sons, Inc. p. 452.
- ^ «Document 2 — CausticSodamanual2008.pdf» (PDF). 2013. Archived from the original (PDF) on March 19, 2015. Retrieved July 17, 2014.
- ^ Sample, Ian (16 September 2009). «Trafigura case: toxic slop left behind by caustic washing». The Guardian. Retrieved 2009-09-17.
- ^ «Trafigura knew of waste dangers». BBC Newsnight. 16 September 2009. Retrieved 2009-09-17.
- ^ «A Guide to Caustic Chemicals Used in Soap Making | Brenntag». www.brenntag.com. Retrieved 2020-10-03.
- ^ «Sodium Hydroxide | Uses, Benefits, and Chemical Safety Facts». ChemicalSafetyFacts.org. 2016-09-06. Retrieved 2020-10-03.
- ^ Ayres, Chris (27 February 2010) Clean green finish that sends a loved one down the drain Times Online. Retrieved 2013-02-20.
- ^ a b Thacker, H. Leon; Kastner, Justin (August 2004). Carcass Disposal: A Comprehensive Review. Chapter 6. National Agricultural Biosecurity Center, Kansas State University, 2004. Retrieved 2010-03-08
- ^ Roach, Mary (2004). Stiff: The Curious Lives of Human Cadavers, New York: W.W. Norton & Company. ISBN 0-393-32482-6.
- ^ «Sodium:Getting rid of dirt – and murder victims». BBC News. 3 May 2014.
- ^ William Booth (January 27, 2009). «‘Stewmaker’ Stirs Horror in Mexico». Washington Post.
- ^ «ATSDR – Medical Management Guidelines (MMGs): Sodium Hydroxide». www.atsdr.cdc.gov.
- ^ PubChem. «Aluminium sodium tetrahydroxide». pubchem.ncbi.nlm.nih.gov. Retrieved 2020-10-03.
- ^ Morfit, Campbell (1856). A treatise on chemistry applied to the manufacture of soap and candles. Parry and McMillan.
- ^ «Side by Side Comparison: Potassium Hydroxide and Sodium Hydroxide — Similarities, Differences and Use Cases». info.noahtech.com. Retrieved 2020-10-03.
- ^ «Sodium Hydroxide». rsc.org. 2014. Retrieved November 9, 2014.
- ^ «Hominy without Lye». National Center for Home Food Preservation.
- ^ «Olives: Safe Methods for Home Pickling (application/pdf Object)» (PDF). ucanr.org. 2010. Retrieved January 22, 2012.
- ^ «Drinking Water Treatment – pH Adjustment». 2011. Archived from the original on August 10, 2018. Retrieved June 23, 2016.
- ^ Brian Oram, PG (2014). «Drinking Water Issues Corrosive Water (Lead, Copper, Aluminum, Zinc and More)». Retrieved June 23, 2016.
- ^ Page 168 in: The Detection of poisons and strong drugs.
Author: Wilhelm Autenrieth.
Publisher: P. Blakiston’s son & Company, 1909. - ^ Turner, R. H.; Truscello, V. C. (1 January 1977). «Large-scale thermal energy storage using sodium hydroxide /NaOH/». International Solar Energy Society. Bibcode:1977ises.meet…18T.
- ^ Weber, R (2010). «Long-Term Heat Storage with NaOH» (PDF).
- ^ «The Water Network | by AquaSPE». thewaternetwork.com.
- ^ «Energy storage in residual salt will help Hyme outflank competitors». energywatch.com. 20 January 2022.
- ^ «Empa – 604 – Communication – NaOH-heat-storage». www.empa.ch.
- ^ «Seaborg completes experiments to optimise its molten salt reactor design — Nuclear Engineering International». www.neimagazine.com.
- ^ Pubchem. «SODIUM HYDROXIDE | NaOH – PubChem». pubchem.ncbi.nlm.nih.gov. Retrieved 2016-09-04.
- ^ «aluminium_water_hydrogen.pdf (application/pdf Object)» (PDF). www1.eere.energy.gov. 2008. Archived from the original (PDF) on September 14, 2012. Retrieved January 15, 2013.
- ^ a b c Thorpe, Thomas Edward, ed., A Dictionary of Applied Chemistry (London, England: Longmans, Green, and Co., 1913), vol. 5, [1]
- ^ See: History of Science and Technology in Islam: Description of Soap Making
- ^ The English chemist and archaeologist Henry Ernest Stapleton (1878–1962) presented evidence that the Persian alchemist and physician Muhammad ibn Zakariya al-Razi (c. 865–925) knew about sodium hydroxide. See {{cite journal
Bibliography[edit]
- Haynes, William M., ed. (2011). CRC Handbook of Chemistry and Physics (92nd ed.). CRC Press. ISBN 978-1439855119.
External links[edit]
- International Chemical Safety Card 0360
- Euro Chlor-How is chlorine made? Chlorine Online
- NIOSH Pocket Guide to Chemical Hazards
- CDC – Sodium Hydroxide – NIOSH Workplace Safety and Health Topic
- Production by brine electrolysis
- Data sheets
- Technical charts (page 33—41) for enthalpy, temperature and pressure
- Sodium Hydroxide MSDS
- Certified Lye MSDS
- Hill Brothers MSDS
- Titration of acids with sodium hydroxide; freeware for data analysis, simulation of curves and pH calculation
- Caustic soda production in continuous causticising plant by lime soda process

|
|

|
|
| Names | |
|---|---|
| IUPAC name
Sodium hydroxide[3] |
|
Other names
|
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChEBI |
|
| ChemSpider |
|
| ECHA InfoCard | 100.013.805 |
| EC Number |
|
| E number | E524 (acidity regulators, …) |
|
Gmelin Reference |
68430 |
| KEGG |
|
| MeSH | Sodium+Hydroxide |
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
| UN number | 1824, 1823 |
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
NaOH |
| Molar mass | 39.9971 g/mol |
| Appearance | White, hard (when pure), opaque crystals |
| Odor | odorless |
| Density | 2.13 g/cm3[4] |
| Melting point | 323 °C (613 °F; 596 K)[4] |
| Boiling point | 1,388 °C (2,530 °F; 1,661 K)[4] |
|
Solubility in water |
418 g/L (0 °C) 1000 g/L (25 °C)[4] 3370 g/L (100 °C) |
| Solubility | soluble in glycerol, negligible in ammonia, insoluble in ether, slowly soluble in propylene glycol |
| Solubility in methanol | 238 g/L |
| Solubility in ethanol | <<139 g/L |
| Vapor pressure | <2.4 kPa (at 20 °C) |
| Acidity (pKa) | 15.7 |
|
Magnetic susceptibility (χ) |
−15.8·10−6 cm3/mol (aq.)[5] |
|
Refractive index (nD) |
1.3576 |
| Structure[6] | |
|
Crystal structure |
Orthorhombic, oS8 |
|
Space group |
Cmcm, No. 63 |
|
Lattice constant |
a = 0.34013 nm, b = 1.1378 nm, c = 0.33984 nm |
|
Formula units (Z) |
4 |
| Thermochemistry[7] | |
|
Heat capacity (C) |
59.5 J/(mol·K) |
|
Std molar |
64.4 J/(mol·K) |
|
Std enthalpy of |
−425.8 kJ/mol |
|
Gibbs free energy (ΔfG⦵) |
-379.7 kJ/mol |
| Hazards | |
| GHS labelling: | |
|
Pictograms |

|
|
Signal word |
Danger |
|
Hazard statements |
H290, H314 |
|
Precautionary statements |
P280, P305+P351+P338, P310 |
| NFPA 704 (fire diamond) |
3 0 1 ALK |
| Lethal dose or concentration (LD, LC): | |
|
LD50 (median dose) |
40 mg/kg (mouse, intraperitoneal)[9] |
|
LDLo (lowest published) |
500 mg/kg (rabbit, oral)[10] |
| NIOSH (US health exposure limits): | |
|
PEL (Permissible) |
TWA 2 mg/m3[8] |
|
REL (Recommended) |
C 2 mg/m3[8] |
|
IDLH (Immediate danger) |
10 mg/m3[8] |
| Safety data sheet (SDS) | External SDS |
| Related compounds | |
|
Other anions |
|
|
Other cations |
|
|
Related compounds |
Sodium deuteroxide |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Sodium hydroxide, also known as lye and caustic soda,[1][2] is an inorganic compound with the formula NaOH. It is a white solid ionic compound consisting of sodium cations Na+ and hydroxide anions OH−.
Sodium hydroxide is a highly caustic base and alkali that decomposes proteins at ordinary ambient temperatures and may cause severe chemical burns. It is highly soluble in water, and readily absorbs moisture and carbon dioxide from the air. It forms a series of hydrates NaOH·nH2O.[11] The monohydrate NaOH·H2O crystallizes from water solutions between 12.3 and 61.8 °C. The commercially available «sodium hydroxide» is often this monohydrate, and published data may refer to it instead of the anhydrous compound.
As one of the simplest hydroxides, sodium hydroxide is frequently used alongside neutral water and acidic hydrochloric acid to demonstrate the pH scale to chemistry students.[12]
Sodium hydroxide is used in many industries: in the manufacture of pulp and paper, textiles, drinking water, soaps and detergents, and as a drain cleaner. Worldwide production in 2004 was approximately 60 million tons, while demand was 51 million tons.[13]
Properties[edit]
Physical properties[edit]
Pure sodium hydroxide is a colorless crystalline solid that melts at 318 °C (604 °F) without decomposition, and with a boiling point of 1,388 °C (2,530 °F). It is highly soluble in water, with a lower solubility in polar solvents such as ethanol and methanol.[14] NaOH is insoluble in ether and other non-polar solvents.
Similar to the hydration of sulfuric acid, dissolution of solid sodium hydroxide in water is a highly exothermic reaction[15] where a large amount of heat is liberated, posing a threat to safety through the possibility of splashing. The resulting solution is usually colorless and odorless. As with other alkaline solutions, it feels slippery with skin contact due to the process of saponification that occurs between NaOH and natural skin oils.
Viscosity[edit]
Concentrated (50%) aqueous solutions of sodium hydroxide have a characteristic viscosity, 78 mPa·s, that is much greater than that of water (1.0 mPa·s) and near that of olive oil (85 mPa·s) at room temperature. The viscosity of aqueous NaOH, as with any liquid chemical, is inversely related to its service temperature, i.e., its viscosity decreases as temperature increases, and vice versa. The viscosity of sodium hydroxide solutions plays a direct role in its application as well as its storage.[14]
Hydrates[edit]
Sodium hydroxide can form several hydrates NaOH·nH2O, which result in a complex solubility diagram that was described in detail by S. U. Pickering in 1893.[16] The known hydrates and the approximate ranges of temperature and concentration (mass percent of NaOH) of their saturated water solutions are:[11]
- Heptahydrate, NaOH·7H2O: from −28 °C (18.8%) to −24 °C (22.2%).[16]
- Pentahydrate, NaOH·5H2O: from −24 °C (22.2%) to −17.7 (24.8%).[16]
- Tetrahydrate, NaOH·4H2O, α form: from −17.7 (24.8%) to +5.4 °C (32.5%).[16][17]
- Tetrahydrate, NaOH·4H2O, β form: metastable.[16][17]
- Trihemihydrate, NaOH·3.5H2O: from +5.4 °C (32.5%) to +15.38 °C (38.8%) and then to +5.0 °C (45.7%).[16][11]
- Trihydrate, NaOH·3H2O: metastable.[16]
- Dihydrate, NaOH·2H2O: from +5.0 °C (45.7%) to +12.3 °C (51%).[16][11]
- Monohydrate, NaOH·H2O: from +12.3 °C (51%) to 65.10 °C (69%) then to 62.63 °C (73.1%).[16][18]
Early reports refer to hydrates with n = 0.5 or n = 2/3, but later careful investigations failed to confirm their existence.[18]
The only hydrates with stable melting points are NaOH·H2O (65.10 °C) and NaOH·3.5H2O (15.38 °C). The other hydrates, except the metastable ones NaOH·3H2O and NaOH·4H2O (β) can be crystallized from solutions of the proper composition, as listed above. However, solutions of NaOH can be easily supercooled by many degrees, which allows the formation of hydrates (including the metastable ones) from solutions with different concentrations.[11][18]
For example, when a solution of NaOH and water with 1:2 mole ratio (52.6% NaOH by mass) is cooled, the monohydrate normally starts to crystallize (at about 22 °C) before the dihydrate. However, the solution can easily be supercooled down to −15 °C, at which point it may quickly crystallize as the dihydrate. When heated, the solid dihydrate might melt directly into a solution at 13.35 °C; however, once the temperature exceeds 12.58 °C. it often decomposes into solid monohydrate and a liquid solution. Even the n = 3.5 hydrate is difficult to crystallize, because the solution supercools so much that other hydrates become more stable.[11]
A hot water solution containing 73.1% (mass) of NaOH is a eutectic that solidifies at about 62.63 °C as an intimate mix of anhydrous and monohydrate crystals.[19][18]
A second stable eutectic composition is 45.4% (mass) of NaOH, that solidifies at about 4.9 °C into a mixture of crystals of the dihydrate and of the 3.5-hydrate.[11]
The third stable eutectic has 18.4% (mass) of NaOH. It solidifies at about −28.7 °C as a mixture of water ice and the heptahydrate NaOH·7H2O.[16][20]
When solutions with less than 18.4% NaOH are cooled, water ice crystallizes first, leaving the NaOH in solution.[16]
The α form of the tetrahydrate has density 1.33 g/cm3. It melts congruously at 7.55 °C into a liquid with 35.7% NaOH and density 1.392 g/cm3, and therefore floats on it like ice on water. However, at about 4.9 °C it may instead melt incongruously into a mixture of solid NaOH·3.5H2O and a liquid solution.[17]
The β form of the tetrahydrate is metastable, and often transforms spontaneously to the α form when cooled below −20 °C.[17] Once initiated, the exothermic transformation is complete in a few minutes, with a 6.5% increase in volume of the solid. The β form can be crystallized from supercooled solutions at −26 °C, and melts partially at −1.83 °C.[17]
The «sodium hydroxide» of commerce is often the monohydrate (density 1.829 g/cm3). Physical data in technical literature may refer to this form, rather than the anhydrous compound.
Crystal structure[edit]
NaOH and its monohydrate form orthorhombic crystals with the space groups Cmcm (oS8) and Pbca (oP24), respectively. The monohydrate cell dimensions are a = 1.1825, b = 0.6213, c = 0.6069 nm. The atoms are arranged in a hydrargillite-like layer structure, with each sodium atom surrounded by six oxygen atoms, three each from hydroxide ions and three from water molecules. The hydrogen atoms of the hydroxyls form strong bonds with oxygen atoms within each O layer. Adjacent O layers are held together by hydrogen bonds between water molecules.[21]
Chemical properties[edit]
Reaction with acids[edit]
Sodium hydroxide reacts with protic acids to produce water and the corresponding salts. For example, when sodium hydroxide reacts with hydrochloric acid, sodium chloride is formed:
- NaOH(aq) + HCl(aq) → NaCl(aq) + H2O(l)
In general, such neutralization reactions are represented by one simple net ionic equation:
- OH−(aq) + H+(aq) → H2O(l)
This type of reaction with a strong acid releases heat, and hence is exothermic. Such acid–base reactions can also be used for titrations. However, sodium hydroxide is not used as a primary standard because it is hygroscopic and absorbs carbon dioxide from air.
Reaction with acidic oxides[edit]
Sodium hydroxide also reacts with acidic oxides, such as sulfur dioxide. Such reactions are often used to «scrub» harmful acidic gases (like SO2 and H2S) produced in the burning of coal and thus prevent their release into the atmosphere. For example,
- 2 NaOH + SO2 → Na2SO3 + H2O
Reaction with metals and oxides[edit]
Glass reacts slowly with aqueous sodium hydroxide solutions at ambient temperatures to form soluble silicates. Because of this, glass joints and stopcocks exposed to sodium hydroxide have a tendency to «freeze». Flasks and glass-lined chemical reactors are damaged by long exposure to hot sodium hydroxide, which also frosts the glass. Sodium hydroxide does not attack iron at room temperatures, since iron does not have amphoteric properties (i.e., it only dissolves in acid, not base).
Nevertheless, at high temperatures (e.g. above 500 °C), iron can react endothermically with sodium hydroxide to form iron(III) oxide, sodium metal, and hydrogen gas.[22] This is due to the lower enthalpy of formation of iron(III) oxide (−824.2 kJ/mol) compared to sodium hydroxide (-500 kJ/mol) and positive entropy change of reaction, which imply spontaneity at high temperatures (ΔST > ΔH, ΔG < 0) and non-spontaneity at low temperatures (ΔST < ΔH, ΔG > 0). Consider the following reaction between molten sodium hydroxide and finely divided iron filings:
- 4 Fe + 6 NaOH → 2 Fe2O3 + 6 Na + 3 H2
A few transition metals, however, may react vigorously with sodium hydroxide under milder conditions.
In 1986, an aluminium road tanker in the UK was mistakenly used to transport 25% sodium hydroxide solution,[23] causing pressurization of the contents and damage to the tanker. The pressurization was due to the hydrogen gas which is produced in the reaction between sodium hydroxide and aluminium:
- 2 Al + 2 NaOH + 6 H2O → 2 Na[Al(OH)4] + 3 H2
Precipitant[edit]
Unlike sodium hydroxide, which is soluble, the hydroxides of most transition metals are insoluble, and therefore sodium hydroxide can be used to precipitate transition metal hydroxides. The following colours are observed:
- Copper — blue
- Iron(II) — green
- Iron(III) — yellow / brown
Zinc and lead salts dissolve in excess sodium hydroxide to give a clear solution of Na2ZnO2 or Na2PbO2.
Aluminium hydroxide is used as a gelatinous flocculant to filter out particulate matter in water treatment. Aluminium hydroxide is prepared at the treatment plant from aluminium sulfate by reacting it with sodium hydroxide or bicarbonate.
- Al2(SO4)3 + 6 NaOH → 2 Al(OH)3 + 3 Na2SO4
- Al2(SO4)3 + 6 NaHCO3 → 2 Al(OH)3 + 3 Na2SO4 + 6 CO2
Saponification[edit]
Sodium hydroxide can be used for the base-driven hydrolysis of esters (as in saponification), amides and alkyl halides.[14] However, the limited solubility of sodium hydroxide in organic solvents means that the more soluble potassium hydroxide (KOH) is often preferred. Touching a sodium hydroxide solution with bare hands, while not recommended, produces a slippery feeling. This happens because oils on the skin such as sebum are converted to soap.
Despite solubility in propylene glycol it is unlikely to replace water in saponification due to propylene glycol’s primary reaction with fat before reaction between sodium hydroxide and fat.
| Mass fraction of NaOH (wt%) | 4 | 10 | 20 | 30 | 40 | 50 |
|---|---|---|---|---|---|---|
| Molar concentration of NaOH (M) | 1.04 | 2.77 | 6.09 | 9.95 | 14.30 | 19.05 |
| Mass concentration of NaOH (g/L) | 41.7 | 110.9 | 243.8 | 398.3 | 572.0 | 762.2 |
| Density of solution (g/mL) | 1.043 | 1.109 | 1.219 | 1.328 | 1.430 | 1.524 |
Production[edit]
Sodium hydroxide is industrially produced as a 50% solution by variations of the electrolytic chloralkali process.[24] Chlorine gas is also produced in this process.[24] Solid sodium hydroxide is obtained from this solution by the evaporation of water. Solid sodium hydroxide is most commonly sold as flakes, prills, and cast blocks.[13]
In 2004, world production was estimated at 60 million dry tonnes of sodium hydroxide, and demand was estimated at 51 million tonnes.[13] In 1998, total world production was around 45 million tonnes. North America and Asia each contributed around 14 million tonnes, while Europe produced around 10 million tonnes. In the United States, the major producer of sodium hydroxide is Olin, which has annual production around 5.7 million tonnes from sites at Freeport, Texas, and Plaquemine, Louisiana, St Gabriel, Louisiana, McIntosh, Alabama, Charleston, Tennessee, Niagara Falls, New York, and Becancour, Canada. Other major US producers include Oxychem, Westlake, Shintek and Formosa. All of these companies use the chloralkali process.[25]
Historically, sodium hydroxide was produced by treating sodium carbonate with calcium hydroxide in a metathesis reaction which takes advantage of the fact that sodium hydroxide is soluble, while calcium carbonate is not. This process was called causticizing.[26]
- Ca(OH)2(aq) + Na2CO3(s) → CaCO3(s) + 2 NaOH(aq)
This process was superseded by the Solvay process in the late 19th century, which was in turn supplanted by the Leblanc process and then chloralkali process which is in use today.
Sodium hydroxide is also produced by combining pure sodium metal with water. The byproducts are hydrogen gas and heat, often resulting in a flame.
- 2 Na(s) + 2 H2O(l) → 2 NaOH(aq) + H2
This reaction is commonly used for demonstrating the reactivity of alkali metals in academic environments; however, it is not commercially viable, as the isolation of sodium metal is typically performed by reduction or electrolysis of sodium compounds including sodium hydroxide.
Uses[edit]
Sodium hydroxide is a popular strong base used in industry. Sodium hydroxide is used in the manufacture of sodium salts and detergents, pH regulation, and organic synthesis. In bulk, it is most often handled as an aqueous solution,[27] since solutions are cheaper and easier to handle.
Sodium hydroxide is used in many scenarios where it is desirable to increase the alkalinity of a mixture, or to neutralize acids.
For example, in the petroleum industry, sodium hydroxide is used as an additive in drilling mud to increase alkalinity in bentonite mud systems, to increase the mud viscosity, and to neutralize any acid gas (such as hydrogen sulfide and carbon dioxide) which may be encountered in the geological formation as drilling progresses.
Another use is in Salt spray testing where pH needs to be regulated. Sodium hydroxide is used with hydrochloric acid to balance pH. The resultant salt, NaCl, is the corrosive agent used in the standard neutral pH salt spray test.
Poor quality crude oil can be treated with sodium hydroxide to remove sulfurous impurities in a process known as caustic washing. As above, sodium hydroxide reacts with weak acids such as hydrogen sulfide and mercaptans to yield non-volatile sodium salts, which can be removed. The waste which is formed is toxic and difficult to deal with, and the process is banned in many countries because of this. In 2006, Trafigura used the process and then dumped the waste in Ivory Coast.[28][29]
Other common uses of sodium hydroxide include:
- for making soaps and detergents. Sodium hydroxide is used for hard bar soap, while potassium hydroxide is used for liquid soaps.[30][31] Sodium hydroxide is used more often than potassium hydroxide because it is cheaper and a smaller quantity is needed.
- as drain cleaners that contain sodium hydroxide convert fats and grease that can clog pipes into soap, which dissolves in water (see cleaning agent).
- for making artificial textile fibres (such as Rayon).
- in the manufacture of paper. Around 56% of sodium hydroxide produced is used by industry, 25% of which is used in the paper industry (see chemical pulping).
- in purifying bauxite ore from which aluminium metal is extracted. This is known as Bayer process (see dissolving amphoteric metals and compounds).
- in de-greasing metals, oil refining, and making dyes and bleaches.
- in water treatment plants for pH regulation.
- to treat bagels and pretzel dough, giving the distinctive shiny finish.
Chemical pulping[edit]
Sodium hydroxide is also widely used in pulping of wood for making paper or regenerated fibers. Along with sodium sulfide, sodium hydroxide is a key component of the white liquor solution used to separate lignin from cellulose fibers in the kraft process. It also plays a key role in several later stages of the process of bleaching the brown pulp resulting from the pulping process. These stages include oxygen delignification, oxidative extraction, and simple extraction, all of which require a strong alkaline environment with a pH > 10.5 at the end of the stages.
Tissue digestion[edit]
In a similar fashion, sodium hydroxide is used to digest tissues, as in a process that was used with farm animals at one time. This process involved placing a carcass into a sealed chamber, then adding a mixture of sodium hydroxide and water (which breaks the chemical bonds that keep the flesh intact). This eventually turns the body into a liquid with a dark brown color,[32][33] and the only solids that remain are bone hulls, which can be crushed between one’s fingertips.[34]
Sodium hydroxide is frequently used in the process of decomposing roadkill dumped in landfills by animal disposal contractors.[33] Due to its availability and low cost, it has been used by criminals to dispose of corpses. Italian serial killer Leonarda Cianciulli used this chemical to turn dead bodies into soap.[35] In Mexico, a man who worked for drug cartels admitted disposing of over 300 bodies with it.[36]
Sodium hydroxide is a dangerous chemical due to its ability to hydrolyze protein. If a dilute solution is spilled on the skin, burns may result if the area is not washed thoroughly and for several minutes with running water. Splashes in the eye can be more serious and can lead to blindness.[37]
Dissolving amphoteric metals and compounds[edit]
Strong bases attack aluminium. Sodium hydroxide reacts with aluminium and water to release hydrogen gas. The aluminium takes the oxygen atom from sodium hydroxide, which in turn takes the oxygen atom from the water, and releases the two hydrogen atoms. The reaction thus produces hydrogen gas and sodium aluminate. In this reaction, sodium hydroxide acts as an agent to make the solution alkaline, which aluminium can dissolve in.
- 2 Al + 2 NaOH + 2 H2O → 2 NaAlO2 + 3 H2
Sodium aluminate is an inorganic chemical that is used as an effective source of aluminium hydroxide for many industrial and technical applications. Pure sodium aluminate (anhydrous) is a white crystalline solid having a formula variously given as NaAlO2, Na3AlO3, Na[Al(OH)4], Na2O·Al2O3 or Na2Al2O4. Formation of sodium tetrahydroxoaluminate(III) or hydrated sodium aluminate is given by:[38]
- 2 Al + 2 NaOH + 6 H2O → 2 Na[Al(OH)4] + 3 H2
This reaction can be useful in etching, removing anodizing, or converting a polished surface to a satin-like finish, but without further passivation such as anodizing or alodining the surface may become degraded, either under normal use or in severe atmospheric conditions.
In the Bayer process, sodium hydroxide is used in the refining of alumina containing ores (bauxite) to produce alumina (aluminium oxide) which is the raw material used to produce aluminium metal via the electrolytic Hall-Héroult process. Since the alumina is amphoteric, it dissolves in the sodium hydroxide, leaving impurities less soluble at high pH such as iron oxides behind in the form of a highly alkaline red mud.
Other amphoteric metals are zinc and lead which dissolve in concentrated sodium hydroxide solutions to give sodium zincate and sodium plumbate respectively.
Esterification and transesterification reagent[edit]
Sodium hydroxide is traditionally used in soap making (cold process soap, saponification).[39] It was made in the nineteenth century for a hard surface rather than liquid product because it was easier to store and transport.
For the manufacture of biodiesel, sodium hydroxide is used as a catalyst for the transesterification of methanol and triglycerides. This only works with anhydrous sodium hydroxide, because combined with water the fat would turn into soap, which would be tainted with methanol. NaOH is used more often than potassium hydroxide because it is cheaper and a smaller quantity is needed. Due to production costs, NaOH, which is produced using common salt is cheaper than potassium hydroxide.[40]
Food preparation[edit]
Food uses of sodium hydroxide include washing or chemical peeling of fruits and vegetables, chocolate and cocoa processing, caramel coloring production, poultry scalding, soft drink processing, and thickening ice cream.[41] Olives are often soaked in sodium hydroxide for softening; Pretzels and German lye rolls are glazed with a sodium hydroxide solution before baking to make them crisp. Owing to the difficulty in obtaining food grade sodium hydroxide in small quantities for home use, sodium carbonate is often used in place of sodium hydroxide.[42] It is known as E number E524.
Specific foods processed with sodium hydroxide include:
- German pretzels are poached in a boiling sodium carbonate solution or cold sodium hydroxide solution before baking, which contributes to their unique crust.
- Lye-water is an essential ingredient in the crust of the traditional baked Chinese moon cakes.
- Most yellow coloured Chinese noodles are made with lye-water but are commonly mistaken for containing egg.
- One variety of zongzi uses lye water to impart a sweet flavor.
- Sodium hydroxide is also the chemical that causes gelling of egg whites in the production of Century eggs.
- Some methods of preparing olives involve subjecting them to a lye-based brine.[43]
- The Filipino dessert (Filipino: kakanin) called kutsinta uses a small quantity of lye water to help give the rice flour batter a jelly like consistency. A similar process is also used in the kakanin known as pitsi-pitsi or pichi-pichi except that the mixture uses grated cassava instead of rice flour.
- The Norwegian dish known as lutefisk (Norwegian: lutfisk, lit. ‘lye fish’).
- Bagels are often boiled in a lye solution before baking, contributing to their shiny crust.
- Hominy is dried maize (corn) kernels reconstituted by soaking in lye-water. These expand considerably in size and may be further processed by frying to make corn nuts or by drying and grinding to make grits. Hominy is used to create Masa, a popular flour used in Mexican cuisine to make Corn tortillas and tamales. Nixtamal is similar, but uses calcium hydroxide instead of sodium hydroxide.
Cleaning agent[edit]
Sodium hydroxide is frequently used as an industrial cleaning agent where it is often called «caustic». It is added to water, heated, and then used to clean process equipment, storage tanks, etc. It can dissolve grease, oils, fats and protein-based deposits. It is also used for cleaning waste discharge pipes under sinks and drains in domestic properties. Surfactants can be added to the sodium hydroxide solution in order to stabilize dissolved substances and thus prevent redeposition. A sodium hydroxide soak solution is used as a powerful degreaser on stainless steel and glass bakeware. It is also a common ingredient in oven cleaners.
A common use of sodium hydroxide is in the production of parts washer detergents. Parts washer detergents based on sodium hydroxide are some of the most aggressive parts washer cleaning chemicals. The sodium hydroxide-based detergents include surfactants, rust inhibitors and defoamers. A parts washer heats water and the detergent in a closed cabinet and then sprays the heated sodium hydroxide and hot water at pressure against dirty parts for degreasing applications. Sodium hydroxide used in this manner replaced many solvent-based systems in the early 1990s[citation needed] when trichloroethane was outlawed by the Montreal Protocol. Water and sodium hydroxide detergent-based parts washers are considered to be an environmental improvement over the solvent-based cleaning methods.
Paint stripping with caustic soda
Sodium hydroxide is used in the home as a type of drain opener to unblock clogged drains, usually in the form of a dry crystal or as a thick liquid gel. The alkali dissolves greases to produce water soluble products. It also hydrolyzes proteins, such as those found in hair, which may block water pipes. These reactions are sped by the heat generated when sodium hydroxide and the other chemical components of the cleaner dissolve in water. Such alkaline drain cleaners and their acidic versions are highly corrosive and should be handled with great caution.
Relaxer[edit]
Sodium hydroxide is used in some relaxers to straighten hair. However, because of the high incidence and intensity of chemical burns, manufacturers of chemical relaxers use other alkaline chemicals in preparations available to consumers. Sodium hydroxide relaxers are still available, but they are used mostly by professionals.
Paint stripper[edit]
A solution of sodium hydroxide in water was traditionally used as the most common paint stripper on wooden objects. Its use has become less common, because it can damage the wood surface, raising the grain and staining the colour.
Water treatment[edit]
Sodium hydroxide is sometimes used during water purification to raise the pH of water supplies. Increased pH makes the water less corrosive to plumbing and reduces the amount of lead, copper and other toxic metals that can dissolve into drinking water.[44][45]
Historical uses[edit]
Sodium hydroxide has been used for detection of carbon monoxide poisoning, with blood samples of such patients turning to a vermilion color upon the addition of a few drops of sodium hydroxide.[46] Today, carbon monoxide poisoning can be detected by CO oximetry.
In cement mixes, mortars, concrete, grouts[edit]
Sodium hydroxide is used in some cement mix plasticisers. This helps homogenise cement mixes, preventing segregation of sands and cement, decreases the amount of water required in a mix and increases workability of the cement product, be it mortar, render or concrete.
Experimental[edit]
Flavonoids[edit]
See: Sodium hydroxide test for flavonoids
Summer-winter heat storage[edit]
After decades of research,[47][48] EMPA researchers and others[49][50] are experimenting with concentrated sodium hydroxide (NaOH) as the thermal storage or seasonal reservoir medium for power plants and domestic space-heating. If water is added to solid or concentrated sodium hydroxide (NaOH), heat is released. The dilution is exothermic – chemical energy is released in the form of heat. Conversely, by applying heat energy into a dilute sodium hydroxide solution the water will evaporate so that the solution becomes more concentrated and thus stores the supplied heat as latent chemical energy.[51]
Neutron moderator[edit]
Seaborg Technologies is working on a reactor design in which NaOH is used as a neutron moderator,[52]
Safety[edit]
Chemical burns caused by sodium hydroxide solution photographed 44 hours after exposure.
Like other corrosive acids and alkalis, drops of sodium hydroxide solutions can readily decompose proteins and lipids in living tissues via amide hydrolysis and ester hydrolysis, which consequently cause chemical burns and may induce permanent blindness upon contact with eyes.[1][2] Solid alkali can also express its corrosive nature if there is water, such as water vapor. Thus, protective equipment, like rubber gloves, safety clothing and eye protection, should always be used when handling this chemical or its solutions. The standard first aid measures for alkali spills on the skin is, as for other corrosives, irrigation with large quantities of water. Washing is continued for at least ten to fifteen minutes.
Moreover, dissolution of sodium hydroxide is highly exothermic, and the resulting heat may cause heat burns or ignite flammables. It also produces heat when reacted with acids.
Sodium hydroxide is also mildly corrosive to glass, which can cause damage to glazing or cause ground glass joints to bind.[53] Sodium hydroxide is corrosive to several metals, like aluminium which reacts with the alkali to produce flammable hydrogen gas on contact.[54]
Storage[edit]
Two industrial fiberglass barrels of caustic-soda
Careful storage is needed when handling sodium hydroxide for use, especially bulk volumes. Following proper NaOH storage guidelines and maintaining worker/environment safety is always recommended given the chemical’s burn hazard.
Sodium hydroxide is often stored in bottles for small-scale laboratory use, within intermediate bulk containers (medium volume containers) for cargo handling and transport, or within large stationary storage tanks with volumes up to 100,000 gallons for manufacturing or waste water plants with extensive NaOH use. Common materials that are compatible with sodium hydroxide and often utilized for NaOH storage include: polyethylene (HDPE, usual, XLPE, less common), carbon steel, polyvinyl chloride (PVC), stainless steel, and fiberglass reinforced plastic (FRP, with a resistant liner).[14]
Sodium hydroxide must be stored in airtight containers to preserve its normality as it will absorb water from the atmosphere.
History[edit]
Sodium hydroxide was first prepared by soap makers.[55]: p45 A procedure for making sodium hydroxide appeared as part of a recipe for making soap in an Arab book of the late 13th century: Al-mukhtara’ fi funun min al-suna’ (Inventions from the Various Industrial Arts), which was compiled by al-Muzaffar Yusuf ibn ‘Umar ibn ‘Ali ibn Rasul (d. 1295), a king of Yemen.[56][57] The recipe called for passing water repeatedly through a mixture of alkali (Arabic: al-qily, where qily is ash from saltwort plants, which are rich in sodium; hence alkali was impure sodium carbonate)[58] and quicklime (calcium oxide, CaO), whereby a solution of sodium hydroxide was obtained. European soap makers also followed this recipe. When in 1791 the French chemist and surgeon Nicolas Leblanc (1742–1806) patented a process for mass-producing sodium carbonate, natural «soda ash» (impure sodium carbonate that was obtained from the ashes of plants that are rich in sodium)[55]: p36 was replaced by this artificial version.[55]: p46 However, by the 20th century, the electrolysis of sodium chloride had become the primary method for producing sodium hydroxide.[59]
See also[edit]
- Acid and base
- HAZMAT Class 8 Corrosive Substances
- List of cleaning agents
References[edit]
- ^ a b c «Material Safety Datasheet» (PDF). certified-lye.com.
- ^ a b c «Material Safety Datasheet 2» (PDF). hillbrothers.com. Archived from the original (PDF) on 2012-08-03. Retrieved 2012-05-20.
- ^ a b «Sodium Hydroxide – Compound Summary». Retrieved June 12, 2012.
- ^ a b c d Haynes, p. 4.90
- ^ Haynes, p. 4.135
- ^ Jacobs, H.; Kockelkorn, J. and Tacke, Th. (1985). «Hydroxide des Natriums, Kaliums und Rubidiums: Einkristallzüchtung und röntgenographische Strukturbestimmung an der bei Raumtemperatur stabilen Modifikation». Z. Anorg. Allg. Chem. 531 (12): 119–124. doi:10.1002/zaac.19855311217.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ Haynes, p. 5.13
- ^ a b c NIOSH Pocket Guide to Chemical Hazards. «#0565». National Institute for Occupational Safety and Health (NIOSH).
- ^ Michael Chambers. «ChemIDplus – 1310-73-2 – HEMHJVSKTPXQMS-UHFFFAOYSA-M – Sodium hydroxide [NF<nowiki»></nowiki»> – Similar structures search, synonyms, formulas, resource links, and other chemical information.»]. nih.gov.
- ^ «Sodium hydroxide». Immediately Dangerous to Life or Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ^ a b c d e f g Siemens, P. R.; Giauque, William F. (1969). «Entropies of the hydrates of sodium hydroxide. II. Low-temperature heat capacities and heats of fusion of NaOH·2H2O and NaOH·3.5H2O». Journal of Physical Chemistry. 73 (1): 149–157. doi:10.1021/j100721a024.
- ^ «Examples of Common Laboratory Chemicals and their Hazard Class». Archived from the original on 2018-01-10. Retrieved 2018-01-09.
- ^ a b c Cetin Kurt, Jürgen Bittner. «Sodium Hydroxide». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a24_345.pub2.
- ^ a b c d «Sodium Hydroxide Storage Tanks & Specifications». Protank. 2018-09-08. Retrieved 2018-11-21.
- ^ «Exothermic vs. Endothermic: Chemistry’s Give and Take». Discovery Express.
- ^ a b c d e f g h i j k Umfreville Pickering, Spencer (1893). «LXI.—The hydrates of sodium, potassium, and lithium hydroxides». Journal of the Chemical Society, Transactions. 63: 890–909. doi:10.1039/CT8936300890.
- ^ a b c d e Mraw, S. C.; Giauque, W. F. (1974). «Entropies of the hydrates of sodium hydroxide. III. Low-temperature heat capacities and heats of fusion of the α and β crystalline forms of sodium hydroxide tetrahydrate». Journal of Physical Chemistry. 78 (17): 1701–1709. doi:10.1021/j100610a005.
- ^ a b c d Murch, L. E.; Giauque, W. F. (1962). «The thermodynamic properties of sodium hydroxide and its monohydrate. Heat capacities to low temperatures. Heats of solution». Journal of Physical Chemistry. 66 (10): 2052–2059. doi:10.1021/j100816a052.
- ^ Brodale, G. E.; Giauque, W. F. (1962). «The freezing point-solubility curve of aqueous sodium hydroxide in the region near the anhydrous-monohydrate eutectic». Journal of Physical Chemistry. 66 (10): 2051. doi:10.1021/j100816a051.
- ^ M. Conde Engineering: «Solid-Liquid Equilibrium (SLE) and Vapour-Liquid Equilibrium (VLE) of Aqueous NaOH». Online report, accessed on 2017-04-29.
- ^ Jacobs, H. and Metzner, U. (1991). «Ungewöhnliche H-Brückenbindungen in Natriumhydroxidmonohydrat: Röntgen- und Neutronenbeugung an NaOH·H<sub»>2</sub»>O bzw. NaOD·D<sub»>2</sub»>O». Zeitschrift für anorganische und allgemeine Chemie. 597 (1): 97–106. doi:10.1002/zaac.19915970113.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ 祖恩, 许 (1992), 钾素,钾肥溯源[J]
- ^ Stamell, Jim (2001), EXCEL HSC Chemistry, Pascal Press, p. 199, ISBN 978-1-74125-299-6
- ^ a b Fengmin Du, David M Warsinger, Tamanna I Urmi, Gregory P Thiel, Amit Kumar, John H Lienhard (2018). «Sodium hydroxide production from seawater desalination brine: process design and energy efficiency». Environmental Science & Technology. 52 (10): 5949–5958. Bibcode:2018EnST…52.5949D. doi:10.1021/acs.est.8b01195. hdl:1721.1/123096. PMID 29669210.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ Kirk-Othmer Encyclopedia of Chemical Technology[permanent dead link], 5th edition, John Wiley & Sons.
- ^ Deming, Horace G. (1925). General Chemistry: An Elementary Survey Emphasizing Industrial Applications of Fundamental Principles (2nd ed.). New York: John Wiley & Sons, Inc. p. 452.
- ^ «Document 2 — CausticSodamanual2008.pdf» (PDF). 2013. Archived from the original (PDF) on March 19, 2015. Retrieved July 17, 2014.
- ^ Sample, Ian (16 September 2009). «Trafigura case: toxic slop left behind by caustic washing». The Guardian. Retrieved 2009-09-17.
- ^ «Trafigura knew of waste dangers». BBC Newsnight. 16 September 2009. Retrieved 2009-09-17.
- ^ «A Guide to Caustic Chemicals Used in Soap Making | Brenntag». www.brenntag.com. Retrieved 2020-10-03.
- ^ «Sodium Hydroxide | Uses, Benefits, and Chemical Safety Facts». ChemicalSafetyFacts.org. 2016-09-06. Retrieved 2020-10-03.
- ^ Ayres, Chris (27 February 2010) Clean green finish that sends a loved one down the drain Times Online. Retrieved 2013-02-20.
- ^ a b Thacker, H. Leon; Kastner, Justin (August 2004). Carcass Disposal: A Comprehensive Review. Chapter 6. National Agricultural Biosecurity Center, Kansas State University, 2004. Retrieved 2010-03-08
- ^ Roach, Mary (2004). Stiff: The Curious Lives of Human Cadavers, New York: W.W. Norton & Company. ISBN 0-393-32482-6.
- ^ «Sodium:Getting rid of dirt – and murder victims». BBC News. 3 May 2014.
- ^ William Booth (January 27, 2009). «‘Stewmaker’ Stirs Horror in Mexico». Washington Post.
- ^ «ATSDR – Medical Management Guidelines (MMGs): Sodium Hydroxide». www.atsdr.cdc.gov.
- ^ PubChem. «Aluminium sodium tetrahydroxide». pubchem.ncbi.nlm.nih.gov. Retrieved 2020-10-03.
- ^ Morfit, Campbell (1856). A treatise on chemistry applied to the manufacture of soap and candles. Parry and McMillan.
- ^ «Side by Side Comparison: Potassium Hydroxide and Sodium Hydroxide — Similarities, Differences and Use Cases». info.noahtech.com. Retrieved 2020-10-03.
- ^ «Sodium Hydroxide». rsc.org. 2014. Retrieved November 9, 2014.
- ^ «Hominy without Lye». National Center for Home Food Preservation.
- ^ «Olives: Safe Methods for Home Pickling (application/pdf Object)» (PDF). ucanr.org. 2010. Retrieved January 22, 2012.
- ^ «Drinking Water Treatment – pH Adjustment». 2011. Archived from the original on August 10, 2018. Retrieved June 23, 2016.
- ^ Brian Oram, PG (2014). «Drinking Water Issues Corrosive Water (Lead, Copper, Aluminum, Zinc and More)». Retrieved June 23, 2016.
- ^ Page 168 in: The Detection of poisons and strong drugs.
Author: Wilhelm Autenrieth.
Publisher: P. Blakiston’s son & Company, 1909. - ^ Turner, R. H.; Truscello, V. C. (1 January 1977). «Large-scale thermal energy storage using sodium hydroxide /NaOH/». International Solar Energy Society. Bibcode:1977ises.meet…18T.
- ^ Weber, R (2010). «Long-Term Heat Storage with NaOH» (PDF).
- ^ «The Water Network | by AquaSPE». thewaternetwork.com.
- ^ «Energy storage in residual salt will help Hyme outflank competitors». energywatch.com. 20 January 2022.
- ^ «Empa – 604 – Communication – NaOH-heat-storage». www.empa.ch.
- ^ «Seaborg completes experiments to optimise its molten salt reactor design — Nuclear Engineering International». www.neimagazine.com.
- ^ Pubchem. «SODIUM HYDROXIDE | NaOH – PubChem». pubchem.ncbi.nlm.nih.gov. Retrieved 2016-09-04.
- ^ «aluminium_water_hydrogen.pdf (application/pdf Object)» (PDF). www1.eere.energy.gov. 2008. Archived from the original (PDF) on September 14, 2012. Retrieved January 15, 2013.
- ^ a b c Thorpe, Thomas Edward, ed., A Dictionary of Applied Chemistry (London, England: Longmans, Green, and Co., 1913), vol. 5, [1]
- ^ See: History of Science and Technology in Islam: Description of Soap Making
- ^ The English chemist and archaeologist Henry Ernest Stapleton (1878–1962) presented evidence that the Persian alchemist and physician Muhammad ibn Zakariya al-Razi (c. 865–925) knew about sodium hydroxide. See {{cite journal
Bibliography[edit]
- Haynes, William M., ed. (2011). CRC Handbook of Chemistry and Physics (92nd ed.). CRC Press. ISBN 978-1439855119.
External links[edit]
- International Chemical Safety Card 0360
- Euro Chlor-How is chlorine made? Chlorine Online
- NIOSH Pocket Guide to Chemical Hazards
- CDC – Sodium Hydroxide – NIOSH Workplace Safety and Health Topic
- Production by brine electrolysis
- Data sheets
- Technical charts (page 33—41) for enthalpy, temperature and pressure
- Sodium Hydroxide MSDS
- Certified Lye MSDS
- Hill Brothers MSDS
- Titration of acids with sodium hydroxide; freeware for data analysis, simulation of curves and pH calculation
- Caustic soda production in continuous causticising plant by lime soda process
Как правильно пишется словосочетание «едкий натр»
- Как правильно пишется слово «едкий»
- Как правильно пишется слово «натереть»
Делаем Карту слов лучше вместе
Привет! Меня зовут Лампобот, я компьютерная программа, которая помогает делать
Карту слов. Я отлично
умею считать, но пока плохо понимаю, как устроен ваш мир. Помоги мне разобраться!
Спасибо! Я стал чуточку лучше понимать мир эмоций.
Вопрос: грядущий — это что-то нейтральное, положительное или отрицательное?
Ассоциации к слову «едкий»
Ассоциации к слову «натереть»
Синонимы к словосочетанию «едкий натр»
Предложения со словосочетанием «едкий натр»
- Едкий натр химически взаимодействует с различными белковыми веществами кожи, способствуя тем самым более глубокому и быстрому проникновению внутрь кожи.
- Едкий натр фонтаном врывался в баллон и вытекал из него по особой стеклянной трубочке.
- Органические примеси определяют с помощью 3 %-ного водного раствора едкого натра: обрабатывают навеску песка этим раствором в соотношении 1: 1 (по массе) и дают отстояться сутки.
- (все предложения)
Значение словосочетания «едкий натр»
-
Едкий натр (хим., тех.) — гидрат окиси натрия, то же, что каустическая сода. См. также натр. (Толковый словарь Ушакова)
Все значения словосочетания ЕДКИЙ НАТР
Афоризмы русских писателей со словом «едкий»
- Не бойся едких осуждений,
Но упоительных похвал… - О, будь мой верный талисман!
Храни меня от тяжких ран
И света, и толпы ничтожной,
От едкой жажды славы ложной.
От обольстительной мечты
И от душевной пустоты. - Пройдемте по миру, как дети,
Полюбим шуршанье осок,
И терпкость прошедших столетий,
И едкого знания сок. - (все афоризмы русских писателей)
Отправить комментарий
Дополнительно
На букву Е Со слова «едкий»
Фраза «едкий натр»
Фраза состоит из двух слов и 9 букв без пробелов.
- Синонимы к фразе
- Написание фразы наоборот
- Написание фразы в транслите
- Написание фразы шрифтом Брайля
- Передача фразы на азбуке Морзе
- Произношение фразы на дактильной азбуке
- Остальные фразы со слова «едкий»
- Остальные фразы из 2 слов

Получение сильной щёлочи. Едкий натрий для восстановления золота.

???? Насколько ОПАСНО для человека СРЕДСТВО ДЛЯ ЧИСТКИ ТРУБ и ЩЕЛОЧЬ? Техника безопасности важна!

20190722 Засыпаем Едкий Натр Каустическую соду Каустик в Септик Выгребную яму

Как сделать NaOH (гидроксид натрия)?

Едкий натр чистит канализацию — инструкция
Экстримальный восстановитель
Синонимы к фразе «едкий натр»
Какие близкие по смыслу слова и фразы, а также похожие выражения существуют. Как можно написать по-другому или сказать другими словами.
Фразы
- + азотнокислое серебро −
- + алюминиевая пудра −
- + аммиачная селитра −
- + ароматические углеводороды −
- + бесцветный газ −
- + бриллиантовый зелёный −
- + водные растворы −
- + вредные примеси −
- + газообразные вещества −
- + едкая щёлочь −
- + едкий натр −
- + едкое кали −
- + железный купорос −
- + закись железа −
- + известковое молоко −
- + ионообменные смолы −
- + каустическая сода −
- + красный фосфор −
- + окись этилена −
- + оксид кальция −
- + органические растворители −
- + поливиниловый спирт −
- + способный растворять −
- + хлорат калия −
Ваш синоним добавлен!
Написание фразы «едкий натр» наоборот
Как эта фраза пишется в обратной последовательности.
ртан йикде 😀
Написание фразы «едкий натр» в транслите
Как эта фраза пишется в транслитерации.
в армянской🇦🇲 եդկիյ նատր
в грузинской🇬🇪 ედკი ნათრ
в еврейской🇮🇱 אדכיי נאטר
в латинской🇬🇧 yedky natr
Как эта фраза пишется в пьюникоде — Punycode, ACE-последовательность IDN
xn--d1abked xn--80azkh
Как эта фраза пишется в английской Qwerty-раскладке клавиатуры.
tlrbqyfnh
Написание фразы «едкий натр» шрифтом Брайля
Как эта фраза пишется рельефно-точечным тактильным шрифтом.
⠑⠙⠅⠊⠯⠀⠝⠁⠞⠗
Передача фразы «едкий натр» на азбуке Морзе
Как эта фраза передаётся на морзянке.
⋅ – ⋅ ⋅ – ⋅ – ⋅ ⋅ ⋅ – – – – ⋅ ⋅ – – ⋅ – ⋅
Произношение фразы «едкий натр» на дактильной азбуке
Как эта фраза произносится на ручной азбуке глухонемых (но не на языке жестов).
Передача фразы «едкий натр» семафорной азбукой
Как эта фраза передаётся флажковой сигнализацией.
Остальные фразы со слова «едкий»
Какие ещё фразы начинаются с этого слова.
- едкий белый дым
- едкий взгляд
- едкий воздух
- едкий газ
- едкий густой дым
- едкий дым
- едкий дым костра
- едкий дымок
- едкий запах
- едкий запах дыма
- едкий кали
- едкий ответ
- едкий пар
- едкий пороховой дым
- едкий пот
- едкий привкус
- едкий раствор
- едкий сарказм
- едкий сигаретный дым
- едкий сизый дым
- едкий смешок
- едкий смог
- едкий смрад
- едкий сок
Ваша фраза добавлена!
Остальные фразы из 2 слов
Какие ещё фразы состоят из такого же количества слов.
- а вдобавок
- а вдруг
- а ведь
- а вот
- а если
- а ещё
- а именно
- а капелла
- а каторга
- а ну-ка
- а приятно
- а также
- а там
- а то
- аа говорит
- аа отвечает
- аа рассказывает
- ааронов жезл
- аароново благословение
- аароново согласие
- аб ово
- абажур лампы
- абазинская аристократия
- абазинская литература
Комментарии

18:14
Что значит фраза «едкий натр»? Как это понять?..
Ответить

09:29

×
Здравствуйте!
У вас есть вопрос или вам нужна помощь?
Спасибо, ваш вопрос принят.
Ответ на него появится на сайте в ближайшее время.
А Б В Г Д Е Ё Ж З И Й К Л М Н О П Р С Т У Ф Х Ц Ч Ш Щ Ъ Ы Ь Э Ю Я
Транслит Пьюникод Шрифт Брайля Азбука Морзе Дактильная азбука Семафорная азбука
Палиндромы Сантана

Народный словарь великого и могучего живого великорусского языка.
Онлайн-словарь слов и выражений русского языка. Ассоциации к словам, синонимы слов, сочетаемость фраз. Морфологический разбор: склонение существительных и прилагательных, а также спряжение глаголов. Морфемный разбор по составу словоформ.
По всем вопросам просьба обращаться в письмошную.
Физические свойства
Гидроксид натрия (едкий натр) NaOH — белый, гигроскопичный, плавится и кипит без разложения. Хорошо растворяется в воде.
Относительная молекулярная масса Mr = 40; относительная плотность для тв. и ж. состояния d = 2,130; tпл = 321º C; tкип = 1390º C;
Способы получения
1. Гидроксид натрия получают электролизом раствора хлорида натрия:
2NaCl + 2H2O → 2NaOH + H2 + Cl2
2. При взаимодействии натрия, оксида натрия, гидрида натрия и пероксида натрия с водой также образуется гидроксид натрия:
2Na + 2H2O → 2NaOH + H2
Na2O + H2O → 2NaOH
2NaH + 2H2O → 2NaOH + H2
Na2O2 + H2O → 2NaOH + H2O2
3. Карбонат натрия при взаимодействии с гидроксидом кальция образует гидроксид натрия:
Na2CO3 + Ca(OH)2 → CaCO3↓ + 2NaOH
Качественная реакция
Качественная реакция на гидроксид натрия — окрашивание фенолфталеина в малиновый цвет.
Химические свойства
1. Гидроксид натрия реагируют со всеми кислотами (и сильными, и слабыми, и растворимыми, и нерастворимыми). При этом образуются средние или кислые соли, в зависимости от соотношения реагентов:
3NaOH + H3PO4 → Na3PO4 + H2O
2NaOH + H3PO4 → Na2HPO4 + 2H2O
NaOH + H3PO4 → NaH2PO4 + H2O
2. Гидроксид натрия реагирует с кислотными оксидами. При этом образуются средние или кислые соли, в зависимости от соотношения реагентов:
2NaOH(избыток) + CO2 → Na2CO3 + H2O
NaOH + CO2 (избыток) → NaHCO3
3. Гидроксид натрия реагирует с амфотерными оксидами и гидроксидами. При этом в расплаве образуются средние соли, а в растворе комплексные соли:
2NaOH + Al2O3 → 2NaAlO2 + H2O
в растворе образуется комплексная соль — тетрагидроксоалюминат:
2NaOH + Al2O3 + 3H2O → 2Na[Al(OH)4]
4. С кислыми солями гидроксид натрия также может взаимодействовать. При этом образуются средние соли, или менее кислые соли:
NaOH + NaHCO3 → Na2CO3 + H2O
5. Гидроксид натрия взаимодействует с простыми веществами-неметаллами (кроме инертных газов, азота, кислорода, водорода и углерода).
При этом кремний окисляется до силиката и водорода:
2NaOH + Si + H2O → Na2SiO3 + H2
Фтор окисляет щелочь. При этом выделяется молекулярный кислород:
4NaOH + 2F2 → 4NaF + O2 (OF2) + 2H2O
Другие галогены, сера и фосфор — диспропорционируют в растворе гидроксида натрия:
3NaOH + P4 + 3H2O = 3NaH2PO2 + PH3↑
2NaOH(холодный) + Cl2 = NaClO + NaCl + H2O
6NaOH(горячий) + 3Cl2 = NaClO3 + 5NaCl + 3H2O
Сера взаимодействует с гидроксидом натрия только при нагревании:
6NaOH + 3S = 2Na2S + Na2SO3 + 3H2O
6. Гидроксид натрия взаимодействует с амфотерными металлами, кроме железа и хрома. При этом в расплаве образуются соль и водород:
2NaOH + Zn → Na2ZnO2 + H2
В растворе образуются комплексная соль и водород:
2NaOH + 2Al + 6Н2О = 2Na[Al(OH)4] + 3Н2
7. Гидроксид натрия вступает в обменные реакции с растворимыми солями.
Хлорид меди (II) реагирует с гидроксидом натрия с образованием хлорида натрия и осадка гидроксида меди (II):
2NaOH + CuCl2 = Cu(OH)2↓+ 2NaCl
Также с гидроксидом натрия взаимодействуют соли аммония.
Например, при взаимодействии хлорида аммония и гидроксида натрия образуются хлорид натрия, аммиак и вода:
NH4Cl + NaOH = NH3 + H2O + NaCl
8. Гидроксид натрия разлагается при нагревании до температуры 600°С:
2NaOH → Na2O + H2O
9. Гидроксид натрия проявляет свойства сильного основания. В воде практически полностью диссоциирует, образуя щелочную среду и меняя окраску индикаторов.
NaOH ↔ Na+ + OH—
10. Гидроксид натрия в расплаве подвергается электролизу. При этом на катоде восстанавливается натрий, а на аноде выделяется молекулярный кислород:
4NaOH → 4Na + O2 + 2H2O
У этого термина существуют и другие значения, см. Сода.
| Гидроксид натрия | |
|---|---|
 |
|
 |
|
| Общие | |
| Систематическое наименование |
Гидроксид натрия |
| Традиционные названия |
Едкий натр, гидроокись натрия, каустик, аскарит, каустическая сода, едкая щёлочь |
| Хим. формула | NaOH |
| Рац. формула | NaOH |
| Физические свойства | |
| Молярная масса | 39,997 г/моль |
| Плотность | 2,13 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 323 °C |
| • кипения | 1403 °C |
| Энтальпия | |
| • образования | -425,6 кДж/моль |
| Давление пара | 0 ± 1 мм рт.ст. |
| Химические свойства | |
| Растворимость | |
| • в воде | 108,7 г/100 мл |
| Классификация | |
| Рег. номер CAS | 1310-73-2 |
| PubChem | 14798 |
| Рег. номер EINECS | 215-185-5 |
| SMILES |
[OH-].[Na+] |
| InChI |
InChI=1S/Na.H2O/h;1H2/q+1;/p-1 HEMHJVSKTPXQMS-UHFFFAOYSA-M |
| Кодекс Алиментариус | E524 |
| RTECS | WB4900000 |
| ChEBI | 32145 |
| Номер ООН | 1823 |
| ChemSpider | 14114 |
| Безопасность | |
| Предельная концентрация | 0,5 мг/м³ |
| ЛД50 | 149 мг/кг |
| Токсичность | ирритант, высокотоксичен |
| Пиктограммы СГС |
|
| NFPA 704 |
0 3 1 ALK |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Гидрокси́д на́трия (лат. Nátrii hydroxídum; др. названия — каустическая сóда, éдкий натр[1], гидроóкись нáтрия, хим. формула — NaOH) — неорганическое химическое соединение, являющееся самой распространённой щёлочью. В год в мире производится и потребляется около 57 миллионов тонн едкого натра.
История
История тривиальных названий как гидроксида натрия, так и других щелочей основывается на их свойствах. Название «едкая щёлочь» обусловлено свойством вещества разъедать кожу (вызывая сильные химические ожоги)[2], бумагу и другие органические вещества. До XVII века щёлочью (фр. alkali) называли также карбонаты натрия и калия. В 1736 году французский учёный Анри Дюамель дю Монсо впервые указал на различие этих веществ: гидроксид натрия получил название «каустическая сода», карбонат натрия — «кальцинированная сода», а карбонат калия — «поташ».
В настоящее время содой принято называть натриевые соли угольной кислоты. В английском и французском языках слово sodium означает «натрий», а potassium — «калий».
Физические свойства
Гидроксид натрия — белое твёрдое вещество. Сильно гигроскопичен, на воздухе «расплывается», активно поглощая пары воды и углекислый газ из воздуха. Хорошо растворяется в воде, при этом выделяется большое количество теплоты. Раствор едкого натра мылок на ощупь.
Термодинамика растворов
ΔH0 растворения для бесконечно разбавленного водного раствора −44,45 кДж/моль.
Из водных растворов при +12,3…+61,8 °C кристаллизуется моногидрат (ромбическая сингония), температура плавления +65,1 °C; плотность 1,829 г/см3; ΔH0обр −425,6 кДж/моль), в интервале от −28 до −24 °C — гептагидрат, от −24 до −17,7 °C — пентагидрат, от −17,7 до −5,4 °C — тетрагидрат (α-модификация). Растворимость в метаноле 23,6 г/л (t = +28 °C), в этаноле 14,7 г/л (t = +28 °C). NaOH·3,5Н2О (температура плавления +15,5 °C).
Химические свойства
Гидроксид натрия (едкая щёлочь) — сильное химическое основание (к сильным основаниям относят гидроксиды, молекулы которых полностью диссоциируют в воде), к которым относят гидроксиды щелочных и щёлочноземельных металлов подгрупп IА и IIА периодической системы химических элементов Д. И. Менделеева, KOH (едкое кали), Ba(OH)2 (едкий барит), LiOH, RbOH, CsOH, а также гидроксид одновалентного таллия TlOH. Щёлочность (основность) определяется валентностью металла, радиусом внешней электронной оболочки и электрохимической активностью: чем больше радиус электронной оболочки (увеличивается с порядковым номером), тем легче металл отдаёт электроны, и тем выше его электрохимическая активность и тем левее располагается элемент в электрохимическом ряду активности металлов, в котором за ноль принята активность водорода.

Водные растворы NaOH имеют сильную щелочную реакцию (pH 1%-го раствора = 13,4). Основными методами определения щелочей в растворах являются реакции на гидроксид-ион (OH−), (c фенолфталеином — малиновое окрашивание и метиловым оранжевым (метилоранжем) — жёлтое окрашивание). Чем больше гидроксид-ионов находится в растворе, тем сильнее щёлочь и тем интенсивнее окраска индикатора.
Гидроксид натрия вступает в следующие реакции:
- с кислотами, амфотерными оксидами и гидроксидами
- c кислотами — с образованием солей и воды:
;
(кислая соль, при отношении 1:1);
(в избытке NaOH).
Общая реакция в ионном виде:
;
- с амфотерными оксидами обладающими как основными, так и кислотными свойствами, и способностью реагировать с щелочами, как с твёрдыми при сплавлении:
;
— в растворе;
- с амфотерными гидроксидами
— при сплавлении;
— в растворе;
- с солями в растворе:
Гидроксид натрия используется для осаждения гидроксидов металлов. К примеру, так получают гелеобразный гидроксид алюминия, действуя гидроксидом натрия на сульфат алюминия в водном растворе, при этом избегая избытка щёлочи и растворения осадка. Его и используют, в частности, для очистки воды от мелких взвесей.
- c неметаллами:
например, с фосфором — с образованием гипофосфита натрия:
;
- с серой
;
- с галогенами
(дисмутация хлора в разбавленном растворе при комнатной температуре);
(дисмутация хлора при нагревании в концентрированном растворе).
- с металлами
Гидроксид натрия вступает в реакцию с алюминием, цинком, титаном. Он не реагирует с железом и медью (металлами, которые имеют низкий электрохимический потенциал). Алюминий легко растворяется в едкой щёлочи с образованием хорошо растворимого комплекса — тетрагидроксоалюмината натрия и водорода:
Эта реакция использовалась в первой половине XX века в воздухоплавании: для заполнения водородом аэростатов и дирижаблей в полевых (в том числе боевых) условиях, так как данная реакция не требует источников электроэнергии, а исходные реагенты для неё могут легко транспортироваться.
Гидроксид натрия используется в солях для перевода из одного кислотного остатка в другой:
- с эфирами, амидами и алкилгалогенидами (гидролиз):
с жирами (омыление) такая реакция необратима, так как получающаяся кислота со щёлочью образует мыло и глицерин. Глицерин впоследствии извлекается из подмыльных щёлоков путём вакуум-выпарки и дополнительной дистилляционной очистки полученных продуктов. Этот способ получения мыла был известен на Ближнем Востоке с VII века.
В результате взаимодействия жиров с гидроксидом натрия получают твёрдые мыла (они используются для производства кускового мыла), а с гидроксидом калия либо твёрдые, либо жидкие мыла в зависимости от состава жира.
- с многоатомными спиртами — с образованием алкоголятов:
Качественное определение ионов натрия

Атомы натрия придают пламени жёлтое свечение
- По цвету пламени горелки — атомы натрия придают пламени жёлтую окраску.
- С использованием специфических реакций на ионы натрия.
| Реагент | Фторид аммония | Нитрит цезия-калия-висмута | Ацетат магния | Ацетат цинка | Пикро-
лоновая кислота |
Диокси-
винная кислота |
Бромбензол-
сульфокислота |
Ацетат уранила-цинка |
|---|---|---|---|---|---|---|---|---|
| Цвет осадка | белый | бледно-жёлтый | жёлто-зелёный | жёлто-зелёный | белый | белый | бледно-жёлтый | зеленовато-жёлтый |
Методы получения
Гидроксид натрия может получаться в промышленности химическими и электрохимическими методами.
Химические методы получения гидроксида натрия
К химическим методам получения гидроксида натрия относятся пиролитический, известковый и ферритный.
Химические методы получения гидроксида натрия имеют существенные недостатки: расходуется большое количество энергоносителей, получаемый едкий натр сильно загрязнён примесями.
В настоящее время эти методы почти полностью вытеснены электрохимическими методами производства.
Пиролитический метод
Пиролитический метод получения гидроксида натрия является наиболее древним и начинается с получения оксида натрия Na2О путём прокаливания карбоната натрия (например, в муфельной печи). В качестве сырья может быть использован и гидрокарбонат натрия, разлагающийся при нагревании на карбонат натрия, углекислый газ и воду:
Полученный оксид натрия охлаждают и очень осторожно (реакция происходит с выделением большого количества тепла) добавляют в воду:
Известковый метод
Известковый метод получения гидроксида натрия заключается во взаимодействии раствора соды с гашеной известью при температуре около 80 °С. Этот процесс называется каустификацией и проходит по реакции:
В результате реакции получается раствор гидроксида натрия и осадок карбоната кальция. Карбонат кальция отделяется от раствора фильтрацией, затем раствор упаривается до получения расплавленного продукта, содержащего около 92 % масс. NaOH. Затем NaOH плавят и разливают в железные барабаны, где он кристаллизуется.
Ферритный метод
Ферритный метод получения гидроксида натрия состоит из двух этапов:
Первая реакция представляет собой процесс спекания кальцинированной соды с окисью железа при температуре 800—900 °С. При этом образуется спёк — феррит натрия и выделяется двуокись углерода. Далее спёк обрабатывают (выщелачивают) водой по второй реакции; получается раствор гидроксида натрия и осадок Fe2O3
Электрохимические методы получения гидроксида натрия
Способ основан на электролизе растворов галита (минерала, состоящего в основном из поваренной соли NaCl) с одновременным получением водорода и хлора. Этот процесс можно представить суммарной формулой:
Едкая щёлочь и хлор вырабатываются тремя электрохимическими методами. Два из них — электролиз с твёрдым катодом (диафрагменный и мембранный методы), третий — электролиз с жидким ртутным катодом (ртутный метод).
В мировой производственной практике используются все три метода получения хлора и каустика с явной тенденцией к увеличению доли мембранного электролиза.
| Показатель на 1 тонну NaOH | Ртутный метод | Диафрагменный метод | Мембранный метод |
|---|---|---|---|
| Выход хлора, % | 99 | 96 | 98,5 |
| Электроэнергия, кВт·ч | 3150 | 3260 | 2520 |
| Концентрация NaOH, % | 50 | 12 | 35 |
| Чистота хлора, % | 99,2 | 98 | 99,3 |
| Чистота водорода, % | 99,9 | 99,9 | 99,9 |
| Массовая доля O2 в хлоре, % | 0,1 | 1—2 | 0,3 |
| Массовая доля Cl− в NaOH, % | 0,003 | 1—1,2 | 0,005 |
В России приблизительно 35 % от всего выпускаемого каустика вырабатывается электролизом с ртутным катодом и 65 % — электролизом с твёрдым катодом.
Диафрагменный метод

Схема старинного диафрагменного электролизера для получения хлора и щёлоков: А — анод, В — изоляторы, С — катод, D — пространство заполненное газами (над анодом — хлор, над катодом — водород), М — диафрагма
Наиболее простым из электрохимических методов в плане организации процесса и конструкционных материалов для электролизера является диафрагменный метод получения гидроксида натрия.
Раствор соли в диафрагменном электролизере непрерывно подаётся в анодное пространство и протекает через, как правило, нанесённую на стальную катодную сетку асбестовую диафрагму, в которую иногда добавляют небольшое количество полимерных волокон.
Во многих конструкциях электролизеров катод полностью погружен под слой анолита (электролита из анодного пространства), а выделяющийся на катодной сетке водород отводится из под катода при помощи газоотводных труб, не проникая через диафрагму в анодное пространство благодаря противотоку.
Противоток — очень важная особенность устройства диафрагменного электролизера. Именно благодаря противоточному потоку, направленному из анодного пространства в катодное через пористую диафрагму, становится возможным раздельное получение щёлоков и хлора. Противоточный поток рассчитывается так, чтобы противодействовать диффузии и миграции OH— ионов в анодное пространство. Если величина противотока недостаточна, тогда в анодном пространстве в больших количествах начинает образовываться гипохлорит-ион (ClO—), который затем может окисляться на аноде до хлорат-иона ClO3—. Образование хлорат-иона серьёзно снижает выход по току хлора и является основным побочным процессом в этом методе получения гидроксида натрия. Также вредит и выделение кислорода, которое, к тому же, ведёт к разрушению анодов и, если они из углеродных материалов, попаданию в хлор примесей фосгена.
- На аноде
— основной процесс;
;
- На Катоде
— основной процесс;
;
В качестве анода в диафрагменных электролизерах может использоваться графитовый или угольный электроды. На сегодня их, в основном, заменили титановые аноды с окисидно-рутениево-титановым покрытием (аноды ОРТА) или другие малорасходуемые аноды.
На следующей стадии электролитический щёлок упаривают и доводят содержание в нём NaOH до товарной концентрации 42—50 % масс. в соответствии со стандартом.
Поваренная соль, сульфат натрия и другие примеси при повышении их концентрации в растворе выше их предела растворимости выпадают в осадок. Раствор едкой щёлочи декантируют от осадка и передаётся в качестве готового продукта на склад или продолжают стадию упаривания для получения твёрдого продукта, с последующим плавлением, превращением в чешуйки или гранулы.
Выпавшую в осадок в виде кристаллов поваренную соль возвращают назад в процесс, приготавливая из неё так называемый обратный рассол. От неё, во избежание накапливания примесей в растворах, перед приготовлением обратного рассола отделяют примеси.
Убыль анолита восполняют добавкой свежего рассола, получаемого подземным выщелачиванием соляных пластов, минеральных рассолов типа бишофита, предварительно очищенного от примесей или растворением галита. Свежий рассол перед смешиванием его с обратным рассолом очищают от механических взвесей и большей части ионов кальция и магния.
Полученный хлор отделяется от паров воды, сжимается компрессорами и подаётся либо на производство хлорсодержащих продуктов, либо на сжижение.
Благодаря относительной простоте и дешевизне диафрагменный метод получения гидроксида натрия до сих пор широко используется в промышленности.
Мембранный метод
Мембранный метод производства гидроксида натрия наиболее энергоэффективен, однако сложен в организации и эксплуатации.
С точки зрения электрохимических процессов мембранный метод подобен диафрагменному, но анодное и катодное пространства полностью разделены непроницаемой для анионов катионообменной мембраной. Благодаря этому свойству становится возможным получение более чистых, чем в случае с диафрагменного метода, щелоков. Поэтому в мембранном электролизере, в отличие от диафрагменного, не один поток, а два.
В анодное пространство поступает, как и в диафрагменном методе, поток раствора соли. А в катодное — деионизированная вода.
Из анодного пространства вытекает поток обеднённого анолита, содержащего также примеси гипохлорит- и хлорат-ионов и хлор, а из катодного — щёлока и водород, практически не содержащие примесей и близкие к товарной концентрации, что уменьшает затраты энергии на их упаривание и очистку.
Щёлочь, получаемая с помощью мембранного электролиза, практически не уступает по качеству получаемой при помощи метода с использованием ртутного катода и постепенно заменяет щёлочь, получаемую ртутным методом.
Однако питающий раствор соли (как свежий, так и оборотный) и вода предварительно максимально очищается от любых примесей. Такая тщательная очистка объясняется высокой стоимостью полимерных катионообменных мембран и их уязвимостью для примесей в питающем растворе.
Кроме того, ограниченная геометрическая форма, а также низкая механическая прочность и термическая стойкость ионообменных мембран во многом определяют сравнительно сложные конструкции установок мембранного электролиза. По той же причине мембранные установки требуют наиболее сложных систем автоматического контроля и управления.
- Схема мембранного электролизера.
Ртутный метод с жидким катодом
В ряду электрохимических методов получения щёлоков самым эффективным способом является электролиз с ртутным катодом.
Щёлоки, полученные при электролизе с жидким ртутным катодом, значительно чище полученных диафрагменным способом (для некоторых производств это критично). Например, в производстве искусственных волокон можно применять только высокочистый каустик), а по сравнению с мембранным методом организация процесса при получении щёлочи ртутным методом гораздо проще.
Установка для ртутного электролиза состоит из электролизёра, разлагателя амальгамы и ртутного насоса, объединённых между собой ртутепроводами.
Катодом электролизёра служит поток ртути, прокачиваемой насосом. Аноды — графитовые, угольные или малоизнашивающиеся (ОРТА, ТДМА или другие). Вместе с ртутью через электролизёр непрерывно течёт поток питающего раствор поваренной соли.
На аноде происходит окисление ионов хлора из электролита, и выделяется хлор:
— основной процесс;
;
Хлор и анолит отводится из электролизёра. Анолит, выходящий из электролизёра, донасыщают свежим галитом, извлекают из него примеси, внесённые с ним, а также вымываемые из анодов и конструкционных материалов, и возвращают на электролиз. Перед донасыщением из анолита извлекают растворённый в нём хлор.
На катоде восстанавливаются ионы натрия, которые образуют низкоконцентрированный раствор натрия в ртути (амальгаму натрия):
Амальгама непрерывно перетекает из электролизёра в разлагатель амальгамы. В разлагатель также непрерывно подаётся высокоочищенная вода. В нём амальгама натрия в результате самопроизвольного химического процесса почти полностью разлагается водой с образованием ртути, раствора каустика и водорода:
Полученный таким образом раствор каустика, являющийся товарным продуктом, практически не содержит примесей. Ртуть почти полностью освобождается от металлического натрия и возвращается в электролизер. Водород отводится на очистку.
Растущие требования к экологической безопасности производств и дороговизна металлической ртути ведут к постепенному вытеснению ртутного метода методами получения щёлочи с твёрдым катодом, в особенности мембранным методом.
Лабораторные методы получения
В лаборатории гидроксид натрия иногда получают химическими способами, но чаще используется небольшой электролизёр диафрагменного или мембранного типа[источник не указан 919 дней].
Рынок каустической соды
В России, согласно ГОСТ 2263-79, производятся следующие марки натра едкого:
- ТР — твёрдый ртутный (чешуированный);
- ТД — твёрдый диафрагменный (плавленый);
- РР — раствор ртутный;
- РХ — раствор химический;
- РД — раствор диафрагменный.
| Наименование показателя | ТР ОКП 21 3211 0400 | ТД ОКП 21 3212 0200 | РР ОКП 21 3211 0100 | РХ 1 сорт ОКП 21 3221 0530 | РХ 2 сорт ОКП 21 3221 0540 | РД Высший сорт ОКП 21 3212 0320 | РД Первый сорт ОКП 21 3212 0330 |
|---|---|---|---|---|---|---|---|
| Внешний вид | Чешуированная масса белого цвета. Допускается слабая окраска | Плавленая масса белого цвета. Допускается слабая окраска | Бесцветная прозрачная жидкость | Бесцветная или окрашенная жидкость. Допускается выкристаллизованный осадок | Бесцветная или окрашенная жидкость. Допускается выкристаллизованный осадок | Бесцветная или окрашенная жидкость. Допускается выкристаллизованный осадок | Бесцветная или окрашенная жидкость. Допускается выкристаллизованный осадок |
| Массовая доля гидроксида натрия, %, не менее | 98,5 | 94,0 | 42,0 | 45,5 | 43,0 | 46,0 | 44,0 |
Основные сферы применения

Едкий натр применяется во множестве отраслей промышленности и для бытовых нужд:
- Каустик применяется в целлюлозно-бумажной промышленности для делигнификации (сульфатный процесс) целлюлозы, в производстве бумаги, картона, искусственных волокон, древесно-волоконных плит.
- Для омыления жиров при производстве мыла, шампуня и других моющих средств. В древности во время стирки в воду добавляли золу, и, по-видимому, хозяйки обратили внимание, что если зола содержит жир, попавший в очаг во время приготовления пищи, то посуда легко моется. О профессии мыловара (сапонариуса) впервые упоминает примерно в 385 году нашей эры Теодор Присцианус. Арабы варили мыло из масел и соды с VII века, сегодня мыла производятся тем же способом, что и 10 веков назад. В настоящее время продукты на основе гидроксида натрия (с добавлением гидроксида калия), нагретые до +50…+60 °C, применяются в сфере промышленной мойки для очистки изделий из нержавеющей стали от жира и других масляных веществ, а также остатков механической обработки.
- В химических отраслях промышленности — для нейтрализации кислот и кислотных оксидов, как реагент или катализатор в химических реакциях, в химическом анализе для титрования, для травления алюминия и в производстве чистых металлов, в нефтепереработке — для производства масел.
- Для изготовления биодизельного топлива — получаемого из растительных масел и используемого для замены обычного дизельного топлива. Для получения биодизеля к девяти массовым единицам растительного масла добавляется одна массовая единица спирта (то есть соблюдается соотношение 9:1), а также щелочной катализатор (NaOH). Полученный эфир (главным образом линолевой кислоты) отличается хорошей воспламеняемостью, обеспечиваемой высоким цетановым числом. Цетановое число — условная количественная характеристика самовоспламеняемости дизельных топлив в цилиндре двигателя (аналог октанового числа для бензинов). Если для минерального дизтоплива характерен показатель в 50-52 %, то метиловый эфир уже изначально соответствует 56-58 % цетана. Сырьём для производства биодизеля могут быть различные растительные масла: рапсовое, соевое и другие, кроме тех, в составе которых высокое содержание пальмитиновой кислоты (пальмовое масло). При его производстве в процессе этерификации также образуется глицерин, который используется в пищевой, косметической и бумажной промышленности, либо перерабатывается в эпихлоргидрин по методу Solvay.
- В качестве агента для растворения засоров канализационных труб, в виде сухих гранул или в составе гелей (наряду с гидроксидом калия). Гидроксид натрия дезагрегирует засор и способствует лёгкому продвижению его далее по трубе.
- В гражданской обороне для дегазации и нейтрализации отравляющих веществ, в том числе зарина, в ребризерах (изолирующих дыхательных аппаратах (ИДА), для очистки выдыхаемого воздуха от углекислого газа.
- В текстильной промышленности — для мерсеризации хлопка и шерсти. При кратковременной обработке едким натром с последующей промывкой волокно приобретает прочность и шелковистый блеск.
- Гидроксид натрия также используется для мойки пресс-форм автопокрышек.
- В приготовлении пищи: для мытья и очистки фруктов и овощей от кожицы, в производстве шоколада и какао, напитков, мороженого, окрашивания карамели, для размягчения маслин и придания им чёрной окраски, при производстве хлебобулочных изделий. Зарегистрирован в качестве пищевой добавки E-524. Некоторые блюда готовятся с применением каустика:
- лютефиск — скандинавское блюдо из рыбы — сушёная треска вымачивается 5-6 дней в едкой щёлочи и приобретает мягкую, желеобразную консистенцию.
- брецель — немецкие крендели — перед выпечкой их обрабатывают в растворе едкой щёлочи, которая способствует образованию уникальной хрустящей корочки.
- В косметологии для удаления ороговевших участков кожи, бородавок, папиллом.
- В фотографии — как ускоряющее вещество в проявителях для высокоскоростной обработки фотографических материалов[3][4].
Меры предосторожности при обращении с гидроксидом натрия

Химический ожог в результате действия раствора гидроксида натрия. Фотография сделана через 44 часа после воздействия

Гидроксид натрия (едкий натр) — едкое и весьма токсичное вещество, обладающее ярко выраженными щелочными свойствами. По ГОСТ 12.1.005-76 едкий натр относится к вредным веществам 2-го класса опасности[5][6]. Поэтому при работе с ним нужно соблюдать осторожность. При попадании на кожу, слизистые оболочки и в глаза образуются серьёзные химические ожоги[7]. Попадание больших количеств едкого натра в глаза вызывает необратимые изменения зрительного нерва (атрофию) и, как следствие, потерю зрения.
При контакте слизистых поверхностей с едкой щёлочью необходимо промыть поражённый участок струёй воды, а при попадании на кожу — слабым раствором уксусной и борной кислоты. При попадании едкого натра в глаза следует немедленно промыть их сначала раствором борной кислоты, а затем водой.
Предельно допустимая концентрация аэрозоля гидроксида натрия NaOH в воздухе рабочей зоны составляет 0,5 мг/м³ в соответствии с ГОСТ 12.1.007-76[8].
Гидроксид натрия негорюч; пожаро- и взрывобезопасен[9].
Охрана природы
Едкий натр — опасное вещество для окружающей среды, подавляет биохимические процессы, оказывает токсическое действие[10][11].
Защита окружающей среды должна быть обеспечена соблюдением требований технологического регламента, правил перевозки и хранения.
Предельно допустимая концентрация (ПДК) едкого натра в воде водных объектов хозяйственно-питьевого и культурно-бытового водопользования (по катионам натрия) составляет 200 мг/дм3, 2-й класс опасности в соответствии с гигиеническими нормативами[12]. Необходим контроль водородного показателя (pH 6,5-8,5 и не более)[13].
Ориентировочно безопасный уровень воздействия (ОБУВ) едкого натра в атмосферном воздухе населённых мест составляет 0,01 мг/м3 в соответствии с гигиеническими нормативами[14].
При утечке или же рассыпании значительного количества едкий натр нейтрализуют слабым раствором кислоты. Нейтрализованный раствор направляют на обезвреживание и утилизацию[2].
Примечания
- ↑ name=https://www.mkmagna.ru_Натр едкий технический 46 % рд (раствор)
- ↑ 1 2 name=https://www.safework.ru_Гидроксид натрия
- ↑ Редько, 1999, с. 129.
- ↑ Гурлев, 1988, с. 294.
- ↑ name=https://docs.cntd.ru_ГОСТ (недоступная ссылка) 4328-77 Реактивы. Натрия гидроокись. Технические условия (с Изменениями N 1, 2)
- ↑ name=https://docs.cntd.ru_ГОСТ (недоступная ссылка) 2263-79 Реактивы. Натр едкий технический. Технические условия (с Изменениями N 1, 2)
- ↑ name=https://docs.cntd.ru_ГОСТ (недоступная ссылка) Р 55064-2012 Натр едкий очищенный. Технические условия
- ↑ name=https://docs.cntd.ru_ГОСТ (недоступная ссылка) 12.1.007-76 Система стандартов безопасности труда (ССБТ). Вредные вещества. Классификация и общие требования безопасности (с Изменениями N 1, 2)
- ↑ name=https://docs.cntd.ru_ГОСТ (недоступная ссылка) 12.1.004-91 Система стандартов безопасности труда (ССБТ) Пожарная безопасность. Общие требования (с Изменением N 1)
- ↑ name=https://docs.cntd.ru_ГОСТ (недоступная ссылка) 4328-66 Реактивы. Натрия гидрат окиси (натр едкий)
- ↑ name=https://docs.cntd.ru_ГОСТ (недоступная ссылка) 2263-59 Натр едкий технический (сода каустическая)
- ↑ name=https://docs.cntd.ru_ГОСТ (недоступная ссылка) P 55064-2012 Натр едкий технический. Технические условия
- ↑ name=https://docs.cntd.ru_ГОСТ (недоступная ссылка) 2263-71 Натр едкий технический (с Изменением N 2)
- ↑ name=https://www.chempack.ru_Натр едкий технический гранулированный
Литература
- Общая химическая технология. Под ред. И. П. Мухленова. Учебник для химико-технологических специальностей вузов. — М.: Высшая школа.
- Некрасов Б. В. Основы общей химии, т. 3. — М.: Химия, 1970.
- Фурмер И. Э., Зайцев В. Н. Общая химическая технология. — М.: Высшая школа, 1978.
- Приказ Минздрава РФ от 28 марта 2003 г. № 126 «Об утверждении Перечня вредных производственных факторов, при воздействии которых в профилактических целях рекомендуется употребление молока или других равноценных пищевых продуктов».
- Постановление Главного государственного санитарного врача РФ от 4 апреля 2003 г. № 32 «О введении в действие Санитарных правил по организации грузовых перевозок на железнодорожном транспорте. СП 2.5.1250-03».
- Федеральный закон от 21 июля 1997 г. № 116-ФЗ «О промышленной безопасности опасных производственных объектов» (с изм. на 18 декабря 2006 г.).
- Приказ МПР РФ от 2 декабря 2002 г. № 786 «Об утверждении федерального классификационного каталога отходов» (с изм. и доп. от 30 июля 2003 г.).
- Постановление Госкомтруда СССР от 25 октября 1974 г. № 298/П-22 «Об утверждении списка производств, цехов, профессий и должностей с вредными условиями труда, работа в которых даёт право на дополнительный отпуск и сокращённый рабочий день» (с изм. на 29 мая 1991 г.).
- Постановление Министерства труда России от 22 июля 1999 г. № 26 «Об утверждении типовых отраслевых норм бесплатной выдачи специальной одежды, специальной обуви и других средств индивидуальной защиты работникам химических производств».
- Постановление Главного государственного санитарного врача РФ от 30 мая 2003 г. № 116 О введении в действие ГН 2.1.6.1339-03 «Ориентировочные безопасные уровни воздействия (ОБУВ) загрязняющих веществ в атмосферном воздухе населённых мест».(с изм. на 3 ноября 2005 г.).
- Гурлев Д. С. Справочник по фотографии (обработка фотоматериалов). — К.: Тэхника, 1988.
- Редько А. В. Основы фотографических процессов. — 2-е изд.. — СПб.: «Лань», 1999. — 512 с. — (Учебники для ВУЗов. Специальная литература). — 3000 экз. — ISBN 5-8114-0146-9.
Эта страница в последний раз была отредактирована 27 декабря 2022 в 10:18.
Как только страница обновилась в Википедии она обновляется в Вики 2.
Обычно почти сразу, изредка в течении часа.





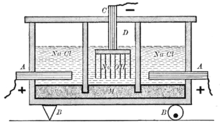














![{displaystyle {mathsf {2NaOH+ZnO {xrightarrow[{}]{500-600^{o}C}} Na_{2}ZnO_{2}+H_{2}O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/cf5c5320b97b63eff6055d192d32c1aa5cac905d)
![{displaystyle {mathsf {2NaOH+ZnO+H_{2}Orightarrow Na_{2}[Zn(OH)_{4}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/998901176ff5d911bf45c0726b6fb15579713e10)

![{mathsf {3NaOH+Al(OH)_{3}rightarrow Na_{3}[Al(OH)_{6}]}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f712e037a7471c3dcfe1bdee33b39d5f730b2756)





![{displaystyle {mathsf {2Al+2NaOH+6H_{2}Orightarrow 2Na[Al(OH)_{4}]+3H_{2}!uparrow }}.}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0ae2cb883ec7c81934b1e9346f6633caab94e745)



















![{displaystyle {mathsf {Na^{+}+e^{-}{xrightarrow[{}]{Hg}}NaHg}}.}](https://wikimedia.org/api/rest_v1/media/math/render/svg/bb793d374883044ff5ddcb3502bed8c88d1fc8f4)
![{displaystyle {mathsf {2NaHg+2H_{2}O {xrightarrow[{-Hg}]{}} 2NaOH+H_{2}uparrow }}.}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e03cf16ed9a4e2b18371d5cb5373f147660a195d)
