Iron(III) chloride (hydrate) |
||

Iron(III) chloride (anhydrous) |
||
|
||
| Names | ||
|---|---|---|
| IUPAC names
Iron(III) chloride |
||
Other names
|
||
| Identifiers | ||
|
CAS Number |
|
|
|
3D model (JSmol) |
|
|
| ChEBI |
|
|
| ChemSpider |
|
|
| ECHA InfoCard | 100.028.846 |
|
| EC Number |
|
|
|
PubChem CID |
|
|
| RTECS number |
|
|
| UNII |
|
|
| UN number |
|
|
|
CompTox Dashboard (EPA) |
|
|
|
InChI
|
||
|
SMILES
|
||
| Properties | ||
|
Chemical formula |
FeCl3 | |
| Molar mass |
|
|
| Appearance | Green-black by reflected light; purple-red by transmitted light; yellow solid as hexahydrate; brown as aqueous solution | |
| Odor | Slight HCl | |
| Density |
|
|
| Melting point | 307.6 °C (585.7 °F; 580.8 K) (anhydrous) 37 °C (99 °F; 310 K) (hexahydrate)[1] |
|
| Boiling point |
|
|
|
Solubility in water |
912 g/L (anhydrous or hexahydrate, 25 °C)[1] | |
Solubility in
|
|
|
|
Magnetic susceptibility (χ) |
+13,450·10−6 cm3/mol[2] | |
| Viscosity | 12 cP (40% solution) | |
| Structure | ||
|
Crystal structure |
Hexagonal, hR24 | |
|
Space group |
R3, No. 148[3] | |
|
Lattice constant |
a = 0.6065 nm, b = 0.6065 nm, c = 1.742 nm α = 90°, β = 90°, γ = 120° |
|
|
Formula units (Z) |
6 | |
|
Coordination geometry |
Octahedral | |
| Hazards[5][6][Note 1] | ||
| GHS labelling: | ||
|
Pictograms |
 
|
|
|
Signal word |
Danger | |
|
Hazard statements |
H290, H302, H314 | |
|
Precautionary statements |
P234, P260, P264, P270, P273, P280, P301+P312, P301+P330+P331, P303+P361+P353, P304+P340, P305+P351+P338, P310, P321, P363, P390, P405, P406, P501 | |
| NFPA 704 (fire diamond) |
2 0 0 |
|
| Flash point | Non-flammable | |
| NIOSH (US health exposure limits): | ||
|
REL (Recommended) |
TWA 1 mg/m3[4] | |
| Safety data sheet (SDS) | ICSC 1499 | |
| Related compounds | ||
|
Other anions |
|
|
|
Other cations |
|
|
|
Related coagulants |
|
|
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Iron(III) chloride hexahydrate
Iron(III) chloride is the inorganic compound with the formula FeCl3. Also called ferric chloride, it is a common compound of iron in the +3 oxidation state. The anhydrous compound is a crystalline solid with a melting point of 307.6 °C. The colour depends on the viewing angle: by reflected light the crystals appear dark green, but by transmitted light they appear purple-red.
Structure and properties[edit]
Anhydrous[edit]
Anhydrous iron(III) chloride has the BiI3 structure, with octahedral Fe(III) centres interconnected by two-coordinate chloride ligands.[3]
Iron(III) chloride has a relatively low melting point and boils at around 315 °C. The vapor consists of the dimer Fe2Cl6 (like aluminium chloride) which increasingly dissociates into the monomeric FeCl3 (with D3h point group molecular symmetry) at higher temperature, in competition with its reversible decomposition to give iron(II) chloride and chlorine gas.[8]
Hydrates[edit]
In addition to the anhydrous material, ferric chloride forms four hydrates. All forms of iron(III) chloride feature two or more chlorides as ligands, and three hydrates feature [FeCl4]−.[9]
- dihydrate: FeCl3·2H2O has the structural formula trans—[FeCl2(H2O)4][FeCl4].
- FeCl3·2.5H2O has the structural formula cis—[FeCl2(H2O)4][FeCl4]·H2O.
- FeCl3·3.5H2O has the structural formula cis—[FeCl2(H2O)4][FeCl4]·3H2O.
- hexahydrate: FeCl3·6H2O has the structural formula trans—[FeCl2(H2O)4]Cl·2H2O.[10]
Aqueous solution[edit]
Aqueous solutions of ferric chloride are characteristically yellow, in contrast to the pale pink solutions of [Fe(H2O)6]3+. According to spectroscopic measurements, the main species in aqueous solutions of ferric chloride are the octahedral complex [FeCl2(H2O)4]+ (stereochemistry unspecified) and the tetrahedral [FeCl4]−.[9]
Preparation[edit]
Anhydrous iron(III) chloride may be prepared by treating iron with chlorine:[11]
- 2 Fe + 3 Cl2 → 2 FeCl3
Solutions of iron(III) chloride are produced industrially both from iron and from ore, in a closed-loop process.
- Dissolving iron ore in hydrochloric acid
- Fe3O4 + 8 HCl → FeCl2 + 2 FeCl3 + 4 H2O
- Oxidation of iron(II) chloride with chlorine
- 2 FeCl2 + Cl2 → 2 FeCl3
- Oxidation of iron(II) chloride with oxygen and hydrochloric acid
- 4 FeCl2 + O2 + 4 HCl → 4 FeCl3 + 2 H2O
Heating hydrated iron(III) chloride does not yield anhydrous ferric chloride. Instead, the solid decomposes into hydrochloric acid and iron oxychloride. Hydrated iron(III) chloride can be converted to the anhydrous form by treatment with thionyl chloride.[12] Similarly, dehydration can be effected with trimethylsilyl chloride:[13]
- FeCl3·6H2O + 12 (CH3)3SiCl → FeCl3 + 6 ((CH3)3Si)2O + 12 HCl
Reactions[edit]
A brown, acidic solution of iron(III) chloride
When dissolved in water, iron(III) chloride give a strongly acidic solution.[14][9]
When heated with iron(III) oxide at 350 °C, iron(III) chloride gives iron oxychloride.[15]
- FeCl3 + Fe2O3 → 3FeOCl
The anhydrous salt is a moderately strong Lewis acid, forming adducts with Lewis bases such as triphenylphosphine oxide; e.g., FeCl3(OPPh3)2 where Ph is phenyl. It also reacts with other chloride salts to give the yellow tetrahedral [FeCl4]− ion. Salts of [FeCl4]− in hydrochloric acid can be extracted into diethyl ether.
Redox reactions[edit]
Iron(III) chloride is a mild oxidizing agent, for example, it oxidizes copper(I) chloride to copper(II) chloride.
- FeCl3 + CuCl → FeCl2 + CuCl2
In a comproportionation reaction, it reacts with iron to form iron(II) chloride:
- 2 FeCl3 + Fe → 3 FeCl2
A traditional synthesis of anhydrous ferrous chloride is the reduction of FeCl3 with chlorobenzene:[16]
- 2 FeCl3 + C6H5Cl → 2 FeCl2 + C6H4Cl2 + HCl
With carboxylate anions[edit]
Oxalates react rapidly with aqueous iron(III) chloride to give [Fe(C2O4)3]3−. Other carboxylate salts form complexes; e.g., citrate and tartrate.
With alkali metal alkoxides[edit]
Alkali metal alkoxides react to give the metal alkoxide complexes of varying complexity.[17] The compounds can be dimeric or trimeric.[18] In the solid phase a variety of multinuclear complexes have been described for the nominal stoichiometric reaction between FeCl3 and sodium ethoxide:[19][20]
- FeCl3 + 3 [CH3CH2O]−Na+ → Fe(OCH2CH3)3 + 3 NaCl
With organometallic compounds[edit]
Iron(III) chloride in ether solution oxidizes methyl lithium LiCH3 to give first light greenish yellow lithium tetrachloroferrate(III) Li[FeCl4] solution and then, with further addition of methyl lithium, lithium tetrachloroferrate(II) Li2[FeCl4]:[21]
- 2 FeCl3 + LiCH3 → FeCl2 + Li[FeCl4] + •CH3
- Li[FeCl4] + LiCH3 → Li2[FeCl4] + •CH3
The methyl radicals combine with themselves or react with other components to give mostly ethane C2H6 and some methane CH4.
Uses[edit]
Industrial[edit]
Iron(III) chloride is used in sewage treatment and drinking water production as a coagulant and flocculant.[22] In this application, FeCl3 in slightly basic water reacts with the hydroxide ion (OH−) to form a floc of iron(III) hydroxide (Fe(OH)3), also formulated as FeO(OH) (ferrihydrite), that can remove suspended materials.
- [Fe(H2O)6]3+ + 4 OH− → [Fe(OH)4(H2O)2]− + 4 H2O → [FeO(OH)2(H2O)]− + 6 H2O
It is also used as a leaching agent in chloride hydrometallurgy,[23] for example in the production of Si from FeSi (Silgrain process by Elkem).[24]
Another important application of iron(III) chloride is etching copper in two-step redox reaction to copper(I) chloride and then to copper(II) chloride in the production of printed circuit boards (PCB).[25]
- FeCl3 + Cu → FeCl2 + CuCl
- FeCl3 + CuCl → FeCl2 + CuCl2
Iron(III) chloride is used as catalyst for the reaction of ethylene with chlorine, forming ethylene dichloride (1,2-dichloroethane), an important commodity chemical, which is mainly used for the industrial production of vinyl chloride, the monomer for making PVC.
- H2C=CH2 + Cl2 → ClCH2CH2Cl
Laboratory use[edit]
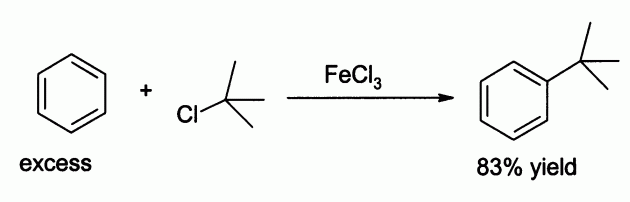
In the laboratory iron(III) chloride is commonly employed as a Lewis acid for catalysing reactions such as chlorination of aromatic compounds and Friedel–Crafts reaction of aromatics.[citation needed] It is less powerful than aluminium chloride, but in some cases this mildness leads to higher yields, for example in the alkylation of benzene:
The ferric chloride test is a traditional colorimetric test for phenols, which uses a 1% iron(III) chloride solution that has been neutralized with sodium hydroxide until a slight precipitate of FeO(OH) is formed.[26] The mixture is filtered before use. The organic substance is dissolved in water, methanol or ethanol, then the neutralized iron(III) chloride solution is added—a transient or permanent coloration (usually purple, green or blue) indicates the presence of a phenol or enol.
This reaction is exploited in the Trinder spot test, which is used to indicate the presence of salicylates, particularly salicylic acid, which contains a phenolic OH group.
This test can be used to detect the presence of gamma-hydroxybutyric acid and gamma-butyrolactone,[27] which cause it to turn red-brown.
Other uses[edit]
- Used in anhydrous form as a drying reagent in certain reactions.
- Used to detect the presence of phenol compounds in organic synthesis; e.g., examining purity of synthesized Aspirin.
- Used in water and wastewater treatment to precipitate phosphate as iron(III) phosphate.
- Used in wastewater treatment for odor control.
- Used by American coin collectors to identify the dates of Buffalo nickels that are so badly worn that the date is no longer visible.
- Used by bladesmiths and artisans in pattern welding to etch the metal, giving it a contrasting effect, to view metal layering or imperfections.
- Used to etch the widmanstatten pattern in iron meteorites.
- Necessary for the etching of photogravure plates for printing photographic and fine art images in intaglio and for etching rotogravure cylinders used in the printing industry.
- Used to make printed circuit boards (PCBs) by etching copper.
- Used to strip aluminum coating from mirrors.
- Used to etch intricate medical devices.
- Used in veterinary practice to treat overcropping of an animal’s claws, particularly when the overcropping results in bleeding.
- Reacts with cyclopentadienylmagnesium bromide in one preparation of ferrocene, a metal-sandwich complex.[28]
- Sometimes used in a technique of Raku ware firing, the iron coloring a pottery piece shades of pink, brown, and orange.
- Used to test the pitting and crevice corrosion resistance of stainless steels and other alloys.
- Used in conjunction with NaI in acetonitrile to mildly reduce organic azides to primary amines.[29]
- Used in an animal thrombosis model.[30]
- Used in an experimental energy storage systems.[31]
- Historically it was used to make direct positive blueprints.[32][33]
- A component of modified Carnoy’s solution used for surgical treatment of keratocystic odontogenic tumor (KOT).
- Used as an additive to sodium chloride (NaCl) to produce clear crystals.
Safety[edit]
Iron(III) chloride is harmful, highly corrosive and acidic. The anhydrous material is a powerful dehydrating agent.
Although reports of poisoning in humans are rare, ingestion of ferric chloride can result in serious morbidity and mortality. Inappropriate labeling and storage lead to accidental swallowing or misdiagnosis. Early diagnosis is important, especially in seriously poisoned patients.
Natural occurrence[edit]
The natural counterpart of FeCl3 is the rare mineral molysite, usually related to volcanic and other-type fumaroles.[34][35]
FeCl3 is also produced as an atmospheric salt aerosol by reaction between iron-rich dust and hydrochloric acid from sea salt. This iron salt aerosol causes about 5% of naturally-occurring oxidization of methane and is thought to have a range of cooling effects.[36]
The atmosphere of the planet Venus is approximately 1% FeCl3.[37][38]
See also[edit]
- Verhoeff’s stain
- Ferrosilicon
Notes[edit]
- ^ An alternative GHS classification from the Japanese GHS Inter-ministerial Committee (2006)[7] notes the possibility of respiratory tract irritation from FeCl3 and differs slightly in other respects from the classification used here.
References[edit]
- ^ a b c d e f Haynes, William M., ed. (2011). CRC Handbook of Chemistry and Physics (92nd ed.). Boca Raton, FL: CRC Press. p. 4.69. ISBN 1-4398-5511-0.
- ^ Haynes, William M., ed. (2011). CRC Handbook of Chemistry and Physics (92nd ed.). Boca Raton, FL: CRC Press. p. 4.133. ISBN 1-4398-5511-0.
- ^ a b Hashimoto S, Forster K, Moss SC (1989). «Structure refinement of an FeCl3 crystal using a thin plate sample». J. Appl. Crystallogr. 22 (2): 173–180. doi:10.1107/S0021889888013913.
- ^ NIOSH Pocket Guide to Chemical Hazards. «#0346». National Institute for Occupational Safety and Health (NIOSH).
- ^ HSNO Chemical Classification Information Database, New Zealand Environmental Risk Management Authority, retrieved 19 Sep 2010
- ^ Various suppliers, collated by the Baylor College of Dentistry, Texas A&M University. (accessed 2010-09-19)
- ^ GHS classification – ID 831, Japanese GHS Inter-ministerial Committee, 2006, retrieved 19 Sep 2010
- ^ Holleman AF, Wiberg E (2001). Wiberg N (ed.). Inorganic Chemistry. San Diego: Academic Press. ISBN 978-0-12-352651-9.
- ^ a b c Simon A. Cotton (2018). «Iron(III) chloride and its coordination chemistry». Journal of Coordination Chemistry. 71 (21): 3415–3443. doi:10.1080/00958972.2018.1519188. S2CID 105925459.
- ^ Lind, M. D. (1967). «Crystal Structure of Ferric Chloride Hexahydrate». The Journal of Chemical Physics. 47 (3): 990–993. Bibcode:1967JChPh..47..990L. doi:10.1063/1.1712067.
- ^ Tarr BR, Booth HS, Dolance A (1950). Anhydrous Iron(III) Chloride. Inorganic Syntheses. Vol. 3. pp. 191–194. doi:10.1002/9780470132340.ch51.
- ^ Pray AR, Heitmiller RF, Strycker S, et al. (1990). «Anhydrous Metal Chlorides». Inorganic Syntheses. Vol. 28. pp. 321–323. doi:10.1002/9780470132593.ch80. ISBN 9780470132593.
- ^ Boudjouk P, So JH, Ackermann MN, et al. (1992). «Solvated and Unsolvated Anhydrous Metal Chlorides from Metal Chloride Hydrates». Inorganic Syntheses. Inorganic Syntheses. Vol. 29. pp. 108–111. doi:10.1002/9780470132609.ch26. ISBN 9780470132609.
- ^ Housecroft, C. E.; Sharpe, A. G. (2012). Inorganic Chemistry (4th ed.). Prentice Hall. p. 747. ISBN 978-0-273-74275-3.
- ^
Kikkawa S, Kanamaru F, Koizumi M, et al. (1984). «Layered Intercalation Compounds». In Holt SL Jr (ed.). Inorganic Syntheses. John Wiley & Sons, Inc. pp. 86–89. doi:10.1002/9780470132531.ch17. ISBN 9780470132531. - ^ P. Kovacic and N. O. Brace (1960). «Iron(II) Chloride». Inorganic Syntheses. Inorganic Syntheses. Vol. 6. pp. 172–173. doi:10.1002/9780470132371.ch54. ISBN 9780470132371.
- ^ Turova NY, Turevskaya EP, Kessler VG, et al., eds. (2002). «12.22.1 Synthesis». The Chemistry of Metal Alkoxides. Springer Science. p. 481. ISBN 0306476576.
- ^ Bradley DC, Mehrotra RC, Rothwell I, et al. (2001). «3.2.10. Alkoxides of later 3d metals». Alkoxo and aryloxo derivatives of metals. San Diego: Academic Press. p. 69. ISBN 9780121241407. OCLC 162129468.
- ^
Michael V, Grätz F, Huch V (2001). «Fe9O3(OC2H5)21•C2H5OH—A New Structure Type of an Uncharged Iron(III) Oxide-Alkoxide Cluster». Eur. J. Inorg. Chem. 2001 (2): 367. doi:10.1002/1099-0682(200102)2001:2<367::AID-EJIC367>3.0.CO;2-V. - ^
Seisenbaeva GA, Gohil S, Suslova EV, et al. (2005). «The synthesis of iron (III) ethoxide revisited: Characterization of the metathesis products of iron (III) halides and sodium ethoxide». Inorg. Chim. Acta. 358 (12): 3506–3512. doi:10.1016/j.ica.2005.03.048. - ^ Berthold HJ, Spiegl HJ (1972). «Über die Bildung von Lithiumtetrachloroferrat(II) Li2FeCl4 bei der Umsetzung von Eisen(III)-chlorid mil Lithiummethyl (1:1) in ätherischer Lösung». Z. Anorg. Allg. Chem. (in German). 391 (3): 193–202. doi:10.1002/zaac.19723910302.
- ^ Water Treatment Chemicals (PDF). Akzo Nobel Base Chemicals. 2007. Archived from the original (PDF) on 13 August 2010. Retrieved 26 Oct 2007.
- ^ Park KH, Mohapatra D, Reddy BR (2006). «A study on the acidified ferric chloride leaching of a complex (Cu–Ni–Co–Fe) matte». Separation and Purification Technology. 51 (3): 332–337. doi:10.1016/j.seppur.2006.02.013.
- ^ Dueñas Díez M, Fjeld M, Andersen E, et al. (2006). «Validation of a compartmental population balance model of an industrial leaching process: The Silgrain process». Chem. Eng. Sci. 61 (1): 229–245. doi:10.1016/j.ces.2005.01.047.
- ^ Greenwood NN, Earnshaw A (1997). Chemistry of the Elements (2nd ed.). Oxford: Butterworth-Heinemann. p. 1084. ISBN 9780750633659.
- ^
Furniss BS, Hannaford AJ, Smith PW, et al. (1989). Vogel’s Textbook of Practical Organic Chemistry (5th ed.). New York: Longman/Wiley. ISBN 9780582462366. - ^
Zhang SY, Huang ZP (2006). «A color test for rapid screening of gamma-hydroxybutyric acid (GHB) and gamma-butyrolactone (GBL) in drink and urine». Fa Yi Xue Za Zhi. 22 (6): 424–7. PMID 17285863. - ^ Kealy TJ, Pauson PL (1951). «A New Type of Organo-Iron Compound». Nature. 168 (4285): 1040. Bibcode:1951Natur.168.1039K. doi:10.1038/1681039b0. S2CID 4181383.
- ^ Kamal A, Ramana K, Ankati H, et al. (2002). «Mild and efficient reduction of azides to amines: synthesis of fused [2,1-b]quinazolines». Tetrahedron Lett. 43 (38): 6861–6863. doi:10.1016/S0040-4039(02)01454-5.
- ^ Tseng M, Dozier A, Haribabu B, et al. (2006). «Transendothelial migration of ferric ion in FeCl3 injured murine common carotid artery». Thromb. Res. 118 (2): 275–280. doi:10.1016/j.thromres.2005.09.004. PMID 16243382.
- ^ Manohar, Aswin K.; Kim, Kyu Min; Plichta, Edward; Hendrickson, Mary; Rawlings, Sabrina; Narayanan, S. R. (28 October 2015). «A High Efficiency Iron-Chloride Redox Flow Battery for Large-Scale Energy Storage». Journal of the Electrochemical Society. 163 (1): A5118. doi:10.1149/2.0161601jes. ISSN 1945-7111. S2CID 100823390.
- ^ US Patent 241713, Pellet H, «Method of preparing paper», published 1881
- ^ Lietze E (1888). Modern Heliographic Processes. New York: D. Van Norstrand Company. pp. 65.
- ^ «Molysite». www.mindat.org.
- ^ «List of Minerals». www.ima-mineralogy.org. March 21, 2011.
- ^ Oeste, Franz Dietrich; de Richter, Renaud; Ming, Tingzhen; Caillol, Sylvain (January 13, 2017). «Climate engineering by mimicking natural dust climate control: the iron salt aerosol method». Earth System Dynamics. 8 (1): 1–54. Bibcode:2017ESD…..8….1O. doi:10.5194/esd-8-1-2017 – via esd.copernicus.org.
- ^ Krasnopolsky, V. A.; Parshev, V. A. (1981). «Chemical composition of the atmosphere of Venus». Nature. 292 (5824): 610–613. Bibcode:1981Natur.292..610K. doi:10.1038/292610a0. S2CID 4369293.
- ^ Krasnopolsky, Vladimir A. (2006). «Chemical composition of Venus atmosphere and clouds: Some unsolved problems». Planetary and Space Science. 54 (13–14): 1352–1359. Bibcode:2006P&SS…54.1352K. doi:10.1016/j.pss.2006.04.019.
Further reading[edit]
- Lide DR, ed. (1990). CRC Handbook of Chemistry and Physics (71st ed.). Ann Arbor, MI, USA: CRC Press. ISBN 9780849304712.
- Stecher PG, Finkel MJ, Siegmund OH, eds. (1960). The Merck Index of Chemicals and Drugs (7th ed.). Rahway, NJ, USA: Merck & Co.
- Nicholls D (1974). Complexes and First-Row Transition Elements, Macmillan Press, London, 1973. A Macmillan chemistry text. London: Macmillan Press. ISBN 9780333170885.
- Wells AF (1984). Structural Inorganic Chemistry. Oxford science publications (5th ed.). Oxford, UK: Oxford University Press. ISBN 9780198553700.
- March J (1992). Advanced Organic Chemistry (4th ed.). New York: John Wiley & Sons, Inc. pp. 723. ISBN 9780471581482.
- Reich HJ, Rigby HJ, eds. (1999). Acidic and Basic Reagents. Handbook of Reagents for Organic Synthesis. New York: John Wiley & Sons, Inc. ISBN 9780471979258.

Iron(III) chloride (hydrate) |
||

Iron(III) chloride (anhydrous) |
||
|
||
| Names | ||
|---|---|---|
| IUPAC names
Iron(III) chloride |
||
Other names
|
||
| Identifiers | ||
|
CAS Number |
|
|
|
3D model (JSmol) |
|
|
| ChEBI |
|
|
| ChemSpider |
|
|
| ECHA InfoCard | 100.028.846 |
|
| EC Number |
|
|
|
PubChem CID |
|
|
| RTECS number |
|
|
| UNII |
|
|
| UN number |
|
|
|
CompTox Dashboard (EPA) |
|
|
|
InChI
|
||
|
SMILES
|
||
| Properties | ||
|
Chemical formula |
FeCl3 | |
| Molar mass |
|
|
| Appearance | Green-black by reflected light; purple-red by transmitted light; yellow solid as hexahydrate; brown as aqueous solution | |
| Odor | Slight HCl | |
| Density |
|
|
| Melting point | 307.6 °C (585.7 °F; 580.8 K) (anhydrous) 37 °C (99 °F; 310 K) (hexahydrate)[1] |
|
| Boiling point |
|
|
|
Solubility in water |
912 g/L (anhydrous or hexahydrate, 25 °C)[1] | |
Solubility in
|
|
|
|
Magnetic susceptibility (χ) |
+13,450·10−6 cm3/mol[2] | |
| Viscosity | 12 cP (40% solution) | |
| Structure | ||
|
Crystal structure |
Hexagonal, hR24 | |
|
Space group |
R3, No. 148[3] | |
|
Lattice constant |
a = 0.6065 nm, b = 0.6065 nm, c = 1.742 nm α = 90°, β = 90°, γ = 120° |
|
|
Formula units (Z) |
6 | |
|
Coordination geometry |
Octahedral | |
| Hazards[5][6][Note 1] | ||
| GHS labelling: | ||
|
Pictograms |
 
|
|
|
Signal word |
Danger | |
|
Hazard statements |
H290, H302, H314 | |
|
Precautionary statements |
P234, P260, P264, P270, P273, P280, P301+P312, P301+P330+P331, P303+P361+P353, P304+P340, P305+P351+P338, P310, P321, P363, P390, P405, P406, P501 | |
| NFPA 704 (fire diamond) |
2 0 0 |
|
| Flash point | Non-flammable | |
| NIOSH (US health exposure limits): | ||
|
REL (Recommended) |
TWA 1 mg/m3[4] | |
| Safety data sheet (SDS) | ICSC 1499 | |
| Related compounds | ||
|
Other anions |
|
|
|
Other cations |
|
|
|
Related coagulants |
|
|
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Iron(III) chloride hexahydrate
Iron(III) chloride is the inorganic compound with the formula FeCl3. Also called ferric chloride, it is a common compound of iron in the +3 oxidation state. The anhydrous compound is a crystalline solid with a melting point of 307.6 °C. The colour depends on the viewing angle: by reflected light the crystals appear dark green, but by transmitted light they appear purple-red.
Structure and properties[edit]
Anhydrous[edit]
Anhydrous iron(III) chloride has the BiI3 structure, with octahedral Fe(III) centres interconnected by two-coordinate chloride ligands.[3]
Iron(III) chloride has a relatively low melting point and boils at around 315 °C. The vapor consists of the dimer Fe2Cl6 (like aluminium chloride) which increasingly dissociates into the monomeric FeCl3 (with D3h point group molecular symmetry) at higher temperature, in competition with its reversible decomposition to give iron(II) chloride and chlorine gas.[8]
Hydrates[edit]
In addition to the anhydrous material, ferric chloride forms four hydrates. All forms of iron(III) chloride feature two or more chlorides as ligands, and three hydrates feature [FeCl4]−.[9]
- dihydrate: FeCl3·2H2O has the structural formula trans—[FeCl2(H2O)4][FeCl4].
- FeCl3·2.5H2O has the structural formula cis—[FeCl2(H2O)4][FeCl4]·H2O.
- FeCl3·3.5H2O has the structural formula cis—[FeCl2(H2O)4][FeCl4]·3H2O.
- hexahydrate: FeCl3·6H2O has the structural formula trans—[FeCl2(H2O)4]Cl·2H2O.[10]
Aqueous solution[edit]
Aqueous solutions of ferric chloride are characteristically yellow, in contrast to the pale pink solutions of [Fe(H2O)6]3+. According to spectroscopic measurements, the main species in aqueous solutions of ferric chloride are the octahedral complex [FeCl2(H2O)4]+ (stereochemistry unspecified) and the tetrahedral [FeCl4]−.[9]
Preparation[edit]
Anhydrous iron(III) chloride may be prepared by treating iron with chlorine:[11]
- 2 Fe + 3 Cl2 → 2 FeCl3
Solutions of iron(III) chloride are produced industrially both from iron and from ore, in a closed-loop process.
- Dissolving iron ore in hydrochloric acid
- Fe3O4 + 8 HCl → FeCl2 + 2 FeCl3 + 4 H2O
- Oxidation of iron(II) chloride with chlorine
- 2 FeCl2 + Cl2 → 2 FeCl3
- Oxidation of iron(II) chloride with oxygen and hydrochloric acid
- 4 FeCl2 + O2 + 4 HCl → 4 FeCl3 + 2 H2O
Heating hydrated iron(III) chloride does not yield anhydrous ferric chloride. Instead, the solid decomposes into hydrochloric acid and iron oxychloride. Hydrated iron(III) chloride can be converted to the anhydrous form by treatment with thionyl chloride.[12] Similarly, dehydration can be effected with trimethylsilyl chloride:[13]
- FeCl3·6H2O + 12 (CH3)3SiCl → FeCl3 + 6 ((CH3)3Si)2O + 12 HCl
Reactions[edit]
A brown, acidic solution of iron(III) chloride
When dissolved in water, iron(III) chloride give a strongly acidic solution.[14][9]
When heated with iron(III) oxide at 350 °C, iron(III) chloride gives iron oxychloride.[15]
- FeCl3 + Fe2O3 → 3FeOCl
The anhydrous salt is a moderately strong Lewis acid, forming adducts with Lewis bases such as triphenylphosphine oxide; e.g., FeCl3(OPPh3)2 where Ph is phenyl. It also reacts with other chloride salts to give the yellow tetrahedral [FeCl4]− ion. Salts of [FeCl4]− in hydrochloric acid can be extracted into diethyl ether.
Redox reactions[edit]
Iron(III) chloride is a mild oxidizing agent, for example, it oxidizes copper(I) chloride to copper(II) chloride.
- FeCl3 + CuCl → FeCl2 + CuCl2
In a comproportionation reaction, it reacts with iron to form iron(II) chloride:
- 2 FeCl3 + Fe → 3 FeCl2
A traditional synthesis of anhydrous ferrous chloride is the reduction of FeCl3 with chlorobenzene:[16]
- 2 FeCl3 + C6H5Cl → 2 FeCl2 + C6H4Cl2 + HCl
With carboxylate anions[edit]
Oxalates react rapidly with aqueous iron(III) chloride to give [Fe(C2O4)3]3−. Other carboxylate salts form complexes; e.g., citrate and tartrate.
With alkali metal alkoxides[edit]
Alkali metal alkoxides react to give the metal alkoxide complexes of varying complexity.[17] The compounds can be dimeric or trimeric.[18] In the solid phase a variety of multinuclear complexes have been described for the nominal stoichiometric reaction between FeCl3 and sodium ethoxide:[19][20]
- FeCl3 + 3 [CH3CH2O]−Na+ → Fe(OCH2CH3)3 + 3 NaCl
With organometallic compounds[edit]
Iron(III) chloride in ether solution oxidizes methyl lithium LiCH3 to give first light greenish yellow lithium tetrachloroferrate(III) Li[FeCl4] solution and then, with further addition of methyl lithium, lithium tetrachloroferrate(II) Li2[FeCl4]:[21]
- 2 FeCl3 + LiCH3 → FeCl2 + Li[FeCl4] + •CH3
- Li[FeCl4] + LiCH3 → Li2[FeCl4] + •CH3
The methyl radicals combine with themselves or react with other components to give mostly ethane C2H6 and some methane CH4.
Uses[edit]
Industrial[edit]
Iron(III) chloride is used in sewage treatment and drinking water production as a coagulant and flocculant.[22] In this application, FeCl3 in slightly basic water reacts with the hydroxide ion (OH−) to form a floc of iron(III) hydroxide (Fe(OH)3), also formulated as FeO(OH) (ferrihydrite), that can remove suspended materials.
- [Fe(H2O)6]3+ + 4 OH− → [Fe(OH)4(H2O)2]− + 4 H2O → [FeO(OH)2(H2O)]− + 6 H2O
It is also used as a leaching agent in chloride hydrometallurgy,[23] for example in the production of Si from FeSi (Silgrain process by Elkem).[24]
Another important application of iron(III) chloride is etching copper in two-step redox reaction to copper(I) chloride and then to copper(II) chloride in the production of printed circuit boards (PCB).[25]
- FeCl3 + Cu → FeCl2 + CuCl
- FeCl3 + CuCl → FeCl2 + CuCl2
Iron(III) chloride is used as catalyst for the reaction of ethylene with chlorine, forming ethylene dichloride (1,2-dichloroethane), an important commodity chemical, which is mainly used for the industrial production of vinyl chloride, the monomer for making PVC.
- H2C=CH2 + Cl2 → ClCH2CH2Cl
Laboratory use[edit]
In the laboratory iron(III) chloride is commonly employed as a Lewis acid for catalysing reactions such as chlorination of aromatic compounds and Friedel–Crafts reaction of aromatics.[citation needed] It is less powerful than aluminium chloride, but in some cases this mildness leads to higher yields, for example in the alkylation of benzene:
The ferric chloride test is a traditional colorimetric test for phenols, which uses a 1% iron(III) chloride solution that has been neutralized with sodium hydroxide until a slight precipitate of FeO(OH) is formed.[26] The mixture is filtered before use. The organic substance is dissolved in water, methanol or ethanol, then the neutralized iron(III) chloride solution is added—a transient or permanent coloration (usually purple, green or blue) indicates the presence of a phenol or enol.
This reaction is exploited in the Trinder spot test, which is used to indicate the presence of salicylates, particularly salicylic acid, which contains a phenolic OH group.
This test can be used to detect the presence of gamma-hydroxybutyric acid and gamma-butyrolactone,[27] which cause it to turn red-brown.
Other uses[edit]
- Used in anhydrous form as a drying reagent in certain reactions.
- Used to detect the presence of phenol compounds in organic synthesis; e.g., examining purity of synthesized Aspirin.
- Used in water and wastewater treatment to precipitate phosphate as iron(III) phosphate.
- Used in wastewater treatment for odor control.
- Used by American coin collectors to identify the dates of Buffalo nickels that are so badly worn that the date is no longer visible.
- Used by bladesmiths and artisans in pattern welding to etch the metal, giving it a contrasting effect, to view metal layering or imperfections.
- Used to etch the widmanstatten pattern in iron meteorites.
- Necessary for the etching of photogravure plates for printing photographic and fine art images in intaglio and for etching rotogravure cylinders used in the printing industry.
- Used to make printed circuit boards (PCBs) by etching copper.
- Used to strip aluminum coating from mirrors.
- Used to etch intricate medical devices.
- Used in veterinary practice to treat overcropping of an animal’s claws, particularly when the overcropping results in bleeding.
- Reacts with cyclopentadienylmagnesium bromide in one preparation of ferrocene, a metal-sandwich complex.[28]
- Sometimes used in a technique of Raku ware firing, the iron coloring a pottery piece shades of pink, brown, and orange.
- Used to test the pitting and crevice corrosion resistance of stainless steels and other alloys.
- Used in conjunction with NaI in acetonitrile to mildly reduce organic azides to primary amines.[29]
- Used in an animal thrombosis model.[30]
- Used in an experimental energy storage systems.[31]
- Historically it was used to make direct positive blueprints.[32][33]
- A component of modified Carnoy’s solution used for surgical treatment of keratocystic odontogenic tumor (KOT).
- Used as an additive to sodium chloride (NaCl) to produce clear crystals.
Safety[edit]
Iron(III) chloride is harmful, highly corrosive and acidic. The anhydrous material is a powerful dehydrating agent.
Although reports of poisoning in humans are rare, ingestion of ferric chloride can result in serious morbidity and mortality. Inappropriate labeling and storage lead to accidental swallowing or misdiagnosis. Early diagnosis is important, especially in seriously poisoned patients.
Natural occurrence[edit]
The natural counterpart of FeCl3 is the rare mineral molysite, usually related to volcanic and other-type fumaroles.[34][35]
FeCl3 is also produced as an atmospheric salt aerosol by reaction between iron-rich dust and hydrochloric acid from sea salt. This iron salt aerosol causes about 5% of naturally-occurring oxidization of methane and is thought to have a range of cooling effects.[36]
The atmosphere of the planet Venus is approximately 1% FeCl3.[37][38]
See also[edit]
- Verhoeff’s stain
- Ferrosilicon
Notes[edit]
- ^ An alternative GHS classification from the Japanese GHS Inter-ministerial Committee (2006)[7] notes the possibility of respiratory tract irritation from FeCl3 and differs slightly in other respects from the classification used here.
References[edit]
- ^ a b c d e f Haynes, William M., ed. (2011). CRC Handbook of Chemistry and Physics (92nd ed.). Boca Raton, FL: CRC Press. p. 4.69. ISBN 1-4398-5511-0.
- ^ Haynes, William M., ed. (2011). CRC Handbook of Chemistry and Physics (92nd ed.). Boca Raton, FL: CRC Press. p. 4.133. ISBN 1-4398-5511-0.
- ^ a b Hashimoto S, Forster K, Moss SC (1989). «Structure refinement of an FeCl3 crystal using a thin plate sample». J. Appl. Crystallogr. 22 (2): 173–180. doi:10.1107/S0021889888013913.
- ^ NIOSH Pocket Guide to Chemical Hazards. «#0346». National Institute for Occupational Safety and Health (NIOSH).
- ^ HSNO Chemical Classification Information Database, New Zealand Environmental Risk Management Authority, retrieved 19 Sep 2010
- ^ Various suppliers, collated by the Baylor College of Dentistry, Texas A&M University. (accessed 2010-09-19)
- ^ GHS classification – ID 831, Japanese GHS Inter-ministerial Committee, 2006, retrieved 19 Sep 2010
- ^ Holleman AF, Wiberg E (2001). Wiberg N (ed.). Inorganic Chemistry. San Diego: Academic Press. ISBN 978-0-12-352651-9.
- ^ a b c Simon A. Cotton (2018). «Iron(III) chloride and its coordination chemistry». Journal of Coordination Chemistry. 71 (21): 3415–3443. doi:10.1080/00958972.2018.1519188. S2CID 105925459.
- ^ Lind, M. D. (1967). «Crystal Structure of Ferric Chloride Hexahydrate». The Journal of Chemical Physics. 47 (3): 990–993. Bibcode:1967JChPh..47..990L. doi:10.1063/1.1712067.
- ^ Tarr BR, Booth HS, Dolance A (1950). Anhydrous Iron(III) Chloride. Inorganic Syntheses. Vol. 3. pp. 191–194. doi:10.1002/9780470132340.ch51.
- ^ Pray AR, Heitmiller RF, Strycker S, et al. (1990). «Anhydrous Metal Chlorides». Inorganic Syntheses. Vol. 28. pp. 321–323. doi:10.1002/9780470132593.ch80. ISBN 9780470132593.
- ^ Boudjouk P, So JH, Ackermann MN, et al. (1992). «Solvated and Unsolvated Anhydrous Metal Chlorides from Metal Chloride Hydrates». Inorganic Syntheses. Inorganic Syntheses. Vol. 29. pp. 108–111. doi:10.1002/9780470132609.ch26. ISBN 9780470132609.
- ^ Housecroft, C. E.; Sharpe, A. G. (2012). Inorganic Chemistry (4th ed.). Prentice Hall. p. 747. ISBN 978-0-273-74275-3.
- ^
Kikkawa S, Kanamaru F, Koizumi M, et al. (1984). «Layered Intercalation Compounds». In Holt SL Jr (ed.). Inorganic Syntheses. John Wiley & Sons, Inc. pp. 86–89. doi:10.1002/9780470132531.ch17. ISBN 9780470132531. - ^ P. Kovacic and N. O. Brace (1960). «Iron(II) Chloride». Inorganic Syntheses. Inorganic Syntheses. Vol. 6. pp. 172–173. doi:10.1002/9780470132371.ch54. ISBN 9780470132371.
- ^ Turova NY, Turevskaya EP, Kessler VG, et al., eds. (2002). «12.22.1 Synthesis». The Chemistry of Metal Alkoxides. Springer Science. p. 481. ISBN 0306476576.
- ^ Bradley DC, Mehrotra RC, Rothwell I, et al. (2001). «3.2.10. Alkoxides of later 3d metals». Alkoxo and aryloxo derivatives of metals. San Diego: Academic Press. p. 69. ISBN 9780121241407. OCLC 162129468.
- ^
Michael V, Grätz F, Huch V (2001). «Fe9O3(OC2H5)21•C2H5OH—A New Structure Type of an Uncharged Iron(III) Oxide-Alkoxide Cluster». Eur. J. Inorg. Chem. 2001 (2): 367. doi:10.1002/1099-0682(200102)2001:2<367::AID-EJIC367>3.0.CO;2-V. - ^
Seisenbaeva GA, Gohil S, Suslova EV, et al. (2005). «The synthesis of iron (III) ethoxide revisited: Characterization of the metathesis products of iron (III) halides and sodium ethoxide». Inorg. Chim. Acta. 358 (12): 3506–3512. doi:10.1016/j.ica.2005.03.048. - ^ Berthold HJ, Spiegl HJ (1972). «Über die Bildung von Lithiumtetrachloroferrat(II) Li2FeCl4 bei der Umsetzung von Eisen(III)-chlorid mil Lithiummethyl (1:1) in ätherischer Lösung». Z. Anorg. Allg. Chem. (in German). 391 (3): 193–202. doi:10.1002/zaac.19723910302.
- ^ Water Treatment Chemicals (PDF). Akzo Nobel Base Chemicals. 2007. Archived from the original (PDF) on 13 August 2010. Retrieved 26 Oct 2007.
- ^ Park KH, Mohapatra D, Reddy BR (2006). «A study on the acidified ferric chloride leaching of a complex (Cu–Ni–Co–Fe) matte». Separation and Purification Technology. 51 (3): 332–337. doi:10.1016/j.seppur.2006.02.013.
- ^ Dueñas Díez M, Fjeld M, Andersen E, et al. (2006). «Validation of a compartmental population balance model of an industrial leaching process: The Silgrain process». Chem. Eng. Sci. 61 (1): 229–245. doi:10.1016/j.ces.2005.01.047.
- ^ Greenwood NN, Earnshaw A (1997). Chemistry of the Elements (2nd ed.). Oxford: Butterworth-Heinemann. p. 1084. ISBN 9780750633659.
- ^
Furniss BS, Hannaford AJ, Smith PW, et al. (1989). Vogel’s Textbook of Practical Organic Chemistry (5th ed.). New York: Longman/Wiley. ISBN 9780582462366. - ^
Zhang SY, Huang ZP (2006). «A color test for rapid screening of gamma-hydroxybutyric acid (GHB) and gamma-butyrolactone (GBL) in drink and urine». Fa Yi Xue Za Zhi. 22 (6): 424–7. PMID 17285863. - ^ Kealy TJ, Pauson PL (1951). «A New Type of Organo-Iron Compound». Nature. 168 (4285): 1040. Bibcode:1951Natur.168.1039K. doi:10.1038/1681039b0. S2CID 4181383.
- ^ Kamal A, Ramana K, Ankati H, et al. (2002). «Mild and efficient reduction of azides to amines: synthesis of fused [2,1-b]quinazolines». Tetrahedron Lett. 43 (38): 6861–6863. doi:10.1016/S0040-4039(02)01454-5.
- ^ Tseng M, Dozier A, Haribabu B, et al. (2006). «Transendothelial migration of ferric ion in FeCl3 injured murine common carotid artery». Thromb. Res. 118 (2): 275–280. doi:10.1016/j.thromres.2005.09.004. PMID 16243382.
- ^ Manohar, Aswin K.; Kim, Kyu Min; Plichta, Edward; Hendrickson, Mary; Rawlings, Sabrina; Narayanan, S. R. (28 October 2015). «A High Efficiency Iron-Chloride Redox Flow Battery for Large-Scale Energy Storage». Journal of the Electrochemical Society. 163 (1): A5118. doi:10.1149/2.0161601jes. ISSN 1945-7111. S2CID 100823390.
- ^ US Patent 241713, Pellet H, «Method of preparing paper», published 1881
- ^ Lietze E (1888). Modern Heliographic Processes. New York: D. Van Norstrand Company. pp. 65.
- ^ «Molysite». www.mindat.org.
- ^ «List of Minerals». www.ima-mineralogy.org. March 21, 2011.
- ^ Oeste, Franz Dietrich; de Richter, Renaud; Ming, Tingzhen; Caillol, Sylvain (January 13, 2017). «Climate engineering by mimicking natural dust climate control: the iron salt aerosol method». Earth System Dynamics. 8 (1): 1–54. Bibcode:2017ESD…..8….1O. doi:10.5194/esd-8-1-2017 – via esd.copernicus.org.
- ^ Krasnopolsky, V. A.; Parshev, V. A. (1981). «Chemical composition of the atmosphere of Venus». Nature. 292 (5824): 610–613. Bibcode:1981Natur.292..610K. doi:10.1038/292610a0. S2CID 4369293.
- ^ Krasnopolsky, Vladimir A. (2006). «Chemical composition of Venus atmosphere and clouds: Some unsolved problems». Planetary and Space Science. 54 (13–14): 1352–1359. Bibcode:2006P&SS…54.1352K. doi:10.1016/j.pss.2006.04.019.
Further reading[edit]
- Lide DR, ed. (1990). CRC Handbook of Chemistry and Physics (71st ed.). Ann Arbor, MI, USA: CRC Press. ISBN 9780849304712.
- Stecher PG, Finkel MJ, Siegmund OH, eds. (1960). The Merck Index of Chemicals and Drugs (7th ed.). Rahway, NJ, USA: Merck & Co.
- Nicholls D (1974). Complexes and First-Row Transition Elements, Macmillan Press, London, 1973. A Macmillan chemistry text. London: Macmillan Press. ISBN 9780333170885.
- Wells AF (1984). Structural Inorganic Chemistry. Oxford science publications (5th ed.). Oxford, UK: Oxford University Press. ISBN 9780198553700.
- March J (1992). Advanced Organic Chemistry (4th ed.). New York: John Wiley & Sons, Inc. pp. 723. ISBN 9780471581482.
- Reich HJ, Rigby HJ, eds. (1999). Acidic and Basic Reagents. Handbook of Reagents for Organic Synthesis. New York: John Wiley & Sons, Inc. ISBN 9780471979258.
- Хлорид железа (III)
-
Хлорид железа(III) Общие Систематическое наименование Хлорид железа(III) Химическая формула FeCl3 Отн. молек. масса 162 а. е. м. Молярная масса 162.2 г/моль Физические свойства Плотность вещества 2,8 г/см³ Состояние (ст. усл.) твердый Термические свойства Температура плавления 306 °C Температура кипения 315 °C Химические свойства Растворимость в воде 92 г/100 мл Классификация номер CAS 7705-08-0 Хлорид железа(III), хлорное железо FeCl3 — средняя соль трёхвалентного железа и соляной кислоты.
Содержание
- 1 Физические свойства
- 2 Методы получения
- 3 Химические свойства
- 4 Применение
- 5 См. также
Физические свойства
Мерцающие, слегка зеленоватые листочки с металлическим блеском. Сильно гигроскопичен, на воздухе превращается в гидрат FeCl3· 6Н2О — гигроскопичные жёлтые кристаллы, хорошо растворимые в воде (при 20 °C в 100 г воды растворяется 91,9 г безводной соли). Tпл 309 °C.
Методы получения
- Самым простым методом получения трихлорида железа является действие на жлезные опилки газообразным хлором. При этом, в отличии от действия соляной кислоты, образуется соль трёхвалентного железа:
- 2Fe + 3Cl2 → 2FeCl3
- Также трихлорид получается при окислении хлором хлорида железа(II):
- 2FeCl2 + Cl2 → 2FeCl3
- Также существет достаточно интересный метод окисления оксидом серы(IV):
- 4FeCl2 + SO2 + 4HCl → 4FeCl3 + S + 2H2O
Химические свойства
- При нагревании в атмосферном давлении до температуры плавления, начинается медленное разложение трихлорида железа с образованием дихлорида и молекулярного хлора:
- 2FeCl3 → 2FeCl2 + Cl2↑
- За счёт того, что трихлорид железа является сильной кислотой Льюиса, он вступает во взаимодействие с некоторыми другими хлоридами, при этом образуются комлексные соли тетрахлорожелезной кислоты:
- FeCl3 + Cl− → [FeCl4]−
- При нагревании до 350°C с оксидом железа(III) образуется оксохлорид железа:
- FeCl3 + Fe2O3 → 3FeOCl
- Соли трёхвалентного железа являются слабыми окислителями, в частности, трихлорид железа хорошо окислет металлическую медь, переводя её в растворимые хлориды:
- FeCl3 + Cu → FeCl2 + CuCl
- FeCl3 + CuCl → FeCl2 + CuCl2
Применение
Хлорид железа(III) в роли катализатора реакции электрофильного замещения Фриделя-Крафтса
- Хлорид железа(III) применятеся для травлении печатных плат.
- Применяется как протрава при крашении тканей.
- В промышленных масштабах применяется как коагулянт для очистки воды.
- За счёт чётко выраженных кислотных свойств, широко применяется в качестве катализатора в органическом синтезе. Например, для реакции электрофильного замещения в ароматических углеводородах.
См. также
- Хлорид железа(II)
Wikimedia Foundation.
2010.
Полезное
Смотреть что такое «Хлорид железа (III)» в других словарях:
-
Хлорид железа(III) — У этого термина существуют и другие значения, см. Хлорид железа. Хлорид железа(III) … Википедия
-
хлорид железа(III) — трёххлористое железо, хлористое железо(III) … Cловарь химических синонимов I
-
Хлорид железа(II,III) — Общие Систематическое наименование Хлорид железа(II,III) Традиционные названия Хлористое железо Химическая формула Fe3Cl8 Физические свойства … Википедия
-
Хлорид железа (II) — Хлорид железа(II) (хлористое железо) FeCl2 соль. Содержание 1 Свойства 2 Получение 3 Применение 4 См. также // … Википедия
-
Хлорид хрома(III) — Хлорид хрома(III) … Википедия
-
Хлорид гексаамминхрома(III) — Общие Систематическое наименование Хлорид гексаамминхрома(III) Традиционные названия гексамминхромихлорид Химическая формула [Сr(NH3)6]Cl3 Физические свойства … Википедия
-
Хлорид золота (III) — трихлорид золота AuCl3. Внешний вид красные моноклинные кристаллы. Молярная масса 303,33 г/моль. В безводном состоянии лучше всего получать действием хлора на золотую фольгу или на сухой порошок золота, полученный восстановлением сульфатом… … Википедия
-
Хлорид хрома (III) — Хлорид хрома(III) CrCl3. Свойства Фиолетовые кристаллы; плотность 2,76 г/см3; tпл 1152°С. При 600°С возгоняется в токе хлора и разлагается в его отсутствие на хлор и CrCl2. В воде растворим в присутствии восстановителей (Cr2+, Fe2+). Получение В… … Википедия
-
Хлорид железа(II) — У этого термина существуют и другие значения, см. Хлорид железа. Хлорид железа(II) … Википедия
-
Хлорид железа — неорганическое соединение железа с хлором: Известны следующие хлориды железа: Хлорид железа(II); Хлорид железа(III) … Википедия
| Хлорид железа | |
|---|---|
 |
|
| Систематическое наименование |
Хлорид железа (III) |
| Хим. формула | FeCl3 |
| Состояние | твердый |
| Молярная масса | 162.5 г/моль |
| Плотность | 2,8 г/см³ |
| Т. плав. | 306 °C |
| Т. кип. | 315 °C |
| Растворимость в воде | 92 г/100 мл |
| ГОСТ | ГОСТ 4147-74 |
| Рег. номер CAS | 7705-08-0 |
| PubChem | 24380 |
| Рег. номер EINECS | 231-729-4 |
| SMILES |
Cl[Fe](Cl)Cl |
| InChI |
1S/3ClH.Fe/h3*1H;/q;;;+3/p-3 RBTARNINKXHZNM-UHFFFAOYSA-K |
| RTECS | LJ9100000 |
| ChEBI | 30808 |
| ChemSpider | 22792 |
| ЛД50 | 440 мг/кг (крысы, орально) |
| Токсичность | |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. |
Хлорид железа (III), хлорное железо, также — трихлорид железа. FeCl3 — средняя соль трёхвалентного железа и соляной кислоты.
Физические свойства
Мерцающие, черно-коричневые, либо темно-красные, либо фиолетовые в проходящем свете, зеленые в отраженном свете листочки с металлическим блеском. Сильно гигроскопичен, на воздухе превращается в гидрат FeCl3· 6H2O — гигроскопичные жёлтые, по другим источникам желто-коричневые кристаллы, хорошо растворимые в воде (при 20 °C в 100 г воды растворяется 91,9 г безводной соли). Tпл 309 °C.
Методы получения
- Самым простым методом получения трихлорида железа является действие на железные опилки или раскалённую железную проволоку газообразным хлором. При этом, в отличие от действия соляной кислоты, образуется соль трёхвалентного железа — выделяется бурый дым из мельчайших её частиц:
-
- 2Fe + 3Cl2 → 2FeCl3
- Также трихлорид получается при окислении хлором хлорида железа (II):
-
- 2FeCl2 + Cl2 → 2FeCl3
- Также существует достаточно интересный метод окисления оксидом серы (IV):
-
- 4FeCl2 + SO2↑ + 4HCl → 4FeCl3 + S + 2H2O
- Другим способом получения трихлорида железа (FeCl3) является взаимодействие
оксида железа(III) с соляной кислотой, сопровождающееся выделением воды и энергии в виде тепла:
-
- Fe2O3 + 6HCl → 2FeCl3 + 3H2O + Q↑
Химические свойства
- При нагревании в атмосферном давлении до температуры плавления начинается медленное разложение трихлорида железа с образованием дихлорида и молекулярного хлора:
-
- 2FeCl3 → 2FeCl2 + Cl2
- За счёт того, что трихлорид железа является сильной кислотой Льюиса, он вступает во взаимодействие с некоторыми другими хлоридами, при этом образуются комплексные соли тетрахлороферратной кислоты:
-
- FeCl3 + Cl− → [FeCl4]−
- При нагревании до 350 °C с оксидом железа(III) образуется оксохлорид железа:
-
- FeCl3 + Fe2O3 → 3FeOCl
- Соли трёхвалентного железа являются слабыми окислителями, в частности, трихлорид железа хорошо окисляет металлическую медь, переводя её в растворимые хлориды:
-
- FeCl3 + Cu → FeCl2 + CuCl
- FeCl3 + CuCl → FeCl2 + CuCl2
- реагирует с иодоводородом:
-
- 2FeCl3 + 2HI → 2FeCl2 + I2 + 2HCl
Применение
Хлорид железа (III) в роли катализатора реакции электрофильного замещения Фриделя-Крафтса
- Хлорид железа(III) применяется при травлении печатных плат (радиотехника, системотехника).
- Используется для травления печатных форм (офорт, цинкография), как альтернатива азотной кислоте, реакция с которой сопровождается выделением высокотоксичных паров («лисий хвост»).
- Используется в кузнечном деле для проявления рисунка железа.
- Применяется как протрава при крашении тканей.
- В промышленных масштабах применяется как коагулянт для очистки воды.
- За счёт чётко выраженных кислотных свойств широко применяется в качестве катализатора в органическом синтезе. Например, для реакции электрофильного замещения в ароматических углеводородах.
Безопасность
Хлорид железа (III) является токсичным, высококоррозионным соединением. Безводная соль служит осушителем.
|
Соединения железа |
|---|
|
Хлорное железо — неорганическое вещество, соль соляной кислоты 
Получают соединение различными способами, в том числе экономически дешевым методом — из отходов при производстве хлорида титана и хлорида алюминия.
Свойства
Темные кристаллы с красновато-коричневым металлическим блеском, которые на воздухе быстро приобретают ржаво-коричневый цвет. Очень гигроскопичные, легко растворяются в воде, образуют несколько видов кристаллогидратов. Самый востребованный из них — железо хлорное 6-водное FeCl3 ∙ 6H2O. Растворение в воде сопровождается выделением тепла. Реактив растворяется в спиртах, ацетоне. При нагревании теряет часть хлора, превращаясь в хлорид двухвалентного железа.
Трихлорид железа обладает окислительными свойствами, вступает в реакции с медью и другими металлами, йодоводородом, оксидом железа (III), некоторыми хлоридами металлов. Качественной реакцией на реагент является реакция с фенолом. Несколько капель FeCl3 окрашивают раствор фенола в фиолетовый цвет.
Меры предосторожности

Попадание брызг в глаза приводит к химическому ожогу. Если это произошло, следует немедленно их промыть и обратиться к врачу. Очень опасно проглатывание хлорного железа. Рабочее место должно быть оборудовано вентиляцией, так как вдыхать пары опасно.
Перевозить реактив можно любым видом транспорта. Хранят его в прохладных складах без отопления, без доступа солнечных лучей, в герметичной таре, защищающей от контакта с воздухом.
Раствор трихлорида железа коррозионно активен, поэтому его хранят в стойких к коррозии емкостях.
Применение
- Для быстрого осаждения части растворимых и большинства нерастворимых органических и неорганических примесей из производственных и бытовых сточных вод.
- Для осветления и умягчения воды в водоподготовке.
- В нефтедобыче для нейтрализации сероводорода при ремонте скважин; в нефтеперерабатывающей отрасли в качестве катализатора при производстве термостойких смол и битумов.
- В химпроме — катализатор при производстве органических веществ и материалов.
- В радиоэлектронике, промышленной и любительской, для травления плат, деталей, медной фольги.
- В печатном деле (цинкография, офорт) для изготовления печатных форм.
- В текстильной индустрии (относится к «мягким» протравам, не разрушающим волокна ткани).
- Для замены азотной кислоты в тех случаях, когда в результате реакции выделяется ядовитый оксид азота NO2.
- В качестве хлорирующего агента при извлечении нужных элементов из рудного сырья.
- Для удаления масла из сточных вод масложиркомбинатов; хрома из сточных вод кожевенных предприятий.
- В быту — для удаления гальванических покрытий на основе хрома и меди.
- В строительной индустрии добавляют в портландцемент для ускорения схватываемости и увеличения прочности бетона.
- В косметической, пищевой, пивоваренной, фармацевтической индустрии и ювелирном деле.
В продажу хлорное железо поступает в виде твердого вещества и в виде раствора. В магазине «ПраймКемикалсГрупп» вы можете купить 6-водное хлорное железо в виде кусков или кристаллов, оптом и в розницу. Есть скидки, возможность самовывоза и доставка.
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
qungngeligh213
Вопрос по химии:
Ферум (III) хлорид
напишите пожалуйста формулу
Трудности с пониманием предмета? Готовишься к экзаменам, ОГЭ или ЕГЭ?
Воспользуйся формой подбора репетитора и занимайся онлайн. Пробный урок — бесплатно!
Ответы и объяснения 2
geneghw866
howawskeng98
FeCl3, так как у железа валентность 3, а у хлора валентность 1
3/3=1 (Fe) 3/1=3(Cl)
2Fe + 3Cl2 = 2FeCl3
Знаете ответ? Поделитесь им!
Гость ?
Как написать хороший ответ?
Как написать хороший ответ?
Чтобы добавить хороший ответ необходимо:
- Отвечать достоверно на те вопросы, на которые знаете
правильный ответ; - Писать подробно, чтобы ответ был исчерпывающий и не
побуждал на дополнительные вопросы к нему; - Писать без грамматических, орфографических и
пунктуационных ошибок.
Этого делать не стоит:
- Копировать ответы со сторонних ресурсов. Хорошо ценятся
уникальные и личные объяснения; - Отвечать не по сути: «Подумай сам(а)», «Легкотня», «Не
знаю» и так далее; - Использовать мат — это неуважительно по отношению к
пользователям; - Писать в ВЕРХНЕМ РЕГИСТРЕ.
Есть сомнения?
Не нашли подходящего ответа на вопрос или ответ отсутствует?
Воспользуйтесь поиском по сайту, чтобы найти все ответы на похожие
вопросы в разделе Химия.
Трудности с домашними заданиями? Не стесняйтесь попросить о помощи —
смело задавайте вопросы!
Химия — одна из важнейших и обширных областей естествознания, наука о веществах, их составе и строении, их свойствах, зависящих от состава и строения, их превращениях, ведущих к изменению состава — химических реакциях, а также о законах и закономерностях, которым эти превращения подчиняются.