(Redirected from Naval Jelly)
This article is about orthophosphoric acid. For other acids commonly called «phosphoric acid», see Phosphoric acids and phosphates.

|
||
|
||
| Names | ||
|---|---|---|
| IUPAC name
Phosphoric acid |
||
| Other names
Orthophosphoric acid |
||
| Identifiers | ||
|
CAS Number |
|
|
|
3D model (JSmol) |
|
|
| ChEBI |
|
|
| ChEMBL |
|
|
| ChemSpider |
|
|
| ECHA InfoCard | 100.028.758 |
|
| EC Number |
|
|
| E number | E338 (antioxidants, …) | |
| KEGG |
|
|
|
PubChem CID |
|
|
| RTECS number |
|
|
| UNII |
|
|
| UN number | 1805 | |
|
CompTox Dashboard (EPA) |
|
|
|
InChI
|
||
|
SMILES
|
||
| Properties | ||
|
Chemical formula |
H3PO4 | |
| Molar mass | 97.994 g·mol−1 | |
| Appearance | Colorless solid | |
| Odor | Odorless | |
| Density | 1.6845 g/cm3 (25 °C, 85%),[1] 1.834 g/cm3 (solid)[2] | |
| Melting point | 40–42.4 °C (104.0–108.3 °F; 313.1–315.5 K)[6] | |
| Boiling point |
|
|
|
Solubility in water |
|
|
| Solubility | Soluble in ethanol | |
| log P | −2.15[7] | |
| Vapor pressure | 0.03 mmHg (20 °C)[8] | |
| Conjugate base | Dihydrogen phosphate | |
|
Magnetic susceptibility (χ) |
−43.8·10−6 cm3/mol[10] | |
|
Refractive index (nD) |
|
|
| Viscosity | 2.4–9.4 cP (85% aq. soln.) 147 cP (100%) |
|
| Structure | ||
|
Crystal structure |
Monoclinic | |
|
Molecular shape |
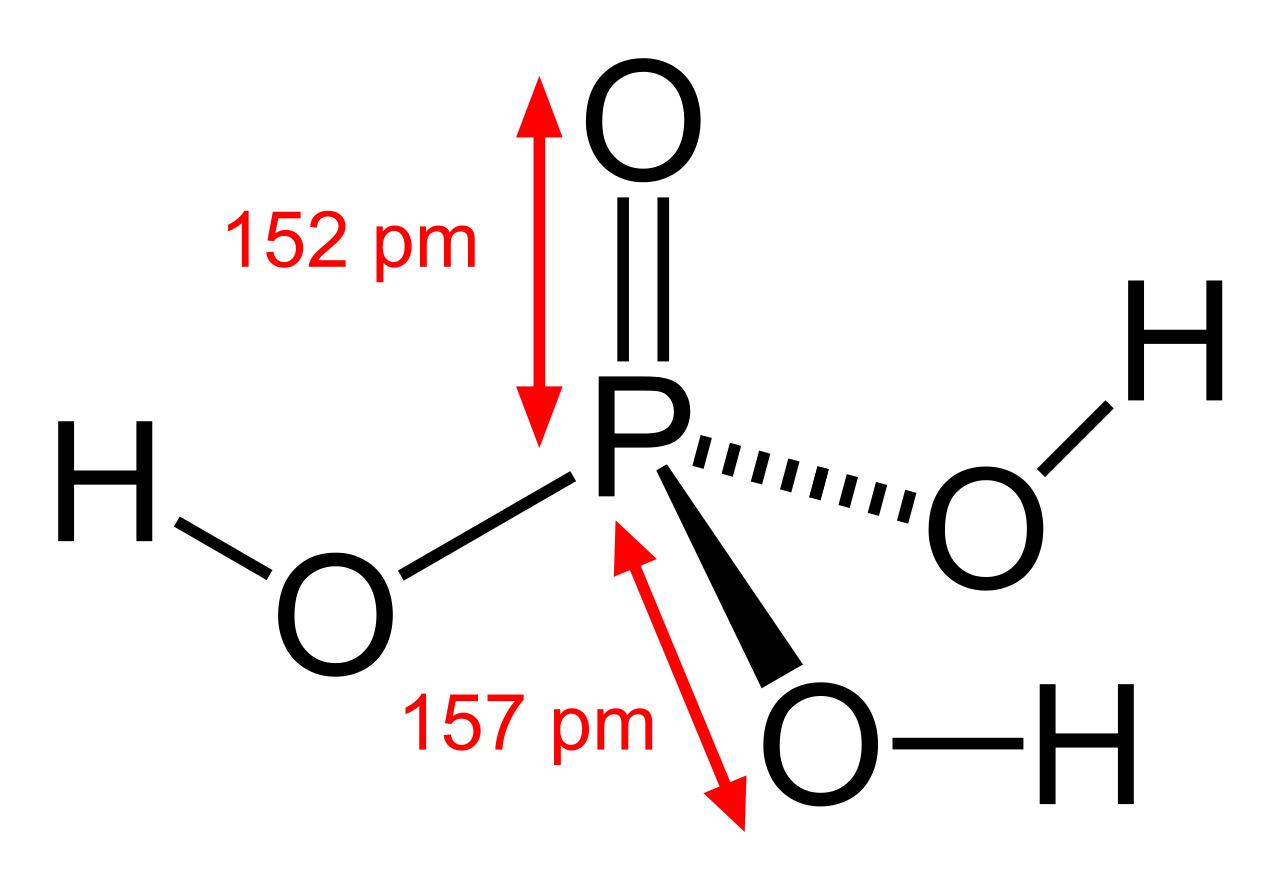
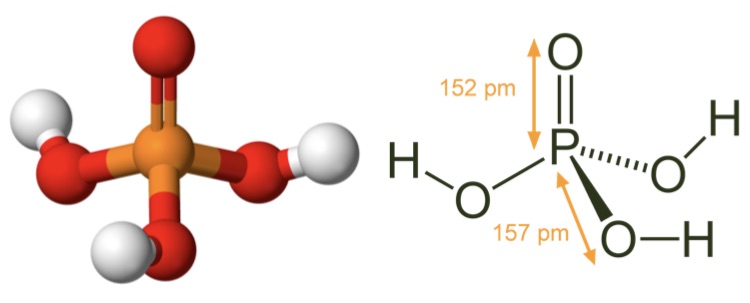
Tetrahedral | |
| Thermochemistry[12] | ||
|
Heat capacity (C) |
145.0 J/(mol⋅K) | |
|
Std molar |
150.8 J/(mol⋅K) | |
|
Std enthalpy of |
−1271.7 kJ/mol | |
|
Gibbs free energy (ΔfG⦵) |
−1123.6 kJ/mol | |
| Hazards | ||
| GHS labelling: | ||
|
Pictograms |
 [13] [13]
|
|
|
Signal word |
Danger | |
|
Hazard statements |
H290, H314[13] | |
|
Precautionary statements |
P280, P305+P351+P338, P310[13] | |
| NFPA 704 (fire diamond) |
3 0 0 |
|
| Flash point | Non-flammable | |
| Lethal dose or concentration (LD, LC): | ||
|
LD50 (median dose) |
1530 mg/kg (rat, oral)[14] | |
| NIOSH (US health exposure limits): | ||
|
PEL (Permissible) |
TWA 1 mg/m3[8] | |
|
REL (Recommended) |
TWA 1 mg/m3 ST 3 mg/m3[8] | |
|
IDLH (Immediate danger) |
1000 mg/m3[8] | |
| Safety data sheet (SDS) | ICSC 1008 | |
| Related compounds | ||
|
Related phosphorus oxoacids |
|
|
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Phosphoric acid (orthophosphoric acid, monophosphoric acid or phosphoric(V) acid) is a colorless, odorless phosphorus-containing solid, and inorganic compound with the chemical formula H3PO4. It is commonly encountered as an 85% aqueous solution, which is a colourless, odourless, and non-volatile syrupy liquid. It is a major industrial chemical, being a component of many fertilizers.
The compound is an acid. Removal of all three H+ ions gives the phosphate ion PO3−4. Removal of one or two protons gives dihydrogen phosphate ion H2PO−4, and the hydrogen phosphate ion HPO2−4, respectively. Phosphoric acid forms esters, called organophosphates.[15]
The name «orthophosphoric acid» can be used to distinguish this specific acid from other «phosphoric acids», such as pyrophosphoric acid. Nevertheless, the term «phosphoric acid» often means this specific compound; and that is the current IUPAC nomenclature.
Production[edit]
Phosphoric acid is produced industrially by one of two routes, wet processes and dry.[16]
Wet process[edit]
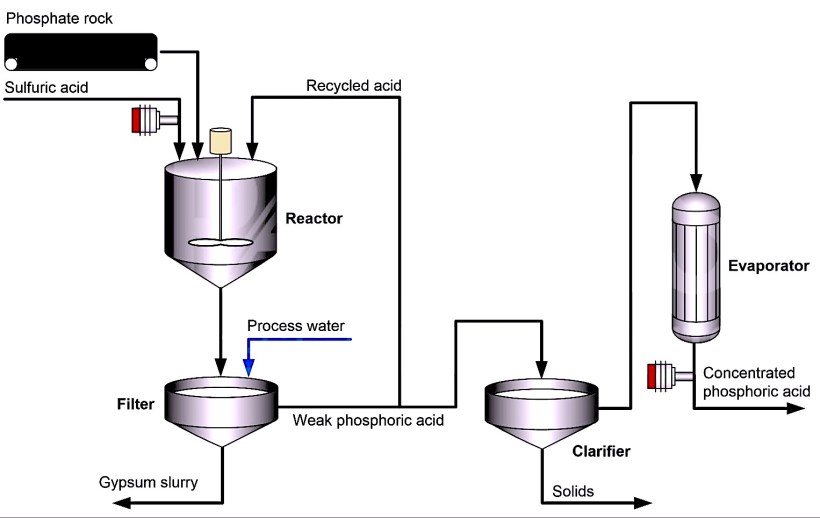
In the wet process, a phosphate-containing mineral such as calcium hydroxyapatite and fluorapatite are treated with sulfuric acid.[17]
- Ca5(PO4)3OH + 5 H2SO4 → 3 H3PO4 + 5 CaSO4 + H2O
- Ca5(PO4)3F + 5 H2SO4 → 3 H3PO4 + 5 CaSO4 + HF
Calcium sulfate (gypsum, CaSO4) is a by-product, which is removed as phosphogypsum. The hydrogen fluoride (HF) gas is streamed into a wet (water) scrubber producing hydrofluoric acid. In both cases the phosphoric acid solution usually contains 23–33% P2O5 (32–46% H3PO4). It may be concentrated to produce commercial- or merchant-grade phosphoric acid, which contains about 54–62% P2O5 (75–85% H3PO4). Further removal of water yields superphosphoric acid with a P2O5 concentration above 70% (corresponding to nearly 100% H3PO4). The phosphoric acid from both processes may be further purified by removing compounds of arsenic and other potentially toxic impurities.
Dry process[edit]
To produce food-grade phosphoric acid, phosphate ore is first reduced with coke in an electric arc furnace, to give elemental phosphorus. Silica is also added, resulting in the production of calcium silicate slag. Elemental phosphorus is distilled out of the furnace and burned with air to produce high-purity phosphorus pentoxide, which is dissolved in water to make phosphoric acid.[18]
Acidic properties[edit]
In aqueous solution phosphoric acid behaves as a triprotic acid.
- H3PO4 ⇌ H2PO−4 + H+, pKa1 = 2.14
- H2PO−4 ⇌ HPO2−4 + H+, pKa2 = 7.20
- HPO2−4 ⇌ PO3−4 + H+, pKa3 = 12.37
The difference between successive pKa values is sufficiently large so that salts of either monohydrogen phosphate, HPO2−4 or dihydrogen phosphate, H2PO−4, can be prepared from a solution of phosphoric acid by adjusting the pH to be mid-way between the respective pK values.
Uses[edit]
The dominant use of phosphoric acid is for fertilizers, consuming approximately 90% of production.[19]
| Application | Demand (2006) in thousands of tons | Main phosphate derivatives |
|---|---|---|
| Soaps and detergents | 1836 | STPP |
| Food industry | 309 | STPP (Na5P3O10), SHMP, TSP, SAPP, SAlP, MCP, DSP (Na2HPO4), H3PO4 |
| Water treatment | 164 | SHMP, STPP, TSPP, MSP (NaH2PO4), DSP |
| Toothpastes | 68 | DCP (CaHPO4), IMP, SMFP |
| Other applications | 287 | STPP (Na3P3O9), TCP, APP, DAP, zinc phosphate (Zn3(PO4)2), aluminium phosphate (AlPO4), H3PO4 |
Food-grade phosphoric acid (additive E338[20]) is used to acidify foods and beverages such as various colas and jams, providing a tangy or sour taste. The phosphoric acid also serves as a preservative.[21] Soft drinks containing phosphoric acid, which would include Coca-Cola, are sometimes called phosphate sodas or phosphates. Phosphoric acid in soft drinks has the potential to cause dental erosion.[22] Phosphoric acid also has the potential to contribute to the formation of kidney stones, especially in those who have had kidney stones previously.[23]
Specific applications of phosphoric acid include:
- in anti-rust treatment by phosphate conversion coating or passivation
- to prevent iron oxidation by means of the Parkerization process
- as an external standard for phosphorus-31 nuclear magnetic resonance
- in phosphoric acid fuel cells
- in activated carbon production[24]
- in compound semiconductor processing, to etch Indium gallium arsenide selectively with respect to indium phosphide[25]
- in microfabrication to etch silicon nitride selectively with respect to silicon dioxide[26]
- in microfabrication to etch aluminum
- as a pH adjuster in cosmetics and skin-care products[27]
- as a sanitizing agent in the dairy, food, and brewing industries[28]
Safety[edit]
Phosphoric acid is not a strong acid. However, at moderate concentrations phosphoric acid solutions are irritating to the skin. Contact with concentrated solutions can cause severe skin burns and permanent eye damage.[29]
A link has been shown between long-term regular cola intake and osteoporosis in later middle age in women (but not men).[30]
See also[edit]
- Phosphate fertilizers, such as ammonium phosphate fertilizers
References[edit]
- ^ Christensen, J. H.; Reed, R. B. (1955). «Design and Analysis Data—Density of Aqueous Solutions of Phosphoric Acid Measurements at 25 °C». Ind. Eng. Chem. 47 (6): 1277–1280. doi:10.1021/ie50546a061.
- ^ «CAMEO Chemicals Datasheet – Phosphoric Acid». Archived from the original on 15 August 2019. Retrieved 15 August 2019.
- ^ «Phosphoric acid». www.chemspider.com. Archived from the original on 12 March 2020. Retrieved 3 March 2020.
- ^ Brown, Earl H.; Whitt, Carlton D. (1952). «Vapor Pressure of Phosphoric Acids». Industrial & Engineering Chemistry. 44 (3): 615–618. doi:10.1021/ie50507a050.
- ^ Seidell, Atherton; Linke, William F. (1952). Solubilities of Inorganic and Organic Compounds. Van Nostrand. Archived from the original on 11 March 2020. Retrieved 2 June 2014.
- ^ a b Haynes, p. 4.80
- ^ «phosphoric acid_msds». Archived from the original on 4 July 2017. Retrieved 2 May 2018.
- ^ a b c d NIOSH Pocket Guide to Chemical Hazards. «#0506». National Institute for Occupational Safety and Health (NIOSH).
- ^ Haynes, p. 5.92
- ^ Haynes, p. 4.134
- ^ Edwards, O. W.; Dunn, R. L.; Hatfield, J. D. (1964). «Refractive Index of Phosphoric Acid Solutions at 25 C.». J. Chem. Eng. Data. 9 (4): 508–509. doi:10.1021/je60023a010.
- ^ Haynes, p. 5.13
- ^ a b c Sigma-Aldrich Co., Phosphoric acid.
- ^ «Phosphoric acid». Immediately Dangerous to Life or Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ^ Westheimer, F.H. (6 June 1987). «Why nature chose phosphates». Science. 235 (4793): 1173–1178 (see pp. 1175–1176). Bibcode:1987Sci…235.1173W. CiteSeerX 10.1.1.462.3441. doi:10.1126/science.2434996. PMID 2434996.
- ^ Becker, Pierre (1988). Phosphates and phosphoric acid. New York: Marcel Dekker. ISBN 978-0824717124.
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. pp. 520–522. ISBN 978-0-08-037941-8.
- ^ Geeson, Michael B.; Cummins, Christopher C. (2020). «Let’s Make White Phosphorus Obsolete». ACS Central Science. 6 (6): 848–860. doi:10.1021/acscentsci.0c00332. PMC 7318074. PMID 32607432.
- ^ Schrödter, Klaus; Bettermann, Gerhard; Staffel, Thomas; Wahl, Friedrich; Klein, Thomas; Hofmann, Thomas (2008). «Phosphoric Acid and Phosphates». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a19_465.pub3.
- ^ «Current EU approved additives and their E Numbers». Foods Standards Agency. 14 March 2012. Archived from the original on 21 August 2013. Retrieved 22 July 2012.
- ^ «Why is phosphoric acid used in some Coca‑Cola drinks?| Frequently Asked Questions | Coca-Cola GB». www.coca-cola.co.uk. Archived from the original on 2 August 2021. Retrieved 31 August 2021.
- ^ Moynihan, P. J. (23 November 2002). «Dietary advice in dental practice». British Dental Journal. 193 (10): 563–568. doi:10.1038/sj.bdj.4801628. PMID 12481178.
- ^ Qaseem, A; Dallas, P; Forciea, MA; Starkey, M; et al. (4 November 2014). «Dietary and pharmacologic management to prevent recurrent nephrolithiasis in adults: A clinical practice guideline from the American College of Physicians». Annals of Internal Medicine. 161 (9): 659–67. doi:10.7326/M13-2908. PMID 25364887.
- ^ Toles, C.; Rimmer, S.; Hower, J. C. (1996). «Production of activated carbons from a washington lignite using phosphoric acid activation». Carbon. 34 (11): 1419. doi:10.1016/S0008-6223(96)00093-0.
- ^ Wet chemical etching. Archived 25 September 2012 at the Wayback Machine umd.edu.
- ^ Wolf, S.; R. N. Tauber (1986). Silicon processing for the VLSI era: Volume 1 – Process technology. p. 534. ISBN 978-0-9616721-6-4.
- ^ «Ingredient dictionary: P». Cosmetic ingredient dictionary. Paula’s Choice. Archived from the original on 18 January 2008. Retrieved 16 November 2007.
- ^ «STAR SAN» (PDF). Five Star Chemicals. Archived (PDF) from the original on 8 February 2016. Retrieved 17 August 2015.
- ^ «Phosphoric Acid, 85 wt.% SDS». Sigma-Aldrich. 5 May 2016. Archived from the original on 18 January 2017. Retrieved 16 January 2017.
- ^ Tucker KL, Morita K, Qiao N, Hannan MT, Cupples LA, Kiel DP (1 October 2006). «Colas, but not other carbonated beverages, are associated with low bone mineral density in older women: The Framingham Osteoporosis Study». American Journal of Clinical Nutrition. 84 (4): 936–942. doi:10.1093/ajcn/84.4.936. PMID 17023723.
Cited sources[edit]
- Haynes, William M., ed. (2011). CRC Handbook of Chemistry and Physics (92nd ed.). CRC Press. ISBN 978-1439855119.
External links[edit]
- National pollutant inventory – Phosphoric acid fact sheet
- NIOSH Pocket guide to chemical hazards
(Redirected from Naval Jelly)
This article is about orthophosphoric acid. For other acids commonly called «phosphoric acid», see Phosphoric acids and phosphates.

|
||
|
||
| Names | ||
|---|---|---|
| IUPAC name
Phosphoric acid |
||
| Other names
Orthophosphoric acid |
||
| Identifiers | ||
|
CAS Number |
|
|
|
3D model (JSmol) |
|
|
| ChEBI |
|
|
| ChEMBL |
|
|
| ChemSpider |
|
|
| ECHA InfoCard | 100.028.758 |
|
| EC Number |
|
|
| E number | E338 (antioxidants, …) | |
| KEGG |
|
|
|
PubChem CID |
|
|
| RTECS number |
|
|
| UNII |
|
|
| UN number | 1805 | |
|
CompTox Dashboard (EPA) |
|
|
|
InChI
|
||
|
SMILES
|
||
| Properties | ||
|
Chemical formula |
H3PO4 | |
| Molar mass | 97.994 g·mol−1 | |
| Appearance | Colorless solid | |
| Odor | Odorless | |
| Density | 1.6845 g/cm3 (25 °C, 85%),[1] 1.834 g/cm3 (solid)[2] | |
| Melting point | 40–42.4 °C (104.0–108.3 °F; 313.1–315.5 K)[6] | |
| Boiling point |
|
|
|
Solubility in water |
|
|
| Solubility | Soluble in ethanol | |
| log P | −2.15[7] | |
| Vapor pressure | 0.03 mmHg (20 °C)[8] | |
| Conjugate base | Dihydrogen phosphate | |
|
Magnetic susceptibility (χ) |
−43.8·10−6 cm3/mol[10] | |
|
Refractive index (nD) |
|
|
| Viscosity | 2.4–9.4 cP (85% aq. soln.) 147 cP (100%) |
|
| Structure | ||
|
Crystal structure |
Monoclinic | |
|
Molecular shape |
Tetrahedral | |
| Thermochemistry[12] | ||
|
Heat capacity (C) |
145.0 J/(mol⋅K) | |
|
Std molar |
150.8 J/(mol⋅K) | |
|
Std enthalpy of |
−1271.7 kJ/mol | |
|
Gibbs free energy (ΔfG⦵) |
−1123.6 kJ/mol | |
| Hazards | ||
| GHS labelling: | ||
|
Pictograms |
 [13] [13]
|
|
|
Signal word |
Danger | |
|
Hazard statements |
H290, H314[13] | |
|
Precautionary statements |
P280, P305+P351+P338, P310[13] | |
| NFPA 704 (fire diamond) |
3 0 0 |
|
| Flash point | Non-flammable | |
| Lethal dose or concentration (LD, LC): | ||
|
LD50 (median dose) |
1530 mg/kg (rat, oral)[14] | |
| NIOSH (US health exposure limits): | ||
|
PEL (Permissible) |
TWA 1 mg/m3[8] | |
|
REL (Recommended) |
TWA 1 mg/m3 ST 3 mg/m3[8] | |
|
IDLH (Immediate danger) |
1000 mg/m3[8] | |
| Safety data sheet (SDS) | ICSC 1008 | |
| Related compounds | ||
|
Related phosphorus oxoacids |
|
|
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Phosphoric acid (orthophosphoric acid, monophosphoric acid or phosphoric(V) acid) is a colorless, odorless phosphorus-containing solid, and inorganic compound with the chemical formula H3PO4. It is commonly encountered as an 85% aqueous solution, which is a colourless, odourless, and non-volatile syrupy liquid. It is a major industrial chemical, being a component of many fertilizers.
The compound is an acid. Removal of all three H+ ions gives the phosphate ion PO3−4. Removal of one or two protons gives dihydrogen phosphate ion H2PO−4, and the hydrogen phosphate ion HPO2−4, respectively. Phosphoric acid forms esters, called organophosphates.[15]
The name «orthophosphoric acid» can be used to distinguish this specific acid from other «phosphoric acids», such as pyrophosphoric acid. Nevertheless, the term «phosphoric acid» often means this specific compound; and that is the current IUPAC nomenclature.
Production[edit]
Phosphoric acid is produced industrially by one of two routes, wet processes and dry.[16]
Wet process[edit]
In the wet process, a phosphate-containing mineral such as calcium hydroxyapatite and fluorapatite are treated with sulfuric acid.[17]
- Ca5(PO4)3OH + 5 H2SO4 → 3 H3PO4 + 5 CaSO4 + H2O
- Ca5(PO4)3F + 5 H2SO4 → 3 H3PO4 + 5 CaSO4 + HF
Calcium sulfate (gypsum, CaSO4) is a by-product, which is removed as phosphogypsum. The hydrogen fluoride (HF) gas is streamed into a wet (water) scrubber producing hydrofluoric acid. In both cases the phosphoric acid solution usually contains 23–33% P2O5 (32–46% H3PO4). It may be concentrated to produce commercial- or merchant-grade phosphoric acid, which contains about 54–62% P2O5 (75–85% H3PO4). Further removal of water yields superphosphoric acid with a P2O5 concentration above 70% (corresponding to nearly 100% H3PO4). The phosphoric acid from both processes may be further purified by removing compounds of arsenic and other potentially toxic impurities.
Dry process[edit]
To produce food-grade phosphoric acid, phosphate ore is first reduced with coke in an electric arc furnace, to give elemental phosphorus. Silica is also added, resulting in the production of calcium silicate slag. Elemental phosphorus is distilled out of the furnace and burned with air to produce high-purity phosphorus pentoxide, which is dissolved in water to make phosphoric acid.[18]
Acidic properties[edit]
In aqueous solution phosphoric acid behaves as a triprotic acid.
- H3PO4 ⇌ H2PO−4 + H+, pKa1 = 2.14
- H2PO−4 ⇌ HPO2−4 + H+, pKa2 = 7.20
- HPO2−4 ⇌ PO3−4 + H+, pKa3 = 12.37
The difference between successive pKa values is sufficiently large so that salts of either monohydrogen phosphate, HPO2−4 or dihydrogen phosphate, H2PO−4, can be prepared from a solution of phosphoric acid by adjusting the pH to be mid-way between the respective pK values.
Uses[edit]
The dominant use of phosphoric acid is for fertilizers, consuming approximately 90% of production.[19]
| Application | Demand (2006) in thousands of tons | Main phosphate derivatives |
|---|---|---|
| Soaps and detergents | 1836 | STPP |
| Food industry | 309 | STPP (Na5P3O10), SHMP, TSP, SAPP, SAlP, MCP, DSP (Na2HPO4), H3PO4 |
| Water treatment | 164 | SHMP, STPP, TSPP, MSP (NaH2PO4), DSP |
| Toothpastes | 68 | DCP (CaHPO4), IMP, SMFP |
| Other applications | 287 | STPP (Na3P3O9), TCP, APP, DAP, zinc phosphate (Zn3(PO4)2), aluminium phosphate (AlPO4), H3PO4 |
Food-grade phosphoric acid (additive E338[20]) is used to acidify foods and beverages such as various colas and jams, providing a tangy or sour taste. The phosphoric acid also serves as a preservative.[21] Soft drinks containing phosphoric acid, which would include Coca-Cola, are sometimes called phosphate sodas or phosphates. Phosphoric acid in soft drinks has the potential to cause dental erosion.[22] Phosphoric acid also has the potential to contribute to the formation of kidney stones, especially in those who have had kidney stones previously.[23]
Specific applications of phosphoric acid include:
- in anti-rust treatment by phosphate conversion coating or passivation
- to prevent iron oxidation by means of the Parkerization process
- as an external standard for phosphorus-31 nuclear magnetic resonance
- in phosphoric acid fuel cells
- in activated carbon production[24]
- in compound semiconductor processing, to etch Indium gallium arsenide selectively with respect to indium phosphide[25]
- in microfabrication to etch silicon nitride selectively with respect to silicon dioxide[26]
- in microfabrication to etch aluminum
- as a pH adjuster in cosmetics and skin-care products[27]
- as a sanitizing agent in the dairy, food, and brewing industries[28]
Safety[edit]
Phosphoric acid is not a strong acid. However, at moderate concentrations phosphoric acid solutions are irritating to the skin. Contact with concentrated solutions can cause severe skin burns and permanent eye damage.[29]
A link has been shown between long-term regular cola intake and osteoporosis in later middle age in women (but not men).[30]
See also[edit]
- Phosphate fertilizers, such as ammonium phosphate fertilizers
References[edit]
- ^ Christensen, J. H.; Reed, R. B. (1955). «Design and Analysis Data—Density of Aqueous Solutions of Phosphoric Acid Measurements at 25 °C». Ind. Eng. Chem. 47 (6): 1277–1280. doi:10.1021/ie50546a061.
- ^ «CAMEO Chemicals Datasheet – Phosphoric Acid». Archived from the original on 15 August 2019. Retrieved 15 August 2019.
- ^ «Phosphoric acid». www.chemspider.com. Archived from the original on 12 March 2020. Retrieved 3 March 2020.
- ^ Brown, Earl H.; Whitt, Carlton D. (1952). «Vapor Pressure of Phosphoric Acids». Industrial & Engineering Chemistry. 44 (3): 615–618. doi:10.1021/ie50507a050.
- ^ Seidell, Atherton; Linke, William F. (1952). Solubilities of Inorganic and Organic Compounds. Van Nostrand. Archived from the original on 11 March 2020. Retrieved 2 June 2014.
- ^ a b Haynes, p. 4.80
- ^ «phosphoric acid_msds». Archived from the original on 4 July 2017. Retrieved 2 May 2018.
- ^ a b c d NIOSH Pocket Guide to Chemical Hazards. «#0506». National Institute for Occupational Safety and Health (NIOSH).
- ^ Haynes, p. 5.92
- ^ Haynes, p. 4.134
- ^ Edwards, O. W.; Dunn, R. L.; Hatfield, J. D. (1964). «Refractive Index of Phosphoric Acid Solutions at 25 C.». J. Chem. Eng. Data. 9 (4): 508–509. doi:10.1021/je60023a010.
- ^ Haynes, p. 5.13
- ^ a b c Sigma-Aldrich Co., Phosphoric acid.
- ^ «Phosphoric acid». Immediately Dangerous to Life or Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ^ Westheimer, F.H. (6 June 1987). «Why nature chose phosphates». Science. 235 (4793): 1173–1178 (see pp. 1175–1176). Bibcode:1987Sci…235.1173W. CiteSeerX 10.1.1.462.3441. doi:10.1126/science.2434996. PMID 2434996.
- ^ Becker, Pierre (1988). Phosphates and phosphoric acid. New York: Marcel Dekker. ISBN 978-0824717124.
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. pp. 520–522. ISBN 978-0-08-037941-8.
- ^ Geeson, Michael B.; Cummins, Christopher C. (2020). «Let’s Make White Phosphorus Obsolete». ACS Central Science. 6 (6): 848–860. doi:10.1021/acscentsci.0c00332. PMC 7318074. PMID 32607432.
- ^ Schrödter, Klaus; Bettermann, Gerhard; Staffel, Thomas; Wahl, Friedrich; Klein, Thomas; Hofmann, Thomas (2008). «Phosphoric Acid and Phosphates». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a19_465.pub3.
- ^ «Current EU approved additives and their E Numbers». Foods Standards Agency. 14 March 2012. Archived from the original on 21 August 2013. Retrieved 22 July 2012.
- ^ «Why is phosphoric acid used in some Coca‑Cola drinks?| Frequently Asked Questions | Coca-Cola GB». www.coca-cola.co.uk. Archived from the original on 2 August 2021. Retrieved 31 August 2021.
- ^ Moynihan, P. J. (23 November 2002). «Dietary advice in dental practice». British Dental Journal. 193 (10): 563–568. doi:10.1038/sj.bdj.4801628. PMID 12481178.
- ^ Qaseem, A; Dallas, P; Forciea, MA; Starkey, M; et al. (4 November 2014). «Dietary and pharmacologic management to prevent recurrent nephrolithiasis in adults: A clinical practice guideline from the American College of Physicians». Annals of Internal Medicine. 161 (9): 659–67. doi:10.7326/M13-2908. PMID 25364887.
- ^ Toles, C.; Rimmer, S.; Hower, J. C. (1996). «Production of activated carbons from a washington lignite using phosphoric acid activation». Carbon. 34 (11): 1419. doi:10.1016/S0008-6223(96)00093-0.
- ^ Wet chemical etching. Archived 25 September 2012 at the Wayback Machine umd.edu.
- ^ Wolf, S.; R. N. Tauber (1986). Silicon processing for the VLSI era: Volume 1 – Process technology. p. 534. ISBN 978-0-9616721-6-4.
- ^ «Ingredient dictionary: P». Cosmetic ingredient dictionary. Paula’s Choice. Archived from the original on 18 January 2008. Retrieved 16 November 2007.
- ^ «STAR SAN» (PDF). Five Star Chemicals. Archived (PDF) from the original on 8 February 2016. Retrieved 17 August 2015.
- ^ «Phosphoric Acid, 85 wt.% SDS». Sigma-Aldrich. 5 May 2016. Archived from the original on 18 January 2017. Retrieved 16 January 2017.
- ^ Tucker KL, Morita K, Qiao N, Hannan MT, Cupples LA, Kiel DP (1 October 2006). «Colas, but not other carbonated beverages, are associated with low bone mineral density in older women: The Framingham Osteoporosis Study». American Journal of Clinical Nutrition. 84 (4): 936–942. doi:10.1093/ajcn/84.4.936. PMID 17023723.
Cited sources[edit]
- Haynes, William M., ed. (2011). CRC Handbook of Chemistry and Physics (92nd ed.). CRC Press. ISBN 978-1439855119.
External links[edit]
- National pollutant inventory – Phosphoric acid fact sheet
- NIOSH Pocket guide to chemical hazards
Фосфорная кислота
Строение молекулы и физические свойства
Фосфор в степени окисления +5 образует несколько кислот: орто-фосфорную H3PO4, мета-фосфорную HPO3, пиро-фосфорную H4P2O7.
Фосфорная кислота H3PO4 – это кислота средней силы, трехосновная, прочная и нелетучая. При обычных условиях фосфорная кислота – твердое вещество, хорошо растворимое в воде и гигроскопичное.
Валентность фосфора в фосфорной кислоте равна V.
При температуре выше +213 °C орто-фосфорная кислота переходит в пирофосфорную H4P2O7.
При взаимодействии высшего оксида фосфора с водой на холоде образуется метафосфорная кислота HPO3, представляющая собой прозрачную стекловидную массу.
Способы получения
Наибольшее практическое значение из фосфорных кислот имеет ортофосфорная кислота.
1. Получить орто-фосфорную кислоту можно взаимодействием оксида фосфора (V) с водой:
P2O5 + 3H2O → 2H3PO4
2. Еще один способ получения фосфорной кислоты — вытеснение фосфорной кислоты из солей (фосфатов, гидрофосфатов и дигидрофосфатов) под действием более сильных кислот (серной, азотной, соляной и др.).
Промышленный способ получения фосфорной кислоты обработка фосфорита концентрированной серной кислотой:
Ca3(PO4)2(тв) + 3H2SO4(конц) → 2H3PO4 + 3CaSO4
3. Фосфорную кислоту также можно получить жестким окислением соединений фосфора в водном растворе в присутствии кислот.
Например, концентрированная азотная кислота окисляет фосфор до фосфорной кислоты:
5HNO3 + P → H3PO4 + 5NO2↑ + H2O
Химические свойства
Фосфорная кислота – это кислота средней силы (по второй и третьей ступени слабая).
1. Фосфорная кислота частично и ступенчато диссоциирует в водном растворе.
H3PO4 ⇄ H+ + H2PO4–
H2PO4– ⇄ H+ + HPO42–
HPO42– ⇄ H+ + PO43–
2. Фосфорная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами.
Например, фосфорная кислота взаимодействует с оксидом магния:
2H3PO4 + 3MgO → Mg3(PO4)2 + 3H2O
Еще пример: при взаимодействии фосфорной кислоты с гидроксидом калия образуются фосфаты, гидрофосфаты или дигидрофосфаты:
H3PO4 + КОН → KH2РО4 + H2O
H3PO4 + 2КОН → К2НРО4 + 2H2O
H3PO4 + 3КОН → К3РО4 + 3H2O
3. Фосфорная кислота вытесняет более слабые кислоты из их солей (карбонатов, сульфидов и др.). Также фосфорная кислота вступает в обменные реакции с солями.
Например, фосфорная кислота взаимодействует с гидрокарбонатом натрия:
Н3PO4 + 3NaHCO3 → Na3PO4 + CO2 + 3H2O
4. При нагревании H3PO4 до 200°С происходит отщепление от нее молекулы воды с образованием пирофосфорной кислоты H2P2O7:
2H3PO4 → H2P2O7 + H2O
5. Фосфорная кислота взаимодействует с металлами, которые расположены в ряду активности металлов до водорода. При этом образуются соль и водород.
Например, фосфорная кислота реагирует с магнием:
2H3PO4 + 3Mg → Mg3(PO4)2 + 3H2
Фосфорная кислота взаимодействует также с аммиаком с образованием солей аммония:
2H3PO4 + 3NH3 → NH4H2PO4 + (NH4)2HPO4
7. Качественная реакция на фосфат-ионы и фосфорную кислоту — взаимодействие с нитратом серебра. При этом образуется ярко-желтый осадок фосфата серебра:
Н3PO4 + 3AgNO3 → Ag3PO4↓ + 3НNO3
Видеоопыт взаимодействия фосфата натрия и нитрата серебра в растворе (качественная реакция на фосфат-ион) можно посмотреть здесь.
Фосфорная (ортофосфорная) кислота
H3PO4
представляет собой твёрдое прозрачное кристаллическое вещество. Она очень хорошо растворяется в воде (смешивается в любых соотношениях) и обычно применяется в виде растворов.
Рис. (1). Раствор фосфорной кислоты
В водных растворах фосфорная кислота диссоциирует ступенчато:
Диссоциация на каждой следующей ступени протекает слабее, чем на предыдущей. Полностью на ионы фосфорная кислота не распадается и относится к кислотам средней силы. Она менее активна в химических реакциях по сравнению с серной, азотной, соляной кислотами.
Фосфорная кислота вступает в реакции:
- с металлами, расположенными в ряду активности до водорода:
;
- с основными оксидами:
- с основаниями:
- с солями, если выделяется газ или осадок:
;
- с аммиаком:
В реакциях могут образовываться не только средние соли фосфаты с кислотным остатком
PO43−
, но и кислые: гидрофосфаты (HPO42−) и дигидрофосфаты (
H2PO4−
). В названиях кислых солей приставка гидро- обозначает атом водорода, а дигидро- — два атома водорода. Состав соли зависит от мольных соотношений кислоты и реагирующего с ней вещества:
,
Средние соли фосфорной кислоты фосфаты (например,
Ca3(PO4)2
) нерастворимы в воде, кроме фосфатов щелочных металлов. Характерную жёлтую окраску имеет фосфат серебра. Это свойство используется для качественного определения растворимых фосфатов. При добавлении к ним раствора нитрата серебра выпадает жёлтый осадок, растворимый в азотной кислоте:
Рис. (2). Фосфат серебра
Большинство дигидрофосфатов (
CaH2PO4
и др.) растворяется в воде хорошо. Гидрофосфаты (
Ca(HPO4)2
и др.) растворяются лучше, чем фосфаты, но хуже по сравнению с дигидрофосфатами.
Фосфорная кислота используется:
- для производства минеральных удобрений,
- в качестве пищевой добавки в напитках,
- в производстве синтетических моющих средств,
- на производстве кормовых добавок для животных.
Соли фосфорной кислоты применяются в качестве минеральных удобрений.
Рис. (3). Суперфосфат
Источники:
Рис. 1. Раствор фосфорной кислоты https://www.shutterstock.com/ru/image-photo/selective-focus-phosphoric-acid-solution-brown-1806002407
Рис. 2. Фосфат серебра © ЯКласс
Рис. 3. Суперфосфат https://cdn.pixabay.com/photo/2017/12/28/12/29/fertilizer-3045121_960_720.jpg
Формула фосфорной кислоты
Определение и формула фосфорной кислоты
Химическая формула –
Молярная масса равна г/моль.
Физические свойства – при комнатной температуре это бесцветные гигроскопичные кристаллы с температурой плавления , температурой кипения
, растворимость в воде составляет 5,48 г/мл.
Химические свойства фосфорной кислоты
— трёхосновная кислота средней силы. В водных растворах подвергается электролитической диссоциации в три стадии. Её показатели констант диссоциации имеют следующие значения
.
-
взаимодействует c металлами, стоящими в ряду напряжения до водорода, с оксидами металлов, с основаниями, с солями и очень сильными кислотами:
- При нагревании выше
превращается в пирофосфорную кислоту
:
- При нагревании выше
H_3PO_4 превращается в метафосфорную кислоту:
Получение фосфорной кислоты
- Фосфорную кислоту можно получить из фосфата кальция:
- Можно синтезировать гидролизом пентахлорида фосфора:
- Также её получают взаимодействием с водой оксида фосфора
:
- Фосфорную кислоту в лабораторных условиях синтезируют окислением фосфора
-ным раствором азотной кислоты:
Применение
Ортофосфорная кислота используется для очищения от ржавчины металлических поверхностей,
как пищевая добавка E338 (регулятор кислотности),
применяется в производстве удобрений,
в текстильной промышленности для крашения тканей,
в органическом синтезе в качестве катализатор,
в стоматологии для получения зубного цемента.
Качественная реакция
Качественной реакцией на фосфорную кислоту является образование ярко-жёлтого осадка молибденофосфата аммония:
и жёлтого осадка с нитратом серебра
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |
ФОСФОРНАЯ КИСЛОТА
- ФОСФОРНАЯ КИСЛОТА
-
(ортофосфорная к-та) H3PO4, мол. м. 97,995; бесцв. гигроскопичные кристаллы моноклинной сингонии (а = 0,5762 нм, b=0,4831 нм, с =1,1569 нм,
= 95,31°, пространств, гр. Р21/с); расплывается на воздухе; т. пл. 42,50 С; плотн. 1,88 г/см 3;
-1283 кДж/моль; наиб. стабильное соед. в ряду кислородсодержащих к-т фосфора. В расплавленном состоянии склонна к переохлаждению; при 15 0C образует густую маслянистую жидкость, при -121 0C- стеклообразную массу.
F. к. смешивается с водой в любых соотношениях. Разб. водные р-ры имеют кисловатый вкус. Из высококонц. р-ров кристаллизуется в виде гемигидрата (полугидрата) H3PO4
Химическая энциклопедия. — М.: Советская энциклопедия.
.
1988.
Смотреть что такое «ФОСФОРНАЯ КИСЛОТА» в других словарях:
-
Фосфорная кислота — (ортофосфорная кислота или обыкновенная фосфорная кислота) (H3PO4) получается при действии серной кислоты на природный фосфат трикальция. Полученная таким образом техническая кислота содержит в качестве примесей пентаоксид дифосфора,… … Официальная терминология
-
ФОСФОРНАЯ КИСЛОТА — Соединение фосфора с кислородом. Объяснение 25000 иностранных слов, вошедших в употребление в русский язык, с означением их корней. Михельсон А.Д., 1865. ФОСФОРНАЯ КИСЛОТА соединение фосфора к кислородом, кристаллы её бесцветны, призматичны,… … Словарь иностранных слов русского языка
-
ФОСФОРНАЯ КИСЛОТА — (ортофосфорная кислота), H3PO4, твердое вещество, tпл 42,35шC. Применяют фосфорную кислоту в производстве удобрений, различных фосфатов, для обработки кормов для скота, нанесения антикоррозионных покрытий на металлы, осветления сахара, как… … Современная энциклопедия
-
ФОСФОРНАЯ КИСЛОТА — (Acidum phosphori cum), этим наименованием охватывают к ты 5 валентного фосфора. Для удобства классификации их можно рассматривать как продукты взаимодействия фосфорного ангидрида (Р206) и воды; известны одноосновная метафосфор ная к та, НР03( =… … Большая медицинская энциклопедия
-
Фосфорная кислота — Фосфорные кислоты соединения фосфора в степени окисления +5 общей формулы P2O5·nH2O: метафосфорная кислота HPO3 P2O5 + H2O = 2HPO3 (на холоде); ортофосфорная кислота H3PO4 HPO3 + H2O = H3PO4 (при кипячении); пирофосфорная кислота (дифосфорная)… … Википедия
-
фосфорная кислота — (ортофосфорная кислота), Н3РО4, tпл 42,5°C, кислота средней силы. Соли и эфиры называются фосфатами. Фосфорная кислота полупродукт в производстве удобрений, фармацевтических препаратов, кормовых концентратов, катализатор в органическом синтезе,… … Энциклопедический словарь
-
фосфорная кислота — ortofosfato rūgštis statusas T sritis chemija formulė H₃PO₄ atitikmenys: angl. orthophosphoric acid; phosphoric acid rus. ортофосфорная кислота; фосфорная кислота ryšiai: sinonimas – vandenilio tetraoksofosfatas (3–) sinonimas – fosforo rūgštis … Chemijos terminų aiškinamasis žodynas
-
ФОСФОРНАЯ КИСЛОТА — (ортофосфорная кислота), Н3РО,), tnn 42,5 °С, кислота средней силы. Соли и эфиры наз. фосфатами. Ф. к. полупродукт в произ ве удобрений, фарм. препаратов, кормовых концентратов, катализатор в органич. синтезе, антипирен, компонент… … Естествознание. Энциклопедический словарь
-
Фосфорная кислота — Жарг. шк. Пренебр. То же, что серная кислота 2. (Запись 2004 г.) … Большой словарь русских поговорок
-
фосфорная кислота — ортофосфорная кислота … Cловарь химических синонимов I
-
Фосфорная кислота — см. Фосфор … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Фосфорная кислота — это коррозионно-активная неорганическая кислота с химической формулой H3PO4. Это слабая кислота, доступная в различных количествах, чистоте и различных классах реагентов.
В чистом виде фосфорная кислота представляет собой бесцветное твердое вещество. В менее концентрированном виде это вязкая жидкость без запаха с плотностью 1,885 г/мл. Обычно она нелетучая и нетоксична, но 85-процентный раствор по-прежнему может повредить глаза и вызвать сильное раздражение кожи.
Номенклатура ИЮПАК для этого соединения — ортофосфорная кислота. Орто — это греческий термин, означающий «истинный», поэтому приставка «орто» относится к истинной форме фосфорной кислоты, то есть H3PO4.
Давайте копнем глубже и выясним, как образуется фосфорная кислота, как она выглядит на молекулярном уровне, каковы ее физические и химические свойства и где она используется.
Профиль фосфорной кислоты
Молярная масса: 97,994 г/моль
Внешний вид: густая бесцветная жидкость.
Точка кипения: 212 °C
Точка плавления: 42,35 °C (кристаллического твердого вещества)
Динамическая вязкость: от 2,4 до 9,4 сантипуаз (85% водный раствор).
Плотность: 1,83 г / см3 (твердое вещество); 1,68 г / см3 (85% водный раствор при 25 °C)
Структура
Соединение H3PO4 имеет в общей сложности 32 валентных электрона. Поскольку фосфор является наименее электроотрицательным, он помещается в центре. Атомы водорода присоединяются к внешней стороне атомов кислорода, образуя он-Группы.
В этой структуре каждый атом имеет полную внешнюю оболочку: атомы фосфора и кислорода имеют восемь валентных электронов, а атомы водорода имеют вокруг себя два валентных электрона.
Фосфор может иметь расширенный октет (более восьми валентных электронов), поэтому он получает формальный заряд +1, в то время как кислород (тот, который не присоединен к атому водорода) получает формальный заряд -1. Образуя двойную связь, фосфор и кислород теряют свои заряды.
В структуре все еще есть 32 валентных электрона, и каждый атом имеет формальный заряд, равный нулю. Таким образом, это наиболее вероятная или вероятная структура Льюиса для H3PO4.
Соединение содержит 3 одинарные связи ОН, 3 одинарные связи PO и 1 двойную связь P = O. Каждая одинарная связь является сигма-связью, а двойная связь состоит из сигма-связи и пи-связи.
Молекулярная геометрия PO (OH)3 является тетраэдрической, а кристаллическая структура-моноклинной. А поскольку распределение зарядов на центральных атомах асимметрично, то молекула считается полярной.
Последние достижения в области нанотехнологий, включая методы поглощения рентгеновских лучей вблизи краев и методы рассеяния рентгеновских лучей под большим углом, позволили ученым точно определить структуру фосфорной кислоты. Расстояние связи P=O в структуре близко к 152 пикометрам, и расстояния P=O-O были уточнены до 309 пикометров, с углом связи близким к тетраэдрическому.
Как она производится?
Фосфорная кислота может быть синтезирована либо мокрым способом, либо термическим способом.
В последнем в качестве сырья используются воздух, вода и элементарный фосфор. Он включает в себя три важных этапа: сгорание, увлажнение и запотевание. Вот как это происходит:
Во-первых, жидкий элементарный фосфор сжигается в камере сгорания при высоких температурах в диапазоне от 1650 до 2760 °C. Эта реакция окисления происходит в окружающем воздухе и производит пятиокись фосфора.
4P + 5O 2 -> 2 P 2 O 5
Затем продукт гидратируют водой с образованием сильной фосфорной кислоты (в жидком состоянии).
P 2 O 5 + 6 H 2 O -> 2 P 2 O 5
На последнем этапе для удаления фосфорно-кислотного тумана из потока дымовых газов используются высоконапорные каплеуловители.
Концентрация фосфорной кислоты, синтезированной в этом процессе, обычно составляет от 75 до 85 процентов. Такие уровни концентрации необходимы для производства высококачественной химической продукции. Несколько эффективных установок извлекают чрезвычайно концентрированную фосфорную кислоту (до 99,9%), используя тот же тепловой процесс.
Однако почти 80% фосфорной кислоты производится мокрым способом. В этом методе серная кислота обрабатывается природным фосфатсодержащим минералом, таким как гидроксиапатит.
Ca 5 (PO 4) 3 OH + 5 H 2 SO 4 -> 3 H 3 PO 4 + 5 CaSO 4 + H 2 O
Минерал высушивают, крошат, а затем подают в реактор вместе с серной кислотой. В результате реакции сульфат сливается с кальцием (из минерала), образуя сульфат кальция (гипс).
Затем добавляется обработанная вода, и гипс вместе с другими нерастворимыми примесями удаляется через фильтр. Фосфорная кислота, полученная этим мокрым способом, содержит 25-30% пятиокиси фосфора.
Обычно эта кислота дополнительно концентрируется, чтобы соответствовать требованиям, предъявляемым к производству удобрений. В большинстве случаев фосфорная кислота концентрируется до 40-55% пятиокиси фосфора с помощью двух / трех вакуумных испарителей.
Свойства
Чистая фосфорная кислота в лаборатории выглядит как плотное, бесцветное, бесформенное кристаллическое твердое вещество, которое плавится при температуре 42,35 °C. Ее физические свойства зависят от чистоты, концентрации кислоты, а также от температуры, при которой вы ее видите.
Фосфорная кислота менее агрессивна и менее опасна по сравнению с азотной и серной кислотами. Это негорючее вещество как в жидкой, так и в твердой форме.
Когда кислота подвергается воздействию тепла, а затем охлаждается до комнатной температуры, она образует прозрачное, хрупкое стекло. После такого воздействия тепла состав кислоты остается прежним.
Обычно фосфорная кислота выпускается в виде бесцветного сиропа с концентрацией в воде 85 процентов и плотностью 1,885 граммов на миллилитр.
В водном растворе фосфорная кислота действует как трипротовая кислота, имеющая три ионизируемых атома водорода. Соединение может потерять эти атомы в виде протонов (ионов H +).
- Когда один протон удаляется, в результате образуется дигидрофосфат-Ион H 2 PO 4 −
- Когда два протона удаляются, в результате образуется Ион фосфата водорода HPO 4 2−
- Удаление всех трех протонов дает ортофосфат-Ион PO 4 3− .
Кислота растворима как в воде, так и в этаноле. Однако большинство ее солей не растворимы в воде, если нет сильной минеральной кислоты.
Области применения
Фосфорная кислота имеет несколько важных применений. Ее соли, такие как фосфаты аммония и кальция, широко используются в качестве удобрений. Кислота используется для производства электролитов, средств для удаления ржавчины, модификаторов рН, травителей, бытовых чистящих средств и дезинфицирующих средств.
Поскольку это вещество нетоксично и имеет умеренно кислую природу, оно также используется в напитках, пищевых ароматизаторах, косметике, средствах для ухода за зубами и кожей. Давайте подробнее рассмотрим, чем полезна фосфорная кислота.
В менее концентрированной форме она используется для производства различных видов безопасных фосфорных удобрений, которые помогают растениям расти. Фактически, почти 90% синтезированной фосфорной кислоты используется в качестве удобрений.
Многие безалкогольные напитки, в том числе Coca-Cola, содержат фосфорную кислоту. Это придает напитку слегка кисловатый вкус. Несмотря на то, что его концентрация достаточно низкая, экстремальный прием таких напитков может вызвать эрозию зубов и даже привести к образованию почечных камней.
Фосфорная кислота в качестве электролита имеет полезные характеристики, такие как хорошая ионная проводимость, низкая летучесть, стабильность при относительно высоких температурах и устойчивость к диоксиду углерода и монооксиду углерода.
Поскольку чистая фосфорная кислота обладает высокой протонной проводимостью и превосходной термостабильностью, полибензимидазол (PBI), допированный фосфорной кислотой, является наиболее многообещающим среди мембран на основе PBI, которые могут обеспечить хорошую производительность топливных элементов даже при низком уровне увлажнения и температуре 200 °С.
Специфическое применение фосфорной кислоты:
- Трифосфат натрия используется в мыле и моющих средствах.
- Дикальцийфосфат используется в зубной пасте как полирующее средство.
- Фосфатное покрытие наносится на стальные детали для защиты от коррозии и смазки.
- Он используется для контроля pH косметических средств и средств личной гигиены.
- В строительной отрасли он используется для удаления минеральных отложений и чистых пятен от жесткой воды,
Глобальный рынок
Многие развивающиеся страны начали сосредотачиваться на увеличении добычи фосфатов и производства фосфатов. Правительства некоторых стран уже сотрудничали с различными поставщиками по всему миру для создания заводов по добыче минералов для производства фосфорной кислоты.
В 2019 году объем мирового рынка фосфорной кислоты оценивался в 45,85 миллиарда долларов. Ожидается, что к 2027 году он достигнет более 61 миллиарда долларов, а совокупный годовой темп роста составит 3,7%.
Рынок подразделяется на Азиатско-Тихоокеанский регион, Европу, Северную Америку, Латинскую Америку, Ближний Восток и Африку. Ожидается, что в ближайшем будущем Азиатско-Тихоокеанский регион будет доминировать на мировом рынке. Рост рынка фосфорной кислоты в этих регионах будет дополнительно подпитываться развитым сельскохозяйственным сектором Индии и Китая.











 = 95,31°, пространств, гр. Р21/с); расплывается на воздухе; т. пл. 42,50 С; плотн. 1,88 г/см 3;
= 95,31°, пространств, гр. Р21/с); расплывается на воздухе; т. пл. 42,50 С; плотн. 1,88 г/см 3;  -1283 кДж/моль; наиб. стабильное соед. в ряду кислородсодержащих к-т фосфора. В расплавленном состоянии склонна к переохлаждению; при 15 0C образует густую маслянистую жидкость, при -121 0C- стеклообразную массу.
-1283 кДж/моль; наиб. стабильное соед. в ряду кислородсодержащих к-т фосфора. В расплавленном состоянии склонна к переохлаждению; при 15 0C образует густую маслянистую жидкость, при -121 0C- стеклообразную массу.