гепатит с
-
1
Гепатит
— hepatitis;
Большой русско-латинский словарь Поляшева > Гепатит
-
2
hepatitis
,tidis f
гепатит-воспалительное заболевание печени
Латинский для медиков > hepatitis
См. также в других словарях:
-
Гепатит — Микрофотография клеток печени, поражённой ал … Википедия
-
Гепатит B — МКБ 10 B16.16., B18.018.0 B … Википедия
-
Гепатит А — МКБ 10 BB 15 15. 15. МКБ 9 070.1 070.1 070.1 DiseasesDB … Википедия
-
Гепатит E — МКБ 10 B … Википедия
-
Гепатит — острое или хроническое воспаление печени. Существует несколько форм гепатита, различаемых в зависимости от вызвавшей их причины. Острые токсические гепатиты, вызываемые лекарственными продуктами, грибными ядами бледной поганки, сморчков… … Справочник по болезням
-
ГЕПАТИТ — ГЕПАТИТ, воспаление печени, может быть одним из проявлений инфекционного заболевания. Ранние признаки включают летаргию, тошноту, лихорадку, желтуху, мышечные и суставные боли. В настоящее время выявлено пять различных вирусов гепатита: А, В, С,… … Научно-технический энциклопедический словарь
-
ГЕПАТИТ — (греч., от hepar печень, и lithos камень). 1) печеночный камень, часто встречающийся в сланце; у древних считался драгоценным камнем. 2) воспаление печени. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910. ГЕПАТИТ… … Словарь иностранных слов русского языка
-
Гепатит C — МКБ 10 B … Википедия
-
Гепатит D — МКБ 10 B17.017.0, B18.018.0 МКБ 9 … Википедия
-
ГЕПАТИТ — (от греческого hepar, родительный падеж hepatos печень), группа воспалительных заболеваний печени инфекционной (например, гепатит вирусный) или неинфекционной (например, при отравлениях) природы у человека и животных. Нарушения функции печени при … Современная энциклопедия
-
ГЕПАТИТ — (от греч. hepar род. п. hepatos печень), группа воспалительных заболеваний печени инфекционной (напр., гепатит вирусный) или неинфекционной (напр., при отравлениях) природы у человека и животных. Нарушения функции печени при остром гепатите часто … Большой Энциклопедический словарь
Синонимы слова «ГЕПАТИТ»:
БОЛЕЗНЬ, ГЕПАТОЛИТ
Смотреть что такое ГЕПАТИТ в других словарях:
ГЕПАТИТ
коричневая разновидность барита, пропитанная битуминозными веществами. Встречается в Конгсберге (в Норвегии) и провинции Скон в Швеции.
ГЕПАТИТ
(от греч. hepar, родительный падеж hepatos — печень) общее название воспалительных заболеваний печени, возникающих от различных причин и имеющих… смотреть
ГЕПАТИТ
ГЕПАТИТ, -а, м. Воспалительное заболевание печени. Инфекционный(вирусный) г. II прил. гепатитный, -ая, -ое.
ГЕПАТИТ
гепатит м. Болезнь, характеризующаяся воспалением печени и обычно сопровождающаяся желтизной кожного покрова, белков глаз и т.п.
ГЕПАТИТ
гепатит
сущ., кол-во синонимов: 2
• болезнь (995)
• гепатолит (2)
Словарь синонимов ASIS.В.Н. Тришин.2013.
.
Синонимы:
болезнь, гепатолит
ГЕПАТИТ
Гепатит — коричневая разновидность барита, пропитанная битуминозными веществами. Встречается в Конгсберге (в Норвегии) и провинции Скон в Швеции.
ГЕПАТИТ
гепатит (hepatitis; гепат- + -ит) — воспаление печени. гепатит агрессивный (h. aggressiva) — см. Гепатит активный. гепатит активный (h. activ… смотреть
ГЕПАТИТ
(hepatitis; Гепат- + -ит)воспаление печени.
Гепати́т агресси́вный (h. aggressiva) — см. Гепатит активный.
Гепати́т акти́вный (h. activa; син.: Г. агр… смотреть
ГЕПАТИТ
ГЕПАТИТострое или хроническое воспаление печени. Существует несколько форм гепатита, дифференцируемых в зависимости от вызвавшей их причины. Гепатит могут вызвать некоторые лекарственные вещества, например транквилизаторы (успокаивающие средства) или антибиотики в случае их длительного применения. Токсические гепатиты, обусловленные воздействием на печеночную ткань определенных химических соединений, таких, как четыреххлористый углерод, некоторые сульфаниламиды или алкоголь, возникают в первую очередь у людей с предшествовавшими нарушениями функций печени. Иногда гепатиты связаны с инфекционными или системными заболеваниями. Они наблюдаются при инфекционном мононуклеозе, сифилисе, туберкулезе, как осложнение при амебной дизентерии, при некоторых болезнях соединительной ткани, например системной красной волчанке.Чаще всего встречаются вирусные гепатиты, и их выделяют в отдельную группу. Они вызываются разными вирусами, причем заражение каждым вирусом имеет свои отличительные особенности. Гепатит A, ранее известный как инфекционный гепатит, или болезнь Боткина, возникает при заражении алиментарным (через рот) путем: вирус гепатита A попадает в организм с частицами фекалий в пище или воде, в экзотических случаях — с сырыми моллюсками. Гепатит B, или сывороточный гепатит, вызывается вирусом гепатита B при попадании его непосредственно в кровоток, например при переливаниях инфицированной крови, использовании загрязненных игл для внутривенных инъекций или общих игл для татуировки, при порезах (например, у хирургов и медицинских работников) или даже в результате половых контактов, если один из партнеров инфицирован. Сходным путем передается и вирус гепатита C, обозначавшегося ранее как гепатит «ни A, ни B». К тому же семейству вирусов, что и вирус гепатита C, относится и недавно описанный вирус гепатита G. Гепатит E встречается в основном в развивающихся странах и передается, как и гепатит А, фекально-оральным способом. Шестой вирус — «дельта-агент», или вирус гепатита D, — сопутствующая гепатиту B инфекция; этот вирус размножается только в присутствии вируса гепатита B (самостоятельно размножаться в клетке он не может из-за дефектности своего генома) и тоже передается с кровью. Заражение им значительно усугубляет тяжесть течения гепатита B: возможно развитие т.н. «фульминантного» (молниеносного) гепатита, часто со смертельным исходом.Диагноз. Заболевания, вызываемые разными вирусами гепатита, имеют много общих признаков, связанных с нарушением функции печеночных клеток. К клиническим симптомам гепатита относятся болезненность в правом подреберье, увеличение размеров печени (край печени выступает из-под реберной дуги, закруглен и мягок) и желтуха (пожелтение кожи и склер). Исследования крови выявляют нарушения функции печени и помогают определить вирус, хотя иногда тип гепатита можно приближенно установить по данным анамнеза. Так, если больной приехал из Западной Африки или другого региона, где распространен гепатит А, то у него вероятнее всего именно этот тип вирусного гепатита; если гепатит связан с предшествующим переливанием крови и у больного в течение нескольких недель или месяцев отмечается желтуха, то наиболее вероятные возбудители — вирусы гепатита B, C или G. Неожиданная активация патологического процесса и резкое ухудшение состояния больного могут свидетельствовать о дополнительной инфекции вирусом гепатита D. В последние годы отмечено повышение заболеваемости гепатитами A и B среди гомосексуалов-мужчин и гепатитами B и C среди наркоманов, использующих внутривенное введение наркотиков.Течение болезни. Инкубационный период при гепатите A продолжается 2-6 недель. При гепатитах, связанных с переливанием крови (B, C и G), инкубационный период более продолжителен и длится от 6 недель до 6 месяцев, в среднем ок. 2-3 месяцев.При гепатите B лихорадка и желтуха развиваются довольно быстро; при гепатите A начало болезни протекает в стертой форме. Наблюдаются тошнота и рвота, плохой аппетит, иногда жидкий стул. Больные жалуются на болезненность в правой верхней части живота.Острый период при вирусных гепатитах обычно продолжается несколько недель, иногда до 2 месяцев и даже дольше. Полное выздоровление занимает 4-6 месяцев.В некоторых случаях люди, перенесшие вирусный гепатит (особенно гепатит B), становятся вирусоносителями. У них отсутствуют клинические проявления болезни, однако вирус сохраняется в организме и может инфицировать других людей. При гепатитах B и C иногда развиваются хронические формы гепатита с менее отчетливой симптоматикой, без выраженных проявлений болезни в течение многих месяцев и даже лет. У больных хроническим гепатитом возможно развитие цирроза печени, и у части из них в конечном итоге возникает рак печени.Лечение. Не существует специфического лечения гепатитов. Обычно рекомендуются покой и высококалорийная диета, богатая белками, углеводами и витаминами. Больным в течение 6-12 месяцев необходимо воздерживаться от потребления алкоголя, который ухудшает состояние печени.После выздоровления в организме синтезируются антитела против вируса, вызвавшего заболевание. Однако они защищают только от повторного заражения вирусом того же типа. В очагах инфекции для профилактики вирусных гепатитов, особенно гепатита A, используют донорский иммуноглобулин. Для активной иммунизации в группах риска заражения гепатитом B применяют вакцины. См. также ВИРУСЫ; ЖЕЛТУХА…. смотреть
ГЕПАТИТ
Гепатит — острое или хроническое воспаление печени. Существует несколько форм гепатита, различаемых в зависимости от вызвавшей их причины. Острые токси… смотреть
ГЕПАТИТ
ГЕПАТИТ(греч., от hepar — печень, и lithos — камень). 1) печеночный камень, часто встречающийся в сланце; у древних считался драгоценным камнем. 2) вос… смотреть
ГЕПАТИТ
(hepatitis) воспаление печени, вызванное наличием вирусов, токсических веществ или нарушением иммунитета в организме человека. Инфекционный гепатит (infectious hepatitis) вызывается вирусами, четыре основных типа которых считаются причиной развития у человека соответственно гепатита А, гепатита В, гепатита С и гепатита D; наличие в организме этих вирусов может быть установлено с помощью соответствующего анализа крови. К другим вирусам, которые могут привести к развитию гепатита, относится вирус ЭпстайнаБарра. См. также Entamoeba. Заражение гепатитом A (hepatitis A) (или эпидемическим гепатитом (epidemic hepatitis)) происходит через зараженную больным человеком или вирусоносителем пищу или воду, особенно в местах с плохими санитарными условиями. После инкубационного периода, длящегося 15-40 дней, у человека повышается температура и развивается слабость. Примерно через неделю кожа начинает желтеть (см. Желтуха); такая се окраска может сохраняться в течение трех недель. Больной остается заразным на протяжении всего этого времени. Серьезные осложнения этого заболевания встречаются редко; после перенесения его у человека вырабатывается стойкий иммунитет. Инъекции гамма-глобулина являются лишь временной мерой защиты от этой болезни, поэтому более предпочтительной для защиты от этого заболевания оказывается активная иммунизация населения. Заражение гепатитом В (hepatitis В) (ранее он назывался сывороточным гепатитом (serum hepatitis)) происходит через инфицированную кровь и продукты крови, иглы для инъекций или иглы для нанесения татуировок, во время переливания крови или при половом контакте: это очень распространенное среди наркоманов заболевание. Симптомы болезни развиваются внезапно после инкубационного периода, составляющего от 1 до б месяцев; к ним относятся: головная боль, повышение температуры, озноб, общая слабость и желтуха. Большинство больных постепенно выздоравливают, однако смертность от этого заболевания составляет 5-20%. Наличие отдельного вируса, вызывающего у человека гепатит С (hepatitis С), было выявлено лишь недавно; заражение им происходит аналогично гепатиту В. Гепатит D (hepatitis D) развивается у человека только одновременно с гепатитом В или после него. Хронический гепатит (chronic hepatitis) может длиться месяцы и годы, в конце концов приводя к циррозу печени (см. также Гепатома). Причиной его может являться постоянное присутствие в организме вируса гепатита (обычно гепатита В или С), избавиться от которого можно с помощью интерферона, или наличие аутоиммунной болезни, которая успешно лечится кортикостероидами или иммуносупрессорной терапией…. смотреть
ГЕПАТИТ
гепатит (Hepatitis; от греч. hēpar род. п. hēpatos печень), воспаление соединительнотканной стромы печени, сопровождающееся дистрофическими, некроб… смотреть
ГЕПАТИТ
м. hepatitis вирусный острый паренхиматозный гепатит — acute yellow atrophy of liver, acute parenchymatous hepatitis передаваемый через инфицированную воду гепатит — waterborne type of hepatitis<p>— агрессивный гепатит — активный хронический гепатит — активный гепатит — аллергический гепатит — амёбный гепатит — аскаридозный гепатит — безжелтушный гепатит — бруцеллёзный гепатит — вирусный гепатит — вирусный безжелтушный гепатит — вирусный желтушный гепатит — вирусный затяжной гепатит — вирусный малый гепатит — вирусный персистирующий гепатит — вирусный плазмоцитоклеточный гепатит — вирусный рецидивирующий гепатит — вирусный гепатит типа А — вирусный гепатит типа В — вирусный гепатит типа C — вирусный гепатит типа D — волчаночный гепатит — врождённый гепатит — галотановый гепатит — гелиотропный гепатит — герпетический гепатит — гигантоклеточный гепатит — гнойный гепатит — гуммозный гепатит — диффузный гепатит — диффузный мезенхимальный гепатит — вирусный гепатит затяжного типа — инокуляционный гепатит — интерлобулярный гепатит — интерстициальный гепатит — инфекционный гепатит — латентный гепатит — лекарственный гепатит — лучевой гепатит — люпоидный гепатит — люэтический гепатит — лямблиозный гепатит — малярийный гепатит — междольковый гепатит — мезенхимальный гепатит — метаболический гепатит — молниеносный гепатит — мононуклеозный гепатит — некротический гепатит — острый гепатит — очаговый гепатит — парентеральный гепатит — паренхиматозный гепатит — персистирующий гепатит — гепатит плода — подострый гепатит — посттрансфузионный гепатит — продуктивный гепатит — протозойный гепатит — реактивный гепатит — ревматический гепатит — свинцовый гепатит — септический гепатит — серозный гепатит — сифилитический гепатит — скарлатинозный гепатит — скоротечный гепатит — скрытый гепатит — сывороточный гепатит — токсико-аллергический гепатит — токсико-химический гепатит — токсический гепатит — трофопатический гепатит — туберкулёзный гепатит — фетальный гепатит — фульминантный гепатит — холангиогенный гепатит — холангиолитический гепатит — холестатический гепатит — хронический гепатит — шприцевой гепатит — экспериментальный гепатит — энзоотический гепатит — эпидемический гепатит — эпителиальный гепатит</p><div class=»fb-quote»></div>… смотреть
ГЕПАТИТ
ГЕПАТИТ, воспаление печени, может быть одним из проявлений инфекционного заболевания. Ранние признаки включают летаргию, тошноту, лихорадку, желтуху, м… смотреть
ГЕПАТИТ
m
Hepatitis f, Leberentzündung f
токсический профессиональный гепатит — arbeitsbedingte toxische Hepatitis f
гепатит Аагрессивный гепатитактивный гепатитбезжелтушный гепатитгепатит Ввирусный гепатитволчаночный гепатитврождённый гигантоклеточный гепатитгерпетический гепатитжелтушный гепатитинтерлобулярный гепатитинтерстициальный гепатитинфекционный гепатитлекарственный гепатитлюпоидный гепатитмезенхимальный гепатитметаболический гепатитмолниеносный гепатитмононуклеозный гепатитнеспецифический гепатитни В гепатит ни Аоблитерирующий сегментарный гепатиточаговый гепатитпаренхиматозный гепатитперсистирующий гепатитпосттрансфузионный гепатитпродуктивный гепатитпротозойный гепатитреактивный гепатитрецидивирующий гепатитсептический гепатитсерозный гепатитсывороточный гепатиттоксико-аллергический гепатиттоксический гепатиттрансфузионный гепатиттрофопатический гепатитфетальный гепатитфульминантный гепатитхолангиогенный гепатит… смотреть
ГЕПАТИТ
ГЕПАТИ́Т, у, ч., вет., мед.Загальна назва запальних захворювань печінки.Через погані побутові умови діти наражаються на інфекційний гепатит та інші сер… смотреть
ГЕПАТИТ
– общее название острых и хронических диффузных воспалительных заболеваний печени различной этиологии.
Гепатит может быть первичным, и в этом случае он является самостоятельным заболеванием, или вторичным, тогда он представляет собой проявление другой болезни. Развитие первичного гепатита связано с воздействием гепатотропных факторов – вирусов, алкоголя (алкогольный гепатит), лекарственных средств (медикаментозный гепатит) или химических веществ (токсический гепатит). Гепатит бывает врожденным заболеванием (фетальный, или врожденный, гепатит); его причинами являются вирусная инфекция, несовместимость крови матери и плода и др. Вторичный гепатит возникает на фоне инфекций, интоксикаций, при заболеваниях желудочно-кишечного тракта, диффузных болезнях соединительной ткани как одно из их проявлений…. смотреть
ГЕПАТИТ
1) Орфографическая запись слова: гепатит2) Ударение в слове: гепат`ит3) Деление слова на слоги (перенос слова): гепатит4) Фонетическая транскрипция сло… смотреть
ГЕПАТИТ
ЖОВТЯНИ́ЦЯ (захворювання печінки), ЖОВТУ́ХА розм., ГЕПАТИ́Т книжн. Йому (Суворову) вдруге зробили операцію, після якої він захворів на жовтяницю (С. До… смотреть
ГЕПАТИТ
-у, ч. Загальна назва запальних захворювань печінки. •• Вірусний гепатит — інфекційне захворювання, збудником якого є вірус, що фільтрується. Променев… смотреть
ГЕПАТИТ
ГЕПАТИТ а, м. hépatite <гр. hepar печень. мед. Воспаление печени. Крысин 1998. — Лекс. СИС 1954: гепати/т.
Синонимы:
болезнь, гепатолит
ГЕПАТИТ
корень — ГЕПАТ; суффикс — ИТ; нулевое окончание;Основа слова: ГЕПАТИТВычисленный способ образования слова: Суффиксальный∩ — ГЕПАТ; ∧ — ИТ; ⏰Слово Гепат… смотреть
ГЕПАТИТ
ГЕПАТИТ (от греческого hepar, родительный падеж hepatos — печень), группа воспалительных заболеваний печени инфекционной (например, гепатит вирусный) или неинфекционной (например, при отравлениях) природы у человека и животных. Нарушения функции печени при остром гепатите часто сопровождаются желтухой. Хронический гепатит может привести к развитию цирроза печени. <br>… смотреть
ГЕПАТИТ
(от греч. печень), группа воспалит. заболеваний печени инф. (напр., гепатит вирусный) или неинф. (напр., при отравлениях) природы у человека и животных… смотреть
ГЕПАТИТ
(от греческого hepar, родительный падеж hepatos — печень), группа воспалительных заболеваний печени инфекционной (например, гепатит вирусный) или неинфекционной (например, при отравлениях) природы у человека и животных. Нарушения функции печени при остром гепатите часто сопровождаются желтухой. Хронический гепатит может привести к развитию цирроза печени…. смотреть
ГЕПАТИТ
ГЕПАТИТ (от греч . hepar, род. п. hepatos — печень), группа воспалительных заболеваний печени инфекционной (напр., гепатит вирусный) или неинфекционной (напр., при отравлениях) природы у человека и животных. Нарушения функции печени при остром гепатите часто сопровождаются желтухой. Хронический гепатит может привести к развитию цирроза печени.<br><br><br>… смотреть
ГЕПАТИТ
ГЕПАТИТ (от греч. hepar — род. п. hepatos — печень), группа воспалительных заболеваний печени инфекционной (напр., гепатит вирусный) или неинфекционной (напр., при отравлениях) природы у человека и животных. Нарушения функции печени при остром гепатите часто сопровождаются желтухой. Хронический гепатит может привести к развитию цирроза печени.<br>… смотреть
ГЕПАТИТ
— м-л, разнов. барита, содер. битумы. Геологический словарь: в 2-х томах. — М.: Недра.Под редакцией К. Н. Паффенгольца и др..1978.Синонимы:
болезнь… смотреть
ГЕПАТИТ
— (от греч. hepar — род. п. hepatos — печень), группа воспалительныхзаболеваний печени инфекционной (напр., гепатит вирусный) илинеинфекционной (напр., при отравлениях) природы у человека и животных.Нарушения функции печени при остром гепатите часто сопровождаютсяжелтухой. Хронический гепатит может привести к развитию цирроза печени…. смотреть
ГЕПАТИТ
-а, м.
Общее название воспалительных заболеваний печени, обычно сопровождаемых желтизной кожи, белков глаз и т. д.[От греч. ‛η̃πας, ‛η̃πατος — печень]… смотреть
ГЕПАТИТ
гепати́т,
гепати́ты,
гепати́та,
гепати́тов,
гепати́ту,
гепати́там,
гепати́т,
гепати́ты,
гепати́том,
гепати́тами,
гепати́те,
гепати́тах
(Источник: «Полная акцентуированная парадигма по А. А. Зализняку»)
.
Синонимы:
болезнь, гепатолит… смотреть
ГЕПАТИТ
-у, ч. Загальна назва запальних захворювань печінки.Вірусний гепатит — інфекційне захворювання, збудником якого є вірус, що фільтрується.Променевий геп… смотреть
ГЕПАТИТ
м мед
hepatite fСинонимы:
болезнь, гепатолит
ГЕПАТИТ
Ударение в слове: гепат`итУдарение падает на букву: иБезударные гласные в слове: гепат`ит
ГЕПАТИТ
сущ. муж. родамед.гепатит -у
ГЕПАТИТ
гепати’т, гепати’ты, гепати’та, гепати’тов, гепати’ту, гепати’там, гепати’т, гепати’ты, гепати’том, гепати’тами, гепати’те, гепати’тах
ГЕПАТИТ
гепати́тСинонимы:
болезнь, гепатолит
ГЕПАТИТ
м.
epatite f
инфекционный / вирусный гепатит — epatite virale
Итальяно-русский словарь.2003.
Синонимы:
болезнь, гепатолит
ГЕПАТИТ
гепат’ит, -аСинонимы:
болезнь, гепатолит
ГЕПАТИТ
гепатит, гепат′ит, -а, м. Воспалительное заболевание печени. Инфекционный (вирусный) г.прил. ~ный, -ая, -ое.
ГЕПАТИТ
ГЕПАТИТ, -а, м. Воспалительное заболевание печени. Инфекционный (вирусный) гепатит || прилагательное гепатитный, -ая, -ое.
ГЕПАТИТ
(2 м)Синонимы:
болезнь, гепатолит
ГЕПАТИТ
hepatitСинонимы:
болезнь, гепатолит
ГЕПАТИТ
דלקת הכבדСинонимы:
болезнь, гепатолит
ГЕПАТИТ
hepatiteСинонимы:
болезнь, гепатолит
ГЕПАТИТ
肝炎〔阳〕肝炎. Синонимы:
болезнь, гепатолит
ГЕПАТИТ
Начальная форма — Гепатит, винительный падеж, единственное число, мужской род, неодушевленное
ГЕПАТИТ
(бауырға салқын тию ауруы).; гепатит гнойный іріңді гепатит;- гепатит токсический улы гепатит
ГЕПАТИТ
гепати́т
[від грец. ήπαρ (ήπατος) – печінка]
запальне захворювання печінки.
ГЕПАТИТ
Тепа Ипат Гит Гетит Гет Гепатит Гап Тета Тип Агит Тит Пат Петит Пие Тег
ГЕПАТИТ
гепатит [ гр. мраг (hepaloe) печень] — воспаление печени.
ГЕПАТИТ
гепатит; ч.
(гр., печінка)
запальне захворювання печінки.
ГЕПАТИТ
(hepatitis; гепат- + -ит) воспаление печени.
ГЕПАТИТ
гепатит
қубод, зотулкабид, гепатит
ГЕПАТИТ
гепати́т
іменник чоловічого роду
| Hepatitis C | |
|---|---|
 |
|
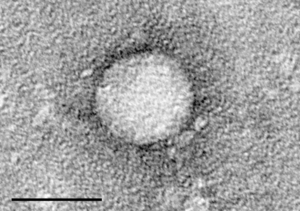
| Electron micrograph of hepatitis C virus from cell culture (scale = 50 nanometers) | |
| Specialty | Gastroenterology, Infectious disease |
| Symptoms | Typically none[1] |
| Complications | Liver failure, liver cancer, esophageal and gastric varices[2] |
| Duration | Long term (80%)[1] |
| Causes | Hepatitis C virus usually spread by blood-to-blood contact[1][3] |
| Diagnostic method | Blood testing for antibodies or viral RNA[1] |
| Prevention | Sterile needles, testing donated blood[4] |
| Treatment | Medications, liver transplant[5] |
| Medication | Antivirals (sofosbuvir, simeprevir, others)[1][4] |
| Frequency | 58 million (2019)[6] |
| Deaths | 290,000 (2019)[6] |
Hepatitis C is an infectious disease caused by the hepatitis C virus (HCV) that primarily affects the liver;[2] it is a type of viral hepatitis.[7] During the initial infection people often have mild or no symptoms.[1] Occasionally a fever, dark urine, abdominal pain, and yellow tinged skin occurs.[1] The virus persists in the liver in about 75% to 85% of those initially infected.[1] Early on, chronic infection typically has no symptoms.[1] Over many years however, it often leads to liver disease and occasionally cirrhosis.[1] In some cases, those with cirrhosis will develop serious complications such as liver failure, liver cancer, or dilated blood vessels in the esophagus and stomach.[2]
HCV is spread primarily by blood-to-blood contact associated with injection drug use, poorly sterilized medical equipment, needlestick injuries in healthcare, and transfusions.[1][3] Using blood screening, the risk from a transfusion is less than one per two million.[1] It may also be spread from an infected mother to her baby during birth.[1] It is not spread by superficial contact.[4] It is one of five known hepatitis viruses: A, B, C, D, and E.[8]
Diagnosis is by blood testing to look for either antibodies to the virus or viral RNA.[1] In the United States, screening for HCV infection is recommended in all adults age 18 to 79 years old.[9]
There is no vaccine against hepatitis C.[1][10] Prevention includes harm reduction efforts among people who inject drugs, testing donated blood, and treatment of people with chronic infection.[4][11] Chronic infection can be cured more than 95% of the time with antiviral medications such as sofosbuvir or simeprevir.[6][1][4] Peginterferon and ribavirin were earlier generation treatments that had a cure rate of less than 50% and greater side effects.[4][12] Getting access to the newer treatments, however, can be expensive.[4] Those who develop cirrhosis or liver cancer may require a liver transplant.[5] Hepatitis C is the leading reason for liver transplantation, though the virus usually recurs after transplantation.[5]
An estimated 58 million people worldwide were infected with hepatitis C in 2019. Approximately 290,000 deaths from the virus, mainly from liver cancer and cirrhosis attributed to hepatitis C, also occurred in 2019.[13] The existence of hepatitis C – originally identifiable only as a type of non-A non-B hepatitis – was suggested in the 1970s and proven in 1989.[14] Hepatitis C infects only humans and chimpanzees.[15]
Signs and symptoms[edit]
Acute infection[edit]
Acute symptoms develop in some 20–30% of those infected.[1] When this occurs, it is generally 4–12 weeks following infection (but it may take from 2 weeks to 6 months for acute symptoms to appear).[1][4]
Symptoms are generally mild and vague, and may include fatigue, nausea and vomiting, fever, muscle or joint pains, abdominal pain, decreased appetite and weight loss, jaundice (occurs in ~25% of those infected), dark urine, and clay-coloured stools.[1][16][17] Acute liver failure due to acute hepatitis C is exceedingly rare.[18] Symptoms and laboratory findings suggestive of liver disease should prompt further tests and can thus help establish a diagnosis of hepatitis C infection early on.[17]
Following the acute phase, the infection may resolve spontaneously in 10–50% of affected people; this occurs more frequently in young people, and females.[16]
Chronic infection[edit]
About 80% of those exposed to the virus develop a chronic infection.[19] This is defined as the presence of detectable viral replication for at least six months. Most experience minimal or no symptoms during the initial few decades of the infection.[20] Chronic hepatitis C can be associated with fatigue[21] and mild cognitive problems.[22] Chronic infection after several years may cause cirrhosis or liver cancer.[5] The liver enzymes measured from blood samples are normal in 7–53%.[23] (Elevated levels indicate liver cells are being damaged by the virus or other disease). Late relapses after apparent cure have been reported, but these can be difficult to distinguish from reinfection.[23]
Fatty changes to the liver occur in about half of those infected and are usually present before cirrhosis develops.[24][25] Usually (80% of the time) this change affects less than a third of the liver.[24] Worldwide hepatitis C is the cause of 27% of cirrhosis cases and 25% of hepatocellular carcinoma.[26] About 10–30% of those infected develop cirrhosis over 30 years.[5][17] Cirrhosis is more common in those also infected with hepatitis B, schistosoma, or HIV, in alcoholics and in those of male sex.[17] In those with hepatitis C, excess alcohol increases the risk of developing cirrhosis 5-fold.[27] Those who develop cirrhosis have a 20-fold greater risk of hepatocellular carcinoma. This transformation occurs at a rate of 1–3% per year.[5][17] Being infected with hepatitis B in addition to hepatitis C increases this risk further.[28]
Liver cirrhosis may lead to portal hypertension, ascites (accumulation of fluid in the abdomen), easy bruising or bleeding, varices (enlarged veins, especially in the stomach and esophagus), jaundice, and a syndrome of cognitive impairment known as hepatic encephalopathy.[29] Ascites occurs at some stage in more than half of those who have a chronic infection.[30]
[edit]
The most common problem due to hepatitis C but not involving the liver is mixed cryoglobulinemia (usually the type II form) – an inflammation of small and medium-sized blood vessels.[31][32] Hepatitis C is also associated with autoimmune disorders such as Sjögren’s syndrome, lichen planus, a low platelet count, porphyria cutanea tarda, necrolytic acral erythema, insulin resistance, diabetes mellitus, diabetic nephropathy, autoimmune thyroiditis, and B-cell lymphoproliferative disorders.[34] 20–30% of people infected have rheumatoid factor – a type of antibody.[35] Possible associations include Hyde’s prurigo nodularis[36] and membranoproliferative glomerulonephritis.[21] Cardiomyopathy with associated abnormal heart rhythms has also been reported.[37] A variety of central nervous system disorders has been reported.[38] Chronic infection seems to be associated with an increased risk of pancreatic cancer.[10][39] People may experience other issues in the mouth such as dryness, salivary duct stones, and crusted lesions around the mouth.[40][41][42]
Occult infection[edit]
Persons who have been infected with hepatitis C may appear to clear the virus but remain infected.[43] The virus is not detectable with conventional testing but can be found with ultra-sensitive tests.[44] The original method of detection was by demonstrating the viral genome within liver biopsies, but newer methods include an antibody test for the virus’ core protein and the detection of the viral genome after first concentrating the viral particles by ultracentrifugation.[45] A form of infection with persistently moderately elevated serum liver enzymes but without antibodies to hepatitis C has also been reported.[46] This form is known as cryptogenic occult infection.
Several clinical pictures have been associated with this type of infection.[47] It may be found in people with anti-hepatitis-C antibodies but with normal serum levels of liver enzymes; in antibody-negative people with ongoing elevated liver enzymes of unknown cause; in healthy populations without evidence of liver disease; and in groups at risk for HCV infection including those on hemodialysis or family members of people with occult HCV. The clinical relevance of this form of infection is under investigation.[48] The consequences of occult infection appear to be less severe than with chronic infection but can vary from minimal to hepatocellular carcinoma.[45]
The rate of occult infection in those apparently cured is controversial but appears to be low.[23] 40% of those with hepatitis but with both negative hepatitis C serology and the absence of detectable viral genome in the serum have hepatitis C virus in the liver on biopsy.[49] How commonly this occurs in children is unknown.[50]
Virology[edit]
The hepatitis C virus (HCV) is a small, enveloped, single-stranded, positive-sense RNA virus.[5] It is a member of the genus Hepacivirus in the family Flaviviridae.[21] There are seven major genotypes of HCV, which are known as genotypes one to seven.[51] The genotypes are divided into several subtypes with the number of subtypes depending on the genotype. In the United States, about 70% of cases are caused by genotype 1, 20% by genotype 2 and about 1% by each of the other genotypes.[17] Genotype 1 is also the most common in South America and Europe.[5]
The half life of the virus particles in the serum is around 3 hours and may be as short as 45 minutes.[52][53] In an infected person, about 1012 virus particles are produced each day.[52] In addition to replicating in the liver the virus can multiply in lymphocytes.[54]
Transmission[edit]
Hepatitis C infection in the United States by source
Percutaneous contact with contaminated blood is responsible for most infections; however, the method of transmission is strongly dependent on both geographic region and economic status.[55] Indeed, the primary route of transmission in the developed world is injection drug use, while in the developing world the main methods are blood transfusions and unsafe medical procedures.[3] The cause of transmission remains unknown in 20% of cases;[56] however, many of these are believed to be accounted for by injection drug use.[16]
Drug use[edit]
Injection drug use (IDU) is a major risk factor for hepatitis C in many parts of the world.[57] Of 77 countries reviewed, 25 (including the United States) were found to have a prevalence of hepatitis C of between 60% and 80% among people who use injection drugs.[19][57] Twelve countries had rates greater than 80%.[19] It is believed that ten million intravenous drug users are infected with hepatitis C; China (1.6 million), the United States (1.5 million), and Russia (1.3 million) have the highest absolute totals.[19] Occurrence of hepatitis C among prison inmates in the United States is 10 to 20 times that of the occurrence observed in the general population; this has been attributed to high-risk behavior in prisons such as IDU and tattooing with non-sterile equipment.[58][59] Shared intranasal drug use may also be a risk factor.[60]
Healthcare exposure[edit]
Blood transfusion, transfusion of blood products, or organ transplants without HCV screening carry significant risks of infection.[17] The United States instituted universal screening in 1992,[61] and Canada instituted universal screening in 1990.[62] This decreased the risk from one in 200 units[61] to between one in 10,000 to one in 10,000,000 per unit of blood.[16][56] This low risk remains as there is a period of about 11–70 days between the potential blood donor’s acquiring hepatitis C and the blood’s testing positive depending on the method.[56] Some countries do not screen for hepatitis C due to the cost.[26]
Those who have experienced a needle stick injury from someone who was HCV positive have about a 1.8% chance of subsequently contracting the disease themselves.[17] The risk is greater if the needle in question is hollow and the puncture wound is deep.[26] There is a risk from mucosal exposures to blood, but this risk is low, and there is no risk if blood exposure occurs on intact skin.[26]
Hospital equipment has also been documented as a method of transmission of hepatitis C, including reuse of needles and syringes; multiple-use medication vials; infusion bags; and improperly sterilized surgical equipment, among others.[26] Limitations in the implementation and enforcement of stringent standard precautions in public and private medical and dental facilities are known to have been the primary cause of the spread of HCV in Egypt, the country that had the highest rate of infection in the world in 2012, and currently has one of the lowest in the world in 2021.[63][64]
For more, see HONOReform (Hepatitis Outbreaks National Organization for Reform).
Sexual intercourse[edit]
Sexual transmission of hepatitis C is uncommon.[12] Studies examining the risk of HCV transmission between heterosexual partners, when one is infected and the other is not, have found very low risks.[12] Sexual practices that involve higher levels of trauma to the anogenital mucosa, such as anal penetrative sex, or that occur when there is a concurrent sexually transmitted infection, including HIV or genital ulceration, present greater risks.[12][65] The United States Department of Veterans Affairs recommends condom use to prevent hepatitis C transmission in those with multiple partners, but not those in relationships that involve only a single partner.[66]
Body modification[edit]
Tattooing is associated with two to threefold increased risk of hepatitis C.[67] This could be due to either improperly sterilized equipment or contamination of the dyes being used.[67] Tattoos or piercings performed either before the mid-1980s, «underground», or nonprofessionally are of particular concern, since sterile techniques in such settings may be lacking. The risk also appears to be greater for larger tattoos.[67] It is estimated that nearly half of prison inmates share unsterilized tattooing equipment.[67] It is rare for tattoos in a licensed facility to be directly associated with HCV infection.[68]
Shared personal items[edit]
Personal-care items such as razors, toothbrushes, and manicuring or pedicuring equipment can be contaminated with blood. Sharing such items can potentially lead to exposure to HCV.[69][70] Appropriate caution should be taken regarding any medical condition that results in bleeding, such as cuts and sores.[70] HCV is not spread through casual contact, such as hugging, kissing, or sharing eating or cooking utensils,[70] nor is it transmitted through food or water.[71]
Mother-to-child transmission[edit]
Mother-to-child transmission of hepatitis C occurs in fewer than 10% of pregnancies.[72] There are no measures that alter this risk.[72] It is not clear when transmission occurs during pregnancy, but it may occur both during gestation and at delivery.[56] A long labor is associated with a greater risk of transmission.[26] There is no evidence that breastfeeding spreads HCV; however, to be cautious, an infected mother is advised to avoid breastfeeding if her nipples are cracked and bleeding,[73] or if her viral loads are high.[56]
Diagnosis[edit]
Serologic profile of Hepatitis C infection
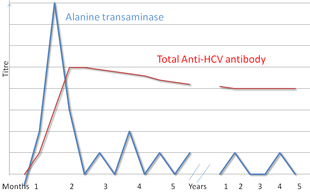
There are a number of diagnostic tests for hepatitis C, including HCV antibody enzyme immunoassay (ELISA), recombinant immunoblot assay, and quantitative HCV RNA polymerase chain reaction (PCR).[17] HCV RNA can be detected by PCR typically one to two weeks after infection, while antibodies can take substantially longer to form and thus be detected.[29]
Diagnosing patients is generally a challenge as patients with acute illness generally present with mild, non-specific flu-like symptoms,[74] while the transition from acute to chronic is sub-clinical.[75] Chronic hepatitis C is defined as infection with the hepatitis C virus persisting for more than six months based on the presence of its RNA.[20] Chronic infections are typically asymptomatic during the first few decades,[20] and thus are most commonly discovered following the investigation of elevated liver enzyme levels or during a routine screening of high-risk individuals. Testing is not able to distinguish between acute and chronic infections.[26] Diagnosis in infants is difficult as maternal antibodies may persist for up to 18 months.[50]
Serology[edit]
Hepatitis C testing typically begins with blood testing to detect the presence of antibodies to the HCV, using an enzyme immunoassay.[17] If this test is positive, a confirmatory test is then performed to verify the immunoassay and to determine the viral load.[17] A recombinant immunoblot assay is used to verify the immunoassay and the viral load is determined by an HCV RNA polymerase chain reaction.[17] If there is no RNA and the immunoblot is positive, it means that the person tested had a previous infection but cleared it either with treatment or spontaneously; if the immunoblot is negative, it means that the immunoassay was wrong.[17] It takes about 6–8 weeks following infection before the immunoassay will test positive.[21] A number of tests are available as point-of-care testing (POCT), which can provide results within 30 minutes.[76]
Liver enzymes are variable during the initial part of the infection[20] and on average begin to rise at seven weeks after infection.[21] The elevation of liver enzymes does not closely follow disease severity.[21]
Biopsy[edit]
Liver biopsies are used to determine the degree of liver damage present; however, there are risks from the procedure.[5] The typical changes seen are lymphocytes within the parenchyma, lymphoid follicles in portal triad, and changes to the bile ducts.[5] There are a number of blood tests available that try to determine the degree of hepatic fibrosis and alleviate the need for biopsy.[5]
Screening[edit]
It is believed that only 5–50% of those infected in the United States and Canada are aware of their status.[67] Routine screening for those between the ages of 18 and 79 was recommended by the United States Preventive Services Task Force in 2020.[9] Previously, testing was recommended for those at high risk, including injection drug users, those who have received blood transfusions before 1992,[60] those who have been incarcerated, those on long-term hemodialysis,[60] and those with tattoos.[67] Screening is also recommended for those with elevated liver enzymes, as this is frequently the only sign of chronic hepatitis.[77] As of 2012, the U.S. Centers for Disease Control and Prevention (CDC) recommends a single screening test for those born between 1945 and 1965.[78][79][80][81] In Canada, a one-time screening is recommended for those born between 1945 and 1975.[82]
Prevention[edit]
As of 2016, no approved vaccine protects against contracting hepatitis C.[83] A combination of harm reduction strategies, such as the provision of new needles and syringes and treatment of substance use, decreases the risk of hepatitis C in people using injection drugs by about 75%.[84] The screening of blood donors is important at a national level, as is adhering to universal precautions within healthcare facilities.[21] In countries where there is an insufficient supply of sterile syringes, medications should be given orally rather than via injection (when possible).[26] Recent research also suggests that treating people with active infection, thereby reducing the potential for transmission, may be an effective preventive measure.[11]
Treatment[edit]
Those with chronic hepatitis C are advised to avoid alcohol and medications that are toxic to the liver.[17] They should also be vaccinated against hepatitis A and hepatitis B due to the increased risk if also infected.[17] Use of acetaminophen is generally considered safe at reduced doses.[12] Nonsteroidal anti-inflammatory drugs (NSAIDs) are not recommended in those with advanced liver disease due to an increased risk of bleeding.[12] Ultrasound surveillance for hepatocellular carcinoma is recommended in those with accompanying cirrhosis.[17] Coffee consumption has been associated with[vague] a slower rate of liver scarring in those infected with HCV.[12]
Medications[edit]
Approximately 90% of chronic cases clear with treatment.[4] Treatment with antiviral medication is recommended for all people with proven chronic hepatitis C who are not at high risk of death from other causes.[85] People with the highest complication risk, which is based on the degree of liver scarring, should be treated first.[85] The initial recommended treatment depends on the type of hepatitis C virus, if the person has received previous hepatitis C treatment, and whether the person has cirrhosis.[86] Direct-acting antivirals are the preferred treatment and have been validated by testing for virus particles in patients’ blood.[87]
No prior treatment[edit]
- HCV genotype 1a (no cirrhosis): 8 weeks of glecaprevir/pibrentasvir or ledipasvir/sofosbuvir (the latter for people who do not have HIV/AIDS, are not African-American, and have less than 6 million HCV viral copies per milliliter of blood) or 12 weeks of elbasvir/grazoprevir, ledipasvir/sofosbuvir, or sofosbuvir/velpatasvir.[88] Sofosbuvir with either daclatasvir or simeprevir may also be used.[86]
- HCV genotype 1a (with compensated cirrhosis): 12 weeks of elbasvir/grazoprevir, glecaprevir/pibrentasvir, ledipasvir/sofosbuvir, or sofosbuvir/velpatasvir. An alternative treatment regimen of elbasvir/grazoprevir with weight-based ribavirin for 16 weeks can be used if the HCV is found to have antiviral resistance mutations against NS5A protease inhibitors.[89]
- HCV genotype 1b (no cirrhosis): 8 weeks of glecaprevir/pibrentasvir or ledipasvir/sofosbuvir (with the aforementioned limitations for the latter as above) or 12 weeks of elbasvir/grazoprevir, ledipasvir/sofosbuvir, or sofosbuvir/velpatasvir. Alternative regimens include 12 weeks of ombitasvir/paritaprevir/ritonavir with dasabuvir or 12 weeks of sofosbuvir with either daclatasvir or simeprevir.[90]
- HCV genotype 1b (with compensated cirrhosis): 12 weeks of elbasvir/grazoprevir, glecaprevir/pibrentasvir, ledipasvir/sofosbuvir, or sofosbuvir/velpatasvir. A 12-week course of paritaprevir/ritonavir/ombitasvir with dasabuvir may also be used.[91]
- HCV genotype 2 (no cirrhosis): 8 weeks of glecaprevir/pibrentasvir or 12 weeks of sofosbuvir/velpatasvir. Alternatively, 12 weeks of sofosbuvir/daclatasvir can be used.[92]
- HCV genotype 2 (with compensated cirrhosis): 12 weeks of sofosbuvir/velpatasvir or glecaprevir/pibrentasvir. An alternative regimen of sofosbuvir/daclatasvir can be used for 16–24 weeks.[93]
- HCV genotype 3 (no cirrhosis): 8 weeks of glecaprevir/pibrentasvir or 12 weeks of sofosbuvir/velpatasvir or sofosbuvir and daclatasvir.[94]
- HCV genotype 3 (with compensated cirrhosis): 12 weeks of glecaprevir/pibrentasvir, sofosbuvir/velpatasvir, or if certain antiviral mutations are present, 12 weeks of sofosbuvir/velpatasvir/voxilaprevir (when certain antiviral mutations are present), or 24 weeks of sofosbuvir and daclatasvir.[95]
- HCV genotype 4 (no cirrhosis): 8 weeks of glecaprevir/pibrentasvir or 12 weeks of sofosbuvir/velpatasvir, elbasvir/grazoprevir, or ledipasvir/sofosbuvir. A 12-week regimen of ombitasvir/paritaprevir/ritonavir is also acceptable in combination with weight-based ribavirin.[96]
- HCV genotype 4 (with compensated cirrhosis): A 12-week regimen of sofosbuvir/velpatasvir, glecaprevir/pibrentasavir, elbasvir/grazoprevir, or ledipasvir/sofosbuvir is recommended. A 12-week course of ombitasvir/paritaprevir/ritonavir with weight-based ribavirin is an acceptable alternative.[97]
- HCV genotype 5 or 6 (with or without compensated cirrhosis): If no cirrhosis is present, then 8 weeks of glecaprevir/pibrentasvir is recommended. If cirrhosis is present, then a 12-week course of glecaprevir/pibrentasvir, sofosbuvir/velpatasvir, or ledipasvir/sofosbuvir is warranted.[98]
More than 90% of people with chronic infection can be cured when treated with medications.[99] However, accessing these treatments can be expensive.[4] The combination of sofosbuvir, velpatasvir, and voxilaprevir may be used in those who have previously been treated with sofosbuvir or other drugs that inhibit NS5A and were not cured.[100]
Prior to 2011, treatments consisted of a combination of pegylated interferon alpha and ribavirin for a period of 24 or 48 weeks, depending on HCV genotype.[17] This treatment produces cure rates of between 70 and 80% for genotype 2 and 3, respectively, and 45 to 70% for genotypes 1 and 4.[101] Adverse effects with these treatments were common, with 50 to 60% of those being treated experiencing flu-like symptoms and nearly a third experiencing depression or other emotional issues.[17] Treatment during the first six months of infection (the acute stage) is more effective than when hepatitis C has entered the chronic stage.[29] In those with chronic hepatitis B, treatment for hepatitis C results in reactivation of hepatitis B about 25% of the time.[102]
Surgery[edit]
Cirrhosis due to hepatitis C is a common reason for liver transplantation,[29] though the virus usually (80–90% of cases) recurs afterwards.[5][103] Infection of the graft leads to 10–30% of people developing cirrhosis within five years.[104] Treatment with pegylated interferon and ribavirin post-transplant decreases the risk of recurrence to 70%.[105] A 2013 review found no clear evidence as to whether antiviral medication is useful if the graft became reinfected.[106]
Alternative medicine[edit]
Several alternative therapies are claimed by their proponents to be helpful for hepatitis C, including milk thistle, ginseng, and colloidal silver.[107] However, no alternative therapy has been shown to improve outcomes for hepatitis C patients, and no evidence exists that alternative therapies have any effect on the virus.[107][108][109]
Prognosis[edit]
Disability-adjusted life year for hepatitis C in 2004 per 100,000 inhabitants
|
no data <10 10–15 15–20 20–25 25–30 30–35 |
35–40 40–45 45–50 50–75 75–100 >100 |
The responses to treatment is measured by sustained viral response (SVR), defined as the absence of detectable RNA of the hepatitis C virus in blood serum for at least 24 weeks after discontinuing treatment,[110] and rapid virological response (RVR), defined as undetectable levels achieved within four weeks of treatment. Successful treatment decreases the future risk of hepatocellular carcinoma by 75%.[111]
Prior to 2012, sustained response occurred in about 40–50% of those with HCV genotype 1 who received 48 weeks of treatment.[5] A sustained response was seen in 70–80% of people with HCV genotypes 2 and 3 following 24 weeks of treatment.[5] A sustained response occurs for about 65% of those with genotype 4 after 48 weeks of treatment. For those with HCV genotype 6, a 48-week treatment protocol of pegylated interferon and ribavirin results in a higher rate of sustained responses than for genotype 1 (86% vs. 52%). Further studies are needed to determine results for shorter 24-week treatments and for those given at lower dosages.[112]
Spontaneous resolution[edit]
Depending on a variety of patient factors, between 15 and 45% of those with acute HCV infections will spontaneously clear the virus within six months, before the infection is considered chronic.[4] Spontaneous resolution following acute infection appears more common in females and in patients who are younger, and may be influenced by certain genetic factors.[16] Chronic HCV infection may also resolve spontaneously months or years after the acute phase has passed, though this is unusual.[16]
Epidemiology[edit]
|
|
This section needs to be updated. Please help update this article to reflect recent events or newly available information. (July 2020) |
Percentage of people infected with hepatitis C by country in 2019
The World Health Organization estimated in a 2021 report that 58 million people globally were living with chronic hepatitis C as of 2019.[13] About 1.5 million people are infected per year, and about 290,000 people die yearly from hepatitis C-related diseases, mainly from liver cancer and cirrhosis.[113]
Hepatitis C infection rates increased substantially in the 20th century due to a combination of intravenous drug abuse and the reuse of poorly sterilized medical equipment.[26] However, advancements in treatment have led to notable declines in chronic infections and deaths from the virus. As a result, the number of chronic patients receiving treatment worldwide has grown from about 950,000 in 2015 to 9.4 million in 2019. During the same period, hepatitis C deaths declined from about 400,000 to 290,000.[4][13]
Previously, a 2013 study found high infection rates (>3.5% population infected) in Central and East Asia, North Africa and the Middle East, intermediate infection rates (1.5–3.5%) in South and Southeast Asia, sub-Saharan Africa, Andean, Central and Southern Latin America, Caribbean, Oceania, Australasia and Central, Eastern and Western Europe; and low infection rates (<1.5%) in Asia-Pacific, Tropical Latin America and North America.[114]
Among those chronically infected, the risk of cirrhosis after 20 years varies between studies but has been estimated at ~10–15% for men and ~1–5% for women. The reason for this difference is not known. Once cirrhosis is established, the rate of developing hepatocellular carcinoma is ~1–4% per year.[115] Rates of new infections have decreased in the Western world since the 1990s due to improved screening of blood before transfusion.[29]
In Egypt, following Egypt’s 2030 Vision, the country managed to bring down the infection rates of Hepatitis C from 22% in 2011 to just 2% in 2021.[63] It was believed that the high prevalence in Egypt was linked to a discontinued mass-treatment campaign for schistosomiasis, using improperly sterilized glass syringes.[26]
In the United States, about 2% of people have chronic hepatitis C.[17] In 2014, an estimated 30,500 new acute hepatitis C cases occurred (0.7 per 100,000 population), an increase from 2010 to 2012.[116] The number of deaths from hepatitis C has increased to 15,800 in 2008[117] having overtaken HIV/AIDS as a cause of death in the US in 2007.[118] In 2014 it was the single greatest cause of infectious death in the United States.[119] This mortality rate is expected to increase, as those infected by transfusion before HCV testing become apparent.[120] In Europe the percentage of people with chronic infections has been estimated to be between 0.13 and 3.26%.[121]
In the United Kingdom about 118,000 people were chronically infected in 2019.[122] About half of people using a needle exchange in London in 2017/8 tested positive for hepatitis C of which half were unaware that they had it.[123] As part of a bid to eradicate hepatitis C by 2025 NHS England conducted a large procurement exercise in 2019. Merck Sharp & Dohme, Gilead Sciences, and Abbvie were awarded contracts, which, together, are worth up to £1 billion over five years.[124]
The total number of people with this infection is higher in some countries in Africa and Asia.[125] Countries with particularly high rates of infection include Pakistan (4.8%) and China (3.2%).[126]
Since 2014, extremely effective medication have been available to eradication the disease in 8–12 weeks in most people.[127] In 2015 about 950,000 people were treated while 1.7 million new infections occurred, meaning that overall the number of people with HCV increased.[127] These numbers differ by country and improved in 2016, with some countries achieving higher cure rates than new infection rates (mostly high income countries).[127] By 2018, twelve countries are on track to achieve HCV elimination.[127] While antiviral agents will curb new infections, it is less clear whether they impact overall deaths and morbidity.[127] Furthermore, for them to be effective, people need to be aware of their infection – it is estimated that worldwide only 20% of infected people are aware of their infection (in the US fewer than half were aware).[127]
History[edit]
Nobel Prize in Physiology or Medicine 2020: Seminal experiments by HJ Alter, M Houghton and CM Rice leading to the discovery of HCV as the causative agent of non-A, non-B hepatitis.
In the mid-1970s, Harvey J. Alter, Chief of the Infectious Disease Section in the Department of Transfusion Medicine at the National Institutes of Health, and his research team demonstrated how most post-transfusion hepatitis cases were not due to hepatitis A or B viruses. Despite this discovery, international research efforts to identify the virus, initially called non-A, non-B hepatitis (NANBH), failed for the next decade. In 1987, Michael Houghton, Qui-Lim Choo, and George Kuo at Chiron Corporation, collaborating with Daniel W. Bradley at the Centers for Disease Control and Prevention, used a novel molecular cloning approach to identify the unknown organism and develop a diagnostic test.[128] In 1988, Alter confirmed the virus by verifying its presence in a panel of NANBH specimens, and Chiron announced its discovery at a Washington, DC Press conference in May, 1988.
At the time, Chiron was in talks with the Japanese health ministry to sell a biotech version of the Hepatitis B vaccine. Simultaneously, Emperor Hirohito had developed cancer and required numerous blood transfusions. The Japanese health ministry placed a screening order for Chiron’s experimental NANBH test. Chiron’s Japanese marketing subsidiary, Diagnostic Systems KK invented the term «Hepatitis C» in November, 1988 in Tokyo news reports publicizing the testing of the Emperor’s blood.[129] Chiron managed to sell a screening order to the Japanese health ministry in November 1988, earning the company $60 million a year. However, because Chiron had not published any of its research and did not make a culture model available to other researchers to verify Chiron’s discovery, Hepatitis C earned the nickname «The Emperor’s New Virus.»
In April 1989, the «discovery» of HCV was published in two articles in the journal Science.[130][131] Chiron filed for several patents on the virus and its diagnosis.[132] A competing patent application by the CDC was dropped in 1990 after Chiron paid $1.9 million to the CDC and $337,500 to Bradley. In 1994, Bradley sued Chiron, seeking to invalidate the patent, have himself included as a coinventor, and receive damages and royalty income. He dropped the suit in 1998 after losing before an appeals court.[133]
Because of the unique molecular «isolation» of the Hepatitis C virus, although Houghton and Kuo’s team at Chiron had discovered strong biochemical markers for the virus and the test proved effective at reducing cases of post-transfusion hepatitis, the existence of a Hepatitis C virus was essentially inferred.[134] In 1992, the San Francisco Chronicle reported the virus had never been observed under an electron microscope.[135] In 1997, the American FDA approved the first Hepatitis C drug on the basis of a Surrogate Marker called «Sustained Virological Response.» In response, the pharmaceutical industry established a nationwide network of «Astro-Turf» patient advocacy groups to raise awareness (and fear) of the disease.[136]
Hepatitis C was finally «discovered» in 2005 when a Japanese team was able to propagate a molecular clone in a cell culture called Huh7.[137] This discovery enabled proper characterization of the viral particle and rapid research into the development of protease inhibitors replacing early interferon treatments. The first of these, Sovaldi, was approved on December 6, 2013. These drugs are marketed as «cures;» however, because they were approved on the basis of surrogate markers and not clinical endpoints such as prolonging life or improving liver health, many experts question their value.[138][needs update][139]
After blood screening began, a notable Hepatitis C prevalence was discovered in Egypt, which claimed six million individuals were infected by unsterile needles in a late 1970’s mass chemotherapy campaign to eliminate snail fever.[140]
On October 5, 2020, Houghton and Alter, together with Charles M. Rice, were awarded the Nobel Prize in Physiology or Medicine for their work.[141][142]
Society and culture[edit]
|
|
This section needs to be updated. Please help update this article to reflect recent events or newly available information. (July 2020) |
World Hepatitis Day, held on July 28, is coordinated by the World Hepatitis Alliance.[143] The economic costs of hepatitis C are significant both to the individual and to society. In the United States the average lifetime cost of the disease was estimated at US$33,407 in 2003[144] with the cost of a liver transplant as of 2011 costing approximately US$200,000.[145] In Canada the cost of a course of antiviral treatment is as high as 30,000 CAD in 2003,[146] while the United States costs are between 9,200 and 17,600 in 1998 USD.[144] In many areas of the world, people are unable to afford treatment with antivirals as they either lack insurance coverage or the insurance they have will not pay for antivirals.[147] In the English National Health Service treatment rates for hepatitis C are higher among wealthier groups per 2010–2012 data.[148] Spanish anaesthetist Juan Maeso infected 275 patients between 1988 and 1997 as he used the same needles to give both himself and the patients opioids.[149] For this he was jailed.[150]
Special populations[edit]
Children and pregnancy[edit]
Compared with adults, infection in children is much less understood. Worldwide the prevalence of hepatitis C virus infection in pregnant women and children has been estimated to 1–8% and 0.05–5% respectively.[151] The vertical transmission rate has been estimated to be 3–5% and there is a high rate of spontaneous clearance (25–50%) in the children. Higher rates have been reported for both vertical transmission (18%, 6–36% and 41%)[152][153] and prevalence in children (15%).[154]
In developed countries transmission around the time of birth is now the leading cause of HCV infection. In the absence of virus in the mother’s blood transmission seems to be rare.[153] Factors associated with an increased rate of infection include membrane rupture of longer than 6 hours before delivery and procedures exposing the infant to maternal blood.[155] Cesarean sections are not recommended. Breastfeeding is considered safe if the nipples are not damaged. Infection around the time of birth in one child does not increase the risk in a subsequent pregnancy. All genotypes appear to have the same risk of transmission.
HCV infection is frequently found in children who have previously been presumed to have non-A, non-B hepatitis and cryptogenic liver disease.[156] The presentation in childhood may be asymptomatic or with elevated liver function tests.[157] While infection is commonly asymptomatic both cirrhosis with liver failure and hepatocellular carcinoma may occur in childhood.
Immunosuppressed[edit]
The rate of hepatitis C in immunosuppressed people is higher. This is particularly true in those with human immunodeficiency virus infection, recipients of organ transplants, and those with hypogammaglobulinemia.[158] Infection in these people is associated with an unusually rapid progression to cirrhosis. People with stable HIV who never received medication for HCV, may be treated with a combination of peginterferon plus ribavirin with caution to the possible side effects.[159]
Research[edit]
As of 2011, there are about one hundred medications in development for hepatitis C.[145] These include vaccines to treat hepatitis, immunomodulators, and cyclophilin inhibitors, among others.[160] These potential new treatments have come about due to a better understanding of the hepatitis C virus.[161] There are a number of vaccines under development and some have shown encouraging results.[83]
The combination of sofosbuvir and velpatasvir in one trial (reported in 2015) resulted in cure rates of 99%.[162] More studies are needed to investigate the role of the preventive antiviral medication against HCV recurrence after transplantation.[163]
Animal models[edit]
One barrier to finding treatments for hepatitis C is the lack of a suitable animal model. Despite moderate success, research highlights the need for pre-clinical testing in mammalian systems such as mouse, particularly for the development of vaccines in poorer communities. Chimpanzees remain the only available living system to study, yet their use has ethical concerns and regulatory restrictions. While scientists have made use of human cell culture systems such as hepatocytes, questions have been raised about their accuracy in reflecting the body’s response to infection.[164]
One aspect of hepatitis research is to reproduce infections in mammalian models. A strategy is to introduce liver tissues from humans into mice, a technique known as xenotransplantation. This is done by generating chimeric mice, and exposing the mice HCV infection. This engineering process is known to create humanized mice, and provide opportunities to study hepatitis C within the 3D architectural design of the liver and evaluating antiviral compounds.[164] Alternatively, generating inbred mice with susceptibility to HCV would simplify the process of studying mouse models.
See also[edit]
- PSI-6130, an experimental drug treatment
References[edit]
- ^ a b c d e f g h i j k l m n o p q r s «Q&A for Health Professionals». Viral Hepatitis. Centers for Disease Control and Prevention. Retrieved 28 September 2020.
- ^ a b c Ryan KJ, Ray CG, eds. (2004). Sherris Medical Microbiology (4th ed.). McGraw Hill. pp. 551–52. ISBN 978-0-8385-8529-0.
- ^ a b c Maheshwari A, Thuluvath PJ (February 2010). «Management of acute hepatitis C». Clinics in Liver Disease. 14 (1): 169–76, x. doi:10.1016/j.cld.2009.11.007. PMID 20123448.
- ^ a b c d e f g h i j k l «Hepatitis C Fact sheet N°164». WHO. July 2015. Archived from the original on 31 January 2016. Retrieved 4 February 2016.
- ^ a b c d e f g h i j k l m n Rosen HR (June 2011). «Clinical practice. Chronic hepatitis C infection». The New England Journal of Medicine. 364 (25): 2429–38. doi:10.1056/NEJMcp1006613. PMID 21696309. S2CID 19755395.
- ^ a b c «Hepatitis C». World Health Organization. 9 July 2019. Archived from the original on 2020-05-26. Retrieved 2020-05-26.
- ^ «Hepatitis MedlinePlus». U.S. National Library of Medicine. Retrieved 2020-06-19.
- ^ «Viral Hepatitis: A through E and Beyond». National Institute of Diabetes and Digestive and Kidney Diseases. April 2012. Archived from the original on 2 February 2016. Retrieved 4 February 2016.
- ^ a b Owens DK, Davidson KW, Krist AH, Barry MJ, Cabana M, Caughey AB, et al. (March 2020). «Screening for Hepatitis C Virus Infection in Adolescents and Adults: US Preventive Services Task Force Recommendation Statement». JAMA. 323 (10): 970–975. doi:10.1001/jama.2020.1123. PMID 32119076.
- ^ a b Webster DP, Klenerman P, Dusheiko GM (March 2015). «Hepatitis C». Lancet. 385 (9973): 1124–35. doi:10.1016/S0140-6736(14)62401-6. PMC 4878852. PMID 25687730.
- ^ a b Zelenev A, Li J, Mazhnaya A, Basu S, Altice FL (February 2018). «Hepatitis C virus treatment as prevention in an extended network of people who inject drugs in the USA: a modelling study». The Lancet. Infectious Diseases. 18 (2): 215–224. doi:10.1016/S1473-3099(17)30676-X. PMC 5860640. PMID 29153265.
- ^ a b c d e f g Kim A (September 2016). «Hepatitis C Virus». Annals of Internal Medicine (Review). 165 (5): ITC33–ITC48. doi:10.7326/AITC201609060. PMID 27595226. S2CID 95756.
- ^ a b c «Global progress report on HIV, viral hepatitis and sexually transmitted infections, 2021». www.who.int. Retrieved 2022-01-19.
- ^ Houghton M (November 2009). «The long and winding road leading to the identification of the hepatitis C virus». Journal of Hepatology. 51 (5): 939–48. doi:10.1016/j.jhep.2009.08.004. PMID 19781804.
- ^ Shors T (2011). Understanding viruses (2nd ed.). Burlington, MA: Jones & Bartlett Learning. p. 535. ISBN 978-0-7637-8553-6. Archived from the original on 2016-05-15.
- ^ a b c d e f Chronic Hepatitis C Virus Advances in Treatment, Promise for the Future. Springer Verlag. 2011. p. 14. ISBN 978-1-4614-1191-8. Archived from the original on 2016-06-17.
- ^ a b c d e f g h i j k l m n o p q r s Wilkins T, Malcolm JK, Raina D, Schade RR (June 2010). «Hepatitis C: diagnosis and treatment» (PDF). American Family Physician. 81 (11): 1351–7. PMID 20521755. Archived (PDF) from the original on 2013-05-21.
- ^ Rao, A; Rule, JA; Cerro-Chiang, G; Stravitz, RT; McGuire, BM; Lee, G; Fontana, RJ; Lee, WM (11 May 2022). «Role of Hepatitis C Infection in Acute Liver Injury/Acute Liver Failure in North America». Digestive Diseases and Sciences: 1–8. doi:10.1007/s10620-022-07524-6. PMC 9094131. PMID 35546205.
- ^ a b c d Nelson PK, Mathers BM, Cowie B, Hagan H, Des Jarlais D, Horyniak D, Degenhardt L (August 2011). «Global epidemiology of hepatitis B and hepatitis C in people who inject drugs: results of systematic reviews». Lancet. 378 (9791): 571–83. doi:10.1016/S0140-6736(11)61097-0. PMC 3285467. PMID 21802134.
- ^ a b c d Kanwal F, Bacon BR (2011). «Does Treatment Alter the Natural History of Chronic HCV?». In Schiffman ML (ed.). Chronic Hepatitis C Virus Advances in Treatment, Promise for the Future. Springer Verlag. pp. 103–04. ISBN 978-1-4614-1191-8.
- ^ a b c d e f g Ray SC, Thomas DL (2009). «Chapter 154: Hepatitis C». In Mandell GL, Bennett, Dolin R (eds.). Mandell, Douglas, and Bennett’s principles and practice of infectious diseases (7th ed.). Philadelphia, PA: Churchill Livingstone. ISBN 978-0-443-06839-3.
- ^ Forton DM, Allsop JM, Cox IJ, Hamilton G, Wesnes K, Thomas HC, Taylor-Robinson SD (October 2005). «A review of cognitive impairment and cerebral metabolite abnormalities in patients with hepatitis C infection». AIDS. 19 Suppl 3 (Suppl 3): S53-63. doi:10.1097/01.aids.0000192071.72948.77. PMID 16251829.
- ^ a b c Nicot F (2004). «Chapter 19. Liver biopsy in modern medicine.». Occult hepatitis C virus infection: Where are we now?. ISBN 978-953-307-883-0.
- ^ a b El-Zayadi AR (July 2008). «Hepatic steatosis: a benign disease or a silent killer». World Journal of Gastroenterology. 14 (26): 4120–6. doi:10.3748/wjg.14.4120. PMC 2725370. PMID 18636654.
- ^ Paradis V, Bedossa P (December 2008). «Definition and natural history of metabolic steatosis: histology and cellular aspects». Diabetes & Metabolism. 34 (6 Pt 2): 638–42. doi:10.1016/S1262-3636(08)74598-1. PMID 19195624.
- ^ a b c d e f g h i j Alter MJ (May 2007). «Epidemiology of hepatitis C virus infection». World Journal of Gastroenterology. 13 (17): 2436–41. doi:10.3748/wjg.v13.i17.2436. PMC 4146761. PMID 17552026.
- ^ Mueller S, Millonig G, Seitz HK (July 2009). «Alcoholic liver disease and hepatitis C: a frequently underestimated combination». World Journal of Gastroenterology. 15 (28): 3462–71. doi:10.3748/wjg.15.3462. PMC 2715970. PMID 19630099. Retrieved 10 July 2020.
- ^ Fattovich G, Stroffolini T, Zagni I, Donato F (November 2004). «Hepatocellular carcinoma in cirrhosis: incidence and risk factors». Gastroenterology. 127 (5 Suppl 1): S35-50. doi:10.1053/j.gastro.2004.09.014. PMID 15508101.
- ^ a b c d e Ozaras R, Tahan V (April 2009). «Acute hepatitis C: prevention and treatment». Expert Review of Anti-Infective Therapy. 7 (3): 351–61. doi:10.1586/eri.09.8. PMID 19344247. S2CID 25574917.
- ^ Zaltron S, Spinetti A, Biasi L, Baiguera C, Castelli F (2012). «Chronic HCV infection: epidemiological and clinical relevance». BMC Infectious Diseases. 12 Suppl 2 (Suppl 2): S2. doi:10.1186/1471-2334-12-S2-S2. PMC 3495628. PMID 23173556.
- ^ Dammacco F, Sansonno D (September 2013). «Therapy for hepatitis C virus-related cryoglobulinemic vasculitis». The New England Journal of Medicine. 369 (11): 1035–45. doi:10.1056/NEJMra1208642. PMID 24024840. S2CID 205116488.
- ^ Iannuzzella F, Vaglio A, Garini G (May 2010). «Management of hepatitis C virus-related mixed cryoglobulinemia». The American Journal of Medicine. 123 (5): 400–8. doi:10.1016/j.amjmed.2009.09.038. PMID 20399313.
- ^ Ko HM, Hernandez-Prera JC, Zhu H, Dikman SH, Sidhu HK, Ward SC, Thung SN (2012). «Morphologic features of extrahepatic manifestations of hepatitis C virus infection». Clinical & Developmental Immunology. 2012: 740138. doi:10.1155/2012/740138. PMC 3420144. PMID 22919404.
- ^ Dammacco F, Sansonno D, Piccoli C, Racanelli V, D’Amore FP, Lauletta G (2000). «The lymphoid system in hepatitis C virus infection: autoimmunity, mixed cryoglobulinemia, and Overt B-cell malignancy». Seminars in Liver Disease. 20 (2): 143–57. doi:10.1055/s-2000-9613. PMID 10946420.
- ^ Lee MR, Shumack S (November 2005). «Prurigo nodularis: a review». The Australasian Journal of Dermatology. 46 (4): 211–18, quiz 219–20. doi:10.1111/j.1440-0960.2005.00187.x. PMID 16197418. S2CID 30087432.
- ^ Matsumori A (2006). Role of hepatitis C virus in cardiomyopathies. Ernst Schering Research Foundation Workshop. Vol. 55. pp. 99–120. doi:10.1007/3-540-30822-9_7. ISBN 978-3-540-23971-0. PMID 16329660.
- ^ Monaco S, Ferrari S, Gajofatto A, Zanusso G, Mariotto S (2012). «HCV-related nervous system disorders». Clinical & Developmental Immunology. 2012: 236148. doi:10.1155/2012/236148. PMC 3414089. PMID 22899946.
- ^ Xu JH, Fu JJ, Wang XL, Zhu JY, Ye XH, Chen SD (July 2013). «Hepatitis B or C viral infection and risk of pancreatic cancer: a meta-analysis of observational studies». World Journal of Gastroenterology. 19 (26): 4234–41. doi:10.3748/wjg.v19.i26.4234. PMC 3710428. PMID 23864789.
- ^ Lodi G, Porter SR, Scully C (July 1998). «Hepatitis C virus infection: Review and implications for the dentist». Oral Surgery, Oral Medicine, Oral Pathology, Oral Radiology, and Endodontics. 86 (1): 8–22. CiteSeerX 10.1.1.852.7880. doi:10.1016/S1079-2104(98)90143-3. PMID 9690239.
- ^ Carrozzo M, Gandolfo S (2003-03-01). «Oral diseases possibly associated with hepatitis C virus». Critical Reviews in Oral Biology and Medicine. 14 (2): 115–27. doi:10.1177/154411130301400205. PMID 12764074.
- ^ Little JW, Falace DA, Miller C, Rhodus NL (2013). Dental Management of the Medically Compromised Patient. p. 151. ISBN 978-0323080286.
- ^ Sugden PB, Cameron B, Bull R, White PA, Lloyd AR (September 2012). «Occult infection with hepatitis C virus: friend or foe?». Immunology and Cell Biology. 90 (8): 763–73. doi:10.1038/icb.2012.20. PMID 22546735. S2CID 23845868.
- ^ Carreño V (November 2006). «Occult hepatitis C virus infection: a new form of hepatitis C». World Journal of Gastroenterology. 12 (43): 6922–5. doi:10.3748/wjg.12.6922. PMC 4087333. PMID 17109511.
- ^ a b Carreño García V, Nebreda JB, Aguilar IC, Quiroga Estévez JA (March 2011). «[Occult hepatitis C virus infection]». Enfermedades Infecciosas y Microbiologia Clinica. 29 Suppl 3: 14–9. doi:10.1016/S0213-005X(11)70022-2. PMID 21458706.
- ^ Pham TN, Coffin CS, Michalak TI (April 2010). «Occult hepatitis C virus infection: what does it mean?». Liver International. 30 (4): 502–11. doi:10.1111/j.1478-3231.2009.02193.x. PMID 20070513. S2CID 205651069.
- ^ Carreño V, Bartolomé J, Castillo I, Quiroga JA (June 2012). «New perspectives in occult hepatitis C virus infection». World Journal of Gastroenterology. 18 (23): 2887–94. doi:10.3748/wjg.v18.i23.2887. PMC 3380315. PMID 22736911.
- ^ Carreño V, Bartolomé J, Castillo I, Quiroga JA (May–June 2008). «Occult hepatitis B virus and hepatitis C virus infections». Reviews in Medical Virology. 18 (3): 139–57. doi:10.1002/rmv.569. PMID 18265423. S2CID 12331754.
- ^ Scott JD, Gretch DR (February 2007). «Molecular diagnostics of hepatitis C virus infection: a systematic review». JAMA. 297 (7): 724–32. doi:10.1001/jama.297.7.724. PMID 17312292.
- ^ a b Robinson, JL (July 2008). «Vertical transmission of the hepatitis C virus: Current knowledge and issues». Paediatrics & Child Health. 13 (6): 529–41. doi:10.1093/pch/13.6.529. PMC 2532905. PMID 19436425.
- ^ Nakano T, Lau GM, Lau GM, Sugiyama M, Mizokami M (February 2012). «An updated analysis of hepatitis C virus genotypes and subtypes based on the complete coding region». Liver International. 32 (2): 339–45. doi:10.1111/j.1478-3231.2011.02684.x. PMID 22142261. S2CID 23271017.
- ^ a b Lerat H, Hollinger FB (January 2004). «Hepatitis C virus (HCV) occult infection or occult HCV RNA detection?». The Journal of Infectious Diseases. 189 (1): 3–6. doi:10.1086/380203. PMID 14702146.
- ^ Pockros P (2011). Novel and Combination Therapies for Hepatitis C Virus, An Issue of Clinics in Liver Disease. p. 47. ISBN 978-1-4557-7198-1. Archived from the original on 2016-05-21.
- ^ Zignego AL, Giannini C, Gragnani L, Piluso A, Fognani E (August 2012). «Hepatitis C virus infection in the immunocompromised host: a complex scenario with variable clinical impact». Journal of Translational Medicine. 10 (1): 158. doi:10.1186/1479-5876-10-158. PMC 3441205. PMID 22863056.
- ^ Hagan LM, Schinazi RF (February 2013). «Best strategies for global HCV eradication». Liver International. 33 Suppl 1 (s1): 68–79. doi:10.1111/liv.12063. PMC 4110680. PMID 23286849.
- ^ a b c d e Pondé RA (February 2011). «Hidden hazards of HCV transmission». Medical Microbiology and Immunology. 200 (1): 7–11. doi:10.1007/s00430-010-0159-9. PMID 20461405. S2CID 664199.
- ^ a b Xia X, Luo J, Bai J, Yu R (October 2008). «Epidemiology of hepatitis C virus infection among injection drug users in China: systematic review and meta-analysis». Public Health. 122 (10): 990–1003. doi:10.1016/j.puhe.2008.01.014. PMID 18486955.
- ^ Imperial JC (June 2010). «Chronic hepatitis C in the state prison system: insights into the problems and possible solutions». Expert Review of Gastroenterology & Hepatology. 4 (3): 355–64. doi:10.1586/egh.10.26. PMID 20528122. S2CID 7931472.
- ^ Vescio MF, Longo B, Babudieri S, Starnini G, Carbonara S, Rezza G, Monarca R (April 2008). «Correlates of hepatitis C virus seropositivity in prison inmates: a meta-analysis». Journal of Epidemiology and Community Health. 62 (4): 305–13. doi:10.1136/jech.2006.051599. PMID 18339822. S2CID 206989111.
- ^ a b c Moyer VA (September 2013). «Screening for hepatitis C virus infection in adults: U.S. Preventive Services Task Force recommendation statement». Annals of Internal Medicine. 159 (5): 349–57. doi:10.7326/0003-4819-159-5-201309030-00672. PMID 23798026. S2CID 8563203.
- ^ a b Marx J (2010). Rosen’s emergency medicine: concepts and clinical practice (7th ed.). Philadelphia, PA: Mosby/Elsevier. p. 1154. ISBN 978-0-323-05472-0.
- ^ Day RA, Paul P, Williams B (2009). Brunner & Suddarth’s textbook of Canadian medical-surgical nursing (Canadian 2nd ed.). Philadelphia, PA: Lippincott Williams & Wilkins. p. 1237. ISBN 978-0-7817-9989-8. Archived from the original on 2016-04-25.
- ^ a b «Hepatitis C prevalence in Egypt drops from 7% to 2% thanks to Sisi’s initiative». EgyptToday. 2021-02-06. Retrieved 2021-03-06.
- ^ «Highest Rates of Hepatitis C Virus Transmission Found in Egypt». Al Bawaaba. 2010-08-09. Archived from the original on 2012-05-15. Retrieved 2010-08-27.
- ^ Tohme RA, Holmberg SD (October 2010). «Is sexual contact a major mode of hepatitis C virus transmission?». Hepatology. 52 (4): 1497–505. doi:10.1002/hep.23808. PMID 20635398. S2CID 5592006.
- ^ «Hepatitis C Group Education Class». United States Department of Veteran Affairs. Archived from the original on 2011-11-09. Retrieved 2011-11-20.
- ^ a b c d e f Jafari S, Copes R, Baharlou S, Etminan M, Buxton J (November 2010). «Tattooing and the risk of transmission of hepatitis C: a systematic review and meta-analysis». International Journal of Infectious Diseases. 14 (11): e928-40. doi:10.1016/j.ijid.2010.03.019. PMID 20678951.
- ^ «Hepatitis C» (PDF). Centers for Disease Control and Prevention (CDC). Archived (PDF) from the original on 5 January 2012. Retrieved 2 January 2012.
- ^ Lock G, Dirscherl M, Obermeier F, Gelbmann CM, Hellerbrand C, Knöll A, et al. (September 2006). «Hepatitis C — contamination of toothbrushes: myth or reality?». Journal of Viral Hepatitis. 13 (9): 571–3. doi:10.1111/j.1365-2893.2006.00735.x. PMID 16907842. S2CID 24264376.
- ^ a b c «Hepatitis C FAQs for Health Professionals». Centers for Disease Control and Prevention (CDC). Archived from the original on 4 January 2012. Retrieved 2 January 2012.
- ^ Wong T, Lee SS (February 2006). «Hepatitis C: a review for primary care physicians». CMAJ. 174 (5): 649–59. doi:10.1503/cmaj.1030034. PMC 1389829. PMID 16505462.
- ^ a b Lam NC, Gotsch PB, Langan RC (November 2010). «Caring for pregnant women and newborns with hepatitis B or C» (PDF). American Family Physician. 82 (10): 1225–9. PMID 21121533. Archived (PDF) from the original on 2013-05-21.
- ^ Mast EE (2004). «Mother-to-infant hepatitis C virus transmission and breastfeeding». Protecting Infants through Human Milk. Advances in Experimental Medicine and Biology. Vol. 554. pp. 211–16. doi:10.1007/978-1-4757-4242-8_18. ISBN 978-1-4419-3461-1. PMID 15384578.
- ^ Westbrook RH, Dusheiko G (November 2014). «Natural history of hepatitis C». Journal of Hepatology. 61 (1 Suppl): S58-68. doi:10.1016/j.jhep.2014.07.012. PMID 25443346.
- ^ Patel K, Muir AJ, McHutchison JG (April 2006). «Diagnosis and treatment of chronic hepatitis C infection». BMJ. 332 (7548): 1013–7. doi:10.1136/bmj.332.7548.1013. PMC 1450048. PMID 16644828.
- ^ Shivkumar S, Peeling R, Jafari Y, Joseph L, Pant Pai N (October 2012). «Accuracy of rapid and point-of-care screening tests for hepatitis C: a systematic review and meta-analysis». Annals of Internal Medicine. 157 (8): 558–66. doi:10.7326/0003-4819-157-8-201210160-00006. PMID 23070489. S2CID 5650682.
- ^ Senadhi V (July 2011). «A paradigm shift in the outpatient approach to liver function tests». Southern Medical Journal. 104 (7): 521–5. doi:10.1097/SMJ.0b013e31821e8ff5. PMID 21886053. S2CID 26462106.
- ^ Smith BD, Morgan RL, Beckett GA, Falck-Ytter Y, Holtzman D, Teo CG, et al. (August 2012). «Recommendations for the identification of chronic hepatitis C virus infection among persons born during 1945-1965» (PDF). MMWR. Recommendations and Reports. 61 (RR-4): 1–32. PMID 22895429.
- ^ «Testing Recommendations for Hepatitis C Virus Infection – HCV – Division of Viral Hepatitis». U.S. Centers for Disease Control and Prevention (CDC). 12 June 2019. Retrieved 11 January 2020.
- ^ «People Born 1945–1965 (Baby Boomers) – Populations and Settings – Division of Viral Hepatitis». U.S. Centers for Disease Control and Prevention (CDC). 26 July 2019. Archived from the original on 22 October 2019. Retrieved 11 January 2020.
- ^ «Final Update Summary: Hepatitis C: Screening». US Preventive Services Task Force. Retrieved 11 January 2020.
- ^ Shah H, Bilodeau M, Burak KW, Cooper C, Klein M, Ramji A, et al. (June 2018). «The management of chronic hepatitis C: 2018 guideline update from the Canadian Association for the Study of the Liver». CMAJ. 190 (22): E677–E687. doi:10.1503/cmaj.170453. PMC 5988519. PMID 29866893.
- ^ a b Abdelwahab KS, Ahmed Said ZN (January 2016). «Status of hepatitis C virus vaccination: Recent update». World Journal of Gastroenterology. 22 (2): 862–73. doi:10.3748/wjg.v22.i2.862. PMC 4716084. PMID 26811632.
- ^ Hagan H, Pouget ER, Des Jarlais DC (July 2011). «A systematic review and meta-analysis of interventions to prevent hepatitis C virus infection in people who inject drugs». The Journal of Infectious Diseases. 204 (1): 74–83. doi:10.1093/infdis/jir196. PMC 3105033. PMID 21628661.
- ^ a b AASLD/IDSA HCV Guidance Panel (September 2015). «Hepatitis C guidance: AASLD-IDSA recommendations for testing, managing, and treating adults infected with hepatitis C virus». Hepatology. 62 (3): 932–54. doi:10.1002/hep.27950. PMID 26111063.
- ^ a b «HCV Guidance: Recommendations for Testing, Managing, and Treating Hepatitis C» (PDF). 12 April 2017. Archived from the original (PDF) on 2017-07-10. Retrieved 28 July 2017.
- ^ Jakobsen JC, Nielsen EE, Feinberg J, Katakam KK, Fobian K, Hauser G, et al. (September 2017). «Direct-acting antivirals for chronic hepatitis C». The Cochrane Database of Systematic Reviews. 9 (9): CD012143. doi:10.1002/14651858.CD012143.pub3. PMC 6484376. PMID 28922704.
- ^ «Treatment: Naive Genotype 1a Without Cirrhosis». HCV Guidance: Recommendations for Testing, Managing, and Treating Hepatitis C. www.hcvguidelines.org. American Association for the Study of Liver Diseases. Retrieved 26 April 2017.
- ^ «Treatment: Naive Genotype 1a With Compensated Cirrhosis». HCV Guidance: Recommendations for Testing, Managing, and Treating Hepatitis C. www.hcvguidelines.org. American Association for the Study of Liver Diseases. Retrieved 26 April 2017.
- ^ «Treatment: Naive Genotype 1b Without Cirrhosis». HCV Guidance: Recommendations for Testing, Managing, and Treating Hepatitis C. www.hcvguidelines.org. American Association for the Study of Liver Diseases. Retrieved 26 April 2017.
- ^ «Treatment: Naive Genotype 1b With Compensated Cirrhosis». HCV Guidance: Recommendations for Testing, Managing, and Treating Hepatitis C. www.hcvguidelines.org. American Association for the Study of Liver Diseases. Retrieved 26 April 2017.
- ^ «Treatment; Naive Genotype 2 Without Cirrhosis». HCV Guidance: Recommendations for Testing, Managing, and Treating Hepatitis C. www.hcvguidelines.org. American Association for the Study of Liver Diseases. Retrieved 26 April 2017.
- ^ «Treatment – Naive Genotype 2 With Compensated Cirrhosis». HCV Guidance: Recommendations for Testing, Managing, and Treating Hepatitis C. www.hcvguidelines.org. American Association for the Study of Liver Diseases. Retrieved 26 April 2017.
- ^ «Treatment: Naive Genotype 3 Without Cirrhosis». HCV Guidance: Recommendations for Testing, Managing, and Treating Hepatitis C. www.hcvguidelines.org. American Association for the Study of Liver Diseases. Retrieved 26 April 2017.
- ^ «Treatment: Naive Genotype 3 With Compensated Cirrhosis». HCV Guidance: Recommendations for Testing, Managing, and Treating Hepatitis C. www.hcvguidelines.org. American Association for the Study of Liver Diseases. Retrieved 26 April 2017.
- ^ «Treatment: Naive Genotype 4 Without Cirrhosis». HCV Guidance: Recommendations for Testing, Managing, and Treating Hepatitis C. www.hcvguidelines.org. American Association for the Study of Liver Diseases. Retrieved 26 April 2017.
- ^ «Treatment: Naive Genotype 4 With Compensated Cirrhosis». HCV Guidance: Recommendations for Testing, Managing, and Treating Hepatitis C. www.hcvguidelines.org. American Association for the Study of Liver Diseases. Retrieved 26 April 2017.
- ^ «Treatment: Naive Genotype 5 or 6». HCV Guidance: Recommendations for Testing, Managing, and Treating Hepatitis C. www.hcvguidelines.org. American Association for the Study of Liver Diseases. Retrieved 26 April 2017.
- ^ «Hepatitis C Questions and Answers for Health Professionals». www.cdc.gov. 2 July 2019. Retrieved 23 July 2019.
- ^ «FDA approves Vosevi for Hepatitis C». U.S. Food and Drug Administration (FDA) (Press release). 18 July 2017. Archived from the original on 23 July 2017. Retrieved 27 July 2017.
- ^ Liang TJ, Ghany MG (May 2013). «Current and future therapies for hepatitis C virus infection». The New England Journal of Medicine. 368 (20): 1907–17. doi:10.1056/NEJMra1213651. PMC 3893124. PMID 23675659.
- ^ Mücke MM, Backus LI, Mücke VT, Coppola N, Preda CM, Yeh ML, et al. (March 2018). «Hepatitis B virus reactivation during direct-acting antiviral therapy for hepatitis C: a systematic review and meta-analysis». The Lancet. Gastroenterology & Hepatology. 3 (3): 172–180. doi:10.1016/S2468-1253(18)30002-5. PMID 29371017.
- ^ Sanders M (2011). Mosby’s Paramedic Textbook. Jones & Bartlett Publishers. p. 839. ISBN 978-0-323-07275-5. Archived from the original on 2016-05-11.
- ^ Ciria R, Pleguezuelo M, Khorsandi SE, Davila D, Suddle A, Vilca-Melendez H, et al. (May 2013). «Strategies to reduce hepatitis C virus recurrence after liver transplantation». World Journal of Hepatology. 5 (5): 237–50. doi:10.4254/wjh.v5.i5.237. PMC 3664282. PMID 23717735.
- ^ Coilly A, Roche B, Samuel D (February 2013). «Current management and perspectives for HCV recurrence after liver transplantation». Liver International. 33 Suppl 1: 56–62. doi:10.1111/liv.12062. PMID 23286847. S2CID 23601091.
- ^ Gurusamy KS, Tsochatzis E, Toon CD, Xirouchakis E, Burroughs AK, Davidson BR (December 2013). «Antiviral interventions for liver transplant patients with recurrent graft infection due to hepatitis C virus». The Cochrane Database of Systematic Reviews. 2014 (12): CD006803. doi:10.1002/14651858.CD006803.pub4. PMC 8930021. PMID 24307460.
- ^ a b Hepatitis C and CAM: What the Science Says Archived 2011-03-20 at the Wayback Machine. National Center for Complementary and Alternative Medicine (NCCAM). March 2011. (Retrieved 7 March 2011)
- ^ Liu J, Manheimer E, Tsutani K, Gluud C (March 2003). «Medicinal herbs for hepatitis C virus infection: a Cochrane hepatobiliary systematic review of randomized trials». The American Journal of Gastroenterology. 98 (3): 538–44. doi:10.1111/j.1572-0241.2003.07298.x. PMID 12650784. S2CID 20014583.
- ^ Rambaldi A, Jacobs BP, Gluud C (October 2007). «Milk thistle for alcoholic and/or hepatitis B or C virus liver diseases». The Cochrane Database of Systematic Reviews. 2009 (4): CD003620. doi:10.1002/14651858.CD003620.pub3. PMC 8724782. PMID 17943794.
- ^ Helms RA, Quan DJ, eds. (2006). Textbook of Therapeutics: Drug and Disease Management (8th ed.). Philadelphia, PA [u.a.]: Lippincott Williams & Wilkins. p. 1340. ISBN 978-0-7817-5734-8. Archived from the original on 5 December 2015. Retrieved 7 November 2014.
- ^ Morgan RL, Baack B, Smith BD, Yartel A, Pitasi M, Falck-Ytter Y (March 2013). «Eradication of hepatitis C virus infection and the development of hepatocellular carcinoma: a meta-analysis of observational studies». Annals of Internal Medicine. 158 (5 Pt 1): 329–37. doi:10.7326/0003-4819-158-5-201303050-00005. PMID 23460056.
- ^ Fung J, Lai CL, Hung I, Young J, Cheng C, Wong D, Yuen MF (September 2008). «Chronic hepatitis C virus genotype 6 infection: response to pegylated interferon and ribavirin». The Journal of Infectious Diseases. 198 (6): 808–12. doi:10.1086/591252. PMID 18657036.
- ^ «World Health Organization Fact Sheet: Hepatitis C». www.who.int. Retrieved 2022-01-19.
{{cite web}}: CS1 maint: url-status (link) - ^ Mohd Hanafiah K, Groeger J, Flaxman AD, Wiersma ST (April 2013). «Global epidemiology of hepatitis C virus infection: new estimates of age-specific antibody to HCV seroprevalence». Hepatology. 57 (4): 1333–42. doi:10.1002/hep.26141. PMID 23172780. S2CID 16265266.
- ^ Yu ML, Chuang WL (March 2009). «Treatment of chronic hepatitis C in Asia: when East meets West». Journal of Gastroenterology and Hepatology. 24 (3): 336–45. doi:10.1111/j.1440-1746.2009.05789.x. PMID 19335784. S2CID 27333980.
- ^ «U.S. 2014 Surveillance Data for Viral Hepatitis, Statistics & Surveillance, Division of Viral Hepatitis». CDC. Archived from the original on 2016-08-08. Retrieved 2016-08-04.
- ^ Table 4.5. «Number and rate of deaths with hepatitis C listed as a cause of death, by demographic characteristic and year – United States, 2004–2008». Viral Hepatitis on the CDC web site. Centers for Disease Control and Prevention, Atlanta, GA. Archived from the original on 9 March 2014. Retrieved 28 July 2013.
- ^ «Hepatitis Death Rate Creeps past AIDS». New York Times. 27 February 2012. Archived from the original on 30 June 2017. Retrieved 28 July 2013.
- ^ «Hepatitis C Kills More Americans than Any Other Infectious Disease». Centers for Disease Control and Prevention. May 4, 2016. Archived from the original on 9 August 2016. Retrieved 3 August 2016.
- ^ Blatt LM, Tong M (2004). Colacino JM, Heinz BA (eds.). Hepatitis prevention and treatment. Basel: Birkhäuser. p. 32. ISBN 978-3-7643-5956-0. Archived from the original on 2016-06-24.
- ^ Blachier M, Leleu H, Peck-Radosavljevic M, Valla DC, Roudot-Thoraval F (March 2013). «The burden of liver disease in Europe: a review of available epidemiological data». Journal of Hepatology. 58 (3): 593–608. doi:10.1016/j.jhep.2012.12.005. PMID 23419824.
- ^ «Hepatitis C». 24 October 2017.
- ^ «More than half of patients using needle exchange pilot tested positive for Hepatitis C». Pharmaceutical Journal. 17 May 2018. Archived from the original on 16 August 2018. Retrieved 15 August 2018.
- ^ «Legal action firm among winners for largest medicines procurement». Health Service Journal. 30 April 2019. Retrieved 9 June 2019.
- ^ Holmberg S (2011-05-12). Brunette GW, Kozarsky PE, Magill AJ, Shlim DR, Whatley AD (eds.). CDC Health Information for International Travel 2012. New York: Oxford University Press. p. 231. ISBN 978-0-19-976901-8.
- ^ «Hepatitis C». World Health Organization (WHO). June 2011. Archived from the original on 2011-07-12. Retrieved 2011-07-13.
- ^ a b c d e f Lombardi A, Mondelli MU (March 2019). «Hepatitis C: Is eradication possible?». Liver International. 39 (3): 416–426. doi:10.1111/liv.14011. PMID 30472772.
- ^ Boyer JL (2001). Liver cirrhosis and its development: proceedings of the Falk Symposium 115. Springer. pp. 344. ISBN 978-0-7923-8760-2.
- ^ Barnum, Alex (May 12, 1992). «US Biotech is Thriving in Japan: Chiron got its start by using blood test on Emperor Hirohito» (PDF). San Francisco Chronicle.
- ^ Choo QL, Kuo G, Weiner AJ, Overby LR, Bradley DW, Houghton M (April 1989). «Isolation of a cDNA clone derived from a blood-borne non-A, non-B viral hepatitis genome» (PDF). Science. 244 (4902): 359–62. Bibcode:1989Sci…244..359C. CiteSeerX 10.1.1.469.3592. doi:10.1126/science.2523562. PMID 2523562.
- ^ Kuo G, Choo QL, Alter HJ, Gitnick GL, Redeker AG, Purcell RH, et al. (April 1989). «An assay for circulating antibodies to a major etiologic virus of human non-A, non-B hepatitis». Science. 244 (4902): 362–4. Bibcode:1989Sci…244..362K. doi:10.1126/science.2496467. PMID 2496467.
- ^ EP patent 0318216, Houghton M, Choo QL, Kuo G, «NANBV diagnostics», issued 1989-05-31, assigned to Chiron
- ^ Wilken. «United States Court of Appeals for the Federal Circuit». United States Court of Appeals for the Federal Circuit. Archived from the original on 19 November 2009. Retrieved 11 January 2012.
- ^ «Hepatitis C Investigative guidelines» (PDF). Oregon Health Authority. January 2020.
- ^ Barnum, Alex (May 12, 1992). «US Biotech is Thriving in Japan: Chiron got its start by using blood test on Emperor Hirohito» (PDF). San Francisco Chronicle.
- ^ OHarrow, Robert (September 12, 2000). «Grass Roots seeded by Drugmaker». Washington Post.
- ^ Wakida, Tekaji (July 11, 2005). «Production of infectious hepatitis C virus in tissue culture from a cloned viral genome». Nature Medicine. 11 (7): 791–796. doi:10.1038/nm1268. PMC 2918402. PMID 15951748.
- ^ Jakobsen, Janus (June 6, 2017). «Direct‐acting antivirals for chronic hepatitis C». Cochrane Database of Systematic Reviews. 6 (6): CD012143. doi:10.1002/14651858.CD012143.pub2. PMC 6484383. PMID 28585310.
- ^ Koretz, Ronald (January 13, 2015). «Is Widespread Screening for Hepatitis C Justified?». British Medical Journal. 350: g7809. doi:10.1136/bmj.g7809. PMID 25587052. S2CID 36816304.
- ^ McNeil, Donald (December 15, 2015). «Curing Hepatitis C, in an Experiment the Size of Egypt». The New York Times.
- ^ Gallagher J (2020-10-05). «Hepatitis C discovery wins the Nobel Prize». BBC News. Retrieved 2020-10-05.
- ^ Ledford, Heidi (19 October 2020). «The unsung heroes of the Nobel-winning hepatitis C discovery». Nature. 586 (7830): 485. Bibcode:2020Natur.586..485L. doi:10.1038/d41586-020-02932-y. PMID 33082542. S2CID 224822368. Retrieved 20 October 2020.
- ^ Eurosurveillance editorial team (July 2011). «World Hepatitis Day 2011» (PDF). Euro Surveillance. 16 (30). PMID 21813077. Archived (PDF) from the original on 2011-11-25.
- ^ a b Wong JB (2006). «Hepatitis C: cost of illness and considerations for the economic evaluation of antiviral therapies». PharmacoEconomics. 24 (7): 661–72. doi:10.2165/00019053-200624070-00005. PMID 16802842. S2CID 6713508.
- ^ a b El Khoury AC, Klimack WK, Wallace C, Razavi H (March 2012). «Economic burden of hepatitis C-associated diseases in the United States». Journal of Viral Hepatitis. 19 (3): 153–60. doi:10.1111/j.1365-2893.2011.01563.x. PMID 22329369. S2CID 27409621.
- ^ «Hepatitis C Prevention, Support and Research ProgramHealth Canada». Public Health Agency of Canada. Nov 2003. Archived from the original on 22 March 2011. Retrieved 10 January 2012.
- ^ Thomas H, Lemon S, Zuckerman A, eds. (2008). Viral Hepatitis (3rd ed.). Oxford: John Wiley & Sons. p. 532. ISBN 978-1-4051-4388-2. Archived from the original on 2016-06-17.
- ^ «Commissioning supplement: Health inequalities tell a tale of data neglect». Health Service Journal. 19 March 2015. Archived from the original on 28 July 2015. Retrieved 30 April 2015.
- ^ «Spanish Anesthetist Infected Patients». The Washington Post. 15 May 2007. Archived from the original on 22 August 2016. Retrieved 13 July 2016.
- ^ «Spanish Hep C anaesthetist jailed». BBC. 15 May 2007. Archived from the original on 23 October 2007. Retrieved 13 July 2016.
- ^ Arshad M, El-Kamary SS, Jhaveri R (April 2011). «Hepatitis C virus infection during pregnancy and the newborn period—are they opportunities for treatment?». Journal of Viral Hepatitis. 18 (4): 229–36. doi:10.1111/j.1365-2893.2010.01413.x. PMID 21392169. S2CID 35515919.
- ^ Hunt CM, Carson KL, Sharara AI (May 1997). «Hepatitis C in pregnancy». Obstetrics and Gynecology. 89 (5 Pt 2): 883–90. doi:10.1016/S0029-7844(97)81434-2. PMID 9166361. S2CID 23182340.
- ^ a b Thomas SL, Newell ML, Peckham CS, Ades AE, Hall AJ (February 1998). «A review of hepatitis C virus (HCV) vertical transmission: risks of transmission to infants born to mothers with and without HCV viraemia or human immunodeficiency virus infection». International Journal of Epidemiology. 27 (1): 108–17. doi:10.1093/ije/27.1.108. PMID 9563703.
- ^ Fischler B (June 2007). «Hepatitis C virus infection». Seminars in Fetal & Neonatal Medicine. 12 (3): 168–73. CiteSeerX 10.1.1.852.7880. doi:10.1016/j.siny.2007.01.008. PMID 17320495.
- ^ Indolfi G, Resti M (May 2009). «Perinatal transmission of hepatitis C virus infection». Journal of Medical Virology. 81 (5): 836–43. doi:10.1002/jmv.21437. PMID 19319981. S2CID 21207996.
- ^ González-Peralta RP (November 1997). «Hepatitis C virus infection in pediatric patients». Clinics in Liver Disease. 1 (3): 691–705, ix. doi:10.1016/s1089-3261(05)70329-9. PMID 15560066.
- ^ Suskind DL, Rosenthal P (February 2004). «Chronic viral hepatitis». Adolescent Medicine Clinics. 15 (1): 145–58, x–xi. doi:10.1016/j.admecli.2003.11.001. PMID 15272262.
- ^ Einav S, Koziel MJ (June 2002). «Immunopathogenesis of hepatitis C virus in the immunosuppressed host». Transplant Infectious Disease. 4 (2): 85–92. doi:10.1034/j.1399-3062.2002.t01-2-02001.x. PMID 12220245. S2CID 27843061.
- ^ Iorio A, Marchesini E, Awad T, Gluud LL (January 2010). «Antiviral treatment for chronic hepatitis C in patients with human immunodeficiency virus». The Cochrane Database of Systematic Reviews (1): CD004888. doi:10.1002/14651858.CD004888.pub2. PMID 20091566.
- ^ Ahn J, Flamm SL (August 2011). «Hepatitis C therapy: other players in the game». Clinics in Liver Disease. 15 (3): 641–56. doi:10.1016/j.cld.2011.05.008. PMID 21867942.
- ^ Vermehren J, Sarrazin C (February 2011). «New HCV therapies on the horizon». Clinical Microbiology and Infection. 17 (2): 122–34. doi:10.1111/j.1469-0691.2010.03430.x. PMID 21087349.
- ^ Feld JJ, Jacobson IM, Hézode C, Asselah T, Ruane PJ, Gruener N, et al. (December 2015). «Sofosbuvir and Velpatasvir for HCV Genotype 1, 2, 4, 5, and 6 Infection». The New England Journal of Medicine. 373 (27): 2599–607. doi:10.1056/NEJMoa1512610. hdl:10722/226358. PMID 26571066.
- ^ Gurusamy KS, Tsochatzis E, Toon CD, Davidson BR, Burroughs AK (December 2013). «Antiviral prophylaxis for the prevention of chronic hepatitis C virus in patients undergoing liver transplantation». The Cochrane Database of Systematic Reviews. 2013 (12): CD006573. doi:10.1002/14651858.CD006573.pub3. PMC 6599865. PMID 24297303.
- ^ a b Sandmann L, Ploss A (January 2013). «Barriers of hepatitis C virus interspecies transmission». Virology. 435 (1): 70–80. doi:10.1016/j.virol.2012.09.044. PMC 3523278. PMID 23217617.
External links[edit]
This audio file was created from a revision of this article dated 26 July 2014, and does not reflect subsequent edits.
- Hepatitis C at Curlie
- «Recommendations for Testing, Managing, and Treating Hepatitis C». www.hcvguidelines.org. IDSA/AASLD. Retrieved 28 July 2017.
- «Hepatitis C». MedlinePlus. U.S. National Library of Medicine.
| Hepatitis C | |
|---|---|
 |
|
| Electron micrograph of hepatitis C virus from cell culture (scale = 50 nanometers) | |
| Specialty | Gastroenterology, Infectious disease |
| Symptoms | Typically none[1] |
| Complications | Liver failure, liver cancer, esophageal and gastric varices[2] |
| Duration | Long term (80%)[1] |
| Causes | Hepatitis C virus usually spread by blood-to-blood contact[1][3] |
| Diagnostic method | Blood testing for antibodies or viral RNA[1] |
| Prevention | Sterile needles, testing donated blood[4] |
| Treatment | Medications, liver transplant[5] |
| Medication | Antivirals (sofosbuvir, simeprevir, others)[1][4] |
| Frequency | 58 million (2019)[6] |
| Deaths | 290,000 (2019)[6] |
Hepatitis C is an infectious disease caused by the hepatitis C virus (HCV) that primarily affects the liver;[2] it is a type of viral hepatitis.[7] During the initial infection people often have mild or no symptoms.[1] Occasionally a fever, dark urine, abdominal pain, and yellow tinged skin occurs.[1] The virus persists in the liver in about 75% to 85% of those initially infected.[1] Early on, chronic infection typically has no symptoms.[1] Over many years however, it often leads to liver disease and occasionally cirrhosis.[1] In some cases, those with cirrhosis will develop serious complications such as liver failure, liver cancer, or dilated blood vessels in the esophagus and stomach.[2]
HCV is spread primarily by blood-to-blood contact associated with injection drug use, poorly sterilized medical equipment, needlestick injuries in healthcare, and transfusions.[1][3] Using blood screening, the risk from a transfusion is less than one per two million.[1] It may also be spread from an infected mother to her baby during birth.[1] It is not spread by superficial contact.[4] It is one of five known hepatitis viruses: A, B, C, D, and E.[8]
Diagnosis is by blood testing to look for either antibodies to the virus or viral RNA.[1] In the United States, screening for HCV infection is recommended in all adults age 18 to 79 years old.[9]
There is no vaccine against hepatitis C.[1][10] Prevention includes harm reduction efforts among people who inject drugs, testing donated blood, and treatment of people with chronic infection.[4][11] Chronic infection can be cured more than 95% of the time with antiviral medications such as sofosbuvir or simeprevir.[6][1][4] Peginterferon and ribavirin were earlier generation treatments that had a cure rate of less than 50% and greater side effects.[4][12] Getting access to the newer treatments, however, can be expensive.[4] Those who develop cirrhosis or liver cancer may require a liver transplant.[5] Hepatitis C is the leading reason for liver transplantation, though the virus usually recurs after transplantation.[5]
An estimated 58 million people worldwide were infected with hepatitis C in 2019. Approximately 290,000 deaths from the virus, mainly from liver cancer and cirrhosis attributed to hepatitis C, also occurred in 2019.[13] The existence of hepatitis C – originally identifiable only as a type of non-A non-B hepatitis – was suggested in the 1970s and proven in 1989.[14] Hepatitis C infects only humans and chimpanzees.[15]
Signs and symptoms[edit]
Acute infection[edit]
Acute symptoms develop in some 20–30% of those infected.[1] When this occurs, it is generally 4–12 weeks following infection (but it may take from 2 weeks to 6 months for acute symptoms to appear).[1][4]
Symptoms are generally mild and vague, and may include fatigue, nausea and vomiting, fever, muscle or joint pains, abdominal pain, decreased appetite and weight loss, jaundice (occurs in ~25% of those infected), dark urine, and clay-coloured stools.[1][16][17] Acute liver failure due to acute hepatitis C is exceedingly rare.[18] Symptoms and laboratory findings suggestive of liver disease should prompt further tests and can thus help establish a diagnosis of hepatitis C infection early on.[17]
Following the acute phase, the infection may resolve spontaneously in 10–50% of affected people; this occurs more frequently in young people, and females.[16]
Chronic infection[edit]
About 80% of those exposed to the virus develop a chronic infection.[19] This is defined as the presence of detectable viral replication for at least six months. Most experience minimal or no symptoms during the initial few decades of the infection.[20] Chronic hepatitis C can be associated with fatigue[21] and mild cognitive problems.[22] Chronic infection after several years may cause cirrhosis or liver cancer.[5] The liver enzymes measured from blood samples are normal in 7–53%.[23] (Elevated levels indicate liver cells are being damaged by the virus or other disease). Late relapses after apparent cure have been reported, but these can be difficult to distinguish from reinfection.[23]
Fatty changes to the liver occur in about half of those infected and are usually present before cirrhosis develops.[24][25] Usually (80% of the time) this change affects less than a third of the liver.[24] Worldwide hepatitis C is the cause of 27% of cirrhosis cases and 25% of hepatocellular carcinoma.[26] About 10–30% of those infected develop cirrhosis over 30 years.[5][17] Cirrhosis is more common in those also infected with hepatitis B, schistosoma, or HIV, in alcoholics and in those of male sex.[17] In those with hepatitis C, excess alcohol increases the risk of developing cirrhosis 5-fold.[27] Those who develop cirrhosis have a 20-fold greater risk of hepatocellular carcinoma. This transformation occurs at a rate of 1–3% per year.[5][17] Being infected with hepatitis B in addition to hepatitis C increases this risk further.[28]
Liver cirrhosis may lead to portal hypertension, ascites (accumulation of fluid in the abdomen), easy bruising or bleeding, varices (enlarged veins, especially in the stomach and esophagus), jaundice, and a syndrome of cognitive impairment known as hepatic encephalopathy.[29] Ascites occurs at some stage in more than half of those who have a chronic infection.[30]
[edit]
The most common problem due to hepatitis C but not involving the liver is mixed cryoglobulinemia (usually the type II form) – an inflammation of small and medium-sized blood vessels.[31][32] Hepatitis C is also associated with autoimmune disorders such as Sjögren’s syndrome, lichen planus, a low platelet count, porphyria cutanea tarda, necrolytic acral erythema, insulin resistance, diabetes mellitus, diabetic nephropathy, autoimmune thyroiditis, and B-cell lymphoproliferative disorders.[34] 20–30% of people infected have rheumatoid factor – a type of antibody.[35] Possible associations include Hyde’s prurigo nodularis[36] and membranoproliferative glomerulonephritis.[21] Cardiomyopathy with associated abnormal heart rhythms has also been reported.[37] A variety of central nervous system disorders has been reported.[38] Chronic infection seems to be associated with an increased risk of pancreatic cancer.[10][39] People may experience other issues in the mouth such as dryness, salivary duct stones, and crusted lesions around the mouth.[40][41][42]
Occult infection[edit]
Persons who have been infected with hepatitis C may appear to clear the virus but remain infected.[43] The virus is not detectable with conventional testing but can be found with ultra-sensitive tests.[44] The original method of detection was by demonstrating the viral genome within liver biopsies, but newer methods include an antibody test for the virus’ core protein and the detection of the viral genome after first concentrating the viral particles by ultracentrifugation.[45] A form of infection with persistently moderately elevated serum liver enzymes but without antibodies to hepatitis C has also been reported.[46] This form is known as cryptogenic occult infection.
Several clinical pictures have been associated with this type of infection.[47] It may be found in people with anti-hepatitis-C antibodies but with normal serum levels of liver enzymes; in antibody-negative people with ongoing elevated liver enzymes of unknown cause; in healthy populations without evidence of liver disease; and in groups at risk for HCV infection including those on hemodialysis or family members of people with occult HCV. The clinical relevance of this form of infection is under investigation.[48] The consequences of occult infection appear to be less severe than with chronic infection but can vary from minimal to hepatocellular carcinoma.[45]
The rate of occult infection in those apparently cured is controversial but appears to be low.[23] 40% of those with hepatitis but with both negative hepatitis C serology and the absence of detectable viral genome in the serum have hepatitis C virus in the liver on biopsy.[49] How commonly this occurs in children is unknown.[50]
Virology[edit]
The hepatitis C virus (HCV) is a small, enveloped, single-stranded, positive-sense RNA virus.[5] It is a member of the genus Hepacivirus in the family Flaviviridae.[21] There are seven major genotypes of HCV, which are known as genotypes one to seven.[51] The genotypes are divided into several subtypes with the number of subtypes depending on the genotype. In the United States, about 70% of cases are caused by genotype 1, 20% by genotype 2 and about 1% by each of the other genotypes.[17] Genotype 1 is also the most common in South America and Europe.[5]
The half life of the virus particles in the serum is around 3 hours and may be as short as 45 minutes.[52][53] In an infected person, about 1012 virus particles are produced each day.[52] In addition to replicating in the liver the virus can multiply in lymphocytes.[54]
Transmission[edit]
Hepatitis C infection in the United States by source
Percutaneous contact with contaminated blood is responsible for most infections; however, the method of transmission is strongly dependent on both geographic region and economic status.[55] Indeed, the primary route of transmission in the developed world is injection drug use, while in the developing world the main methods are blood transfusions and unsafe medical procedures.[3] The cause of transmission remains unknown in 20% of cases;[56] however, many of these are believed to be accounted for by injection drug use.[16]
Drug use[edit]
Injection drug use (IDU) is a major risk factor for hepatitis C in many parts of the world.[57] Of 77 countries reviewed, 25 (including the United States) were found to have a prevalence of hepatitis C of between 60% and 80% among people who use injection drugs.[19][57] Twelve countries had rates greater than 80%.[19] It is believed that ten million intravenous drug users are infected with hepatitis C; China (1.6 million), the United States (1.5 million), and Russia (1.3 million) have the highest absolute totals.[19] Occurrence of hepatitis C among prison inmates in the United States is 10 to 20 times that of the occurrence observed in the general population; this has been attributed to high-risk behavior in prisons such as IDU and tattooing with non-sterile equipment.[58][59] Shared intranasal drug use may also be a risk factor.[60]
Healthcare exposure[edit]
Blood transfusion, transfusion of blood products, or organ transplants without HCV screening carry significant risks of infection.[17] The United States instituted universal screening in 1992,[61] and Canada instituted universal screening in 1990.[62] This decreased the risk from one in 200 units[61] to between one in 10,000 to one in 10,000,000 per unit of blood.[16][56] This low risk remains as there is a period of about 11–70 days between the potential blood donor’s acquiring hepatitis C and the blood’s testing positive depending on the method.[56] Some countries do not screen for hepatitis C due to the cost.[26]
Those who have experienced a needle stick injury from someone who was HCV positive have about a 1.8% chance of subsequently contracting the disease themselves.[17] The risk is greater if the needle in question is hollow and the puncture wound is deep.[26] There is a risk from mucosal exposures to blood, but this risk is low, and there is no risk if blood exposure occurs on intact skin.[26]
Hospital equipment has also been documented as a method of transmission of hepatitis C, including reuse of needles and syringes; multiple-use medication vials; infusion bags; and improperly sterilized surgical equipment, among others.[26] Limitations in the implementation and enforcement of stringent standard precautions in public and private medical and dental facilities are known to have been the primary cause of the spread of HCV in Egypt, the country that had the highest rate of infection in the world in 2012, and currently has one of the lowest in the world in 2021.[63][64]
For more, see HONOReform (Hepatitis Outbreaks National Organization for Reform).
Sexual intercourse[edit]
Sexual transmission of hepatitis C is uncommon.[12] Studies examining the risk of HCV transmission between heterosexual partners, when one is infected and the other is not, have found very low risks.[12] Sexual practices that involve higher levels of trauma to the anogenital mucosa, such as anal penetrative sex, or that occur when there is a concurrent sexually transmitted infection, including HIV or genital ulceration, present greater risks.[12][65] The United States Department of Veterans Affairs recommends condom use to prevent hepatitis C transmission in those with multiple partners, but not those in relationships that involve only a single partner.[66]
Body modification[edit]
Tattooing is associated with two to threefold increased risk of hepatitis C.[67] This could be due to either improperly sterilized equipment or contamination of the dyes being used.[67] Tattoos or piercings performed either before the mid-1980s, «underground», or nonprofessionally are of particular concern, since sterile techniques in such settings may be lacking. The risk also appears to be greater for larger tattoos.[67] It is estimated that nearly half of prison inmates share unsterilized tattooing equipment.[67] It is rare for tattoos in a licensed facility to be directly associated with HCV infection.[68]
Shared personal items[edit]
Personal-care items such as razors, toothbrushes, and manicuring or pedicuring equipment can be contaminated with blood. Sharing such items can potentially lead to exposure to HCV.[69][70] Appropriate caution should be taken regarding any medical condition that results in bleeding, such as cuts and sores.[70] HCV is not spread through casual contact, such as hugging, kissing, or sharing eating or cooking utensils,[70] nor is it transmitted through food or water.[71]
Mother-to-child transmission[edit]
Mother-to-child transmission of hepatitis C occurs in fewer than 10% of pregnancies.[72] There are no measures that alter this risk.[72] It is not clear when transmission occurs during pregnancy, but it may occur both during gestation and at delivery.[56] A long labor is associated with a greater risk of transmission.[26] There is no evidence that breastfeeding spreads HCV; however, to be cautious, an infected mother is advised to avoid breastfeeding if her nipples are cracked and bleeding,[73] or if her viral loads are high.[56]
Diagnosis[edit]
Serologic profile of Hepatitis C infection
There are a number of diagnostic tests for hepatitis C, including HCV antibody enzyme immunoassay (ELISA), recombinant immunoblot assay, and quantitative HCV RNA polymerase chain reaction (PCR).[17] HCV RNA can be detected by PCR typically one to two weeks after infection, while antibodies can take substantially longer to form and thus be detected.[29]
Diagnosing patients is generally a challenge as patients with acute illness generally present with mild, non-specific flu-like symptoms,[74] while the transition from acute to chronic is sub-clinical.[75] Chronic hepatitis C is defined as infection with the hepatitis C virus persisting for more than six months based on the presence of its RNA.[20] Chronic infections are typically asymptomatic during the first few decades,[20] and thus are most commonly discovered following the investigation of elevated liver enzyme levels or during a routine screening of high-risk individuals. Testing is not able to distinguish between acute and chronic infections.[26] Diagnosis in infants is difficult as maternal antibodies may persist for up to 18 months.[50]
Serology[edit]
Hepatitis C testing typically begins with blood testing to detect the presence of antibodies to the HCV, using an enzyme immunoassay.[17] If this test is positive, a confirmatory test is then performed to verify the immunoassay and to determine the viral load.[17] A recombinant immunoblot assay is used to verify the immunoassay and the viral load is determined by an HCV RNA polymerase chain reaction.[17] If there is no RNA and the immunoblot is positive, it means that the person tested had a previous infection but cleared it either with treatment or spontaneously; if the immunoblot is negative, it means that the immunoassay was wrong.[17] It takes about 6–8 weeks following infection before the immunoassay will test positive.[21] A number of tests are available as point-of-care testing (POCT), which can provide results within 30 minutes.[76]
Liver enzymes are variable during the initial part of the infection[20] and on average begin to rise at seven weeks after infection.[21] The elevation of liver enzymes does not closely follow disease severity.[21]
Biopsy[edit]
Liver biopsies are used to determine the degree of liver damage present; however, there are risks from the procedure.[5] The typical changes seen are lymphocytes within the parenchyma, lymphoid follicles in portal triad, and changes to the bile ducts.[5] There are a number of blood tests available that try to determine the degree of hepatic fibrosis and alleviate the need for biopsy.[5]
Screening[edit]
It is believed that only 5–50% of those infected in the United States and Canada are aware of their status.[67] Routine screening for those between the ages of 18 and 79 was recommended by the United States Preventive Services Task Force in 2020.[9] Previously, testing was recommended for those at high risk, including injection drug users, those who have received blood transfusions before 1992,[60] those who have been incarcerated, those on long-term hemodialysis,[60] and those with tattoos.[67] Screening is also recommended for those with elevated liver enzymes, as this is frequently the only sign of chronic hepatitis.[77] As of 2012, the U.S. Centers for Disease Control and Prevention (CDC) recommends a single screening test for those born between 1945 and 1965.[78][79][80][81] In Canada, a one-time screening is recommended for those born between 1945 and 1975.[82]
Prevention[edit]
As of 2016, no approved vaccine protects against contracting hepatitis C.[83] A combination of harm reduction strategies, such as the provision of new needles and syringes and treatment of substance use, decreases the risk of hepatitis C in people using injection drugs by about 75%.[84] The screening of blood donors is important at a national level, as is adhering to universal precautions within healthcare facilities.[21] In countries where there is an insufficient supply of sterile syringes, medications should be given orally rather than via injection (when possible).[26] Recent research also suggests that treating people with active infection, thereby reducing the potential for transmission, may be an effective preventive measure.[11]
Treatment[edit]
Those with chronic hepatitis C are advised to avoid alcohol and medications that are toxic to the liver.[17] They should also be vaccinated against hepatitis A and hepatitis B due to the increased risk if also infected.[17] Use of acetaminophen is generally considered safe at reduced doses.[12] Nonsteroidal anti-inflammatory drugs (NSAIDs) are not recommended in those with advanced liver disease due to an increased risk of bleeding.[12] Ultrasound surveillance for hepatocellular carcinoma is recommended in those with accompanying cirrhosis.[17] Coffee consumption has been associated with[vague] a slower rate of liver scarring in those infected with HCV.[12]
Medications[edit]
Approximately 90% of chronic cases clear with treatment.[4] Treatment with antiviral medication is recommended for all people with proven chronic hepatitis C who are not at high risk of death from other causes.[85] People with the highest complication risk, which is based on the degree of liver scarring, should be treated first.[85] The initial recommended treatment depends on the type of hepatitis C virus, if the person has received previous hepatitis C treatment, and whether the person has cirrhosis.[86] Direct-acting antivirals are the preferred treatment and have been validated by testing for virus particles in patients’ blood.[87]
No prior treatment[edit]
- HCV genotype 1a (no cirrhosis): 8 weeks of glecaprevir/pibrentasvir or ledipasvir/sofosbuvir (the latter for people who do not have HIV/AIDS, are not African-American, and have less than 6 million HCV viral copies per milliliter of blood) or 12 weeks of elbasvir/grazoprevir, ledipasvir/sofosbuvir, or sofosbuvir/velpatasvir.[88] Sofosbuvir with either daclatasvir or simeprevir may also be used.[86]
- HCV genotype 1a (with compensated cirrhosis): 12 weeks of elbasvir/grazoprevir, glecaprevir/pibrentasvir, ledipasvir/sofosbuvir, or sofosbuvir/velpatasvir. An alternative treatment regimen of elbasvir/grazoprevir with weight-based ribavirin for 16 weeks can be used if the HCV is found to have antiviral resistance mutations against NS5A protease inhibitors.[89]
- HCV genotype 1b (no cirrhosis): 8 weeks of glecaprevir/pibrentasvir or ledipasvir/sofosbuvir (with the aforementioned limitations for the latter as above) or 12 weeks of elbasvir/grazoprevir, ledipasvir/sofosbuvir, or sofosbuvir/velpatasvir. Alternative regimens include 12 weeks of ombitasvir/paritaprevir/ritonavir with dasabuvir or 12 weeks of sofosbuvir with either daclatasvir or simeprevir.[90]
- HCV genotype 1b (with compensated cirrhosis): 12 weeks of elbasvir/grazoprevir, glecaprevir/pibrentasvir, ledipasvir/sofosbuvir, or sofosbuvir/velpatasvir. A 12-week course of paritaprevir/ritonavir/ombitasvir with dasabuvir may also be used.[91]
- HCV genotype 2 (no cirrhosis): 8 weeks of glecaprevir/pibrentasvir or 12 weeks of sofosbuvir/velpatasvir. Alternatively, 12 weeks of sofosbuvir/daclatasvir can be used.[92]
- HCV genotype 2 (with compensated cirrhosis): 12 weeks of sofosbuvir/velpatasvir or glecaprevir/pibrentasvir. An alternative regimen of sofosbuvir/daclatasvir can be used for 16–24 weeks.[93]
- HCV genotype 3 (no cirrhosis): 8 weeks of glecaprevir/pibrentasvir or 12 weeks of sofosbuvir/velpatasvir or sofosbuvir and daclatasvir.[94]
- HCV genotype 3 (with compensated cirrhosis): 12 weeks of glecaprevir/pibrentasvir, sofosbuvir/velpatasvir, or if certain antiviral mutations are present, 12 weeks of sofosbuvir/velpatasvir/voxilaprevir (when certain antiviral mutations are present), or 24 weeks of sofosbuvir and daclatasvir.[95]
- HCV genotype 4 (no cirrhosis): 8 weeks of glecaprevir/pibrentasvir or 12 weeks of sofosbuvir/velpatasvir, elbasvir/grazoprevir, or ledipasvir/sofosbuvir. A 12-week regimen of ombitasvir/paritaprevir/ritonavir is also acceptable in combination with weight-based ribavirin.[96]
- HCV genotype 4 (with compensated cirrhosis): A 12-week regimen of sofosbuvir/velpatasvir, glecaprevir/pibrentasavir, elbasvir/grazoprevir, or ledipasvir/sofosbuvir is recommended. A 12-week course of ombitasvir/paritaprevir/ritonavir with weight-based ribavirin is an acceptable alternative.[97]
- HCV genotype 5 or 6 (with or without compensated cirrhosis): If no cirrhosis is present, then 8 weeks of glecaprevir/pibrentasvir is recommended. If cirrhosis is present, then a 12-week course of glecaprevir/pibrentasvir, sofosbuvir/velpatasvir, or ledipasvir/sofosbuvir is warranted.[98]
More than 90% of people with chronic infection can be cured when treated with medications.[99] However, accessing these treatments can be expensive.[4] The combination of sofosbuvir, velpatasvir, and voxilaprevir may be used in those who have previously been treated with sofosbuvir or other drugs that inhibit NS5A and were not cured.[100]
Prior to 2011, treatments consisted of a combination of pegylated interferon alpha and ribavirin for a period of 24 or 48 weeks, depending on HCV genotype.[17] This treatment produces cure rates of between 70 and 80% for genotype 2 and 3, respectively, and 45 to 70% for genotypes 1 and 4.[101] Adverse effects with these treatments were common, with 50 to 60% of those being treated experiencing flu-like symptoms and nearly a third experiencing depression or other emotional issues.[17] Treatment during the first six months of infection (the acute stage) is more effective than when hepatitis C has entered the chronic stage.[29] In those with chronic hepatitis B, treatment for hepatitis C results in reactivation of hepatitis B about 25% of the time.[102]
Surgery[edit]
Cirrhosis due to hepatitis C is a common reason for liver transplantation,[29] though the virus usually (80–90% of cases) recurs afterwards.[5][103] Infection of the graft leads to 10–30% of people developing cirrhosis within five years.[104] Treatment with pegylated interferon and ribavirin post-transplant decreases the risk of recurrence to 70%.[105] A 2013 review found no clear evidence as to whether antiviral medication is useful if the graft became reinfected.[106]
Alternative medicine[edit]
Several alternative therapies are claimed by their proponents to be helpful for hepatitis C, including milk thistle, ginseng, and colloidal silver.[107] However, no alternative therapy has been shown to improve outcomes for hepatitis C patients, and no evidence exists that alternative therapies have any effect on the virus.[107][108][109]
Prognosis[edit]
Disability-adjusted life year for hepatitis C in 2004 per 100,000 inhabitants
|
no data <10 10–15 15–20 20–25 25–30 30–35 |
35–40 40–45 45–50 50–75 75–100 >100 |
The responses to treatment is measured by sustained viral response (SVR), defined as the absence of detectable RNA of the hepatitis C virus in blood serum for at least 24 weeks after discontinuing treatment,[110] and rapid virological response (RVR), defined as undetectable levels achieved within four weeks of treatment. Successful treatment decreases the future risk of hepatocellular carcinoma by 75%.[111]
Prior to 2012, sustained response occurred in about 40–50% of those with HCV genotype 1 who received 48 weeks of treatment.[5] A sustained response was seen in 70–80% of people with HCV genotypes 2 and 3 following 24 weeks of treatment.[5] A sustained response occurs for about 65% of those with genotype 4 after 48 weeks of treatment. For those with HCV genotype 6, a 48-week treatment protocol of pegylated interferon and ribavirin results in a higher rate of sustained responses than for genotype 1 (86% vs. 52%). Further studies are needed to determine results for shorter 24-week treatments and for those given at lower dosages.[112]
Spontaneous resolution[edit]
Depending on a variety of patient factors, between 15 and 45% of those with acute HCV infections will spontaneously clear the virus within six months, before the infection is considered chronic.[4] Spontaneous resolution following acute infection appears more common in females and in patients who are younger, and may be influenced by certain genetic factors.[16] Chronic HCV infection may also resolve spontaneously months or years after the acute phase has passed, though this is unusual.[16]
Epidemiology[edit]
|
|
This section needs to be updated. Please help update this article to reflect recent events or newly available information. (July 2020) |
Percentage of people infected with hepatitis C by country in 2019
The World Health Organization estimated in a 2021 report that 58 million people globally were living with chronic hepatitis C as of 2019.[13] About 1.5 million people are infected per year, and about 290,000 people die yearly from hepatitis C-related diseases, mainly from liver cancer and cirrhosis.[113]
Hepatitis C infection rates increased substantially in the 20th century due to a combination of intravenous drug abuse and the reuse of poorly sterilized medical equipment.[26] However, advancements in treatment have led to notable declines in chronic infections and deaths from the virus. As a result, the number of chronic patients receiving treatment worldwide has grown from about 950,000 in 2015 to 9.4 million in 2019. During the same period, hepatitis C deaths declined from about 400,000 to 290,000.[4][13]
Previously, a 2013 study found high infection rates (>3.5% population infected) in Central and East Asia, North Africa and the Middle East, intermediate infection rates (1.5–3.5%) in South and Southeast Asia, sub-Saharan Africa, Andean, Central and Southern Latin America, Caribbean, Oceania, Australasia and Central, Eastern and Western Europe; and low infection rates (<1.5%) in Asia-Pacific, Tropical Latin America and North America.[114]
Among those chronically infected, the risk of cirrhosis after 20 years varies between studies but has been estimated at ~10–15% for men and ~1–5% for women. The reason for this difference is not known. Once cirrhosis is established, the rate of developing hepatocellular carcinoma is ~1–4% per year.[115] Rates of new infections have decreased in the Western world since the 1990s due to improved screening of blood before transfusion.[29]
In Egypt, following Egypt’s 2030 Vision, the country managed to bring down the infection rates of Hepatitis C from 22% in 2011 to just 2% in 2021.[63] It was believed that the high prevalence in Egypt was linked to a discontinued mass-treatment campaign for schistosomiasis, using improperly sterilized glass syringes.[26]
In the United States, about 2% of people have chronic hepatitis C.[17] In 2014, an estimated 30,500 new acute hepatitis C cases occurred (0.7 per 100,000 population), an increase from 2010 to 2012.[116] The number of deaths from hepatitis C has increased to 15,800 in 2008[117] having overtaken HIV/AIDS as a cause of death in the US in 2007.[118] In 2014 it was the single greatest cause of infectious death in the United States.[119] This mortality rate is expected to increase, as those infected by transfusion before HCV testing become apparent.[120] In Europe the percentage of people with chronic infections has been estimated to be between 0.13 and 3.26%.[121]
In the United Kingdom about 118,000 people were chronically infected in 2019.[122] About half of people using a needle exchange in London in 2017/8 tested positive for hepatitis C of which half were unaware that they had it.[123] As part of a bid to eradicate hepatitis C by 2025 NHS England conducted a large procurement exercise in 2019. Merck Sharp & Dohme, Gilead Sciences, and Abbvie were awarded contracts, which, together, are worth up to £1 billion over five years.[124]
The total number of people with this infection is higher in some countries in Africa and Asia.[125] Countries with particularly high rates of infection include Pakistan (4.8%) and China (3.2%).[126]
Since 2014, extremely effective medication have been available to eradication the disease in 8–12 weeks in most people.[127] In 2015 about 950,000 people were treated while 1.7 million new infections occurred, meaning that overall the number of people with HCV increased.[127] These numbers differ by country and improved in 2016, with some countries achieving higher cure rates than new infection rates (mostly high income countries).[127] By 2018, twelve countries are on track to achieve HCV elimination.[127] While antiviral agents will curb new infections, it is less clear whether they impact overall deaths and morbidity.[127] Furthermore, for them to be effective, people need to be aware of their infection – it is estimated that worldwide only 20% of infected people are aware of their infection (in the US fewer than half were aware).[127]
History[edit]
Nobel Prize in Physiology or Medicine 2020: Seminal experiments by HJ Alter, M Houghton and CM Rice leading to the discovery of HCV as the causative agent of non-A, non-B hepatitis.
In the mid-1970s, Harvey J. Alter, Chief of the Infectious Disease Section in the Department of Transfusion Medicine at the National Institutes of Health, and his research team demonstrated how most post-transfusion hepatitis cases were not due to hepatitis A or B viruses. Despite this discovery, international research efforts to identify the virus, initially called non-A, non-B hepatitis (NANBH), failed for the next decade. In 1987, Michael Houghton, Qui-Lim Choo, and George Kuo at Chiron Corporation, collaborating with Daniel W. Bradley at the Centers for Disease Control and Prevention, used a novel molecular cloning approach to identify the unknown organism and develop a diagnostic test.[128] In 1988, Alter confirmed the virus by verifying its presence in a panel of NANBH specimens, and Chiron announced its discovery at a Washington, DC Press conference in May, 1988.
At the time, Chiron was in talks with the Japanese health ministry to sell a biotech version of the Hepatitis B vaccine. Simultaneously, Emperor Hirohito had developed cancer and required numerous blood transfusions. The Japanese health ministry placed a screening order for Chiron’s experimental NANBH test. Chiron’s Japanese marketing subsidiary, Diagnostic Systems KK invented the term «Hepatitis C» in November, 1988 in Tokyo news reports publicizing the testing of the Emperor’s blood.[129] Chiron managed to sell a screening order to the Japanese health ministry in November 1988, earning the company $60 million a year. However, because Chiron had not published any of its research and did not make a culture model available to other researchers to verify Chiron’s discovery, Hepatitis C earned the nickname «The Emperor’s New Virus.»
In April 1989, the «discovery» of HCV was published in two articles in the journal Science.[130][131] Chiron filed for several patents on the virus and its diagnosis.[132] A competing patent application by the CDC was dropped in 1990 after Chiron paid $1.9 million to the CDC and $337,500 to Bradley. In 1994, Bradley sued Chiron, seeking to invalidate the patent, have himself included as a coinventor, and receive damages and royalty income. He dropped the suit in 1998 after losing before an appeals court.[133]
Because of the unique molecular «isolation» of the Hepatitis C virus, although Houghton and Kuo’s team at Chiron had discovered strong biochemical markers for the virus and the test proved effective at reducing cases of post-transfusion hepatitis, the existence of a Hepatitis C virus was essentially inferred.[134] In 1992, the San Francisco Chronicle reported the virus had never been observed under an electron microscope.[135] In 1997, the American FDA approved the first Hepatitis C drug on the basis of a Surrogate Marker called «Sustained Virological Response.» In response, the pharmaceutical industry established a nationwide network of «Astro-Turf» patient advocacy groups to raise awareness (and fear) of the disease.[136]
Hepatitis C was finally «discovered» in 2005 when a Japanese team was able to propagate a molecular clone in a cell culture called Huh7.[137] This discovery enabled proper characterization of the viral particle and rapid research into the development of protease inhibitors replacing early interferon treatments. The first of these, Sovaldi, was approved on December 6, 2013. These drugs are marketed as «cures;» however, because they were approved on the basis of surrogate markers and not clinical endpoints such as prolonging life or improving liver health, many experts question their value.[138][needs update][139]
After blood screening began, a notable Hepatitis C prevalence was discovered in Egypt, which claimed six million individuals were infected by unsterile needles in a late 1970’s mass chemotherapy campaign to eliminate snail fever.[140]
On October 5, 2020, Houghton and Alter, together with Charles M. Rice, were awarded the Nobel Prize in Physiology or Medicine for their work.[141][142]
Society and culture[edit]
|
|
This section needs to be updated. Please help update this article to reflect recent events or newly available information. (July 2020) |
World Hepatitis Day, held on July 28, is coordinated by the World Hepatitis Alliance.[143] The economic costs of hepatitis C are significant both to the individual and to society. In the United States the average lifetime cost of the disease was estimated at US$33,407 in 2003[144] with the cost of a liver transplant as of 2011 costing approximately US$200,000.[145] In Canada the cost of a course of antiviral treatment is as high as 30,000 CAD in 2003,[146] while the United States costs are between 9,200 and 17,600 in 1998 USD.[144] In many areas of the world, people are unable to afford treatment with antivirals as they either lack insurance coverage or the insurance they have will not pay for antivirals.[147] In the English National Health Service treatment rates for hepatitis C are higher among wealthier groups per 2010–2012 data.[148] Spanish anaesthetist Juan Maeso infected 275 patients between 1988 and 1997 as he used the same needles to give both himself and the patients opioids.[149] For this he was jailed.[150]
Special populations[edit]
Children and pregnancy[edit]
Compared with adults, infection in children is much less understood. Worldwide the prevalence of hepatitis C virus infection in pregnant women and children has been estimated to 1–8% and 0.05–5% respectively.[151] The vertical transmission rate has been estimated to be 3–5% and there is a high rate of spontaneous clearance (25–50%) in the children. Higher rates have been reported for both vertical transmission (18%, 6–36% and 41%)[152][153] and prevalence in children (15%).[154]
In developed countries transmission around the time of birth is now the leading cause of HCV infection. In the absence of virus in the mother’s blood transmission seems to be rare.[153] Factors associated with an increased rate of infection include membrane rupture of longer than 6 hours before delivery and procedures exposing the infant to maternal blood.[155] Cesarean sections are not recommended. Breastfeeding is considered safe if the nipples are not damaged. Infection around the time of birth in one child does not increase the risk in a subsequent pregnancy. All genotypes appear to have the same risk of transmission.
HCV infection is frequently found in children who have previously been presumed to have non-A, non-B hepatitis and cryptogenic liver disease.[156] The presentation in childhood may be asymptomatic or with elevated liver function tests.[157] While infection is commonly asymptomatic both cirrhosis with liver failure and hepatocellular carcinoma may occur in childhood.
Immunosuppressed[edit]
The rate of hepatitis C in immunosuppressed people is higher. This is particularly true in those with human immunodeficiency virus infection, recipients of organ transplants, and those with hypogammaglobulinemia.[158] Infection in these people is associated with an unusually rapid progression to cirrhosis. People with stable HIV who never received medication for HCV, may be treated with a combination of peginterferon plus ribavirin with caution to the possible side effects.[159]
Research[edit]
As of 2011, there are about one hundred medications in development for hepatitis C.[145] These include vaccines to treat hepatitis, immunomodulators, and cyclophilin inhibitors, among others.[160] These potential new treatments have come about due to a better understanding of the hepatitis C virus.[161] There are a number of vaccines under development and some have shown encouraging results.[83]
The combination of sofosbuvir and velpatasvir in one trial (reported in 2015) resulted in cure rates of 99%.[162] More studies are needed to investigate the role of the preventive antiviral medication against HCV recurrence after transplantation.[163]
Animal models[edit]
One barrier to finding treatments for hepatitis C is the lack of a suitable animal model. Despite moderate success, research highlights the need for pre-clinical testing in mammalian systems such as mouse, particularly for the development of vaccines in poorer communities. Chimpanzees remain the only available living system to study, yet their use has ethical concerns and regulatory restrictions. While scientists have made use of human cell culture systems such as hepatocytes, questions have been raised about their accuracy in reflecting the body’s response to infection.[164]
One aspect of hepatitis research is to reproduce infections in mammalian models. A strategy is to introduce liver tissues from humans into mice, a technique known as xenotransplantation. This is done by generating chimeric mice, and exposing the mice HCV infection. This engineering process is known to create humanized mice, and provide opportunities to study hepatitis C within the 3D architectural design of the liver and evaluating antiviral compounds.[164] Alternatively, generating inbred mice with susceptibility to HCV would simplify the process of studying mouse models.
See also[edit]
- PSI-6130, an experimental drug treatment
References[edit]
- ^ a b c d e f g h i j k l m n o p q r s «Q&A for Health Professionals». Viral Hepatitis. Centers for Disease Control and Prevention. Retrieved 28 September 2020.
- ^ a b c Ryan KJ, Ray CG, eds. (2004). Sherris Medical Microbiology (4th ed.). McGraw Hill. pp. 551–52. ISBN 978-0-8385-8529-0.
- ^ a b c Maheshwari A, Thuluvath PJ (February 2010). «Management of acute hepatitis C». Clinics in Liver Disease. 14 (1): 169–76, x. doi:10.1016/j.cld.2009.11.007. PMID 20123448.
- ^ a b c d e f g h i j k l «Hepatitis C Fact sheet N°164». WHO. July 2015. Archived from the original on 31 January 2016. Retrieved 4 February 2016.
- ^ a b c d e f g h i j k l m n Rosen HR (June 2011). «Clinical practice. Chronic hepatitis C infection». The New England Journal of Medicine. 364 (25): 2429–38. doi:10.1056/NEJMcp1006613. PMID 21696309. S2CID 19755395.
- ^ a b c «Hepatitis C». World Health Organization. 9 July 2019. Archived from the original on 2020-05-26. Retrieved 2020-05-26.
- ^ «Hepatitis MedlinePlus». U.S. National Library of Medicine. Retrieved 2020-06-19.
- ^ «Viral Hepatitis: A through E and Beyond». National Institute of Diabetes and Digestive and Kidney Diseases. April 2012. Archived from the original on 2 February 2016. Retrieved 4 February 2016.
- ^ a b Owens DK, Davidson KW, Krist AH, Barry MJ, Cabana M, Caughey AB, et al. (March 2020). «Screening for Hepatitis C Virus Infection in Adolescents and Adults: US Preventive Services Task Force Recommendation Statement». JAMA. 323 (10): 970–975. doi:10.1001/jama.2020.1123. PMID 32119076.
- ^ a b Webster DP, Klenerman P, Dusheiko GM (March 2015). «Hepatitis C». Lancet. 385 (9973): 1124–35. doi:10.1016/S0140-6736(14)62401-6. PMC 4878852. PMID 25687730.
- ^ a b Zelenev A, Li J, Mazhnaya A, Basu S, Altice FL (February 2018). «Hepatitis C virus treatment as prevention in an extended network of people who inject drugs in the USA: a modelling study». The Lancet. Infectious Diseases. 18 (2): 215–224. doi:10.1016/S1473-3099(17)30676-X. PMC 5860640. PMID 29153265.
- ^ a b c d e f g Kim A (September 2016). «Hepatitis C Virus». Annals of Internal Medicine (Review). 165 (5): ITC33–ITC48. doi:10.7326/AITC201609060. PMID 27595226. S2CID 95756.
- ^ a b c «Global progress report on HIV, viral hepatitis and sexually transmitted infections, 2021». www.who.int. Retrieved 2022-01-19.
- ^ Houghton M (November 2009). «The long and winding road leading to the identification of the hepatitis C virus». Journal of Hepatology. 51 (5): 939–48. doi:10.1016/j.jhep.2009.08.004. PMID 19781804.
- ^ Shors T (2011). Understanding viruses (2nd ed.). Burlington, MA: Jones & Bartlett Learning. p. 535. ISBN 978-0-7637-8553-6. Archived from the original on 2016-05-15.
- ^ a b c d e f Chronic Hepatitis C Virus Advances in Treatment, Promise for the Future. Springer Verlag. 2011. p. 14. ISBN 978-1-4614-1191-8. Archived from the original on 2016-06-17.
- ^ a b c d e f g h i j k l m n o p q r s Wilkins T, Malcolm JK, Raina D, Schade RR (June 2010). «Hepatitis C: diagnosis and treatment» (PDF). American Family Physician. 81 (11): 1351–7. PMID 20521755. Archived (PDF) from the original on 2013-05-21.
- ^ Rao, A; Rule, JA; Cerro-Chiang, G; Stravitz, RT; McGuire, BM; Lee, G; Fontana, RJ; Lee, WM (11 May 2022). «Role of Hepatitis C Infection in Acute Liver Injury/Acute Liver Failure in North America». Digestive Diseases and Sciences: 1–8. doi:10.1007/s10620-022-07524-6. PMC 9094131. PMID 35546205.
- ^ a b c d Nelson PK, Mathers BM, Cowie B, Hagan H, Des Jarlais D, Horyniak D, Degenhardt L (August 2011). «Global epidemiology of hepatitis B and hepatitis C in people who inject drugs: results of systematic reviews». Lancet. 378 (9791): 571–83. doi:10.1016/S0140-6736(11)61097-0. PMC 3285467. PMID 21802134.
- ^ a b c d Kanwal F, Bacon BR (2011). «Does Treatment Alter the Natural History of Chronic HCV?». In Schiffman ML (ed.). Chronic Hepatitis C Virus Advances in Treatment, Promise for the Future. Springer Verlag. pp. 103–04. ISBN 978-1-4614-1191-8.
- ^ a b c d e f g Ray SC, Thomas DL (2009). «Chapter 154: Hepatitis C». In Mandell GL, Bennett, Dolin R (eds.). Mandell, Douglas, and Bennett’s principles and practice of infectious diseases (7th ed.). Philadelphia, PA: Churchill Livingstone. ISBN 978-0-443-06839-3.
- ^ Forton DM, Allsop JM, Cox IJ, Hamilton G, Wesnes K, Thomas HC, Taylor-Robinson SD (October 2005). «A review of cognitive impairment and cerebral metabolite abnormalities in patients with hepatitis C infection». AIDS. 19 Suppl 3 (Suppl 3): S53-63. doi:10.1097/01.aids.0000192071.72948.77. PMID 16251829.
- ^ a b c Nicot F (2004). «Chapter 19. Liver biopsy in modern medicine.». Occult hepatitis C virus infection: Where are we now?. ISBN 978-953-307-883-0.
- ^ a b El-Zayadi AR (July 2008). «Hepatic steatosis: a benign disease or a silent killer». World Journal of Gastroenterology. 14 (26): 4120–6. doi:10.3748/wjg.14.4120. PMC 2725370. PMID 18636654.
- ^ Paradis V, Bedossa P (December 2008). «Definition and natural history of metabolic steatosis: histology and cellular aspects». Diabetes & Metabolism. 34 (6 Pt 2): 638–42. doi:10.1016/S1262-3636(08)74598-1. PMID 19195624.
- ^ a b c d e f g h i j Alter MJ (May 2007). «Epidemiology of hepatitis C virus infection». World Journal of Gastroenterology. 13 (17): 2436–41. doi:10.3748/wjg.v13.i17.2436. PMC 4146761. PMID 17552026.
- ^ Mueller S, Millonig G, Seitz HK (July 2009). «Alcoholic liver disease and hepatitis C: a frequently underestimated combination». World Journal of Gastroenterology. 15 (28): 3462–71. doi:10.3748/wjg.15.3462. PMC 2715970. PMID 19630099. Retrieved 10 July 2020.
- ^ Fattovich G, Stroffolini T, Zagni I, Donato F (November 2004). «Hepatocellular carcinoma in cirrhosis: incidence and risk factors». Gastroenterology. 127 (5 Suppl 1): S35-50. doi:10.1053/j.gastro.2004.09.014. PMID 15508101.
- ^ a b c d e Ozaras R, Tahan V (April 2009). «Acute hepatitis C: prevention and treatment». Expert Review of Anti-Infective Therapy. 7 (3): 351–61. doi:10.1586/eri.09.8. PMID 19344247. S2CID 25574917.
- ^ Zaltron S, Spinetti A, Biasi L, Baiguera C, Castelli F (2012). «Chronic HCV infection: epidemiological and clinical relevance». BMC Infectious Diseases. 12 Suppl 2 (Suppl 2): S2. doi:10.1186/1471-2334-12-S2-S2. PMC 3495628. PMID 23173556.
- ^ Dammacco F, Sansonno D (September 2013). «Therapy for hepatitis C virus-related cryoglobulinemic vasculitis». The New England Journal of Medicine. 369 (11): 1035–45. doi:10.1056/NEJMra1208642. PMID 24024840. S2CID 205116488.
- ^ Iannuzzella F, Vaglio A, Garini G (May 2010). «Management of hepatitis C virus-related mixed cryoglobulinemia». The American Journal of Medicine. 123 (5): 400–8. doi:10.1016/j.amjmed.2009.09.038. PMID 20399313.
- ^ Ko HM, Hernandez-Prera JC, Zhu H, Dikman SH, Sidhu HK, Ward SC, Thung SN (2012). «Morphologic features of extrahepatic manifestations of hepatitis C virus infection». Clinical & Developmental Immunology. 2012: 740138. doi:10.1155/2012/740138. PMC 3420144. PMID 22919404.
- ^ Dammacco F, Sansonno D, Piccoli C, Racanelli V, D’Amore FP, Lauletta G (2000). «The lymphoid system in hepatitis C virus infection: autoimmunity, mixed cryoglobulinemia, and Overt B-cell malignancy». Seminars in Liver Disease. 20 (2): 143–57. doi:10.1055/s-2000-9613. PMID 10946420.
- ^ Lee MR, Shumack S (November 2005). «Prurigo nodularis: a review». The Australasian Journal of Dermatology. 46 (4): 211–18, quiz 219–20. doi:10.1111/j.1440-0960.2005.00187.x. PMID 16197418. S2CID 30087432.
- ^ Matsumori A (2006). Role of hepatitis C virus in cardiomyopathies. Ernst Schering Research Foundation Workshop. Vol. 55. pp. 99–120. doi:10.1007/3-540-30822-9_7. ISBN 978-3-540-23971-0. PMID 16329660.
- ^ Monaco S, Ferrari S, Gajofatto A, Zanusso G, Mariotto S (2012). «HCV-related nervous system disorders». Clinical & Developmental Immunology. 2012: 236148. doi:10.1155/2012/236148. PMC 3414089. PMID 22899946.
- ^ Xu JH, Fu JJ, Wang XL, Zhu JY, Ye XH, Chen SD (July 2013). «Hepatitis B or C viral infection and risk of pancreatic cancer: a meta-analysis of observational studies». World Journal of Gastroenterology. 19 (26): 4234–41. doi:10.3748/wjg.v19.i26.4234. PMC 3710428. PMID 23864789.
- ^ Lodi G, Porter SR, Scully C (July 1998). «Hepatitis C virus infection: Review and implications for the dentist». Oral Surgery, Oral Medicine, Oral Pathology, Oral Radiology, and Endodontics. 86 (1): 8–22. CiteSeerX 10.1.1.852.7880. doi:10.1016/S1079-2104(98)90143-3. PMID 9690239.
- ^ Carrozzo M, Gandolfo S (2003-03-01). «Oral diseases possibly associated with hepatitis C virus». Critical Reviews in Oral Biology and Medicine. 14 (2): 115–27. doi:10.1177/154411130301400205. PMID 12764074.
- ^ Little JW, Falace DA, Miller C, Rhodus NL (2013). Dental Management of the Medically Compromised Patient. p. 151. ISBN 978-0323080286.
- ^ Sugden PB, Cameron B, Bull R, White PA, Lloyd AR (September 2012). «Occult infection with hepatitis C virus: friend or foe?». Immunology and Cell Biology. 90 (8): 763–73. doi:10.1038/icb.2012.20. PMID 22546735. S2CID 23845868.
- ^ Carreño V (November 2006). «Occult hepatitis C virus infection: a new form of hepatitis C». World Journal of Gastroenterology. 12 (43): 6922–5. doi:10.3748/wjg.12.6922. PMC 4087333. PMID 17109511.
- ^ a b Carreño García V, Nebreda JB, Aguilar IC, Quiroga Estévez JA (March 2011). «[Occult hepatitis C virus infection]». Enfermedades Infecciosas y Microbiologia Clinica. 29 Suppl 3: 14–9. doi:10.1016/S0213-005X(11)70022-2. PMID 21458706.
- ^ Pham TN, Coffin CS, Michalak TI (April 2010). «Occult hepatitis C virus infection: what does it mean?». Liver International. 30 (4): 502–11. doi:10.1111/j.1478-3231.2009.02193.x. PMID 20070513. S2CID 205651069.
- ^ Carreño V, Bartolomé J, Castillo I, Quiroga JA (June 2012). «New perspectives in occult hepatitis C virus infection». World Journal of Gastroenterology. 18 (23): 2887–94. doi:10.3748/wjg.v18.i23.2887. PMC 3380315. PMID 22736911.
- ^ Carreño V, Bartolomé J, Castillo I, Quiroga JA (May–June 2008). «Occult hepatitis B virus and hepatitis C virus infections». Reviews in Medical Virology. 18 (3): 139–57. doi:10.1002/rmv.569. PMID 18265423. S2CID 12331754.
- ^ Scott JD, Gretch DR (February 2007). «Molecular diagnostics of hepatitis C virus infection: a systematic review». JAMA. 297 (7): 724–32. doi:10.1001/jama.297.7.724. PMID 17312292.
- ^ a b Robinson, JL (July 2008). «Vertical transmission of the hepatitis C virus: Current knowledge and issues». Paediatrics & Child Health. 13 (6): 529–41. doi:10.1093/pch/13.6.529. PMC 2532905. PMID 19436425.
- ^ Nakano T, Lau GM, Lau GM, Sugiyama M, Mizokami M (February 2012). «An updated analysis of hepatitis C virus genotypes and subtypes based on the complete coding region». Liver International. 32 (2): 339–45. doi:10.1111/j.1478-3231.2011.02684.x. PMID 22142261. S2CID 23271017.
- ^ a b Lerat H, Hollinger FB (January 2004). «Hepatitis C virus (HCV) occult infection or occult HCV RNA detection?». The Journal of Infectious Diseases. 189 (1): 3–6. doi:10.1086/380203. PMID 14702146.
- ^ Pockros P (2011). Novel and Combination Therapies for Hepatitis C Virus, An Issue of Clinics in Liver Disease. p. 47. ISBN 978-1-4557-7198-1. Archived from the original on 2016-05-21.
- ^ Zignego AL, Giannini C, Gragnani L, Piluso A, Fognani E (August 2012). «Hepatitis C virus infection in the immunocompromised host: a complex scenario with variable clinical impact». Journal of Translational Medicine. 10 (1): 158. doi:10.1186/1479-5876-10-158. PMC 3441205. PMID 22863056.
- ^ Hagan LM, Schinazi RF (February 2013). «Best strategies for global HCV eradication». Liver International. 33 Suppl 1 (s1): 68–79. doi:10.1111/liv.12063. PMC 4110680. PMID 23286849.
- ^ a b c d e Pondé RA (February 2011). «Hidden hazards of HCV transmission». Medical Microbiology and Immunology. 200 (1): 7–11. doi:10.1007/s00430-010-0159-9. PMID 20461405. S2CID 664199.
- ^ a b Xia X, Luo J, Bai J, Yu R (October 2008). «Epidemiology of hepatitis C virus infection among injection drug users in China: systematic review and meta-analysis». Public Health. 122 (10): 990–1003. doi:10.1016/j.puhe.2008.01.014. PMID 18486955.
- ^ Imperial JC (June 2010). «Chronic hepatitis C in the state prison system: insights into the problems and possible solutions». Expert Review of Gastroenterology & Hepatology. 4 (3): 355–64. doi:10.1586/egh.10.26. PMID 20528122. S2CID 7931472.
- ^ Vescio MF, Longo B, Babudieri S, Starnini G, Carbonara S, Rezza G, Monarca R (April 2008). «Correlates of hepatitis C virus seropositivity in prison inmates: a meta-analysis». Journal of Epidemiology and Community Health. 62 (4): 305–13. doi:10.1136/jech.2006.051599. PMID 18339822. S2CID 206989111.
- ^ a b c Moyer VA (September 2013). «Screening for hepatitis C virus infection in adults: U.S. Preventive Services Task Force recommendation statement». Annals of Internal Medicine. 159 (5): 349–57. doi:10.7326/0003-4819-159-5-201309030-00672. PMID 23798026. S2CID 8563203.
- ^ a b Marx J (2010). Rosen’s emergency medicine: concepts and clinical practice (7th ed.). Philadelphia, PA: Mosby/Elsevier. p. 1154. ISBN 978-0-323-05472-0.
- ^ Day RA, Paul P, Williams B (2009). Brunner & Suddarth’s textbook of Canadian medical-surgical nursing (Canadian 2nd ed.). Philadelphia, PA: Lippincott Williams & Wilkins. p. 1237. ISBN 978-0-7817-9989-8. Archived from the original on 2016-04-25.
- ^ a b «Hepatitis C prevalence in Egypt drops from 7% to 2% thanks to Sisi’s initiative». EgyptToday. 2021-02-06. Retrieved 2021-03-06.
- ^ «Highest Rates of Hepatitis C Virus Transmission Found in Egypt». Al Bawaaba. 2010-08-09. Archived from the original on 2012-05-15. Retrieved 2010-08-27.
- ^ Tohme RA, Holmberg SD (October 2010). «Is sexual contact a major mode of hepatitis C virus transmission?». Hepatology. 52 (4): 1497–505. doi:10.1002/hep.23808. PMID 20635398. S2CID 5592006.
- ^ «Hepatitis C Group Education Class». United States Department of Veteran Affairs. Archived from the original on 2011-11-09. Retrieved 2011-11-20.
- ^ a b c d e f Jafari S, Copes R, Baharlou S, Etminan M, Buxton J (November 2010). «Tattooing and the risk of transmission of hepatitis C: a systematic review and meta-analysis». International Journal of Infectious Diseases. 14 (11): e928-40. doi:10.1016/j.ijid.2010.03.019. PMID 20678951.
- ^ «Hepatitis C» (PDF). Centers for Disease Control and Prevention (CDC). Archived (PDF) from the original on 5 January 2012. Retrieved 2 January 2012.
- ^ Lock G, Dirscherl M, Obermeier F, Gelbmann CM, Hellerbrand C, Knöll A, et al. (September 2006). «Hepatitis C — contamination of toothbrushes: myth or reality?». Journal of Viral Hepatitis. 13 (9): 571–3. doi:10.1111/j.1365-2893.2006.00735.x. PMID 16907842. S2CID 24264376.
- ^ a b c «Hepatitis C FAQs for Health Professionals». Centers for Disease Control and Prevention (CDC). Archived from the original on 4 January 2012. Retrieved 2 January 2012.
- ^ Wong T, Lee SS (February 2006). «Hepatitis C: a review for primary care physicians». CMAJ. 174 (5): 649–59. doi:10.1503/cmaj.1030034. PMC 1389829. PMID 16505462.
- ^ a b Lam NC, Gotsch PB, Langan RC (November 2010). «Caring for pregnant women and newborns with hepatitis B or C» (PDF). American Family Physician. 82 (10): 1225–9. PMID 21121533. Archived (PDF) from the original on 2013-05-21.
- ^ Mast EE (2004). «Mother-to-infant hepatitis C virus transmission and breastfeeding». Protecting Infants through Human Milk. Advances in Experimental Medicine and Biology. Vol. 554. pp. 211–16. doi:10.1007/978-1-4757-4242-8_18. ISBN 978-1-4419-3461-1. PMID 15384578.
- ^ Westbrook RH, Dusheiko G (November 2014). «Natural history of hepatitis C». Journal of Hepatology. 61 (1 Suppl): S58-68. doi:10.1016/j.jhep.2014.07.012. PMID 25443346.
- ^ Patel K, Muir AJ, McHutchison JG (April 2006). «Diagnosis and treatment of chronic hepatitis C infection». BMJ. 332 (7548): 1013–7. doi:10.1136/bmj.332.7548.1013. PMC 1450048. PMID 16644828.
- ^ Shivkumar S, Peeling R, Jafari Y, Joseph L, Pant Pai N (October 2012). «Accuracy of rapid and point-of-care screening tests for hepatitis C: a systematic review and meta-analysis». Annals of Internal Medicine. 157 (8): 558–66. doi:10.7326/0003-4819-157-8-201210160-00006. PMID 23070489. S2CID 5650682.
- ^ Senadhi V (July 2011). «A paradigm shift in the outpatient approach to liver function tests». Southern Medical Journal. 104 (7): 521–5. doi:10.1097/SMJ.0b013e31821e8ff5. PMID 21886053. S2CID 26462106.
- ^ Smith BD, Morgan RL, Beckett GA, Falck-Ytter Y, Holtzman D, Teo CG, et al. (August 2012). «Recommendations for the identification of chronic hepatitis C virus infection among persons born during 1945-1965» (PDF). MMWR. Recommendations and Reports. 61 (RR-4): 1–32. PMID 22895429.
- ^ «Testing Recommendations for Hepatitis C Virus Infection – HCV – Division of Viral Hepatitis». U.S. Centers for Disease Control and Prevention (CDC). 12 June 2019. Retrieved 11 January 2020.
- ^ «People Born 1945–1965 (Baby Boomers) – Populations and Settings – Division of Viral Hepatitis». U.S. Centers for Disease Control and Prevention (CDC). 26 July 2019. Archived from the original on 22 October 2019. Retrieved 11 January 2020.
- ^ «Final Update Summary: Hepatitis C: Screening». US Preventive Services Task Force. Retrieved 11 January 2020.
- ^ Shah H, Bilodeau M, Burak KW, Cooper C, Klein M, Ramji A, et al. (June 2018). «The management of chronic hepatitis C: 2018 guideline update from the Canadian Association for the Study of the Liver». CMAJ. 190 (22): E677–E687. doi:10.1503/cmaj.170453. PMC 5988519. PMID 29866893.
- ^ a b Abdelwahab KS, Ahmed Said ZN (January 2016). «Status of hepatitis C virus vaccination: Recent update». World Journal of Gastroenterology. 22 (2): 862–73. doi:10.3748/wjg.v22.i2.862. PMC 4716084. PMID 26811632.
- ^ Hagan H, Pouget ER, Des Jarlais DC (July 2011). «A systematic review and meta-analysis of interventions to prevent hepatitis C virus infection in people who inject drugs». The Journal of Infectious Diseases. 204 (1): 74–83. doi:10.1093/infdis/jir196. PMC 3105033. PMID 21628661.
- ^ a b AASLD/IDSA HCV Guidance Panel (September 2015). «Hepatitis C guidance: AASLD-IDSA recommendations for testing, managing, and treating adults infected with hepatitis C virus». Hepatology. 62 (3): 932–54. doi:10.1002/hep.27950. PMID 26111063.
- ^ a b «HCV Guidance: Recommendations for Testing, Managing, and Treating Hepatitis C» (PDF). 12 April 2017. Archived from the original (PDF) on 2017-07-10. Retrieved 28 July 2017.
- ^ Jakobsen JC, Nielsen EE, Feinberg J, Katakam KK, Fobian K, Hauser G, et al. (September 2017). «Direct-acting antivirals for chronic hepatitis C». The Cochrane Database of Systematic Reviews. 9 (9): CD012143. doi:10.1002/14651858.CD012143.pub3. PMC 6484376. PMID 28922704.
- ^ «Treatment: Naive Genotype 1a Without Cirrhosis». HCV Guidance: Recommendations for Testing, Managing, and Treating Hepatitis C. www.hcvguidelines.org. American Association for the Study of Liver Diseases. Retrieved 26 April 2017.
- ^ «Treatment: Naive Genotype 1a With Compensated Cirrhosis». HCV Guidance: Recommendations for Testing, Managing, and Treating Hepatitis C. www.hcvguidelines.org. American Association for the Study of Liver Diseases. Retrieved 26 April 2017.
- ^ «Treatment: Naive Genotype 1b Without Cirrhosis». HCV Guidance: Recommendations for Testing, Managing, and Treating Hepatitis C. www.hcvguidelines.org. American Association for the Study of Liver Diseases. Retrieved 26 April 2017.
- ^ «Treatment: Naive Genotype 1b With Compensated Cirrhosis». HCV Guidance: Recommendations for Testing, Managing, and Treating Hepatitis C. www.hcvguidelines.org. American Association for the Study of Liver Diseases. Retrieved 26 April 2017.
- ^ «Treatment; Naive Genotype 2 Without Cirrhosis». HCV Guidance: Recommendations for Testing, Managing, and Treating Hepatitis C. www.hcvguidelines.org. American Association for the Study of Liver Diseases. Retrieved 26 April 2017.
- ^ «Treatment – Naive Genotype 2 With Compensated Cirrhosis». HCV Guidance: Recommendations for Testing, Managing, and Treating Hepatitis C. www.hcvguidelines.org. American Association for the Study of Liver Diseases. Retrieved 26 April 2017.
- ^ «Treatment: Naive Genotype 3 Without Cirrhosis». HCV Guidance: Recommendations for Testing, Managing, and Treating Hepatitis C. www.hcvguidelines.org. American Association for the Study of Liver Diseases. Retrieved 26 April 2017.
- ^ «Treatment: Naive Genotype 3 With Compensated Cirrhosis». HCV Guidance: Recommendations for Testing, Managing, and Treating Hepatitis C. www.hcvguidelines.org. American Association for the Study of Liver Diseases. Retrieved 26 April 2017.
- ^ «Treatment: Naive Genotype 4 Without Cirrhosis». HCV Guidance: Recommendations for Testing, Managing, and Treating Hepatitis C. www.hcvguidelines.org. American Association for the Study of Liver Diseases. Retrieved 26 April 2017.
- ^ «Treatment: Naive Genotype 4 With Compensated Cirrhosis». HCV Guidance: Recommendations for Testing, Managing, and Treating Hepatitis C. www.hcvguidelines.org. American Association for the Study of Liver Diseases. Retrieved 26 April 2017.
- ^ «Treatment: Naive Genotype 5 or 6». HCV Guidance: Recommendations for Testing, Managing, and Treating Hepatitis C. www.hcvguidelines.org. American Association for the Study of Liver Diseases. Retrieved 26 April 2017.
- ^ «Hepatitis C Questions and Answers for Health Professionals». www.cdc.gov. 2 July 2019. Retrieved 23 July 2019.
- ^ «FDA approves Vosevi for Hepatitis C». U.S. Food and Drug Administration (FDA) (Press release). 18 July 2017. Archived from the original on 23 July 2017. Retrieved 27 July 2017.
- ^ Liang TJ, Ghany MG (May 2013). «Current and future therapies for hepatitis C virus infection». The New England Journal of Medicine. 368 (20): 1907–17. doi:10.1056/NEJMra1213651. PMC 3893124. PMID 23675659.
- ^ Mücke MM, Backus LI, Mücke VT, Coppola N, Preda CM, Yeh ML, et al. (March 2018). «Hepatitis B virus reactivation during direct-acting antiviral therapy for hepatitis C: a systematic review and meta-analysis». The Lancet. Gastroenterology & Hepatology. 3 (3): 172–180. doi:10.1016/S2468-1253(18)30002-5. PMID 29371017.
- ^ Sanders M (2011). Mosby’s Paramedic Textbook. Jones & Bartlett Publishers. p. 839. ISBN 978-0-323-07275-5. Archived from the original on 2016-05-11.
- ^ Ciria R, Pleguezuelo M, Khorsandi SE, Davila D, Suddle A, Vilca-Melendez H, et al. (May 2013). «Strategies to reduce hepatitis C virus recurrence after liver transplantation». World Journal of Hepatology. 5 (5): 237–50. doi:10.4254/wjh.v5.i5.237. PMC 3664282. PMID 23717735.
- ^ Coilly A, Roche B, Samuel D (February 2013). «Current management and perspectives for HCV recurrence after liver transplantation». Liver International. 33 Suppl 1: 56–62. doi:10.1111/liv.12062. PMID 23286847. S2CID 23601091.
- ^ Gurusamy KS, Tsochatzis E, Toon CD, Xirouchakis E, Burroughs AK, Davidson BR (December 2013). «Antiviral interventions for liver transplant patients with recurrent graft infection due to hepatitis C virus». The Cochrane Database of Systematic Reviews. 2014 (12): CD006803. doi:10.1002/14651858.CD006803.pub4. PMC 8930021. PMID 24307460.
- ^ a b Hepatitis C and CAM: What the Science Says Archived 2011-03-20 at the Wayback Machine. National Center for Complementary and Alternative Medicine (NCCAM). March 2011. (Retrieved 7 March 2011)
- ^ Liu J, Manheimer E, Tsutani K, Gluud C (March 2003). «Medicinal herbs for hepatitis C virus infection: a Cochrane hepatobiliary systematic review of randomized trials». The American Journal of Gastroenterology. 98 (3): 538–44. doi:10.1111/j.1572-0241.2003.07298.x. PMID 12650784. S2CID 20014583.
- ^ Rambaldi A, Jacobs BP, Gluud C (October 2007). «Milk thistle for alcoholic and/or hepatitis B or C virus liver diseases». The Cochrane Database of Systematic Reviews. 2009 (4): CD003620. doi:10.1002/14651858.CD003620.pub3. PMC 8724782. PMID 17943794.
- ^ Helms RA, Quan DJ, eds. (2006). Textbook of Therapeutics: Drug and Disease Management (8th ed.). Philadelphia, PA [u.a.]: Lippincott Williams & Wilkins. p. 1340. ISBN 978-0-7817-5734-8. Archived from the original on 5 December 2015. Retrieved 7 November 2014.
- ^ Morgan RL, Baack B, Smith BD, Yartel A, Pitasi M, Falck-Ytter Y (March 2013). «Eradication of hepatitis C virus infection and the development of hepatocellular carcinoma: a meta-analysis of observational studies». Annals of Internal Medicine. 158 (5 Pt 1): 329–37. doi:10.7326/0003-4819-158-5-201303050-00005. PMID 23460056.
- ^ Fung J, Lai CL, Hung I, Young J, Cheng C, Wong D, Yuen MF (September 2008). «Chronic hepatitis C virus genotype 6 infection: response to pegylated interferon and ribavirin». The Journal of Infectious Diseases. 198 (6): 808–12. doi:10.1086/591252. PMID 18657036.
- ^ «World Health Organization Fact Sheet: Hepatitis C». www.who.int. Retrieved 2022-01-19.
{{cite web}}: CS1 maint: url-status (link) - ^ Mohd Hanafiah K, Groeger J, Flaxman AD, Wiersma ST (April 2013). «Global epidemiology of hepatitis C virus infection: new estimates of age-specific antibody to HCV seroprevalence». Hepatology. 57 (4): 1333–42. doi:10.1002/hep.26141. PMID 23172780. S2CID 16265266.
- ^ Yu ML, Chuang WL (March 2009). «Treatment of chronic hepatitis C in Asia: when East meets West». Journal of Gastroenterology and Hepatology. 24 (3): 336–45. doi:10.1111/j.1440-1746.2009.05789.x. PMID 19335784. S2CID 27333980.
- ^ «U.S. 2014 Surveillance Data for Viral Hepatitis, Statistics & Surveillance, Division of Viral Hepatitis». CDC. Archived from the original on 2016-08-08. Retrieved 2016-08-04.
- ^ Table 4.5. «Number and rate of deaths with hepatitis C listed as a cause of death, by demographic characteristic and year – United States, 2004–2008». Viral Hepatitis on the CDC web site. Centers for Disease Control and Prevention, Atlanta, GA. Archived from the original on 9 March 2014. Retrieved 28 July 2013.
- ^ «Hepatitis Death Rate Creeps past AIDS». New York Times. 27 February 2012. Archived from the original on 30 June 2017. Retrieved 28 July 2013.
- ^ «Hepatitis C Kills More Americans than Any Other Infectious Disease». Centers for Disease Control and Prevention. May 4, 2016. Archived from the original on 9 August 2016. Retrieved 3 August 2016.
- ^ Blatt LM, Tong M (2004). Colacino JM, Heinz BA (eds.). Hepatitis prevention and treatment. Basel: Birkhäuser. p. 32. ISBN 978-3-7643-5956-0. Archived from the original on 2016-06-24.
- ^ Blachier M, Leleu H, Peck-Radosavljevic M, Valla DC, Roudot-Thoraval F (March 2013). «The burden of liver disease in Europe: a review of available epidemiological data». Journal of Hepatology. 58 (3): 593–608. doi:10.1016/j.jhep.2012.12.005. PMID 23419824.
- ^ «Hepatitis C». 24 October 2017.
- ^ «More than half of patients using needle exchange pilot tested positive for Hepatitis C». Pharmaceutical Journal. 17 May 2018. Archived from the original on 16 August 2018. Retrieved 15 August 2018.
- ^ «Legal action firm among winners for largest medicines procurement». Health Service Journal. 30 April 2019. Retrieved 9 June 2019.
- ^ Holmberg S (2011-05-12). Brunette GW, Kozarsky PE, Magill AJ, Shlim DR, Whatley AD (eds.). CDC Health Information for International Travel 2012. New York: Oxford University Press. p. 231. ISBN 978-0-19-976901-8.
- ^ «Hepatitis C». World Health Organization (WHO). June 2011. Archived from the original on 2011-07-12. Retrieved 2011-07-13.
- ^ a b c d e f Lombardi A, Mondelli MU (March 2019). «Hepatitis C: Is eradication possible?». Liver International. 39 (3): 416–426. doi:10.1111/liv.14011. PMID 30472772.
- ^ Boyer JL (2001). Liver cirrhosis and its development: proceedings of the Falk Symposium 115. Springer. pp. 344. ISBN 978-0-7923-8760-2.
- ^ Barnum, Alex (May 12, 1992). «US Biotech is Thriving in Japan: Chiron got its start by using blood test on Emperor Hirohito» (PDF). San Francisco Chronicle.
- ^ Choo QL, Kuo G, Weiner AJ, Overby LR, Bradley DW, Houghton M (April 1989). «Isolation of a cDNA clone derived from a blood-borne non-A, non-B viral hepatitis genome» (PDF). Science. 244 (4902): 359–62. Bibcode:1989Sci…244..359C. CiteSeerX 10.1.1.469.3592. doi:10.1126/science.2523562. PMID 2523562.
- ^ Kuo G, Choo QL, Alter HJ, Gitnick GL, Redeker AG, Purcell RH, et al. (April 1989). «An assay for circulating antibodies to a major etiologic virus of human non-A, non-B hepatitis». Science. 244 (4902): 362–4. Bibcode:1989Sci…244..362K. doi:10.1126/science.2496467. PMID 2496467.
- ^ EP patent 0318216, Houghton M, Choo QL, Kuo G, «NANBV diagnostics», issued 1989-05-31, assigned to Chiron
- ^ Wilken. «United States Court of Appeals for the Federal Circuit». United States Court of Appeals for the Federal Circuit. Archived from the original on 19 November 2009. Retrieved 11 January 2012.
- ^ «Hepatitis C Investigative guidelines» (PDF). Oregon Health Authority. January 2020.
- ^ Barnum, Alex (May 12, 1992). «US Biotech is Thriving in Japan: Chiron got its start by using blood test on Emperor Hirohito» (PDF). San Francisco Chronicle.
- ^ OHarrow, Robert (September 12, 2000). «Grass Roots seeded by Drugmaker». Washington Post.
- ^ Wakida, Tekaji (July 11, 2005). «Production of infectious hepatitis C virus in tissue culture from a cloned viral genome». Nature Medicine. 11 (7): 791–796. doi:10.1038/nm1268. PMC 2918402. PMID 15951748.
- ^ Jakobsen, Janus (June 6, 2017). «Direct‐acting antivirals for chronic hepatitis C». Cochrane Database of Systematic Reviews. 6 (6): CD012143. doi:10.1002/14651858.CD012143.pub2. PMC 6484383. PMID 28585310.
- ^ Koretz, Ronald (January 13, 2015). «Is Widespread Screening for Hepatitis C Justified?». British Medical Journal. 350: g7809. doi:10.1136/bmj.g7809. PMID 25587052. S2CID 36816304.
- ^ McNeil, Donald (December 15, 2015). «Curing Hepatitis C, in an Experiment the Size of Egypt». The New York Times.
- ^ Gallagher J (2020-10-05). «Hepatitis C discovery wins the Nobel Prize». BBC News. Retrieved 2020-10-05.
- ^ Ledford, Heidi (19 October 2020). «The unsung heroes of the Nobel-winning hepatitis C discovery». Nature. 586 (7830): 485. Bibcode:2020Natur.586..485L. doi:10.1038/d41586-020-02932-y. PMID 33082542. S2CID 224822368. Retrieved 20 October 2020.
- ^ Eurosurveillance editorial team (July 2011). «World Hepatitis Day 2011» (PDF). Euro Surveillance. 16 (30). PMID 21813077. Archived (PDF) from the original on 2011-11-25.
- ^ a b Wong JB (2006). «Hepatitis C: cost of illness and considerations for the economic evaluation of antiviral therapies». PharmacoEconomics. 24 (7): 661–72. doi:10.2165/00019053-200624070-00005. PMID 16802842. S2CID 6713508.
- ^ a b El Khoury AC, Klimack WK, Wallace C, Razavi H (March 2012). «Economic burden of hepatitis C-associated diseases in the United States». Journal of Viral Hepatitis. 19 (3): 153–60. doi:10.1111/j.1365-2893.2011.01563.x. PMID 22329369. S2CID 27409621.
- ^ «Hepatitis C Prevention, Support and Research ProgramHealth Canada». Public Health Agency of Canada. Nov 2003. Archived from the original on 22 March 2011. Retrieved 10 January 2012.
- ^ Thomas H, Lemon S, Zuckerman A, eds. (2008). Viral Hepatitis (3rd ed.). Oxford: John Wiley & Sons. p. 532. ISBN 978-1-4051-4388-2. Archived from the original on 2016-06-17.
- ^ «Commissioning supplement: Health inequalities tell a tale of data neglect». Health Service Journal. 19 March 2015. Archived from the original on 28 July 2015. Retrieved 30 April 2015.
- ^ «Spanish Anesthetist Infected Patients». The Washington Post. 15 May 2007. Archived from the original on 22 August 2016. Retrieved 13 July 2016.
- ^ «Spanish Hep C anaesthetist jailed». BBC. 15 May 2007. Archived from the original on 23 October 2007. Retrieved 13 July 2016.
- ^ Arshad M, El-Kamary SS, Jhaveri R (April 2011). «Hepatitis C virus infection during pregnancy and the newborn period—are they opportunities for treatment?». Journal of Viral Hepatitis. 18 (4): 229–36. doi:10.1111/j.1365-2893.2010.01413.x. PMID 21392169. S2CID 35515919.
- ^ Hunt CM, Carson KL, Sharara AI (May 1997). «Hepatitis C in pregnancy». Obstetrics and Gynecology. 89 (5 Pt 2): 883–90. doi:10.1016/S0029-7844(97)81434-2. PMID 9166361. S2CID 23182340.
- ^ a b Thomas SL, Newell ML, Peckham CS, Ades AE, Hall AJ (February 1998). «A review of hepatitis C virus (HCV) vertical transmission: risks of transmission to infants born to mothers with and without HCV viraemia or human immunodeficiency virus infection». International Journal of Epidemiology. 27 (1): 108–17. doi:10.1093/ije/27.1.108. PMID 9563703.
- ^ Fischler B (June 2007). «Hepatitis C virus infection». Seminars in Fetal & Neonatal Medicine. 12 (3): 168–73. CiteSeerX 10.1.1.852.7880. doi:10.1016/j.siny.2007.01.008. PMID 17320495.
- ^ Indolfi G, Resti M (May 2009). «Perinatal transmission of hepatitis C virus infection». Journal of Medical Virology. 81 (5): 836–43. doi:10.1002/jmv.21437. PMID 19319981. S2CID 21207996.
- ^ González-Peralta RP (November 1997). «Hepatitis C virus infection in pediatric patients». Clinics in Liver Disease. 1 (3): 691–705, ix. doi:10.1016/s1089-3261(05)70329-9. PMID 15560066.
- ^ Suskind DL, Rosenthal P (February 2004). «Chronic viral hepatitis». Adolescent Medicine Clinics. 15 (1): 145–58, x–xi. doi:10.1016/j.admecli.2003.11.001. PMID 15272262.
- ^ Einav S, Koziel MJ (June 2002). «Immunopathogenesis of hepatitis C virus in the immunosuppressed host». Transplant Infectious Disease. 4 (2): 85–92. doi:10.1034/j.1399-3062.2002.t01-2-02001.x. PMID 12220245. S2CID 27843061.
- ^ Iorio A, Marchesini E, Awad T, Gluud LL (January 2010). «Antiviral treatment for chronic hepatitis C in patients with human immunodeficiency virus». The Cochrane Database of Systematic Reviews (1): CD004888. doi:10.1002/14651858.CD004888.pub2. PMID 20091566.
- ^ Ahn J, Flamm SL (August 2011). «Hepatitis C therapy: other players in the game». Clinics in Liver Disease. 15 (3): 641–56. doi:10.1016/j.cld.2011.05.008. PMID 21867942.
- ^ Vermehren J, Sarrazin C (February 2011). «New HCV therapies on the horizon». Clinical Microbiology and Infection. 17 (2): 122–34. doi:10.1111/j.1469-0691.2010.03430.x. PMID 21087349.
- ^ Feld JJ, Jacobson IM, Hézode C, Asselah T, Ruane PJ, Gruener N, et al. (December 2015). «Sofosbuvir and Velpatasvir for HCV Genotype 1, 2, 4, 5, and 6 Infection». The New England Journal of Medicine. 373 (27): 2599–607. doi:10.1056/NEJMoa1512610. hdl:10722/226358. PMID 26571066.
- ^ Gurusamy KS, Tsochatzis E, Toon CD, Davidson BR, Burroughs AK (December 2013). «Antiviral prophylaxis for the prevention of chronic hepatitis C virus in patients undergoing liver transplantation». The Cochrane Database of Systematic Reviews. 2013 (12): CD006573. doi:10.1002/14651858.CD006573.pub3. PMC 6599865. PMID 24297303.
- ^ a b Sandmann L, Ploss A (January 2013). «Barriers of hepatitis C virus interspecies transmission». Virology. 435 (1): 70–80. doi:10.1016/j.virol.2012.09.044. PMC 3523278. PMID 23217617.
External links[edit]
This audio file was created from a revision of this article dated 26 July 2014, and does not reflect subsequent edits.
- Hepatitis C at Curlie
- «Recommendations for Testing, Managing, and Treating Hepatitis C». www.hcvguidelines.org. IDSA/AASLD. Retrieved 28 July 2017.
- «Hepatitis C». MedlinePlus. U.S. National Library of Medicine.
ContDict.ru > Русско латинский словарь и переводчик
Вход
Регистрация
й
ё
ъ
ь
‘
—
Русская клавиатура
Русско-латинский словарь
Перевод «Гепатит-С» на латынь: «Hepatitis-C»
|
|
|
|
гепатит-с:
|
Hepatitis-C |
|
гепатит |
alcoholic источник пожаловаться Langcrowd.com |
|
Гепатит С |
Hepatitis C источник пожаловаться Langcrowd.com |
|
гепатит-Це |
hepatitis-TSE источник пожаловаться Langcrowd.com |
|
Гепатит-С |
Hepatitis-C источник пожаловаться Langcrowd.com |
|
гепатит-Б |
hepatitis-B источник пожаловаться Langcrowd.com |
|
с |
regant источник пожаловаться Langcrowd.com |
|
Гепатит |
Hepatitis источник пожаловаться Langcrowd.com |
|
С с’ |
C’est источник пожаловаться Langcrowd.com |
|
с |
consentaneam источник пожаловаться Langcrowd.com |
|
с |
instrumentali источник пожаловаться Langcrowd.com |
|
Гнойный гепатит |
Suppurative hepatitis источник пожаловаться Langcrowd.com |
|
гепатит острый |
hepatitidis acutae источник пожаловаться Langcrowd.com |
|
с |
oecosystematum источник пожаловаться Langcrowd.com |
|
Серозный гепатит |
Serous hepatitis источник пожаловаться Langcrowd.com |
|
С-С-С |
S-S-S источник пожаловаться Langcrowd.com |
|
гепатит острый |
hepatitis acuta источник пожаловаться Langcrowd.com |
|
гепатит острый |
hepatitidissds acutae источник пожаловаться Langcrowd.com |
|
с с |
cum источник пожаловаться Langcrowd.com |
|
с с’ |
c’est источник пожаловаться Langcrowd.com |
|
гепатит б |
hepatitis b источник пожаловаться Langcrowd.com |
Пожалуйста, исправьте перевод и/или сообщите о нарушениях, ошибках, грубой лексике:
|
Плохой пример Ошибки в тексте Грубая лексика Другое |
| Комментарий: |
|
Докажите, что вы не робот:
Зарегистрированные пользователи могут исправлять переводы! Зарегистрируйтесь или войдите на сайт для этого. |
Пожалуйста, помогите другим пользователям с корректировкой их текстов:
Ishlab chiqarish vositalari, ular qanchalik mukammal bo’lmasin, o’zlarida hech qanday qadr-qimmatga
Русский
Йон — шерсть, перевод с татарского;
Юн — стругай ( если вариант твёрдого произношения);
Юн —
Русский
In scholas vestros pueros mittitis. Enim educari in scholis debemus. Ibi nos legere, scribere
Латынь
The concept of public security.
Концепция общественной безопасности.
Conceptus securitas
Латынь
Пожалуйста, помогите c переводом:
вы все поплатись за тот бред,что причинили мне
Русский-Латынь
МНОГОУРОВЕННЫЙ
Русский-Латынь
В миллионах жестоких деяний ночи
Русский-Латынь
Тьма,приказываю тебе,вырваться из меня,из моей души.
Русский-Латынь
Пожалуйста, войдите или зарегистрируйтесь!
Популярные направления онлайн-перевода:
Английский-Русский Итальянский-Русский Латынь-Русский Немецкий-Русский Сербский-Русский Татарский-Русский Турецкий-Русский Узбекский-Русский Хорватский-Русский Чешский-Русский
© 2023 ContDict.ru — контекстный словарь и переводчик
Privacy policy
Terms of use
Contact
ResponsiveVoice-NonCommercial licensed under (CC BY-NC-ND 4.0)
Медицинский эксперт статьи
Новые публикации
, медицинский редактор
Последняя редакция: 20.10.2021
х
Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
- Код по МКБ-10
- Эпидемиология
- Причины
- Возбудители
- Факторы риска
- Патогенез
- Симптомы
- Где болит?
- Что беспокоит?
- Стадии
- Формы
- Диагностика
- Что нужно обследовать?
- Как обследовать?
- Какие анализы необходимы?
- Дифференциальная диагностика
- Лечение
- К кому обратиться?
- Лекарства
- Профилактика
- Прогноз
Гепатит С (вирусный гепатит С, Hepatitis С) — антропонозная инфекционная болезнь с контактным механизмом передачи возбудителя, характеризуемая лёгким или субклиническим течением острого периода болезни, частым формированием хронического гепатита С, возможным развитием цирроза печени и гепатоцеллюлярной карциномы.

Код по МКБ-10
B17.1 Острый гепатит С
B18.2 Хронический вирусный гепатит С
Эпидемиология
Гепатит С занимает первое место в перечне факторов, провоцирующих хронические заболевания печени, опережая гепатит В, алкоголь и даже СПИД. Вирус гепатита С был выделен и идентифицирован более 20 лет назад и определен в группу флавивирусов (желтый — от латинского flavus).
Распространенность HCV (гепатита С) на сегодняшний день достигает от 1,5 до 2% во всех странах, считающихся развитыми, по оценкам экспертов во всем мире насчитывается до 200 миллионов людей, инфицированных вирусом, и их число растет ежегодно. Региональные особенности, которые имеет эпидемиология гепатита С, очевидно, связаны с уровнем жизни населения и с качеством санитарно-эпидемиологического надзора. В целом, статистика выглядит следующим образом:
- Страны Ближнего Востока, где печальную пальму первенства держит Египет – до 20% населения.
- Страны с высоким уровнем жизни – Западная Европа, США, Япония и Австралия – 1,5-2%.
- Страны Северной Европы – Норвегия, Дания, Швеция, Финляндия, Гренландия, Исландия – всего 0,1-0,8%.
- Страны Восточной Европы, а также Северная Африка и Азия – от 5 до 6,5%.
Очевидно, что динамика роста заболеваний гепатитом С, увеличивающиеся с каждым голом показатели выявленного хронического HCV и рост наркомании, свидетельствуют о том, что реальное количество инфицированных людей намного больше. Сегодня многие врачи с тревогой говорят о скрытой эпидемии HCV.
Заболеваемость в Украине этим заболеванием в 2010 г. по сравнению с 1994 г. (первый год официальной регистрации) увеличилась почти в 7 раз: с 3,2 до 20,7 на 100 тыс. населения. С 2001 г. заболеваемость острым гепатитом С стала снижаться, и в 2006 г. этот показатель составил 4,5 на 100 тыс. населения. Необходимо учитывать, что данные официальной регистрации, вероятно, не полные, так как невозможно учесть те случаи острых вирусных гепатитов, которые протекают без желтухи (при остром гепатите С доля таких больных составляет около 80%). Основную группу заболевших составляют лица в возрасте 20-29 лет и подростки. В Украине на смену резкому подъёму заболеваемости острыми вирусными гепатитами, наблюдавшемуся в 1996-1999 гг., пришла эпидемия хронических вирусных гепатитов. В структуре хронических поражений печени доля вирусного гепатита С достигает более 40%.
Как можно заразиться гепатитом С?
Вирусный гепатит С — антропоноз: единственный источник (резервуар) возбудителя инфекции — человек, больной острым или хроническим гепатитом. Вирусный гепатит С относят к инфекциям с контактным (кровоконтактным) механизмом передачи возбудителя, реализация которого происходит естественным (вертикальным — при передаче вируса от матери к ребёнку, контактным — при использовании предметов быта и при половых контактах) и искусственным (артифициальным) путями. Искусственный путь заражения может быть реализован посредством гемотрансфузий инфицированной крови или её препаратов и любых парентеральных манипуляций (медицинского и не медицинского характера), сопровождаемых нарушением целостности кожного покрова и слизистых оболочек, если манипуляции проводились инструментами, контаминированными кровью, содержащей HCV.
Естественные пути заражения вирусным гепатитом С реализуются реже, чем при вирусном гепатите В, что связано, вероятно, с более низкой концентрацией HCV в биологических субстратах. Риск заражения ребёнка серопозитивной матерью в среднем составляет 2%, возрастает до 7% при выявлении РНК HCV в крови беременной, до 10%, если женщина практикует внутривенное введение наркотиков, и до 20%. если у беременной регистрируют коинфекцию HCV и ВИЧ. Инфицированным матерям не противопоказано кормление грудью, однако при наличии трещин на сосках, по мнению некоторых исследователей, от кормления грудью следует воздержаться. От ребёнка к ребёнку инфекция передается редко, поэтому посещение ребёнком школы и его общение с другими детьми, включая занятия контактными видами спорта, не ограничиваются. Нет необходимости ограничивать и бытовые контакты, за исключением тех, которые могут повлечь за собой контакт с инфицированной кровью (пользование общей зубной щеткой, бритвой, маникюрными принадлежностями и др.).
Заражение постоянных половых партнёров-носителей HCV редко происходит половым путём. Поэтому, рекомендуя носителям HCV ставить в известность об инфекции своих половых партнёров, следует подчеркнуть, что риск передачи при половом контакте настолько мал, что некоторые специалисты считают использование презервативов необязательным. При большом числе половых партнёров вероятность заражения возрастает.
Особая опасность в распространении HCV — внутривенное введение наркотических средств без соблюдения правил безопасной инъекционной практики. У большинства вновь регистрируемых больных острым гепатитом С (70-85%) есть указания на внутривенное использование наркотических средств. Подъём заболеваемости вирусным гепатитом С в Украине в 90-х годах обусловлен ростом наркомании. По данным экспертов, в Украине насчитывается более 3 млн лиц, потребляющих наркотические и психотропные вещества, среди них в последние годы число анти-HCV позитивных возросло в 3-4 раза, поэтому данная категория лиц представляет особую опасность как источник вирусного гепатита С. Группой риска также выступают пациенты, которым проводят гемодиализ, больные с онкологической и гематологической патологией и другие, получающие длительное и многократное стационарное лечение, а также медицинские работники, имеющие контакт с кровью, и доноры. Возможно также заражение HCV при переливании препаратов инфицированной крови, хотя в последние годы в связи с обязательным определением анти-HCV у доноров число заражённых после гемотрансфузий лиц резко сократилось и составляет 1-2% всех случаев заражения. Однако даже использование высокочувствительного метода ИФА для тестирования донорской крови не позволяет полностью исключить вероятность передачи этой инфекции, поэтому в трансфузиологическую службу в последние годы внедрён метод карантинизации препаратов крови. В некоторых странах мира проводят тестирование донорской крови на присутствие РНК HCV методом ПЦР. Возбудитель может передаваться не только при проведении парентеральных медицинских манипуляций (инъекции, стоматологические и гинекологические манипуляции, гастро-, колоноскопия и др.), но и при нанесении татуировок, ритуальных надрезов, при проведении пирсинга, маникюра, педикюра и т.д. в случае использования загрязнённых инфицированной кровью инструментов.
Естественная восприимчивость людей к HCV высока. Вероятность заражения в большой степени определяет инфицирующая доза. Выявляемые в организме инфицированного человека антитела не обладают протективными свойствами, и их обнаружение не свидетельствует о формировании иммунитета (показана возможность повторного инфицирования HCV как иным, так и гомологичным штаммом).
HCV в мире инфицировано около 3% популяции (170 млн человек), примерно у 80% лиц, перенёсших острую форму болезни, происходит формирование хронического гепатита. Хроническая HCV-инфекция — одна из основных причин цирроза печени и наиболее частое показание для ортотопической трансплантации печени.

Причины гепатита С
Причина гепатита С — вирус гепатита С (HCV). Относят к семейству Flaviviridae, имеет липидную оболочку, сферическую форму, средний диаметр составляет 50 нм, нуклеокапсид содержит однонитевую линейную РНК. Геном содержит около 9600 нуклеотидов. В геноме HCV выделяют две области, одна из которых (локус core, El и E2/NS1) кодирует структурные белки, входящие в состав вириона (нуклеокапсид, белки оболочки), другая (локус NS2, NS3, NS4A, NS4B, NS5A и NS5B) — неструктурные (функциональные) белки, не входящие в состав вириона, но обладающие ферментативной активностью и жизненно необходимые для репликации вируса (протеазу, хеликазу, РНК-зависимую РНК-полимеразу). Изучение функциональной роли белков, кодируемых в неструктурной области генома HCV и участвующих в репликации вируса, имеет исключительную важность для создания новых препаратов, которые могли бы блокировать репликацию вируса.
Установлено, что вирус гепатита С циркулирует в организме человека в виде смеси мутантных штаммов, генетически отличаемых друг от друга и получивших название «квазивидов». Особенность строения генома HCV — его высокая мутационная изменчивость, способность постоянно изменять свою антигенную структуру, что позволяет вирусу избегать иммунной элиминации и длительно персистировать в организме человека. Согласно наиболее распространённой классификации, выделяют шесть генотипов и свыше ста субтипов HCV. В различных регионах Земли циркулируют разные генотипы вируса. Так, в Украине распространены преимущественно генотипы 1b и За. Генотип не влияет на исход инфекции, но позволяет предсказать эффективность лечения и во многих случаях определяет его длительность. Пациенты, инфицированные генотипами 1 и 4, хуже отвечают на противовирусную терапию. В качестве экспериментальной модели для изучения ВГС могут выступать только шимпанзе.

Возбудители
Факторы риска
Выделяют следующие группы риска, которые одновременно являются и источником заражения окружающих. Это люди, страдающие наркотической зависимостью. Статистические данные информируют о таких процентных соотношениях инфицирования:
- Гемотрансфузия (переливание крови) и трансплантация органов – более 55%.
- Употребление инъекционных наркотиков – 20-22%.
- Гемодиализ (внепочечное очищение крови) – 10-12%.
- Половые контакты – 5-7%.
- Профессиональный путь инфицирования (врачи, медицинские работники, имеющие контакт с кровью – 5-6%.
Группы повышенного риска – это все люди, связанные с инъекционными наркотиками, кроме того в категорию риска заражения попадают:
- Пациенты, которым по витальным (жизненным) показаниям требуются систематические процедуры гемотрансфузии.
- Пациенты, которым проводится гемодиализ.
- Пациенты онкологических диспансеров с опухолями органов кроветворения.
- Медицинский персонал, имеющий контакт с кровью.
- Доноры, в том числе лица, сдающие плазму.
- Люди, не пользующиеся средствами защиты при половых контактах и имеющие несколько партнеров.
- ВИЧ-инфицированные.
- Лица с нетрадиционной сексуальной ориентацией (гомосексуализм).
- Сексуальные партнеры лиц, больных гепатитом.
- Беременные женщины, инфицированные вирусом HCV, в смысле передачи гепатита плоду.

Патогенез
После инфицирования HCV гематогенно попадает в гепатоциты, где преимущественно и происходит его репликация. Поражение клеток печени обусловлено прямым цитопатическим действием компонентов вируса или вирусспецифических продуктов на клеточные мембраны и структуры гепатоцита и иммунологически опосредованным (в том числе аутоиммунным) повреждением, направленным на внутриклеточные антигены HCV. Течение и исход инфекции HCV (элиминация вируса или его персистенция), определяет прежде всего эффективность иммунного ответа макроорганизма. При острой фазе инфекции уровень РНК HCV достигает высоких концентраций в сыворотке крови в течение первой недели после инфицирования. При остром гепатите С (как у людей, так и в эксперименте) специфический клеточный иммунный ответ запаздывает как минимум на один месяц, гуморальный — на два месяца, вирус «опережает» адаптивный иммунный ответ. Развитие желтухи (следствие Т-клеточного повреждения печени) редко наблюдают при остром гепатите С. Примерно через 8-12 нед после инфицирования, когда возникает максимальное увеличение уровня АЛТ в крови, происходит снижение титра РНК HCV. Антитела к HCV определяются несколько позже и могут вообще отсутствовать, а их появление не означает окончания инфекции. У большинства больных развивается хронический гепатит С с относительно стабильной вирусной нагрузкой, которая на 2-3 порядка ниже, чем в острой фазе инфекции. Только небольшая часть больных (около 20%) выздоравливает. РНК HCV перестает определяться при использовании стандартных диагностических тестов. Исчезновение вируса из печени и. возможно, из других органов происходит позднее, чем из крови, поскольку возврат вирусемии обнаруживают у некоторых пациентов и подопытных шимпанзе даже через 4-5 мес после того, как РНК HCV перестала определяться в крови. До сих пор неизвестно, исчезает ли вирус из организма окончательно. Почти у всех спонтанно выздоровевших от острого гепатита С пациентов можно наблюдать сильный поликлональный специфичный ответ Т-клеток, что убедительно доказывает зависимость между длительностью и силой специфического клеточного иммунного ответа и благоприятным исходом болезни. Напротив, клеточный иммунный ответ у пациентов с хронической НСV-инфекцией обычно слабый, узкофокусный и/или непродолжительный. Факторы вируса и хозяина, обусловливающие неспособность иммунного ответа контролировать HCV-инфекцию. изучены недостаточно. Известен феномен ускользания из-под контроля иммунного ответа хозяина, который обусловлен высокой мутационной изменчивостью генома HCV. результатом чего является способность вируса к длительной (возможно, пожизненной) персистенции в организме человека.
При HCV-инфекции возможно появление разнообразных внепечёночных поражений, обусловленных иммунопатологическими реакциями иммунокомпетентных клеток, которые реализуются либо иммуноклеточными (гранулёматоз, лимфомакрофагальные инфильтраты), либо иммунокомплексными реакциями (васкулиты различной локализации).
Морфологические изменения в печени при вирусном гепатите С неспецифичны. Наблюдают преимущественно лимфоидную инфильтрацию портальных трактов с образованием лимфоидных фолликулов, лимфоидную инфильтрацию долек, ступенчатые некрозы, стеатоз, повреждение мелких жёлчных протоков, фиброз печени, которые встречают в различной комбинации и которые определяют степень гистологической активности и стадию гепатита. Воспалительная инфильтрация при хронической HCV-инфекции имеет свои особенности: в портальных трактах и вокруг очагов повреждения и гибели гепатоцитов преобладают лимфоциты, что отражает участие иммунной системы в патогенезе поражения печени. В гепатоцитах наблюдают жировую дистрофию, при этом стеатоз печени в большей степени выражен при инфицировании генотипом За, по сравнению с генотипом 1. Хронический гепатит С даже с невысокой степенью гистологической активности может сопровождать развитие фиброза печени. Фиброзу подвергаются не только портальные и перипортальные зоны долек, часто выявляют и перивенулярный фиброз. Тяжёлый фиброз ведёт к развитию цирроза (диффузный фиброз с образованием ложных долек), на фоне которого возможно развитие гепатоцеллюлярной карциномы. Цирроз печени развивается у 15-20% больных с выраженными воспалительными изменениями в ткани печени. В настоящее время помимо морфологического описания полученных биоптатов разработано несколько систем числовой оценки, которые позволяют проводить полуколичественное (ранговое) определение ИГА — активности воспалительно-некротического процесса в печени, а также стадии болезни, определяемой по степени выраженности фиброза (индекса фиброза). На основании этих показателей определяют прогноз заболевания, стратегию и тактику противовирусной терапии.

Симптомы гепатита С
Клинические симптомы гепатита С не имеют принципиальных отличий от таковых при других парентеральных гепатитах. Длительность преджелтушного периода составляет от нескольких дней до 2 нед. может отсутствовать у 20% больных.
Инфицирование вирусом гепатита С приводит к развитию острого гепатита С, в 80% случаев протекающего в безжелтушной форме без клинических проявлений, в результате чего острую фазу заболевания диагностируют редко. Инкубационный период при остром гепатите С колеблется от 2 до 26 нед (в среднем 6-8 нед).
Симптомы острого гепатита С
В преджелтушном периоде чаще всего преобладает астеновегетативный синдром, выражающийся слабостью, быстрой утомляемостью. Часто возникают диспепсические расстройства: снижение аппетита, дискомфорт в правом подреберье, тошнота и рвота. Существенно реже бывает артралгический синдром, возможен кожный зуд. Желтушный период протекает значительно легче, чем при других парентеральных гепатитах. Ведущие симптомы острого периода — слабость, снижение аппетита и чувство дискомфорта в животе. Тошноту и зуд встречают у трети больных, головокружение и головную боль — у каждого пятого, рвоту — у каждого десятого больного. Практически у всех больных увеличена печень, у 20% — селезёнка. Для острого гепатита С характерны такие же изменения биохимических показателей, как при других парентеральных гепатитах: повышение уровня билирубина (при безжелтушной форме количество билирубина соответствует нормальным показателям), значительное повышение активности АЛТ (более чем в 10 раз). Нередко отмечают волнообразный характер гиперферментемии, что не сопровождается ухудшением самочувствия. В большинстве случаев уровень билирубина нормализуется к тридцатому дню после появления желтухи. Другие биохимические показатели (осадочные пробы, уровень общего белка и белковых фракций, протромбина, холестерина, щелочной фосфатазы) — обычно в пределах нормальных значений. Иногда регистрируют увеличение содержания ГГТ. В гемограмме тенденция к лейкопении, в моче обнаруживают жёлчные пигменты.
Острый гепатит С протекает преимущественно в среднетяжёлой форме, у 30% больных — в лёгкой. Возможно тяжёлое течение болезни (редко), а фульминантный острый гепатит С, приводящий к летальному исходу, встречают очень редко. При естественном течении вирусного гепатита С 20-25% больных острым гепатитом С спонтанно выздоравливают, у остальных 75-80% происходит развитие хронического гепатита С. Окончательные критерии выздоровления после перенесённого острого гепатита С не разработаны, однако о спонтанном выздоровлении можно говорить в том случае, если у пациента, не получавшего специфическую противовирусную терапию, на фоне хорошего самочувствия и нормальных размеров печени и селезёнки определяют нормальные биохимические показатели крови, а в сыворотке крови не обнаруживают РНК HCV не менее чем в течение двух лет после острого гепатита С. Факторы, связанные со спонтанной элиминацией вируса: молодой возраст, женский пол и определённое сочетание генов главного комплекса гистосовместимости.

Симптомы хронического гепатита С
У 70-80% лиц. перенёсших острую форму болезни, происходит формирование хронического гепатита, который выступает наиболее распространённой патологией среди хронических вирусных поражений печени. Формирование хронического гепатита С может сопровождать нормализация клинико-биохимических показателей вслед за острым периодом, однако, в последующем вновь появляется гиперферментемия и РНК HCV в сыворотке крови. Большинство больных с биохимическими признаками хронического гепатита С (70%) имеет благоприятное течение (слабовыраженную или умеренную воспалительную активность в ткани печени и минимально выраженный фиброз). Отдалённый исход у этой группы пациентов пока неизвестен. У 30% больных хроническим гепатитом С болезнь имеет прогрессирующее течение, у части из них (12,5% — за 20 лет, 20-30% — за 30 лет) происходит формирование цирроза печени, который может быть причиной смерти. Декомпенсированный цирроз печени ассоциируется с повышенной смертностью и является показанием к трансплантации печени. У 70% больных причина смерти — гепатоцеллюлярная карцинома, печёночно-клеточная недостаточность и кровотечение.
Для больных хроническим гепатитом С риск развития гепатоцеллюлярной карциномы через 20 лет после инфицирования составляет 1-5%. В большинстве случаев гепатоцеллюлярная карцинома возникает на фоне цирроза печени с частотой 1-4% в год, 5-летняя выживаемость больных с этой формой рака составляет менее 5%. Независимые факторы риска прогрессирования фиброза: мужской пол, возраст на момент инфицирования (прогрессирование происходит быстрее у пациентов, заражённых в возрасте старше 40 лет), инфицирование другими вирусами (HBV, ВИЧ), ежедневное употребление более 40 г чистого этанола. Ещё один неблагоприятный фактор — избыточный вес, вызывающий развитие стеатоза печени, который, в свою очередь, способствует более быстрому формированию фиброза. Вероятность прогрессирования болезни не имеет связи с генотипом HCV или вирусной нагрузкой.
Особенность хронического гепатита С — латентное или малосимптомное течение в продолжение многих лет, обычно без желтухи. Повышение активности АЛТ и ACT, выявление анти-HCV и РНК HCV в сыворотке крови в течение не менее 6 мес — основные признаки хронического гепатита С. Чаще всего эту категорию больных обнаруживают случайно, при обследовании перед оперативным вмешательством, при прохождении диспансеризации и т.д. Иногда пациенты попадают в поле зрения врача только при формировании цирроза печени и при появлении признаков его декомпенсации.
Хроническую НСV-инфекцию может сопровождать нормальная активность АЛТ при повторных исследованиях в течение 6-12 мес, несмотря на продолжающуюся репликацию РНК HCV. Доля таких пациентов среди всех больных с хронической инфекцией составляет 20-40%. У части из этой категории больных (15-20%) при проведении биопсии печени можно выявить серьёзные фиброзные изменения. Пункционная биопсия печени — важный диагностический метод, позволяющий выявить пациентов с прогрессирующим серьёзным поражением печени, нуждающихся в безотлагательной противовирусной терапии. Скорость прогрессирования фиброза печени у больных с нормальной активностью АЛТ, по-видимому, ниже, чем у пациентов с повышением её активности.
Внепечёночные симптомы гепатита С встречают, по данным разных авторов, у 30-75% больных. Они могут выходить на первый план в течении болезни и определять прогноз заболевания. Течение хронического гепатита С могут сопровождать такие иммуноопосредованные внепечёночные проявления, как смешанная криоглобулинемия, красный плоский лишай, мезангиокапиллярный гломерулонефрит. поздняя кожная порфирия, ревматоидные симптомы. Установлена роль HCV в развитии В-клеточной лимфомы, идиопатической тромбоцитопении, поражения эндокринных (тиреоидит) и экзокринных желёз (прежде всего, вовлечение в патологический процесс слюнных и слёзных желёз, в том числе в рамках синдрома Шёгрена), глаз, кожи, мышц, суставов, нервной системы и др.
Симптомы гепатита С безжелтушной формы
Заболевание начинается постепенно, могут отмечаться жалобы на утомляемость, ухудшение аппетита, боли в животе нерезкого характера. Через несколько дней на фойе развившихся астенических и диспептических явлений отмечаются увеличение и уплотнение печени, которая выступает на 2-5 см ниже реберной дуги, у отдельных больных одновременно наблюдается увеличение селезенки.
Частота клинических симптомов (%) в период разгара гепатита С
|
Симптом |
Форма | ||
|
безжелтушная |
легкая |
среднетяжелая |
|
|
Головная боль |
— |
6,0 |
14,0 |
|
Слабость |
6,9 |
18 |
47,0 |
|
Беспокойство |
— |
— |
4,7 |
|
Ухудшение аппетита |
13,8 |
39,0 |
56,4 |
|
Рвота |
— |
15,0 |
23,5 |
|
Боли в животе |
6,9 |
12,0 |
56,4 |
|
Увеличение печени (из подреберья): |
72,4 |
78,0 |
51,7 |
|
от 2.5 до 5 см |
27,6 |
18,0 |
42,3 |
|
Чувствительность печени |
17,2 |
63,0 |
47,0 |
|
Консистенция печени: плотноэластическая |
48,3 |
66,0 |
61,1 |
|
уплотненная |
24,1 |
24,0 |
37,6 |
|
Увеличение селезенки (из подреберья): до 1 см |
17,2 |
18,0 |
32,9 |
|
до 3 см |
— |
3,0 |
14,0 |
Из показателей функциональных проб печени обращает на себя внимание гиперферментемия (3-10-кратное повышение активности аминотрансфераз) при нормальном уровне билирубина. Осадочные пробы мало изменены.
Биохимические показатели в период разгара острого гепатита С
|
Показатель |
Форма |
||
|
безжелтушная |
легкая |
среднетяжелая |
|
|
Билирубин : |
13,1±0,4 6,2±0,3 |
40,3+4,9 |
119,0±12,3 |
|
АЛТ, ЕД/л |
290±35 |
330±28 |
400±41 |
|
ACT, ЕД/л |
160±45 |
250±30 |
320±53 |
|
Тимоловая проба, ЕД/л |
6,3±1,1 |
7,8±1,6 |
12,0±2.4 |
Легкая форма
Заболевание начинается с появления слабости, ухудшения аппетита, иногда — болей в животе. Температура тела остается нормальной или повышается не выше 38 °С. Через несколько дней обнаруживается увеличение печени.
Продолжительность преджелтушного периода — от 3 до 7 сут. в среднем 4,3±1,2 сут. С появлением желтухи состояние больных не ухудшается, интоксикация не усиливается. В желтушном периоде определяется умеренно выраженный гепатолиенальный синдром. Печень уплотнена, чувствительна, выступает из подреберья на 1-3 см; селезенка пальпируется у большинства больных у края реберной нуги и у отдельных — на 1-3 см ниже реберного края.
В сыворотке крови содержание билирубина составляет в среднем 40,3±5,0 мкмоль/л, почта исключительно за счет конъюгированной фракции, активность печеночно-клеточных ферментов возрастает не более чем в 3-10 раз. показатели тимоловой пробы в пределах нормы или слегка повышены.
Длительность желтушного периода — от 5 до 12 сут. в среднем 7,8±Т,2 сут.
Среднетяжелая форма
В начальном периоде болезни характерны астенические и диспептические явления (вялость, адинамия, головокружение, потеря аппетита, повторная рвота, боли в животе), у отдельных больных возможно повышение температуры тела до 38-39 С. Преджелтушный период длится 5-8 сут, составляя в среднем 5,7±1,7 сут.
С появлением желтухи сохраняются или усиливаются симптомы интоксикации, но в целом они выражены умеренно. В течение 2-5 сут желтуха достигает максимума, затем в течение 5-10 сут, а иногда и дольше, остается на одном и том же уровне и далее начинает уменьшаться. В среднем длительность желтушного периода составляет 16±3,5 сут. В желтушном периоде край печени пальпируется ниже реберной дуги на 2-5 см, при этом орган определяется уплотненным и болезненным. Селезенка обычно пальпируется на 1-3 см ниже реберной дуги. У отдельных больных отмечаются единичные «синячки» на конечностях и туловище как проявление геморрагического синдрома.
В биохимическом анализе крови регистрируется 5-10 кратное увеличение уровня билирубина, в среднем 119,0+12,3 мкмоль/л, главным образом конъюгированного, высокая активность печеночно-клеточных ферментов, при этом показатели АЛТ и ACT превышают норму в 5-15 раз, показатели тимоловой пробы умеренно повышены, показатели протромбинового индекса снижены до 60-65%.
В среднем длительность желтушного периода составляет 16,0±3,5 сут.
Тяжелая форма
При гепатите С встречается редко. В начальном периоде болезни отмечаются резкая слабость, разбитость, головокружение, головные боли, анорексия, боли в правом подреберье, тошнота, повторная рвота. В желтушном периоде интоксикация ярко выражена, наблюдаются проявления геморрагического синдрома (экхимозы на конечностях и туловище, петехиальные элементы, носовые кровотечения). Печень плотная, болезненная, определяется на 5-10 см ниже реберной дуги; селезенка выступает из подреберья на 3-5 см.
В сыворотке крови уровень билирубина возрастает более чем в 10 раз, за счет как конъюгированной, так и неконъюгировапной фракции; характерны высокая гиперферментемия и снижение протромбиновош индекса до 50% и более.
Желтушный период продолжается до 3-4 нед и, как правило, сопровождается пролонгированной интоксикацией.
Злокачественная форма
В литературе имеются лишь единичные сообщения о развитии злокачественного (фульминантного) гепатита С как у взрослых, так и у детей. Сообщается, что клинические проявления фульминантного гепатита С ничем не отличаются от таковых при HBV-инфекции.
Субклиническая форма гепатита С
Характеризуется отсутствием клинических проявлений, наличием биохимических и серологических сдвигов. В сыворотке крови повышается активность аминотрасфераз и появляются специфические маркеры — РНК HCV и анти-HCV.
Где болит?
Что беспокоит?
Стадии
Различают острое, затяжное и хроническое течение болезни.
Острое течение гепатита С характеризуется относительно быстрым обратным изменением клинико-лабораторных показателей гепатита с выздоровлением и полным восстановлением функционального состояния печени в сроки до 3 мес. от начала заболевания.
Вариантами доброкачественного течения болезни могут быть:
- выздоровление с полным структурам и функциональным восстановлением печени;
- выздоровление с остаточным фиброзом печени (остаточный фиброз);
- выздоровление с поражением желчевыводящих путей (дискинезия, холецистит, холангит и др.).
Затяжное течение гепатита С чаще проявляется тем, что после исчезновения желтухи и, казалось бы, завершения острого периода затягивается гиперферментемия. Состояние пациентов в этих случаях вполне удовлетворительное, печень умеренно увеличена, но селезенка чаще перестает пальпироваться. Гиперферментемия может удерживаться в течение 6 -9 и даже 12 мес, но в конечном итоге наступает нормализация активности ферментов и полное выздоровление.
Хроническое течение гепатита С устанавливают после констатации активно текущего более 6 мес процесса в печени Большинство клиницистов указывают на высокую частоту хронизации гепатита С — от 40 до 56-81%. Причем одним из частых вариантов считается бессимптомная, с самого начала заболевания, гиперферментемия, сохраняющаяся в дальнейшем в течение нескольких лет, то усиливаясь, то ослабевая.
По данным исследований, у 42 детей (53,4%) после стихания острого периода сохранялась повышенная активность аминотрасфераз и у 10 продолжала выявляться РНК НСV в сыворотке крови; при этом практически у всех больных пальпировалась плотноватая увеличенная печень. Примерно поровну из всех форм острого гепатита С формировался хронический процесс. Нужно отметить, что у всех детей, как выздоровевших, так и с исходом болезни в хроническую форму, в сыворотке крови выявлялись антитела к вирусу гепатита С.
По-видимому, можно утверждать как о закономерном явлении факт перехода острого манифестного гепатита С в хроническую форму. Строгих обоснований этому факту пока не дано, но понимание указанной закономерности будет получено при изучении НСV-инфекции с учетом генотипов РНК вируса гепатита С.

Формы
- По наличию желтухи в острой фазе болезни:
- Желтушный.
- Безжелтушный.
- По длительности течения.
- Острое (до 3 мес).
- Затяжное (более 3 мес).
- Хроническое (более 6 мес).
- По тяжести.
- Лёгкая.
- Среднетяжёлая.
- Тяжёлая.
- Фульминантная.
- Осложнения.
- Печёночная кома.
- Исходы.
- Выздоровление.
- Хронический гепатит С.
- Цирроз печени.
- Гепатоцеллюлярная карцинома.
По характеру клинических проявлений острой фазы болезни различают типичный и атипичный гепатит С. К типичным относят все случаи заболевания, сопровождающиеся клинически видимой желтухой, а к атипичным — безжелтушные и субклинические формы.
Все типичные варианты болезни в зависимости от выраженности симптомов (интоксикация, желтуха, гепатоспленомегалия и др.) и биохимических сдвигов (повышение уровня билирубина, снижение протромбинового индекса и др.) принято делить на легкие, среднетяжелые, тяжелые и злокачественные (фульминантные) формы.
В зависимости от продолжительности различают острый, затяжной и хронический гепатит С.

Диагностика гепатита С
Клинические симптомы острого гепатита С у значительной части больных слабо выражены, поэтому диагностика острого гепатита С основана на комплексной оценке данных эпидемиологического анамнеза в сроки, соответствующие инкубационному периоду, желтухи, увеличения показателей билирубина, повышения уровня АЛТ более чем в 10 раз, наличия впервые выявленных маркёров вирусного гепатита С (анти-HCV, РНК HCV) при исключении гепатитов другой природы. Учитывая, что у большинства больных острым гепатитом С отсутствуют клинические признаки острого гепатита, а имеющиеся серологические и биохимические проявления не всегда позволяют отличить острый гепатит от обострения хронического, диагноз острого гепатита С устанавливают в тех случаях, когда наряду с характерными клинико-эпидемиологическими и биохимическими данными при первичном исследовании сыворотки крови отсутствуют антитела к HCV, которые появляются спустя 4-6 и более недель от начала болезни. Для диагностики острого гепатита С можно прибегнуть к выявлению вирусной РНК методом ПЦР, так как её можно обнаружить уже в первые 1-2 нед заболевания, в то время как антитела появляются только через несколько недель. Использование тест-систем третьего поколения, значительно более чувствительных и специфичных, позволяет выявить анти-HCV в сыворотке крови уже через 7-10 дней от начала желтухи. Анти-HCV можно обнаружить как при остром гепатите С, так и при хроническом гепатите С. При этом анти-HCV антител IgM одинаково часто обнаруживают у больных как острым, так и хроническим гепатитом С. Таким образом, обнаружение анти-HCV IgM не может быть использовано как маркёр острой фазы вирусного гепатита С. Кроме того. анти-HCV могут изолированно циркулировать в крови пациентов, которые выздоровели после острого гепатита С или находятся в фазе ремиссии после элиминации РНК HCV в результате противовирусной терапии. Современные тест-системы позволяют повысить выявляемость анти-HCV у 98-100% иммунокомпетентных инфицированных лиц, в то время как у иммунокомпроментированных пациентов частота выявления анти-HCV значительно ниже. Необходимо помнить о возможности ложноположительных результатов при проведении реакции на анти-HCV, которые могут составлять 20% и более (у онкологических больных, при аутоиммунных заболеваниях и иммунодефицитах и др.).
Для подтверждения хронического гепатита С используют эпидемиологические и клинические данные, динамическое определение биохимических показателей, наличие в сыворотке крови анти-HCV и РНК HCV. Однако золотой стандарт диагностики хронического гепатита С — пункционная биопсия печени, которая показана пациентам, имеющим диагностические критерии хронического гепатита. Цели проведения пункционной биопсии печени — установление степени активности некротических и воспалительных изменений в ткани печени (определение ИГА), уточнение степени выраженности и распространённости фиброза — стадии болезни (определение индекса фиброза), а также оценка эффективности лечения. На основании результатов гистологического исследования ткани печени определяют тактику ведения больного, показания к проведению противовирусной терапии и прогноз заболевания.
Стандарт диагностики острого гепатита С
Обязательные лабораторные исследования:
- клинический анализ крови;
- биохимический анализ крови: билирубин, АЛТ, ACT, тимоловая проба, протромбиновый индекс;
- иммунологическое исследование: анти-HCV, HB-Ag. анти-НВс IgM, анти-ВИЧ;
- определение группы крови, резус-фактора;
- клинический анализ мочи и жёлчные пигменты (билирубин).
Дополнительные лабораторные исследования:
- иммунологическое исследование: РНК HCV (качественный анализ), антидельта суммарные, анти-HAV IgM, анти-HEV IgM, ЦИК, LE-клетки;
- биохимический анализ крови: холестерин, липопротеиды, триглицериды, общий белок и белковые фракции, глюкоза, калий, натрий, хлориды, СРБ, амилаза, щелочная фосфатаза, ГГТ, церулоплазмин;
- кислотно-основное состояние крови;
- коагулограмма.
Инструментальные исследования:
- УЗИ органов брюшной полости;
- ЭКГ;
- рентгенография органов грудной клетки.

Стандарт диагностики хронического гепатита С
Обязательные лабораторные исследования:
- клинический анализ крови;
- биохимический анализ крови: билирубин, АЛТ, ACT, тимоловая проба;
- иммунологическое исследование: Анти-HCV; HBсAg;
- клинический анализ мочи и жёлчные пигменты (билирубин).
Дополнительные лабораторные исследования;
- биохимический анализ крови: холестерин, липопротеиды, триглицериды, общий белок и белковые фракции, глюкоза, калий, натрий, хлориды, СРБ, амилаза, щелочная фосфатаза, ГГТ, церулоплазмин, железо, гормоны щитовидной железы;
- коагулограмма;
- определение группы крови, резус-фактора;
- иммунологическое исследование: РНК HCV (качественный анализ), антидельта суммарные, анти-HAV IgM, анти-HEV IgM, ЦИК, LE-клетки, анти-НВс IgM, анти-дельта IgM, HBеAg, анти-НВе, ДНК HBV (качественный анализ), аутоантитела, анти-ВИЧ, а-фетопротеин;
- кал на скрытую кровь.
Инструментальная диагностика (дополнительная):
- УЗИ органов брюшной полости:
- ЭКГ;
- рентгенография органов грудной клетки:
- чрескожная пункционная биопсия печени:
- ЭГДС.
Что нужно обследовать?
Как обследовать?
Какие анализы необходимы?
Дифференциальная диагностика
Дифференциальную диагностику проводят с другими вирусными гепатитами. При постановке диагноза учитывают, прежде всего, свойственное острому гепатиту С относительно лёгкое течение болезни со значительно меньшей степенью выраженности синдрома интоксикации, с быстрой нормализацией биохимических показателей. Большое значение при проведении дифференциальной диагностики имеет динамика маркёров вирусных гепатитов.
Показания к консультации других специалистов
Наличие желтухи, дискомфорт или боль в животе, повышение активности АЛТ и ACT, отсутствие маркёров вирусных гепатитов может потребовать консультации хирурга для исключения подпечёночного характера желтухи.
К кому обратиться?
Лечение гепатита С
Госпитализация показана при остром вирусном гепатите и подозрении на вирусный гепатит С.
Медикаментозное лечение гепатита С
В качестве этиотропного средства при лечении острого гепатита С применяют стандартный интерферон альфа-2. Увеличить количество выздоровевших (до 80-90%) от острого гепатита С удаётся при использовании следующих схем лечения:
- интерферон альфа-2 по 5 млн ME внутримышечно ежедневно в течение 4 нед, затем по 5 млн ME внутримышечно трижды в неделю в течение 20 нед;
- интерферон альфа-2 по 10 млн ME внутримышечно ежедневно до нормализации уровня трансаминаз (что происходит обычно на 3-6-й неделе от начала применения препарата).
Эффективна монотерапия пегилированным интерфероном альфа-2 в течение 24 нед.
Комплекс лечебных мероприятий при хроническом гепатите С включает проведение базисной и этиотропной (противовирусной) терапии. Базисная терапия предполагает соблюдение диеты (стол № 5), курсовое применение средств, нормализующих деятельность ЖКТ, влияющих на функциональную активность гепатоцитов (панкреатические энзимы, гепатопротекторы, желчегонные средства для восстановления микрофлоры кишечника и др.). Следует также ограничивать физическую нагрузку, оказывать пациентам психоэмоциональную и социальную поддержку, лечить сопутствующие заболевания. Цель проведения этиотропной терапии хронического гепатита С — подавление вирусной репликации, эрадикация вируса из организма и прекращение инфекционного процесса. Это является основой замедления прогрессирования заболевания, стабилизации или регрессии патологических изменений в печени, предупреждения формирования цирроза печени и первичной гепатоцеллюлярной карциномы, а также повышения качества жизни, связанного с состоянием здоровья.
В настоящее время наилучший вариант проведения противовирусной терапии хронического гепатита С — комбинированное применение пегилпрованного интерферона альфа-2 и рибавирина в течение 6-12 мес (в зависимости от генотипа вируса, вызвавшего заболевание). Стандарт лечения хронического гепатита С — стандартный интерферон альфа-2, комбинация стандартного интерферона альфа-2 и рибавирина. а также комбинация пегилированного интерферона альфа-2 и рибавирина. Стандартный интерферон альфа-2 назначают в дозе 3 млн ME 3 раза в неделю подкожно или внутримышечно. пегилированный интерферон альфа-2а назначают в дозе 180 мкг, пегилированный интерферон альфа-2b — из расчёта 1.5 мкг/кг — 1 раз в неделю под кожу в течение 48 нед при генотипе 1 и 4 в течение 24 нед при других генотипах. Рибавирин принимают ежедневно в дозе 800-1200 мг в два приёма в зависимости от генотипа HCV и массы тела.
Принципиально важны установление показаний для этиотропной терапии хронического генотипа С и выбор адекватной программы её проведения. В каждом случае необходим тщательный дифференцированный подход при определении группы лиц, подлежащих лечению. Согласно рекомендациям согласительных конференций, проведённых в 2002 г., противовирусное лечение гепатита С проводят только взрослым пациентам с хроническим гепатитом С, при наличии РНК HCV в сыворотке крови и при наличии гистологических признаков поражения печени.
Лечение можно не назначать пациентам с хроническим гепатитом С лёгкой степени тяжести, у которых вероятность прогрессирования заболевания при отсутствии отягощающих факторов (ожирения, чрезмерного употребления алкоголя, коинфицирования ВИЧ) низка. В этих ситуациях возможно динамическое наблюдение за течением болезни.
Лечение назначают пациентам с хроническим гепатитом на стадии F2 или F3 по системе METAVIR, вне зависимости от степени активности некротического воспаления печени, а также пациентам с циррозом печени (с целью получения вирусологического ответа, стабилизации процесса в печени, предотвращения гепатоцеллюлярной карциномы). После первичного курса лечения при отсутствии вирусологического ответа, но при наличии биохимического ответа может быть назначена поддерживающая терапия интерфероном альфа-2 для замедления прогрессии заболевания. Предикторы ответа на лечение при хроническом гепатите С — факторы хозяина и факторы вируса. Так. больные в возрасте менее 40 лет, пациенты с небольшой продолжительностью болезни и пациентки чаще отвечают на терапию интерфероном. Хуже поддаётся лечению болезнь у пациентов, злоупотребляющих алкоголем, больных сахарным диабетом, стеатозом печени, ожирением. Поэтому модификация диеты перед началом лечения может улучшить её результаты. Частота ответа на лечение выше у больных со слабым фиброзом, чем при фиброзе 3-4-й стадии или при циррозе. Однако у половины больных с циррозом печени удаётся достичь вирусологического ответа (при генотипе 1 — у 37%. при не 1 — более чем у 70% больных), поэтому эта категория пациентов также должна получать противовирусную терапию, хотя тактика её проведения при необходимости должна подлежать коррекции. Частота успешного вирусологического ответа при лечении стандартным и пегилированным интерфероном альфа-2 в сочетании с рибави-рином или без него зависит от генотипа HCV и вирусной нагрузки. Чаще всего на лечение гепатита С отвечают больные с генотипами 2 и 3, у больных с генотипами 1 и 4 вероятность успешного вирусологического ответа существенно ниже. Пациенты с высокой вирусной нагрузкой (>850 тыс. МЕ/мл) хуже отвечают на лечение, чем пациенты с низкой вирусной нагрузкой. Большое значение в достижении эффекта при проведении противовирусного лечения имеет приверженность больного к лечению. Вероятность достижения эффекта выше, если больной получил полный курс лечения — более 80% дозы препаратов в течение более 80% от намеченного срока лечения.
Оценку эффективности специфического лечения гепатита С осуществляют на основании нескольких критериев — вирусологического (исчезновение РНК HCV из сыворотки крови), биохимического (нормализация уровня АЛТ) и морфологического (уменьшение индекса гистологической активности и стадии фиброза). Возможно несколько вариантов ответа на проведение противовирусного лечения гепатита С. Если регистрируют нормализацию уровня АЛТ и ACT и исчезновение РНК HCV в сыворотке крови сразу после окончания терапии, то говорят о полной ремиссии, о биохимическом и вирусологическом ответе в конце лечения. Устойчивый биохимический и вирусологический ответ отмечают в том случае, если через 24 нед (6 мес) после прекращения курса лечения в сыворотке крови определяют нормальный уровень АЛТ и отсутствует РНК HCV. Рецидив болезни регистрируют тогда, когда повышается уровень АЛТ и ACT и/или появляется РНК HCV в сыворотке крови после прекращения лечения. Отсутствие лечебного эффекта означает отсутствие нормализации уровня АЛТ и ACT и/или сохранение РНК HCV в сыворотке крови на фоне проводимого лечения. Прогнозирование эффективности проводимой противовирусной терапии возможно путём оценки раннего вирусологического ответа. Наличие раннего вирусологического ответа предполагает отсутствие РНК HCV или снижение вирусной нагрузки более чем на 2xIg10 в сыворотке крови через 12 нед лечения. При регистрации раннего вирусологического ответа вероятность эффективной противовирусной терапии высока, в то время как его отсутствие указывает на низкие шансы достижения успешного вирусологического ответа даже в том случае, если курс лечения пациента составит 48 нед. В настоящее время при прогнозировании эффективности противовирусной терапии ориентируются на быстрый вирусологический ответ — исчезновение РНК HCV через 4 нед после начала противовирусного лечения.
Продолжительность лечения гепатита С зависит от генотипа HCV. При генотипе 1, если через 12 нед от начала лечения отсутствует РНК HCV в сыворотке крови, то длительность лечения составляет 48 нед. В том случае если у больного с генотипом 1 вирусная нагрузка через 12 нед лечения снижается по крайней мере на 2xlgl0 по сравнению с исходной, но РНК HCV продолжает определяться в крови, необходимо провести повторное исследование РНК HCV на 24-й нед лечения.
Если РНК HCV остаётся положительной через 24 нед, то лечение гепатита С следует прекратить. Отсутствие раннего вирусологического ответа позволяет достаточно точно прогнозировать неэффективность дальнейшей терапии, в связи с чем лечение также следует прекратить. При 2-м или 3-м генотипе комбинированную терапию интерфероном с рибавирином проводят в течение 24 недель без определения вирусной нагрузки. При 4-м генотипе, как и при 1-м, рекомендуют комбинированное лечение гепатита С в течение 48 нед. Во время лечения препаратами интерферонового ряда и рибавирином возможны нежелательные явления. Обязательное условие терапии рибавирином — применение контрацепции обоими партнерами в течение всего периода лечения (рекомендуют также избегать наступления беременности ещё в течение 6 мес после окончания курса лечения). Побочные эффекты интерферона и рибавирина иногда вынуждают снижать их дозы (временно или постоянно) или отменять препараты. Во время лечения гепатита С следует вести наблюдение за пациентами, осуществлять биохимический контроль (каждые две недели в начале лечения, затем ежемесячно), вирусологический контроль (при генотипе 1 — через 12 нед от начала терапии, при генотипе 2 или 3 — на момент окончания лечения). В некоторых случаях в конце курса лечения проводят повторную пункционную биопсию печени для оценки гистологической картины. Исследуют гемограмму, один раз в четыре месяца — концентрацию креатинина и мочевой кислоты, ТТГ, АНФ.
Благодаря наличию общих путей передачи вирусов хронического гепатита С часто сопровождается инфицированием HBV и/или ВИЧ. Коинфекция повышает риск развития цирроза печени, терминальной печёночно-клеточной недостаточности и гепатоцеллюлярной карциномы, а также смертности больных по сравнению с таковой у больных с моноинфекцией HCV. Предварительные данные свидетельствуют о том, что комбинация пегилированного интерферона и рибавирина позволяет добиться вирусологического и/или гистологического ответа у ВИЧ-инфицированных больных хроническим гепатитом С. При назначении противовирусной терапии больным с хроническим вирусным гепатитом при микст-инфекции выбор схемы лечения определяет наличие фазы репликации HBV и HCV.
Принципы проведения патогенетической и симптоматической терапии при остром гепатите С такие же, как и при других вирусных гепатитах. На фоне физического покоя и диеты (стол № 5) проводят дезинтоксикационную терапию в виде обильного питья или внутривенных вливаний 5-10% раствора глюкозы, полиионных растворов и аскорбиновой кислоты. По индивидуальным показаниям применяют ингибиторы протеаз. спазмолитики, гемостатическне средства, гипербарическую оксигенацию, гемосорбцию, плазмаферез, лазеротерапию.
Диспансеризация
Особенность диспансеризации больных вирусным гепатитом С — длительность проведения. Больных вирусным гепатитом С наблюдают пожизненно в связи с отсутствием надёжных критериев выздоровления с целью своевременного выявления признаков реактивации инфекции и коррекции тактики наблюдения и лечения.

Что нужно знать больному вирусным гепатитом С?
Вы перенесли острый гепатит С, и Вам необходимо знать, что исчезновение желтухи, удовлетворительные лабораторные показатели и хорошее самочувствие не являются показателями полного выздоровления, так как полное восстановление здоровья печени наступает в течение 6 мес. Для предупреждения обострения заболевания и перехода в хроническую форму важно строго соблюдать врачебные рекомендации, относимые к последующему наблюдению и обследованию в условиях поликлиники, режиму дня, диете, а также к условиям труда.
Режим и диета при гепатите С
Режим полупостельный при лёгком и среднетяжёлом остром гепатите С. При тяжёлом течении острого гепатита С строгий постельный режим. При хроническом гепатите С — соблюдение режима труда и отдыха, не рекомендованы работа в ночную смену и на производствах, связанных с токсическими продуктами, командировки, поднятие тяжестей и др.
Диета щадящая (по кулинарной обработке и исключению раздражающих веществ), стол № 5.
Возвращение к трудовой деятельности, связанной с большим физическим напряжением или профессиональными вредностями, допустимо не ранее чем через 3-6 мес после выписки. До этого возможно продолжение трудовой деятельности в режиме лёгкого труда.
После выписки из стационара следует остерегаться переохлаждения и избегать перегревания на солнце, не рекомендованы поездки на южные курорты на протяжении первых 3 мес. Также следует остерегаться приёма медикаментов, оказывающих побочное (токсическое) влияние на печень. После нормализации биохимических показателей крови на протяжении 6 мес запрещено участие в спортивных соревнованиях. Переболевших острым гепатитом В освобождают от профилактических прививок на 6 мес. Занятия спортом ограничивают лишь комплексом лечебной гимнастики.
На протяжении 6 мес после выписки необходимо обращать особое внимание на питание, которое должно быть достаточно полноценным, при полном исключении вредных для печени веществ. Алкогольные напитки (в том числе пиво) категорически запрещены. Питаться в течение дня необходимо регулярно через каждые 3-4 ч, избегая переедания.
Разрешены:
- молоко и молочные продукты во всех видах;
- отварное и тушёное мясо — говядина, телятина, куры, индейка, кролик;
- отварная свежая рыба — щука, карп, судак и морская рыба (треска, окунь);
- овощи, овощные блюда, фрукты, квашеная капуста;
- крупяные и мучные изделия;
- супы овощные, крупяные, молочные;
Следует ограничить употребление:
- мясных бульонов и супов (нежирные, не чаще 1-2 раз в неделю);
- сливочного масла (не более 50-70 г в день, для детей — 30-40 г), сливок,
- сметаны;
- яиц (не более 2-3 раз в неделю белковые омлеты);
- сыра (в небольшом количестве, только не острый);
- мясных продуктов (сосиски говяжьи, колбасы докторская, диетическая, столовая);
- икры лососёвых и осетровых, сельди:
- помидоров.
Запрещены:
- алкогольные напитки:
- все виды жареных, копчёных и маринованных продуктов;
- свинина, баранина, гусь, утка;
- острые приправы (хрен, перец, горчица, уксус);
- кондитерские изделия (торты, пирожные);
- шоколад, шоколадные конфеты, какао, кофе;
- томатный сок.
Врачебное наблюдение и контроль
Обследование перенёсших вирусный гепатит С проводят через 1, 3, 6 мес, а далее в зависимости от заключения диспансерного врача. Снятие с учёта при благоприятном исходе проводят не ранее 12 мес после выписки из стационара.
Помните, что только наблюдение врача-инфекциониста и регулярное лабораторное обследование позволит установить факт Вашего выздоровления или перехода заболевания в хроническую форму. В случае назначения врачом противовирусного лечения гепатита С Вы должны строго соблюдать режим введения препарата и регулярно приходить на лабораторный контроль показателей крови, так как это позволит максимально снизить вероятность побочного действия препарата и обеспечить контроль над инфекцией.
Явиться на лабораторное обследование нужно в строго назначенный врачом день натощак.
Ваше первое посещение КИЗ поликлиники назначает лечащий врач.
Установленные контрольные сроки повторных врачебных осмотров в поликлинике или гепатологическом центре — обязательны для всех, перенёсших вирусный гепатит С. При необходимости Вы можете обращаться в кабинет последующих наблюдений стационаров, или гепатологический центр, или КИЗ поликлиники также и помимо этих сроков.
Будьте внимательны к своему здоровью!
Строго соблюдайте режим и диету!
Являйтесь регулярно на врачебные осмотры!
Лекарства
Профилактика
Профилактика гепатита С особенно актуальна и по причине эпидемиологической распространенности заболевания, и по причине отсутствия вакцины против смертельно опасной инфекции.
Неспецифический метод – это повсеместное применение одноразовых медицинских инструментов, которыми проводятся процедуры, связанные с кровью. Кроме того, гемотрансфузии, гемодиализ назначается только по строгим показаниям, когда риск летальности превышает риск инфицирования гепатитом С. Весь медицинский персонал регулярно оснащается одноразовыми перчатками, специальными средствами обработки приборов и инструментов многоразового пользования.
Специфическая профилактика гепатита С – это строгий контроль донорской крови и выявление возможных вирусоносителей. В многих развитых странах эти меры закреплены в официальных документах органов здравоохранения. Все препараты крови для предотвращения передачи HCV подвергаются обработке с помощью прогревания или методом химического обезвреживания. Также считается эффективным вакцинация вирусоносителей гепатита С прививками от гепатита А и В.
Профилактика гепатита С предполагает тотальное обследование на возможное вирусоносительство людей, входящих в группы риска:
- Лица, поставленные на учет по поводу употребления инъекционных наркотиков.
- ВИЧ-инфицированные больные.
- Пациенты с диагностированной гемофилией.
- Пациенты, проходящие гемодиализ.
- Пациенты, перенесшие трансплантацию органов – до 1992-го года.
- Пациенты, которым была проведена гемотрансфузия (переливание крови) – до 1992-го года.
- Младенцы, мать которых заражена HCV.
- Медицинский персонал, имеющий контакт с кровью.
Также желательно проводить обследование на предмет выявления вируса гепатита С у лиц, имеющих в анамнезе ЗППП – заболевания, передающиеся половым путем.
Вакцинация против гепатита С
К сожалению, вакцины, помогающей предотвратить инфицирование HCV, на сегодняшний день не существует. Вакцинаций против гепатита С – это цель многих сотен ученых, врачей, микробиологов, инфекционистов, упорно работающих над созданием высокоэффективного противовирусного препараты, сыворотки, нацеленной на прерывание мутации конкретных субтипов, нуклеотидных звеньев, повреждающих гепатоциты. Задача разработчиков вакцины – определить и выявить единый белок, который был бы специфичен для всех множественных подвидов гепатита С, как только это произойдет, иммунитет получит возможность вырабатывать нейтрализующие или защитные антитела. Вакцинация против гепатита С помогла бы замедлить нарастающий темп распространенности HCV, в идеале — остановить эпидемию заболевания. По информации ВОЗ в лабораториях европейских стран (Франция, Дания) проводятся испытания экспериментальных образцов вакцины на животных, однако клинического подтверждения эффективности этих препаратов пока нет.

Прогноз
Статистические данные, которые систематически собираются и анализируются в ВОЗ, пока не утешительны. Прогноз гепатита С в цифрах таков:
- Активное, острое течение заболевания – развитие цирроза печени в 20% случаев, из них более 5% заканчиваются карциномой.
- 60-80% из всех инфицированных вирусом гепатита С имеют хроническую форма заболевания.
- 70-75% из всего количества больных имеют патологические изменения структуры и функций печени без малигнизации (развития рака).
- У 20% больных хронической формой HCV развивается цирроз печени.
- 30-35 больных гепатитом С, сопровождающимся циррозом, умирают от рака печени.
- 5% больных хроническим гепатитом С умирают от карциномы.
Прогноз при остром гепатите С существенно улучшился с внедрением противовирусной терапии, своевременное назначение которой позволяет добиться выздоровления у 80-90% больных. В том случае, когда диагностировать острую фазу инфекции не удалось и пациенты не получают противовирусную терапию, прогноз хуже — у 80% больных происходит формирование хронического гепатита С, у 15-20% больных с прогрессирующим течением заболевания возможно формирование цирроза печени в течение 20-30 лет. На фоне цирроза печени с частотой 1-4% в год возникает первичная гепатоцеллюлярная карцинома.

Опубликовано: 16.04.2012 Обновлено: 20.05.2021 Просмотров: 186926

Потребность в интерпретации лабораторных тестов при вирусных гепатитах больше, чем при других инфекционных заболеваниях, потому что многочисленные тесты, назначаемые при подозрении на вирусный гепатит, предназначены для решения различных задач.
Врачами СИТИЛАБ подготовлены информационные материалы по лабораторным тестам при вирусных гепатитах в помощь специалистам.
Гепатит А
|
Возбудитель |
Вирус гепатита А (HAV), семейство Picornaviridae, родHepatoviridae. |
|
Эпидемиология |
Распространён по всему миру, самая низкая заболеваемость в Северной и Центральной Европе. |
|
Пути передачи |
Почти всегда фекально-оральным путём через загрязненную пищу. Например, в мидиях вирус может сохраниться в течение многих месяцев. Из-за гигиенических мер профилактики новые случаи инфекции стали редкими в Северной Европе. Встречающиеся случаи — чаще привозные. |
|
Инкубационный период |
2-6 недель. |
|
Клиническая картина |
Всегда острый гепатит, часто проходящий незамеченным у детей, живущих в эндемичных районах. У взрослых течение болезни более тяжёлое, в редких случаях приводит к печеночной недостаточности. Никогда не переходит в хроническую форму и никогда не вызывает цирроз печени. Вирус выделяется с калом. |
|
Группы риска |
Медицинский персонал, сантехники, рабочие водоканала, наркоманы. Жители эндемичных районов, особенно старшего возраста, путешественники. Инфицирование HCV-положительных пациентов вирусом гепатита А может привести к тяжёлой форме заболевания. |
|
Вакцинация |
При активной иммунизации длительно сохраняется иммунитет (10 лет). Иммунизация может быть проведена даже перед поездкой. Возможна также пассивная иммунизация в случае контакта с зараженными людьми. |
Диагностика гепатита А
|
Наименование исследования |
Клиническое значение |
|
42-20-002 — АТ к вирусу гепатита А (anti-HAV) (суммарн.) |
Определяются антитела классов IgG и IgM. Скрининговый тест при подозрении на новую или прошлую инфекцию. В начале заболевания может быть отрицательным. Тест может также использоваться для оценки напряжённости иммунитета перед прививкой. |
|
42-20-001 — АТ к вирусу гепатита АIgM (колич.) |
Положительный в случае новой инфекции. Следует отметить, что тест может быть положительным в течение двух лет после перенесенного гепатита A. Антитела к HAV класса IgM могут быть положительными в течение короткого времени после прививки. В редких случаях, например, инфекция вирусом Эпштейна-Барр, тест может быть сомнительным или слабо положительным. |
|
63-10-001 — Вирус гепатита А (HAV) ПЦР |
При гепатите А РНК вируса может определяться в крови. |
Гепатит В
|
Возбудитель |
Вирус гепатита В (HBV), ДНК-содержащий вирус, семейство Hepadnaviridae, род Orthohepadnaviridae. |
|
Эпидемиология |
Распространён по всему миру, самая высокая заболеваемость в Юго-восточной Азии и Африке. Распространённость в Центральной Европе — 1-2%. В России больны хроническим гепатитом В около 8 млн человек. |
|
Пути передачи |
HBV наиболее часто передается при половых контактах. Возможна вертикальная передача плоду при родах, через кровь от больного (переливание крови, препаратов крови; татуировки; пирсинг; повреждения кожи). HBV может обнаруживаться во всех жидкостях организма. Самая высокая концентрация вируса определяется в крови (до 1000 блн. инфекционных частиц/мл). Попадание в кровь приблизительно 10 вирусов достаточно для инфицирования. |
|
Инкубационный период |
2-3 месяца, в единичных случаях до 1 года. |
|
Клиническая картина |
HBV может вызывать как острый, так и хронический гепатит. Клиническое течение острого гепатита может быть различным от инапарантной формы (носительство) до молниеносного течения. Приблизительно у 10% инфицированных гепатит В протекает в хронической форме, выделяют хроническую инфекцию без клинической активности и хронический гепатит В. Приблизительно у 10% больных хроническим гепатитом В развивается цирроз печени. Кроме того, больные хроническим гепатитом В имеют высокий риск развития гепатоцеллюлярной карциномы. |
|
Группы риска |
Медицинский персонал, лица, перенёсшие переливание крови, реципиенты органов и тканей, диализные больные, лица, имеющие контакты с больными гепатитом В, новорождённые, рожденные от больных матерей, жители домов инвалидов и престарелых. |
|
Вакцинация |
Иммунизация является успешной, если титр антител кHBsAg 100 мМЕ/мл или больше спустя 4-8 недель после третьей прививки. В этом случае иммунитет к заболеванию может сохраняться достаточно долго (по крайней мере, 10 лет). Лицам, у которых после 3-х должным образом проведённых прививок, через 8 недель титр антител к HBsAgне повысился, необходимо провести повторную вакцинацию (другой вакциной или большими дозами). Все новорождённые и подростки между 12 и 14 годами должны быть привиты, так же как и лица, входящие в группу риска. До проведения вакцинации необходимо провести исследование на антитела к HBsAg, если титр антител меньше 10 мМЕ/мл, то необходима срочная вакцинация. |
Диагностика гепатита В
При гепатите В возможно определение антител, антигенов и ДНК вируса.
|
Наименование исследования |
Клиническое значение |
|
42-20-010 — Антиген «s» вируса гепатита В (HBsAg) |
Поверхностный белок вируса гепатита В, обнаруживается в сыворотке в трех различных формах: на поверхности неповрежденных инфекционных частиц, или как свободный протеин (нитевидный или сферический). Основной маркер острого и хронического гепатита В. В большинстве случаев HBsAg обнаруживается уже в инкубационном периоде и при остром течении гепатита выявляется в крови в течение 5-6 месяцев. Обнаружение поверхностного антигена вируса гепатита В дольше 6 месяцев после начала заболевания свидетельствует о возможной хронизации процесса. Возможно пожизненное носительство HBsAg. Из-за наличия различных форм HBsAg в сыворотке, при его обнаружении невозможно дифференцировать заболевание и HBsAg-носительство. Для этого необходимо провести дополнительные исследования (определение ДНК вируса гепатита В, HBeAg и антител к HBeAg). |
|
42-20-016 — Подтверждающий тест на антиген «s» вируса гепатита В (HBsAg) |
Методы иммуноферментного анализа, применяемые для определения HBsAg в сыворотке крови, являются скрининговыми и в очень редких случаях могут давать ложноположительные результаты. Поэтому в случае получения положительного результата для подтверждения его специфичности специалисты лаборатории ставят подтверждающий тест — повторное исследование сыворотки крови пациента с иммуноингибированием и разведением. Исследование проводится для подтверждения положительного результата исследования на HBsAg. |
|
42-20-011 — АТ к антигену «s» вируса гепатита В (anti-HBsAg) (колич.) |
Показатель наличия иммунитета к вирусу гепатита В, проводится перед вакцинацией и через 4-8 недель после вакцинации для контроля за эффективностью вакцинации. |
|
42-20-013 — АТ к сердцевине вируса гепатита В (anti-HBc) IgM |
Антитела к HBcAg класса IgM выявляются в сыворотке при остром гепатите и реактивации хронического гепатита. При молниеносной форме течения заболевания только этот тест может давать положительный результат. |
|
42-20-012 — АТ к сердцевине вируса гепатита В (anti-HBc) IgG |
Определение антител к НBcAg класса IgG применяют в целях диагностики текущего или перенесенного в прошлом гепатита В. Однако наличие антител не дает возможности дифференцировать острую, хроническую или перенесенную в прошлом инфекцию. |
|
42-20-014 — Антиген «e» вируса гепатита В (HBeAg) |
HBeAg — маркер активной репликации вируса гепатита B. HBеAg является продуктом распада сердцевинного антигена вируса гепатита В (НBсAg). |
|
42-20-015 — АТ к антигену «e» вируса гепатита В (anti-HBeAg) |
Является показателем начала сероконверсии, свидетельствует о прекращении репликации вируса. Однако обнаружение антител к HBeAg не всегда является показателем отсутствия инфекционности. Иногда возможно появление мутантной, дефектной HBeAg-отрицательной формы вируса, то есть вирус данный антиген синтезировать не способен или синтезирует в малых количествах, при этом, хотя в крови обнаруживаются антитела к HBeAg, высокая репликативная активность вируса сохраняется. |
|
63-10-003 — Вирус гепатита В качественно (ПЦР) |
Определяется ДНК вируса гепатита В в крови. При положительном результате исследования необходимо провести количественное исследование. |
|
63-10-004 — Вирус гепатита В количественно (ПЦР) |
Определяется количество копий ДНК вируса гепатита B в 1 мл крови (вирусная нагрузка). Исследование проводится для контроля за эффективностью лечения. |
Гепатит С
|
Возбудитель |
РНК-содержащий вирус, семейство Flaviviridae. В настоящее время выделяют 8 генотипов (1-7, 10) с многочисленными подгруппами. |
|
Эпидемиология |
Распространён повсеместно, наиболее высокая заболеваемость в Южной Азии, Египте и Центральной Африке. По данным Robert-Koch-Institute (RKI). гепатит С является причиной 20% острых гепатитов, больше чем 40 % всех случаев цирроза печени, 70-85% хронических гепатитов и 60% всех опухолей печени. |
|
Пути передачи |
Как и при гепатите В, заражение происходит при переливании крови и продуктов крови. Передача инфекции половым путём не играет значительной роли; перинатальная передача низка (4%). Возможно заражение при инъекциях, аутогемотерапии, через инструменты стоматолога, при эндоскопии. |
|
Инкубационный период |
6-12 недель, иногда до 1 года. |
|
Клиническая картина |
Острый гепатит С часто имеет умеренное клиническое течение и остается незамеченным, у 85% заболевших развивается хронический гепатит и у 20% больных хроническим гепатитом развивается цирроз печени. Характерной особенностью клинического течения заболевания является небольшое увеличение активности трансаминаз, которое часто не связывают с возможностью вирусного гепатита. Это приводит к поздней диагностике заболевания. |
|
Группы риска |
Медицинский персонал, лица после переливания крови, диализные пациенты, дети, рождённые от матерей, больных гепатитом С. |
|
Вакцинация |
В настоящее время вакцин нет. |
Диагностика гепатита С
|
Наименование исследования |
Клиническое значение |
|
42-20-020 — АТ к вирусу гепатита С (anti-HCV) (суммарн.) |
Антитела к HCV обычно определяются спустя 6-8 недель после инфицирования. В единичных случаях позже. Отрицательный результат не исключает недавно приобретенную инфекцию HCV. Положительный результат может свидетельствовать об остром или хроническом гепатите С. Данное исследование не позволяет различить острый и хронический гепатит, а также стадию выздоровления после гепатита С. Антитела к HCV необходимо определять у всех пациентов с незначительным повышением активности трансаминаз и у людей, относящихся к группе риска. |
|
48-20-335 — Подтверждающий тест на антитела к вирусу гепатита С |
Определение суммарных антител к вирусу гепатита С является скрининговым тестом для диагностики заболевания. В случае получения положительного результата для подтверждения его специфичности используют подтверждающий тест — определение широкого спектра антител к белкам специфичным для вируса гепатита С (сore, NS1 NS2, NS3, NS4, NS5) в сыворотке крови больного. Исследование считается положительным, если выявляются антитела к 2 или более белкам вируса гепатита С. Подтверждающий тест на антитела к вирусу гепатита С используют для подтверждения специфичности скринингового метода. |
|
42-20-021 — АТ к вирусу гепатита С (anti-HCV) IgM |
Положительный результат может свидетельствовать об остром гепатите С или обострении хронического гепатита С. Отрицательный результат свидетельствует о том, что гепатит С не выявлен (при отрицательном результате исследования суммарных антител к гепатиту С), или у пациента хронический гепатит С вне обострения (при положительном результате исследования суммарных антител). |
|
63-10-006 — Вирус гепатита С (HCV) качественно (ПЦР) |
Определяется РНК вируса гепатита С в крови. Положительный результат свидетельствует о репликации вируса. При положительном результате должно проводиться количественное исследование, чтобы определить степень виремии. Метод выбора — так называемый «Real time» ПЦР. РНК вируса необходимо определять в случае положительного результата исследования на антитела, кроме того, и при отрицательном результате, если подозревается гепатит С (особенно в случае диализных пациентов). Исследование на РНК вируса гепатита С показано для новорожденных, рождённых от матерей больных гепатитом С. Так как у новорожденных в крови могут определяться материнские антитела, по этой причине обнаружение антител к HCV не может использоваться у этой категории пациентов. |
|
63-10-007 — Вирус гепатита С (HCV) количественно (ПЦР) |
Исследование проводится для определения вирусной нагрузки. |
|
63-10-009 — Вирус гепатита С (HCV) (типирование, 5 типов) |
Определяется генотип вируса для выбора схемы лечения. В настоящее время в лабораторной практике определяется 5 генотипов. |
Гепатит D
|
Возбудитель |
Дефектный РНК-содержащий вирус. Для репликации необходим вирус гепатита В. Обнаруживается только у лиц, инфицированных вирусом гепатита В. |
|
Эпидемиология |
Низкий уровень заболеваемости в Северной Европе; более высокий в Средиземноморских странах и в странах Черноморского региона; высокая заболеваемость в Центральной Африке и Южной Америке. |
|
Пути передачи |
Как и гепатит B, парентеральным путем, при переливании зараженной крови или при сексуальных контактах. |
|
Инкубационный период |
Несколько недель или месяцев. |
|
Клиническая картина |
В случае коинфекции (одновременное заражение гепатитом B и гепатитом D) — острый гепатит с очень тяжёлым клиническим течением, часто наблюдается высокая смертность. В случае суперинфекции (заражение вирусом гепатита D HBV-положительных пациентов) развивается хронический гепатит с более тяжёлым течением, чем просто хронический гепатит B. |
|
Группы риска |
Такие же, как и для гепатита B, и лица, проживающие в эндемичных областях. |
|
Вакцинация |
В настоящее время вакцин против гепатита D нет, но иммунизация против гепатита B защищает от инфицирования. |
Диагностика гепатита D
|
Наименование исследования |
Клиническое значение |
|
42-20-031 — АТ к вирусу гепатита D IgM |
Антитела к вирусу гепатита D класса IgМ появляются в острый период «дельта-инфекции» (со 2-й недели). Антитела IgМ свидетельствуют об активной репликации вируса. Положительный результат исследования свидетельствует об остром периоде вирусного гепатита D, ранней стадии реконвалесценции, или персистирующем вирусном гепатите D. Отрицательный результат — отсутствие антител класса IgM к вирусу гепатита D. |
|
42-20-030 — АТ к вирусу гепатита D (anti-HDV) (суммарн.) |
Определяются IgG и IgM антитела. Скрининговое исследование назначается, если подозревается новая или хроническая инфекция. Антитела к HDV обнаруживаются спустя 1-2 недели после появления клинических признаков заболевания. |
|
63-10-015 — Вирус гепатита D (HDV) (ПЦР) |
РНК к вирусу гепатита D обнаруживается в крови при появлении клинических признаков заболевания. Как правило, результат исследования на ДНК вируса гепатита В в этот период отрицательный. |
Гепатит Е
|
Возбудитель |
РНК-содержащий вирус семейства Caliciviridae. |
|
Эпидемиология |
Высокая заболеваемость встречается в Центральной Америке, Южной Азии и в некоторых регионах Африки. |
|
Пути передачи |
Как и у гепатита А — фекально-оральный. |
|
Инкубационный период |
4-6 недель. |
|
Клиническая картина |
Острый гепатит, который никогда не переходит в хроническую форму. У беременных женщин может развиться тяжёлый гепатит с молниеносной формой клинического течения с высокой летальностью. |
|
Группы риска |
Жители эндемичных районов, путешественники. |
|
Вакцинация |
Вакцин в настоящее время нет. |
Диагностика гепатита Е
|
Наименование исследования |
Клиническое значение |
|
42-20-041 — АТ к вирусу гепатита Е IgM |
Обнаружение антител класса IgM к вирусу гепатита Е свидетельствует об острой стадии гепатита Е. Антитела к вирусу гепатита Е IgM выявляются в крови после появления желтухи. Чувствительность данного исследования, по данным литературы, составляет более 93%. Отрицательный результат исследования не исключает инфицирования вирусом гепатита Е. Показания к назначению исследования: наличие клинической картины заболевания или лабораторных данных (повышение АЛТ, АСТ, билирубина), обследование в эндемичных районах. |
|
42-20-040 — АТ к вирусу гепатита Е IgG |
Антитела класса IgG к вирусу гепатита Е появляются в период разгара заболевания. Антитела класса IgG могут исчезать после перенесенного заболевания в течение 6 месяцев, но у некоторых лиц могут определяться в крови до 6-8 лет и более. Показания к назначению исследования: диагностика гепатита Е, проведение эпидемиологических исследований. |