(Redirected from Cu(OH)2)

|
|

|
|
| Names | |
|---|---|
| IUPAC name
Copper(II) hydroxide |
|
| Other names
Cupric hydroxide |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChemSpider |
|
| ECHA InfoCard | 100.039.817 |
| KEGG |
|
|
PubChem CID |
|
| UNII |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
Cu(OH)2 |
| Molar mass | 97.561 g/mol |
| Appearance | Blue or blue-green solid |
| Density | 3.368 g/cm3, solid |
| Melting point | 80 °C (176 °F; 353 K) approximate, decomposes into CuO |
|
Solubility in water |
negligible |
|
Solubility product (Ksp) |
2.20 x 10−20[1] |
| Solubility | insoluble in ethanol; soluble in NH4OH |
|
Magnetic susceptibility (χ) |
+1170.0·10−6 cm3/mol |
| Thermochemistry | |
|
Std molar |
108 J·mol−1·K−1 |
|
Std enthalpy of |
−450 kJ·mol−1 |
| Hazards | |
| Occupational safety and health (OHS/OSH): | |
|
Main hazards |
Skin, Eye, & Respiratory Irritant |
| NFPA 704 (fire diamond) |
2 0 0 |
| Flash point | Non-flammable |
| Lethal dose or concentration (LD, LC): | |
|
LD50 (median dose) |
1000 mg/kg (oral, rat) |
| NIOSH (US health exposure limits): | |
|
PEL (Permissible) |
TWA 1 mg/m3 (as Cu)[2] |
|
REL (Recommended) |
TWA 1 mg/m3 (as Cu)[2] |
|
IDLH (Immediate danger) |
TWA 100 mg/m3 (as Cu)[2] |
| Safety data sheet (SDS) | SDS |
| Related compounds | |
|
Other anions |
Copper(II) oxide Copper(II) carbonate Copper(II) sulfate Copper(II) chloride |
|
Other cations |
Nickel(II) hydroxide Zinc hydroxide Iron(II) hydroxide Cobalt hydroxide |
|
Related compounds |
Copper(I) oxide Copper(I) chloride |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Copper(II) hydroxide is the hydroxide of copper with the chemical formula of Cu(OH)2. It is a pale greenish blue or bluish green solid. Some forms of copper(II) hydroxide are sold as «stabilized» copper(II) hydroxide, although they likely consist of a mixture of copper(II) carbonate and hydroxide. Cupric hydroxide is a strong base, although its low solubility in water makes this hard to observe directly.
Occurrence[edit]
Copper(II) hydroxide has been known since copper smelting began around 5000 BC although the alchemists were probably the first to manufacture it by mixing solutions of lye (sodium or potassium hydroxide) and blue vitriol (copper(II) sulfate).[3] Sources of both compounds were available in antiquity.
It was produced on an industrial scale during the 17th and 18th centuries for use in pigments such as blue verditer and Bremen green.[4] These pigments were used in ceramics and painting.[5]
Mineral[edit]
The mineral of the formula Cu(OH)2 is called spertiniite. Copper(II) hydroxide is rarely found as an uncombined mineral because it slowly reacts with carbon dioxide from the atmosphere to form a basic copper(II) carbonate. Thus copper slowly acquires a dull green coating in moist air by the reaction:
- 2 Cu(OH)2 + CO2 → Cu2CO3(OH)2 + H2O
The green material is in principle a 1:1 mole mixture of Cu(OH)2 and CuCO3.[6] This patina forms on bronze and other copper alloy statues such as the Statue of Liberty.
Production[edit]
Copper(II) hydroxide can be produced by adding sodium hydroxide to a solution of a soluble copper(II) salt, such as copper(II) sulfate (CuSO4·5H2O):[7]
- 2NaOH + CuSO4·5H2O → Cu(OH)2 + 6H2O + Na2SO4
The precipitate produced in this manner, however, often contains water and an appreciable amount of sodium-containing impurities. Furthermore, this form of copper hydroxide tends to convert to black copper(II) oxide:[8]
- Cu(OH)2 → CuO + H2O
A purer product can be attained if ammonium chloride is added to the solution beforehand to generate ammonia in situ.[9] Alternatively it can be produced in a two-step procedure from copper(II) sulfate via «basic copper sulfate:»[8]
- 4 CuSO4 + 6 NH3 + 6H2O → Cu4SO4(OH)6 + 3 (NH4)2SO4
- Cu4SO4(OH)6 + 2 NaOH → 4 Cu(OH)2 + Na2SO4
Alternatively, copper hydroxide is readily made by electrolysis of water (containing a little electrolyte such as sodium sulfate or magnesium sulfate) with a copper anode:
- Cu + 2OH− → Cu(OH)2 + 2e−
Structure[edit]
The structure of Cu(OH)2 has been determined by X-ray crystallography The copper center is square pyramidal. Four Cu-O distances in the plane range are 1.96 Å, and the axial Cu-O distance is 2.36 Å. The hydroxide ligands in the plane are either doubly bridging or triply bridging.[10]
Reactions[edit]
It is stable to about 100 °C.[7]
Copper(II) hydroxide reacts with a solution of ammonia to form a deep blue solution of tetramminecopper [Cu(NH3)4]2+ complex ion.
Copper(II) hydroxide catalyzes the oxidation of ammonia solutions in presence of dioxygen, giving rise to copper ammine nitrites, such as Cu(NO2)2(NH3)n.[11][12]
Copper(II) hydroxide is mildly amphoteric. It dissolves slightly in concentrated alkali, forming [Cu(OH)4]2−.[13][7]
Reagent for organic chemistry[edit]
Copper(II) hydroxide has a rather specialized role in organic synthesis. Often, when it is utilized for this purpose, it is prepared in situ by mixing a soluble copper(II) salt and potassium hydroxide.
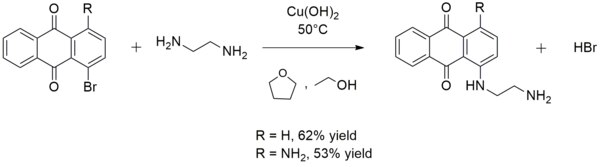
It is sometimes used in the synthesis of aryl amines. For example, copper(II) hydroxide catalyzes the reaction of ethylenediamine with 1-bromoanthraquinone or 1-amino-4-bromoanthraquinone to form 1-((2-aminoethyl)amino)anthraquinone or 1-amino-4-((2-aminoethyl)amino)anthraquinone, respectively:[14]
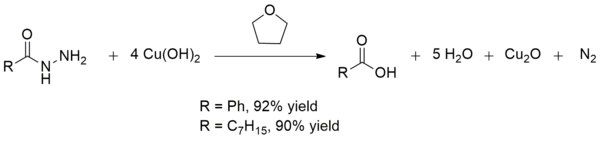
Copper(II) hydroxide also converts acid hydrazides to carboxylic acids at room temperature. This conversion is useful in the synthesis of carboxylic acids in the presence of other fragile functional groups. The yields are generally excellent as is the case with the production of benzoic acid and octanoic acid:[14]
Uses[edit]
Copper(II) hydroxide in ammonia solution, known as Schweizer’s reagent, possesses the interesting ability to dissolve cellulose. This property led to it being used in the production of rayon, a cellulose fiber.
It is also used widely in the aquarium industry for its ability to destroy external parasites in fish, including flukes, marine ich, Brooklynellosis, and marine velvet, without killing the fish. Although other water-soluble copper compounds can be effective in this role, they generally result in high fish mortality.
Copper(II) hydroxide has been used as an alternative to the Bordeaux mixture, a fungicide and nematicide.[15] Such products include Kocide 3000, produced by Kocide L.L.C. Copper(II) hydroxide is also occasionally used as ceramic colorant.
Copper(II) hydroxide has been combined with latex paint, making a product designed to control root growth in potted plants. Secondary and lateral roots thrive and expand, resulting in a dense and healthy root system. It was sold under the name Spin Out, which was first introduced by Griffin L.L.C. The rights are now owned by SePRO Corp.[16] It is now sold as Microkote either in a solution you apply yourself, or as treated pots.
Other copper(II) hydroxides[edit]
Chemical structure of azurite, one of many copper(II) hydroxides (color code: red = O, green = Cu, gray = C, white = H).[17]
Together with other components, copper(II) hydroxides are numerous. Several copper(II)-containing minerals contain hydroxide. Notable examples include azurite, malachite, antlerite, and brochantite. Azurite (2CuCO3·Cu(OH)2) and malachite (CuCO3·Cu(OH)2) are hydroxy-carbonates, whereas antlerite (CuSO4·2Cu(OH)2) and brochantite (CuSO4·3Cu(OH)2) are hydroxy-sulfates.
Many synthetic copper(II) hydroxide derivatives have been investigated.[18]
References[edit]
- ^ Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, ISBN 0-07-049439-8
- ^ a b c NIOSH Pocket Guide to Chemical Hazards. «#0150». National Institute for Occupational Safety and Health (NIOSH).
- ^ Richard Cowen, Essays on Geology, History, and People, Chapter 3: «Fire and Metals: Copper».
- ^ Tony Johansen, Historic Artist’s Pigments Archived 2009-06-09 at the Wayback Machine. PaintMaking.com. 2006.
- ^ Blue verditer Archived 2007-09-27 at the Wayback Machine. Natural Pigments. 2007.
- ^ Masterson, W. L., & Hurley, C. N. (2004). Chemistry: Principles and Reactions, 5th Ed. Thomson Learning, Inc. (p 331)»
- ^ a b c O. Glemser and H. Sauer «Copper(II) Hydroxide» in Handbook of Preparative Inorganic Chemistry, 2nd Ed. Edited by G. Brauer, Academic Press, 1963, NY. Vol. 2. p. 1013.
- ^ a b Solomon, Sally D.; Rutkowsky, Susan A.; Mahon, Megan L.; Halpern, Erica M. (2011). «Synthesis of Copper Pigments, Malachite and Verdigris: Making Tempera Paint». Journal of Chemical Education. 88 (12): 1694–1697. Bibcode:2011JChEd..88.1694S. doi:10.1021/ed200096e.
- ^ Y. Cudennec, A. Lecerf (2003). «The transformation of Cu(OH)2 into CuO, revisited» (PDF). Solid State Sciences. 5 (11–12): 1471–1474. Bibcode:2003SSSci…5.1471C. doi:10.1016/j.solidstatesciences.2003.09.009. S2CID 96363475.
- ^ H. R. Oswald, A. Reller, H. W. Schmalle, E. Dubler (1990). «Structure of Copper(II) Hydroxide, Cu(OH)2«. Acta Crystallogr. C46 (12): 2279–2284. doi:10.1107/S0108270190006230.
{{cite journal}}: CS1 maint: uses authors parameter (link) - ^ Y. Cudennec; et al. (1995). «Etude cinétique de l’oxydation de l’ammoniac en présence d’ions cuivriques». Comptes Rendus de l’Académie des Sciences, Série IIB. 320 (6): 309–316.
- ^ Y. Cudennec; et al. (1993). «Synthesis and study of Cu(NO2)2(NH3)4 and Cu(NO2)2(NH3)2″. European Journal of Solid State and Inorganic Chemistry. 30 (1–2): 77–85.
- ^ Pauling, Linus (1970). General Chemistry. Dover Publications, Inc. (p 702).
- ^ a b Tsuda, T. (2001). «Copper(II) Hydroxide». Encyclopedia of Reagents for Organic Synthesis. doi:10.1002/047084289X.rc228. ISBN 0471936235.
- ^ Bordeaux Mixture. UC IPM online. 2007.
- ^ «SePRO Corporation».
- ^ Zigan, F.; Schuster, H.D. (1972). «Verfeinerung der Struktur von Azurit, Cu3(OH)2(CO3)2, durch Neutronenbeugung». Zeitschrift für Kristallographie, Kristallgeometrie, Kristallphysik, Kristallchemie. 135 (5–6): 416–436. Bibcode:1972ZK….135..416Z. doi:10.1524/zkri.1972.135.5-6.416. S2CID 95738208.
- ^ Kondinski, A.; Monakhov, K. (2017). «Breaking the Gordian Knot in the Structural Chemistry of Polyoxometalates: Copper(II)–Oxo/Hydroxo Clusters». Chemistry: A European Journal. 23 (33): 7841–7852. doi:10.1002/chem.201605876. PMID 28083988.
External links[edit]
- Material Safety Data Sheet
(Redirected from Cu(OH)2)

|
|

|
|
| Names | |
|---|---|
| IUPAC name
Copper(II) hydroxide |
|
| Other names
Cupric hydroxide |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChemSpider |
|
| ECHA InfoCard | 100.039.817 |
| KEGG |
|
|
PubChem CID |
|
| UNII |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
Cu(OH)2 |
| Molar mass | 97.561 g/mol |
| Appearance | Blue or blue-green solid |
| Density | 3.368 g/cm3, solid |
| Melting point | 80 °C (176 °F; 353 K) approximate, decomposes into CuO |
|
Solubility in water |
negligible |
|
Solubility product (Ksp) |
2.20 x 10−20[1] |
| Solubility | insoluble in ethanol; soluble in NH4OH |
|
Magnetic susceptibility (χ) |
+1170.0·10−6 cm3/mol |
| Thermochemistry | |
|
Std molar |
108 J·mol−1·K−1 |
|
Std enthalpy of |
−450 kJ·mol−1 |
| Hazards | |
| Occupational safety and health (OHS/OSH): | |
|
Main hazards |
Skin, Eye, & Respiratory Irritant |
| NFPA 704 (fire diamond) |
2 0 0 |
| Flash point | Non-flammable |
| Lethal dose or concentration (LD, LC): | |
|
LD50 (median dose) |
1000 mg/kg (oral, rat) |
| NIOSH (US health exposure limits): | |
|
PEL (Permissible) |
TWA 1 mg/m3 (as Cu)[2] |
|
REL (Recommended) |
TWA 1 mg/m3 (as Cu)[2] |
|
IDLH (Immediate danger) |
TWA 100 mg/m3 (as Cu)[2] |
| Safety data sheet (SDS) | SDS |
| Related compounds | |
|
Other anions |
Copper(II) oxide Copper(II) carbonate Copper(II) sulfate Copper(II) chloride |
|
Other cations |
Nickel(II) hydroxide Zinc hydroxide Iron(II) hydroxide Cobalt hydroxide |
|
Related compounds |
Copper(I) oxide Copper(I) chloride |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Copper(II) hydroxide is the hydroxide of copper with the chemical formula of Cu(OH)2. It is a pale greenish blue or bluish green solid. Some forms of copper(II) hydroxide are sold as «stabilized» copper(II) hydroxide, although they likely consist of a mixture of copper(II) carbonate and hydroxide. Cupric hydroxide is a strong base, although its low solubility in water makes this hard to observe directly.
Occurrence[edit]
Copper(II) hydroxide has been known since copper smelting began around 5000 BC although the alchemists were probably the first to manufacture it by mixing solutions of lye (sodium or potassium hydroxide) and blue vitriol (copper(II) sulfate).[3] Sources of both compounds were available in antiquity.
It was produced on an industrial scale during the 17th and 18th centuries for use in pigments such as blue verditer and Bremen green.[4] These pigments were used in ceramics and painting.[5]
Mineral[edit]
The mineral of the formula Cu(OH)2 is called spertiniite. Copper(II) hydroxide is rarely found as an uncombined mineral because it slowly reacts with carbon dioxide from the atmosphere to form a basic copper(II) carbonate. Thus copper slowly acquires a dull green coating in moist air by the reaction:
- 2 Cu(OH)2 + CO2 → Cu2CO3(OH)2 + H2O
The green material is in principle a 1:1 mole mixture of Cu(OH)2 and CuCO3.[6] This patina forms on bronze and other copper alloy statues such as the Statue of Liberty.
Production[edit]
Copper(II) hydroxide can be produced by adding sodium hydroxide to a solution of a soluble copper(II) salt, such as copper(II) sulfate (CuSO4·5H2O):[7]
- 2NaOH + CuSO4·5H2O → Cu(OH)2 + 6H2O + Na2SO4
The precipitate produced in this manner, however, often contains water and an appreciable amount of sodium-containing impurities. Furthermore, this form of copper hydroxide tends to convert to black copper(II) oxide:[8]
- Cu(OH)2 → CuO + H2O
A purer product can be attained if ammonium chloride is added to the solution beforehand to generate ammonia in situ.[9] Alternatively it can be produced in a two-step procedure from copper(II) sulfate via «basic copper sulfate:»[8]
- 4 CuSO4 + 6 NH3 + 6H2O → Cu4SO4(OH)6 + 3 (NH4)2SO4
- Cu4SO4(OH)6 + 2 NaOH → 4 Cu(OH)2 + Na2SO4
Alternatively, copper hydroxide is readily made by electrolysis of water (containing a little electrolyte such as sodium sulfate or magnesium sulfate) with a copper anode:
- Cu + 2OH− → Cu(OH)2 + 2e−
Structure[edit]
The structure of Cu(OH)2 has been determined by X-ray crystallography The copper center is square pyramidal. Four Cu-O distances in the plane range are 1.96 Å, and the axial Cu-O distance is 2.36 Å. The hydroxide ligands in the plane are either doubly bridging or triply bridging.[10]
Reactions[edit]
It is stable to about 100 °C.[7]
Copper(II) hydroxide reacts with a solution of ammonia to form a deep blue solution of tetramminecopper [Cu(NH3)4]2+ complex ion.
Copper(II) hydroxide catalyzes the oxidation of ammonia solutions in presence of dioxygen, giving rise to copper ammine nitrites, such as Cu(NO2)2(NH3)n.[11][12]
Copper(II) hydroxide is mildly amphoteric. It dissolves slightly in concentrated alkali, forming [Cu(OH)4]2−.[13][7]
Reagent for organic chemistry[edit]
Copper(II) hydroxide has a rather specialized role in organic synthesis. Often, when it is utilized for this purpose, it is prepared in situ by mixing a soluble copper(II) salt and potassium hydroxide.
It is sometimes used in the synthesis of aryl amines. For example, copper(II) hydroxide catalyzes the reaction of ethylenediamine with 1-bromoanthraquinone or 1-amino-4-bromoanthraquinone to form 1-((2-aminoethyl)amino)anthraquinone or 1-amino-4-((2-aminoethyl)amino)anthraquinone, respectively:[14]
Copper(II) hydroxide also converts acid hydrazides to carboxylic acids at room temperature. This conversion is useful in the synthesis of carboxylic acids in the presence of other fragile functional groups. The yields are generally excellent as is the case with the production of benzoic acid and octanoic acid:[14]
Uses[edit]
Copper(II) hydroxide in ammonia solution, known as Schweizer’s reagent, possesses the interesting ability to dissolve cellulose. This property led to it being used in the production of rayon, a cellulose fiber.
It is also used widely in the aquarium industry for its ability to destroy external parasites in fish, including flukes, marine ich, Brooklynellosis, and marine velvet, without killing the fish. Although other water-soluble copper compounds can be effective in this role, they generally result in high fish mortality.
Copper(II) hydroxide has been used as an alternative to the Bordeaux mixture, a fungicide and nematicide.[15] Such products include Kocide 3000, produced by Kocide L.L.C. Copper(II) hydroxide is also occasionally used as ceramic colorant.
Copper(II) hydroxide has been combined with latex paint, making a product designed to control root growth in potted plants. Secondary and lateral roots thrive and expand, resulting in a dense and healthy root system. It was sold under the name Spin Out, which was first introduced by Griffin L.L.C. The rights are now owned by SePRO Corp.[16] It is now sold as Microkote either in a solution you apply yourself, or as treated pots.
Other copper(II) hydroxides[edit]
Chemical structure of azurite, one of many copper(II) hydroxides (color code: red = O, green = Cu, gray = C, white = H).[17]
Together with other components, copper(II) hydroxides are numerous. Several copper(II)-containing minerals contain hydroxide. Notable examples include azurite, malachite, antlerite, and brochantite. Azurite (2CuCO3·Cu(OH)2) and malachite (CuCO3·Cu(OH)2) are hydroxy-carbonates, whereas antlerite (CuSO4·2Cu(OH)2) and brochantite (CuSO4·3Cu(OH)2) are hydroxy-sulfates.
Many synthetic copper(II) hydroxide derivatives have been investigated.[18]
References[edit]
- ^ Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, ISBN 0-07-049439-8
- ^ a b c NIOSH Pocket Guide to Chemical Hazards. «#0150». National Institute for Occupational Safety and Health (NIOSH).
- ^ Richard Cowen, Essays on Geology, History, and People, Chapter 3: «Fire and Metals: Copper».
- ^ Tony Johansen, Historic Artist’s Pigments Archived 2009-06-09 at the Wayback Machine. PaintMaking.com. 2006.
- ^ Blue verditer Archived 2007-09-27 at the Wayback Machine. Natural Pigments. 2007.
- ^ Masterson, W. L., & Hurley, C. N. (2004). Chemistry: Principles and Reactions, 5th Ed. Thomson Learning, Inc. (p 331)»
- ^ a b c O. Glemser and H. Sauer «Copper(II) Hydroxide» in Handbook of Preparative Inorganic Chemistry, 2nd Ed. Edited by G. Brauer, Academic Press, 1963, NY. Vol. 2. p. 1013.
- ^ a b Solomon, Sally D.; Rutkowsky, Susan A.; Mahon, Megan L.; Halpern, Erica M. (2011). «Synthesis of Copper Pigments, Malachite and Verdigris: Making Tempera Paint». Journal of Chemical Education. 88 (12): 1694–1697. Bibcode:2011JChEd..88.1694S. doi:10.1021/ed200096e.
- ^ Y. Cudennec, A. Lecerf (2003). «The transformation of Cu(OH)2 into CuO, revisited» (PDF). Solid State Sciences. 5 (11–12): 1471–1474. Bibcode:2003SSSci…5.1471C. doi:10.1016/j.solidstatesciences.2003.09.009. S2CID 96363475.
- ^ H. R. Oswald, A. Reller, H. W. Schmalle, E. Dubler (1990). «Structure of Copper(II) Hydroxide, Cu(OH)2«. Acta Crystallogr. C46 (12): 2279–2284. doi:10.1107/S0108270190006230.
{{cite journal}}: CS1 maint: uses authors parameter (link) - ^ Y. Cudennec; et al. (1995). «Etude cinétique de l’oxydation de l’ammoniac en présence d’ions cuivriques». Comptes Rendus de l’Académie des Sciences, Série IIB. 320 (6): 309–316.
- ^ Y. Cudennec; et al. (1993). «Synthesis and study of Cu(NO2)2(NH3)4 and Cu(NO2)2(NH3)2″. European Journal of Solid State and Inorganic Chemistry. 30 (1–2): 77–85.
- ^ Pauling, Linus (1970). General Chemistry. Dover Publications, Inc. (p 702).
- ^ a b Tsuda, T. (2001). «Copper(II) Hydroxide». Encyclopedia of Reagents for Organic Synthesis. doi:10.1002/047084289X.rc228. ISBN 0471936235.
- ^ Bordeaux Mixture. UC IPM online. 2007.
- ^ «SePRO Corporation».
- ^ Zigan, F.; Schuster, H.D. (1972). «Verfeinerung der Struktur von Azurit, Cu3(OH)2(CO3)2, durch Neutronenbeugung». Zeitschrift für Kristallographie, Kristallgeometrie, Kristallphysik, Kristallchemie. 135 (5–6): 416–436. Bibcode:1972ZK….135..416Z. doi:10.1524/zkri.1972.135.5-6.416. S2CID 95738208.
- ^ Kondinski, A.; Monakhov, K. (2017). «Breaking the Gordian Knot in the Structural Chemistry of Polyoxometalates: Copper(II)–Oxo/Hydroxo Clusters». Chemistry: A European Journal. 23 (33): 7841–7852. doi:10.1002/chem.201605876. PMID 28083988.
External links[edit]
- Material Safety Data Sheet
МЕДИ ГИДРОКСИДЫ
- МЕДИ ГИДРОКСИДЫ
- .
Гидроксид меди(II) Сu(ОН)2 -голубое кристаллич. или аморфное в-во; кристаллич. решетка ромбич. (а= 0,2949 нм, b =1,059 нм, с =0,5256 нм, z = 4); плотн. 3,368 г/см 3; C0p 96,2 Дж/(моль.K); DH0 обр -444,4 кДж/моль, DG0 обр -359,4 кДж/моль; S0298 83,7 Дж/(моль. К). Практически не раств. в воде (5.10—4% по массе при 20 °С). При нагр. выше 70-90 °С Сu(ОН)2 или его водных р-ров разлагается до СuО и Н 2 О. С к-тами образует соответствующие соли Cu(II), в водных р-рах щелочей -ярко-синие неустойчивые купраты М 2[Сu(ОН)4], в водных р-рах NH3 — темно-синий аммиакат [Сu(NН 3)4](ОН)2 (т. наз. реактив Швейцера), с H2S — CuS и Н 2 О. При пропускании СО 2 через р-р Сu(ОН)2 получают основные карбонаты Сu. Кристаллич. М. г. получают введением эквивалентного кол-ва NaOH или КОН в аммиачный р-р CuSO4([Cu(NH3)4]SO4) взаимод. кипящего р-ра Cu(NO3)2 с твердым NaOH. При смешении водных р-ров CuSO4 и NaOH образуется некристаллизующийся гель М. г. Применяют в качестве пигмента для стекла, эмалей и глазурей, протравы при крашении, как фунгицид, стабилизатор нейлона, для предотвращения обрастания судов, для приготовления реактива Швейцера (используемого в произ-ве медноаммиачных волокон), для получения солей Сu(II). Гидроксид меди(I) СuОН как индивидуальное соед. не получен. При взаимод. солей Сu(I) с щелочами в р-ре образуется гидратированный оксид Сu2 О.xН 2 О, а из р-ра выделяется только Сu2 О. Однако при растворении Сu2 О в р-рах щелочей образуются комплексные гидроксиды Cu(I) состава М[Сu(ОН)2], где М — щелочной металл. М. г. токсичны. П. М. Чукуров.
Химическая энциклопедия. — М.: Советская энциклопедия.
.
1988.
Полезное
Смотреть что такое «МЕДИ ГИДРОКСИДЫ» в других словарях:
-
Меди гидроксиды — Гидроксиды меди: Гидроксид меди(I) CuOH Гидроксид меди(II) Cu(OH)2 … Википедия
-
Гидроксиды — (гидроокиси) соединения оксидов химических элементов с водой. Известны гидроксиды почти всех химических элементов; некоторые из них встречаются в природе в виде минералов. Гидроксиды щелочных металлов называются щелочами. Классификация В… … Википедия
-
Гидроксид меди(I) — Общие Систематическое наименование Гидроксид меди(I) Традиционные названия гидроокись меди Химическая формула CuOH Физические свойства Состояние ( … Википедия
-
Гидроксиды меди — … Википедия
-
Оксид меди(I) — Оксид меди(I) … Википедия
-
Гидроксид меди(II) — У этого термина существуют и другие значения, см. Гидроксид меди. Гидроксид меди(II) … Википедия
-
Амфотерные гидроксиды — Амфотерные гидроксиды неорганические соединения, гидроксиды амфотерных элементов, в зависимости от условий проявляющие свойства кислотных или основных гидроксидов. Содержание 1 Общие свойства 2 Получение … Википедия
-
Гидроксид меди — Гидроксиды меди название ряда химических соединений меди. Гидроксид меди(II) Cu(OH)2 Гидроксид меди(I) CuOH существование соединения с таким составом является спорным. В реакциях, в которых возможно образование гидроксида меди(I),… … Википедия
-
МЕДЬ — (лат. Cuprum от назв. о. Кипр, где в древности добывали медную руду) Сu, хим. элемент I гр. периодич. системы, ат. н. 29, ат. м. 63,546. Прир. М. состоит из смеси двух стабильных изотопов 63 Сu (69,09%) и 65 Сu (30,91%). Поперечное сечение… … Химическая энциклопедия
-
Основание (химия) — У этого термина существуют и другие значения, см. Основание. Основания класс химических соединений. Основания (основные гидроксиды) сложные вещества, которые состоят из атомов металла или иона аммония и гидроксогруппы ( OH). В водном… … Википедия
Поиск химических веществ по названиям или формулам.
Справочник содержит названия веществ и описания химических формул (в т.ч. структурные формулы и скелетные формулы).
Введите часть названия или формулу для поиска:
Языки:
По умолчанию |
Все возможные |
Из списка
|
Применить к найденному
Гидроксид меди(II)
Брутто-формула:
H2CuO2
CAS# 20427-59-2
Категории:
Гидроксиды
PubChem CID: 164826
| ChemSpider ID: 144498
| CB7455575
Названия
Русский:
- Гидроксид меди(II) [Wiki]
English:
- Bactecide
- Blue Shield
- Blue Shield DF
- Champ
- Champ DP
- Champ Dry Prill
- Champ FormulaII
- Champion 50 WP
- Comac Parasol
- Copper dihydroxide
- Copper monohydroxide
- Copper(2+) hydroxide
- Copper(I) hydroxide
- Copper(II) hydroxide [Wiki]
- Copper(II) hydroxide(Cu(OH)2)
- Copperhydroxide
- Cupravit Blue
- Cupravit blau
- Cupric hydroxide
- Cupric hydroxide(Cu(OH)2)
- Cuprous hydroxide
- Cuzin
- EINECS:243-815-9
- Funguran OH
- GX 306062E
- KOP Hydroxide
- KOP Hydroxide WP
- Kocide
- Kocide 101
- Kocide 101PM
- Kocide 2000
- Kocide 3000
- Kocide Bordeaux
- Kocide DF
- Kocide LF
- Kocide SD
- Kuprablau
- Nu-Cop
- SPU 02310F0OD
- SPU 02540F
- SPU 02690F
- Spin Out FP
- Wetcol
- copper(2+) dihydroxide(IUPAC)
- copper;dihydroxide(IUPAC)
German:
- Blaukupfer
- Kupfer(2+)dihydroxid(IUPAC)
- Kupfer(II)-hydroxid [Wiki]
- Kupferdihydroxid
- Kupferhydroxid
- Kupferoxidhydrat
العربية:
- ماءات النحاس
- هيدروكسيد النحاس الثنائي(IUPAC) [Wiki]
Español:
- Hidróxido cúprico [Wiki]
- Hidróxido de cobre (II)(IUPAC)
French:
- Dihydroxyde de cuivre(2+)(IUPAC)
- Hydroxyde de cuivre(II) [Wiki]
Italiano:
- Comac
- Diidrossido di rame(IUPAC)
- Idrossido di rame(II) [Wiki]
- Idrossido rameico
- Kocide
- Parasol
日本語:
- 水酸化銅(II)(IUPAC) [Wiki]
Português:
- Hidróxido cúprico
- Hidróxido de cobre (II)(IUPAC) [Wiki]
中文:
- 氢氧化铜 [Wiki]
- 氢氧化铜(II)
Варианты формулы:
Cu(OH)2
$L(1.2)H/O^-Cu^++/0O`^-H
HO-Cu-OH
Химический состав
Реакции, в которых участвует Гидроксид меди(II)
-
2Cu(OH)2 + K2S2O6(O2) + 2KOH -> Cu2O3 + 2K2SO4 + 3H2O
-
{M}(OH)2 + H2{X} = {M}{X} + 2H2O
, где M =
Mg Ca Ba Sr Cu Zn; X =
SO4 SO3 CO3 -
Cu(OH)2 «T»-> CuO + H2O
-
{M}{X}2 + 2{R}OH -> {M}(OH)2″|v» + 2{R}{X}
, где M =
Cu Cd Cr; X =
Cl F Br I; R =
Li Na K Rb Cs -
HCOH + 4Cu(OH)2 -> CO2 + 2Cu2O + 5H2O
И ещё 8 реакций…
 |
|
 |
|
| Имена | |
|---|---|
| Название IUPAC Медь (II) гидроксид | |
| Другие названия Гидроксид меди | |
| Идентификаторы | |
| Номер CAS |
|
| 3D-модель (JSmol ) |
|
| ChemSpider |
|
| ECHA InfoCard | 100.039.817 |
| KEGG |
|
| PubChem CID |
|
| UNII |
|
| CompTox Dashboard (EPA ) |
|
InChI
|
|
УЛЫБКА
|
|
| Свойства | |
| Химическая формула | Cu (OH) 2 |
| Молярная масса | 97,561 г / моль |
| Внешний вид | Синее или сине-зеленое твердое вещество |
| Плотность | 3,368 г / см, твердое вещество |
| Температура плавления | 80 ° C (176 ° F; 353 K) (разлагается на CuO ) |
| Растворимость в вода | незначительно |
| произведение растворимости (Ksp) | 2,20 x 10 |
| Solubi лити | не растворим в этаноле ;. растворим в NH4OH |
| Магнитная восприимчивость (χ) | + 1170,0 · 10 см / моль |
| Термохимия | |
| Стандартная молярная. энтропия (S 298) | 108 Дж · моль · K |
| Стандартная энтальпия образования. (ΔfH298) | −450 кДж · моль |
| Опасности | |
| Основные опасности | Кожа, глаза и дыхательные пути Раздражающий |
| Паспорт безопасности | http://www.sciencelab.com/xMSDS-Cupric_Hydroxide-9923594 |
| NFPA 704 (огненный алмаз) |  0 2 0 0 2 0 |
| Температура вспышки | Не- легковоспламеняющийся |
| Смертельная доза или концентрация (LD, LC): | |
| LD50(средняя доза ) | 1000 мг / кг (перорально, крыса) |
| NIOSH (пределы воздействия на здоровье в США): | |
| PEL (Допустимо) | TWA 1 мг / м (для Cu) |
| REL (Рекомендуется) | TWA 1 мг / м (для Cu) |
| IDLH ( Непосредственная опасность) | TWA 100 мг / м (в виде Cu) |
| Родственные соединения | |
| Другие анионы | Оксид меди (II). Карбонат меди (II). Медь (II) сульфат. хлорид меди (II) |
| Другие катионы | гидроксид никеля (II). гидроксид цинка. гидроксид железа (II). гидроксид кобальта |
| родственные соединения | С Оксид оппера (I). Хлорид меди (I) |
| Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки в информационном окне | |
Гидроксид меди (II) — это гидроксид из меди с химическая формула Cu (OH) 2. Это бледно-зеленовато-синее или голубовато-зеленое твердое вещество. Некоторые формы гидроксида меди (II) продаются как «стабилизированный» гидроксид меди (II), хотя они, вероятно, состоят из смеси карбоната меди (II) и гидроксида. Гидроксид меди — слабое основание.
Содержание
- 1 Происхождение
- 1.1 Лабораторный синтез
- 1.2 Минерал
- 2 Структура
- 3 Реакции
- 3.1 Реагент для органической химии
- 4 Использует
- 5 Другая медь ( II) гидроксиды
- 6 Ссылки
- 7 Внешние ссылки
Возникновение
Гидроксид меди (II) известен с тех пор, как плавление меди началось около 5000 г. до н.э., хотя алхимики, вероятно, были первыми, кто изготовил его, смешав растворы щелока (гидроксид натрия или калия) и медного купороса (сульфата меди (II)). Источники обоих соединений были доступны еще в древности.
Он производился в промышленных масштабах в 17-18 веках для использования в пигментах, таких как синий вердитер и бременский зеленый. Эти пигменты использовались в керамике и окраске.
Лабораторный синтез
Гидроксид меди (II) может быть получен добавлением гидроксида натрия к разбавленному раствору. раствор сульфата меди (II) (CuSO 4 · 5H 2 O). Однако полученный таким образом осадок часто содержит воду и заметное количество примеси гидроксида натрия. Более чистый продукт может быть получен, если к раствору заранее добавить хлорид аммония. В качестве альтернативы гидроксид меди легко получить электролизом воды (содержащей небольшое количество электролита, такого как сульфат натрия или сульфат магния ) с медь анод.
Минерал
Минерал формулы Cu (OH) 2 называется спертиниит. Гидроксид меди (II) редко встречается как несвязанный минерал, потому что он медленно реагирует с диоксидом углерода из атмосферы с образованием основного карбоната меди (II). Таким образом, медь медленно приобретает матово-зеленый налет во влажном воздухе по реакции:
- 2 Cu (OH) 2 + CO 2 → Cu 2CO3(OH) 2 + H 2O
Необработанный материал в принципе представляет собой мольную смесь 1: 1 Cu (OH) 2 и CuCO 3. Эта патина образует бронзу и другие статуи из медного сплава, такие как Статуя Свободы.
Структура
Структура Cu (OH) 2 определено с помощью рентгеновской кристаллографии. Медный центр имеет квадратно-пирамидальную форму. Четыре расстояния Cu-O в плоскости составляют 1,96 Å, а аксиальное расстояние Cu-O составляет 2,36 Å. Гидроксидные лиганды в плоскости являются либо дважды мостиковыми, либо тройными мостиковыми.
Реакциями
Он стабилен примерно до 100 ° C.
Медь ( II) гидроксид реагирует с раствором аммиака с образованием темно-синего раствора тетрамминмеди [Cu (NH 3)4]комплексный ион. Он катализирует окисление растворов аммиака в присутствие дикислорода, приводящего к образованию нитритов аммиака меди, таких как Cu (NO 2)2(NH 3)n.
Гидроксид меди (II) слабо амфотерный. Он слегка растворяется в концентрированной щелочи, образуя [Cu (OH) 4].
.
Реагент для органической химии
Гидроксид меди (II) играет довольно специализированную роль в органическом синтезе. Часто, когда он используется для этой цели, его получают in situ путем смешивания растворимой соли меди (II) и гидроксида калия.
. Иногда его используют в синтезе арил аминов. Например, гидроксид меди (II) катализирует реакцию этилендиамина с 1-бромо антрахинон или 1-амино-4-бромантрахинон с образованием 1 — ((2-аминоэтил) амино) антрахинона или 1-амино-4 — ((2-аминоэтил) амино) антрахинона соответственно:
гидроксид меди (II) превращает кислоты гидразиды в карбоновые кислоты при комнатной температуре. Это превращение полезно при синтезе карбоновых кислот в присутствии других хрупких функциональных групп. Выходы обычно превосходны, как в случае с производством бензойной кислоты и октановой кислоты :
. Используется
гидроксид меди (II) в растворе аммиака, известный как Реагент Швейцера обладает интересной способностью растворять целлюлозу. Это свойство привело к его использованию в производстве вискозы, целлюлозного волокна.
. Оно также широко используется в аквариумной промышленности благодаря своей способности уничтожать внешних паразитов у рыб, включая сосальщиков, морской их, ручей и морской бархат, не убивая рыбу. Хотя другие водорастворимые соединения меди могут быть эффективными в этой роли, они обычно приводят к высокой смертности рыб.
Гидроксид меди (II) использовали в качестве альтернативы бордоской смеси, фунгициду и нематициду. К таким продуктам относится Kocide 3000, производимый Kocide L.L.C. Гидроксид меди (II) также иногда используется в качестве керамического красителя..
Гидроксид меди (II) объединяют с латексной краской, создавая продукт, предназначенный для контроля роста корней у горшечных растений. Вторичные и боковые корни разрастаются и разрастаются, в результате чего корневая система становится плотной и здоровой. Он продавался под названием Spin Out, которое впервые было представлено Griffin L.L.C. Теперь права принадлежат SePRO Corp. Теперь он продается как Microkote либо в растворе, который вы применяете самостоятельно, либо в виде обработанных горшков.
Другие гидроксиды меди (II)

Вместе с другими компонентами гидроксиды меди (II) многочисленны. Некоторые содержащие медь (II) минералы содержат гидроксид. Известные примеры включают азурит, малахит, антлерит и брошантит. Азурит (2CuCO 3 · Cu (OH) 2) и малахит (CuCO 3 · Cu (OH) 2) являются гидрокси- карбонаты, тогда как антлерит (CuSO 4 · 2Cu (OH) 2) и брошантит (CuSO 4 · 3Cu (OH) 2) представляют собой гидрокси- сульфаты.
Многие синтетические производные гидроксида меди (II) были исследованы.
Ссылки
Внешние ссылки
- Паспортом безопасности материала
Содержание
- Получение
- Химические свойства
- Токсичность
Гидроксид меди(II) — Cu(ОН)2, голубое аморфное или кристаллическое вещество. Кристаллы образуют решётку ромбической сингонии, параметры ячейки a = 0, 2949 нм, b = 1, 059 нм, c = 0, 5256 нм, Z = 4. Cu(ОН)2 практически не растворим в воде. При нагревании до 70—90 °C порошка Cu(ОН)2 или его водных суспензий разлагается до CuО и Н2О.
| Гидроксид меди(II) | |
|---|---|
| Общие | |
| Хим. формула | Cu(OH)2 |
| Физические свойства | |
| Состояние | синие кристаллы |
| Молярная масса | 97,561 г/моль |
| Плотность | 3,37 г/см³ |
| Термические свойства | |
| Температура | |
| • разложения | >70 °C |
| Энтальпия | |
| • образования | -444,4 кДж/моль |
| Классификация | |
| Рег. номер CAS | [20427-59-2] |
| PubChem | 164826 |
| Рег. номер EINECS | 243-815-9 |
| SMILES |
[OH-].[OH-].[Cu+2] |
| InChI |
1S/Cu.2H2O/h;2*1H2/q+2;;/p-2 JJLJMEJHUUYSSY-UHFFFAOYSA-L |
| ChEBI | 81907 |
| ChemSpider | 144498 и 21171179 |
| Безопасность | |
| ЛД50 | 1000 мг/кг (крыса, орально), кожа, глаза, дыхательные пути |
| NFPA 704 |
Получение
В лаборатории получают действием на холоде растворимых гидроксидов, кроме NH4OH, на растворимые соли меди, например:
Химические свойства
Является амфотерным гидроксидом. Реагирует с кислотами с образованием воды и соответствующей соли меди:
С разбавленными растворами щелочей не реагирует, в концентрированных растворяется, образуя ярко-синие тетрагидроксокупраты(II):
Как и все нерастворимые основания, гидроксид меди(II) при нагревании разлагается на оксид и воду, в данном случае образуется оксид меди(II):
При длительном стоянии на воздухе, обогащённом кислородом, гидроксид меди(II) вступает в обратимую реакцию с кислородом, образуя грязно-красный оксид меди(III):
Равновесие в этой реакции сдвинуто влево.
При избытке влаги может образоваться гидроксид куприла(III):
Очень легко растворяется в избытке аммиака с образованием дигидроксотетрааммиаката меди:
или
Аммиакат меди имеет интенсивный сине-фиолетовый цвет, поэтому его используют в аналитической химии для определения малых количеств ионов Cu2+ в растворе.
Токсичность
Как и большинство соединений меди, гидроксид меди (II) токсичен, но токсичность невысокая из-за нерастворимости.
| Гидроксид меди (II) | |
|---|---|
 |
|
| Хим. формула | Cu(OH)2 |
| Состояние | синие кристаллы |
| Молярная масса | 97,561 г/моль |
| Плотность | 3,37 г/см³ |
| Температура | |
| • разложения | >70 °C |
| Энтальпия | |
| • образования | -444,4 кДж/моль |
| Рег. номер CAS | [20427-59-2] |
| PubChem | 164826 |
| Рег. номер EINECS | 243-815-9 |
| SMILES |
[OH-].[OH-].[Cu+2] |
| InChI |
1S/Cu.2H2O/h;2*1H2/q+2;;/p-2 JJLJMEJHUUYSSY-UHFFFAOYSA-L |
| ChEBI | 81907 |
| ChemSpider | 144498 и 21171179 |
| ЛД50 | 1000 мг/кг (крыса, орально), кожа, глаза, дыхательные пути |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Гидроксид меди (II) — Cu(ОН)2, голубое аморфное или кристаллическое вещество. Кристаллы образуют решётку ромбической сингонии, параметры ячейки a = 0,2949 нм, b = 1,059 нм, c = 0,5256 нм, Z = 4. Cu(ОН)2 практически не растворим в воде. При нагревании до 70—90 °C порошка Cu(ОН)2 или его водных суспензий разлагается до CuО и H2O.
Получение
В лаборатории получают действием на холоде растворимых гидроксидов, кроме NH4OH, на растворимые соли меди, например:
-
- Cu(NO3)2 + 2NaOH → Cu(OH)2↓ + 2NaNO3
- CuSO4 + 2KOH → Cu(OH)2↓ + K2SO4
Химические свойства
Является амфотерным гидроксидом. Реагирует с кислотами с образованием воды и соответствующей соли меди:
-
- Cu(OH)2 + H2SO4 → CuSO4 + 2H2O
С разбавленными растворами щелочей не реагирует, в концентрированных растворяется, образуя ярко-синие тетрагидроксокупраты (II):
-
- Cu(OH)2 + 2NaOH → Na2[Cu(OH)4]
Как и все нерастворимые основания, гидроксид меди (II) при нагревании разлагается на оксид и воду, в данном случае образуется оксид меди (II):
-
- Cu(OH)2 →to CuO + H2O
При длительном стоянии на воздухе, обогащённом кислородом, гидроксид меди (II) вступает в обратимую реакцию с кислородом, образуя грязно-красный оксид меди (III):
-
- 4Cu(OH)2 + O2 ⇄ 2Cu2O3↓ + 2H2O
Равновесие в этой реакции сдвинуто влево.
При избытке влаги может образоваться гидроксид куприла (III):
-
- 4Cu(OH)2 + O2 → 4CuO(OH)↓ + H2O
Очень легко растворяется в избытке аммиака с образованием дигидроксотетрааммиаката меди:
-
- Cu(OH)2 + 4NH3 ⋅ H2O → [Cu(NH3)4](OH)2 + 4H2O
или
-
- Cu(OH)2 + 4NH3 → [Cu(NH3)4](OH)2
Аммиакат меди имеет интенсивный сине-фиолетовый цвет, поэтому его используют в аналитической химии для определения малых количеств ионов Cu2+ в растворе.
Токсичность
Как и большинство соединений меди, гидроксид меди (II) токсичен, но токсичность невысокая.
Что мы делаем. Каждая страница проходит через несколько сотен совершенствующих техник. Совершенно та же Википедия. Только лучше.
Из Википедии — свободной энциклопедии
У этого термина существуют и другие значения, см. Гидроксид меди.
Гидрокси́д ме́ди(II) (химическая формула — Cu(OН)2) — слабое нерастворимое неорганическое основание.
При стандартных условиях, гидроксид меди(II) — это голубое аморфное или кристаллическое вещество.
Физические свойства
Кристаллы образуют решётку ромбической сингонии, параметры ячейки a = 0,2949 нм, b = 1,059 нм, c = 0,5256 нм, Z = 4. Гидроксид меди практически не растворим в воде[1]. При нагревании до 70—90 °C порошка Cu(ОН)2 или его водных суспензий разлагается до оксида меди(II) и воды.
Химические свойства

Гидроксид меди(II)
Относится к классу амфотерных гидроксидов.
1) Взаимодействие с кислотами с образованием воды и соответствующей соли меди:
2) С разбавленными растворами щелочей не реагирует, а в концентрированных растворяется, образуя ярко-синие тетрагидроксокупраты(II):
3) Как и все нерастворимые основания, гидроксид меди(II) при нагревании разлагается на оксид и воду, в данном случае образуется чёрный оксид меди(II)[2]:
4) При длительном стоянии на воздухе, обогащённом кислородом, гидроксид меди(II) вступает в обратимую реакцию с кислородом, образуя грязно-красную смесь оксидов Cu(II) и Cu(III):
Равновесие в данной реакции сдвинуто влево.
При избытке влаги может образоваться гидроксид куприла(III):
Очень легко растворяется в избытке аммиака с образованием дигидроксотетрааммиаката меди:
или
Аммиакат меди имеет интенсивный сине-фиолетовый цвет, поэтому его используют в аналитической химии для определения малых количеств ионов Cu2+ в растворе.
Получение
Лабораторные способы получения: действие на холоде растворимых гидроксидов (кроме гидроксида аммония), на растворимые соли меди, например:
Токсичность
Гидроксид меди (II) малотоксичен вследствие низкой растворимости в воде.
Примечания
- ↑ Демонстрация нерастворимости (недоступная ссылка) (видео)
- ↑ Химические свойства нерастворимых оснований Архивная копия от 14 июля 2014 на Wayback Machine — видеоопыт в Единой коллекции цифровых образовательных ресурсов
Эта страница в последний раз была отредактирована 18 декабря 2022 в 16:32.
Как только страница обновилась в Википедии она обновляется в Вики 2.
Обычно почти сразу, изредка в течении часа.



![{mathsf {Cu(OH)_{2}+2NaOH{xrightarrow {}} Na_{2}[Cu(OH)_{4}]}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/cc900381969d06779ed722f6966505fe9f688b86)



_{2}+4H_{2}O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6f4032f46b43e39e9873bf892de04a5e1d8a9c2e)
_{2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ad0bd39ddab12b7b7c6083982d54f572e6da6ff9)


