
|
|

|
|
| Names | |
|---|---|
| Other names
Barium muriate |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChemSpider |
|
| ECHA InfoCard | 100.030.704 |
| EC Number |
|
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
| UN number | 1564 |
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
BaCl2 |
| Molar mass | 208.23 g/mol (anhydrous) 244.26 g/mol (dihydrate) |
| Appearance | White solid |
| Odor | Odourless |
| Density | 3.856 g/cm3 (anhydrous) 3.0979 g/cm3 (dihydrate) |
| Melting point | 962 °C (1,764 °F; 1,235 K) (960 °C, dihydrate) |
| Boiling point | 1,560 °C (2,840 °F; 1,830 K) |
|
Solubility in water |
31.2 g/100 mL (0 °C) 35.8 g/100 mL (20 °C) 59.4 g/100 mL (100 °C) |
| Solubility | soluble in methanol, insoluble in ethanol, ethyl acetate[2] |
|
Magnetic susceptibility (χ) |
−72.6×10−6 cm3/mol |
| Structure | |
|
Crystal structure |
orthogonal (anhydrous) monoclinic (dihydrate) |
|
Coordination geometry |
7–9 |
| Thermochemistry | |
|
Std molar |
123.9 J/(k mol) |
|
Std enthalpy of |
−858.56 kJ/mol |
| Hazards | |
| Occupational safety and health (OHS/OSH): | |
|
Main hazards |
Highly toxic, corrosive |
| GHS labelling: | |
|
Pictograms |

|
|
Signal word |
Danger |
|
Hazard statements |
H301, H302, H332 |
|
Precautionary statements |
P261, P264, P270, P271, P301+P310, P304+P312, P304+P340, P312, P321, P330, P405, P501 |
| NFPA 704 (fire diamond) |
3 0 0 |
| Flash point | Non-flammable |
| Lethal dose or concentration (LD, LC): | |
|
LD50 (median dose) |
78 mg/kg (rat, oral) 50 mg/kg (guinea pig, oral)[4] |
|
LDLo (lowest published) |
112 mg Ba/kg (rabbit, oral) 59 mg Ba/kg (dog, oral) 46 mg Ba/kg (mouse, oral)[4] |
| NIOSH (US health exposure limits): | |
|
PEL (Permissible) |
TWA 0.5 mg/m3[3] |
|
REL (Recommended) |
TWA 0.5 mg/m3[3] |
|
IDLH (Immediate danger) |
50 mg/m3[3] |
| Safety data sheet (SDS) | NIH BaCl |
| Related compounds | |
|
Other anions |
Barium fluoride Barium bromide Barium iodide |
|
Other cations |
Beryllium chloride Magnesium chloride Calcium chloride Strontium chloride Radium chloride Lead chloride |
| Supplementary data page | |
| Barium chloride (data page) | |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Barium chloride is an inorganic compound with the formula BaCl2. It is one of the most common water-soluble salts of barium. Like most other water-soluble barium salts, it is white, highly toxic, and imparts a yellow-green coloration to a flame. It is also hygroscopic, converting first to the dihydrate BaCl2(H2O)2. It has limited use in the laboratory and industry.[5]
Structure and properties[edit]
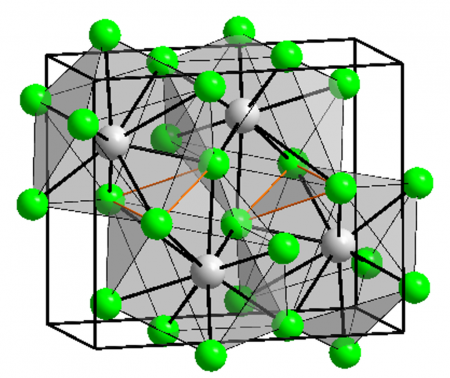
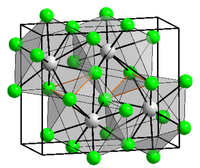
BaCl2 crystallizes in two forms (polymorphs). One form has the cubic fluorite (CaF2) structure and the other the orthorhombic cotunnite (PbCl2) structure. Both polymorphs accommodate the preference of the large Ba2+ ion for coordination numbers greater than six.[6] The coordination of Ba2+ is 8 in the fluorite structure[7] and 9 in the cotunnite structure.[8] When cotunnite-structure BaCl2 is subjected to pressures of 7–10 GPa, it transforms to a third structure, a monoclinic post-cotunnite phase. The coordination number of Ba2+ increases from 9 to 10.[9]
In aqueous solution BaCl2 behaves as a simple salt; in water it is a 1:2 electrolyte and the solution exhibits a neutral pH. Its solutions react with sulfate ion to produce a thick white precipitate of barium sulfate.
- Ba2+ + SO2−
4 → BaSO4
Oxalate effects a similar reaction:
- Ba2+ + C
2O2−
4 → BaC2O4
When it is mixed with sodium hydroxide, it gives the dihydroxide, which is moderately soluble in water.
Preparation[edit]
On an industrial scale, it is prepared via a two step process from barite (barium sulfate):[10]
- BaSO4 + 4 C → BaS + 4 CO
This first step requires high temperatures.
- BaS + 2 HCl → BaCl2 + H2S
In place of HCl, chlorine can be used.[5]
Barium chloride can in principle be prepared from barium hydroxide or barium carbonate. These basic salts react with hydrochloric acid to give hydrated barium chloride.
Uses[edit]
Although inexpensive, barium chloride finds limited applications in the laboratory and industry. In industry, barium chloride is mainly used in the purification of brine solution in caustic chlorine plants and also in the manufacture of heat treatment salts, case hardening of steel.[5] It is also used to make red pigments such as Lithol red and Red Lake C. Its toxicity limits its applicability.
Safety[edit]
Barium chloride, along with other water-soluble barium salts, is highly toxic.[11] Sodium sulfate and magnesium sulfate are potential antidotes because they form barium sulfate BaSO4, which is relatively non-toxic because of its insolubility.
References[edit]
- ^ Chemical Recreations: A Series of Amusing and Instructive Experiments, which May be Performed with Ease, Safety, Success, and Economy ; to which is Added, the Romance of Chemistry : An Inquiry into the Fallacies of the Prevailing Theory of Chemistry : With a New Theory and a New Nomenclature. R. Griffin & Company. 1834.
- ^ Handbook of Chemistry and Physics, 71st edition, CRC Press, Ann Arbor, Michigan, 1990.
- ^ a b c NIOSH Pocket Guide to Chemical Hazards. «#0045». National Institute for Occupational Safety and Health (NIOSH).
- ^ a b «Barium (soluble compounds, as Ba)». Immediately Dangerous to Life or Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ^ a b c Kresse, Robert; Baudis, Ulrich; Jäger, Paul; Riechers, H. Hermann; Wagner, Heinz; Winkler, Jocher; Wolf, Hans Uwe (2007). «Barium and Barium Compounds». In Ullman, Franz (ed.). Ullmann’s Encyclopedia of Industrial Chemistry. Wiley-VCH. doi:10.1002/14356007.a03_325.pub2. ISBN 978-3527306732.
- ^ Wells, A. F. (1984) Structural Inorganic Chemistry, Oxford: Clarendon Press. ISBN 0-19-855370-6.
- ^ Haase, A.; Brauer, G. (1978). «Hydratstufen und Kristallstrukturen von Bariumchlorid». Z. anorg. allg. Chem. 441: 181–195. doi:10.1002/zaac.19784410120.
- ^ Brackett, E. B.; Brackett, T. E.; Sass, R. L. (1963). «The Crystal Structures of Barium Chloride, Barium Bromide, and Barium Iodide». J. Phys. Chem. 67 (10): 2132. doi:10.1021/j100804a038.
- ^ Léger, J. M.; Haines, J.; Atouf, A. (1995). «The Post-Cotunnite Phase in BaCl2, BaBr2 and BaI2 under High Pressure». J. Appl. Crystallogr. 28 (4): 416. doi:10.1107/S0021889895001580.
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ^ The Merck Index, 7th edition, Merck & Co., Rahway, New Jersey, 1960.
External links[edit]
- International Chemical Safety Card 0614. (anhydrous)
- International Chemical Safety Card 0615. (dihydrate)
- Barium chloride’s use in industry.
- ChemSub Online: Barium chloride.

|
|

|
|
| Names | |
|---|---|
| Other names
Barium muriate |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChemSpider |
|
| ECHA InfoCard | 100.030.704 |
| EC Number |
|
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
| UN number | 1564 |
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
BaCl2 |
| Molar mass | 208.23 g/mol (anhydrous) 244.26 g/mol (dihydrate) |
| Appearance | White solid |
| Odor | Odourless |
| Density | 3.856 g/cm3 (anhydrous) 3.0979 g/cm3 (dihydrate) |
| Melting point | 962 °C (1,764 °F; 1,235 K) (960 °C, dihydrate) |
| Boiling point | 1,560 °C (2,840 °F; 1,830 K) |
|
Solubility in water |
31.2 g/100 mL (0 °C) 35.8 g/100 mL (20 °C) 59.4 g/100 mL (100 °C) |
| Solubility | soluble in methanol, insoluble in ethanol, ethyl acetate[2] |
|
Magnetic susceptibility (χ) |
−72.6×10−6 cm3/mol |
| Structure | |
|
Crystal structure |
orthogonal (anhydrous) monoclinic (dihydrate) |
|
Coordination geometry |
7–9 |
| Thermochemistry | |
|
Std molar |
123.9 J/(k mol) |
|
Std enthalpy of |
−858.56 kJ/mol |
| Hazards | |
| Occupational safety and health (OHS/OSH): | |
|
Main hazards |
Highly toxic, corrosive |
| GHS labelling: | |
|
Pictograms |

|
|
Signal word |
Danger |
|
Hazard statements |
H301, H302, H332 |
|
Precautionary statements |
P261, P264, P270, P271, P301+P310, P304+P312, P304+P340, P312, P321, P330, P405, P501 |
| NFPA 704 (fire diamond) |
3 0 0 |
| Flash point | Non-flammable |
| Lethal dose or concentration (LD, LC): | |
|
LD50 (median dose) |
78 mg/kg (rat, oral) 50 mg/kg (guinea pig, oral)[4] |
|
LDLo (lowest published) |
112 mg Ba/kg (rabbit, oral) 59 mg Ba/kg (dog, oral) 46 mg Ba/kg (mouse, oral)[4] |
| NIOSH (US health exposure limits): | |
|
PEL (Permissible) |
TWA 0.5 mg/m3[3] |
|
REL (Recommended) |
TWA 0.5 mg/m3[3] |
|
IDLH (Immediate danger) |
50 mg/m3[3] |
| Safety data sheet (SDS) | NIH BaCl |
| Related compounds | |
|
Other anions |
Barium fluoride Barium bromide Barium iodide |
|
Other cations |
Beryllium chloride Magnesium chloride Calcium chloride Strontium chloride Radium chloride Lead chloride |
| Supplementary data page | |
| Barium chloride (data page) | |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Barium chloride is an inorganic compound with the formula BaCl2. It is one of the most common water-soluble salts of barium. Like most other water-soluble barium salts, it is white, highly toxic, and imparts a yellow-green coloration to a flame. It is also hygroscopic, converting first to the dihydrate BaCl2(H2O)2. It has limited use in the laboratory and industry.[5]
Structure and properties[edit]
BaCl2 crystallizes in two forms (polymorphs). One form has the cubic fluorite (CaF2) structure and the other the orthorhombic cotunnite (PbCl2) structure. Both polymorphs accommodate the preference of the large Ba2+ ion for coordination numbers greater than six.[6] The coordination of Ba2+ is 8 in the fluorite structure[7] and 9 in the cotunnite structure.[8] When cotunnite-structure BaCl2 is subjected to pressures of 7–10 GPa, it transforms to a third structure, a monoclinic post-cotunnite phase. The coordination number of Ba2+ increases from 9 to 10.[9]
In aqueous solution BaCl2 behaves as a simple salt; in water it is a 1:2 electrolyte and the solution exhibits a neutral pH. Its solutions react with sulfate ion to produce a thick white precipitate of barium sulfate.
- Ba2+ + SO2−
4 → BaSO4
Oxalate effects a similar reaction:
- Ba2+ + C
2O2−
4 → BaC2O4
When it is mixed with sodium hydroxide, it gives the dihydroxide, which is moderately soluble in water.
Preparation[edit]
On an industrial scale, it is prepared via a two step process from barite (barium sulfate):[10]
- BaSO4 + 4 C → BaS + 4 CO
This first step requires high temperatures.
- BaS + 2 HCl → BaCl2 + H2S
In place of HCl, chlorine can be used.[5]
Barium chloride can in principle be prepared from barium hydroxide or barium carbonate. These basic salts react with hydrochloric acid to give hydrated barium chloride.
Uses[edit]
Although inexpensive, barium chloride finds limited applications in the laboratory and industry. In industry, barium chloride is mainly used in the purification of brine solution in caustic chlorine plants and also in the manufacture of heat treatment salts, case hardening of steel.[5] It is also used to make red pigments such as Lithol red and Red Lake C. Its toxicity limits its applicability.
Safety[edit]
Barium chloride, along with other water-soluble barium salts, is highly toxic.[11] Sodium sulfate and magnesium sulfate are potential antidotes because they form barium sulfate BaSO4, which is relatively non-toxic because of its insolubility.
References[edit]
- ^ Chemical Recreations: A Series of Amusing and Instructive Experiments, which May be Performed with Ease, Safety, Success, and Economy ; to which is Added, the Romance of Chemistry : An Inquiry into the Fallacies of the Prevailing Theory of Chemistry : With a New Theory and a New Nomenclature. R. Griffin & Company. 1834.
- ^ Handbook of Chemistry and Physics, 71st edition, CRC Press, Ann Arbor, Michigan, 1990.
- ^ a b c NIOSH Pocket Guide to Chemical Hazards. «#0045». National Institute for Occupational Safety and Health (NIOSH).
- ^ a b «Barium (soluble compounds, as Ba)». Immediately Dangerous to Life or Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ^ a b c Kresse, Robert; Baudis, Ulrich; Jäger, Paul; Riechers, H. Hermann; Wagner, Heinz; Winkler, Jocher; Wolf, Hans Uwe (2007). «Barium and Barium Compounds». In Ullman, Franz (ed.). Ullmann’s Encyclopedia of Industrial Chemistry. Wiley-VCH. doi:10.1002/14356007.a03_325.pub2. ISBN 978-3527306732.
- ^ Wells, A. F. (1984) Structural Inorganic Chemistry, Oxford: Clarendon Press. ISBN 0-19-855370-6.
- ^ Haase, A.; Brauer, G. (1978). «Hydratstufen und Kristallstrukturen von Bariumchlorid». Z. anorg. allg. Chem. 441: 181–195. doi:10.1002/zaac.19784410120.
- ^ Brackett, E. B.; Brackett, T. E.; Sass, R. L. (1963). «The Crystal Structures of Barium Chloride, Barium Bromide, and Barium Iodide». J. Phys. Chem. 67 (10): 2132. doi:10.1021/j100804a038.
- ^ Léger, J. M.; Haines, J.; Atouf, A. (1995). «The Post-Cotunnite Phase in BaCl2, BaBr2 and BaI2 under High Pressure». J. Appl. Crystallogr. 28 (4): 416. doi:10.1107/S0021889895001580.
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ^ The Merck Index, 7th edition, Merck & Co., Rahway, New Jersey, 1960.
External links[edit]
- International Chemical Safety Card 0614. (anhydrous)
- International Chemical Safety Card 0615. (dihydrate)
- Barium chloride’s use in industry.
- ChemSub Online: Barium chloride.
| Хлорид бария | |
|---|---|
 |
|
 |
|
| Общие | |
| Систематическое наименование |
Хлорид бария |
| Традиционные названия | Хлорид бария, хлористый барий, барий солянокислый |
| Хим. формула | BaCl2 |
| Рац. формула | BaCl2 |
| Физические свойства | |
| Состояние | твёрдое |
| Молярная масса | 208,246 г/моль |
| Плотность | 3,92 (20 °C) |
| Термические свойства | |
| Температура | |
| • плавления | 962 °C |
| • кипения | 1560 °C |
| Энтальпия | |
| • образования | -860,1 кДж/моль |
| Химические свойства | |
| Растворимость | |
| • в воде | 36,2 (20 °C)[1] |
| Классификация | |
| Рег. номер CAS | 10361-37-2 |
| Безопасность | |
| Предельная концентрация | 0,5 мг/м3 (в воздухе рабочей зоны)[2] |
| ЛД50 | 50-149,2 мг/кг (крысы, орально) |
| Токсичность | Класс опасности 2 |
| Пиктограммы ECB |
|
| NFPA 704 |
0 3 0 POI |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Хлори́д ба́рия (хлoристый барий, в просторечии — барий солянокислый, химическая формула — BaCl2) — бинарное неорганическое вещество, относящееся к классу солей.
Хлорид бария представляет собой бесцветные кристаллы, хорошо растворимые в воде. Ядовит.
Описание
Хлорид бария при стандартных условиях представляет собой бесцветные ромбические кристаллы. Малорастворим в спирте, не растворим в диэтиловом эфире, но хорошо растворим в воде. Из водных растворов кристаллизуется дигидрат хлорида бария [math]displaystyle{ mathsf{BaCl_2 cdot 2H_2O} }[/math] — бесцветные кристаллы с моноклинной решёткой. ПДК 0,5 мг/м³[2] в воздухе рабочих помещений (в соответствии с ГОСТ 12.1.005-76).
Стандартизация
В РФ действует ГОСТ 4108-72 «Реактивы. Барий хлорид 2-водный. Технические условия.»
Получение
1. Взаимодействие металлического бария с хлором:
[math]displaystyle{ mathsf{Ba + Cl_2 longrightarrow BaCl_2} }[/math]
2. Взаимодействие оксида бария с соляной кислотой:
[math]displaystyle{ mathsf{BaO + 2HCl longrightarrow BaCl_2 + H_2O} }[/math]
3. Взаимодействие гидроксида бария с соляной кислотой (реакция нейтрализации):
[math]displaystyle{ mathsf{Ba(OH)_2 + 2HCl longrightarrow BaCl_2 + 2H_2O} }[/math]
4. Взаимодействие сульфида бария с хлоридом кальция:
[math]displaystyle{ mathsf{BaS + CaCl_2 longrightarrow BaCl_2 + CaS} }[/math]
5. Взаимодействие карбоната бария с соляной кислотой:
[math]displaystyle{ mathsf{BaCO_3 + 2HCl longrightarrow BaCl_2 + H_2O + CO_2 uparrow} }[/math]
Химические свойства
1. Взаимодействие с растворами солей (реакция идёт, если образуется нерастворимое вещество):
[math]displaystyle{ mathsf{BaCl_2 + MgSO_4 longrightarrow BaSO_4 downarrow + MgCl_2} }[/math]
[math]displaystyle{ mathsf{BaCl_2 + K_2CrO_4 longrightarrow BaCrO_4 downarrow + 2 KCl} }[/math]
2. Взаимодействие с некоторыми кислотами (реакция идёт, если образуется нерастворимое вещество):
[math]displaystyle{ mathsf{BaCl_2 + H_2SO_4 longrightarrow BaSO_4 downarrow + 2 HCl} }[/math]
3. С парами воды при высокой температуре образует оксид бария[3]:
[math]displaystyle{ mathsf{BaCl_2 + H_2O xrightarrow[]{900-950^oC} BaO + 2HCl} }[/math]
Сферы применения
Хлорид бария применяют в производстве пигментов (например, баритового жёлтого [math]displaystyle{ mbox{BaCrO}_4 }[/math], касселевой зелени [math]displaystyle{ mbox{BaMnO}_4 }[/math] и других соединений), в качестве добавки в электролиты при получении магния, для закалки быстрорежущей стали (в виде расплавов смеси хлорида бария с хлоридами щелочных и щёлочноземельных металлов), как компонент керамики, реактив на [math]displaystyle{ mbox{SO}_4^{2-} }[/math] (сульфат-ион), для утяжеления и осветления кожи в кожевенной промышленности, как зооцид[2].
Имелись также данные, что хлорид бария использовался в медицине, несмотря на ядовитость ионов бария для живых организмов.
Особенности обращения, биологическое действие
Вещество токсично. ПДК 0,7 мг/л. При попадании на кожу и в глаза в большом количестве хлористый барий может вызывать химические ожоги; пожаро- и взрывобезопасен.
В связи с возможной токсичностью ионов бария его попадание внутрь организма, насколько это известно, считается недопустимым.
Средняя смертельная доза (ЛД50) для крыс при оральном введении составляет 50-149,2 мг/кг.
II класс опасности по ГОСТ 12.1.007-76.
См. также
- Иодид бария
- Барий
- Фторид бария
- Сульфат бария
Примечания
- ↑ [www.xumuk.ru/spravochnik/383.html Хлорид бария на XuMuK.Ru]
- ↑ 2,0 2,1 2,2 [www.xumuk.ru/encyklopedia/475.html Описание и применение хлорида бария на XuMuK.Ru]
- ↑ Лидин, 2000, с. 72.
Литература
- Лидин Р. А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
Соль, образованная сильным основанием Ba(OH)2 и сильной кислотой HCl.
Альтернативное название
Барий хлористый
Формула
BaCl2
Свойства хлорида бария
Физические свойства
| Свойство | Описание |
|---|---|
| Внешний вид | Бесцветные кристаллы |
| Молярная масса | 208,25 г/моль |
| Плотность | при 20°С – 3,92 г/см3 |
| Температура плавления (в °C) | 960 |
| Температура кипения (в °C) | 1560 |
| Растворимость в воде | при 0°С – 31,6 г/100 г при 20°С – 36,2 г/100 г при 50°С – 43,7 г/100 г при 100°С – 58,2 г/100 г |
Химические свойства
В водном растворе диссоциирует на ионы:
BaCl2 ↔ 2Cl— + Ba2+.
Гидролизу хлорид бария не подвергается.
Среда раствора нейтральная.
При взаимодействии с концентрированной серной кислотой образуется хлороводород:
BaCl2 + H2SO4 = 2HCl↑ + BaSO4.
Хлорид бария вступает в реакции обмена с образованием нерастворимого осадка с:
- карбонатами BaCl2 + Na2CO3 = 2NaCl + BaCO3↓;
- фосфатами 3BaCl2 + 2Na3PO4 = 6NaCl + Ba3(PO4)2↓;
- сульфатами BaCl2 + Na2SO4 = 2NaCl + BaSO4↓;
- сульфитами BaCl2 + Na2SO3 = 2NaCl + BaSO3↓;
- оксалатами BaCl2 + Na2C2O4 = 2NaCl + BaC2O4 ↓;
- фторидами BaCl2 + 2NaF= 2NaCl + BaF2↓;
- хроматами BaCl2 + Na2CrO4 = 2NaCl + BaCrO4↓;
- манганатами BaCl2 + Na2MnO4 = 2NaCl + BaMnO4↓;
Получение
Получение в лаборатории
Хлорид бария получают из гидроксида бария и соляной кислоты:
Ba(OH)2 + 2HCl = BaCl2 + 2Н2О.
Получение в промышленности
Хлорид бария получают из карбоната бария:
BaCO3 + 2HCl = BaCl2 + Н2О + CO2.
Применение
- Хлорид бария применяют в произодстве пигментов (напр., баритового желтого ВаСrО4, бариевых белил ВаSО4 и касселевой зелени ВаМnО4).
- Его используют в качестве добавки в электролиты при получении Mg.
- Применяют для закалки быстрорежущей стали (в виде расплавов смеси ВаС12 с хлоридами щелочных и щелочноземельных металлов).
- В кожевенной промышленности для утяжеления и осветления кожи.
- В бумажной промышленности для утяжеления бумаги для печати купюр.
- В медицине его применяют как контраст при рентгене.
Пример решения задачи
В четырех пробирках находятся растворы различных веществ. В каждую добавили раствор хлорида бария. Во всех пробирках выпал осадок. После добавления соляной кислоты в двух пробирках №1 и №2 началось выделение газов, причем в пробирке №1 у газа был резкий запах горелой серы, а в №2 был лишен запаха. В пробирке №3 осадок растворился, а в №4 остался без изменений. Какие вещества содержались в пробирках, если известно, что опущенная в растворы проволока окрашивала пламя в фиолетовый цвет?
Напишите уравнения реакций.
Решение
В фиолетовый цвет окрашивают пламя соли калия.
В пробирке №1 находился сульфит калия:
BaCl2 + K2SO3 = 2KCl + BaSO3↓;
С соляной кислотой сульфит бария взаимодействует с выделением диоксида серы (сернистого газа):
BaSO3 + 2HCl = BaCl2 + Н2О+ SO2↑.
В пробирке №2 находился карбонат калия:
BaCl2 + K2CO3 = 2KCl + BaCO3↓.
С соляной кислотой карбонат бария взаимодействует с выделением диоксида углерода (углекислого газа):
BaCO3 + 2HCl = BaCl2 + Н2О+ CO2↑.
В пробирке №3 находился фосфат калия:
3BaCl2 + 2K3PO4 = 6KCl + Ba3(PO4)↓.
В соляной кислоте фосфат бария медленно растворяется:
Ba3(PO4)2↓+ 6HCl = BaCl2 + 2Н3PO4.
Тест по теме «Хлорид бария»
| Хлорид бария | |
|---|---|
 |
|
| Систематическое наименование |
Хлорид бария |
| Традиционные названия | Хлористый барий |
| Хим. формула | BaCl2 |
| Рац. формула | BaCl2 |
| Состояние | твёрдое |
| Молярная масса | 208,246 г/моль |
| Плотность | 3,92 (20 °C) |
| Температура | |
| • плавления | 962 °C |
| • кипения | 1560 °C |
| Энтальпия | |
| • образования | -860,1 кДж/моль |
| Растворимость | |
| • в воде | 36,2 (20 °C) |
| ГОСТ | ГОСТ 4108-72 ГОСТ 742-78 |
| Рег. номер CAS | 10361-37-2 |
| PubChem | 25204 |
| Рег. номер EINECS | 233-788-1 |
| SMILES |
[Cl-].[Cl-].[Ba+2] |
| InChI |
1S/Ba.2ClH/h;2*1H/q+2;;/p-2 WDIHJSXYQDMJHN-UHFFFAOYSA-L |
| RTECS | CQ8750000 |
| ChEBI | 63317 |
| Номер ООН | 1564 |
| ChemSpider | 23540 |
| ЛД50 | 50-78 мг/кг (крысы, орально) |
| Пиктограммы ECB |  |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Хлорид бария (хлористый барий) — бинарное неорганическое вещество, относящееся к классу солей. Химическая формула — BaCl2.
Описание
Хлорид бария при стандартных условиях представляет собой бесцветные ромбические кристаллы. Малорастворим в спирте, не растворим в диэтиловом эфире. Из водных растворов кристаллизуется дигидрат хлорида бария BaCl2 ⋅ 2H2O — бесцветные кристаллы с моноклинной решёткой. Токсичен, ПДК 0,5 мг/м³
ГОСТ 4108-72 Реактивы. Барий хлорид 2-водный. Технические условия
Получение
1. Взаимодействие металлического бария с хлором:
Ba + Cl2 ⟶ BaCl2
2. Взаимодействие оксида бария с соляной кислотой:
BaO + 2HCl ⟶ BaCl2 + H2O
3. Взаимодействие гидроксида бария с соляной кислотой (реакция нейтрализации):
Ba(OH)2 + 2HCl ⟶ BaCl2 + 2H2O
4. Взаимодействие сульфида бария с хлоридом кальция:
BaS + CaCl2 ⟶ BaCl2 + CaS
5. Взаимодействие карбоната бария с соляной кислотой:
BaCO3 + 2HCl ⟶ BaCl2 + H2O + CO2↑
Химические свойства
1. Взаимодействие с растворами солей (реакция идёт, если образуется нерастворимое вещество):
BaCl2 + MgSO4 ⟶ BaSO4↓ + MgCl2
BaCl2 + K2CrO4 ⟶ BaCrO4↓ + 2KCl
2. Взаимодействие с некоторыми кислотами (реакция идёт, если образуется нерастворимое вещество):
BaCl2 + H2SO4 ⟶ BaSO4↓ + 2HCl
Применение
Хлорид бария применяют в производстве пигментов (например, баритового жёлтого BaCrO4, касселевой зелени BaMnO4 и других соединений), в качестве добавки в электролиты при получении магния, для закалки быстрорежущей стали (в виде расплавов смеси хлорида бария с хлоридами щелочных и щёлочноземельных металлов), как компонент керамики, реактив на SO42− (сульфат-ион), для утяжеления и осветления кожи в кожевенной промышленности, как зооцид.
| Хлорид бария | |
 |
|
 |
|
| Общие | |
|---|---|
| Систематическое наименование | Хлорид бария |
| Традиционные названия | Хлористый барий |
| Химическая формула | BaCl2 |
| Эмпирическая формула | BaCl2 |
| Физические свойства | |
| Состояние (ст. усл.) | твёрдое |
| Молярная масса | 208,246 г/моль |
| Плотность | 3,92 (20 °C) г/см³ |
| Термические свойства | |
| Температура плавления | 962 °C |
| Температура кипения | 1560 °C |
| Энтальпия образования (ст. усл.) | -860,1 кДж/моль |
| Химические свойства | |
| Растворимость в воде | 36,2 (20 °C)[1] г/100 мл |
| Классификация | |
| Рег. номер CAS | 10361-37-2 |
Хлори́д ба́рия (хлористый барий) — бинарное неорганическое вещество, относящееся к классу солей. Химическая формула — BaCl2.
Описание
Хлорид бария при стандартных условиях представляет собой бесцветные ромбические кристаллы. Малорастворим в спирте, не растворим в эфире. Из водных растворов кристаллизуется дигидрат хлорида бария 
Получение
1. Взаимодействие металлического бария с хлором:
2. Взаимодействие оксида бария с соляной кислотой:
3. Взаимодействие гидроксида бария с соляной кислотой (реакция нейтрализации):
4. Взаимодействие сульфида бария с хлоридом кальция:
5. Взаимодействие карбоната бария с соляной кислотой:
Химические свойства
1. Взаимодействие с растворами солей (реакция идёт, если образуется нерастворимое вещество):
2. Взаимодействие с некоторыми кислотами (реакция идёт, если образуется нерастворимое вещество):
Применение
Хлорид бария применяют в производстве пигментов (например, баритового жёлте 


См. также
- Барий
- Хлориды
Примечания
- ↑ Хлорид бария на XuMuK.Ru
- ↑ 1 2 Описание и применение хлорида бария на XuMuK.Ru
|
Растворимость кислот, оснований и солей в воде |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
Соединения бария |
|---|
|
Амид бария (Ba(NH2)2) • Ацетат бария (Ba(CH3COO)2) • Бромид бария (BaBr2) • Гидрид бария (BaH2) • Гидроксид бария (Ba(OH)2) • Гидросульфид бария (Ba(HS)2) • Дитионат бария (BaS2O6) • Иодат бария (Ba(IO3)2) • Иодид бария (BaI2) • Карбид бария (BaC2) • Карбонат бария (BaCO3) • Манганат бария (BaMnO4) • Метаборат бария (Ba(BO2)2) • Нитрат бария (Ba(NO3)2) • Нитрид бария (Ba3N2) • Нитрит бария (Ba(NO2)2) • Оксалат бария (BaC2O4) • Оксид бария (BaO) • Пероксид бария (BaO2) • Перхлорат бария (BaClO4) • Силикат бария (ВаSiO3) • Сульфат бария (BaSO4) • Сульфид бария (BaS) • Сульфит бария (BaSO3) • Титанат бария (BaTiO3) • Феррат бария (BaFeO4) • Феррит бария (BaFe2O4) • Фосфат бария (Ba3(PO4)2) • Фосфид бария (Ba3P2) • Фторид бария (BaF2) • Хлорат бария (Ba(ClO3)2) • Хлорид бария (BaCl2) • Хромат бария (BaCrO4) • Хромат(V) бария (Ba3(CrO4)2) • Цианид бария (Ba(CN)2) • Цирконат бария (BaZrO3) |
| Хлорид бария | |
|---|---|
 |
|
 |
|
| Общие | |
| Систематическое наименование (b) |
Хлорид бария |
| Традиционные названия | Хлорид бария, хлористый барий, барий солянокислый |
| Хим. формула (b) | BaCl2 |
| Рац. формула (b) | BaCl2 |
| Физические свойства | |
| Состояние (b) | твёрдое |
| Молярная масса (b) | 208,246 г/моль (b) |
| Плотность (b) | 3,92 (20 °C) |
| Термические свойства | |
| Температура | |
| • плавления (b) | 962 °C |
| • кипения (b) | 1560 °C |
| Энтальпия | |
| • образования | -860,1 кДж/моль |
| Химические свойства | |
| Растворимость (b) | |
| • в воде | 36,2 (20 °C)[1] |
| Классификация | |
| Рег. номер CAS (b) | 10361-37-2 |
| PubChem (b) | 25204 |
| Рег. номер EINECS (b) | 233-788-1 |
| SMILES (b) |
[Cl-].[Cl-].[Ba+2] |
| InChI (b) |
InChI=1S/Ba.2ClH/h;2*1H/q+2;;/p-2 WDIHJSXYQDMJHN-UHFFFAOYSA-L |
| RTECS (b) | CQ8750000 |
| ChEBI | 63317 |
| Номер ООН (b) | 1564 |
| ChemSpider (b) | 23540 |
| Безопасность | |
| Предельная концентрация (b) | 0,5 мг/м3 (в воздухе рабочей зоны (b) )[2] |
| ЛД50 (b) | 50-149,2 мг/кг (крысы (b) , орально) |
| Токсичность (b) | Класс опасности (b) 2 |
| Пиктограммы ECB | |
| NFPA 704 (b) |
 0 3 0 POI |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Хлори́д ба́рия (хлoристый барий, в просторечии — барий солянокислый, химическая формула (b) — BaCl2) — бинарное (b) неорганическое вещество (b) , относящееся к классу солей (b) .
Хлорид бария представляет собой бесцветные кристаллы, хорошо растворимые (b) в воде (b) . Ядовит (b) .
Описание
Хлорид бария при стандартных условиях (b) представляет собой бесцветные ромбические кристаллы (b) . Малорастворим (b) в спирте (b) , не растворим в диэтиловом эфире (b) , но хорошо растворим в воде (b) . Из водных растворов (b) кристаллизуется (b) дигидрат хлорида (b) бария — бесцветные кристаллы (b) с моноклинной решёткой. ПДК (b) 0,5 мг/м³[2] в воздухе рабочих помещений (b) (в соответствии с ГОСТ (b) 12.1.005-76).
Стандартизация
В РФ действует ГОСТ 4108-72 «Реактивы. Барий хлорид 2-водный. Технические условия.»
Получение
1. Взаимодействие металлического бария (b) с хлором (b) :
2. Взаимодействие оксида бария (b) с соляной кислотой (b) :
3. Взаимодействие гидроксида бария (b) с соляной кислотой (b) (реакция нейтрализации (b) ):
4. Взаимодействие сульфида бария (b) с хлоридом кальция (b) :
5. Взаимодействие карбоната бария (b) с соляной кислотой (b) :
Химические свойства
1. Взаимодействие с растворами (b) солей (b) (реакция идёт, если образуется нерастворимое вещество):
2. Взаимодействие с некоторыми кислотами (b) (реакция идёт, если образуется нерастворимое вещество):
3. С парами воды при высокой температуре образует оксид бария[3]:
Сферы применения
Хлорид бария применяют в производстве пигментов (b) (например, баритового жёлтого (b) , касселевой зелени (b) и других соединений), в качестве добавки в электролиты (b) при получении магния (b) , для закалки (b) быстрорежущей стали (b) (в виде расплавов смеси хлорида бария с хлоридами (b) щелочных (b) и щёлочноземельных металлов (b) ), как компонент керамики (b) , реактив на (сульфат-ион (b) ), для утяжеления и осветления кожи (b) в кожевенной промышленности (b) , как зооцид (b) [2].
Имелись также данные, что хлорид бария использовался в медицине (b) , несмотря на ядовитость (b) ионов (b) бария (b) для живых организмов (b) .
Особенности обращения, биологическое действие
Вещество (b) токсично. ПДК (b) 0,7 мг/л. При попадании на кожу (b) и в глаза (b) в большом количестве хлористый (b) барий (b) может вызывать химические ожоги (b) ; пожаро (b) — и взрывобезопасен (b) .
В связи с возможной токсичностью (b) ионов (b) бария (b) его попадание внутрь организма (b) , насколько это известно, считается недопустимым.
Средняя смертельная доза (ЛД50) (b) для крыс (b) при оральном введении (b) составляет 50-149,2 мг/кг.
II класс опасности (b) по ГОСТ 12.1.007-76.
См. также
- Иодид бария (b)
- Барий (b)
- Фторид бария (b)
- Сульфат бария (b)
Примечания
- ↑ [www.xumuk.ru/spravochnik/383.html Хлорид бария на XuMuK.Ru]
- 1 2 3 [www.xumuk.ru/encyklopedia/475.html Описание и применение хлорида бария на XuMuK.Ru]
- ↑ Лидин, 2000, с. 72.
Литература
- Лидин Р. А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
|
|
Некоторые внешние ссылки в этой статье ведут на сайты, занесённые в спам-лист. Эти сайты могут нарушать авторские права, быть признаны неавторитетными источниками или по другим причинам быть запрещены в Википедии. Редакторам следует заменить такие ссылки ссылками на соответствующие правилам сайты или библиографическими ссылками на печатные источники либо удалить их (возможно, вместе с подтверждаемым ими содержимым). Список проблемных ссылок
|
Поиск химических веществ по названиям или формулам.
Справочник содержит названия веществ и описания химических формул (в т.ч. структурные формулы и скелетные формулы).
Введите часть названия или формулу для поиска:
Языки:
По умолчанию |
Все возможные |
Из списка
|
Применить к найденному
Хлорид бария
Брутто-формула:
BaCl2
CAS# 10361-37-2
Категории:
Неорганические соли
PubChem CID: 5360350
| ChemSpider ID: 23540
| NSC 146181
| UNII-0VK51DA1T2
Названия
Русский:
- Хлорид бария [Wiki]
- хлористый барий
English:
- Ba 0108E
- Barium chloride [Wiki]
- Barium dichloride(IUPAC)
- CCRIS 2286
- EINECS:233-788-1
- NCI-C61074
- SBA 0108E
- barium(2+);dichloride(IUPAC)
German:
- Bariumchlorid [Wiki]
- Bariumdichlorid(IUPAC)
- Chlorbarium
العربية:
- كلوريد الباريوم [Wiki]
- كلوريد باريوم(IUPAC)
Ελληνικά:
- Χλωριούχο βάριο [Wiki]
Español:
- Cloruro de bario(IUPAC) [Wiki]
French:
- Chlorure de baryum [Wiki]
- Dichlorure de baryum(IUPAC)
Italiano:
- Cloruro di bario [Wiki]
- dicloruro di bario(IUPAC)
日本語:
- 塩化バリウム [Wiki]
Português:
- Cloreto de bário [Wiki]
中文:
- 氯化鋇 [Wiki]
Варианты формулы:
BaCl2
Cl-Ba-Cl
Cl`^-$L(1.5)/hBa^++hCl^-
Cl^-$L(1.5)Ba^2+/0Cl^-
Вещества, имеющие отношение…
Анион:
Хлориды
Химический состав
Реакции, в которых участвует Хлорид бария
-
{M}O + 2H{X} -> {M}{X}2 + H2O
, где M =
Cu Ca Mg Sr Ba Hg Mn Cr Ni Fe Cd Zn Pb; X =
Cl F Br I -
BaCl2 + Rb2SO4 -> 2RbCl + BaSO4″|v»
-
{M} + 2H{X} -> {M}{X}2 + H2″|^»
, где M =
Ca Mg Ba Sr Cd Zn; X =
Cl F Br I -
{M} + {Hal}2 = {M}{Hal}2
, где M =
Mg Ca Ba Sr Cd Zn; Hal =
F Cl Br I -
{M}(OH)2 + 2H{X} -> {M}{X}2 + 2H2O
, где M =
Ca Mg Ba Sr Cd Fe Ni Zn Mn; X =
F Cl Br I
И ещё 28 реакций…
Барий хлористый — неорганическое вещество, которое 
Свойства
Тонкозернистый порошок белого или сероватого цвета с мелкими бесцветными кристалликами. Водорастворим, слабо растворим в спирте и спиртовых растворах, не растворим в эфирах. Из водных растворов выкристаллизовываются бесцветные кристаллогидраты с одной или двумя молекулами воды. Реактив огне- и взрывобезопасен. Проявляет диамагнитные свойства.
Химически достаточно активная соль. Реагирует с другими солями в водных растворах, если в результате получается нерастворимое соединение, выпадающее в осадок. Это свойство используется в аналитике для обнаружения сульфат-ионов. Хим. реактив способен образовывать двойные соли, эвтектические смеси, а с бромидом бария — твердые растворы.
Меры предосторожности
Барий хлористый безводный и его кристаллогидраты крайне токсичны. Отравление приводит к необратимым последствиям для головного мозга и серьезному поражению почек, селезенки, желудочного тракта, параличу и потере зрения. Попадание реактива с пылью оказывает негативное воздействие на органы дыхания. Опасно также попадание пыли или раствора в глаза или на кожу.
При проглатывании следует сразу же вызвать врача и промыть желудок 1%-ным раствором сернокислого натрия или магния. Если порошкообразный реактив рассыпан, его нельзя заливать водой. Его следует изолировать, засыпать песком и потом утилизировать.
Работать с хлористым барием следует в спец. одежде, респираторе, резиновых перчатках и защитных очках. Помещение должно быть оборудовано вентиляцией, а места возможного сильного запыления — локальным укрытием и дополнительной местной вентиляцией. В лабораториях для работы с хлоридом бария используют вытяжной шкаф.
Хранят реактив в полиэтиленовых мешках, в сухом помещении, строго следят за тем, чтобы он не контактировал с водой. Перевозят любым крытым транспортом, кроме самолета.
При нагревании BaCl2 разлагается с выделением химически активного хлороводорода, поэтому пожарные должны быть извещены, если в зоне пожара оказались значительные количества реактива.
Применение
- В химпроме для получения солей бария и реактивов
на основе бария; пигментов, в том числе таких популярных как баритовый желтый и касселева зелень.
- Входит в состав электролитов, использующихся при электролитическом получении химически чистого магния и алюминия.
- Часть смесей, применяющихся для закалки сталей режущих марок.
- В технологии горячего прессования в металлургии.
- В сталелитейном производстве — для цианирования (насыщения верхнего слоя металлической поверхности углеродом и азотом).
- Для обработки кож с целью их осветления и утяжеления.
- Входит в состав массы, из которой изготавливают керамические изделия.
- В аналитической химии — для обнаружения в растворах присутствия серной кислоты или сульфатов (выпадает белый осадок).
- Для уничтожения насекомых-вредителей растений в сельском хозяйстве.











 на основе бария; пигментов, в том числе таких популярных как баритовый желтый и касселева зелень.
на основе бария; пигментов, в том числе таких популярных как баритовый желтый и касселева зелень.