 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chromium | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Appearance | silvery metallic | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Standard atomic weight Ar°(Cr) |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chromium in the periodic table | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic number (Z) | 24 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Group | group 6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Period | period 4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Block | d-block | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electron configuration | [Ar] 3d5 4s1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrons per shell | 2, 8, 13, 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physical properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase at STP | solid | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Melting point | 2180 K (1907 °C, 3465 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Boiling point | 2944 K (2671 °C, 4840 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Density (near r.t.) | 7.15 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| when liquid (at m.p.) | 6.3 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of fusion | 21.0 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of vaporization | 347 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar heat capacity | 23.35 J/(mol·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Vapor pressure
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidation states | −4, −2, −1, 0, +1, +2, +3, +4, +5, +6 (depending on the oxidation state, an acidic, basic, or amphoteric oxide) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegativity | Pauling scale: 1.66 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ionization energies |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic radius | empirical: 128 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Covalent radius | 139±5 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Spectral lines of chromium |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Other properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Natural occurrence | primordial | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | body-centered cubic (bcc)
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Speed of sound thin rod | 5940 m/s (at 20 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermal expansion | 4.9 µm/(m⋅K) (at 25 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermal conductivity | 93.9 W/(m⋅K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrical resistivity | 125 nΩ⋅m (at 20 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetic ordering | antiferromagnetic (rather: SDW)[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar magnetic susceptibility | +280.0×10−6 cm3/mol (273 K)[3] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Young’s modulus | 279 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Shear modulus | 115 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bulk modulus | 160 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Poisson ratio | 0.21 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mohs hardness | 8.5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vickers hardness | 1060 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Brinell hardness | 687–6500 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS Number | 7440-47-3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| History | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Discovery and first isolation | Louis Nicolas Vauquelin (1794, 1797) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Main isotopes of chromium
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| references |
Chromium is a chemical element with the symbol Cr and atomic number 24. It is the first element in group 6. It is a steely-grey, lustrous, hard, and brittle transition metal.[4]
Chromium metal is valued for its high corrosion resistance and hardness. A major development in steel production was the discovery that steel could be made highly resistant to corrosion and discoloration by adding metallic chromium to form stainless steel. Stainless steel and chrome plating (electroplating with chromium) together comprise 85% of the commercial use. Chromium is also greatly valued as a metal that is able to be highly polished while resisting tarnishing. Polished chromium reflects almost 70% of the visible spectrum, and almost 90% of infrared light.[5] The name of the element is derived from the Greek word χρῶμα, chrōma, meaning color,[6] because many chromium compounds are intensely colored.
Industrial production of chromium proceeds from chromite ore (mostly FeCr2O4) to produce ferrochromium, an iron-chromium alloy, by means of aluminothermic or silicothermic reactions. Ferrochromium is then used to produce alloys such as stainless steel. Pure chromium metal is produced by a different process: roasting and leaching of chromite to separate it from iron, followed by reduction with carbon and then aluminium.
In the United States, trivalent chromium (Cr(III)) ion is considered an essential nutrient in humans for insulin, sugar, and lipid metabolism.[7] However, in 2014, the European Food Safety Authority, acting for the European Union, concluded that there was insufficient evidence for chromium to be recognized as essential.[8]
While chromium metal and Cr(III) ions are considered non-toxic, hexavalent chromium, Cr(VI), is toxic and carcinogenic. According to the European Chemicals Agency (ECHA), chromium trioxide that is used in industrial electroplating processes is a «substance of very high concern» (SVHC).[9]
Abandoned chromium production sites often require environmental cleanup.[10]
Physical properties[edit]
Atomic[edit]
Chromium is the fourth transition metal found on the periodic table, and has an electron configuration of [Ar] 3d5 4s1. It is also the first element in the periodic table whose ground-state electron configuration violates the Aufbau principle. This occurs again later in the periodic table with other elements and their electron configurations, such as copper, niobium, and molybdenum.[11] This occurs because electrons in the same orbital repel each other due to their like charges. In the previous elements, the energetic cost of promoting an electron to the next higher energy level is too great to compensate for that released by lessening inter-electronic repulsion. However, in the 3d transition metals, the energy gap between the 3d and the next-higher 4s subshell is very small, and because the 3d subshell is more compact than the 4s subshell, inter-electron repulsion is smaller between 4s electrons than between 3d electrons. This lowers the energetic cost of promotion and increases the energy released by it, so that the promotion becomes energetically feasible and one or even two electrons are always promoted to the 4s subshell. (Similar promotions happen for every transition metal atom but one, palladium.)[12]
Chromium is the first element in the 3d series where the 3d electrons start to sink into the nucleus; they thus contribute less to metallic bonding, and hence the melting and boiling points and the enthalpy of atomisation of chromium are lower than those of the preceding element vanadium. Chromium(VI) is a strong oxidising agent in contrast to the molybdenum(VI) and tungsten(VI) oxides.[13]
Bulk[edit]
Sample of pure chromium metal
Chromium is extremely hard, and is the third hardest element behind carbon (diamond) and boron. Its Mohs hardness is 8.5, which means that it can scratch samples of quartz and topaz, but can be scratched by corundum. Chromium is highly resistant to tarnishing, which makes it useful as a metal that preserves its outermost layer from corroding, unlike other metals such as copper, magnesium, and aluminium.
Chromium has a melting point of 1907 °C (3465 °F), which is relatively low compared to the majority of transition metals. However, it still has the second highest melting point out of all the Period 4 elements, being topped by vanadium by 3 °C (5 °F) at 1910 °C (3470 °F). The boiling point of 2671 °C (4840 °F), however, is comparatively lower, having the fourth lowest boiling point out of the Period 4 transition metals alone behind copper, manganese and zinc.[note 1] The electrical resistivity of chromium at 20 °C is 125 nanoohm-meters.
Chromium has a high specular reflection in comparison to other transition metals. In infrared, at 425 μm, chromium has a maximum reflectance of about 72%, reducing to a minimum of 62% at 750 μm before rising again to 90% at 4000 μm.[5] When chromium is used in stainless steel alloys and polished, the specular reflection decreases with the inclusion of additional metals, yet is still high in comparison with other alloys. Between 40% and 60% of the visible spectrum is reflected from polished stainless steel.[5] The explanation on why chromium displays such a high turnout of reflected photon waves in general, especially the 90% in infrared, can be attributed to chromium’s magnetic properties.[14] Chromium has unique magnetic properties — chromium is the only elemental solid that shows antiferromagnetic ordering at room temperature and below. Above 38 °C, its magnetic ordering becomes paramagnetic.[2] The antiferromagnetic properties, which cause the chromium atoms to temporarily ionize and bond with themselves, are present because the body-centric cubic’s magnetic properties are disproportionate to the lattice periodicity. This is due to the magnetic moments at the cube’s corners and the unequal, but antiparallel, cube centers.[14] From here, the frequency-dependent relative permittivity of chromium, deriving from Maxwell’s equations and chromium’s antiferromagnetism, leaves chromium with a high infrared and visible light reflectance.[15]
Passivation[edit]
Chromium metal left standing in air is passivated — it forms a thin, protective, surface layer of oxide. This layer has a spinel structure a few atomic layers thick; it is very dense and inhibits the diffusion of oxygen into the underlying metal. In contrast, iron forms a more porous oxide through which oxygen can migrate, causing continued rusting.[16] Passivation can be enhanced by short contact with oxidizing acids like nitric acid. Passivated chromium is stable against acids. Passivation can be removed with a strong reducing agent that destroys the protective oxide layer on the metal. Chromium metal treated in this way readily dissolves in weak acids.[17]
Chromium, unlike iron and nickel, does not suffer from hydrogen embrittlement. However, it does suffer from nitrogen embrittlement, reacting with nitrogen from air and forming brittle nitrides at the high temperatures necessary to work the metal parts.[18]
Isotopes[edit]
Naturally occurring chromium is composed of four stable isotopes; 50Cr, 52Cr, 53Cr and 54Cr, with 52Cr being the most abundant (83.789% natural abundance). 50Cr is observationally stable, as it is theoretically capable of decaying to 50Ti via double electron capture with a half-life of no less than 1.3×1018 years. Twenty-five radioisotopes have been characterized, ranging from 42Cr to 70Cr; the most stable radioisotope is 51Cr with a half-life of 27.7 days. All of the remaining radioactive isotopes have half-lives that are less than 24 hours and the majority less than 1 minute. Chromium also has two metastable nuclear isomers.[19]
53Cr is the radiogenic decay product of 53Mn (half-life 3.74 million years).[20] Chromium isotopes are typically collocated (and compounded) with manganese isotopes. This circumstance is useful in isotope geology. Manganese-chromium isotope ratios reinforce the evidence from 26Al and 107Pd concerning the early history of the Solar System. Variations in 53Cr/52Cr and Mn/Cr ratios from several meteorites indicate an initial 53Mn/55Mn ratio that suggests Mn-Cr isotopic composition must result from in-situ decay of 53Mn in differentiated planetary bodies. Hence 53Cr provides additional evidence for nucleosynthetic processes immediately before coalescence of the Solar System.[21]
The isotopes of chromium range in atomic mass from 43 u (43Cr) to 67 u (67Cr). The primary decay mode before the most abundant stable isotope, 52Cr, is electron capture and the primary mode after is beta decay.[19] 53Cr has been posited as a proxy for atmospheric oxygen concentration.[22]
Chemistry and compounds[edit]
The Pourbaix diagram for chromium in pure water, perchloric acid, or sodium hydroxide[23][24]
Chromium is a member of group 6, of the transition metals. The +3 and +6 states occur most commonly within chromium compounds, followed by +2; charges of +1, +4 and +5 for chromium are rare, but do nevertheless occasionally exist.[25][26]
Common oxidation states[edit]
| Oxidation states[note 2][26] |
|
|---|---|
| −4 (d10) | Na4[Cr(CO)4][27] |
| −2 (d8) | Na 2[Cr(CO) 5] |
| −1 (d7) | Na 2[Cr 2(CO) 10] |
| 0 (d6) | Cr(C 6H 6) 2 |
| +1 (d5) | K 3[Cr(CN) 5NO] |
| +2 (d4) | CrCl 2 |
| +3 (d3) | CrCl 3 |
| +4 (d2) | K 2CrF 6 |
| +5 (d1) | K 3Cr(O 2) 4 |
| +6 (d0) | K 2CrO 4 |
Chromium(0)[edit]
Many Cr(0) complexes are known. Bis(benzene)chromium and chromium hexacarbonyl are highlights in organochromium chemistry.
Chromium(II)[edit]
Chromium(II) compounds are uncommon, in part because they readily oxidize to chromium(III) derivatives in air. Water-stable chromium(II) chloride CrCl
2 that can be made by reducing chromium(III) chloride with zinc. The resulting bright blue solution created from dissolving chromium(II) chloride is stable at neutral pH.[17] Some other notable chromium(II) compounds include chromium(II) oxide CrO, and chromium(II) sulfate CrSO
4. Many chromium(II) carboxylates are known. The red chromium(II) acetate (Cr2(O2CCH3)4) is somewhat famous. It features a Cr-Cr quadruple bond.[28]
Chromium(III)[edit]
Anhydrous chromium(III) chloride (CrCl3)
A large number of chromium(III) compounds are known, such as chromium(III) nitrate, chromium(III) acetate, and chromium(III) oxide.[29] Chromium(III) can be obtained by dissolving elemental chromium in acids like hydrochloric acid or sulfuric acid, but it can also be formed through the reduction of chromium(VI) by cytochrome c7.[30] The Cr3+
ion has a similar radius (63 pm) to Al3+
(radius 50 pm), and they can replace each other in some compounds, such as in chrome alum and alum.
Chromium(III) tends to form octahedral complexes. Commercially available chromium(III) chloride hydrate is the dark green complex [CrCl2(H2O)4]Cl. Closely related compounds are the pale green [CrCl(H2O)5]Cl2 and violet [Cr(H2O)6]Cl3. If anhydrous violet[31] chromium(III) chloride is dissolved in water, the violet solution turns green after some time as the chloride in the inner coordination sphere is replaced by water. This kind of reaction is also observed with solutions of chrome alum and other water-soluble chromium(III) salts. A tetrahedral coordination of chromium(III) has been reported for the Cr-centered Keggin anion [α-CrW12O40]5–.[32]
Chromium(III) hydroxide (Cr(OH)3) is amphoteric, dissolving in acidic solutions to form [Cr(H2O)6]3+, and in basic solutions to form [Cr(OH)
6]3−
. It is dehydrated by heating to form the green chromium(III) oxide (Cr2O3), a stable oxide with a crystal structure identical to that of corundum.[17]
Chromium(VI)[edit]
Chromium(VI) compounds are oxidants at low or neutral pH. Chromate anions (CrO2−
4) and dichromate (Cr2O72−) anions are the principal ions at this oxidation state. They exist at an equilibrium, determined by pH:
- 2 [CrO4]2− + 2 H+ ⇌ [Cr2O7]2− + H2O
Chromium(VI) oxyhalides are known also and include chromyl fluoride (CrO2F2) and chromyl chloride (CrO
2Cl
2).[17] However, despite several erroneous claims, chromium hexafluoride (as well as all higher hexahalides) remains unknown, as of 2020.[33]
Sodium chromate is produced industrially by the oxidative roasting of chromite ore with sodium carbonate. The change in equilibrium is visible by a change from yellow (chromate) to orange (dichromate), such as when an acid is added to a neutral solution of potassium chromate. At yet lower pH values, further condensation to more complex oxyanions of chromium is possible.
Both the chromate and dichromate anions are strong oxidizing reagents at low pH:[17]
- Cr
2O2−
7 + 14 H
3O+
+ 6 e− → 2 Cr3+
+ 21 H
2O (ε0 = 1.33 V)
They are, however, only moderately oxidizing at high pH:[17]
- CrO2−
4 + 4 H
2O + 3 e− → Cr(OH)
3 + 5 OH−
(ε0 = −0.13 V)
Chromium(VI) compounds in solution can be detected by adding an acidic hydrogen peroxide solution. The unstable dark blue chromium(VI) peroxide (CrO5) is formed, which can be stabilized as an ether adduct CrO
5·OR
2.[17]
Chromic acid has the hypothetical formula H
2CrO
4. It is a vaguely described chemical, despite many well-defined chromates and dichromates being known. The dark red chromium(VI) oxide CrO
3, the acid anhydride of chromic acid, is sold industrially as «chromic acid».[17] It can be produced by mixing sulfuric acid with dichromate and is a strong oxidizing agent.
Other oxidation states[edit]
Compounds of chromium(V) are rather rare; the oxidation state +5 is only realized in few compounds but are intermediates in many reactions involving oxidations by chromate. The only binary compound is the volatile chromium(V) fluoride (CrF5). This red solid has a melting point of 30 °C and a boiling point of 117 °C. It can be prepared by treating chromium metal with fluorine at 400 °C and 200 bar pressure. The peroxochromate(V) is another example of the +5 oxidation state. Potassium peroxochromate (K3[Cr(O2)4]) is made by reacting potassium chromate with hydrogen peroxide at low temperatures. This red brown compound is stable at room temperature but decomposes spontaneously at 150–170 °C.[34]
Compounds of chromium(IV) are slightly more common than those of chromium(V). The tetrahalides, CrF4, CrCl4, and CrBr4, can be produced by treating the trihalides (CrX
3) with the corresponding halogen at elevated temperatures. Such compounds are susceptible to disproportionation reactions and are not stable in water. Organic compounds containing Cr(IV) state such as chromium tetra t-butoxide are also known.[35]
Most chromium(I) compounds are obtained solely by oxidation of electron-rich, octahedral chromium(0) complexes. Other chromium(I) complexes contain cyclopentadienyl ligands. As verified by X-ray diffraction, a Cr-Cr quintuple bond (length 183.51(4) pm) has also been described.[36] Extremely bulky monodentate ligands stabilize this compound by shielding the quintuple bond from further reactions.
Chromium compound determined experimentally to contain a Cr-Cr quintuple bond
Occurrence[edit]
Chromium is the 21st[37] most abundant element in Earth’s crust with an average concentration of 100 ppm. Chromium compounds are found in the environment from the erosion of chromium-containing rocks, and can be redistributed by volcanic eruptions. Typical background concentrations of chromium in environmental media are: atmosphere <10 ng/m3; soil <500 mg/kg; vegetation <0.5 mg/kg; freshwater <10 μg/L; seawater <1 μg/L; sediment <80 mg/kg.[38] Chromium is mined as chromite (FeCr2O4) ore.[39]
About two-fifths of the chromite ores and concentrates in the world are produced in South Africa, about a third in Kazakhstan,[40] while India, Russia, and Turkey are also substantial producers. Untapped chromite deposits are plentiful, but geographically concentrated in Kazakhstan and southern Africa.[41] Although rare, deposits of native chromium exist.[42][43] The Udachnaya Pipe in Russia produces samples of the native metal. This mine is a kimberlite pipe, rich in diamonds, and the reducing environment helped produce both elemental chromium and diamonds.[44]
The relation between Cr(III) and Cr(VI) strongly depends on pH and oxidative properties of the location. In most cases, Cr(III) is the dominating species,[23] but in some areas, the ground water can contain up to 39 µg/L of total chromium, of which 30 µg/L is Cr(VI).[45]
History[edit]
Early applications[edit]
Chromium minerals as pigments came to the attention of the west in the eighteenth century. On 26 July 1761, Johann Gottlob Lehmann found an orange-red mineral in the Beryozovskoye mines in the Ural Mountains which he named Siberian red lead.[46][47] Though misidentified as a lead compound with selenium and iron components, the mineral was in fact crocoite with a formula of PbCrO4.[48] In 1770, Peter Simon Pallas visited the same site as Lehmann and found a red lead mineral that was discovered to possess useful properties as a pigment in paints. After Pallas, the use of Siberian red lead as a paint pigment began to develop rapidly throughout the region.[49] Crocoite would be the principal source of chromium in pigments until the discovery of chromite many years later.[50]
The red color of rubies is due to trace amounts of chromium within the corundum.
In 1794, Louis Nicolas Vauquelin received samples of crocoite ore. He produced chromium trioxide (CrO3) by mixing crocoite with hydrochloric acid.[48] In 1797, Vauquelin discovered that he could isolate metallic chromium by heating the oxide in a charcoal oven, for which he is credited as the one who truly discovered the element.[51][52] Vauquelin was also able to detect traces of chromium in precious gemstones, such as ruby and emerald.[48][53]
During the nineteenth century, chromium was primarily used not only as a component of paints, but in tanning salts as well. For quite some time, the crocoite found in Russia was the main source for such tanning materials. In 1827, a larger chromite deposit was discovered near Baltimore, United States, which quickly met the demand for tanning salts much more adequately than the crocoite that had been used previously.[54] This made the United States the largest producer of chromium products until the year 1848, when larger deposits of chromite were uncovered near the city of Bursa, Turkey.[39] With the development of metallurgy and chemical industries in the Western world, the need for chromium increased.[55]
Chromium is also famous for its reflective, metallic luster when polished. It is used as a protective and decorative coating on car parts, plumbing fixtures, furniture parts and many other items, usually applied by electroplating. Chromium was used for electroplating as early as 1848, but this use only became widespread with the development of an improved process in 1924.[56]
Production[edit]
World production trend of chromium
Chromium, remelted in a horizontal arc zone-refiner, showing large visible crystal grains
Approximately 28.8 million metric tons (Mt) of marketable chromite ore was produced in 2013, and converted into 7.5 Mt of ferrochromium.[41] According to John F. Papp, writing for the USGS, «Ferrochromium is the leading end use of chromite ore, [and] stainless steel is the leading end use of ferrochromium.»[41]
The largest producers of chromium ore in 2013 have been South Africa (48%), Kazakhstan (13%), Turkey (11%), and India (10%), with several other countries producing the rest of about 18% of the world production.[41]
The two main products of chromium ore refining are ferrochromium and metallic chromium. For those products the ore smelter process differs considerably. For the production of ferrochromium, the chromite ore (FeCr2O4) is reduced in large scale in electric arc furnace or in smaller smelters with either aluminium or silicon in an aluminothermic reaction.[57]
Chromium ore output in 2002[58]
For the production of pure chromium, the iron must be separated from the chromium in a two step roasting and leaching process. The chromite ore is heated with a mixture of calcium carbonate and sodium carbonate in the presence of air. The chromium is oxidized to the hexavalent form, while the iron forms the stable Fe2O3. The subsequent leaching at higher elevated temperatures dissolves the chromates and leaves the insoluble iron oxide. The chromate is converted by sulfuric acid into the dichromate.[57]
- 4 FeCr2O4 + 8 Na2CO3 + 7 O2 → 8 Na2CrO4 + 2 Fe2O3 + 8 CO2
- 2 Na2CrO4 + H2SO4 → Na2Cr2O7 + Na2SO4 + H2O
The dichromate is converted to the chromium(III) oxide by reduction with carbon and then reduced in an aluminothermic reaction to chromium.[57]
- Na2Cr2O7 + 2 C → Cr2O3 + Na2CO3 + CO
- Cr2O3 + 2 Al → Al2O3 + 2 Cr
Applications[edit]
The creation of metal alloys account for 85% of the available chromium’s usage. The remainder of chromium is used in the chemical, refractory, and foundry industries.[59]
Metallurgy[edit]
Stainless steel cutlery made from Cromargan 18/10, containing 18% chromium
The strengthening effect of forming stable metal carbides at grain boundaries, and the strong increase in corrosion resistance made chromium an important alloying material for steel. High-speed tool steels contain between 3 and 5% chromium. Stainless steel, the primary corrosion-resistant metal alloy, is formed when chromium is introduced to iron in concentrations above 11%.[60] For stainless steel’s formation, ferrochromium is added to the molten iron. Also, nickel-based alloys have increased strength due to the formation of discrete, stable, metal, carbide particles at the grain boundaries. For example, Inconel 718 contains 18.6% chromium. Because of the excellent high-temperature properties of these nickel superalloys, they are used in jet engines and gas turbines in lieu of common structural materials.[61] ASTM B163 relies on Chromium for condenser and heat-exchanger tubes, while castings with high strength at elevated temperatures that contain Chromium are standardised with ASTM A567.[62] AISI type 332 is used where high temperature would normally cause carburization, oxidation or corrosion.[63] Incoloy 800 «is capable of remaining stable and maintaining its austenitic structure even after long time exposures to high temperatures».[64] Nichrome is used as resistance wire for heating elements in things like toasters and space heaters. These uses make chromium a strategic material. Consequently, during World War II, U.S. road engineers were instructed to avoid chromium in yellow road paint, as it «may become a critical material during the emergency.»[65] The United States likewise considered chromium «essential for the German war industry» and made intense diplomatic efforts to keep it out of the hands of Nazi Germany.[66]
Decorative chrome plating on a motorcycle
The high hardness and corrosion resistance of unalloyed chromium makes it a reliable metal for surface coating; it is still the most popular metal for sheet coating, with its above-average durability, compared to other coating metals.[67] A layer of chromium is deposited on pretreated metallic surfaces by electroplating techniques. There are two deposition methods: thin, and thick. Thin deposition involves a layer of chromium below 1 µm thickness deposited by chrome plating, and is used for decorative surfaces. Thicker chromium layers are deposited if wear-resistant surfaces are needed. Both methods use acidic chromate or dichromate solutions. To prevent the energy-consuming change in oxidation state, the use of chromium(III) sulfate is under development; for most applications of chromium, the previously established process is used.[56]
In the chromate conversion coating process, the strong oxidative properties of chromates are used to deposit a protective oxide layer on metals like aluminium, zinc, and cadmium. This passivation and the self-healing properties of the chromate stored in the chromate conversion coating, which is able to migrate to local defects, are the benefits of this coating method.[68] Because of environmental and health regulations on chromates, alternative coating methods are under development.[69]
Chromic acid anodizing (or Type I anodizing) of aluminium is another electrochemical process that does not lead to the deposition of chromium, but uses chromic acid as an electrolyte in the solution. During anodization, an oxide layer is formed on the aluminium. The use of chromic acid, instead of the normally used sulfuric acid, leads to a slight difference of these oxide layers.[70]
The high toxicity of Cr(VI) compounds, used in the established chromium electroplating process, and the strengthening of safety and environmental regulations demand a search for substitutes for chromium, or at least a change to less toxic chromium(III) compounds.[56]
Pigment[edit]
The mineral crocoite (which is also lead chromate PbCrO4) was used as a yellow pigment shortly after its discovery. After a synthesis method became available starting from the more abundant chromite, chrome yellow was, together with cadmium yellow, one of the most used yellow pigments. The pigment does not photodegrade, but it tends to darken due to the formation of chromium(III) oxide. It has a strong color, and was used for school buses in the United States and for the postal services (for example, the Deutsche Post) in Europe. The use of chrome yellow has since declined due to environmental and safety concerns and was replaced by organic pigments or other alternatives that are free from lead and chromium. Other pigments that are based around chromium are, for example, the deep shade of red pigment chrome red, which is simply lead chromate with lead(II) hydroxide (PbCrO4·Pb(OH)2). A very important chromate pigment, which was used widely in metal primer formulations, was zinc chromate, now replaced by zinc phosphate. A wash primer was formulated to replace the dangerous practice of pre-treating aluminium aircraft bodies with a phosphoric acid solution. This used zinc tetroxychromate dispersed in a solution of polyvinyl butyral. An 8% solution of phosphoric acid in solvent was added just before application. It was found that an easily oxidized alcohol was an essential ingredient. A thin layer of about 10–15 µm was applied, which turned from yellow to dark green when it was cured. There is still a question as to the correct mechanism. Chrome green is a mixture of Prussian blue and chrome yellow, while the chrome oxide green is chromium(III) oxide.[71]
Chromium oxides are also used as a green pigment in the field of glassmaking and also as a glaze for ceramics.[72] Green chromium oxide is extremely lightfast and as such is used in cladding coatings. It is also the main ingredient in infrared reflecting paints, used by the armed forces to paint vehicles and to give them the same infrared reflectance as green leaves.[73]
Other uses[edit]
Red crystal of a ruby laser
Chromium(III) ions present in corundum crystals (aluminium oxide) cause them to be colored red; when corundum appears as such, it is known as a ruby. If the corundum is lacking in chromium(III) ions, it is known as a sapphire.[note 3] A red-colored artificial ruby may also be achieved by doping chromium(III) into artificial corundum crystals, thus making chromium a requirement for making synthetic rubies.[note 4][74] Such a synthetic ruby crystal was the basis for the first laser, produced in 1960, which relied on stimulated emission of light from the chromium atoms in such a crystal. Ruby has a laser transition at 694.3 nanometers, in a deep red color.[75]
Because of their toxicity, chromium(VI) salts are used for the preservation of wood. For example, chromated copper arsenate (CCA) is used in timber treatment to protect wood from decay fungi, wood-attacking insects, including termites, and marine borers.[76] The formulations contain chromium based on the oxide CrO3 between 35.3% and 65.5%. In the United States, 65,300 metric tons of CCA solution were used in 1996.[76]
Chromium(III) salts, especially chrome alum and chromium(III) sulfate, are used in the tanning of leather. The chromium(III) stabilizes the leather by cross linking the collagen fibers.[77] Chromium tanned leather can contain between 4 and 5% of chromium, which is tightly bound to the proteins.[39] Although the form of chromium used for tanning is not the toxic hexavalent variety, there remains interest in management of chromium in the tanning industry. Recovery and reuse, direct/indirect recycling,[78] and «chrome-less» or «chrome-free» tanning are practiced to better manage chromium usage.[79]
The high heat resistivity and high melting point makes chromite and chromium(III) oxide a material for high temperature refractory applications, like blast furnaces, cement kilns, molds for the firing of bricks and as foundry sands for the casting of metals. In these applications, the refractory materials are made from mixtures of chromite and magnesite. The use is declining because of the environmental regulations due to the possibility of the formation of chromium(VI).[57] [80]
Several chromium compounds are used as catalysts for processing hydrocarbons. For example, the Phillips catalyst, prepared from chromium oxides, is used for the production of about half the world’s polyethylene.[81] Fe-Cr mixed oxides are employed as high-temperature catalysts for the water gas shift reaction.[82][83] Copper chromite is a useful hydrogenation catalyst.[84]
Chromates of metals are used in humistor.[85]
Uses of compounds[edit]
- Chromium(IV) oxide (CrO2) is a magnetic compound. Its ideal shape anisotropy, which imparts high coercivity and remnant magnetization, made it a compound superior to γ-Fe2O3. Chromium(IV) oxide is used to manufacture magnetic tape used in high-performance audio tape and standard audio cassettes.[86]
- Chromium(III) oxide (Cr2O3) is a metal polish known as green rouge.[87][88]
- Chromic acid is a powerful oxidizing agent and is a useful compound for cleaning laboratory glassware of any trace of organic compounds.[89] It is prepared by dissolving potassium dichromate in concentrated sulfuric acid, which is then used to wash the apparatus. Sodium dichromate is sometimes used because of its higher solubility (50 g/L versus 200 g/L respectively). The use of dichromate cleaning solutions is now phased out due to the high toxicity and environmental concerns. Modern cleaning solutions are highly effective and chromium free.[90]
- Potassium dichromate is a chemical reagent, used as a titrating agent.[91]
- Chromates are added to drilling muds to prevent corrosion of steel under wet conditions.[92]
- Chrome alum is Chromium(III) potassium sulfate and is used as a mordant (i.e., a fixing agent) for dyes in fabric and in tanning.[93]
Biological role[edit]
The biologically beneficial effects of chromium(III) are debated.[94][95] Chromium is accepted by the U.S. National Institutes of Health as a trace element for its roles in the action of insulin, a hormone that mediates the metabolism and storage of carbohydrate, fat, and protein.[7] The mechanism of its actions in the body, however, have not been defined, leaving in question the essentiality of chromium.[96][97]
In contrast, hexavalent chromium (Cr(VI) or Cr6+) is highly toxic and mutagenic.[98] Ingestion of chromium(VI) in water has been linked to stomach tumors, and it may also cause allergic contact dermatitis (ACD).[99]
«Chromium deficiency», involving a lack of Cr(III) in the body, or perhaps some complex of it, such as glucose tolerance factor, is controversial.[7] Some studies suggest that the biologically active form of chromium (III) is transported in the body via an oligopeptide called low-molecular-weight chromium-binding substance (LMWCr), which might play a role in the insulin signaling pathway.[100]
The chromium content of common foods is generally low (1-13 micrograms per serving).[7][101] The chromium content of food varies widely, due to differences in soil mineral content, growing season, plant cultivar, and contamination during processing.[101] Chromium (and nickel) leach into food cooked in stainless steel, with the effect being largest when the cookware is new. Acidic foods that are cooked for many hours also exacerbate this effect.[102][103]
Dietary recommendations[edit]
There is disagreement on chromium’s status as an essential nutrient. Governmental departments from Australia, New Zealand, India, Japan, and the United States consider chromium essential[104][105][106][107] while the European Food Safety Authority (EFSA) of the European Union does not.[108]
The U.S. National Academy of Medicine (NAM) updated the Estimated Average Requirements (EARs) and the Recommended Dietary Allowances (RDAs) for chromium in 2001. For chromium, there was insufficient information to set EARs and RDAs, so its needs are described as estimates for Adequate Intakes (AIs). The current AIs of chromium for women ages 14 through 50 is 25 μg/day, and the AIs for women ages 50 and above is 20 μg/day. The AIs for women who are pregnant are 30 μg/day, and for women who are lactating, the set AIs are 45 μg/day. The AIs for men ages 14 through 50 are 35 μg/day, and the AIs for men ages 50 and above are 30 μg/day. For children ages 1 through 13, the AIs increase with age from 0.2 μg/day up to 25 μg/day. As for safety, the NAM sets Tolerable Upper Intake Levels (ULs) for vitamins and minerals when the evidence is sufficient. In the case of chromium, there is not yet enough information, hence no UL has been established. Collectively, the EARs, RDAs, AIs, and ULs are the parameters for the nutrition recommendation system known as Dietary Reference Intake (DRI).[107] Australia and New Zealand consider chromium to be an essential nutrient, with an AI of 35 μg/day for men, 25 μg/day for women, 30 μg/day for women who are pregnant, and 45 μg/day for women who are lactating. A UL has not been set due to the lack of sufficient data.[104] India considers chromium to be an essential nutrient, with an adult recommended intake of 33 μg/day.[105] Japan also considers chromium to be an essential nutrient, with an AI of 10 μg/day for adults, including women who are pregnant or lactating. A UL has not been set.[106] The EFSA of the European Union however, does not consider chromium to be an essential nutrient; chromium is the only mineral for which the United States and the European Union disagree.[108][109]
Labeling[edit]
For U.S. food and dietary supplement labeling purposes, the amount of the substance in a serving is expressed as a percent of the Daily Value (%DV). For chromium labeling purposes, 100% of the Daily Value was 120 μg. As of May 27, 2016, the percentage of daily value was revised to 35 μg to bring the chromium intake into a consensus with the official Recommended Dietary Allowance.[110][111] A table of the old and new adult daily values is provided at Reference Daily Intake.
Food sources[edit]
Food composition databases such as those maintained by the U.S. Department of Agriculture do not contain information on the chromium content of foods.[112] A wide variety of animal and vegetable foods contain chromium.[107] Content per serving is influenced by the chromium content of the soil in which the plants are grown, by foodstuffs fed to animals, and by processing methods, as chromium is leached into foods if processed or cooked in stainless steel equipment.[113] One diet analysis study conducted in Mexico reported an average daily chromium intake of 30 micrograms.[114] An estimated 31% of adults in the United States consume multi-vitamin/mineral dietary supplements,[115] which often contain 25 to 60 micrograms of chromium.
Supplementation[edit]
Chromium is an ingredient in total parenteral nutrition (TPN), because deficiency can occur after months of intravenous feeding with chromium-free TPN.[116] It is also added to nutritional products for preterm infants.[117] Although the mechanism of action in biological roles for chromium is unclear, in the United States chromium-containing products are sold as non-prescription dietary supplements in amounts ranging from 50 to 1,000 μg. Lower amounts of chromium are also often incorporated into multi-vitamin/mineral supplements consumed by an estimated 31% of adults in the United States.[115] Chemical compounds used in dietary supplements include chromium chloride, chromium citrate, chromium(III) picolinate, chromium(III) polynicotinate, and other chemical compositions.[7] The benefit of supplements has not been proven.[7][118]
Approved and disapproved health claims[edit]
In 2005, the U.S. Food and Drug Administration had approved a qualified health claim for chromium picolinate with a requirement for very specific label wording: «One small study suggests that chromium picolinate may reduce the risk of insulin resistance, and therefore possibly may reduce the risk of type 2 diabetes. FDA concludes, however, that the existence of such a relationship between chromium picolinate and either insulin resistance or type 2 diabetes is highly uncertain.» At the same time, in answer to other parts of the petition, the FDA rejected claims for chromium picolinate and cardiovascular disease, retinopathy or kidney disease caused by abnormally high blood sugar levels.[119] In 2010, chromium(III) picolinate was approved by Health Canada to be used in dietary supplements. Approved labeling statements include: a factor in the maintenance of good health, provides support for healthy glucose metabolism, helps the body to metabolize carbohydrates and helps the body to metabolize fats.[120] The European Food Safety Authority (EFSA) approved claims in 2010 that chromium contributed to normal macronutrient metabolism and maintenance of normal blood glucose concentration, but rejected claims for maintenance or achievement of a normal body weight, or reduction of tiredness or fatigue.[121]
Given the evidence for chromium deficiency causing problems with glucose management in the context of intravenous nutrition products formulated without chromium,[116] research interest turned to whether chromium supplementation would benefit people who have type 2 diabetes but are not chromium deficient. Looking at the results from four meta-analyses, one reported a statistically significant decrease in fasting plasma glucose levels (FPG) and a non-significant trend in lower hemoglobin A1C.[122] A second reported the same,[123] a third reported significant decreases for both measures,[124] while a fourth reported no benefit for either.[125] A review published in 2016 listed 53 randomized clinical trials that were included in one or more of six meta-analyses. It concluded that whereas there may be modest decreases in FPG and/or HbA1C that achieve statistical significance in some of these meta-analyses, few of the trials achieved decreases large enough to be expected to be relevant to clinical outcome.[126]
Two systematic reviews looked at chromium supplements as a mean of managing body weight in overweight and obese people. One, limited to chromium picolinate, a popular supplement ingredient, reported a statistically significant −1.1 kg (2.4 lb) weight loss in trials longer than 12 weeks.[127] The other included all chromium compounds and reported a statistically significant −0.50 kg (1.1 lb) weight change.[128] Change in percent body fat did not reach statistical significance. Authors of both reviews considered the clinical relevance of this modest weight loss as uncertain/unreliable.[127][128] The European Food Safety Authority reviewed the literature and concluded that there was insufficient evidence to support a claim.[121]
Chromium is promoted as a sports performance dietary supplement, based on the theory that it potentiates insulin activity, with anticipated results of increased muscle mass, and faster recovery of glycogen storage during post-exercise recovery.[118][129][130] A review of clinical trials reported that chromium supplementation did not improve exercise performance or increase muscle strength.[131] The International Olympic Committee reviewed dietary supplements for high-performance athletes in 2018 and concluded there was no need to increase chromium intake for athletes, nor support for claims of losing body fat.[132]
Fresh-water fish[edit]
Chromium is naturally present in the environment in trace amounts, but industrial use in rubber and stainless steel manufacturing, chrome plating, dyes for textiles, tanneries and other uses contaminates aquatic systems. In Bangladesh, rivers in or downstream from industrialized areas exhibit heavy metal contamination. Irrigation water standards for chromium are 0.1 mg/L, but some rivers are more than five times that amount. The standard for fish for human consumption is less than 1 mg/kg, but many tested samples were more than five times that amount.[133] Chromium, especially hexavalent chromium, is highly toxic to fish because it is easily absorbed across the gills, readily enters blood circulation, crosses cell membranes and bioconcentrates up the food chain. In contrast, the toxicity of trivalent chromium is very low, attributed to poor membrane permeability and little biomagnification.[134]
Acute and chronic exposure to chromium(VI) affects fish behavior, physiology, reproduction and survival. Hyperactivity and erratic swimming have been reported in contaminated environments. Egg hatching and fingerling survival are affected. In adult fish there are reports of histopathological damage to liver, kidney, muscle, intestines, and gills. Mechanisms include mutagenic gene damage and disruptions of enzyme functions.[134]
There is evidence that fish may not require chromium, but benefit from a measured amount in diet. In one study, juvenile fish gained weight on a zero chromium diet, but the addition of 500 μg of chromium in the form of chromium chloride or other supplement types, per kilogram of food (dry weight), increased weight gain. At 2,000 μg/kg the weight gain was no better than with the zero chromium diet, and there were increased DNA strand breaks.[135]
Precautions[edit]
Water-insoluble chromium(III) compounds and chromium metal are not considered a health hazard, while the toxicity and carcinogenic properties of chromium(VI) have been known for a long time.[136] Because of the specific transport mechanisms, only limited amounts of chromium(III) enter the cells. Acute oral toxicity ranges between 50 and 150 mg/kg.[137] A 2008 review suggested that moderate uptake of chromium(III) through dietary supplements poses no genetic-toxic risk.[138] In the US, the Occupational Safety and Health Administration (OSHA) has designated an air permissible exposure limit (PEL) in the workplace as a time-weighted average (TWA) of 1 mg/m3. The National Institute for Occupational Safety and Health (NIOSH) has set a recommended exposure limit (REL) of 0.5 mg/m3, time-weighted average. The IDLH (immediately dangerous to life and health) value is 250 mg/m3.[139]
Chromium(VI) toxicity[edit]
The acute oral toxicity for chromium(VI) ranges between 1.5 and 3.3 mg/kg.[137] In the body, chromium(VI) is reduced by several mechanisms to chromium(III) already in the blood before it enters the cells. The chromium(III) is excreted from the body, whereas the chromate ion is transferred into the cell by a transport mechanism, by which also sulfate and phosphate ions enter the cell. The acute toxicity of chromium(VI) is due to its strong oxidant properties. After it reaches the blood stream, it damages the kidneys, the liver and blood cells through oxidation reactions. Hemolysis, renal, and liver failure result. Aggressive dialysis can be therapeutic.[140]
The carcinogenity of chromate dust has been known for a long time, and in 1890 the first publication described the elevated cancer risk of workers in a chromate dye company.[141][142] Three mechanisms have been proposed to describe the genotoxicity of chromium(VI). The first mechanism includes highly reactive hydroxyl radicals and other reactive radicals which are by products of the reduction of chromium(VI) to chromium(III). The second process includes the direct binding of chromium(V), produced by reduction in the cell, and chromium(IV) compounds to the DNA. The last mechanism attributed the genotoxicity to the binding to the DNA of the end product of the chromium(III) reduction.[143][144]
Chromium salts (chromates) are also the cause of allergic reactions in some people. Chromates are often used to manufacture, amongst other things, leather products, paints, cement, mortar and anti-corrosives. Contact with products containing chromates can lead to allergic contact dermatitis and irritant dermatitis, resulting in ulceration of the skin, sometimes referred to as «chrome ulcers». This condition is often found in workers that have been exposed to strong chromate solutions in electroplating, tanning and chrome-producing manufacturers.[145][146]
Environmental issues[edit]
Because chromium compounds were used in dyes, paints, and leather tanning compounds, these compounds are often found in soil and groundwater at active and abandoned industrial sites, needing environmental cleanup and remediation. Primer paint containing hexavalent chromium is still widely used for aerospace and automobile refinishing applications.[147]
In 2010, the Environmental Working Group studied the drinking water in 35 American cities in the first nationwide study. The study found measurable hexavalent chromium in the tap water of 31 of the cities sampled, with Norman, Oklahoma, at the top of list; 25 cities had levels that exceeded California’s proposed limit.[148]
The more toxic hexavalent chromium form can be reduced to the less soluble trivalent oxidation state in soils by organic matter, ferrous iron, sulfides, and other reducing agents, with the rates of such reduction being faster under more acidic conditions than under more alkaline ones. In contrast, trivalent chromium can be oxidized to hexavalent chromium in soils by manganese oxides, such as Mn(III) and Mn(IV) compounds. Since the solubility and toxicity of chromium (VI) are greater that those of chromium (III), the oxidation-reduction conversions between the two oxidation states have implications for movement and bioavailability of chromium in soils, groundwater, and plants.[149]
Notes[edit]
- ^ The melting/boiling point of transition metals are usually higher compared to the alkali metals, alkaline earth metals, and nonmetals, which is why the range of elements compared to chromium differed between comparisons
- ^ Most common oxidation states of chromium are in bold. The right column lists a representative compound for each oxidation state.
- ^ Any color of corundum (disregarding red) is known as a sapphire. If the corundum is red, then it is a ruby. Sapphires are not required to be blue corundum crystals, as sapphires can be other colors such as yellow and purple
- ^ When Cr3+
replaces Al3+
in corundum (aluminium oxide, Al2O3), pink sapphire or ruby is formed, depending on the amount of chromium.
References[edit]
- ^ «Standard Atomic Weights: Chromium». CIAAW. 1983.
- ^ a b Fawcett, Eric (1988). «Spin-density-wave antiferromagnetism in chromium». Reviews of Modern Physics. 60: 209. Bibcode:1988RvMP…60..209F. doi:10.1103/RevModPhys.60.209.
- ^ Weast, Robert (1984). CRC, Handbook of Chemistry and Physics. Boca Raton, Florida: Chemical Rubber Company Publishing. pp. E110. ISBN 0-8493-0464-4.
- ^ Brandes, EA; Greenaway, HT; Stone, HEN (1956). «Ductility in Chromium». Nature. 178 (4533): 587. Bibcode:1956Natur.178..587B. doi:10.1038/178587a0. S2CID 4221048.
- ^ a b c Coblentz, WW; Stair, R. «Reflecting power of beryllium, chromium, and several other metals» (PDF). National Institute of Standards and Technology. NIST Publications. Retrieved 11 October 2018.
- ^ χρῶμα, Henry George Liddell, Robert Scott, A Greek-English Lexicon, on Perseus
- ^ a b c d e f «Chromium». Office of Dietary Supplements, US National Institutes of Health. 2016. Retrieved 26 June 2016.
- ^ «Scientific Opinion on Dietary Reference Values for chromium». European Food Safety Authority. 18 September 2014. Retrieved 20 March 2018.
- ^ «Substance Information — ECHA». echa.europa.eu. Retrieved 17 January 2022.
- ^ EPA (August 2000). «Abandoned Mine Site Characterization and Cleanup Handbook» (PDF). United States Environmental Protection Agency. Retrieved 8 September 2019.
- ^ «The Nature of X-Ray Photoelectron Spectra». CasaXPS. Casa Software Ltd. 2005. Retrieved 10 March 2019.
- ^ Schwarz, W. H. Eugen (April 2010). «The Full Story of the Electron Configurations of the Transition Elements» (PDF). Journal of Chemical Education. 87 (4): 444–8. Bibcode:2010JChEd..87..444S. doi:10.1021/ed8001286. Retrieved 9 November 2018.
- ^ Greenwood and Earnshaw, pp. 1004–5
- ^ a b Lind, Michael Acton (1972). «The infrared reflectivity of chromium and chromium-aluminium alloys». Iowa State University Digital Repository. Iowa State University. Bibcode:1972PhDT……..54L. Retrieved 4 November 2018.
- ^ Bos, Laurence William (1969). «Optical properties of chromium-manganese alloys». Iowa State University Digital Repository. Iowa State University. Bibcode:1969PhDT…….118B. Retrieved 4 November 2018.
- ^ Wallwork, GR (1976). «The oxidation of alloys». Reports on Progress in Physics. 39 (5): 401–485. Bibcode:1976RPPh…39..401W. doi:10.1088/0034-4885/39/5/001. S2CID 250853920.
- ^ a b c d e f g h Holleman, Arnold F; Wiber, Egon; Wiberg, Nils (1985). «Chromium». Lehrbuch der Anorganischen Chemie (in German) (91–100 ed.). Walter de Gruyter. pp. 1081–1095. ISBN 978-3-11-007511-3.
- ^ National Research Council (U.S.). Committee on Coatings (1970). High-temperature oxidation-resistant coatings: coatings for protection from oxidation of superalloys, refractory metals, and graphite. National Academy of Sciences. ISBN 978-0-309-01769-5.
- ^ a b Kondev, F. G.; Wang, M.; Huang, W. J.; Naimi, S.; Audi, G. (2021). «The NUBASE2020 evaluation of nuclear properties» (PDF). Chinese Physics C. 45 (3): 030001. doi:10.1088/1674-1137/abddae.
- ^ «Live Chart of Nuclides». International Atomic Energy Agency — Nuclear Data Section. Retrieved 18 October 2018.
- ^ Birck, JL; Rotaru, M; Allegre, C (1999). «53Mn-53Cr evolution of the early solar system». Geochimica et Cosmochimica Acta. 63 (23–24): 4111–4117. Bibcode:1999GeCoA..63.4111B. doi:10.1016/S0016-7037(99)00312-9.
- ^ Frei, Robert; Gaucher, Claudio; Poulton, Simon W; Canfield, Don E (2009). «Fluctuations in Precambrian atmospheric oxygenation recorded by chromium isotopes». Nature. 461 (7261): 250–253. Bibcode:2009Natur.461..250F. doi:10.1038/nature08266. PMID 19741707. S2CID 4373201.
- ^ a b Kotaś, J.; Stasicka, Z. (2000). «Chromium occurrence in the environment and methods of its speciation». Environmental Pollution. 107 (3): 263–283. doi:10.1016/S0269-7491(99)00168-2. PMID 15092973.
- ^ Puigdomenech, Ignasi Hydra/Medusa Chemical Equilibrium Database and Plotting Software Archived 5 June 2013 at the Wayback Machine (2004) KTH Royal Institute of Technology
- ^ Clark, Jim. «Oxidation states (oxidation numbers)». Chemguide. Retrieved 3 October 2018.
- ^ a b Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ^ Theopold, Klaus H.; Kucharczyk, Robin R. (15 December 2011), «Chromium: Organometallic Chemistry», in Scott, Robert A. (ed.), Encyclopedia of Inorganic and Bioinorganic Chemistry, John Wiley & Sons, Ltd, pp. eibc0042, doi:10.1002/9781119951438.eibc0042, ISBN 978-1-119-95143-8.
- ^ Cotton, FA; Walton, RA (1993). Multiple Bonds Between Metal Atoms. Oxford: Oxford University Press. ISBN 978-0-19-855649-7.
- ^ «Chromium(III) compounds». National Pollutant Inventory. Commonwealth of Australia. Retrieved 8 November 2018.
- ^ Assfalg, M; Banci, L; Bertini, I; Bruschi, M; Michel, C; Giudici-Orticoni, M; Turano, P (31 July 2002). «NMR structural characterization of the reduction of chromium(VI) to chromium(III) by cytochrome c7». Protein Data Bank (1LM2). doi:10.2210/pdb1LM2/pdb. Retrieved 8 November 2018.
- ^ Luther, George W. (2016). «Introduction to Transition Metals». Inorganic Chemistry for Geochemistry & Environmental Sciences: Fundamentals & Applications. Hydrate (Solvate) Isomers. John Wiley & Sons. p. 244. ISBN 978-1118851371. Retrieved 7 August 2019.
- ^ Gumerova, Nadiia I.; Roller, Alexander; Giester, Gerald; Krzystek, J.; Cano, Joan; Rompel, Annette (19 February 2020). «Incorporation of CrIII into a Keggin Polyoxometalate as a Chemical Strategy to Stabilize a Labile {CrIIIO4} Tetrahedral Conformation and Promote Unattended Single-Ion Magnet Properties». Journal of the American Chemical Society. 142 (7): 3336–3339. doi:10.1021/jacs.9b12797. ISSN 0002-7863. PMC 7052816. PMID 31967803.
- ^ Seppelt, Konrad (28 January 2015). «Molecular Hexafluorides». Chemical Reviews. 115 (2): 1296–1306. doi:10.1021/cr5001783. ISSN 0009-2665. PMID 25418862.
- ^ Haxhillazi, Gentiana (2003). Preparation, Structure and Vibrational Spectroscopy of Tetraperoxo Complexes of CrV+, VV+, NbV+ and TaV+ (PhD thesis). University of Siegen.
- ^ Thaler, Eric G.; Rypdal, Kristin; Haaland, Arne; Caulton, Kenneth G. (1 June 1989). «Structure and reactivity of chromium(4+) tert-butoxide». Inorganic Chemistry. 28 (12): 2431–2434. doi:10.1021/ic00311a035. ISSN 0020-1669.
- ^ Nguyen, T; Sutton, AD; Brynda, M; Fettinger, JC; Long, GJ; Power, PP (2005). «Synthesis of a stable compound with fivefold bonding between two chromium(I) centers». Science. 310 (5749): 844–847. Bibcode:2005Sci…310..844N. doi:10.1126/science.1116789. PMID 16179432. S2CID 42853922.
- ^ Emsley, John (2001). «Chromium». Nature’s Building Blocks: An A–Z Guide to the Elements. Oxford, England, UK: Oxford University Press. pp. 495–498. ISBN 978-0-19-850340-8.
- ^ John Rieuwerts (14 July 2017). The Elements of Environmental Pollution. Taylor & Francis. ISBN 978-1-135-12679-7.
- ^ a b c National Research Council (U.S.). Committee on Biologic Effects of Atmospheric Pollutants (1974). Chromium. National Academy of Sciences. ISBN 978-0-309-02217-0.
- ^ Champion, Marc (11 January 2018). «How a Trump SoHo Partner Ended Up With Toxic Mining Riches From Kazakhstan». Bloomberg.com. Bloomberg L.P. Retrieved 21 January 2018.
- ^ a b c d Papp, John F. «Mineral Yearbook 2015: Chromium» (PDF). United States Geological Survey. Retrieved 3 June 2015.
- ^ Fleischer, Michael (1982). «New Mineral Names» (PDF). American Mineralogist. 67: 854–860.
- ^ Chromium (with location data), Mindat.
- ^ Chromium from Udachnaya-Vostochnaya pipe, Daldyn, Daldyn-Alakit kimberlite field, Saha Republic (Sakha Republic; Yakutia), Eastern-Siberian Region, Russia, Mindat.
- ^ Gonzalez, A. R.; Ndung’u, K.; Flegal, A. R. (2005). «Natural Occurrence of Hexavalent Chromium in the Aromas Red Sands Aquifer, California». Environmental Science and Technology. 39 (15): 5505–5511. Bibcode:2005EnST…39.5505G. doi:10.1021/es048835n. PMID 16124280.
- ^ Meyer, RJ (1962). Chrom : Teil A — Lieferung 1. Geschichtliches · Vorkommen · Technologie · Element bis Physikalische Eigenschaften (in German). Berlin, Heidelberg: Springer Berlin Heidelberg Imprint Springer. ISBN 978-3-662-11865-8. OCLC 913810356.
- ^ Lehmanni, Iohannis Gottlob (1766). De Nova Minerae Plumbi Specie Crystallina Rubra, Epistola.
- ^ a b c Guertin, Jacques; Jacobs, James Alan & Avakian, Cynthia P. (2005). Chromium (VI) Handbook. CRC Press. pp. 7–11. ISBN 978-1-56670-608-7.
- ^ Weeks, Mary Elvira (1932). «The discovery of the elements. V. Chromium, molybdenum, tungsten and uranium». Journal of Chemical Education. 9 (3): 459–73. Bibcode:1932JChEd…9..459W. doi:10.1021/ed009p459. ISSN 0021-9584.
- ^ Casteran, Rene. «Chromite mining». Oregon Encyclopedia. Portland State University and the Oregon Historical Society. Retrieved 1 October 2018.
- ^ Vauquelin, Louis Nicolas (1798). «Memoir on a New Metallic Acid which exists in the Red Lead of Siberia». Journal of Natural Philosophy, Chemistry, and the Arts. 3: 145–146.
- ^ Glenn, William (1895). «Chrome in the Southern Appalachian Region». Transactions of the American Institute of Mining, Metallurgical and Petroleum Engineers. 25: 482.
- ^ van der Krogt, Peter. «Chromium». Retrieved 24 August 2008.
- ^ Ortt, Richard A Jr. «Soldier’s Delight, Baltimore Country». Maryland Department of Natural Resources. Maryland Geological Survey. Retrieved 13 May 2019.
- ^ Bilgin, Arif; Çağlar, Burhan (eds.). Klasikten Moderne Osmanlı Ekonomisi. Turkey: Kronik Kitap. p. 240.
- ^ a b c Dennis, JK; Such, TE (1993). «History of Chromium Plating». Nickel and Chromium Plating. Woodhead Publishing. pp. 9–12. ISBN 978-1-85573-081-6.
- ^ a b c d Papp, John F. & Lipin, Bruce R. (2006). «Chromite». Industrial Minerals & Rocks: Commodities, Markets, and Uses (7th ed.). SME. ISBN 978-0-87335-233-8.
- ^ Papp, John F. «Mineral Yearbook 2002: Chromium» (PDF). United States Geological Survey. Retrieved 16 February 2009.
- ^ Morrison, RD; Murphy, BL (4 August 2010). Environmental Forensics: Contaminant Specific Guide. Academic Press. ISBN 9780080494784.
- ^ Davis, JR (2000). Alloy digest sourcebook : stainless steels (in Afrikaans). Materials Park, OH: ASM International. pp. 1–5. ISBN 978-0-87170-649-2. OCLC 43083287.
- ^ Bhadeshia, HK. «Nickel-Based Superalloys». University of Cambridge. Archived from the original on 25 August 2006. Retrieved 17 February 2009.
- ^ «Chromium, Nickel and Welding». IARC Monographs. International Agency for Research on Cancer. 49: 49–50. 1990.
- ^ «Stainless Steel Grade 332 (UNS S33200)». AZoNetwork. 5 March 2013.
- ^ «Super Alloy INCOLOY Alloy 800 (UNS N08800)». AZoNetwork. 3 July 2013.
- ^ «Manual On Uniform Traffic Control Devices (War Emergency Edition)» (PDF). Washington, DC: American Associan of State Highway Officials. November 1942. p. 52. Retrieved 8 July 2021.
- ^ State Department, United States. «Allied Relations and Negotiations with Turkey» (PDF). Archived (PDF) from the original on 9 November 2020.
- ^ Breitsameter, M (15 August 2002). «Thermal Spraying versus Hard Chrome Plating». Azo Materials. AZoNetwork. Retrieved 1 October 2018.
- ^ Edwards, J (1997). Coating and Surface Treatment Systems for Metals. Finishing Publications Ltd. and ASMy International. pp. 66–71. ISBN 978-0-904477-16-0.
- ^ Zhao J, Xia L, Sehgal A, Lu D, McCreery RL, Frankel GS (2001). «Effects of chromate and chromate conversion coatings on corrosion of aluminum alloy 2024-T3». Surface and Coatings Technology. 140 (1): 51–57. doi:10.1016/S0257-8972(01)01003-9. hdl:1811/36519.
- ^ Cotell, CM; Sprague, JA; Smidt, FA (1994). ASM Handbook: Surface Engineering. ASM International. ISBN 978-0-87170-384-2. Retrieved 17 February 2009.
- ^ Gettens, Rutherford John (1966). «Chrome yellow». Painting Materials: A Short Encyclopaedia. Courier Dover Publications. pp. 105–106. ISBN 978-0-486-21597-6.
- ^ Gerd Anger et al. «Chromium Compounds» Ullmann’s Encyclopedia of Industrial Chemistry 2005, Wiley-VCH, Weinheim. doi:10.1002/14356007.a07_067
- ^ Marrion, Alastair (2004). The chemistry and physics of coatings. Royal Society of Chemistry. pp. 287–. ISBN 978-0-85404-604-1.
- ^ Moss, SC; Newnham, RE (1964). «The chromium position in ruby» (PDF). Zeitschrift für Kristallographie. 120 (4–5): 359–363. Bibcode:1964ZK….120..359M. doi:10.1524/zkri.1964.120.4-5.359.
- ^ Webb, Colin E; Jones, Julian DC (2004). Handbook of Laser Technology and Applications: Laser design and laser systems. CRC Press. pp. 323–. ISBN 978-0-7503-0963-9.
- ^ a b Hingston, J; Collins, CD; Murphy, RJ; Lester, JN (2001). «Leaching of chromated copper arsenate wood preservatives: a review». Environmental Pollution. 111 (1): 53–66. doi:10.1016/S0269-7491(00)00030-0. PMID 11202715.
- ^ Brown, EM (1997). «A Conformational Study of Collagen as Affected by Tanning Procedures». Journal of the American Leather Chemists Association. 92: 225–233.
- ^ Sreeram, K.; Ramasami, T. (2003). «Sustaining tanning process through conservation, recovery and better utilization of chromium». Resources, Conservation and Recycling. 38 (3): 185–212. doi:10.1016/S0921-3449(02)00151-9.
- ^ Qiang, Taotao; Gao, Xin; Ren, Jing; Chen, Xiaoke; Wang, Xuechuan (9 December 2015). «A Chrome-Free and Chrome-Less Tanning System Based on the Hyperbranched Polymer». ACS Sustainable Chemistry & Engineering. 4 (3): 701–707. doi:10.1021/acssuschemeng.5b00917.
- ^ Barnhart, Joel (1997). «Occurrences, Uses, and Properties of Chromium». Regulatory Toxicology and Pharmacology. 26 (1): S3–S7. doi:10.1006/rtph.1997.1132. ISSN 0273-2300. PMID 9380835.
- ^ Weckhuysen, Bert M; Schoonheydt, Robert A (1999). «Olefin polymerization over supported chromium oxide catalysts» (PDF). Catalysis Today. 51 (2): 215–221. doi:10.1016/S0920-5861(99)00046-2. hdl:1874/21357. S2CID 98324455.
- ^ Twigg, MVE (1989). «The Water-Gas Shift Reaction». Catalyst Handbook. ISBN 978-0-7234-0857-4.
- ^ Rhodes, C; Hutchings, GJ; Ward, AM (1995). «Water-gas shift reaction: Finding the mechanistic boundary». Catalysis Today. 23: 43–58. doi:10.1016/0920-5861(94)00135-O.
- ^ Lazier, WA & Arnold, HR (1939). «Copper Chromite Catalyst». Organic Syntheses. 19: 31.; Collective Volume, vol. 2, p. 142
- ^ Kitagawa, Hiraku (April 1989). «LiTe and CaTe thin-film junctions as humidity sensors». Sensors and Actuators. 16 (4): 369–378. doi:10.1016/0250-6874(89)85007-3.
- ^ Mallinson, John C. (1993). «Chromium Dioxide». The foundations of magnetic recording. Academic Press. p. 32. ISBN 978-0-12-466626-9.
- ^ Toshiro Doi; Ioan D. Marinescu; Syuhei Kurokawa (30 November 2011). Advances in CMP Polishing Technologies. William Andrew. pp. 60–. ISBN 978-1-4377-7860-1.
- ^ Baral, Anil; Engelken, Robert D. (2002). «Chromium-based regulations and greening in metal finishing industries in the USA». Environmental Science & Policy. 5 (2): 121–133. doi:10.1016/S1462-9011(02)00028-X.
- ^ Soderberg, Tim (3 June 2019). «Oxidizing Agents». LibreTexts. MindTouch. Retrieved 8 September 2019.
- ^ Roth, Alexander (1994). Vacuum Sealing Techniques. Springer Science & Business Media. pp. 118–. ISBN 978-1-56396-259-2.
- ^ Lancashire, Robert J (27 October 2008). «Determination of iron using potassium dichromate: Redox indicators». The Department of Chemistry UWI, Jamaica. Retrieved 8 September 2019.
- ^ Garverick, Linda (1994). Corrosion in the Petrochemical Industry. ASM International. ISBN 978-0-87170-505-1.
- ^ Shahid Ul-Islam (18 July 2017). Plant-Based Natural Products: Derivatives and Applications. Wiley. pp. 74–. ISBN 978-1-119-42388-1.
- ^ Vincent, JB (2013). «Chapter 6. Chromium: Is It Essential, Pharmacologically Relevant, or Toxic?». In Astrid Sigel; Helmut Sigel; Roland KO Sigel (eds.). Interrelations between Essential Metal Ions and Human Diseases. Metal Ions in Life Sciences. Vol. 13. Springer. pp. 171–198. doi:10.1007/978-94-007-7500-8_6. ISBN 978-94-007-7499-5. PMID 24470092.
- ^ Maret, Wolfgang (2019). «Chapter 9. Chromium Supplementation in Human Health, Metabolic Syndrome, and Diabetes». In Sigel, Astrid; Freisinger, Eva; Sigel, Roland K. O.; Carver, Peggy L. (eds.). Essential Metals in Medicine:Therapeutic Use and Toxicity of Metal Ions in the Clinic. Metal Ions in Life Sciences. Vol. 19. Berlin: de Gruyter GmbH. pp. 231–251. doi:10.1515/9783110527872-015. ISBN 978-3-11-052691-2. PMID 30855110.
- ^ European Food Safety Authority (2014). «Scientific Opinion on Dietary Reference Values for chromium». EFSA Journal. 12 (10): 3845. doi:10.2903/j.efsa.2014.3845.
- ^ Di Bona KR, Love S, Rhodes NR, McAdory D, Sinha SH, Kern N, Kent J, Strickland J, Wilson A, Beaird J, Ramage J, Rasco JF, Vincent JB (2011). «Chromium is not an essential trace element for mammals: effects of a «low-chromium» diet». J Biol Inorg Chem. 16 (3): 381–390. doi:10.1007/s00775-010-0734-y. PMID 21086001. S2CID 22376660.
- ^ Wise, SS; Wise, JP, Sr (2012). «Chromium and genomic stability». Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis. 733 (1–2): 78–82. doi:10.1016/j.mrfmmm.2011.12.002. PMC 4138963. PMID 22192535.
- ^ «ToxFAQs: Chromium». Agency for Toxic Substances & Disease Registry, Centers for Disease Control and Prevention. February 2001. Archived from the original on 8 July 2014. Retrieved 2 October 2007.
- ^ Vincent, JB (2015). «Is the Pharmacological Mode of Action of Chromium(III) as a Second Messenger?». Biological Trace Element Research. 166 (1): 7–12. doi:10.1007/s12011-015-0231-9. PMID 25595680. S2CID 16895342.
- ^ a b Thor, MY; Harnack, L; King, D; Jasthi, B; Pettit, J (2011). «Evaluation of the comprehensiveness and reliability of the chromium composition of foods in the literature». Journal of Food Composition and Analysis. 24 (8): 1147–1152. doi:10.1016/j.jfca.2011.04.006. PMC 3467697. PMID 23066174.
- ^ Kamerud KL; Hobbie KA; Anderson KA (2013). «Stainless steel leaches nickel and chromium into foods during cooking». Journal of Agricultural and Food Chemistry. 61 (39): 9495–9501. doi:10.1021/jf402400v. PMC 4284091. PMID 23984718.
- ^ Flint GN; Packirisamy S (1997). «Purity of food cooked in stainless steel utensils». Food Additives and Contaminants. 14 (2): 115–126. doi:10.1080/02652039709374506. PMID 9102344.
- ^ a b «Chromium». Nutrient Reference Values for Australia and New Zealand. 2014. Retrieved 4 October 2018.
- ^ a b «Nutrient Requirements and Recommended Dietary Allowances for Indians: A Report of the Expert Group of the Indian Council of Medical Research. pp.283-295 (2009)» (PDF). Archived from the original (PDF) on 15 June 2016. Retrieved 3 October 2018.
- ^ a b «DRIs for Chromium (μg/day)» (PDF). Overview of Dietary Reference Intakes for Japanese. 2015. p. 41. Retrieved 4 October 2018.
- ^ a b c «Chromium. IN: Dietary Reference Intakes for Vitamin A, Vitamin K, Arsenic, Boron, Chromium, Chromium, Iodine, Iron, Manganese, Molybdenum, Nickel, Silicon, Vanadium, and Chromium». Institute of Medicine (U.S.) Panel on Micronutrients, National Academy Press. 2001. pp. 197–223. Retrieved 3 October 2018.
- ^ a b «Overview on Dietary Reference Values for the EU population as derived by the EFSA Panel on Dietetic Products, Nutrition and Allergies» (PDF). 2017.
- ^ Tolerable Upper Intake Levels For Vitamins And Minerals (PDF), European Food Safety Authority, 2006
- ^ «Federal Register May 27, 2016 Food Labeling: Revision of the Nutrition and Supplement Facts Labels. FR page 33982» (PDF).
- ^ «Daily Value Reference of the Dietary Supplement Label Database (DSLD)». Dietary Supplement Label Database (DSLD). Archived from the original on 7 April 2020. Retrieved 16 May 2020.
- ^ «USDA Food Composition Databases». United States Department of Agriculture Agricultural Research Service. April 2018. Retrieved 4 October 2018.
- ^
Kumpulainen, JT (1992). «Chromium content of foods and diets». Biological Trace Element Research. 32 (1–3): 9–18. doi:10.1007/BF02784582. PMID 1375091. S2CID 10189109. - ^ Grijalva Haro, MI; Ballesteros Vázquez, MN; Cabrera Pacheco, RM (2001). «Chromium content in foods and dietary intake estimation in the Northwest of Mexico». Arch Latinoam Nutr (in Spanish). 51 (1): 105–110. PMID 11515227.
- ^ a b Kantor, Elizabeth D; Rehm, Colin D; Du, Mengmeng; White, Emily; Giovannucci, Edward L (11 October 2017). «Trends in Dietary Supplement Use Among US Adults From 1999-2012». JAMA. 316 (14): 1464–1474. doi:10.1001/jama.2016.14403. PMC 5540241. PMID 27727382.
- ^ a b Stehle, P; Stoffel-Wagner, B; Kuh, KS (6 April 2014). «Parenteral trace element provision: recent clinical research and practical conclusions». European Journal of Clinical Nutrition. 70 (8): 886–893. doi:10.1038/ejcn.2016.53. PMC 5399133. PMID 27049031.
- ^ Finch, Carolyn Weiglein (February 2015). «Review of trace mineral requirements for preterm infants: What are the current recommendations for clinical practice?». Nutrition in Clinical Practice. 30 (1): 44–58. doi:10.1177/0884533614563353. PMID 25527182.
- ^ a b Vincent, John B (2010). «Chromium: Celebrating 50 years as an essential element?». Dalton Transactions. 39 (16): 3787–3794. doi:10.1039/B920480F. PMID 20372701.
- ^ FDA Qualified Health Claims: Letters of Enforcement Discretion, Letters of Denial U.S. Food and Drug Administration, Docket #2004Q-0144 (August 2005).
- ^ «Monograph: Chromium (from Chromium picolinate)». Health Canada. 9 December 2009. Retrieved 18 October 2018.
- ^ a b Scientific Opinion on the substantiation of health claims related to chromium and contribution to normal macronutrient metabolism (ID 260, 401, 4665, 4666, 4667), maintenance of normal blood glucose concentrations (ID 262, 4667), contribution to the maintenance or achievement of a normal body weight (ID 339, 4665, 4666), and reduction of tiredness and fatigue (ID 261) pursuant to Article 13(1) of Regulation (EC) No 1924/2006 Archived 21 April 2020 at the Wayback Machine European Food Safety Authority EFSA J 2010;8(10)1732.
- ^ San Mauro-Martin I, Ruiz-León AM, Camina-Martín MA, Garicano-Vilar E, Collado-Yurrita L, Mateo-Silleras B, Redondo P (2016). «[Chromium supplementation in patients with type 2 diabetes and high risk of type 2 diabetes: a meta-analysis of randomized controlled trials]». Nutr Hosp (in Spanish). 33 (1): 27. doi:10.20960/nh.27. PMID 27019254.
- ^ Abdollahi, M; Farshchi, A; Nikfar, S; Seyedifar, M (2013). «Effect of chromium on glucose and lipid profiles in patients with type 2 diabetes; a meta-analysis review of randomized trials». J Pharm Pharm Sci. 16 (1): 99–114. doi:10.18433/J3G022. PMID 23683609.
- ^ Suksomboon, N; Poolsup, N; Yuwanakorn, A (17 March 2013). «Systematic review and meta-analysis of the efficacy and safety of chromium supplementation in diabetes». J Clin Pharm Ther. 39 (3): 292–306. doi:10.1111/jcpt.12147. PMID 24635480. S2CID 22326435.
- ^ Bailey, Christopher H (January 2014). «Improved meta-analytic methods show no effect of chromium supplements on fasting glucose». Biol Trace Elem Res. 157 (1): 1–8. doi:10.1007/s12011-013-9863-9. PMID 24293356. S2CID 2441511.
- ^ Costello, Rebecca B; Dwyer, Johanna T; Bailey, Regan L (30 May 2016). «Chromium supplements for glycemic control in type 2 diabetes: limited evidence of effectiveness». Nutrition Reviews. 74 (7): 455–468. doi:10.1093/nutrit/nuw011. PMC 5009459. PMID 27261273.
- ^ a b Tian, Honglian; Guo, Xiaohu; Wang, Xiyu; He, Zhiyun; Sun, Rao; Ge, Sai; Zhang, Zongjiu (2013). «Chromium picolinate supplementation for overweight or obese adults». Cochrane Database Syst Rev. 2013 (11): CD010063. doi:10.1002/14651858.CD010063.pub2. PMC 7433292. PMID 24293292.
- ^ a b Onakpoya, I; Posadzki, P; Ernst, E (2013). «Chromium supplementation in overweight and obesity: a systematic review and meta-analysis of randomized clinical trials». Obes Rev. 14 (6): 496–507. doi:10.1111/obr.12026. PMID 23495911. S2CID 21832321.
- ^ Lefavi RG, Anderson RA, Keith RE, Wilson GD, McMillan JL, Stone MH (1992). «Efficacy of chromium supplementation in athletes: emphasis on anabolism». International Journal of Sport Nutrition. 2 (2): 111–122. doi:10.1123/ijsn.2.2.111. PMID 1299487.
- ^ Vincent JB (2003). «The potential value and toxicity of chromium picolinate as a nutritional supplement, weight loss agent and muscle development agent». Sports Med. 33 (3): 213–230. doi:10.2165/00007256-200333030-00004. PMID 12656641. S2CID 9981172.
- ^ Jenkinson DM, Harbert AJ (2008). «Supplements and sports». Am Fam Physician. 78 (9): 1039–1046. PMID 19007050.
- ^ Maughan RJ, Burke LM, et al. (2018). «IOC Consensus Statement: Dietary Supplements and the High-Performance Athlete». International Journal of Sport Nutrition and Exercise Metabolism. 28 (2): 104–125. doi:10.1123/ijsnem.2018-0020. PMC 5867441. PMID 29589768.
- ^ Islam MM, Karim MR, Zheng X, Li X (2018). «Heavy Metal and Metalloid Pollution of Soil, Water and Foods in Bangladesh: A Critical Review». International Journal of Environmental Research and Public Health. 15 (12): 2825. doi:10.3390/ijerph15122825. PMC 6313774. PMID 30544988.
- ^ a b Bakshi A, Panigrahi AK (2018). «A comprehensive review on chromium induced alterations in fresh water fishes». Toxicol Rep. 5: 440–447. doi:10.1016/j.toxrep.2018.03.007. PMC 5977408. PMID 29854615.
- ^ Ahmed AR, Jha AN, Davies SJ (2012). «The efficacy of chromium as a growth enhancer for mirror carp (Cyprinus carpio L): an integrated study using biochemical, genetic, and histological responses». Biol Trace Elem Res. 148 (2): 187–197. doi:10.1007/s12011-012-9354-4. PMID 22351105. S2CID 16154712.
- ^ Barceloux, Donald G; Barceloux, Donald (1999). «Chromium». Clinical Toxicology. 37 (2): 173–194. doi:10.1081/CLT-100102418. PMID 10382554.
- ^ a b Katz, SA; Salem, H (1992). «The toxicology of chromium with respect to its chemical speciation: A review». Journal of Applied Toxicology. 13 (3): 217–224. doi:10.1002/jat.2550130314. PMID 8326093. S2CID 31117557.
- ^ Eastmond, DA; MacGregor, JT; Slesinski, RS (2008). «Trivalent Chromium: Assessing the Genotoxic Risk of an Essential Trace Element and Widely Used Human and Animal Nutritional Supplement». Critical Reviews in Toxicology. 38 (3): 173–190. doi:10.1080/10408440701845401. PMID 18324515. S2CID 21033504.
- ^ NIOSH Pocket Guide to Chemical Hazards. «#0141». National Institute for Occupational Safety and Health (NIOSH).
- ^ Dayan, AD; Paine, AJ (2001). «Mechanisms of chromium toxicity, carcinogenicity and allergenicity: Review of the literature from 1985 to 2000». Human & Experimental Toxicology. 20 (9): 439–451. doi:10.1191/096032701682693062. PMID 11776406. S2CID 31351037.
- ^ Newman, D. (1890). «A case of adeno-carcinoma of the left inferior turbinated body, and perforation of the nasal septum, in the person of a worker in chrome pigments». Glasgow Medical Journal. 33: 469–470.
- ^ Langard, S (1990). «One Hundred Years of Chromium and Cancer: A Review of Epidemiological Evidence and Selected Case Reports». American Journal of Industrial Medicine. 17 (2): 189–214. doi:10.1002/ajim.4700170205. PMID 2405656.
- ^ Cohen, MD; Kargacin, B; Klein, CB; Costa, M (1993). «Mechanisms of chromium carcinogenicity and toxicity». Critical Reviews in Toxicology. 23 (3): 255–281. doi:10.3109/10408449309105012. PMID 8260068.
- ^ Methods to Develop Inhalation Cancer Risk Estimates for Chromium and Nickel Compounds. Research Triangle Park, NC: U.S. Environmental Protection Agency, Office of Air Quality Planning and Standards, Health and Environmental Impacts Division. 2011. Retrieved 19 March 2015.
- ^ Ngan, V (2002). «Chrome Allergy». DermNet NZ.
- ^ Basketter, David; Horev, L; Slodovnik, D; Merimes, S; Trattner, A; Ingber, A (2000). «Investigation of the threshold for allergic reactivity to chromium». Contact Dermatitis. 44 (2): 70–74. doi:10.1034/j.1600-0536.2001.440202.x. PMID 11205406. S2CID 45426346.
- ^ Baselt, Randall C (2008). Disposition of Toxic Drugs and Chemicals in Man (8th ed.). Foster City: Biomedical Publications. pp. 305–307. ISBN 978-0-9626523-7-0.
- ^ «US water has large amounts of likely carcinogen: study». Yahoo News. 19 December 2010. Archived from the original on 23 December 2010. Retrieved 19 December 2010.
- ^ James, Bruce (1996). «The challenge of remediating chromium-contaminated soil». Environmental Science and Technology. 30 (6): 248A–251A. doi:10.1021/es962269h. PMID 21648723.
General bibliography[edit]
- Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
External links[edit]
Wikimedia Commons has media related to Chromium.
Look up chromium in Wiktionary, the free dictionary.
- ATSDR Case Studies in Environmental Medicine: Chromium Toxicity U.S. Department of Health and Human Services
- IARC Monograph «Chromium and Chromium compounds»
- It’s Elemental – The Element Chromium
- The Merck Manual – Mineral Deficiency and Toxicity
- National Institute for Occupational Safety and Health – Chromium Page
- Chromium at The Periodic Table of Videos (University of Nottingham)
- «Chromium» . Encyclopædia Britannica. Vol. 6 (11th ed.). 1911. pp. 296–298.
 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chromium | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Appearance | silvery metallic | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Standard atomic weight Ar°(Cr) |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chromium in the periodic table | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic number (Z) | 24 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Group | group 6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Period | period 4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Block | d-block | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electron configuration | [Ar] 3d5 4s1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrons per shell | 2, 8, 13, 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physical properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase at STP | solid | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Melting point | 2180 K (1907 °C, 3465 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Boiling point | 2944 K (2671 °C, 4840 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Density (near r.t.) | 7.15 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| when liquid (at m.p.) | 6.3 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of fusion | 21.0 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of vaporization | 347 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar heat capacity | 23.35 J/(mol·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Vapor pressure
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidation states | −4, −2, −1, 0, +1, +2, +3, +4, +5, +6 (depending on the oxidation state, an acidic, basic, or amphoteric oxide) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegativity | Pauling scale: 1.66 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ionization energies |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic radius | empirical: 128 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Covalent radius | 139±5 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Spectral lines of chromium |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Other properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Natural occurrence | primordial | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | body-centered cubic (bcc)
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Speed of sound thin rod | 5940 m/s (at 20 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermal expansion | 4.9 µm/(m⋅K) (at 25 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermal conductivity | 93.9 W/(m⋅K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrical resistivity | 125 nΩ⋅m (at 20 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetic ordering | antiferromagnetic (rather: SDW)[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar magnetic susceptibility | +280.0×10−6 cm3/mol (273 K)[3] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Young’s modulus | 279 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Shear modulus | 115 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bulk modulus | 160 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Poisson ratio | 0.21 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mohs hardness | 8.5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vickers hardness | 1060 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Brinell hardness | 687–6500 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS Number | 7440-47-3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| History | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Discovery and first isolation | Louis Nicolas Vauquelin (1794, 1797) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Main isotopes of chromium
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| references |
Chromium is a chemical element with the symbol Cr and atomic number 24. It is the first element in group 6. It is a steely-grey, lustrous, hard, and brittle transition metal.[4]
Chromium metal is valued for its high corrosion resistance and hardness. A major development in steel production was the discovery that steel could be made highly resistant to corrosion and discoloration by adding metallic chromium to form stainless steel. Stainless steel and chrome plating (electroplating with chromium) together comprise 85% of the commercial use. Chromium is also greatly valued as a metal that is able to be highly polished while resisting tarnishing. Polished chromium reflects almost 70% of the visible spectrum, and almost 90% of infrared light.[5] The name of the element is derived from the Greek word χρῶμα, chrōma, meaning color,[6] because many chromium compounds are intensely colored.
Industrial production of chromium proceeds from chromite ore (mostly FeCr2O4) to produce ferrochromium, an iron-chromium alloy, by means of aluminothermic or silicothermic reactions. Ferrochromium is then used to produce alloys such as stainless steel. Pure chromium metal is produced by a different process: roasting and leaching of chromite to separate it from iron, followed by reduction with carbon and then aluminium.
In the United States, trivalent chromium (Cr(III)) ion is considered an essential nutrient in humans for insulin, sugar, and lipid metabolism.[7] However, in 2014, the European Food Safety Authority, acting for the European Union, concluded that there was insufficient evidence for chromium to be recognized as essential.[8]
While chromium metal and Cr(III) ions are considered non-toxic, hexavalent chromium, Cr(VI), is toxic and carcinogenic. According to the European Chemicals Agency (ECHA), chromium trioxide that is used in industrial electroplating processes is a «substance of very high concern» (SVHC).[9]
Abandoned chromium production sites often require environmental cleanup.[10]
Physical properties[edit]
Atomic[edit]
Chromium is the fourth transition metal found on the periodic table, and has an electron configuration of [Ar] 3d5 4s1. It is also the first element in the periodic table whose ground-state electron configuration violates the Aufbau principle. This occurs again later in the periodic table with other elements and their electron configurations, such as copper, niobium, and molybdenum.[11] This occurs because electrons in the same orbital repel each other due to their like charges. In the previous elements, the energetic cost of promoting an electron to the next higher energy level is too great to compensate for that released by lessening inter-electronic repulsion. However, in the 3d transition metals, the energy gap between the 3d and the next-higher 4s subshell is very small, and because the 3d subshell is more compact than the 4s subshell, inter-electron repulsion is smaller between 4s electrons than between 3d electrons. This lowers the energetic cost of promotion and increases the energy released by it, so that the promotion becomes energetically feasible and one or even two electrons are always promoted to the 4s subshell. (Similar promotions happen for every transition metal atom but one, palladium.)[12]
Chromium is the first element in the 3d series where the 3d electrons start to sink into the nucleus; they thus contribute less to metallic bonding, and hence the melting and boiling points and the enthalpy of atomisation of chromium are lower than those of the preceding element vanadium. Chromium(VI) is a strong oxidising agent in contrast to the molybdenum(VI) and tungsten(VI) oxides.[13]
Bulk[edit]
Sample of pure chromium metal
Chromium is extremely hard, and is the third hardest element behind carbon (diamond) and boron. Its Mohs hardness is 8.5, which means that it can scratch samples of quartz and topaz, but can be scratched by corundum. Chromium is highly resistant to tarnishing, which makes it useful as a metal that preserves its outermost layer from corroding, unlike other metals such as copper, magnesium, and aluminium.
Chromium has a melting point of 1907 °C (3465 °F), which is relatively low compared to the majority of transition metals. However, it still has the second highest melting point out of all the Period 4 elements, being topped by vanadium by 3 °C (5 °F) at 1910 °C (3470 °F). The boiling point of 2671 °C (4840 °F), however, is comparatively lower, having the fourth lowest boiling point out of the Period 4 transition metals alone behind copper, manganese and zinc.[note 1] The electrical resistivity of chromium at 20 °C is 125 nanoohm-meters.
Chromium has a high specular reflection in comparison to other transition metals. In infrared, at 425 μm, chromium has a maximum reflectance of about 72%, reducing to a minimum of 62% at 750 μm before rising again to 90% at 4000 μm.[5] When chromium is used in stainless steel alloys and polished, the specular reflection decreases with the inclusion of additional metals, yet is still high in comparison with other alloys. Between 40% and 60% of the visible spectrum is reflected from polished stainless steel.[5] The explanation on why chromium displays such a high turnout of reflected photon waves in general, especially the 90% in infrared, can be attributed to chromium’s magnetic properties.[14] Chromium has unique magnetic properties — chromium is the only elemental solid that shows antiferromagnetic ordering at room temperature and below. Above 38 °C, its magnetic ordering becomes paramagnetic.[2] The antiferromagnetic properties, which cause the chromium atoms to temporarily ionize and bond with themselves, are present because the body-centric cubic’s magnetic properties are disproportionate to the lattice periodicity. This is due to the magnetic moments at the cube’s corners and the unequal, but antiparallel, cube centers.[14] From here, the frequency-dependent relative permittivity of chromium, deriving from Maxwell’s equations and chromium’s antiferromagnetism, leaves chromium with a high infrared and visible light reflectance.[15]
Passivation[edit]
Chromium metal left standing in air is passivated — it forms a thin, protective, surface layer of oxide. This layer has a spinel structure a few atomic layers thick; it is very dense and inhibits the diffusion of oxygen into the underlying metal. In contrast, iron forms a more porous oxide through which oxygen can migrate, causing continued rusting.[16] Passivation can be enhanced by short contact with oxidizing acids like nitric acid. Passivated chromium is stable against acids. Passivation can be removed with a strong reducing agent that destroys the protective oxide layer on the metal. Chromium metal treated in this way readily dissolves in weak acids.[17]
Chromium, unlike iron and nickel, does not suffer from hydrogen embrittlement. However, it does suffer from nitrogen embrittlement, reacting with nitrogen from air and forming brittle nitrides at the high temperatures necessary to work the metal parts.[18]
Isotopes[edit]
Naturally occurring chromium is composed of four stable isotopes; 50Cr, 52Cr, 53Cr and 54Cr, with 52Cr being the most abundant (83.789% natural abundance). 50Cr is observationally stable, as it is theoretically capable of decaying to 50Ti via double electron capture with a half-life of no less than 1.3×1018 years. Twenty-five radioisotopes have been characterized, ranging from 42Cr to 70Cr; the most stable radioisotope is 51Cr with a half-life of 27.7 days. All of the remaining radioactive isotopes have half-lives that are less than 24 hours and the majority less than 1 minute. Chromium also has two metastable nuclear isomers.[19]
53Cr is the radiogenic decay product of 53Mn (half-life 3.74 million years).[20] Chromium isotopes are typically collocated (and compounded) with manganese isotopes. This circumstance is useful in isotope geology. Manganese-chromium isotope ratios reinforce the evidence from 26Al and 107Pd concerning the early history of the Solar System. Variations in 53Cr/52Cr and Mn/Cr ratios from several meteorites indicate an initial 53Mn/55Mn ratio that suggests Mn-Cr isotopic composition must result from in-situ decay of 53Mn in differentiated planetary bodies. Hence 53Cr provides additional evidence for nucleosynthetic processes immediately before coalescence of the Solar System.[21]
The isotopes of chromium range in atomic mass from 43 u (43Cr) to 67 u (67Cr). The primary decay mode before the most abundant stable isotope, 52Cr, is electron capture and the primary mode after is beta decay.[19] 53Cr has been posited as a proxy for atmospheric oxygen concentration.[22]
Chemistry and compounds[edit]
The Pourbaix diagram for chromium in pure water, perchloric acid, or sodium hydroxide[23][24]
Chromium is a member of group 6, of the transition metals. The +3 and +6 states occur most commonly within chromium compounds, followed by +2; charges of +1, +4 and +5 for chromium are rare, but do nevertheless occasionally exist.[25][26]
Common oxidation states[edit]
| Oxidation states[note 2][26] |
|
|---|---|
| −4 (d10) | Na4[Cr(CO)4][27] |
| −2 (d8) | Na 2[Cr(CO) 5] |
| −1 (d7) | Na 2[Cr 2(CO) 10] |
| 0 (d6) | Cr(C 6H 6) 2 |
| +1 (d5) | K 3[Cr(CN) 5NO] |
| +2 (d4) | CrCl 2 |
| +3 (d3) | CrCl 3 |
| +4 (d2) | K 2CrF 6 |
| +5 (d1) | K 3Cr(O 2) 4 |
| +6 (d0) | K 2CrO 4 |
Chromium(0)[edit]
Many Cr(0) complexes are known. Bis(benzene)chromium and chromium hexacarbonyl are highlights in organochromium chemistry.
Chromium(II)[edit]
Chromium(II) compounds are uncommon, in part because they readily oxidize to chromium(III) derivatives in air. Water-stable chromium(II) chloride CrCl
2 that can be made by reducing chromium(III) chloride with zinc. The resulting bright blue solution created from dissolving chromium(II) chloride is stable at neutral pH.[17] Some other notable chromium(II) compounds include chromium(II) oxide CrO, and chromium(II) sulfate CrSO
4. Many chromium(II) carboxylates are known. The red chromium(II) acetate (Cr2(O2CCH3)4) is somewhat famous. It features a Cr-Cr quadruple bond.[28]
Chromium(III)[edit]
Anhydrous chromium(III) chloride (CrCl3)
A large number of chromium(III) compounds are known, such as chromium(III) nitrate, chromium(III) acetate, and chromium(III) oxide.[29] Chromium(III) can be obtained by dissolving elemental chromium in acids like hydrochloric acid or sulfuric acid, but it can also be formed through the reduction of chromium(VI) by cytochrome c7.[30] The Cr3+
ion has a similar radius (63 pm) to Al3+
(radius 50 pm), and they can replace each other in some compounds, such as in chrome alum and alum.
Chromium(III) tends to form octahedral complexes. Commercially available chromium(III) chloride hydrate is the dark green complex [CrCl2(H2O)4]Cl. Closely related compounds are the pale green [CrCl(H2O)5]Cl2 and violet [Cr(H2O)6]Cl3. If anhydrous violet[31] chromium(III) chloride is dissolved in water, the violet solution turns green after some time as the chloride in the inner coordination sphere is replaced by water. This kind of reaction is also observed with solutions of chrome alum and other water-soluble chromium(III) salts. A tetrahedral coordination of chromium(III) has been reported for the Cr-centered Keggin anion [α-CrW12O40]5–.[32]
Chromium(III) hydroxide (Cr(OH)3) is amphoteric, dissolving in acidic solutions to form [Cr(H2O)6]3+, and in basic solutions to form [Cr(OH)
6]3−
. It is dehydrated by heating to form the green chromium(III) oxide (Cr2O3), a stable oxide with a crystal structure identical to that of corundum.[17]
Chromium(VI)[edit]
Chromium(VI) compounds are oxidants at low or neutral pH. Chromate anions (CrO2−
4) and dichromate (Cr2O72−) anions are the principal ions at this oxidation state. They exist at an equilibrium, determined by pH:
- 2 [CrO4]2− + 2 H+ ⇌ [Cr2O7]2− + H2O
Chromium(VI) oxyhalides are known also and include chromyl fluoride (CrO2F2) and chromyl chloride (CrO
2Cl
2).[17] However, despite several erroneous claims, chromium hexafluoride (as well as all higher hexahalides) remains unknown, as of 2020.[33]
Sodium chromate is produced industrially by the oxidative roasting of chromite ore with sodium carbonate. The change in equilibrium is visible by a change from yellow (chromate) to orange (dichromate), such as when an acid is added to a neutral solution of potassium chromate. At yet lower pH values, further condensation to more complex oxyanions of chromium is possible.
Both the chromate and dichromate anions are strong oxidizing reagents at low pH:[17]
- Cr
2O2−
7 + 14 H
3O+
+ 6 e− → 2 Cr3+
+ 21 H
2O (ε0 = 1.33 V)
They are, however, only moderately oxidizing at high pH:[17]
- CrO2−
4 + 4 H
2O + 3 e− → Cr(OH)
3 + 5 OH−
(ε0 = −0.13 V)
Chromium(VI) compounds in solution can be detected by adding an acidic hydrogen peroxide solution. The unstable dark blue chromium(VI) peroxide (CrO5) is formed, which can be stabilized as an ether adduct CrO
5·OR
2.[17]
Chromic acid has the hypothetical formula H
2CrO
4. It is a vaguely described chemical, despite many well-defined chromates and dichromates being known. The dark red chromium(VI) oxide CrO
3, the acid anhydride of chromic acid, is sold industrially as «chromic acid».[17] It can be produced by mixing sulfuric acid with dichromate and is a strong oxidizing agent.
Other oxidation states[edit]
Compounds of chromium(V) are rather rare; the oxidation state +5 is only realized in few compounds but are intermediates in many reactions involving oxidations by chromate. The only binary compound is the volatile chromium(V) fluoride (CrF5). This red solid has a melting point of 30 °C and a boiling point of 117 °C. It can be prepared by treating chromium metal with fluorine at 400 °C and 200 bar pressure. The peroxochromate(V) is another example of the +5 oxidation state. Potassium peroxochromate (K3[Cr(O2)4]) is made by reacting potassium chromate with hydrogen peroxide at low temperatures. This red brown compound is stable at room temperature but decomposes spontaneously at 150–170 °C.[34]
Compounds of chromium(IV) are slightly more common than those of chromium(V). The tetrahalides, CrF4, CrCl4, and CrBr4, can be produced by treating the trihalides (CrX
3) with the corresponding halogen at elevated temperatures. Such compounds are susceptible to disproportionation reactions and are not stable in water. Organic compounds containing Cr(IV) state such as chromium tetra t-butoxide are also known.[35]
Most chromium(I) compounds are obtained solely by oxidation of electron-rich, octahedral chromium(0) complexes. Other chromium(I) complexes contain cyclopentadienyl ligands. As verified by X-ray diffraction, a Cr-Cr quintuple bond (length 183.51(4) pm) has also been described.[36] Extremely bulky monodentate ligands stabilize this compound by shielding the quintuple bond from further reactions.
Chromium compound determined experimentally to contain a Cr-Cr quintuple bond
Occurrence[edit]
Chromium is the 21st[37] most abundant element in Earth’s crust with an average concentration of 100 ppm. Chromium compounds are found in the environment from the erosion of chromium-containing rocks, and can be redistributed by volcanic eruptions. Typical background concentrations of chromium in environmental media are: atmosphere <10 ng/m3; soil <500 mg/kg; vegetation <0.5 mg/kg; freshwater <10 μg/L; seawater <1 μg/L; sediment <80 mg/kg.[38] Chromium is mined as chromite (FeCr2O4) ore.[39]
About two-fifths of the chromite ores and concentrates in the world are produced in South Africa, about a third in Kazakhstan,[40] while India, Russia, and Turkey are also substantial producers. Untapped chromite deposits are plentiful, but geographically concentrated in Kazakhstan and southern Africa.[41] Although rare, deposits of native chromium exist.[42][43] The Udachnaya Pipe in Russia produces samples of the native metal. This mine is a kimberlite pipe, rich in diamonds, and the reducing environment helped produce both elemental chromium and diamonds.[44]
The relation between Cr(III) and Cr(VI) strongly depends on pH and oxidative properties of the location. In most cases, Cr(III) is the dominating species,[23] but in some areas, the ground water can contain up to 39 µg/L of total chromium, of which 30 µg/L is Cr(VI).[45]
History[edit]
Early applications[edit]
Chromium minerals as pigments came to the attention of the west in the eighteenth century. On 26 July 1761, Johann Gottlob Lehmann found an orange-red mineral in the Beryozovskoye mines in the Ural Mountains which he named Siberian red lead.[46][47] Though misidentified as a lead compound with selenium and iron components, the mineral was in fact crocoite with a formula of PbCrO4.[48] In 1770, Peter Simon Pallas visited the same site as Lehmann and found a red lead mineral that was discovered to possess useful properties as a pigment in paints. After Pallas, the use of Siberian red lead as a paint pigment began to develop rapidly throughout the region.[49] Crocoite would be the principal source of chromium in pigments until the discovery of chromite many years later.[50]
The red color of rubies is due to trace amounts of chromium within the corundum.
In 1794, Louis Nicolas Vauquelin received samples of crocoite ore. He produced chromium trioxide (CrO3) by mixing crocoite with hydrochloric acid.[48] In 1797, Vauquelin discovered that he could isolate metallic chromium by heating the oxide in a charcoal oven, for which he is credited as the one who truly discovered the element.[51][52] Vauquelin was also able to detect traces of chromium in precious gemstones, such as ruby and emerald.[48][53]
During the nineteenth century, chromium was primarily used not only as a component of paints, but in tanning salts as well. For quite some time, the crocoite found in Russia was the main source for such tanning materials. In 1827, a larger chromite deposit was discovered near Baltimore, United States, which quickly met the demand for tanning salts much more adequately than the crocoite that had been used previously.[54] This made the United States the largest producer of chromium products until the year 1848, when larger deposits of chromite were uncovered near the city of Bursa, Turkey.[39] With the development of metallurgy and chemical industries in the Western world, the need for chromium increased.[55]
Chromium is also famous for its reflective, metallic luster when polished. It is used as a protective and decorative coating on car parts, plumbing fixtures, furniture parts and many other items, usually applied by electroplating. Chromium was used for electroplating as early as 1848, but this use only became widespread with the development of an improved process in 1924.[56]
Production[edit]
World production trend of chromium
Chromium, remelted in a horizontal arc zone-refiner, showing large visible crystal grains
Approximately 28.8 million metric tons (Mt) of marketable chromite ore was produced in 2013, and converted into 7.5 Mt of ferrochromium.[41] According to John F. Papp, writing for the USGS, «Ferrochromium is the leading end use of chromite ore, [and] stainless steel is the leading end use of ferrochromium.»[41]
The largest producers of chromium ore in 2013 have been South Africa (48%), Kazakhstan (13%), Turkey (11%), and India (10%), with several other countries producing the rest of about 18% of the world production.[41]
The two main products of chromium ore refining are ferrochromium and metallic chromium. For those products the ore smelter process differs considerably. For the production of ferrochromium, the chromite ore (FeCr2O4) is reduced in large scale in electric arc furnace or in smaller smelters with either aluminium or silicon in an aluminothermic reaction.[57]
Chromium ore output in 2002[58]
For the production of pure chromium, the iron must be separated from the chromium in a two step roasting and leaching process. The chromite ore is heated with a mixture of calcium carbonate and sodium carbonate in the presence of air. The chromium is oxidized to the hexavalent form, while the iron forms the stable Fe2O3. The subsequent leaching at higher elevated temperatures dissolves the chromates and leaves the insoluble iron oxide. The chromate is converted by sulfuric acid into the dichromate.[57]
- 4 FeCr2O4 + 8 Na2CO3 + 7 O2 → 8 Na2CrO4 + 2 Fe2O3 + 8 CO2
- 2 Na2CrO4 + H2SO4 → Na2Cr2O7 + Na2SO4 + H2O
The dichromate is converted to the chromium(III) oxide by reduction with carbon and then reduced in an aluminothermic reaction to chromium.[57]
- Na2Cr2O7 + 2 C → Cr2O3 + Na2CO3 + CO
- Cr2O3 + 2 Al → Al2O3 + 2 Cr
Applications[edit]
The creation of metal alloys account for 85% of the available chromium’s usage. The remainder of chromium is used in the chemical, refractory, and foundry industries.[59]
Metallurgy[edit]
Stainless steel cutlery made from Cromargan 18/10, containing 18% chromium
The strengthening effect of forming stable metal carbides at grain boundaries, and the strong increase in corrosion resistance made chromium an important alloying material for steel. High-speed tool steels contain between 3 and 5% chromium. Stainless steel, the primary corrosion-resistant metal alloy, is formed when chromium is introduced to iron in concentrations above 11%.[60] For stainless steel’s formation, ferrochromium is added to the molten iron. Also, nickel-based alloys have increased strength due to the formation of discrete, stable, metal, carbide particles at the grain boundaries. For example, Inconel 718 contains 18.6% chromium. Because of the excellent high-temperature properties of these nickel superalloys, they are used in jet engines and gas turbines in lieu of common structural materials.[61] ASTM B163 relies on Chromium for condenser and heat-exchanger tubes, while castings with high strength at elevated temperatures that contain Chromium are standardised with ASTM A567.[62] AISI type 332 is used where high temperature would normally cause carburization, oxidation or corrosion.[63] Incoloy 800 «is capable of remaining stable and maintaining its austenitic structure even after long time exposures to high temperatures».[64] Nichrome is used as resistance wire for heating elements in things like toasters and space heaters. These uses make chromium a strategic material. Consequently, during World War II, U.S. road engineers were instructed to avoid chromium in yellow road paint, as it «may become a critical material during the emergency.»[65] The United States likewise considered chromium «essential for the German war industry» and made intense diplomatic efforts to keep it out of the hands of Nazi Germany.[66]
Decorative chrome plating on a motorcycle
The high hardness and corrosion resistance of unalloyed chromium makes it a reliable metal for surface coating; it is still the most popular metal for sheet coating, with its above-average durability, compared to other coating metals.[67] A layer of chromium is deposited on pretreated metallic surfaces by electroplating techniques. There are two deposition methods: thin, and thick. Thin deposition involves a layer of chromium below 1 µm thickness deposited by chrome plating, and is used for decorative surfaces. Thicker chromium layers are deposited if wear-resistant surfaces are needed. Both methods use acidic chromate or dichromate solutions. To prevent the energy-consuming change in oxidation state, the use of chromium(III) sulfate is under development; for most applications of chromium, the previously established process is used.[56]
In the chromate conversion coating process, the strong oxidative properties of chromates are used to deposit a protective oxide layer on metals like aluminium, zinc, and cadmium. This passivation and the self-healing properties of the chromate stored in the chromate conversion coating, which is able to migrate to local defects, are the benefits of this coating method.[68] Because of environmental and health regulations on chromates, alternative coating methods are under development.[69]
Chromic acid anodizing (or Type I anodizing) of aluminium is another electrochemical process that does not lead to the deposition of chromium, but uses chromic acid as an electrolyte in the solution. During anodization, an oxide layer is formed on the aluminium. The use of chromic acid, instead of the normally used sulfuric acid, leads to a slight difference of these oxide layers.[70]
The high toxicity of Cr(VI) compounds, used in the established chromium electroplating process, and the strengthening of safety and environmental regulations demand a search for substitutes for chromium, or at least a change to less toxic chromium(III) compounds.[56]
Pigment[edit]
The mineral crocoite (which is also lead chromate PbCrO4) was used as a yellow pigment shortly after its discovery. After a synthesis method became available starting from the more abundant chromite, chrome yellow was, together with cadmium yellow, one of the most used yellow pigments. The pigment does not photodegrade, but it tends to darken due to the formation of chromium(III) oxide. It has a strong color, and was used for school buses in the United States and for the postal services (for example, the Deutsche Post) in Europe. The use of chrome yellow has since declined due to environmental and safety concerns and was replaced by organic pigments or other alternatives that are free from lead and chromium. Other pigments that are based around chromium are, for example, the deep shade of red pigment chrome red, which is simply lead chromate with lead(II) hydroxide (PbCrO4·Pb(OH)2). A very important chromate pigment, which was used widely in metal primer formulations, was zinc chromate, now replaced by zinc phosphate. A wash primer was formulated to replace the dangerous practice of pre-treating aluminium aircraft bodies with a phosphoric acid solution. This used zinc tetroxychromate dispersed in a solution of polyvinyl butyral. An 8% solution of phosphoric acid in solvent was added just before application. It was found that an easily oxidized alcohol was an essential ingredient. A thin layer of about 10–15 µm was applied, which turned from yellow to dark green when it was cured. There is still a question as to the correct mechanism. Chrome green is a mixture of Prussian blue and chrome yellow, while the chrome oxide green is chromium(III) oxide.[71]
Chromium oxides are also used as a green pigment in the field of glassmaking and also as a glaze for ceramics.[72] Green chromium oxide is extremely lightfast and as such is used in cladding coatings. It is also the main ingredient in infrared reflecting paints, used by the armed forces to paint vehicles and to give them the same infrared reflectance as green leaves.[73]
Other uses[edit]
Red crystal of a ruby laser
Chromium(III) ions present in corundum crystals (aluminium oxide) cause them to be colored red; when corundum appears as such, it is known as a ruby. If the corundum is lacking in chromium(III) ions, it is known as a sapphire.[note 3] A red-colored artificial ruby may also be achieved by doping chromium(III) into artificial corundum crystals, thus making chromium a requirement for making synthetic rubies.[note 4][74] Such a synthetic ruby crystal was the basis for the first laser, produced in 1960, which relied on stimulated emission of light from the chromium atoms in such a crystal. Ruby has a laser transition at 694.3 nanometers, in a deep red color.[75]
Because of their toxicity, chromium(VI) salts are used for the preservation of wood. For example, chromated copper arsenate (CCA) is used in timber treatment to protect wood from decay fungi, wood-attacking insects, including termites, and marine borers.[76] The formulations contain chromium based on the oxide CrO3 between 35.3% and 65.5%. In the United States, 65,300 metric tons of CCA solution were used in 1996.[76]
Chromium(III) salts, especially chrome alum and chromium(III) sulfate, are used in the tanning of leather. The chromium(III) stabilizes the leather by cross linking the collagen fibers.[77] Chromium tanned leather can contain between 4 and 5% of chromium, which is tightly bound to the proteins.[39] Although the form of chromium used for tanning is not the toxic hexavalent variety, there remains interest in management of chromium in the tanning industry. Recovery and reuse, direct/indirect recycling,[78] and «chrome-less» or «chrome-free» tanning are practiced to better manage chromium usage.[79]
The high heat resistivity and high melting point makes chromite and chromium(III) oxide a material for high temperature refractory applications, like blast furnaces, cement kilns, molds for the firing of bricks and as foundry sands for the casting of metals. In these applications, the refractory materials are made from mixtures of chromite and magnesite. The use is declining because of the environmental regulations due to the possibility of the formation of chromium(VI).[57] [80]
Several chromium compounds are used as catalysts for processing hydrocarbons. For example, the Phillips catalyst, prepared from chromium oxides, is used for the production of about half the world’s polyethylene.[81] Fe-Cr mixed oxides are employed as high-temperature catalysts for the water gas shift reaction.[82][83] Copper chromite is a useful hydrogenation catalyst.[84]
Chromates of metals are used in humistor.[85]
Uses of compounds[edit]
- Chromium(IV) oxide (CrO2) is a magnetic compound. Its ideal shape anisotropy, which imparts high coercivity and remnant magnetization, made it a compound superior to γ-Fe2O3. Chromium(IV) oxide is used to manufacture magnetic tape used in high-performance audio tape and standard audio cassettes.[86]
- Chromium(III) oxide (Cr2O3) is a metal polish known as green rouge.[87][88]
- Chromic acid is a powerful oxidizing agent and is a useful compound for cleaning laboratory glassware of any trace of organic compounds.[89] It is prepared by dissolving potassium dichromate in concentrated sulfuric acid, which is then used to wash the apparatus. Sodium dichromate is sometimes used because of its higher solubility (50 g/L versus 200 g/L respectively). The use of dichromate cleaning solutions is now phased out due to the high toxicity and environmental concerns. Modern cleaning solutions are highly effective and chromium free.[90]
- Potassium dichromate is a chemical reagent, used as a titrating agent.[91]
- Chromates are added to drilling muds to prevent corrosion of steel under wet conditions.[92]
- Chrome alum is Chromium(III) potassium sulfate and is used as a mordant (i.e., a fixing agent) for dyes in fabric and in tanning.[93]
Biological role[edit]
The biologically beneficial effects of chromium(III) are debated.[94][95] Chromium is accepted by the U.S. National Institutes of Health as a trace element for its roles in the action of insulin, a hormone that mediates the metabolism and storage of carbohydrate, fat, and protein.[7] The mechanism of its actions in the body, however, have not been defined, leaving in question the essentiality of chromium.[96][97]
In contrast, hexavalent chromium (Cr(VI) or Cr6+) is highly toxic and mutagenic.[98] Ingestion of chromium(VI) in water has been linked to stomach tumors, and it may also cause allergic contact dermatitis (ACD).[99]
«Chromium deficiency», involving a lack of Cr(III) in the body, or perhaps some complex of it, such as glucose tolerance factor, is controversial.[7] Some studies suggest that the biologically active form of chromium (III) is transported in the body via an oligopeptide called low-molecular-weight chromium-binding substance (LMWCr), which might play a role in the insulin signaling pathway.[100]
The chromium content of common foods is generally low (1-13 micrograms per serving).[7][101] The chromium content of food varies widely, due to differences in soil mineral content, growing season, plant cultivar, and contamination during processing.[101] Chromium (and nickel) leach into food cooked in stainless steel, with the effect being largest when the cookware is new. Acidic foods that are cooked for many hours also exacerbate this effect.[102][103]
Dietary recommendations[edit]
There is disagreement on chromium’s status as an essential nutrient. Governmental departments from Australia, New Zealand, India, Japan, and the United States consider chromium essential[104][105][106][107] while the European Food Safety Authority (EFSA) of the European Union does not.[108]
The U.S. National Academy of Medicine (NAM) updated the Estimated Average Requirements (EARs) and the Recommended Dietary Allowances (RDAs) for chromium in 2001. For chromium, there was insufficient information to set EARs and RDAs, so its needs are described as estimates for Adequate Intakes (AIs). The current AIs of chromium for women ages 14 through 50 is 25 μg/day, and the AIs for women ages 50 and above is 20 μg/day. The AIs for women who are pregnant are 30 μg/day, and for women who are lactating, the set AIs are 45 μg/day. The AIs for men ages 14 through 50 are 35 μg/day, and the AIs for men ages 50 and above are 30 μg/day. For children ages 1 through 13, the AIs increase with age from 0.2 μg/day up to 25 μg/day. As for safety, the NAM sets Tolerable Upper Intake Levels (ULs) for vitamins and minerals when the evidence is sufficient. In the case of chromium, there is not yet enough information, hence no UL has been established. Collectively, the EARs, RDAs, AIs, and ULs are the parameters for the nutrition recommendation system known as Dietary Reference Intake (DRI).[107] Australia and New Zealand consider chromium to be an essential nutrient, with an AI of 35 μg/day for men, 25 μg/day for women, 30 μg/day for women who are pregnant, and 45 μg/day for women who are lactating. A UL has not been set due to the lack of sufficient data.[104] India considers chromium to be an essential nutrient, with an adult recommended intake of 33 μg/day.[105] Japan also considers chromium to be an essential nutrient, with an AI of 10 μg/day for adults, including women who are pregnant or lactating. A UL has not been set.[106] The EFSA of the European Union however, does not consider chromium to be an essential nutrient; chromium is the only mineral for which the United States and the European Union disagree.[108][109]
Labeling[edit]
For U.S. food and dietary supplement labeling purposes, the amount of the substance in a serving is expressed as a percent of the Daily Value (%DV). For chromium labeling purposes, 100% of the Daily Value was 120 μg. As of May 27, 2016, the percentage of daily value was revised to 35 μg to bring the chromium intake into a consensus with the official Recommended Dietary Allowance.[110][111] A table of the old and new adult daily values is provided at Reference Daily Intake.
Food sources[edit]
Food composition databases such as those maintained by the U.S. Department of Agriculture do not contain information on the chromium content of foods.[112] A wide variety of animal and vegetable foods contain chromium.[107] Content per serving is influenced by the chromium content of the soil in which the plants are grown, by foodstuffs fed to animals, and by processing methods, as chromium is leached into foods if processed or cooked in stainless steel equipment.[113] One diet analysis study conducted in Mexico reported an average daily chromium intake of 30 micrograms.[114] An estimated 31% of adults in the United States consume multi-vitamin/mineral dietary supplements,[115] which often contain 25 to 60 micrograms of chromium.
Supplementation[edit]
Chromium is an ingredient in total parenteral nutrition (TPN), because deficiency can occur after months of intravenous feeding with chromium-free TPN.[116] It is also added to nutritional products for preterm infants.[117] Although the mechanism of action in biological roles for chromium is unclear, in the United States chromium-containing products are sold as non-prescription dietary supplements in amounts ranging from 50 to 1,000 μg. Lower amounts of chromium are also often incorporated into multi-vitamin/mineral supplements consumed by an estimated 31% of adults in the United States.[115] Chemical compounds used in dietary supplements include chromium chloride, chromium citrate, chromium(III) picolinate, chromium(III) polynicotinate, and other chemical compositions.[7] The benefit of supplements has not been proven.[7][118]
Approved and disapproved health claims[edit]
In 2005, the U.S. Food and Drug Administration had approved a qualified health claim for chromium picolinate with a requirement for very specific label wording: «One small study suggests that chromium picolinate may reduce the risk of insulin resistance, and therefore possibly may reduce the risk of type 2 diabetes. FDA concludes, however, that the existence of such a relationship between chromium picolinate and either insulin resistance or type 2 diabetes is highly uncertain.» At the same time, in answer to other parts of the petition, the FDA rejected claims for chromium picolinate and cardiovascular disease, retinopathy or kidney disease caused by abnormally high blood sugar levels.[119] In 2010, chromium(III) picolinate was approved by Health Canada to be used in dietary supplements. Approved labeling statements include: a factor in the maintenance of good health, provides support for healthy glucose metabolism, helps the body to metabolize carbohydrates and helps the body to metabolize fats.[120] The European Food Safety Authority (EFSA) approved claims in 2010 that chromium contributed to normal macronutrient metabolism and maintenance of normal blood glucose concentration, but rejected claims for maintenance or achievement of a normal body weight, or reduction of tiredness or fatigue.[121]
Given the evidence for chromium deficiency causing problems with glucose management in the context of intravenous nutrition products formulated without chromium,[116] research interest turned to whether chromium supplementation would benefit people who have type 2 diabetes but are not chromium deficient. Looking at the results from four meta-analyses, one reported a statistically significant decrease in fasting plasma glucose levels (FPG) and a non-significant trend in lower hemoglobin A1C.[122] A second reported the same,[123] a third reported significant decreases for both measures,[124] while a fourth reported no benefit for either.[125] A review published in 2016 listed 53 randomized clinical trials that were included in one or more of six meta-analyses. It concluded that whereas there may be modest decreases in FPG and/or HbA1C that achieve statistical significance in some of these meta-analyses, few of the trials achieved decreases large enough to be expected to be relevant to clinical outcome.[126]
Two systematic reviews looked at chromium supplements as a mean of managing body weight in overweight and obese people. One, limited to chromium picolinate, a popular supplement ingredient, reported a statistically significant −1.1 kg (2.4 lb) weight loss in trials longer than 12 weeks.[127] The other included all chromium compounds and reported a statistically significant −0.50 kg (1.1 lb) weight change.[128] Change in percent body fat did not reach statistical significance. Authors of both reviews considered the clinical relevance of this modest weight loss as uncertain/unreliable.[127][128] The European Food Safety Authority reviewed the literature and concluded that there was insufficient evidence to support a claim.[121]
Chromium is promoted as a sports performance dietary supplement, based on the theory that it potentiates insulin activity, with anticipated results of increased muscle mass, and faster recovery of glycogen storage during post-exercise recovery.[118][129][130] A review of clinical trials reported that chromium supplementation did not improve exercise performance or increase muscle strength.[131] The International Olympic Committee reviewed dietary supplements for high-performance athletes in 2018 and concluded there was no need to increase chromium intake for athletes, nor support for claims of losing body fat.[132]
Fresh-water fish[edit]
Chromium is naturally present in the environment in trace amounts, but industrial use in rubber and stainless steel manufacturing, chrome plating, dyes for textiles, tanneries and other uses contaminates aquatic systems. In Bangladesh, rivers in or downstream from industrialized areas exhibit heavy metal contamination. Irrigation water standards for chromium are 0.1 mg/L, but some rivers are more than five times that amount. The standard for fish for human consumption is less than 1 mg/kg, but many tested samples were more than five times that amount.[133] Chromium, especially hexavalent chromium, is highly toxic to fish because it is easily absorbed across the gills, readily enters blood circulation, crosses cell membranes and bioconcentrates up the food chain. In contrast, the toxicity of trivalent chromium is very low, attributed to poor membrane permeability and little biomagnification.[134]
Acute and chronic exposure to chromium(VI) affects fish behavior, physiology, reproduction and survival. Hyperactivity and erratic swimming have been reported in contaminated environments. Egg hatching and fingerling survival are affected. In adult fish there are reports of histopathological damage to liver, kidney, muscle, intestines, and gills. Mechanisms include mutagenic gene damage and disruptions of enzyme functions.[134]
There is evidence that fish may not require chromium, but benefit from a measured amount in diet. In one study, juvenile fish gained weight on a zero chromium diet, but the addition of 500 μg of chromium in the form of chromium chloride or other supplement types, per kilogram of food (dry weight), increased weight gain. At 2,000 μg/kg the weight gain was no better than with the zero chromium diet, and there were increased DNA strand breaks.[135]
Precautions[edit]
Water-insoluble chromium(III) compounds and chromium metal are not considered a health hazard, while the toxicity and carcinogenic properties of chromium(VI) have been known for a long time.[136] Because of the specific transport mechanisms, only limited amounts of chromium(III) enter the cells. Acute oral toxicity ranges between 50 and 150 mg/kg.[137] A 2008 review suggested that moderate uptake of chromium(III) through dietary supplements poses no genetic-toxic risk.[138] In the US, the Occupational Safety and Health Administration (OSHA) has designated an air permissible exposure limit (PEL) in the workplace as a time-weighted average (TWA) of 1 mg/m3. The National Institute for Occupational Safety and Health (NIOSH) has set a recommended exposure limit (REL) of 0.5 mg/m3, time-weighted average. The IDLH (immediately dangerous to life and health) value is 250 mg/m3.[139]
Chromium(VI) toxicity[edit]
The acute oral toxicity for chromium(VI) ranges between 1.5 and 3.3 mg/kg.[137] In the body, chromium(VI) is reduced by several mechanisms to chromium(III) already in the blood before it enters the cells. The chromium(III) is excreted from the body, whereas the chromate ion is transferred into the cell by a transport mechanism, by which also sulfate and phosphate ions enter the cell. The acute toxicity of chromium(VI) is due to its strong oxidant properties. After it reaches the blood stream, it damages the kidneys, the liver and blood cells through oxidation reactions. Hemolysis, renal, and liver failure result. Aggressive dialysis can be therapeutic.[140]
The carcinogenity of chromate dust has been known for a long time, and in 1890 the first publication described the elevated cancer risk of workers in a chromate dye company.[141][142] Three mechanisms have been proposed to describe the genotoxicity of chromium(VI). The first mechanism includes highly reactive hydroxyl radicals and other reactive radicals which are by products of the reduction of chromium(VI) to chromium(III). The second process includes the direct binding of chromium(V), produced by reduction in the cell, and chromium(IV) compounds to the DNA. The last mechanism attributed the genotoxicity to the binding to the DNA of the end product of the chromium(III) reduction.[143][144]
Chromium salts (chromates) are also the cause of allergic reactions in some people. Chromates are often used to manufacture, amongst other things, leather products, paints, cement, mortar and anti-corrosives. Contact with products containing chromates can lead to allergic contact dermatitis and irritant dermatitis, resulting in ulceration of the skin, sometimes referred to as «chrome ulcers». This condition is often found in workers that have been exposed to strong chromate solutions in electroplating, tanning and chrome-producing manufacturers.[145][146]
Environmental issues[edit]
Because chromium compounds were used in dyes, paints, and leather tanning compounds, these compounds are often found in soil and groundwater at active and abandoned industrial sites, needing environmental cleanup and remediation. Primer paint containing hexavalent chromium is still widely used for aerospace and automobile refinishing applications.[147]
In 2010, the Environmental Working Group studied the drinking water in 35 American cities in the first nationwide study. The study found measurable hexavalent chromium in the tap water of 31 of the cities sampled, with Norman, Oklahoma, at the top of list; 25 cities had levels that exceeded California’s proposed limit.[148]
The more toxic hexavalent chromium form can be reduced to the less soluble trivalent oxidation state in soils by organic matter, ferrous iron, sulfides, and other reducing agents, with the rates of such reduction being faster under more acidic conditions than under more alkaline ones. In contrast, trivalent chromium can be oxidized to hexavalent chromium in soils by manganese oxides, such as Mn(III) and Mn(IV) compounds. Since the solubility and toxicity of chromium (VI) are greater that those of chromium (III), the oxidation-reduction conversions between the two oxidation states have implications for movement and bioavailability of chromium in soils, groundwater, and plants.[149]
Notes[edit]
- ^ The melting/boiling point of transition metals are usually higher compared to the alkali metals, alkaline earth metals, and nonmetals, which is why the range of elements compared to chromium differed between comparisons
- ^ Most common oxidation states of chromium are in bold. The right column lists a representative compound for each oxidation state.
- ^ Any color of corundum (disregarding red) is known as a sapphire. If the corundum is red, then it is a ruby. Sapphires are not required to be blue corundum crystals, as sapphires can be other colors such as yellow and purple
- ^ When Cr3+
replaces Al3+
in corundum (aluminium oxide, Al2O3), pink sapphire or ruby is formed, depending on the amount of chromium.
References[edit]
- ^ «Standard Atomic Weights: Chromium». CIAAW. 1983.
- ^ a b Fawcett, Eric (1988). «Spin-density-wave antiferromagnetism in chromium». Reviews of Modern Physics. 60: 209. Bibcode:1988RvMP…60..209F. doi:10.1103/RevModPhys.60.209.
- ^ Weast, Robert (1984). CRC, Handbook of Chemistry and Physics. Boca Raton, Florida: Chemical Rubber Company Publishing. pp. E110. ISBN 0-8493-0464-4.
- ^ Brandes, EA; Greenaway, HT; Stone, HEN (1956). «Ductility in Chromium». Nature. 178 (4533): 587. Bibcode:1956Natur.178..587B. doi:10.1038/178587a0. S2CID 4221048.
- ^ a b c Coblentz, WW; Stair, R. «Reflecting power of beryllium, chromium, and several other metals» (PDF). National Institute of Standards and Technology. NIST Publications. Retrieved 11 October 2018.
- ^ χρῶμα, Henry George Liddell, Robert Scott, A Greek-English Lexicon, on Perseus
- ^ a b c d e f «Chromium». Office of Dietary Supplements, US National Institutes of Health. 2016. Retrieved 26 June 2016.
- ^ «Scientific Opinion on Dietary Reference Values for chromium». European Food Safety Authority. 18 September 2014. Retrieved 20 March 2018.
- ^ «Substance Information — ECHA». echa.europa.eu. Retrieved 17 January 2022.
- ^ EPA (August 2000). «Abandoned Mine Site Characterization and Cleanup Handbook» (PDF). United States Environmental Protection Agency. Retrieved 8 September 2019.
- ^ «The Nature of X-Ray Photoelectron Spectra». CasaXPS. Casa Software Ltd. 2005. Retrieved 10 March 2019.
- ^ Schwarz, W. H. Eugen (April 2010). «The Full Story of the Electron Configurations of the Transition Elements» (PDF). Journal of Chemical Education. 87 (4): 444–8. Bibcode:2010JChEd..87..444S. doi:10.1021/ed8001286. Retrieved 9 November 2018.
- ^ Greenwood and Earnshaw, pp. 1004–5
- ^ a b Lind, Michael Acton (1972). «The infrared reflectivity of chromium and chromium-aluminium alloys». Iowa State University Digital Repository. Iowa State University. Bibcode:1972PhDT……..54L. Retrieved 4 November 2018.
- ^ Bos, Laurence William (1969). «Optical properties of chromium-manganese alloys». Iowa State University Digital Repository. Iowa State University. Bibcode:1969PhDT…….118B. Retrieved 4 November 2018.
- ^ Wallwork, GR (1976). «The oxidation of alloys». Reports on Progress in Physics. 39 (5): 401–485. Bibcode:1976RPPh…39..401W. doi:10.1088/0034-4885/39/5/001. S2CID 250853920.
- ^ a b c d e f g h Holleman, Arnold F; Wiber, Egon; Wiberg, Nils (1985). «Chromium». Lehrbuch der Anorganischen Chemie (in German) (91–100 ed.). Walter de Gruyter. pp. 1081–1095. ISBN 978-3-11-007511-3.
- ^ National Research Council (U.S.). Committee on Coatings (1970). High-temperature oxidation-resistant coatings: coatings for protection from oxidation of superalloys, refractory metals, and graphite. National Academy of Sciences. ISBN 978-0-309-01769-5.
- ^ a b Kondev, F. G.; Wang, M.; Huang, W. J.; Naimi, S.; Audi, G. (2021). «The NUBASE2020 evaluation of nuclear properties» (PDF). Chinese Physics C. 45 (3): 030001. doi:10.1088/1674-1137/abddae.
- ^ «Live Chart of Nuclides». International Atomic Energy Agency — Nuclear Data Section. Retrieved 18 October 2018.
- ^ Birck, JL; Rotaru, M; Allegre, C (1999). «53Mn-53Cr evolution of the early solar system». Geochimica et Cosmochimica Acta. 63 (23–24): 4111–4117. Bibcode:1999GeCoA..63.4111B. doi:10.1016/S0016-7037(99)00312-9.
- ^ Frei, Robert; Gaucher, Claudio; Poulton, Simon W; Canfield, Don E (2009). «Fluctuations in Precambrian atmospheric oxygenation recorded by chromium isotopes». Nature. 461 (7261): 250–253. Bibcode:2009Natur.461..250F. doi:10.1038/nature08266. PMID 19741707. S2CID 4373201.
- ^ a b Kotaś, J.; Stasicka, Z. (2000). «Chromium occurrence in the environment and methods of its speciation». Environmental Pollution. 107 (3): 263–283. doi:10.1016/S0269-7491(99)00168-2. PMID 15092973.
- ^ Puigdomenech, Ignasi Hydra/Medusa Chemical Equilibrium Database and Plotting Software Archived 5 June 2013 at the Wayback Machine (2004) KTH Royal Institute of Technology
- ^ Clark, Jim. «Oxidation states (oxidation numbers)». Chemguide. Retrieved 3 October 2018.
- ^ a b Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ^ Theopold, Klaus H.; Kucharczyk, Robin R. (15 December 2011), «Chromium: Organometallic Chemistry», in Scott, Robert A. (ed.), Encyclopedia of Inorganic and Bioinorganic Chemistry, John Wiley & Sons, Ltd, pp. eibc0042, doi:10.1002/9781119951438.eibc0042, ISBN 978-1-119-95143-8.
- ^ Cotton, FA; Walton, RA (1993). Multiple Bonds Between Metal Atoms. Oxford: Oxford University Press. ISBN 978-0-19-855649-7.
- ^ «Chromium(III) compounds». National Pollutant Inventory. Commonwealth of Australia. Retrieved 8 November 2018.
- ^ Assfalg, M; Banci, L; Bertini, I; Bruschi, M; Michel, C; Giudici-Orticoni, M; Turano, P (31 July 2002). «NMR structural characterization of the reduction of chromium(VI) to chromium(III) by cytochrome c7». Protein Data Bank (1LM2). doi:10.2210/pdb1LM2/pdb. Retrieved 8 November 2018.
- ^ Luther, George W. (2016). «Introduction to Transition Metals». Inorganic Chemistry for Geochemistry & Environmental Sciences: Fundamentals & Applications. Hydrate (Solvate) Isomers. John Wiley & Sons. p. 244. ISBN 978-1118851371. Retrieved 7 August 2019.
- ^ Gumerova, Nadiia I.; Roller, Alexander; Giester, Gerald; Krzystek, J.; Cano, Joan; Rompel, Annette (19 February 2020). «Incorporation of CrIII into a Keggin Polyoxometalate as a Chemical Strategy to Stabilize a Labile {CrIIIO4} Tetrahedral Conformation and Promote Unattended Single-Ion Magnet Properties». Journal of the American Chemical Society. 142 (7): 3336–3339. doi:10.1021/jacs.9b12797. ISSN 0002-7863. PMC 7052816. PMID 31967803.
- ^ Seppelt, Konrad (28 January 2015). «Molecular Hexafluorides». Chemical Reviews. 115 (2): 1296–1306. doi:10.1021/cr5001783. ISSN 0009-2665. PMID 25418862.
- ^ Haxhillazi, Gentiana (2003). Preparation, Structure and Vibrational Spectroscopy of Tetraperoxo Complexes of CrV+, VV+, NbV+ and TaV+ (PhD thesis). University of Siegen.
- ^ Thaler, Eric G.; Rypdal, Kristin; Haaland, Arne; Caulton, Kenneth G. (1 June 1989). «Structure and reactivity of chromium(4+) tert-butoxide». Inorganic Chemistry. 28 (12): 2431–2434. doi:10.1021/ic00311a035. ISSN 0020-1669.
- ^ Nguyen, T; Sutton, AD; Brynda, M; Fettinger, JC; Long, GJ; Power, PP (2005). «Synthesis of a stable compound with fivefold bonding between two chromium(I) centers». Science. 310 (5749): 844–847. Bibcode:2005Sci…310..844N. doi:10.1126/science.1116789. PMID 16179432. S2CID 42853922.
- ^ Emsley, John (2001). «Chromium». Nature’s Building Blocks: An A–Z Guide to the Elements. Oxford, England, UK: Oxford University Press. pp. 495–498. ISBN 978-0-19-850340-8.
- ^ John Rieuwerts (14 July 2017). The Elements of Environmental Pollution. Taylor & Francis. ISBN 978-1-135-12679-7.
- ^ a b c National Research Council (U.S.). Committee on Biologic Effects of Atmospheric Pollutants (1974). Chromium. National Academy of Sciences. ISBN 978-0-309-02217-0.
- ^ Champion, Marc (11 January 2018). «How a Trump SoHo Partner Ended Up With Toxic Mining Riches From Kazakhstan». Bloomberg.com. Bloomberg L.P. Retrieved 21 January 2018.
- ^ a b c d Papp, John F. «Mineral Yearbook 2015: Chromium» (PDF). United States Geological Survey. Retrieved 3 June 2015.
- ^ Fleischer, Michael (1982). «New Mineral Names» (PDF). American Mineralogist. 67: 854–860.
- ^ Chromium (with location data), Mindat.
- ^ Chromium from Udachnaya-Vostochnaya pipe, Daldyn, Daldyn-Alakit kimberlite field, Saha Republic (Sakha Republic; Yakutia), Eastern-Siberian Region, Russia, Mindat.
- ^ Gonzalez, A. R.; Ndung’u, K.; Flegal, A. R. (2005). «Natural Occurrence of Hexavalent Chromium in the Aromas Red Sands Aquifer, California». Environmental Science and Technology. 39 (15): 5505–5511. Bibcode:2005EnST…39.5505G. doi:10.1021/es048835n. PMID 16124280.
- ^ Meyer, RJ (1962). Chrom : Teil A — Lieferung 1. Geschichtliches · Vorkommen · Technologie · Element bis Physikalische Eigenschaften (in German). Berlin, Heidelberg: Springer Berlin Heidelberg Imprint Springer. ISBN 978-3-662-11865-8. OCLC 913810356.
- ^ Lehmanni, Iohannis Gottlob (1766). De Nova Minerae Plumbi Specie Crystallina Rubra, Epistola.
- ^ a b c Guertin, Jacques; Jacobs, James Alan & Avakian, Cynthia P. (2005). Chromium (VI) Handbook. CRC Press. pp. 7–11. ISBN 978-1-56670-608-7.
- ^ Weeks, Mary Elvira (1932). «The discovery of the elements. V. Chromium, molybdenum, tungsten and uranium». Journal of Chemical Education. 9 (3): 459–73. Bibcode:1932JChEd…9..459W. doi:10.1021/ed009p459. ISSN 0021-9584.
- ^ Casteran, Rene. «Chromite mining». Oregon Encyclopedia. Portland State University and the Oregon Historical Society. Retrieved 1 October 2018.
- ^ Vauquelin, Louis Nicolas (1798). «Memoir on a New Metallic Acid which exists in the Red Lead of Siberia». Journal of Natural Philosophy, Chemistry, and the Arts. 3: 145–146.
- ^ Glenn, William (1895). «Chrome in the Southern Appalachian Region». Transactions of the American Institute of Mining, Metallurgical and Petroleum Engineers. 25: 482.
- ^ van der Krogt, Peter. «Chromium». Retrieved 24 August 2008.
- ^ Ortt, Richard A Jr. «Soldier’s Delight, Baltimore Country». Maryland Department of Natural Resources. Maryland Geological Survey. Retrieved 13 May 2019.
- ^ Bilgin, Arif; Çağlar, Burhan (eds.). Klasikten Moderne Osmanlı Ekonomisi. Turkey: Kronik Kitap. p. 240.
- ^ a b c Dennis, JK; Such, TE (1993). «History of Chromium Plating». Nickel and Chromium Plating. Woodhead Publishing. pp. 9–12. ISBN 978-1-85573-081-6.
- ^ a b c d Papp, John F. & Lipin, Bruce R. (2006). «Chromite». Industrial Minerals & Rocks: Commodities, Markets, and Uses (7th ed.). SME. ISBN 978-0-87335-233-8.
- ^ Papp, John F. «Mineral Yearbook 2002: Chromium» (PDF). United States Geological Survey. Retrieved 16 February 2009.
- ^ Morrison, RD; Murphy, BL (4 August 2010). Environmental Forensics: Contaminant Specific Guide. Academic Press. ISBN 9780080494784.
- ^ Davis, JR (2000). Alloy digest sourcebook : stainless steels (in Afrikaans). Materials Park, OH: ASM International. pp. 1–5. ISBN 978-0-87170-649-2. OCLC 43083287.
- ^ Bhadeshia, HK. «Nickel-Based Superalloys». University of Cambridge. Archived from the original on 25 August 2006. Retrieved 17 February 2009.
- ^ «Chromium, Nickel and Welding». IARC Monographs. International Agency for Research on Cancer. 49: 49–50. 1990.
- ^ «Stainless Steel Grade 332 (UNS S33200)». AZoNetwork. 5 March 2013.
- ^ «Super Alloy INCOLOY Alloy 800 (UNS N08800)». AZoNetwork. 3 July 2013.
- ^ «Manual On Uniform Traffic Control Devices (War Emergency Edition)» (PDF). Washington, DC: American Associan of State Highway Officials. November 1942. p. 52. Retrieved 8 July 2021.
- ^ State Department, United States. «Allied Relations and Negotiations with Turkey» (PDF). Archived (PDF) from the original on 9 November 2020.
- ^ Breitsameter, M (15 August 2002). «Thermal Spraying versus Hard Chrome Plating». Azo Materials. AZoNetwork. Retrieved 1 October 2018.
- ^ Edwards, J (1997). Coating and Surface Treatment Systems for Metals. Finishing Publications Ltd. and ASMy International. pp. 66–71. ISBN 978-0-904477-16-0.
- ^ Zhao J, Xia L, Sehgal A, Lu D, McCreery RL, Frankel GS (2001). «Effects of chromate and chromate conversion coatings on corrosion of aluminum alloy 2024-T3». Surface and Coatings Technology. 140 (1): 51–57. doi:10.1016/S0257-8972(01)01003-9. hdl:1811/36519.
- ^ Cotell, CM; Sprague, JA; Smidt, FA (1994). ASM Handbook: Surface Engineering. ASM International. ISBN 978-0-87170-384-2. Retrieved 17 February 2009.
- ^ Gettens, Rutherford John (1966). «Chrome yellow». Painting Materials: A Short Encyclopaedia. Courier Dover Publications. pp. 105–106. ISBN 978-0-486-21597-6.
- ^ Gerd Anger et al. «Chromium Compounds» Ullmann’s Encyclopedia of Industrial Chemistry 2005, Wiley-VCH, Weinheim. doi:10.1002/14356007.a07_067
- ^ Marrion, Alastair (2004). The chemistry and physics of coatings. Royal Society of Chemistry. pp. 287–. ISBN 978-0-85404-604-1.
- ^ Moss, SC; Newnham, RE (1964). «The chromium position in ruby» (PDF). Zeitschrift für Kristallographie. 120 (4–5): 359–363. Bibcode:1964ZK….120..359M. doi:10.1524/zkri.1964.120.4-5.359.
- ^ Webb, Colin E; Jones, Julian DC (2004). Handbook of Laser Technology and Applications: Laser design and laser systems. CRC Press. pp. 323–. ISBN 978-0-7503-0963-9.
- ^ a b Hingston, J; Collins, CD; Murphy, RJ; Lester, JN (2001). «Leaching of chromated copper arsenate wood preservatives: a review». Environmental Pollution. 111 (1): 53–66. doi:10.1016/S0269-7491(00)00030-0. PMID 11202715.
- ^ Brown, EM (1997). «A Conformational Study of Collagen as Affected by Tanning Procedures». Journal of the American Leather Chemists Association. 92: 225–233.
- ^ Sreeram, K.; Ramasami, T. (2003). «Sustaining tanning process through conservation, recovery and better utilization of chromium». Resources, Conservation and Recycling. 38 (3): 185–212. doi:10.1016/S0921-3449(02)00151-9.
- ^ Qiang, Taotao; Gao, Xin; Ren, Jing; Chen, Xiaoke; Wang, Xuechuan (9 December 2015). «A Chrome-Free and Chrome-Less Tanning System Based on the Hyperbranched Polymer». ACS Sustainable Chemistry & Engineering. 4 (3): 701–707. doi:10.1021/acssuschemeng.5b00917.
- ^ Barnhart, Joel (1997). «Occurrences, Uses, and Properties of Chromium». Regulatory Toxicology and Pharmacology. 26 (1): S3–S7. doi:10.1006/rtph.1997.1132. ISSN 0273-2300. PMID 9380835.
- ^ Weckhuysen, Bert M; Schoonheydt, Robert A (1999). «Olefin polymerization over supported chromium oxide catalysts» (PDF). Catalysis Today. 51 (2): 215–221. doi:10.1016/S0920-5861(99)00046-2. hdl:1874/21357. S2CID 98324455.
- ^ Twigg, MVE (1989). «The Water-Gas Shift Reaction». Catalyst Handbook. ISBN 978-0-7234-0857-4.
- ^ Rhodes, C; Hutchings, GJ; Ward, AM (1995). «Water-gas shift reaction: Finding the mechanistic boundary». Catalysis Today. 23: 43–58. doi:10.1016/0920-5861(94)00135-O.
- ^ Lazier, WA & Arnold, HR (1939). «Copper Chromite Catalyst». Organic Syntheses. 19: 31.; Collective Volume, vol. 2, p. 142
- ^ Kitagawa, Hiraku (April 1989). «LiTe and CaTe thin-film junctions as humidity sensors». Sensors and Actuators. 16 (4): 369–378. doi:10.1016/0250-6874(89)85007-3.
- ^ Mallinson, John C. (1993). «Chromium Dioxide». The foundations of magnetic recording. Academic Press. p. 32. ISBN 978-0-12-466626-9.
- ^ Toshiro Doi; Ioan D. Marinescu; Syuhei Kurokawa (30 November 2011). Advances in CMP Polishing Technologies. William Andrew. pp. 60–. ISBN 978-1-4377-7860-1.
- ^ Baral, Anil; Engelken, Robert D. (2002). «Chromium-based regulations and greening in metal finishing industries in the USA». Environmental Science & Policy. 5 (2): 121–133. doi:10.1016/S1462-9011(02)00028-X.
- ^ Soderberg, Tim (3 June 2019). «Oxidizing Agents». LibreTexts. MindTouch. Retrieved 8 September 2019.
- ^ Roth, Alexander (1994). Vacuum Sealing Techniques. Springer Science & Business Media. pp. 118–. ISBN 978-1-56396-259-2.
- ^ Lancashire, Robert J (27 October 2008). «Determination of iron using potassium dichromate: Redox indicators». The Department of Chemistry UWI, Jamaica. Retrieved 8 September 2019.
- ^ Garverick, Linda (1994). Corrosion in the Petrochemical Industry. ASM International. ISBN 978-0-87170-505-1.
- ^ Shahid Ul-Islam (18 July 2017). Plant-Based Natural Products: Derivatives and Applications. Wiley. pp. 74–. ISBN 978-1-119-42388-1.
- ^ Vincent, JB (2013). «Chapter 6. Chromium: Is It Essential, Pharmacologically Relevant, or Toxic?». In Astrid Sigel; Helmut Sigel; Roland KO Sigel (eds.). Interrelations between Essential Metal Ions and Human Diseases. Metal Ions in Life Sciences. Vol. 13. Springer. pp. 171–198. doi:10.1007/978-94-007-7500-8_6. ISBN 978-94-007-7499-5. PMID 24470092.
- ^ Maret, Wolfgang (2019). «Chapter 9. Chromium Supplementation in Human Health, Metabolic Syndrome, and Diabetes». In Sigel, Astrid; Freisinger, Eva; Sigel, Roland K. O.; Carver, Peggy L. (eds.). Essential Metals in Medicine:Therapeutic Use and Toxicity of Metal Ions in the Clinic. Metal Ions in Life Sciences. Vol. 19. Berlin: de Gruyter GmbH. pp. 231–251. doi:10.1515/9783110527872-015. ISBN 978-3-11-052691-2. PMID 30855110.
- ^ European Food Safety Authority (2014). «Scientific Opinion on Dietary Reference Values for chromium». EFSA Journal. 12 (10): 3845. doi:10.2903/j.efsa.2014.3845.
- ^ Di Bona KR, Love S, Rhodes NR, McAdory D, Sinha SH, Kern N, Kent J, Strickland J, Wilson A, Beaird J, Ramage J, Rasco JF, Vincent JB (2011). «Chromium is not an essential trace element for mammals: effects of a «low-chromium» diet». J Biol Inorg Chem. 16 (3): 381–390. doi:10.1007/s00775-010-0734-y. PMID 21086001. S2CID 22376660.
- ^ Wise, SS; Wise, JP, Sr (2012). «Chromium and genomic stability». Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis. 733 (1–2): 78–82. doi:10.1016/j.mrfmmm.2011.12.002. PMC 4138963. PMID 22192535.
- ^ «ToxFAQs: Chromium». Agency for Toxic Substances & Disease Registry, Centers for Disease Control and Prevention. February 2001. Archived from the original on 8 July 2014. Retrieved 2 October 2007.
- ^ Vincent, JB (2015). «Is the Pharmacological Mode of Action of Chromium(III) as a Second Messenger?». Biological Trace Element Research. 166 (1): 7–12. doi:10.1007/s12011-015-0231-9. PMID 25595680. S2CID 16895342.
- ^ a b Thor, MY; Harnack, L; King, D; Jasthi, B; Pettit, J (2011). «Evaluation of the comprehensiveness and reliability of the chromium composition of foods in the literature». Journal of Food Composition and Analysis. 24 (8): 1147–1152. doi:10.1016/j.jfca.2011.04.006. PMC 3467697. PMID 23066174.
- ^ Kamerud KL; Hobbie KA; Anderson KA (2013). «Stainless steel leaches nickel and chromium into foods during cooking». Journal of Agricultural and Food Chemistry. 61 (39): 9495–9501. doi:10.1021/jf402400v. PMC 4284091. PMID 23984718.
- ^ Flint GN; Packirisamy S (1997). «Purity of food cooked in stainless steel utensils». Food Additives and Contaminants. 14 (2): 115–126. doi:10.1080/02652039709374506. PMID 9102344.
- ^ a b «Chromium». Nutrient Reference Values for Australia and New Zealand. 2014. Retrieved 4 October 2018.
- ^ a b «Nutrient Requirements and Recommended Dietary Allowances for Indians: A Report of the Expert Group of the Indian Council of Medical Research. pp.283-295 (2009)» (PDF). Archived from the original (PDF) on 15 June 2016. Retrieved 3 October 2018.
- ^ a b «DRIs for Chromium (μg/day)» (PDF). Overview of Dietary Reference Intakes for Japanese. 2015. p. 41. Retrieved 4 October 2018.
- ^ a b c «Chromium. IN: Dietary Reference Intakes for Vitamin A, Vitamin K, Arsenic, Boron, Chromium, Chromium, Iodine, Iron, Manganese, Molybdenum, Nickel, Silicon, Vanadium, and Chromium». Institute of Medicine (U.S.) Panel on Micronutrients, National Academy Press. 2001. pp. 197–223. Retrieved 3 October 2018.
- ^ a b «Overview on Dietary Reference Values for the EU population as derived by the EFSA Panel on Dietetic Products, Nutrition and Allergies» (PDF). 2017.
- ^ Tolerable Upper Intake Levels For Vitamins And Minerals (PDF), European Food Safety Authority, 2006
- ^ «Federal Register May 27, 2016 Food Labeling: Revision of the Nutrition and Supplement Facts Labels. FR page 33982» (PDF).
- ^ «Daily Value Reference of the Dietary Supplement Label Database (DSLD)». Dietary Supplement Label Database (DSLD). Archived from the original on 7 April 2020. Retrieved 16 May 2020.
- ^ «USDA Food Composition Databases». United States Department of Agriculture Agricultural Research Service. April 2018. Retrieved 4 October 2018.
- ^
Kumpulainen, JT (1992). «Chromium content of foods and diets». Biological Trace Element Research. 32 (1–3): 9–18. doi:10.1007/BF02784582. PMID 1375091. S2CID 10189109. - ^ Grijalva Haro, MI; Ballesteros Vázquez, MN; Cabrera Pacheco, RM (2001). «Chromium content in foods and dietary intake estimation in the Northwest of Mexico». Arch Latinoam Nutr (in Spanish). 51 (1): 105–110. PMID 11515227.
- ^ a b Kantor, Elizabeth D; Rehm, Colin D; Du, Mengmeng; White, Emily; Giovannucci, Edward L (11 October 2017). «Trends in Dietary Supplement Use Among US Adults From 1999-2012». JAMA. 316 (14): 1464–1474. doi:10.1001/jama.2016.14403. PMC 5540241. PMID 27727382.
- ^ a b Stehle, P; Stoffel-Wagner, B; Kuh, KS (6 April 2014). «Parenteral trace element provision: recent clinical research and practical conclusions». European Journal of Clinical Nutrition. 70 (8): 886–893. doi:10.1038/ejcn.2016.53. PMC 5399133. PMID 27049031.
- ^ Finch, Carolyn Weiglein (February 2015). «Review of trace mineral requirements for preterm infants: What are the current recommendations for clinical practice?». Nutrition in Clinical Practice. 30 (1): 44–58. doi:10.1177/0884533614563353. PMID 25527182.
- ^ a b Vincent, John B (2010). «Chromium: Celebrating 50 years as an essential element?». Dalton Transactions. 39 (16): 3787–3794. doi:10.1039/B920480F. PMID 20372701.
- ^ FDA Qualified Health Claims: Letters of Enforcement Discretion, Letters of Denial U.S. Food and Drug Administration, Docket #2004Q-0144 (August 2005).
- ^ «Monograph: Chromium (from Chromium picolinate)». Health Canada. 9 December 2009. Retrieved 18 October 2018.
- ^ a b Scientific Opinion on the substantiation of health claims related to chromium and contribution to normal macronutrient metabolism (ID 260, 401, 4665, 4666, 4667), maintenance of normal blood glucose concentrations (ID 262, 4667), contribution to the maintenance or achievement of a normal body weight (ID 339, 4665, 4666), and reduction of tiredness and fatigue (ID 261) pursuant to Article 13(1) of Regulation (EC) No 1924/2006 Archived 21 April 2020 at the Wayback Machine European Food Safety Authority EFSA J 2010;8(10)1732.
- ^ San Mauro-Martin I, Ruiz-León AM, Camina-Martín MA, Garicano-Vilar E, Collado-Yurrita L, Mateo-Silleras B, Redondo P (2016). «[Chromium supplementation in patients with type 2 diabetes and high risk of type 2 diabetes: a meta-analysis of randomized controlled trials]». Nutr Hosp (in Spanish). 33 (1): 27. doi:10.20960/nh.27. PMID 27019254.
- ^ Abdollahi, M; Farshchi, A; Nikfar, S; Seyedifar, M (2013). «Effect of chromium on glucose and lipid profiles in patients with type 2 diabetes; a meta-analysis review of randomized trials». J Pharm Pharm Sci. 16 (1): 99–114. doi:10.18433/J3G022. PMID 23683609.
- ^ Suksomboon, N; Poolsup, N; Yuwanakorn, A (17 March 2013). «Systematic review and meta-analysis of the efficacy and safety of chromium supplementation in diabetes». J Clin Pharm Ther. 39 (3): 292–306. doi:10.1111/jcpt.12147. PMID 24635480. S2CID 22326435.
- ^ Bailey, Christopher H (January 2014). «Improved meta-analytic methods show no effect of chromium supplements on fasting glucose». Biol Trace Elem Res. 157 (1): 1–8. doi:10.1007/s12011-013-9863-9. PMID 24293356. S2CID 2441511.
- ^ Costello, Rebecca B; Dwyer, Johanna T; Bailey, Regan L (30 May 2016). «Chromium supplements for glycemic control in type 2 diabetes: limited evidence of effectiveness». Nutrition Reviews. 74 (7): 455–468. doi:10.1093/nutrit/nuw011. PMC 5009459. PMID 27261273.
- ^ a b Tian, Honglian; Guo, Xiaohu; Wang, Xiyu; He, Zhiyun; Sun, Rao; Ge, Sai; Zhang, Zongjiu (2013). «Chromium picolinate supplementation for overweight or obese adults». Cochrane Database Syst Rev. 2013 (11): CD010063. doi:10.1002/14651858.CD010063.pub2. PMC 7433292. PMID 24293292.
- ^ a b Onakpoya, I; Posadzki, P; Ernst, E (2013). «Chromium supplementation in overweight and obesity: a systematic review and meta-analysis of randomized clinical trials». Obes Rev. 14 (6): 496–507. doi:10.1111/obr.12026. PMID 23495911. S2CID 21832321.
- ^ Lefavi RG, Anderson RA, Keith RE, Wilson GD, McMillan JL, Stone MH (1992). «Efficacy of chromium supplementation in athletes: emphasis on anabolism». International Journal of Sport Nutrition. 2 (2): 111–122. doi:10.1123/ijsn.2.2.111. PMID 1299487.
- ^ Vincent JB (2003). «The potential value and toxicity of chromium picolinate as a nutritional supplement, weight loss agent and muscle development agent». Sports Med. 33 (3): 213–230. doi:10.2165/00007256-200333030-00004. PMID 12656641. S2CID 9981172.
- ^ Jenkinson DM, Harbert AJ (2008). «Supplements and sports». Am Fam Physician. 78 (9): 1039–1046. PMID 19007050.
- ^ Maughan RJ, Burke LM, et al. (2018). «IOC Consensus Statement: Dietary Supplements and the High-Performance Athlete». International Journal of Sport Nutrition and Exercise Metabolism. 28 (2): 104–125. doi:10.1123/ijsnem.2018-0020. PMC 5867441. PMID 29589768.
- ^ Islam MM, Karim MR, Zheng X, Li X (2018). «Heavy Metal and Metalloid Pollution of Soil, Water and Foods in Bangladesh: A Critical Review». International Journal of Environmental Research and Public Health. 15 (12): 2825. doi:10.3390/ijerph15122825. PMC 6313774. PMID 30544988.
- ^ a b Bakshi A, Panigrahi AK (2018). «A comprehensive review on chromium induced alterations in fresh water fishes». Toxicol Rep. 5: 440–447. doi:10.1016/j.toxrep.2018.03.007. PMC 5977408. PMID 29854615.
- ^ Ahmed AR, Jha AN, Davies SJ (2012). «The efficacy of chromium as a growth enhancer for mirror carp (Cyprinus carpio L): an integrated study using biochemical, genetic, and histological responses». Biol Trace Elem Res. 148 (2): 187–197. doi:10.1007/s12011-012-9354-4. PMID 22351105. S2CID 16154712.
- ^ Barceloux, Donald G; Barceloux, Donald (1999). «Chromium». Clinical Toxicology. 37 (2): 173–194. doi:10.1081/CLT-100102418. PMID 10382554.
- ^ a b Katz, SA; Salem, H (1992). «The toxicology of chromium with respect to its chemical speciation: A review». Journal of Applied Toxicology. 13 (3): 217–224. doi:10.1002/jat.2550130314. PMID 8326093. S2CID 31117557.
- ^ Eastmond, DA; MacGregor, JT; Slesinski, RS (2008). «Trivalent Chromium: Assessing the Genotoxic Risk of an Essential Trace Element and Widely Used Human and Animal Nutritional Supplement». Critical Reviews in Toxicology. 38 (3): 173–190. doi:10.1080/10408440701845401. PMID 18324515. S2CID 21033504.
- ^ NIOSH Pocket Guide to Chemical Hazards. «#0141». National Institute for Occupational Safety and Health (NIOSH).
- ^ Dayan, AD; Paine, AJ (2001). «Mechanisms of chromium toxicity, carcinogenicity and allergenicity: Review of the literature from 1985 to 2000». Human & Experimental Toxicology. 20 (9): 439–451. doi:10.1191/096032701682693062. PMID 11776406. S2CID 31351037.
- ^ Newman, D. (1890). «A case of adeno-carcinoma of the left inferior turbinated body, and perforation of the nasal septum, in the person of a worker in chrome pigments». Glasgow Medical Journal. 33: 469–470.
- ^ Langard, S (1990). «One Hundred Years of Chromium and Cancer: A Review of Epidemiological Evidence and Selected Case Reports». American Journal of Industrial Medicine. 17 (2): 189–214. doi:10.1002/ajim.4700170205. PMID 2405656.
- ^ Cohen, MD; Kargacin, B; Klein, CB; Costa, M (1993). «Mechanisms of chromium carcinogenicity and toxicity». Critical Reviews in Toxicology. 23 (3): 255–281. doi:10.3109/10408449309105012. PMID 8260068.
- ^ Methods to Develop Inhalation Cancer Risk Estimates for Chromium and Nickel Compounds. Research Triangle Park, NC: U.S. Environmental Protection Agency, Office of Air Quality Planning and Standards, Health and Environmental Impacts Division. 2011. Retrieved 19 March 2015.
- ^ Ngan, V (2002). «Chrome Allergy». DermNet NZ.
- ^ Basketter, David; Horev, L; Slodovnik, D; Merimes, S; Trattner, A; Ingber, A (2000). «Investigation of the threshold for allergic reactivity to chromium». Contact Dermatitis. 44 (2): 70–74. doi:10.1034/j.1600-0536.2001.440202.x. PMID 11205406. S2CID 45426346.
- ^ Baselt, Randall C (2008). Disposition of Toxic Drugs and Chemicals in Man (8th ed.). Foster City: Biomedical Publications. pp. 305–307. ISBN 978-0-9626523-7-0.
- ^ «US water has large amounts of likely carcinogen: study». Yahoo News. 19 December 2010. Archived from the original on 23 December 2010. Retrieved 19 December 2010.
- ^ James, Bruce (1996). «The challenge of remediating chromium-contaminated soil». Environmental Science and Technology. 30 (6): 248A–251A. doi:10.1021/es962269h. PMID 21648723.
General bibliography[edit]
- Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
External links[edit]
Wikimedia Commons has media related to Chromium.
Look up chromium in Wiktionary, the free dictionary.
- ATSDR Case Studies in Environmental Medicine: Chromium Toxicity U.S. Department of Health and Human Services
- IARC Monograph «Chromium and Chromium compounds»
- It’s Elemental – The Element Chromium
- The Merck Manual – Mineral Deficiency and Toxicity
- National Institute for Occupational Safety and Health – Chromium Page
- Chromium at The Periodic Table of Videos (University of Nottingham)
- «Chromium» . Encyclopædia Britannica. Vol. 6 (11th ed.). 1911. pp. 296–298.
Хром в таблице менделеева занимает 24 место, в 4 периоде.
| Символ | Cr |
| Номер | 24 |
| Атомный вес | 51.9961000 |
| Латинское название | Chromium |
| Русское название | Хром |
Как самостоятельно построить электронную конфигурацию? Ответ здесь
Электронная схема хрома
Cr: 1s2 2s2 2p6 3s2 3p6 4s1 3d5
Короткая запись:
Cr: [Ar]4s1 3d5
Такое же количество электронов как и атом хрома имеют:
Ti-2, V-1, Mn+1, Fe+2, Co+3, Ni+4
Порядок заполнения оболочек атома хрома (Cr) электронами:
1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d →
5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
На подуровне ‘s’ может находиться до 2 электронов, на ‘s’ — до 6, на
‘d’ — до 10 и на ‘f’ до 14
Хром имеет 24 электрона,
заполним электронные оболочки в описанном выше порядке:
Элемент Cr является исключением!
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
2 электрона на 3s-подуровне
6 электронов на 3p-подуровне
1 электрон на 4s-подуровне
5 электронов на 3d-подуровне
Степень окисления хрома
Атомы хрома в соединениях имеют степени окисления 6, 5, 4, 3, 2, 1, 0, -1, -2, -3, -4.
Степень окисления — это условный заряд атома в соединении: связь в молекуле
между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается
заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается,
то степень окисления положительная.
Ионы хрома
Валентность Cr
Атомы хрома в соединениях проявляют валентность VI, V, IV, III, II, I.
Валентность хрома характеризует способность атома Cr к образованию хмических связей.
Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании
химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа Cr
Квантовые числа определяются последним электроном в конфигурации,
для атома Cr эти числа имеют значение N = 3, L = 2, Ml = 2, Ms = +½
Видео заполнения электронной конфигурации (gif):
Результат:
Энергия ионизации
Чем ближе электрон к центру атома — тем больше энергии необходимо, что бы его оторвать.
Энергия, затрачиваемая на отрыв электрона от атома называется энергией ионизации и обозначается Eo.
Если не указано иное, то энергия ионизации — это энергия отрыва первого электрона, также существуют энергии
ионизации для каждого последующего электрона.
Энергия ионизации Cr:
Eo = 653 кДж/моль
— Что такое ион читайте в статье.
Перейти к другим элементам таблицы менделеева
Где Cr в таблице менделеева?
Таблица Менделеева
Скачать таблицу менделеева в хорошем качестве
Содержание
- 1 История
- 1.1 Происхождение названия
- 1.2 История
- 2 Нахождение в природе
- 2.1 Месторождения
- 3 Геохимия и минералогия
- 4 Получение
- 5 Физические свойства
- 5.1 Изотопы
- 6 Химические свойства
- 6.1 Характерные степени окисления
- 6.2 Простое вещество
- 6.3 Соединения Cr(+2)
- 6.4 Соединения Cr(+3)
- 6.5 Соединения хрома (+4)
- 6.6 Соединения хрома (+6)
- 7 Применение
- 8 Биологическая роль и физиологическое действие
История
Происхождение названия
Название элемент получил от греч. χρῶμα — цвет, краска — из-за разнообразия окраски своих соединений.
История
Открыт на Среднем Урале, в Березовском золоторудном месторождении. Впервые упоминается в труде М. В. Ломоносова «Первые основания металлургии» (1763 год), как красная свинцовая руда, PbCrO4. Современное название — крокоит. В 1797 году французский химик Л. Н. Воклен выделил из него новый тугоплавкий металл (скорее всего, Воклен получил карбид хрома).
Нахождение в природе
Хром является довольно распространённым элементом в земной коре (0,012 % по массе). Основные соединения хрома — хромистый железняк (хромит) FeO·Cr2O3. Вторым по значимости минералом является крокоит PbCrO4.
Месторождения
Самые большие месторождения хрома находятся в ЮАР (1-е место в мире), Казахстане, России, Зимбабве, Мадагаскаре. Также есть месторождения на территории Турции, Индии, Армении, Бразилии, на Филиппинах.
Главные месторождения хромовых руд в РФ известны на Урале (Донские и Сарановское).
Разведанные запасы в Казахстане составляют свыше 350 миллионов тонн (2-е место в мире).
Геохимия и минералогия
Среднее содержание хрома в различных изверженных породах резко непостоянно. В ультраосновных породах (перидотитах) оно достигает 2 кг/т, в основных породах (базальтах и др.) — 200 г/т, а в гранитах десятки г/т. Кларк хрома в земной коре 83 г/т. Он является типичным литофильным элементом и почти весь заключен в минералах типа хромшпинелидов. Хром вместе с железом, титаном, никелем, ванадием и марганцем составляют одно геохимическое семейство.
Различают три основных минерала хрома: магнохромит (Mg, Fe)Cr2O4, хромпикотит (Mg, Fe)(Cr, Al)2O4 и алюмохромит (Fe, Mg)(Cr, Al)2O4. По внешнему виду они неразличимы, и их неточно называют «хромиты». Состав их изменчив:
- Cr2O3 18—62 %,
- FeO 1—18 %,
- MgO 5—16 %,
- Al2O3 0,2 — 0,4 (до 33 %),
- Fe2O3 2 — 30 %,
- примеси TiO2 до 2 %,
- V2O5 до 0,2 %,
- ZnO до 5 %,
- MnO до 1 %; присутствуют также Co, Ni и др.
Собственно, хромит, то есть FeCr2O4 сравнительно редок. Помимо различных хромитов, хром входит в состав ряда других минералов — хромовой слюды (фуксита), хромового хлорита, хромвезувиана, хромдиопсида, хромтурмалина, хромового граната (уваровита) и др., которые нередко сопровождают руды, но сами промышленного значения не имеют. В экзогенных условиях хром, как и железо, мигрирует в виде взвесей и может накапливаться в глинах. Наиболее подвижной формой являются хроматы.
Получение
Хром встречается в природе в основном в виде хромистого железняка Fe(CrO2)2 (хромит железа). Из него получают феррохром восстановлением в электропечах коксом (углеродом):
-
- Fe(CrO2)2 + 4C → Fe + 2Cr + 4CO
Феррохром применяют для производства легированных сталей.
Чтобы получить чистый хром, реакцию ведут следующим образом:
1) сплавляют хромит железа с карбонатом натрия (кальцинированная сода) на воздухе:
-
- 4Fe(CrO2)2 + 8Na2CO3 + 7O2 → 8Na2CrO4 + 2Fe2O3 + 8CO2
2) растворяют хромат натрия и отделяют его от оксида железа;
3) переводят хромат в дихромат, подкисляя раствор и выкристаллизовывая дихромат;
4) получают чистый оксид хрома восстановлением дихромата натрия углём:
-
- Na2Cr27 + 2C → Cr2O3 + Na2CO3 + CO
5) с помощью алюминотермии получают металлический хром:
-
- Cr2O3 + 2Al → Al2O3 + 2Cr + 130kcal
6) с помощью электролиза получают электролитический хром из раствора хромового ангидрида в воде, содержащего добавку серной кислоты. При этом на катодах совершаются в основном 3 процесса:
- восстановление шестивалентного хрома до трехвалентного с переходом его в раствор;
- разряд ионов водорода с выделением газообразного водорода;
- разряд ионов, содержащих шестивалентный хром, с осаждением металлического хрома;
-
- Cr2O72− + 14H+ + 12e− → 2Cr + 7H2O
Физические свойства
В свободном виде — голубовато-белый металл с кубической объёмноцентрированной решёткой, a = 0,28845 нм. Ниже температуры 38 °C является антиферромагнетиком, выше переходит в парамагнитное состояние (точка Нееля).
Хром имеет твёрдость по шкале Мооса 5, один из самых твёрдых чистых металлов (уступает только иридию, бериллию, вольфраму и урану). Очень чистый хром достаточно хорошо поддаётся механической обработке.
Изотопы
Основная статья: Изотопы хрома
Природный хром состоит из четырех стабильных изотопов (50Cr (изотопная распространённость 4,345 %), 52Cr (83.789 %), 53Cr (9.501 %), 54Cr (2.365 %)).
Химические свойства
Характерные степени окисления
Для хрома характерны степени окисления +2, +3 и +6 (см. табл.). Практически все соединения хрома окрашены.
| Степень окисления | Оксид | Гидроксид | Характер | Преобладающие формы в растворах | Примечания |
|---|---|---|---|---|---|
| +2 | CrO (чёрный) | Cr(OH)2 (жёлтый) | Основный | Cr2+ (соли голубого цвета) | Очень сильный восстановитель |
| +3 | Cr2O3 (зелёный) | Cr(OH)3 (серо-зелёный) | Амфотерный | Cr3+ (зелёные или лиловые соли)
[Cr(OH)4]− (зелёный) |
|
| +4 | CrO2 | не существует | Несолеобразующий | — | Встречается редко, малохарактерна |
| +6 | CrO3 (красный) | H2CrO4
H2Cr2O7 |
Кислотный | CrO42− (хроматы, желтые)
Cr2O72− (дихроматы, оранжевые) |
Переход зависит от рН среды. Сильнейший окислитель, гигроскопичен, очень ядовит. |
Диаграмма Пурбе для хрома
Простое вещество
Устойчив на воздухе за счёт пассивирования. По этой же причине не реагирует с серной и азотной кислотами. При 2000 °C сгорает с образованием зелёного оксида хрома(III) Cr2O3, обладающего амфотерными свойствами.
Синтезированы соединения хрома с бором (бориды Cr2B, CrB, Cr3B4, CrB2, CrB4 и Cr5B3), с углеродом (карбиды Cr23C6, Cr7C3 и Cr3C2), c кремнием (силициды Cr3Si, Cr5Si3 и CrSi) и азотом (нитриды CrN и Cr2N).
Соединения Cr(+2)
Степени окисления +2 соответствует основный оксид CrO (чёрный). Соли Cr2+ (растворы голубого цвета) получаются при восстановлении солей Cr3+ или дихроматов цинком в кислой среде («водородом в момент выделения»):
- [H]
- 2Cr3+ → Zn,HCl 2Cr2+
Все эти соли Cr2+ — сильные восстановители вплоть до того, что при стоянии вытесняют водород из воды. Кислородом воздуха, особенно в кислой среде, Cr2+ окисляется, в результате чего голубой раствор быстро зеленеет.
Коричневый или жёлтый гидроксид Cr(OH)2 осаждается при добавлении щелочей к растворам солей хрома(II).
Синтезированы дигалогениды хрома CrF2, CrCl2, CrBr2 и CrI2
Соединения Cr(+3)
Степени окисления +3 соответствует амфотерный оксид Cr2O3 и гидроксид Cr(OH)3 (оба — зелёного цвета). Это — наиболее устойчивая степень окисления хрома. Соединения хрома в этой степени окисления имеют цвет от грязно-лилового (в водных растворах ион Cr3+ существует в виде аквакомплексов [Cr(H2O)6]3+) до зелёного (в координационной сфере присутствуют анионы).
Cr3+ склонен к образованию двойных сульфатов вида MICr(SO4)2·12H2O (квасцов)
Гидроксид хрома (III) получают, действуя аммиаком на растворы солей хрома (III):
-
- Cr3+ + 3NH3 + 3H2O → Cr(OH)3↓ + 3NH4+
Можно использовать растворы щелочей, но в их избытке образуется растворимый гидроксокомплекс:
-
- Cr3+ + 3OH− → Cr(OH)3↓
- Cr(OH)3 + 3OH− → [Cr(OH)6]3−
Сплавляя Cr2O3 со щелочами, получают хромиты:
-
- Cr2O3 + 2NaOH → 2NaCrO2 + H2O
Непрокаленный оксид хрома(III) растворяется в щелочных растворах и в кислотах:
-
- Cr2O3 + 6HCl → 2CrCl3 + 3H2O
При окислении соединений хрома(III) в щелочной среде образуются соединения хрома(VI):
-
- 2Na3[Cr(OH)6] + 3H2O2 → 2Na2CrO4 + 2NaOH + 8H2O
То же самое происходит при сплавлении оксида хрома (III) со щелочью и окислителями, или со щелочью на воздухе (расплав при этом приобретает жёлтую окраску):
-
- 2Cr2O3 + 8NaOH + 3O2 → 4Na2CrO4 + 4H2O
Соединения хрома (+4)
При осторожном разложении оксида хрома(VI) CrO3 в гидротермальных условиях получают оксид хрома(IV) CrO2, который является ферромагнетиком и обладает металлической проводимостью.
Среди тетрагалогенидов хрома устойчив CrF4, тетрахлорид хрома CrCl4 существует только в парах.
Соединения хрома (+6)
Степени окисления +6 соответствует кислотный оксид хрома (VI) CrO3 и целый ряд кислот, между которыми существует равновесие. Простейшие из них — хромовая H2CrO4 и двухромовая H2Cr2O7. Они образуют два ряда солей: желтые хроматы и оранжевые дихроматы соответственно.
Оксид хрома (VI) CrO3 образуется при взаимодействии концентрированной серной кислоты с растворами дихроматов. Типичный кислотный оксид, при взаимодействии с водой он образует сильные неустойчивые хромовые кислоты: хромовую H2CrO4, дихромовую H2Cr2O7 и другие изополикислоты с общей формулой H2CrnO3n+1. Увеличение степени полимеризации происходит с уменьшением рН, то есть увеличением кислотности:
-
- 2CrO42− + 2H+ → Cr2O72− + H2O
Но если к оранжевому раствору K2Cr2O7 прилить раствор щёлочи, как окраска вновь переходит в жёлтую, так как снова образуется хромат K2CrO4:
-
- Cr2O72− + 2OH− → 2CrO42− + H2O
До высокой степени полимеризации, как это происходит у вольфрама и молибдена, не доходит, так как полихромовая кислота распадается на оксид хрома(VI) и воду:
-
- H2CrnO3n+1 → H2O + nCrO3
Растворимость хроматов примерно соответствует растворимости сульфатов. В частности, жёлтый хромат бария BaCrO4 выпадает при добавлении солей бария как к растворам хроматов, так и к растворам дихроматов:
-
- Ba2+ + CrO42− → BaCrO4↓
- 2Ba2+ + Cr2O72− + H2O → 2BaCrO4↓ + 2H+
Образование кроваво-красного малорастворимого хромата серебра используют для обнаружения серебра в сплавах при помощи пробирной кислоты.
Известны пентафторид хрома CrF5 и малоустойчивый гексафторид хрома CrF6. Также получены летучие оксигалогениды хрома CrO2F2 и CrO2Cl2 (хромилхлорид).
Соединения хрома(VI) — сильные окислители, например:
-
- K2Cr2O7 + 14HCl → 2CrCl3 + 2KCl + 3Cl2↑ + 7H2O
Добавление к дихроматам перекиси водорода, серной кислоты и органического растворителя (эфира) приводит к образованию синего монопероксида хрома(VI) CrO5 (CrO(O2)2), который экстрагируется в органический слой; данная реакция используется как аналитическая.
Применение
Хром — важный компонент во многих легированных сталях (в частности, нержавеющих), а также и в ряде других сплавов. Добавка хрома существенно повышает твердость и коррозийную стойкость сплавов.
Используется в качестве износоустойчивых и красивых гальванических покрытий (хромирование).
Хром применяется для производства сплавов: хром-30 и хром-90, незаменимых для производства сопел мощных плазмотронов и в авиакосмической промышленности.
Биологическая роль и физиологическое действие
Хром — один из биогенных элементов, постоянно входит в состав тканей растений и животных. У животных хром участвует в обмене липидов, белков (входит в состав фермента трипсина), углеводов. Снижение содержания хрома в пище и крови приводит к уменьшению скорости роста, увеличению холестерина в крови.
В чистом виде хром довольно токсичен, металлическая пыль хрома раздражает ткани лёгких. Соединения хрома(III) вызывают дерматиты.
Пример соединения хрома (VI): Оксид хрома (VI)
Соединения хрома в степени окисления +6 особо токсичны. Практически вся хромовая руда обрабатывается через преобразование в дихромат натрия. В 1985 году было произведено примерно 136 000 тонн шестивалентного хрома. Другими источниками шестивалентного хрома являются триоксид хрома и различные соли — хроматы и дихроматы. Шестивалентный хром используется при производстве нержавеющих сталей, текстильных красок, консервантов для дерева, при хромировании и пр.
Шестивалентный хром является признанным канцерогеном при вдыхании. На многих рабочих местах сотрудники подвержены воздействию шестивалентного хрома, например, при гальваническом хромировании или сварке нержавеющих сталей. В Европейском союзе использование шестивалентного хрома существенно ограничено директивой RoHS.
Шестивалентный хром транспортируется в клетки человеческого организма с помощью сульфатного транспортного механизма благодаря своей близости к сульфатам по структуре и заряду. Трёхвалентный хром, более часто встречающийся, не транспортируется в клетки.
Внутри клетки Cr(VI) восстанавливается до метастабильного пятивалентного хрома (Cr(V)), затем до трехвалентного хрома (Cr(III)). Трехвалентный хром, присоединяясь к протеинам, создает гаптены, которые включают иммунную реакцию. После их появления чувствительность к хрому не пропадает. В этом случае даже контакт с текстильными изделиями, окрашенными хромсодержащими красками или с кожей, обработанной хромом, может вызвать раздражение кожи. Витамин C и другие агенты реагируют с хроматами и образуют Cr(III) внутри клетки.
Продукты шестивалентного хрома являются генотоксичными канцерогенами. Хроническое вдыхание соединений шестивалентного хрома увеличивает риск заболеваний носоглотки, риск рака лёгких. (Лёгкие особенно уязвимы из-за большого количества мелких капилляров). Видимо, механизм генотоксичности запускается пяти- и трёхвалентным хромом.
В США предельно допустимая концентрация шестивалентного хрома в воздухе составляет 5 мкг/м³ (0,005 мг/м³). В России предельно допустимая концентрация хрома (VI) существенно ниже — 1,5 мкг/м³ (0,0015 мг/м³).
Одним из общепризнанных методов избежания шестивалентного хрома является переход от технологий гальванического хромирования к газотермическому и вакуумному напылению.
Основанный на реальных событиях фильм «Эрин Брокович» режиссёра Стивена Содерберга рассказывает о крупном судебном процессе, связанном с загрязнением окружающей среды шестивалентным хромом, в результате которого у многих людей развились серьёзные заболевания.
Запрос «Cr» перенаправляется сюда; см. также другие значения.
|
|||
| Внешний вид простого вещества | |||
|---|---|---|---|
|
|
|||
| Свойства атома | |||
| Имя, символ, номер |
Хром / Chromium (Cr), 24 |
||
| Атомная масса (молярная масса) |
51,9961 а. е. м. (г/моль) |
||
| Электронная конфигурация |
[Ar] 3d5 4s1 |
||
| Радиус атома |
130 пм |
||
| Химические свойства | |||
| Ковалентный радиус |
118 пм |
||
| Радиус иона |
(+6e)52 (+3e)63 пм |
||
| Электроотрицательность |
1,66 (шкала Полинга) |
||
| Электродный потенциал |
-0.74 |
||
| Степени окисления |
6, 3, 2, 0 |
||
| Энергия ионизации (первый электрон) |
652,4 (6,76) кДж/моль (эВ) |
||
| Термодинамические свойства простого вещества | |||
| Плотность (при н. у.) |
7,19 г/см³ |
||
| Температура плавления |
2130 K |
||
| Температура кипения |
2945 K |
||
| Теплота плавления |
21 кДж/моль |
||
| Теплота испарения |
342 кДж/моль |
||
| Молярная теплоёмкость |
23,3[1] Дж/(K·моль) |
||
| Молярный объём |
7,23 см³/моль |
||
| Кристаллическая решётка простого вещества | |||
| Структура решётки |
кубическая |
||
| Параметры решётки |
2,885 Å |
||
| Температура Дебая |
460 K |
||
| Прочие характеристики | |||
| Теплопроводность |
(300 K) 93,9 Вт/(м·К) |
Хром — элемент побочной подгруппы шестой группы четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 24. Обозначается символом Cr (лат. Chromium). Простое вещество хром (CAS-номер: 7440-47-3) — твёрдый металл голубовато-белого цвета.
Содержание
- 1 История
- 2 Происхождение названия
- 3 Нахождение в природе
- 3.1 Месторождения
- 4 Геохимия и минералогия
- 5 Получение
- 6 Физические свойства
- 7 Химические свойства
- 7.1 Характерные степени окисления
- 7.2 Простое вещество
- 7.3 Соединения Cr(+2)
- 7.4 Соединения Cr(+3)
- 7.5 Соединения хрома (+4)
- 7.6 Соединения хрома (+6)
- 8 Применение
- 9 Биологическая роль и физиологическое действие
- 10 Интересные факты
- 11 См. также
- 12 Примечания
- 13 Ссылки
История
В 1766 году в окрестностях Екатеринбурга был обнаружен минерал, который получил название «сибирский красный свинец», PbCrO4. Современное название — крокоит. В 1797 французский химик Л. Н. Воклен выделил из него новый тугоплавкий металл (скорее всего Воклен получил карбид хрома).
Происхождение названия
Название элемент получил от греч. χρῶμα — цвет, краска — из-за разнообразия окраски своих соединений.
Нахождение в природе
Хром является довольно распространённым элементом (0,02 масс. долей, %). Основные соединения хрома — хромистый железняк (хромит) FeO·Cr2O3. Вторым по значимости минералом является крокоит PbCrO4.
Месторождения
Самые большие месторождения хрома находятся в ЮАР (1 место в мире), Казахстане, России, Зимбабве, Мадагаскаре. Также есть месторождения на территории Турции, Индии, Армении[2], Бразилии, на Филиппинах[3].
Главные месторождения хромовых руд в РФ известны на Урале (Донские и Сарановское).
Разведанные запасы в Казахстане составляют свыше 350 миллионов тонн (2 место в мире)[3].
Геохимия и минералогия
Среднее содержание хрома в различных изверженных породах резко непостоянно. В ультраосновных породах (перидотитах) оно достигает 2 кг/т, в основных породах (базальтах и др.) — 200 г/т, а в гранитах десятки г/т. Кларк хрома в земной коре 83 г/т. Он является типичным литофильным элементом и почти весь заключен в минералах типа хромшпинелидов. Хром вместе с железом, титаном, никелем, ванадием и марганцем составляют одно геохимическое семейство.
Различают три основных минерала хрома: магнохромит (Mn, Fe)Cr2O4, хромпикотит (Mg, Fe)(Cr, Al)2O4 и алюмохромит (Fe, Mg)(Cr, Al)2O4. По внешнему виду они неразличимы и их неточно называют «хромиты». Состав их изменчив:
- Cr2O3 18—62 %,
- FeO 1—18 %,
- MgO 5—16 %,
- Al2O3 0,2 — 0,4 (до 33 %),
- Fe2O3 2 — 30 %,
- примеси TiO2 до 2 %,
- ZnO до 5 %,
- MnO до 1 %; присутствуют также Co, Ni и др.
Собственно хромит, то есть FeCr2O4 сравнительно редок. Помимо различных хромитов, хром входит в состав ряда других минералов — хромовой слюды (фуксита), хромового хлорита, хромвезувиана, хромдиопсида, хромтурмалина, хромового граната (уваровита) и др., которые нередко сопровождают руды, но сами промышленного значения не имеют. В экзогенных условиях хром, как и железо, мигрирует в виде взвесей и может накапливаться в глинах. Наиболее подвижной формой являются хроматы.
Получение
Хром встречается в природе в основном в виде хромистого железняка Fe(CrO2)2 (хромит железа). Из него получают феррохром восстановлением в электропечах коксом (углеродом):
Феррохром применяют для производства легированных сталей.
Чтобы получить чистый хром, реакцию ведут следующим образом:
1) сплавляют хромит железа с карбонатом натрия (кальцинированная сода) на воздухе:
2) растворяют хромат натрия и отделяют его от оксида железа;
3) переводят хромат в дихромат, подкисляя раствор и выкристаллизовывая дихромат;
4) получают чистый оксид хрома восстановлением дихромата натрия углём:
5) с помощью алюминотермии получают металлический хром:
6) с помощью электролиза получают электролитический хром из раствора хромового ангидрида в воде, содержащего добавку серной кислоты. При этом на катодах совершаются в основном 3 процесса:
- восстановление шестивалентного хрома до трехвалентного с переходом его в раствор;
- разряд ионов водорода с выделением газообразного водорода;
- разряд ионов, содержащих шестивалентный хром, с осаждением металлического хрома;
Физические свойства
В свободном виде — голубовато-белый металл с кубической объемно-центрированной решеткой, а = 0,28845 нм. При температуре 39 °C переходит из парамагнитного состояния в антиферромагнитное (точка Нееля).
Хром имеет твердость по шкале Мооса 5.[4] Очень чистый хром достаточно хорошо поддаётся механической обработке.
Химические свойства
Характерные степени окисления
Для хрома характерны степени окисления +2, +3 и +6. (см. табл.) Практически все соединения хрома окрашены[5].
| Степень окисления | Оксид | Гидроксид | Характер | Преобладающие формы в растворах | Примечания |
|---|---|---|---|---|---|
| +2 | CrO (чёрный) | Не существует | Основный | Cr2+ (соли голубого цвета) | Очень сильный восстановитель |
| +3 | Cr2O3(зелёный) | Cr(OH)3 | Амфотерный | Cr3+ (зеленые или лиловые соли) [Cr(OH)4]— (зелёный) |
|
| +4 | CrO2 | не существует | Несолеобразующий | — | Встречается редко, малохарактерна |
| +6 | CrO3(красный) | H2CrO4 H2Cr2O7 |
Кислотный | CrO42- (хроматы, желтые) Cr2O72- (дихроматы, оранжевые) |
Переход зависит от рН среды. Сильнейший окислитель, гигроскопичен, очень ядовит. |
Простое вещество
Устойчив на воздухе за счёт пассивирования. По этой же причине не реагирует с серной и азотной кислотами. При 2000 °C сгорает с образованием зелёного оксида хрома(III) Cr2O3, обладающего амфотерными свойствами.
Синтезированы соединения хрома с бором (бориды Cr2B, CrB, Cr3B4, CrB2, CrB4 и Cr5B3), с углеродом (карбиды Cr23C6, Cr7C3 и Cr3C2), c кремнием (силициды Cr3Si, Cr5Si3 и CrSi) и азотом (нитриды CrN и Cr2N).
Соединения Cr(+2)
Степени окисления +2 соответствует основный оксид CrO (чёрный). Соли Cr2+ (растворы голубого цвета) получаются при восстановлении солей Cr3+ или дихроматов цинком в кислой среде («водородом в момент выделения»):
Все эти соли Cr2+ — сильные восстановители вплоть до того, что при стоянии вытесняют водород из воды[6]. Кислородом воздуха, особенно в кислой среде, Cr2+ окисляется, в результате чего голубой раствор быстро зеленеет.
Коричневый или желтый гидроксид Cr(OH)2 осаждается при добавлении щелочей к растворам солей хрома(II).
Синтезированы дигалогениды хрома CrF2, CrCl2, CrBr2 и CrI2
Соединения Cr(+3)
Степени окисления +3 соответствует амфотерный оксид Cr2O3 и гидроксид Cr(OH)3 (оба — зелёного цвета). Это — наиболее устойчивая степень окисления хрома. Соединения хрома в этой степени окисления имеют цвет от грязно-лилового (ион [Cr(H2O)6]3+ до зелёного (в координационной сфере присутствуют анионы).
Cr3+ склонен к образованию двойных сульфатов вида MICr(SO4)2·12H2O (квасцов)
Гидроксид хрома (III) получают, действуя аммиаком на растворы солей хрома (III):
Можно использовать растворы щелочей, но в их избытке образуется растворимый гидроксокомплекс:
Сплавляя Cr2O3 со щелочами получают хромиты:
Непрокаленный оксид хрома(III) растворяется в щелочных растворах и в кислотах:
При окислении соединений хрома(III) в щелочной среде образуются соединения хрома(VI):
То же самое происходит при сплавлении оксида хрома (III) со щелочью и окислителями, или со щелочью на воздухе (рассплав при этом приобретает жёлтую окраску):
Соединения хрома (+4)
При осторожном разложении оксида хрома(VI) CrO3 в гидротермальных условиях получают оксид хрома(IV) CrO2, который является ферромагнетиком и обладает металлической проводимостью.
Среди тетрагалогенидов хрома устойчив CrF4, тетрахлорид хрома CrCl4 существует только в парах.
Соединения хрома (+6)
Степени окисления +6 соответствует кислотный оксид хрома (VI) CrO3 и целый ряд кислот, между которыми существует равновесие. Простейшие из них — хромовая H2CrO4 и двухромовая H2Cr2O7. Они образуют два ряда солей: желтые хроматы и оранжевые дихроматы соответственно.
Оксид хрома (VI) CrO3 образуется при взаимодействии концентрированной серной кислоты с растворами дихроматов. Типичный кислотный оксид, при взаимодействии с водой он образует сильные неустойчивые хромовые кислоты: хромовую H2CrO4, хромат K2CrO4:
До высокой степени полимеризации, как это происходит у вольфрама и молибдена, не доходит, так как полихромовая кислота распадается на оксид хрома(VI) и воду:
Растворимость хроматов примерно соответствует растворимости сульфатов. В частности, желтый хромат бария BaCrO4 выпадает при добавлении солей бария как к растворам хроматов, так и к растворам дихроматов:
Образование кроваво-красного малорастворимого хромата серебра используют для обнаружения серебра в сплавах при помощи пробирной кислоты.
Известны пентафторид хрома CrF5 и малоустойчивый гексафторид хрома CrF6. Также получены летучие оксигалогениды хрома CrO2F2 и CrO2Cl2 (хромилхлорид).
Соединения хрома(VI) — сильные окислители, например:
Добавление к дихроматам перекиси водорода, серной кислоты и органического растворителя (эфира) приводит к образованию синего пероксида хрома CrO5L (L — молекула растворителя), который экстрагируется в органический слой; данная реакция используется как аналитическая.
Применение
Хром — важный компонент во многих легированных сталях (в частности, нержавеющих), а также и в ряде других сплавов. Используется в качестве износоустойчивых и красивых гальванических покрытий (хромирование). Хром применяется для производства сплавов: хром-30 и хром-90, незаменимых для производства сопел мощных плазмотронов и в авиакосмической промышленности.
Биологическая роль и физиологическое действие
Хром — один из биогенных элементов, постоянно входит в состав тканей растений и животных. У животных хром участвует в обмене липидов, белков (входит в состав фермента трипсина), углеводов. Снижение содержания хрома в пище и крови приводит к уменьшению скорости роста, увеличению холестерина в крови.
В чистом виде хром довольно токсичен, металлическая пыль хрома раздражает ткани лёгких. Соединения хрома(III) вызывают дерматиты. Соединения хрома(VI) приводят к разным заболеваниям человека, в том числе и онкологическим. ПДК хрома(VI) в атмосферном воздухе 0,0015 мг/м³.
Интересные факты
- Пиколинат хрома входит в состав средств для похудения.[источник не указан 284 дня]
- Основанный на реальных событиях фильм «Эрин Брокович» режиссёра Стивена Содерберга рассказывает о крупном судебном процессе, связанном с загрязнением окружающей среды шестивалентным хромом, в результате которого у многих людей развились серьёзные заболевания.[7]
См. также
- Категория:Соединения хрома
- Хромтау
Примечания
- ↑ Редкол.:Зефиров Н. С. (гл. ред.) Химическая энциклопедия: в 5 т. — Москва: Большая Российская энциклопедия, 1999. — Т. 5. — С. 308.
- ↑ статья «Минеральные ресурсы». Энциклопедия «Кругосвет». Архивировано из первоисточника 21 августа 2011.
- ↑ 1 2 ХРОМ | Онлайн Энциклопедия Кругосвет
- ↑ Поваренных А. С. Твердость минералов. — АН УССР, 1963. — С. 197-208. — 304 с.
- ↑ Реми Г. Курс неорганической химии. Т. 2. М., Мир, 1966. С. 142-180
- ↑ Некрасов Б. В. Курс общей химии. М:, ГНХТИ, 1952, С. 334
- ↑ Официальный сайт Эрин Брокович, страница, посвящённая фильму
Ссылки
| Хром на Викискладе? |
- Хром на Webelements
- Хром в Популярной библиотеке химических элементов
- Хром в месторождениях
- Свойства хрома
- Хромовая зелень, применение в живописи
| Периодическая система химических элементов Д. И. Менделеева | ||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||
| 1 | H | He | ||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Fl | Uup | Lv | Uus | Uuo |
|
| |
|---|
|
Eu, Sm, Li, Cs, Rb, K, Ra, Ba, Sr, Ca, Na, Ac, La, Ce, Pr, Nd, Pm, Gd, Tb, Mg, Y, Dy, Am, Ho, Er, Tm, Lu, Sc, Pu, Th, Np, U, Hf, Be, Al, Ti, Zr, Yb, Mn, V, Nb, Pa, Cr, Zn, Ga, Fe, Cd, In, Tl, Co, Ni, Te, Mo, Sn, Pb, H2, W, Sb, Bi, Ge, Re, Cu, Tc, Te, Rh, Po, Hg, Ag, Pd, Os, Ir, Pt, Au Элементы расположены в порядке возрастания стандартного электродного потенциала. |
|
Соединения хрома |
|---|
|
Бихромат аммония ((NH4)2Cr2O7) • Борид хрома (CrB) • Бромид хрома(II) (CrBr2) • Бромид хрома(III) (CrBr3) • Гексагидроксохромат (III) натрия (Na3[Сr(OH)6]) • Гексакарбонил хрома (Cr(CO)6) • Гидроксид хрома (III) (Cr(OH)3) • Гидроксид хрома(II) (Cr(OH)2) • Двухромовая кислота (H2Cr2O7) • Диоксид-дихлорид хрома (CrO2Cl2) • Дихромат калия (K2Cr2O7) • Дихромат лития (Li2Cr2O7) • Дихромат натрия (Na2Cr2O7) • Дихромат рубидия (Rb2Cr2O7) • Дихромат цезия (Cs2Cr2O7) • Зелень Гинье (Cr2O3•nH2O) • Иодид хрома(II) (CrI2) • Иодид хрома(III) (CrI3) • Карбид хрома(II) (Cr3C2) • Нитрат хрома (Cr(NO3)3) • Нитрид хрома (CrN) • Оксид хрома(II) (CrO) • Оксид хрома(III) (Cr2O3) • Оксид хрома(IV) (CrO2) • Оксид хрома(VI) (CrO3) • Оксифторид хрома(III) (CrOF) • Ортофосфат хрома(III) (CrPO4) • Пероксид хрома(VI) (CrO5) • Сульфат хрома(II) (CrSO4) • Сульфат хрома(III) (Cr2(SO4)3) • Сульфид хрома(II) (CrS) • Сульфид хрома(III) (Cr2S3) • Сульфат хрома(III)-калия (KCr(SO4)2) Фосфат хрома (CrPO4) • Фосфид хрома (CrP) • Фторид хрома(II) (CrF2) • Фторид хрома(III) (CrF3) • Фторид хрома(IV) (CrF4) • Фторид хрома(V) (CrF5) • Фтористый хромил (CrO2F2) • Хлорид гексаамминхрома(III) ([Сr(NH3)6]Cl3) • Хлорид хрома(II) (CrCl2) • Хлорид хрома(III) (CrCl3) • Хлорид хрома(IV) (CrCl4) • Хлористый хромил (CrO2Cl2) • Хромат аммония ((NH4)2CrO4) • Хромат калия (K2CrO4) • Хромат лития (Li2CrO4) • Хромат натрия (Na2CrO4) • Хромат рубидия (Rb2CrO4) • Хромат серебра (Ag2CrO4) • Хромат цезия (Cs2CrO4) • Хромит железа(II) (Fe(CrO2)2) • Хромит калия (KCrO2) • Хромовая кислота (H2CrO4) • |
| |
|
|---|---|
| Металлы | Алюминий (Al) | Железо (Fe) | Золото (Au) | Медь (Cu) | Никель (Ni) | Олово (Sn) | Палладий (Pd) | Платина (Pt) | Серебро (Ag) | Свинец (Pb) | Хром (Cr) | Цинк (Zn) |
| Сплавы | Акмонитал | Алюминиевая бронза (CuAl) | Биллон (CuAg) | Бронза (CuSn) | Колыванская медь (CuAuAg) | Латунь (CuZn) | Медно-никелевый сплав (CuNi) | Мельхиор (CuNiFeMn) | Нейзильбер, нойзильбер (CuZnNi) | Нержавеющая сталь (FeCrNi) | Никелевая бронза (CuSnNi) | Никелево-железный сплав (NiFe) | Никелево-цинковый сплав (NiZn) | Потин | Северное золото (CuAlZnSn) | Сталь (Fe) | Стерлинг (AgCu) | Томпак (CuZn) | Хромированная сталь (FeCr) | Чугун (Fe) | Электр, электрон, электрум (AuAg) |
| Группы монет | Биметаллические монеты | Бронзовые монеты | Медные монеты | Железные монеты | Золотые монеты | Палладиевые монеты | Платиновые монеты | Серебряные монеты | Сибирская монета |
| Группы металлов | Монетная группа (подгруппа меди) | Благородные металлы | Платиновая группа |
| См. также | Безмонетный период | Бумажные деньги | Денежная бумага | Кожаные рубли | Марки-деньги | Монетное дело | Нотгельд | Символы благородных металлов |
Химические элементы: названия, символы и произношение символов
В таблице содержатся русские и латинские названия химических элементов, символы химических элементов и произношение символов. Для правильного произношения названий и символов в русских названиях и произношениях проставлены ударения.
| Русское название элемента | Латинское название элемента | Символ элемента | Произношение символа |
|---|---|---|---|
| Азо́т | Nitrogenium | N | эн |
| Акти́ний | Actinium | Ac | акти́ний |
| Алюми́ний | Aluminium | Al | алюми́ний |
| Амери́ций | Americium | Am | амери́ций |
| Арго́н | Argon | Ar | арго́н |
| Аста́т | Astatum | At | аста́т |
| Ба́рий | Barium | Ba | ба́рий |
| Бери́ллий | Beryllium | Be | бери́ллий |
| Бе́рклий | Berkelium | Bk | бе́рклий |
| Бор | Borum | B | бор |
| Бо́рий | Bohrium | Bh | бо́рий |
| Бром | Bromium | Br | бром |
| Вана́дий | Vanadium | V | вана́дий |
| Ви́смут | Bismuthum | Bi | ви́смут |
| Водоро́д | Hydrogenium | H | аш |
| Вольфра́м | Wolframium | W | вольфра́м |
| Гадоли́ний | Gadolinium | Gd | гадоли́ний |
| Га́ллий | Gallium | Ga | га́ллий |
| Га́фний | Hafnium | Hf | га́фний |
| Ге́лий | Helium | He | ге́лий |
| Герма́ний | Germanium | Ge | герма́ний |
| Го́льмий | Holmium | Ho | го́льмий |
| Дармшта́дтий | Darmstadtium | Ds | дармшта́дтий |
| Диспро́зий | Dysprosium | Dy | диспро́зий |
| Ду́бний | Dubnium | Db | ду́бний |
| Евро́пий | Europium | Eu | евро́пий |
| Желе́зо | Ferrum | Fe | фе́ррум |
| Зо́лото | Aurum | Au | а́урум |
| И́ндий | Indium | In | и́ндий |
| Йод | Iodium | I | йод |
| Ири́дий | Iridium | Ir | ири́дий |
| Итте́рбий | Ytterbium | Yb | итте́рбий |
| И́ттрий | Yttrium | Y | и́ттрий |
| Ка́дмий | Cadmium | Cd | ка́дмий |
| Ка́лий | Kalium | K | ка́лий |
| Калифо́рний | Californium | Cf | калифо́рний |
| Ка́льций | Calcium | Ca | ка́льций |
| Кислоро́д | Oxygenium | O | о |
| Ко́бальт | Cobaltum | Co | ко́бальт |
| Коперни́ций | Copernicium | Cn | коперни́ций |
| Кре́мний | Silicium | Si | сили́циум |
| Крипто́н | Krypton | Kr | крипто́н |
| Ксено́н | Xenon | Xe | ксено́н |
| Кю́рий | Curium | Cm | кю́рий |
| Ланта́н | Lanthanum | La | ланта́н |
| Ливермо́рий | Livermorium | Lv | ливермо́рий |
| Ли́тий | Lithium | Li | ли́тий |
| Лоуре́нсий | Lawrencium | Lr | лоуре́нсий |
| Люте́ций | Lutetium | Lu | люте́ций |
| Ма́гний | Magnesium | Mg | ма́гний |
| Ма́рганец | Manganum | Mn | ма́рганец |
| Медь | Cuprum | Cu | ку́прум |
| Мейтне́рий | Meitnerium | Mt | мейтне́рий |
| Менделе́вий | Mendelevium | Md | менделе́вий |
| Молибде́н | Molybdaenum | Mo | молибде́н |
| Моско́вий | Moscovium | Mc | моско́вий |
| Мышья́к | Arsenicum | As | арсе́никум |
| На́трий | Natrium | Na | на́трий |
| Неоди́м | Neodymium | Nd | неоди́м |
| Нео́н | Neon | Ne | нео́н |
| Непту́ний | Neptunium | Np | непту́ний |
| Ни́кель | Niccolum | Ni | ни́кель |
| Нио́бий | Niobium | Nb | нио́бий |
| Нихо́ний | Nihonium | Nh | нихо́ний |
| Нобе́лий | Nobelium | No | нобе́лий |
| Оганесо́н | Oganesson | Og | оганесо́н |
| О́лово | Stannum | Sn | ста́ннум |
| О́смий | Osmium | Os | о́смий |
| Палла́дий | Palladium | Pd | палла́дий |
| Пла́тина | Platinum | Pt | пла́тина |
| Плуто́ний | Plutonium | Pu | плуто́ний |
| Поло́ний | Polonium | Po | поло́ний |
| Празеоди́м | Praseodymium | Pr | празеоди́м |
| Проме́тий | Promethium | Pm | проме́тий |
| Протакти́ний | Protactinium | Pa | протакти́ний |
| Ра́дий | Radium | Ra | ра́дий |
| Радо́н | Radon | Rn | радо́н |
| Резерфо́рдий | Rutherfordium | Rf | резерфо́рдий |
| Ре́ний | Rhenium | Re | ре́ний |
| Рентге́ний | Roentgenium | Rg | рентге́ний |
| Ро́дий | Rhodium | Rh | ро́дий |
| Ртуть | Hydrargyrum | Hg | гидра́ргирум |
| Руби́дий | Rubidium | Rb | руби́дий |
| Руте́ний | Ruthenium | Ru | руте́ний |
| Сама́рий | Samarium | Sm | сама́рий |
| Свине́ц | Plumbum | Pb | плю́мбум |
| Селе́н | Selenium | Se | селе́н |
| Се́ра | Sulfur | S | эс |
| Серебро́ | Argentum | Ag | арге́нтум |
| Сибо́ргий | Seaborgium | Sg | сибо́ргий |
| Ска́ндий | Scandium | Sc | ска́ндий |
| Стро́нций | Strontium | Sr | стро́нций |
| Сурьма́ | Stibium | Sb | сти́биум |
| Та́ллий | Thallium | Tl | та́ллий |
| Танта́л | Tantalum | Ta | танта́л |
| Теллу́р | Tellurium | Te | теллу́р |
| Теннесси́н | Tennessium | Ts | теннесси́н |
| Те́рбий | Terbium | Tb | те́рбий |
| Техне́ций | Technetium | Tc | техне́ций |
| Тита́н | Titanium | Ti | тита́н |
| То́рий | Thorium | Th | то́рий |
| Ту́лий | Thulium | Tm | ту́лий |
| Углеро́д | Carboneum | C | цэ |
| Ура́н | Uranium | U | ура́н |
| Фе́рмий | Fermium | Fm | фе́рмий |
| Флеро́вий | Flerovium | Fl | флеро́вий |
| Фо́сфор | Phosphorus | P | пэ |
| Фра́нций | Francium | Fr | фра́нций |
| Фтор | Fluorum | F | фтор |
| Ха́ссий | Hassium | Hs | га́ссий |
| Хлор | Chlorum | Cl | хлор |
| Хром | Chromium | Cr | хром |
| Це́зий | Caesium | Cs | це́зий |
| Це́рий | Cerium | Ce | це́рий |
| Цинк | Zincum | Zn | цинк |
| Цирко́ний | Zirconium | Zr | цирко́ний |
| Эйнште́йний | Einsteinium | Es | эйнште́йний |
| Э́рбий | Erbium | Er | э́рбий |
Этот металл любят все. Промышленники – за отличные полезные характеристики. Эстеты и любители шикарных авто – за красоту и практичность. Хром востребован военными и ядерщиками.
Содержание
- Что представляет собой
- История открытия
- Месторождения и добыча
- Физико-химические характеристики
- Нахождение в природе
- Технология получения
- Где используется
- Металлургия
- Другие отрасли промышленности
- Декор
- Цены
- Значение для человека
- Здоровье
- Питание
- Дозировка
- Предостережение
Что представляет собой
Хром – это металл, элемент таблицы Менделеева №24.
Международное обозначение и формула – Chromium, Cr.
Серебристо-голубоватое блестящее вещество – одно из самых твердых (5,5 по Моосу) и тугоплавких металлов, но хрупко. Относится к чёрным металлам.
Структура, свойства роднят его с железом, марганцем, титаном, никелем. Эти элементы объединены в одно семейство.
Уникальная особенность элемента – ярко-радужная окраска соединений: голубизна, фиолет, зелень до изумрудности, желтизна, оранж, пурпур. Они обусловили название, благодаря им легко отличить хром от других металлов.
По-древнегречески χρῶμα (хрома) – краска, цвет.
История открытия
Хром как самостоятельный элемент впервые в истории упомянут Михаилом Ломоносовым (1763 год). Великий русский ученый обнаружил его, исследуя золотую руду с Урала (Березовский рудник).
Это был минерал крокоит. Первооткрыватель нарек его красной свинцовой рудой.
Спустя тридцать лет его французский коллега Луи Николя Воклен выделил из «сибирского красного свинца» металл с примесью карбида.
Месторождения и добыча
Первое и второе место по запасам у ЮАР и Казахстана.
Россия третья. Ее месторождения – на Среднем Урале.
Хромовые руды есть также у Зимбабве, Турции, Армении, Индии, на Филиппинах, Мадагаскаре.
Добыча ведется традиционными способами – карьерным либо шахтным.
Физико-химические характеристики
Физические и химические свойства хрома типичны для металлов:
- Химически малоактивен. В обычных условиях не взаимодействует с водой, растворами щелочей. Реакция запускается при +600°С.
- Кислород создает на его поверхности защитную оксидную пленку.
- В соединениях проявляет три степени: +2, +3, +6. Самые устойчивые – трехвалентные.
Применение хрома затрудняют недостатки:
- Явное ухудшение характеристик примесями в составе.
- Необходимость дополнительной обработки сверхтвердого металла для получения пластичности.
Однако они компенсируются достоинствами металла: тугоплавкостью, твердостью (пятый среди металлов), стойкостью к коррозии.
| Свойства атома | |
|---|---|
| Название, символ, номер | Хром / Chromium (Cr), 24 |
| Атомная масса (молярная масса) |
51,9961(6) а. е. м. (г/моль) |
| Электронная конфигурация | [Ar] 3d5 4s1 |
| Радиус атома | 130 пм |
| Химические свойства | |
| Ковалентный радиус | 118 пм |
| Радиус иона | (+6e)52 (+3e)63 пм |
| Электроотрицательность | 1,66 (шкала Полинга) |
| Электродный потенциал | −0,74 |
| Степени окисления | 6, 3, 2, 0 |
| Энергия ионизации (первый электрон) |
652,4 (6,76) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | 7,19 г/см³ |
| Температура плавления | 2130 K (1856,9 °C) |
| Температура кипения | 2945 K (2671,9 °C) |
| Уд. теплота плавления | 21 кДж/моль |
| Уд. теплота испарения | 342 кДж/моль |
| Молярная теплоёмкость | 23,3 Дж/(K·моль) |
| Молярный объём | 7,23 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | кубическая объёмноцентрированая |
| Параметры решётки | 2,885 Å |
| Температура Дебая | 460 K |
| Прочие характеристики | |
| Теплопроводность | (300 K) 93,9 Вт/(м·К) |
| Номер CAS | 7440-47-3 |
Нахождение в природе
В природе отмечено два десятка хромовых минералов. Основные – хромит и крокоит.
Изверженные породы содержат разную концентрацию элемента (г/т):
- ультраосновные – 2000;
- базальты, другие основные – 200.
Каждая тонна земной коры содержит в среднем 83 г хрома.
Промышленный интерес представляет один класс – хромшпинелиды.
Металл содержат драгоценные камни – хромтурмалин, уваровит (хромовый гранат), другие.
Технология получения
Традиционное сырье для получения хрома – хромшпинелиды.
Главные способы получения металла – обогащение руды методом электролиза либо восстановлением.
Для повышения степени чистоты конечного продукта сырье сплавляют в электропечи с содой, добавляя кислород.
Производство металлического хрома почти абсолютной чистоты ведется методом электролиза концентрированных хромовых растворов либо восстановлением оксида хрома алюминием в вакуумных печах (при 1500°C).
Где используется
Металл используется по двум направлениям: как лигатура к другим металлам и как покрытие.
Металлургия
Отрасль, забирающая три четверти объемов металла. Хромом легируют стали для улучшения кондиций.
Получают продукт:
- нержавеющий;
- износостойкий;
- жаропрочный.
Такие достоинства сталей обусловили их применение как материала стволов артиллерии, корпусов субмарин, сейфов, металлорежущего, медицинского, химического инструментария. Из них выполнены двигатели космических кораблей, начинка плазмотронов.
Даже незначительное количество хрома в составе кратно улучшает механические свойства материала.
Самые известные хромсодержащие сплавы – с никелем (нихром) и железом (фехраль). Это прецизионные материалы с повышенным электрическим сопротивлением. Используются для работы при экстремальных температурах.
Другие отрасли промышленности
Продукция из металла и сплавов с ним выпускается для разных сегментов рынка:
- Кирпичи – корпус металлургических печей.
- Нагревательные элементы (сплав с никелем).
- Хирургический инструментарий (сплав с никелем, молибденом, кобальтом).
- Соединения хрома пригождаются при производстве спичек, обуви, одежды (знаменитая блестяще-прочная хромовая кожа), окраске текстиля, обработке мебельной древесины.
- Зеленую хромовую краску наносят на керамику перед покрытием глазурью и обжигом.
Краски из перетертых хромовых руд применяли еще иконописцы Древней Руси.
- Трехвалентный оксид металла – исходник при выращивании синтетических рубинов для лазеров.
- Зеленые огни салюта – заслуга хрома.
Хром закупают фармацевтические гиганты, производители биодобавок, препаратов для похудения.
Декор
Хромированное покрытие корпуса часов либо деталей авто – не только маркер статусности. Такая обработка защищает от износа, коррозии, механических повреждений.
Толщина покрытия металлом зависит от назначения изделия: от 2 мкм (декоративный ассортимент) до 0,1 мм (детали байков, велосипедов, авто).
Процесс покрытия хромом называется хромированием. Он технологически прост и недорог.
Цены
На мировых биржах реализуют хромовую руду (Cr – 42%) в основном из Китая.
На конец апреля 2021 года цена составляла $242 за тонну.
Значение для человека
Хром присутствует в организме человека изначально.
Здоровье
Он – участник ряда биологических процессов:
- Липидный, углеродный обмен.
- Выведение «плохого» холестерина
- Баланс сахара в крови.
- Укрепление костной ткани.
- Активация действия инсулина.
- Способность замещать йод.
- Стимуляция регенерации тканей.
Достаточное содержание хрома в организме критично важно для людей с лишним весом, диабетом, заболеваниями щитовидной железы, сердца, сосудов.
Питание
Хромом богаты продукты всех основных групп:
- Мясо – курятина, говядина (и печень);
- Рыба – скумбрия, тунец, сельдь.
- Крупы – манная, перловая.
- Овощи – помидоры, редис, зеленый лук.
Металлом насыщены сыры, бобовые, кукурузное масло, фрукты, хлеб из муки крупного помола, пивные дрожжи.
Дозировка
Ежесуточная потребность в хроме (мкг):
- Дети – 12-34 (в зависимости от возраста).
- Женщины – 55-68.
- Мужчины – 59-79.
При беременности у женщин, активном образе жизни, физических нагрузках у мужчин потребность удваивается.
Предостережение
Опасность представляет чистый металл. Особенно попадание его пыли в дыхательную систему.
Это провоцирует онкологию, раздражение кожи.
По стандартам РФ, предельно допустимая концентрация хрома – 1,5 мкг на кубометр.
Люди, работающие на металлургических предприятиях, пользуются респираторами, другими средствами защиты.
Хромовая «пудра» самовоспламеняется на воздухе.
Химический элемент с атомным номером 24
Химический элемент с атомным номером 24
 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Хром | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Внешний вид | серебристый металлик | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Стандартный атомный вес A r, std (Cr) | 51,9961 (6) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Хром в периодической таблица | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Атомный номер (Z) | 24 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Группа | группа 6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Период | период 4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Блок | d-блок | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Категория элемента | Переходный металл | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Электронная конфигурация | [Ar ] 3d 4s | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Электронов на оболочку | 2, 8, 13, 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Физические свойства | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Фаза при STP | твердое тело | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Точка плавления | 2180 K (1907 ° C, 3465 ° F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Температура кипения | 2944 K (2671 ° C, 4840 ° F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Плотность (около rt ) | 7,19 г / см | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| в жидком состоянии ( при т.пл. ) | 6,3 г / см | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Теплота плавления | 21,0 кДж / моль | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Теплота испарения | 347 кДж / моль | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Молярная теплоемкость | 23,35 Дж / (моль · К) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Давление пара
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Атомные свойства | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Степени окисления | −4, −2, −1, 0, +1, +2, +3, +4, +5, +6 (в зависимости от степени окисления, кислотный, основной или амфотерный оксид) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Электроотрицательность | Шкала Полинга: 1,66 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ионизация ru эргии |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Атомный радиус | эмпирический: 128 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ковалентный радиус | 139 ± 5 мкм | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Другие свойства | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Естественное происхождение | изначальное | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Кристаллическая структура | объемно-центрированная кубическая (bcc)  |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Скорость звука тонкий стержень | 5940 м / с (при 20 ° C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Тепловое расширение | 4,9 мкм / (м · К) (при 25 ° C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Теплопроводность | 93,9 Вт / (м · К) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Удельное электрическое сопротивление | 125 нОм · м (при 20 ° C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Магнитное упорядочение | антиферромагнетик (скорее : SDW ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Магнитная восприимчивость | + 280,0 · 10 см / моль (273 K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Модуль Юнга | 279 ГПа | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Модуль сдвига | 115 ГПа | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Объемный модуль | 160 ГПа | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Коэффициент Пуассона | 0,21 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Твердость по Моосу | 8,5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Твердость по Виккерсу | 1060 МПа | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Твердость по Бринеллю | 687–6500 МПа | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Номер CAS | 7440-47-3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| История | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Открытие и первая изоляция | Луи Николя Воклен ( 1794, 1797) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Основные изотопы хрома | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ссылки |
Хром — это химический элемент с символом Crи атомным номером 24. Это первый элемент в группе 6. Это стально-серый, блестящий, твердый и хрупкий переходный металл. Хром является основной добавкой в нержавеющей стали, которая придает ей антикоррозионные свойства. Хром также высоко ценится как металл, который может быть хорошо отполирован, при этом сопротивляясь потускнению. Полированный хром отражает почти 70% видимого спектра, при этом отражается почти 90% инфракрасного света. Название элемента происходит от греческого слова χρῶμα, chrōma, что означает цвет, потому что многие соединения хрома сильно окрашены.
Феррохром коммерчески производится из хромита с помощью силикотермической или алюмотермической реакции и металлического хрома путем обжига и процессы выщелачивания с последующим восстановлением углеродом, а затем алюминием. Металлический хром имеет высокую ценность благодаря своей высокой коррозионной стойкости и твердости. Важным достижением в производстве стали стало открытие того, что сталь можно сделать очень устойчивой к коррозии и обесцвечиванию путем добавления металлического хрома для образования нержавеющей стали. Нержавеющая сталь и хромирование (гальваническое покрытие хромом) вместе составляют 85% коммерческого использования.
В США трехвалентный хром (Cr (III)) ион считается основным питательным веществом у людей для инсулина., сахар и липид метаболизм. Однако в 2014 году Европейское управление по безопасности пищевых продуктов, действующее от имени Европейского Союза, пришло к выводу, что нет достаточных доказательств того, что хром может быть признан незаменимым.
Хотя металлический хром и Cr ( III) ионы не считаются токсичными, шестивалентный хром, Cr (VI) одновременно токсичны и канцерогены. Заброшенные предприятия по производству хрома часто требуют очистки окружающей среды.
Содержание
- 1 Физические свойства
- 1,1 Атомарно
- 1,2 Объем
- 1.2.1 Пассивация
- 1,3 Изотопы
- 2 Химический состав и соединения
- 2.1 Химические свойства
- 2.2 Обычные степени окисления
- 2.2.1 Хром (III)
- 2.2.2 Хром (VI)
- 2.3 Другие степени окисления
- 3 Возникновение
- 4 История
- 4.1 Раннее применение
- 5 Производство
- 6 Применение
- 6.1 Металлургия
- 6.2 Пигмент
- 6.3 Другое применение
- 6.4 Использование соединений
- 7 Биологическая роль
- 7.1 Диетическое питание рекомендации
- 7.2 Источники пищи
- 7.3 Добавки
- 7.3.1 Одобренные и отклоненные заявления о пользе для здоровья
- 7.4 Пресноводная рыба
- 8 Меры предосторожности
- 8.1 Токсичность хрома (VI)
- 8.2 Окружающая среда проблемы
- 9 См. также
- 10 Пояснительные примечания
- 11 Цитаты
- 12 Общая библиография
- 13 Внешние ссылки
Физические свойства
Атомарный
Хром четвертый переходный металл, обнаруженный на пер. йодная таблица и имеет электронную конфигурацию [Ar ] 3d 4s. Это также первый элемент периодической таблицы, электронная конфигурация которого в основном состоянии нарушает принцип Ауфбау. Это снова происходит позже в периодической таблице с другими элементами и их электронными конфигурациями, такими как медь, ниобий и молибден. Это происходит потому, что электроны на одной орбитали отталкиваются друг от друга из-за одинаковых зарядов. В предыдущих элементах энергетические затраты на продвижение электрона на следующий более высокий энергетический уровень слишком велики, чтобы компенсировать высвобождение за счет уменьшения межэлектронного отталкивания. Однако в 3d переходных металлах энергетическая щель между 3d и следующей более высокой подоболочкой 4s очень мала, и поскольку 3d подоболочка более компактна, чем подоболочка 4s, межэлектронное отталкивание меньше между 4s электронами, чем между 3d электронами. электроны. Это снижает энергетические затраты на продвижение и увеличивает выделяемую при этом энергию, так что продвижение становится энергетически возможным, и один или даже два электрона всегда продвигаются в подоболочку 4s. (Подобные акции происходят для каждого атома переходного металла, кроме одного, палладий.)
Хром является первым элементом в серии 3d, где 3d-электроны начинают опускаться в инертное ядро ; таким образом, они вносят меньший вклад с металлической связью, и, следовательно, точки плавления и кипения, а также энтальпия распыления хрома ниже, чем у предыдущего элемента ванадия. Хром (VI) является сильным окислителем в отличие от оксидов молибдена (VI) и вольфрама (VI).
Bulk

Хром чрезвычайно твердый и является третьим по твердости элементом после углерода (алмаза ) и бора. Твердость по Моосу составляет 8,5, что означает, что он может поцарапать образцы кварца и топаза, но может быть поцарапан корундом. Хром высокая устойчивость к потускнению, что делает его полезным в качестве металла, сохраняющего свой внешний вид. самый стойкий слой из корродирующего, в отличие от других металлов, таких как медь, магний и алюминий.
. Хром имеет температуру плавления 1907 ° C (3465 ° F), что относительно мало по сравнению с большинством переходных металлов. Тем не менее, он по-прежнему имеет вторую по величине температуру плавления из всех элементов периода 4, уступая место ванадию на 3 ° C (5 ° F) при 1910 ° C (3470 ° C). F). точка кипения 2671 ° C (4840 ° F), однако, сравнительно ниже, имея третью самую низкую точку кипения из периода 4 переходных металлов только за марганцем и цинком. удельное электрическое сопротивление хрома при 20 ° C составляет 125 наноом — метров.
Хром имеет высокое зеркальное отражение по сравнению с другими переходными металлами.. В инфракрасном, при 425 мкм, хром имеет максимальный коэффициент отражения около 72%, снижающийся до минимального 62% при 750 мкм, а затем снова повышающийся до 90% при 4000 мкм. Когда хром используется в сплавах нержавеющей стали и полированной, зеркальное отражение уменьшается с включением дополнительных металлов, но все же остается высоким по сравнению с другими сплавами. От полированной нержавеющей стали отражается от 40% до 60% видимого спектра. Объяснение того, почему хром демонстрирует такое большое количество отраженных фотонных волн в целом, особенно 90% в инфракрасном диапазоне, можно отнести к магнитным свойствам хрома. Хром обладает уникальными магнитными свойствами в том смысле, что хром является единственным твердым элементом, который демонстрирует антиферромагнитное упорядочение при комнатной температуре (и ниже). При температуре выше 38 ° C его магнитное упорядочение меняется на парамагнитное. Антиферромагнитные свойства, которые заставляют атомы хрома временно ионизировать и связываться с собой, присутствуют, потому что магнитные свойства объемно-центрической кубики непропорциональны периодичности решетки. Это связано с тем, что магнитные моменты в углах куба и в центрах куба не равны, но все же антипараллельны. Отсюда частотно-зависимая относительная диэлектрическая проницаемость хрома, полученная из уравнений Максвелла в сочетании с антиферромагнитностью хрома, оставляет хром с высоким коэффициентом отражения инфракрасного и видимого света..
Пассивация
Металлический хром, оставшийся на воздухе, пассивирован, т.е. образует тонкий защитный поверхностный слой оксида. Этот слой имеет структуру шпинели, толщиной всего несколько атомных слоев. Он очень плотный и препятствует диффузии кислорода в нижележащий металл. Напротив, железо образует более пористый оксид, через который может мигрировать кислород, вызывая продолжающуюся ржавчину. Пассивацию можно усилить коротким контактом с окисляющими кислотами, такими как азотная кислота. Пассивированный хром устойчив к кислотам. Пассивацию можно удалить сильным восстановителем, разрушающим защитный оксидный слой на металле. Обработанный таким образом металлический хром легко растворяется в слабых кислотах.
Хром, в отличие от таких металлов, как железо и никель, не страдает водородной хрупкостью. Однако он действительно страдает азотом охрупчиванием, реагируя с азотом из воздуха и образуя хрупкие нитриды при высоких температурах, необходимых для обработки металлических деталей.
Изотопы
Встречающиеся в природе хром состоит из трех стабильных изотопов ; Cr, Cr и Cr, причем Cr является наиболее распространенным (83,789% естественное содержание ). Было охарактеризовано 19 радиоизотопов, наиболее стабильным из которых является Cr с периодом полураспада (более) 1,8 × 10 лет и Cr с периодом полураспада 27,7 дня. Все оставшиеся радиоактивные изотопы имеют период полураспада менее 24 часов, а у большинства менее 1 минуты. Хром также имеет два метастабильных ядерных изомера.
Cr является радиогенным продуктом распада Mn (период полураспада = 3,74 миллиона лет). Изотопы хрома обычно находятся в одном месте (и смешиваются) с изотопами марганца. Это обстоятельство полезно в изотопной геологии. Отношения изотопов марганца и хрома подтверждают данные из Al и Pd относительно ранней истории Солнечной системы. Вариации соотношений Cr / Cr и Mn / Cr для нескольких метеоритов указывают на исходное соотношение Mn / Mn, которое предполагает, что изотопный состав Mn-Cr должен быть результатом распада Mn на месте в дифференцированных планетных телах. Следовательно, Cr является дополнительным свидетельством нуклеосинтетических процессов непосредственно перед слиянием Солнечной системы.
Изотопы хрома находятся в диапазоне атомной массы от 43 u (Cr) до 67 мкм (Cr). Первичная мода распада перед наиболее распространенным стабильным изотопом Cr — это захват электронов, а первичная мода после — бета-распад. Cr был установлен в качестве заместителя. для концентрации кислорода в атмосфере.
Химия и соединения
Химические свойства

Хром является членом группы 6 переходных металлов . Состояния +3 и +6 чаще всего встречаются в соединениях хрома; заряды +1, +4 и +5 для хрома редки, но, тем не менее, иногда существуют.
Обычные степени окисления
| Степени окисления. | |
|---|---|
| −4 (d) | Na4[ Cr (CO) 4] |
| −2 (d) | Na. 2[Cr (CO). 5] |
| −1 (d) | Na. 2[Cr. 2(CO). 10] |
| 0 (d) | Cr (C. 6H. 6). 2 |
| +1 (d) | K. 3[Cr (CN). 5NO] |
| +2 (d) | CrCl. 2 |
| +3 (d) | CrCl. 3 |
| +4 (d) | K. 2CrF. 6 |
| +5 (d) | K. 3CrO. 8 |
| +6 (d) | K. 2CrO. 4 |
Хром (III)

Известно большое количество соединений хрома (III), таких как нитрат хрома (III), ацетат хрома (III) и хром (III). оксид. Хром (III) может быть получен растворением элементарного хрома в таких кислотах, как соляная кислота или серная кислота, но он также может быть образован путем восстановления хрома (VI) на цитохром c7. Ион Cr. имеет такой же радиус (63 pm ), что и Al. (радиус 50 мкм), и они могут заменять друг друга в некоторых соединениях., например, в хромовых квасцах и а lum.
Хром (III) имеет тенденцию образовывать октаэдрические комплексы. Коммерчески доступный гидрат хлорида хрома (III) представляет собой темно-зеленый комплекс [CrCl 2(H2O)4] Cl. Близко родственными соединениями являются бледно-зеленый [CrCl (H 2O)5] Cl 2 и фиолетовый [Cr (H 2O)6] Cl 3). Если безводный зеленый хлорид хрома (III) растворяется в воде, зеленый раствор через некоторое время становится фиолетовым, так как хлорид во внутренней координационной сфере заменяется водой. Такой тип реакции наблюдается также с растворами хромовые квасцы и другие водорастворимые соли хрома (III). тетраэдрическая координация хрома (III) описана для Cr-центрированного Анион Кеггина [α-CrW 12O40].
гидроксид хрома (III) (Cr (OH) 3) является амфотерным, растворяется в кислых растворах с образованием [Cr (H 2O)6], и в щелочных растворах с образованием [Cr (OH). 6].. Он дегидратируется путем нагревания с образованием зеленого оксида хрома (III) (Cr 2O3), a стабильный оксид с кристаллической структурой, идентичной кристаллической структуре корунда.
Хром (VI)
Соединения хрома (VI) являются окислителями при низком или нейтральном pH. Хромат ани. анионы (CrO. 4) и дихромат (Cr 2O7) анионы являются основными ионами в этой степени окисления. Они существуют при равновесии, определяемом pH:
- 2 [CrO 4 ] + 2 H ⇌ [Cr 2O7] + H 2O
Оксигалогениды хрома (VI) также известны и включают хромилфторид (CrO 2F2) и хромилхлорид (CrO. 2Cl. 2). Однако, несмотря на несколько ошибочных заявлений, гексафторид хрома (а также все высшие гексагалогениды) остается неизвестным по состоянию на 2020 год.

Хромат натрия промышленно производится окислительный обжиг хромитовой руды с карбонатом натрия. Изменение равновесия видно по изменению цвета от желтого (хромат) до оранжевого (дихромат), например, когда кислота добавляется к нейтральному раствору хромата калия. При еще более низких значениях pH возможна дальнейшая конденсация до более сложных оксианионов хрома.
Хроматный и дихроматный анионы являются сильными окисляющими реагентами при низком pH:
- Cr. 2O. 7+ 14 H. 3O. + 6 e → 2 Cr. + 21 H. 2O (ε 0 = 1,33 В)
Однако они обладают умеренной окислительностью при высоком pH:
- CrO. 4+ 4 H. 2O + 3 e → Cr (OH). 3+ 5 OH. (ε0= -0,13 В)

Соединения хрома (VI) в растворе можно обнаружить, добавив кислый раствор пероксида водорода. Образуется нестабильный темно-синий пероксид хрома (VI) (CrO 5), который может быть стабилизирован в виде эфирного аддукта CrO. 5· OR. 2.
Хромовая кислота имеет гипотетическую формулу H. 2CrO. 4. Это нечетко описанное химическое вещество, несмотря на то, что известны многие четко определенные хроматы и дихроматы. Темно-красный хром (VI) оксид CrO. 3, кислота ангидрид хромовой кислоты, продается в промышленных масштабах как «хромовая кислота». Он может быть получен путем смешивания серной кислоты с дихроматом и является сильным окислителем. 521>
Другой Степени окисления
Соединения хрома (V) довольно редки; степень окисления +5 реализуется только в немногих соединениях, но является промежуточным звеном во многих реакциях, включающих окисление хроматом. Единственным бинарным соединением является летучий фторид хрома (V) (CrF 5). Это красное твердое вещество имеет температуру плавления 30 ° C и точку кипения 117 ° C. Его можно получить обработкой металлического хрома фтором при 400 ° C и давлении 200 бар. Пероксохромат (V) — еще один пример степени окисления +5. Пероксохромат калия (K3[Cr (O 2)4]) получают путем реакции хромата калия с пероксидом водорода при низких температурах. Это красно-коричневое соединение стабильно при комнатной температуре, но спонтанно разлагается при 150–170 ° C.
Соединения хрома (IV) встречаются немного чаще, чем соединения хрома (V). Тетрагалогениды CrF 4, CrCl 4 и CrBr 4 могут быть получены обработкой тригалогенидов (CrX. 3) соответствующим галогеном при повышенных температурах. Такие соединения подвержены реакциям диспропорционирования и нестабильны в воде.
Известно много соединений хрома (II), например водостойкий хлорид хрома (II) CrCl. 2, который можно получить путем восстановления хлорида хрома (III) цинком. Полученный ярко-синий раствор, созданный из растворения хлорида хрома (II), стабилен только при нейтральном pH. Некоторые другие известные соединения хрома (II) включают оксид хрома (II) CrO и сульфат хрома (II) CrSO. 4. Также известны многие хромовые карбоксилаты, наиболее известным из которых является красный ацетат хрома (II) (Cr 2(O2CCH 3)4), который имеет четверную связь.
Большинство соединения хрома (I) получают исключительно окислением богатых электронами октаэдрических комплексов хрома (0). Другие комплексы хрома (I) содержат циклопентадиенильные лиганды. Как подтверждено методом дифракции рентгеновских лучей, также была описана пятичастная связь Cr-Cr (длина 183,51 (4) мкм). Чрезвычайно объемные монодентатные лиганды стабилизируют это соединение, защищая пятерную связь от дальнейших реакций.

Большинство соединений хрома (0) являются производными соединений гексакарбонил хрома или бис (бензол) хрома.
Возникновение


Хром является 21-м по содержанию элементом в земной коре со средней концентрацией 100 ppm. Соединения хрома встречаются в окружающая среда от эрозии хромсодержащих пород и может быть перераспределена в результате извержений вулканов. Типичные фоновыес помощью хрома в окружающей среде: атмосфера <10 ng/m; soil <500 mg/kg; vegetation <0.5 mg/kg; freshwater <10 μg/L; seawater <1 μg/L; sediment <80 mg/kg. Chromium is mined as хромит (FeCr 2O4) руда.
Около двух пятых хромитовых руд и концентратов в мире добывается в ЮАР, около трети — в Казахстане, а Индия, Россия и Турция также являются крупными производителями. Неиспользованные месторождения хромита многочисленны, но географически сконцентрированы в Казахстане и на юге A фрика. Хотя и редко, но присутствуют отложения самородного хрома. Трубка «Удачная» в России производит образцы самородного металла. Этот рудник представляет собой кимберлитовую трубку , богатую алмазами, и восстанавливающую среду помогла добыть как элементарный хром, так и алмазы.
Взаимосвязь между Cr (III) и Cr (VI) сильно зависит от pH и окислительных свойств места. В большинстве случаев Cr (III) является доминирующим видом, но в некоторых районах грунтовые воды могут содержать до 39 мкг / л общего хрома, из 30 мкг / л составляет Cr (VI).
История
Ранние применения
Минералы хрома в качестве пигментов привлекли внимание Запада в восемнадцатом веке. 26 июля 1761 года Иоганн Готтлоб Леманн нашел оранжево-красный минерал в Березовских рудниках в Уральских горах, который он назвал сибирским красным свинцом. Хотя он был ошибочно идентифицирован как соединение свинца с компонентами селен и железо, на самом деле минерал был крокоитом с формулой PbCrO 4. В 1770 году Питер Саймон Паллас показал то же место, что и Леманн, и обнаружил красный свинец, который, как было обнаружено, обладает полезными свойствами в качестве пигмента в красках. После Паллада использование сибирского красного свинца в качестве пигмента краски начало быстро развиваться во всем мире. Крокоит был создан хрома в пигментах до открытия хромита много лет спустя.

В 1794 г., Луи Николя Воклен получил образцы крокоитовой руды. Он произвел триоксид хрома (CrO 3 путем смешивания крокоита с соляной кислотой. В 1797 году Воклен обнаружил, что он может изолировать металлический хром, нагревая оксид в угольной печи, за что ему приписывают настоящее открытие этого элемента. Vauquelin также смог построить следы хрома в драгоценных камнях драгоценных камней, таких как рубин и изумруд.
. В девятнадцатом веке хром в основном использовался не только в качестве компонента. красок, но также в дубильных солях. Некоторое время использования таких дубильных материалов был крокоит, найденный в России. В 1827 году недалеко от Балтимора, США было обнаружено более крупное месторождение хромита, которое быстро удовлетворило спрос на дубильное месторождение более адекватно, чем крокоит, который использовался ранее. Крупнейшие месторождения нефти и газа в Турции до 1848 года. С развития металлургии и промышленности в западном мире потребность в хроме увеличилась.
Хром также известен своим отражающим металлическим блеском при полировке. Используется как в качестве защитного и декоративного покрытия автомобильных деталей, сантехники, деталей мебели и многих других предметов, обычно наносится методом гальваникой. Хром использовался для гальваники еще в 1848 году, но это использование стало широко распространенным только с помощью усовершенствованного процесса в 1924 году.
Производство




Крупнейшие производители хромовой руды в В 2013 г. на долю ЮАР (48%), Казахстана (13%), Турции (11%) и Индии (10%) приходилось несколько других стран, на долю которых приходилось около 18% мирового производства.
Двумя продуктами переработки хромовой руды являются феррохром и металлический хром. Для этих продуктов процесс плавки руды значительно отличается. Для производства феррохрома хромитовая руда (FeCr 2O4) восстанавливается в больших масштабах в дуговой электропечи или в небольших плавильных печах с использованием либо алюминия, либо кремния <592.>в алюмотермической реакции.

Для производства чистого хрома железо быть отделено от хрома в двухстадийном процессе обжига и выщелачивания. Хромитовая руда нагревается со смесью карбоната кальция и карбоната натрия в присутствии воздуха. Хром окисляется до шестивалентной формы, а железо образует стабильный Fe 2O3. Последующее выщелачивание при более высоких повышенных температурах растворяет хроматы и оставляет нерастворимый оксид железа. Хромат превращается серной кислотой в дихромат.
- 4 FeCr 2O4+ 8 Na 2CO3+ 7 O 2 → 8 Na 2 CrO 4 + 2 Fe 2O3+ 8 CO 2
- 2 Na 2 CrO 4 + H 2SO4→ Na 2Cr2O7+ Na 2SO4+ H 2O
Дихромат превращается в оксид хрома (III) восстановлением углеродом, а затем восстанавливается в алюмотермической реакции до хрома.
- Na2Cr2O7+ 2 C → Cr 2O3+ Na 2CO3+ CO
- Cr2O3+ 2 Al → Al 2O3+ 2 Cr
Области применения
На создание металлических сплавов приходится 85% использование доступного хрома. Остальная часть хрома используется в химический, огнеупорный и литейный Промышленный.
Металлургия

Упрочняющий эффект образования стабильных карбидов металлов на границах зерен и значительное повышение коррозионной стойкости сделал важным легирующим материалом для стали. быстрорежущие инструментальные стали содержат от 3 до 5% хрома. Нержавеющая сталь, первичный коррозионно-стойкий металлический сплав, образует, когда хром вводится в железо в достаточных элементах, обычно когда хрома превышает 11%. Для образования нержавеющей стали в жидкий чугун феррохром. Кроме того, сплавы на основе никеля увеличивают прочность из-за образования дискретных стабильных частиц карбида металла на границах зерен. Например, Инконель 718 содержит 18,6% хрома. Из-за превосходных высокотемпературных свойств этих никелевых суперсплавов они используются в реактивных двигателях и газовых турбинах вместо обычных конструкционных материалов.

Относительно высокая твердость и коррозионная стойкость нелегированного хрома делают хром надежным металлом для покрытия поверхностей; Это по-прежнему самый популярный металл для покрытия листов с его долговечностью выше средней по сравнению с другими металлами покрытия. Слой хрома наносится на обработанные металлические поверхности с помощью гальванических методов. Есть два метода нанесения: тонкий и толстый. Тонкое нанесение включает в себя слой хрома толщиной 1 мкм, нанесенный посредством хромирования, и используется для декоративных поверхностей. Если необходимы износостойкие поверхности, наносятся более толстые слои хрома. В обоих методах использованы растворы кислого хромата или дихромата. Чтобы предотвратить энергозатратное изменение степени окисления, в настоящее время реализовано использование сульфата хрома (III); для применений хрома используется ранее установленный процесс.
В процессе конверсионного хроматного покрытия сильные окислительные свойства хроматов используются для нанесения защитного оксидного слоя на металлы, такие как алюминий, цинк и кадмий. Эта пассивация и свойства самовосстановления за счет хромата, хранящегося в хроматном конверсионном покрытии, которое может мигрировать в локальные дефекты, являющиеся преимуществами этого метода покрытия. Из-за экологических и санитарных норм, выдвигаются альтернативные методы нанесения покрытия.
Хромовая кислота анодирование (или анодирование типа I) алюминия — это еще один электрохимический процесс, который не приводит к осаждение хрома, но в качестве электролита в растворе используется хромовая кислота. Во время анодирования на алюминии образует оксидный слой. Использование хромовой кислоты обычно вместо используемой серной кислоты приводит к небольшому различию этих оксидных слоев. Высокая токсичность соединений Cr (VI), используемых в устоявшемся процессе гальваники хрома, а также усиление требований по безопасности и охране окружающей среды требуют поиска заменителей хрома или, по крайней мере, перехода на менее токсичные соединения хрома (III).
Пигмент
Минерал крокоит (который также является хроматом свинца PbCrO 4) был использован в качестве желтого пигмента вскоре после его открытия.. После того, как стал доступным метод синтеза, начиная с более распространенного хромита, хромовый желтый вместе с кадмиевым желтым стал одним из наиболее часто используемых желтых пигментов. Пигмент не фоторазлагается, но имеет тенденцию темнеть из-за образования оксида хрома (III). Он имеет яркий цвет и использовался для школьных автобусов в США и для почтовой службы (например, Deutsche Post ) в Европе. Использование желтого хрома с тех пор сократилось из-за проблем, связанных с окружающей средой и безопасностью, и его заменили органические пигменты или другие альтернативы, не содержащие свинца и хрома. Другими пигментами на основе хрома являются, например, глубокий оттенок красного пигмента хромовый красный, который представляет собой просто хромат свинца с гидроксидом свинца (II) (PbCrO 4 · Pb (OH) 2). Очень важным хроматным пигментом, который широко использовался в составах металлических грунтовок, был хромат цинка, который теперь заменен фосфатом цинка. Промывочная грунтовка была разработана для замены опасной практики предварительной обработки алюминиевых корпусов самолетов раствором фосфорной кислоты. Для этого использовали тетроксихромат цинка, диспергированный в растворе поливинилбутираля . Непосредственно перед нанесением добавляли 8% раствор фосфорной кислоты в растворителе. Было обнаружено, что важным ингредиентом является легкоокисляемый спирт. Наносили тонкий слой примерно 10–15 мкм, который при отверждении менял цвет с желтого на темно-зеленый. Остается вопрос о правильном механизме. Зеленый хром представляет собой смесь берлинской синей и желтого хрома, а зеленый оксид хрома — это оксид хрома (III).
Оксиды хрома также используются в качестве зеленого пигмента. в стекольной промышленности, а также в качестве глазури для керамики. Зеленый оксид хрома чрезвычайно светостойкий и поэтому используется в плакирующих покрытиях. Он также является основным ингредиентом красок, отражающих инфракрасное излучение, используемых вооруженными силами для окраски транспортных средств и придания им такой же отражающей способности инфракрасного излучения, как и зеленые листья.
Другое применение

Ионы хрома (III), присутствующие в кристаллах корунда (оксид алюминия), вызывают их красный цвет; когда корунд появляется как таковой, он известен как рубин. Если в корунде отсутствуют ионы хрома (III), он известен как сапфир. Искусственный рубин красного цвета может быть также получен путем добавления хрома (III) в кристаллы искусственного корунда, что делает хром необходимым для производства синтетических рубинов. Такой синтетический кристалл рубина стал основой для первого лазера, произведенного в 1960 году, который основывался на стимулированном излучении света от атомов хрома в таком кристалле. Рубиновый лазер излучает лазер с длиной волны 694,3 нм и имеет темно-красный цвет.
Из-за своей токсичности соли хрома (VI) используются для консервации древесины. Например, хромированный арсенат меди (CCA) используется в обработке древесины для защиты древесины от грибков гниения, насекомых, атакующих древесину, включая термитов, и морских бурильных молотков. Составы содержат хром на основе оксида CrO 3 от 35,3% до 65,5%. В США в 1996 году было использовано 65 300 метрических тонн раствора ХАК.
Соли хрома (III), особенно квасцы хрома и сульфат хрома (III), используются при дублении кожи. Хром (III) стабилизирует кожу, сшивая волокна коллагена . Кожа, дубленная хромом, может содержать от 4 до 5% хрома, который прочно связан с белками. Хотя форма хрома, используемая для дубления, не является токсичной шестивалентной разновидностью, сохраняется интерес к управлению хромом в дубильной промышленности. Восстановление и повторное использование, прямая / непрямая переработка и дубление «без хрома» или «без хрома» практикуются для более эффективного управления использованием хрома.
Высокая термостойкость и высокая температура плавления делают хромитом и оксид хрома (III) — материал для высоких температур для применения в качестве огнеупоров, таких как доменные печи, цементные формы печи, для обжига кирпичей и в качестве литейных песков для литья металлов. В этих применениях огнеупорные материалы изготавливаются из смесей хромита и магнезита. Использование сокращается из-за экологических норм из-за возможности образования хрома (VI).
Некоторые соединения хрома используются в качестве катализаторов для переработки углеводородов. Например, катализатор Филлипса, приготовленный из оксидов хрома, используется для производства примерно половины полиэтилена в мире. Смешанные оксиды Fe-Cr используются в качестве высокотемпературных катализаторов для реакции конверсии водяного газа. Хромит меди является полезным катализатором гидрирования.
Использование соединений
- Оксид хрома (IV) (CrO 2) представляет собой магнитное соединение. Его идеальная форма , анизотропия, которая дает высокую коэрцитивную силу и остаточную намагниченность, делает его соединением, превосходящим γ-Fe 2O3. Оксид хрома (IV) используется для производства магнитной ленты, используемой в высококачественной системе аудиокассет.
- Оксид хрома (III) (Cr 2O3) представляет собой полироль для металлов, известный как зеленые румяна.
- Хромовая кислота — мощный двигательлитель и полезное соединение для очистки лабораторной посуды от любых электрических соединений. Его получают растворением дихромата калия в концентрированной серной кислоте, которую используют для промывки аппарата. Дихромат натрия иногда используется из-за его более высокой растворимости (50 г / л против 200 г / л соответственно). В настоящее время использование чистящих растворов на основе дихромата прекращено из-за их высокой токсичности и экологических проблем. Современные очищающие растворы высокоэффективны и не содержат хрома.
- Дихромат калия — химический реагент, использованный в качестве титрующего агента.
- Хроматы добавляются в буровые растворы для предотвращения коррозии стали во влажных условиях.
- Квасцы хрома представьте собой сульфат калия хрома (III) и используются в качестве протравы (то есть фиксирующего агента) для красителей в ткани и в дублении.
Биологическая роль
Биологически полезные эффекты хрома (III) продолжают обсуждаться. Некоторые эксперты считают, что они отражают фармакологические, не пищевые реакции, в то время как другие предполагают, что они являются побочными эффектами токсичного металла. Обсуждение омрачено элементами негатива и становится иногда резким. Хром принятый Национальный институт здравоохранения США в качестве микроэлемента из-за его роли в действии инсулина, гормона, важного для метаболизма и хранения углеводов, жиров и белков. Однако точный механизм его действия в организме не был определен, поэтому вопрос, необходим ли хром для здоровых людей.
Напротив, шестивалентный хром (Cr (VI) или Cr) очень токсичен и мутаген при вдыхании. Попадание хрома (VI) связано с опухолями желудка, а также может вызвать аллергический контактный дерматит (ACD).
Дефицит хрома, связанный с недостатком Cr (III). в организме или, возможно, какой-то его комплекс, такой как фактор толерантности к глюкозе, является спорным. Некоторые исследования предполагают, что биологически активная форма хрома (III) транспортируется в организм через олигопептид, называемый низкомолекулярным хромсвязывающим веществом (LMWCr), может играть роль в передаче сигналов инсулина.
Содержание хрома в обычных пищевых продуктах, как правило, низкое (1-13 микрограммов на порцию). Содержание хрома в продуктах питания широко распространяется из-за различий в минеральном содержании почвы, вегетационного периода, растения сорт и загрязнения во время обработки. Кроме того, хром (и никель ) проникает в пищу, приготовленную из нержавеющей стали, с наибольшим эффектом, когда посуда новая. Кислые продукты, такие как томатный соус, которые готовятся в течение многих часов, также усугубляют этот эффект.
Рекомендации по питанию
Существуют разногласия по поводу статуса хрома как важного питательного вещества. Правительственные ведомства Австралии, Новой Зеландии, Индии, Японии и США считают хром незаменимым, в то время как Европейское управление по безопасности пищевых продуктов (EFSA), представляющее Европейский Союз, не считает.
151>Национальная медицинская академия (NAM) обновила расчетные средние потребности (EAR) и рекомендуемые диетические нормы (RDA) для хрома в 2001 году. недостаточно информации для установки EAR и RDA, поэтому его потребности потребности как оценки для Адекватное потребление (AI). В настоящее время AI хрома для женщин в возрасте от 14 до 50 составляет 25 мкг / день, а AI для женщин в возрасте 50 лет и старше составляет 20 мкг / день. ИИ для беременных женщин составляют 30 мкг / день, а для кормящих женщин установленные ИИ составляют 45 мкг / день. ИИ для мужчин в возрасте от 14 до 50 составляет 35 мкг / день, а ИИ для мужчин в возрасте от 50 лет и старше — 30 мкг / день. Для детей в возрасте от 1 до 13 лет AI увеличивается с возрастом с 0,2 мкг / день до 25 мкг / день. Что касается безопасности, NAM устанавливает допустимые верхние уровни потребления (UL) для витаминов и минералов, если доказательств достаточно. В случае хрома информации пока недостаточно, и поэтому UL не установлен. В совокупности EAR, RDA, AI и UL предусмотрены системы рекомендаций по питанию, известная как Референтное потребление диеты (DRI). Австралия и Новая Зеландия считают хром важным питательным веществом с ИИ 35 мкг / день для мужчин, 25 мкг / день для женщин, 30 мкг / день для беременных женщин и 45 мкг / день для кормящих женщин.. UL не установлен из-за отсутствия достаточных данных. Индия считает хром незаменимым питательным веществом, при этом рекомендуемая доза для взрослых составляет 33 мкг / день. Япония также считает хром важным питательным веществом с AI 10 мкг / день для взрослых, включая беременных и кормящих женщин. UL не установлен. EFSA Европейского Союза, однако, не считает хром важным питательным веществом; хром является единственным минералом, по которому США и Европейский Союз не согласны.
Для целей маркировки пищевых продуктов и пищевых добавок в США количество вещества в порции выражается в процентах от суточной нормы. Значение (% DV). Для целей маркировки хрома 100% дневной нормы составляли 120 мкг. По состоянию на 27 мая 2016 года процентное содержание дневной нормы было изменено до 35 мкг, чтобы привести потребление хрома в соответствие с официальной Рекомендуемой диетической нормой. Соблюдение обновленных правил маркировки требовалось к 1 января 2020 года для производителей с годовым объемом продаж продуктов питания 10 миллионов долларов и более и к 1 января 2021 года для производителей с годовым объемом продаж продуктов питания менее 10 миллионов долларов. В течение первых шести месяцев после даты соответствия 1 января 2020 года FDA планирует сотрудничать с производителями, чтобы соответствовать новым требованиям, предъявляемым к этикеткам Nutrition Facts, и не будет сосредоточиваться на принудительных мерах в отношении этих требований в течение этого времени. Таблица старых и новых суточных значений для взрослых приведена в разделе Референсное суточное потребление.
Источники питания
Базы данных о составе пищевых продуктов, такие как те, которые ведутся Министерством сельского хозяйства США, не содержат информации о хроме. состав продуктов. Широкий спектр продуктов животного и растительного происхождения содержит хром. Содержание на порцию зависит от содержания хрома в почве, в которой выращиваются растения, и от кормов для животных; также методами обработки, поскольку хром выщелачивается в пищевые продукты, если их обрабатывать или готовить на оборудовании из хромосодержащей нержавеющей стали. Одно исследование по анализу рациона, проведенное в Мексике, показало, что среднесуточное потребление хрома составляет 30 мкг. По оценкам, 31% взрослого населения США потребляют поливитаминные / минеральные пищевые добавки, которые часто содержат от 25 до 60 микрограммов хрома.
Добавки
Хром является ингредиентом полного парентерального питания (TPN), поскольку дефицит может возникнуть после месяцев внутривенного кормления с TPN без хрома. По этой причине хром добавляется в растворы TPN вместе с другими микроэлементами. Он также входит в состав пищевых продуктов для недоношенных детей. Хотя механизм биологической роли хрома неясен, в Соединенных Штатах хромосодержащие продукты продаются как безрецептурные диетические добавки в количествах от 50 до 1000 мкг. Более низкое количество хрома также часто включается в поливитаминные / минеральные добавки, которые, по оценкам, потребляет 31% взрослого населения США. Химические соединения, используемые в пищевых добавках, включают хлорид хрома, цитрат хрома, пиколинат хрома (III), полиникотинат хрома (III) и другие химические составы. Польза добавок не доказана.
Одобренные и отклоненные заявления о вреде для здоровья
В 2005 году Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США одобрило квалифицированное заявление о вреде для здоровья пиколината хрома с требованием очень конкретных формулировка на этикетке: «Одно небольшое исследование предполагает, что пиколинат хрома может снизить риск инсулинорезистентности и, следовательно, может снизить риск диабета 2 типа. Однако FDA заключает, что существует такая взаимосвязь между пиколинатом хрома и инсулинорезистентностью. или диабет 2 типа очень сомнительна ». В то же время, в ответ на другие части петиции, FDA отклонило заявления о пиколинате хрома и сердечно-сосудистых заболеваниях, ретинопатии или заболеваниях почек, вызванных аномально высоким уровнем сахара в крови. В 2010 году пиколинат хрома (III) был одобрен Министерством здравоохранения Канады для использования в пищевых добавках. Утвержденные заявления на этикетке включают: фактор поддержания хорошего здоровья, обеспечивает поддержку здорового метаболизма глюкозы, помогает организму усваивать углеводы и помогает организму усваивать жиры. Европейское управление по безопасности пищевых продуктов (EFSA) в 2010 году одобрило утверждения о том, что хром способствует нормальному метаболизму макронутриентов и поддержанию нормальной концентрации глюкозы в крови, но отклонило заявления о поддержании или достижении нормальной массы тела или уменьшении усталости. или усталость.
Учитывая доказательства того, что дефицит хрома вызывает проблемы с регулированием глюкозы в контексте продуктов для внутривенного питания, составленных без хрома, исследовательский интерес обратился к вопросу о том, принесет ли добавка хрома пользу людям с диабетом 2 типа, но не хромом дефицитный. Глядя на результаты четырех метаанализов, один сообщил о статистически значимом снижении уровней глюкозы в плазме натощак (FPG) и незначительной тенденции к более низкому гемоглобину A1C. Второй сообщил о том же, третий сообщил о значительном снижении обоих показателей, а четвертый сообщил об отсутствии каких-либо преимуществ. В обзоре, опубликованном в 2016 году, было перечислено 53 рандомизированных клинических испытания, которые были включены в один или несколько из шести метаанализов. Он пришел к выводу, что, хотя может наблюдаться умеренное снижение ГПН и / или HbA1C, которое достигает статистической значимости в некоторых из этих метаанализов, в нескольких проведенных испытаниях это снижение достаточно велико, чтобы можно было ожидать, что оно будет иметь отношение к клиническому исходу.>Два систематических обзора рассматривали добавки хрома как средство управления массой тела у людей с избыточным весом и ожирением. Один, ограниченный пиколинатом хрома, популярным ингредиентом добавки, сообщил о статистически значимой потере веса -1,1 кг (2,4 фунта) в испытаниях продолжительностью более 12 недель. Другой включал все соединения хрома и сообщил о статистически значимом изменении веса -0,50 кг (1,1 фунта). Изменение процента жира в организме не достигло статистической значимости. Авторы обоих обзоров сочли клиническую значимость этой умеренной потери веса неопределенной / ненадежной. Европейское управление по безопасности пищевых продуктов проверило литературу и пришло к выводу, что доказательств недостаточно.
Хром продвигается как спортивная диетическая добавка на основании теории о том, что он усиливает действие инсулина. активности, с ожидаемыми результатами увеличения мышечной массы и более быстрым восстановлением запасов гликогена во время восстановления после тренировки. Обзор клинических испытаний показал, что добавление хрома не улучшило физическую работоспособность или не увеличило мышечную силу. Международный олимпийский комитет рассмотрел пищевые добавки для спортсменов с высокими спортивными показателями в 2018 году и пришел к выводу, что нет необходимости увеличивать потребление хрома для спортсменов и поддерживать заявления о потере жира.
Пресноводная рыба
Хром естественным образом присутствует в окружающей среде в следовых количествах, но промышленное использование в производстве резины и нержавеющей стали, хромирование, красители для текстильных изделий, кожевенное производство и другие виды использования загрязняют водные системы. В Бангладеш реки в промышленно развитых районах или ниже по течению от них подвержены загрязнению тяжелыми металлами. Нормы содержания хрома в оросительной воде составляют 0,1 мг / л, но в некоторых реках его более чем в пять раз. Стандарт на рыбу для употребления в пищу составляет менее 1 мг / кг, но многие испытанные образцы были более чем в пять раз больше. Хром, особенно шестивалентный хром, очень токсичен для рыб, потому что он легко всасывается через жабры, легко проникает в кровоток, проникает через клеточные мембраны и биоконцентрируется вверх по пищевой цепи. Напротив, токсичность трехвалентного хрома очень низкая, что объясняется плохой проницаемостью мембраны и небольшим биомагнификацией.
Острое и хроническое воздействие хрома (VI) влияет на поведение, физиологию, воспроизводство и выживаемость рыб. Сообщалось о гиперактивности и беспорядочном плавании в загрязненной окружающей среде. Это влияет на вылупление яиц и выживаемость сеголетков. У взрослых рыб есть сообщения о гистопатологических повреждениях печени, почек, мышц, кишечника и жабр. Механизмы включают мутагенное повреждение генов и нарушение функций ферментов.
Имеются данные, свидетельствующие о том, что рыбе может не требоваться хром, но определенное количество в рационе приносит пользу. В одном исследовании молодь рыб набирала вес на диете без содержания хрома, но добавление 500 мкг хрома в виде хлорида хрома или других видов добавок на килограмм корма (сухой вес) увеличивало привес. При дозе 2000 мкг / кг прибавка в весе была не лучше, чем при нулевой хромовой диете, и увеличивалось количество разрывов цепей ДНК.
Меры предосторожности
Нерастворимые в воде соединения хрома (III) и металлический хром не считаются опасными для здоровья, а токсичность и канцерогенные свойства хрома (VI) известны давно. Из-за специфических транспортных механизмов в клетки попадает только ограниченное количество хрома (III). Острая пероральная токсичность колеблется от 50 до 150 мг / кг. Обзор 2008 года показал, что умеренное потребление хрома (III) через пищевые добавки не представляет генетически-токсического риска. В США Управление охраны труда (OSHA) определило допустимый предел воздействия (PEL) на рабочем месте как средневзвешенное по времени (TWA) 1 мг. / м. Национальный институт охраны труда (NIOSH) установил рекомендуемый предел воздействия (REL) 0,5 мг / м3, средневзвешенное по времени. Значение IDLH (непосредственная опасность для жизни и здоровья) составляет 250 мг / м.
Хром (VI) токсичность
Острая пероральная токсичность для хрома (VI) составляет от 1,5 до 3,3 мг / кг. В организме хром (VI) восстанавливается несколькими механизмами до хрома (III) уже в крови, прежде чем он попадет в клетки. Хром (III) выводится из организма, в то время как ион хрома переносится в клетку с помощью транспортного механизма, по которому также ионы сульфата и фосфата проникают в клетку. Острая токсичность хрома (VI) обусловлена его сильными окислительными свойствами. Попадая в кровоток, он повреждает почки, печень и клетки крови в результате реакций окисления. Гемолиз, почечный и печеночная недостаточность. Агрессивный диализ может быть терапевтическим.
Канцерогенность хроматной пыли известна давно, и в 1890 году первая публикация описала повышенный риск рака у рабочих на предприятии по производству хроматных красителей. Было предложено три механизма для описания генотоксичности хрома (VI). Первый механизм включает высокореактивные гидроксильные радикалы и другие реакционноспособные радикалы, которые являются продуктами восстановления хрома (VI) до хрома (III). Второй процесс включает прямое связывание хрома (V), продуцируемого восстановлением в клетке, и соединений хрома (IV) с ДНК. Последний механизм объясняет генотоксичность связыванием с ДНК конечного продукта восстановления хрома (III).
Соли хрома (хроматы) также являются причиной аллергических реакций в некоторых люди. Хроматы часто используются, среди прочего, для производства кожаных изделий, красок, цемента, строительного раствора и антикоррозионных средств. Контакт с продуктами, содержащими хроматы, может привести к аллергическому контактному дерматиту и раздражающему дерматиту, что приводит к образованию язв на коже, иногда называемых «хромовыми язвами». Это состояние часто встречается у рабочих, которые подвергались воздействию сильных растворов хромата на предприятиях по гальванике, дублению и производству хрома.
Проблемы окружающей среды
Поскольку соединения хрома использовались в красителях, краски и составы для дубления кожи, эти соединения часто обнаруживаются в почве и грунтовых водах действующих и заброшенных промышленных объектов, требуется очистка окружающей среды и восстановление. Грунтовка, содержащая шестивалентный хром, по-прежнему широко используется для аэрокосмической и автомобильной ремонтной окраски.
В 2010 году Рабочая группа по охране окружающей среды изучил питьевую воду в 35 американских городах в первом общенациональном исследовании. В результате исследования было обнаружено измеримое количество шестивалентного хрома в водопроводной воде в 31 из выбранных городов, при этом Норман, Оклахома, вверху списка; В 25 городах уровни превышали предлагаемый в Калифорнии предел.
См. Также
- Хромирование
- Дефицит хрома
- Хром в метаболизме глюкозы
- Токсичность хрома
- Хром-ванадиевая сталь
- Шестивалентный хром
- Нихром
- Нержавеющая сталь
Пояснения
- ^Точки плавления / кипения переходных металлов обычно выше, чем у щелочных металлов, щелочноземельных металлов и неметаллов, поэтому ряд элементов в сравнении с хромом различались в сравнении
- ^Наиболее распространенные степени окисления хрома выделены жирным шрифтом. В правом столбце перечислены типичные соединения для каждой степени окисления.
- ^Любой цвет корунда (кроме красного) известен как сапфир. Если корунд красный, то это рубин. Сапфиры не обязательно должны быть синими кристаллами корунда, поскольку сапфиры могут быть других цветов, например, желтого и пурпурного
- ^Когда Cr. заменяет Al. в корунде (оксид алюминия, Al 2O3) Образуется розовый сапфир или рубин, в зависимости от количества хрома.
Цитаты
Общая библиография
- Гринвуд, Норман Н. ; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн. ISBN 978-0-08-037941-8.
Внешние ссылки
| На Викискладе есть материалы, связанные с Chromium. |
| Найдите хром в Викисловаре, бесплатном словаре. |
- Примеры из практики ATSDR в области экологической медицины: токсичность хрома США Министерство здравоохранения и социальных служб
- Монография МАИР «Хром и соединения хрома»
- Элементарный — Элемент Хром
- Руководство компании Merck — Дефицит минералов и токсичность
- Национальный институт безопасности и гигиены труда — Страница Chromium
- Chromium в Периодическая таблица видео (Университет Ноттингема)
- «Chromium». Encyclopædia Britannica. 6(11-е изд.). 1911. pp. 296–298.


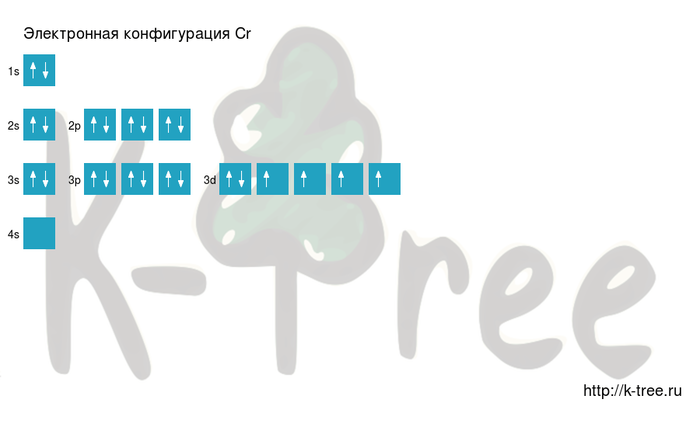
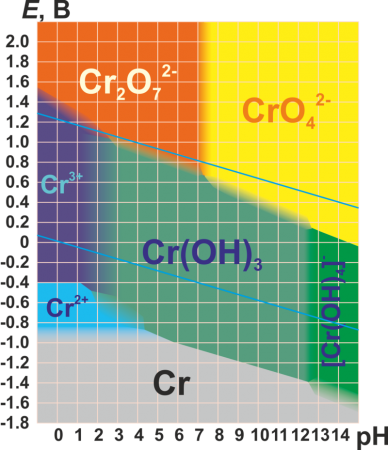










![mathsf{2Cr^{3+} xrightarrow[Zn, HCl]{[H]} 2Cr^{2+}}](https://dic.academic.ru/dic.nsf/ruwiki/87d12f941f6a6e5a19176df6a608882e.png)


![mathsf{Cr(OH)_3 + 3OH^- rightarrow [Cr(OH)_6]}](https://dic.academic.ru/dic.nsf/ruwiki/a45458e97b48003157cef2acb4152180.png)


![mathsf{2Na_3[Cr(OH)_6] + 3H_2O_2 rightarrow 2Na_2CrO_4 + 2NaOH + 8H_2O}](https://dic.academic.ru/dic.nsf/ruwiki/8fb0927ed6d5bb7517fc9e5f79e1e83f.png)









