An ion ()[1] is an atom or molecule with a net electrical charge.
The charge of an electron is considered to be negative by convention and this charge is equal and opposite to the charge of a proton, which is considered to be positive by convention. The net charge of an ion is not zero because its total number of electrons is unequal to its total number of protons.
A cation is a positively charged ion with fewer electrons than protons[2] while an anion is a negatively charged ion with more electrons than protons.[3] Opposite electric charges are pulled towards one another by electrostatic force, so cations and anions attract each other and readily form ionic compounds.
Ions consisting of only a single atom are termed atomic or monatomic ions, while two or more atoms form molecular ions or polyatomic ions. In the case of physical ionization in a fluid (gas or liquid), «ion pairs» are created by spontaneous molecule collisions, where each generated pair consists of a free electron and a positive ion.[4] Ions are also created by chemical interactions, such as the dissolution of a salt in liquids, or by other means, such as passing a direct current through a conducting solution, dissolving an anode via ionization.
History of discovery
The word ion was coined from Greek neuter present participle of ienai (Greek: ἰέναι), meaning «to go». A cation is something that moves down (Greek: κάτω pronounced kato, meaning «down») and an anion is something that moves up (Greek: ano ἄνω, meaning «up»). They are so called because ions move toward the electrode of opposite charge. This term was introduced (after a suggestion by the English polymath William Whewell)[5] by English physicist and chemist Michael Faraday in 1834 for the then-unknown species that goes from one electrode to the other through an aqueous medium.[6][7] Faraday did not know the nature of these species, but he knew that since metals dissolved into and entered a solution at one electrode and new metal came forth from a solution at the other electrode; that some kind of substance has moved through the solution in a current. This conveys matter from one place to the other. In correspondence with Faraday, Whewell also coined the words anode and cathode, as well as anion and cation as ions that are attracted to the respective electrodes.[5]
Svante Arrhenius put forth, in his 1884 dissertation, the explanation of the fact that solid crystalline salts dissociate into paired charged particles when dissolved, for which he would win the 1903 Nobel Prize in Chemistry.[8] Arrhenius’ explanation was that in forming a solution, the salt dissociates into Faraday’s ions, he proposed that ions formed even in the absence of an electric current.[9][10][11]
Characteristics
Ions in their gas-like state are highly reactive and will rapidly interact with ions of opposite charge to give neutral molecules or ionic salts. Ions are also produced in the liquid or solid state when salts interact with solvents (for example, water) to produce solvated ions, which are more stable, for reasons involving a combination of energy and entropy changes as the ions move away from each other to interact with the liquid. These stabilized species are more commonly found in the environment at low temperatures. A common example is the ions present in seawater, which are derived from dissolved salts.
As charged objects, ions are attracted to opposite electric charges (positive to negative, and vice versa) and repelled by like charges. When they move, their trajectories can be deflected by a magnetic field.
Electrons, due to their smaller mass and thus larger space-filling properties as matter waves, determine the size of atoms and molecules that possess any electrons at all. Thus, anions (negatively charged ions) are larger than the parent molecule or atom, as the excess electron(s) repel each other and add to the physical size of the ion, because its size is determined by its electron cloud. Cations are smaller than the corresponding parent atom or molecule due to the smaller size of the electron cloud. One particular cation (that of hydrogen) contains no electrons, and thus consists of a single proton — much smaller than the parent hydrogen atom.
Anions and cations
«Anion» redirects here. Not to be confused with the quasiparticle Anyon.
Hydrogen atom (center) contains a single proton and a single electron. Removal of the electron gives a cation (left), whereas the addition of an electron gives an anion (right). The hydrogen anion, with its loosely held two-electron cloud, has a larger radius than the neutral atom, which in turn is much larger than the bare proton of the cation. Hydrogen forms the only charge-+1 cation that has no electrons, but even cations that (unlike hydrogen) retain one or more electrons are still smaller than the neutral atoms or molecules from which they are derived.
Since the electric charge on a proton is equal in magnitude to the charge on an electron, the net electric charge on an ion is equal to the number of protons in the ion minus the number of electrons.
An anion (−) ( ANN-eye-ən, from the Greek word ἄνω (ánō), meaning «up»[12]) is an ion with more electrons than protons, giving it a net negative charge (since electrons are negatively charged and protons are positively charged).[13]
A cation (+) ( KAT-eye-ən, from the Greek word κάτω (káto), meaning «down»[14]) is an ion with fewer electrons than protons, giving it a positive charge.[15]
There are additional names used for ions with multiple charges. For example, an ion with a −2 charge is known as a dianion and an ion with a +2 charge is known as a dication. A zwitterion is a neutral molecule with positive and negative charges at different locations within that molecule.[16]
Cations and anions are measured by their ionic radius and they differ in relative size: «Cations are small, most of them less than 10−10 m (10−8 cm) in radius. But most anions are large, as is the most common Earth anion, oxygen. From this fact it is apparent that most of the space of a crystal is occupied by the anion and that the cations fit into the spaces between them.»[17]
The terms anion and cation (for ions that respectively travel to the anode and cathode during electrolysis) were introduced by Michael Faraday in 1834 following his consultation with William Whewell.
Natural occurrences
Ions are ubiquitous in nature and are responsible for diverse phenomena from the luminescence of the Sun to the existence of the Earth’s ionosphere. Atoms in their ionic state may have a different color from neutral atoms, and thus light absorption by metal ions gives the color of gemstones. In both inorganic and organic chemistry (including biochemistry), the interaction of water and ions is extremely important[citation needed]; an example is energy that drives the breakdown of adenosine triphosphate (ATP)[clarification needed].
Ions can be non-chemically prepared using various ion sources, usually involving high voltage or temperature. These are used in a multitude of devices such as mass spectrometers, optical emission spectrometers, particle accelerators, ion implanters, and ion engines.
As reactive charged particles, they are also used in air purification by disrupting microbes, and in household items such as smoke detectors.
As signalling and metabolism in organisms are controlled by a precise ionic gradient across membranes, the disruption of this gradient contributes to cell death. This is a common mechanism exploited by natural and artificial biocides, including the ion channels gramicidin and amphotericin (a fungicide).
Inorganic dissolved ions are a component of total dissolved solids, a widely known indicator of water quality.
Detection of ionizing radiation
Schematic of an ion chamber, showing drift of ions. Electrons drift faster than positive ions due to their much smaller mass.[4]
Avalanche effect between two electrodes. The original ionization event liberates one electron, and each subsequent collision liberates a further electron, so two electrons emerge from each collision: the ionizing electron and the liberated electron.
The ionizing effect of radiation on a gas is extensively used for the detection of radiation such as alpha, beta, gamma, and X-rays. The original ionization event in these instruments results in the formation of an «ion pair»; a positive ion and a free electron, by ion impact by the radiation on the gas molecules. The ionization chamber is the simplest of these detectors, and collects all the charges created by direct ionization within the gas through the application of an electric field.[4]
The Geiger–Müller tube and the proportional counter both use a phenomenon known as a Townsend avalanche to multiply the effect of the original ionizing event by means of a cascade effect whereby the free electrons are given sufficient energy by the electric field to release further electrons by ion impact.
Chemistry
Denoting the charged state
Equivalent notations for an iron atom (Fe) that lost two electrons, referred to as ferrous.
When writing the chemical formula for an ion, its net charge is written in superscript immediately after the chemical structure for the molecule/atom. The net charge is written with the magnitude before the sign; that is, a doubly charged cation is indicated as 2+ instead of +2. However, the magnitude of the charge is omitted for singly charged molecules/atoms; for example, the sodium cation is indicated as Na+ and not Na1+.
An alternative (and acceptable) way of showing a molecule/atom with multiple charges is by drawing out the signs multiple times, this is often seen with transition metals. Chemists sometimes circle the sign; this is merely ornamental and does not alter the chemical meaning. All three representations of Fe2+, Fe++, and Fe⊕⊕ shown in the figure, are thus equivalent.
Mixed Roman numerals and charge notations for the uranyl ion. The oxidation state of the metal is shown as superscripted Roman numerals, whereas the charge of the entire complex is shown by the angle symbol together with the magnitude and sign of the net charge.
Monatomic ions are sometimes also denoted with Roman numerals, particularly in spectroscopy; for example, the Fe2+ example seen above is referred to as Fe(II) or FeII. The Roman numeral designates the formal oxidation state of an element, whereas the superscripted Indo-Arabic numerals denote the net charge. The two notations are, therefore, exchangeable for monatomic ions, but the Roman numerals cannot be applied to polyatomic ions. However, it is possible to mix the notations for the individual metal centre with a polyatomic complex, as shown by the uranyl ion example.
Sub-classes
If an ion contains unpaired electrons, it is called a radical ion. Just like uncharged radicals, radical ions are very reactive. Polyatomic ions containing oxygen, such as carbonate and sulfate, are called oxyanions. Molecular ions that contain at least one carbon to hydrogen bond are called organic ions. If the charge in an organic ion is formally centred on a carbon, it is termed a carbocation (if positively charged) or carbanion (if negatively charged).
Formation
Formation of monatomic ions
Monatomic ions are formed by the gain or loss of electrons to the valence shell (the outer-most electron shell) in an atom. The inner shells of an atom are filled with electrons that are tightly bound to the positively charged atomic nucleus, and so do not participate in this kind of chemical interaction. The process of gaining or losing electrons from a neutral atom or molecule is called ionization.
Atoms can be ionized by bombardment with radiation, but the more usual process of ionization encountered in chemistry is the transfer of electrons between atoms or molecules. This transfer is usually driven by the attaining of stable («closed shell») electronic configurations. Atoms will gain or lose electrons depending on which action takes the least energy.
For example, a sodium atom, Na, has a single electron in its valence shell, surrounding 2 stable, filled inner shells of 2 and 8 electrons. Since these filled shells are very stable, a sodium atom tends to lose its extra electron and attain this stable configuration, becoming a sodium cation in the process
On the other hand, a chlorine atom, Cl, has 7 electrons in its valence shell, which is one short of the stable, filled shell with 8 electrons. Thus, a chlorine atom tends to gain an extra electron and attain a stable 8-electron configuration, becoming a chloride anion in the process:
This driving force is what causes sodium and chlorine to undergo a chemical reaction, wherein the «extra» electron is transferred from sodium to chlorine, forming sodium cations and chloride anions. Being oppositely charged, these cations and anions form ionic bonds and combine to form sodium chloride, NaCl, more commonly known as table salt.
Formation of polyatomic and molecular ions
Polyatomic and molecular ions are often formed by the gaining or losing of elemental ions such as a proton, H+, in neutral molecules. For example, when ammonia, NH3, accepts a proton, H+—a process called protonation—it forms the ammonium ion, NH+4. Ammonia and ammonium have the same number of electrons in essentially the same electronic configuration, but ammonium has an extra proton that gives it a net positive charge.
Ammonia can also lose an electron to gain a positive charge, forming the ion NH+3. However, this ion is unstable, because it has an incomplete valence shell around the nitrogen atom, making it a very reactive radical ion.
Due to the instability of radical ions, polyatomic and molecular ions are usually formed by gaining or losing elemental ions such as H+, rather than gaining or losing electrons. This allows the molecule to preserve its stable electronic configuration while acquiring an electrical charge.
Ionization potential
The energy required to detach an electron in its lowest energy state from an atom or molecule of a gas with less net electric charge is called the ionization potential, or ionization energy. The nth ionization energy of an atom is the energy required to detach its nth electron after the first n − 1 electrons have already been detached.
Each successive ionization energy is markedly greater than the last. Particularly great increases occur after any given block of atomic orbitals is exhausted of electrons. For this reason, ions tend to form in ways that leave them with full orbital blocks. For example, sodium has one valence electron in its outermost shell, so in ionized form it is commonly found with one lost electron, as Na+. On the other side of the periodic table, chlorine has seven valence electrons, so in ionized form it is commonly found with one gained electron, as Cl−. Caesium has the lowest measured ionization energy of all the elements and helium has the greatest.[18] In general, the ionization energy of metals is much lower than the ionization energy of nonmetals, which is why, in general, metals will lose electrons to form positively charged ions and nonmetals will gain electrons to form negatively charged ions.
Ionic bonding
Ionic bonding is a kind of chemical bonding that arises from the mutual attraction of oppositely charged ions. Ions of like charge repel each other, and ions of opposite charge attract each other. Therefore, ions do not usually exist on their own, but will bind with ions of opposite charge to form a crystal lattice. The resulting compound is called an ionic compound, and is said to be held together by ionic bonding. In ionic compounds there arise characteristic distances between ion neighbours from which the spatial extension and the ionic radius of individual ions may be derived.
The most common type of ionic bonding is seen in compounds of metals and nonmetals (except noble gases, which rarely form chemical compounds). Metals are characterized by having a small number of electrons in excess of a stable, closed-shell electronic configuration. As such, they have the tendency to lose these extra electrons in order to attain a stable configuration. This property is known as electropositivity. Non-metals, on the other hand, are characterized by having an electron configuration just a few electrons short of a stable configuration. As such, they have the tendency to gain more electrons in order to achieve a stable configuration. This tendency is known as electronegativity. When a highly electropositive metal is combined with a highly electronegative nonmetal, the extra electrons from the metal atoms are transferred to the electron-deficient nonmetal atoms. This reaction produces metal cations and nonmetal anions, which are attracted to each other to form a salt.
Common ions
Common cations[19]
|
Common anions[19]
|
See also
- Air ionizer
- Aurora
- Electrolyte
- Gaseous ionization detectors
- Ioliomics
- Ion beam
- Ion exchange
- Ionizing radiation
- Stopping power of radiation particles
References
- ^ «Ion» Archived 2013-12-24 at the Wayback Machine entry in Collins English Dictionary.
- ^ «Definition of CATION». www.merriam-webster.com. Archived from the original on 2021-10-06. Retrieved 2021-10-06.
- ^ «Definition of ANION». www.merriam-webster.com. Archived from the original on 2021-10-06. Retrieved 2021-10-06.
- ^ a b c Knoll, Glenn F (1999). Radiation detection and measurement (3rd ed.). New York: Wiley. ISBN 978-0-471-07338-3.
- ^ a b Frank A. J. L. James, ed. (1991). The Correspondence of Michael Faraday, Vol. 2: 1832-1840. p. 183. ISBN 9780863412493. Archived from the original on 2021-04-14. Retrieved 2020-10-16.
- ^ Michael Faraday (1791-1867). UK: BBC.
- ^ «Online etymology dictionary». Archived from the original on 2011-05-14. Retrieved 2011-01-07.
- ^ «The Nobel Prize in Chemistry 1903». www.nobelprize.org. Archived from the original on 2018-07-08. Retrieved 2017-06-13.
- ^ Harris, William; Levey, Judith, eds. (1976). The New Columbia Encyclopedia (4th ed.). New York City: Columbia University. p. 155. ISBN 978-0-231-03572-9.
- ^ Goetz, Philip W. (1992). McHenry, Charles (ed.). The New Encyclopædia Britannica. Chicago: Encyclopaedia Britannica Inc. Vol. 1 (15 ed.). Chicago: Encyclopædia Britannica, Inc. p. 587. Bibcode:1991neb..book…..G. ISBN 978-0-85229-553-3.
- ^ Cillispie, Charles, ed. (1970). Dictionary of Scientific Biography (1 ed.). New York City: Charles Scribner’s Sons. pp. 296–302. ISBN 978-0-684-10112-5.
- ^ Oxford University Press (2013). «Oxford Reference: OVERVIEW anion». oxfordreference.com. Archived from the original on 2017-01-18. Retrieved 2017-01-15.
- ^ University of Colorado Boulder (November 21, 2013). «Atoms and Elements, Isotopes and Ions». colorado.edu. Archived from the original on February 2, 2015. Retrieved November 22, 2013.
- ^ Oxford University Press (2013). «Oxford Reference: OVERVIEW cation». oxfordreference.com. Archived from the original on 2017-01-18. Retrieved 2017-01-15.
- ^ Douglas W. Haywick, Ph.D.; University of South Alabama (2007–2008). «Elemental Chemistry» (PDF). usouthal.edu. Archived (PDF) from the original on 2011-12-04. Retrieved 2013-11-22.
- ^ Purdue University (November 21, 2013). «Amino Acids». purdue.edu. Archived from the original on July 13, 2011. Retrieved November 22, 2013.
- ^ Press, Frank; Siever, Raymond (1986). Earth (14th ed.). New York: W. H. Freeman and Company. p. 63. ISBN 0-7167-1743-3. OCLC 12556840.
- ^ Chemical elements listed by ionization energy Archived 2009-03-30 at the Wayback Machine. Lenntech.com
- ^ a b c «Common Ions and Their Charges» (PDF). Science Geek. Archived (PDF) from the original on 2018-02-18. Retrieved 2018-05-11.
An ion ()[1] is an atom or molecule with a net electrical charge.
The charge of an electron is considered to be negative by convention and this charge is equal and opposite to the charge of a proton, which is considered to be positive by convention. The net charge of an ion is not zero because its total number of electrons is unequal to its total number of protons.
A cation is a positively charged ion with fewer electrons than protons[2] while an anion is a negatively charged ion with more electrons than protons.[3] Opposite electric charges are pulled towards one another by electrostatic force, so cations and anions attract each other and readily form ionic compounds.
Ions consisting of only a single atom are termed atomic or monatomic ions, while two or more atoms form molecular ions or polyatomic ions. In the case of physical ionization in a fluid (gas or liquid), «ion pairs» are created by spontaneous molecule collisions, where each generated pair consists of a free electron and a positive ion.[4] Ions are also created by chemical interactions, such as the dissolution of a salt in liquids, or by other means, such as passing a direct current through a conducting solution, dissolving an anode via ionization.
History of discovery
The word ion was coined from Greek neuter present participle of ienai (Greek: ἰέναι), meaning «to go». A cation is something that moves down (Greek: κάτω pronounced kato, meaning «down») and an anion is something that moves up (Greek: ano ἄνω, meaning «up»). They are so called because ions move toward the electrode of opposite charge. This term was introduced (after a suggestion by the English polymath William Whewell)[5] by English physicist and chemist Michael Faraday in 1834 for the then-unknown species that goes from one electrode to the other through an aqueous medium.[6][7] Faraday did not know the nature of these species, but he knew that since metals dissolved into and entered a solution at one electrode and new metal came forth from a solution at the other electrode; that some kind of substance has moved through the solution in a current. This conveys matter from one place to the other. In correspondence with Faraday, Whewell also coined the words anode and cathode, as well as anion and cation as ions that are attracted to the respective electrodes.[5]
Svante Arrhenius put forth, in his 1884 dissertation, the explanation of the fact that solid crystalline salts dissociate into paired charged particles when dissolved, for which he would win the 1903 Nobel Prize in Chemistry.[8] Arrhenius’ explanation was that in forming a solution, the salt dissociates into Faraday’s ions, he proposed that ions formed even in the absence of an electric current.[9][10][11]
Characteristics
Ions in their gas-like state are highly reactive and will rapidly interact with ions of opposite charge to give neutral molecules or ionic salts. Ions are also produced in the liquid or solid state when salts interact with solvents (for example, water) to produce solvated ions, which are more stable, for reasons involving a combination of energy and entropy changes as the ions move away from each other to interact with the liquid. These stabilized species are more commonly found in the environment at low temperatures. A common example is the ions present in seawater, which are derived from dissolved salts.
As charged objects, ions are attracted to opposite electric charges (positive to negative, and vice versa) and repelled by like charges. When they move, their trajectories can be deflected by a magnetic field.
Electrons, due to their smaller mass and thus larger space-filling properties as matter waves, determine the size of atoms and molecules that possess any electrons at all. Thus, anions (negatively charged ions) are larger than the parent molecule or atom, as the excess electron(s) repel each other and add to the physical size of the ion, because its size is determined by its electron cloud. Cations are smaller than the corresponding parent atom or molecule due to the smaller size of the electron cloud. One particular cation (that of hydrogen) contains no electrons, and thus consists of a single proton — much smaller than the parent hydrogen atom.
Anions and cations
«Anion» redirects here. Not to be confused with the quasiparticle Anyon.
Hydrogen atom (center) contains a single proton and a single electron. Removal of the electron gives a cation (left), whereas the addition of an electron gives an anion (right). The hydrogen anion, with its loosely held two-electron cloud, has a larger radius than the neutral atom, which in turn is much larger than the bare proton of the cation. Hydrogen forms the only charge-+1 cation that has no electrons, but even cations that (unlike hydrogen) retain one or more electrons are still smaller than the neutral atoms or molecules from which they are derived.
Since the electric charge on a proton is equal in magnitude to the charge on an electron, the net electric charge on an ion is equal to the number of protons in the ion minus the number of electrons.
An anion (−) ( ANN-eye-ən, from the Greek word ἄνω (ánō), meaning «up»[12]) is an ion with more electrons than protons, giving it a net negative charge (since electrons are negatively charged and protons are positively charged).[13]
A cation (+) ( KAT-eye-ən, from the Greek word κάτω (káto), meaning «down»[14]) is an ion with fewer electrons than protons, giving it a positive charge.[15]
There are additional names used for ions with multiple charges. For example, an ion with a −2 charge is known as a dianion and an ion with a +2 charge is known as a dication. A zwitterion is a neutral molecule with positive and negative charges at different locations within that molecule.[16]
Cations and anions are measured by their ionic radius and they differ in relative size: «Cations are small, most of them less than 10−10 m (10−8 cm) in radius. But most anions are large, as is the most common Earth anion, oxygen. From this fact it is apparent that most of the space of a crystal is occupied by the anion and that the cations fit into the spaces between them.»[17]
The terms anion and cation (for ions that respectively travel to the anode and cathode during electrolysis) were introduced by Michael Faraday in 1834 following his consultation with William Whewell.
Natural occurrences
Ions are ubiquitous in nature and are responsible for diverse phenomena from the luminescence of the Sun to the existence of the Earth’s ionosphere. Atoms in their ionic state may have a different color from neutral atoms, and thus light absorption by metal ions gives the color of gemstones. In both inorganic and organic chemistry (including biochemistry), the interaction of water and ions is extremely important[citation needed]; an example is energy that drives the breakdown of adenosine triphosphate (ATP)[clarification needed].
Ions can be non-chemically prepared using various ion sources, usually involving high voltage or temperature. These are used in a multitude of devices such as mass spectrometers, optical emission spectrometers, particle accelerators, ion implanters, and ion engines.
As reactive charged particles, they are also used in air purification by disrupting microbes, and in household items such as smoke detectors.
As signalling and metabolism in organisms are controlled by a precise ionic gradient across membranes, the disruption of this gradient contributes to cell death. This is a common mechanism exploited by natural and artificial biocides, including the ion channels gramicidin and amphotericin (a fungicide).
Inorganic dissolved ions are a component of total dissolved solids, a widely known indicator of water quality.
Detection of ionizing radiation
Schematic of an ion chamber, showing drift of ions. Electrons drift faster than positive ions due to their much smaller mass.[4]
Avalanche effect between two electrodes. The original ionization event liberates one electron, and each subsequent collision liberates a further electron, so two electrons emerge from each collision: the ionizing electron and the liberated electron.
The ionizing effect of radiation on a gas is extensively used for the detection of radiation such as alpha, beta, gamma, and X-rays. The original ionization event in these instruments results in the formation of an «ion pair»; a positive ion and a free electron, by ion impact by the radiation on the gas molecules. The ionization chamber is the simplest of these detectors, and collects all the charges created by direct ionization within the gas through the application of an electric field.[4]
The Geiger–Müller tube and the proportional counter both use a phenomenon known as a Townsend avalanche to multiply the effect of the original ionizing event by means of a cascade effect whereby the free electrons are given sufficient energy by the electric field to release further electrons by ion impact.
Chemistry
Denoting the charged state
Equivalent notations for an iron atom (Fe) that lost two electrons, referred to as ferrous.
When writing the chemical formula for an ion, its net charge is written in superscript immediately after the chemical structure for the molecule/atom. The net charge is written with the magnitude before the sign; that is, a doubly charged cation is indicated as 2+ instead of +2. However, the magnitude of the charge is omitted for singly charged molecules/atoms; for example, the sodium cation is indicated as Na+ and not Na1+.
An alternative (and acceptable) way of showing a molecule/atom with multiple charges is by drawing out the signs multiple times, this is often seen with transition metals. Chemists sometimes circle the sign; this is merely ornamental and does not alter the chemical meaning. All three representations of Fe2+, Fe++, and Fe⊕⊕ shown in the figure, are thus equivalent.
Mixed Roman numerals and charge notations for the uranyl ion. The oxidation state of the metal is shown as superscripted Roman numerals, whereas the charge of the entire complex is shown by the angle symbol together with the magnitude and sign of the net charge.
Monatomic ions are sometimes also denoted with Roman numerals, particularly in spectroscopy; for example, the Fe2+ example seen above is referred to as Fe(II) or FeII. The Roman numeral designates the formal oxidation state of an element, whereas the superscripted Indo-Arabic numerals denote the net charge. The two notations are, therefore, exchangeable for monatomic ions, but the Roman numerals cannot be applied to polyatomic ions. However, it is possible to mix the notations for the individual metal centre with a polyatomic complex, as shown by the uranyl ion example.
Sub-classes
If an ion contains unpaired electrons, it is called a radical ion. Just like uncharged radicals, radical ions are very reactive. Polyatomic ions containing oxygen, such as carbonate and sulfate, are called oxyanions. Molecular ions that contain at least one carbon to hydrogen bond are called organic ions. If the charge in an organic ion is formally centred on a carbon, it is termed a carbocation (if positively charged) or carbanion (if negatively charged).
Formation
Formation of monatomic ions
Monatomic ions are formed by the gain or loss of electrons to the valence shell (the outer-most electron shell) in an atom. The inner shells of an atom are filled with electrons that are tightly bound to the positively charged atomic nucleus, and so do not participate in this kind of chemical interaction. The process of gaining or losing electrons from a neutral atom or molecule is called ionization.
Atoms can be ionized by bombardment with radiation, but the more usual process of ionization encountered in chemistry is the transfer of electrons between atoms or molecules. This transfer is usually driven by the attaining of stable («closed shell») electronic configurations. Atoms will gain or lose electrons depending on which action takes the least energy.
For example, a sodium atom, Na, has a single electron in its valence shell, surrounding 2 stable, filled inner shells of 2 and 8 electrons. Since these filled shells are very stable, a sodium atom tends to lose its extra electron and attain this stable configuration, becoming a sodium cation in the process
On the other hand, a chlorine atom, Cl, has 7 electrons in its valence shell, which is one short of the stable, filled shell with 8 electrons. Thus, a chlorine atom tends to gain an extra electron and attain a stable 8-electron configuration, becoming a chloride anion in the process:
This driving force is what causes sodium and chlorine to undergo a chemical reaction, wherein the «extra» electron is transferred from sodium to chlorine, forming sodium cations and chloride anions. Being oppositely charged, these cations and anions form ionic bonds and combine to form sodium chloride, NaCl, more commonly known as table salt.
Formation of polyatomic and molecular ions
Polyatomic and molecular ions are often formed by the gaining or losing of elemental ions such as a proton, H+, in neutral molecules. For example, when ammonia, NH3, accepts a proton, H+—a process called protonation—it forms the ammonium ion, NH+4. Ammonia and ammonium have the same number of electrons in essentially the same electronic configuration, but ammonium has an extra proton that gives it a net positive charge.
Ammonia can also lose an electron to gain a positive charge, forming the ion NH+3. However, this ion is unstable, because it has an incomplete valence shell around the nitrogen atom, making it a very reactive radical ion.
Due to the instability of radical ions, polyatomic and molecular ions are usually formed by gaining or losing elemental ions such as H+, rather than gaining or losing electrons. This allows the molecule to preserve its stable electronic configuration while acquiring an electrical charge.
Ionization potential
The energy required to detach an electron in its lowest energy state from an atom or molecule of a gas with less net electric charge is called the ionization potential, or ionization energy. The nth ionization energy of an atom is the energy required to detach its nth electron after the first n − 1 electrons have already been detached.
Each successive ionization energy is markedly greater than the last. Particularly great increases occur after any given block of atomic orbitals is exhausted of electrons. For this reason, ions tend to form in ways that leave them with full orbital blocks. For example, sodium has one valence electron in its outermost shell, so in ionized form it is commonly found with one lost electron, as Na+. On the other side of the periodic table, chlorine has seven valence electrons, so in ionized form it is commonly found with one gained electron, as Cl−. Caesium has the lowest measured ionization energy of all the elements and helium has the greatest.[18] In general, the ionization energy of metals is much lower than the ionization energy of nonmetals, which is why, in general, metals will lose electrons to form positively charged ions and nonmetals will gain electrons to form negatively charged ions.
Ionic bonding
Ionic bonding is a kind of chemical bonding that arises from the mutual attraction of oppositely charged ions. Ions of like charge repel each other, and ions of opposite charge attract each other. Therefore, ions do not usually exist on their own, but will bind with ions of opposite charge to form a crystal lattice. The resulting compound is called an ionic compound, and is said to be held together by ionic bonding. In ionic compounds there arise characteristic distances between ion neighbours from which the spatial extension and the ionic radius of individual ions may be derived.
The most common type of ionic bonding is seen in compounds of metals and nonmetals (except noble gases, which rarely form chemical compounds). Metals are characterized by having a small number of electrons in excess of a stable, closed-shell electronic configuration. As such, they have the tendency to lose these extra electrons in order to attain a stable configuration. This property is known as electropositivity. Non-metals, on the other hand, are characterized by having an electron configuration just a few electrons short of a stable configuration. As such, they have the tendency to gain more electrons in order to achieve a stable configuration. This tendency is known as electronegativity. When a highly electropositive metal is combined with a highly electronegative nonmetal, the extra electrons from the metal atoms are transferred to the electron-deficient nonmetal atoms. This reaction produces metal cations and nonmetal anions, which are attracted to each other to form a salt.
Common ions
Common cations[19]
|
Common anions[19]
|
See also
- Air ionizer
- Aurora
- Electrolyte
- Gaseous ionization detectors
- Ioliomics
- Ion beam
- Ion exchange
- Ionizing radiation
- Stopping power of radiation particles
References
- ^ «Ion» Archived 2013-12-24 at the Wayback Machine entry in Collins English Dictionary.
- ^ «Definition of CATION». www.merriam-webster.com. Archived from the original on 2021-10-06. Retrieved 2021-10-06.
- ^ «Definition of ANION». www.merriam-webster.com. Archived from the original on 2021-10-06. Retrieved 2021-10-06.
- ^ a b c Knoll, Glenn F (1999). Radiation detection and measurement (3rd ed.). New York: Wiley. ISBN 978-0-471-07338-3.
- ^ a b Frank A. J. L. James, ed. (1991). The Correspondence of Michael Faraday, Vol. 2: 1832-1840. p. 183. ISBN 9780863412493. Archived from the original on 2021-04-14. Retrieved 2020-10-16.
- ^ Michael Faraday (1791-1867). UK: BBC.
- ^ «Online etymology dictionary». Archived from the original on 2011-05-14. Retrieved 2011-01-07.
- ^ «The Nobel Prize in Chemistry 1903». www.nobelprize.org. Archived from the original on 2018-07-08. Retrieved 2017-06-13.
- ^ Harris, William; Levey, Judith, eds. (1976). The New Columbia Encyclopedia (4th ed.). New York City: Columbia University. p. 155. ISBN 978-0-231-03572-9.
- ^ Goetz, Philip W. (1992). McHenry, Charles (ed.). The New Encyclopædia Britannica. Chicago: Encyclopaedia Britannica Inc. Vol. 1 (15 ed.). Chicago: Encyclopædia Britannica, Inc. p. 587. Bibcode:1991neb..book…..G. ISBN 978-0-85229-553-3.
- ^ Cillispie, Charles, ed. (1970). Dictionary of Scientific Biography (1 ed.). New York City: Charles Scribner’s Sons. pp. 296–302. ISBN 978-0-684-10112-5.
- ^ Oxford University Press (2013). «Oxford Reference: OVERVIEW anion». oxfordreference.com. Archived from the original on 2017-01-18. Retrieved 2017-01-15.
- ^ University of Colorado Boulder (November 21, 2013). «Atoms and Elements, Isotopes and Ions». colorado.edu. Archived from the original on February 2, 2015. Retrieved November 22, 2013.
- ^ Oxford University Press (2013). «Oxford Reference: OVERVIEW cation». oxfordreference.com. Archived from the original on 2017-01-18. Retrieved 2017-01-15.
- ^ Douglas W. Haywick, Ph.D.; University of South Alabama (2007–2008). «Elemental Chemistry» (PDF). usouthal.edu. Archived (PDF) from the original on 2011-12-04. Retrieved 2013-11-22.
- ^ Purdue University (November 21, 2013). «Amino Acids». purdue.edu. Archived from the original on July 13, 2011. Retrieved November 22, 2013.
- ^ Press, Frank; Siever, Raymond (1986). Earth (14th ed.). New York: W. H. Freeman and Company. p. 63. ISBN 0-7167-1743-3. OCLC 12556840.
- ^ Chemical elements listed by ionization energy Archived 2009-03-30 at the Wayback Machine. Lenntech.com
- ^ a b c «Common Ions and Their Charges» (PDF). Science Geek. Archived (PDF) from the original on 2018-02-18. Retrieved 2018-05-11.
В уроке 6 «Простые ионы» из курса «Химия для чайников» познакомимся с простыми ионами и выясним, чему равен его заряд; также рассмотрим как образуется ионная химическая связь; научимся определять степень окисления и валентность элементов. Данный урок очень важный, и чтобы его лучше понять, обязательно просмотрите прошлые уроки, особое внимание уделяя уроку 1 «Схема строения атомов», а также уроку 3 «Схема образования молекул».
Содержание
- Ионная химическая связь
- Положительные и отрицательные ионы
- Степень окисления веществ
- Валентность химических элементов
- Название ионов
Ионная химическая связь
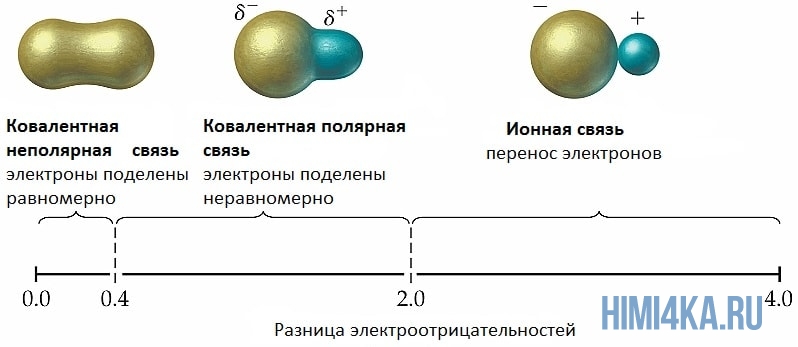
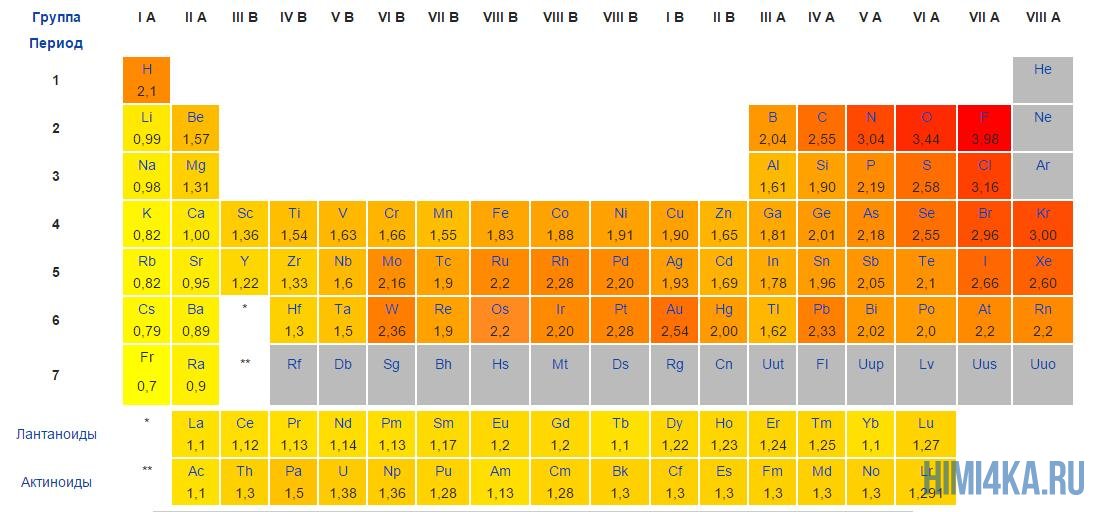
Мы уже кратко рассматривали ковалентную полярную химическую связь, в которой из-за незначительного различия в электроотрицательности атомов (0.4-2.0) электронная пара распределяется между ними не равномерно. Для тех, кто забыл, напоминаю, что электроотрицательность — это способность атомов притягивать к себе электроны.
Однако, если электроотрицательность атомов различается больше чем на 2 по таблице электроотрицательности, то электронная пара полностью переходит к более электроотрицательному атому, и в результате образуется ионная химическая связь. Ионная химическая связь образуется только между атомами типичных металлов (т.к. они легко теряют внешние электроны) и неметаллов (т.к. они обладают большой электроотрицательностью).
Положительные и отрицательные ионы
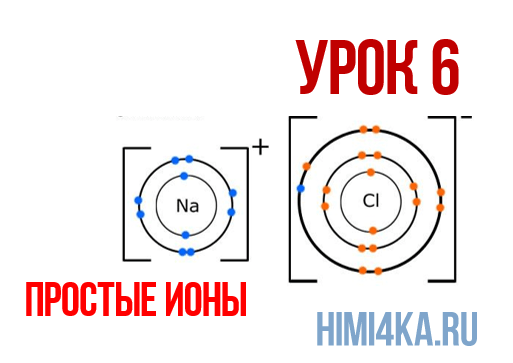
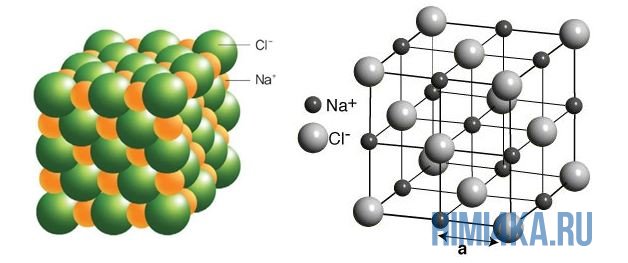
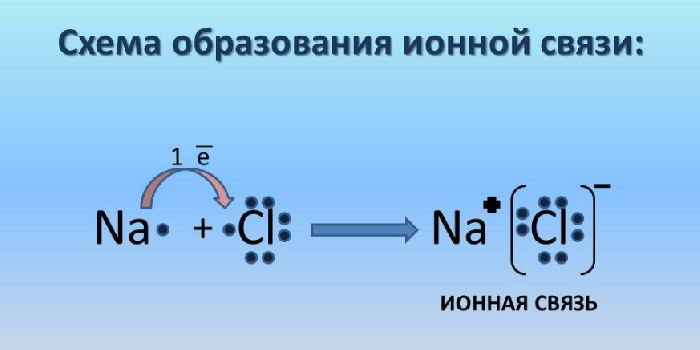
Наглядным примером ионной химической связи может служить обычная поваренная соль NaCl, которая присутствует на каждой кухне. Атомы натрия (и вообще всех металлов) слабо удерживают внешние электроны, тогда как атомы хлора напротив, обладают очень большой способностью притягивать к себе электроны, т.е обладают большой электроотрицательностью.
Поэтому при образовании молекулы NaCl каждый атом Na теряет один электрон (e—), образуя положительный ион натрия Na+, а каждый атом Cl, наоборот, приобретает этот потерянный электрон натрия, образуя отрицательный ион хлора Cl—. Это записывается в виде двух реакций:
- Na → Na+ + e— и ½Cl2 + e— → Cl—
Записать ½Cl2 пришлось потому, что газообразный хлор в природе состоит из двухатомных молекул, а не из свободных одиночных атомов хлора.
На рисунке выше, изображена кристаллическая решетка NaCl, где каждый хлорид-ион Cl— окружен со всех сторон соседними положительными ионами натрия Na+; ионы натрия Na+ точно также окружены ближайшими хлорид-ионами Cl—. Подобное расположение ионов обладает высокой устойчивостью.
Положительно заряженные ионы называются катионами. К ним в основном относятся металлы, так как они легко отдают от одного до трех электронов. Ниже приведены примеры катионов:
Анионами являются неметаллы, поскольку с радостью присоединяют к себе электроны, превращаясь в отрицательно заряженные ионы. Примеры анионов:
Степень окисления веществ
Заряд простого, одноатомного иона, например Mg2+ или F2-, называется его степенью окисления. Степень окисления — это такое число электронов, которое необходимо прибавить (восстановить) к иону или отнять (окислить) у него, чтобы он превратился обратно в нейтральный атом.
- Реакция восстановления: Mg2+ + 2e— → Mg
- Реакция окисления: F2- → F + 2e—
Процесс присоединения электронов к атому или просто их смещение в сторону данного атома называется реакцией восстановления, а оттягивание электронов от атома или их полное удаление называется реакцией окисления. Вот вам отличная шпаргалка со степенями окисления простых ионов:
Пример 12. Окисляется или восстанавливается хлор при образовании хлорид-иона? Какова степень окисления этого иона?
Решение: Хлор восстанавливается, поскольку к каждому атому хлора необходимо присоединить один электрон, чтобы образовался хлорид-ион. Хлорид-ион, Сl—, имеет степень окисления -1.
Пример 13. Окисляются или восстанавливаются металлы при образовании ими ионов? Какова степень окисления иона алюминия?
Решение: При образовании ионов металлов последние окисляются, поскольку при этом происходит удаление электронов от атомов металла. Ион алюминия, Аl3+, имеет степень окисления +3.
Валентность химических элементов
Валентностью называют число химических связей, которые данный атом образует с другими атомами в молекуле. Однако, если говорить простыми словами, то под валентностью понимается все та же степень окисления, но в отличии от нее валентность не имеет знака и не равна нулю.
| Молекулярная формула | Валентность | Степень окисления |
| H2O | H(I), O(II) | H+1, O-2 |
| CS2 | C(IV), S(II) | C+4, S-2 |
| CH4 | C(IV), H(I) | C-4, H+1 |
Название ионов
Ионы металлов, которые имеют различные (переменные) степени окисления, записываются следующим образом:
- Fe2+ железо(II) или ион двухвалентного железа
- Fe3+ железо(III) или ион трехвалентного железа
- Сu+ медь(I) или ион одновалентной меди
- Cu2+ медь (II) или ион двухвалентной меди
- Sn2+ олово(II) или двухвалентного олова
- Sn4+ олово(IV) или ион четырехвалентного олова
Пример 2: Окисление или восстановление происходит при превращении иона трехвалентного железа в ион двухвалентного? Запишите уравнение этого процесса.
Решение: Уравнение реакции имеет следующий вид: Fe3+ + e— → Fe2+. Она представляет собой процесс восстановления, поскольку к исходному иону присоединяется электрон.
Надеюсь урок 6 «Простые ионы» оказался для вас понятным и полезным. Если у вас возникли вопросы, пишите их в комментарии.
Ионы

4.7
Средняя оценка: 4.7
Всего получено оценок: 133.
4.7
Средняя оценка: 4.7
Всего получено оценок: 133.
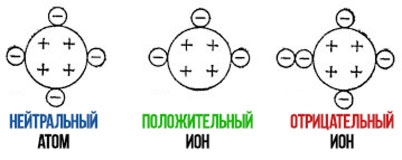
Частица, в которой содержится разное число протонов и электронов, называется ионом. Если количество протонов больше, ион приобретает положительный заряд и становится катионом. Ионы с отрицательным зарядом (преобладают электроны) называются анионами.
Общее описание
Впервые в химии понятие «ион» появилось в 1834 году благодаря экспериментам Майкла Фарадея. Учёный изучал электропроводность водных растворов кислот, солей, щелочей. Он предположил, что возможность проводить электричество обусловлена движением в растворе заряженных частиц – ионов.
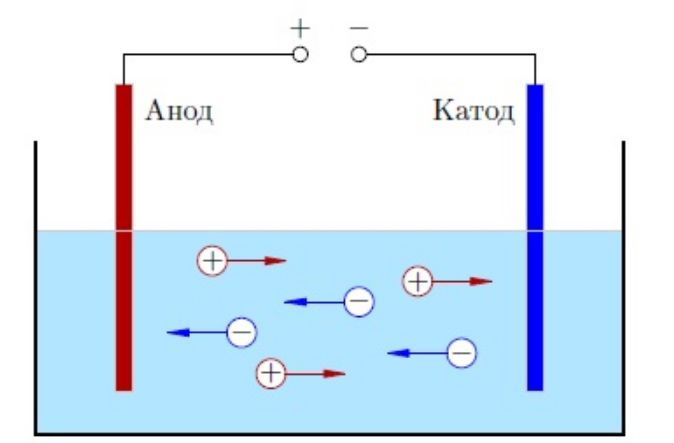
Молекулы способны распадаться на ионы – атомы с недостатком или избытком электроном. Процесс распада называется электролитической диссоциацией, а образованный раствор или расплав – электролитом. Если опустить в раствор электролита электрод, катионы начнут двигаться к катоду – отрицательному полюсу, анионы – к аноду – положительному полюсу. Этим объясняется электропроводность электролитов.
В растворах или в расплавах ионы образуются под действием молекул воды или высокой температуры.
Строение
Ионы состоят из ядра и электронов, движущихся вокруг. Ядро образуют положительно заряженные частицы (протоны) и нейтральные частицы (нейтроны). Количество протонов совпадает с порядковым номером элемента. Количество нейтронов равно значению разницы между относительной атомной массой и количеством протонов.
Электроны располагаются на энергетических уровнях. Количество уровней совпадает с периодом, в котором находится элемент. На внешнем энергетическом уровне находятся валентные электроны, которые могут взаимодействовать с другими атомами. При отдаче валентных электронов атом превращается в катион, при присоединении дополнительного электрона становится анионом.
Например, если к атому хлора присоединить ещё один электрон он станет отрицательно заряженным ионом – анионом. А если у атома натрия отнять один электрон, он станет положительно заряженным ионом – катионом, т.к. количество протонов станет больше, чем отрицательных электронов.
Катионы в уравнениях отмечаются плюсом, а анионы – минусом. Например, Fe2+, Al3+, Na+, F–, Cl–. Цифра означает, сколько электронов отдал или принял атом, став ионом, т.е. показывает степень окисления. Количество катионов или анионов можно посмотреть по таблице растворимости веществ.
Классификация
Ионы делятся на две группы:
- простые или моноатомные – содержат одно ядро, т.е. состоят из одного атома вещества;
- сложные или полиатомные – содержат минимум два ядра, т.е. состоят из двух и более атомов вещества.
К простым ионам относятся катионы и анионы металлов и неметаллов – Na+, Mg2+, Cl–. Сложные ионы образуются при присоединении иона к нейтральным молекулам вещества. Например:
- NH3 + H+ → NH4+;
- BF3 + F– → BF4–.
Катионами являются ионы металлов, водорода, аммония и некоторых других веществ. Анионами являются гидроксид-ион (OH–), ионы кислотных остатков, неметаллов и других веществ.
Некоторые атомы могут становиться катионами или анионами в зависимости от реакции.
Также выделяют ион-радикалы – свободные заряженные частицы, способные присоединять атомы или присоединяться к атомам других веществ. В зависимости от заряда делятся на китионы-радикалы и анионы-радикалы.
Ионная связь – класс соединения ионов. Ионная связь возникает в результате электростатического притяжения анионов и катионов. При этом атом с большей электроотрицательностью притягивает атом с меньшей электроотрицательностью. Ионная связь возникает преимущественно между ионами металлов и неметаллов. Металл всегда отдаёт электроны, т.е. является восстановителем.
Что мы узнали?
Из темы урока узнали, что такое ионы. Атом становится ионом при отщеплении или присоединении электронов. Если электронов становится меньше, то атом приобретает положительный заряд за счёт преобладания протонов и становится катионом. При увеличении количества отрицательно заряженных электронов атом становится анионом. Ионы способны передавать электричество и обязательно присутствуют в электролитах. Между ионами возникает ионная связь за счёт электростатического притяжения отрицательных и положительно заряженных частиц.
Тест по теме
Доска почёта

Чтобы попасть сюда — пройдите тест.
-
Сергей Ефремов
7/10
Оценка доклада
4.7
Средняя оценка: 4.7
Всего получено оценок: 133.
А какая ваша оценка?

Ион
Ион — это заряженная частица, образованная из молекулы или атома путём потери или приобретения одного электрона.
Отсюда следует, что в ионе количество протонов не равно количеству электронов.
После изучения статьи Вы узнаете, какими бывают заряженные частицы, что такое ионы, катионы и анионы, также
Вы сможете по номеру элемента узнать, каким зарядом он может обладать.
Число электронов в ионе
Количество электронов в нейтральном атоме равно количеству протонов в ядре, например, у хрома (24Cr)
24 протона, соответствено, вокруг ядра вращается 24 электрона. Как было рассказано в статье
«электронная конфигурация атома», каждый
электрон двигается по некой орбитали, то есть обладает заданным количеством энергии.
Если ион образован из-за потери электрона, то заряд иона становится положительным (электрон имеет отрицательный
заряд), схема для запоминания:
24Cr — e— = 24Cr + e+ = 24Cr+
24Cr — 3e— = 24Cr + 3e+ = 24Cr3+
Аналогично при присоединении электрона:
24Cr + e— = 24Cr — e+ = 24Cr—
24Cr + 3e— = 24Cr — 3e+ = 24Cr3-
Энергия ионизации
Если электрону сообщить достаточное количество энергии, то электрон «оторвётся» от атома. Чем ближе электрон
к ядру — тем сложнее его отрывать, а значит, больше энергии необходимо передать. Энергия, необходимая для отрыва
электрона, называется энергией ионизации или ионизационный потенциал (I). Значения I затабулированы и могут быть
найдены в различных справочниках.
| # | Элемент | Название | кДж/моль |
|---|---|---|---|
| 1 | H | Водород | 1312 |
| 2 | He | Гелий | 2373 |
| 3 | Li | Литий | 520 |
| 4 | Be | Бериллий | 899.5 |
| 5 | B | Бор | 801 |
| 6 | C | Углерод | 1086 |
| 7 | N | Азот | 1402 |
| 8 | O | Кислород | 1314 |
| 9 | F | Фтор | 1681 |
| 10 | Ne | Неон | 2080.7 |
| 11 | Na | Натрий | 495 |
| 12 | Mg | Магний | 738 |
| 13 | Al | Алюминий | 578 |
| 14 | Si | Кремний | 787 |
| 15 | P | Фосфор | 1012 |
| 16 | S | Сера | 1000 |
| 17 | Cl | Хлор | 1251 |
| 18 | Ar | Аргон | 1520.6 |
| 19 | K | Калий | 418.8 |
| 20 | Ca | Кальций | 590 |
| 21 | Sc | Скандий | 633.1 |
| 22 | Ti | Титан | 658.8 |
| 23 | V | Ванадий | 650.9 |
| 24 | Cr | Хром | 652.9 |
| 25 | Mn | Марганец | 717.3 |
| 26 | Fe | Железо | 762.5 |
| 27 | Co | Кобальт | 760.4 |
| 28 | Ni | Никель | 737.1 |
| 29 | Cu | Медь | 745.5 |
| 30 | Zn | Цинк | 906.4 |
| 31 | Ga | Галлий | 578.8 |
| 32 | Ge | Германий | 762 |
| 33 | As | Мышьяк | 947 |
| 34 | Se | Селен | 941 |
| 35 | Br | Бром | 1142 |
| 36 | Kr | Криптон | 1350.8 |
| 37 | Rb | Рубидий | 403 |
| 38 | Sr | Стронций | 549 |
| 39 | Y | Иттрий | 600 |
| 40 | Zr | Цирконий | 640.1 |
| 41 | Nb | Ниобий | 652.1 |
| 42 | Mo | Молибден | 684.3 |
| 43 | Tc | Технеций | 702 |
| 44 | Ru | Рутений | 710.2 |
| 45 | Rh | Родий | 719.7 |
| 46 | Pd | Палладий | 804.4 |
| 47 | Ag | Серебро | 731 |
| 48 | Cd | Кадмий | 867.8 |
| 49 | In | Индий | 558.3 |
| 50 | Sn | Олово | 709 |
| 51 | Sb | Сурьма | 834 |
| 52 | Te | Теллур | 869 |
| 53 | I | Иод | 1008 |
| 54 | Xe | Ксенон | 1170.4 |
| 55 | Cs | Цезий | 375.7 |
| 56 | Ba | Барий | 503 |
| 57 | La | Лантан | 538.1 |
| 58 | Ce | Церий | 534.4 |
| 59 | Pr | Празеодим | 527 |
| 60 | Nd | Неодим | 533.1 |
| 61 | Pm | Прометий | 540 |
| 62 | Sm | Самарий | 544.5 |
| 63 | Eu | Европий | 547.1 |
| 64 | Gd | Гадолиний | 593.4 |
| 65 | Tb | Тербий | 565.8 |
| 66 | Dy | Диспрозий | 573 |
| 67 | Ho | Гольмий | 581 |
| 68 | Er | Эрбий | 589.3 |
| 69 | Tm | Тулий | 596.7 |
| 70 | Yb | Иттербий | 603.4 |
| 71 | Lu | Лютеций | 523.5 |
| 72 | Hf | Гафний | 658.5 |
| 73 | Ta | Тантал | 761 |
| 74 | W | Вольфрам | 770 |
| 75 | Re | Рений | 760 |
| 76 | Os | Осмий | 840 |
| 77 | Ir | Иридий | 880 |
| 78 | Pt | Платина | 870 |
| 79 | Au | Золото | 890.1 |
| 80 | Hg | Ртуть | 1007.1 |
| 81 | Tl | Таллий | 589.4 |
| 82 | Pb | Свинец | 715.6 |
| 83 | Bi | Висмут | 703 |
| 84 | Po | Полоний | 812.1 |
| 85 | At | Астат | 890 |
| 86 | Rn | Радон | 1037 |
| 87 | Fr | Франций | 380 |
| 88 | Ra | Радий | 509.3 |
| 89 | Ac | Актиний | 499 |
| 90 | Th | Торий | 587 |
| 91 | Pa | Протактиний | 568 |
| 92 | U | Уран | 597.6 |
| 93 | Np | Нептуний | 604.5 |
| 94 | Pu | Плутоний | 584.7 |
| 95 | Am | Америций | 578 |
| 96 | Cm | Кюрий | 581 |
| 97 | Bk | Берклий | 601 |
| 98 | Cf | Калифорний | 608 |
| 99 | Es | Эйнштейний | 619 |
| 100 | Fm | Фермий | 627 |
| 101 | Md | Менделевий | 635 |
| 102 | No | Нобелий | 642 |
| 103 | Lr | Лоуренсий | 470 |
| 104 | Rf | Резерфордий | 580 |
| Таблица 1. Энергия ионизации, справочные данные |
Энергия сродства электрону
Также электроны могут присоединяться к атому, в процессе присоединения электрон выделяет энергию, такая энергия
называется энергией сродства электрону, для каждого электрона конкретного атома энергия сродства численно равна
и противоположна по знаку энергии ионизации, например, 17Cl, что бы оторвать 17й электрон у атома
хлора, необходимо сообщить ему 13 эВ, любой другой электрон, который присоединится на место 17го электрона
также выделит 13 эВ.
Катионы и анионы
Атомы, в которых количество протонов не равно количеству электронов называются ионами, поскольку электрон имеет
отрицательный заряд, то если электронов больше протонов, то суммарный заряд отрицательный: S2-
означает, что в данном атоме серы количество электронов больше чем протонов на два электрона. Соответственно,
если электронов меньше чем протонов, то суммарный заряд положительный и обозначается H+.
Отрицательно заряженные атомы называются анионами, положительно заряженные атомы — катионами.
Какой заряд будет у атома?
Теоретически возможно отобрать все электроны у атома, но это возможно только в лабораторных условиях и за
пределами лаборатории атомы в таком состоянии находиться не будут, почему?
Вернёмся к устройству электронной оболочки. Вокруг атома электроны сгруппированы по энергетическим уровням,
каждый заполненный уровень экранирует ядро и является более стабильным, нежели не до конца заполненный
уровень. То есть электронная конфигурация стремиться к состоянию заполненного подуровня: если на p-оболочке
находится 5 электронов, то вероятнее атом примет один электрон, нежели отдаст пять. Так, например, у атома
хлора, пять электронов на 3p-подуровне, энергия сродства хлора — 3.61 эВ, энергия ионизации — 13 эВ. У натрия
на последнем подуровне один электрон, энергия сродства — 0,78 эВ, потенциал ионизации — 0,49 эВ, поэтому
вероятнее натрий отдаст один электрон, нежели примет его.
Зная потенциал ионизации и энергию сродства мы можем сделать предположение о взаимодействии веществ. Если
смешать натрий и хлор, и сообщить им энергию, то вероятнее всего Na будет отдавать один электрон Cl и
в результате получится смесь ионов Na+ и Cl—.
Пример
Так можно по номеру элемента предположить, какой заряд он будет иметь, например, 19й элемент, электронная
конфигурация — 1s 22s 22p 63s 23p64s 1,
вероятнее всего, такой элемент может либо отдать, либо принять один электрон.
У 27го элемента электронная конфигурация выглядит так:
1s 22s 22p 63s 23p64s 23d7,
у d-подуровня всего может быть 10 атомов, т.е. либо атом примет 1,2 или 3 электрона, либо отдаст
1,2,3…7 электронов, так, вероятнее, он примет 3, т.е. возможные состояния — это +1, +2 и +3,
Теперь Вы знаете, что такое ионы, осталось изучить химическую связи и Вы сможете составлять
окислительно-восстановительные реакции!
Вам понравилась статья?
/
Просмотров: 11 868
Атом или молекула, в которых общее количество электронов не равно общему количеству протонов, что дает атому или молекуле чистый положительный результат или отрицательный электрический заряд.
Ион () — это атом или молекула, имеющая нетто электрический заряд. Поскольку заряд электрона (считающийся отрицательным по традиции) равен заряду протона (считающемуся положительным по соглашению) и противоположен ему, суммарный заряд иона отличен от нуля из-за его общего числа электронов не равно его общему количеству протонов. катион представляет собой положительно заряженный ион с меньшим количеством электронов, чем протонов, в то время как анион заряжен отрицательно, с большим количеством электронов, чем протонов. Из-за своих противоположных электрических зарядов катионы и анионы притягиваются друг к другу и легко образуют ионные соединения.
Ионы, состоящие только из одного атома, называются атомарными или одноатомными ионами, в то время как два или более атомов образуют молекулярные ионы или многоатомные ионы. В случае физической ионизации в жидкости (газе или жидкости) «ионные пары» создаются спонтанными столкновениями молекул, где каждая сгенерированная пара состоит из свободного электрона и положительного иона. Ионы также создаются химическими взаимодействиями, такими как растворение соли в жидкостях, или другими способами, такими как пропускание постоянного тока через проводящий раствор, растворение анод посредством ионизации.
Содержание
- 1 История открытия
- 2 Характеристики
- 2.1 Анионы и катионы
- 2.2 Природные явления
- 3 Сопутствующие технологии
- 3.1 Обнаружение ионизирующего излучения
- 4 Химия
- 4.1 Обозначение заряженного состояния
- 4.2 Подклассы
- 4.3 Образование
- 4.3.1 Образование одноатомных ионов
- 4.3.2 Образование многоатомных и молекулярных ионов
- 4.3.3 Потенциал ионизации
- 4.4 Ионная связь
- 4.5 Общие ионы
- 5 См. Также
- 6 Ссылки
История открытия
Слово ион происходит от греческого слово ἰόν, ion, «идущий», причастие настоящего слова ναι, ienai, «идти». Этот термин был введен (после предложения английского полимата Уильяма Уэвелла ) английским физиком и химиком Майклом Фарадеем в 1834 году для неизвестных тогда видов, от одного электрода к другому через водную среду. Фарадей не знал природы этих видов, но он знал, что, поскольку металлы растворяются и входят в раствор на одном электроде, а новый металл выходит из раствора на другом электроде; что какое-то вещество прошло сквозь раствор в токе. Это переносит материю из одного места в другое. В переписке с Фарадеем Уэвелл также придумал слова анод и катод, а также анион и катион как ионы, которые притягиваются к соответствующим электродам.
Сванте Аррениус выдвинул в своей диссертации 1884 г. свое объяснение того факта, что твердые кристаллические соли диссоциируют на парные заряженные частицы при растворении, за что он получил Нобелевскую премию по химии 1903 года. Объяснение Аррениуса заключалось в том, что при образовании раствора соль диссоциирует на ионы Фарадея. Аррениус предположил, что ионы образуются даже в отсутствие электрического тока.
Характеристики
Ионы в своем газообразном состоянии обладают высокой реакционной способностью и будут быстро взаимодействовать с ионами противоположного заряда, давая нейтральные молекулы. или ионные соли. Ионы также образуются в жидком или твердом состоянии, когда соли взаимодействуют с растворителями (например, водой) с образованием сольватированных ионов, которые более стабильны по причинам, связанным с комбинацией энергии и энтропии изменяется, когда ионы удаляются друг от друга, чтобы взаимодействовать с жидкостью. Эти стабилизированные виды чаще встречаются в окружающей среде при низких температурах. Типичным примером являются ионы, присутствующие в морской воде, полученные из растворенных солей.
Будучи заряженными объектами, ионы притягиваются к противоположным электрическим зарядам (от положительного к отрицательному и наоборот) и отталкиваются одинаковыми зарядами. Когда они движутся, их траектории могут отклоняться магнитным полем.
Электроны из-за их меньшей массы и, следовательно, большей способности заполнять пространство, как волны материи, определяют размер атомов и молекул. которые вообще имеют какие-либо электроны. Таким образом, анионы (отрицательно заряженные ионы) больше, чем исходная молекула или атом, поскольку избыточный электрон (ы) отталкивает друг друга и увеличивает физический размер иона, поскольку его размер определяется его электронным облаком. Катионы меньше соответствующего родительского атома или молекулы из-за меньшего размера электронного облака. Один конкретный катион (катион водорода) не содержит электронов и, следовательно, состоит из одного протона — намного меньше, чем родительский атом водорода.
Анионы и катионы

Поскольку электрический заряд на протоне по величине равен заряду электрона, чистый электрический заряд на ионе равен количеству протонов в ионе минус количество электронов.
Анион (-) (), от греческого слова ἄνω (ánō), означающего «вверх», представляет собой ион с большим количеством электронов, чем протонов, поэтому чистый отрицательный заряд (поскольку электроны заряжены отрицательно, а протоны заряжены положительно).
Катион (+) (), от греческого слова κάτω (káto), что означает «вниз», это ион с меньшим количеством электронов, чем протонов, что придает ему положительный заряд.
Для ионов с несколькими зарядами используются дополнительные названия. Например, ион с зарядом -2 известен как дианион, а ион с зарядом +2 известен как дикатион. цвиттерион представляет собой нейтральную молекулу с положительными и отрицательными зарядами в разных местах внутри этой молекулы.
Катионы и анионы измеряются по их ионному радиусу, и они различаются относительным размер: «Катионы маленькие, большинство из них менее 10 м (10 см) в радиусе. Но большинство анионов имеют большие размеры, как и самый распространенный анион Земли, кислород. Из этого факта очевидно, что большая часть пространства кристалла занята анионом, и катионы помещаются в промежутки между ними ».
Термины анион и катион (для ионов, которые, соответственно, перемещаются к аноду и катод во время электролиза) были введены Майклом Фарадеем в 1834 году..
Природные явления
Ионы повсеместно встречаются в природе и ответственны за различные явления, от люминесценции Солнца до существование ионосферы Земли . Атомы в ионном состоянии могут иметь цвет, отличный от нейтральных атомов, и, таким образом, поглощение света ионами металлов дает цвет драгоценных камней. Как в неорганической, так и в органической химии (включая биохимию) взаимодействие воды и ионов чрезвычайно важно; Примером является энергия, которая управляет распадом аденозинтрифосфата (АТФ ). В следующих разделах описываются контексты, в которых ионы занимают видное место; они расположены в убывающем физическом масштабе, от астрономического до микроскопического.
Родственная технология
Ионы могут быть получены нехимическим способом с использованием различных источников ионов, обычно с использованием высокого напряжения или температуры. Они используются во множестве устройств, таких как масс-спектрометры, оптические эмиссионные спектрометры, ускорители частиц, ионные имплантеры и <74.>ионные двигатели.
В качестве реактивных заряженных частиц они также используются в очистке воздуха путем уничтожения микробов, а также в таких предметах домашнего обихода, как детекторы дыма.
для контроля передачи сигналов и метаболизма в организмах за счет точного ионного градиента через мембраны нарушение этого градиента способствует гибели клеток. Это обычный механизм, используемый естественными и искусственными биоцидами, включая ионные каналы грамицидин и амфотерицин (фунгицид ).
Неорганические растворенные ионы являются компонентом общего количества растворенных твердых веществ, широко известного показателя качества воды.
Обнаружение ионизирующего излучения


Ионизирующее воздействие излучения на газ широко используется для обнаружения излучения, такого как альфа, бета, гамма и рентгеновские лучи. Исходный акт ионизации в этих приборах приводит к образованию «ионной пары»; положительный ион и свободный электрон в результате воздействия излучения на молекулы газа. Ионизационная камера является простейшим из этих детекторов и собирает все заряды, создаваемые прямой ионизацией в газе посредством приложения электрического поля.
Трубка Гейгера – Мюллера и пропорциональный счетчик оба используют явление, известное как лавина Таунсенда, чтобы умножить эффект первоначального ионизирующего события посредством каскадного эффекта, при котором свободным электронам дается достаточно энергия электрического поля для высвобождения дополнительных электронов ионным ударом.
Химия
Обозначение заряженного состояния

При записи химической формулы для иона его суммарный заряд записывается в верхнем индексе сразу после химической структуры молекулы / атома. Сумма нетто-заряда указывается перед знаком; то есть двухзарядный катион обозначен как 2+ вместо +2 . Однако для однозарядных молекул / атомов величина заряда опускается; например, катион натрия обозначается как Na, а не Na.
Альтернативный (и приемлемый) способ показать молекулу / атом с несколькими зарядами — это нарисовать знаки несколько раз, это часто наблюдается с переходными металлами. Химики иногда обводят знак; это просто орнамент и не меняет химического значения. Таким образом, все три представления Fe., Fe и Fe, показанные на рисунке, эквивалентны.

Одноатомные ионы иногда также обозначаются римскими цифрами, особенно в спектроскопии ; например, приведенный выше пример Fe. иногда упоминается как Fe (Ⅲ) или Fe, где римская цифра Ⅰ означает нейтральное состояние, а все ионизации на одну цифру больше стандартного числа. Римская цифра обозначает формальную степень окисления элемента, тогда как индо-арабские цифры с индексом обозначают чистый заряд. Таким образом, эти два обозначения можно заменить на одноатомные ионы, но римские цифры нельзя применять к многоатомным ионам. Однако можно смешивать обозначения для отдельного металлического центра с многоатомным комплексом, как показано на примере иона уранила.
Подклассы
Если ион содержит неспаренные электроны, он называется радикальным ионом. Ионы-радикалы, как и незаряженные радикалы, очень реактивны. Многоатомные ионы, содержащие кислород, такие как карбонат и сульфат, называются оксианионами. Молекулярные ионы, которые содержат по крайней мере одну связь углерода с водородом, называются органическими ионами. Если заряд в органическом ионе формально центрирован на углероде, он называется карбокатионом (если заряжен положительно) или карбанионом (если заряжен отрицательно).
Образование
Образование одноатомных ионов
Одноатомные ионы образуются за счет усиления или потери электронов на валентной оболочке (крайний электронный оболочка) в атоме. Внутренние оболочки атома заполнены электронами, которые прочно связаны с положительно заряженным атомным ядром и поэтому не участвуют в таком химическом взаимодействии. Процесс получения или потери электронов нейтральным атомом или молекулой называется ионизацией.
Атомы можно ионизировать путем бомбардировки излучением, но более обычный процесс ионизации, встречающийся в химии, — это перенос электронов между атомами или молекулами. Этот переход обычно обусловлен достижением стабильных («закрытых») электронных конфигураций. Атомы будут получать или терять электроны в зависимости от того, какое действие требует наименьшей энергии.
Например, атом натрия, Na, имеет один электрон в своей валентной оболочке, окружающий 2 стабильные заполненные внутренние оболочки из 2 и 8 электронов. Поскольку эти заполненные оболочки очень стабильны, атом натрия имеет тенденцию терять свой лишний электрон и достигать этой стабильной конфигурации, становясь катионом натрия в процессе
- Na → Na. +. e.
С другой стороны, хлор атом, Cl, имеет 7 электронов в валентной оболочке, что на один меньше стабильной заполненной оболочки с 8 электронами. Таким образом, атом хлора имеет тенденцию приобретать дополнительный электрон и достигать стабильной 8-электронной конфигурации, становясь в процессе хлорид-анионом:
- Cl +. e. → Cl.
Эта движущая сила является причиной натрия и хлора. пройти химическую реакцию, в которой «лишний» электрон передается от натрия к хлору, образуя катионы натрия и анионы хлора. Будучи противоположно заряженными, эти катионы и анионы образуют ионные связи и объединяются с образованием хлорида натрия, NaCl, более известного как поваренная соль.
- Na. + Cl. → NaCl
Образование многоатомных и молекулярных ионов

Многоатомные и молекулярные ионы часто образуются в результате приобретения или потери элементарных ионов, таких как протон, H., в нейтральных молекулах. Например, когда аммиак, NH. 3, принимает протон, H. — процесс, называемый протонированием — он образует ион аммония, NH. 4. Аммиак и аммоний имеют одинаковое количество электронов в по существу одинаковой электронной конфигурации, но у аммония есть дополнительный протон, который придает ему чистый положительный заряд.
Аммиак также может потерять электрон, чтобы получить положительный заряд, образуя ион NH. 3. Однако этот ион нестабилен, поскольку он имеет неполную валентную оболочку вокруг атома азота, что делает его очень реакционноспособным радикальным ионом.
Из-за нестабильности ион-радикалов многоатомные и молекулярные ионы обычно образуются за счет приобретения или потери элементарных ионов, таких как H., а не за счет приобретения или потери электронов. Это позволяет молекуле сохранять свою стабильную электронную конфигурацию, приобретая электрический заряд.
Потенциал ионизации
энергия, необходимая для отделения электрона в его самом низком энергетическом состоянии от атома или молекулы газа с меньшим суммарным электрическим зарядом, называется потенциалом ионизации., или энергия ионизации. Энергия n-й ионизации атома — это энергия, необходимая для отделения его n-го электрона после того, как первые n — 1 электронов уже были отделены.
Каждая последующая энергия ионизации заметно больше предыдущей. Особенно большое увеличение происходит после того, как любой заданный блок атомных орбиталей исчерпывается электронами. По этой причине ионы имеют тенденцию формироваться таким образом, чтобы у них оставались полные орбитальные блоки. Например, натрий имеет один валентный электрон в своей внешней оболочке, поэтому в ионизированной форме он обычно встречается с одним потерянным электроном, как Na.. С другой стороны периодической таблицы, хлор имеет семь валентных электронов, поэтому в ионизированной форме он обычно встречается с одним приобретенным электроном, как Cl.. У цезия самая низкая измеренная энергия ионизации из всех элементов, а у гелия — самая большая. В общем, энергия ионизации металлов намного ниже, чем энергия ионизации неметаллов, поэтому, как правило, металлы теряют электроны с образованием положительно заряженных ионов, а неметаллы получают электроны с образованием отрицательно заряженных ионов.
Ионная связь
Ионная связь — это разновидность химической связи, которая возникает из-за взаимного притяжения противоположно заряженных ионов. Ионы с одинаковым зарядом отталкиваются друг от друга, а ионы с противоположным зарядом притягиваются друг к другу. Следовательно, ионы обычно не существуют сами по себе, но будут связываться с ионами противоположного заряда, образуя кристаллическую решетку . Полученное соединение называется ионным соединением и, как говорят, удерживается вместе за счет ионной связи. В ионных соединениях возникают характерные расстояния между соседними ионами, из которых можно определить пространственную протяженность и ионный радиус отдельных ионов.
Наиболее распространенный тип ионной связи наблюдается в соединениях металлов и неметаллов (кроме благородных газов, которые редко образуют химические соединения). Металлы характеризуются небольшим количеством электронов, превышающим стабильную электронную конфигурацию с замкнутой оболочкой. Таким образом, они имеют тенденцию терять эти лишние электроны для достижения стабильной конфигурации. Это свойство известно как электроположительность. Неметаллы, с другой стороны, характеризуются наличием электронной конфигурации всего на несколько электронов от стабильной конфигурации. Таким образом, они имеют тенденцию получать больше электронов, чтобы достичь стабильной конфигурации. Эта тенденция известна как электроотрицательность. Когда сильно электроположительный металл сочетается с сильно электроотрицательным неметаллом, лишние электроны от атомов металла передаются электронно-дефицитным атомам неметалла. В результате этой реакции образуются катионы металлов и анионы неметаллов, которые притягиваются друг к другу, образуя соль.
Обычные ионы
Обычные катионы
|
Обычные анионы
|
См. Также
- Ионизатор воздуха
- Aurora
- Электролит
- Детекторы газовой ионизации
- Ioliomics
- Ion луч
- Ионный обмен
- Ионизирующее излучение
- Тормозная способность радиационных частиц
Ссылки
ионы
- ионы
- ио́ны
(от греч. iōn — идущий), заряженные частицы, образующиеся из атома (молекулы) в результате потери или присоединения одного или нескольких электронов. В растворах положительно заряженные ионы называются катионами, отрицательно заряженные ионы — анионами. Термин предложен М. Фарадеем в 1834.
* * *
ИОНЫ
ИО́НЫ (от греч. ion — идущий), электрически заряженные частицы, образующиеся в результате потери или присоединения одного или нескольких электронов (см. ЭЛЕКТРОН (частица)) (или других заряженных частиц) к атому, молекуле, радикалу или другому иону. Положительно заряженные ионы называются катионами (см. КАТИОН), отрицательно заряженные ионы — анионами (см. АНИОН). Термин предложен М. Фарадеем (см. ФАРАДЕЙ Майкл) в 1834 г.
Ионы обозначают химическим символом с индексом, расположенным вверху справа. Индекс указывает знак и величину заряда, т. е. кратность иона, в единицах заряда электрона. При потере или приобретении атомом 1, 2, 3… электронов образуются, соответственно, одно-, двух- и трЕхзарядные ионы (см. Ионизация (см. ИОНИЗАЦИЯ)), например Na+, Ca2+, Al3+, Cl—, SO42-.
Атомные ионы обозначают также химическим символом элемента с римскими цифрами, указывающими кратность иона, в этом случае римские цифры являются спектроскопическими символами и их значение больше величины заряда на единицу, т. е. NI означает нейтральный атом N, обозначение иона NII означает однократно заряженный ион N+, NIII означает N2+.
Последовательность ионов различных химических элементов, содержащих одинаковое число электронов, образует изоэлектронный ряд.
Ионы могут входить в состав молекул веществ, образуя молекулы благодаря ионной связи (см. ИОННАЯ СВЯЗЬ). В виде самостоятельных частиц, в несвязанном состоянии, ионы встречаются во всех агрегатных состояниях вещества — в газах (в частности, в атмосфере), в жидкостях (в расплавах и в растворах), в кристаллах. В жидкостях, в зависимости от природы растворителя и растворенного вещества, ионы могут существовать бесконечно долго, например, ион Na+ в водном растворе поваренной соли NaCl. Соли в твердом состоянии обычно образуют ионные кристаллы (см. ИОННЫЕ КРИСТАЛЛЫ). Кристаллическая решетка металлов состоит из положительно заряженных ионов, внутри которой находится «электронный газ». Энергия взаимодействия атомных ионов может быть вычислена с помощью различных приближенных методов, учитывающих межатомное взаимодействие (см. МЕЖАТОМНОЕ ВЗАИМОДЕЙСТВИЕ).
Образование ионов происходит в процессе ионизации. Для удаления электрона из нейтрального атома или молекулы необходимо затратить определенную энергию, которая называется энергией ионизации. Энергия ионизации, отнесенная к заряду электрона, называется ионизационным потенциалом. Сродство к электрону — характеристика, противоположная энергии ионизации, и показывает величину энергии связи дополнительного электрона в отрицательном ионе.
Нейтральные атомы и молекулы ионизируются под действием квантов оптического излучения, рентгеновского и g-излучения, электрического поля при столкновении с другими атомами, частицами и т. д.
В газах ионы образуются в основном под действием ударов частиц большой энергии или при фотоионизации под действием ультрафиолетовых, рентгеновских и g-лучей (см. Ионизирующие излучения (см. ИОНИЗИРУЮЩИЕ ИЗЛУЧЕНИЯ)). Образовавшиеся таким путем ионы в обычных условиях недолговечны. При высокой температуре ионизация атомов и ионов (термическая ионизация, т. е. термическая диссоциация с отделением электрона) может происходить также как равновесный процесс (см. РАВНОВЕСНЫЙ ПРОЦЕСС), в котором степень ионизации возрастает с повышением температуры и с понижением давления. Газ переходит при этом в состояние плазмы (см. ПЛАЗМА).
Ионы в газах играют большую роль во многих явлениях. В природных условиях ионы образуются в воздухе под действием космических лучей, солнечного излучения или электрического разряда (молнии). Присутствие ионов, их вид и концентрация влияют на многие физические свойства воздуха, на его физиологическую активность.
Энциклопедический словарь.
2009.
Полезное
Смотреть что такое «ионы» в других словарях:
-
ИОНЫ — (от греч. ion идущий,странствующий), атомы или хим. радикалы, несущие электрические заряды. И с т о р и я. Как установил впервые Фарадей (Faraday), проведение электрического тока в растворах связано с передвижением материальных частиц, несущих… … Большая медицинская энциклопедия
-
ИОНЫ — ИОНЫ, электрически заряженные частицы, образующиеся из атома (молекулы) в результате потери или присоединения одного или нескольких электронов. Положительно заряженные ионы называются катионами, отрицательно заряженные ионы анионами … Современная энциклопедия
-
ионы — – электрически заряженные атомы или молекулы. Общая химия : учебник / А. В. Жолнин [1] Ионы – электрически заряженные частицы, возникающие при потере или присоединении электронов атомами, молекулами и радикалами. Словарь по аналитической химии… … Химические термины
-
ИОНЫ — Продукты разложения какого либо тела при посредстве электролиза. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910 … Словарь иностранных слов русского языка
-
Ионы — Ион (греч. ιόν «идущий») электрически заряженная частица (атом, молекула), образующаяся, обычно[1], в результате потери или присоединения одного или нескольких электронов атомами или молекулами. Заряд иона кратен заряду электрона. Понятие и… … Википедия
-
Ионы — [ions] (от греческого ion идущий) электрически заряженные частицы, образующиеся при потере или присоединении электронов (или других заряженных частиц) атомами или группами атомов (молекулы, радикалы и др.). Понятие и термин ионы ввел в 1834 г.… … Энциклопедический словарь по металлургии
-
ИОНЫ — (от греч. идущий), одноатомные или многоатомные частицы, несущие электрич. заряд, напр. Н +, Li+, Аl3+, NH4+, F , SO42 . Положительные И. называют катионами (от греч. kation, буквально идущий вниз), отрицательные а н и о н а м и (от греч. anion,… … Химическая энциклопедия
-
Ионы — (от греч. ión идущий) электрически заряженные частицы, образующиеся при потере или присоединении электронов (или других заряженных частиц) атомами или группами атомов. Такими группами атомов могут быть молекулы, радикалы или другие И.… … Большая советская энциклопедия
-
ионы — физ. частицы, несущие положительный или отрицательный заряд. Положительно заряженные ионы несут меньше электронов, чем положено , а отрицательные больше … Универсальный дополнительный практический толковый словарь И. Мостицкого
-
Ионы пророка книга — см. Книга пророка Ионы … Библейская энциклопедия Брокгауза