Not to be confused with Sodium bicarbonate (baking soda), a similar compound.

|
|

|
|
| Names | |
|---|---|
| IUPAC name
Sodium carbonate |
|
| Preferred IUPAC name
Disodium carbonate |
|
| Other names
Soda ash, washing soda, soda crystals, sodium trioxocarbonate |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChEBI |
|
| ChEMBL |
|
| ChemSpider |
|
| ECHA InfoCard | 100.007.127 |
| EC Number |
|
| E number | E500(i) (acidity regulators, …) |
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
Na2CO3 |
| Molar mass | 105.9888 g/mol (anhydrous) 286.1416 g/mol (decahydrate) |
| Appearance | White solid, hygroscopic |
| Odor | Odorless |
| Density |
|
| Melting point | 851 °C (1,564 °F; 1,124 K) (Anhydrous) 100 °C (212 °F; 373 K) decomposes (monohydrate) 33.5 °C (92.3 °F; 306.6 K) decomposes (heptahydrate) 34 °C (93 °F; 307 K) (decahydrate)[2][7] |
|
Solubility in water |
Anhydrous, g/100 mL:
|
| Solubility | Soluble in aq. alkalis,[3] glycerol Slightly soluble in aq. alcohol Insoluble in CS2, acetone, alkyl acetates, alcohol, benzonitrile, liquid ammonia[4] |
| Solubility in glycerine | 98.3 g/100 g (155 °C)[4] |
| Solubility in ethanediol | 3.46 g/100 g (20 °C)[5] |
| Solubility in dimethylformamide | 0.5 g/kg[5] |
| Acidity (pKa) | 10.33 [6] |
|
Magnetic susceptibility (χ) |
−4.1·10−5 cm3/mol[2] |
|
Refractive index (nD) |
1.485 (anhydrous) 1.420 (monohydrate)[7] 1.405 (decahydrate) |
| Viscosity | 3.4 cP (887 °C)[5] |
| Structure | |
|
Crystal structure |
Monoclinic (γ-form, β-form, δ-form, anhydrous)[8] Orthorhombic (monohydrate, heptahydrate)[1][9] |
|
Space group |
C2/m, No. 12 (γ-form, anhydrous, 170 K) C2/m, No. 12 (β-form, anhydrous, 628 K) P21/n, No. 14 (δ-form, anhydrous, 110 K)[8] Pca21, No. 29 (monohydrate)[1] Pbca, No. 61 (heptahydrate)[9] |
|
Point group |
2/m (γ-form, β-form, δ-form, anhydrous)[8] mm2 (monohydrate)[1] 2/m 2/m 2/m (heptahydrate)[9] |
|
Lattice constant |
a = 8.920(7) Å, b = 5.245(5) Å, c = 6.050(5) Å (γ-form, anhydrous, 295 K)[8] α = 90°, β = 101.35(8)°, γ = 90° |
|
Coordination geometry |
Octahedral (Na+, anhydrous) |
| Thermochemistry | |
|
Heat capacity (C) |
112.3 J/mol·K[2] |
|
Std molar |
135 J/mol·K[2] |
|
Std enthalpy of |
−1130.7 kJ/mol[2][5] |
|
Gibbs free energy (ΔfG⦵) |
−1044.4 kJ/mol[2] |
| Hazards | |
| Occupational safety and health (OHS/OSH): | |
|
Main hazards |
Irritant |
| GHS labelling: | |
|
Pictograms |
 [10] [10]
|
|
Signal word |
Warning |
|
Hazard statements |
H319[10] |
|
Precautionary statements |
P305+P351+P338[10] |
| NFPA 704 (fire diamond) |
[12] 2 0 0 |
| Lethal dose or concentration (LD, LC): | |
|
LD50 (median dose) |
4090 mg/kg (rat, oral)[11] |
| Safety data sheet (SDS) | MSDS |
| Related compounds | |
|
Other anions |
Sodium bicarbonate |
|
Other cations |
Lithium carbonate Potassium carbonate Rubidium carbonate Cesium carbonate |
|
Related compounds |
Sodium sesquicarbonate Sodium percarbonate |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
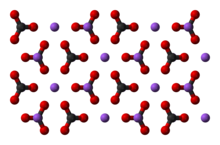
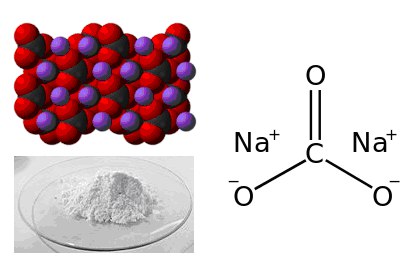
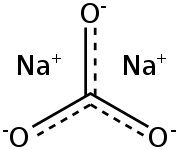
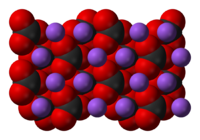
Sodium carbonate, Na2CO3, (also known as washing soda, soda ash and soda crystals) is the inorganic compound with the formula Na2CO3 and its various hydrates. All forms are white, odourless, water-soluble salts that yield moderately alkaline solutions in water. Historically, it was extracted from the ashes of plants growing in sodium-rich soils. Because the ashes of these sodium-rich plants were noticeably different from ashes of wood (once used to produce potash), sodium carbonate became known as «soda ash».[13] It is produced in large quantities from sodium chloride and limestone by the Solvay process.
Hydrates[edit]
Sodium carbonate is obtained as three hydrates and as the anhydrous salt:
- sodium carbonate decahydrate (natron), Na2CO3·10H2O, which readily effloresces to form the monohydrate.
- sodium carbonate heptahydrate (not known in mineral form), Na2CO3·7H2O.
- sodium carbonate monohydrate (thermonatrite), Na2CO3·H2O. Also known as crystal carbonate.
- anhydrous sodium carbonate (natrite), also known as calcined soda, is formed by heating the hydrates. It is also formed when sodium hydrogencarbonate is heated (calcined) e.g. in the final step of the Solvay process.
The decahydrate is formed from water solutions crystallizing in the temperature range −2.1 to +32.0 °C, the heptahydrate in the narrow range 32.0 to 35.4 °C and above this temperature the monohydrate forms.[14] In dry air the decahydrate and heptahydrate lose water to give the monohydrate. Other hydrates have been reported, e.g. with 2.5 units of water per sodium carbonate unit («pentahemihydrate»).[15]
Washing soda[edit]
Sodium carbonate decahydrate (Na2CO3·10H2O), also known as washing soda, is the most common hydrate of sodium carbonate containing 10 molecules of water of crystallization. Soda ash is dissolved in water and crystallized to get washing soda.
- It is white crystalline solid;
- It is one of the few metal carbonates which are soluble in water;
- It is alkaline; it turns red litmus to blue;
- It has detergent properties through the process of saponification which makes fats and grease water-miscible.
Applications[edit]
Some common applications of sodium carbonate include:
- As a cleansing agent for domestic purposes like washing clothes. Sodium carbonate is a component of many dry soap powders.
- It is used for removing temporary and permanent hardness of water.[16] (see water softening).
- It is used in the manufacture of glass, soap and paper. (see glass manufacture)
- It is used in the manufacture of sodium compounds like borax.
Glass manufacture[edit]
Sodium carbonate serves as a flux for silica (SiO2, melting point 1,713 °C), lowering the melting point of the mixture to something achievable without special materials. This «soda glass» is mildly water-soluble, so some calcium carbonate is added to the melt mixture to make the glass insoluble. Bottle and window glass («soda-lime glass» with transistion temperature ~570 °C) is made by melting such mixtures of sodium carbonate, calcium carbonate, and silica sand (silicon dioxide (SiO2)). When these materials are heated, the carbonates release carbon dioxide. In this way, sodium carbonate is a source of sodium oxide. Soda-lime glass has been the most common form of glass for centuries. It is also a key input for tableware glass manufacturing.[17]
Water softening[edit]
Hard water contains dissolved compounds, usually calcium or magnesium compounds. Sodium carbonate is used for removing temporary and permanent hardness of water.[16]
As sodium carbonate is water-soluble and magnesium carbonate and calcium carbonate are insoluble, the former is used to soften water by removing Mg2+ and Ca2+. These ions form insoluble solid precipitates upon treatment with carbonate ions:
Similarly, 
The water is softened because it no longer contains dissolved calcium ions and magnesium ions.[16]
Food additive and cooking[edit]
Sodium carbonate has several uses in cuisine, largely because it is a stronger base than baking soda (sodium bicarbonate) but weaker than lye (which may refer to sodium hydroxide or, less commonly, potassium hydroxide). Alkalinity affects gluten production in kneaded doughs, and also improves browning by reducing the temperature at which the Maillard reaction occurs. To take advantage of the former effect, sodium carbonate is therefore one of the components of kansui (かん水), a solution of alkaline salts used to give Japanese ramen noodles their characteristic flavor and chewy texture; a similar solution is used in Chinese cuisine to make lamian, for similar reasons. Cantonese bakers similarly use sodium carbonate as a substitute for lye-water to give moon cakes their characteristic texture and improve browning. In German cuisine (and Central European cuisine more broadly), breads such as pretzels and lye rolls traditionally treated with lye to improve browning can be treated instead with sodium carbonate; sodium carbonate does not produce quite as strong a browning as lye, but is much safer and easier to work with.[18]
Sodium carbonate is used in the production of sherbet powder. The cooling and fizzing sensation results from the endothermic reaction between sodium carbonate and a weak acid, commonly citric acid, releasing carbon dioxide gas, which occurs when the sherbet is moistened by saliva.
Sodium carbonate also finds use in food industry as a food additive (E500) as an acidity regulator, anticaking agent, raising agent, and stabilizer. It is also used in the production of snus to stabilize the pH of the final product.
While it is less likely to cause chemical burns than lye, care must still be taken when working with sodium carbonate in the kitchen, as it is corrosive to aluminum cookware, utensils, and foil.[19]
Other applications[edit]
Sodium carbonate is also used as a relatively strong base in various fields. As a common alkali, it is preferred in many chemical processes because it is cheaper than sodium hydroxide and far safer to handle. Its mildness especially recommends its use in domestic applications.
For example, it is used as a pH regulator to maintain stable alkaline conditions necessary for the action of the majority of photographic film developing agents. It is also a common additive in swimming pools and aquarium water to maintain a desired pH and carbonate hardness (KH). In dyeing with fiber-reactive dyes, sodium carbonate (often under a name such as soda ash fixative or soda ash activator) is used to ensure proper chemical bonding of the dye with cellulose (plant) fibers, typically before dyeing (for tie dyes), mixed with the dye (for dye painting), or after dyeing (for immersion dyeing). It is also used in the froth flotation process to maintain a favourable pH as a float conditioner besides CaO and other mildly basic compounds.
Precursor to other compounds[edit]
Sodium bicarbonate (NaHCO3) or baking soda, also a component in fire extinguishers, is often generated from sodium carbonate. Although NaHCO3 is itself an intermediate product of the Solvay process, the heating needed to remove the ammonia that contaminates it decomposes some NaHCO3, making it more economic to react finished Na2CO3 with CO2:
- Na2CO3 + CO2 + H2O → 2NaHCO3
In a related reaction, sodium carbonate is used to make sodium bisulfite (NaHSO3), which is used for the «sulfite» method of separating lignin from cellulose. This reaction is exploited for removing sulfur dioxide from flue gases in power stations:
- Na2CO3 + SO2 + H2O → NaHCO3 + NaHSO3
This application has become more common, especially where stations have to meet stringent emission controls.
Sodium carbonate is used by the cotton industry to neutralize the sulfuric acid needed for acid delinting of fuzzy cottonseed.
It is also used to form carbonates of other metals by ion exchange, often with the other metals’ sulphates.
Miscellaneous[edit]
Sodium carbonate is used by the brick industry as a wetting agent to reduce the amount of water needed to extrude the clay. In casting, it is referred to as «bonding agent» and is used to allow wet alginate to adhere to gelled alginate. Sodium carbonate is used in toothpastes, where it acts as a foaming agent and an abrasive, and to temporarily increase mouth pH.
Sodium carbonate is also used in the processing and tanning of animal hides.[citation needed]
Physical properties[edit]
The integral enthalpy of solution of sodium carbonate is −28.1 kJ/mol for a 10% w/w aqueous solution.[20] The Mohs hardness of sodium carbonate monohydrate is 1.3.[7]
Occurrence as natural mineral[edit]
Structure of monohydrate at 346 K
Sodium carbonate is soluble in water, and can occur naturally in arid regions, especially in mineral deposits (evaporites) formed when seasonal lakes evaporate. Deposits of the mineral natron have been mined from dry lake bottoms in Egypt since ancient times, when natron was used in the preparation of mummies and in the early manufacture of glass.
The anhydrous mineral form of sodium carbonate is quite rare and called natrite. Sodium carbonate also erupts from Ol Doinyo Lengai, Tanzania’s unique volcano, and it is presumed to have erupted from other volcanoes in the past, but due to these minerals’ instability at the earth’s surface, are likely to be eroded. All three mineralogical forms of sodium carbonate, as well as trona, trisodium hydrogendicarbonate dihydrate, are also known from ultra-alkaline pegmatitic rocks, that occur for example in the Kola Peninsula in Russia.
Extraterrestrially, known sodium carbonate is rare. Deposits have been identified as the source of bright spots on Ceres, interior material that has been brought to the surface.[21] While there are carbonates on Mars, and these are expected to include sodium carbonate,[22] deposits have yet to be confirmed, this absence is explained by some as being due to a global dominance of low pH in previously aqueous Martian soil.[23]
Production[edit]
Mining[edit]
Trona, also known as trisodium hydrogendicarbonate dihydrate (Na3HCO3CO3·2H2O), is mined in several areas of the US and provides nearly all the US consumption of sodium carbonate. Large natural deposits found in 1938, such as the one near Green River, Wyoming, have made mining more economical than industrial production in North America.
There are important reserves of trona in Turkey; two million tons of soda ash have been extracted from the reserves near Ankara.
It is also mined from some alkaline lakes such as Lake Magadi in Kenya by dredging. Hot saline springs continuously replenish salt in the lake so that, provided the rate of dredging is no greater than the replenishment rate, the source is fully sustainable.[citation needed]
Barilla and kelp[edit]
Several «halophyte» (salt-tolerant) plant species and seaweed species can be processed to yield an impure form of sodium carbonate, and these sources predominated in Europe and elsewhere until the early 19th century. The land plants (typically glassworts or saltworts) or the seaweed (typically Fucus species) were harvested, dried, and burned. The ashes were then «lixivated» (washed with water) to form an alkali solution. This solution was boiled dry to create the final product, which was termed «soda ash»; this very old name derives from the Arabic word soda, in turn applied to salsola soda, one of the many species of seashore plants harvested for production. «Barilla» is a commercial term applied to an impure form of potash obtained from coastal plants or kelp.[24]
The sodium carbonate concentration in soda ash varied very widely, from 2–3 percent for the seaweed-derived form («kelp»), to 30 percent for the best barilla produced from saltwort plants in Spain. Plant and seaweed sources for soda ash, and also for the related alkali «potash», became increasingly inadequate by the end of the 18th century, and the search for commercially viable routes to synthesizing soda ash from salt and other chemicals intensified.[25]
Leblanc process[edit]
In 1792, the French chemist Nicolas Leblanc patented a process for producing sodium carbonate from salt, sulfuric acid, limestone, and coal. In the first step, sodium chloride is treated with sulfuric acid in the Mannheim process. This reaction produces sodium sulfate (salt cake) and hydrogen chloride:
- 2NaCl + H2SO4 → Na2SO4 + 2HCl
The salt cake and crushed limestone (calcium carbonate) was reduced by heating with coal.[17] This conversion entails two parts. First is the carbothermic reaction whereby the coal, a source of carbon, reduces the sulfate to sulfide:
- Na2SO4 + 2C → Na2S + 2CO2
The second stage is the reaction to produce sodium carbonate and calcium sulfide:
- Na2S + CaCO3 → Na2CO3 + CaS
This mixture is called black ash. The soda ash is extracted from the black ash with water. Evaporation of this extract yields solid sodium carbonate. This extraction process was termed lixiviating.
The hydrochloric acid produced by the Leblanc process was a major source of air pollution, and the calcium sulfide byproduct also presented waste disposal issues. However, it remained the major production method for sodium carbonate until the late 1880s.[25][26]
Solvay process[edit]
In 1861, the Belgian industrial chemist Ernest Solvay developed a method to make sodium carbonate by first reacting sodium chloride, ammonia, water, and carbon dioxide to generate sodium bicarbonate and ammonium chloride:[17]
- NaCl + NH3 + CO2 + H2O → NaHCO3 + NH4Cl
The resulting sodium bicarbonate was then converted to sodium carbonate by heating it, releasing water and carbon dioxide:
- 2NaHCO3 → Na2CO3 + H2O + CO2
Meanwhile, the ammonia was regenerated from the ammonium chloride byproduct by treating it with the lime (calcium oxide) left over from carbon dioxide generation:
- 2NH4Cl + CaO → 2NH3 + CaCl2 + H2O
The Solvay process recycles its ammonia. It consumes only brine and limestone, and calcium chloride is its only waste product. The process is substantially more economical than the Leblanc process, which generates two waste products, calcium sulfide and hydrogen chloride. The Solvay process quickly came to dominate sodium carbonate production worldwide. By 1900, 90% of sodium carbonate was produced by the Solvay process, and the last Leblanc process plant closed in the early 1920s.[17]
The second step of the Solvay process, heating sodium bicarbonate, is used on a small scale by home cooks and in restaurants to make sodium carbonate for culinary purposes (including pretzels and alkali noodles). The method is appealing to such users because sodium bicarbonate is widely sold as baking soda, and the temperatures required (250 °F (121 °C) to 300 °F (149 °C)) to convert baking soda to sodium carbonate are readily achieved in conventional kitchen ovens.[18]
Hou’s process[edit]
This process was developed by Chinese chemist Hou Debang in the 1930s. The earlier steam reforming byproduct carbon dioxide was pumped through a saturated solution of sodium chloride and ammonia to produce sodium bicarbonate by these reactions:
- CH4 + 2H2O → CO2 + 4H2
- 3H2 + N2 → 2NH3
- NH3 + CO2 + H2O → NH4HCO3
- NH4HCO3 + NaCl → NH4Cl + NaHCO3
The sodium bicarbonate was collected as a precipitate due to its low solubility and then heated up to approximately 80 °C (176 °F) or 95 °C (203 °F) to yield pure sodium carbonate similar to last step of the Solvay process. More sodium chloride is added to the remaining solution of ammonium and sodium chlorides; also, more ammonia is pumped at 30-40 °C to this solution. The solution temperature is then lowered to below 10 °C. Solubility of ammonium chloride is higher than that of sodium chloride at 30 °C and lower at 10 °C. Due to this temperature-dependent solubility difference and the common-ion effect, ammonium chloride is precipitated in a sodium chloride solution.
The Chinese name of Hou’s process, lianhe zhijian fa (联合制碱法), means «coupled manufacturing alkali method»: Hou’s process is coupled to the Haber process and offers better atom economy by eliminating the production of calcium chloride, since ammonia no longer needs to be regenerated. The byproduct ammonium chloride can be sold as a fertilizer.
See also[edit]
- Residual sodium carbonate index
References[edit]
- ^ a b c d Harper, J.P (1936). Antipov, Evgeny; Bismayer, Ulrich; Huppertz, Hubert; Petrícek, Václav; Pöttgen, Rainer; Schmahl, Wolfgang; Tiekink, E.R.T.; Zou, Xiaodong (eds.). «Crystal Structure of Sodium Carbonate Monohydrate, Na2CO3. H2O». Zeitschrift für Kristallographie — Crystalline Materials. 95 (1): 266–273. doi:10.1524/zkri.1936.95.1.266. ISSN 2196-7105. Retrieved 2014-07-25.
- ^ a b c d e f g Lide, David R., ed. (2009). CRC Handbook of Chemistry and Physics (90th ed.). Boca Raton, Florida: CRC Press. ISBN 978-1-4200-9084-0.
- ^ a b Seidell, Atherton; Linke, William F. (1919). Solubilities of Inorganic and Organic Compounds (2nd ed.). New York: D. Van Nostrand Company. p. 633.
- ^ a b Comey, Arthur Messinger; Hahn, Dorothy A. (February 1921). A Dictionary of Chemical Solubilities: Inorganic (2nd ed.). New York: The MacMillan Company. pp. 208–209.
- ^ a b c d Anatolievich, Kiper Ruslan. «sodium carbonate». chemister.ru. Retrieved 2014-07-25.
- ^ «Sodium carbonate». www.chemicalbook.com. Retrieved 25 June 2021.
- ^ a b c Pradyot, Patnaik (2003). Handbook of Inorganic Chemicals. The McGraw-Hill Companies, Inc. p. 861. ISBN 978-0-07-049439-8.
- ^ a b c d Dusek, Michal; Chapuis, Gervais; Meyer, Mathias; Petricek, Vaclav (2003). «Sodium carbonate revisited» (PDF). Acta Crystallographica Section B. 59 (3): 337–352. doi:10.1107/S0108768103009017. ISSN 0108-7681. PMID 12761404. Retrieved 2014-07-25.
- ^ a b c Betzel, C.; Saenger, W.; Loewus, D. (1982). «Sodium Carbonate Heptahydrate». Acta Crystallographica Section B. 38 (11): 2802–2804. doi:10.1107/S0567740882009996.
- ^ a b c Sigma-Aldrich Co., Sodium carbonate. Retrieved on 2014-05-06.
- ^ Chambers, Michael. «ChemIDplus — 497-19-8 — CDBYLPFSWZWCQE-UHFFFAOYSA-L — Sodium carbonate [NF] — Similar structures search, synonyms, formulas, resource links, and other chemical information».
- ^ «Material Safety Data Sheet – Sodium Carbonate, Anhydrous» (PDF). conservationsupportsystems.com. ConservationSupportSystems. Retrieved 2014-07-25.
- ^ «minerals.usgs.gov/minerals» (PDF).
- ^ T.W.Richards and A.H. Fiske (1914). «On the transition temperatures of the transition temperatures of the hydrates of sodium carbonate as fix points in thermometry». Journal of the American Chemical Society. 36 (3): 485–490. doi:10.1021/ja02180a003.
- ^ A. Pabst. «On the hydrates of sodium carbonate» (PDF).
- ^ a b c https://www.ccmr.cornell.edu/wp-content/uploads/sites/2/2015/11/Water-Hardness-Reading.pdf[bare URL PDF]
- ^ a b c d Christian Thieme (2000). «Sodium Carbonates». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a24_299. ISBN 978-3527306732.
- ^ a b McGee, Harold (24 September 2010). «For Old-Fashioned Flavor, Bake the Baking Soda». The New York Times. Retrieved 25 April 2019.
- ^ «Sodium Carbonate». corrosionpedia. Janalta Interactive. Retrieved 9 November 2020.
- ^ «Tatachemicals.com/north-america/product/images/fig_2_1.jpg».
- ^ De Sanctis, M. C.; et al. (29 June 2016). «Bright carbonate deposits as evidence of aqueous alteration on (1) Ceres». Nature. 536 (7614): 54–57. Bibcode:2016Natur.536…54D. doi:10.1038/nature18290. PMID 27362221. S2CID 4465999.
- ^ Jeffrey S. Kargel (23 July 2004). Mars — A Warmer, Wetter Planet. Springer Science & Business Media. pp. 399–. ISBN 978-1-85233-568-7.
- ^ Grotzinger, J. and R. Milliken (eds.) 2012. Sedimentary Geology of Mars. SEPM
- ^ Hooper, Robert (1802). Lexicon Medicum (1848 ed.). London: Longman. pp. 1198–9. OCLC 27671024.
- ^ a b
Clow, Archibald and Clow, Nan L. (1952). Chemical Revolution, (Ayer Co Pub, June 1952), pp. 65–90. ISBN 0-8369-1909-2. - ^ Kiefer, David M. (January 2002). «It was all about alkali». Today’s Chemist at Work. 11 (1): 45–6.
Further reading[edit]
- Eggeman, T. (2011). «Sodium Carbonate». Kirk-Othmer Encyclopedia of Chemical Technology. doi:10.1002/0471238961.1915040918012108.a01.pub3. ISBN 978-0471238966.
- Thieme, C. (2000). «Sodium Carbonates». Ullmann’s Encyclopedia of Industrial Chemistry. doi:10.1002/14356007.a24_299. ISBN 978-3527306732.
External links[edit]
- American Natural Soda Ash Company
- International Chemical Safety Card 1135
- FMC Wyoming Corporation
- Use of sodium carbonate in dyeing
- Sodium carbonate manufacturing by synthetic processes
Not to be confused with Sodium bicarbonate (baking soda), a similar compound.

|
|

|
|
| Names | |
|---|---|
| IUPAC name
Sodium carbonate |
|
| Preferred IUPAC name
Disodium carbonate |
|
| Other names
Soda ash, washing soda, soda crystals, sodium trioxocarbonate |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChEBI |
|
| ChEMBL |
|
| ChemSpider |
|
| ECHA InfoCard | 100.007.127 |
| EC Number |
|
| E number | E500(i) (acidity regulators, …) |
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
Na2CO3 |
| Molar mass | 105.9888 g/mol (anhydrous) 286.1416 g/mol (decahydrate) |
| Appearance | White solid, hygroscopic |
| Odor | Odorless |
| Density |
|
| Melting point | 851 °C (1,564 °F; 1,124 K) (Anhydrous) 100 °C (212 °F; 373 K) decomposes (monohydrate) 33.5 °C (92.3 °F; 306.6 K) decomposes (heptahydrate) 34 °C (93 °F; 307 K) (decahydrate)[2][7] |
|
Solubility in water |
Anhydrous, g/100 mL:
|
| Solubility | Soluble in aq. alkalis,[3] glycerol Slightly soluble in aq. alcohol Insoluble in CS2, acetone, alkyl acetates, alcohol, benzonitrile, liquid ammonia[4] |
| Solubility in glycerine | 98.3 g/100 g (155 °C)[4] |
| Solubility in ethanediol | 3.46 g/100 g (20 °C)[5] |
| Solubility in dimethylformamide | 0.5 g/kg[5] |
| Acidity (pKa) | 10.33 [6] |
|
Magnetic susceptibility (χ) |
−4.1·10−5 cm3/mol[2] |
|
Refractive index (nD) |
1.485 (anhydrous) 1.420 (monohydrate)[7] 1.405 (decahydrate) |
| Viscosity | 3.4 cP (887 °C)[5] |
| Structure | |
|
Crystal structure |
Monoclinic (γ-form, β-form, δ-form, anhydrous)[8] Orthorhombic (monohydrate, heptahydrate)[1][9] |
|
Space group |
C2/m, No. 12 (γ-form, anhydrous, 170 K) C2/m, No. 12 (β-form, anhydrous, 628 K) P21/n, No. 14 (δ-form, anhydrous, 110 K)[8] Pca21, No. 29 (monohydrate)[1] Pbca, No. 61 (heptahydrate)[9] |
|
Point group |
2/m (γ-form, β-form, δ-form, anhydrous)[8] mm2 (monohydrate)[1] 2/m 2/m 2/m (heptahydrate)[9] |
|
Lattice constant |
a = 8.920(7) Å, b = 5.245(5) Å, c = 6.050(5) Å (γ-form, anhydrous, 295 K)[8] α = 90°, β = 101.35(8)°, γ = 90° |
|
Coordination geometry |
Octahedral (Na+, anhydrous) |
| Thermochemistry | |
|
Heat capacity (C) |
112.3 J/mol·K[2] |
|
Std molar |
135 J/mol·K[2] |
|
Std enthalpy of |
−1130.7 kJ/mol[2][5] |
|
Gibbs free energy (ΔfG⦵) |
−1044.4 kJ/mol[2] |
| Hazards | |
| Occupational safety and health (OHS/OSH): | |
|
Main hazards |
Irritant |
| GHS labelling: | |
|
Pictograms |
 [10] [10]
|
|
Signal word |
Warning |
|
Hazard statements |
H319[10] |
|
Precautionary statements |
P305+P351+P338[10] |
| NFPA 704 (fire diamond) |
[12] 2 0 0 |
| Lethal dose or concentration (LD, LC): | |
|
LD50 (median dose) |
4090 mg/kg (rat, oral)[11] |
| Safety data sheet (SDS) | MSDS |
| Related compounds | |
|
Other anions |
Sodium bicarbonate |
|
Other cations |
Lithium carbonate Potassium carbonate Rubidium carbonate Cesium carbonate |
|
Related compounds |
Sodium sesquicarbonate Sodium percarbonate |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Sodium carbonate, Na2CO3, (also known as washing soda, soda ash and soda crystals) is the inorganic compound with the formula Na2CO3 and its various hydrates. All forms are white, odourless, water-soluble salts that yield moderately alkaline solutions in water. Historically, it was extracted from the ashes of plants growing in sodium-rich soils. Because the ashes of these sodium-rich plants were noticeably different from ashes of wood (once used to produce potash), sodium carbonate became known as «soda ash».[13] It is produced in large quantities from sodium chloride and limestone by the Solvay process.
Hydrates[edit]
Sodium carbonate is obtained as three hydrates and as the anhydrous salt:
- sodium carbonate decahydrate (natron), Na2CO3·10H2O, which readily effloresces to form the monohydrate.
- sodium carbonate heptahydrate (not known in mineral form), Na2CO3·7H2O.
- sodium carbonate monohydrate (thermonatrite), Na2CO3·H2O. Also known as crystal carbonate.
- anhydrous sodium carbonate (natrite), also known as calcined soda, is formed by heating the hydrates. It is also formed when sodium hydrogencarbonate is heated (calcined) e.g. in the final step of the Solvay process.
The decahydrate is formed from water solutions crystallizing in the temperature range −2.1 to +32.0 °C, the heptahydrate in the narrow range 32.0 to 35.4 °C and above this temperature the monohydrate forms.[14] In dry air the decahydrate and heptahydrate lose water to give the monohydrate. Other hydrates have been reported, e.g. with 2.5 units of water per sodium carbonate unit («pentahemihydrate»).[15]
Washing soda[edit]
Sodium carbonate decahydrate (Na2CO3·10H2O), also known as washing soda, is the most common hydrate of sodium carbonate containing 10 molecules of water of crystallization. Soda ash is dissolved in water and crystallized to get washing soda.
- It is white crystalline solid;
- It is one of the few metal carbonates which are soluble in water;
- It is alkaline; it turns red litmus to blue;
- It has detergent properties through the process of saponification which makes fats and grease water-miscible.
Applications[edit]
Some common applications of sodium carbonate include:
- As a cleansing agent for domestic purposes like washing clothes. Sodium carbonate is a component of many dry soap powders.
- It is used for removing temporary and permanent hardness of water.[16] (see water softening).
- It is used in the manufacture of glass, soap and paper. (see glass manufacture)
- It is used in the manufacture of sodium compounds like borax.
Glass manufacture[edit]
Sodium carbonate serves as a flux for silica (SiO2, melting point 1,713 °C), lowering the melting point of the mixture to something achievable without special materials. This «soda glass» is mildly water-soluble, so some calcium carbonate is added to the melt mixture to make the glass insoluble. Bottle and window glass («soda-lime glass» with transistion temperature ~570 °C) is made by melting such mixtures of sodium carbonate, calcium carbonate, and silica sand (silicon dioxide (SiO2)). When these materials are heated, the carbonates release carbon dioxide. In this way, sodium carbonate is a source of sodium oxide. Soda-lime glass has been the most common form of glass for centuries. It is also a key input for tableware glass manufacturing.[17]
Water softening[edit]
Hard water contains dissolved compounds, usually calcium or magnesium compounds. Sodium carbonate is used for removing temporary and permanent hardness of water.[16]
As sodium carbonate is water-soluble and magnesium carbonate and calcium carbonate are insoluble, the former is used to soften water by removing Mg2+ and Ca2+. These ions form insoluble solid precipitates upon treatment with carbonate ions:
Similarly, 
The water is softened because it no longer contains dissolved calcium ions and magnesium ions.[16]
Food additive and cooking[edit]
Sodium carbonate has several uses in cuisine, largely because it is a stronger base than baking soda (sodium bicarbonate) but weaker than lye (which may refer to sodium hydroxide or, less commonly, potassium hydroxide). Alkalinity affects gluten production in kneaded doughs, and also improves browning by reducing the temperature at which the Maillard reaction occurs. To take advantage of the former effect, sodium carbonate is therefore one of the components of kansui (かん水), a solution of alkaline salts used to give Japanese ramen noodles their characteristic flavor and chewy texture; a similar solution is used in Chinese cuisine to make lamian, for similar reasons. Cantonese bakers similarly use sodium carbonate as a substitute for lye-water to give moon cakes their characteristic texture and improve browning. In German cuisine (and Central European cuisine more broadly), breads such as pretzels and lye rolls traditionally treated with lye to improve browning can be treated instead with sodium carbonate; sodium carbonate does not produce quite as strong a browning as lye, but is much safer and easier to work with.[18]
Sodium carbonate is used in the production of sherbet powder. The cooling and fizzing sensation results from the endothermic reaction between sodium carbonate and a weak acid, commonly citric acid, releasing carbon dioxide gas, which occurs when the sherbet is moistened by saliva.
Sodium carbonate also finds use in food industry as a food additive (E500) as an acidity regulator, anticaking agent, raising agent, and stabilizer. It is also used in the production of snus to stabilize the pH of the final product.
While it is less likely to cause chemical burns than lye, care must still be taken when working with sodium carbonate in the kitchen, as it is corrosive to aluminum cookware, utensils, and foil.[19]
Other applications[edit]
Sodium carbonate is also used as a relatively strong base in various fields. As a common alkali, it is preferred in many chemical processes because it is cheaper than sodium hydroxide and far safer to handle. Its mildness especially recommends its use in domestic applications.
For example, it is used as a pH regulator to maintain stable alkaline conditions necessary for the action of the majority of photographic film developing agents. It is also a common additive in swimming pools and aquarium water to maintain a desired pH and carbonate hardness (KH). In dyeing with fiber-reactive dyes, sodium carbonate (often under a name such as soda ash fixative or soda ash activator) is used to ensure proper chemical bonding of the dye with cellulose (plant) fibers, typically before dyeing (for tie dyes), mixed with the dye (for dye painting), or after dyeing (for immersion dyeing). It is also used in the froth flotation process to maintain a favourable pH as a float conditioner besides CaO and other mildly basic compounds.
Precursor to other compounds[edit]
Sodium bicarbonate (NaHCO3) or baking soda, also a component in fire extinguishers, is often generated from sodium carbonate. Although NaHCO3 is itself an intermediate product of the Solvay process, the heating needed to remove the ammonia that contaminates it decomposes some NaHCO3, making it more economic to react finished Na2CO3 with CO2:
- Na2CO3 + CO2 + H2O → 2NaHCO3
In a related reaction, sodium carbonate is used to make sodium bisulfite (NaHSO3), which is used for the «sulfite» method of separating lignin from cellulose. This reaction is exploited for removing sulfur dioxide from flue gases in power stations:
- Na2CO3 + SO2 + H2O → NaHCO3 + NaHSO3
This application has become more common, especially where stations have to meet stringent emission controls.
Sodium carbonate is used by the cotton industry to neutralize the sulfuric acid needed for acid delinting of fuzzy cottonseed.
It is also used to form carbonates of other metals by ion exchange, often with the other metals’ sulphates.
Miscellaneous[edit]
Sodium carbonate is used by the brick industry as a wetting agent to reduce the amount of water needed to extrude the clay. In casting, it is referred to as «bonding agent» and is used to allow wet alginate to adhere to gelled alginate. Sodium carbonate is used in toothpastes, where it acts as a foaming agent and an abrasive, and to temporarily increase mouth pH.
Sodium carbonate is also used in the processing and tanning of animal hides.[citation needed]
Physical properties[edit]
The integral enthalpy of solution of sodium carbonate is −28.1 kJ/mol for a 10% w/w aqueous solution.[20] The Mohs hardness of sodium carbonate monohydrate is 1.3.[7]
Occurrence as natural mineral[edit]
Structure of monohydrate at 346 K
Sodium carbonate is soluble in water, and can occur naturally in arid regions, especially in mineral deposits (evaporites) formed when seasonal lakes evaporate. Deposits of the mineral natron have been mined from dry lake bottoms in Egypt since ancient times, when natron was used in the preparation of mummies and in the early manufacture of glass.
The anhydrous mineral form of sodium carbonate is quite rare and called natrite. Sodium carbonate also erupts from Ol Doinyo Lengai, Tanzania’s unique volcano, and it is presumed to have erupted from other volcanoes in the past, but due to these minerals’ instability at the earth’s surface, are likely to be eroded. All three mineralogical forms of sodium carbonate, as well as trona, trisodium hydrogendicarbonate dihydrate, are also known from ultra-alkaline pegmatitic rocks, that occur for example in the Kola Peninsula in Russia.
Extraterrestrially, known sodium carbonate is rare. Deposits have been identified as the source of bright spots on Ceres, interior material that has been brought to the surface.[21] While there are carbonates on Mars, and these are expected to include sodium carbonate,[22] deposits have yet to be confirmed, this absence is explained by some as being due to a global dominance of low pH in previously aqueous Martian soil.[23]
Production[edit]
Mining[edit]
Trona, also known as trisodium hydrogendicarbonate dihydrate (Na3HCO3CO3·2H2O), is mined in several areas of the US and provides nearly all the US consumption of sodium carbonate. Large natural deposits found in 1938, such as the one near Green River, Wyoming, have made mining more economical than industrial production in North America.
There are important reserves of trona in Turkey; two million tons of soda ash have been extracted from the reserves near Ankara.
It is also mined from some alkaline lakes such as Lake Magadi in Kenya by dredging. Hot saline springs continuously replenish salt in the lake so that, provided the rate of dredging is no greater than the replenishment rate, the source is fully sustainable.[citation needed]
Barilla and kelp[edit]
Several «halophyte» (salt-tolerant) plant species and seaweed species can be processed to yield an impure form of sodium carbonate, and these sources predominated in Europe and elsewhere until the early 19th century. The land plants (typically glassworts or saltworts) or the seaweed (typically Fucus species) were harvested, dried, and burned. The ashes were then «lixivated» (washed with water) to form an alkali solution. This solution was boiled dry to create the final product, which was termed «soda ash»; this very old name derives from the Arabic word soda, in turn applied to salsola soda, one of the many species of seashore plants harvested for production. «Barilla» is a commercial term applied to an impure form of potash obtained from coastal plants or kelp.[24]
The sodium carbonate concentration in soda ash varied very widely, from 2–3 percent for the seaweed-derived form («kelp»), to 30 percent for the best barilla produced from saltwort plants in Spain. Plant and seaweed sources for soda ash, and also for the related alkali «potash», became increasingly inadequate by the end of the 18th century, and the search for commercially viable routes to synthesizing soda ash from salt and other chemicals intensified.[25]
Leblanc process[edit]
In 1792, the French chemist Nicolas Leblanc patented a process for producing sodium carbonate from salt, sulfuric acid, limestone, and coal. In the first step, sodium chloride is treated with sulfuric acid in the Mannheim process. This reaction produces sodium sulfate (salt cake) and hydrogen chloride:
- 2NaCl + H2SO4 → Na2SO4 + 2HCl
The salt cake and crushed limestone (calcium carbonate) was reduced by heating with coal.[17] This conversion entails two parts. First is the carbothermic reaction whereby the coal, a source of carbon, reduces the sulfate to sulfide:
- Na2SO4 + 2C → Na2S + 2CO2
The second stage is the reaction to produce sodium carbonate and calcium sulfide:
- Na2S + CaCO3 → Na2CO3 + CaS
This mixture is called black ash. The soda ash is extracted from the black ash with water. Evaporation of this extract yields solid sodium carbonate. This extraction process was termed lixiviating.
The hydrochloric acid produced by the Leblanc process was a major source of air pollution, and the calcium sulfide byproduct also presented waste disposal issues. However, it remained the major production method for sodium carbonate until the late 1880s.[25][26]
Solvay process[edit]
In 1861, the Belgian industrial chemist Ernest Solvay developed a method to make sodium carbonate by first reacting sodium chloride, ammonia, water, and carbon dioxide to generate sodium bicarbonate and ammonium chloride:[17]
- NaCl + NH3 + CO2 + H2O → NaHCO3 + NH4Cl
The resulting sodium bicarbonate was then converted to sodium carbonate by heating it, releasing water and carbon dioxide:
- 2NaHCO3 → Na2CO3 + H2O + CO2
Meanwhile, the ammonia was regenerated from the ammonium chloride byproduct by treating it with the lime (calcium oxide) left over from carbon dioxide generation:
- 2NH4Cl + CaO → 2NH3 + CaCl2 + H2O
The Solvay process recycles its ammonia. It consumes only brine and limestone, and calcium chloride is its only waste product. The process is substantially more economical than the Leblanc process, which generates two waste products, calcium sulfide and hydrogen chloride. The Solvay process quickly came to dominate sodium carbonate production worldwide. By 1900, 90% of sodium carbonate was produced by the Solvay process, and the last Leblanc process plant closed in the early 1920s.[17]
The second step of the Solvay process, heating sodium bicarbonate, is used on a small scale by home cooks and in restaurants to make sodium carbonate for culinary purposes (including pretzels and alkali noodles). The method is appealing to such users because sodium bicarbonate is widely sold as baking soda, and the temperatures required (250 °F (121 °C) to 300 °F (149 °C)) to convert baking soda to sodium carbonate are readily achieved in conventional kitchen ovens.[18]
Hou’s process[edit]
This process was developed by Chinese chemist Hou Debang in the 1930s. The earlier steam reforming byproduct carbon dioxide was pumped through a saturated solution of sodium chloride and ammonia to produce sodium bicarbonate by these reactions:
- CH4 + 2H2O → CO2 + 4H2
- 3H2 + N2 → 2NH3
- NH3 + CO2 + H2O → NH4HCO3
- NH4HCO3 + NaCl → NH4Cl + NaHCO3
The sodium bicarbonate was collected as a precipitate due to its low solubility and then heated up to approximately 80 °C (176 °F) or 95 °C (203 °F) to yield pure sodium carbonate similar to last step of the Solvay process. More sodium chloride is added to the remaining solution of ammonium and sodium chlorides; also, more ammonia is pumped at 30-40 °C to this solution. The solution temperature is then lowered to below 10 °C. Solubility of ammonium chloride is higher than that of sodium chloride at 30 °C and lower at 10 °C. Due to this temperature-dependent solubility difference and the common-ion effect, ammonium chloride is precipitated in a sodium chloride solution.
The Chinese name of Hou’s process, lianhe zhijian fa (联合制碱法), means «coupled manufacturing alkali method»: Hou’s process is coupled to the Haber process and offers better atom economy by eliminating the production of calcium chloride, since ammonia no longer needs to be regenerated. The byproduct ammonium chloride can be sold as a fertilizer.
See also[edit]
- Residual sodium carbonate index
References[edit]
- ^ a b c d Harper, J.P (1936). Antipov, Evgeny; Bismayer, Ulrich; Huppertz, Hubert; Petrícek, Václav; Pöttgen, Rainer; Schmahl, Wolfgang; Tiekink, E.R.T.; Zou, Xiaodong (eds.). «Crystal Structure of Sodium Carbonate Monohydrate, Na2CO3. H2O». Zeitschrift für Kristallographie — Crystalline Materials. 95 (1): 266–273. doi:10.1524/zkri.1936.95.1.266. ISSN 2196-7105. Retrieved 2014-07-25.
- ^ a b c d e f g Lide, David R., ed. (2009). CRC Handbook of Chemistry and Physics (90th ed.). Boca Raton, Florida: CRC Press. ISBN 978-1-4200-9084-0.
- ^ a b Seidell, Atherton; Linke, William F. (1919). Solubilities of Inorganic and Organic Compounds (2nd ed.). New York: D. Van Nostrand Company. p. 633.
- ^ a b Comey, Arthur Messinger; Hahn, Dorothy A. (February 1921). A Dictionary of Chemical Solubilities: Inorganic (2nd ed.). New York: The MacMillan Company. pp. 208–209.
- ^ a b c d Anatolievich, Kiper Ruslan. «sodium carbonate». chemister.ru. Retrieved 2014-07-25.
- ^ «Sodium carbonate». www.chemicalbook.com. Retrieved 25 June 2021.
- ^ a b c Pradyot, Patnaik (2003). Handbook of Inorganic Chemicals. The McGraw-Hill Companies, Inc. p. 861. ISBN 978-0-07-049439-8.
- ^ a b c d Dusek, Michal; Chapuis, Gervais; Meyer, Mathias; Petricek, Vaclav (2003). «Sodium carbonate revisited» (PDF). Acta Crystallographica Section B. 59 (3): 337–352. doi:10.1107/S0108768103009017. ISSN 0108-7681. PMID 12761404. Retrieved 2014-07-25.
- ^ a b c Betzel, C.; Saenger, W.; Loewus, D. (1982). «Sodium Carbonate Heptahydrate». Acta Crystallographica Section B. 38 (11): 2802–2804. doi:10.1107/S0567740882009996.
- ^ a b c Sigma-Aldrich Co., Sodium carbonate. Retrieved on 2014-05-06.
- ^ Chambers, Michael. «ChemIDplus — 497-19-8 — CDBYLPFSWZWCQE-UHFFFAOYSA-L — Sodium carbonate [NF] — Similar structures search, synonyms, formulas, resource links, and other chemical information».
- ^ «Material Safety Data Sheet – Sodium Carbonate, Anhydrous» (PDF). conservationsupportsystems.com. ConservationSupportSystems. Retrieved 2014-07-25.
- ^ «minerals.usgs.gov/minerals» (PDF).
- ^ T.W.Richards and A.H. Fiske (1914). «On the transition temperatures of the transition temperatures of the hydrates of sodium carbonate as fix points in thermometry». Journal of the American Chemical Society. 36 (3): 485–490. doi:10.1021/ja02180a003.
- ^ A. Pabst. «On the hydrates of sodium carbonate» (PDF).
- ^ a b c https://www.ccmr.cornell.edu/wp-content/uploads/sites/2/2015/11/Water-Hardness-Reading.pdf[bare URL PDF]
- ^ a b c d Christian Thieme (2000). «Sodium Carbonates». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a24_299. ISBN 978-3527306732.
- ^ a b McGee, Harold (24 September 2010). «For Old-Fashioned Flavor, Bake the Baking Soda». The New York Times. Retrieved 25 April 2019.
- ^ «Sodium Carbonate». corrosionpedia. Janalta Interactive. Retrieved 9 November 2020.
- ^ «Tatachemicals.com/north-america/product/images/fig_2_1.jpg».
- ^ De Sanctis, M. C.; et al. (29 June 2016). «Bright carbonate deposits as evidence of aqueous alteration on (1) Ceres». Nature. 536 (7614): 54–57. Bibcode:2016Natur.536…54D. doi:10.1038/nature18290. PMID 27362221. S2CID 4465999.
- ^ Jeffrey S. Kargel (23 July 2004). Mars — A Warmer, Wetter Planet. Springer Science & Business Media. pp. 399–. ISBN 978-1-85233-568-7.
- ^ Grotzinger, J. and R. Milliken (eds.) 2012. Sedimentary Geology of Mars. SEPM
- ^ Hooper, Robert (1802). Lexicon Medicum (1848 ed.). London: Longman. pp. 1198–9. OCLC 27671024.
- ^ a b
Clow, Archibald and Clow, Nan L. (1952). Chemical Revolution, (Ayer Co Pub, June 1952), pp. 65–90. ISBN 0-8369-1909-2. - ^ Kiefer, David M. (January 2002). «It was all about alkali». Today’s Chemist at Work. 11 (1): 45–6.
Further reading[edit]
- Eggeman, T. (2011). «Sodium Carbonate». Kirk-Othmer Encyclopedia of Chemical Technology. doi:10.1002/0471238961.1915040918012108.a01.pub3. ISBN 978-0471238966.
- Thieme, C. (2000). «Sodium Carbonates». Ullmann’s Encyclopedia of Industrial Chemistry. doi:10.1002/14356007.a24_299. ISBN 978-3527306732.
External links[edit]
- American Natural Soda Ash Company
- International Chemical Safety Card 1135
- FMC Wyoming Corporation
- Use of sodium carbonate in dyeing
- Sodium carbonate manufacturing by synthetic processes
Физические свойства
Карбонат натрия Na2CO3 — соль щелочного металла натрия и угольной кислоты. Белое вещество, плавится без разложения, при дальнейшем нагревании разлагается.
Относительная молекулярная масса Mr = 105,99; относительная плотность для тв. и ж. состояния d = 2,539; tпл = 851º C;
Способ получения
1. Карбонат натрия можно получить путем взаимодействия оксида натрия и углекислого газа:
Na2O + CO2 = Na2CO3
2. В результате взаимодействия концентрированного раствора гидроксида натрия и углекислого газа образуется карбонат натрия и вода:
2NaOH + CO2 = Na2CO3↓ + H2O
3. При взаимодействии гидрокарбоната натрия и концентрированного раствора гидроксида натрия образуется карбонат натрия и вода:
NaHCO3 + NaOH = Na2CO3 + H2O
Качественная реакция
Качественная реакция на карбонат натрия — взаимодействие его с раствором сильных кислот. В результате реакции происходит бурное выделение углекислого газа, образование которого можно проверить, если пропустить его через известковую воду, которая мутнеет из-за образования осадка:
1. При взаимодействии с хлороводородной кислотой, карбонат натрия образует хлорид натрия, углекислый газ и воду:
Na2CO3 + 2HCl = 2NaCl + CO2↑ + H2O
2. Взаимодействуя с серной кислотой, карбонат натрия образует углекислый газ и воду, а также сульфат натрия:
Na2CO3 + H2SO4 = 2Na2SO4 + CO2↑ +H2O.
Химические свойства
1. Карбонат натрия может реагировать с простыми веществами:
1.1. Карбонат натрия при 900–1000º C реагирует с углеродом. При этом образуется натрий и угарный газ:
Na2CO3 + 2C(кокс) = Na + 3CO
1.2. С хлором концентрированный и горячий раствор карбоната натрия реагирует с образованием хлорида натрия, хлората натрия и углекислого газа:
Na2CO3 + 3Cl2 = 5NaCl + NaClO3 + 3CO2↑
2. Карбонат натрия вступает в реакцию со многими сложными веществами:
2.1. Насыщенный карбонат натрия реагирует при 30–40º C с водой и углекислым газом, образуя осадок гидрокарбоната натрия:
Na2CO3 + H2O + CO2 ↔ 2NaHCO3↓
2.2. Карбонат натрия может реагировать с насыщенным гидроксидом кальция с образованием гидроксида натрия и карбоната кальция:
Na2CO3 + Ca(OH)2 = 2NaOH + CaCO3
2.3. При взаимодействии с разбавленной хлороводородной кислотой карбонат натрия образует хлорид натрия, углекислый газ и воду:
Na2CO3 + 2HCl = 2NaCl + CO2↑ +H2O
2.4. Карбонат натрия реагирует с разбавленной плавиковой кислотой. Взаимодействие карбоната натрия с плавиковой кислотой приводит к образованию фторида натрия, воды и углекислого газа:
Na2CO3 + 2HF = 2NaF + H2O + CO2↑
2.5. Концентрированный раствор карбоната натрия взаимодействует с оксидом серы. При этом образуются карбонат натрия и углекислый газ:
Na2CO3 + SO2 = Na2SO3 + CO2↑.

Онлайн калькуляторы
На нашем сайте собрано более 100 бесплатных онлайн калькуляторов по математике, геометрии и физике.

Справочник
Основные формулы, таблицы и теоремы для учащихся. Все что нужно, чтобы сделать домашнее задание!

Заказать решение
Не можете решить контрольную?!
Мы поможем! Более 20 000 авторов выполнят вашу работу от 100 руб!
Формула карбоната натрия
Определение и формула карбоната натрия
Формула –
Молярная масса равна г/моль.
Сода (гидрат), сода кальцинированная, или стиральная (безводный).
Физические свойства – белый, плавится без разложения, при дальнейшем нагревании разлагается.
Хорошо растворяется в воде (сильный гидролиз по аниону), создает сильнощелочную среду:
Химические свойства карбоната натрия
- Реагирует с кислотами:
- Взаимодействует с основаниями:
- Вступает в химическое взаимодействие с углеродом (кокс) при высокой температуре:
- Вступает в реакцию с
с образованием сульфита натрия:
- При прокаливании
разлагается:
Получение
Карбонат натрия можно получать взаимодействием гидроксида натрия и углекислого газа:
Также можно привести способ получения из гидрокарбоната натрия при его нагревании до :
Применение
Карбонат натрия находит широкое применение в стекольном производстве; мыловарении и производстве стиральных и чистящих порошков; применяется для уменьшения жёсткости воды. Карбонат натрия — исходный реагент для получения гидроксида натрия. Также он используется в качестве пищевой добавки (разрыхлитель).
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |
| Карбонат натрия | |
  |
|
 |
|
| Общие | |
|---|---|
| Систематическое наименование | динатрий триоксокарбонат[1] |
| Традиционные названия | кальцинированная сода, углекислый натрий |
| Химическая формула | Na2CO3 |
| Физические свойства | |
| Отн. молек. масса | 106 а. е. м. |
| Молярная масса | 105,99 г/моль |
| Плотность | 2,53 г/см³ |
| Термические свойства | |
| Температура плавления | 852 °C |
| Температура кипения | 1600 °C |
| Химические свойства | |
| pKa | 10,33 |
| Растворимость в воде при 20 °C | 21,8 г/100 мл |
| Классификация | |
| Рег. номер CAS | 497-19-8 |
| Рег. номер EINECS | 207-838-8 |
Карбона́т на́трия Na2CO3 — химическое соединение, натриевая соль угольной кислоты.
Содержание
- 1 Тривиальные названия
- 2 Оксиды и гидроксиды
- 3 Нахождение в природе
- 4 Получение
- 4.1 Способ Леблана
- 4.2 Промышленный аммиачный способ (способ Сольве)
- 4.3 Способ Хоу
- 4.3.1 Сравнение способов
- 5 Свойства
- 6 Применение
- 7 Примечания
Тривиальные названия
Сода — общее название технических натриевых солей угольной кислоты.
- Na2CO3 (карбонат натрия) — кальцинированная сода
- Na2CO3·10H2O (декагидрат карбоната натрия, содержит 62,5 % кристаллизационной воды) — стиральная сода; иногда выпускается в виде Na2CO3·H2O или Na2CO3·7H2O
- NaHCO3 (гидрокарбонат натрия) — питьевая сода, натрий двууглекислый, бикарбонат натрия
Название «сода» происходит от растения Salsola Soda, из золы которого её добывали. Кальцинированной соду называли потому, что для получения её из кристаллогидрата приходилось его кальцинировать (то есть нагревать до высокой температуры).
Каустической содой называют гидроксид натрия (NaOH).
Оксиды и гидроксиды
| Вид | Для Na | Для С |
|---|---|---|
| Гидроксид | NaOH | H2CO3 |
| Оксид | Na2O | CO2 |
Нахождение в природе
В природе сода встречается в золе некоторых морских водорослей, а также в виде следующих минералов:
- нахколит NaHCO3
- трона Na2CO3·NaHCO3·2H2O
- натрит (сода) Na2CO3·10H2O
- термонатрит Na2CO3·Н2O.
Современные содовые озёра известны в Забайкалье и в Западной Сибири; большой известностью пользуется озеро Натрон в Танзании и озеро Сирлс в Калифорнии. Трона, имеющая промышленное значение, открыта в 1938 в составе эоценовой толщи Грин-Ривер (Вайоминг, США). Вместе с троной в этой осадочной толще обнаружено много ранее считавшихся редкими минералов, в том числе давсонит, который рассматривается как сырьё для получения соды и глинозёма. В США природная сода удовлетворяет более 40 % потребности страны в этом полезном ископаемом.
Получение
До начала XIX века карбонат натрия получали преимущественно из золы некоторых морских водорослей и прибрежных растений.
Способ Леблана
В 1791 году французский химик Никола Леблан получил патент на «Способ превращения глауберовой соли в соду». По этому способу при температуре около 1000 °C запекается смесь сульфата натрия («глауберовой соли»), мела или известняка (карбоната кальция) и древесного угля. Уголь восстанавливает сульфат натрия до сульфида:
- Na2SO4 + 2C → Na2S + 2CO2↑.
Сульфид натрия реагирует с карбонатом кальция:
- Na2S + СаСО3 → Na2CO3 + CaS.
Полученный расплав обрабатывают водой, при этом карбонат натрия переходит в раствор, сульфид кальция отфильтровывают, затем раствор карбоната натрия упаривают. Сырую соду очищают перекристаллизацией. Процесс Леблана даёт соду в виде кристаллогидрата (см. выше), поэтому полученную соду обезвоживают кальцинированием.
Сульфат натрия получали обработкой каменной соли (хлорида натрия) серной кислотой:
- 2NaCl + H2SO4 → Na2SO4 + 2HCl↑.
Выделявшийся в ходе реакции хлороводород улавливали водой с получением соляной кислоты.
Первый содовый завод такого типа в России был основан промышленником М. Прангом и появился в Барнауле в 1864 году.
После появления более экономичного (не остаётся в больших количествах побочный сульфид кальция) и технологичного способа Сольве, заводы, работающие по способу Леблана, стали закрываться. К 1900 90 % предприятий производили соду по методу Сольве, а последние фабрики, работающие по методу Леблана закрылись в начале 1920-х.
Промышленный аммиачный способ (способ Сольве)
Карбонат натрия
В 1861 году бельгийский инженер-химик Эрнест Сольве запатентовал метод производства соды, который используется и по сей день.
В насыщенный раствор хлорида натрия пропускают эквимолярные количества газообразных аммиака и диоксида углерода, то есть как бы вводят гидрокарбонат аммония NH4HCO3:
- NH3 + CO2 + H2O + NaCl → NaHCO3 + NH4Cl.
Выпавший остаток малорастворимого (9,6 г на 100 г воды при 20 °C) гидрокарбоната натрия отфильтровывают и кальцинируют (обезвоживают) нагреванием до 140—160 °C, при этом он переходит в карбонат натрия:
- 2NaHCO3 →(t) Na2CO3 + CO2↑ + H2O.
Образовавшийся CO2 возвращают в производственный цикл. Хлорид аммония NH4Cl обрабатывают гидроксидом кальция Ca(OH)2:
- 2NH4Cl + Ca(OH)2 → CaCl2 + 2NH3↑ + 2H2O,
и полученный NH3 также возвращают в производственный цикл.
Таким образом, единственным отходом производства является хлорид кальция, не имеющий широкого промышленного применения, кроме использования в качестве противообледеняющего реагента для посыпания улиц.
Первый содовый завод такого типа в мире был открыт в 1863 в Бельгии; первый завод такого типа в России был основан в районе уральского города Березники фирмой «Любимов, Сольве и Ко» в 1883 году. Его производительность составляла 20 тысяч тонн соды в год. В 2010 году ФАС России отказал фирме Solvay в покупке этого завода, разрешив покупку группе Башкирская химия (ей также принадлежит завод Сода).[источник не указан 293 дня]
До сих пор этот способ остаётся основным способом получения соды во всех странах.
Способ Хоу
Разработан китайским химиком Хоу (Hou Debang) в 1930-х годах. Отличается от процесса Сольве тем, что не использует гидроксид кальция.
По способу Хоу в раствор хлорида натрия при температуре 40 градусов подается диоксид углерода и аммиак. Менее растворимый гидрокарбонат натрия в ходе реакции выпадает в осадок (как и в методе Сольве). Затем раствор охлаждают до 10 градусов. При этом выпадает в осадок хлорид аммония, а раствор используют повторно для производства следующих порций соды.
Сравнение способов
По методу Хоу в качестве побочного продукта образуется NH4Cl вместо CaCl2 по методу Сольве.
Способ Сольве был разработан до появления процесса Габера, в то время аммиак был в дефиците, поэтому регенерировать его из NH4Cl было необходимо. Метод Хоу появился позже, необходимость регенерации аммиака уже не стояла так остро, соответственно, аммиак можно было не извлекать, а использовать его как азотное удобрение в виде соединения NH4Cl.
Тем не менее NH4Cl содержит хлор, избыток которого вреден для многих растений, поэтому использование NH4Cl в качестве удобрения ограничено. В свою очередь рис хорошо переносит избыток хлора, и в Китае, где применяется NH4Cl для рисоводства, метод Хоу, дающий NH4Cl в качестве побочного продукта, более широко представлен по сравнению с другими регионами.
В настоящее время в ряде стран практически весь искусственно производящийся карбонат натрия вырабатывается по методу Сольве (включая метод Хоу как модификацию), а именно в Европе 94 % искусственно производимой соды, во всем мире — 84 % (2000 год)[2].
Свойства
Кристаллогидраты карбоната натрия существуют в разных формах: бесцветный моноклинный Na2CO3·10H2O, при 32,017 °C переходит в бесцветный ромбический Na2CO3·7H2O, последний при нагревании до 35,27 °C бесцветный переходит в ромбический Na2CO3·H2O.
Безводный карбонат натрия представляет собой бесцветный кристаллический порошок.
| Параметр | Безводный карбонат натрия | Декагидрат Na2CO3·10H2O |
|---|---|---|
| Молекулярная масса | 105,99 а. е. м. | 286,14 а. е. м. |
| Температура плавления | 852 °C (по другим источникам, 853 °C) | 32 °C |
| Растворимость | Не растворим в ацетоне, и сероуглероде, мало растворим в этаноле хорошо растворим в глицерине, и воде (см. таблицу ниже) | растворим в воде, не растворим в этаноле |
| Плотность ρ | 2,53 г/см³ (при 20 °C) | 1,446 г/см³ (при 17 °C) |
| Стандартная энтальпия образования ΔH | −1131 кДж/моль (т) (при 297 К) | −4083,5 кДж/моль ((т) (при 297 К) |
| Стандартная энергия Гиббса образования G | −1047,5 кДж/моль (т) (при 297 К) | −3242,3 кДж/моль ((т) (при 297 К) |
| Стандартная энтропия образования S | 136,4 Дж/моль·K (т) (при 297 К) | |
| Стандартная мольная теплоёмкость Cp | 109,2 Дж/моль·K (жг) (при 297 К) |
| Температура, °C | 0 | 10 | 20 | 25 | 30 | 40 | 50 | 60 | 80 | 100 | 120 | 140 |
| Растворимость, г Na2CO3 на 100 г H2O | 7 | 12,2 | 21,8 | 29,4 | 39,7 | 48,8 | 47,3 | 46,4 | 45,1 | 44,7 | 42,7 | 39,3 |
В водном растворе карбонат натрия гидролизуется, что обеспечивает щелочную реакцию среды. Уравнение гидролиза (в ионной форме):
CO32− + H2O ↔ HCO3− + OH−
Первая константа диссоциации угольной кислоты равна 4,5·10−7. Все кислоты, более сильные, чем угольная, вытесняют её в реакции с карбонатом натрия. Так как угольная кислота крайне нестойкая, она тут же разлагается на воду и углекислый газ:
Na2CO3 + H2SO4 → Na2SO4 + CO2↑ + H2O
Применение
| Карбонат натрия на Викискладе? |
Карбонат натрия используют в стекольном производстве, мыловарении и производстве стиральных и чистящих порошков, эмалей, для получения ультрамарина. Также он применяется для смягчения воды паровых котлов и вообще устранения жёсткости воды, для обезжиривания металлов и десульфатизации доменного чугуна. Карбонат натрия — исходный продукт для получения NaOH, Na2B4O7, Na2HPO4. Карбонат натрия (кальцинированная сода) Название и функция вещества:
Карбонат натрия (кальцинированная сода) — регулятор кислотности; окислитель. Имеется в составе жидкости для мытья посуды, сигарет, пестицидов.
В пищевой промышленности зарегистрирован в качестве пищевой добавки E500, регулятора кислотности, разрыхлителя, препятствующего комкованию и слёживанию.
Примечания
- ↑ ftp.unilib.neva.ru
- ↑ WebCite query result
|
Растворимость кислот, оснований и солей в воде |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
Соединения натрия |
|---|
|
Азид натрия (NaN3) • Альгинат натрия • Алюминат натрия (NaAlO2) • Амид натрия (NaNH2) • Арсенат натрия (Na3AsO4) • Бензилнатрий (NaCH2C6H5) • Бензоат натрия (NaC6H5CO2) • Борогидрид натрия (NaBH4) • Бромат натрия (NaBrO3) • Бромид натрия (NaBr) • Висмутат натрия (NaBiO3) • Вольфрамат натрия (Na2WO4) • Гексагидроксостаннат(IV) натрия (Na2[Sn(OH)6]) • Гексагидроксохромат (III) натрия (Na3[Сr(OH)6]) • Гексанитрокобальтат(III) натрия (Na3[Co(NO2)6]) • Гексафтороалюминат натрия (Na3[AlF6]) • Гексафторосиликат натрия (Na2[SiF6]) • Гексафторостибат натрия (Na[SbF6]) • Гексафторофосфат(V) натрия (Na[PF6]) • Гексахлороиридат(III) натрия (Na3[IrCl6]) • Гексахлорородат(III) натрия (Na3[RhCl6]) • Германат натрия (Na2GeO3) • Гидрид натрия (NaH) • Гидрокарбонат натрия (NaHCO3) • Гидроксид натрия (NaOH) • Гидросульфат натрия (NaHSO4) • Гидросульфид натрия (NaHS) • Гидросульфит натрия (NaHSO3) • Гидрофосфат натрия (Na2HPO4) • Гипонитрит натрия (Na2N2O2) • Гипофосфит натрия (Na(PH2O2)) • Гипохлорит натрия (NaOCl) • Глутамат натрия (C5H8NNaO4) • Дигидропирофосфат натрия (Na2H2P2O7) • Дигидроортопериодат натрия (Na3H2IO6) • Дигидрофосфат натрия (NaH2PO4) • Диоксоферрат(III) натрия (NaFeO2) • Дитионат натрия (Na2S2O6) • Дитионит натрия (Na2S2O4) • Дихромат натрия (Na2Cr2O7) • Диэтилдитиокарбамат натрия (C5H10NS2Na) • Инозинат натрия (C10H11N2Na2O8P) • Иодат натрия (NaIO3) • Иодид натрия (NaI) • Карбонат натрия (Na2CO3) • Лаурилсульфат натрия (C12H25SO4Na) • Метаарсенит натрия (NaAsO2) • Метаборат натрия (NaBO2) • Метаванадат натрия (NaVO3) • Метадисульфит натрия (Na2S2O5) • Метасиликат натрия (Na2SiO3) • Метафосфат натрия (NaPO3) • Надпероксид натрия (NaO2) • Нитрат натрия (NaNO3) • Нитрид натрия (Na3N) • Нитрит натрия (NaNO2) • Нонагидридоренат(VII) натрия (Na2[ReH9]) • Оксид натрия (Na2O) • Ортованадат натрия (Na3VO4) • Ортосиликат натрия (Na4SiO4) • Ортотеллурат натрия (Na6TeO6) • Ортофосфат натрия (Na3PO4) • Пентаборат натрия (NaB5O8) • Периодат натрия (NaIO4) • Перманганат натрия (NaMnO4) • Пероксид натрия (Na2O2) • Перосмат натрия (Na2[OsO2(OH)4]) • Пиросульфат натрия (Na2S2O7) • Пирофосфат натрия (Na4P2O7) • Полисульфид натрия (Na2Sn) • Сегнетова соль (KNaC4H4O6•4H2O) • Селенат натрия (Na2SeO4) • Селенид натрия (Na2Se) • Селенит натрия (Na2SeO3) • Тиоантимонат натрия (Na3[SbS4]•9H2O) • Сульфат натрия (Na2SO4) • Сульфид натрия (Na2S) • Сульфит натрия (Na2SO3) • Тартрат натрия (Na2C4H4O6) • Теллурит натрия (Na2TeO3) • Теллурид натрия (Na2Te) • Тетраборат натрия (Na2B4O7) • Тетрагидроксоцинкат(II) натрия (Na2[Zn(OH)4]) • Тетраоксоманганат(V) натрия (Na3MnO4) • Тетратиоарсенат натрия (Na3[AsS4]) • Тиосульфат натрия (Na2S2O3) • Тиоцианат натрия (NaSCN) • Тритиостибат натрия (Na3[SbS3]) • Трифосфат натрия (Na5P3O10) • Фенилнатрий (NaC6H5) • Формиат натрия (HCOONa) • Фосфид натрия (Na3P) • Фосфит натрия (Na2(PHO2)) • Фторид натрия (NaF) • Хлорид натрия (NaCl) • Хлорат натрия (NaClO3) • Хлорит натрия (NaClO2) • Цианат натрия (NaNCO) • Этилнатрий (NaC2H5) |
|
Пищевые добавки |
|---|
|
Пищевые красители E1xx | Консерванты E2xx | Антиокислители и регуляторы кислотности E3xx | Стабилизаторы, загустители и эмульгаторы E4xx | Регуляторы рН и вещества против слёживания E5xx | Усилители вкуса и аромата, ароматизаторы E6xx | Антибиотики E7xx | Резерв E8xx | Прочие E9xx | Дополнительные вещества E1xxx Прочие: Воск (E900—909) • Глазурь (E910—919) • Восстановитель (E920—929) • Газ для упаковки (E930—949) • Заменители сахара (E950—969) • Вспениватель (E990—999) |
Поиск химических веществ по названиям или формулам.
Справочник содержит названия веществ и описания химических формул (в т.ч. структурные формулы и скелетные формулы).
Введите часть названия или формулу для поиска:
Языки:
По умолчанию |
Все возможные |
Из списка
|
Применить к найденному
Карбонат натрия
Брутто-формула:
CNa2O3
CAS# 497-19-8
Категории:
Неорганические соли
PubChem CID: 10340
| CB9853672
| ChemSpider ID: 9916
| CHEBI:29377
| CHEMBL186314
| MolPort-003-926-299
| NSC 156204
| UNII-45P3261C7T
Названия
Русский:
- Карбонат натрия [Wiki]
- динатрий(IUPAC)
- кальцинированная сода
- натрия карбонат
- триоксокарбонат(IUPAC)
- углекислый натрий
English:
- EINECS:207-838-8
- Soda ash
- Soda crystals
- Sodium carbonate(IUPAC) [Wiki]
- Washing soda
Варианты формулы:
Na2CO3
Na(+)2C(+4)O(-2)3
Na^+|0O`^-/`|O|O^-`|0Na^+
Na-O-C<`||O>-O-Na
Вещества, имеющие отношение…
Анион:
Карбонаты
Химический состав
Реакции, в которых участвует Карбонат натрия
-
Na2[Zn(OH)4] + CO2 -> Na2CO3 + Zn(OH)2″|v» + H2O
-
{M}2O + {X}O2 -> {M}2{X}O3
, где M =
Na K Li Rb Cs; X =
C S Si -
2AgNO3 + Na2CO3 -> Ag2CO3″|v» + 2NaNO3
-
Na2CO3 «851^oC»—> Na2O + CO2″|^»
-
2CO2 + 2Na2O2 -> 2Na2CO3 + O2
И ещё 83 реакции…
Государственное
образовательное учреждение
Высшего
профессионального образования
«Пермская
государственная фармацевтическая
академия
Федерального
агентства по здравоохранению и социальному
развитию
Российской
Федерации»
кафедра
аналитической химии
Курсовая
работа:
Карбонат
натрия.
Выполнила:
студентка
26 группы
Лекомцева
Вероника
Проверила:
Шурова
Лидия
Андреевна
Пермь,
2010
Содержание.
-
Карбонат
натрия (описание вещества)
3 -
Способы
получения
4 -
Качественный
анализ
5-
Аналитические
реакции катиона натрия
5 -
Аналитические
реакции карбонат иона
6
-
-
Количественный
анализ
8-
Кислотно-основное
титрование в водных растворах
8
-
-
Инструментальный
анализ
9-
Потенциометрический
метод
9
-
-
Практическое
применение карбоната натрия
10 -
Список
использованной литературы
11
2
-
Карбонат
натрия.
Формула
соединения:
Na2CO3.
Химическое
название:
Карбонат
натрия. Кальцинированная сода.
СОДА
– техническое название карбонатов
натрия. Na2CO3
– это нормальный карбонат или
кальцинированная (безводная) сода.
Na2CO3
– бесцветные кристаллы, с растворимостью
в 100 г. воды, при температуре 20ºС равна
– 14,9 г. Водные растворы имеют щелочную
реакцию.
Природные
источники незначительны (минералы:
натрон, термонатрит, трона).
3
-
Получение:
Карбонат
натрия получают главным образом
насыщением аммиаком и углекислым газом
раствора хлорида натрия и дальнейшим
нагреванием до 140º – 160º С , а также из
нефелина.
4
-
Качественный
анализ.
Качественный
анализ – это установление подлинности
неорганических веществ, основанное на
обнаружении с помощью аналитических
реакций катионов и анионов, образующих
молекулу вещества.
3.1.
Реакции на определение катиона натрия.
-
Реакция
с ацетатом диксоуран (VI)
цинка Zn(UO2)3(CH3COO)3
c
образованием жёлтого кристаллического
осадка или жёлтых кристаллов тетра- и
октаэдрической формы, нерастворимых
в уксусной кислоте. Для повышения
чувствительности реакции, следует
нагреть исследуемую смесь на предметном
стекле:
NaNO2
+ Zn(UO2)3(CH3COO)3
+CH3COOH
+ 9H2O
→
→NaZn(UO2)3(CH3COO)9
x 9H2O↓
+ HNO2
Избыток
ионов калия, катионы тяжёлых металлов
(Hg2+,
Sn2+,
Bi3+,
Fe3+
и др.). Реакция используется как дробная,
после удаления мешающих ионов.
-
Окрашивание
бесцветного пламени горелки в жёлтый
цвет. -
Реакция
с пикриновой кислотой, с образованием
кристаллов пикрата натрия жёлтого
цвета игольчатой формы, исходящие из
одной точки:
Реакция
используется как дробная только в
отсутствии мешающих ионов (K+,
NH4+,
Ag+).
5
-
Реакция
с гексагидроксостибатом (V)
калия K[Sb(OH)6]
с образованием белого кристаллического
осадка, растворимого в щелочах:
NaNO2
+ K[Sb(OH)6]
→ Na[Sb(OH)6]↓
+ KNO2
Условия
проведения реакции:
-
Достаточная
концентрация Na+; -
Нейтральная
реакция раствора; -
Проведение
реакции на холоде; -
Потирание
стеклянной палочкой о стенку пробирки.
Мешающие
ионы: NH4+,
Mg2+
и др.
В
кислой среде реагент разрушается с
образованием белого аморфного осадка
метасурьмяной кислоты HSbO3:
K[Sb(OH)6]
+ HCl → KCl + H3SbO4
+ 2H2O
H3SbO4
→ HSbO3↓
+ H2O.
-
Реакции
на определение карбонат иона.
-
Количественный
анализ.
4.1.
Кислотно-основное титрование в водных
растворах.
Стандартизация
0,1 М раствора серной кислоты
по
точной навеске карбоната натрия (способ
отдельных навесок).
Na2CO3
+ H2SO4
→ Na2SO4
+ CO2↑
+ H2O
М
(Na2CO3)
= 105,99 г/моль
Методика:
0,05-0,07 г (точная навеска) карбоната натрия
количественно переносят в колбу для
титрования, растворяют в 25 см3
дистиллированной воды, прибавляют 2-3
капли раствора метилового оранжевого
и титруют 0,1 М раствором серной кислоты
до перехода жёлтой окраски в
розовато-оранжевую.
Поправочный
коэффициент раствора серной кислоты
рассчитывают по формуле:
-
Инструментальный
анализ.
5.1.
Потенциометрический метод.
Потенциометрический
метод анализа основан на использовании
зависимости электродвижущей силы (ЭДС)
электрохимической ячейки от концентрации
анализируемого вещества в растворе.
Потенциометрическое
определение гидроксида и карбоната
натрия
при
совместном присутствии.
Определение
компонентов смеси в растворе основано
да дифференцированном титровании их
раствором хлороводородной кислоты с
фиксированием двух точек эквивалентности
по резкому скачку потенциала. В качестве
индикаторного используют стеклянный
электрод, электрод сравнения –
хлорсеребряный. В растворе смеси
гидроксида и карбоната натрия одновременно
могут находиться ионы Na+,
OH—,
HCO3—,
CO32-:
NaOH
→ Na+
+ OH—
Na2CO3
→ 2 Na+
+ CO32-
CO32-
+ H2O
↔ HCO3—
+ OH—
HCO3—
+ H2O
↔ H2CO3
+ OH—
В
присутствии гидроксида натрия подавляется
гидролиз карбоната натрия, поэтому при
титровании смеси этих соединений
кислотой сначала оттитровывается
гидроксид натрия. По мере уменьшения
содержания щёлочи в растворе, происходит
гидролиз карбоната натрия по первой
ступени и его взаимодействие с титрантом.
При
этом гидролиз карбоната натрия на второй
ступени и титрование продуктов гидролиза
не происходят, так как константы ионизации
соответствующих оснований отличаются
на четыре порядка:
При
этом наблюдается первый скачок титрования
(рН 8,3):
NaOH
+ HCl → NaCl + H2O
Na2CO3
+ HCl → NaCl + NaHCO3
Затем
титруется гидрокарбонат натрия,
наблюдается второй скачок титрования
(рН 3,8):
NaHCO3
+ HCl
→
NaCl
+ СО2
+ H2O
М
NaOH
= 40,00 г/моль
М
Na2CO3
= 105,99 г/моль
Методика:
2-4
см3
анализируемого раствора помещают в
стакан, вместимостью 50 см3
с магнитным стержнем, добавляют
дистиллированную воду до объёма.
Бюретку
заполняют 0,1 моль/дм3
раствором хлороводородной кислоты,
закрепляют штатив. Стакан с анализируемым
раствором устанавливают на столик
электромагнитной мешалки, погружают в
раствор электроды и приступают к
титрованию. Проводят ориентировочное
и точное титрования согласно общим
указаниям, фиксируя два скачка титрования
по резкому изменению потенциала.
Результаты измерений заносят в таблицы.
По
интегральному или дифференциальным
графикам находят:
-
V1
– объём титранта, соответствующий
первому скачку титрования, прореагирующий
со всей щёлочью и ½ количества карбоната
натрия до NaHCO3; -
Vобщ
– объём титранта, соответствующий
второму скачку титрования, прореагировавший
со щёлочью и карбонатом натрия.
По
результатам титрования рассчитывают:
V2
= Vобщ
— V1
– объём титранта, израсходованный на
титрование
½
Na2CO3
до
NaHCO3;
V3
= 2 V2
= 2(Vобщ
— V1)
– объём титранта, израсходованный
на
титрование всего Na2CO3;
V4
= (V1
— V2)
– объём титранта, израсходованный на
титрование NaOH.
Затем
рассчитывают Q
и ω%.
-
Практическое
применение.
Применяют
в стекольной, мыловаренной, текстильной,
целлюлозно-бумажной промышленности;
для очистки нефти и др.
-
Список
литературы.
-
Лурье
Ю.Ю. «Справочник по аналитической
химии», Москва, 1979; -
Методическое
пособие по аналитической химии.
«Инструментальные методы анализа»,
Пермь, 2004; -
Методическое
пособие по аналитической химии.
«Качественный химический анализ»,
Пермь, 2003; -
Методическое
пособие по аналитической химии.
«Количественный химический анализ»,
Пермь, 2004; -
«Новая
иллюстрированная энциклопедия», том
№ 8, 12, 17. Москва,
ООО
«Мир книги», 2001;
-
Рабинович
В.А., Хавин З.Я. «Краткий химический
справочник», Ленинград, Химия, 1977; -
Харитонов
Ю.Я. «Аналитическая химия», в 2х
книгах, Москва, 2001.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #