Что такое массовая доля
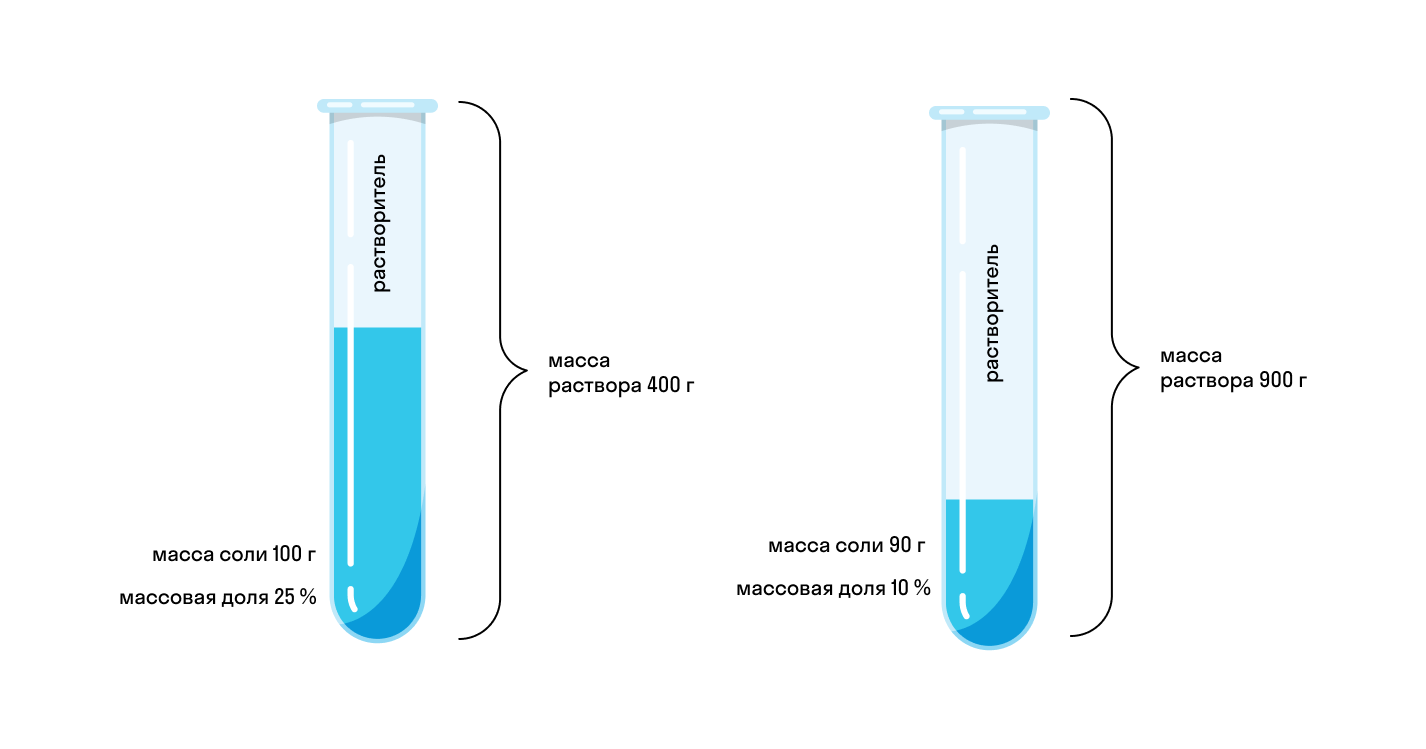
Начнем с примера: допустим, мы приготовили два раствора соли. Первый имеет массу 400 г и для него использовано 100 г соли. Масса второго 900 г и для него использовали 90 г соли. Какой раствор будет более концентрированным? Чтобы это понять, нужно выяснить процент соли в каждом растворе. Можно сказать иначе — нужно определить, какую долю в растворе занимает соль.
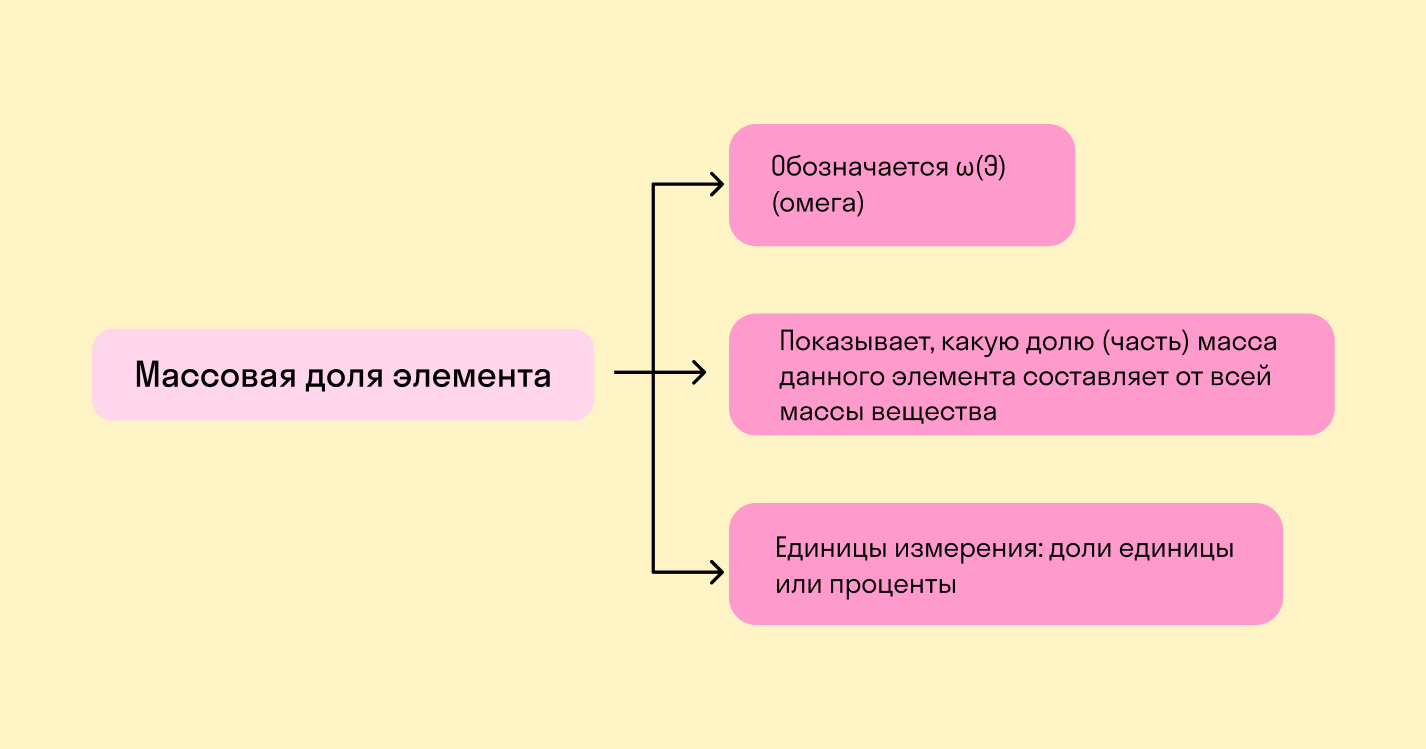
Массовая доля — это отношение растворенного вещества к массе раствора. Она может измеряться в процентах (от 0 до 100%) или в долях от единицы (от 0 до 1).
Как найти массовую долю растворенного вещества, расскажет формула:
где
— обозначение массовой доли;
— масса вещества;
— масса раствора.
В нашем примере и без формул понятно, что в первом растворе соль занимает 25%, а в то втором — только 10%. А что будет, если в первый раствор добавить еще столько же соли и воды? Очевидно, что на концентрацию это не повлияет. Доля соли останется прежней, пусть даже масса раствора увеличилась.
Массовая доля химического элемента — это отношение между относительной массой его атомов и относительной молекулярной массой соединения, частью которого является данный элемент.
Как видите, фактическая масса сложного вещества или его отдельного компонента не имеет значения. Если мы не знаем этих показателей, для расчетов берутся относительные величины.
Такое определение массовой доли элемента выражается формулой:
В данном случае:
-
— количество атомов искомого элемента;
-
— относительная атомная масса элемента;
-
— относительная молекулярная масса сложного вещества.
Если нужен показатель в процентах, результат надо умножить на 100%.
Практикующий детский психолог Екатерина Мурашова
Бесплатный курс для современных мам и пап от Екатерины Мурашовой. Запишитесь и участвуйте в розыгрыше 8 уроков
Относительная атомная и молекулярная масса
В формуле нахождения массовой доли мы видим две важные составляющие: относительную массу атома элемента (Ar) и относительную массу молекулы вещества (Mr). Разберемся, что это такое. И та, и другая величина — это отношение реальной массы к эталонной единице, за которую взята 1/12 массы атома углерода.
Относительная атомная масса элемента (Ar) говорит о том, насколько масса его атома больше 1/12 массы атома углерода. Для каждого элемента эта величина является постоянной и ее можно увидеть в таблице Менделеева.
Относительная молекулярная масса соединения (Mr) складывается из относительных атомных масс всех элементов в составе его молекулы. Она показывает, насколько молекула вещества больше 1/12 массы атома углерода.
Это не измеряемые величины, то есть они не имеют единиц измерения. Буква r в обозначениях относительной атомной и молекулярной массы восходит к английскому слову relative — «относительный».
Важно
Численно относительная молекулярная масса вещества равна его молярной массе, что удобно использовать в расчетах. Но путать эти два понятия не стоит. Относительная молекулярная масса характеризует 1 молекулу вещества, в то время как молярная масса — 1 моль вещества.
Как найти массовую долю элемента в веществе
Выше мы рассмотрели формулу для вычисления массовой доли химического элемента в веществе и узнали, откуда берутся ее составляющие. Применим эти знания на практике.
Пример 1
Оксид магния массой 8 г образовался при вступлении 4,8 г магния в реакцию с кислородом. Каковы массовые доли магния и кислорода в полученном оксиде?
Решение:
Для начала вычислим массу кислорода. Согласно закону сохранения массы веществ в соединении можно воспользоваться формулой m(O) = m(MgO) − m(Mg).
m(O) = 8 − 4,8 = 3,2 г
Вспоминаем, как найти массовую долю элемента в веществе: нужно понять, какую часть соединения оно составляет.
Зная массы каждого компонента оксида, сделать расчет несложно:
или
.
или
.
Ответ: массовые доли магния и кислорода в оксиде магния составляют 60% и 40% соответственно.
Пример 2
Потренируемся находить массовую долю элемента в сложном веществе. Определим, какую часть этилового спирта С2H6O составляет водород.
Решение:
В данном случае у нас нет конкретных указаний на массы элементов или всего вещества. Но мы можем воспользоваться другой формулой массовой доли в химии, которая позволяет работать с относительными величинами:
, значит
.
Согласно таблице Менделеева относительная атомная масса водорода равна единице.
Ar(H) = 1.
Вычислим относительную молекулярную массу соединения С2H6O, которая складывается из соответствующих масс каждого элемента:
Mr(С2H6O) = 2M(C) + 6M(H) + M(O) = 212 + 6 1 + 16 = 46.
Полученные данные подставим в формулу и определим массовую долю элемента в соединении:
или
.
Ответ: в этиловом спирте массовая доля водорода составляет 13%.
Как вычислить массовую долю вещества в растворе
Вспомним, что такое концентрация раствора. Она говорит о том, в каком соотношении находятся растворенное вещество и растворитель, а другими словами — сколько растворенного вещества содержится в единице объема или массы. Концентрация может быть безразмерной величиной и выражаться в процентах, но также ее можно выразить в массовых или в молярных долях.
Важно
Указание массовой доли вещества — один из способов выражения концентрации раствора.
В случае с растворами применима та же формула:
Если нужно значение в процентах, результат надо умножить на 100%.
Пример
Требуется приготовить 0,5 л раствора карбоната натрия плотностью 1,13 г/мл. Определите массу карбоната натрия при условии, что концентрация раствора должна быть 13%.
Решение:
Вначале нам нужно узнать массу раствора, что легко сделать, когда известны его объем и плотность. Воспользуется формулой m(р–ра) = ρ × V
m(р–ра) = 500 × 1,13 = 565 г.
Дальше вспомним, как находить массовую долю растворенного вещества:
, а значит
.
Поскольку концентрация раствора — это и есть массовая доля растворенного вещества, подставим ее в уравнение:
m(Э) = 0,13 × 565 = 73,45 г.
Ответ: для раствора понадобится 73,45 г карбоната натрия.
Вопросы для самопроверки:
-
Как обозначается массовая доля и в чем она выражается?
-
В чем разница между молекулярной массой вещества и его молярной массой?
-
Как найти массовую долю элемента в веществе, если мы знаем массу элемента и массу вещества?
-
Как рассчитать массовую долю вещества в растворе?
-
В каких безразмерных и размерных величинах можно выразить концентрацию раствора?
(Redirected from Mass percent)
In chemistry, the mass fraction of a substance within a mixture is the ratio 



Because the individual masses of the ingredients of a mixture sum to 
Mass fraction can also be expressed, with a denominator of 100, as percentage by mass (in commercial contexts often called percentage by weight, abbreviated wt%; see mass versus weight). It is one way of expressing the composition of a mixture in a dimensionless size; mole fraction (percentage by moles, mol%) and volume fraction (percentage by volume, vol%) are others.
When the prevalences of interest are those of individual chemical elements, rather than of compounds or other substances, the term mass fraction can also refer to the ratio of the mass of an element to the total mass of a sample. In these contexts an alternative term is mass percent composition. The mass fraction of an element in a compound can be calculated from the compound’s empirical formula[2] or its chemical formula.[3]
Terminology[edit]
Percent concentration does not refer to this quantity. This improper name persists, especially in elementary textbooks. In biology, the unit «%» is sometimes (incorrectly) used to denote mass concentration, also called mass/volume percentage. A solution with 1 g of solute dissolved in a final volume of 100 mL of solution would be labeled as «1%» or «1% m/v» (mass/volume). This is incorrect because the unit «%» can only be used for dimensionless quantities. Instead, the concentration should simply be given in units of g/mL. Percent solution or percentage solution are thus terms best reserved for mass percent solutions (m/m, m%, or mass solute/mass total solution after mixing), or volume percent solutions (v/v, v%, or volume solute per volume of total solution after mixing). The very ambiguous terms percent solution and percentage solutions with no other qualifiers continue to occasionally be encountered.
In thermal engineering, vapor quality is used for the mass fraction of vapor in the steam.
In alloys, especially those of noble metals, the term fineness is used for the mass fraction of the noble metal in the alloy.
Properties[edit]
The mass fraction is independent of temperature until phase change occurs.
[edit]
Mixing ratio[edit]
The mixing of two pure components can be expressed introducing the (mass) mixing ratio of them 
The mass ratio equals the ratio of mass fractions of components:
due to division of both numerator and denominator by the sum of masses of components.
Mass concentration[edit]
The mass fraction of a component in a solution is the ratio of the mass concentration of that component ρi (density of that component in the mixture) to the density of solution 
Molar concentration[edit]
The relation to molar concentration is like that from above substituting the relation between mass and molar concentration:
where 


Mass percentage[edit]
Mass percentage is defined as the mass fraction multiplied by 100.
Mole fraction[edit]
The mole fraction 
where 


Replacing the expression of the molar-mass products,
Spatial variation and gradient[edit]
In a spatially non-uniform mixture, the mass fraction gradient gives rise to the phenomenon of diffusion.
See also[edit]
- Mass-flux fraction
References[edit]
- ^ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the «Gold Book») (1997). Online corrected version: (2006–) «mass fraction». doi:10.1351/goldbook.M03722
- ^ Formula from Mass Composition.
- ^ «How to Calculate Mass Percent Composition». ThoughtCo. Retrieved 2018-01-05.
(Redirected from Mass percent)
In chemistry, the mass fraction of a substance within a mixture is the ratio 



Because the individual masses of the ingredients of a mixture sum to 
Mass fraction can also be expressed, with a denominator of 100, as percentage by mass (in commercial contexts often called percentage by weight, abbreviated wt%; see mass versus weight). It is one way of expressing the composition of a mixture in a dimensionless size; mole fraction (percentage by moles, mol%) and volume fraction (percentage by volume, vol%) are others.
When the prevalences of interest are those of individual chemical elements, rather than of compounds or other substances, the term mass fraction can also refer to the ratio of the mass of an element to the total mass of a sample. In these contexts an alternative term is mass percent composition. The mass fraction of an element in a compound can be calculated from the compound’s empirical formula[2] or its chemical formula.[3]
Terminology[edit]
Percent concentration does not refer to this quantity. This improper name persists, especially in elementary textbooks. In biology, the unit «%» is sometimes (incorrectly) used to denote mass concentration, also called mass/volume percentage. A solution with 1 g of solute dissolved in a final volume of 100 mL of solution would be labeled as «1%» or «1% m/v» (mass/volume). This is incorrect because the unit «%» can only be used for dimensionless quantities. Instead, the concentration should simply be given in units of g/mL. Percent solution or percentage solution are thus terms best reserved for mass percent solutions (m/m, m%, or mass solute/mass total solution after mixing), or volume percent solutions (v/v, v%, or volume solute per volume of total solution after mixing). The very ambiguous terms percent solution and percentage solutions with no other qualifiers continue to occasionally be encountered.
In thermal engineering, vapor quality is used for the mass fraction of vapor in the steam.
In alloys, especially those of noble metals, the term fineness is used for the mass fraction of the noble metal in the alloy.
Properties[edit]
The mass fraction is independent of temperature until phase change occurs.
[edit]
Mixing ratio[edit]
The mixing of two pure components can be expressed introducing the (mass) mixing ratio of them 
The mass ratio equals the ratio of mass fractions of components:
due to division of both numerator and denominator by the sum of masses of components.
Mass concentration[edit]
The mass fraction of a component in a solution is the ratio of the mass concentration of that component ρi (density of that component in the mixture) to the density of solution 
Molar concentration[edit]
The relation to molar concentration is like that from above substituting the relation between mass and molar concentration:
where 


Mass percentage[edit]
Mass percentage is defined as the mass fraction multiplied by 100.
Mole fraction[edit]
The mole fraction 
where 


Replacing the expression of the molar-mass products,
Spatial variation and gradient[edit]
In a spatially non-uniform mixture, the mass fraction gradient gives rise to the phenomenon of diffusion.
See also[edit]
- Mass-flux fraction
References[edit]
- ^ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the «Gold Book») (1997). Online corrected version: (2006–) «mass fraction». doi:10.1351/goldbook.M03722
- ^ Formula from Mass Composition.
- ^ «How to Calculate Mass Percent Composition». ThoughtCo. Retrieved 2018-01-05.