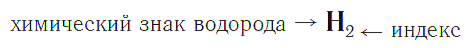Химическая формула вещества — условная запись вещества, отражающая его качественный и количественный состав.
Символы химических элементов показывают из каких атомов состоит вещество (его качественный состав), а индексы — число атомов химических элементов в веществе (его количественный состав).
Индекс — цифра, находящаяся справа внизу символа химического элемента, обозначающая число атомов этого элемента в химической формуле вещества.
Обрати внимание!
Индекс «(1)» в химической формуле опускается (не пишется).
Если в формуле записан знак химического элемента без индекса, значит, в частице вещества содержится один атом данного элемента.
Химические формулы веществ молекулярного строения показывают состав молекул. Это молекулярные формулы.
Пример:
(«о-два») — молекулярная формула кислорода. В молекуле кислорода содержатся два атома химического элемента кислорода.
(«гелий») — молекулярная формула инертного (благородного) газа гелия. Молекулы благородных газов одноатомные.
(«аш-два-эс-о-четыре») — молекулярная формула серной кислоты. Молекула серной кислоты содержит два атома водорода, один атом серы и четыре атома кислорода.
Химические формулы веществ немолекулярного строения показывают простейшее соотношение числа атомов химических элементов в веществе. Такие формулы называют простейшими формулами.
Группа атомов, состав которой соответствует простейшей формуле вещества, называется формульной единицей.
Для простых веществ немолекулярного строения формульной единицей является атом, поэтому их формулы записывают просто знаками химических элементов без индексов.
Пример:
(«купрум»)— формула меди, которая показывает, что её формульной единицей является атом.
(«феррум-два-о-три») — простейшая формула оксида железа(
III
). В этом веществе на два атома железа приходится три атома кислорода.
Обрати внимание!
Повторяющиеся группы атомов в формуле заключают в скобки.
Пример:
(«магний-о-аш-дважды»)— в гидроксиде магния на один атом магния приходится два атома кислорода и два атома водорода.
(«кальций-три-пэ-о-четыре-дважды»)— в фосфате кальция на три атома кальция приходится два атома фосфора и восемь атомов кислорода.
В химических записях используются коэффициенты.
Коэффициент — цифра в химической записи, которая ставится перед формулой и показывает число отдельных атомов, молекул или формульных единиц.
Обрати внимание!
Коэффициент «(1)» не записывается.
Пример:
— три молекулы водорода, каждая из которых состоит из двух атомов химического элемента водорода.
— десять молекул серной кислоты, содержащих по два атома водорода, одному атому серы и по четыре атома кислорода.
— две формульные единицы гидроксида магния, состоящие из одного атома магния, двух атомов кислорода и двух атомов водорода.
Загрузить PDF
Загрузить PDF
Молекулярная формула содержит важную информацию о соответствующем химическом соединении. По ней можно определить, из каких атомов состоит данное соединение, и сколько атомов каждого элемента содержится в нем. Для нахождения молекулярной формулы необходимо знать эмпирическую формулу. Чтобы получить из эмпирической формулы молекулярную, следует умножить экспериментальные значения на целочисленный множитель.
-
1
Необходимо понимать связь между молекулярной и эмпирической формулами. Эмпирическая формула показывает количественное соотношение атомов в молекуле: например, два атома кислорода на каждый атом углерода. Молекулярная формула указывает на то, сколько атомов каждого вида входит в состав молекулы: к примеру, один атом углерода и два атома кислорода (диоксид углерода, или углекислый газ). Эти две формулы однозначно соотносятся друг с другом, и если умножить эмпирическую формулу на их целочисленное отношение, то получится молекулярная формула.[1]
-
2
Вычислите количество молей газа. Используйте для этого уравнение состояния идеального газа. С его помощью можно найти количество молей вещества, если известны давление, объем и температура, которые определяются экспериментальным путем. Количество молей находится по следующей формуле: n = PV/RT.[2]
- В данной формуле n — количество молей, P — давление, V — объем, T — температура в Кельвинах, и R — универсальная газовая постоянная.
- Например: n = PV/RT = (0,984 атм * 1 л) / (0,08206 л атм моль-1 K-1 * 318,15 K) = 0,0377 моль
-
3
Определите молекулярный вес газа. Это можно сделать лишь после того, как с помощью уравнения состояния идеального газа вы найдете количество молей газа. Необходимо также знать массу газа. Для того, чтобы найти молекулярный вес газа, следует поделить его массу в граммах на количество молей.
- Например: 14,42 г / 0.0377 моль = 382,49 г/моль
-
4
Сложите атомные веса всех атомов, которые входят в эмпирическую формулу. Каждый атом в эмпирической формуле имеет свой атомный вес. Этот вес можно найти в периодической таблице Менделеева под символом соответствующего элемента. Сложите атомные веса входящих в эмпирическую формулу элементов.[3]
- Например: (12,0107 г * 12) + (15,9994 г * 1) + (1,00794 г * 30) = 144,1284 + 15,9994 + 30,2382 = 190,366 г
-
5
Найдите соотношение между весами в молекулярной и эмпирической формулах. Таким образом вы определите, сколько раз эмпирический вес повторяется в реальной молекуле. Это позволит вам найти число повторений эмпирической формулы в молекулярной. Найденная величина должна представлять собой целое число. Если получится дробное число, необходимо округлить его до целого.
- Например: 382,49 / 190,366 = 2,009
-
6
Умножьте эмпирическую формулу на найденное соотношение. Умножьте подстрочные индексы в эмпирической формуле на полученное соотношение. В результате вы найдете молекулярную формулу. Если соотношение равно “1”, то молекулярная формула совпадает с эмпирической.
- Например: C12OH30 * 2 = C24O2H60
Реклама
-
1
Найдите массу каждого атома. Иногда массы атомов даются в условии. В некоторых задачах указываются массовые проценты. В последнем случае предположите, что полная масса вещества составляет 100 граммов — это позволит вам записать массовые проценты в виде обычной массы в граммах.[4]
- Например: 75,46 г C, 8,43 г O, 16,11 г H
-
2
Переведите массу в моли. Следует перевести молекулярную массу каждого элемента в количество молей. Для этого необходимо поделить молекулярную массу каждого элемента на его атомную массу. Атомные массы можно найти в периодической таблице Менделеева под символами соответствующих элементов.[5]
- Например:
- 75,46 г C * (1 моль / 12,0107 г) = 6,28 моль C
- 8,43 г O * (1 моль / 15,9994 г) = 0,53 моль O
- 16,11 г H * (1 моль / 1,00794) = 15,98 моль H
- Например:
-
3
Поделите все молярные значения на наименьшее количество молей. Необходимо найти элемент с минимальным количеством молей и поделить на эту величину количество молей каждого элемента, входящего в данное соединение. Таким образом вы найдете простейшие мольные соотношения. В результате для самого малочисленного элемента у вас получится “1”, а для остальных элементов числа больше единицы.[6]
- Например: меньше всего в соединении кислорода, его количество составляет 0,53 моль.
- 6,28 моль/0,53 моль = 11,83
- 0,53 моль/0,53 моль = 1
- 15,98 моль/0,53 моль= 30,15
- Например: меньше всего в соединении кислорода, его количество составляет 0,53 моль.
-
4
Округлите количество молей до целых чисел. Молярные количества войдут в эмпирическую формулу в виде подстрочных индексов. Необходимо округлить их до ближайших целых чисел. После нахождения этих чисел можно записать эмпирическую формулу.[7]
- Например: эмпирическая формула имеет вид C12OH30:
- 11,83 = 12
- 1 = 1
- 30,15 = 30
Реклама
- Например: эмпирическая формула имеет вид C12OH30:
-
1
Ознакомьтесь с понятием эмпирической формулы. Эмпирическая формула содержит информацию о соотношении количества атомов в молекуле. Она не показывает, сколько именно атомов входит в состав данной молекулы. Кроме того, эмпирическая формула не позволяет судить о структуре молекулы и связях между входящими в нее атомами.[8]
-
2
Узнайте о том, какая информация содержится в молекулярной формуле. Как и эмпирическая формула, молекулярная формула не позволяет судить о структуре молекулы и связях между атомами. Однако в отличие от эмпирической формулы, молекулярная формула показывает, сколько атомов того или иного элемента входит в состав молекулы. Между эмпирической и молекулярной формулами существует целочисленное соотношение.[9]
-
3
Ознакомьтесь с понятием структурной формулы. Структурная формула содержит больше информации, чем молекулярная формула. Помимо количества атомов каждого вида, структурная формула содержит информацию о связях между атомами и структуре молекулы. Эта информация очень важна для понимания того, как молекула будет реагировать с другими веществами.[10]
Реклама
Советы
- Внимательно прочитайте условие задачи и начальные данные.
Реклама
Предупреждения
- Не путайте эмпирические и молекулярные формулы.
Реклама
Что вам понадобится
- Периодическая таблица Менделеева
- Калькулятор
- Карандаш
- Лист бумаги
Похожие статьи
Об этой статье
Эту страницу просматривали 21 810 раз.
Была ли эта статья полезной?
В уроке 5 «Химическая формула» из курса «Химия для чайников» дадим определение химическим формулам и их индексам, а также выясним различия химических формул веществ молекулярного и немолекулярного строения. Напоминаю, что в прошлом уроке «Сложные вещества» мы дали определение химическим соединениям, рассмотрели различия органических и неорганических соединений, а также выяснили, что означает качественный и количественный состав.
Состав любого вещества выражается в виде химической формулы.
Химическая формула — это условная запись состава вещества с помощью химических знаков и индексов.
Качественный состав показывается с помощью знаков (символов) химических элементов, а количественный — с помощью индексов, которые записываются справа и чуть ниже знаков химических элементов.
Индекс — число атомов данного химического элемента в формуле вещества.
Например, химическая формула простого вещества водорода записывается так:
и читается «аш-два».
Химические формулы веществ молекулярного строения
Формулы двухатомных молекул: кислорода — О2 («о-два»), хлора — Сl2 («хлор-два»), азота — N2 («эн-два»). Трехатомная молекула озона и восьмиатомная молекула серы обозначаются формулами О3 («о-три») и S8 («эс-восемь»).
Формулы молекул сложных веществ также отображают их качественный и количественный состав. Например, формула воды, как вы уже, наверное, хорошо знаете, Н2О («аш-два-о»), метана — СН4 («це-аш-четыре»), а аммиака — NH3 («эн-аш-три»). Точно так же читаются формулы любых сложных веществ. Например, формула серной кислоты — H2SO4 («аш-два-эс-о-четыре»), а глюкозы — C6H12O6 («це-шесть-аш-двенадцать-о-шесть»).
Химические формулы веществ молекулярного строения (их называют молекулярными формулами) показывают состав элементарных частей, т. е. условных «кирпичиков», из которых состоят эти вещества. Такими элементарными составными частями (элементарными структурными единицами, или просто структурными единицами) в данном случае являются молекулы.
Химические формулы веществ немолекулярного строения
А если вещество имеет немолекулярное строение? Химические формулы простых веществ такого типа (например, металлов) записывают просто знаками соответствующих элементов без индексов (или, вернее, с индексом, равным единице, которая не записывается). Так, формула простого вещества железа — Fe, меди — Cu, алюминия — Al.
Состав сложных веществ немолекулярного строения выражают с помощью формул, которые показывают простейшее соотношение чисел атомов разных химических элементов в этих веществах. Такие формулы называются простейшими. Например, простейшая формула кварца — главной составной части речного песка — SiO2. Она показывает, что в кристалле кварца на один атом кремния приходятся два атома кислорода, т. е. простейшее соотношение чисел атомов кремния и кислорода в этом веществе равно 1:2. Простейшая формула Al2O3 показывает, что в этом соединении простейшее соотношение между числами атомов алюминия и кислорода равно 2:3.
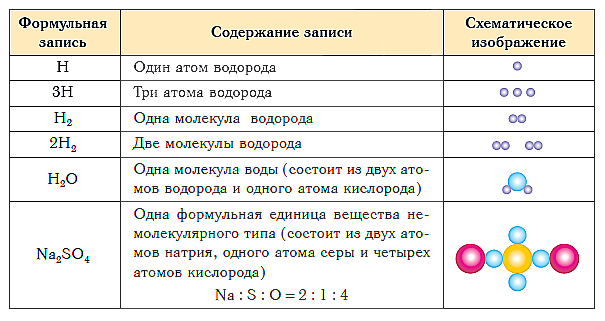
Группа атомов, состав которой соответствует простейшей формуле вещества немолекулярного строения, называется его формульной единицей.
Формульная единица, поваренной соли NaCl («натрий-хлор») — группа из одного атома натрия и одного атома хлора. Формульная единица мела CaCO3 («кальций-це-о-три») — группа из одного атома кальция, одного атома углерода и трех атомов кислорода.
Формулы более сложных соединений немолекулярного строения читаются аналогично. Дополнительно указывается только число групп атомов, заключенных в круглые скобки: Al2(SO4)3 («алюминий-два-эс-о-четыре-трижды»), Mg(NO3)2 («магний-эн-о-три-дважды») и т. д.
Таким образом, структурными единицами веществ молекулярного строения являются молекулы. Структурными единицами веществ немолекулярного строения являются их формульные единицы.
В таблице ниже показаны формульная запись и схематическое изображение состава веществ различного типа.
Краткие выводы урока:
- Качественный и количественный состав вещества выражается с помощью химических формул.
- Химическая формула вещества молекулярного строения показывает состав его молекулы, которая является элементарной структурной единицей данного вещества.
- Химическая формула вещества немолекулярного строения показывает простейшее соотношение атомов в его формульной единице.
Надеюсь урок 5 «Химическая формула» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Download Article
Download Article
The molecular formula is an important piece of information for any chemical compound. The molecular formula tells you which atoms are present in the compound, and how many of each are present. You will need to know the empirical formula to calculate the molecular formula, and you will need to know that the difference between these two formulas is a whole number multiplier.
-
1
Know the relationship between molecular and empirical formulae. The empirical formula provides the simplest, most reduced ratio of elements within a molecule, for example, two oxygens for every carbon. The molecular formula tells you how many of each of those atoms is present in the molecule. For example, one carbon and two oxygens (carbon dioxide). The two formulae are related by a whole number ratio such that if the empirical formula is multiplied by the ratio, it will yield the molecular formula.[1]
-
2
Calculate the number of moles of gas. This means utilizing the ideal gas law. You can determine the number of moles based on the pressure, volume, and temperature provided by the experimental data. The number of moles can be calculated using the following formula: n = PV/RT.[2]
- In this formula, n is the number of moles, P is the pressure, V is the volume, T is the temperature in Kelvin, and R is the gas constant.
- Example: n = PV/RT = (0.984 atm * 1 L) / (0.08206 L atm mol-1 K-1 * 318.15 K) = 0.0377 mol
Advertisement
-
3
Calculate the molecular weight of the gas. This can only be done after finding the moles of gas present using the ideal gas law. You will also need to know how many grams of gas were present. Then divide the grams of gas by the moles of gas present to yield molecular weight.
- Example: 14.42 g / 0.0377 mol = 382.49 g/mol
-
4
Add together the atomic weight of all atoms in the empirical formula. Each atom in the empirical formula has its own atomic weight. This value can be found at the bottom of the atom’s square on the periodic table. Add these weights together to get the weight of the empirical formula.[3]
- For example, carbon has an atomic weight of 12.0107, hydrogen has an atomic weight of 1.00794, and oxygen has an atomic weight of 15.9994. It’s okay to look up the atomic weight if you don’t know it.
- Example: (12.0107 g * 12) + (15.9994 g * 1) + (1.00794 g * 30) = 144.1284 + 15.9994 + 30.2382 = 190.366 g
-
5
Find the ratio between the molecular and empirical formula weights. In doing this, you can determine how many times the empirical weight is repeated within the actual molecule. Knowing how many times the empirical weight is repeated will let you find the number of times that the empirical formula repeats itself in the molecular formula. This should be a whole number. If the ratio is not a whole number, you will have to round it.
- Example: 382.49 / 190.366 = 2.009
-
6
Multiply the empirical formula by the ratio. Multiply the subscripts of the empirical formula by the ratio. This will yield the molecular formula. Note that for any compound with a ratio of “1,” the empirical formula and molecular formula will be the same.
- Example: C12OH30 * 2 = C24O2H60
Advertisement
-
1
Find the mass of each atom present. Sometimes the mass of each atom will be given. Other times, it will be given as a percent mass. If this is the case, assume a 100 g sample of the compound. This will allow you to write the percent mass as an actual mass in grams.[4]
- Example: 75.46 g C, 8.43 g O, 16.11 g H
-
2
Convert the masses to moles. You need to convert the molecular masses of each element to moles. In order to do this, you need to divide the molecular masses by the atomic masses of each respective element. You can find the atomic mass in the bottom of that element’s square on the periodic table.[5]
- Example:
- 75.46 g C * (1 mol / 12.0107 g) = 6.28 mol C
- 8.43 g O * (1 mol / 15.9994 g) = 0.53 mol O
- 16.11 g H * (1 mol / 1.00794) = 15.98 mol H
- Example:
-
3
Divide all molar values by the smallest molar value. You need to divide the number of moles for each separate element by the smallest molar amount from all the elements present in the compound. In doing so, you can find the simplest mole ratios. This works, because it gives sets the least abundant element to “1” and provides the respective ratios of other elements in the compound.[6]
- Example: Smallest molar amount is oxygen with 0.53 mol.
- 6.28 mol/0.53 mol = 11.83
- 0.53 mol/0.53 mol = 1
- 15.98 mol/0.53 mol= 30.15
- Example: Smallest molar amount is oxygen with 0.53 mol.
-
4
Round your molar values to whole numbers. These numbers will become the subscripts in the empirical formula. You should round them to the nearest whole number. After finding these numbers, you can write the empirical formula.[7]
- Example: The empirical formula would be C12OH30
- 11.83 = 12
- 1 = 1
- 30.15 = 30
- Example: The empirical formula would be C12OH30
Advertisement
-
1
Understand an empirical formula. An empirical formula gives you information about the molar ratios of one atom to another in a molecule. This does not provide any information about exactly how many atoms are present in the molecule. The empirical formula also fails to provide information about the structure and bonding of atoms in a molecule.[8]
-
2
Know what a molecular formula tells you. Like the empirical formula, the molecular formula fails to provide information about the bonding and structure of a molecule. Unlike the empirical formula, the molecular formula gives you details about how many of each atom is present in the molecule. The empirical formula and molecular formula are related by a whole number ratio.[9]
-
3
Understand structural representations. Structural representations give even more information than molecular formulas. In addition to showing how many of each atom is present in a molecule, structural representations give you information about the bonding and structure of the molecule. This information is crucial to understanding the way the molecule will react.[10]
- There are several different types of structural representations, which show you different things about the compound. For example, it might show the compound’s connectivity or its molecular shape, such as by drawing dashed lines to indicate their bonds.
Advertisement
Add New Question
-
Question
How do I find molecular formulas?
Meredith Juncker is a PhD candidate in Biochemistry and Molecular Biology at Louisiana State University Health Sciences Center. Her studies are focused on proteins and neurodegenerative diseases.
Scientific Researcher
Expert Answer
Support wikiHow by
unlocking this expert answer.You can follow the steps above. Start by finding the empirical formula. You should then calculate the empirical formula weight. Then, divide the molecular formula weight by the empirical formula weight. This answer gives you the number you’ll need to multiply the subscripts in the empirical formula to get the molecular formula. You can double check that you got the right answer by calculating the molecular molar mass of the molecular formula you calculated.
-
Question
A compound contains 3.2g of Cu, 0.6g of C and 2.4 O2. How do I find its empirical formula?
You would first need to convert each of the gram measurements to moles. Accomplish this by dividing each by its respective atomic mass on the periodic table. Then divide each measurement by the lowest mole amount. You can continue doing this until you get whole number subscripts.
-
Question
If the molar mass is 99 g/mol, what is the molecular formula?
We do not have enough information. It could be multiple elements in different ratios.
See more answers
Ask a Question
200 characters left
Include your email address to get a message when this question is answered.
Submit
Advertisement
-
Read the problem (or data) carefully.
-
Keep in mind that the lowest number of atoms in a molecule for some elements might not be 1. For example, a ratio could be 1.333, which as a fraction is 4/3. To get rid of your fraction, you can multiply by the denominator, in this case 3.
Advertisement
-
Do not confuse the empirical formula with the molecular formula or vice versa.
Advertisement
Things You’ll Need
- Periodic table of elements
- Calculator
- Pencil
- Paper
References
About This Article
Article SummaryX
To find a molecular formula, start by calculating the number of moles and the molecular weight of the gas using their respective formulas. Then, add together the atomic weight of each of the atoms in the formula, which you can find using the periodic table. Next, divide the molecular weight by the empirical formula weights to come up with a ratio. Finally, multiply the entire empirical formula by this ratio to yield the molecular formula. For tips from our Science reviewer on how to remember the differences between a molecular formula and an empirical formula, read on!
Did this summary help you?
Thanks to all authors for creating a page that has been read 162,638 times.
Did this article help you?
Download Article
Download Article
The molecular formula is an important piece of information for any chemical compound. The molecular formula tells you which atoms are present in the compound, and how many of each are present. You will need to know the empirical formula to calculate the molecular formula, and you will need to know that the difference between these two formulas is a whole number multiplier.
-
1
Know the relationship between molecular and empirical formulae. The empirical formula provides the simplest, most reduced ratio of elements within a molecule, for example, two oxygens for every carbon. The molecular formula tells you how many of each of those atoms is present in the molecule. For example, one carbon and two oxygens (carbon dioxide). The two formulae are related by a whole number ratio such that if the empirical formula is multiplied by the ratio, it will yield the molecular formula.[1]
-
2
Calculate the number of moles of gas. This means utilizing the ideal gas law. You can determine the number of moles based on the pressure, volume, and temperature provided by the experimental data. The number of moles can be calculated using the following formula: n = PV/RT.[2]
- In this formula, n is the number of moles, P is the pressure, V is the volume, T is the temperature in Kelvin, and R is the gas constant.
- Example: n = PV/RT = (0.984 atm * 1 L) / (0.08206 L atm mol-1 K-1 * 318.15 K) = 0.0377 mol
Advertisement
-
3
Calculate the molecular weight of the gas. This can only be done after finding the moles of gas present using the ideal gas law. You will also need to know how many grams of gas were present. Then divide the grams of gas by the moles of gas present to yield molecular weight.
- Example: 14.42 g / 0.0377 mol = 382.49 g/mol
-
4
Add together the atomic weight of all atoms in the empirical formula. Each atom in the empirical formula has its own atomic weight. This value can be found at the bottom of the atom’s square on the periodic table. Add these weights together to get the weight of the empirical formula.[3]
- For example, carbon has an atomic weight of 12.0107, hydrogen has an atomic weight of 1.00794, and oxygen has an atomic weight of 15.9994. It’s okay to look up the atomic weight if you don’t know it.
- Example: (12.0107 g * 12) + (15.9994 g * 1) + (1.00794 g * 30) = 144.1284 + 15.9994 + 30.2382 = 190.366 g
-
5
Find the ratio between the molecular and empirical formula weights. In doing this, you can determine how many times the empirical weight is repeated within the actual molecule. Knowing how many times the empirical weight is repeated will let you find the number of times that the empirical formula repeats itself in the molecular formula. This should be a whole number. If the ratio is not a whole number, you will have to round it.
- Example: 382.49 / 190.366 = 2.009
-
6
Multiply the empirical formula by the ratio. Multiply the subscripts of the empirical formula by the ratio. This will yield the molecular formula. Note that for any compound with a ratio of “1,” the empirical formula and molecular formula will be the same.
- Example: C12OH30 * 2 = C24O2H60
Advertisement
-
1
Find the mass of each atom present. Sometimes the mass of each atom will be given. Other times, it will be given as a percent mass. If this is the case, assume a 100 g sample of the compound. This will allow you to write the percent mass as an actual mass in grams.[4]
- Example: 75.46 g C, 8.43 g O, 16.11 g H
-
2
Convert the masses to moles. You need to convert the molecular masses of each element to moles. In order to do this, you need to divide the molecular masses by the atomic masses of each respective element. You can find the atomic mass in the bottom of that element’s square on the periodic table.[5]
- Example:
- 75.46 g C * (1 mol / 12.0107 g) = 6.28 mol C
- 8.43 g O * (1 mol / 15.9994 g) = 0.53 mol O
- 16.11 g H * (1 mol / 1.00794) = 15.98 mol H
- Example:
-
3
Divide all molar values by the smallest molar value. You need to divide the number of moles for each separate element by the smallest molar amount from all the elements present in the compound. In doing so, you can find the simplest mole ratios. This works, because it gives sets the least abundant element to “1” and provides the respective ratios of other elements in the compound.[6]
- Example: Smallest molar amount is oxygen with 0.53 mol.
- 6.28 mol/0.53 mol = 11.83
- 0.53 mol/0.53 mol = 1
- 15.98 mol/0.53 mol= 30.15
- Example: Smallest molar amount is oxygen with 0.53 mol.
-
4
Round your molar values to whole numbers. These numbers will become the subscripts in the empirical formula. You should round them to the nearest whole number. After finding these numbers, you can write the empirical formula.[7]
- Example: The empirical formula would be C12OH30
- 11.83 = 12
- 1 = 1
- 30.15 = 30
- Example: The empirical formula would be C12OH30
Advertisement
-
1
Understand an empirical formula. An empirical formula gives you information about the molar ratios of one atom to another in a molecule. This does not provide any information about exactly how many atoms are present in the molecule. The empirical formula also fails to provide information about the structure and bonding of atoms in a molecule.[8]
-
2
Know what a molecular formula tells you. Like the empirical formula, the molecular formula fails to provide information about the bonding and structure of a molecule. Unlike the empirical formula, the molecular formula gives you details about how many of each atom is present in the molecule. The empirical formula and molecular formula are related by a whole number ratio.[9]
-
3
Understand structural representations. Structural representations give even more information than molecular formulas. In addition to showing how many of each atom is present in a molecule, structural representations give you information about the bonding and structure of the molecule. This information is crucial to understanding the way the molecule will react.[10]
- There are several different types of structural representations, which show you different things about the compound. For example, it might show the compound’s connectivity or its molecular shape, such as by drawing dashed lines to indicate their bonds.
Advertisement
Add New Question
-
Question
How do I find molecular formulas?
Meredith Juncker is a PhD candidate in Biochemistry and Molecular Biology at Louisiana State University Health Sciences Center. Her studies are focused on proteins and neurodegenerative diseases.
Scientific Researcher
Expert Answer
Support wikiHow by
unlocking this expert answer.You can follow the steps above. Start by finding the empirical formula. You should then calculate the empirical formula weight. Then, divide the molecular formula weight by the empirical formula weight. This answer gives you the number you’ll need to multiply the subscripts in the empirical formula to get the molecular formula. You can double check that you got the right answer by calculating the molecular molar mass of the molecular formula you calculated.
-
Question
A compound contains 3.2g of Cu, 0.6g of C and 2.4 O2. How do I find its empirical formula?
You would first need to convert each of the gram measurements to moles. Accomplish this by dividing each by its respective atomic mass on the periodic table. Then divide each measurement by the lowest mole amount. You can continue doing this until you get whole number subscripts.
-
Question
If the molar mass is 99 g/mol, what is the molecular formula?
We do not have enough information. It could be multiple elements in different ratios.
See more answers
Ask a Question
200 characters left
Include your email address to get a message when this question is answered.
Submit
Advertisement
-
Read the problem (or data) carefully.
-
Keep in mind that the lowest number of atoms in a molecule for some elements might not be 1. For example, a ratio could be 1.333, which as a fraction is 4/3. To get rid of your fraction, you can multiply by the denominator, in this case 3.
Advertisement
-
Do not confuse the empirical formula with the molecular formula or vice versa.
Advertisement
Things You’ll Need
- Periodic table of elements
- Calculator
- Pencil
- Paper
References
About This Article
Article SummaryX
To find a molecular formula, start by calculating the number of moles and the molecular weight of the gas using their respective formulas. Then, add together the atomic weight of each of the atoms in the formula, which you can find using the periodic table. Next, divide the molecular weight by the empirical formula weights to come up with a ratio. Finally, multiply the entire empirical formula by this ratio to yield the molecular formula. For tips from our Science reviewer on how to remember the differences between a molecular formula and an empirical formula, read on!
Did this summary help you?
Thanks to all authors for creating a page that has been read 162,638 times.