«Ant acid» redirects here. For substances that neutralize stomach acidity, see antacid.
|
||

|
||
| Names | ||
|---|---|---|
| Preferred IUPAC name
Formic acid[1] |
||
| Systematic IUPAC name
Methanoic acid[1] |
||
| Other names
Carbonous acid; Formylic acid; Hydrogen carboxylic acid; Hydroxy(oxo)methane; Metacarbonoic acid; Oxocarbinic acid; Oxomethanol |
||
| Identifiers | ||
|
CAS Number |
|
|
|
3D model (JSmol) |
|
|
|
Beilstein Reference |
1209246 | |
| ChEBI |
|
|
| ChEMBL |
|
|
| ChemSpider |
|
|
| DrugBank |
|
|
| ECHA InfoCard | 100.000.527 |
|
| EC Number |
|
|
| E number | E236 (preservatives) | |
|
Gmelin Reference |
1008 | |
| KEGG |
|
|
|
PubChem CID |
|
|
| RTECS number |
|
|
| UNII |
|
|
|
CompTox Dashboard (EPA) |
|
|
|
InChI
|
||
|
SMILES
|
||
| Properties | ||
|
Chemical formula |
CH2O2 | |
| Molar mass | 46.025 g·mol−1 | |
| Appearance | Colorless fuming liquid | |
| Odor | Pungent, penetrating | |
| Density | 1.220 g/mL | |
| Melting point | 8.4 °C (47.1 °F; 281.5 K) | |
| Boiling point | 100.8 °C (213.4 °F; 373.9 K) | |
|
Solubility in water |
Miscible | |
| Solubility | Miscible with ether, acetone, ethyl acetate, glycerol, methanol, ethanol Partially soluble in benzene, toluene, xylenes |
|
| log P | −0.54 | |
| Vapor pressure | 35 mmHg (20 °C)[2] | |
| Acidity (pKa) | 3.745[3] | |
| Conjugate base | Formate | |
|
Magnetic susceptibility (χ) |
−19.90×10−6 cm3/mol | |
|
Refractive index (nD) |
1.3714 (20 °C) | |
| Viscosity | 1.57 cP at 268 °C | |
| Structure | ||
|
Molecular shape |
Planar | |
|
Dipole moment |
1.41 D (gas) | |
| Thermochemistry | ||
|
Std molar |
131.8 J/mol K | |
|
Std enthalpy of |
−425.0 kJ/mol | |
|
Std enthalpy of |
−254.6 kJ/mol | |
| Pharmacology | ||
|
ATCvet code |
QP53AG01 (WHO) | |
| Hazards | ||
| Occupational safety and health (OHS/OSH): | ||
|
Main hazards |
Corrosive; irritant; sensitizer |
|
| GHS labelling: | ||
|
Pictograms |

|
|
|
Signal word |
Danger | |
|
Hazard statements |
H314 | |
|
Precautionary statements |
P260, P264, P280, P301+P330+P331, P303+P361+P353, P304+P340, P305+P351+P338, P310, P321, P363, P405, P501 | |
| NFPA 704 (fire diamond) |
3 2 0 |
|
| Flash point | 69 °C (156 °F; 342 K) | |
|
Autoignition |
601 °C (1,114 °F; 874 K) | |
| Explosive limits | 14–34%[citation needed] 18–57% (90% solution)[2] |
|
| Lethal dose or concentration (LD, LC): | ||
|
LD50 (median dose) |
700 mg/kg (mouse, oral), 1100 mg/kg (rat, oral), 4000 mg/kg (dog, oral)[4] | |
|
LC50 (median concentration) |
7853 ppm (rat, 15 min) 3246 ppm (mouse, 15 min)[4] |
|
| NIOSH (US health exposure limits): | ||
|
PEL (Permissible) |
TWA 5 ppm (9 mg/m3)[2] | |
|
REL (Recommended) |
TWA 5 ppm (9 mg/m3)[2] | |
|
IDLH (Immediate danger) |
30 ppm[2] | |
| Safety data sheet (SDS) | MSDS from JT Baker | |
| Related compounds | ||
|
Related carboxylic acids |
Acetic acid Propionic acid |
|
|
Related compounds |
Formaldehyde Methanol |
|
| Supplementary data page | ||
| Formic acid (data page) | ||
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Formic acid (from Latin formica ‘ant’), systematically named methanoic acid, is the simplest carboxylic acid, and has the chemical formula HCOOH and structure H−C(=O)−O−H. It is an important intermediate in chemical synthesis and occurs naturally, most notably in some ants. Esters, salts and the anion derived from formic acid are called formates. Industrially, formic acid is produced from methanol.
Natural occurrence[edit]
In nature, formic acid is found in most ants and in stingless bees of the genus Oxytrigona.[5][6] Wood ants from the genus Formica can spray formic acid on their prey or to defend the nest. The puss moth caterpillar (Cerura vinula) will spray it as well when threatened by predators. It is also found in the trichomes of stinging nettle (Urtica dioica). Apart from that, this acid is incorporated in many fruits such as pineapple (0.21mg per 100g), apple (2mg per 100g) and kiwi (1mg per 100g), as well as in many vegetables, namely onion (45mg per 100g), eggplant (1.34 mg per 100g) and, in extremely low concentrations, cucumber (0.11mg per 100g).[7] Formic acid is a naturally occurring component of the atmosphere primarily due to forest emissions.[8]
History[edit]
Some alchemists and naturalists were aware that ant hills give off an acidic vapor as early as the 15th century. The first person to describe the isolation of this substance (by the distillation of large numbers of ants) was the English naturalist John Ray, in 1671.[9][10] Ants secrete the formic acid for attack and defense purposes. Formic acid was first synthesized from hydrocyanic acid by the French chemist Joseph Gay-Lussac. In 1855, another French chemist, Marcellin Berthelot, developed a synthesis from carbon monoxide similar to the process used today.
Formic acid was long considered a chemical compound of only minor interest in the chemical industry. In the late 1960s, however, significant quantities became available as a byproduct of acetic acid production. It now finds increasing use as a preservative and antibacterial in livestock feed.
Properties[edit]
Cyclic dimer of formic acid; dashed green lines represent hydrogen bonds
Formic acid is a colorless liquid having a pungent, penetrating odor[11] at room temperature, comparable to the related acetic acid. Formic acid is about ten times stronger than acetic acid.
It is miscible with water and most polar organic solvents, and is somewhat soluble in hydrocarbons. In hydrocarbons and in the vapor phase, it consists of hydrogen-bonded dimers rather than individual molecules.[12][13] Owing to its tendency to hydrogen-bond, gaseous formic acid does not obey the ideal gas law.[13] Solid formic acid, which can exist in either of two polymorphs, consists of an effectively endless network of hydrogen-bonded formic acid molecules. Formic acid forms a high-boiling azeotrope with water (22.4%). Liquid formic acid tends to supercool.
Chemical reactions[edit]
Decomposition[edit]
Formic acid readily decomposes by dehydration in the presence of concentrated sulfuric acid to form carbon monoxide and water:
- HCO2H → H2O + CO
Treatment of formic acid with sulfuric acid is a convenient laboratory source of CO.[14][15]
In the presence of platinum, it decomposes with a release of hydrogen and carbon dioxide.
- HCO2H → H2 + CO2
Soluble ruthenium catalysts are also effective.[16][17] Carbon monoxide free hydrogen has been generated in a very wide pressure range (1–600 bar).[16]
Reactant[edit]
Formic acid shares most of the chemical properties of other carboxylic acids. Because of its high acidity, solutions in alcohols form esters spontaneously. Formic acid shares some of the reducing properties of aldehydes, reducing solutions of metal oxides to their respective metal.[18]
Formic acid is a source for a formyl group for example in the formylation of methylaniline to N-methylformanilide in toluene.[19]
In synthetic organic chemistry, formic acid is often used as a source of hydride ion, as in the Eschweiler-Clarke reaction:
It is used as a source of hydrogen in transfer hydrogenation, as in the Leuckart reaction to make amines, and (in aqueous solution or in its azeotrope with triethylamine) for hydrogenation of ketones.[20]
Addition to alkenes[edit]
Formic acid is unique among the carboxylic acids in its ability to participate in addition reactions with alkenes. Formic acids and alkenes readily react to form formate esters. In the presence of certain acids, including sulfuric and hydrofluoric acids, however, a variant of the Koch reaction occurs instead, and formic acid adds to the alkene to produce a larger carboxylic acid.[21]
Formic acid anhydride[edit]
An unstable formic anhydride, H(C=O)−O−(C=O)H, can be obtained by dehydration of formic acid with N,N′-dicyclohexylcarbodiimide in ether at low temperature.[22]
Production[edit]
In 2009, the worldwide capacity for producing formic acid was 720 thousand tonnes (1.6 billion pounds) per year, roughly equally divided between Europe (350 thousand tonnes or 770 million pounds, mainly in Germany) and Asia (370 thousand tonnes or 820 million pounds, mainly in China) while production was below 1 thousand tonnes or 2.2 million pounds per year in all other continents.[23] It is commercially available in solutions of various concentrations between 85 and 99 w/w %.[12] As of 2009, the largest producers are BASF, Eastman Chemical Company, LC Industrial, and Feicheng Acid Chemicals, with the largest production facilities in Ludwigshafen (200 thousand tonnes or 440 million pounds per year, BASF, Germany), Oulu (105 thousand tonnes or 230 million pounds, Eastman, Finland), Nakhon Pathom (n/a, LC Industrial), and Feicheng (100 thousand tonnes or 220 million pounds, Feicheng, China). 2010 prices ranged from around €650/tonne (equivalent to around $800/tonne) in Western Europe to $1250/tonne in the United States.[23]
From methyl formate and formamide[edit]
When methanol and carbon monoxide are combined in the presence of a strong base, the result is methyl formate, according to the chemical equation:[12]
- CH3OH + CO → HCO2CH3
In industry, this reaction is performed in the liquid phase at elevated pressure. Typical reaction conditions are 80 °C and 40 atm. The most widely used base is sodium methoxide. Hydrolysis of the methyl formate produces formic acid:
- HCO2CH3 + H2O → HCOOH + CH3OH
Efficient hydrolysis of methyl formate requires a large excess of water. Some routes proceed indirectly by first treating the methyl formate with ammonia to give formamide, which is then hydrolyzed with sulfuric acid:
- HCO2CH3 + NH3 → HC(O)NH2 + CH3OH
- 2 HC(O)NH2 + 2H2O + H2SO4 → 2HCO2H + (NH4)2SO4
A disadvantage of this approach is the need to dispose of the ammonium sulfate byproduct. This problem has led some manufacturers to develop energy-efficient methods of separating formic acid from the excess water used in direct hydrolysis. In one of these processes, used by BASF, the formic acid is removed from the water by liquid-liquid extraction with an organic base.[citation needed]
Niche and obsolete chemical routes[edit]
By-product of acetic acid production[edit]
A significant amount of formic acid is produced as a byproduct in the manufacture of other chemicals. At one time, acetic acid was produced on a large scale by oxidation of alkanes, by a process that cogenerates significant formic acid.[12] This oxidative route to acetic acid has declined in importance so that the aforementioned dedicated routes to formic acid have become more important.
Hydrogenation of carbon dioxide[edit]
The catalytic hydrogenation of CO2 to formic acid has long been studied. This reaction can be conducted homogeneously.[24][25]
Oxidation of biomass[edit]
Formic acid can also be obtained by aqueous catalytic partial oxidation of wet biomass by the OxFA process.[26][27] A Keggin-type polyoxometalate (H5PV2Mo10O40) is used as the homogeneous catalyst to convert sugars, wood, waste paper, or cyanobacteria to formic acid and CO2 as the sole byproduct. Yields of up to 53% formic acid can be achieved.[citation needed]
Laboratory methods[edit]
In the laboratory, formic acid can be obtained by heating oxalic acid in glycerol and extraction by steam distillation.[28] Glycerol acts as a catalyst, as the reaction proceeds through a glyceryl oxalate intermediate. If the reaction mixture is heated to higher temperatures, allyl alcohol results. The net reaction is thus:
- C2O4H2 → HCO2H + CO2
Another illustrative method involves the reaction between lead formate and hydrogen sulfide, driven by the formation of lead sulfide.[29]
- Pb(HCOO)2 + H2S → 2HCOOH + PbS
Electrochemical production[edit]
It has been reported that formate can be formed by the electrochemical reduction of CO2 (in the form of bicarbonate) at a lead cathode at pH 8.6:[30]
- HCO−
3 + H
2O + 2e− → HCO−
2 + 2OH−
or
- CO
2 + H
2O + 2e− → HCO−
2 + OH−
If the feed is CO
2 and oxygen is evolved at the anode, the total reaction is:
- CO2 + OH−
→ HCO−
2 + 1/2 O2
Biosynthesis[edit]
Formic acid is named after ants which have high concentrations of the compound in their venom. In ants, formic acid is derived from serine through a 5,10-methenyltetrahydrofolate intermediate.[31] The conjugate base of formic acid, formate, also occurs widely in nature. An assay for formic acid in body fluids, designed for determination of formate after methanol poisoning, is based on the reaction of formate with bacterial formate dehydrogenase.[32]
Uses[edit]
Agriculture[edit]
A major use of formic acid is as a preservative and antibacterial agent in livestock feed. In Europe, it is applied on silage, including fresh hay, to promote the fermentation of lactic acid and to suppress the formation of butyric acid; it also allows fermentation to occur quickly, and at a lower temperature, reducing the loss of nutritional value.[12] Formic acid arrests certain decay processes and causes the feed to retain its nutritive value longer, and so it is widely used to preserve winter feed for cattle.[33] In the poultry industry, it is sometimes added to feed to kill E. coli bacteria.[34][35] Use as a preservative for silage and (other) animal feed constituted 30% of the global consumption in 2009.[23]
Beekeepers use formic acid as a miticide against the tracheal mite (Acarapis woodi) and the Varroa destructor mite and Varroa jacobsoni mite.[36]
Energy[edit]
Formic acid can be used in a fuel cell (it can be used directly in formic acid fuel cells and indirectly in hydrogen fuel cells).[37][38]
Electrolytic conversion of electrical energy to chemical fuel has been proposed as a large-scale source of formate by various groups.[39] The formate could be used as feed to modified E. coli bacteria for producing biomass.[40][41] Natural microbes do exist that can feed on formic acid or formate (see Methylotroph).
Formic acid has been considered as a means of hydrogen storage.[42] The co-product of this decomposition, carbon dioxide, can be rehydrogenated back to formic acid in a second step. Formic acid contains 53 g/L hydrogen at room temperature and atmospheric pressure, which is three and a half times as much as compressed hydrogen gas can attain at 350 bar pressure (14.7 g/L). Pure formic acid is a liquid with a flash point of +69 °C, much higher than that of gasoline (−40 °C) or ethanol (+13 °C).[citation needed]
It is possible to use formic acid as an intermediary to produce isobutanol from CO2 using microbes.[43][44]
Artificial photosynthesis[edit]
In August 2020 researchers at Cambridge University announced a stand-alone advanced ‘photosheet’ technology that converts sunlight, carbon dioxide and water into oxygen and formic acid with no other inputs.[45]
Soldering[edit]
Formic acid has a potential application in soldering. Due to its capacity to reduce oxide layers, formic acid gas can be blasted at an oxide surface in order to increase solder wettability.
Chromatography[edit]
Formic acid used as a volatile pH modifier in HPLC and capillary electrophoresis.
Formic acid is often used as a component of mobile phase in reversed-phase high-performance liquid chromatography (RP-HPLC) analysis and separation techniques for the separation of hydrophobic macromolecules, such as peptides, proteins and more complex structures including intact viruses. Especially when paired with mass spectrometry detection, formic acid offers several advantages over the more traditionally used phosphoric acid.[46][47]
Other uses[edit]
Formic acid is also significantly used in the production of leather, including tanning (23% of the global consumption in 2009[23]), and in dyeing and finishing textiles (9% of the global consumption in 2009[23]) because of its acidic nature. Use as a coagulant in the production of rubber[12] consumed 6% of the global production in 2009.[23]
Formic acid is also used in place of mineral acids for various cleaning products,[12] such as limescale remover and toilet bowl cleaner. Some formate esters are artificial flavorings and perfumes.
Formic acid application has been reported to be an effective treatment for warts.[48]
Safety[edit]
Formic acid has low toxicity (hence its use as a food additive), with an LD50 of 1.8 g/kg (tested orally on mice). The concentrated acid is corrosive to the skin.[12]
Formic acid is readily metabolized and eliminated by the body. Nonetheless, it has specific toxic effects; the formic acid and formaldehyde produced as metabolites of methanol are responsible for the optic nerve damage, causing blindness, seen in methanol poisoning.[49] Some chronic effects of formic acid exposure have been documented. Some experiments on bacterial species have demonstrated it to be a mutagen.[50] Chronic exposure in humans may cause kidney damage.[50] Another possible effect of chronic exposure is development of a skin allergy that manifests upon re-exposure to the chemical.
Concentrated formic acid slowly decomposes to carbon monoxide and water, leading to pressure buildup in the containing vessel. For this reason, 98% formic acid is shipped in plastic bottles with self-venting caps.
The hazards of solutions of formic acid depend on the concentration. The following table lists the Globally Harmonized System of Classification and Labelling of Chemicals for formic acid solutions:[citation needed]
| Concentration (weight percent) | Pictogram | H-Phrases |
|---|---|---|
| 2–10% | 
|
H315 |
| 10–90% | 
|
H313 |
| >90% | 
|
H314 |
Formic acid in 85% concentration is flammable, and diluted formic acid is on the U.S. Food and Drug Administration list of food additives.[51] The principal danger from formic acid is from skin or eye contact with the concentrated liquid or vapors. The U.S. OSHA Permissible Exposure Level (PEL) of formic acid vapor in the work environment is 5 parts per million parts of air (ppm).
See also[edit]
- Orthoformic acid
- Formic acid vehicle
References[edit]
- ^ a b Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. p. 745. doi:10.1039/9781849733069. ISBN 978-0-85404-182-4.
- ^ a b c d e NIOSH Pocket Guide to Chemical Hazards. «#0296». National Institute for Occupational Safety and Health (NIOSH).
- ^ Smith, Robert M.; Martell, Arthur E. (1989). Critical Stability Constants Volume 6: Second Supplement. New York: Plenum Press. p. 299. ISBN 0-306-43104-1.
- ^ a b «Formic acid». Immediately Dangerous to Life or Health Concentrations (IDLH). National Institute for Occupational Safety and Health. 4 December 2014. Retrieved 26 March 2015.
- ^ Hoffman, Donald R (2010). «Ant venoms». Current Opinion in Allergy and Clinical Immunology. 10 (4): 342–6. doi:10.1097/ACI.0b013e328339f325. PMID 20445444. S2CID 4999650.
- ^ Roubik, DW; Smith, BH; Carlson, RG (1987). «Formic acid in caustic cephalic secretions of stingless bee,Oxytrigona (Hymenoptera: Apidae)». J Chem Ecol. 13 (5): 1079–86. doi:10.1007/BF01020539. PMID 24302133. S2CID 30511107.
- ^ Otles, S; Yalcin, B (2012). «Phenolic compounds analysis of root, stalk, and leaves of nettle». ScientificWorldJournal. 2012: 564367. doi:10.1100/2012/564367. PMC 3349212. PMID 22593694.
- ^ Sanhueza, Eugenio; Andreae, Meinrat O (1991). «Emission of formic and acetic acids from tropical Savanna soils». Geophysical Research Letters. 18 (9): 1707–10. Bibcode:1991GeoRL..18.1707S. doi:10.1029/91GL01565.
- ^ Wray, J (1670). «Extract of a Letter, Written by Mr John Wray to the Publisher January 13. 1670. Concerning Some Un-Common Observations and Experiments Made with an Acid Juyce to be Found in Ants». Philosophical Transactions of the Royal Society of London. 5 (57–68): 2063–2066. Bibcode:1670RSPT….5.2063W. doi:10.1098/rstl.1670.0052.
- ^ Johnson, W. B. (1803). History of the process and present state of animal chemistry.
- ^ «OSHA Occupational Chemical Database – Occupational Safety and Health Administration». osha.gov. Archived from the original on 29 April 2021. Retrieved 17 April 2015.
- ^ a b c d e f g h Reutemann, Werner; Kieczka, Heinz (2000). «Formic Acid». Ullmann’s Encyclopedia of Industrial Chemistry. doi:10.1002/14356007.a12_013. ISBN 978-3-527-30673-2.
- ^ a b Roman M. Balabin (2009). «Polar (Acyclic) Isomer of Formic Acid Dimer: Gas-Phase Raman Spectroscopy Study and Thermodynamic Parameters». The Journal of Physical Chemistry A. 113 (17): 4910–8. Bibcode:2009JPCA..113.4910B. doi:10.1021/jp9002643. PMID 19344174.
- ^ Koch, H.; Haaf, W. (1973). «1-Adamantanecarboxylic Acid». Organic Syntheses.; Collective Volume, vol. 5, p. 20
- ^ G. H. Coleman, David Craig (1943). «p-Tolualdehyde». Organic Syntheses.; Collective Volume, vol. 2, p. 583
- ^ a b Fellay, Céline; Dyson, Paul J.; Laurenczy, Gábor (2008). «A Viable Hydrogen-Storage System Based on Selective Formic Acid Decomposition with a Ruthenium Catalyst». Angewandte Chemie International Edition. 47 (21): 3966–8. doi:10.1002/anie.200800320. PMID 18393267.
- ^ G. Laurenczy, C. Fellay, P. J. Dyson, Hydrogen production from formic acid. PCT Int. Appl. (2008), 36pp. CODEN: PIXXD2 WO 2008047312 A1 20080424 AN 2008:502691
- ^ Ozawa, Naoto; Okubo, Tatsuo; Matsuda, Jun; Sakai, Tatsuo (October 2016). «Observation and analysis of metal oxide reduction by formic acid for soldering». 2016 11th International Microsystems, Packaging, Assembly and Circuits Technology Conference (IMPACT): 148–151. doi:10.1109/IMPACT.2016.7799990. ISBN 978-1-5090-4769-7. S2CID 32545113.
- ^ L. F. Fieser; J. E. Jones (1955). «N-Methylformanilide». Organic Syntheses.; Collective Volume, vol. 3, p. 590
- ^ Zhou, Xiaowei; et al. (2012). «Varying the ratio of formic acid to triethylamine impacts on asymmetric transfer hydrogenation of ketones». Journal of Molecular Catalysis A: Chemical. 357: 133–140. doi:10.1016/j.molcata.2012.02.002. ISSN 1381-1169.
- ^ Haaf, Wolfgang (1966). «Die Synthese sekundärer Carbonsäuren nach der Ameisensäure-Methode». Chemische Berichte. 99 (4): 1149–52. doi:10.1002/cber.19660990410.
- ^ Wu, G; Shlykov, S; Van Alseny, F. S; Geise, H. J; Sluyts, E; Van Der Veken, B. J (1995). «Formic Anhydride in the Gas Phase, Studied by Electron Diffraction and Microwave and Infrared Spectroscopy, Supplemented with Ab-Initio Calculations of Geometries and Force Fields». The Journal of Physical Chemistry. 99 (21): 8589–98. doi:10.1021/j100021a022.
- ^ a b c d e f S. N. Bizzari; M. Blagoev (June 2010). «CEH Marketing Research Report: FORMIC ACID». Chemical Economics Handbook. SRI consulting. Archived from the original on 14 September 2011.
- ^ P. G. Jessop (2007). J. G. de Vries, C. J. Elsevier (ed.). Handbook of Homogeneous Hydrogenation. Weinheim, Germany: Wiley-VCH. pp. 489–511.
- ^ Jessop, Philip G; Joó, Ferenc; Tai, Chih-Cheng (2004). «Recent advances in the homogeneous hydrogenation of carbon dioxide». Coordination Chemistry Reviews. 248 (21–24): 2425. doi:10.1016/j.ccr.2004.05.019.
- ^ Wölfel, Rene; Taccardi, Nicola; Bösmann, Andreas; Wasserscheid, Peter (2011). «Selective catalytic conversion of biobased carbohydrates to formic acid using molecular oxygen». Green Chemistry. 13 (10): 2759. doi:10.1039/C1GC15434F. S2CID 97572039.
- ^ Albert, Jakob; Wölfel, Rene; Bösmann, Andreas; Wasserscheid, Peter (2012). «Selective oxidation of complex, water-insoluble biomass to formic acid using additives as reaction accelerators». Energy & Environmental Science. 5 (7): 7956. doi:10.1039/C2EE21428H. S2CID 93224286.
- ^ Chattaway, Frederick Daniel (1914). «XX.—Interaction of glycerol and oxalic acid». Journal of the Chemical Society, Transactions. 105: 151–6. doi:10.1039/CT9140500151. hdl:2027/mdp.39015067135775.
- ^ Arthur Sutcliffe (1930). Practical Chemistry for Advanced Students (1949 ed.). London: John Murray.
- ^ B. Innocent; et al. (February 2009). «Electro-reduction of carbon dioxide to formate on lead electrode in aqueous medium». Journal of Applied Electrochemistry. 39 (2): 227–232. doi:10.1007/s10800-008-9658-4. S2CID 98437382.
- ^ Hefetz, Abraham; Blum, Murray (1 November 1978). «Biosynthesis of formic acid by the poison glands of formicine ants». Biochimica et Biophysica Acta (BBA) — General Subjects. 543 (4): 484–496. doi:10.1016/0304-4165(78)90303-3. PMID 718985.
- ^ Makar, A.B; McMartin, K.E; Palese, M; Tephly, T.R (1975). «Formate assay in body fluids: Application in methanol poisoning». Biochemical Medicine. 13 (2): 117–26. doi:10.1016/0006-2944(75)90147-7. PMID 1.
- ^ Organic Acids and Food Preservation, Maria M. Theron, J. F. Rykers Lues
- ^ Griggs, J. P; Jacob, J. P (2005). «Alternatives to Antibiotics for Organic Poultry Production». The Journal of Applied Poultry Research. 14 (4): 750. doi:10.1093/japr/14.4.750.
- ^ Garcia, V; Catala-Gregori, P; Hernandez, F; Megias, M. D; Madrid, J (2007). «Effect of Formic Acid and Plant Extracts on Growth, Nutrient Digestibility, Intestine Mucosa Morphology, and Meat Yield of Broilers». The Journal of Applied Poultry Research. 16 (4): 555. doi:10.3382/japr.2006-00116.
- ^ Hoppe, H.; Ritter, W.; Stephen, E. W. C. (1989). «The control of parasitic bee mites: Varroa jacobsoni, Acarapis woodi and Tropilaelaps clareae with formic acid». American Bee Journal.
- ^ Ha, S; Larsen, R; Masel, R.I (2005). «Performance characterization of Pd/C nanocatalyst for direct formic acid fuel cells». Journal of Power Sources. 144 (1): 28–34. Bibcode:2005JPS…144…28H. doi:10.1016/j.jpowsour.2004.12.031.
- ^ Jorn Madslien (27 June 2017). «Ant power: Take a ride on a bus that runs on formic acid». BBC News. Retrieved 11 July 2017.
- ^ Yishai, Oren; Lindner, Steffen N; Gonzalez de la Cruz, Jorge; Tenenboim, Hezi; Bar-Even, Arren (December 2016). «The formate bio-economy». Current Opinion in Chemical Biology. 35: 1–9. doi:10.1016/j.cbpa.2016.07.005. PMID 27459678.
- ^ Shmuel Gleizer; et al. (November 2019). «Conversion of Escherichia coli to Generate All Biomass Carbon from CO2«. Cell. 179 (6): 1255–1263.e12. doi:10.1016/j.cell.2019.11.009. PMC 6904909. PMID 31778652.
- ^ Kim, Seohyoung; Lindner, Steffen N.; Aslan, Selçuk; Yishai, Oren; Wenk, Sebastian; Schann, Karin; Bar-Even, Arren (10 February 2020). «Growth of E. coli on formate and methanol via the reductive glycine pathway». Nature Chemical Biology. 16 (5): 538–545. doi:10.1038/s41589-020-0473-5. ISSN 1552-4469. PMID 32042198. S2CID 211074951.
- ^ Joó, Ferenc (2008). «Breakthroughs in Hydrogen Storage-Formic Acid as a Sustainable Storage Material for Hydrogen». ChemSusChem. 1 (10): 805–8. doi:10.1002/cssc.200800133. PMID 18781551.
- ^ «UCLA Researchers Use Electricity and CO2 to Make Butanol». 30 March 2012.
- ^ Liao, James C.; Cho, Kwang Myung; Huo, Yi-Xin; Malati, Peter; Higashide, Wendy; Wu, Tung-Yun; Rogers, Steve; Wernick, David G.; Opgenorth, Paul H.; Li, Han (30 March 2012). «Integrated Electromicrobial Conversion of CO2 to Higher Alcohols». Science. 335 (6076): 1596. Bibcode:2012Sci…335.1596L. doi:10.1126/science.1217643. PMID 22461604. S2CID 24328552.
- ^ Sampson, Joanna (2 August 2020). «Wireless device makes clean fuel from sunlight, CO2 and water». Gasworld. Retrieved 26 August 2020.
- ^ «Archived copy». Archived from the original on 7 November 2017. Retrieved 7 November 2017.
{{cite web}}: CS1 maint: archived copy as title (link)[full citation needed] - ^ Heukeshoven, Jochen; Dernick, Rudolf (1982). «Reversed-phase high-performance liquid chromatography of virus proteins and other large hydrophobic proteins in formic acid containing solvents». Journal of Chromatography A. 252: 241–54. doi:10.1016/S0021-9673(01)88415-6. PMID 6304128.
- ^ Bhat, Ramesh M; Vidya, Krishna; Kamath, Ganesh (2001). «Topical formic acid puncture technique for the treatment of common warts». International Journal of Dermatology. 40 (6): 415–9. doi:10.1046/j.1365-4362.2001.01242.x. PMID 11589750. S2CID 42351889.
- ^ Sadun, A. A (2002). «Mitochondrial optic neuropathies». Journal of Neurology, Neurosurgery, and Psychiatry. 72 (4): 423–5. doi:10.1136/jnnp.72.4.423. PMC 1737836. PMID 11909893.
- ^ a b «Occupational Safety and Health Guideline for Formic Acid». OSHA. Archived from the original on 20 September 2011. Retrieved 28 May 2011.
- ^ 21 CFR 186.1316, 21 CFR 172.515
External links[edit]
- International Chemical Safety Card 0485.
- NIOSH Pocket Guide to Chemical Hazards.
- ChemSub Online (Formic acid).
«Ant acid» redirects here. For substances that neutralize stomach acidity, see antacid.
|
||

|
||
| Names | ||
|---|---|---|
| Preferred IUPAC name
Formic acid[1] |
||
| Systematic IUPAC name
Methanoic acid[1] |
||
| Other names
Carbonous acid; Formylic acid; Hydrogen carboxylic acid; Hydroxy(oxo)methane; Metacarbonoic acid; Oxocarbinic acid; Oxomethanol |
||
| Identifiers | ||
|
CAS Number |
|
|
|
3D model (JSmol) |
|
|
|
Beilstein Reference |
1209246 | |
| ChEBI |
|
|
| ChEMBL |
|
|
| ChemSpider |
|
|
| DrugBank |
|
|
| ECHA InfoCard | 100.000.527 |
|
| EC Number |
|
|
| E number | E236 (preservatives) | |
|
Gmelin Reference |
1008 | |
| KEGG |
|
|
|
PubChem CID |
|
|
| RTECS number |
|
|
| UNII |
|
|
|
CompTox Dashboard (EPA) |
|
|
|
InChI
|
||
|
SMILES
|
||
| Properties | ||
|
Chemical formula |
CH2O2 | |
| Molar mass | 46.025 g·mol−1 | |
| Appearance | Colorless fuming liquid | |
| Odor | Pungent, penetrating | |
| Density | 1.220 g/mL | |
| Melting point | 8.4 °C (47.1 °F; 281.5 K) | |
| Boiling point | 100.8 °C (213.4 °F; 373.9 K) | |
|
Solubility in water |
Miscible | |
| Solubility | Miscible with ether, acetone, ethyl acetate, glycerol, methanol, ethanol Partially soluble in benzene, toluene, xylenes |
|
| log P | −0.54 | |
| Vapor pressure | 35 mmHg (20 °C)[2] | |
| Acidity (pKa) | 3.745[3] | |
| Conjugate base | Formate | |
|
Magnetic susceptibility (χ) |
−19.90×10−6 cm3/mol | |
|
Refractive index (nD) |
1.3714 (20 °C) | |
| Viscosity | 1.57 cP at 268 °C | |
| Structure | ||
|
Molecular shape |
Planar | |
|
Dipole moment |
1.41 D (gas) | |
| Thermochemistry | ||
|
Std molar |
131.8 J/mol K | |
|
Std enthalpy of |
−425.0 kJ/mol | |
|
Std enthalpy of |
−254.6 kJ/mol | |
| Pharmacology | ||
|
ATCvet code |
QP53AG01 (WHO) | |
| Hazards | ||
| Occupational safety and health (OHS/OSH): | ||
|
Main hazards |
Corrosive; irritant; sensitizer |
|
| GHS labelling: | ||
|
Pictograms |

|
|
|
Signal word |
Danger | |
|
Hazard statements |
H314 | |
|
Precautionary statements |
P260, P264, P280, P301+P330+P331, P303+P361+P353, P304+P340, P305+P351+P338, P310, P321, P363, P405, P501 | |
| NFPA 704 (fire diamond) |
3 2 0 |
|
| Flash point | 69 °C (156 °F; 342 K) | |
|
Autoignition |
601 °C (1,114 °F; 874 K) | |
| Explosive limits | 14–34%[citation needed] 18–57% (90% solution)[2] |
|
| Lethal dose or concentration (LD, LC): | ||
|
LD50 (median dose) |
700 mg/kg (mouse, oral), 1100 mg/kg (rat, oral), 4000 mg/kg (dog, oral)[4] | |
|
LC50 (median concentration) |
7853 ppm (rat, 15 min) 3246 ppm (mouse, 15 min)[4] |
|
| NIOSH (US health exposure limits): | ||
|
PEL (Permissible) |
TWA 5 ppm (9 mg/m3)[2] | |
|
REL (Recommended) |
TWA 5 ppm (9 mg/m3)[2] | |
|
IDLH (Immediate danger) |
30 ppm[2] | |
| Safety data sheet (SDS) | MSDS from JT Baker | |
| Related compounds | ||
|
Related carboxylic acids |
Acetic acid Propionic acid |
|
|
Related compounds |
Formaldehyde Methanol |
|
| Supplementary data page | ||
| Formic acid (data page) | ||
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Formic acid (from Latin formica ‘ant’), systematically named methanoic acid, is the simplest carboxylic acid, and has the chemical formula HCOOH and structure H−C(=O)−O−H. It is an important intermediate in chemical synthesis and occurs naturally, most notably in some ants. Esters, salts and the anion derived from formic acid are called formates. Industrially, formic acid is produced from methanol.
Natural occurrence[edit]
In nature, formic acid is found in most ants and in stingless bees of the genus Oxytrigona.[5][6] Wood ants from the genus Formica can spray formic acid on their prey or to defend the nest. The puss moth caterpillar (Cerura vinula) will spray it as well when threatened by predators. It is also found in the trichomes of stinging nettle (Urtica dioica). Apart from that, this acid is incorporated in many fruits such as pineapple (0.21mg per 100g), apple (2mg per 100g) and kiwi (1mg per 100g), as well as in many vegetables, namely onion (45mg per 100g), eggplant (1.34 mg per 100g) and, in extremely low concentrations, cucumber (0.11mg per 100g).[7] Formic acid is a naturally occurring component of the atmosphere primarily due to forest emissions.[8]
History[edit]
Some alchemists and naturalists were aware that ant hills give off an acidic vapor as early as the 15th century. The first person to describe the isolation of this substance (by the distillation of large numbers of ants) was the English naturalist John Ray, in 1671.[9][10] Ants secrete the formic acid for attack and defense purposes. Formic acid was first synthesized from hydrocyanic acid by the French chemist Joseph Gay-Lussac. In 1855, another French chemist, Marcellin Berthelot, developed a synthesis from carbon monoxide similar to the process used today.
Formic acid was long considered a chemical compound of only minor interest in the chemical industry. In the late 1960s, however, significant quantities became available as a byproduct of acetic acid production. It now finds increasing use as a preservative and antibacterial in livestock feed.
Properties[edit]
Cyclic dimer of formic acid; dashed green lines represent hydrogen bonds
Formic acid is a colorless liquid having a pungent, penetrating odor[11] at room temperature, comparable to the related acetic acid. Formic acid is about ten times stronger than acetic acid.
It is miscible with water and most polar organic solvents, and is somewhat soluble in hydrocarbons. In hydrocarbons and in the vapor phase, it consists of hydrogen-bonded dimers rather than individual molecules.[12][13] Owing to its tendency to hydrogen-bond, gaseous formic acid does not obey the ideal gas law.[13] Solid formic acid, which can exist in either of two polymorphs, consists of an effectively endless network of hydrogen-bonded formic acid molecules. Formic acid forms a high-boiling azeotrope with water (22.4%). Liquid formic acid tends to supercool.
Chemical reactions[edit]
Decomposition[edit]
Formic acid readily decomposes by dehydration in the presence of concentrated sulfuric acid to form carbon monoxide and water:
- HCO2H → H2O + CO
Treatment of formic acid with sulfuric acid is a convenient laboratory source of CO.[14][15]
In the presence of platinum, it decomposes with a release of hydrogen and carbon dioxide.
- HCO2H → H2 + CO2
Soluble ruthenium catalysts are also effective.[16][17] Carbon monoxide free hydrogen has been generated in a very wide pressure range (1–600 bar).[16]
Reactant[edit]
Formic acid shares most of the chemical properties of other carboxylic acids. Because of its high acidity, solutions in alcohols form esters spontaneously. Formic acid shares some of the reducing properties of aldehydes, reducing solutions of metal oxides to their respective metal.[18]
Formic acid is a source for a formyl group for example in the formylation of methylaniline to N-methylformanilide in toluene.[19]
In synthetic organic chemistry, formic acid is often used as a source of hydride ion, as in the Eschweiler-Clarke reaction:
It is used as a source of hydrogen in transfer hydrogenation, as in the Leuckart reaction to make amines, and (in aqueous solution or in its azeotrope with triethylamine) for hydrogenation of ketones.[20]
Addition to alkenes[edit]
Formic acid is unique among the carboxylic acids in its ability to participate in addition reactions with alkenes. Formic acids and alkenes readily react to form formate esters. In the presence of certain acids, including sulfuric and hydrofluoric acids, however, a variant of the Koch reaction occurs instead, and formic acid adds to the alkene to produce a larger carboxylic acid.[21]
Formic acid anhydride[edit]
An unstable formic anhydride, H(C=O)−O−(C=O)H, can be obtained by dehydration of formic acid with N,N′-dicyclohexylcarbodiimide in ether at low temperature.[22]
Production[edit]
In 2009, the worldwide capacity for producing formic acid was 720 thousand tonnes (1.6 billion pounds) per year, roughly equally divided between Europe (350 thousand tonnes or 770 million pounds, mainly in Germany) and Asia (370 thousand tonnes or 820 million pounds, mainly in China) while production was below 1 thousand tonnes or 2.2 million pounds per year in all other continents.[23] It is commercially available in solutions of various concentrations between 85 and 99 w/w %.[12] As of 2009, the largest producers are BASF, Eastman Chemical Company, LC Industrial, and Feicheng Acid Chemicals, with the largest production facilities in Ludwigshafen (200 thousand tonnes or 440 million pounds per year, BASF, Germany), Oulu (105 thousand tonnes or 230 million pounds, Eastman, Finland), Nakhon Pathom (n/a, LC Industrial), and Feicheng (100 thousand tonnes or 220 million pounds, Feicheng, China). 2010 prices ranged from around €650/tonne (equivalent to around $800/tonne) in Western Europe to $1250/tonne in the United States.[23]
From methyl formate and formamide[edit]
When methanol and carbon monoxide are combined in the presence of a strong base, the result is methyl formate, according to the chemical equation:[12]
- CH3OH + CO → HCO2CH3
In industry, this reaction is performed in the liquid phase at elevated pressure. Typical reaction conditions are 80 °C and 40 atm. The most widely used base is sodium methoxide. Hydrolysis of the methyl formate produces formic acid:
- HCO2CH3 + H2O → HCOOH + CH3OH
Efficient hydrolysis of methyl formate requires a large excess of water. Some routes proceed indirectly by first treating the methyl formate with ammonia to give formamide, which is then hydrolyzed with sulfuric acid:
- HCO2CH3 + NH3 → HC(O)NH2 + CH3OH
- 2 HC(O)NH2 + 2H2O + H2SO4 → 2HCO2H + (NH4)2SO4
A disadvantage of this approach is the need to dispose of the ammonium sulfate byproduct. This problem has led some manufacturers to develop energy-efficient methods of separating formic acid from the excess water used in direct hydrolysis. In one of these processes, used by BASF, the formic acid is removed from the water by liquid-liquid extraction with an organic base.[citation needed]
Niche and obsolete chemical routes[edit]
By-product of acetic acid production[edit]
A significant amount of formic acid is produced as a byproduct in the manufacture of other chemicals. At one time, acetic acid was produced on a large scale by oxidation of alkanes, by a process that cogenerates significant formic acid.[12] This oxidative route to acetic acid has declined in importance so that the aforementioned dedicated routes to formic acid have become more important.
Hydrogenation of carbon dioxide[edit]
The catalytic hydrogenation of CO2 to formic acid has long been studied. This reaction can be conducted homogeneously.[24][25]
Oxidation of biomass[edit]
Formic acid can also be obtained by aqueous catalytic partial oxidation of wet biomass by the OxFA process.[26][27] A Keggin-type polyoxometalate (H5PV2Mo10O40) is used as the homogeneous catalyst to convert sugars, wood, waste paper, or cyanobacteria to formic acid and CO2 as the sole byproduct. Yields of up to 53% formic acid can be achieved.[citation needed]
Laboratory methods[edit]
In the laboratory, formic acid can be obtained by heating oxalic acid in glycerol and extraction by steam distillation.[28] Glycerol acts as a catalyst, as the reaction proceeds through a glyceryl oxalate intermediate. If the reaction mixture is heated to higher temperatures, allyl alcohol results. The net reaction is thus:
- C2O4H2 → HCO2H + CO2
Another illustrative method involves the reaction between lead formate and hydrogen sulfide, driven by the formation of lead sulfide.[29]
- Pb(HCOO)2 + H2S → 2HCOOH + PbS
Electrochemical production[edit]
It has been reported that formate can be formed by the electrochemical reduction of CO2 (in the form of bicarbonate) at a lead cathode at pH 8.6:[30]
- HCO−
3 + H
2O + 2e− → HCO−
2 + 2OH−
or
- CO
2 + H
2O + 2e− → HCO−
2 + OH−
If the feed is CO
2 and oxygen is evolved at the anode, the total reaction is:
- CO2 + OH−
→ HCO−
2 + 1/2 O2
Biosynthesis[edit]
Formic acid is named after ants which have high concentrations of the compound in their venom. In ants, formic acid is derived from serine through a 5,10-methenyltetrahydrofolate intermediate.[31] The conjugate base of formic acid, formate, also occurs widely in nature. An assay for formic acid in body fluids, designed for determination of formate after methanol poisoning, is based on the reaction of formate with bacterial formate dehydrogenase.[32]
Uses[edit]
Agriculture[edit]
A major use of formic acid is as a preservative and antibacterial agent in livestock feed. In Europe, it is applied on silage, including fresh hay, to promote the fermentation of lactic acid and to suppress the formation of butyric acid; it also allows fermentation to occur quickly, and at a lower temperature, reducing the loss of nutritional value.[12] Formic acid arrests certain decay processes and causes the feed to retain its nutritive value longer, and so it is widely used to preserve winter feed for cattle.[33] In the poultry industry, it is sometimes added to feed to kill E. coli bacteria.[34][35] Use as a preservative for silage and (other) animal feed constituted 30% of the global consumption in 2009.[23]
Beekeepers use formic acid as a miticide against the tracheal mite (Acarapis woodi) and the Varroa destructor mite and Varroa jacobsoni mite.[36]
Energy[edit]
Formic acid can be used in a fuel cell (it can be used directly in formic acid fuel cells and indirectly in hydrogen fuel cells).[37][38]
Electrolytic conversion of electrical energy to chemical fuel has been proposed as a large-scale source of formate by various groups.[39] The formate could be used as feed to modified E. coli bacteria for producing biomass.[40][41] Natural microbes do exist that can feed on formic acid or formate (see Methylotroph).
Formic acid has been considered as a means of hydrogen storage.[42] The co-product of this decomposition, carbon dioxide, can be rehydrogenated back to formic acid in a second step. Formic acid contains 53 g/L hydrogen at room temperature and atmospheric pressure, which is three and a half times as much as compressed hydrogen gas can attain at 350 bar pressure (14.7 g/L). Pure formic acid is a liquid with a flash point of +69 °C, much higher than that of gasoline (−40 °C) or ethanol (+13 °C).[citation needed]
It is possible to use formic acid as an intermediary to produce isobutanol from CO2 using microbes.[43][44]
Artificial photosynthesis[edit]
In August 2020 researchers at Cambridge University announced a stand-alone advanced ‘photosheet’ technology that converts sunlight, carbon dioxide and water into oxygen and formic acid with no other inputs.[45]
Soldering[edit]
Formic acid has a potential application in soldering. Due to its capacity to reduce oxide layers, formic acid gas can be blasted at an oxide surface in order to increase solder wettability.
Chromatography[edit]
Formic acid used as a volatile pH modifier in HPLC and capillary electrophoresis.
Formic acid is often used as a component of mobile phase in reversed-phase high-performance liquid chromatography (RP-HPLC) analysis and separation techniques for the separation of hydrophobic macromolecules, such as peptides, proteins and more complex structures including intact viruses. Especially when paired with mass spectrometry detection, formic acid offers several advantages over the more traditionally used phosphoric acid.[46][47]
Other uses[edit]
Formic acid is also significantly used in the production of leather, including tanning (23% of the global consumption in 2009[23]), and in dyeing and finishing textiles (9% of the global consumption in 2009[23]) because of its acidic nature. Use as a coagulant in the production of rubber[12] consumed 6% of the global production in 2009.[23]
Formic acid is also used in place of mineral acids for various cleaning products,[12] such as limescale remover and toilet bowl cleaner. Some formate esters are artificial flavorings and perfumes.
Formic acid application has been reported to be an effective treatment for warts.[48]
Safety[edit]
Formic acid has low toxicity (hence its use as a food additive), with an LD50 of 1.8 g/kg (tested orally on mice). The concentrated acid is corrosive to the skin.[12]
Formic acid is readily metabolized and eliminated by the body. Nonetheless, it has specific toxic effects; the formic acid and formaldehyde produced as metabolites of methanol are responsible for the optic nerve damage, causing blindness, seen in methanol poisoning.[49] Some chronic effects of formic acid exposure have been documented. Some experiments on bacterial species have demonstrated it to be a mutagen.[50] Chronic exposure in humans may cause kidney damage.[50] Another possible effect of chronic exposure is development of a skin allergy that manifests upon re-exposure to the chemical.
Concentrated formic acid slowly decomposes to carbon monoxide and water, leading to pressure buildup in the containing vessel. For this reason, 98% formic acid is shipped in plastic bottles with self-venting caps.
The hazards of solutions of formic acid depend on the concentration. The following table lists the Globally Harmonized System of Classification and Labelling of Chemicals for formic acid solutions:[citation needed]
| Concentration (weight percent) | Pictogram | H-Phrases |
|---|---|---|
| 2–10% | 
|
H315 |
| 10–90% | 
|
H313 |
| >90% | 
|
H314 |
Formic acid in 85% concentration is flammable, and diluted formic acid is on the U.S. Food and Drug Administration list of food additives.[51] The principal danger from formic acid is from skin or eye contact with the concentrated liquid or vapors. The U.S. OSHA Permissible Exposure Level (PEL) of formic acid vapor in the work environment is 5 parts per million parts of air (ppm).
See also[edit]
- Orthoformic acid
- Formic acid vehicle
References[edit]
- ^ a b Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. p. 745. doi:10.1039/9781849733069. ISBN 978-0-85404-182-4.
- ^ a b c d e NIOSH Pocket Guide to Chemical Hazards. «#0296». National Institute for Occupational Safety and Health (NIOSH).
- ^ Smith, Robert M.; Martell, Arthur E. (1989). Critical Stability Constants Volume 6: Second Supplement. New York: Plenum Press. p. 299. ISBN 0-306-43104-1.
- ^ a b «Formic acid». Immediately Dangerous to Life or Health Concentrations (IDLH). National Institute for Occupational Safety and Health. 4 December 2014. Retrieved 26 March 2015.
- ^ Hoffman, Donald R (2010). «Ant venoms». Current Opinion in Allergy and Clinical Immunology. 10 (4): 342–6. doi:10.1097/ACI.0b013e328339f325. PMID 20445444. S2CID 4999650.
- ^ Roubik, DW; Smith, BH; Carlson, RG (1987). «Formic acid in caustic cephalic secretions of stingless bee,Oxytrigona (Hymenoptera: Apidae)». J Chem Ecol. 13 (5): 1079–86. doi:10.1007/BF01020539. PMID 24302133. S2CID 30511107.
- ^ Otles, S; Yalcin, B (2012). «Phenolic compounds analysis of root, stalk, and leaves of nettle». ScientificWorldJournal. 2012: 564367. doi:10.1100/2012/564367. PMC 3349212. PMID 22593694.
- ^ Sanhueza, Eugenio; Andreae, Meinrat O (1991). «Emission of formic and acetic acids from tropical Savanna soils». Geophysical Research Letters. 18 (9): 1707–10. Bibcode:1991GeoRL..18.1707S. doi:10.1029/91GL01565.
- ^ Wray, J (1670). «Extract of a Letter, Written by Mr John Wray to the Publisher January 13. 1670. Concerning Some Un-Common Observations and Experiments Made with an Acid Juyce to be Found in Ants». Philosophical Transactions of the Royal Society of London. 5 (57–68): 2063–2066. Bibcode:1670RSPT….5.2063W. doi:10.1098/rstl.1670.0052.
- ^ Johnson, W. B. (1803). History of the process and present state of animal chemistry.
- ^ «OSHA Occupational Chemical Database – Occupational Safety and Health Administration». osha.gov. Archived from the original on 29 April 2021. Retrieved 17 April 2015.
- ^ a b c d e f g h Reutemann, Werner; Kieczka, Heinz (2000). «Formic Acid». Ullmann’s Encyclopedia of Industrial Chemistry. doi:10.1002/14356007.a12_013. ISBN 978-3-527-30673-2.
- ^ a b Roman M. Balabin (2009). «Polar (Acyclic) Isomer of Formic Acid Dimer: Gas-Phase Raman Spectroscopy Study and Thermodynamic Parameters». The Journal of Physical Chemistry A. 113 (17): 4910–8. Bibcode:2009JPCA..113.4910B. doi:10.1021/jp9002643. PMID 19344174.
- ^ Koch, H.; Haaf, W. (1973). «1-Adamantanecarboxylic Acid». Organic Syntheses.; Collective Volume, vol. 5, p. 20
- ^ G. H. Coleman, David Craig (1943). «p-Tolualdehyde». Organic Syntheses.; Collective Volume, vol. 2, p. 583
- ^ a b Fellay, Céline; Dyson, Paul J.; Laurenczy, Gábor (2008). «A Viable Hydrogen-Storage System Based on Selective Formic Acid Decomposition with a Ruthenium Catalyst». Angewandte Chemie International Edition. 47 (21): 3966–8. doi:10.1002/anie.200800320. PMID 18393267.
- ^ G. Laurenczy, C. Fellay, P. J. Dyson, Hydrogen production from formic acid. PCT Int. Appl. (2008), 36pp. CODEN: PIXXD2 WO 2008047312 A1 20080424 AN 2008:502691
- ^ Ozawa, Naoto; Okubo, Tatsuo; Matsuda, Jun; Sakai, Tatsuo (October 2016). «Observation and analysis of metal oxide reduction by formic acid for soldering». 2016 11th International Microsystems, Packaging, Assembly and Circuits Technology Conference (IMPACT): 148–151. doi:10.1109/IMPACT.2016.7799990. ISBN 978-1-5090-4769-7. S2CID 32545113.
- ^ L. F. Fieser; J. E. Jones (1955). «N-Methylformanilide». Organic Syntheses.; Collective Volume, vol. 3, p. 590
- ^ Zhou, Xiaowei; et al. (2012). «Varying the ratio of formic acid to triethylamine impacts on asymmetric transfer hydrogenation of ketones». Journal of Molecular Catalysis A: Chemical. 357: 133–140. doi:10.1016/j.molcata.2012.02.002. ISSN 1381-1169.
- ^ Haaf, Wolfgang (1966). «Die Synthese sekundärer Carbonsäuren nach der Ameisensäure-Methode». Chemische Berichte. 99 (4): 1149–52. doi:10.1002/cber.19660990410.
- ^ Wu, G; Shlykov, S; Van Alseny, F. S; Geise, H. J; Sluyts, E; Van Der Veken, B. J (1995). «Formic Anhydride in the Gas Phase, Studied by Electron Diffraction and Microwave and Infrared Spectroscopy, Supplemented with Ab-Initio Calculations of Geometries and Force Fields». The Journal of Physical Chemistry. 99 (21): 8589–98. doi:10.1021/j100021a022.
- ^ a b c d e f S. N. Bizzari; M. Blagoev (June 2010). «CEH Marketing Research Report: FORMIC ACID». Chemical Economics Handbook. SRI consulting. Archived from the original on 14 September 2011.
- ^ P. G. Jessop (2007). J. G. de Vries, C. J. Elsevier (ed.). Handbook of Homogeneous Hydrogenation. Weinheim, Germany: Wiley-VCH. pp. 489–511.
- ^ Jessop, Philip G; Joó, Ferenc; Tai, Chih-Cheng (2004). «Recent advances in the homogeneous hydrogenation of carbon dioxide». Coordination Chemistry Reviews. 248 (21–24): 2425. doi:10.1016/j.ccr.2004.05.019.
- ^ Wölfel, Rene; Taccardi, Nicola; Bösmann, Andreas; Wasserscheid, Peter (2011). «Selective catalytic conversion of biobased carbohydrates to formic acid using molecular oxygen». Green Chemistry. 13 (10): 2759. doi:10.1039/C1GC15434F. S2CID 97572039.
- ^ Albert, Jakob; Wölfel, Rene; Bösmann, Andreas; Wasserscheid, Peter (2012). «Selective oxidation of complex, water-insoluble biomass to formic acid using additives as reaction accelerators». Energy & Environmental Science. 5 (7): 7956. doi:10.1039/C2EE21428H. S2CID 93224286.
- ^ Chattaway, Frederick Daniel (1914). «XX.—Interaction of glycerol and oxalic acid». Journal of the Chemical Society, Transactions. 105: 151–6. doi:10.1039/CT9140500151. hdl:2027/mdp.39015067135775.
- ^ Arthur Sutcliffe (1930). Practical Chemistry for Advanced Students (1949 ed.). London: John Murray.
- ^ B. Innocent; et al. (February 2009). «Electro-reduction of carbon dioxide to formate on lead electrode in aqueous medium». Journal of Applied Electrochemistry. 39 (2): 227–232. doi:10.1007/s10800-008-9658-4. S2CID 98437382.
- ^ Hefetz, Abraham; Blum, Murray (1 November 1978). «Biosynthesis of formic acid by the poison glands of formicine ants». Biochimica et Biophysica Acta (BBA) — General Subjects. 543 (4): 484–496. doi:10.1016/0304-4165(78)90303-3. PMID 718985.
- ^ Makar, A.B; McMartin, K.E; Palese, M; Tephly, T.R (1975). «Formate assay in body fluids: Application in methanol poisoning». Biochemical Medicine. 13 (2): 117–26. doi:10.1016/0006-2944(75)90147-7. PMID 1.
- ^ Organic Acids and Food Preservation, Maria M. Theron, J. F. Rykers Lues
- ^ Griggs, J. P; Jacob, J. P (2005). «Alternatives to Antibiotics for Organic Poultry Production». The Journal of Applied Poultry Research. 14 (4): 750. doi:10.1093/japr/14.4.750.
- ^ Garcia, V; Catala-Gregori, P; Hernandez, F; Megias, M. D; Madrid, J (2007). «Effect of Formic Acid and Plant Extracts on Growth, Nutrient Digestibility, Intestine Mucosa Morphology, and Meat Yield of Broilers». The Journal of Applied Poultry Research. 16 (4): 555. doi:10.3382/japr.2006-00116.
- ^ Hoppe, H.; Ritter, W.; Stephen, E. W. C. (1989). «The control of parasitic bee mites: Varroa jacobsoni, Acarapis woodi and Tropilaelaps clareae with formic acid». American Bee Journal.
- ^ Ha, S; Larsen, R; Masel, R.I (2005). «Performance characterization of Pd/C nanocatalyst for direct formic acid fuel cells». Journal of Power Sources. 144 (1): 28–34. Bibcode:2005JPS…144…28H. doi:10.1016/j.jpowsour.2004.12.031.
- ^ Jorn Madslien (27 June 2017). «Ant power: Take a ride on a bus that runs on formic acid». BBC News. Retrieved 11 July 2017.
- ^ Yishai, Oren; Lindner, Steffen N; Gonzalez de la Cruz, Jorge; Tenenboim, Hezi; Bar-Even, Arren (December 2016). «The formate bio-economy». Current Opinion in Chemical Biology. 35: 1–9. doi:10.1016/j.cbpa.2016.07.005. PMID 27459678.
- ^ Shmuel Gleizer; et al. (November 2019). «Conversion of Escherichia coli to Generate All Biomass Carbon from CO2«. Cell. 179 (6): 1255–1263.e12. doi:10.1016/j.cell.2019.11.009. PMC 6904909. PMID 31778652.
- ^ Kim, Seohyoung; Lindner, Steffen N.; Aslan, Selçuk; Yishai, Oren; Wenk, Sebastian; Schann, Karin; Bar-Even, Arren (10 February 2020). «Growth of E. coli on formate and methanol via the reductive glycine pathway». Nature Chemical Biology. 16 (5): 538–545. doi:10.1038/s41589-020-0473-5. ISSN 1552-4469. PMID 32042198. S2CID 211074951.
- ^ Joó, Ferenc (2008). «Breakthroughs in Hydrogen Storage-Formic Acid as a Sustainable Storage Material for Hydrogen». ChemSusChem. 1 (10): 805–8. doi:10.1002/cssc.200800133. PMID 18781551.
- ^ «UCLA Researchers Use Electricity and CO2 to Make Butanol». 30 March 2012.
- ^ Liao, James C.; Cho, Kwang Myung; Huo, Yi-Xin; Malati, Peter; Higashide, Wendy; Wu, Tung-Yun; Rogers, Steve; Wernick, David G.; Opgenorth, Paul H.; Li, Han (30 March 2012). «Integrated Electromicrobial Conversion of CO2 to Higher Alcohols». Science. 335 (6076): 1596. Bibcode:2012Sci…335.1596L. doi:10.1126/science.1217643. PMID 22461604. S2CID 24328552.
- ^ Sampson, Joanna (2 August 2020). «Wireless device makes clean fuel from sunlight, CO2 and water». Gasworld. Retrieved 26 August 2020.
- ^ «Archived copy». Archived from the original on 7 November 2017. Retrieved 7 November 2017.
{{cite web}}: CS1 maint: archived copy as title (link)[full citation needed] - ^ Heukeshoven, Jochen; Dernick, Rudolf (1982). «Reversed-phase high-performance liquid chromatography of virus proteins and other large hydrophobic proteins in formic acid containing solvents». Journal of Chromatography A. 252: 241–54. doi:10.1016/S0021-9673(01)88415-6. PMID 6304128.
- ^ Bhat, Ramesh M; Vidya, Krishna; Kamath, Ganesh (2001). «Topical formic acid puncture technique for the treatment of common warts». International Journal of Dermatology. 40 (6): 415–9. doi:10.1046/j.1365-4362.2001.01242.x. PMID 11589750. S2CID 42351889.
- ^ Sadun, A. A (2002). «Mitochondrial optic neuropathies». Journal of Neurology, Neurosurgery, and Psychiatry. 72 (4): 423–5. doi:10.1136/jnnp.72.4.423. PMC 1737836. PMID 11909893.
- ^ a b «Occupational Safety and Health Guideline for Formic Acid». OSHA. Archived from the original on 20 September 2011. Retrieved 28 May 2011.
- ^ 21 CFR 186.1316, 21 CFR 172.515
External links[edit]
- International Chemical Safety Card 0485.
- NIOSH Pocket Guide to Chemical Hazards.
- ChemSub Online (Formic acid).
(метановая к-та) НСООН, мол. м. 46,03; бесцв. жидкость с резким запахом; т. пл. 8,4 °С, т. кип. 100,7°С; d204 1,220; D20 1,3714; h 1,784 мПа . с (25°С); g 37,58 мН/м; давление пара безводной М. к. (кПа): 4,40 (20 °С), 10,98 (40 °С), 25,23 (60 °С), 52,94 (80 °С); DH0 пл 12,69 кДж/моль, D0 исп 46,3 кДж/моль, S0298 129 ДжДмоль .K); С° 98,78 Дж/(моль . К) (17 °С); e 56,1 (25 °С); m 4,7.10-30 Кл Х м; р К а3,45 (25 °С). Смешивается во всех соотношениях с водой, диэтиловым эфиром, этанолом, не раств. в али-фатич. углеводородах, умеренно раств. в бензоле, толуоле, ССl4, образует азеотропную смесь с водой (т. кип. 107,3°С; 77,5% по массе М. к.).
Молекула М. к. имеет плоское строение. Длины связей СЧН, С=О, СЧО и ОЧН равны соотв. 0,1085, 0,1245, 0,1312 и 0,095 нм; углы ОЧС=О, НЧС=О и СЧОЧН соотв. 124,3, 117,8 и 107,8°.
Остаток М. к.-формил, соли и эфиры-формиаты.
М. к.-простейшая карбоновая к-та, заметно сильнее др. алифатич. к-т. Вступает в р-ции окисления — восстановления, присоединения, циклизации.
При нагревании М. к. разлагается с образованием СО 2 и Н 2; H2SO4 расщепляет ее на СО и Н 2 О; Н 2 О 2 окисляет до надмуравьиной к-ты НСОООН. Со спиртами в присут. H2SO4 дает сложные эфиры (см. табл.). Подобно альдегидам М. к. проявляет восстановит. св-ва: осаждает серебро из аммиачных р-ров AgNO3; вступает в р-цию восстановит. аминирования, в частности в Лейкарта-Валлаха реакцию; при взаимод. первичных и вторичных аминов с М. к. и формальдегидом образуются N-метилированные амины; смесь М. к. со стехиометрич. кол-вом третичных аминов-эффективный восстановитель карбонильных соед. до спиртов.
М. к. легко присоединяется к олефинам с образованием сложных эфиров; в присут. H2SO4 олефины карбоксили-руются до третичных карбоновых к-т (р-ции Коха-Хаафа), напр.:
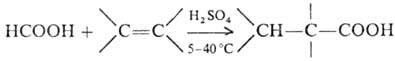
Р-ция М. к. с олефинами в присут. Н 2 О 2 и кислотных катализаторов приводит к гликолевым эфирам, а р-ции с ацетиленом в паровой фазе-к виниловому эфиру. М. к. вступает в р-ции циклизации, образуя с о-фенилендиамином бензимидазол, с 4,5-диаминопиримидином-пурин.
СВОЙСТВА ЭФИРОВ МУРАВЬИНОЙ КИСЛОТЫ
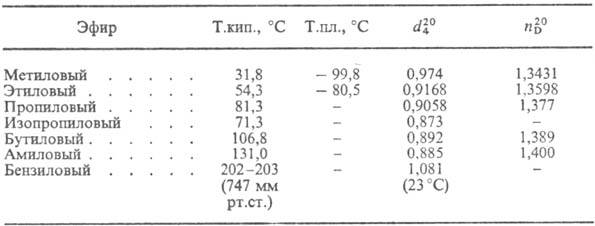
В природе М. к. обнаружена в хвое, крапиве, фруктах, едких выделениях пчел и муравьев (в последних впервые обнаружена в 17 в., отсюда назв.).
В больших кол-вах М. к. образуется в качестве побочного продукта при жидкофазном окислении бутана и легкой бензиновой фракции в произ-ве уксусной к-ты. М. к. получают также (~ 35% от общего мирового произ-ва) гидролизом формамида; процесс состоит из неск. стадий: карбо-нилирование метанола, взаимод. метилформиата с безводным NH3 и последующий гидролиз образовавшегося формамида 75%-ной H2SO4. Иногда используют прямой гидролиз метилформиата (р-цию проводят в избытке воды или в присут. третичного амина), гидратацию СО в присут. щелочи (к-ту выделяют из соли действием H2SO4), дегидрогенизацию СН 3 ОН в паровой фазе в присут. катализаторов, содержащих Сu, а также Zr, Zn, Cr, Mn, Mg и др. (метод не имеет пром. значения).
М. к. применяют как протраву при крашении и отделке текстиля и бумаги, обработке кожи; как консервант при силосовании зеленой массы, фруктовых соков, а также для дезинфекции бочек для пива и вина; для борьбы с клещами, вызывающими варрооз пчел; для получения лек. ср-в, пестицидов, р-рителей (напр., диметилформамида), солей и эфиров. Метилформиат-р-ритель жиров, минер. и растит. масел, целлюлозы, жирных к-т; ацилирующий агент; используют в произ-ве нек-рых уретанов, формамида и др. Этил-формиат — р-ритель нитрата и ацетата целлюлозы; ацилирующий агент; отдушка для мыла; применяют в произ-ве витаминов B1, A, E. Изоамилформиат — р-ритель смол и нитроцеллюлозы; бензилформиат — р-ритель лаков, красителей, душистых в-в.
М. к. раздражает верх. дыхат. пути и слизистые оболочки глаз; при попадании на кожу вызывает хим. ожоги.
Для М. к., метил- и этилформиата соотв. т. всп. 60, Ч21, -20°С; т. самовоспл. 504, 456, 440 °С; КПВ 14,3-33,0, 5,5-21,8, 2,8-16%; ПДК 1, 100, 100 мг/м 3.
Т-ра хранения М. к. не ниже 0°С; при комнатной т-ре медленно разлагается на СО и Н 2 О; для хранения при т-ре до 35°С М. к. стабилизируют добавлением до 1% воды, а при 35-55 °С-до 3% воды. Объем мирового произ-ва М. К.-250 тыс. т/год (1980).
Лит.: Физико-химические свойства продуктов производства изопрена, под ред. С. К. Огородникова, М., 1974; Агуйло А., Хорленко Т., «Нефть, газ и нефтехимия за рубежом», 1980, № 11^, с. 104-13. Н. Г. Вергунова.
Химическая энциклопедия. — М.: Советская энциклопедия.
.
1988.
Определение и формула
Органическое соединение, относится к насыщенным одноосновным карбоновым кислотам.
Альтернативное название
Метановая кислота
Формула
HCOOH
Свойства муравьиной кислоты
Физические свойства
Муравьиная кислота – прозрачная жидкость с резким характерным запахом.
С водой, этиловым спиртом и диэтиловым эфиром она смешивается во всех отношениях, растворима в ацетоне и в ароматических углеводородах (бензоле, толуоле), нерастворима в алифатических углеводородах (бензине, гексане, уайт-спирите). Муравьиная кислота в концентрации 77,5 % образует азеотропную смесь, кипящую при температуре 107,3°С.
| Свойство | Описание |
|---|---|
| Внешний вид | Прозрачная жидкость белого цвета |
| Молярная масса | 46,025 г/моль |
| Плотность при 20°С | 1,220 г/см3 |
| Показатель преломления при 20°С | 1,37142 nD20 |
| Температура плавления | 8,25°С |
| Температура кипения | 100,7°С |
Химические свойства
При взаимодействии с основаниями образует соли – формиаты:
NaOH + НСООН = HCOONa + H2O.
Формиаты легко растворимы в воде.
При нагревании муравьиной кислоты со спиртами в присутствии серной кислоты образуются сложные эфиры:
CH3OH +НСООН = НСООСН3 + H2O.
Муравьиную кислоту можно считать альдегидом угольной кислоты, поэтому она легко окисляется перманганатом калия:
5НСООН + KMnO4 + H2S04 = 6H2O + 5СО2 + MnSO4.
Наличие альдегидной группы в соединениях определяют при помощи реакции серебряного зеркала:
НСООН + 2[Ag(NH3)2]OH → 2Ag + (NH4)2CO3 + 2NH3 + H2O.
Муравьиная кислота горюча:
2НСООН + О2 = H2O + 2CO2.
При нагревании в присутствии иридия она разлагается на углекислый газ и водород:
НСООН = H2 + CO2,
При нагревании с серной кислотой выделяется монооксид углерода:
НСООН = Н2О+ СО.
Последняя реакция является лабораторным способом получения монооксида углерода (угарного газа).
Получение
Естественные способы получения
Муравьиной эта кислота названа Джоном Рэйем, который получил ее в 1670 году из муравьев. Она встречается также в пчелином яде, в крапиве и хвое. Присутствует в некоторых плодах и ягодах.
Лабораторный способ получения
Муравьиная кислота получается при нагревании щавелевой кислоты в присутствии глицерина:
(СООН)2 = НСООН + СО2.
Получение в промышленности
Самый распространенный промышленный метод получения муравьиной кислоты – это реакция между монооксидом углерода СО и едким натром:
NaOH + СО = HCOONa.
Получающийся формиат натрия переводят в муравьиную кислоту:
2HCOONa + H2SO4 = 2НСООН + Na2SO4.
Значительная часть муравьиной кислоты получается в производстве уксусной кислоты методом окисления бутана в жидкой фазе как побочный продукт.
Есть и множество других способов, но они пока не получили большого распространения.
Применение
Муравьиную кислоту применяют наружно при болезнях суставов в виде 1,75% спиртового раствора, который называют муравьиным спиртом. В косметике ее включают в состав лосьонов от угревой сыпи.
Применяется она при выделке кожи и при крашении тканей. В химической промышленности из нее получают растворитель метилформиат НСООСН3 (метиловый эфир муравьиной кислоты).
В животноводстве муравьиную кислоту добавляют в корма с целью профилактики кишечных заболеваний у скота, в особенности молодняка. Пчеловоды пользуются ей для лечения варроатоза.
Муравьиная кислота, маркируемая как Е236, входит в состав напитков, конфет, пирожных и других кондитерских изделий. Добавляют ее и при мариновании овощей.
Муравьиная кислота из пищевых продуктов легко усваивается организмом. А вот растворы ее с концентрацией больше 10% могут вызвать ожоги. Очень опасна концентрированная кислота, поскольку легко проникает в ткани и оставляет очень глубокие ожоги. При попадании на кожу или в глаза следует немедленно смыть ее раствором соды.
Пример решения задачи
Осуществите следующие превращения:
СН4→CH3Cl→СН3ОН→НСНО→НСООН→НСООСН3.
Решение
СН4 + Cl2 = CH3Cl + HCl;
CH3Cl + NaOH = СН3ОН + NaCl;
2СН3ОН + O2 = 2НСНО + Н2О;
НСНО + Cu(OH)2 = НСООН + Cu2O + 2Н2О;
СН3ОН + НСООН = НСООСН3 + Н2О.
Тест по теме «Муравьиная кислота»
Содержание
- Структурная формула
- Русское название
- Английское название
- Латинское название вещества Муравьиная кислота
- Брутто формула
- Фармакологическая группа вещества Муравьиная кислота
- Нозологическая классификация
- Код CAS
- Фармакологическое действие
- Характеристика
- Фармакология
- Применение вещества Муравьиная кислота
- Противопоказания
- Побочные действия вещества Муравьиная кислота
- Способ применения и дозы
- Меры предосторожности
- Торговые названия с действующим веществом Муравьиная кислота
Структурная формула
Русское название
Муравьиная кислота
Английское название
Formic acid
Латинское название вещества Муравьиная кислота
Acidum formicicum (род. Acidum formicici)
Фармакологическая группа вещества Муравьиная кислота
Фармакологическое действие
—
местноанестезирующее, местнораздражающее, отвлекающее, противовоспалительное, улучшающее тканевой метаболизм.
Характеристика
Органическая кислота, pKа (20 °C) 3,75. Смешивается с водой, эфиром, метанолом, этанолом; с водой образует азеотропную смесь (77,5%). В медицинской практике применяют в виде 1,4% спиртового раствора (муравьиный спирт) — прозрачная бесцветная жидкость со своеобразным резким запахом.
Фармакология
Вызывает рефлекторные реакции, обусловленные раздражением чувствительных нервных окончаний кожи, мышечной ткани и сопровождающиеся стимуляцией образования и высвобождения энкефалинов и нейропептидов, регулирующих болевые ощущения и проницаемость сосудов. Стимулирует либерацию гистамина, кининов и др. биологически активных соединений, расширяющих сосуды, стимулирующих иммунологические процессы, влияющих на свертываемость крови.
Используется в пищевой промышленности в качестве разрешенной к применению пищевой добавки Е236.
Применение вещества Муравьиная кислота
Миозит, ревматические боли, невралгии, радикулиты.
Противопоказания
Гиперчувствительность, дерматит, экзема, нарушение целостности кожи.
Побочные действия вещества Муравьиная кислота
Местное раздражение кожи (покраснение, зуд, шелушение).
Способ применения и дозы
Наружно. Наносят на кожу в достаточном количестве и тщательно втирают.
Меры предосторожности
Необходимо избегать нанесения на слизистые, приема внутрь.
Торговые названия с действующим веществом Муравьиная кислота
| Торговое название | Цена за упаковку, руб. |
|---|---|
| Муравьиный спирт |
от 24.00 до 71.00 |
| Муравьиный спирт Реневал |
104.00 |
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Значение словосочетания «муравьиная кислота»

-
Муравьиная кислота — кислота, содержащаяся в хвое, крапиве, едких выделениях муравьев и пчел (используется в медицине и в химии).
См. также муравьиный.
Источник (печатная версия): Словарь русского языка: В 4-х
т. / РАН,
Ин-т лингвистич.
исследований; Под ред. А. П. Евгеньевой. — 4-е изд., стер. — М.: Рус. яз.;
Полиграфресурсы,
1999;
(электронная версия): Фундаментальная
электронная
библиотека
- Муравьиная кислота (систематическое наименование: метановая кислота) HCOOH — первый представитель в ряду насыщенных одноосновных карбоновых кислот. Зарегистрирована в качестве пищевой добавки под обозначением E236. Своё название муравьиная кислота получила потому, что впервые она была выделена в 1670 году английским натуралистом Джоном Рэйем из рыжих лесных муравьёв. В природе также обнаружена у пчёл, в крапиве, хвое. Соли и анионы муравьиной кислоты называются формиатами.
Источник: Википедия
-
муравьиная кислота
1. хим. органическое соединение, простейшая насыщенная одноосновная карбоновая кислота, химическая формула HCOOH ◆ Соли и эфиры муравьиной кислоты называют формиатами.
Источник: Викисловарь
Делаем Карту слов лучше вместе
Привет! Меня зовут Лампобот, я компьютерная программа, которая помогает делать
Карту слов. Я отлично
умею считать, но пока плохо понимаю, как устроен ваш мир. Помоги мне разобраться!
Спасибо! Я стал чуточку лучше понимать мир эмоций.
Вопрос: колюче — это что-то нейтральное, положительное или отрицательное?
Ассоциации к слову «муравьиный»
Ассоциации к слову «кислота»
Синонимы к словосочетанию «муравьиная кислота»
Предложения со словосочетанием «муравьиная кислота»
- За ним осталась струйка быстро испаряющейся муравьиной кислоты.
- При употреблении крапивы в пищу лучше всего использовать крапиву двудомную – в клеточном соке её волосков содержится меньшее количество муравьиной кислоты, поэтому она не такая жгучая, как вышеописанное растение.
- Муравьиная кислота вредна растениям, и они хиреют прямо на глазах.
- (все предложения)
Сочетаемость слова «кислота»
- лимонная кислота
аскорбиновая кислота
серная кислота - кислоты омега
соляная кислота желудочного сока
жирные кислоты класса омега - раствор борной кислоты
действие кислоты
соли мочевой кислоты - содержать органические кислоты
добавить лимонную кислоту
превращаться в кислоту - (полная таблица сочетаемости)
Понятия со словосочетанием «муравьиная кислота»
-
Муравьиная кислота (систематическое наименование: метановая кислота) HCOOH — органическое соединение, первый представитель в ряду насыщенных одноосновных карбоновых кислот. Зарегистрирована в качестве пищевой добавки под обозначением E236. Своё название муравьиная кислота получила потому, что впервые она была выделена в 1670 году английским натуралистом Джоном Рэйем из рыжих лесных муравьёв. В природе также обнаружена у пчёл, в крапиве, хвое. Соли и анионы муравьиной кислоты называются формиатами…
- (все понятия)
Отправить комментарий
Дополнительно
Поиск химических веществ по названиям или формулам.
Справочник содержит названия веществ и описания химических формул (в т.ч. структурные формулы и скелетные формулы).
Введите часть названия или формулу для поиска:
Языки:
По умолчанию |
Все возможные |
Из списка
[▼]
|
Применить к найденному
Муравьиная кислота
Брутто-формула:
CH2O2
CAS# 64-18-6
Категории:
Кислота
, Карбоновые кислоты
PubChem CID: 284
Названия
Русский:
- Метановая кислота(IUPAC)
- Муравьиная кислота [Wiki]
Варианты формулы:
HCOOH
H/C`|O|OH
H/`|O|OH
OH`/||O
Вещества, имеющие отношение…
Альдегид:
Формальдегид
Ангидрид:
Ангидрид муравьиной-уксусной кислоты
Анион:
Формиаты
Следущий гомолог:
Уксусная кислота
Сложные эфиры:
Метилформиат; Этилформиат; Изобутилформиат; изоамилформиат; Бензилформиат; фенилформиат; винилформиат; Бутилформиат
Химический состав
Реакции, в которых участвует Муравьиная кислота
-
{R}/`|O|OH + HO/CH3 -> {R}/`|O|O/CH3 + H2O
, где R =
H H3C H3C H3C/ -
{R}/`|O|H + 2[Ag(NH3)2]OH -> 2Ag»|v» + {R}/`|O|OH + 4NH3 + H2O
, где R =
H H3C H3C HO/<`|wOH><|dOH>/<`|dOH><|dOH> -
{R}/`|O|OH + ClS|O`|/Cl -> {R}/`|O|Cl + SO2 + HCl
, где R =
H H3C H3C -
HCOOH —> H2O + CO»|^»
-
HCOOH + ClSO3H -> H2SO4 + HCl + CO»|^»
И ещё 21 реакция…
Муравьиная кислота – вещество, входящее в группу карбоновых насыщенных одноосновных кислот. Оно имеет широкую сферу применения, активно используется в разных областях. В этой статье рассмотрим основные свойства муравьиной кислоты, способы её получения и другие особенности.
Формула и альтернативные названия
Муравьиная кислота, формула которой – HCOOH (в сокращённом варианте – CH2O2), имеет несколько альтернативных наименований. Корректное общепринятое химическое название – метановая кислота. Если вещество используется в качестве пищевой добавки, то производители продуктов питания обозначают его маркировкой E236. В косметических средствах и медикаментах встречается наименование Formic acid.
Муравьиная кислота название получила с подачи учёного из Англии Джона Рея в XVII столетии. Тогда исследователь изучал обезболивающий эффект выделений муравьёв и для получения лекарства провёл эксперимент – довёл до кипения несколько десятков насекомых, а затем осуществил дистилляцию. Образовался конденсат с кислотными свойствами, характерным вкусом. Эту жидкость учёный назвал муравьиной кислотой.
Двумя веками позже химиком французского происхождения Бертело был открыт иной метод получения вещества – путём выделения из оксида углерода. Джозеф Гей-Люссак сумел синтезировать соединение из уксусной кислоты. В 19-м столетии был разработан промышленный способ производства. Стали использовать иное название – метановая кислота (формула та же).
Свойства
Муравьиная кислота является жидкостью с резким специфическим запахом, кислым вкусом. В любых пропорциях вещество хорошо смешивается с диэтиловым эфиром, обычной водой, этиловым спиртом.
Метановая кислота растворяется в ацетоне, глицерине, нефтепродуктах, углеводородах ароматического ряда – толуоле, бензоле. В углеводородах алифатического типа вещество не меняет структуру. При нагреве муравьиная кислота разлагается на двуокись углерода и водород. Вещество горючее, пожароопасное.
Полезная информация! Муравьиная кислота цвета не имеет. Жидкость абсолютно прозрачная.
Муравьиная кислота относится к сильным карбоновым кислотам, она сильнее более известной уксусной в 10 раз. Главное отличие от прочих подобных соединений – проявление не только кислотных свойств, но и отдельных характеристик альдегидов. Это обусловлено молекулярным строением, в котором присутствуют альдегидная связь H-CO и кислотная составляющая CO-OH. При вступлении метановой кислоты в реакцию с гидроокисью меди формируется не соль, а комбинация углекислого газа, оксида меди и воды. Кислотные свойства вещество демонстрирует при контактах с солями, металлами, гидроксидами.
Польза и вред
Возможны опасные свойства для человека, и их выраженность зависит от концентрации вещества. Так, если муравьиная кислота содержится в растворе в объеме до 10%, то она считается относительно безвредной. При концентрации 10-15% вещество демонстрирует раздражающий эффект при контактах со слизистыми оболочками и с кожей. Если метановая кислота содержится в растворах в количестве более 15-20%, то она оказывает разъедающее воздействие.
При более высоких концентрациях вещество при попадании на слизистые оболочки или кожные покровы оставляет сильнейшие химические ожоги, в тяжёлых случаях провоцирует анафилактический шок. При продолжительном периоде и обширных зонах контактов вероятен летальный исход.
Но нельзя недооценивать пользу муравьиной кислоты, ведь она выполняет важные функции, поддерживает нормальную жизнедеятельность живых существ – людей и животных. Вещество участвует в синтезе нуклеиновых кислот, пуриновых оснований, метионина. Оно запускает важные реакции в клетках, соединительных тканях и внутренних органах. Также свойства метановой кислоты включают обезболивающий, противопаразитарный, антисептический, противовоспалительный и прочие эффекты.
Содержание муравьиной кислоты в продуктах
Есть ли муравьиная кислота в продуктах? Да, она встречается в природе и обнаружена в разных концентрациях в авокадо, клубнике, папайе, яблоках, киноа, диком ямсе, малине, питайе, китайском личи.
Есть метановая кислота и в некоторых растениях: крапиве, хвойных деревьях. Вещество присутствует в организмах живых существ – в телах и некоторых выделениях человека, медуз, пчёл. Но получить метановую кислоту из природных источников крайне сложно, так как её содержание в них обычно невысокое.
Получение муравьиной кислоты
Муравьиную кислоту можно получить разными способами.
- Нагрев щавелевой кислоты. Муравьиная кислота выделяется из её глицериновых эфиров.
- Изготовление уксусной кислоты. Метановая кислота является побочным продуктом, образующимся в жидкой фазе реакции окисления бутана.
- Вступление едкого натра в реакцию с монооксидом углерода. Получение муравьиной кислоты таким путём является самым популярным, поэтому часто применяется в промышленных масштабах.
- Разложение формамида. Метановая кислота образуется при вступлении этого вещества в реакцию с серной кислотой высокой концентрации.
- Окисление метанола. Процесс преобразования метилового спирта протекает последовательно, в несколько этапов и с использованием разных катализаторов.
- Воздействие на углеродсодержащие соединения. Пример – реакция хлороформа и разбавленной щёлочи.
Применение муравьиной кислоты
Муравьиная кислота, производство которой налажено в Китае, Германии, России, имеет широкую сферу применения. Её используют в промышленности, в медицине, в быту, сельском хозяйстве. Ниже рассмотрим все существующие направления.
Применение в пищевой промышленности
Муравьиная кислота останавливает развитие патогенной микрофлоры в еде, благодаря чему эффективно применяется в пищевой промышленности качестве консерванта, продлевающего сроки хранения продуктов и обеспечивающего их свежесть.
Добавка с маркировкой E236 входит в состав:
- маринадов для рыбы;
- напитков без содержания алкоголя;
- мёда;
- консервов из мяса, рыбы, морепродуктов;
- соусов;
- консервированных фруктов, овощей, ягод;
- кондитерских изделий – тортов, конфет, пирожных;
- продуктов с содержанием сыров.
Также вещество применяют в промышленности для дезинфицирующей обработки бочек, в которых изготавливается алкогольная продукция – вино, пиво. Часто добавку комбинируют с иными консервантами, такими как бензойная кислота.
Максимальная суточная доза муравьиной кислоты – 3 миллиграмма на каждый килограмм веса человека. Вещество в организме не накапливается, быстро усваивается, перерабатывается печенью, выводится вместе с каловыми массами. Высокие концентрации метановой кислоты способны оказывать мочегонное воздействие.
Важная информация! В качестве пищевой добавки вещество с маркировкой E236 разрешено использовать в странах-членах Евразийского экономического союза – Казахстане, Армении, России, Киргизии, Белоруссии. В государствах Евросоюза можно добавлять метановую кислоту только в косметические продукты. В США допустимо применять вещество при изготовлении синтетических пищевых ароматизаторов.
Применение в медицине
Муравьиная кислота в медицине применяется только наружно. Самая популярная форма выпуска – муравьиный спирт 1,4%, который обладает местнораздражающим эффектом, благодаря чему снимает воспаление, борется с болевыми ощущениями, расширяет сосуды и нормализует кровоснабжение, питание тканей. Также отмечаются бактерицидные свойства.
Муравьиный спирт можно использовать при:
- миозите;
- травмах: ушибах, вывихах, гематомах, растяжениях;
- артралгии;
- миалгии;
- артритах;
- невралгии;
- грибке ногтевых пластин или кожи;
- ревматизме;
- болях в голове, суставах;
- варикозе;
- пролежнях у лежачих больных;
- туберкулёзе (в составе многокомпонентных средств);
- радикулите.
Полезно знать! На основе муравьиной кислоты выпускаются другие средства для наружного местного использования – мази, кремы, гели, спреи.
Применение в косметологии
Благодаря дезинфицирующим, противовоспалительным и очищающим свойствам метановая кислота применяется в косметологии для:
- борьбы с акне, чёрными точками;
- матирования жирной кожи;
- очищения пор;
- улучшения цвета кожных покровов за счёт расширения сосудов и нормализации кровообращения;
- получения ровного загара в солярии (нужно соблюдать осторожность);
- купирования воспалений;
- борьбы с нежелательными волосками на теле – замедления их роста после депиляции, а также разрушения фолликулов (при регулярном применении).
Муравьиная кислота входит в состав различных косметических средств, например, лосьонов, тоников, кремов, сывороток. Также вещество можно использовать в домашних условиях, добавляя в народные средства – самодельные маски, кремы, отвары для умывания.
Применение в быту
Муравьиную кислоту используют предприятия химической промышленности. Вещество справляется с удалением извести, патины, цемента, ржавчины, кальциевого мыла, а также иных органических и минеральных неорганических частиц.
Метановая кислота входит в состав бытовой химии для:
- удаления налёта накипи на сантехнике и посуде;
- чистки унитазов и ванн;
- предотвращения образования накипи в посудомоечных, стиральных машинах;
- очищения металлических изделий, включая автомобильные диски и прочие детали;
- стирки или кондиционирования белья;
- дезинфекции поверхностей.
Так как муравьиная кислота – вещество биоразлагаемое, то все средства на его основе не вредят окружающей среде и являются экологически чистыми.
Применение в других отраслях
Применение муравьиной кислоты очень широко и включает несколько других направлений:
- Пчеловодство. Вещество защищает насекомых-медоносов от клещей, уничтожающих целые ульи.
- Кожевенные, меховые производства. Кожа и мех с помощью метановой кислоты очищаются от загрязнений и дезинфицируются, обретают равномерный оттенок и эластичную структуру.
- Сельское хозяйство. Обработка кормов муравьиной кислотой при заготовке продлевает сроки хранения пищи для скота и птицы, сохраняет её пользу и защищает от паразитов.
- Борьба с гололёдом. Вещество добавляется в реагенты, используемые для обработки скользких замёрзших дорог в зимнее время.
- Строительство. В бетонных растворах кислота используется в качестве добавки, препятствующей промерзанию конструкций.
- Животный мир. Муравьиная кислота, запах и раздражающие свойства которой отпугивают паразитов, используется медведями. Эти животные, просыпаясь после зимнего сна, намеренно усаживаются на муравейники. Насекомые, защищаясь, выделяют кислоту. Вещество оседает в густом мехе и защищает представителей фауны от укусов кровососущих насекомых.
Меры безопасности
Чтобы муравьиная кислота не навредила, следует соблюдать такие меры безопасности:
- Не превышать суточную норму потребления.
- Не контактировать с концентрированными формами вещества – более 10%. Если необходимо работать с ними, следует надевать перчатки, защитный костюм и очки. Водные растворы с содержанием менее 10% муравьиной кислоты входят в 3-й класс умеренно опасных соединений.
- Не использовать средства на основе муравьиной кислоты в косметологических или медицинских целях при повреждениях кожи, а также индивидуальной непереносимости вещества. Перед применением надо провести аллергический тест – нанести немного состава на локтевой сгиб и подождать полчаса. При отсутствии реакций косметическое или лечебное средство можно использовать.
- Если концентрированная кислота попала на кожные покровы, то следует незамедлительно промыть поражённую поверхность, но не водой, а раствором соды либо нашатырного спирта.
- Не применять вещество для ухода за кожей, лечения или профилактики заболеваний без предварительной консультации специалиста – косметолога или лечащего врача.
- Не нюхать метановую кислоту, не подносить к лицу. Вдыхание её паров крайне опасно. Оно провоцирует раздражение верхних дыхательных путей с першением и кашлем, отёк лёгких (в тяжёлых случаях), сильную аллергию, поражение зрительного нерва (вплоть до полной слепоты). Во избежание таких последствий при работе с концентрированными соединениями надевайте маску-респиратор.
Муравьиная кислота давно и активно используется в разных сферах. В высоких концентрациях она опасна. Но если знать и соблюдать правила применения и меры предосторожности, то можно извлечь из вещества максимум пользы и избежать негативных последствий.









