|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Arsenic | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Pronunciation |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Allotropes | grey (most common), yellow, black (see Allotropes of arsenic) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Appearance | metallic grey | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Standard atomic weight Ar°(As) |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Arsenic in the periodic table | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic number (Z) | 33 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Group | group 15 (pnictogens) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Period | period 4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Block | p-block | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electron configuration | [Ar] 3d10 4s2 4p3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrons per shell | 2, 8, 18, 5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physical properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase at STP | solid | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sublimation point | 887 K (615 °C, 1137 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Density (near r.t.) | 5.727 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| when liquid (at m.p.) | 5.22 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Triple point | 1090 K, 3628 kPa[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Critical point | 1673 K, ? MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of fusion | grey: 24.44 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of vaporization | 34.76 kJ/mol (?) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar heat capacity | 24.64 J/(mol·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Vapor pressure
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidation states | −3, −2, −1, 0,[3] +1,[4] +2, +3, +4, +5 (a mildly acidic oxide) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegativity | Pauling scale: 2.18 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ionization energies |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic radius | empirical: 119 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Covalent radius | 119±4 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waals radius | 185 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Spectral lines of arsenic |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Other properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Natural occurrence | primordial | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | rhombohedral
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermal expansion | 5.6 µm/(m⋅K)[5] (at r.t.) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermal conductivity | 50.2 W/(m⋅K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrical resistivity | 333 nΩ⋅m (at 20 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetic ordering | diamagnetic[6] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar magnetic susceptibility | −5.5×10−6 cm3/mol[7] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Young’s modulus | 8 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bulk modulus | 22 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mohs hardness | 3.5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Brinell hardness | 1440 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS Number | 7440-38-2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| History | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Discovery | Arabic alchemists (before AD 815) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Main isotopes of arsenic
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| references |
Arsenic is a chemical element with the symbol As and atomic number 33. Arsenic occurs in many minerals, usually in combination with sulfur and metals, but also as a pure elemental crystal. Arsenic is a metalloid. It has various allotropes, but only the gray form, which has a metallic appearance, is important to industry.
The primary use of arsenic is in alloys of lead (for example, in car batteries and ammunition). Arsenic is a common n-type dopant in semiconductor electronic devices. It is also a component of the III-V compound semiconductor gallium arsenide. Arsenic and its compounds, especially the trioxide, are used in the production of pesticides, treated wood products, herbicides, and insecticides. These applications are declining with the increasing recognition of the toxicity of arsenic and its compounds.[8]
A few species of bacteria are able to use arsenic compounds as respiratory metabolites. Trace quantities of arsenic are an essential dietary element in rats, hamsters, goats, chickens, and presumably other species. A role in human metabolism is not known.[9][10][11] However, arsenic poisoning occurs in multicellular life if quantities are larger than needed. Arsenic contamination of groundwater is a problem that affects millions of people across the world.
The United States’ Environmental Protection Agency states that all forms of arsenic are a serious risk to human health.[12] The United States’ Agency for Toxic Substances and Disease Registry ranked arsenic as number 1 in its 2001 Priority List of Hazardous Substances at Superfund sites.[13] Arsenic is classified as a Group-A carcinogen.[12]
Characteristics[edit]
Physical characteristics[edit]
Crystal structure common to Sb, AsSb and gray As
The three most common arsenic allotropes are gray, yellow, and black arsenic, with gray being the most common.[14] Gray arsenic (α-As, space group R3m No. 166) adopts a double-layered structure consisting of many interlocked, ruffled, six-membered rings. Because of weak bonding between the layers, gray arsenic is brittle and has a relatively low Mohs hardness of 3.5. Nearest and next-nearest neighbors form a distorted octahedral complex, with the three atoms in the same double-layer being slightly closer than the three atoms in the next.[15] This relatively close packing leads to a high density of 5.73 g/cm3.[16] Gray arsenic is a semimetal, but becomes a semiconductor with a bandgap of 1.2–1.4 eV if amorphized.[17] Gray arsenic is also the most stable form.
Yellow arsenic is soft and waxy, and somewhat similar to tetraphosphorus (P4).[18] Both have four atoms arranged in a tetrahedral structure in which each atom is bound to each of the other three atoms by a single bond. This unstable allotrope, being molecular, is the most volatile, least dense, and most toxic. Solid yellow arsenic is produced by rapid cooling of arsenic vapor, As4. It is rapidly transformed into gray arsenic by light. The yellow form has a density of 1.97 g/cm3.[16] Black arsenic is similar in structure to black phosphorus.[16]
Black arsenic can also be formed by cooling vapor at around 100–220 °C and by crystallization of amorphous arsenic in the presence of mercury vapors.[19] It is glassy and brittle. Black arsenic is also a poor electrical conductor.[20] As arsenic’s triple point is at 3.628 MPa (35.81 atm), it does not have a melting point at standard pressure but instead sublimes from solid to vapor at 887 K (615 °C or 1137 °F).[2]
Isotopes[edit]
Arsenic occurs in nature as one stable isotope, 75As, a monoisotopic element.[21] As of 2003, at least 33 radioisotopes have also been synthesized, ranging in atomic mass from 60 to 92. The most stable of these is 73As with a half-life of 80.30 days. All other isotopes have half-lives of under one day, with the exception of 71As (t1/2=65.30 hours), 72As (t1/2=26.0 hours), 74As (t1/2=17.77 days), 76As (t1/2=1.0942 days), and 77As (t1/2=38.83 hours). Isotopes that are lighter than the stable 75As tend to decay by β+ decay, and those that are heavier tend to decay by β− decay, with some exceptions.
At least 10 nuclear isomers have been described, ranging in atomic mass from 66 to 84. The most stable of arsenic’s isomers is 68mAs with a half-life of 111 seconds.[21]
Chemistry[edit]
Arsenic has a similar electronegativity and ionization energies to its lighter congener phosphorus and accordingly readily forms covalent molecules with most of the nonmetals. Though stable in dry air, arsenic forms a golden-bronze tarnish upon exposure to humidity which eventually becomes a black surface layer.[22] When heated in air, arsenic oxidizes to arsenic trioxide; the fumes from this reaction have an odor resembling garlic. This odor can be detected on striking arsenide minerals such as arsenopyrite with a hammer.[2] It burns in oxygen to form arsenic trioxide and arsenic pentoxide, which have the same structure as the more well-known phosphorus compounds, and in fluorine to give arsenic pentafluoride.[22] Arsenic (and some arsenic compounds) sublimes upon heating at atmospheric pressure, converting directly to a gaseous form without an intervening liquid state at 887 K (614 °C).[2] The triple point is 3.63 MPa and 1,090 K (820 °C).[16][2] Arsenic makes arsenic acid with concentrated nitric acid, arsenous acid with dilute nitric acid, and arsenic trioxide with concentrated sulfuric acid; however, it does not react with water, alkalis, or non-oxidising acids.[23] Arsenic reacts with metals to form arsenides, though these are not ionic compounds containing the As3− ion as the formation of such an anion would be highly endothermic and even the group 1 arsenides have properties of intermetallic compounds.[22] Like germanium, selenium, and bromine, which like arsenic succeed the 3d transition series, arsenic is much less stable in the group oxidation state of +5 than its vertical neighbors phosphorus and antimony, and hence arsenic pentoxide and arsenic acid are potent oxidizers.[22]
Compounds[edit]
Compounds of arsenic resemble in some respects those of phosphorus which occupies the same group (column) of the periodic table. The most common oxidation states for arsenic are: −3 in the arsenides, which are alloy-like intermetallic compounds, +3 in the arsenites, and +5 in the arsenates and most organoarsenic compounds. Arsenic also bonds readily to itself as seen in the square As3−4 ions in the mineral skutterudite.[24] In the +3 oxidation state, arsenic is typically pyramidal owing to the influence of the lone pair of electrons.[14]
Inorganic compounds[edit]
One of the simplest arsenic compounds is the trihydride, the highly toxic, flammable, pyrophoric arsine (AsH3). This compound is generally regarded as stable, since at room temperature it decomposes only slowly. At temperatures of 250–300 °C decomposition to arsenic and hydrogen is rapid.[25] Several factors, such as humidity, presence of light and certain catalysts (namely aluminium) facilitate the rate of decomposition.[26] It oxidises readily in air to form arsenic trioxide and water, and analogous reactions take place with sulfur and selenium instead of oxygen.[25]
Arsenic forms colorless, odorless, crystalline oxides As2O3 («white arsenic») and As2O5 which are hygroscopic and readily soluble in water to form acidic solutions. Arsenic(V) acid is a weak acid and the salts are called arsenates,[27] the most common arsenic contamination of groundwater, and a problem that affects many people. Synthetic arsenates include Scheele’s Green (cupric hydrogen arsenate, acidic copper arsenate), calcium arsenate, and lead hydrogen arsenate. These three have been used as agricultural insecticides and poisons.
The protonation steps between the arsenate and arsenic acid are similar to those between phosphate and phosphoric acid. Unlike phosphorous acid, arsenous acid is genuinely tribasic, with the formula As(OH)3.[27]
A broad variety of sulfur compounds of arsenic are known. Orpiment (As2S3) and realgar (As4S4) are somewhat abundant and were formerly used as painting pigments. In As4S10, arsenic has a formal oxidation state of +2 in As4S4 which features As-As bonds so that the total covalency of As is still 3.[28] Both orpiment and realgar, as well as As4S3, have selenium analogs; the analogous As2Te3 is known as the mineral kalgoorlieite,[29] and the anion As2Te− is known as a ligand in cobalt complexes.[30]
All trihalides of arsenic(III) are well known except the astatide, which is unknown. Arsenic pentafluoride (AsF5) is the only important pentahalide, reflecting the lower stability of the +5 oxidation state; even so, it is a very strong fluorinating and oxidizing agent. (The pentachloride is stable only below −50 °C, at which temperature it decomposes to the trichloride, releasing chlorine gas.[16])
Alloys[edit]
Arsenic is used as the group 5 element in the III-V semiconductors gallium arsenide, indium arsenide, and aluminium arsenide.[31] The valence electron count of GaAs is the same as a pair of Si atoms, but the band structure is completely different which results in distinct bulk properties.[32] Other arsenic alloys include the II-V semiconductor cadmium arsenide.[33]
Organoarsenic compounds[edit]
A large variety of organoarsenic compounds are known. Several were developed as chemical warfare agents during World War I, including vesicants such as lewisite and vomiting agents such as adamsite.[34][35][36] Cacodylic acid, which is of historic and practical interest, arises from the methylation of arsenic trioxide, a reaction that has no analogy in phosphorus chemistry. Cacodyl was the first organometallic compound known (even though arsenic is not a true metal) and was named from the Greek κακωδία «stink» for its offensive odor; it is very poisonous.[37]
Occurrence and production[edit]
A large sample of native arsenic
Arsenic comprises about 1.5 ppm (0.00015%) of the Earth’s crust, and is the 53rd most abundant element. Typical background concentrations of arsenic do not exceed 3 ng/m3 in the atmosphere; 100 mg/kg in soil; 400 μg/kg in vegetation; 10 μg/L in freshwater and 1.5 μg/L in seawater.[38]
Minerals with the formula MAsS and MAs2 (M = Fe, Ni, Co) are the dominant commercial sources of arsenic, together with realgar (an arsenic sulfide mineral) and native (elemental) arsenic. An illustrative mineral is arsenopyrite (FeAsS), which is structurally related to iron pyrite. Many minor As-containing minerals are known. Arsenic also occurs in various organic forms in the environment.[39]
Arsenic output in 2006[40]
In 2014, China was the top producer of white arsenic with almost 70% world share, followed by Morocco, Russia, and Belgium, according to the British Geological Survey and the United States Geological Survey.[41] Most arsenic refinement operations in the US and Europe have closed over environmental concerns. Arsenic is found in the smelter dust from copper, gold, and lead smelters, and is recovered primarily from copper refinement dust.[42]
On roasting arsenopyrite in air, arsenic sublimes as arsenic(III) oxide leaving iron oxides,[39] while roasting without air results in the production of gray arsenic. Further purification from sulfur and other chalcogens is achieved by sublimation in vacuum, in a hydrogen atmosphere, or by distillation from molten lead-arsenic mixture.[43]
| Rank | Country | 2014 As2O3 Production[41] |
|---|---|---|
| 1 | 25,000 T | |
| 2 | 8,800 T | |
| 3 | 1,500 T | |
| 4 | 1,000 T | |
| 5 | 52 T | |
| 6 | 45 T | |
| — | World Total (rounded) | 36,400 T |
History[edit]
The word arsenic has its origin in the Syriac word ܠܐ ܙܐܦܢܝܐ (al) zarniqa,[44][better source needed] from Arabic al-zarnīḵ الزرنيخ ‘the orpiment’, based on Persian zar ‘gold’ from the word زرنيخ zarnikh, meaning «yellow» (literally «gold-colored») and hence «(yellow) orpiment». It was adopted into Greek as arsenikon (ἀρσενικόν), a form that is folk etymology, being the neuter form of the Greek word arsenikos (ἀρσενικός), meaning «male», «virile».
The Greek word was adopted in Latin as arsenicum, which in French became arsenic, from which the English word arsenic is taken.[44][better source needed] Arsenic sulfides (orpiment, realgar) and oxides have been known and used since ancient times.[45] Zosimos (circa 300 AD) describes roasting sandarach (realgar) to obtain cloud of arsenic (arsenic trioxide), which he then reduces to gray arsenic.[46] As the symptoms of arsenic poisoning are not very specific, it was frequently used for murder until the advent of the Marsh test, a sensitive chemical test for its presence. (Another less sensitive but more general test is the Reinsch test.) Owing to its use by the ruling class to murder one another and its potency and discreetness, arsenic has been called the «poison of kings» and the «king of poisons».[47] In the Renaissance era, arsenic was known as “inheritance powder” due to use in killing family members.[48]
During the Bronze Age, arsenic was often included in bronze, which made the alloy harder (so-called «arsenical bronze»).[49][50]
The isolation of arsenic was described by Jabir ibn Hayyan before 815 AD.[51] Albertus Magnus (Albert the Great, 1193–1280) later isolated the element from a compound in 1250, by heating soap together with arsenic trisulfide.[52] In 1649, Johann Schröder published two ways of preparing arsenic.[53] Crystals of elemental (native) arsenic are found in nature, although rare.
Cadet’s fuming liquid (impure cacodyl), often claimed as the first synthetic organometallic compound, was synthesized in 1760 by Louis Claude Cadet de Gassicourt by the reaction of potassium acetate with arsenic trioxide.[54]
Satirical cartoon by Honoré Daumier of a chemist giving a public demonstration of arsenic, 1841
In the Victorian era, «arsenic» («white arsenic» or arsenic trioxide) was mixed with vinegar and chalk and eaten by women to improve the complexion of their faces, making their skin paler to show they did not work in the fields.[55] The accidental use of arsenic in the adulteration of foodstuffs led to the Bradford sweet poisoning in 1858, which resulted in 21 deaths.[56] Wallpaper production also began to use dyes made from arsenic, which was thought to increase the pigment’s brightness.[57]
Two arsenic pigments have been widely used since their discovery – Paris Green and Scheele’s Green. After the toxicity of arsenic became widely known, these chemicals were used less often as pigments and more often as insecticides. In the 1860s, an arsenic byproduct of dye production, London Purple, was widely used. This was a solid mixture of arsenic trioxide, aniline, lime, and ferrous oxide, insoluble in water and very toxic by inhalation or ingestion[58] But it was later replaced with Paris Green, another arsenic-based dye.[59] With better understanding of the toxicology mechanism, two other compounds were used starting in the 1890s.[60] Arsenite of lime and arsenate of lead were used widely as insecticides until the discovery of DDT in 1942.[61][62][63]
Applications[edit]
Agricultural[edit]
Roxarsone is a controversial arsenic compound used as a feed ingredient for chickens.
The toxicity of arsenic to insects, bacteria, and fungi led to its use as a wood preservative.[64] In the 1930s, a process of treating wood with chromated copper arsenate (also known as CCA or Tanalith) was invented, and for decades, this treatment was the most extensive industrial use of arsenic. An increased appreciation of the toxicity of arsenic led to a ban of CCA in consumer products in 2004, initiated by the European Union and United States.[65][66] However, CCA remains in heavy use in other countries (such as on Malaysian rubber plantations).[8]
Arsenic was also used in various agricultural insecticides and poisons. For example, lead hydrogen arsenate was a common insecticide on fruit trees,[67] but contact with the compound sometimes resulted in brain damage among those working the sprayers. In the second half of the 20th century, monosodium methyl arsenate (MSMA) and disodium methyl arsenate (DSMA) – less toxic organic forms of arsenic – replaced lead arsenate in agriculture. These organic arsenicals were in turn phased out by 2013 in all agricultural activities except cotton farming.[68]
The biogeochemistry of arsenic is complex and includes various adsorption and desorption processes. The toxicity of arsenic is connected to its solubility and is affected by pH. Arsenite (AsO3−3) is more soluble than arsenate (AsO3−4) and is more toxic; however, at a lower pH, arsenate becomes more mobile and toxic. It was found that addition of sulfur, phosphorus, and iron oxides to high-arsenite soils greatly reduces arsenic phytotoxicity.[69]
Arsenic is used as a feed additive in poultry and swine production, in particular in the U.S. to increase weight gain, improve feed efficiency, and prevent disease.[70][71] An example is roxarsone, which had been used as a broiler starter by about 70% of U.S. broiler growers.[72] Alpharma, a subsidiary of Pfizer Inc., which produces roxarsone, voluntarily suspended sales of the drug in response to studies showing elevated levels of inorganic arsenic, a carcinogen, in treated chickens.[73] A successor to Alpharma, Zoetis, continues to sell nitarsone, primarily for use in turkeys.[73]
Arsenic is intentionally added to the feed of chickens raised for human consumption. Organic arsenic compounds are less toxic than pure arsenic, and promote the growth of chickens. Under some conditions, the arsenic in chicken feed is converted to the toxic inorganic form.[74]
A 2006 study of the remains of the Australian racehorse, Phar Lap, determined that the 1932 death of the famous champion was caused by a massive overdose of arsenic. Sydney veterinarian Percy Sykes stated, «In those days, arsenic was quite a common tonic, usually given in the form of a solution (Fowler’s Solution) … It was so common that I’d reckon 90 per cent of the horses had arsenic in their system.»[75]
Medical use[edit]
During the 17th, 18th, and 19th centuries, a number of arsenic compounds were used as medicines, including arsphenamine (by Paul Ehrlich) and arsenic trioxide (by Thomas Fowler).[76] Arsphenamine, as well as neosalvarsan, was indicated for syphilis, but has been superseded by modern antibiotics. However, arsenicals such as melarsoprol are still used for the treatment of trypanosomiasis, since although these drugs have the disadvantage of severe toxicity, the disease is almost uniformly fatal if untreated.[77]
Arsenic trioxide has been used in a variety of ways since the 15th century, most commonly in the treatment of cancer, but also in medications as diverse as Fowler’s solution in psoriasis.[78] The US Food and Drug Administration in the year 2000 approved this compound for the treatment of patients with acute promyelocytic leukemia that is resistant to all-trans retinoic acid.[79]
A 2008 paper reports success in locating tumors using arsenic-74 (a positron emitter). This isotope produces clearer PET scan images than the previous radioactive agent, iodine-124, because the body tends to transport iodine to the thyroid gland producing signal noise.[80] Nanoparticles of arsenic have shown ability to kill cancer cells with lesser cytotoxicity than other arsenic formulations.[81]
In subtoxic doses, soluble arsenic compounds act as stimulants, and were once popular in small doses as medicine by people in the mid-18th to 19th centuries;[16][82][83] its use as a stimulant was especially prevalent as sport animals such as race horses or with work dogs.[84]
Alloys[edit]
The main use of arsenic is in alloying with lead. Lead components in car batteries are strengthened by the presence of a very small percentage of arsenic.[8][85] Dezincification of brass (a copper-zinc alloy) is greatly reduced by the addition of arsenic.[86] «Phosphorus Deoxidized Arsenical Copper» with an arsenic content of 0.3% has an increased corrosion stability in certain environments.[87] Gallium arsenide is an important semiconductor material, used in integrated circuits. Circuits made from GaAs are much faster (but also much more expensive) than those made from silicon. Unlike silicon, GaAs has a direct bandgap, and can be used in laser diodes and LEDs to convert electrical energy directly into light.[8]
Military[edit]
After World War I, the United States built a stockpile of 20,000 tons of weaponized lewisite (ClCH=CHAsCl2), an organoarsenic vesicant (blister agent) and lung irritant. The stockpile was neutralized with bleach and dumped into the Gulf of Mexico in the 1950s.[88] During the Vietnam War, the United States used Agent Blue, a mixture of sodium cacodylate and its acid form, as one of the rainbow herbicides to deprive North Vietnamese soldiers of foliage cover and rice.[89][90]
Other uses[edit]
- Copper acetoarsenite was used as a green pigment known under many names, including Paris Green and Emerald Green. It caused numerous arsenic poisonings. Scheele’s Green, a copper arsenate, was used in the 19th century as a coloring agent in sweets.[91]
- Arsenic is used in bronzing[92] and pyrotechnics.
- As much as 2% of produced arsenic is used in lead alloys for lead shot and bullets.[93]
- Arsenic is added in small quantities to alpha-brass to make it dezincification-resistant. This grade of brass is used in plumbing fittings and other wet environments.[94]
- Arsenic is also used for taxonomic sample preservation. It was also used in embalming fluids historically.[95]
- Arsenic was used as an opacifier in ceramics, creating white glazes.[96]
- Until recently, arsenic was used in optical glass. Modern glass manufacturers, under pressure from environmentalists, have ceased using both arsenic and lead.[97]
- In computers; arsenic is used in the chips as the n-type doping[98]
Biological role[edit]
Bacteria[edit]
Some species of bacteria obtain their energy in the absence of oxygen by oxidizing various fuels while reducing arsenate to arsenite. Under oxidative environmental conditions some bacteria use arsenite as fuel, which they oxidize to arsenate.[99] The enzymes involved are known as arsenate reductases (Arr).[100]
In 2008, bacteria were discovered that employ a version of photosynthesis in the absence of oxygen with arsenites as electron donors, producing arsenates (just as ordinary photosynthesis uses water as electron donor, producing molecular oxygen). Researchers conjecture that, over the course of history, these photosynthesizing organisms produced the arsenates that allowed the arsenate-reducing bacteria to thrive. One strain PHS-1 has been isolated and is related to the gammaproteobacterium Ectothiorhodospira shaposhnikovii. The mechanism is unknown, but an encoded Arr enzyme may function in reverse to its known homologues.[101]
In 2011, it was postulated that a strain of Halomonadaceae could be grown in the absence of phosphorus if that element were substituted with arsenic,[102] exploiting the fact that the arsenate and phosphate anions are similar structurally. The study was widely criticised and subsequently refuted by independent researcher groups.[103][104]
Essential trace element in higher animals[edit]
Arsenic is understood to be an essential trace mineral in birds as it is involved in the synthesis of methionine metabolites, with feeding recommendations being between 0.012 and 0.050 mg/kg.[105]
Some evidence indicates that arsenic is an essential trace mineral in mammals. However, the biological function is not known.[106][107][108]
Heredity[edit]
Arsenic has been linked to epigenetic changes, heritable changes in gene expression that occur without changes in DNA sequence. These include DNA methylation, histone modification, and RNA interference. Toxic levels of arsenic cause significant DNA hypermethylation of tumor suppressor genes p16 and p53, thus increasing risk of carcinogenesis. These epigenetic events have been studied in vitro using human kidney cells and in vivo using rat liver cells and peripheral blood leukocytes in humans.[109] Inductively coupled plasma mass spectrometry (ICP-MS) is used to detect precise levels of intracellular arsenic and other arsenic bases involved in epigenetic modification of DNA.[110] Studies investigating arsenic as an epigenetic factor can be used to develop precise biomarkers of exposure and susceptibility.
The Chinese brake fern (Pteris vittata) hyperaccumulates arsenic from the soil into its leaves and has a proposed use in phytoremediation.[111]
Biomethylation[edit]
Inorganic arsenic and its compounds, upon entering the food chain, are progressively metabolized through a process of methylation.[112][113] For example, the mold Scopulariopsis brevicaulis produces trimethylarsine if inorganic arsenic is present.[114] The organic compound arsenobetaine is found in some marine foods such as fish and algae, and also in mushrooms in larger concentrations. The average person’s intake is about 10–50 µg/day. Values about 1000 µg are not unusual following consumption of fish or mushrooms, but there is little danger in eating fish because this arsenic compound is nearly non-toxic.[115]
Environmental issues[edit]
Exposure[edit]
Naturally occurring sources of human exposure include volcanic ash, weathering of minerals and ores, and mineralized groundwater. Arsenic is also found in food, water, soil, and air.[116] Arsenic is absorbed by all plants, but is more concentrated in leafy vegetables, rice, apple and grape juice, and seafood.[117] An additional route of exposure is inhalation of atmospheric gases and dusts.[118]
During the Victorian era, arsenic was widely used in home decor, especially wallpapers.[119]
Occurrence in drinking water[edit]
Extensive arsenic contamination of groundwater has led to widespread arsenic poisoning in Bangladesh[120] and neighboring countries. It is estimated that approximately 57 million people in the Bengal basin are drinking groundwater with arsenic concentrations elevated above the World Health Organization’s standard of 10 parts per billion (ppb).[121] However, a study of cancer rates in Taiwan[122] suggested that significant increases in cancer mortality appear only at levels above 150 ppb. The arsenic in the groundwater is of natural origin, and is released from the sediment into the groundwater, caused by the anoxic conditions of the subsurface. This groundwater was used after local and western NGOs and the Bangladeshi government undertook a massive shallow tube well drinking-water program in the late twentieth century. This program was designed to prevent drinking of bacteria-contaminated surface waters, but failed to test for arsenic in the groundwater. Many other countries and districts in Southeast Asia, such as Vietnam and Cambodia, have geological environments that produce groundwater with a high arsenic content. Arsenicosis was reported in Nakhon Si Thammarat, Thailand in 1987, and the Chao Phraya River probably contains high levels of naturally occurring dissolved arsenic without being a public health problem because much of the public uses bottled water.[123] In Pakistan, more than 60 million people are exposed to arsenic polluted drinking water indicated by a recent report of Science. Podgorski’s team investigated more than 1200 samples and more than 66% exceeded the WHO minimum contamination level.[124]
Since the 1980s, residents of the Ba Men region of Inner Mongolia, China have been chronically exposed to arsenic through drinking water from contaminated wells.[125] A 2009 research study observed an elevated presence of skin lesions among residents with well water arsenic concentrations between 5 and 10 µg/L, suggesting that arsenic induced toxicity may occur at relatively low concentrations with chronic exposure.[125] Overall, 20 of China’s 34 provinces have high arsenic concentrations in the groundwater supply, potentially exposing 19 million people to hazardous drinking water.[126]
In the United States, arsenic is most commonly found in the ground waters of the southwest.[127] Parts of New England, Michigan, Wisconsin, Minnesota and the Dakotas are also known to have significant concentrations of arsenic in ground water.[128] Increased levels of skin cancer have been associated with arsenic exposure in Wisconsin, even at levels below the 10 part per billion drinking water standard.[129] According to a recent film funded by the US Superfund, millions of private wells have unknown arsenic levels, and in some areas of the US, more than 20% of the wells may contain levels that exceed established limits.[130]
Low-level exposure to arsenic at concentrations of 100 parts per billion (i.e., above the 10 parts per billion drinking water standard) compromises the initial immune response to H1N1 or swine flu infection according to NIEHS-supported scientists. The study, conducted in laboratory mice, suggests that people exposed to arsenic in their drinking water may be at increased risk for more serious illness or death from the virus.[131]
Some Canadians are drinking water that contains inorganic arsenic. Private-dug–well waters are most at risk for containing inorganic arsenic. Preliminary well water analysis typically does not test for arsenic. Researchers at the Geological Survey of Canada have modeled relative variation in natural arsenic hazard potential for the province of New Brunswick. This study has important implications for potable water and health concerns relating to inorganic arsenic.[132]
Epidemiological evidence from Chile shows a dose-dependent connection between chronic arsenic exposure and various forms of cancer, in particular when other risk factors, such as cigarette smoking, are present. These effects have been demonstrated at contaminations less than 50 ppb.[133] Arsenic is itself a constituent of tobacco smoke.[134]
Analyzing multiple epidemiological studies on inorganic arsenic exposure suggests a small but measurable increase in risk for bladder cancer at 10 ppb.[135] According to Peter Ravenscroft of the Department of Geography at the University of Cambridge,[136] roughly 80 million people worldwide consume between 10 and 50 ppb arsenic in their drinking water. If they all consumed exactly 10 ppb arsenic in their drinking water, the previously cited multiple epidemiological study analysis would predict an additional 2,000 cases of bladder cancer alone. This represents a clear underestimate of the overall impact, since it does not include lung or skin cancer, and explicitly underestimates the exposure. Those exposed to levels of arsenic above the current WHO standard should weigh the costs and benefits of arsenic remediation.
Early (1973) evaluations of the processes for removing dissolved arsenic from drinking water demonstrated the efficacy of co-precipitation with either iron or aluminum oxides. In particular, iron as a coagulant was found to remove arsenic with an efficacy exceeding 90%.[137][138] Several adsorptive media systems have been approved for use at point-of-service in a study funded by the United States Environmental Protection Agency (US EPA) and the National Science Foundation (NSF). A team of European and Indian scientists and engineers have set up six arsenic treatment plants in West Bengal based on in-situ remediation method (SAR Technology). This technology does not use any chemicals and arsenic is left in an insoluble form (+5 state) in the subterranean zone by recharging aerated water into the aquifer and developing an oxidation zone that supports arsenic oxidizing micro-organisms. This process does not produce any waste stream or sludge and is relatively cheap.[139]
Another effective and inexpensive method to avoid arsenic contamination is to sink wells 500 feet or deeper to reach purer waters. A recent 2011 study funded by the US National Institute of Environmental Health Sciences’ Superfund Research Program shows that deep sediments can remove arsenic and take it out of circulation. In this process, called adsorption, arsenic sticks to the surfaces of deep sediment particles and is naturally removed from the ground water.[140]
Magnetic separations of arsenic at very low magnetic field gradients with high-surface-area and monodisperse magnetite (Fe3O4) nanocrystals have been demonstrated in point-of-use water purification. Using the high specific surface area of Fe3O4 nanocrystals, the mass of waste associated with arsenic removal from water has been dramatically reduced.[141]
Epidemiological studies have suggested a correlation between chronic consumption of drinking water contaminated with arsenic and the incidence of all leading causes of mortality.[142] The literature indicates that arsenic exposure is causative in the pathogenesis of diabetes.[143]
Chaff-based filters have recently been shown to reduce the arsenic content of water to 3 µg/L. This may find applications in areas where the potable water is extracted from underground aquifers.[144]
San Pedro de Atacama[edit]
For several centuries, the people of San Pedro de Atacama in Chile have been drinking water that is contaminated with arsenic, and some evidence suggests they have developed some immunity.[145][146][147]
Hazard maps for contaminated groundwater[edit]
Around one-third of the world’s population drinks water from groundwater resources. Of this, about 10 percent, approximately 300 million people, obtains water from groundwater resources that are contaminated with unhealthy levels of arsenic or fluoride.[148] These trace elements derive mainly from minerals and ions in the ground.[149][150]
Redox transformation of arsenic in natural waters[edit]
Arsenic is unique among the trace metalloids and oxyanion-forming trace metals (e.g. As, Se, Sb, Mo, V, Cr, U, Re). It is sensitive to mobilization at pH values typical of natural waters (pH 6.5–8.5) under both oxidizing and reducing conditions. Arsenic can occur in the environment in several oxidation states (−3, 0, +3 and +5), but in natural waters it is mostly found in inorganic forms as oxyanions of trivalent arsenite [As(III)] or pentavalent arsenate [As(V)]. Organic forms of arsenic are produced by biological activity, mostly in surface waters, but are rarely quantitatively important. Organic arsenic compounds may, however, occur where waters are significantly impacted by industrial pollution.[151]
Arsenic may be solubilized by various processes. When pH is high, arsenic may be released from surface binding sites that lose their positive charge. When water level drops and sulfide minerals are exposed to air, arsenic trapped in sulfide minerals can be released into water. When organic carbon is present in water, bacteria are fed by directly reducing As(V) to As(III) or by reducing the element at the binding site, releasing inorganic arsenic.[152]
The aquatic transformations of arsenic are affected by pH, reduction-oxidation potential, organic matter concentration and the concentrations and forms of other elements, especially iron and manganese. The main factors are pH and the redox potential. Generally, the main forms of arsenic under oxic conditions are H3AsO4, H2AsO4−, HAsO42−, and AsO43− at pH 2, 2–7, 7–11 and 11, respectively. Under reducing conditions, H3AsO4 is predominant at pH 2–9.
Oxidation and reduction affects the migration of arsenic in subsurface environments. Arsenite is the most stable soluble form of arsenic in reducing environments and arsenate, which is less mobile than arsenite, is dominant in oxidizing environments at neutral pH. Therefore, arsenic may be more mobile under reducing conditions. The reducing environment is also rich in organic matter which may enhance the solubility of arsenic compounds. As a result, the adsorption of arsenic is reduced and dissolved arsenic accumulates in groundwater. That is why the arsenic content is higher in reducing environments than in oxidizing environments.[153]
The presence of sulfur is another factor that affects the transformation of arsenic in natural water. Arsenic can precipitate when metal sulfides form. In this way, arsenic is removed from the water and its mobility decreases. When oxygen is present, bacteria oxidize reduced sulfur to generate energy, potentially releasing bound arsenic.
Redox reactions involving Fe also appear to be essential factors in the fate of arsenic in aquatic systems. The reduction of iron oxyhydroxides plays a key role in the release of arsenic to water. So arsenic can be enriched in water with elevated Fe concentrations.[154] Under oxidizing conditions, arsenic can be mobilized from pyrite or iron oxides especially at elevated pH. Under reducing conditions, arsenic can be mobilized by reductive desorption or dissolution when associated with iron oxides. The reductive desorption occurs under two circumstances. One is when arsenate is reduced to arsenite which adsorbs to iron oxides less strongly. The other results from a change in the charge on the mineral surface which leads to the desorption of bound arsenic.[155]
Some species of bacteria catalyze redox transformations of arsenic. Dissimilatory arsenate-respiring prokaryotes (DARP) speed up the reduction of As(V) to As(III). DARP use As(V) as the electron acceptor of anaerobic respiration and obtain energy to survive. Other organic and inorganic substances can be oxidized in this process. Chemoautotrophic arsenite oxidizers (CAO) and heterotrophic arsenite oxidizers (HAO) convert As(III) into As(V). CAO combine the oxidation of As(III) with the reduction of oxygen or nitrate. They use obtained energy to fix produce organic carbon from CO2. HAO cannot obtain energy from As(III) oxidation. This process may be an arsenic detoxification mechanism for the bacteria.[156]
Equilibrium thermodynamic calculations predict that As(V) concentrations should be greater than As(III) concentrations in all but strongly reducing conditions, i.e. where SO42− reduction is occurring. However, abiotic redox reactions of arsenic are slow. Oxidation of As(III) by dissolved O2 is a particularly slow reaction. For example, Johnson and Pilson (1975) gave half-lives for the oxygenation of As(III) in seawater ranging from several months to a year.[157] In other studies, As(V)/As(III) ratios were stable over periods of days or weeks during water sampling when no particular care was taken to prevent oxidation, again suggesting relatively slow oxidation rates. Cherry found from experimental studies that the As(V)/As(III) ratios were stable in anoxic solutions for up to 3 weeks but that gradual changes occurred over longer timescales.[158] Sterile water samples have been observed to be less susceptible to speciation changes than non-sterile samples.[159] Oremland found that the reduction of As(V) to As(III) in Mono Lake was rapidly catalyzed by bacteria with rate constants ranging from 0.02 to 0.3-day−1.[160]
Wood preservation in the US[edit]
As of 2002, US-based industries consumed 19,600 metric tons of arsenic. Ninety percent of this was used for treatment of wood with chromated copper arsenate (CCA). In 2007, 50% of the 5,280 metric tons of consumption was still used for this purpose.[42][161] In the United States, the voluntary phasing-out of arsenic in production of consumer products and residential and general consumer construction products began on 31 December 2003, and alternative chemicals are now used, such as Alkaline Copper Quaternary, borates, copper azole, cyproconazole, and propiconazole.[162]
Although discontinued, this application is also one of the most concerning to the general public. The vast majority of older pressure-treated wood was treated with CCA. CCA lumber is still in widespread use in many countries, and was heavily used during the latter half of the 20th century as a structural and outdoor building material. Although the use of CCA lumber was banned in many areas after studies showed that arsenic could leach out of the wood into the surrounding soil (from playground equipment, for instance), a risk is also presented by the burning of older CCA timber. The direct or indirect ingestion of wood ash from burnt CCA lumber has caused fatalities in animals and serious poisonings in humans; the lethal human dose is approximately 20 grams of ash.[163] Scrap CCA lumber from construction and demolition sites may be inadvertently used in commercial and domestic fires. Protocols for safe disposal of CCA lumber are not consistent throughout the world. Widespread landfill disposal of such timber raises some concern,[164] but other studies have shown no arsenic contamination in the groundwater.[165][166]
Mapping of industrial releases in the US[edit]
One tool that maps the location (and other information) of arsenic releases in the United States is TOXMAP.[167] TOXMAP is a Geographic Information System (GIS) from the Division of Specialized Information Services of the United States National Library of Medicine (NLM) funded by the US Federal Government. With marked-up maps of the United States, TOXMAP enables users to visually explore data from the United States Environmental Protection Agency’s (EPA) Toxics Release Inventory and Superfund Basic Research Programs. TOXMAP’s chemical and environmental health information is taken from NLM’s Toxicology Data Network (TOXNET),[168] PubMed, and from other authoritative sources.
Bioremediation[edit]
Physical, chemical, and biological methods have been used to remediate arsenic contaminated water.[169] Bioremediation is said to be cost-effective and environmentally friendly.[170] Bioremediation of ground water contaminated with arsenic aims to convert arsenite, the toxic form of arsenic to humans, to arsenate. Arsenate (+5 oxidation state) is the dominant form of arsenic in surface water, while arsenite (+3 oxidation state) is the dominant form in hypoxic to anoxic environments. Arsenite is more soluble and mobile than arsenate. Many species of bacteria can transform arsenite to arsenate in anoxic conditions by using arsenite as an electron donor.[171] This is a useful method in ground water remediation. Another bioremediation strategy is to use plants that accumulate arsenic in their tissues via phytoremediation but the disposal of contaminated plant material needs to be considered.
Bioremediation requires careful evaluation and design in accordance with existing conditions. Some sites may require the addition of an electron acceptor while others require microbe supplementation (bioaugmentation). Regardless of the method used, only constant monitoring can prevent future contamination.
Toxicity and precautions[edit]
Arsenic| Hazards | |
|---|---|
| GHS labelling:[172] | |
|
Pictograms |
   
|
|
Signal word |
Danger |
|
Hazard statements |
H301+H331, H315, H318, H350, H410 |
|
Precautionary statements |
P273, P280, P301+P310, P302+P352, P304+P340+P311, P305+P351+P338 |
Arsenic and many of its compounds are especially potent poisons. Small amount of arsenic can be detected by pharmacopoial methods which includes reduction of arsenic to arsenious with help of zinc and can be confirmed with mercuric chloride paper.[173]
Classification[edit]
Elemental arsenic and arsenic sulfate and trioxide compounds are classified as «toxic» and «dangerous for the environment» in the European Union under directive 67/548/EEC.
The International Agency for Research on Cancer (IARC) recognizes arsenic and inorganic arsenic compounds as group 1 carcinogens, and the EU lists arsenic trioxide, arsenic pentoxide, and arsenate salts as category 1 carcinogens.
Arsenic is known to cause arsenicosis when present in drinking water, «the most common species being arsenate [HAsO2−4; As(V)] and arsenite [H3AsO3; As(III)]».
Legal limits, food, and drink[edit]
In the United States since 2006, the maximum concentration in drinking water allowed by the Environmental Protection Agency (EPA) is 10 ppb[174] and the FDA set the same standard in 2005 for bottled water.[175] The Department of Environmental Protection for New Jersey set a drinking water limit of 5 ppb in 2006.[176] The IDLH (immediately dangerous to life and health) value for arsenic metal and inorganic arsenic compounds is 5 mg/m3 (5 ppb). The Occupational Safety and Health Administration has set the permissible exposure limit (PEL) to a time-weighted average (TWA) of 0.01 mg/m3 (0.01 ppb), and the National Institute for Occupational Safety and Health (NIOSH) has set the recommended exposure limit (REL) to a 15-minute constant exposure of 0.002 mg/m3 (0.002 ppb).[177] The PEL for organic arsenic compounds is a TWA of 0.5 mg/m3.[178] (0.5 ppb).
In 2008, based on its ongoing testing of a wide variety of American foods for toxic chemicals,[179] the U.S. Food and Drug Administration set the «level of concern» for inorganic arsenic in apple and pear juices at 23 ppb, based on non-carcinogenic effects, and began blocking importation of products in excess of this level; it also required recalls for non-conforming domestic products.[175] In 2011, the national Dr. Oz television show broadcast a program highlighting tests performed by an independent lab hired by the producers. Though the methodology was disputed (it did not distinguish between organic and inorganic arsenic) the tests showed levels of arsenic up to 36 ppb.[180] In response, FDA tested the worst brand from the Dr. Oz show and found much lower levels. Ongoing testing found 95% of the apple juice samples were below the level of concern. Later testing by Consumer Reports showed inorganic arsenic at levels slightly above 10 ppb, and the organization urged parents to reduce consumption.[181] In July 2013, on consideration of consumption by children, chronic exposure, and carcinogenic effect, the FDA established an «action level» of 10 ppb for apple juice, the same as the drinking water standard.[175]
Concern about arsenic in rice in Bangladesh was raised in 2002, but at the time only Australia had a legal limit for food (one milligram per kilogram).[182][183] Concern was raised about people who were eating U.S. rice exceeding WHO standards for personal arsenic intake in 2005.[184] In 2011, the People’s Republic of China set a food standard of 150 ppb for arsenic.[185]
In the United States in 2012, testing by separate groups of researchers at the Children’s Environmental Health and Disease Prevention Research Center at Dartmouth College (early in the year, focusing on urinary levels in children)[186] and Consumer Reports (in November)[187][188] found levels of arsenic in rice that resulted in calls for the FDA to set limits.[189] The FDA released some testing results in September 2012,[190][191] and as of July 2013, is still collecting data in support of a new potential regulation. It has not recommended any changes in consumer behavior.[192]
Consumer Reports recommended:
- That the EPA and FDA eliminate arsenic-containing fertilizer, drugs, and pesticides in food production;
- That the FDA establish a legal limit for food;
- That industry change production practices to lower arsenic levels, especially in food for children; and
- That consumers test home water supplies, eat a varied diet, and cook rice with excess water, then draining it off (reducing inorganic arsenic by about one third along with a slight reduction in vitamin content).[188]
- Evidence-based public health advocates also recommend that, given the lack of regulation or labeling for arsenic in the U.S., children should eat no more than 1.5 servings per week of rice and should not drink rice milk as part of their daily diet before age 5.[193] They also offer recommendations for adults and infants on how to limit arsenic exposure from rice, drinking water, and fruit juice.[193]
A 2014 World Health Organization advisory conference was scheduled to consider limits of 200–300 ppb for rice.[188]
Reducing arsenic content in rice[edit]
An improved rice cooking approach to maximise arsenic removal while preserving nutrient elements[194]
In 2020, scientists assessed multiple preparation procedures of rice for their capacity to reduce arsenic content and preserve nutrients, recommending a procedure involving parboiling and water-absorption.[195][194][196]
Occupational exposure limits[edit]
| Country | Limit[197] |
|---|---|
| Argentina | Confirmed human carcinogen |
| Australia | TWA 0.05 mg/m3 – Carcinogen |
| Belgium | TWA 0.1 mg/m3 – Carcinogen |
| Bulgaria | Confirmed human carcinogen |
| Canada | TWA 0.01 mg/m3 |
| Colombia | Confirmed human carcinogen |
| Denmark | TWA 0.01 mg/m3 |
| Finland | Carcinogen |
| Egypt | TWA 0.2 mg/m3 |
| Hungary | Ceiling concentration 0.01 mg/m3 – Skin, carcinogen |
| India | TWA 0.2 mg/m3 |
| Japan | Group 1 carcinogen |
| Jordan | Confirmed human carcinogen |
| Mexico | TWA 0.2 mg/m3 |
| New Zealand | TWA 0.05 mg/m3 – Carcinogen |
| Norway | TWA 0.02 mg/m3 |
| Philippines | TWA 0.5 mg/m3 |
| Poland | TWA 0.01 mg/m3 |
| Singapore | Confirmed human carcinogen |
| South Korea | TWA 0.01 mg/m3[198][199] |
| Sweden | TWA 0.01 mg/m3 |
| Thailand | TWA 0.5 mg/m3 |
| Turkey | TWA 0.5 mg/m3 |
| United Kingdom | TWA 0.1 mg/m3 |
| United States | TWA 0.01 mg/m3 |
| Vietnam | Confirmed human carcinogen |
Ecotoxicity[edit]
Arsenic is bioaccumulative in many organisms, marine species in particular, but it does not appear to biomagnify significantly in food webs.[200] In polluted areas, plant growth may be affected by root uptake of arsenate, which is a phosphate analog and therefore readily transported in plant tissues and cells. In polluted areas, uptake of the more toxic arsenite ion (found more particularly in reducing conditions) is likely in poorly-drained soils.
Toxicity in animals[edit]
| Compound | Animal | LD50 | Route |
|---|---|---|---|
| Arsenic | Rat | 763 mg/kg | oral |
| Arsenic | Mouse | 145 mg/kg | oral |
| Calcium arsenate | Rat | 20 mg/kg | oral |
| Calcium arsenate | Mouse | 794 mg/kg | oral |
| Calcium arsenate | Rabbit | 50 mg/kg | oral |
| Calcium arsenate | Dog | 38 mg/kg | oral |
| Lead arsenate | Rabbit | 75 mg/kg | oral |
| Compound | Animal | LD50[201] | Route |
|---|---|---|---|
| Arsenic trioxide (As(III)) | Mouse | 26 mg/kg | oral |
| Arsenite (As(III)) | Mouse | 8 mg/kg | im |
| Arsenate (As(V)) | Mouse | 21 mg/kg | im |
| MMA (As(III)) | Hamster | 2 mg/kg | ip |
| MMA (As(V)) | Mouse | 916 mg/kg | oral |
| DMA (As(V)) | Mouse | 648 mg/kg | oral |
| im = injected intramuscularly
ip = administered intraperitoneally |
Biological mechanism[edit]
Arsenic’s toxicity comes from the affinity of arsenic(III) oxides for thiols. Thiols, in the form of cysteine residues and cofactors such as lipoic acid and coenzyme A, are situated at the active sites of many important enzymes.[8]
Arsenic disrupts ATP production through several mechanisms. At the level of the citric acid cycle, arsenic inhibits lipoic acid, which is a cofactor for pyruvate dehydrogenase. By competing with phosphate, arsenate uncouples oxidative phosphorylation, thus inhibiting energy-linked reduction of NAD+, mitochondrial respiration and ATP synthesis. Hydrogen peroxide production is also increased, which, it is speculated, has potential to form reactive oxygen species and oxidative stress. These metabolic interferences lead to death from multi-system organ failure. The organ failure is presumed to be from necrotic cell death, not apoptosis, since energy reserves have been too depleted for apoptosis to occur.[201]
Exposure risks and remediation[edit]
Occupational exposure and arsenic poisoning may occur in persons working in industries involving the use of inorganic arsenic and its compounds, such as wood preservation, glass production, nonferrous metal alloys, and electronic semiconductor manufacturing. Inorganic arsenic is also found in coke oven emissions associated with the smelter industry.[202]
The conversion between As(III) and As(V) is a large factor in arsenic environmental contamination. According to Croal, Gralnick, Malasarn and Newman, «[the] understanding [of] what stimulates As(III) oxidation and/or limits As(V) reduction is relevant for bioremediation of contaminated sites (Croal). The study of chemolithoautotrophic As(III) oxidizers and the heterotrophic As(V) reducers can help the understanding of the oxidation and/or reduction of arsenic.[203]
Treatment[edit]
Treatment of chronic arsenic poisoning is possible. British anti-lewisite (dimercaprol) is prescribed in doses of 5 mg/kg up to 300 mg every 4 hours for the first day, then every 6 hours for the second day, and finally every 8 hours for 8 additional days.[204] However the USA’s Agency for Toxic Substances and Disease Registry (ATSDR) states that the long-term effects of arsenic exposure cannot be predicted.[118] Blood, urine, hair, and nails may be tested for arsenic; however, these tests cannot foresee possible health outcomes from the exposure.[118] Long-term exposure and consequent excretion through urine has been linked to bladder and kidney cancer in addition to cancer of the liver, prostate, skin, lungs, and nasal cavity.[205]
See also[edit]
- Aqua Tofana
- Arsenic and Old Lace
- Arsenic biochemistry
- Arsenic compounds
- Arsenic poisoning
- Arsenic toxicity
- Arsenic trioxide
- Fowler’s solution
- GFAJ-1
- Grainger challenge
- Hypothetical types of biochemistry
- Organoarsenic chemistry
- Toxic heavy metal
- White arsenic
References[edit]
- ^ «Standard Atomic Weights: Arsenic». CIAAW. 2013.
- ^ a b c d e Gokcen, N. A (1989). «The As (arsenic) system». Bull. Alloy Phase Diagrams. 10: 11–22. doi:10.1007/BF02882166.
- ^ Abraham, Mariham Y.; Wang, Yuzhong; Xie, Yaoming; Wei, Pingrong; Shaefer III, Henry F.; Schleyer, P. von R.; Robinson, Gregory H. (2010). «Carbene Stabilization of Diarsenic: From Hypervalency to Allotropy». Chemistry: A European Journal. 16 (2): 432–5. doi:10.1002/chem.200902840. PMID 19937872.
- ^ Ellis, Bobby D.; MacDonald, Charles L. B. (2004). «Stabilized Arsenic(I) Iodide: A Ready Source of Arsenic Iodide Fragments and a Useful Reagent for the Generation of Clusters». Inorganic Chemistry. 43 (19): 5981–6. doi:10.1021/ic049281s. PMID 15360247.
- ^ Cverna, Fran (2002). ASM Ready Reference: Thermal properties of metals. ASM International. pp. 8–. ISBN 978-0-87170-768-0. pdf.
- ^ Lide, David R., ed. (2000). «Magnetic susceptibility of the elements and inorganic compounds». Handbook of Chemistry and Physics (PDF) (81 ed.). CRC press. ISBN 0849304814.
- ^ Weast, Robert (1984). CRC, Handbook of Chemistry and Physics. Boca Raton, Florida: Chemical Rubber Company Publishing. pp. E110. ISBN 0-8493-0464-4.
- ^ a b c d e Grund, Sabina C.; Hanusch, Kunibert; Wolf, Hans Uwe. «Arsenic and Arsenic Compounds». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a03_113.pub2.
- ^ Anke M. Arsenic. In: Mertz W. ed., Trace elements in human and Animal Nutrition, 5th ed. Orlando, FL: Academic Press, 1986, 347–372
- ^ Uthus, Eric O. (1992). «Evidence for arsenic essentiality». Environmental Geochemistry and Health. 14 (2): 55–58. doi:10.1007/BF01783629. PMID 24197927. S2CID 22882255.
- ^ Uthus E.O., Arsenic essentiality and factors affecting its importance. In: Chappell W.R, Abernathy C.O, Cothern C.R. eds., Arsenic Exposure and Health. Northwood, UK: Science and Technology Letters, 1994, 199–208.
- ^ a b Dibyendu, Sarkar; Datta, Rupali (2007). «Biogeochemistry of Arsenic in Contaminated Soils of Superfund Sites». EPA. United States Environmental Protection Agency. Retrieved 25 February 2018.
- ^ Carelton, James (2007). «Final Report: Biogeochemistry of Arsenic in Contaminated Soils of Superfund Sites». EPA. United States Environmental Protection Agency. Retrieved 25 February 2018.
- ^ a b Norman, Nicholas C. (1998). Chemistry of Arsenic, Antimony and Bismuth. Springer. p. 50. ISBN 978-0-7514-0389-3.
- ^ Wiberg, Egon; Wiberg, Nils; Holleman, Arnold Frederick (2001). Inorganic Chemistry. Academic Press. ISBN 978-0-12-352651-9.
- ^ a b c d e f Holleman, Arnold F.; Wiberg, Egon; Wiberg, Nils (1985). «Arsen». Lehrbuch der Anorganischen Chemie (in German) (91–100 ed.). Walter de Gruyter. pp. 675–681. ISBN 978-3-11-007511-3.
- ^ Madelung, Otfried (2004). Semiconductors: data handbook. Birkhäuser. pp. 410–. ISBN 978-3-540-40488-0.
- ^ Seidl, Michael; Balázs, Gábor; Scheer, Manfred (22 March 2019). «The Chemistry of Yellow Arsenic». Chemical Reviews. 119 (14): 8406–8434. doi:10.1021/acs.chemrev.8b00713. PMID 30900440. S2CID 85448636.
- ^ Antonatos, Nikolas; Luxa, Jan; Sturala, Jiri; Sofer, Zdeněk (2020). «Black arsenic: a new synthetic method by catalytic crystallization of arsenic glass». Nanoscale. 12 (9): 5397–5401. doi:10.1039/C9NR09627B. PMID 31894222. S2CID 209544160.
- ^ Arsenic Element Facts. chemicool.com
- ^ a b Audi, Georges; Bersillon, Olivier; Blachot, Jean; Wapstra, Aaldert Hendrik (2003), «The NUBASE evaluation of nuclear and decay properties», Nuclear Physics A, 729: 3–128, Bibcode:2003NuPhA.729….3A, doi:10.1016/j.nuclphysa.2003.11.001
- ^ a b c d Greenwood and Earnshaw, pp. 552–4
- ^ Chisholm, Hugh, ed. (1911). «Arsenic» . Encyclopædia Britannica. Vol. 2 (11th ed.). Cambridge University Press. pp. 651–654.
- ^ Uher, Ctirad (2001). «Chapter 5 Skutterudites: Prospective novel thermoelectrics». Recent Trends in Thermoelectric Materials Research I: Skutterudites: Prospective novel thermoelectrics. Semiconductors and Semimetals. Vol. 69. pp. 139–253. doi:10.1016/S0080-8784(01)80151-4. ISBN 978-0-12-752178-7.
- ^ a b Greenwood and Earnshaw, pp. 557–558
- ^ «Fiche toxicologique No. 53: Trihydrure d’arsenic» (PDF). Institut National de Recherche et de Sécurité (in French). 2000. Archived from the original (PDF) on 26 November 2006. Retrieved 6 September 2006.
- ^ a b Greenwood and Earnshaw, pp. 572–578
- ^ «Arsenic: arsenic(II) sulfide compound data». WebElements.com. Archived from the original on 11 December 2007. Retrieved 10 December 2007.
- ^
«Kalgoorlieite». Mindat. Hudson Institute of Mineralogy. 1993–2017. Retrieved 2 September 2017. - ^ Greenwood and Earnshaw, pp. 578–583
- ^ Tanaka, A. (2004). «Toxicity of indium arsenide, gallium arsenide, and aluminium gallium arsenide». Toxicology and Applied Pharmacology. 198 (3): 405–411. doi:10.1016/j.taap.2003.10.019. PMID 15276420.
- ^ Ossicini, Stefano; Pavesi, Lorenzo; Priolo, Francesco (2003). Light Emitting Silicon for Microphotonics. ISBN 978-3-540-40233-6. Retrieved 27 September 2013.
- ^ Din, M. B.; Gould, R. D. (1998). High field conduction mechanism of the evaporated cadmium arsenide thin films. ICSE’98. 1998 IEEE International Conference on Semiconductor Electronics. Proceedings (Cat. No.98EX187). p. 168. doi:10.1109/SMELEC.1998.781173. ISBN 978-0-7803-4971-1. S2CID 110904915.
- ^ Ellison, Hank D. (2007). Handbook of chemical and biological warfare agents. CRC Press. ISBN 978-0-8493-1434-6.
- ^ Girard, James (2010). Principles of Environmental Chemistry. Jones & Bartlett Learning. ISBN 978-0-7637-5939-1.
- ^ Somani, Satu M. (2001). Chemical warfare agents: toxicity at low levels. CRC Press. ISBN 978-0-8493-0872-7.
- ^ Greenwood, p. 584
- ^ Rieuwerts, John (2015). The Elements of Environmental Pollution. London and New York: Earthscan Routledge. p. 145. ISBN 978-0-415-85919-6. OCLC 886492996.
- ^ a b Matschullat, Jörg (2000). «Arsenic in the geosphere – a review». The Science of the Total Environment. 249 (1–3): 297–312. Bibcode:2000ScTEn.249..297M. doi:10.1016/S0048-9697(99)00524-0. PMID 10813460.
- ^ Brooks, William E. «Mineral Commodity Summaries 2007: Arsenic» (PDF). United States Geological Survey. Archived (PDF) from the original on 17 December 2008. Retrieved 25 November 2008.
- ^ a b Edelstein, Daniel L. «Mineral Commodity Summaries 2016: Arsenic» (PDF). United States Geological Survey. Retrieved 1 July 2016.
- ^ a b Brooks, William E. «Minerals Yearbook 2007: Arsenic» (PDF). United States Geological Survey. Archived (PDF) from the original on 17 December 2008. Retrieved 8 November 2008.
- ^ Whelan, J. M.; Struthers, J. D.; Ditzenberger, J. A. (1960). «Separation of Sulfur, Selenium, and Tellurium from Arsenic». Journal of the Electrochemical Society. 107 (12): 982–985. doi:10.1149/1.2427585.
- ^ a b Harper, Douglas. «arsenic». Online Etymology Dictionary. Retrieved 15 May 2010.
- ^ Bentley, Ronald; Chasteen, Thomas G. (2002). «Arsenic Curiosa and Humanity». The Chemical Educator. 7 (2): 51–60. doi:10.1007/s00897020539a. S2CID 6831485.
- ^ Holmyard John Eric (2007). Makers of Chemistry. Read Books. ISBN 978-1-4067-3275-7.
- ^ Vahidnia, A.; Van Der Voet, G. B.; De Wolff, F. A. (2007). «Arsenic neurotoxicity – a review». Human & Experimental Toxicology. 26 (10): 823–832. doi:10.1177/0960327107084539. PMID 18025055. S2CID 24138885.
- ^ Ketha, Hema; Garg, Uttam (1 January 2020), Ketha, Hema; Garg, Uttam (eds.), «Chapter 1 — An introduction to clinical and forensic toxicology», Toxicology Cases for the Clinical and Forensic Laboratory, Academic Press, pp. 3–6, ISBN 978-0-12-815846-3, retrieved 1 May 2022
- ^ Lechtman, H. (1996). «Arsenic Bronze: Dirty Copper or Chosen Alloy? A View from the Americas». Journal of Field Archaeology. 23 (4): 477–514. doi:10.2307/530550. JSTOR 530550.
- ^ Charles, J. A. (1967). «Early Arsenical Bronzes—A Metallurgical View». American Journal of Archaeology. 71 (1): 21–26. doi:10.2307/501586. JSTOR 501586.
- ^ George Sarton, Introduction to the History of Science. «We find in his writings […] preparation of various substances (e.g., basic lead carbonatic, arsenic and antimony from their sulphides).»
- ^ Emsley, John (2001). Nature’s Building Blocks: An A-Z Guide to the Elements. Oxford: Oxford University Press. pp. 43, 513, 529. ISBN 978-0-19-850341-5.
- ^ (Comte), Antoine-François de Fourcroy (1804). A general system of chemical knowledge, and its application to the phenomena of nature and art. pp. 84–.
- ^ Seyferth, Dietmar (2001). «Cadet’s Fuming Arsenical Liquid and the Cacodyl Compounds of Bunsen». Organometallics. 20 (8): 1488–1498. doi:10.1021/om0101947.
- ^ «Display Ad 48 – no Title». The Washington Post (1877–1922). 13 February 1898.
- ^ Turner, Alan (1999). «Viewpoint: the story so far: An overview of developments in UK food regulation and associated advisory committees». British Food Journal. 101 (4): 274–283. doi:10.1108/00070709910272141.
- ^ Hawksley, Lucinda (2016). Bitten by Witch Fever: Wallpaper & Arsenic in the Victorian Home. New York: Thames & Hudson.
- ^ «London purple. (8012-74-6)», Chemical Book
- ^ Lanman, Susan W. (2000). «Colour in the Garden: ‘Malignant Magenta’«. Garden History. 28 (2): 209–221. doi:10.2307/1587270. JSTOR 1587270.
- ^ Holton, E. C. (1926). «Insecticides and Fungicides». Industrial & Engineering Chemistry. 18 (9): 931–933. doi:10.1021/ie50201a018.
- ^ Murphy, E. A.; Aucott, M. (1998). «An assessment of the amounts of arsenical pesticides used historically in a geographical area». Science of the Total Environment. 218 (2–3): 89–101. Bibcode:1998ScTEn.218…89M. doi:10.1016/S0048-9697(98)00180-6.
- ^ Marlatt, C. L. (1897). Important Insecticides: Directions for Their Preparation and Use. U.S. Department of Agriculture. p. 5.
- ^ Kassinger, Ruth (2010). Paradise Under Glass: An Amateur Creates a Conservatory Garden. ISBN 978-0-06-199130-1.
- ^ Rahman, F. A.; Allan, D. L.; Rosen, C. J.; Sadowsky, M. J. (2004). «Arsenic availability from chromated copper arsenate (CCA)-treated wood». Journal of Environmental Quality. 33 (1): 173–180. doi:10.2134/jeq2004.0173. PMID 14964372.
- ^ Lichtfouse, Eric (2004). «Electrodialytical Removal of Cu, Cr and As from Threaded Wood». In Lichtfouse, Eric; Schwarzbauer, Jan; Robert, Didier (eds.). Environmental Chemistry: Green Chemistry and Pollutants in Ecosystems. Berlin: Springer. ISBN 978-3-540-22860-8.
- ^ Mandal, Badal Kumar; Suzuki, K. T. (2002). «Arsenic round the world: a review». Talanta. 58 (1): 201–235. doi:10.1016/S0039-9140(02)00268-0. PMID 18968746.
- ^ Peryea, F. J. (20–26 August 1998). Historical use of lead arsenate insecticides, resulting in soil contamination and implications for soil remediation. 16th World Congress of Soil Science. Montpellier, France. Archived from the original on 7 December 2008.
- ^ «organic arsenicals». EPA.
- ^ «Trace Elements in Soils and Plants, Third Edition». CRC Press. Archived from the original on 21 August 2016. Retrieved 2 August 2016.
- ^ Nachman, Keeve E.; Graham, Jay P.; Price, Lance B.; Silbergeld, Ellen K. (2005). «Arsenic: A Roadblock to Potential Animal Waste Management Solutions». Environmental Health Perspectives. 113 (9): 1123–1124. doi:10.1289/ehp.7834. PMC 1280389. PMID 16140615.
- ^ «Arsenic» (PDF). Agency for Toxic Substances and Disease Registry. Section 5.3, p. 310. Archived (PDF) from the original on 9 October 2022.
- ^ Jones, F. T. (2007). «A Broad View of Arsenic». Poultry Science. 86 (1): 2–14. doi:10.1093/ps/86.1.2. PMID 17179408.
- ^ a b Staff (8 June 2011). «Questions and Answers Regarding 3-Nitro (Roxarsone)». U.S. Food and Drug Administration. Retrieved 21 September 2012.
- ^ Gray, Theodore (2012). «Arsenic». In Gray, Theodore; Mann, Nick (eds.). Elements: A Visual Exploration of Every Known Atom in the Universe. Hachette Books. ISBN 978-1579128951.
- ^ «Phar Lap arsenic claims premature: expert». ABC News. 23 October 2006. Retrieved 14 June 2016.
- ^ Gibaud, Stéphane; Jaouen, Gérard (2010). Arsenic – based drugs: from Fowler’s solution to modern anticancer chemotherapy. Topics in Organometallic Chemistry. Vol. 32. pp. 1–20. Bibcode:2010moc..book….1G. doi:10.1007/978-3-642-13185-1_1. ISBN 978-3-642-13184-4.
- ^ Büscher P, Cecchi G, Jamonneau V, Priotto G (2017). «Human African trypanosomiasis». Lancet. 390 (10110): 2397–2409. doi:10.1016/S0140-6736(17)31510-6. PMID 28673422. S2CID 4853616.
- ^ Huet, P. M.; Guillaume, E.; Cote, J.; Légaré, A.; Lavoie, P.; Viallet, A. (1975). «Noncirrhotic presinusoidal portal hypertension associated with chronic arsenical intoxication». Gastroenterology. 68 (5 Pt 1): 1270–1277. doi:10.1016/S0016-5085(75)80244-7. PMID 1126603.
- ^ Antman, Karen H. (2001). «The History of Arsenic Trioxide in Cancer Therapy». The Oncologist. 6 (Suppl 2): 1–2. doi:10.1634/theoncologist.6-suppl_2-1. PMID 11331433.
- ^ Jennewein, Marc; Lewis, M. A.; Zhao, D.; Tsyganov, E.; Slavine, N.; He, J.; Watkins, L.; Kodibagkar, V. D.; O’Kelly, S.; Kulkarni, P.; Antich, P.; Hermanne, A.; Rösch, F.; Mason, R.; Thorpe, Ph. (2008). «Vascular Imaging of Solid Tumors in Rats with a Radioactive Arsenic-Labeled Antibody that Binds Exposed Phosphatidylserine». Clinical Cancer Research. 14 (5): 1377–1385. doi:10.1158/1078-0432.CCR-07-1516. PMC 3436070. PMID 18316558.
- ^ Subastri, Ariraman; Arun, Viswanathan; Sharma, Preeti; Preedia babu, Ezhuthupurakkal; Suyavaran, Arumugam; Nithyananthan, Subramaniyam; Alshammari, Ghedeir M.; Aristatile, Balakrishnan; Dharuman, Venkataraman; Thirunavukkarasu, Chinnasamy (1 November 2018). «Synthesis and characterisation of arsenic nanoparticles and its interaction with DNA and cytotoxic potential on breast cancer cells». Chemico-Biological Interactions. Nanotechnology, Biology and Toxicology. 295: 73–83. doi:10.1016/j.cbi.2017.12.025. ISSN 0009-2797. PMID 29277637. S2CID 1816043.
- ^ Haller, John S. Jr. (1 July 1975). Richert, Lucas; Bond, Gregory; Bouras-Vallianatos, Petros; O’Donnell, Kelly; Virdi, Jaipreet; Bian, He (eds.). «Therapeutic Mule: The Use of Arsenic in the Nineteenth Century Materia Medica». Pharmacy in History. Madison, Wisconsin, United States of America: American Institute of the History of Pharmacy (AIHP). 17 (3): 87–100. ISSN 0031-7047. JSTOR 41108920. OCLC 263600090. PMID 11610136. Archived from the original on 19 March 2021. Retrieved 29 June 2021 – via JSTOR.
- ^ Parascandola, John (2011). «5. What Kills Can Cure: Arsenic in Medicine». King of Poisons: A History of Arsenic. Lincoln, Nebraska, United States of America: University of Nebraska Press. pp. 145–172. ISBN 9781597978095. OCLC 817901966 – via Project MUSE.
- ^ Cope, Rhian; et al. (design by Greg Harris) (2017). «Chapter 15 – Metalloids». In Dalefield, Rosalind; Tenney, Sara; Kruze, Zoe; McLaughlin, Molly; Wortley, Chris (eds.). Veterinary Toxicology for Australia and New Zealand. Amsterdam, Netherlands/Masterton, New Zealand: Elsevier. pp. 255–277. ISBN 978-0-12-420227-6 – via ScienceDirect.
- ^ Bagshaw, N. E. (1995). «Lead alloys: Past, present and future». Journal of Power Sources. 53 (1): 25–30. Bibcode:1995JPS….53…25B. doi:10.1016/0378-7753(94)01973-Y.
- ^ Joseph, Günter; Kundig, Konrad J. A; Association, International Copper (1999). «Dealloying». Copper: Its Trade, Manufacture, Use, and Environmental Status. pp. 123–124. ISBN 978-0-87170-656-0.
- ^ Nayar (1997). The Metals Databook. p. 6. ISBN 978-0-07-462300-8.
- ^ «Blister Agents». Code Red – Weapons of Mass Destruction. Retrieved 15 May 2010.
- ^ Westing, Arthur H. (1972). «Herbicides in war: Current status and future doubt». Biological Conservation. 4 (5): 322–327. doi:10.1016/0006-3207(72)90043-2.
- ^ Westing, Arthur H. (1971). «Forestry and the War in South Vietnam». Journal of Forestry. 69: 777–783.
- ^ Timbrell, John (2005). «Butter Yellow and Scheele’s Green». The Poison Paradox: Chemicals as Friends and Foes. Oxford University Press. ISBN 978-0-19-280495-2.
- ^ Cross, J. D.; Dale, I. M.; Leslie, A. C. D.; Smith, H. (1979). «Industrial exposure to arsenic». Journal of Radioanalytical Chemistry. 48 (1–2): 197–208. doi:10.1007/BF02519786. S2CID 93714157.
- ^ Guruswamy, Sivaraman (1999). «XIV. Ammunition». Engineering Properties and Applications of Lead Alloys. CRC Press. pp. 569–570. ISBN 978-0-8247-8247-4.
- ^ Davis, Joseph R; Handbook Committee, ASM International (2001). «Dealloying». Copper and copper alloys. p. 390. ISBN 978-0-87170-726-0.
- ^ Christine Quigley, Modern Mummies: The Preservation of the Human Body in the Twentieth Century, p 6.
- ^ Parmelee, Cullen W. (1947). Ceramic Glazes (3rd ed.). Boston: Cahners Books. p. 61.
- ^ «Arsenic Supply Demand and the Environment». Pollution technology review 214: Mercury and arsenic wastes: removal, recovery, treatment, and disposal. William Andrew. 1993. p. 68. ISBN 978-0-8155-1326-1.
- ^ Ungers, L. J.; Jones, J. H.; McIntyre, A. J.; McHenry, C. R. (August 1985). «Release of arsenic from semiconductor wafers». American Industrial Hygiene Association Journal. 46 (8): 416–420. doi:10.1080/15298668591395094. ISSN 0002-8894. PMID 4050678.
- ^ Stolz, John F.; Basu, Partha; Santini, Joanne M.; Oremland, Ronald S. (2006). «Arsenic and Selenium in Microbial Metabolism». Annual Review of Microbiology. 60: 107–130. doi:10.1146/annurev.micro.60.080805.142053. PMID 16704340. S2CID 2575554.
- ^ Mukhopadhyay, Rita; Rosen, Barry P.; Phung, Le T.; Silver, Simon (2002). «Microbial arsenic: From geocycles to genes and enzymes». FEMS Microbiology Reviews. 26 (3): 311–325. doi:10.1111/j.1574-6976.2002.tb00617.x. PMID 12165430.
- ^ Kulp, T. R; Hoeft, S. E.; Asao, M.; Madigan, M. T.; Hollibaugh, J. T.; Fisher, J. C.; Stolz, J. F.; Culbertson, C. W.; Miller, L. G.; Oremland, R. S. (2008). «Arsenic(III) fuels anoxygenic photosynthesis in hot spring biofilms from Mono Lake, California». Science. 321 (5891): 967–970. Bibcode:2008Sci…321..967K. doi:10.1126/science.1160799. PMID 18703741. S2CID 39479754.
- Fred Campbell (11 August 2008). «Arsenic-loving bacteria rewrite photosynthesis rules». Chemistry World.
- ^ Wolfe-Simon, F.; Blum, J. S.; Kulp, T. R.; Gordon, G. W.; Hoeft, S. E.; Pett-Ridge, J.; Stolz, J. F.; Webb, S. M.; Weber, P. K. (3 June 2011). «A Bacterium That Can Grow by Using Arsenic Instead of Phosphorus» (PDF). Science. 332 (6034): 1163–1166. Bibcode:2011Sci…332.1163W. doi:10.1126/science.1197258. PMID 21127214. S2CID 51834091. Archived (PDF) from the original on 9 October 2022.
- ^ Erb, T. J.; Kiefer, P.; Hattendorf, B.; Günther, D.; Vorholt, J. A. (2012). «GFAJ-1 is an Arsenate-Resistant, Phosphate-Dependent Organism». Science. 337 (6093): 467–470. Bibcode:2012Sci…337..467E. doi:10.1126/science.1218455. PMID 22773139. S2CID 20229329.
- ^ Reaves, M. L.; Sinha, S.; Rabinowitz, J. D.; Kruglyak, L.; Redfield, R. J. (2012). «Absence of Detectable Arsenate in DNA from Arsenate-Grown GFAJ-1 Cells». Science. 337 (6093): 470–473. arXiv:1201.6643. Bibcode:2012Sci…337..470R. doi:10.1126/science.1219861. PMC 3845625. PMID 22773140.
- ^ Baloš, M. Živkov; Jakšić, S.; Pelić, D. Ljubojević (September 2019). «The role, importance and toxicity of arsenic in poultry nutrition». World’s Poultry Science Journal. 75 (3): 375–386. doi:10.1017/S0043933919000394. ISSN 0043-9339.
- ^ Anke M. (1986) «Arsenic», pp. 347–372 in Mertz W. (ed.), Trace elements in human and Animal Nutrition, 5th ed. Orlando, FL: Academic Press
- ^ Uthus E.O. (1992). «Evidency for arsenical essentiality». Environ Geochem Health. 14 (2): 55–58. doi:10.1007/BF01783629. PMID 24197927. S2CID 22882255.
- ^ Uthus E.O. (1994) «Arsenic essentiality and factors affecting its importance», pp. 199–208 in Chappell W.R, Abernathy C.O, Cothern C.R. (eds.) Arsenic Exposure and Health. Northwood, UK: Science and Technology Letters.
- ^ Baccarelli, A.; Bollati, V. (2009). «Epigenetics and environmental chemicals». Current Opinion in Pediatrics. 21 (2): 243–251. doi:10.1097/MOP.0b013e32832925cc. PMC 3035853. PMID 19663042.
- ^ Nicholis, I.; Curis, E.; Deschamps, P.; Bénazeth, S. (2009). «Arsenite medicinal use, metabolism, pharmacokinetics and monitoring in human hair». Biochimie. 91 (10): 1260–1267. doi:10.1016/j.biochi.2009.06.003. PMID 19527769.
- ^ Lombi, E.; Zhao, F.-J.; Fuhrmann, M.; Ma, L. Q.; McGrath, S. P. (2002). «Arsenic Distribution and Speciation in the Fronds of the Hyperaccumulator Pteris vittata». New Phytologist. 156 (2): 195–203. doi:10.1046/j.1469-8137.2002.00512.x. JSTOR 1514012. PMID 33873285.
- ^ Sakurai, Teruaki Sakurai (2003). «Biomethylation of Arsenic is Essentially Detoxicating Event». Journal of Health Science. 49 (3): 171–178. doi:10.1248/jhs.49.171.
- ^ Reimer, K. J.; Koch, I.; Cullen, W.R. (2010). Organoarsenicals. Distribution and transformation in the environment. Metal Ions in Life Sciences. Vol. 7. pp. 165–229. doi:10.1039/9781849730822-00165. ISBN 978-1-84755-177-1. PMID 20877808.
- ^ Bentley, Ronald; Chasteen, T. G. (2002). «Microbial Methylation of Metalloids: Arsenic, Antimony, and Bismuth». Microbiology and Molecular Biology Reviews. 66 (2): 250–271. doi:10.1128/MMBR.66.2.250-271.2002. PMC 120786. PMID 12040126.
- ^ Cullen, William R.; Reimer, Kenneth J. (1989). «Arsenic speciation in the environment». Chemical Reviews. 89 (4): 713–764. doi:10.1021/cr00094a002. hdl:10214/2162.
- ^ «Case Studies in Environmental Medicine (CSEM) Arsenic Toxicity Exposure Pathways» (PDF). Agency for Toxic Substances & Disease Registry. Retrieved 15 May 2010.
- ^ «Arsenic in Food: FAQ». 5 December 2011. Retrieved 11 April 2010.
- ^ a b c Arsenic. The Agency for Toxic Substances and Disease Registry (2009).
- ^ Archived at Ghostarchive and the Wayback Machine: «How Victorians Were Poisoned By Their Own Homes | Hidden Killers | Absolute Victory». YouTube.
- ^ Meharg, Andrew (2005). Venomous Earth – How Arsenic Caused The World’s Worst Mass Poisoning. Macmillan Science. ISBN 978-1-4039-4499-3.
- ^ Henke, Kevin R. (28 April 2009). Arsenic: Environmental Chemistry, Health Threats and Waste Treatment. p. 317. ISBN 978-0-470-02758-5.
- ^ Lamm, S. H.; Engel, A.; Penn, C. A.; Chen, R.; Feinleib, M. (2006). «Arsenic cancer risk confounder in southwest Taiwan data set». Environ. Health Perspect. 114 (7): 1077–1082. doi:10.1289/ehp.8704. PMC 1513326. PMID 16835062.
- ^ Kohnhorst, Andrew (2005). «Arsenic in Groundwater in Selected Countries in South and Southeast Asia: A Review». J Trop Med Parasitol. 28: 73. Archived from the original on 10 January 2014.
- ^ «Arsenic in drinking water threatens up to 60 million in Pakistan». Science | AAAS. 23 August 2017. Retrieved 11 September 2017.
- ^ a b Xia, Yajuan; Wade, Timothy; Wu, Kegong; Li, Yanhong; Ning, Zhixiong; Le, X Chris; He, Xingzhou; Chen, Binfei; Feng, Yong; Mumford, Judy (9 March 2009). «Well Water Arsenic Exposure, Arsenic Induced Skin-Lesions and Self-Reported Morbidity in Inner Mongolia». International Journal of Environmental Research and Public Health. 6 (3): 1010–1025. doi:10.3390/ijerph6031010. PMC 2672384. PMID 19440430.
- ^ Lall, Upmanu; Josset, Laureline; Russo, Tess (17 October 2020). «A Snapshot of the World’s Groundwater Challenges». Annual Review of Environment and Resources. 45 (1): 171–194. doi:10.1146/annurev-environ-102017-025800. ISSN 1543-5938.
- ^ «Arsenic in Drinking Water: 3. Occurrence in U.S. Waters» (PDF). Archived from the original (PDF) on 7 January 2010. Retrieved 15 May 2010.
- ^ Welch, Alan H.; Westjohn, D. B.; Helsel, Dennis R.; Wanty, Richard B. (2000). «Arsenic in Ground Water of the United States: Occurrence and Geochemistry». Ground Water. 38 (4): 589–604. doi:10.1111/j.1745-6584.2000.tb00251.x. S2CID 129409319.
- ^ Knobeloch, L. M.; Zierold, K. M.; Anderson, H. A. (2006). «Association of arsenic-contaminated drinking-water with prevalence of skin cancer in Wisconsin’s Fox River Valley». J. Health Popul Nutr. 24 (2): 206–213. hdl:1807/50099. PMID 17195561.
- ^ «In Small Doses:Arsenic». The Dartmouth Toxic Metals Superfund Research Program. Dartmouth College.
- ^ Courtney, D.; Ely, Kenneth H.; Enelow, Richard I.; Hamilton, Joshua W. (2009). «Low Dose Arsenic Compromises the Immune Response to Influenza A Infection in vivo». Environmental Health Perspectives. 117 (9): 1441–1447. doi:10.1289/ehp.0900911. PMC 2737023. PMID 19750111.
- ^ Klassen, R. A.; Douma, S. L.; Ford, A.; Rencz, A.; Grunsky, E. (2009). «Geoscience modeling of relative variation in natural arsenic hazard in potential in New Brunswick» (PDF). Geological Survey of Canada. Archived from the original (PDF) on 2 May 2013. Retrieved 14 October 2012.
- ^ Ferreccio, C.; Sancha, A. M. (2006). «Arsenic exposure and its impact on health in Chile». J Health Popul Nutr. 24 (2): 164–175. hdl:1807/50095. PMID 17195557.
- ^ Talhout, Reinskje; Schulz, Thomas; Florek, Ewa; Van Benthem, Jan; Wester, Piet; Opperhuizen, Antoon (2011). «Hazardous Compounds in Tobacco Smoke». International Journal of Environmental Research and Public Health. 8 (12): 613–628. doi:10.3390/ijerph8020613. PMC 3084482. PMID 21556207.
- ^ Chu, H. A.; Crawford-Brown, D. J. (2006). «Inorganic arsenic in drinking water and bladder cancer: a meta-analysis for dose-response assessment». Int. J. Environ. Res. Public Health. 3 (4): 316–322. doi:10.3390/ijerph2006030039. PMID 17159272.
- ^ «Arsenic in drinking water seen as threat – USATODAY.com». USA Today. 30 August 2007. Retrieved 1 January 2008.
- ^ Gulledge, John H.; O’Connor, John T. (1973). «Removal of Arsenic (V) from Water by Adsorption on Aluminum and Ferric Hydroxides». J. American Water Works Assn. 65 (8): 548–552. doi:10.1002/j.1551-8833.1973.tb01893.x.
- ^ O’Connor, J. T.; O’Connor, T. L. «Arsenic in Drinking Water: 4. Removal Methods» (PDF). Archived from the original (PDF) on 7 January 2010.
- ^ «In situ arsenic treatment». insituarsenic.org. Retrieved 13 May 2010.
- ^ Radloff, K. A.; Zheng, Y.; Michael, H. A.; Stute, M.; Bostick, B. C.; Mihajlov, I.; Bounds, M.; Huq, M. R.; Choudhury, I.; Rahman, M.; Schlosser, P.; Ahmed, K.; Van Geen, A. (2011). «Arsenic migration to deep groundwater in Bangladesh influenced by adsorption and water demand». Nature Geoscience. 4 (11): 793–798. Bibcode:2011NatGe…4..793R. doi:10.1038/ngeo1283. PMC 3269239. PMID 22308168.
- ^ Yavuz, Cafer T.; Mayo, J. T.; Yu, W. W.; Prakash, A.; Falkner, J. C.; Yean, S.; Cong, L.; Shipley, H. J.; Kan, A.; Tomson, M.; Natelson, D.; Colvin, V. L. (2005). «Low-Field Magnetic Separation of Monodisperse Fe3O4 Nanocrystals». Science. 314 (5801): 964–967. doi:10.1126/science.1131475. PMID 17095696. S2CID 23522459.
- ^ Meliker, J. R.; Wahl, R. L.; Cameron, L. L.; Nriagu, J. O. (2007). «Arsenic in drinking water and cerebrovascular disease, diabetes mellitus, and kidney disease in Michigan: A standardized mortality ratio analysis». Environmental Health. 6: 4. doi:10.1186/1476-069X-6-4. PMC 1797014. PMID 17274811.
- ^ Tseng, Chin-Hsiao; Tai, Tong-Yuan; Chong, Choon-Khim; Tseng, Ching-Ping; Lai, Mei-Shu; Lin, Boniface J.; Chiou, Hung-Yi; Hsueh, Yu-Mei; Hsu, Kuang-Hung; Chen, C. J. (2000). «Long-Term Arsenic Exposure and Incidence of Non-Insulin-Dependent Diabetes Mellitus: A Cohort Study in Arseniasis-Hyperendemic Villages in Taiwan». Environmental Health Perspectives. 108 (9): 847–851. doi:10.1289/ehp.00108847. PMC 2556925. PMID 11017889.
- ^ Newspaper article Archived 17 April 2012 at the Wayback Machine (in Hungarian) published by Magyar Nemzet on 15 April 2012.
- ^ Goering, P.; Aposhian, H. V.; Mass, M. J.; Cebrián, M.; Beck, B. D.; Waalkes, M. P. (1 May 1999). Peters, Jeffre M.; Campen, Matthew; Willett, Kristie; Hawkins, Virginia M.; States, J. Christopher; Miller, Gary W. (eds.). «The enigma of arsenic carcinogenesis: Role of metabolism» (PDF). Toxicological Sciences. 49 (1): 5–14. doi:10.1093/toxsci/49.1.5. ISSN 1096-0929. LCCN 98660653. OCLC 37825607. PMID 10367337. Archived from the original (PDF) on 27 July 2018. Retrieved 29 June 2021.
- ^ Hopenhayn-Rich, C.; Biggs, M. L.; Smith, Allan H.; Kalman, D. A.; Moore, Lee E. (1996). Kaufman, Joel D.; Boyd, Windy A.; Callahan, Catherine L.; Schroeder, Jane C.; Warren, Julia Boyle; Woolard, Susan Booker (eds.). «Methylation study of a population environmentally exposed to arsenic in drinking water». Environmental Health Perspectives. 104 (6): 620–628. doi:10.1289/ehp.96104620. ISSN 1552-9924. LCCN 76642723. OCLC 01727134. PMC 1469390. PMID 8793350.
- ^ Smith, Allan H.; Arroyo, Alex P.; Mazumder, Guha; Kosnett, Michael J.; Hernandez, Alexandra L.; Beeris, Martin; Smith, Meera M.; Moore, Lee E. (26 May 2000). Kaufman, Joel D.; Boyd, Windy A.; Callahan, Catherine L.; Schroeder, Jane C.; Warren, Julia Boyle; Woolard, Susan Booker (eds.). «Arsenic-induced skin lesions among Atacameño people in Northern Chile despite good nutrition and centuries of exposure» (PDF). Environmental Health Perspectives. 108 (7): 617–620. doi:10.1289/ehp.00108617. ISSN 1552-9924. LCCN 76642723. OCLC 01727134. PMC 1638201. PMID 10903614. Archived from the original (PDF) on 12 September 2015. Retrieved 29 June 2021.
- ^ Eawag (2015) Geogenic Contamination Handbook – Addressing Arsenic and Fluoride in Drinking Water. C.A. Johnson, A. Bretzler (Eds.), Swiss Federal Institute of Aquatic Science and Technology (Eawag), Duebendorf, Switzerland. (download: www.eawag.ch/en/research/humanwelfare/drinkingwater/wrq/geogenic-contamination-handbook/)
- ^ Amini, M.; Abbaspour, K.C.; Berg, M.; Winkel, L.; Hug, S.J.; Hoehn, E.; Yang, H.; Johnson, C.A. (2008). «Statistical modeling of global geogenic arsenic contamination in groundwater». Environmental Science and Technology. 42 (10): 3669–3675. Bibcode:2008EnST…42.3669A. doi:10.1021/es702859e. PMID 18546706.
- ^ Winkel, L.; Berg, M.; Amini, M.; Hug, S.J.; Johnson, C.A. (2008). «Predicting groundwater arsenic contamination in Southeast Asia from surface parameters». Nature Geoscience. 1 (8): 536–542. Bibcode:2008NatGe…1..536W. doi:10.1038/ngeo254.
- ^ Smedley, P. L. (2002). «A review of the source, behaviour and distribution of arsenic in natural waters» (PDF). Applied Geochemistry. 17 (5): 517–568. Bibcode:2002ApGC…17..517S. doi:10.1016/S0883-2927(02)00018-5. S2CID 55596829. Archived (PDF) from the original on 9 October 2022.
- ^ How Does Arsenic Get into the Groundwater. Civil and Environmental Engineering. University of Maine
- ^ Zeng Zhaohua, Zhang Zhiliang (2002). «The formation of As element in groundwater and the controlling factor». Shanghai Geology 87 (3): 11–15.
- ^ Zheng, Y; Stute, M; Van Geen, A; Gavrieli, I; Dhar, R; Simpson, H.J; Schlosser, P; Ahmed, K.M (2004). «Redox control of arsenic mobilization in Bangladesh groundwater». Applied Geochemistry. 19 (2): 201–214. Bibcode:2004ApGC…19..201Z. doi:10.1016/j.apgeochem.2003.09.007.
- ^ Thomas, Mary Ann (2007). «The Association of Arsenic With Redox Conditions, Depth, and Ground-Water Age in the Glacial Aquifer System of the Northern United States». U.S. Geological Survey, Virginia. pp. 1–18.
- ^ Bin, Hong (2006). «Influence of microbes on biogeochemistry of arsenic mechanism of arsenic mobilization in groundwater». Advances in Earth Science. 21 (1): 77–82.
- ^ Johnson, D. L; Pilson, M. E. Q (1975). «The oxidation of arsenite in seawater». Environmental Letters. 8 (2): 157–171. doi:10.1080/00139307509437429. PMID 236901.
- ^ Cherry, J. A. (1979). «Arsenic species as an indicator of redox conditions in groundwater». Contemporary Hydrogeology — the George Burke Maxey Memorial Volume. Developments in Water Science. Vol. 12. pp. 373–392. doi:10.1016/S0167-5648(09)70027-9. ISBN 9780444418487.
- ^ Cullen, William R; Reimer, Kenneth J (1989). «Arsenic speciation in the environment». Chemical Reviews. 89 (4): 713–764. doi:10.1021/cr00094a002. hdl:10214/2162.
- ^ Oremland, Ronald S. (2000). «Bacterial dissimilatory reduction of arsenate and sulfate in meromictic Mono Lake, California». Geochimica et Cosmochimica Acta. 64 (18): 3073–3084. Bibcode:2000GeCoA..64.3073O. doi:10.1016/S0016-7037(00)00422-1.
- ^ Reese, Robert G. Jr. «Commodity Summaries 2002: Arsenic» (PDF). United States Geological Survey. Archived (PDF) from the original on 17 December 2008. Retrieved 8 November 2008.
- ^ «Chromated Copper Arsenate (CCA)». US Environmental Protection Agency. 16 January 2014. Retrieved 15 October 2018.
- ^ «Is CCA treated pine Safe?». www.softwoods.com.au. 26 October 2010. Retrieved 24 February 2017.
- ^ Townsend, Timothy G.; Solo-Gabriele, Helena (2006). Environmental Impacts of Treated Wood. CRC Press. ISBN 9781420006216.
- ^ Saxe, Jennifer K.; Wannamaker, Eric J.; Conklin, Scott W.; Shupe, Todd F.; Beck, Barbara D. (1 January 2007). «Evaluating landfill disposal of chromated copper arsenate (CCA) treated wood and potential effects on groundwater: evidence from Florida». Chemosphere. 66 (3): 496–504. Bibcode:2007Chmsp..66..496S. doi:10.1016/j.chemosphere.2006.05.063. PMID 16870233.
- ^ BuildingOnline. «CCA Treated Wood Disposal | Wood Preservative Science Council | Objective, Sound, Scientific Analysis of CCA». www.woodpreservativescience.org. Retrieved 16 June 2016.
- ^ «TRI Releases Map». Toxmap.nlm.nih.gov. Archived from the original on 20 March 2010. Retrieved 23 March 2010.
- ^ TOXNET – Databases on toxicology, hazardous chemicals, environmental health, and toxic releases. Toxnet.nlm.nih.gov. Retrieved 2011-10-24.
- ^ Jain, C. K.; Singh, R. D. (2012). «Technological options for the removal of arsenic with special reference to South East Asia». Journal of Environmental Management. 107: 1–8. doi:10.1016/j.jenvman.2012.04.016. PMID 22579769.
- ^ Goering, P. (2013). «Bioremediation of arsenic-contaminated water: recent advances and future prospects». Water, Air, & Soil Pollution. 224 (12): 1722. Bibcode:2013WASP..224.1722B. doi:10.1007/s11270-013-1722-y. S2CID 97563539.
- ^ Goering, P. (2015). «Anaerobic arsenite oxidation with an electrode serving as the sole electron acceptor: A novel approach to the bioremediation of arsenic-polluted groundwater». Journal of Hazardous Materials. 283: 617–622. doi:10.1016/j.jhazmat.2014.10.014. hdl:10256/11522. PMID 25464303.
- ^ «Arsenic». Sigma Aldrich. Retrieved 21 December 2021.
- ^ «GENERAL TESTS, PROCESSES AND APPARATUS» (PDF). pmda.go.jp. Retrieved 11 October 2022.
{{cite web}}: CS1 maint: url-status (link) - ^ Arsenic Rule. U.S. Environmental Protection Agency. Adopted 22 January 2001; effective 23 January 2006.
- ^ a b c «Supporting Document for Action Level for Arsenic in Apple Juice». Fda.gov. Retrieved 21 August 2013.
- ^ «A Homeowner’s Guide to Arsenic in Drinking Water». New Jersey Department of Environmental Protection. Retrieved 21 August 2013.
- ^ NIOSH Pocket Guide to Chemical Hazards. «#0038». National Institute for Occupational Safety and Health (NIOSH).
- ^ NIOSH Pocket Guide to Chemical Hazards. «#0039». National Institute for Occupational Safety and Health (NIOSH).
- ^ Total Diet Study and Toxic Elements Program
- ^ Kotz, Deborah (14 September 2011). «Does apple juice have unsafe levels of arsenic? – The Boston Globe». Boston.com. Retrieved 21 August 2013.
- ^ Morran, Chris (30 November 2011). «Consumer Reports Study Finds High Levels of Arsenic & Lead in Some Fruit Juice». consumerist.com.
- ^ «Arsenic contamination of Bangladeshi paddy field soils: Implications for rice contribution to arsenic consumption». Nature. 22 November 2002. doi:10.1038/news021118-11. Retrieved 21 August 2013.
- ^ «Tainted wells pour arsenic onto food crops». New Scientist. 6 December 2002. Retrieved 21 August 2013.
- ^ Peplow, Mark (2 August 2005). «US rice may carry an arsenic burden». Nature News. doi:10.1038/news050801-5.
- ^ «Rice as a source of arsenic exposure».
- ^ Davis, Matthew A.; MacKenzie, Todd A.; Cottingham, Kathryn L.; Gilbert-Diamond, Diane; Punshon, Tracy; Karagas, Margaret R. (2012). «Rice Consumption and Urinary Arsenic Concentrations in U.S. Children». Environmental Health Perspectives. 120 (10): 1418–1424. doi:10.1289/ehp.1205014. PMC 3491944. PMID 23008276.
- ^ «High Levels of Arsenic Found in Rice». NPR.org. 2 March 2012. Retrieved 21 August 2013.
- ^ a b c «Arsenic in Your Food | Consumer Reports Investigation». Consumer Reports. 1 November 2012. Retrieved 21 August 2013.
- ^ Lawmakers Urge FDA to Act on Arsenic Standards. Foodsafetynews.com (24 February 2012). Retrieved 2012-05-23.
- ^ «FDA Looks for Answers on Arsenic in Rice». Fda.gov. 19 September 2012. Retrieved 21 August 2013.
- ^ «Arsenic in Rice». Fda.gov. Retrieved 21 August 2013.
- ^ «Questions & Answers: FDA’s Analysis of Arsenic in Rice and Rice Products». Fda.gov. 21 March 2013. Retrieved 21 August 2013.
- ^ a b «Arsenic in Rice: What You Need to Know». UC Berkeley Wellness. Retrieved 3 September 2014.
- ^ a b Menon, Manoj; Dong, Wanrong; Chen, Xumin; Hufton, Joseph; Rhodes, Edward J. (29 October 2020). «Improved rice cooking approach to maximise arsenic removal while preserving nutrient elements». Science of the Total Environment. 755 (Pt 2): 143341. doi:10.1016/j.scitotenv.2020.143341. ISSN 0048-9697. PMID 33153748.
- ^ «New way of cooking rice removes arsenic and retains mineral nutrients, study shows». phys.org. Retrieved 10 November 2020.
- ^ «How much arsenic is in your rice? Consumer Reports’ new data and guidelines are important for everyone but especially for gluten avoiders». consumerreports.org. Retrieved 15 February 2022.
- ^ «Arsenic». RTECS. National Institute for Occupational Safety and Health (NIOSH). 28 March 2018.
- ^ Korea Occupational Safety & Health Agency Archived 23 January 2017 at the Wayback Machine. kosha.or.kr
- ^ KOSHA GUIDE H-120-2013. naver.com
- ^ Gaion A, Sartori D, Scuderi A, Fattorini D (2014). «Bioaccumulation and biotransformation of arsenic compounds in Hediste diversicolor (Muller 1776) after exposure to spiked sediments». Environmental Science and Pollution Research. 21 (9): 5952–5959. doi:10.1007/s11356-014-2538-z. PMID 24458939. S2CID 12568097.
- ^ a b Hughes, Michael F. (2002). «Arsenic toxicity and potential mechanisms of action». Toxicology Letters. 133 (1): 1–16. doi:10.1016/S0378-4274(02)00084-X. PMID 12076506.
- ^ «OSHA Arsenic». United States Occupational Safety and Health Administration. Archived from the original on 12 October 2007. Retrieved 8 October 2007.
- ^ Croal, Laura R.; Gralnick, Jeffrey A.; Malasarn, Davin; Newman, Dianne K. (2004). «The Genetics of Geochemisty». Annual Review of Genetics. 38: 175–206. doi:10.1146/annurev.genet.38.072902.091138. PMID 15568975.
- ^ Giannini, A. James; Black, Henry Richard; Goettsche, Roger L. (1978). The Psychiatric, Psychogenic and Somatopsychic Disorders Handbook. New Hyde Park, NY: Medical Examination Publishing Co. pp. 81–82. ISBN 978-0-87488-596-5.
- ^ The Tox Guide for Arsenic (2007). The US Agency for Toxic Substances and Disease Registry.
Bibliography[edit]
- Emsley, John (2011). «Arsenic». Nature’s Building Blocks: An A–Z Guide to the Elements. Oxford, England: Oxford University Press. pp. 47–55. ISBN 978-0-19-960563-7.
- Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- Rieuwerts, John (2015). The Elements of Environmental Pollution. Abingdon and New York: Routledge. ISBN 978-0-41-585920-2.
Further reading[edit]
- Whorton, James G. (2011). The Arsenic Century. Oxford University Press. ISBN 978-0-19-960599-6.
External links[edit]
Wikimedia Commons has media related to Arsenic.
Look up arsenic in Wiktionary, the free dictionary.
- Arsenic Cancer Causing Substances, U.S. National Cancer Institute.
- CTD’s Arsenic page and CTD’s Arsenicals page from the Comparative Toxicogenomics Database
- Arsenic intoxication: general aspects and chelating agents, by Geir Bjørklund, Massimiliano Peana et al. Archives of Toxicology (2020) 94:1879–1897.
- A Small Dose of Toxicology
- Arsenic in groundwater Book on arsenic in groundwater by IAH’s Netherlands Chapter and the Netherlands Hydrological Society
- Contaminant Focus: Arsenic by the EPA.
- Environmental Health Criteria for Arsenic and Arsenic Compounds, 2001 by the WHO.
- Kapaj, Simon; Peterson, Hans; Liber, Karsten; Bhattacharya, Prosun (2006). «Human Health Effects from Chronic Arsenic Poisoning–A Review». Journal of Environmental Science and Health, Part A. 41 (10): 2399–2428. doi:10.1080/10934520600873571. PMID 17018421. S2CID 4659770.
- National Institute for Occupational Safety and Health – Arsenic Page
- Arsenic at The Periodic Table of Videos (University of Nottingham)
 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Arsenic | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Pronunciation |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Allotropes | grey (most common), yellow, black (see Allotropes of arsenic) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Appearance | metallic grey | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Standard atomic weight Ar°(As) |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Arsenic in the periodic table | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic number (Z) | 33 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Group | group 15 (pnictogens) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Period | period 4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Block | p-block | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electron configuration | [Ar] 3d10 4s2 4p3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrons per shell | 2, 8, 18, 5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physical properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase at STP | solid | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sublimation point | 887 K (615 °C, 1137 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Density (near r.t.) | 5.727 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| when liquid (at m.p.) | 5.22 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Triple point | 1090 K, 3628 kPa[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Critical point | 1673 K, ? MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of fusion | grey: 24.44 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of vaporization | 34.76 kJ/mol (?) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar heat capacity | 24.64 J/(mol·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Vapor pressure
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidation states | −3, −2, −1, 0,[3] +1,[4] +2, +3, +4, +5 (a mildly acidic oxide) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegativity | Pauling scale: 2.18 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ionization energies |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic radius | empirical: 119 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Covalent radius | 119±4 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waals radius | 185 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Spectral lines of arsenic |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Other properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Natural occurrence | primordial | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | rhombohedral
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermal expansion | 5.6 µm/(m⋅K)[5] (at r.t.) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermal conductivity | 50.2 W/(m⋅K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrical resistivity | 333 nΩ⋅m (at 20 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetic ordering | diamagnetic[6] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar magnetic susceptibility | −5.5×10−6 cm3/mol[7] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Young’s modulus | 8 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bulk modulus | 22 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mohs hardness | 3.5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Brinell hardness | 1440 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS Number | 7440-38-2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| History | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Discovery | Arabic alchemists (before AD 815) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Main isotopes of arsenic
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| references |
Arsenic is a chemical element with the symbol As and atomic number 33. Arsenic occurs in many minerals, usually in combination with sulfur and metals, but also as a pure elemental crystal. Arsenic is a metalloid. It has various allotropes, but only the gray form, which has a metallic appearance, is important to industry.
The primary use of arsenic is in alloys of lead (for example, in car batteries and ammunition). Arsenic is a common n-type dopant in semiconductor electronic devices. It is also a component of the III-V compound semiconductor gallium arsenide. Arsenic and its compounds, especially the trioxide, are used in the production of pesticides, treated wood products, herbicides, and insecticides. These applications are declining with the increasing recognition of the toxicity of arsenic and its compounds.[8]
A few species of bacteria are able to use arsenic compounds as respiratory metabolites. Trace quantities of arsenic are an essential dietary element in rats, hamsters, goats, chickens, and presumably other species. A role in human metabolism is not known.[9][10][11] However, arsenic poisoning occurs in multicellular life if quantities are larger than needed. Arsenic contamination of groundwater is a problem that affects millions of people across the world.
The United States’ Environmental Protection Agency states that all forms of arsenic are a serious risk to human health.[12] The United States’ Agency for Toxic Substances and Disease Registry ranked arsenic as number 1 in its 2001 Priority List of Hazardous Substances at Superfund sites.[13] Arsenic is classified as a Group-A carcinogen.[12]
Characteristics[edit]
Physical characteristics[edit]
Crystal structure common to Sb, AsSb and gray As
The three most common arsenic allotropes are gray, yellow, and black arsenic, with gray being the most common.[14] Gray arsenic (α-As, space group R3m No. 166) adopts a double-layered structure consisting of many interlocked, ruffled, six-membered rings. Because of weak bonding between the layers, gray arsenic is brittle and has a relatively low Mohs hardness of 3.5. Nearest and next-nearest neighbors form a distorted octahedral complex, with the three atoms in the same double-layer being slightly closer than the three atoms in the next.[15] This relatively close packing leads to a high density of 5.73 g/cm3.[16] Gray arsenic is a semimetal, but becomes a semiconductor with a bandgap of 1.2–1.4 eV if amorphized.[17] Gray arsenic is also the most stable form.
Yellow arsenic is soft and waxy, and somewhat similar to tetraphosphorus (P4).[18] Both have four atoms arranged in a tetrahedral structure in which each atom is bound to each of the other three atoms by a single bond. This unstable allotrope, being molecular, is the most volatile, least dense, and most toxic. Solid yellow arsenic is produced by rapid cooling of arsenic vapor, As4. It is rapidly transformed into gray arsenic by light. The yellow form has a density of 1.97 g/cm3.[16] Black arsenic is similar in structure to black phosphorus.[16]
Black arsenic can also be formed by cooling vapor at around 100–220 °C and by crystallization of amorphous arsenic in the presence of mercury vapors.[19] It is glassy and brittle. Black arsenic is also a poor electrical conductor.[20] As arsenic’s triple point is at 3.628 MPa (35.81 atm), it does not have a melting point at standard pressure but instead sublimes from solid to vapor at 887 K (615 °C or 1137 °F).[2]
Isotopes[edit]
Arsenic occurs in nature as one stable isotope, 75As, a monoisotopic element.[21] As of 2003, at least 33 radioisotopes have also been synthesized, ranging in atomic mass from 60 to 92. The most stable of these is 73As with a half-life of 80.30 days. All other isotopes have half-lives of under one day, with the exception of 71As (t1/2=65.30 hours), 72As (t1/2=26.0 hours), 74As (t1/2=17.77 days), 76As (t1/2=1.0942 days), and 77As (t1/2=38.83 hours). Isotopes that are lighter than the stable 75As tend to decay by β+ decay, and those that are heavier tend to decay by β− decay, with some exceptions.
At least 10 nuclear isomers have been described, ranging in atomic mass from 66 to 84. The most stable of arsenic’s isomers is 68mAs with a half-life of 111 seconds.[21]
Chemistry[edit]
Arsenic has a similar electronegativity and ionization energies to its lighter congener phosphorus and accordingly readily forms covalent molecules with most of the nonmetals. Though stable in dry air, arsenic forms a golden-bronze tarnish upon exposure to humidity which eventually becomes a black surface layer.[22] When heated in air, arsenic oxidizes to arsenic trioxide; the fumes from this reaction have an odor resembling garlic. This odor can be detected on striking arsenide minerals such as arsenopyrite with a hammer.[2] It burns in oxygen to form arsenic trioxide and arsenic pentoxide, which have the same structure as the more well-known phosphorus compounds, and in fluorine to give arsenic pentafluoride.[22] Arsenic (and some arsenic compounds) sublimes upon heating at atmospheric pressure, converting directly to a gaseous form without an intervening liquid state at 887 K (614 °C).[2] The triple point is 3.63 MPa and 1,090 K (820 °C).[16][2] Arsenic makes arsenic acid with concentrated nitric acid, arsenous acid with dilute nitric acid, and arsenic trioxide with concentrated sulfuric acid; however, it does not react with water, alkalis, or non-oxidising acids.[23] Arsenic reacts with metals to form arsenides, though these are not ionic compounds containing the As3− ion as the formation of such an anion would be highly endothermic and even the group 1 arsenides have properties of intermetallic compounds.[22] Like germanium, selenium, and bromine, which like arsenic succeed the 3d transition series, arsenic is much less stable in the group oxidation state of +5 than its vertical neighbors phosphorus and antimony, and hence arsenic pentoxide and arsenic acid are potent oxidizers.[22]
Compounds[edit]
Compounds of arsenic resemble in some respects those of phosphorus which occupies the same group (column) of the periodic table. The most common oxidation states for arsenic are: −3 in the arsenides, which are alloy-like intermetallic compounds, +3 in the arsenites, and +5 in the arsenates and most organoarsenic compounds. Arsenic also bonds readily to itself as seen in the square As3−4 ions in the mineral skutterudite.[24] In the +3 oxidation state, arsenic is typically pyramidal owing to the influence of the lone pair of electrons.[14]
Inorganic compounds[edit]
One of the simplest arsenic compounds is the trihydride, the highly toxic, flammable, pyrophoric arsine (AsH3). This compound is generally regarded as stable, since at room temperature it decomposes only slowly. At temperatures of 250–300 °C decomposition to arsenic and hydrogen is rapid.[25] Several factors, such as humidity, presence of light and certain catalysts (namely aluminium) facilitate the rate of decomposition.[26] It oxidises readily in air to form arsenic trioxide and water, and analogous reactions take place with sulfur and selenium instead of oxygen.[25]
Arsenic forms colorless, odorless, crystalline oxides As2O3 («white arsenic») and As2O5 which are hygroscopic and readily soluble in water to form acidic solutions. Arsenic(V) acid is a weak acid and the salts are called arsenates,[27] the most common arsenic contamination of groundwater, and a problem that affects many people. Synthetic arsenates include Scheele’s Green (cupric hydrogen arsenate, acidic copper arsenate), calcium arsenate, and lead hydrogen arsenate. These three have been used as agricultural insecticides and poisons.
The protonation steps between the arsenate and arsenic acid are similar to those between phosphate and phosphoric acid. Unlike phosphorous acid, arsenous acid is genuinely tribasic, with the formula As(OH)3.[27]
A broad variety of sulfur compounds of arsenic are known. Orpiment (As2S3) and realgar (As4S4) are somewhat abundant and were formerly used as painting pigments. In As4S10, arsenic has a formal oxidation state of +2 in As4S4 which features As-As bonds so that the total covalency of As is still 3.[28] Both orpiment and realgar, as well as As4S3, have selenium analogs; the analogous As2Te3 is known as the mineral kalgoorlieite,[29] and the anion As2Te− is known as a ligand in cobalt complexes.[30]
All trihalides of arsenic(III) are well known except the astatide, which is unknown. Arsenic pentafluoride (AsF5) is the only important pentahalide, reflecting the lower stability of the +5 oxidation state; even so, it is a very strong fluorinating and oxidizing agent. (The pentachloride is stable only below −50 °C, at which temperature it decomposes to the trichloride, releasing chlorine gas.[16])
Alloys[edit]
Arsenic is used as the group 5 element in the III-V semiconductors gallium arsenide, indium arsenide, and aluminium arsenide.[31] The valence electron count of GaAs is the same as a pair of Si atoms, but the band structure is completely different which results in distinct bulk properties.[32] Other arsenic alloys include the II-V semiconductor cadmium arsenide.[33]
Organoarsenic compounds[edit]
A large variety of organoarsenic compounds are known. Several were developed as chemical warfare agents during World War I, including vesicants such as lewisite and vomiting agents such as adamsite.[34][35][36] Cacodylic acid, which is of historic and practical interest, arises from the methylation of arsenic trioxide, a reaction that has no analogy in phosphorus chemistry. Cacodyl was the first organometallic compound known (even though arsenic is not a true metal) and was named from the Greek κακωδία «stink» for its offensive odor; it is very poisonous.[37]
Occurrence and production[edit]
A large sample of native arsenic
Arsenic comprises about 1.5 ppm (0.00015%) of the Earth’s crust, and is the 53rd most abundant element. Typical background concentrations of arsenic do not exceed 3 ng/m3 in the atmosphere; 100 mg/kg in soil; 400 μg/kg in vegetation; 10 μg/L in freshwater and 1.5 μg/L in seawater.[38]
Minerals with the formula MAsS and MAs2 (M = Fe, Ni, Co) are the dominant commercial sources of arsenic, together with realgar (an arsenic sulfide mineral) and native (elemental) arsenic. An illustrative mineral is arsenopyrite (FeAsS), which is structurally related to iron pyrite. Many minor As-containing minerals are known. Arsenic also occurs in various organic forms in the environment.[39]
Arsenic output in 2006[40]
In 2014, China was the top producer of white arsenic with almost 70% world share, followed by Morocco, Russia, and Belgium, according to the British Geological Survey and the United States Geological Survey.[41] Most arsenic refinement operations in the US and Europe have closed over environmental concerns. Arsenic is found in the smelter dust from copper, gold, and lead smelters, and is recovered primarily from copper refinement dust.[42]
On roasting arsenopyrite in air, arsenic sublimes as arsenic(III) oxide leaving iron oxides,[39] while roasting without air results in the production of gray arsenic. Further purification from sulfur and other chalcogens is achieved by sublimation in vacuum, in a hydrogen atmosphere, or by distillation from molten lead-arsenic mixture.[43]
| Rank | Country | 2014 As2O3 Production[41] |
|---|---|---|
| 1 | 25,000 T | |
| 2 | 8,800 T | |
| 3 | 1,500 T | |
| 4 | 1,000 T | |
| 5 | 52 T | |
| 6 | 45 T | |
| — | World Total (rounded) | 36,400 T |
History[edit]
The word arsenic has its origin in the Syriac word ܠܐ ܙܐܦܢܝܐ (al) zarniqa,[44][better source needed] from Arabic al-zarnīḵ الزرنيخ ‘the orpiment’, based on Persian zar ‘gold’ from the word زرنيخ zarnikh, meaning «yellow» (literally «gold-colored») and hence «(yellow) orpiment». It was adopted into Greek as arsenikon (ἀρσενικόν), a form that is folk etymology, being the neuter form of the Greek word arsenikos (ἀρσενικός), meaning «male», «virile».
The Greek word was adopted in Latin as arsenicum, which in French became arsenic, from which the English word arsenic is taken.[44][better source needed] Arsenic sulfides (orpiment, realgar) and oxides have been known and used since ancient times.[45] Zosimos (circa 300 AD) describes roasting sandarach (realgar) to obtain cloud of arsenic (arsenic trioxide), which he then reduces to gray arsenic.[46] As the symptoms of arsenic poisoning are not very specific, it was frequently used for murder until the advent of the Marsh test, a sensitive chemical test for its presence. (Another less sensitive but more general test is the Reinsch test.) Owing to its use by the ruling class to murder one another and its potency and discreetness, arsenic has been called the «poison of kings» and the «king of poisons».[47] In the Renaissance era, arsenic was known as “inheritance powder” due to use in killing family members.[48]
During the Bronze Age, arsenic was often included in bronze, which made the alloy harder (so-called «arsenical bronze»).[49][50]
The isolation of arsenic was described by Jabir ibn Hayyan before 815 AD.[51] Albertus Magnus (Albert the Great, 1193–1280) later isolated the element from a compound in 1250, by heating soap together with arsenic trisulfide.[52] In 1649, Johann Schröder published two ways of preparing arsenic.[53] Crystals of elemental (native) arsenic are found in nature, although rare.
Cadet’s fuming liquid (impure cacodyl), often claimed as the first synthetic organometallic compound, was synthesized in 1760 by Louis Claude Cadet de Gassicourt by the reaction of potassium acetate with arsenic trioxide.[54]
Satirical cartoon by Honoré Daumier of a chemist giving a public demonstration of arsenic, 1841
In the Victorian era, «arsenic» («white arsenic» or arsenic trioxide) was mixed with vinegar and chalk and eaten by women to improve the complexion of their faces, making their skin paler to show they did not work in the fields.[55] The accidental use of arsenic in the adulteration of foodstuffs led to the Bradford sweet poisoning in 1858, which resulted in 21 deaths.[56] Wallpaper production also began to use dyes made from arsenic, which was thought to increase the pigment’s brightness.[57]
Two arsenic pigments have been widely used since their discovery – Paris Green and Scheele’s Green. After the toxicity of arsenic became widely known, these chemicals were used less often as pigments and more often as insecticides. In the 1860s, an arsenic byproduct of dye production, London Purple, was widely used. This was a solid mixture of arsenic trioxide, aniline, lime, and ferrous oxide, insoluble in water and very toxic by inhalation or ingestion[58] But it was later replaced with Paris Green, another arsenic-based dye.[59] With better understanding of the toxicology mechanism, two other compounds were used starting in the 1890s.[60] Arsenite of lime and arsenate of lead were used widely as insecticides until the discovery of DDT in 1942.[61][62][63]
Applications[edit]
Agricultural[edit]
Roxarsone is a controversial arsenic compound used as a feed ingredient for chickens.
The toxicity of arsenic to insects, bacteria, and fungi led to its use as a wood preservative.[64] In the 1930s, a process of treating wood with chromated copper arsenate (also known as CCA or Tanalith) was invented, and for decades, this treatment was the most extensive industrial use of arsenic. An increased appreciation of the toxicity of arsenic led to a ban of CCA in consumer products in 2004, initiated by the European Union and United States.[65][66] However, CCA remains in heavy use in other countries (such as on Malaysian rubber plantations).[8]
Arsenic was also used in various agricultural insecticides and poisons. For example, lead hydrogen arsenate was a common insecticide on fruit trees,[67] but contact with the compound sometimes resulted in brain damage among those working the sprayers. In the second half of the 20th century, monosodium methyl arsenate (MSMA) and disodium methyl arsenate (DSMA) – less toxic organic forms of arsenic – replaced lead arsenate in agriculture. These organic arsenicals were in turn phased out by 2013 in all agricultural activities except cotton farming.[68]
The biogeochemistry of arsenic is complex and includes various adsorption and desorption processes. The toxicity of arsenic is connected to its solubility and is affected by pH. Arsenite (AsO3−3) is more soluble than arsenate (AsO3−4) and is more toxic; however, at a lower pH, arsenate becomes more mobile and toxic. It was found that addition of sulfur, phosphorus, and iron oxides to high-arsenite soils greatly reduces arsenic phytotoxicity.[69]
Arsenic is used as a feed additive in poultry and swine production, in particular in the U.S. to increase weight gain, improve feed efficiency, and prevent disease.[70][71] An example is roxarsone, which had been used as a broiler starter by about 70% of U.S. broiler growers.[72] Alpharma, a subsidiary of Pfizer Inc., which produces roxarsone, voluntarily suspended sales of the drug in response to studies showing elevated levels of inorganic arsenic, a carcinogen, in treated chickens.[73] A successor to Alpharma, Zoetis, continues to sell nitarsone, primarily for use in turkeys.[73]
Arsenic is intentionally added to the feed of chickens raised for human consumption. Organic arsenic compounds are less toxic than pure arsenic, and promote the growth of chickens. Under some conditions, the arsenic in chicken feed is converted to the toxic inorganic form.[74]
A 2006 study of the remains of the Australian racehorse, Phar Lap, determined that the 1932 death of the famous champion was caused by a massive overdose of arsenic. Sydney veterinarian Percy Sykes stated, «In those days, arsenic was quite a common tonic, usually given in the form of a solution (Fowler’s Solution) … It was so common that I’d reckon 90 per cent of the horses had arsenic in their system.»[75]
Medical use[edit]
During the 17th, 18th, and 19th centuries, a number of arsenic compounds were used as medicines, including arsphenamine (by Paul Ehrlich) and arsenic trioxide (by Thomas Fowler).[76] Arsphenamine, as well as neosalvarsan, was indicated for syphilis, but has been superseded by modern antibiotics. However, arsenicals such as melarsoprol are still used for the treatment of trypanosomiasis, since although these drugs have the disadvantage of severe toxicity, the disease is almost uniformly fatal if untreated.[77]
Arsenic trioxide has been used in a variety of ways since the 15th century, most commonly in the treatment of cancer, but also in medications as diverse as Fowler’s solution in psoriasis.[78] The US Food and Drug Administration in the year 2000 approved this compound for the treatment of patients with acute promyelocytic leukemia that is resistant to all-trans retinoic acid.[79]
A 2008 paper reports success in locating tumors using arsenic-74 (a positron emitter). This isotope produces clearer PET scan images than the previous radioactive agent, iodine-124, because the body tends to transport iodine to the thyroid gland producing signal noise.[80] Nanoparticles of arsenic have shown ability to kill cancer cells with lesser cytotoxicity than other arsenic formulations.[81]
In subtoxic doses, soluble arsenic compounds act as stimulants, and were once popular in small doses as medicine by people in the mid-18th to 19th centuries;[16][82][83] its use as a stimulant was especially prevalent as sport animals such as race horses or with work dogs.[84]
Alloys[edit]
The main use of arsenic is in alloying with lead. Lead components in car batteries are strengthened by the presence of a very small percentage of arsenic.[8][85] Dezincification of brass (a copper-zinc alloy) is greatly reduced by the addition of arsenic.[86] «Phosphorus Deoxidized Arsenical Copper» with an arsenic content of 0.3% has an increased corrosion stability in certain environments.[87] Gallium arsenide is an important semiconductor material, used in integrated circuits. Circuits made from GaAs are much faster (but also much more expensive) than those made from silicon. Unlike silicon, GaAs has a direct bandgap, and can be used in laser diodes and LEDs to convert electrical energy directly into light.[8]
Military[edit]
After World War I, the United States built a stockpile of 20,000 tons of weaponized lewisite (ClCH=CHAsCl2), an organoarsenic vesicant (blister agent) and lung irritant. The stockpile was neutralized with bleach and dumped into the Gulf of Mexico in the 1950s.[88] During the Vietnam War, the United States used Agent Blue, a mixture of sodium cacodylate and its acid form, as one of the rainbow herbicides to deprive North Vietnamese soldiers of foliage cover and rice.[89][90]
Other uses[edit]
- Copper acetoarsenite was used as a green pigment known under many names, including Paris Green and Emerald Green. It caused numerous arsenic poisonings. Scheele’s Green, a copper arsenate, was used in the 19th century as a coloring agent in sweets.[91]
- Arsenic is used in bronzing[92] and pyrotechnics.
- As much as 2% of produced arsenic is used in lead alloys for lead shot and bullets.[93]
- Arsenic is added in small quantities to alpha-brass to make it dezincification-resistant. This grade of brass is used in plumbing fittings and other wet environments.[94]
- Arsenic is also used for taxonomic sample preservation. It was also used in embalming fluids historically.[95]
- Arsenic was used as an opacifier in ceramics, creating white glazes.[96]
- Until recently, arsenic was used in optical glass. Modern glass manufacturers, under pressure from environmentalists, have ceased using both arsenic and lead.[97]
- In computers; arsenic is used in the chips as the n-type doping[98]
Biological role[edit]
Bacteria[edit]
Some species of bacteria obtain their energy in the absence of oxygen by oxidizing various fuels while reducing arsenate to arsenite. Under oxidative environmental conditions some bacteria use arsenite as fuel, which they oxidize to arsenate.[99] The enzymes involved are known as arsenate reductases (Arr).[100]
In 2008, bacteria were discovered that employ a version of photosynthesis in the absence of oxygen with arsenites as electron donors, producing arsenates (just as ordinary photosynthesis uses water as electron donor, producing molecular oxygen). Researchers conjecture that, over the course of history, these photosynthesizing organisms produced the arsenates that allowed the arsenate-reducing bacteria to thrive. One strain PHS-1 has been isolated and is related to the gammaproteobacterium Ectothiorhodospira shaposhnikovii. The mechanism is unknown, but an encoded Arr enzyme may function in reverse to its known homologues.[101]
In 2011, it was postulated that a strain of Halomonadaceae could be grown in the absence of phosphorus if that element were substituted with arsenic,[102] exploiting the fact that the arsenate and phosphate anions are similar structurally. The study was widely criticised and subsequently refuted by independent researcher groups.[103][104]
Essential trace element in higher animals[edit]
Arsenic is understood to be an essential trace mineral in birds as it is involved in the synthesis of methionine metabolites, with feeding recommendations being between 0.012 and 0.050 mg/kg.[105]
Some evidence indicates that arsenic is an essential trace mineral in mammals. However, the biological function is not known.[106][107][108]
Heredity[edit]
Arsenic has been linked to epigenetic changes, heritable changes in gene expression that occur without changes in DNA sequence. These include DNA methylation, histone modification, and RNA interference. Toxic levels of arsenic cause significant DNA hypermethylation of tumor suppressor genes p16 and p53, thus increasing risk of carcinogenesis. These epigenetic events have been studied in vitro using human kidney cells and in vivo using rat liver cells and peripheral blood leukocytes in humans.[109] Inductively coupled plasma mass spectrometry (ICP-MS) is used to detect precise levels of intracellular arsenic and other arsenic bases involved in epigenetic modification of DNA.[110] Studies investigating arsenic as an epigenetic factor can be used to develop precise biomarkers of exposure and susceptibility.
The Chinese brake fern (Pteris vittata) hyperaccumulates arsenic from the soil into its leaves and has a proposed use in phytoremediation.[111]
Biomethylation[edit]
Inorganic arsenic and its compounds, upon entering the food chain, are progressively metabolized through a process of methylation.[112][113] For example, the mold Scopulariopsis brevicaulis produces trimethylarsine if inorganic arsenic is present.[114] The organic compound arsenobetaine is found in some marine foods such as fish and algae, and also in mushrooms in larger concentrations. The average person’s intake is about 10–50 µg/day. Values about 1000 µg are not unusual following consumption of fish or mushrooms, but there is little danger in eating fish because this arsenic compound is nearly non-toxic.[115]
Environmental issues[edit]
Exposure[edit]
Naturally occurring sources of human exposure include volcanic ash, weathering of minerals and ores, and mineralized groundwater. Arsenic is also found in food, water, soil, and air.[116] Arsenic is absorbed by all plants, but is more concentrated in leafy vegetables, rice, apple and grape juice, and seafood.[117] An additional route of exposure is inhalation of atmospheric gases and dusts.[118]
During the Victorian era, arsenic was widely used in home decor, especially wallpapers.[119]
Occurrence in drinking water[edit]
Extensive arsenic contamination of groundwater has led to widespread arsenic poisoning in Bangladesh[120] and neighboring countries. It is estimated that approximately 57 million people in the Bengal basin are drinking groundwater with arsenic concentrations elevated above the World Health Organization’s standard of 10 parts per billion (ppb).[121] However, a study of cancer rates in Taiwan[122] suggested that significant increases in cancer mortality appear only at levels above 150 ppb. The arsenic in the groundwater is of natural origin, and is released from the sediment into the groundwater, caused by the anoxic conditions of the subsurface. This groundwater was used after local and western NGOs and the Bangladeshi government undertook a massive shallow tube well drinking-water program in the late twentieth century. This program was designed to prevent drinking of bacteria-contaminated surface waters, but failed to test for arsenic in the groundwater. Many other countries and districts in Southeast Asia, such as Vietnam and Cambodia, have geological environments that produce groundwater with a high arsenic content. Arsenicosis was reported in Nakhon Si Thammarat, Thailand in 1987, and the Chao Phraya River probably contains high levels of naturally occurring dissolved arsenic without being a public health problem because much of the public uses bottled water.[123] In Pakistan, more than 60 million people are exposed to arsenic polluted drinking water indicated by a recent report of Science. Podgorski’s team investigated more than 1200 samples and more than 66% exceeded the WHO minimum contamination level.[124]
Since the 1980s, residents of the Ba Men region of Inner Mongolia, China have been chronically exposed to arsenic through drinking water from contaminated wells.[125] A 2009 research study observed an elevated presence of skin lesions among residents with well water arsenic concentrations between 5 and 10 µg/L, suggesting that arsenic induced toxicity may occur at relatively low concentrations with chronic exposure.[125] Overall, 20 of China’s 34 provinces have high arsenic concentrations in the groundwater supply, potentially exposing 19 million people to hazardous drinking water.[126]
In the United States, arsenic is most commonly found in the ground waters of the southwest.[127] Parts of New England, Michigan, Wisconsin, Minnesota and the Dakotas are also known to have significant concentrations of arsenic in ground water.[128] Increased levels of skin cancer have been associated with arsenic exposure in Wisconsin, even at levels below the 10 part per billion drinking water standard.[129] According to a recent film funded by the US Superfund, millions of private wells have unknown arsenic levels, and in some areas of the US, more than 20% of the wells may contain levels that exceed established limits.[130]
Low-level exposure to arsenic at concentrations of 100 parts per billion (i.e., above the 10 parts per billion drinking water standard) compromises the initial immune response to H1N1 or swine flu infection according to NIEHS-supported scientists. The study, conducted in laboratory mice, suggests that people exposed to arsenic in their drinking water may be at increased risk for more serious illness or death from the virus.[131]
Some Canadians are drinking water that contains inorganic arsenic. Private-dug–well waters are most at risk for containing inorganic arsenic. Preliminary well water analysis typically does not test for arsenic. Researchers at the Geological Survey of Canada have modeled relative variation in natural arsenic hazard potential for the province of New Brunswick. This study has important implications for potable water and health concerns relating to inorganic arsenic.[132]
Epidemiological evidence from Chile shows a dose-dependent connection between chronic arsenic exposure and various forms of cancer, in particular when other risk factors, such as cigarette smoking, are present. These effects have been demonstrated at contaminations less than 50 ppb.[133] Arsenic is itself a constituent of tobacco smoke.[134]
Analyzing multiple epidemiological studies on inorganic arsenic exposure suggests a small but measurable increase in risk for bladder cancer at 10 ppb.[135] According to Peter Ravenscroft of the Department of Geography at the University of Cambridge,[136] roughly 80 million people worldwide consume between 10 and 50 ppb arsenic in their drinking water. If they all consumed exactly 10 ppb arsenic in their drinking water, the previously cited multiple epidemiological study analysis would predict an additional 2,000 cases of bladder cancer alone. This represents a clear underestimate of the overall impact, since it does not include lung or skin cancer, and explicitly underestimates the exposure. Those exposed to levels of arsenic above the current WHO standard should weigh the costs and benefits of arsenic remediation.
Early (1973) evaluations of the processes for removing dissolved arsenic from drinking water demonstrated the efficacy of co-precipitation with either iron or aluminum oxides. In particular, iron as a coagulant was found to remove arsenic with an efficacy exceeding 90%.[137][138] Several adsorptive media systems have been approved for use at point-of-service in a study funded by the United States Environmental Protection Agency (US EPA) and the National Science Foundation (NSF). A team of European and Indian scientists and engineers have set up six arsenic treatment plants in West Bengal based on in-situ remediation method (SAR Technology). This technology does not use any chemicals and arsenic is left in an insoluble form (+5 state) in the subterranean zone by recharging aerated water into the aquifer and developing an oxidation zone that supports arsenic oxidizing micro-organisms. This process does not produce any waste stream or sludge and is relatively cheap.[139]
Another effective and inexpensive method to avoid arsenic contamination is to sink wells 500 feet or deeper to reach purer waters. A recent 2011 study funded by the US National Institute of Environmental Health Sciences’ Superfund Research Program shows that deep sediments can remove arsenic and take it out of circulation. In this process, called adsorption, arsenic sticks to the surfaces of deep sediment particles and is naturally removed from the ground water.[140]
Magnetic separations of arsenic at very low magnetic field gradients with high-surface-area and monodisperse magnetite (Fe3O4) nanocrystals have been demonstrated in point-of-use water purification. Using the high specific surface area of Fe3O4 nanocrystals, the mass of waste associated with arsenic removal from water has been dramatically reduced.[141]
Epidemiological studies have suggested a correlation between chronic consumption of drinking water contaminated with arsenic and the incidence of all leading causes of mortality.[142] The literature indicates that arsenic exposure is causative in the pathogenesis of diabetes.[143]
Chaff-based filters have recently been shown to reduce the arsenic content of water to 3 µg/L. This may find applications in areas where the potable water is extracted from underground aquifers.[144]
San Pedro de Atacama[edit]
For several centuries, the people of San Pedro de Atacama in Chile have been drinking water that is contaminated with arsenic, and some evidence suggests they have developed some immunity.[145][146][147]
Hazard maps for contaminated groundwater[edit]
Around one-third of the world’s population drinks water from groundwater resources. Of this, about 10 percent, approximately 300 million people, obtains water from groundwater resources that are contaminated with unhealthy levels of arsenic or fluoride.[148] These trace elements derive mainly from minerals and ions in the ground.[149][150]
Redox transformation of arsenic in natural waters[edit]
Arsenic is unique among the trace metalloids and oxyanion-forming trace metals (e.g. As, Se, Sb, Mo, V, Cr, U, Re). It is sensitive to mobilization at pH values typical of natural waters (pH 6.5–8.5) under both oxidizing and reducing conditions. Arsenic can occur in the environment in several oxidation states (−3, 0, +3 and +5), but in natural waters it is mostly found in inorganic forms as oxyanions of trivalent arsenite [As(III)] or pentavalent arsenate [As(V)]. Organic forms of arsenic are produced by biological activity, mostly in surface waters, but are rarely quantitatively important. Organic arsenic compounds may, however, occur where waters are significantly impacted by industrial pollution.[151]
Arsenic may be solubilized by various processes. When pH is high, arsenic may be released from surface binding sites that lose their positive charge. When water level drops and sulfide minerals are exposed to air, arsenic trapped in sulfide minerals can be released into water. When organic carbon is present in water, bacteria are fed by directly reducing As(V) to As(III) or by reducing the element at the binding site, releasing inorganic arsenic.[152]
The aquatic transformations of arsenic are affected by pH, reduction-oxidation potential, organic matter concentration and the concentrations and forms of other elements, especially iron and manganese. The main factors are pH and the redox potential. Generally, the main forms of arsenic under oxic conditions are H3AsO4, H2AsO4−, HAsO42−, and AsO43− at pH 2, 2–7, 7–11 and 11, respectively. Under reducing conditions, H3AsO4 is predominant at pH 2–9.
Oxidation and reduction affects the migration of arsenic in subsurface environments. Arsenite is the most stable soluble form of arsenic in reducing environments and arsenate, which is less mobile than arsenite, is dominant in oxidizing environments at neutral pH. Therefore, arsenic may be more mobile under reducing conditions. The reducing environment is also rich in organic matter which may enhance the solubility of arsenic compounds. As a result, the adsorption of arsenic is reduced and dissolved arsenic accumulates in groundwater. That is why the arsenic content is higher in reducing environments than in oxidizing environments.[153]
The presence of sulfur is another factor that affects the transformation of arsenic in natural water. Arsenic can precipitate when metal sulfides form. In this way, arsenic is removed from the water and its mobility decreases. When oxygen is present, bacteria oxidize reduced sulfur to generate energy, potentially releasing bound arsenic.
Redox reactions involving Fe also appear to be essential factors in the fate of arsenic in aquatic systems. The reduction of iron oxyhydroxides plays a key role in the release of arsenic to water. So arsenic can be enriched in water with elevated Fe concentrations.[154] Under oxidizing conditions, arsenic can be mobilized from pyrite or iron oxides especially at elevated pH. Under reducing conditions, arsenic can be mobilized by reductive desorption or dissolution when associated with iron oxides. The reductive desorption occurs under two circumstances. One is when arsenate is reduced to arsenite which adsorbs to iron oxides less strongly. The other results from a change in the charge on the mineral surface which leads to the desorption of bound arsenic.[155]
Some species of bacteria catalyze redox transformations of arsenic. Dissimilatory arsenate-respiring prokaryotes (DARP) speed up the reduction of As(V) to As(III). DARP use As(V) as the electron acceptor of anaerobic respiration and obtain energy to survive. Other organic and inorganic substances can be oxidized in this process. Chemoautotrophic arsenite oxidizers (CAO) and heterotrophic arsenite oxidizers (HAO) convert As(III) into As(V). CAO combine the oxidation of As(III) with the reduction of oxygen or nitrate. They use obtained energy to fix produce organic carbon from CO2. HAO cannot obtain energy from As(III) oxidation. This process may be an arsenic detoxification mechanism for the bacteria.[156]
Equilibrium thermodynamic calculations predict that As(V) concentrations should be greater than As(III) concentrations in all but strongly reducing conditions, i.e. where SO42− reduction is occurring. However, abiotic redox reactions of arsenic are slow. Oxidation of As(III) by dissolved O2 is a particularly slow reaction. For example, Johnson and Pilson (1975) gave half-lives for the oxygenation of As(III) in seawater ranging from several months to a year.[157] In other studies, As(V)/As(III) ratios were stable over periods of days or weeks during water sampling when no particular care was taken to prevent oxidation, again suggesting relatively slow oxidation rates. Cherry found from experimental studies that the As(V)/As(III) ratios were stable in anoxic solutions for up to 3 weeks but that gradual changes occurred over longer timescales.[158] Sterile water samples have been observed to be less susceptible to speciation changes than non-sterile samples.[159] Oremland found that the reduction of As(V) to As(III) in Mono Lake was rapidly catalyzed by bacteria with rate constants ranging from 0.02 to 0.3-day−1.[160]
Wood preservation in the US[edit]
As of 2002, US-based industries consumed 19,600 metric tons of arsenic. Ninety percent of this was used for treatment of wood with chromated copper arsenate (CCA). In 2007, 50% of the 5,280 metric tons of consumption was still used for this purpose.[42][161] In the United States, the voluntary phasing-out of arsenic in production of consumer products and residential and general consumer construction products began on 31 December 2003, and alternative chemicals are now used, such as Alkaline Copper Quaternary, borates, copper azole, cyproconazole, and propiconazole.[162]
Although discontinued, this application is also one of the most concerning to the general public. The vast majority of older pressure-treated wood was treated with CCA. CCA lumber is still in widespread use in many countries, and was heavily used during the latter half of the 20th century as a structural and outdoor building material. Although the use of CCA lumber was banned in many areas after studies showed that arsenic could leach out of the wood into the surrounding soil (from playground equipment, for instance), a risk is also presented by the burning of older CCA timber. The direct or indirect ingestion of wood ash from burnt CCA lumber has caused fatalities in animals and serious poisonings in humans; the lethal human dose is approximately 20 grams of ash.[163] Scrap CCA lumber from construction and demolition sites may be inadvertently used in commercial and domestic fires. Protocols for safe disposal of CCA lumber are not consistent throughout the world. Widespread landfill disposal of such timber raises some concern,[164] but other studies have shown no arsenic contamination in the groundwater.[165][166]
Mapping of industrial releases in the US[edit]
One tool that maps the location (and other information) of arsenic releases in the United States is TOXMAP.[167] TOXMAP is a Geographic Information System (GIS) from the Division of Specialized Information Services of the United States National Library of Medicine (NLM) funded by the US Federal Government. With marked-up maps of the United States, TOXMAP enables users to visually explore data from the United States Environmental Protection Agency’s (EPA) Toxics Release Inventory and Superfund Basic Research Programs. TOXMAP’s chemical and environmental health information is taken from NLM’s Toxicology Data Network (TOXNET),[168] PubMed, and from other authoritative sources.
Bioremediation[edit]
Physical, chemical, and biological methods have been used to remediate arsenic contaminated water.[169] Bioremediation is said to be cost-effective and environmentally friendly.[170] Bioremediation of ground water contaminated with arsenic aims to convert arsenite, the toxic form of arsenic to humans, to arsenate. Arsenate (+5 oxidation state) is the dominant form of arsenic in surface water, while arsenite (+3 oxidation state) is the dominant form in hypoxic to anoxic environments. Arsenite is more soluble and mobile than arsenate. Many species of bacteria can transform arsenite to arsenate in anoxic conditions by using arsenite as an electron donor.[171] This is a useful method in ground water remediation. Another bioremediation strategy is to use plants that accumulate arsenic in their tissues via phytoremediation but the disposal of contaminated plant material needs to be considered.
Bioremediation requires careful evaluation and design in accordance with existing conditions. Some sites may require the addition of an electron acceptor while others require microbe supplementation (bioaugmentation). Regardless of the method used, only constant monitoring can prevent future contamination.
Toxicity and precautions[edit]
Arsenic| Hazards | |
|---|---|
| GHS labelling:[172] | |
|
Pictograms |
   
|
|
Signal word |
Danger |
|
Hazard statements |
H301+H331, H315, H318, H350, H410 |
|
Precautionary statements |
P273, P280, P301+P310, P302+P352, P304+P340+P311, P305+P351+P338 |
Arsenic and many of its compounds are especially potent poisons. Small amount of arsenic can be detected by pharmacopoial methods which includes reduction of arsenic to arsenious with help of zinc and can be confirmed with mercuric chloride paper.[173]
Classification[edit]
Elemental arsenic and arsenic sulfate and trioxide compounds are classified as «toxic» and «dangerous for the environment» in the European Union under directive 67/548/EEC.
The International Agency for Research on Cancer (IARC) recognizes arsenic and inorganic arsenic compounds as group 1 carcinogens, and the EU lists arsenic trioxide, arsenic pentoxide, and arsenate salts as category 1 carcinogens.
Arsenic is known to cause arsenicosis when present in drinking water, «the most common species being arsenate [HAsO2−4; As(V)] and arsenite [H3AsO3; As(III)]».
Legal limits, food, and drink[edit]
In the United States since 2006, the maximum concentration in drinking water allowed by the Environmental Protection Agency (EPA) is 10 ppb[174] and the FDA set the same standard in 2005 for bottled water.[175] The Department of Environmental Protection for New Jersey set a drinking water limit of 5 ppb in 2006.[176] The IDLH (immediately dangerous to life and health) value for arsenic metal and inorganic arsenic compounds is 5 mg/m3 (5 ppb). The Occupational Safety and Health Administration has set the permissible exposure limit (PEL) to a time-weighted average (TWA) of 0.01 mg/m3 (0.01 ppb), and the National Institute for Occupational Safety and Health (NIOSH) has set the recommended exposure limit (REL) to a 15-minute constant exposure of 0.002 mg/m3 (0.002 ppb).[177] The PEL for organic arsenic compounds is a TWA of 0.5 mg/m3.[178] (0.5 ppb).
In 2008, based on its ongoing testing of a wide variety of American foods for toxic chemicals,[179] the U.S. Food and Drug Administration set the «level of concern» for inorganic arsenic in apple and pear juices at 23 ppb, based on non-carcinogenic effects, and began blocking importation of products in excess of this level; it also required recalls for non-conforming domestic products.[175] In 2011, the national Dr. Oz television show broadcast a program highlighting tests performed by an independent lab hired by the producers. Though the methodology was disputed (it did not distinguish between organic and inorganic arsenic) the tests showed levels of arsenic up to 36 ppb.[180] In response, FDA tested the worst brand from the Dr. Oz show and found much lower levels. Ongoing testing found 95% of the apple juice samples were below the level of concern. Later testing by Consumer Reports showed inorganic arsenic at levels slightly above 10 ppb, and the organization urged parents to reduce consumption.[181] In July 2013, on consideration of consumption by children, chronic exposure, and carcinogenic effect, the FDA established an «action level» of 10 ppb for apple juice, the same as the drinking water standard.[175]
Concern about arsenic in rice in Bangladesh was raised in 2002, but at the time only Australia had a legal limit for food (one milligram per kilogram).[182][183] Concern was raised about people who were eating U.S. rice exceeding WHO standards for personal arsenic intake in 2005.[184] In 2011, the People’s Republic of China set a food standard of 150 ppb for arsenic.[185]
In the United States in 2012, testing by separate groups of researchers at the Children’s Environmental Health and Disease Prevention Research Center at Dartmouth College (early in the year, focusing on urinary levels in children)[186] and Consumer Reports (in November)[187][188] found levels of arsenic in rice that resulted in calls for the FDA to set limits.[189] The FDA released some testing results in September 2012,[190][191] and as of July 2013, is still collecting data in support of a new potential regulation. It has not recommended any changes in consumer behavior.[192]
Consumer Reports recommended:
- That the EPA and FDA eliminate arsenic-containing fertilizer, drugs, and pesticides in food production;
- That the FDA establish a legal limit for food;
- That industry change production practices to lower arsenic levels, especially in food for children; and
- That consumers test home water supplies, eat a varied diet, and cook rice with excess water, then draining it off (reducing inorganic arsenic by about one third along with a slight reduction in vitamin content).[188]
- Evidence-based public health advocates also recommend that, given the lack of regulation or labeling for arsenic in the U.S., children should eat no more than 1.5 servings per week of rice and should not drink rice milk as part of their daily diet before age 5.[193] They also offer recommendations for adults and infants on how to limit arsenic exposure from rice, drinking water, and fruit juice.[193]
A 2014 World Health Organization advisory conference was scheduled to consider limits of 200–300 ppb for rice.[188]
Reducing arsenic content in rice[edit]
An improved rice cooking approach to maximise arsenic removal while preserving nutrient elements[194]
In 2020, scientists assessed multiple preparation procedures of rice for their capacity to reduce arsenic content and preserve nutrients, recommending a procedure involving parboiling and water-absorption.[195][194][196]
Occupational exposure limits[edit]
| Country | Limit[197] |
|---|---|
| Argentina | Confirmed human carcinogen |
| Australia | TWA 0.05 mg/m3 – Carcinogen |
| Belgium | TWA 0.1 mg/m3 – Carcinogen |
| Bulgaria | Confirmed human carcinogen |
| Canada | TWA 0.01 mg/m3 |
| Colombia | Confirmed human carcinogen |
| Denmark | TWA 0.01 mg/m3 |
| Finland | Carcinogen |
| Egypt | TWA 0.2 mg/m3 |
| Hungary | Ceiling concentration 0.01 mg/m3 – Skin, carcinogen |
| India | TWA 0.2 mg/m3 |
| Japan | Group 1 carcinogen |
| Jordan | Confirmed human carcinogen |
| Mexico | TWA 0.2 mg/m3 |
| New Zealand | TWA 0.05 mg/m3 – Carcinogen |
| Norway | TWA 0.02 mg/m3 |
| Philippines | TWA 0.5 mg/m3 |
| Poland | TWA 0.01 mg/m3 |
| Singapore | Confirmed human carcinogen |
| South Korea | TWA 0.01 mg/m3[198][199] |
| Sweden | TWA 0.01 mg/m3 |
| Thailand | TWA 0.5 mg/m3 |
| Turkey | TWA 0.5 mg/m3 |
| United Kingdom | TWA 0.1 mg/m3 |
| United States | TWA 0.01 mg/m3 |
| Vietnam | Confirmed human carcinogen |
Ecotoxicity[edit]
Arsenic is bioaccumulative in many organisms, marine species in particular, but it does not appear to biomagnify significantly in food webs.[200] In polluted areas, plant growth may be affected by root uptake of arsenate, which is a phosphate analog and therefore readily transported in plant tissues and cells. In polluted areas, uptake of the more toxic arsenite ion (found more particularly in reducing conditions) is likely in poorly-drained soils.
Toxicity in animals[edit]
| Compound | Animal | LD50 | Route |
|---|---|---|---|
| Arsenic | Rat | 763 mg/kg | oral |
| Arsenic | Mouse | 145 mg/kg | oral |
| Calcium arsenate | Rat | 20 mg/kg | oral |
| Calcium arsenate | Mouse | 794 mg/kg | oral |
| Calcium arsenate | Rabbit | 50 mg/kg | oral |
| Calcium arsenate | Dog | 38 mg/kg | oral |
| Lead arsenate | Rabbit | 75 mg/kg | oral |
| Compound | Animal | LD50[201] | Route |
|---|---|---|---|
| Arsenic trioxide (As(III)) | Mouse | 26 mg/kg | oral |
| Arsenite (As(III)) | Mouse | 8 mg/kg | im |
| Arsenate (As(V)) | Mouse | 21 mg/kg | im |
| MMA (As(III)) | Hamster | 2 mg/kg | ip |
| MMA (As(V)) | Mouse | 916 mg/kg | oral |
| DMA (As(V)) | Mouse | 648 mg/kg | oral |
| im = injected intramuscularly
ip = administered intraperitoneally |
Biological mechanism[edit]
Arsenic’s toxicity comes from the affinity of arsenic(III) oxides for thiols. Thiols, in the form of cysteine residues and cofactors such as lipoic acid and coenzyme A, are situated at the active sites of many important enzymes.[8]
Arsenic disrupts ATP production through several mechanisms. At the level of the citric acid cycle, arsenic inhibits lipoic acid, which is a cofactor for pyruvate dehydrogenase. By competing with phosphate, arsenate uncouples oxidative phosphorylation, thus inhibiting energy-linked reduction of NAD+, mitochondrial respiration and ATP synthesis. Hydrogen peroxide production is also increased, which, it is speculated, has potential to form reactive oxygen species and oxidative stress. These metabolic interferences lead to death from multi-system organ failure. The organ failure is presumed to be from necrotic cell death, not apoptosis, since energy reserves have been too depleted for apoptosis to occur.[201]
Exposure risks and remediation[edit]
Occupational exposure and arsenic poisoning may occur in persons working in industries involving the use of inorganic arsenic and its compounds, such as wood preservation, glass production, nonferrous metal alloys, and electronic semiconductor manufacturing. Inorganic arsenic is also found in coke oven emissions associated with the smelter industry.[202]
The conversion between As(III) and As(V) is a large factor in arsenic environmental contamination. According to Croal, Gralnick, Malasarn and Newman, «[the] understanding [of] what stimulates As(III) oxidation and/or limits As(V) reduction is relevant for bioremediation of contaminated sites (Croal). The study of chemolithoautotrophic As(III) oxidizers and the heterotrophic As(V) reducers can help the understanding of the oxidation and/or reduction of arsenic.[203]
Treatment[edit]
Treatment of chronic arsenic poisoning is possible. British anti-lewisite (dimercaprol) is prescribed in doses of 5 mg/kg up to 300 mg every 4 hours for the first day, then every 6 hours for the second day, and finally every 8 hours for 8 additional days.[204] However the USA’s Agency for Toxic Substances and Disease Registry (ATSDR) states that the long-term effects of arsenic exposure cannot be predicted.[118] Blood, urine, hair, and nails may be tested for arsenic; however, these tests cannot foresee possible health outcomes from the exposure.[118] Long-term exposure and consequent excretion through urine has been linked to bladder and kidney cancer in addition to cancer of the liver, prostate, skin, lungs, and nasal cavity.[205]
See also[edit]
- Aqua Tofana
- Arsenic and Old Lace
- Arsenic biochemistry
- Arsenic compounds
- Arsenic poisoning
- Arsenic toxicity
- Arsenic trioxide
- Fowler’s solution
- GFAJ-1
- Grainger challenge
- Hypothetical types of biochemistry
- Organoarsenic chemistry
- Toxic heavy metal
- White arsenic
References[edit]
- ^ «Standard Atomic Weights: Arsenic». CIAAW. 2013.
- ^ a b c d e Gokcen, N. A (1989). «The As (arsenic) system». Bull. Alloy Phase Diagrams. 10: 11–22. doi:10.1007/BF02882166.
- ^ Abraham, Mariham Y.; Wang, Yuzhong; Xie, Yaoming; Wei, Pingrong; Shaefer III, Henry F.; Schleyer, P. von R.; Robinson, Gregory H. (2010). «Carbene Stabilization of Diarsenic: From Hypervalency to Allotropy». Chemistry: A European Journal. 16 (2): 432–5. doi:10.1002/chem.200902840. PMID 19937872.
- ^ Ellis, Bobby D.; MacDonald, Charles L. B. (2004). «Stabilized Arsenic(I) Iodide: A Ready Source of Arsenic Iodide Fragments and a Useful Reagent for the Generation of Clusters». Inorganic Chemistry. 43 (19): 5981–6. doi:10.1021/ic049281s. PMID 15360247.
- ^ Cverna, Fran (2002). ASM Ready Reference: Thermal properties of metals. ASM International. pp. 8–. ISBN 978-0-87170-768-0. pdf.
- ^ Lide, David R., ed. (2000). «Magnetic susceptibility of the elements and inorganic compounds». Handbook of Chemistry and Physics (PDF) (81 ed.). CRC press. ISBN 0849304814.
- ^ Weast, Robert (1984). CRC, Handbook of Chemistry and Physics. Boca Raton, Florida: Chemical Rubber Company Publishing. pp. E110. ISBN 0-8493-0464-4.
- ^ a b c d e Grund, Sabina C.; Hanusch, Kunibert; Wolf, Hans Uwe. «Arsenic and Arsenic Compounds». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a03_113.pub2.
- ^ Anke M. Arsenic. In: Mertz W. ed., Trace elements in human and Animal Nutrition, 5th ed. Orlando, FL: Academic Press, 1986, 347–372
- ^ Uthus, Eric O. (1992). «Evidence for arsenic essentiality». Environmental Geochemistry and Health. 14 (2): 55–58. doi:10.1007/BF01783629. PMID 24197927. S2CID 22882255.
- ^ Uthus E.O., Arsenic essentiality and factors affecting its importance. In: Chappell W.R, Abernathy C.O, Cothern C.R. eds., Arsenic Exposure and Health. Northwood, UK: Science and Technology Letters, 1994, 199–208.
- ^ a b Dibyendu, Sarkar; Datta, Rupali (2007). «Biogeochemistry of Arsenic in Contaminated Soils of Superfund Sites». EPA. United States Environmental Protection Agency. Retrieved 25 February 2018.
- ^ Carelton, James (2007). «Final Report: Biogeochemistry of Arsenic in Contaminated Soils of Superfund Sites». EPA. United States Environmental Protection Agency. Retrieved 25 February 2018.
- ^ a b Norman, Nicholas C. (1998). Chemistry of Arsenic, Antimony and Bismuth. Springer. p. 50. ISBN 978-0-7514-0389-3.
- ^ Wiberg, Egon; Wiberg, Nils; Holleman, Arnold Frederick (2001). Inorganic Chemistry. Academic Press. ISBN 978-0-12-352651-9.
- ^ a b c d e f Holleman, Arnold F.; Wiberg, Egon; Wiberg, Nils (1985). «Arsen». Lehrbuch der Anorganischen Chemie (in German) (91–100 ed.). Walter de Gruyter. pp. 675–681. ISBN 978-3-11-007511-3.
- ^ Madelung, Otfried (2004). Semiconductors: data handbook. Birkhäuser. pp. 410–. ISBN 978-3-540-40488-0.
- ^ Seidl, Michael; Balázs, Gábor; Scheer, Manfred (22 March 2019). «The Chemistry of Yellow Arsenic». Chemical Reviews. 119 (14): 8406–8434. doi:10.1021/acs.chemrev.8b00713. PMID 30900440. S2CID 85448636.
- ^ Antonatos, Nikolas; Luxa, Jan; Sturala, Jiri; Sofer, Zdeněk (2020). «Black arsenic: a new synthetic method by catalytic crystallization of arsenic glass». Nanoscale. 12 (9): 5397–5401. doi:10.1039/C9NR09627B. PMID 31894222. S2CID 209544160.
- ^ Arsenic Element Facts. chemicool.com
- ^ a b Audi, Georges; Bersillon, Olivier; Blachot, Jean; Wapstra, Aaldert Hendrik (2003), «The NUBASE evaluation of nuclear and decay properties», Nuclear Physics A, 729: 3–128, Bibcode:2003NuPhA.729….3A, doi:10.1016/j.nuclphysa.2003.11.001
- ^ a b c d Greenwood and Earnshaw, pp. 552–4
- ^ Chisholm, Hugh, ed. (1911). «Arsenic» . Encyclopædia Britannica. Vol. 2 (11th ed.). Cambridge University Press. pp. 651–654.
- ^ Uher, Ctirad (2001). «Chapter 5 Skutterudites: Prospective novel thermoelectrics». Recent Trends in Thermoelectric Materials Research I: Skutterudites: Prospective novel thermoelectrics. Semiconductors and Semimetals. Vol. 69. pp. 139–253. doi:10.1016/S0080-8784(01)80151-4. ISBN 978-0-12-752178-7.
- ^ a b Greenwood and Earnshaw, pp. 557–558
- ^ «Fiche toxicologique No. 53: Trihydrure d’arsenic» (PDF). Institut National de Recherche et de Sécurité (in French). 2000. Archived from the original (PDF) on 26 November 2006. Retrieved 6 September 2006.
- ^ a b Greenwood and Earnshaw, pp. 572–578
- ^ «Arsenic: arsenic(II) sulfide compound data». WebElements.com. Archived from the original on 11 December 2007. Retrieved 10 December 2007.
- ^
«Kalgoorlieite». Mindat. Hudson Institute of Mineralogy. 1993–2017. Retrieved 2 September 2017. - ^ Greenwood and Earnshaw, pp. 578–583
- ^ Tanaka, A. (2004). «Toxicity of indium arsenide, gallium arsenide, and aluminium gallium arsenide». Toxicology and Applied Pharmacology. 198 (3): 405–411. doi:10.1016/j.taap.2003.10.019. PMID 15276420.
- ^ Ossicini, Stefano; Pavesi, Lorenzo; Priolo, Francesco (2003). Light Emitting Silicon for Microphotonics. ISBN 978-3-540-40233-6. Retrieved 27 September 2013.
- ^ Din, M. B.; Gould, R. D. (1998). High field conduction mechanism of the evaporated cadmium arsenide thin films. ICSE’98. 1998 IEEE International Conference on Semiconductor Electronics. Proceedings (Cat. No.98EX187). p. 168. doi:10.1109/SMELEC.1998.781173. ISBN 978-0-7803-4971-1. S2CID 110904915.
- ^ Ellison, Hank D. (2007). Handbook of chemical and biological warfare agents. CRC Press. ISBN 978-0-8493-1434-6.
- ^ Girard, James (2010). Principles of Environmental Chemistry. Jones & Bartlett Learning. ISBN 978-0-7637-5939-1.
- ^ Somani, Satu M. (2001). Chemical warfare agents: toxicity at low levels. CRC Press. ISBN 978-0-8493-0872-7.
- ^ Greenwood, p. 584
- ^ Rieuwerts, John (2015). The Elements of Environmental Pollution. London and New York: Earthscan Routledge. p. 145. ISBN 978-0-415-85919-6. OCLC 886492996.
- ^ a b Matschullat, Jörg (2000). «Arsenic in the geosphere – a review». The Science of the Total Environment. 249 (1–3): 297–312. Bibcode:2000ScTEn.249..297M. doi:10.1016/S0048-9697(99)00524-0. PMID 10813460.
- ^ Brooks, William E. «Mineral Commodity Summaries 2007: Arsenic» (PDF). United States Geological Survey. Archived (PDF) from the original on 17 December 2008. Retrieved 25 November 2008.
- ^ a b Edelstein, Daniel L. «Mineral Commodity Summaries 2016: Arsenic» (PDF). United States Geological Survey. Retrieved 1 July 2016.
- ^ a b Brooks, William E. «Minerals Yearbook 2007: Arsenic» (PDF). United States Geological Survey. Archived (PDF) from the original on 17 December 2008. Retrieved 8 November 2008.
- ^ Whelan, J. M.; Struthers, J. D.; Ditzenberger, J. A. (1960). «Separation of Sulfur, Selenium, and Tellurium from Arsenic». Journal of the Electrochemical Society. 107 (12): 982–985. doi:10.1149/1.2427585.
- ^ a b Harper, Douglas. «arsenic». Online Etymology Dictionary. Retrieved 15 May 2010.
- ^ Bentley, Ronald; Chasteen, Thomas G. (2002). «Arsenic Curiosa and Humanity». The Chemical Educator. 7 (2): 51–60. doi:10.1007/s00897020539a. S2CID 6831485.
- ^ Holmyard John Eric (2007). Makers of Chemistry. Read Books. ISBN 978-1-4067-3275-7.
- ^ Vahidnia, A.; Van Der Voet, G. B.; De Wolff, F. A. (2007). «Arsenic neurotoxicity – a review». Human & Experimental Toxicology. 26 (10): 823–832. doi:10.1177/0960327107084539. PMID 18025055. S2CID 24138885.
- ^ Ketha, Hema; Garg, Uttam (1 January 2020), Ketha, Hema; Garg, Uttam (eds.), «Chapter 1 — An introduction to clinical and forensic toxicology», Toxicology Cases for the Clinical and Forensic Laboratory, Academic Press, pp. 3–6, ISBN 978-0-12-815846-3, retrieved 1 May 2022
- ^ Lechtman, H. (1996). «Arsenic Bronze: Dirty Copper or Chosen Alloy? A View from the Americas». Journal of Field Archaeology. 23 (4): 477–514. doi:10.2307/530550. JSTOR 530550.
- ^ Charles, J. A. (1967). «Early Arsenical Bronzes—A Metallurgical View». American Journal of Archaeology. 71 (1): 21–26. doi:10.2307/501586. JSTOR 501586.
- ^ George Sarton, Introduction to the History of Science. «We find in his writings […] preparation of various substances (e.g., basic lead carbonatic, arsenic and antimony from their sulphides).»
- ^ Emsley, John (2001). Nature’s Building Blocks: An A-Z Guide to the Elements. Oxford: Oxford University Press. pp. 43, 513, 529. ISBN 978-0-19-850341-5.
- ^ (Comte), Antoine-François de Fourcroy (1804). A general system of chemical knowledge, and its application to the phenomena of nature and art. pp. 84–.
- ^ Seyferth, Dietmar (2001). «Cadet’s Fuming Arsenical Liquid and the Cacodyl Compounds of Bunsen». Organometallics. 20 (8): 1488–1498. doi:10.1021/om0101947.
- ^ «Display Ad 48 – no Title». The Washington Post (1877–1922). 13 February 1898.
- ^ Turner, Alan (1999). «Viewpoint: the story so far: An overview of developments in UK food regulation and associated advisory committees». British Food Journal. 101 (4): 274–283. doi:10.1108/00070709910272141.
- ^ Hawksley, Lucinda (2016). Bitten by Witch Fever: Wallpaper & Arsenic in the Victorian Home. New York: Thames & Hudson.
- ^ «London purple. (8012-74-6)», Chemical Book
- ^ Lanman, Susan W. (2000). «Colour in the Garden: ‘Malignant Magenta’«. Garden History. 28 (2): 209–221. doi:10.2307/1587270. JSTOR 1587270.
- ^ Holton, E. C. (1926). «Insecticides and Fungicides». Industrial & Engineering Chemistry. 18 (9): 931–933. doi:10.1021/ie50201a018.
- ^ Murphy, E. A.; Aucott, M. (1998). «An assessment of the amounts of arsenical pesticides used historically in a geographical area». Science of the Total Environment. 218 (2–3): 89–101. Bibcode:1998ScTEn.218…89M. doi:10.1016/S0048-9697(98)00180-6.
- ^ Marlatt, C. L. (1897). Important Insecticides: Directions for Their Preparation and Use. U.S. Department of Agriculture. p. 5.
- ^ Kassinger, Ruth (2010). Paradise Under Glass: An Amateur Creates a Conservatory Garden. ISBN 978-0-06-199130-1.
- ^ Rahman, F. A.; Allan, D. L.; Rosen, C. J.; Sadowsky, M. J. (2004). «Arsenic availability from chromated copper arsenate (CCA)-treated wood». Journal of Environmental Quality. 33 (1): 173–180. doi:10.2134/jeq2004.0173. PMID 14964372.
- ^ Lichtfouse, Eric (2004). «Electrodialytical Removal of Cu, Cr and As from Threaded Wood». In Lichtfouse, Eric; Schwarzbauer, Jan; Robert, Didier (eds.). Environmental Chemistry: Green Chemistry and Pollutants in Ecosystems. Berlin: Springer. ISBN 978-3-540-22860-8.
- ^ Mandal, Badal Kumar; Suzuki, K. T. (2002). «Arsenic round the world: a review». Talanta. 58 (1): 201–235. doi:10.1016/S0039-9140(02)00268-0. PMID 18968746.
- ^ Peryea, F. J. (20–26 August 1998). Historical use of lead arsenate insecticides, resulting in soil contamination and implications for soil remediation. 16th World Congress of Soil Science. Montpellier, France. Archived from the original on 7 December 2008.
- ^ «organic arsenicals». EPA.
- ^ «Trace Elements in Soils and Plants, Third Edition». CRC Press. Archived from the original on 21 August 2016. Retrieved 2 August 2016.
- ^ Nachman, Keeve E.; Graham, Jay P.; Price, Lance B.; Silbergeld, Ellen K. (2005). «Arsenic: A Roadblock to Potential Animal Waste Management Solutions». Environmental Health Perspectives. 113 (9): 1123–1124. doi:10.1289/ehp.7834. PMC 1280389. PMID 16140615.
- ^ «Arsenic» (PDF). Agency for Toxic Substances and Disease Registry. Section 5.3, p. 310. Archived (PDF) from the original on 9 October 2022.
- ^ Jones, F. T. (2007). «A Broad View of Arsenic». Poultry Science. 86 (1): 2–14. doi:10.1093/ps/86.1.2. PMID 17179408.
- ^ a b Staff (8 June 2011). «Questions and Answers Regarding 3-Nitro (Roxarsone)». U.S. Food and Drug Administration. Retrieved 21 September 2012.
- ^ Gray, Theodore (2012). «Arsenic». In Gray, Theodore; Mann, Nick (eds.). Elements: A Visual Exploration of Every Known Atom in the Universe. Hachette Books. ISBN 978-1579128951.
- ^ «Phar Lap arsenic claims premature: expert». ABC News. 23 October 2006. Retrieved 14 June 2016.
- ^ Gibaud, Stéphane; Jaouen, Gérard (2010). Arsenic – based drugs: from Fowler’s solution to modern anticancer chemotherapy. Topics in Organometallic Chemistry. Vol. 32. pp. 1–20. Bibcode:2010moc..book….1G. doi:10.1007/978-3-642-13185-1_1. ISBN 978-3-642-13184-4.
- ^ Büscher P, Cecchi G, Jamonneau V, Priotto G (2017). «Human African trypanosomiasis». Lancet. 390 (10110): 2397–2409. doi:10.1016/S0140-6736(17)31510-6. PMID 28673422. S2CID 4853616.
- ^ Huet, P. M.; Guillaume, E.; Cote, J.; Légaré, A.; Lavoie, P.; Viallet, A. (1975). «Noncirrhotic presinusoidal portal hypertension associated with chronic arsenical intoxication». Gastroenterology. 68 (5 Pt 1): 1270–1277. doi:10.1016/S0016-5085(75)80244-7. PMID 1126603.
- ^ Antman, Karen H. (2001). «The History of Arsenic Trioxide in Cancer Therapy». The Oncologist. 6 (Suppl 2): 1–2. doi:10.1634/theoncologist.6-suppl_2-1. PMID 11331433.
- ^ Jennewein, Marc; Lewis, M. A.; Zhao, D.; Tsyganov, E.; Slavine, N.; He, J.; Watkins, L.; Kodibagkar, V. D.; O’Kelly, S.; Kulkarni, P.; Antich, P.; Hermanne, A.; Rösch, F.; Mason, R.; Thorpe, Ph. (2008). «Vascular Imaging of Solid Tumors in Rats with a Radioactive Arsenic-Labeled Antibody that Binds Exposed Phosphatidylserine». Clinical Cancer Research. 14 (5): 1377–1385. doi:10.1158/1078-0432.CCR-07-1516. PMC 3436070. PMID 18316558.
- ^ Subastri, Ariraman; Arun, Viswanathan; Sharma, Preeti; Preedia babu, Ezhuthupurakkal; Suyavaran, Arumugam; Nithyananthan, Subramaniyam; Alshammari, Ghedeir M.; Aristatile, Balakrishnan; Dharuman, Venkataraman; Thirunavukkarasu, Chinnasamy (1 November 2018). «Synthesis and characterisation of arsenic nanoparticles and its interaction with DNA and cytotoxic potential on breast cancer cells». Chemico-Biological Interactions. Nanotechnology, Biology and Toxicology. 295: 73–83. doi:10.1016/j.cbi.2017.12.025. ISSN 0009-2797. PMID 29277637. S2CID 1816043.
- ^ Haller, John S. Jr. (1 July 1975). Richert, Lucas; Bond, Gregory; Bouras-Vallianatos, Petros; O’Donnell, Kelly; Virdi, Jaipreet; Bian, He (eds.). «Therapeutic Mule: The Use of Arsenic in the Nineteenth Century Materia Medica». Pharmacy in History. Madison, Wisconsin, United States of America: American Institute of the History of Pharmacy (AIHP). 17 (3): 87–100. ISSN 0031-7047. JSTOR 41108920. OCLC 263600090. PMID 11610136. Archived from the original on 19 March 2021. Retrieved 29 June 2021 – via JSTOR.
- ^ Parascandola, John (2011). «5. What Kills Can Cure: Arsenic in Medicine». King of Poisons: A History of Arsenic. Lincoln, Nebraska, United States of America: University of Nebraska Press. pp. 145–172. ISBN 9781597978095. OCLC 817901966 – via Project MUSE.
- ^ Cope, Rhian; et al. (design by Greg Harris) (2017). «Chapter 15 – Metalloids». In Dalefield, Rosalind; Tenney, Sara; Kruze, Zoe; McLaughlin, Molly; Wortley, Chris (eds.). Veterinary Toxicology for Australia and New Zealand. Amsterdam, Netherlands/Masterton, New Zealand: Elsevier. pp. 255–277. ISBN 978-0-12-420227-6 – via ScienceDirect.
- ^ Bagshaw, N. E. (1995). «Lead alloys: Past, present and future». Journal of Power Sources. 53 (1): 25–30. Bibcode:1995JPS….53…25B. doi:10.1016/0378-7753(94)01973-Y.
- ^ Joseph, Günter; Kundig, Konrad J. A; Association, International Copper (1999). «Dealloying». Copper: Its Trade, Manufacture, Use, and Environmental Status. pp. 123–124. ISBN 978-0-87170-656-0.
- ^ Nayar (1997). The Metals Databook. p. 6. ISBN 978-0-07-462300-8.
- ^ «Blister Agents». Code Red – Weapons of Mass Destruction. Retrieved 15 May 2010.
- ^ Westing, Arthur H. (1972). «Herbicides in war: Current status and future doubt». Biological Conservation. 4 (5): 322–327. doi:10.1016/0006-3207(72)90043-2.
- ^ Westing, Arthur H. (1971). «Forestry and the War in South Vietnam». Journal of Forestry. 69: 777–783.
- ^ Timbrell, John (2005). «Butter Yellow and Scheele’s Green». The Poison Paradox: Chemicals as Friends and Foes. Oxford University Press. ISBN 978-0-19-280495-2.
- ^ Cross, J. D.; Dale, I. M.; Leslie, A. C. D.; Smith, H. (1979). «Industrial exposure to arsenic». Journal of Radioanalytical Chemistry. 48 (1–2): 197–208. doi:10.1007/BF02519786. S2CID 93714157.
- ^ Guruswamy, Sivaraman (1999). «XIV. Ammunition». Engineering Properties and Applications of Lead Alloys. CRC Press. pp. 569–570. ISBN 978-0-8247-8247-4.
- ^ Davis, Joseph R; Handbook Committee, ASM International (2001). «Dealloying». Copper and copper alloys. p. 390. ISBN 978-0-87170-726-0.
- ^ Christine Quigley, Modern Mummies: The Preservation of the Human Body in the Twentieth Century, p 6.
- ^ Parmelee, Cullen W. (1947). Ceramic Glazes (3rd ed.). Boston: Cahners Books. p. 61.
- ^ «Arsenic Supply Demand and the Environment». Pollution technology review 214: Mercury and arsenic wastes: removal, recovery, treatment, and disposal. William Andrew. 1993. p. 68. ISBN 978-0-8155-1326-1.
- ^ Ungers, L. J.; Jones, J. H.; McIntyre, A. J.; McHenry, C. R. (August 1985). «Release of arsenic from semiconductor wafers». American Industrial Hygiene Association Journal. 46 (8): 416–420. doi:10.1080/15298668591395094. ISSN 0002-8894. PMID 4050678.
- ^ Stolz, John F.; Basu, Partha; Santini, Joanne M.; Oremland, Ronald S. (2006). «Arsenic and Selenium in Microbial Metabolism». Annual Review of Microbiology. 60: 107–130. doi:10.1146/annurev.micro.60.080805.142053. PMID 16704340. S2CID 2575554.
- ^ Mukhopadhyay, Rita; Rosen, Barry P.; Phung, Le T.; Silver, Simon (2002). «Microbial arsenic: From geocycles to genes and enzymes». FEMS Microbiology Reviews. 26 (3): 311–325. doi:10.1111/j.1574-6976.2002.tb00617.x. PMID 12165430.
- ^ Kulp, T. R; Hoeft, S. E.; Asao, M.; Madigan, M. T.; Hollibaugh, J. T.; Fisher, J. C.; Stolz, J. F.; Culbertson, C. W.; Miller, L. G.; Oremland, R. S. (2008). «Arsenic(III) fuels anoxygenic photosynthesis in hot spring biofilms from Mono Lake, California». Science. 321 (5891): 967–970. Bibcode:2008Sci…321..967K. doi:10.1126/science.1160799. PMID 18703741. S2CID 39479754.
- Fred Campbell (11 August 2008). «Arsenic-loving bacteria rewrite photosynthesis rules». Chemistry World.
- ^ Wolfe-Simon, F.; Blum, J. S.; Kulp, T. R.; Gordon, G. W.; Hoeft, S. E.; Pett-Ridge, J.; Stolz, J. F.; Webb, S. M.; Weber, P. K. (3 June 2011). «A Bacterium That Can Grow by Using Arsenic Instead of Phosphorus» (PDF). Science. 332 (6034): 1163–1166. Bibcode:2011Sci…332.1163W. doi:10.1126/science.1197258. PMID 21127214. S2CID 51834091. Archived (PDF) from the original on 9 October 2022.
- ^ Erb, T. J.; Kiefer, P.; Hattendorf, B.; Günther, D.; Vorholt, J. A. (2012). «GFAJ-1 is an Arsenate-Resistant, Phosphate-Dependent Organism». Science. 337 (6093): 467–470. Bibcode:2012Sci…337..467E. doi:10.1126/science.1218455. PMID 22773139. S2CID 20229329.
- ^ Reaves, M. L.; Sinha, S.; Rabinowitz, J. D.; Kruglyak, L.; Redfield, R. J. (2012). «Absence of Detectable Arsenate in DNA from Arsenate-Grown GFAJ-1 Cells». Science. 337 (6093): 470–473. arXiv:1201.6643. Bibcode:2012Sci…337..470R. doi:10.1126/science.1219861. PMC 3845625. PMID 22773140.
- ^ Baloš, M. Živkov; Jakšić, S.; Pelić, D. Ljubojević (September 2019). «The role, importance and toxicity of arsenic in poultry nutrition». World’s Poultry Science Journal. 75 (3): 375–386. doi:10.1017/S0043933919000394. ISSN 0043-9339.
- ^ Anke M. (1986) «Arsenic», pp. 347–372 in Mertz W. (ed.), Trace elements in human and Animal Nutrition, 5th ed. Orlando, FL: Academic Press
- ^ Uthus E.O. (1992). «Evidency for arsenical essentiality». Environ Geochem Health. 14 (2): 55–58. doi:10.1007/BF01783629. PMID 24197927. S2CID 22882255.
- ^ Uthus E.O. (1994) «Arsenic essentiality and factors affecting its importance», pp. 199–208 in Chappell W.R, Abernathy C.O, Cothern C.R. (eds.) Arsenic Exposure and Health. Northwood, UK: Science and Technology Letters.
- ^ Baccarelli, A.; Bollati, V. (2009). «Epigenetics and environmental chemicals». Current Opinion in Pediatrics. 21 (2): 243–251. doi:10.1097/MOP.0b013e32832925cc. PMC 3035853. PMID 19663042.
- ^ Nicholis, I.; Curis, E.; Deschamps, P.; Bénazeth, S. (2009). «Arsenite medicinal use, metabolism, pharmacokinetics and monitoring in human hair». Biochimie. 91 (10): 1260–1267. doi:10.1016/j.biochi.2009.06.003. PMID 19527769.
- ^ Lombi, E.; Zhao, F.-J.; Fuhrmann, M.; Ma, L. Q.; McGrath, S. P. (2002). «Arsenic Distribution and Speciation in the Fronds of the Hyperaccumulator Pteris vittata». New Phytologist. 156 (2): 195–203. doi:10.1046/j.1469-8137.2002.00512.x. JSTOR 1514012. PMID 33873285.
- ^ Sakurai, Teruaki Sakurai (2003). «Biomethylation of Arsenic is Essentially Detoxicating Event». Journal of Health Science. 49 (3): 171–178. doi:10.1248/jhs.49.171.
- ^ Reimer, K. J.; Koch, I.; Cullen, W.R. (2010). Organoarsenicals. Distribution and transformation in the environment. Metal Ions in Life Sciences. Vol. 7. pp. 165–229. doi:10.1039/9781849730822-00165. ISBN 978-1-84755-177-1. PMID 20877808.
- ^ Bentley, Ronald; Chasteen, T. G. (2002). «Microbial Methylation of Metalloids: Arsenic, Antimony, and Bismuth». Microbiology and Molecular Biology Reviews. 66 (2): 250–271. doi:10.1128/MMBR.66.2.250-271.2002. PMC 120786. PMID 12040126.
- ^ Cullen, William R.; Reimer, Kenneth J. (1989). «Arsenic speciation in the environment». Chemical Reviews. 89 (4): 713–764. doi:10.1021/cr00094a002. hdl:10214/2162.
- ^ «Case Studies in Environmental Medicine (CSEM) Arsenic Toxicity Exposure Pathways» (PDF). Agency for Toxic Substances & Disease Registry. Retrieved 15 May 2010.
- ^ «Arsenic in Food: FAQ». 5 December 2011. Retrieved 11 April 2010.
- ^ a b c Arsenic. The Agency for Toxic Substances and Disease Registry (2009).
- ^ Archived at Ghostarchive and the Wayback Machine: «How Victorians Were Poisoned By Their Own Homes | Hidden Killers | Absolute Victory». YouTube.
- ^ Meharg, Andrew (2005). Venomous Earth – How Arsenic Caused The World’s Worst Mass Poisoning. Macmillan Science. ISBN 978-1-4039-4499-3.
- ^ Henke, Kevin R. (28 April 2009). Arsenic: Environmental Chemistry, Health Threats and Waste Treatment. p. 317. ISBN 978-0-470-02758-5.
- ^ Lamm, S. H.; Engel, A.; Penn, C. A.; Chen, R.; Feinleib, M. (2006). «Arsenic cancer risk confounder in southwest Taiwan data set». Environ. Health Perspect. 114 (7): 1077–1082. doi:10.1289/ehp.8704. PMC 1513326. PMID 16835062.
- ^ Kohnhorst, Andrew (2005). «Arsenic in Groundwater in Selected Countries in South and Southeast Asia: A Review». J Trop Med Parasitol. 28: 73. Archived from the original on 10 January 2014.
- ^ «Arsenic in drinking water threatens up to 60 million in Pakistan». Science | AAAS. 23 August 2017. Retrieved 11 September 2017.
- ^ a b Xia, Yajuan; Wade, Timothy; Wu, Kegong; Li, Yanhong; Ning, Zhixiong; Le, X Chris; He, Xingzhou; Chen, Binfei; Feng, Yong; Mumford, Judy (9 March 2009). «Well Water Arsenic Exposure, Arsenic Induced Skin-Lesions and Self-Reported Morbidity in Inner Mongolia». International Journal of Environmental Research and Public Health. 6 (3): 1010–1025. doi:10.3390/ijerph6031010. PMC 2672384. PMID 19440430.
- ^ Lall, Upmanu; Josset, Laureline; Russo, Tess (17 October 2020). «A Snapshot of the World’s Groundwater Challenges». Annual Review of Environment and Resources. 45 (1): 171–194. doi:10.1146/annurev-environ-102017-025800. ISSN 1543-5938.
- ^ «Arsenic in Drinking Water: 3. Occurrence in U.S. Waters» (PDF). Archived from the original (PDF) on 7 January 2010. Retrieved 15 May 2010.
- ^ Welch, Alan H.; Westjohn, D. B.; Helsel, Dennis R.; Wanty, Richard B. (2000). «Arsenic in Ground Water of the United States: Occurrence and Geochemistry». Ground Water. 38 (4): 589–604. doi:10.1111/j.1745-6584.2000.tb00251.x. S2CID 129409319.
- ^ Knobeloch, L. M.; Zierold, K. M.; Anderson, H. A. (2006). «Association of arsenic-contaminated drinking-water with prevalence of skin cancer in Wisconsin’s Fox River Valley». J. Health Popul Nutr. 24 (2): 206–213. hdl:1807/50099. PMID 17195561.
- ^ «In Small Doses:Arsenic». The Dartmouth Toxic Metals Superfund Research Program. Dartmouth College.
- ^ Courtney, D.; Ely, Kenneth H.; Enelow, Richard I.; Hamilton, Joshua W. (2009). «Low Dose Arsenic Compromises the Immune Response to Influenza A Infection in vivo». Environmental Health Perspectives. 117 (9): 1441–1447. doi:10.1289/ehp.0900911. PMC 2737023. PMID 19750111.
- ^ Klassen, R. A.; Douma, S. L.; Ford, A.; Rencz, A.; Grunsky, E. (2009). «Geoscience modeling of relative variation in natural arsenic hazard in potential in New Brunswick» (PDF). Geological Survey of Canada. Archived from the original (PDF) on 2 May 2013. Retrieved 14 October 2012.
- ^ Ferreccio, C.; Sancha, A. M. (2006). «Arsenic exposure and its impact on health in Chile». J Health Popul Nutr. 24 (2): 164–175. hdl:1807/50095. PMID 17195557.
- ^ Talhout, Reinskje; Schulz, Thomas; Florek, Ewa; Van Benthem, Jan; Wester, Piet; Opperhuizen, Antoon (2011). «Hazardous Compounds in Tobacco Smoke». International Journal of Environmental Research and Public Health. 8 (12): 613–628. doi:10.3390/ijerph8020613. PMC 3084482. PMID 21556207.
- ^ Chu, H. A.; Crawford-Brown, D. J. (2006). «Inorganic arsenic in drinking water and bladder cancer: a meta-analysis for dose-response assessment». Int. J. Environ. Res. Public Health. 3 (4): 316–322. doi:10.3390/ijerph2006030039. PMID 17159272.
- ^ «Arsenic in drinking water seen as threat – USATODAY.com». USA Today. 30 August 2007. Retrieved 1 January 2008.
- ^ Gulledge, John H.; O’Connor, John T. (1973). «Removal of Arsenic (V) from Water by Adsorption on Aluminum and Ferric Hydroxides». J. American Water Works Assn. 65 (8): 548–552. doi:10.1002/j.1551-8833.1973.tb01893.x.
- ^ O’Connor, J. T.; O’Connor, T. L. «Arsenic in Drinking Water: 4. Removal Methods» (PDF). Archived from the original (PDF) on 7 January 2010.
- ^ «In situ arsenic treatment». insituarsenic.org. Retrieved 13 May 2010.
- ^ Radloff, K. A.; Zheng, Y.; Michael, H. A.; Stute, M.; Bostick, B. C.; Mihajlov, I.; Bounds, M.; Huq, M. R.; Choudhury, I.; Rahman, M.; Schlosser, P.; Ahmed, K.; Van Geen, A. (2011). «Arsenic migration to deep groundwater in Bangladesh influenced by adsorption and water demand». Nature Geoscience. 4 (11): 793–798. Bibcode:2011NatGe…4..793R. doi:10.1038/ngeo1283. PMC 3269239. PMID 22308168.
- ^ Yavuz, Cafer T.; Mayo, J. T.; Yu, W. W.; Prakash, A.; Falkner, J. C.; Yean, S.; Cong, L.; Shipley, H. J.; Kan, A.; Tomson, M.; Natelson, D.; Colvin, V. L. (2005). «Low-Field Magnetic Separation of Monodisperse Fe3O4 Nanocrystals». Science. 314 (5801): 964–967. doi:10.1126/science.1131475. PMID 17095696. S2CID 23522459.
- ^ Meliker, J. R.; Wahl, R. L.; Cameron, L. L.; Nriagu, J. O. (2007). «Arsenic in drinking water and cerebrovascular disease, diabetes mellitus, and kidney disease in Michigan: A standardized mortality ratio analysis». Environmental Health. 6: 4. doi:10.1186/1476-069X-6-4. PMC 1797014. PMID 17274811.
- ^ Tseng, Chin-Hsiao; Tai, Tong-Yuan; Chong, Choon-Khim; Tseng, Ching-Ping; Lai, Mei-Shu; Lin, Boniface J.; Chiou, Hung-Yi; Hsueh, Yu-Mei; Hsu, Kuang-Hung; Chen, C. J. (2000). «Long-Term Arsenic Exposure and Incidence of Non-Insulin-Dependent Diabetes Mellitus: A Cohort Study in Arseniasis-Hyperendemic Villages in Taiwan». Environmental Health Perspectives. 108 (9): 847–851. doi:10.1289/ehp.00108847. PMC 2556925. PMID 11017889.
- ^ Newspaper article Archived 17 April 2012 at the Wayback Machine (in Hungarian) published by Magyar Nemzet on 15 April 2012.
- ^ Goering, P.; Aposhian, H. V.; Mass, M. J.; Cebrián, M.; Beck, B. D.; Waalkes, M. P. (1 May 1999). Peters, Jeffre M.; Campen, Matthew; Willett, Kristie; Hawkins, Virginia M.; States, J. Christopher; Miller, Gary W. (eds.). «The enigma of arsenic carcinogenesis: Role of metabolism» (PDF). Toxicological Sciences. 49 (1): 5–14. doi:10.1093/toxsci/49.1.5. ISSN 1096-0929. LCCN 98660653. OCLC 37825607. PMID 10367337. Archived from the original (PDF) on 27 July 2018. Retrieved 29 June 2021.
- ^ Hopenhayn-Rich, C.; Biggs, M. L.; Smith, Allan H.; Kalman, D. A.; Moore, Lee E. (1996). Kaufman, Joel D.; Boyd, Windy A.; Callahan, Catherine L.; Schroeder, Jane C.; Warren, Julia Boyle; Woolard, Susan Booker (eds.). «Methylation study of a population environmentally exposed to arsenic in drinking water». Environmental Health Perspectives. 104 (6): 620–628. doi:10.1289/ehp.96104620. ISSN 1552-9924. LCCN 76642723. OCLC 01727134. PMC 1469390. PMID 8793350.
- ^ Smith, Allan H.; Arroyo, Alex P.; Mazumder, Guha; Kosnett, Michael J.; Hernandez, Alexandra L.; Beeris, Martin; Smith, Meera M.; Moore, Lee E. (26 May 2000). Kaufman, Joel D.; Boyd, Windy A.; Callahan, Catherine L.; Schroeder, Jane C.; Warren, Julia Boyle; Woolard, Susan Booker (eds.). «Arsenic-induced skin lesions among Atacameño people in Northern Chile despite good nutrition and centuries of exposure» (PDF). Environmental Health Perspectives. 108 (7): 617–620. doi:10.1289/ehp.00108617. ISSN 1552-9924. LCCN 76642723. OCLC 01727134. PMC 1638201. PMID 10903614. Archived from the original (PDF) on 12 September 2015. Retrieved 29 June 2021.
- ^ Eawag (2015) Geogenic Contamination Handbook – Addressing Arsenic and Fluoride in Drinking Water. C.A. Johnson, A. Bretzler (Eds.), Swiss Federal Institute of Aquatic Science and Technology (Eawag), Duebendorf, Switzerland. (download: www.eawag.ch/en/research/humanwelfare/drinkingwater/wrq/geogenic-contamination-handbook/)
- ^ Amini, M.; Abbaspour, K.C.; Berg, M.; Winkel, L.; Hug, S.J.; Hoehn, E.; Yang, H.; Johnson, C.A. (2008). «Statistical modeling of global geogenic arsenic contamination in groundwater». Environmental Science and Technology. 42 (10): 3669–3675. Bibcode:2008EnST…42.3669A. doi:10.1021/es702859e. PMID 18546706.
- ^ Winkel, L.; Berg, M.; Amini, M.; Hug, S.J.; Johnson, C.A. (2008). «Predicting groundwater arsenic contamination in Southeast Asia from surface parameters». Nature Geoscience. 1 (8): 536–542. Bibcode:2008NatGe…1..536W. doi:10.1038/ngeo254.
- ^ Smedley, P. L. (2002). «A review of the source, behaviour and distribution of arsenic in natural waters» (PDF). Applied Geochemistry. 17 (5): 517–568. Bibcode:2002ApGC…17..517S. doi:10.1016/S0883-2927(02)00018-5. S2CID 55596829. Archived (PDF) from the original on 9 October 2022.
- ^ How Does Arsenic Get into the Groundwater. Civil and Environmental Engineering. University of Maine
- ^ Zeng Zhaohua, Zhang Zhiliang (2002). «The formation of As element in groundwater and the controlling factor». Shanghai Geology 87 (3): 11–15.
- ^ Zheng, Y; Stute, M; Van Geen, A; Gavrieli, I; Dhar, R; Simpson, H.J; Schlosser, P; Ahmed, K.M (2004). «Redox control of arsenic mobilization in Bangladesh groundwater». Applied Geochemistry. 19 (2): 201–214. Bibcode:2004ApGC…19..201Z. doi:10.1016/j.apgeochem.2003.09.007.
- ^ Thomas, Mary Ann (2007). «The Association of Arsenic With Redox Conditions, Depth, and Ground-Water Age in the Glacial Aquifer System of the Northern United States». U.S. Geological Survey, Virginia. pp. 1–18.
- ^ Bin, Hong (2006). «Influence of microbes on biogeochemistry of arsenic mechanism of arsenic mobilization in groundwater». Advances in Earth Science. 21 (1): 77–82.
- ^ Johnson, D. L; Pilson, M. E. Q (1975). «The oxidation of arsenite in seawater». Environmental Letters. 8 (2): 157–171. doi:10.1080/00139307509437429. PMID 236901.
- ^ Cherry, J. A. (1979). «Arsenic species as an indicator of redox conditions in groundwater». Contemporary Hydrogeology — the George Burke Maxey Memorial Volume. Developments in Water Science. Vol. 12. pp. 373–392. doi:10.1016/S0167-5648(09)70027-9. ISBN 9780444418487.
- ^ Cullen, William R; Reimer, Kenneth J (1989). «Arsenic speciation in the environment». Chemical Reviews. 89 (4): 713–764. doi:10.1021/cr00094a002. hdl:10214/2162.
- ^ Oremland, Ronald S. (2000). «Bacterial dissimilatory reduction of arsenate and sulfate in meromictic Mono Lake, California». Geochimica et Cosmochimica Acta. 64 (18): 3073–3084. Bibcode:2000GeCoA..64.3073O. doi:10.1016/S0016-7037(00)00422-1.
- ^ Reese, Robert G. Jr. «Commodity Summaries 2002: Arsenic» (PDF). United States Geological Survey. Archived (PDF) from the original on 17 December 2008. Retrieved 8 November 2008.
- ^ «Chromated Copper Arsenate (CCA)». US Environmental Protection Agency. 16 January 2014. Retrieved 15 October 2018.
- ^ «Is CCA treated pine Safe?». www.softwoods.com.au. 26 October 2010. Retrieved 24 February 2017.
- ^ Townsend, Timothy G.; Solo-Gabriele, Helena (2006). Environmental Impacts of Treated Wood. CRC Press. ISBN 9781420006216.
- ^ Saxe, Jennifer K.; Wannamaker, Eric J.; Conklin, Scott W.; Shupe, Todd F.; Beck, Barbara D. (1 January 2007). «Evaluating landfill disposal of chromated copper arsenate (CCA) treated wood and potential effects on groundwater: evidence from Florida». Chemosphere. 66 (3): 496–504. Bibcode:2007Chmsp..66..496S. doi:10.1016/j.chemosphere.2006.05.063. PMID 16870233.
- ^ BuildingOnline. «CCA Treated Wood Disposal | Wood Preservative Science Council | Objective, Sound, Scientific Analysis of CCA». www.woodpreservativescience.org. Retrieved 16 June 2016.
- ^ «TRI Releases Map». Toxmap.nlm.nih.gov. Archived from the original on 20 March 2010. Retrieved 23 March 2010.
- ^ TOXNET – Databases on toxicology, hazardous chemicals, environmental health, and toxic releases. Toxnet.nlm.nih.gov. Retrieved 2011-10-24.
- ^ Jain, C. K.; Singh, R. D. (2012). «Technological options for the removal of arsenic with special reference to South East Asia». Journal of Environmental Management. 107: 1–8. doi:10.1016/j.jenvman.2012.04.016. PMID 22579769.
- ^ Goering, P. (2013). «Bioremediation of arsenic-contaminated water: recent advances and future prospects». Water, Air, & Soil Pollution. 224 (12): 1722. Bibcode:2013WASP..224.1722B. doi:10.1007/s11270-013-1722-y. S2CID 97563539.
- ^ Goering, P. (2015). «Anaerobic arsenite oxidation with an electrode serving as the sole electron acceptor: A novel approach to the bioremediation of arsenic-polluted groundwater». Journal of Hazardous Materials. 283: 617–622. doi:10.1016/j.jhazmat.2014.10.014. hdl:10256/11522. PMID 25464303.
- ^ «Arsenic». Sigma Aldrich. Retrieved 21 December 2021.
- ^ «GENERAL TESTS, PROCESSES AND APPARATUS» (PDF). pmda.go.jp. Retrieved 11 October 2022.
{{cite web}}: CS1 maint: url-status (link) - ^ Arsenic Rule. U.S. Environmental Protection Agency. Adopted 22 January 2001; effective 23 January 2006.
- ^ a b c «Supporting Document for Action Level for Arsenic in Apple Juice». Fda.gov. Retrieved 21 August 2013.
- ^ «A Homeowner’s Guide to Arsenic in Drinking Water». New Jersey Department of Environmental Protection. Retrieved 21 August 2013.
- ^ NIOSH Pocket Guide to Chemical Hazards. «#0038». National Institute for Occupational Safety and Health (NIOSH).
- ^ NIOSH Pocket Guide to Chemical Hazards. «#0039». National Institute for Occupational Safety and Health (NIOSH).
- ^ Total Diet Study and Toxic Elements Program
- ^ Kotz, Deborah (14 September 2011). «Does apple juice have unsafe levels of arsenic? – The Boston Globe». Boston.com. Retrieved 21 August 2013.
- ^ Morran, Chris (30 November 2011). «Consumer Reports Study Finds High Levels of Arsenic & Lead in Some Fruit Juice». consumerist.com.
- ^ «Arsenic contamination of Bangladeshi paddy field soils: Implications for rice contribution to arsenic consumption». Nature. 22 November 2002. doi:10.1038/news021118-11. Retrieved 21 August 2013.
- ^ «Tainted wells pour arsenic onto food crops». New Scientist. 6 December 2002. Retrieved 21 August 2013.
- ^ Peplow, Mark (2 August 2005). «US rice may carry an arsenic burden». Nature News. doi:10.1038/news050801-5.
- ^ «Rice as a source of arsenic exposure».
- ^ Davis, Matthew A.; MacKenzie, Todd A.; Cottingham, Kathryn L.; Gilbert-Diamond, Diane; Punshon, Tracy; Karagas, Margaret R. (2012). «Rice Consumption and Urinary Arsenic Concentrations in U.S. Children». Environmental Health Perspectives. 120 (10): 1418–1424. doi:10.1289/ehp.1205014. PMC 3491944. PMID 23008276.
- ^ «High Levels of Arsenic Found in Rice». NPR.org. 2 March 2012. Retrieved 21 August 2013.
- ^ a b c «Arsenic in Your Food | Consumer Reports Investigation». Consumer Reports. 1 November 2012. Retrieved 21 August 2013.
- ^ Lawmakers Urge FDA to Act on Arsenic Standards. Foodsafetynews.com (24 February 2012). Retrieved 2012-05-23.
- ^ «FDA Looks for Answers on Arsenic in Rice». Fda.gov. 19 September 2012. Retrieved 21 August 2013.
- ^ «Arsenic in Rice». Fda.gov. Retrieved 21 August 2013.
- ^ «Questions & Answers: FDA’s Analysis of Arsenic in Rice and Rice Products». Fda.gov. 21 March 2013. Retrieved 21 August 2013.
- ^ a b «Arsenic in Rice: What You Need to Know». UC Berkeley Wellness. Retrieved 3 September 2014.
- ^ a b Menon, Manoj; Dong, Wanrong; Chen, Xumin; Hufton, Joseph; Rhodes, Edward J. (29 October 2020). «Improved rice cooking approach to maximise arsenic removal while preserving nutrient elements». Science of the Total Environment. 755 (Pt 2): 143341. doi:10.1016/j.scitotenv.2020.143341. ISSN 0048-9697. PMID 33153748.
- ^ «New way of cooking rice removes arsenic and retains mineral nutrients, study shows». phys.org. Retrieved 10 November 2020.
- ^ «How much arsenic is in your rice? Consumer Reports’ new data and guidelines are important for everyone but especially for gluten avoiders». consumerreports.org. Retrieved 15 February 2022.
- ^ «Arsenic». RTECS. National Institute for Occupational Safety and Health (NIOSH). 28 March 2018.
- ^ Korea Occupational Safety & Health Agency Archived 23 January 2017 at the Wayback Machine. kosha.or.kr
- ^ KOSHA GUIDE H-120-2013. naver.com
- ^ Gaion A, Sartori D, Scuderi A, Fattorini D (2014). «Bioaccumulation and biotransformation of arsenic compounds in Hediste diversicolor (Muller 1776) after exposure to spiked sediments». Environmental Science and Pollution Research. 21 (9): 5952–5959. doi:10.1007/s11356-014-2538-z. PMID 24458939. S2CID 12568097.
- ^ a b Hughes, Michael F. (2002). «Arsenic toxicity and potential mechanisms of action». Toxicology Letters. 133 (1): 1–16. doi:10.1016/S0378-4274(02)00084-X. PMID 12076506.
- ^ «OSHA Arsenic». United States Occupational Safety and Health Administration. Archived from the original on 12 October 2007. Retrieved 8 October 2007.
- ^ Croal, Laura R.; Gralnick, Jeffrey A.; Malasarn, Davin; Newman, Dianne K. (2004). «The Genetics of Geochemisty». Annual Review of Genetics. 38: 175–206. doi:10.1146/annurev.genet.38.072902.091138. PMID 15568975.
- ^ Giannini, A. James; Black, Henry Richard; Goettsche, Roger L. (1978). The Psychiatric, Psychogenic and Somatopsychic Disorders Handbook. New Hyde Park, NY: Medical Examination Publishing Co. pp. 81–82. ISBN 978-0-87488-596-5.
- ^ The Tox Guide for Arsenic (2007). The US Agency for Toxic Substances and Disease Registry.
Bibliography[edit]
- Emsley, John (2011). «Arsenic». Nature’s Building Blocks: An A–Z Guide to the Elements. Oxford, England: Oxford University Press. pp. 47–55. ISBN 978-0-19-960563-7.
- Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- Rieuwerts, John (2015). The Elements of Environmental Pollution. Abingdon and New York: Routledge. ISBN 978-0-41-585920-2.
Further reading[edit]
- Whorton, James G. (2011). The Arsenic Century. Oxford University Press. ISBN 978-0-19-960599-6.
External links[edit]
Wikimedia Commons has media related to Arsenic.
Look up arsenic in Wiktionary, the free dictionary.
- Arsenic Cancer Causing Substances, U.S. National Cancer Institute.
- CTD’s Arsenic page and CTD’s Arsenicals page from the Comparative Toxicogenomics Database
- Arsenic intoxication: general aspects and chelating agents, by Geir Bjørklund, Massimiliano Peana et al. Archives of Toxicology (2020) 94:1879–1897.
- A Small Dose of Toxicology
- Arsenic in groundwater Book on arsenic in groundwater by IAH’s Netherlands Chapter and the Netherlands Hydrological Society
- Contaminant Focus: Arsenic by the EPA.
- Environmental Health Criteria for Arsenic and Arsenic Compounds, 2001 by the WHO.
- Kapaj, Simon; Peterson, Hans; Liber, Karsten; Bhattacharya, Prosun (2006). «Human Health Effects from Chronic Arsenic Poisoning–A Review». Journal of Environmental Science and Health, Part A. 41 (10): 2399–2428. doi:10.1080/10934520600873571. PMID 17018421. S2CID 4659770.
- National Institute for Occupational Safety and Health – Arsenic Page
- Arsenic at The Periodic Table of Videos (University of Nottingham)
Мышьяк — 33-й элемент таблицы Менделеева, относящийся к пниктогенам и располагающийся под фосфором в периодической системе. Его название в химических соединениях читается как арсеникум.
Внимание! Вся информация, присутствующая в данной статье, приведена только в научных целях для ознакомления с химическими свойствами элемента мышьяка. Все химические реакции с соединениями мышьяка требуют специально оборудованных лабораторий и лицензии на работу с сильнодействующими отравляющими веществами. Нельзя воспроизводить данные реакции без соответствующих разрешений.
Геохимия
Аурипигмент Эритрин Реальгар
В природе мышьяк встречается в виде минералов, в первую очередь — сульфидов: аурипигмента (ce{As2S3}) и реальгара (ce{As4S4}). Часто они встречаются вместе, причём аурипигмент имеет жёлтый цвет (поэтому название имеет корень aur, как и в слове aurum — золото), а реальгар — красный. Также известны менее распространённые минералы: кобальтин (ce{CoAsS}), эритрина (ce{Co3(AsO4)2}), герсдорфита и других.
Мышьяк — халькофильный элемент, и поэтому его соединения с халькогенами (в первую очередь серой и кислородом: сульфид и оксид) являются очень прочными.
Поэтому для получения мышьяка сначала производят обжиг сульфидных руд, в процессе чего образуется «дым» из оксида мышьяка(III):
$$ce{2As_2S_3 + 9O_2 -> 2As_2O_3 + 6SO_2 ^}$$
И потом восстанавливают оксид с помощью углерода:
$$ce{As_2O_3 + 3C -> 2As + 3CO ^}$$
Аллотропия
Мышьяк существует в нескольких аллотропных модификациях: черный мышьяк («металлический»), желтый (аналог белого фосфора (ce{As4})) и серый.
Применение
Все соединения мышьяка очень токсичны, поэтому ранее их применяли как очень сильный и незаметный яд: в первую очередь в таких целях применялся оксид мышьяка(III). Именно по причине своей чрезвычайной опасности для здоровья мышьяк в заметных, хотя и очень небольших количествах сейчас встретить можно в электронике, где его высокочистые соединения используются как полупроводниковые материалы.
В очень малых дозах мышьяк иногда используют в медицине (например, для умерщвления зубов, «мышьяк для зубов«).
Помимо этого, его соединения добавляют в стёкла для повышения их твердости.
Химические свойства
Химические свойства мышьяка очень схожи с другими элементами 15 группы таблицы Менделеева — группы пниктогенов, которые, однако, имеют свои особенности. Мышьяк является полуметаллом — то есть сочетает в себе как свойства металла, так и неметалла, и имеет как металлические аллотропные модификации (см. выше про аллотропию), так и модификации молекулярного строения.
Как неметалл, мышьяк не реагирует с разбавленными кислотами-неокислителями (теми кислотами, которые окисляют в растворе только за счёт катионов (ce{H^+})), например, с растворами соляной (ce{HCl}) и серной (ce{H2SO4}) кислот.
Серная кислота в концентрированном состоянии может окислять мышьяк до его самого устойчивого оксида — оксида мышьяка(III):
$$ce{4As + 6H_2SO_4 -> 2As_2O_3 + 6SO_2 ^ + 6H_2O}$$
Разбавленная азотная кислота с мышьяком образует мышьяковистую кислоту, представляющую из себя соединение сложного состава, которое можно условно назвать гидратом оксида мышьяка(III) и записать в форме (ce{H3AsO3}) или (ce{As2O3 * nH2O}):
$$ce{As + HNO_3 + H_2O -> H_3AsO_3 v + NO ^}$$
Концентрированная азотная кислота — сильный окислитель — окисляет мышьяк до высшей степени окисления +5:
$$ce{3As + 5HNO_3 + 2H_2O -> 3H_3AsO_4 + 5NO ^}$$
При этом образуется высшая кислота (ce{H3AsO4}) — мышьяковая.
С щелочами мышьяк сам по себе не взаимодействует, но в присутствии окислителя реакция идёт с образованием соли — метаарсената:
$$ce{8As + 3KOH + 5KNO_3 + 6H_2O -> 8KAsO_3 + 5NH_3 ^}$$
Мышьяк может растворяться и в водном растворе гипохлорита натрия:
$$ce{2As + 5NaClO + 3H_2O -> 2H_3AsO_4 + 5NaCl}$$
Гидриды
Мышьяк образует гидрид — чрезвычайно токсичный газ арсин (ce{AsH3}), который можно получить реакцией арсенида металла с кислотой:
$$ce{Ca_3As_2 + 6HCl -> 3CaCl_2 + 2AsH_3 ^}$$
Или восстановлением оксида мышьяка(III) или солей мышьяковых кислот атомарным водородом (получаемым в реакции цинка с соляной кислотой):
$$ce{As_2O_3 + 6Zn + 12HCl -> 2AsH_3 ^ + 6ZnCl_2 + 3H_2O}$$
Газ арсин термически неустойчив и при нагревании разлагается на простые вещества (при этом мышьяк может осесть тонким слоем на стенках нагреваемой трубки или сосуда):
$$ce{2AsH_3 ->[ce{t^{o}C}] 2As v + 3H_2 ^}$$
Арсин, содержащий мышьяк в степени окисления -3 — достаточно сильный восстановитель, поэтому реагирует с окислителями, например, перманганатом калия в кислой среде, окисляясь до высшей степени окисления:
$$ce{5AsH_3 + 8KMnO_4 + 12H_2SO_4 -> 5H_3AsO_4 + 4K_2SO_4 + 8MnSO_4 + 12H_2O}$$
При поджигании арсин горит ярко-сиреневым пламенем и образуется дым из оксида мышьяка(III):
$$ce{2AsH_3 + 3O_2 -> As_2O_3 + 3H_2O}$$
Проба Марша
В химии пниктогенов известна проба Марша, или реакция Марша, с помощью которой можно различить сурьму и мышьяк. Она заключается в том, что, в отличие от сурьмы, мышьяк вступает в реакцию с гипохлоритом натрия в водном растворе, и зеркало из мышьяка растворяется:
$$ce{2As + 5NaClO + 3H_2O -> 2H_3AsO_4 + 5NaCl}$$
Степень окисления +3
Белый порошок оксида мышьяка(III) — (ce{As4O6}) (структура аналогична оксиду фосфора) — образует сложные аддукты с водой в растворе, среди которых есть, например, (ce{H3AsO3, H3[As(OH)6]}) и многие другие частицы.
Арсениты (соли мышьяковистой кислоты с анионами, содержащими (ce{As^{III}})) могут быть окислены йодом:
$$ce{Na_3AsO_3 + I_2 + 2NaOH -> Na_3AsO_4 + 2NaI + H_2O}$$
Или перманганатом калия в кислой среде:
$$ce{5Na_3AsO_3 + 2KMnO_4 + 3H_2SO_4 -> K_2SO_4 + 2MnSO_4 + 5Na_3AsO_4 + 3H_2O}$$
При таком окислении в большинстве случаев в качестве продуктов образуются соли мышьяка(V) — арсенаты.
В присутствии соляной кислоты мышьяковистая кислота (гидрат оксида мышьяка(III)) образует трихлорид мышьяка, однако эта реакция обратима и в зависимости от концентрации кислоты смещается равновесие реакции:
$$ce{H_3AsO_3 + 3HCl <=> AsCl_3 + 3H_2O}$$
Точно так же концентрированной соляной кислотой можно растворить и оксид мышьяка(III):
$$ce{As_4O_6 + 12HCl -> 4AsCl_3 + 6H_2O}$$
Этот оксид, находящийся в промежуточной степени окисления для мышьяка, проявляет окислительно-восстановительную двойственность (то есть может быть как окислителем, так и восстановителем):
$$ce{As_2O_3 + 2I_2 + 5H_2O -> 2H_3AsO_4 + 4HI}$$
$$ce{As_2O_3 + 6Zn + 12HCl -> 2AsH_3 ^ + 6ZnCl_2 + 3H_2O}$$
$$ce{As_2O_3 + 3H[SnCl_3] + 9HCl -> 2As v + 2H_2[SnCl_6] + 3H_2O}$$
$$ce{As_2O_3 + 3H_3PO_2 -> 2As v + 3H_3PO_3}$$
Сульфид мышьяка(III) при сплавлении со щелочами даёт две соли — тиоарсенит и арсенит:
$$ce{As_2S_3 + 6KOH -> K_3AsS_3 + K_3AsO_3 + 3H_2O}$$
Степень окисления +5
Высший оксид мышьяка — (ce{As2O5}) — это белый гигроскопичный порошок, хорошо растворимый в воде: 230 г на 100 г воды.
Получить его можно, окисляя под давлением оксид мышьяка(III):
$$ce{As_2O_3 + O_2 -> As_2O_5}$$
Или дегидратацией мышьяковой кислоты:
$$ce{2H_3AsO_4 ->[ce{t^{o}C}] As_2O_5 + 3H_2O}$$
(ce{H3AsO4}) — мышьяковая кислота. Она является аналогом фосфорной кислоты, и так же образует монозамещённые, дизамещённые и трехзамещённые соли — соответственно дигидроарсенат, гидроарсенат и арсенат.
При дегидратации дигидроарсената образуется метаарсенат — соль метамышьяковой кислоты (аналогично метафосфосфорной кислоте):
$$ce{NaH_2AsO_4 -> H_2O + NaAsO_3}$$
Качественной реакцией на ортоарсенаты является реакция с нитратом серебра: образуется (ce{Ag3AsO4}) коричневого цвета:
$$ce{3Ag^{+} + AsO_4^{3-} -> Ag_3AsO_4 v} quad K_s = 1.0*10^{-22}$$
Мышьяковая кислота может проявлять себя в качестве окислителя, при этом восстанавливаясь до мышьяковистой:
$$ce{H_3AsO_4 + SO_2 + H_2O -> H_3AsO_3 + H_2SO_4}$$
$$ce{H_3AsO_4 + 2HI -> I_2 v + H_3AsO_3 + H_2O}$$
Мышьяк также образует сульфид мышьяка(V) (ce{As2S5}), который может реагировать с сульфидами с образованием солей — тиоарсенатов:
$$ce{As_2S_5 + 3Na_2S -> 2Na_3AsS_4}$$
Тиоарсенаты, в отличие от тиоарсенитов, не обладают достаточной устойчивостью, поэтому постепенно отщепляют серу и превращаются в них:
$$ce{Na_3AsS_4 -> S v + Na_3AsS_3}$$
Зелёные краски мышьяка
Зелень Шееле
Один из интересных фактов о мышьяке состоит в том, что 200-250 лет назад стены окрашивали стойким зелёным красителем — зеленью Шееле, не подозревая о его высокой токсичности. Этот пигмент обнаружил Карл Вильгельм Шееле, смешав соли мышьяка(III) с медным купоросом:
$$ce{As_2O_3 + 3Na_2CO_3 + 3CuSO_4 + 2H_2O -> Cu(AsO_2)_2 * 2Cu(OH)_2 v + Na_2SO_4 + 3CO_2 ^}$$
Упрощённо зелень Шееле можно считать гидроарсенитом меди (ce{CuHAsO3 * nH2O}). Интересно, что стены комнаты, в которой жил Наполеон в ссылке, были окрашены краской на основе зелени Шееле, из-за чего великий император, согласно распространённому мнению, и скончался.
Парижская зелень
Вторая зелёная краска мышьяка — так называемая парижская зелень, которая представляет из себя смешанный ацетат-арсенит меди(II):
$$ce{6NaAsO_2 + 2CH_3COONa + 4CuSO_4 -> 3Cu(AsO_2)_2 * Cu(CH_3COO)_2 v + 4Na_2SO_4}$$
МЫШЬЯК – химический элемент V группы периодической таблицы, относится к семейству азота. Относительная атомная масса 74,9216. В природе мышьяк представлен только одним стабильным нуклидом 75As. Искусственно получены также более десяти его радиоактивных изотопов с периодом полураспада от нескольких минут до нескольких месяцев. Типичные степени окисления в соединениях –3, +3, +5. Название мышьяка в русском языке связывают с употреблением его соединений для истребления мышей и крыс; латинское название Arsenicum происходит от греческого «арсен» – сильный, мощный.
Исторические сведения.
Мышьяк относится к пяти «алхимическим» элементам, открытым в средние века (удивительно, но четыре из них – As, Sb, Bi и P находятся в одной группе периодической таблицы – пятой). В то же время соединения мышьяка были известны с древних времен, их применяли для производства красок и лекарств. Особенно интересно использование мышьяка в металлургии.
Несколько тысячелетий назад каменный век сменился бронзовым. Бронза – это сплав меди с оловом. Как полагают историки, первую бронзу отлили в долине Тигра и Евфрата, где-то между 30 и 25 вв. до н.э. В некоторых регионах выплавлялась бронза с особо ценными свойствами – она лучше отливалась и легче ковалась. Как выяснили современные ученые, это был сплав меди, содержащий от 1 до 7% мышьяка и не более 3% олова. Вероятно, поначалу при его выплавке спутали богатую медную руду малахит с продуктами выветривания некоторых тоже зеленых сульфидных медно-мышьяковых минералов. Оценив замечательные свойства сплава, древние умельцы затем уже специально искали мышьяковые минералы. Для поисков использовали свойство таких минералов давать при нагревании специфический чесночный запах. Однако со временем выплавка мышьяковой бронзы прекратилась. Скорее всего это произошло из-за частых отравлений при обжиге мышьяксодержащих минералов.
Конечно, мышьяк был известен в далеком прошлом лишь в виде его минералов. Так, в Древнем Китаем твердый минерал реальгар (сульфид состава As4S4, реальгар по-арабски означает «рудниковая пыль») использовали для резьбы по камню, однако при нагревании или на свету он «портился», так как превращался в As2S3. В 4 в. до н.э. Аристотель описал этот минерал под названием «сандарак». В I в. н.э. римский писатель и ученый Плиний Старший, и римский врач и ботаник Диоскорид описали минерал аурипигмент (сульфид мышьяка As2S3). В переводе с латыни название минерала означает «золотая краска»: он использовался как желтый краситель. В 11 в. алхимики различали три «разновидности» мышьяка: так называемый белый мышьяк (оксид As2O3), желтый мышьяк (сульфид As2S3) и красный мышьяк (сульфид As4S4). Белый мышьяк получался при возгонке примесей мышьяка при обжиге медных руд, содержащих этот элемент. Конденсируясь из газовой фазы, оксид мышьяка оседал в виде белого налета. Белый мышьяк использовали с древних времен для уничтожения вредителей, а также…
В 13 в. Альберт фон Больштедт (Альберт Великий) получил металлоподобное вещество, нагревая желтый мышьяк с мылом; возможно, это был первый образец мышьяка в виде простого вещества, полученный искусственно. Но это вещество нарушало мистическую «связь» семи известных металлов с семью планетами; вероятно, поэтому алхимики считали мышьяк «незаконнорожденным металлом». В то же время они обнаружили его свойство придавать меди белый цвет, что дало повод называть его «средством, отбеливающим Венеру (то есть медь)».
Мышьяк был однозначно идентифицирован как индивидуальное вещество в середине 17 в., когда немецкий аптекарь Иоганн Шрёдер получил его в сравнительно чистом виде восстановлением оксида древесным углем. Позднее французский химик и врач Никола Лемери получил мышьяк, нагревая смесь его оксида с мылом и поташом. В 18 в. мышьяк уже был хорошо известен как необычный «полуметалл». В 1775 шведский химик К.В.Шееле получил мышьяковую кислоту и газообразный мышьяковистый водород, а в 1789 А.Л.Лавуазье, наконец, признал мышьяк самостоятельным химическим элементом. В 19 в. были открыты органические соединения, содержащие мышьяк.
Мышьяк в природе.
В земной коре мышьяка немного – около 5·10–4% (то есть 5 г на тонну), примерно столько же, сколько германия, олова, молибдена, вольфрама или брома. Часто мышьяк в минералах встречается совместно с железом, медью, кобальтом, никелем.
Состав минералов, образуемых мышьяком (а их известно около 200), отражает «полуметаллические» свойства этого элемента, который может находиться как в положительной, так и в отрицательной степени окисления и соединяться со многими элементами; в первом случае мышьяк может играть роль металла (например, в сульфидах), во втором – неметалла (например, в арсенидах). Сложный состав ряда минералов мышьяка отражает его способность, с одной стороны, частично заменять в кристаллической решетке атомы серы и сурьмы (ионные радиусы S–2, Sb–3 и As–3 близки и составляют соответственно 0,182, 0,208 и 0,191 нм), с другой – атомы металлов. В первом случае атомы мышьяка имеют скорее отрицательную степень окисления, во втором – положительную.
Электроотрицательность мышьяка (2,0) мала, но выше, чем у сурьмы (1,9) и у большинства металлов, поэтому степень окисления –3 наблюдается для мышьяка лишь в арсенидах металлов, а также в стибарсене SbAs и сростках этого минерала с кристаллами чистых сурьмы или мышьяка (минерал аллемонтит). Многие соединения мышьяка с металлами, судя по их составу, относятся скорее к интерметаллическим соединениям, а не к арсенидам; некоторые из них отличаются переменным содержанием мышьяка. В арсенидах может присутствовать одновременно несколько металлов, атомы которых при близком радиусе ионов замещают друг друга в кристаллической решетке в произвольных соотношениях; в таких случаях в формуле минерала символы элементов перечисляются через запятую. Все арсениды имеют металлический блеск, это непрозрачные, тяжелые минералы, твердость их невелика.
Примером природных арсенидов (их известно около 25) могут служить минералы лёллингит FeAs2 (аналог пирита FeS2), скуттерудит CoAs2–3 и никельскуттерудит NiAs2–3, никелин (красный никелевый колчедан) NiAs, раммельсбергит (белый никелевый колчедан) NiAs2, саффлорит (шпейсовый кобальт) CoAs2 и клиносаффлорит (Co,Fe,Ni)As2, лангисит (Co,Ni)As, сперрилит PtAs2, маухерит Ni11As8, орегонит Ni2FeAs2, альгодонит Cu6As. Из-за высокой плотности (более 7 г/см3) многие из них геологи относят к группе «сверхтяжелых» минералов.
Наиболее распространенный минерал мышьяка – арсенопирит (мышьяковый колчедан) FeAsS можно рассматривать как продукт замещения серы в пирите FeS2 атомами мышьяка (в обычном пирите тоже всегда есть немного мышьяка). Такие соединения называют сульфосолями. Аналогично образовались минералы кобальтин (кобальтовый блеск) CoAsS, глаукодот (Co,Fe)AsS, герсдорфит (никелевый блеск) NiAsS, энаргит и люцонит одинакового состава, но разного строения Cu3AsS4, прустит Ag3AsS3 – важная серебряная руда, которую иногда называют «рубиновым серебром» из-за ярко-красного цвета, она часто встречается в верхних слоях серебряных жил, где найдены великолепные большие кристаллы этого минерала. Сульфосоли могут содержать и благородные металлы платиновой группы; это минералы осарсит (Os,Ru)AsS, руарсит RuAsS, ирарсит (Ir,Ru,Rh,Pt)AsS, платарсит (Pt,Rh,Ru)AsS, холлингуортит (Rd,Pt,Pd)AsS. Иногда роль атомов серы в таких двойных арсенидах играют атомы сурьмы, например, в сейняйоките (Fe,Ni)(Sb,As)2, арсенопалладините Pd8(As,Sb)3, арсенполибазите (Ag,Cu)16(Ar,Sb)2S11.
Интересно строение минералов, в которых мышьяк присутствует одновременно с серой, но играет скорее роль металла, группируясь вместе с другими металлами. Таковы минералы арсеносульванит Cu3(As,V)S4, арсеногаухекорнит Ni9BiAsS8, фрейбергит (Ag,Cu,Fe)12(Sb,As)4S13, теннантит (Cu,Fe)12As4S13, аргентотеннантит (Ag,Cu)10(Zn,Fe)2(As,Sb)4S13, голдфилдит Cu12(Te,Sb,As)4S13, жиродит (Cu,Zn,Ag)12(As,Sb)4(Se,S)13. Можно представить себе, какое сложное строение имеет кристаллическая решетка всех этих минералов.
Однозначно положительную степень окисления мышьяк имеет в природных сульфидах – желтом аурипигменте As2S3, оранжево-желтом диморфите As4S3, оранжево-красном реальгаре As4S4, карминово-красном гетчеллите AsSbS3, а также в бесцветном оксиде As2O3, который встречается в виде минералов арсенолита и клаудетита с разной кристаллической структурой (они образуются в результате выветривания других мышьяковых минералов). Обычно эти минералы встречаются в виде небольших вкраплений. Но в 30-е годы 20 в. в южной части Верхоянского хребта были найдены огромные кристаллы аурипигмента размером до 60 см и массой до 30 кг.
В природных солях мышьяковой кислоты H3AsO4 – арсенатах (их известно около 90) степень окисления мышьяка – +5; примером могут служить ярко-розовый эритрин (кобальтовый цвет) Co3(AsO4)2·8H2O, зеленые аннабергит Ni3(AsO4)2·8H2O, скородит FeIIIAsO4·2H2O и симплезит FeII3(AsO4)2·8H2O, буро-красный гаспарит (Ce,La,Nd)ArO4, бесцветные гёрнесит Mg3(AsO4)2·8H2O, рузвельтит BiAsO4 и кёттигит Zn3(AsO4)2·8H2O, а также множество основных солей, например, оливенит Cu2AsO4(OH), арсенобисмит Bi2(AsO4)(OH)3. А вот природные арсениты – производные мышьяковистой кислоты H3AsO3 очень редки.
В центральной Швеции есть знаменитые лангбановские железо-марганцевые карьеры, в которых нашли и описали более 50 образцов минералов, представляющих собой арсенаты. Некоторые из них нигде больше не встречаются. Они образовались когда-то в результате реакции мышьяковой кислоты H3AsO4 с пирокроитом Mn(OH)2 при не очень высоких температурах. Обычно же арсенаты – продукты окисления сульфидных руд. Они, как правило, не имеют промышленного применения, но некоторые из них очень красивые и украшают минералогические коллекции.
В названиях многочисленных минералов мышьяка можно встретить топонимы (Лёллинг в Австрии, Фрайберг в Саксонии, Сейняйоки в Финляндии, Скуттеруд в Норвегии, Аллемон во Франции, канадский рудник Лангис и рудник Гетчелл в Неваде, штат Орегон в США и др.), имена геологов, химиков, политических деятелей и т.п. (немецкий химик Карл Раммельсберг, мюнхенский торговец минералами Вильям Маухер, владелец шахты Иоганн фон Герсдорф, французский химик Ф.Клоде, английские химики Джон Пруст и Смитсон Теннант, канадский химик Ф.Л.Сперри, президент США Рузвельт и др.), названия растений (так, название минерала саффлорита произошело от шафрана), начальные буквы названий элементов – мышьяка, осмия, рутения, иридия, палладия, платины, греческие корни («эритрос» – красный, «энаргон» – видимый, «литос» – камень) и т.д. и т.п.
Интересно старинное название минерала никелина (NiAs) – купферникель. Средневековые немецкие горняки называли Никелем злого горного духа, а «купферникелем» (Kupfernickel, от нем. Kupfer – медь) – «чертову медь», «фальшивую медь». Медно-красные кристаллы этой руды внешне очень походили на медную руду; ее применяли в стекловарении для окрашивания стекол в зеленый цвет. А вот медь из нее никому получить не удавалось. Эту руду в 1751 исследовал шведский минералог Аксель Кронштедт и выделил из нее новый металл, назвав его никелем.
Поскольку мышьяк химически достаточно инертен, он встречается и в самородном состоянии – в виде сросшихся иголочек или кубиков. Такой мышьяк обычно содержит от 2 до 16% примесей – чаще всего это Sb, Bi, Ag, Fe, Ni, Co. Его легко растереть в порошок. В России самородный мышьяк геологи находили в Забайкалье, в Амурской области, встречается он и в других странах.
Уникален мышьяк тем, что он встречается повсюду – в минералах, горных породах, почве, воде, растениях и животных, недаром его называют «вездесущным». Распределение мышьяка по разным регионам земного шара во многом определялось в процессах формирования литосферы летучестью его соединений при высокой температуре, а также процессами сорбции и десорбции в почвах и осадочных породах. Мышьяк легко мигрирует, чему способствует достаточно высокая растворимость некоторых его соединений в воде. Во влажном климате мышьяк вымывается из почвы и уносится грунтовыми водами, а затем – реками. Среднее содержание мышьяка в реках – 3 мкг/л, в поверхностных водах – около 10 мкг/л, в воде морей и океанов – всего около 1 мкг/л. Это объясняется сравнительно быстрым осаждением его соединений из воды с накоплением в донных отложениях, например, в железомарганцевых конкрециях.
В почвах содержание мышьяка составляет обычно от 0,1 до 40 мг/кг. Но в области залегания мышьяковых руд, а также в вулканических районах в почве может содержаться очень много мышьяка – до 8 г/кг, как в некоторых районах Швейцарии и Новой Зеландии. В таких местах гибнет растительность, а животные болеют. Это характерно для степей и пустынь, где мышьяк не вымывается из почвы. Обогащены по сравнению со средним содержанием и глинистые породы – в них содержится вчетверо больше мышьяка, чем в среднем. В нашей стране предельно допустимой концентрацией мышьяка в почве считается 2 мг/кг.
Мышьяк может выноситься из почвы не только водой, но и ветром. Но для этого он должен сначала превратиться в летучие мышьякорганические соединения. Такое превращение происходит в результате так называемого биометилирования – присоединения метильной группы с образованием связи C–As; этот ферментативный процесс (он хорошо известен для соединений ртути) происходит при участии кофермента метилкобаламина – метилированного производного витамина В12 (он есть и в организме человека). Биометилирование мышьяка происходит как в пресной, так и в морской воде и приводит к образованию мышьякорганических соединений – метиларсоновой кислоты CH3AsO(OH)2, диметиларсиновой (диметилмышьяковой, или какодиловой) кислоты (CH3)2As(O)OH, триметиларсина (CH3)3As и его оксида (CH3)3As = O, которые также встречаются в природе. С помощью 14С-меченого метилкобаламина и 74As-меченого гидроарсената натрия Na2HAsO4 было показано, что один из штаммов метанобактерий восстанавливает и метилирует эту соль до летучего диметиларсина. В результате в воздухе сельских районов содержится в среднем 0,001 – 0,01 мкг/м3 мышьяка, в городах, где нет специфических загрязнений – до 0,03 мкг/м3, а вблизи источников загрязнения (заводы по выплавке цветных металлов, электростанции, работающие на угле с высоким содержание мышьяка, и др.) концентрация мышьяка в воздухе может превысить 1 мкг/м3. Интенсивность выпадения мышьяка в районах расположения промышленных центров составляет 40 кг/км2 в год.
Образование летучих соединений мышьяка (триметиларсин, например, кипит всего при 51°С) вызывало в 19 в. многочисленные отравления, поскольку мышьяк содержался в штукатурке и даже в зеленой краске для обоев. В виде краски раньше использовали зелень Шееле Cu3(AsO3)2 · nH2O и парижскую, или швейфуртскую зелень Cu4(AsO2)6(CH3COO)2. В условиях высокой влажности и появления плесени из такой краски образуются летучие мышьякорганические производные. Предполагают, что этот процесс мог быть причиной медленного отравления Наполеона в последние годы его жизни (как известно, мышьяк был найден в волосах Наполеона спустя полтора столетия после его смерти).
Мышьяк в заметных количествах содержится в некоторых минеральных водах. Российские нормативы устанавливают, что в лечебно-столовых минеральных водах мышьяка должно быть не более 700 мкг/л. В Джермуке его может быть в несколько раз больше. Выпитые один-два стакана «мышьяковой» минеральной воды человеку вреда не принесут: чтобы смертельно отравиться, надо выпить сразу литров триста… Но понятно, что такую воду нельзя пить постоянно вместо обычной воды.
Химики выяснили, что мышьяк в природных водах может находиться в разных формах, что существенно с точки зрения его анализа, способов миграции, а также разной токсичности этих соединений; так, соединения трехвалентного мышьяка в 25–60 раз токсичнее, чем пятивалентного. Соединения As(III) в воде присутствуют обычно в форме слабой мышьяковистой кислоты H3AsO3 (рКа = 9,22), а соединения As(V) – в виде значительно более сильной мышьяковой кислоты H3AsO4 (рКа = 2,20) и ее депротонированых анионов H2AsO4– и HAsO42–.
В живом веществе мышьяка в среднем содержится 6·10–6 %, то есть 6 мкг/кг. Некоторые морские водоросли способны концентрировать мышьяк в такой степени, что становятся опасными для людей. Более того, эти водоросли могут расти и размножаться в чистых растворах мышьяковистой кислоты. Такие водоросли используются в некоторых азиатских странах в качестве средства против крыс. Даже в чистых водах норвежских фьордов водоросли могут содержать мышьяк в количестве до 0,1 г/кг. У человека мышьяк содержится в мозговой ткани и в мышцах, накапливается он в волосах и ногтях.
Свойства мышьяка.
Хотя с виду мышьяк напоминает металл, он все же скорее является неметаллом: не образует солей, например, с серной кислотой, но сам является кислотообразующим элементом. Поэтому этот элемент часто называют полуметаллом. Мышьяк существует в нескольких аллотропных формах и в этом отношении весьма напоминает фосфор. Самая устойчивая из них – серый мышьяк, весьма хрупкое вещество, которое на свежем изломе имеет металлический блеск (отсюда название «металлический мышьяк»); его плотность 5,78 г/см3. При сильном нагревании (до 615° С) он возгоняется без плавления (такое же поведение характерно для иода). Под давлением 3,7 МПа (37 атм) мышьяк плавится при 817° С, что значительно выше температуры возгонки. Электропроводность серого мышьяка в 17 раз меньше, чем у меди, но в 3,6 раза выше, чем у ртути. С повышением температуры его электропроводность, как и у типичных металлов, снижается – примерно в такой же степени, как у меди.
Если пары мышьяка очень быстро охладить до температуры жидкого азота (–196° С), получается прозрачное мягкое вещество желтого цвета, напоминающее желтый фосфор, его плотность (2,03 г/см3) значительно ниже, чем у серого мышьяка. Пары мышьяка и желтый мышьяк состоят из молекул As4, имеющих форму тетраэдра – и здесь аналогия с фосфором. При 800° С начинается заметная диссоциация паров с образованием димеров As2, а при 1700° С остаются только молекулы As2. При нагревании и под действием ультрафиолета желтый мышьяк быстро переходит в серый с выделением тепла. При конденсации паров мышьяка в инертной атмосфере образуется еще одна аморфная форма этого элемента черного цвета. Если пары мышьяка осаждать на стекле, образуется зеркальная пленка.
Строение внешней электронной оболочки у мышьяка такое же, как у азота и фосфора, но в отличие от них, у него 18 электронов на предпоследней оболочке. Как и фосфор, он может образовать три ковалентные связи (конфигурация 4s24p3), и на атоме As остается неподеленная пара. Знак заряда на атоме As в соединениях с ковалентными связями зависит от электроотрицательности соседних атомов. Участие неподеленной пары в комплексообразовании для мышьяка значительно затруднено по сравнению с азотом и фосфором.
Если в атоме As задействованы d-орбитали, возможно распаривание 4s-электронов с образованием пяти ковалентных связей. Такая возможность практически осуществляется только в соединении с фтором – в пентафториде AsF5 (известен и пентахлорил AsCl5, но он исключительно нестоек и быстро разлагается даже при –50° С).
В сухом воздухе мышьяк устойчив, но во влажном тускнеет и покрывается черным оксидом. При возгонке пары мышьяка легко сгорают на воздухе голубым пламенем с образованием тяжелых белых паров мышьяковистого ангидрида As2O3. Этот оксид – один из наиболее распространенных мышьяксодержащих реагентов. Он обладает амфотерными свойствами:
As2O3 + 6HCl ® 2AsCl3 + 3H2O,
2O3 + 6NH4OH ® 2(NH4)3AsO3 + 3H2O.
При окислении As2O3 образуется кислотный оксид – мышьяковый ангидрид:
As2O3 + 2HNO3® As2O5 + H2O + NO2 + NO.
При его взаимодействии с содой получают гидроарсенат натрия, который находит применение в медицине:
As2O3 + 2Na2CO3 + H2O ® 2Na2HAsO4 + 2CO2.
Чистый мышьяк достаточно инертен; вода, щелочи и кислоты, не обладающие окислительными свойствами, на него не действуют. Разбавленная азотная кислота окисляет его до ортомышьяковистой кислоты H3AsO3, а концентрированная – до ортомышьяковой H3AsO4:
3As + 5HNO3 + 2H2O ® 3H3AsO4 + 5NO.
Аналогично реагирует и оксид мышьяка(III):
3As2O3 + 4HNO3 + 7H2O ® 6H3AsO4 + 4NO.
Мышьяковая кислота является кислотой средней силы, чуть слабее фосфорной. В отличие от нее, мышьяковистая кислота очень слабая, по своей силе соответствующая борной кислоте H3BO3. В ее растворах существует равновесие H3AsO3HAsO2 + H2O. Мышьяковистая кислота и ее соли (арсениты) – сильные восстановители:
HAsO2 + I2 + 2H2O ® H3AsO4 + 2HI.
Мышьяк реагирует с галогенами и серой. Хлорид AsCl3 – бесцветная маслянистая жидкость, дымящая на воздухе; водой гидролизуется: AsCl3 + 2H2O ® HAsO2 + 3HCl. Известны бромид AsBr3 и иодид AsI3, которые также разлагаются водой. В реакциях мышьяка с серой образуются сульфиды различного состава – вплоть до Ar2S5. Сульфиды мышьяка растворяются в щелочах, в растворе сульфида аммония и в концентрированной азотной кислоте, например:
As2S3 + 6KOH ® K3AsO3 + K3AsS3 + 3H2O,
2S3 + 3(NH4)2S ® 2(NH4)3AsS3,
2S5 + 3(NH4)2S ® 2(NH4)3AsS4,
As2S5 + 40HNO3 + 4H2O ® 6H2AsO4 + 15H2SO4 + 40NO.
В этих реакциях образуются тиоарсениты и тиоарсенаты – соли соответствующих тиокислот (аналогичных тиосерной кислоте).
В реакции мышьяка с активными металлами образуются солеобразные арсениды, которые гидролизуются водой Особенно быстро реакция идет в кислой среде с образованием арсина: Ca3As2 + 6HCl ® 3CaCl2 + 2AsH3. Арсениды малоактивных металлов – GaAs, InAs и др. имеют алмазоподобную атомную решетку. Арсин – бесцветный очень ядовитый газ без запаха, но примеси придают ему запах чеснока. Арсин медленно разлагается на элементы уже при комнатной температуре и быстро – при нагревании.
Мышьяк образует множество мышьякорганических соединений, например, тетраметилдиарсин (CH3)2As–As(CH3)2. Еще в 1760 директор Сервской фарфоровой фабрики Луи Клод Каде де Гассикур, перегоняя ацетат калия с оксидом мышьяка(III), неожиданно получил содержащую мышьяк дымящуюся жидкость с отвратительным запахом, которую назвали аларсином, или жидкостью Каде. Как выяснили впоследствии, в этой жидкости содержались впервые полученные органические производные мышьяка: так называемая окись какодила, которая образовалась в результате реакции
4CH3COOK + As2O3® (CH3)2As–O–As(CH3)2 + 2K2CO3 + 2CO2, и дикакодил (CH3)2As–As(CH3)2. Какодил (от греч. «какос» – дурной) был одним из первых радикалов, открытых в органических соединениях.
В 1854 парижский профессор химии Огюст Каур синтезировал триметиларсин действием метилиодида на арсенид натрия: 3CH3I + AsNa3® (CH3)3As + 3NaI.
В последующем для синтезов использовали трихлорид мышьяка, например,
(CH3)2Zn + 2AsCl3® 2(CH3)3As + 3ZnCl2.
В 1882 были получены ароматические арсины действием металлического натрия на смесь арилгалогенидов и трихлорида мышьяка: 3C6H5Cl + AsCl3 + 6Na ® (C6H5)3As + 6NaCl. Наиболее интенсивно химия органических производных мышьяка развивалась в 20-е годы 20 в., когда у некоторых из них были обнаружены противомикробное, а также раздражающее и кожно-нарывное действие. В настоящее время синтезированы десятки тысяч мышьякорганических соединений.
Получение мышьяка.
Мышьяк получают, в основном, как побочный продукт переработки медных, свинцовых, цинковых и кобальтовых руд, а также при добыче золота. Некоторые полиметаллические руды содержат до 12% мышьяка. При нагревании таких руд до 650–700° С в отсутствие воздуха мышьяк возгоняется, а при нагревании на воздухе образуется летучий оксид As2O3 – «белый мышьяк». Его конденсируют и нагревают с углем, при этом происходит восстановление мышьяка. Получение мышьяка – вредное производство. Раньше, когда слово «экология» было известно лишь узким специалистам, «белый мышьяк» выпускали в атмосферу, и он оседал на соседних полях и лесах. В отходящих газах мышьяковых заводов содержится от 20 до 250 мг/м3 As2O3, тогда как обычно в воздухе содержится примерно 0,00001мг/м3. Среднесуточной допустимой концентрацией мышьяка в воздухе считают всего 0,003 мг/м3. Парадоксально, но и сейчас намного сильнее загрязняют окружающую среду мышьяком не заводы по его производству, а предприятия цветной металлургии и электростанции, сжигающие каменный уголь. В донных осадках вблизи медеплавильных заводов содержится огромное количество мышьяка – до 10 г/кг. Мышьяк может попасть в почву и с фосфорными удобрениями.
И еще один парадокс: получают мышьяка больше, чем его требуется; это довольно редкий случай. В Швеции «ненужный» мышьяк вынуждены были даже захоранивать в железобетонных контейнерах в глубоких заброшенных шахтах.
Главный промышленный минерал мышьяка – арсенопирит FeAsS. Крупные медно-мышьяковые месторождения есть в Грузии, Средней Азии и Казахстане, в США, Швеции, Норвегии и Японии, мышьяково-кобальтовые – в Канаде, мышьяково-оловянные – в Боливии и Англии. Кроме того, известны золото-мышьяковые месторождения в США и Франции. Россия располагает многочисленными месторождениями мышьяка в Якутии, на Урале, в Сибири, Забайкалье и на Чукотке.
Определение мышьяка.
Качественной реакцией на мышьяк является осаждение желтого сульфида As2S3 из солянокислых растворов. Следы определяют реакцией Марша или методом Гутцейта: полоски бумаги, смоченные HgCl2, темнеют в присутствии арсина, который восстанавливает сулему до ртути.
В последние десятилетия разработаны различные чувствительные методы анализа, с помощью которых можно количественно определить ничтожные концентрации мышьяка, например, в природных водах. В их числе пламенная атомно-абсорбционная спектрометрия, атомно-эмиссионная спектрометрия, масс-спектрометрия, атомно-флуоресцентная спектрометрия, нейтронный активационный анализ… Если мышьяка в воде очень мало, может потребоваться предварительное концентрирование образцов. Используя такое концентрирование, группа харьковских ученых из Национальной академии наук Украины разработала в 1999 экстракционно-рентгенофлуоресцентный метод определения мышьяка (а также селена) в питьевой воде с чувствительностью до 2,5–5 мкг/л.
Для раздельного определения соединений As(III) и As(V) их предварительно отделяют друг от друга с помощью хорошо известных экстракционных и хроматографических методов, а также используя селективное гидрирование. Экстракцию обычно осуществляют с помощью дитиокарбамата натрия или пирролидиндитиокарбамата аммония. Эти соединения образуют с As(III) нерастворимые в воде комплексы, которые можно извлечь хлороформом. Затем с помощью окисления азотной кислотой мышьяк можно снова перевести в водную фазу. Во второй пробе с помощью восстановителя переводят арсенат в арсенит, а затем производят аналогичную экстракцию. Так определяют «общий мышьяк», а затем вычитанием первого результата из второго определяют As(III) и As(V) порознь. Если в воде есть органические соединения мышьяка, их обычно переводят в метилдииодарсин CH3AsI2 или в диметилиодарсин (CH3)2AsI, которые определяют тем или иным хроматографическим методом. Так, с помощью высокоэффективной жидкостной хроматографии можно определить нанограммовые количества вещества.
Многие мышьяковые соединения можно анализировать так называемым гидридным методом. Он заключается в селективном восстановлении анализируемого вещества в летучий арсин. Так, неорганические арсениты восстанавливаются до AsH3 при рН 5 – 7, а при рН < 1 восстанавливаются как арсениты, так и арсенаты. В этих же условиях метиларсоновая и диметиларсиновая кислоты восстанавливаются до метил- и диметиларсина. Летучие арсины можно затем выморозить в ампулу, охлаждаемую жидким азотом. Затем, медленно нагревая ампулу, можно добиться раздельного испарения разных арсинов.
Чувствителен и нейтронно-активационный метод. Он заключается в облучении образца нейтронами, при этом ядра 75As захватывают нейтроны и превращаются в радионуклид 76As, который обнаруживается по характерной радиоактивности с периодом полураспада 26 часов. Так можно обнаружить до 10–10% мышьяка в образце, т.е. 1 мг на 1000 т вещества
Применение мышьяка.
Около 97% добываемого мышьяка используют в виде его соединений. Чистый мышьяк применяют редко. В год во всем мире получают и используют всего несколько сотен тонн металлического мышьяка. В количестве 3% мышьяк улучшает качество подшипниковых сплавов. Добавки мышьяка к свинцу заметно повышают его твердость, что используется при производстве свинцовых аккумуляторов и кабелей. Малые добавки мышьяка повышают коррозионную устойчивость и улучшают термические свойства меди и латуни. Мышьяк высокой степени очистки применяют в производстве полупроводниковых приборов, в которых его сплавляют с кремнием или с германием. Мышьяк используют и в качестве легирующей добавки, которая придает «классическим» полупроводникам (Si, Ge) проводимость определенного типа.
Мышьяк как ценную присадку используют и в цветной металлургии. Так, добавка к свинцу 0,2…1% As значительно повышает его твердость. Уже давно заметили, что если в расплавленный свинец добавить немного мышьяка, то при отливке дроби получаются шарики правильной сферической формы. Добавка 0,15…0,45% мышьяка в медь увеличивает ее прочность на разрыв, твердость и коррозионную стойкость при работе в загазованной среде. Кроме того, мышьяк увеличивает текучесть меди при литье, облегчает процесс волочения проволоки. Добавляют мышьяк в некоторые сорта бронз, латуней, баббитов, типографских сплавов. И в то же время мышьяк очень часто вредит металлургам. В производстве стали и многих цветных металлов умышленно идут на усложнение процесса – лишь бы удалить из металла весь мышьяк. Присутствие мышьяка в руде делает производство вредным. Вредным дважды: во-первых, для здоровья людей; во-вторых, для металла – значительные примеси мышьяка ухудшают свойства почти всех металлов и сплавов.
Более широкое применение имеют различные соединения мышьяка, которые ежегодно производятся десятками тысяч тонн. Оксид As2O3 применяют в стекловарении в качестве осветлителя стекла. Еще древним стеклоделам было известно, что белый мышьяк делает стекло «глухим», т.е. непрозрачным. Однако небольшие добавки этого вещества, напротив, осветляют стекло. Мышьяк и сейчас входит в рецептуры некоторых стекол, например, «венского» стекла для термометров.
Соединения мышьяка применяют в качестве антисептика для предохранения от порчи и консервирования шкур, мехов и чучел, для пропитки древесины, как компонент необрастающих красок для днищ судов. В этом качестве используют соли мышьяковой и мышьяковистой кислот: Na2HAsO4, PbHAsO4, Ca3(AsO3)2 и др. Биологическая активность производных мышьяка заинтересовала ветеринаров, агрономов, специалистов санэпидслужбы. В итоге появились мышьяксодержащие стимуляторы роста и продуктивности скота, противоглистные средства, лекарства для профилактики болезней молодняка на животноводческих фермах. Соединения мышьяка (As2O3, Ca3As2, Na3As, парижская зелень) используются для борьбы с насекомыми, грызунами, а также с сорняками. Раньше такое применение было широко распространено, особенно при обработке фруктовых деревьев, табачных и хлопковых плантаций, для избавления домашнего скота от вшей и блох, для стимулирования прироста в птицеводстве и свиноводстве, а также для высушивания хлопчатника перед уборкой. Еще в Древнем Китае оксидом мышьяка обрабатывали рисовые посевы, чтобы уберечь их от крыс и грибковых заболеваний и таким образом поднять урожай. А в Южном Вьетнаме американские войска применяли в качестве дефолианта какодиловую кислоту («Эйджент блю»). Сейчас из-за ядовитости соединений мышьяка их использование в сельском хозяйстве ограничено.
Важные области применения соединений мышьяка – производство полупроводниковых материалов и микросхем, волоконной оптики, выращивание монокристаллов для лазеров, пленочная электроника. Для введения небольших строго дозированных количеств этого элемента в полупроводники применяют газообразный арсин. Арсениды галлия GaAs и индия InAs применяют при изготовлении диодов, транзисторов, лазеров.
Ограниченное применение находит мышьяк и в медицине. Изотопы мышьяка 72As, 74As и 76As с удобными для исследований периодами полураспада (26 ч, 17,8 сут. и 26,3 ч соответственно) применяются для диагностики различных заболеваний.
Илья Леенсон

- Структура
- Свойства
- Морфология
- Происхождение
- Применение
- Классификация
- Физические свойства
- Оптические свойства
- Кристаллографические свойства
СТРУКТУРА
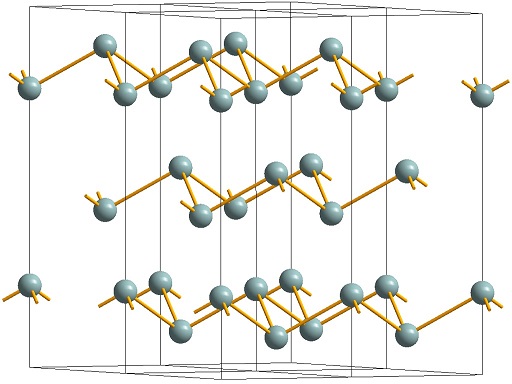
Установлено несколько аллотропных модификаций мышьяка. В обычных условиях устойчив металлический, или серый мышьяк (альфа-мышьяк). Кристаллическая решетка серого мышьяка ромбоэдрическая, слоистая, с периодом а=4,123 А, угол а = 54° 10′. Плотность (при температуре 20° С) 5,72 г/см3; температурный коэфф. линейного расширения 3,36 • 10 град ; удельное электрическое сопротивление (температура 0° С) 35 • 10—6 ом • см; НВ = ж 147; коэфф. сжимаемости (при температуре 30° С) 4,5 х 10-6cm2/кг. Температура плавления альфа-мышьяка 816° С при давлении 36 атмосфер.
Под атм. давлением мышьяк возгоняется при температуре 615° С не плавясь. Теплота сублимации 102 кал/г. Пары мышьяка бесцветны, до т-ры 800° С состоят из молекул As4, от 800 до 1700° С — из смеси As4 и As2, выше температуры 1700° С — только из As2. При быстрой конденсации паров мышьяк на поверхности, охлаждаемой жидким воздухом, образуется желтый мышьяк— прозрачные мягкие кристаллы кубической системы с плотностью 1,97 г/см3. Известны также другие метастабильные модификации мышьяка: бета-мышьяк — аморфная стеклообразная, гамма-мышьяк — желто-коричневая и дельта-мышьяк — коричневая аморфная с плотностями соответственно 4,73; 4,97 и 5,10 г/см3. Выше температуры 270° С эти модификации переходят в серый мышьяк.
СВОЙСТВА

МОРФОЛОГИЯ

ПРОИСХОЖДЕНИЕ

В литературе имеются указания на вторичное происхождение мышьяка в зонах выветривания месторождений мышьяковистых руд, что, вообще говоря, мало вероятно, если учесть, что в этих условиях он очень неустойчив и, быстро окисляясь, разлагается полностью. Черные корочки состоят из тонкой смеси мышьяка и арсенолита (As2О3). В конце концов образуется чистый арсенолит.
В земной коре концентрация мышьяка невелика и составляет 1,5 промилле. Он встречается в почве и минералах и может попасть в воздух, воду и грунт благодаря ветровой и водной эрозии. Кроме того, элемент поступает в атмосферу из других источников. В результате извержения вулканов в воздух выделяется около 3 тыс. т мышьяка в год, микроорганизмы образуют 20 тыс. т летучего метиларсина в год, а в результате сжигания ископаемого топлива за тот же период выделяется 80 тыс. т.
На территории СССР самородный мышьяк был встречен в нескольких месторождениях. Из них отметим Садонское гидротермальное свинцово-цинковое месторождение, где он неоднократно наблюдался в виде почковидных масс на кристаллическом кальците с галенитом и сфалеритом. Крупные почкообразные скопления самородного мышьяка с концентрически-скорлуповатым строением были встречены на левом берегу р. Чикоя (Забайкалье). В парагенезисе с ним наблюдался лишь кальцит в виде оторочек на стенках тонких жил, секущих древние кристаллические сланцы. В виде обломков (рис. 76) мышьяк был найден также в районе ст. Джалинда, Амурской ж. д. и в других местах.
В ряде месторождений Саксонии (Фрейберг, Шнееберг, Аннаберг и др.) самородный мышьяк наблюдался в ассоциации с мышьяковистыми соединениями кобальта, никеля, серебра, самородным висмутом и др. Все эти и другие находки этого минерала практического значения не имеют.
ПРИМЕНЕНИЕ

Сульфидные соединения мышьяка — аурипигмент и реальгар — используются в живописи в качестве красок и в кожевенной отрасли промышленности в качестве средств для удаления волос с кожи. В пиротехнике реальгар употребляется для получения «греческого», или «индийского», огня, возникающего при горении смеси реальгара с серой и селитрой (при горении образует ярко-белое пламя).
Некоторые элементоорганические соединения мышьяка являются боевыми отравляющими веществами, например, люизит.
В начале XX века некоторые производные какодила, например, сальварсан, применяли для лечения сифилиса, со временем эти препараты были вытеснены из медицинского применения для лечения сифилиса другими, менее токсичными и более эффективными, фармацевтическими препаратами, не содержащими мышьяк.
Многие из мышьяковых соединений в очень малых дозах применяются в качестве препаратов для борьбы с малокровием и рядом других тяжелых заболеваний, так как оказывают клинически заметное стимулирующее влияние на ряд специфических функций организма, в частности, на кроветворение. Из неорганических соединений мышьяка мышьяковистый ангидрид может применяться в медицине для приготовления пилюль и в зубоврачебной практике в виде пасты как некротизирующее лекарственное средство. Этот препарат в обиходе и жаргонно называли «мышьяк» и применяли в стоматологии для локального омертвления зубного нерва. В настоящее время препараты мышьяка редко применяются в зубоврачебной практике из-за их токсичности. Сейчас разработаны и применяются другие методы безболезненного омертвления нерва зуба под местной анестезией.
Мышьяк (англ. Arsenic) – As
| Молекулярный вес | 74.92 г/моль |
| Происхождение названия | русское название от слова «мышь», в связи с употреблением его соединений для истребления мышей и крыс. Английское от греч. Arsenikon, изначально применялось к минералу аурипигменту |
| IMA статус | действителен |
КЛАССИФИКАЦИЯ
| Strunz (8-ое издание) | 1/B.01-10 |
| Nickel-Strunz (10-ое издание) | 1.CA.05 |
| Dana (7-ое издание) | 1.3.1.1 |
| Dana (8-ое издание) | 1.3.1.1 |
| Hey’s CIM Ref. | 1.33 |
ФИЗИЧЕСКИЕ СВОЙСТВА
| Цвет минерала | оловянно-белый, с поверхности переходящий в тёмно-серый или чёрный |
| Цвет черты | серый |
| Прозрачность | непрозрачный |
| Блеск | полуметаллический, тусклый |
| Спайность | совершенная по {0001} и менее совершенная по {0112} |
| Твердость (шкала Мооса) | 3,5 |
| Излом | неравномерный |
| Прочность | хрупкий |
| Плотность (измеренная) | 5.63 – 5.78 г/см3 |
| Радиоактивность (GRapi) | 0 |
ОПТИЧЕСКИЕ СВОЙСТВА
| Тип | анизотропный |
| Оптическая анизотропия | различимая – желтовато-коричневый и светло-серый переходящий в желтовато-серый |
| Оптический рельеф | низкий |
| Плеохроизм | слабый |
| Люминесценция в ультрафиолетовом излучении | не флюоресцентный |
КРИСТАЛЛОГРАФИЧЕСКИЕ СВОЙСТВА
| Точечная группа | 3m (3 2/m) – Гексагональная-скаленоэдрическая |
| Пространственная группа | R 3m |
| Сингония | Тригональная |
| Параметры ячейки | a = 3.768Å, c = 10.574Å |
| Двойникование | Двойники редки, по {10_14}, также механические двойники давления по {01_12} |
Интересные статьи:
Глоссарий. Химия
Мышьяк
Мышья́к — химический элемент с атомным номером 33 в периодической системе химических элементов Д.И. Менделеева, обозначается символом As. Представляет собой хрупкий полуметалл стального цвета.
Происхождение названия
Название мышьяка в русском языке связывают с употреблением его соединений для истребления мышей и крыс. Греческое название ἀρσενικόν происходит от персидского زرنيخ (zarnik) — «жёлтый аурипигмент». Народная этимология возводит к др.-греч. ἀρσενικός — мужской.
В 1789 году А. Л. Лавуазье выделил металлический мышьяк из триоксида мышьяка («белого мышьяка»), обосновал, что это самостоятельное простое вещество, и присвоил элементу название «арсеникум».
Получение
Открытие способа получения металлического мышьяка (серого мышьяка) приписывают средневековому алхимику Альберту Великому, жившему в XIII в. Однако гораздо ранее греческие и арабские алхимики умели получать мышьяк в свободном виде, нагревая «белый мышьяк» (триоксид мышьяка) с различными органическими веществами.
Существует множество способов получения мышьяка: сублимацией природного мышьяка, способом термического разложения мышьякового колчедана, восстановлением мышьяковистого ангидрида и др.
В настоящее время для получения металлического мышьяка чаще всего нагревают арсенопирит в муфельных печах без доступа воздуха. При этом освобождается мышьяк, пары которого конденсируются и превращаются в твердый мышьяк в железных трубках, идущих от печей, и в особых керамических приёмниках. Остаток в печах потом нагревают при доступе воздуха, и тогда мышьяк превращается в As2O3. Металлический мышьяк получается в довольно незначительных количествах, и главная часть мышьякосодержащих руд перерабатывается в белый мышьяк, то есть в триоксид мышьяка — мышьяковистый ангидрид As2О3.
Применение
Мышьяк используется для легирования сплавов свинца, идущих на приготовление дроби, так как при отливке дроби башенным способом капли сплава мышьяка со свинцом приобретают строго сферическую форму, и кроме того, прочность и твёрдость свинца возрастают.
Мышьяк особой чистоты (99,9999 %) используется для синтеза ряда ценных и важных полупроводниковых материалов — арсенидов и сложных алмазоподобных полупроводников.
Сульфидные соединения мышьяка — аурипигмент и реальгар — используются в живописи в качестве красок и в кожевенной отрасли промышленности в качестве средств для удаления волос с кожи.
В пиротехнике реальгар употребляется для получения «греческого», или «индийского», огня, возникающего при горении смеси реальгара с серой и селитрой (ярко-белое пламя).
Многие из мышьяковых соединений в очень малых дозах применяются в качестве лекарств для борьбы с малокровием и рядом тяжелых заболеваний, так как оказывают клинически значимое стимулирующее влияние на ряд функций организма, в частности, на кроветворение. Из неорганических соединений мышьяка мышьяковистый ангидрид может применяться в медицине для приготовления пилюль и в зубоврачебной практике в виде пасты как некротизирующее лекарственное средство. Этот препарат называли «мышьяк» и применялся в стоматологии при удалении нерва. В настоящее время препараты мышьяка применяются в зубоврачебной практике редко из-за токсичности. Разработаны и применяются другие методы безболезненной денервации зуба под местной анестезией.
Источник: Википедия
Другие заметки по химии
Мышьяк (название произошло от слова мышь, использовали для травли мышей) – тридцать третий элемент периодической системы. Относится к полуметаллам. В соединение с кислотой он не образует солей, являясь кислотообразующим веществом. Может образовывать аллотропные модификации. Мышьяк имеет три известные на сегодняшний день структуры кристаллической решётки. Жёлтый мышьяк проявляет свойства типичного неметалла, аморфный – чёрный и самый устойчивый металлический, серый. В природе чаще всего встречается в виде соединений, реже – в свободном состоянии. Наиболее распространёнными являются соединения мышьяка с металлами (арсениды), такие как: мышьяковистое железо (арсенопирит, ядовитый колчедан), никелин (купферникель, назван так из-за своей схожести с медной рудой). Мышьяк является малоактивным элементом, нерастворим в воде, а его соединения относятся к слаборастворимым веществам. Окисление мышьяка происходит во время нагрева, при комнатной температуре эта реакция протекает очень медленно.
Все мышьяковые соединения являются очень сильными токсинами, которые оказывают негативное влияние не только на желудочно-кишечный тракт, но и на нервную систему. Истории известно много нашумевших случаев отравления мышьяком и его производными. Соединения мышьяка использовались в качестве яда не только в средневековой Франции, они были известны ещё в древнем Риме, Греции. Популярность мышьяка как сильнодействующего яда объясняется тем, что обнаружить его в пище практически нереально, он не имеет ни запаха, ни вкуса. При нагревании, превращается в оксид мышьяка. Диагностировать отравление мышьяком достаточно сложно, так как оно имеет схожие симптомы с различными заболеваниями. Чаще всего отравление мышьяком путают с холерою.
Где применяется мышьяк?
Несмотря на свою токсичность, производные мышьяка применяют не только для травли мышей и крыс. Поскольку чистый мышьяк обладает высокой электропроводимостью, то его используют как легирующую добавку, которая придаёт таким полупроводникам, как германий, кремний проводимость необходимого типа. В цветной металлургии мышьяк применяется в качестве присадки, которая придаёт сплавам прочность, твёрдость и коррозионную стойкость в загазованной среде. В стекловарении его добавляют в небольших количествах для осветления стёкол, кроме того, он входит в состав знаменитого «венского стекла». Никелин используют для окраски стекла в зелёный цвет. В кожевенном деле сульфатные соединения мышьяка используют при обработке шкур для удаления волосков. Мышьяк входит в состав лаков и красок. В деревообрабатывающий промышленности применяют мышьяк как антисептик. В пиротехнике из сульфидных соединений мышьяка изготавливают «греческий огонь», применяют в производстве спичек. Некоторые соединения мышьяка используют в качестве боевых отравляющих веществ. Токсические свойства мышьяка используются в стоматологической практике для умерщвления пульпы зуба. В медицине, препараты мышьяка применяют в качестве лекарства, повышающего общий тонус организма, для стимуляции увеличения количества эритроцитов. Мышьяк оказывает угнетающее действие на образование лейкоцитов, поэтому его используют при лечении некоторых форм лейкоза. Известно огромное количество медицинских препаратов, созданных на основе мышьяка, но в последнее время их постепенно заменяют менее токсичные лекарства.
Несмотря на свою токсичность, мышьяк является одним из самых необходимых элементов. При работе с его соединениями необходимо придерживаться правил техники безопасности, что поможет избежать нежелательных последствий.
МЫШЬЯ́К (лат. Arsenicum), As, химич. элемент V группы короткой формы (15-й группы длинной формы) периодич. системы; ат. н. 33, ат. м. 74,92160; неметалл. В природе представлен стабильным нуклидом $ce{^{75}As}$; получены радионуклиды с массовыми числами 60–89, 91–92, наиболее долгоживущие из которых $ce{^{73}As}$ ($T_{1/2}$ 80,3 сут, электронный захват) и $ce{^{74} As}$ ($T_{1/2}$ 17,77 сут, $β$-распад, электронный захват).
Историческая справка
Природные соединения М. – жёлтый аурипигмент и тёмно-красный реальгар – использовались в древних Китае, Египте, Греции для приготовления красок и лекарств; было известно также, что соединения М. ядовиты. Сильное действие на организм соединений М. отражено в лат. названии элемента, которое, возможно, происходит от греч. ἄρσην – сильный, мощный. По др. версии, название элементу дано от греч. ἀρσενιϰόν – жёлтый аурипигмент. Рус. название происходит от слов «мышь» и «яд» – соединения М. издавна использовали для уничтожения мелких грызунов. Алхимики, прокаливая на воздухе природные минералы М., получали т. н. белый мышьяк – ядовитый оксид состава $ce{As_2O_3}$ (в средние века использовался для отравления неугодных лиц). В свободном виде М., возможно, впервые получен Альбертом Великим в сер. 13 в.
Распространённость в природе
М. принадлежит к числу редких рассеянных элементов; содержание в земной коре составляет 1,7·10–4% (по массе). Известно более 180 минералов М. Среди них наибольшее значение имеют арсенопирит (мышьяковый колчедан) $ce{FeAsS}$, реальгар $ce{As4S4}$ и аурипигмент $ce{As2S3}$. Очень редко в природе встречается мышьяк самородный. Для пром. получения важное значение имеет присутствие М. в медных и полиметаллич. рудах, при переработке которых получают осн. количества М. и его соединений; см. Мышьяковые руды.
Свойства
Конфигурация внешних электронных оболочек атома М. $3d^{10}4s^24p^3$; в соединениях проявляет степени окисления –3, +3 и +5. Энергии ионизации при переходе от $ce{As^0}$ к $ce{As^{5+}}$ равны соответственно 9,82, 18,62, 28,35, 50,10, 62,60 эВ. Электроотрицательность по Полингу 2,18. Атомный радиус (эмпирический) 115 пм, радиус иона $ce{As^{5+}}$ 60 пм (координац. число 6).
В свободном виде существует в виде нескольких аллотропных модификаций. Наиболее устойчив при обычных условиях серый (металлический) М. ($ce{α-As}$) с ромбоэдрич. решёткой; $ce{α-As}$ – хрупкие кристаллы серо-стального цвета, плотность 5727 кг/м3, удельное электрич. сопротивление 30·10–8 Ом·м, теплопроводность 50 Вт/(м·К). При темп-ре 614 °С серый М. возгоняется. При охлаждении паров образуется модификация с кубической кристаллич. структурой – жёлтый М. (мягкие, как воск, кристаллы). Известны также чёрный аморфный (твёрдый и хрупкий) М. и др. модификации. Расплавить М. можно при 817 °C под давлением его собств. паров (3,7 МПа).
На воздухе поверхность М. тускнеет из-за образования тонкой оксидной плёнки. При нагревании на воздухе М. загорается, образуется кислотный оксид $ce{As_2O_3}$. При нагревании М. реагирует с галогенами (образуются галогениды, напр. хлорид $ce{AsCl_3}$), серой и др. неметаллами. Оксиду $ce{As_2O_3}$ отвечает слабая ортомышьяковистая (мышьяковистая) кислота
$ce{H_3AsO_3}$, существующая только в растворах. Соли этой кислоты – ортоарсениты. При окислении М. в азотной кислоте или в царской водке образуется средняя по силе мышьяковая кислота $ce{H_3AsO_4}$, соли которой – арсенаты (напр., арсенат натрия $ce{Na_3AsO_4}$). При воздействии на раствор, содержащий соединения $ce{As^{3+}}$, водорода в момент его выделения (напр., при реакции цинка с соляной кислотой) образуется арсин – мышьяковистый водород $ce{AsH_3}$. Арсин при нагревании в стеклянной трубке (где происходит его образование) до 300–400 °C быстро разлагается, причём на внутр. стенке трубки образуется чёрный блестящий налёт («мышьяковое зеркало»). По этому налёту судебные медики определяют присутствие в испытуемом материале очень малых количеств веществ, содержащих М. (проба Марша).
С некоторыми металлами М. образует соединения – арсениды. Среди арсенидов наибольшее значение имеет арсенид галлия GaAs, обладающий полупроводниковыми свойствами. Известны многочисл. мышьякорганические соединения.
Соединения М. очень токсичны; хронич. отравления приводят к заболеваниям нервной системы, онемению конечностей, атрофии костного мозга, изменениям в печени и пр. Элементарный М. обладает тератогенными (нарушающими развитие эмбриона) свойствами. М. и его соединения относят к безусловным канцерогенным веществам. Соединения М. составляли основу запрещённого химич. оружия.
Получение
Для получения М. используют сульфидные руды М. или отходы переработки медных и полиметаллич. руд. В обоих случаях проводят обжиг сульфидов, далее М. извлекают в виде оксида $ce{As_2O_}$, который восстанавливают нагреванием с древесным углём до свободного М. Для получения высокочистого М., необходимого при изготовлении полупроводниковых материалов, используют зонную плавку, дистилляцию в вакууме и др. Объём мирового произ-ва М. в пересчёте на $ce{As_2O_3}$ ок. 50 тыс. т/год.
Применение
М. используют как добавку к некоторым сплавам, при получении арсенида галлия и др. полупроводниковых материалов. Соединения М. входят в состав пестицидов, антисептиков для пропитки древесины, применяются в медицине.