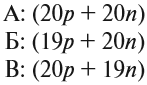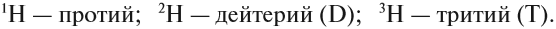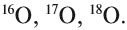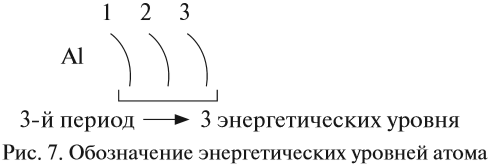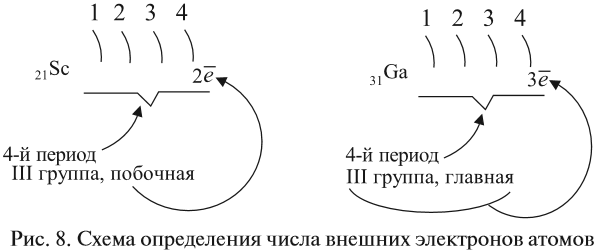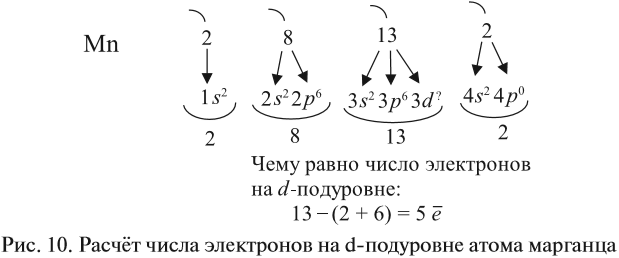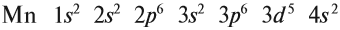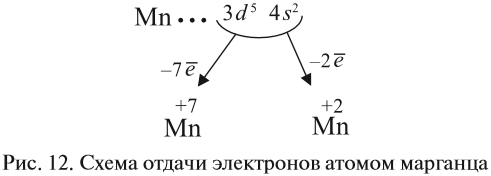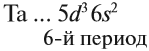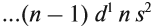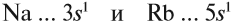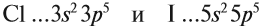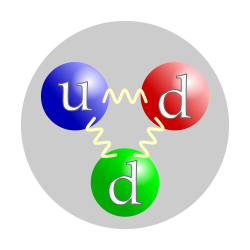
The quark content of the neutron. The color assignment of individual quarks is arbitrary, but all three colors must be present. Forces between quarks are mediated by gluons. |
|
| Classification | Baryon |
|---|---|
| Composition | 1 up quark, 2 down quarks |
| Statistics | Fermionic |
| Family | Hadron |
| Interactions | Gravity, weak, strong, electromagnetic |
| Symbol | n , n0 , N0 |
| Antiparticle | Antineutron |
| Theorized | Ernest Rutherford[1] (1920) |
| Discovered | James Chadwick[2] (1932) |
| Mass | 1.67492749804(95)×10−27 kg[3] 939.56542052(54) MeV/c2[3] 1.00866491588(49) Da[4] |
| Mean lifetime | 879.4(6) s (free)[5] |
| Electric charge | 0 e (−2±  ×10−22 e (experimental limits)[6] ×10−22 e (experimental limits)[6] |
| Electric dipole moment | < 2.9×10−26 e⋅cm (experimental upper limit) |
| Electric polarizability | 1.16(15)×10−3 fm3 |
| Magnetic moment | −0.96623650(23)×10−26 J·T−1[4] −1.04187563(25)×10−3 μB[4] −1.91304273(45) μN[4] |
| Magnetic polarizability | 3.7(20)×10−4 fm3 |
| Spin | 1/2 |
| Isospin | −1/2 |
| Parity | +1 |
| Condensed | I(JP) = 1/2(1/2+) |
The neutron is a subatomic particle, symbol
n
or
n0
, which has a neutral (not positive or negative) charge, and a mass slightly greater than that of a proton. Protons and neutrons constitute the nuclei of atoms. Since protons and neutrons behave similarly within the nucleus, and each has a mass of approximately one atomic mass unit, they are both referred to as nucleons.[7] Their properties and interactions are described by nuclear physics. Protons and neutrons are not elementary particles; each is composed of three quarks.
The chemical properties of an atom are mostly determined by the configuration of electrons that orbit the atom’s heavy nucleus. The electron configuration is determined by the charge of the nucleus, which is determined by the number of protons, or atomic number. The number of neutrons is the neutron number. Neutrons do not affect the electron configuration, but the sum of atomic and neutron numbers is the mass of the nucleus.
Atoms of a chemical element that differ only in neutron number are called isotopes. For example, carbon, with atomic number 6, has an abundant isotope carbon-12 with 6 neutrons and a rare isotope carbon-13 with 7 neutrons. Some elements occur in nature with only one stable isotope, such as fluorine; Other elements occur with many stable isotopes, such as tin with ten stable isotopes, and some elements such as technetium have no stable isotope.
The properties of an atomic nucleus depend on both atomic and neutron numbers. With their positive charge, the protons within the nucleus are repelled by the long-range electromagnetic force, but the much stronger, but short-range, nuclear force binds the nucleons closely together. Neutrons are required for the stability of nuclei, with the exception of the single-proton hydrogen nucleus. Neutrons are produced copiously in nuclear fission and fusion. They are a primary contributor to the nucleosynthesis of chemical elements within stars through fission, fusion, and neutron capture processes.
The neutron is essential to the production of nuclear power. In the decade after the neutron was discovered by James Chadwick in 1932,[8] neutrons were used to induce many different types of nuclear transmutations. With the discovery of nuclear fission in 1938,[9] it was quickly realized that, if a fission event produced neutrons, each of these neutrons might cause further fission events, in a cascade known as a nuclear chain reaction.[10] These events and findings led to the first self-sustaining nuclear reactor (Chicago Pile-1, 1942) and the first nuclear weapon (Trinity, 1945).
Dedicated neutron sources like neutron generators, research reactors and spallation sources produce free neutrons for use in irradiation and in neutron scattering experiments. A free neutron spontaneously decays to a proton, an electron, and an antineutrino, with a mean lifetime of about 15 minutes.[11] Free neutrons do not directly ionize atoms, but they do indirectly cause ionizing radiation, so they can be a biological hazard, depending on dose.[10] A small natural «neutron background» flux of free neutrons exists on Earth, caused by cosmic ray showers, and by the natural radioactivity of spontaneously fissionable elements in the Earth’s crust.[12]
Description[edit]
An atomic nucleus is formed by a number of protons, Z (the atomic number), and a number of neutrons, N (the neutron number), bound together by the nuclear force. The atomic number determines the chemical properties of the atom, and the neutron number determines the isotope or nuclide.[10] The terms isotope and nuclide are often used synonymously, but they refer to chemical and nuclear properties, respectively. Isotopes are nuclides with the same atomic number, but different neutron number. Nuclides with the same neutron number, but different atomic number, are called isotones. The atomic mass number, A, is equal to the sum of atomic and neutron numbers. Nuclides with the same atomic mass number, but different atomic and neutron numbers, are called isobars.
The nucleus of the most common isotope of the hydrogen atom (with the chemical symbol 1H) is a lone proton. The nuclei of the heavy hydrogen isotopes deuterium (D or 2H) and tritium (T or 3H) contain one proton bound to one and two neutrons, respectively. All other types of atomic nuclei are composed of two or more protons and various numbers of neutrons. The most common nuclide of the common chemical element lead, 208Pb, has 82 protons and 126 neutrons, for example. The table of nuclides comprises all the known nuclides. Even though it is not a chemical element, the neutron is included in this table.[13]
The free neutron has a mass of 939565413.3 eV/c2, or 1.674927471×10−27 kg, or 1.00866491588 Da.[4] The neutron has a mean square radius of about 0.8×10−15 m, or 0.8 fm,[14] and it is a spin-½ fermion.[15] The neutron has no measurable electric charge. With its positive electric charge, the proton is directly influenced by electric fields, whereas the neutron is unaffected by electric fields. But the neutron has a magnetic moment, so the neutron is influenced by magnetic fields. The neutron’s magnetic moment has a negative value, because its orientation is opposite to the neutron’s spin.[16]
A free neutron is unstable, decaying to a proton, electron and antineutrino with a mean lifetime of just under 15 minutes (879.6±0.8 s).[5] This radioactive decay, known as beta decay, is possible because the mass of the neutron is slightly greater than that of the proton. The free proton is stable. However, neutrons or protons bound in a nucleus can be stable or unstable, depending on the nuclide. Beta decay, in which neutrons decay to protons, or vice versa, is governed by the weak force, and it requires the emission or absorption of electrons and neutrinos, or their antiparticles.
Nuclear fission caused by absorption of a neutron by uranium-235. The heavy nuclide fragments into lighter components and additional neutrons.
Protons and neutrons behave almost identically under the influence of the nuclear force within the nucleus. The concept of isospin, in which the proton and neutron are viewed as two quantum states of the same particle, is used to model the interactions of nucleons by the nuclear or weak forces. Because of the strength of the nuclear force at short distances, the binding energy of nucleons is more than seven orders of magnitude larger than the electromagnetic energy binding electrons in atoms. Nuclear reactions (such as nuclear fission) therefore have an energy density that is more than ten million times that of chemical reactions. Because of the mass–energy equivalence, nuclear binding energies reduce the mass of nuclei. Ultimately, the ability of the nuclear force to store energy arising from the electromagnetic repulsion of nuclear components is the basis for most of the energy that makes nuclear reactors or bombs possible. In nuclear fission, the absorption of a neutron by a heavy nuclide (e.g., uranium-235) causes the nuclide to become unstable and break into light nuclides and additional neutrons. The positively charged light nuclides then repel, releasing electromagnetic potential energy.
The neutron is classified as a hadron, because it is a composite particle made of quarks. The neutron is also classified as a baryon, because it is composed of three valence quarks.[17] The finite size of the neutron and its magnetic moment both indicate that the neutron is a composite, rather than elementary, particle. A neutron contains two down quarks with charge −1/3e and one up quark with charge +2/3e.
Like protons, the quarks of the neutron are held together by the strong force, mediated by gluons.[18] The nuclear force results from secondary effects of the more fundamental strong force.
Discovery[edit]
The story of the discovery of the neutron and its properties is central to the extraordinary developments in atomic physics that occurred in the first half of the 20th century, leading ultimately to the atomic bomb in 1945. In the 1911 Rutherford model, the atom consisted of a small positively charged massive nucleus surrounded by a much larger cloud of negatively charged electrons. In 1920, Ernest Rutherford suggested that the nucleus consisted of positive protons and neutrally charged particles, suggested to be a proton and an electron bound in some way.[19] Electrons were assumed to reside within the nucleus because it was known that beta radiation consisted of electrons emitted from the nucleus.[19]
About the time Rutherford suggested the neutral proton-electron composite, several other publications appeared making similar suggestions, and in 1921 the American chemist W.D. Harkins first named the hypothetical particle a «neutron».[20][21] The name derives from the Latin root for neutralis (neuter) and the Greek suffix -on (a suffix used in the names of subatomic particles, i.e. electron and proton).[22][23] References to the word neutron in connection with the atom can be found in the literature as early as 1899, however.[21]
Throughout the 1920s, physicists assumed that the atomic nucleus was composed of protons and «nuclear electrons»[24][25] but there were obvious problems. It was difficult to reconcile the proton–electron model for nuclei with the Heisenberg uncertainty relation of quantum mechanics.[26][27] The Klein paradox,[28] discovered by Oskar Klein in 1928, presented further quantum mechanical objections to the notion of an electron confined within a nucleus.[26] Observed properties of atoms and molecules were inconsistent with the nuclear spin expected from the proton–electron hypothesis. Both protons and electrons carry an intrinsic spin of 1/2ħ. Isotopes of the same species (i.e. having the same number of protons) can have both integer or fractional spin, i.e. the neutron spin must be also fractional (1/2ħ). But there is no way to arrange the spins of an electron and a proton (supposed to bond to form a neutron) to get the fractional spin of a neutron.
In 1931, Walther Bothe and Herbert Becker found that if alpha particle radiation from polonium fell on beryllium, boron, or lithium, an unusually penetrating radiation was produced. The radiation was not influenced by an electric field, so Bothe and Becker assumed it was gamma radiation.[29][30] The following year Irène Joliot-Curie and Frédéric Joliot-Curie in Paris showed that if this «gamma» radiation fell on paraffin, or any other hydrogen-containing compound, it ejected protons of very high energy.[31] Neither Rutherford nor James Chadwick at the Cavendish Laboratory in Cambridge were convinced by the gamma ray interpretation.[32] Chadwick quickly performed a series of experiments that showed that the new radiation consisted of uncharged particles with about the same mass as the proton.[8][33][34] These particles were neutrons. Chadwick won the 1935 Nobel Prize in Physics for this discovery.[2]
Models depicting the nucleus and electron energy levels in hydrogen, helium, lithium, and neon atoms. In reality, the diameter of the nucleus is about 100,000 times smaller than the diameter of the atom.
Models for an atomic nucleus consisting of protons and neutrons were quickly developed by Werner Heisenberg[35][36][37] and others.[38][39] The proton–neutron model explained the puzzle of nuclear spins. The origins of beta radiation were explained by Enrico Fermi in 1934 by the process of beta decay, in which the neutron decays to a proton by creating an electron and a (at the time undiscovered) neutrino.[40] In 1935, Chadwick and his doctoral student Maurice Goldhaber reported the first accurate measurement of the mass of the neutron.[41][42]
By 1934, Fermi had bombarded heavier elements with neutrons to induce radioactivity in elements of high atomic number. In 1938, Fermi received the Nobel Prize in Physics «for his demonstrations of the existence of new radioactive elements produced by neutron irradiation, and for his related discovery of nuclear reactions brought about by slow neutrons».[43] In 1938 Otto Hahn, Lise Meitner, and Fritz Strassmann discovered nuclear fission, or the fractionation of uranium nuclei into light elements, induced by neutron bombardment.[44][45][46] In 1945 Hahn received the 1944 Nobel Prize in Chemistry «for his discovery of the fission of heavy atomic nuclei».[47][48][49] The discovery of nuclear fission would lead to the development of nuclear power and the atomic bomb by the end of World War II.
Beta decay and the stability of the nucleus[edit]
Neutrons are a necessary constituent of any atomic nucleus that contains more than one proton. Interacting protons have a mutual electromagnetic repulsion that is stronger than their attractive nuclear interaction, so proton-only nuclei are unstable (see diproton and neutron–proton ratio).[50] Neutrons bind with protons and one another in the nucleus via the nuclear force, effectively moderating the repulsive forces between the protons and stabilizing the nucleus.
Within the nucleus, neutrons can decay to protons, or vice versa. This process is called beta decay, and, for the neutron, it requires the emission of an electron and an anti-neutrino:
n0
→
p+
+
e−
+
ν
e
where
p+
,
e−
, and
ν
e denote the proton, electron and electron antineutrino products, respectively.[51] The decay of the proton to a neutron is similar:
p+
→
n0
+
e+
+
ν
e
where
n0
,
e+
, and
ν
e denote the neutron, positron and electron neutrino products, respectively. In these reactions, the original particle is not composed of the product particles; rather, the product particles are created at the instant of the reaction.
The neutrons and protons bound in a nucleus form a quantum mechanical system wherein each nucleon is bound in a particular, hierarchical quantum state. The emitted particles, that is, the decay products, carry away the energy excess as a nucleon falls from one quantum state to a lower energy state, while the proton (or neutron) changes to a neutron (or proton). Such decay processes can occur only if allowed by basic energy conservation and quantum mechanical constraints. The stability of nuclei is a consequence of these constraints.
«Free» neutrons or protons are nucleons that exist independently, free of any nucleus. Since the neutron is slightly more massive than a proton, the decay of a free neutron to a proton is allowed, while the decay of a free proton is energetically disallowed. A high-energy collision of a proton and an electron or neutrino can result in a neutron, however.
Free neutron decay[edit]
Outside the nucleus, free neutrons are unstable and have a mean lifetime of 879.6±0.8 s (about 14 minutes, 40 seconds); therefore the half-life for this process (which differs from the mean lifetime by a factor of ln(2) = 0.693) is 610.1±0.7 s (about 10 minutes, 10 seconds).[11][52] This decay is only possible because the mass of the proton is less than that of the neutron. By the mass-energy equivalence, when a neutron decays to a proton this way, a lower energy state is attained.
For the free neutron the decay energy for this process (based on the masses of the neutron, proton, and electron) is 0.782343 MeV. The maximal energy of the beta decay electron (in the process wherein the neutrino receives a vanishingly small amount of kinetic energy) has been measured at 0.782±0.013 MeV.[53] The latter number is not well-enough measured to determine the comparatively tiny rest mass of the neutrino (which must in theory be subtracted from the maximal electron kinetic energy) as well as neutrino mass is constrained by many other methods.
A small fraction (about one in 1000) of free neutrons decay with the same products, but add an extra particle in the form of an emitted gamma ray:
n0
→
p+
+
e−
+
ν
e +
γ
This gamma ray may be thought of as an «internal bremsstrahlung» that arises from the electromagnetic interaction of the emitted beta particle with the proton. Internal bremsstrahlung gamma ray production is also a minor feature of beta decays of bound neutrons (as discussed below).
A schematic of the nucleus of an atom indicating
β−
radiation, the emission of a fast electron from the nucleus (the accompanying antineutrino is omitted). In the Rutherford model for the nucleus, red spheres were protons with positive charge and blue spheres were protons tightly bound to an electron with no net charge.
The inset shows beta decay of a free neutron as it is understood today; an electron and antineutrino are created in this process.
A very small minority of neutron decays (about four per million) are so-called «two-body (neutron) decays», in which a proton, electron and antineutrino are produced as usual, but the electron fails to gain the 13.6 eV necessary energy to escape the proton (the ionization energy of hydrogen), and therefore simply remains bound to it, as a neutral hydrogen atom (one of the «two bodies»). In this type of free neutron decay, almost all of the neutron decay energy is carried off by the antineutrino (the other «body»). (The hydrogen atom recoils with a speed of only about (decay energy)/(hydrogen rest energy) times the speed of light, or 250 km/s.)
Bound neutron decay[edit]
While a free neutron has a half life of about 10.2 min, most neutrons within nuclei are stable. According to the nuclear shell model, the protons and neutrons of a nuclide are a quantum mechanical system organized into discrete energy levels with unique quantum numbers. For a neutron to decay, the resulting proton requires an available state at lower energy than the initial neutron state. In stable nuclei the possible lower energy states are all filled, meaning each state is occupied by a pair of protons, one with spin up, another with spin down. When all available proton states are filled, the Pauli exclusion principle disallows the decay of a neutron to a proton within stable nuclei. The situation is similar to electrons of an atom, where electrons that occupy distinct atomic orbitals are prevented by the exclusion principle from decaying to lower, already-filled, energy states, with the emission of a photon.
Neutrons in unstable nuclei can decay by beta decay as described above. In this case, an energetically allowed quantum state is available for the proton resulting from the decay. One example of this decay is carbon-14 (6 protons, 8 neutrons) that decays to nitrogen-14 (7 protons, 7 neutrons) with a half-life of about 5,730 years.
Similarly, a proton inside a nucleus can decay into a neutron, if an energetically allowed quantum state is available for the neutron.
The transformation of a proton to a neutron inside of a nucleus is also possible through electron capture:
p+
+
e−
→
n0
+
ν
e
Positron capture by neutrons in nuclei that contain an excess of neutrons is also possible, but is hindered because positrons are repelled by the positive nucleus, and quickly annihilate when they encounter electrons. Similar, but far more rare, reactions involve the capture of a neutrino by a nucleon in inverse beta decay.
Competition of beta decay types[edit]
Three types of beta decay in competition are illustrated by the single isotope copper-64 (29 protons, 35 neutrons), which has a half-life of about 12.7 hours. This isotope has one unpaired proton and one unpaired neutron, so either the proton or the neutron can decay. This particular nuclide is almost equally likely to undergo proton decay (by positron emission, 18% or by electron capture, 43%) or neutron decay (by electron emission, 39%).
Decay of the neutron by elementary particle physics[edit]
Within the theoretical framework of Standard Model for particle physics, the neutron is composed of two down quarks and an up quark. The only possible decay mode for the neutron that conserves baryon number is for one of the neutron’s quarks to change flavour via the weak interaction. The decay of one of the neutron’s down quarks into a lighter up quark can be achieved by the emission of a W boson. By this process, the Standard Model description of beta decay, the neutron decays into a proton (which contains one down and two up quarks), an electron, and an electron antineutrino.
The decay of the proton to a neutron occurs similarly through the electroweak force. The decay of one of the proton’s up quarks into a down quark can be achieved by the emission of a W boson. The proton decays into a neutron, a positron, and an electron neutrino. This reaction can only occur within an atomic nucleus which has a quantum state at lower energy available for the created neutron.
Intrinsic properties[edit]
Mass[edit]
The mass of a neutron cannot be directly determined by mass spectrometry since it has no electric charge. But since the masses of a proton and of a deuteron can be measured with a mass spectrometer, the mass of a neutron can be deduced by subtracting proton mass from deuteron mass, with the difference being the mass of the neutron plus the binding energy of deuterium (expressed as a positive emitted energy). The latter can be directly measured by measuring the energy (

The energy of the gamma ray can be measured to high precision by X-ray diffraction techniques, as was first done by Bell and Elliot in 1948. The best modern (1986) values for neutron mass by this technique are provided by Greene, et al.[54] These give a neutron mass of:
- mneutron = 1.008644904(14) Da
The value for the neutron mass in MeV is less accurately known, due to less accuracy in the known conversion of Da to MeV/c2:[55]
- mneutron = 939.56563(28) MeV/c2.
Another method to determine the mass of a neutron starts from the beta decay of the neutron, when the momenta of the resulting proton and electron are measured.
Electric charge[edit]
The total electric charge of the neutron is 0 e. This zero value has been tested experimentally, and the present experimental limit for the charge of the neutron is −2(8)×10−22 e,[6] or −3(13)×10−41 C. This value is consistent with zero, given the experimental uncertainties (indicated in parentheses). By comparison, the charge of the proton is +1 e.
Magnetic moment[edit]
Even though the neutron is a neutral particle, the magnetic moment of a neutron is not zero. The neutron is not affected by electric fields, but it is affected by magnetic fields. The value for the neutron’s magnetic moment was first directly measured by Luis Alvarez and Felix Bloch at Berkeley, California, in 1940.[56] Alvarez and Bloch determined the magnetic moment of the neutron to be μn= −1.93(2) μN, where μN is the nuclear magneton.
The magnetic moment of the neutron is an indication of its quark substructure and internal charge distribution.[57] In the quark model for hadrons, the neutron is composed of one up quark (charge +2/3 e) and two down quarks (charge −1/3 e).[57] The magnetic moment of the neutron can be modeled as a sum of the magnetic moments of the constituent quarks.[58] The calculation assumes that the quarks behave like pointlike Dirac particles, each having their own magnetic moment. Simplistically, the magnetic moment of the neutron can be viewed as resulting from the vector sum of the three quark magnetic moments, plus the orbital magnetic moments caused by the movement of the three charged quarks within the neutron.
In one of the early successes of the Standard Model in 1964 Mirza A.B. Beg, Benjamin W. Lee, and Abraham Pais theoretically calculated the ratio of proton to neutron magnetic moments to be −3/2, which agrees with the experimental value to within 3%.[59][60][61] The measured value for this ratio is −1.45989805(34).[4]
The above treatment compares neutrons with protons, allowing the complex behavior of quarks to be subtracted out between models, and merely exploring what the effects would be of differing quark charges (or quark type). Such calculations are enough to show that the interior of neutrons is very much like that of protons, save for the difference in quark composition with a down quark in the neutron replacing an up quark in the proton.
The neutron magnetic moment can be roughly computed by assuming a simple nonrelativistic, quantum mechanical wavefunction for baryons composed of three quarks. A straightforward calculation gives fairly accurate estimates for the magnetic moments of neutrons, protons, and other baryons.[58] For a neutron, the result of this calculation is that the magnetic moment of the neutron is given by μn= 4/3 μd − 1/3 μu, where μd and μu are the magnetic moments for the down and up quarks, respectively. This result combines the intrinsic magnetic moments of the quarks with their orbital magnetic moments, and assumes the three quarks are in a particular, dominant quantum state.
| Baryon | Magnetic moment of quark model |
Computed (  ) )
|
Observed (  ) )
|
|---|---|---|---|
| p | 4/3 μu − 1/3 μd | 2.79 | 2.793 |
| n | 4/3 μd − 1/3 μu | −1.86 | −1.913 |
The results of this calculation are encouraging, but the masses of the up or down quarks were assumed to be 1/3 the mass of a nucleon.[58] The masses of the quarks are actually only about 1% that of a nucleon.[62] The discrepancy stems from the complexity of the Standard Model for nucleons, where most of their mass originates in the gluon fields, virtual particles, and their associated energy that are essential aspects of the strong force.[62][63] Furthermore, the complex system of quarks and gluons that constitute a neutron requires a relativistic treatment.[64] But the nucleon magnetic moment has been successfully computed numerically from first principles, including all of the effects mentioned and using more realistic values for the quark masses. The calculation gave results that were in fair agreement with measurement, but it required significant computing resources.[65][66]
Spin[edit]
The neutron is a spin 1/2 particle, that is, it is a fermion with intrinsic angular momentum equal to 1/2 ħ, where ħ is the reduced Planck constant. For many years after the discovery of the neutron, its exact spin was ambiguous. Although it was assumed to be a spin 1/2 Dirac particle, the possibility that the neutron was a spin 3/2 particle lingered. The interactions of the neutron’s magnetic moment with an external magnetic field were exploited to finally determine the spin of the neutron.[67] In 1949, Hughes and Burgy measured neutrons reflected from a ferromagnetic mirror and found that the angular distribution of the reflections was consistent with spin 1/2.[68] In 1954, Sherwood, Stephenson, and Bernstein employed neutrons in a Stern–Gerlach experiment that used a magnetic field to separate the neutron spin states. They recorded two such spin states, consistent with a spin 1/2 particle.[67][69]
As a fermion, the neutron is subject to the Pauli exclusion principle; two neutrons cannot have the same quantum numbers. This is the source of the degeneracy pressure which makes neutron stars possible.
Structure and geometry of charge distribution[edit]
An article published in 2007 featuring a model-independent analysis concluded that the neutron has a negatively charged exterior, a positively charged middle, and a negative core.[70] In a simplified classical view, the negative «skin» of the neutron assists it to be attracted to the protons with which it interacts in the nucleus; but the main attraction between neutrons and protons is via the nuclear force, which does not involve electric charge.
The simplified classical view of the neutron’s charge distribution also «explains» the fact that the neutron magnetic dipole points in the opposite direction from its spin angular momentum vector (as compared to the proton). This gives the neutron, in effect, a magnetic moment which resembles a negatively charged particle. This can be reconciled classically with a neutral neutron composed of a charge distribution in which the negative sub-parts of the neutron have a larger average radius of distribution, and therefore contribute more to the particle’s magnetic dipole moment, than do the positive parts that are, on average, nearer the core.
Electric dipole moment[edit]
The Standard Model of particle physics predicts a tiny separation of positive and negative charge within the neutron leading to a permanent electric dipole moment.[71] But the predicted value is well below the current sensitivity of experiments. From several unsolved puzzles in particle physics, it is clear that the Standard Model is not the final and full description of all particles and their interactions. New theories going beyond the Standard Model generally lead to much larger predictions for the electric dipole moment of the neutron. Currently, there are at least four experiments trying to measure for the first time a finite neutron electric dipole moment, including:
- Cryogenic neutron EDM experiment being set up at the Institut Laue–Langevin[72]
- nEDM experiment under construction at the new UCN source at the Paul Scherrer Institute[73]
- nEDM experiment being envisaged at the Spallation Neutron Source[74][75]
- nEDM experiment being built at the Institut Laue–Langevin[76]
Antineutron[edit]
The antineutron is the antiparticle of the neutron. It was discovered by Bruce Cork in 1956, a year after the antiproton was discovered. CPT-symmetry puts strong constraints on the relative properties of particles and antiparticles, so studying antineutrons provides stringent tests on CPT-symmetry. The fractional difference in the masses of the neutron and antineutron is (9±6)×10−5. Since the difference is only about two standard deviations away from zero, this does not give any convincing evidence of CPT-violation.[11]
Neutron compounds[edit]
Dineutrons and tetraneutrons[edit]
The existence of stable clusters of 4 neutrons, or tetraneutrons, has been hypothesised by a team led by Francisco-Miguel Marqués at the CNRS Laboratory for Nuclear Physics based on observations of the disintegration of beryllium-14 nuclei. This is particularly interesting because current theory suggests that these clusters should not be stable.
In February 2016, Japanese physicist Susumu Shimoura of the University of Tokyo and co-workers reported they had observed the purported tetraneutrons for the first time experimentally.[77] Nuclear physicists around the world say this discovery, if confirmed, would be a milestone in the field of nuclear physics and certainly would deepen our understanding of the nuclear forces.[78][79]
The dineutron is another hypothetical particle. In 2012, Artemis Spyrou from Michigan State University and coworkers reported that they observed, for the first time, the dineutron emission in the decay of 16Be. The dineutron character is evidenced by a small emission angle between the two neutrons. The authors measured the two-neutron separation energy to be 1.35(10) MeV, in good agreement with shell model calculations, using standard interactions for this mass region.[80]
Neutronium and neutron stars[edit]
At extremely high pressures and temperatures, nucleons and electrons are believed to collapse into bulk neutronic matter, called neutronium. This is presumed to happen in neutron stars.
The extreme pressure inside a neutron star may deform the neutrons into a cubic symmetry, allowing tighter packing of neutrons.[81]
Detection[edit]
The common means of detecting a charged particle by looking for a track of ionization (such as in a cloud chamber) does not work for neutrons directly. Neutrons that elastically scatter off atoms can create an ionization track that is detectable, but the experiments are not as simple to carry out; other means for detecting neutrons, consisting of allowing them to interact with atomic nuclei, are more commonly used. The commonly used methods to detect neutrons can therefore be categorized according to the nuclear processes relied upon, mainly neutron capture or elastic scattering.[82]
Neutron detection by neutron capture[edit]
A common method for detecting neutrons involves converting the energy released from neutron capture reactions into electrical signals. Certain nuclides have a high neutron capture cross section, which is the probability of absorbing a neutron. Upon neutron capture, the compound nucleus emits more easily detectable radiation, for example an alpha particle, which is then detected. The nuclides 3
He
, 6
Li
, 10
B
, 233
U
, 235
U
, 237
Np
, and 239
Pu
are useful for this purpose.
Neutron detection by elastic scattering[edit]
Neutrons can elastically scatter off nuclei, causing the struck nucleus to recoil. Kinematically, a neutron can transfer more energy to a light nucleus such as hydrogen or helium than to a heavier nucleus. Detectors relying on elastic scattering are called fast neutron detectors. Recoiling nuclei can ionize and excite further atoms through collisions. Charge and/or scintillation light produced in this way can be collected to produce a detected signal. A major challenge in fast neutron detection is discerning such signals from erroneous signals produced by gamma radiation in the same detector. Methods such as pulse shape discrimination can be used in distinguishing neutron signals from gamma-ray signals, although certain inorganic scintillator-based detectors have been developed [83][84] to selectively detect neutrons in mixed radiation fields inherently without any additional techniques.
Fast neutron detectors have the advantage of not requiring a moderator, and are therefore capable of measuring the neutron’s energy, time of arrival, and in certain cases direction of incidence.
Sources and production[edit]
Free neutrons are unstable, although they have the longest half-life of any unstable subatomic particle by several orders of magnitude. Their half-life is still only about 10 minutes, so they can be obtained only from sources that produce them continuously.
Natural neutron background. A small natural background flux of free neutrons exists everywhere on Earth. In the atmosphere and deep into the ocean, the «neutron background» is caused by muons produced by cosmic ray interaction with the atmosphere. These high-energy muons are capable of penetration to considerable depths in water and soil. There, in striking atomic nuclei, among other reactions they induce spallation reactions in which a neutron is liberated from the nucleus. Within the Earth’s crust a second source is neutrons produced primarily by spontaneous fission of uranium and thorium present in crustal minerals. The neutron background is not strong enough to be a biological hazard, but it is of importance to very high resolution particle detectors that are looking for very rare events, such as (hypothesized) interactions that might be caused by particles of dark matter.[12] Recent research has shown that even thunderstorms can produce neutrons with energies of up to several tens of MeV.[85] Recent research has shown that the fluence of these neutrons lies between 10−9 and 10−13 per ms and per m2 depending on the detection altitude. The energy of most of these neutrons, even with initial energies of 20 MeV, decreases down to the keV range within 1 ms.[86]
Even stronger neutron background radiation is produced at the surface of Mars, where the atmosphere is thick enough to generate neutrons from cosmic ray muon production and neutron-spallation, but not thick enough to provide significant protection from the neutrons produced. These neutrons not only produce a Martian surface neutron radiation hazard from direct downward-going neutron radiation but may also produce a significant hazard from reflection of neutrons from the Martian surface, which will produce reflected neutron radiation penetrating upward into a Martian craft or habitat from the floor.[87]
Sources of neutrons for research. These include certain types of radioactive decay (spontaneous fission and neutron emission), and from certain nuclear reactions. Convenient nuclear reactions include tabletop reactions such as natural alpha and gamma bombardment of certain nuclides, often beryllium or deuterium, and induced nuclear fission, such as occurs in nuclear reactors. In addition, high-energy nuclear reactions (such as occur in cosmic radiation showers or accelerator collisions) also produce neutrons from disintegration of target nuclei. Small (tabletop) particle accelerators optimized to produce free neutrons in this way, are called neutron generators.
In practice, the most commonly used small laboratory sources of neutrons use radioactive decay to power neutron production. One noted neutron-producing radioisotope, californium-252 decays (half-life 2.65 years) by spontaneous fission 3% of the time with production of 3.7 neutrons per fission, and is used alone as a neutron source from this process. Nuclear reaction sources (that involve two materials) powered by radioisotopes use an alpha decay source plus a beryllium target, or else a source of high-energy gamma radiation from a source that undergoes beta decay followed by gamma decay, which produces photoneutrons on interaction of the high-energy gamma ray with ordinary stable beryllium, or else with the deuterium in heavy water. A popular source of the latter type is radioactive antimony-124 plus beryllium, a system with a half-life of 60.9 days, which can be constructed from natural antimony (which is 42.8% stable antimony-123) by activating it with neutrons in a nuclear reactor, then transported to where the neutron source is needed.[88]
Nuclear fission reactors naturally produce free neutrons; their role is to sustain the energy-producing chain reaction. The intense neutron radiation can also be used to produce various radioisotopes through the process of neutron activation, which is a type of neutron capture.
Experimental nuclear fusion reactors produce free neutrons as a waste product. But it is these neutrons that possess most of the energy, and converting that energy to a useful form has proved a difficult engineering challenge. Fusion reactors that generate neutrons are likely to create radioactive waste, but the waste is composed of neutron-activated lighter isotopes, which have relatively short (50–100 years) decay periods as compared to typical half-lives of 10,000 years[89] for fission waste, which is long due primarily to the long half-life of alpha-emitting transuranic actinides.[90] Some nuclear fusion-fission hybrids are proposed to make use of those neutrons to either maintain a subcritical reactor or to aid in nuclear transmutation of harmful long lived nuclear waste to shorter lived or stable nuclides.
Neutron beams and modification of beams after production[edit]
Free neutron beams are obtained from neutron sources by neutron transport. For access to intense neutron sources, researchers must go to a specialized neutron facility that operates a research reactor or a spallation source.
The neutron’s lack of total electric charge makes it difficult to steer or accelerate them. Charged particles can be accelerated, decelerated, or deflected by electric or magnetic fields. These methods have little effect on neutrons. But some effects may be attained by use of inhomogeneous magnetic fields because of the neutron’s magnetic moment. Neutrons can be controlled by methods that include moderation, reflection, and velocity selection. Thermal neutrons can be polarized by transmission through magnetic materials in a method analogous to the Faraday effect for photons. Cold neutrons of wavelengths of 6–7 angstroms can be produced in beams of a high degree of polarization, by use of magnetic mirrors and magnetized interference filters.[91]
Applications[edit]
The neutron plays an important role in many nuclear reactions. For example, neutron capture often results in neutron activation, inducing radioactivity. In particular, knowledge of neutrons and their behavior has been important in the development of nuclear reactors and nuclear weapons. The fissioning of elements like uranium-235 and plutonium-239 is caused by their absorption of neutrons.
Cold, thermal, and hot neutron radiation is commonly employed in neutron scattering facilities, where the radiation is used in a similar way one uses X-rays for the analysis of condensed matter. Neutrons are complementary to the latter in terms of atomic contrasts by different scattering cross sections; sensitivity to magnetism; energy range for inelastic neutron spectroscopy; and deep penetration into matter.
The development of «neutron lenses» based on total internal reflection within hollow glass capillary tubes or by reflection from dimpled aluminum plates has driven ongoing research into neutron microscopy and neutron/gamma ray tomography.[92][93][94][95]
A major use of neutrons is to excite delayed and prompt gamma rays from elements in materials. This forms the basis of neutron activation analysis (NAA) and prompt gamma neutron activation analysis (PGNAA). NAA is most often used to analyze small samples of materials in a nuclear reactor whilst PGNAA is most often used to analyze subterranean rocks around bore holes and industrial bulk materials on conveyor belts.
Another use of neutron emitters is the detection of light nuclei, in particular the hydrogen found in water molecules. When a fast neutron collides with a light nucleus, it loses a large fraction of its energy. By measuring the rate at which slow neutrons return to the probe after reflecting off of hydrogen nuclei, a neutron probe may determine the water content in soil.
Medical therapies[edit]
Because neutron radiation is both penetrating and ionizing, it can be exploited for medical treatments. However, neutron radiation can have the unfortunate side-effect of leaving the affected area radioactive. Neutron tomography is therefore not a viable medical application.
Fast neutron therapy uses high-energy neutrons typically greater than 20 MeV to treat cancer. Radiation therapy of cancers is based upon the biological response of cells to ionizing radiation. If radiation is delivered in small sessions to damage cancerous areas, normal tissue will have time to repair itself, while tumor cells often cannot.[96] Neutron radiation can deliver energy to a cancerous region at a rate an order of magnitude larger than gamma radiation.[97]
Beams of low-energy neutrons are used in boron neutron capture therapy to treat cancer. In boron neutron capture therapy, the patient is given a drug that contains boron and that preferentially accumulates in the tumor to be targeted. The tumor is then bombarded with very low-energy neutrons (although often higher than thermal energy) which are captured by the boron-10 isotope in the boron, which produces an excited state of boron-11 that then decays to produce lithium-7 and an alpha particle that have sufficient energy to kill the malignant cell, but insufficient range to damage nearby cells. For such a therapy to be applied to the treatment of cancer, a neutron source having an intensity of the order of a thousand million (109) neutrons per second per cm2 is preferred. Such fluxes require a research nuclear reactor.
Protection[edit]
Exposure to free neutrons can be hazardous, since the interaction of neutrons with molecules in the body can cause disruption to molecules and atoms, and can also cause reactions that give rise to other forms of radiation (such as protons). The normal precautions of radiation protection apply: Avoid exposure, stay as far from the source as possible, and keep exposure time to a minimum. But particular thought must be given to how to protect from neutron exposure. For other types of radiation, e.g., alpha particles, beta particles, or gamma rays, material of a high atomic number and with high density makes for good shielding; frequently, lead is used. However, this approach will not work with neutrons, since the absorption of neutrons does not increase straightforwardly with atomic number, as it does with alpha, beta, and gamma radiation. Instead one needs to look at the particular interactions neutrons have with matter (see the section on detection above). For example, hydrogen-rich materials are often used to shield against neutrons, since ordinary hydrogen both scatters and slows neutrons. This often means that simple concrete blocks or even paraffin-loaded plastic blocks afford better protection from neutrons than do far more dense materials. After slowing, neutrons may then be absorbed with an isotope that has high affinity for slow neutrons without causing secondary capture radiation, such as lithium-6.
Hydrogen-rich ordinary water affects neutron absorption in nuclear fission reactors: Usually, neutrons are so strongly absorbed by normal water that fuel enrichment with fissionable isotope is required.[clarification needed] The deuterium in heavy water has a very much lower absorption affinity for neutrons than does protium (normal light hydrogen). Deuterium is, therefore, used in CANDU-type reactors, in order to slow (moderate) neutron velocity, to increase the probability of nuclear fission compared to neutron capture.
Neutron temperature[edit]
Thermal neutrons[edit]
Thermal neutrons are free neutrons whose energies have a Maxwell–Boltzmann distribution with kT = 0.0253 eV (4.0×10−21 J) at room temperature. This gives characteristic (not average, or median) speed of 2.2 km/s. The name ‘thermal’ comes from their energy being that of the room temperature gas or material they are permeating. (see kinetic theory for energies and speeds of molecules). After a number of collisions (often in the range of 10–20) with nuclei, neutrons arrive at this energy level, provided that they are not absorbed.
In many substances, thermal neutron reactions show a much larger effective cross-section than reactions involving faster neutrons, and thermal neutrons can therefore be absorbed more readily (i.e., with higher probability) by any atomic nuclei that they collide with, creating a heavier – and often unstable – isotope of the chemical element as a result.
Most fission reactors use a neutron moderator to slow down, or thermalize the neutrons that are emitted by nuclear fission so that they are more easily captured, causing further fission. Others, called fast breeder reactors, use fission energy neutrons directly.
Cold neutrons[edit]
Cold neutrons are thermal neutrons that have been equilibrated in a very cold substance such as liquid deuterium. Such a cold source is placed in the moderator of a research reactor or spallation source. Cold neutrons are particularly valuable for neutron scattering experiments.[98]
The use of cold and very cold neutrons (VCN) have been a bit limited compared to the use of thermal neutrons due to the relatively lower flux and lack in optical components. However, Innovative solutions have been proposed to offer more options to the scientific community to promote the use of VCN.[99][100]
Cold neutron source providing neutrons at about the temperature of liquid hydrogen
Ultracold neutrons[edit]
Ultracold neutrons are produced by inelastic scattering of cold neutrons in substances with a low neutron absorption cross section at a temperature of a few kelvins, such as solid deuterium[101] or superfluid helium.[102] An alternative production method is the mechanical deceleration of cold neutrons exploiting the Doppler shift.[103][104]
Fission energy neutrons[edit]
A fast neutron is a free neutron with a kinetic energy level close to 1 MeV (1.6×10−13 J), hence a speed of ~14000 km/s (~ 5% of the speed of light). They are named fission energy or fast neutrons to distinguish them from lower-energy thermal neutrons, and high-energy neutrons produced in cosmic showers or accelerators. Fast neutrons are produced by nuclear processes such as nuclear fission. Neutrons produced in fission, as noted above, have a Maxwell–Boltzmann distribution of kinetic energies from 0 to ~14 MeV, a mean energy of 2 MeV (for 235U fission neutrons), and a mode of only 0.75 MeV, which means that more than half of them do not qualify as fast (and thus have almost no chance of initiating fission in fertile materials, such as 238U and 232Th).
Fast neutrons can be made into thermal neutrons via a process called moderation. This is done with a neutron moderator. In reactors, typically heavy water, light water, or graphite are used to moderate neutrons.
Fusion neutrons[edit]
The fusion reaction rate increases rapidly with temperature until it maximizes and then gradually drops off. The D–T rate peaks at a lower temperature (about 70 keV, or 800 million kelvins) and at a higher value than other reactions commonly considered for fusion energy.
D–T (deuterium–tritium) fusion is the fusion reaction that produces the most energetic neutrons, with 14.1 MeV of kinetic energy and traveling at 17% of the speed of light. D–T fusion is also the easiest fusion reaction to ignite, reaching near-peak rates even when the deuterium and tritium nuclei have only a thousandth as much kinetic energy as the 14.1 MeV that will be produced.
14.1 MeV neutrons have about 10 times as much energy as fission neutrons, and are very effective at fissioning even non-fissile heavy nuclei, and these high-energy fissions produce more neutrons on average than fissions by lower-energy neutrons. This makes D–T fusion neutron sources such as proposed tokamak power reactors useful for transmutation of transuranic waste. 14.1 MeV neutrons can also produce neutrons by knocking them loose from nuclei.
On the other hand, these very high-energy neutrons are less likely to simply be captured without causing fission or spallation. For these reasons, nuclear weapon design extensively uses D–T fusion 14.1 MeV neutrons to cause more fission. Fusion neutrons are able to cause fission in ordinarily non-fissile materials, such as depleted uranium (uranium-238), and these materials have been used in the jackets of thermonuclear weapons. Fusion neutrons also can cause fission in substances that are unsuitable or difficult to make into primary fission bombs, such as reactor grade plutonium. This physical fact thus causes ordinary non-weapons grade materials to become of concern in certain nuclear proliferation discussions and treaties.
Other fusion reactions produce much less energetic neutrons. D–D fusion produces a 2.45 MeV neutron and helium-3 half of the time, and produces tritium and a proton but no neutron the rest of the time. D–3He fusion produces no neutron.
Intermediate-energy neutrons[edit]
A fission energy neutron that has slowed down but not yet reached thermal energies is called an epithermal neutron.
Cross sections for both capture and fission reactions often have multiple resonance peaks at specific energies in the epithermal energy range. These are of less significance in a fast-neutron reactor, where most neutrons are absorbed before slowing down to this range, or in a well-moderated thermal reactor, where epithermal neutrons interact mostly with moderator nuclei, not with either fissile or fertile actinide nuclides. But in a partially moderated reactor with more interactions of epithermal neutrons with heavy metal nuclei, there are greater possibilities for transient changes in reactivity that might make reactor control more difficult.
Ratios of capture reactions to fission reactions are also worse (more captures without fission) in most nuclear fuels such as plutonium-239, making epithermal-spectrum reactors using these fuels less desirable, as captures not only waste the one neutron captured but also usually result in a nuclide that is not fissile with thermal or epithermal neutrons, though still fissionable with fast neutrons. The exception is uranium-233 of the thorium cycle, which has good capture-fission ratios at all neutron energies.
High-energy neutrons[edit]
High-energy neutrons have much more energy than fission energy neutrons and are generated as secondary particles by particle accelerators or in the atmosphere from cosmic rays. These high-energy neutrons are extremely efficient at ionization and far more likely to cause cell death than X-rays or protons.[105][106]
See also[edit]
Wikimedia Commons has media related to Neutrons.
- Ionizing radiation
- Isotope
- List of particles
- Neutron radiation and the Sievert radiation scale
- Neutronium
- Nuclear reaction
- Nucleosynthesis
- Neutron capture nucleosynthesis
- R-process
- S-process
- Thermal reactor
Neutron sources[edit]
- Neutron generator
- Neutron source
Processes involving neutrons[edit]
- Neutron bomb
- Neutron diffraction
- Neutron flux
- Neutron transport
- Cosmogenic radionuclide dating
References[edit]
- ^ Ernest Rutherford Archived 2011-08-03 at the Wayback Machine. Chemed.chem.purdue.edu. Retrieved on 2012-08-16.
- ^ a b 1935 Nobel Prize in Physics Archived 2017-10-03 at the Wayback Machine. Nobelprize.org. Retrieved on 2012-08-16.
- ^ a b «2018 CODATA recommended values» https://physics.nist.gov/cuu/Constants/index.html Archived 2018-01-22 at the Wayback Machine
- ^ a b c d e f Mohr, P.J.; Taylor, B.N. and Newell, D.B. (2014), «The 2014 CODATA Recommended Values of the Fundamental Physical Constants» Archived 2013-10-09 at the Wayback Machine (Web Version 7.0). The database was developed by J. Baker, M. Douma, and S. Kotochigova. (2014). National Institute of Standards and Technology, Gaithersburg, Maryland 20899.
- ^ a b Zyla, P. A. (2020). «n MEAN LIFE». PDG Live: 2020 Review of Particle Physics. Particle Data Group. Archived from the original on 17 January 2021. Retrieved 25 February 2021.
- ^ a b Olive, K.A.; (Particle Data Group); et al. (2014). «Review of Particle Physics» (PDF). Chinese Physics C. 38 (9): 1–708. arXiv:1412.1408. Bibcode:2014ChPhC..38i0001O. doi:10.1088/1674-1137/38/9/090001. PMID 10020536. S2CID 118395784. Archived (PDF) from the original on 2020-06-01. Retrieved 2017-10-26.
- ^ Thomas, A.W.; Weise, W. (2001), The Structure of the Nucleon, Wiley-WCH, Berlin, ISBN 978-3-527-40297-7
- ^ a b
Chadwick, James (1932). «Possible Existence of a Neutron». Nature. 129 (3252): 312. Bibcode:1932Natur.129Q.312C. doi:10.1038/129312a0. S2CID 4076465. - ^ Hahn, O. & Strassmann, F. (1939). «Über den Nachweis und das Verhalten der bei der Bestrahlung des Urans mittels Neutronen entstehenden Erdalkalimetalle» [On the detection and characteristics of the alkaline earth metals formed by irradiation of uranium with neutrons]. Die Naturwissenschaften. 27 (1): 11–15. Bibcode:1939NW…..27…11H. doi:10.1007/BF01488241. S2CID 5920336.
- ^ a b c Glasstone, Samuel; Dolan, Philip J., eds. (1977), The Effects of Nuclear Weapons (3rd ed.), U.S. Dept. of Defense and Energy Research and Development Administration, U.S. Government Printing Office, ISBN 978-1-60322-016-3
- ^ a b c Nakamura, K (2010). «Review of Particle Physics». Journal of Physics G. 37 (7A): 1–708. Bibcode:2010JPhG…37g5021N. doi:10.1088/0954-3899/37/7A/075021. PMID 10020536. PDF with 2011 partial update for the 2012 edition Archived 2012-09-20 at the Wayback Machine.
The exact value of the mean lifetime is still uncertain, due to conflicting results from experiments.
The Particle Data Group reports values up to six seconds apart (more than four standard deviations), commenting that «our 2006, 2008, and 2010 Reviews stayed with 885.7±0.8 s; but we noted that in light of SEREBROV 05 our value should be regarded as suspect until further experiments clarified matters. Since our 2010 Review, PICHLMAIER 10 has obtained a mean life of 880.7±1.8 s, closer to the value of SEREBROV 05 than to our average. And SEREBROV 10B[…] claims their values should be lowered by about 6 s, which would bring them into line with the two lower values. But those re-evaluations have not received an enthusiastic response from the experimenters in question; and in any case the Particle Data Group would have to await published changes (by those experimenters) of published values.At this point, we can think of nothing better to do than to average the seven best but discordant measurements, getting 881.5±1.5 s. Note that the error includes a scale factor of 2.7. This is a jump of 4.2 old (and 2.8 new) standard deviations. This state of affairs is a particularly unhappy one, because the value is so important. We again call upon the experimenters to clear this up.»
- ^ a b
Carson, M.J.; et al. (2004). «Neutron background in large-scale xenon detectors for dark matter searches». Astroparticle Physics. 21 (6): 667–687. arXiv:hep-ex/0404042. Bibcode:2004APh….21..667C. doi:10.1016/j.astropartphys.2004.05.001. S2CID 17887096. - ^ Nudat 2 Archived 2009-08-17 at the Wayback Machine. Nndc.bnl.gov. Retrieved on 2010-12-04.
- ^ Povh, B.; Rith, K.; Scholz, C.; Zetsche, F. (2002). Particles and Nuclei: An Introduction to the Physical Concepts. Berlin: Springer-Verlag. p. 73. ISBN 978-3-540-43823-6.
- ^
Basdevant, J.-L.; Rich, J.; Spiro, M. (2005). Fundamentals in Nuclear Physics. Springer. p. 155. ISBN 978-0-387-01672-6. - ^ Tipler, Paul Allen; Llewellyn, Ralph A. (2002). Modern Physics (4 ed.). Macmillan. p. 310. ISBN 978-0-7167-4345-3. Archived from the original on 2022-04-07. Retrieved 2020-08-27.
- ^
Adair, R.K. (1989). The Great Design: Particles, Fields, and Creation. Oxford University Press. p. 214. Bibcode:1988gdpf.book…..A. - ^
Cottingham, W.N.; Greenwood, D.A. (1986). An Introduction to Nuclear Physics. Cambridge University Press. ISBN 9780521657334. - ^ a b
Rutherford, E. (1920). «Nuclear Constitution of Atoms». Proceedings of the Royal Society A. 97 (686): 374–400. Bibcode:1920RSPSA..97..374R. doi:10.1098/rspa.1920.0040. - ^ Harkins, William (1921). «The constitution and stability of atomic nuclei. (A contribution to the subject of inorganic evolution.)». Philos. Mag. 42 (249): 305. doi:10.1080/14786442108633770.
- ^ a b Feather, N. (1960). «A history of neutrons and nuclei. Part 1». Contemporary Physics. 1 (3): 191–203. Bibcode:1960ConPh…1..191F. doi:10.1080/00107516008202611.
- ^ Pauli, Wolfgang; Hermann, A.; Meyenn, K.v; Weisskopff, V.F (1985). «Das Jahr 1932 Die Entdeckung des Neutrons». Wolfgang Pauli. Sources in the History of Mathematics and Physical Sciences. Vol. 6. pp. 105–144. doi:10.1007/978-3-540-78801-0_3. ISBN 978-3-540-13609-5.
- ^ Hendry, John, ed. (1984). Cambridge Physics in the Thirties. Bristol: Adam Hilger. ISBN 978-0852747612.
- ^ Brown, Laurie M. (1978). «The idea of the neutrino». Physics Today. 31 (9): 23–28. Bibcode:1978PhT….31i..23B. doi:10.1063/1.2995181.
- ^ Friedlander G., Kennedy J.W. and Miller J.M. (1964) Nuclear and Radiochemistry (2nd edition), Wiley, pp. 22–23 and 38–39
- ^ a b Stuewer, Roger H. (1985). «Niels Bohr and Nuclear Physics». In French, A.P.; Kennedy, P.J. (eds.). Niels Bohr: A Centenary Volume. Harvard University Press. pp. 197–220. ISBN 978-0674624160.
- ^ Pais, Abraham (1986). Inward Bound. Oxford: Oxford University Press. p. 299. ISBN 978-0198519973.
- ^ Klein, O. (1929). «Die Reflexion von Elektronen an einem Potentialsprung nach der relativistischen Dynamik von Dirac». Zeitschrift für Physik. 53 (3–4): 157–165. Bibcode:1929ZPhy…53..157K. doi:10.1007/BF01339716. S2CID 121771000.
- ^ Bothe, W.; Becker, H. (1930). «Künstliche Erregung von Kern-γ-Strahlen» [Artificial excitation of nuclear γ-radiation]. Zeitschrift für Physik. 66 (5–6): 289–306. Bibcode:1930ZPhy…66..289B. doi:10.1007/BF01390908. S2CID 122888356.
- ^ Becker, H.; Bothe, W. (1932). «Die in Bor und Beryllium erregten γ-Strahlen» [Γ-rays excited in boron and beryllium]. Zeitschrift für Physik. 76 (7–8): 421–438. Bibcode:1932ZPhy…76..421B. doi:10.1007/BF01336726. S2CID 121188471.
- ^ Joliot-Curie, Irène & Joliot, Frédéric (1932). «Émission de protons de grande vitesse par les substances hydrogénées sous l’influence des rayons γ très pénétrants» [Emission of high-speed protons by hydrogenated substances under the influence of very penetrating γ-rays]. Comptes Rendus. 194: 273. Archived from the original on 2022-03-04. Retrieved 2012-06-16.
- ^ Brown, Andrew (1997). The Neutron and the Bomb: A Biography of Sir James Chadwick. Oxford University Press. ISBN 978-0-19-853992-6.
- ^ «Atop the Physics Wave: Rutherford Back in Cambridge, 1919–1937». Rutherford’s Nuclear World. American Institute of Physics. 2011–2014. Archived from the original on 21 October 2014. Retrieved 19 August 2014.
- ^ Chadwick, J. (1933). «Bakerian Lecture. The Neutron». Proceedings of the Royal Society A. 142 (846): 1–25. Bibcode:1933RSPSA.142….1C. doi:10.1098/rspa.1933.0152.
- ^ Heisenberg, W. (1932). «Über den Bau der Atomkerne. I». Zeitschrift für Physik. 77 (1–2): 1–11. Bibcode:1932ZPhy…77….1H. doi:10.1007/BF01342433. S2CID 186218053.
- ^ Heisenberg, W. (1932). «Über den Bau der Atomkerne. II». Zeitschrift für Physik. 78 (3–4): 156–164. Bibcode:1932ZPhy…78..156H. doi:10.1007/BF01337585. S2CID 186221789.
- ^ Heisenberg, W. (1933). «Über den Bau der Atomkerne. III». Zeitschrift für Physik. 80 (9–10): 587–596. Bibcode:1933ZPhy…80..587H. doi:10.1007/BF01335696. S2CID 126422047.
- ^ Iwanenko, D. (1932). «The Neutron Hypothesis». Nature. 129 (3265): 798. Bibcode:1932Natur.129..798I. doi:10.1038/129798d0. S2CID 4096734.
- ^ Miller A.I. (1995) Early Quantum Electrodynamics: A Sourcebook, Cambridge University Press, Cambridge, ISBN 0521568919, pp. 84–88.
- ^ Wilson, Fred L. (1968). «Fermi’s Theory of Beta Decay». American Journal of Physics. 36 (12): 1150–1160. Bibcode:1968AmJPh..36.1150W. doi:10.1119/1.1974382.
- ^ Chadwick, J.; Goldhaber, M. (1934). «A nuclear photo-effect: disintegration of the diplon by gamma rays». Nature. 134 (3381): 237–238. Bibcode:1934Natur.134..237C. doi:10.1038/134237a0. S2CID 4137231.
- ^ Chadwick, J.; Goldhaber, M. (1935). «A nuclear photoelectric effect». Proceedings of the Royal Society of London A. 151 (873): 479–493. Bibcode:1935RSPSA.151..479C. doi:10.1098/rspa.1935.0162.
- ^ Cooper, Dan (1999). Enrico Fermi: And the Revolutions in Modern physics. New York: Oxford University Press. ISBN 978-0-19-511762-2. OCLC 39508200.
- ^ Hahn, O. (1958). «The Discovery of Fission». Scientific American. 198 (2): 76–84. Bibcode:1958SciAm.198b..76H. doi:10.1038/scientificamerican0258-76.
- ^ Rife, Patricia (1999). Lise Meitner and the dawn of the nuclear age. Basel, Switzerland: Birkhäuser. ISBN 978-0-8176-3732-3.
- ^ Hahn, O.; Strassmann, F. (10 February 1939). «Proof of the Formation of Active Isotopes of Barium from Uranium and Thorium Irradiated with Neutrons; Proof of the Existence of More Active Fragments Produced by Uranium Fission». Die Naturwissenschaften. 27 (6): 89–95. Bibcode:1939NW…..27…89H. doi:10.1007/BF01488988. S2CID 33512939.
- ^ «The Nobel Prize in Chemistry 1944». Nobel Foundation. Archived from the original on 2018-12-26. Retrieved 2007-12-17.
- ^ Bernstein, Jeremy (2001). Hitler’s uranium club: the secret recordings at Farm Hall. New York: Copernicus. p. 281. ISBN 978-0-387-95089-1.
- ^ «The Nobel Prize in Chemistry 1944: Presentation Speech». Nobel Foundation. Archived from the original on 2007-10-25. Retrieved 2008-01-03.
- ^ Sir James Chadwick’s Discovery of Neutrons Archived 2011-10-26 at the Wayback Machine. ANS Nuclear Cafe. Retrieved on 2012-08-16.
- ^ Particle Data Group Summary Data Table on Baryons Archived 2011-09-10 at the Wayback Machine. lbl.gov (2007). Retrieved on 2012-08-16.
- ^ Tanabashi, M. (2018). «The Review of Particle Physics». Physical Review D. 54 (1): 1653. doi:10.1103/physrevd.54.1. PMID 10020536. Archived from the original on 2020-10-19. Retrieved 2020-10-14.
- ^ Basic Ideas and Concepts in Nuclear Physics: An Introductory Approach, Third Edition; K. Heyde Taylor & Francis 2004. Print ISBN 978-0-7503-0980-6, 978-1-4200-5494-1. doi:10.1201/9781420054941. full text[permanent dead link]
- ^ Greene, GL; et al. (1986). «New determination of the deuteron binding energy and the neutron mass». Physical Review Letters. 56 (8): 819–822. Bibcode:1986PhRvL..56..819G. doi:10.1103/PhysRevLett.56.819. PMID 10033294.
- ^ Byrne, J. Neutrons, Nuclei, and Matter, Dover Publications, Mineola, New York, 2011, ISBN 0486482383, pp. 18–19
- ^ Alvarez, L.W; Bloch, F. (1940). «A quantitative determination of the neutron magnetic moment in absolute nuclear magnetons». Physical Review. 57 (2): 111–122. Bibcode:1940PhRv…57..111A. doi:10.1103/physrev.57.111.
- ^ a b Gell, Y.; Lichtenberg, D.B. (1969). «Quark model and the magnetic moments of proton and neutron». Il Nuovo Cimento A. Series 10. 61 (1): 27–40. Bibcode:1969NCimA..61…27G. doi:10.1007/BF02760010. S2CID 123822660.
- ^ a b c Perkins, Donald H. (1982). Introduction to High Energy Physics. Addison Wesley, Reading, Massachusetts. pp. 201–202. ISBN 978-0-201-05757-7.
- ^
Greenberg, O.W. (2009), «Color charge degree of freedom in particle physics», Compendium of Quantum Physics, Springer Berlin Heidelberg, pp. 109–111, arXiv:0805.0289, doi:10.1007/978-3-540-70626-7_32, ISBN 978-3-540-70622-9, S2CID 17512393 - ^ Beg, M.A.B.; Lee, B.W.; Pais, A. (1964). «SU(6) and electromagnetic interactions». Physical Review Letters. 13 (16): 514–517, erratum 650. Bibcode:1964PhRvL..13..514B. doi:10.1103/physrevlett.13.514.
- ^ Sakita, B. (1964). «Electromagnetic properties of baryons in the supermultiplet scheme of elementary particles». Physical Review Letters. 13 (21): 643–646. Bibcode:1964PhRvL..13..643S. doi:10.1103/physrevlett.13.643.
- ^ a b Cho, Adrian (2 April 2010). «Mass of the Common Quark Finally Nailed Down». Science. American Association for the Advancement of Science. Archived from the original on 27 August 2015. Retrieved 27 September 2014.
- ^ Wilczek, F. (2003). «The Origin of Mass» (PDF). MIT Physics Annual: 24–35. Archived (PDF) from the original on June 20, 2015. Retrieved May 8, 2015.
- ^
Ji, Xiangdong (1995). «A QCD Analysis of the Mass Structure of the Nucleon». Physical Review Letters. 74 (7): 1071–1074. arXiv:hep-ph/9410274. Bibcode:1995PhRvL..74.1071J. doi:10.1103/PhysRevLett.74.1071. PMID 10058927. S2CID 15148740. - ^ Martinelli, G.; Parisi, G.; Petronzio, R.; Rapuano, F. (1982). «The proton and neutron magnetic moments in lattice QCD» (PDF). Physics Letters B. 116 (6): 434–436. Bibcode:1982PhLB..116..434M. doi:10.1016/0370-2693(82)90162-9. Archived (PDF) from the original on 2020-04-20. Retrieved 2019-08-25.
- ^ Kincade, Kathy (2 February 2015). «Pinpointing the magnetic moments of nuclear matter». Phys.org. Archived from the original on 2 May 2015. Retrieved May 8, 2015.
- ^ a b J. Byrne (2011). Neutrons, Nuclei and Matter: An exploration of the physics of slow neutrons. Mineola, NY: Dover Publications. pp. 28–31. ISBN 978-0486482385.
- ^ Hughes, D.J.; Burgy, M.T. (1949). «Reflection and polarization of neutrons by magnetized mirrors» (PDF). Physical Review. 76 (9): 1413–1414. Bibcode:1949PhRv…76.1413H. doi:10.1103/PhysRev.76.1413. Archived from the original (PDF) on 2016-08-13. Retrieved 2016-06-26.
- ^ Sherwood, J.E.; Stephenson, T.E.; Bernstein, S. (1954). «Stern-Gerlach experiment on polarized neutrons». Physical Review. 96 (6): 1546–1548. Bibcode:1954PhRv…96.1546S. doi:10.1103/PhysRev.96.1546.
- ^
Miller, G.A. (2007). «Charge Densities of the Neutron and Proton». Physical Review Letters. 99 (11): 112001. arXiv:0705.2409. Bibcode:2007PhRvL..99k2001M. doi:10.1103/PhysRevLett.99.112001. PMID 17930428. S2CID 119120565. - ^ «Pear-shaped particles probe big-bang mystery» (Press release). University of Sussex. 20 February 2006. Archived from the original on 2011-06-07. Retrieved 2009-12-14.
- ^ A cryogenic experiment to search for the EDM of the neutron Archived 2012-02-16 at the Wayback Machine. Hepwww.rl.ac.uk. Retrieved on 2012-08-16.
- ^ Search for the neutron electric dipole moment: nEDM Archived 2015-09-25 at the Wayback Machine. Nedm.web.psi.ch (2001-09-12). Retrieved on 2012-08-16.
- ^ US nEDM ORNL experiment public page Archived 2017-04-30 at the Wayback Machine. Retrieved on 2017-02-08.
- ^ SNS Neutron EDM Experiment Archived 2011-02-10 at the Wayback Machine. P25ext.lanl.gov. Retrieved on 2012-08-16.
- ^ Measurement of the Neutron Electric Dipole Moment Archived 2011-08-23 at the Wayback Machine. Nrd.pnpi.spb.ru. Retrieved on 2012-08-16.
- ^ Kisamori, K.; et al. (2016). «Candidate Resonant Tetraneutron State Populated by the He4(He8,Be8) Reaction». Physical Review Letters. 116 (5): 052501. Bibcode:2016PhRvL.116e2501K. doi:10.1103/PhysRevLett.116.052501. PMID 26894705.
- ^ «Physicists find signs of four-neutron nucleus». 2016-02-24. Archived from the original on 2017-07-29. Retrieved 2017-06-27.
- ^ Orr, Nigel (2016-02-03). «Can Four Neutrons Tango?». Physics. 9: 14. Bibcode:2016PhyOJ…9…14O. doi:10.1103/Physics.9.14.
- ^ Spyrou, A.; et al. (2012). «First Observation of Ground State Dineutron Decay: 16Be». Physical Review Letters. 108 (10): 102501. Bibcode:2012PhRvL.108j2501S. doi:10.1103/PhysRevLett.108.102501. PMID 22463404.
- ^ Llanes-Estrada, Felipe J.; Moreno Navarro, Gaspar (2012). «Cubic neutrons». Modern Physics Letters A. 27 (6): 1250033–1–1250033–7. arXiv:1108.1859. Bibcode:2012MPLA…2750033L. doi:10.1142/S0217732312500332. S2CID 118407306.
- ^ Knoll, Glenn F. (1979). «Ch. 14». Radiation Detection and Measurement. John Wiley & Sons. ISBN 978-0471495451.
- ^ Ghosh, P.; W. Fu; M. J. Harrison; P. K. Doyle; N. S. Edwards; J. A. Roberts; D. S. McGregor (2018). «A high-efficiency, low-Ĉerenkov Micro-Layered Fast-Neutron Detector for the TREAT hodoscope». Nuclear Instruments and Methods in Physics: A. 904: 100–106. Bibcode:2018NIMPA.904..100G. doi:10.1016/j.nima.2018.07.035. S2CID 126130994. Archived from the original on 2022-04-12. Retrieved 2020-04-14.
- ^ Ghosh, P.; D. M. Nichols; W. Fu; J. A. Roberts; D. S. McGregor (2020). «Gamma-Ray Rejection of the SiPM-coupled Micro-Layered Fast-Neutron Detector». 2019 IEEE Nuclear Science Symposium and Medical Imaging Conference (NSS/MIC): 1–3. doi:10.1109/NSS/MIC42101.2019.9059869. ISBN 978-1-7281-4164-0. S2CID 204877955.
- ^ Köhn, C.; Ebert, U. (2015). «Calculation of beams of positrons, neutrons and protons associated with terrestrial gamma-ray flashes» (PDF). Journal of Geophysical Research: Atmospheres. 23 (4): 1620–1635. Bibcode:2015JGRD..120.1620K. doi:10.1002/2014JD022229. Archived (PDF) from the original on 2019-12-23. Retrieved 2019-08-25.
- ^ Köhn, C.; Diniz, G.; Harakeh, Muhsin (2017). «Production mechanisms of leptons, photons, and hadrons and their possible feedback close to lightning leaders». Journal of Geophysical Research: Atmospheres. 122 (2): 1365–1383. Bibcode:2017JGRD..122.1365K. doi:10.1002/2016JD025445. PMC 5349290. PMID 28357174.
- ^ Clowdsley, MS; Wilson, JW; Kim, MH; Singleterry, RC; Tripathi, RK; Heinbockel, JH; Badavi, FF; Shinn, JL (2001). «Neutron Environments on the Martian Surface» (PDF). Physica Medica. 17 (Suppl 1): 94–96. PMID 11770546. Archived from the original (PDF) on 2005-02-25.
- ^ Byrne, J. Neutrons, Nuclei, and Matter, Dover Publications, Mineola, New York, 2011, ISBN 0486482383, pp. 32–33.
- ^ «Isotopes and Radioactivity Tutorial». Archived from the original on 2020-02-14. Retrieved 2020-04-16.
- ^ Science/Nature |Q&A: Nuclear fusion reactor Archived 2022-02-25 at the Wayback Machine. BBC News (2006-02-06). Retrieved on 2010-12-04.
- ^ Byrne, J. Neutrons, Nuclei, and Matter, Dover Publications, Mineola, New York, 2011, ISBN 0486482383, p. 453.
- ^ Kumakhov, M.A.; Sharov, V.A. (1992). «A neutron lens». Nature. 357 (6377): 390–391. Bibcode:1992Natur.357..390K. doi:10.1038/357390a0. S2CID 37062511.
- ^ Physorg.com, «New Way of ‘Seeing’: A ‘Neutron Microscope'» Archived 2012-01-24 at the Wayback Machine. Physorg.com (2004-07-30). Retrieved on 2012-08-16.
- ^ «NASA Develops a Nugget to Search for Life in Space» Archived 2014-03-08 at the Wayback Machine. NASA.gov (2007-11-30). Retrieved on 2012-08-16.
- ^ Ioffe, A.; Dabagov, S.; Kumakhov, M. (1995-01-01). «Effective neutron bending at large angles». Neutron News. 6 (3): 20–21. doi:10.1080/10448639508217696. ISSN 1044-8632.
- ^ Hall EJ (2000). Radiobiology for the Radiologist. Lippincott Williams & Wilkins; 5th edition
- ^ Johns HE and Cunningham JR (1978). The Physics of Radiology. Charles C Thomas 3rd edition
- ^ brian.maranville@nist.gov (2017-04-17). «How neutrons are useful». NIST. Archived from the original on 2021-01-25. Retrieved 2021-01-21.
- ^ E Hadden; Y Iso; A Kume; K Umemoto; T Jenke; M Fally; J Klepp; Y Tomita (2022). «HIGHLY EFFICIENT HOLOGRAPHIC OPTICAL ELEMENTS FOR COLD NEUTRON EXPERIMENTS». doi:10.13140/RG.2.2.26033.04963.
- ^ Hadden, Elhoucine; Iso, Yuko; Kume, Atsushi; Umemoto, Koichi; Jenke, Tobias; Fally, Martin; Klepp, Jürgen; Tomita, Yasuo (2022-05-24). McLeod, Robert R; Tomita, Yasuo; Sheridan, John T; Pascual Villalobos, Inmaculada (eds.). «Nanodiamond-based nanoparticle-polymer composite gratings with extremely large neutron refractive index modulation». Photosensitive Materials and Their Applications II. SPIE. 12151: 70–76. Bibcode:2022SPIE12151E..09H. doi:10.1117/12.2623661. ISBN 9781510651784. S2CID 249056691.
- ^ B. Lauss (May 2012). «Startup of the high-intensity ultracold neutron source at the Paul Scherrer Institute». Hyperfine Interact. 211 (1): 21–25. arXiv:1202.6003. Bibcode:2012HyInt.211…21L. doi:10.1007/s10751-012-0578-7. S2CID 119164071.
- ^ R. Golub & J. M. Pendlebury (1977). «The interaction of Ultra-Cold Neutrons (UCN) with liquid helium and a superthermal UCN source». Phys. Lett. A. 62 (5): 337–339. Bibcode:1977PhLA…62..337G. doi:10.1016/0375-9601(77)90434-0.
- ^ A. Steyerl; H. Nagel; F.-X. Schreiber; K.-A. Steinhauser; R. Gähler; W. Gläser; P. Ageron; J. M. Astruc; W. Drexel; G. Gervais & W. Mampe (1986). «A new source of cold and ultracold neutrons». Phys. Lett. A. 116 (7): 347–352. Bibcode:1986PhLA..116..347S. doi:10.1016/0375-9601(86)90587-6.
- ^ Stefan Döge; Jürgen Hingerl & Christoph Morkel (Feb 2020). «Measured velocity spectra and neutron densities of the PF2 ultracold-neutron beam ports at the Institut Laue–Langevin». Nucl. Instrum. Methods A. 953: 163112. arXiv:2001.04538. Bibcode:2020NIMPA.95363112D. doi:10.1016/j.nima.2019.163112. S2CID 209942845. Archived from the original on 2021-02-24. Retrieved 2020-04-24.
- ^ Freeman, Tami (May 23, 2008). «Facing up to secondary neutrons». Medical Physics Web. Archived from the original on 2010-12-20. Retrieved 2011-02-08.
- ^ Heilbronn, L.; Nakamura, T; Iwata, Y; Kurosawa, T; Iwase, H; Townsend, LW (2005). «Expand+Overview of secondary neutron production relevant to shielding in space». Radiation Protection Dosimetry. 116 (1–4): 140–143. doi:10.1093/rpd/nci033. PMID 16604615. Archived from the original on 2019-01-26. Retrieved 2019-01-25.
Further reading[edit]
- James Byrne, Neutrons, Nuclei and Matter: An Exploration of the Physics of Slow Neutrons. Mineola, New York: Dover Publications, 2011. ISBN 0486482383.
- Abraham Pais, Inward Bound, Oxford: Oxford University Press, 1986. ISBN 0198519974.
- Sin-Itiro Tomonaga, The Story of Spin, The University of Chicago Press, 1997
- Herwig Schopper, Weak interactions and nuclear beta decay, Publisher, North-Holland Pub. Co., 1966.
- Annotated bibliography for neutrons from the Alsos Digital Library for Nuclear Issues

The quark content of the neutron. The color assignment of individual quarks is arbitrary, but all three colors must be present. Forces between quarks are mediated by gluons. |
|
| Classification | Baryon |
|---|---|
| Composition | 1 up quark, 2 down quarks |
| Statistics | Fermionic |
| Family | Hadron |
| Interactions | Gravity, weak, strong, electromagnetic |
| Symbol | n , n0 , N0 |
| Antiparticle | Antineutron |
| Theorized | Ernest Rutherford[1] (1920) |
| Discovered | James Chadwick[2] (1932) |
| Mass | 1.67492749804(95)×10−27 kg[3] 939.56542052(54) MeV/c2[3] 1.00866491588(49) Da[4] |
| Mean lifetime | 879.4(6) s (free)[5] |
| Electric charge | 0 e (−2±  ×10−22 e (experimental limits)[6] ×10−22 e (experimental limits)[6] |
| Electric dipole moment | < 2.9×10−26 e⋅cm (experimental upper limit) |
| Electric polarizability | 1.16(15)×10−3 fm3 |
| Magnetic moment | −0.96623650(23)×10−26 J·T−1[4] −1.04187563(25)×10−3 μB[4] −1.91304273(45) μN[4] |
| Magnetic polarizability | 3.7(20)×10−4 fm3 |
| Spin | 1/2 |
| Isospin | −1/2 |
| Parity | +1 |
| Condensed | I(JP) = 1/2(1/2+) |
The neutron is a subatomic particle, symbol
n
or
n0
, which has a neutral (not positive or negative) charge, and a mass slightly greater than that of a proton. Protons and neutrons constitute the nuclei of atoms. Since protons and neutrons behave similarly within the nucleus, and each has a mass of approximately one atomic mass unit, they are both referred to as nucleons.[7] Their properties and interactions are described by nuclear physics. Protons and neutrons are not elementary particles; each is composed of three quarks.
The chemical properties of an atom are mostly determined by the configuration of electrons that orbit the atom’s heavy nucleus. The electron configuration is determined by the charge of the nucleus, which is determined by the number of protons, or atomic number. The number of neutrons is the neutron number. Neutrons do not affect the electron configuration, but the sum of atomic and neutron numbers is the mass of the nucleus.
Atoms of a chemical element that differ only in neutron number are called isotopes. For example, carbon, with atomic number 6, has an abundant isotope carbon-12 with 6 neutrons and a rare isotope carbon-13 with 7 neutrons. Some elements occur in nature with only one stable isotope, such as fluorine; Other elements occur with many stable isotopes, such as tin with ten stable isotopes, and some elements such as technetium have no stable isotope.
The properties of an atomic nucleus depend on both atomic and neutron numbers. With their positive charge, the protons within the nucleus are repelled by the long-range electromagnetic force, but the much stronger, but short-range, nuclear force binds the nucleons closely together. Neutrons are required for the stability of nuclei, with the exception of the single-proton hydrogen nucleus. Neutrons are produced copiously in nuclear fission and fusion. They are a primary contributor to the nucleosynthesis of chemical elements within stars through fission, fusion, and neutron capture processes.
The neutron is essential to the production of nuclear power. In the decade after the neutron was discovered by James Chadwick in 1932,[8] neutrons were used to induce many different types of nuclear transmutations. With the discovery of nuclear fission in 1938,[9] it was quickly realized that, if a fission event produced neutrons, each of these neutrons might cause further fission events, in a cascade known as a nuclear chain reaction.[10] These events and findings led to the first self-sustaining nuclear reactor (Chicago Pile-1, 1942) and the first nuclear weapon (Trinity, 1945).
Dedicated neutron sources like neutron generators, research reactors and spallation sources produce free neutrons for use in irradiation and in neutron scattering experiments. A free neutron spontaneously decays to a proton, an electron, and an antineutrino, with a mean lifetime of about 15 minutes.[11] Free neutrons do not directly ionize atoms, but they do indirectly cause ionizing radiation, so they can be a biological hazard, depending on dose.[10] A small natural «neutron background» flux of free neutrons exists on Earth, caused by cosmic ray showers, and by the natural radioactivity of spontaneously fissionable elements in the Earth’s crust.[12]
Description[edit]
An atomic nucleus is formed by a number of protons, Z (the atomic number), and a number of neutrons, N (the neutron number), bound together by the nuclear force. The atomic number determines the chemical properties of the atom, and the neutron number determines the isotope or nuclide.[10] The terms isotope and nuclide are often used synonymously, but they refer to chemical and nuclear properties, respectively. Isotopes are nuclides with the same atomic number, but different neutron number. Nuclides with the same neutron number, but different atomic number, are called isotones. The atomic mass number, A, is equal to the sum of atomic and neutron numbers. Nuclides with the same atomic mass number, but different atomic and neutron numbers, are called isobars.
The nucleus of the most common isotope of the hydrogen atom (with the chemical symbol 1H) is a lone proton. The nuclei of the heavy hydrogen isotopes deuterium (D or 2H) and tritium (T or 3H) contain one proton bound to one and two neutrons, respectively. All other types of atomic nuclei are composed of two or more protons and various numbers of neutrons. The most common nuclide of the common chemical element lead, 208Pb, has 82 protons and 126 neutrons, for example. The table of nuclides comprises all the known nuclides. Even though it is not a chemical element, the neutron is included in this table.[13]
The free neutron has a mass of 939565413.3 eV/c2, or 1.674927471×10−27 kg, or 1.00866491588 Da.[4] The neutron has a mean square radius of about 0.8×10−15 m, or 0.8 fm,[14] and it is a spin-½ fermion.[15] The neutron has no measurable electric charge. With its positive electric charge, the proton is directly influenced by electric fields, whereas the neutron is unaffected by electric fields. But the neutron has a magnetic moment, so the neutron is influenced by magnetic fields. The neutron’s magnetic moment has a negative value, because its orientation is opposite to the neutron’s spin.[16]
A free neutron is unstable, decaying to a proton, electron and antineutrino with a mean lifetime of just under 15 minutes (879.6±0.8 s).[5] This radioactive decay, known as beta decay, is possible because the mass of the neutron is slightly greater than that of the proton. The free proton is stable. However, neutrons or protons bound in a nucleus can be stable or unstable, depending on the nuclide. Beta decay, in which neutrons decay to protons, or vice versa, is governed by the weak force, and it requires the emission or absorption of electrons and neutrinos, or their antiparticles.
Nuclear fission caused by absorption of a neutron by uranium-235. The heavy nuclide fragments into lighter components and additional neutrons.
Protons and neutrons behave almost identically under the influence of the nuclear force within the nucleus. The concept of isospin, in which the proton and neutron are viewed as two quantum states of the same particle, is used to model the interactions of nucleons by the nuclear or weak forces. Because of the strength of the nuclear force at short distances, the binding energy of nucleons is more than seven orders of magnitude larger than the electromagnetic energy binding electrons in atoms. Nuclear reactions (such as nuclear fission) therefore have an energy density that is more than ten million times that of chemical reactions. Because of the mass–energy equivalence, nuclear binding energies reduce the mass of nuclei. Ultimately, the ability of the nuclear force to store energy arising from the electromagnetic repulsion of nuclear components is the basis for most of the energy that makes nuclear reactors or bombs possible. In nuclear fission, the absorption of a neutron by a heavy nuclide (e.g., uranium-235) causes the nuclide to become unstable and break into light nuclides and additional neutrons. The positively charged light nuclides then repel, releasing electromagnetic potential energy.
The neutron is classified as a hadron, because it is a composite particle made of quarks. The neutron is also classified as a baryon, because it is composed of three valence quarks.[17] The finite size of the neutron and its magnetic moment both indicate that the neutron is a composite, rather than elementary, particle. A neutron contains two down quarks with charge −1/3e and one up quark with charge +2/3e.
Like protons, the quarks of the neutron are held together by the strong force, mediated by gluons.[18] The nuclear force results from secondary effects of the more fundamental strong force.
Discovery[edit]
The story of the discovery of the neutron and its properties is central to the extraordinary developments in atomic physics that occurred in the first half of the 20th century, leading ultimately to the atomic bomb in 1945. In the 1911 Rutherford model, the atom consisted of a small positively charged massive nucleus surrounded by a much larger cloud of negatively charged electrons. In 1920, Ernest Rutherford suggested that the nucleus consisted of positive protons and neutrally charged particles, suggested to be a proton and an electron bound in some way.[19] Electrons were assumed to reside within the nucleus because it was known that beta radiation consisted of electrons emitted from the nucleus.[19]
About the time Rutherford suggested the neutral proton-electron composite, several other publications appeared making similar suggestions, and in 1921 the American chemist W.D. Harkins first named the hypothetical particle a «neutron».[20][21] The name derives from the Latin root for neutralis (neuter) and the Greek suffix -on (a suffix used in the names of subatomic particles, i.e. electron and proton).[22][23] References to the word neutron in connection with the atom can be found in the literature as early as 1899, however.[21]
Throughout the 1920s, physicists assumed that the atomic nucleus was composed of protons and «nuclear electrons»[24][25] but there were obvious problems. It was difficult to reconcile the proton–electron model for nuclei with the Heisenberg uncertainty relation of quantum mechanics.[26][27] The Klein paradox,[28] discovered by Oskar Klein in 1928, presented further quantum mechanical objections to the notion of an electron confined within a nucleus.[26] Observed properties of atoms and molecules were inconsistent with the nuclear spin expected from the proton–electron hypothesis. Both protons and electrons carry an intrinsic spin of 1/2ħ. Isotopes of the same species (i.e. having the same number of protons) can have both integer or fractional spin, i.e. the neutron spin must be also fractional (1/2ħ). But there is no way to arrange the spins of an electron and a proton (supposed to bond to form a neutron) to get the fractional spin of a neutron.
In 1931, Walther Bothe and Herbert Becker found that if alpha particle radiation from polonium fell on beryllium, boron, or lithium, an unusually penetrating radiation was produced. The radiation was not influenced by an electric field, so Bothe and Becker assumed it was gamma radiation.[29][30] The following year Irène Joliot-Curie and Frédéric Joliot-Curie in Paris showed that if this «gamma» radiation fell on paraffin, or any other hydrogen-containing compound, it ejected protons of very high energy.[31] Neither Rutherford nor James Chadwick at the Cavendish Laboratory in Cambridge were convinced by the gamma ray interpretation.[32] Chadwick quickly performed a series of experiments that showed that the new radiation consisted of uncharged particles with about the same mass as the proton.[8][33][34] These particles were neutrons. Chadwick won the 1935 Nobel Prize in Physics for this discovery.[2]
Models depicting the nucleus and electron energy levels in hydrogen, helium, lithium, and neon atoms. In reality, the diameter of the nucleus is about 100,000 times smaller than the diameter of the atom.
Models for an atomic nucleus consisting of protons and neutrons were quickly developed by Werner Heisenberg[35][36][37] and others.[38][39] The proton–neutron model explained the puzzle of nuclear spins. The origins of beta radiation were explained by Enrico Fermi in 1934 by the process of beta decay, in which the neutron decays to a proton by creating an electron and a (at the time undiscovered) neutrino.[40] In 1935, Chadwick and his doctoral student Maurice Goldhaber reported the first accurate measurement of the mass of the neutron.[41][42]
By 1934, Fermi had bombarded heavier elements with neutrons to induce radioactivity in elements of high atomic number. In 1938, Fermi received the Nobel Prize in Physics «for his demonstrations of the existence of new radioactive elements produced by neutron irradiation, and for his related discovery of nuclear reactions brought about by slow neutrons».[43] In 1938 Otto Hahn, Lise Meitner, and Fritz Strassmann discovered nuclear fission, or the fractionation of uranium nuclei into light elements, induced by neutron bombardment.[44][45][46] In 1945 Hahn received the 1944 Nobel Prize in Chemistry «for his discovery of the fission of heavy atomic nuclei».[47][48][49] The discovery of nuclear fission would lead to the development of nuclear power and the atomic bomb by the end of World War II.
Beta decay and the stability of the nucleus[edit]
Neutrons are a necessary constituent of any atomic nucleus that contains more than one proton. Interacting protons have a mutual electromagnetic repulsion that is stronger than their attractive nuclear interaction, so proton-only nuclei are unstable (see diproton and neutron–proton ratio).[50] Neutrons bind with protons and one another in the nucleus via the nuclear force, effectively moderating the repulsive forces between the protons and stabilizing the nucleus.
Within the nucleus, neutrons can decay to protons, or vice versa. This process is called beta decay, and, for the neutron, it requires the emission of an electron and an anti-neutrino:
n0
→
p+
+
e−
+
ν
e
where
p+
,
e−
, and
ν
e denote the proton, electron and electron antineutrino products, respectively.[51] The decay of the proton to a neutron is similar:
p+
→
n0
+
e+
+
ν
e
where
n0
,
e+
, and
ν
e denote the neutron, positron and electron neutrino products, respectively. In these reactions, the original particle is not composed of the product particles; rather, the product particles are created at the instant of the reaction.
The neutrons and protons bound in a nucleus form a quantum mechanical system wherein each nucleon is bound in a particular, hierarchical quantum state. The emitted particles, that is, the decay products, carry away the energy excess as a nucleon falls from one quantum state to a lower energy state, while the proton (or neutron) changes to a neutron (or proton). Such decay processes can occur only if allowed by basic energy conservation and quantum mechanical constraints. The stability of nuclei is a consequence of these constraints.
«Free» neutrons or protons are nucleons that exist independently, free of any nucleus. Since the neutron is slightly more massive than a proton, the decay of a free neutron to a proton is allowed, while the decay of a free proton is energetically disallowed. A high-energy collision of a proton and an electron or neutrino can result in a neutron, however.
Free neutron decay[edit]
Outside the nucleus, free neutrons are unstable and have a mean lifetime of 879.6±0.8 s (about 14 minutes, 40 seconds); therefore the half-life for this process (which differs from the mean lifetime by a factor of ln(2) = 0.693) is 610.1±0.7 s (about 10 minutes, 10 seconds).[11][52] This decay is only possible because the mass of the proton is less than that of the neutron. By the mass-energy equivalence, when a neutron decays to a proton this way, a lower energy state is attained.
For the free neutron the decay energy for this process (based on the masses of the neutron, proton, and electron) is 0.782343 MeV. The maximal energy of the beta decay electron (in the process wherein the neutrino receives a vanishingly small amount of kinetic energy) has been measured at 0.782±0.013 MeV.[53] The latter number is not well-enough measured to determine the comparatively tiny rest mass of the neutrino (which must in theory be subtracted from the maximal electron kinetic energy) as well as neutrino mass is constrained by many other methods.
A small fraction (about one in 1000) of free neutrons decay with the same products, but add an extra particle in the form of an emitted gamma ray:
n0
→
p+
+
e−
+
ν
e +
γ
This gamma ray may be thought of as an «internal bremsstrahlung» that arises from the electromagnetic interaction of the emitted beta particle with the proton. Internal bremsstrahlung gamma ray production is also a minor feature of beta decays of bound neutrons (as discussed below).
A schematic of the nucleus of an atom indicating
β−
radiation, the emission of a fast electron from the nucleus (the accompanying antineutrino is omitted). In the Rutherford model for the nucleus, red spheres were protons with positive charge and blue spheres were protons tightly bound to an electron with no net charge.
The inset shows beta decay of a free neutron as it is understood today; an electron and antineutrino are created in this process.
A very small minority of neutron decays (about four per million) are so-called «two-body (neutron) decays», in which a proton, electron and antineutrino are produced as usual, but the electron fails to gain the 13.6 eV necessary energy to escape the proton (the ionization energy of hydrogen), and therefore simply remains bound to it, as a neutral hydrogen atom (one of the «two bodies»). In this type of free neutron decay, almost all of the neutron decay energy is carried off by the antineutrino (the other «body»). (The hydrogen atom recoils with a speed of only about (decay energy)/(hydrogen rest energy) times the speed of light, or 250 km/s.)
Bound neutron decay[edit]
While a free neutron has a half life of about 10.2 min, most neutrons within nuclei are stable. According to the nuclear shell model, the protons and neutrons of a nuclide are a quantum mechanical system organized into discrete energy levels with unique quantum numbers. For a neutron to decay, the resulting proton requires an available state at lower energy than the initial neutron state. In stable nuclei the possible lower energy states are all filled, meaning each state is occupied by a pair of protons, one with spin up, another with spin down. When all available proton states are filled, the Pauli exclusion principle disallows the decay of a neutron to a proton within stable nuclei. The situation is similar to electrons of an atom, where electrons that occupy distinct atomic orbitals are prevented by the exclusion principle from decaying to lower, already-filled, energy states, with the emission of a photon.
Neutrons in unstable nuclei can decay by beta decay as described above. In this case, an energetically allowed quantum state is available for the proton resulting from the decay. One example of this decay is carbon-14 (6 protons, 8 neutrons) that decays to nitrogen-14 (7 protons, 7 neutrons) with a half-life of about 5,730 years.
Similarly, a proton inside a nucleus can decay into a neutron, if an energetically allowed quantum state is available for the neutron.
The transformation of a proton to a neutron inside of a nucleus is also possible through electron capture:
p+
+
e−
→
n0
+
ν
e
Positron capture by neutrons in nuclei that contain an excess of neutrons is also possible, but is hindered because positrons are repelled by the positive nucleus, and quickly annihilate when they encounter electrons. Similar, but far more rare, reactions involve the capture of a neutrino by a nucleon in inverse beta decay.
Competition of beta decay types[edit]
Three types of beta decay in competition are illustrated by the single isotope copper-64 (29 protons, 35 neutrons), which has a half-life of about 12.7 hours. This isotope has one unpaired proton and one unpaired neutron, so either the proton or the neutron can decay. This particular nuclide is almost equally likely to undergo proton decay (by positron emission, 18% or by electron capture, 43%) or neutron decay (by electron emission, 39%).
Decay of the neutron by elementary particle physics[edit]
Within the theoretical framework of Standard Model for particle physics, the neutron is composed of two down quarks and an up quark. The only possible decay mode for the neutron that conserves baryon number is for one of the neutron’s quarks to change flavour via the weak interaction. The decay of one of the neutron’s down quarks into a lighter up quark can be achieved by the emission of a W boson. By this process, the Standard Model description of beta decay, the neutron decays into a proton (which contains one down and two up quarks), an electron, and an electron antineutrino.
The decay of the proton to a neutron occurs similarly through the electroweak force. The decay of one of the proton’s up quarks into a down quark can be achieved by the emission of a W boson. The proton decays into a neutron, a positron, and an electron neutrino. This reaction can only occur within an atomic nucleus which has a quantum state at lower energy available for the created neutron.
Intrinsic properties[edit]
Mass[edit]
The mass of a neutron cannot be directly determined by mass spectrometry since it has no electric charge. But since the masses of a proton and of a deuteron can be measured with a mass spectrometer, the mass of a neutron can be deduced by subtracting proton mass from deuteron mass, with the difference being the mass of the neutron plus the binding energy of deuterium (expressed as a positive emitted energy). The latter can be directly measured by measuring the energy (

The energy of the gamma ray can be measured to high precision by X-ray diffraction techniques, as was first done by Bell and Elliot in 1948. The best modern (1986) values for neutron mass by this technique are provided by Greene, et al.[54] These give a neutron mass of:
- mneutron = 1.008644904(14) Da
The value for the neutron mass in MeV is less accurately known, due to less accuracy in the known conversion of Da to MeV/c2:[55]
- mneutron = 939.56563(28) MeV/c2.
Another method to determine the mass of a neutron starts from the beta decay of the neutron, when the momenta of the resulting proton and electron are measured.
Electric charge[edit]
The total electric charge of the neutron is 0 e. This zero value has been tested experimentally, and the present experimental limit for the charge of the neutron is −2(8)×10−22 e,[6] or −3(13)×10−41 C. This value is consistent with zero, given the experimental uncertainties (indicated in parentheses). By comparison, the charge of the proton is +1 e.
Magnetic moment[edit]
Even though the neutron is a neutral particle, the magnetic moment of a neutron is not zero. The neutron is not affected by electric fields, but it is affected by magnetic fields. The value for the neutron’s magnetic moment was first directly measured by Luis Alvarez and Felix Bloch at Berkeley, California, in 1940.[56] Alvarez and Bloch determined the magnetic moment of the neutron to be μn= −1.93(2) μN, where μN is the nuclear magneton.
The magnetic moment of the neutron is an indication of its quark substructure and internal charge distribution.[57] In the quark model for hadrons, the neutron is composed of one up quark (charge +2/3 e) and two down quarks (charge −1/3 e).[57] The magnetic moment of the neutron can be modeled as a sum of the magnetic moments of the constituent quarks.[58] The calculation assumes that the quarks behave like pointlike Dirac particles, each having their own magnetic moment. Simplistically, the magnetic moment of the neutron can be viewed as resulting from the vector sum of the three quark magnetic moments, plus the orbital magnetic moments caused by the movement of the three charged quarks within the neutron.
In one of the early successes of the Standard Model in 1964 Mirza A.B. Beg, Benjamin W. Lee, and Abraham Pais theoretically calculated the ratio of proton to neutron magnetic moments to be −3/2, which agrees with the experimental value to within 3%.[59][60][61] The measured value for this ratio is −1.45989805(34).[4]
The above treatment compares neutrons with protons, allowing the complex behavior of quarks to be subtracted out between models, and merely exploring what the effects would be of differing quark charges (or quark type). Such calculations are enough to show that the interior of neutrons is very much like that of protons, save for the difference in quark composition with a down quark in the neutron replacing an up quark in the proton.
The neutron magnetic moment can be roughly computed by assuming a simple nonrelativistic, quantum mechanical wavefunction for baryons composed of three quarks. A straightforward calculation gives fairly accurate estimates for the magnetic moments of neutrons, protons, and other baryons.[58] For a neutron, the result of this calculation is that the magnetic moment of the neutron is given by μn= 4/3 μd − 1/3 μu, where μd and μu are the magnetic moments for the down and up quarks, respectively. This result combines the intrinsic magnetic moments of the quarks with their orbital magnetic moments, and assumes the three quarks are in a particular, dominant quantum state.
| Baryon | Magnetic moment of quark model |
Computed (  ) )
|
Observed (  ) )
|
|---|---|---|---|
| p | 4/3 μu − 1/3 μd | 2.79 | 2.793 |
| n | 4/3 μd − 1/3 μu | −1.86 | −1.913 |
The results of this calculation are encouraging, but the masses of the up or down quarks were assumed to be 1/3 the mass of a nucleon.[58] The masses of the quarks are actually only about 1% that of a nucleon.[62] The discrepancy stems from the complexity of the Standard Model for nucleons, where most of their mass originates in the gluon fields, virtual particles, and their associated energy that are essential aspects of the strong force.[62][63] Furthermore, the complex system of quarks and gluons that constitute a neutron requires a relativistic treatment.[64] But the nucleon magnetic moment has been successfully computed numerically from first principles, including all of the effects mentioned and using more realistic values for the quark masses. The calculation gave results that were in fair agreement with measurement, but it required significant computing resources.[65][66]
Spin[edit]
The neutron is a spin 1/2 particle, that is, it is a fermion with intrinsic angular momentum equal to 1/2 ħ, where ħ is the reduced Planck constant. For many years after the discovery of the neutron, its exact spin was ambiguous. Although it was assumed to be a spin 1/2 Dirac particle, the possibility that the neutron was a spin 3/2 particle lingered. The interactions of the neutron’s magnetic moment with an external magnetic field were exploited to finally determine the spin of the neutron.[67] In 1949, Hughes and Burgy measured neutrons reflected from a ferromagnetic mirror and found that the angular distribution of the reflections was consistent with spin 1/2.[68] In 1954, Sherwood, Stephenson, and Bernstein employed neutrons in a Stern–Gerlach experiment that used a magnetic field to separate the neutron spin states. They recorded two such spin states, consistent with a spin 1/2 particle.[67][69]
As a fermion, the neutron is subject to the Pauli exclusion principle; two neutrons cannot have the same quantum numbers. This is the source of the degeneracy pressure which makes neutron stars possible.
Structure and geometry of charge distribution[edit]
An article published in 2007 featuring a model-independent analysis concluded that the neutron has a negatively charged exterior, a positively charged middle, and a negative core.[70] In a simplified classical view, the negative «skin» of the neutron assists it to be attracted to the protons with which it interacts in the nucleus; but the main attraction between neutrons and protons is via the nuclear force, which does not involve electric charge.
The simplified classical view of the neutron’s charge distribution also «explains» the fact that the neutron magnetic dipole points in the opposite direction from its spin angular momentum vector (as compared to the proton). This gives the neutron, in effect, a magnetic moment which resembles a negatively charged particle. This can be reconciled classically with a neutral neutron composed of a charge distribution in which the negative sub-parts of the neutron have a larger average radius of distribution, and therefore contribute more to the particle’s magnetic dipole moment, than do the positive parts that are, on average, nearer the core.
Electric dipole moment[edit]
The Standard Model of particle physics predicts a tiny separation of positive and negative charge within the neutron leading to a permanent electric dipole moment.[71] But the predicted value is well below the current sensitivity of experiments. From several unsolved puzzles in particle physics, it is clear that the Standard Model is not the final and full description of all particles and their interactions. New theories going beyond the Standard Model generally lead to much larger predictions for the electric dipole moment of the neutron. Currently, there are at least four experiments trying to measure for the first time a finite neutron electric dipole moment, including:
- Cryogenic neutron EDM experiment being set up at the Institut Laue–Langevin[72]
- nEDM experiment under construction at the new UCN source at the Paul Scherrer Institute[73]
- nEDM experiment being envisaged at the Spallation Neutron Source[74][75]
- nEDM experiment being built at the Institut Laue–Langevin[76]
Antineutron[edit]
The antineutron is the antiparticle of the neutron. It was discovered by Bruce Cork in 1956, a year after the antiproton was discovered. CPT-symmetry puts strong constraints on the relative properties of particles and antiparticles, so studying antineutrons provides stringent tests on CPT-symmetry. The fractional difference in the masses of the neutron and antineutron is (9±6)×10−5. Since the difference is only about two standard deviations away from zero, this does not give any convincing evidence of CPT-violation.[11]
Neutron compounds[edit]
Dineutrons and tetraneutrons[edit]
The existence of stable clusters of 4 neutrons, or tetraneutrons, has been hypothesised by a team led by Francisco-Miguel Marqués at the CNRS Laboratory for Nuclear Physics based on observations of the disintegration of beryllium-14 nuclei. This is particularly interesting because current theory suggests that these clusters should not be stable.
In February 2016, Japanese physicist Susumu Shimoura of the University of Tokyo and co-workers reported they had observed the purported tetraneutrons for the first time experimentally.[77] Nuclear physicists around the world say this discovery, if confirmed, would be a milestone in the field of nuclear physics and certainly would deepen our understanding of the nuclear forces.[78][79]
The dineutron is another hypothetical particle. In 2012, Artemis Spyrou from Michigan State University and coworkers reported that they observed, for the first time, the dineutron emission in the decay of 16Be. The dineutron character is evidenced by a small emission angle between the two neutrons. The authors measured the two-neutron separation energy to be 1.35(10) MeV, in good agreement with shell model calculations, using standard interactions for this mass region.[80]
Neutronium and neutron stars[edit]
At extremely high pressures and temperatures, nucleons and electrons are believed to collapse into bulk neutronic matter, called neutronium. This is presumed to happen in neutron stars.
The extreme pressure inside a neutron star may deform the neutrons into a cubic symmetry, allowing tighter packing of neutrons.[81]
Detection[edit]
The common means of detecting a charged particle by looking for a track of ionization (such as in a cloud chamber) does not work for neutrons directly. Neutrons that elastically scatter off atoms can create an ionization track that is detectable, but the experiments are not as simple to carry out; other means for detecting neutrons, consisting of allowing them to interact with atomic nuclei, are more commonly used. The commonly used methods to detect neutrons can therefore be categorized according to the nuclear processes relied upon, mainly neutron capture or elastic scattering.[82]
Neutron detection by neutron capture[edit]
A common method for detecting neutrons involves converting the energy released from neutron capture reactions into electrical signals. Certain nuclides have a high neutron capture cross section, which is the probability of absorbing a neutron. Upon neutron capture, the compound nucleus emits more easily detectable radiation, for example an alpha particle, which is then detected. The nuclides 3
He
, 6
Li
, 10
B
, 233
U
, 235
U
, 237
Np
, and 239
Pu
are useful for this purpose.
Neutron detection by elastic scattering[edit]
Neutrons can elastically scatter off nuclei, causing the struck nucleus to recoil. Kinematically, a neutron can transfer more energy to a light nucleus such as hydrogen or helium than to a heavier nucleus. Detectors relying on elastic scattering are called fast neutron detectors. Recoiling nuclei can ionize and excite further atoms through collisions. Charge and/or scintillation light produced in this way can be collected to produce a detected signal. A major challenge in fast neutron detection is discerning such signals from erroneous signals produced by gamma radiation in the same detector. Methods such as pulse shape discrimination can be used in distinguishing neutron signals from gamma-ray signals, although certain inorganic scintillator-based detectors have been developed [83][84] to selectively detect neutrons in mixed radiation fields inherently without any additional techniques.
Fast neutron detectors have the advantage of not requiring a moderator, and are therefore capable of measuring the neutron’s energy, time of arrival, and in certain cases direction of incidence.
Sources and production[edit]
Free neutrons are unstable, although they have the longest half-life of any unstable subatomic particle by several orders of magnitude. Their half-life is still only about 10 minutes, so they can be obtained only from sources that produce them continuously.
Natural neutron background. A small natural background flux of free neutrons exists everywhere on Earth. In the atmosphere and deep into the ocean, the «neutron background» is caused by muons produced by cosmic ray interaction with the atmosphere. These high-energy muons are capable of penetration to considerable depths in water and soil. There, in striking atomic nuclei, among other reactions they induce spallation reactions in which a neutron is liberated from the nucleus. Within the Earth’s crust a second source is neutrons produced primarily by spontaneous fission of uranium and thorium present in crustal minerals. The neutron background is not strong enough to be a biological hazard, but it is of importance to very high resolution particle detectors that are looking for very rare events, such as (hypothesized) interactions that might be caused by particles of dark matter.[12] Recent research has shown that even thunderstorms can produce neutrons with energies of up to several tens of MeV.[85] Recent research has shown that the fluence of these neutrons lies between 10−9 and 10−13 per ms and per m2 depending on the detection altitude. The energy of most of these neutrons, even with initial energies of 20 MeV, decreases down to the keV range within 1 ms.[86]
Even stronger neutron background radiation is produced at the surface of Mars, where the atmosphere is thick enough to generate neutrons from cosmic ray muon production and neutron-spallation, but not thick enough to provide significant protection from the neutrons produced. These neutrons not only produce a Martian surface neutron radiation hazard from direct downward-going neutron radiation but may also produce a significant hazard from reflection of neutrons from the Martian surface, which will produce reflected neutron radiation penetrating upward into a Martian craft or habitat from the floor.[87]
Sources of neutrons for research. These include certain types of radioactive decay (spontaneous fission and neutron emission), and from certain nuclear reactions. Convenient nuclear reactions include tabletop reactions such as natural alpha and gamma bombardment of certain nuclides, often beryllium or deuterium, and induced nuclear fission, such as occurs in nuclear reactors. In addition, high-energy nuclear reactions (such as occur in cosmic radiation showers or accelerator collisions) also produce neutrons from disintegration of target nuclei. Small (tabletop) particle accelerators optimized to produce free neutrons in this way, are called neutron generators.
In practice, the most commonly used small laboratory sources of neutrons use radioactive decay to power neutron production. One noted neutron-producing radioisotope, californium-252 decays (half-life 2.65 years) by spontaneous fission 3% of the time with production of 3.7 neutrons per fission, and is used alone as a neutron source from this process. Nuclear reaction sources (that involve two materials) powered by radioisotopes use an alpha decay source plus a beryllium target, or else a source of high-energy gamma radiation from a source that undergoes beta decay followed by gamma decay, which produces photoneutrons on interaction of the high-energy gamma ray with ordinary stable beryllium, or else with the deuterium in heavy water. A popular source of the latter type is radioactive antimony-124 plus beryllium, a system with a half-life of 60.9 days, which can be constructed from natural antimony (which is 42.8% stable antimony-123) by activating it with neutrons in a nuclear reactor, then transported to where the neutron source is needed.[88]
Nuclear fission reactors naturally produce free neutrons; their role is to sustain the energy-producing chain reaction. The intense neutron radiation can also be used to produce various radioisotopes through the process of neutron activation, which is a type of neutron capture.
Experimental nuclear fusion reactors produce free neutrons as a waste product. But it is these neutrons that possess most of the energy, and converting that energy to a useful form has proved a difficult engineering challenge. Fusion reactors that generate neutrons are likely to create radioactive waste, but the waste is composed of neutron-activated lighter isotopes, which have relatively short (50–100 years) decay periods as compared to typical half-lives of 10,000 years[89] for fission waste, which is long due primarily to the long half-life of alpha-emitting transuranic actinides.[90] Some nuclear fusion-fission hybrids are proposed to make use of those neutrons to either maintain a subcritical reactor or to aid in nuclear transmutation of harmful long lived nuclear waste to shorter lived or stable nuclides.
Neutron beams and modification of beams after production[edit]
Free neutron beams are obtained from neutron sources by neutron transport. For access to intense neutron sources, researchers must go to a specialized neutron facility that operates a research reactor or a spallation source.
The neutron’s lack of total electric charge makes it difficult to steer or accelerate them. Charged particles can be accelerated, decelerated, or deflected by electric or magnetic fields. These methods have little effect on neutrons. But some effects may be attained by use of inhomogeneous magnetic fields because of the neutron’s magnetic moment. Neutrons can be controlled by methods that include moderation, reflection, and velocity selection. Thermal neutrons can be polarized by transmission through magnetic materials in a method analogous to the Faraday effect for photons. Cold neutrons of wavelengths of 6–7 angstroms can be produced in beams of a high degree of polarization, by use of magnetic mirrors and magnetized interference filters.[91]
Applications[edit]
The neutron plays an important role in many nuclear reactions. For example, neutron capture often results in neutron activation, inducing radioactivity. In particular, knowledge of neutrons and their behavior has been important in the development of nuclear reactors and nuclear weapons. The fissioning of elements like uranium-235 and plutonium-239 is caused by their absorption of neutrons.
Cold, thermal, and hot neutron radiation is commonly employed in neutron scattering facilities, where the radiation is used in a similar way one uses X-rays for the analysis of condensed matter. Neutrons are complementary to the latter in terms of atomic contrasts by different scattering cross sections; sensitivity to magnetism; energy range for inelastic neutron spectroscopy; and deep penetration into matter.
The development of «neutron lenses» based on total internal reflection within hollow glass capillary tubes or by reflection from dimpled aluminum plates has driven ongoing research into neutron microscopy and neutron/gamma ray tomography.[92][93][94][95]
A major use of neutrons is to excite delayed and prompt gamma rays from elements in materials. This forms the basis of neutron activation analysis (NAA) and prompt gamma neutron activation analysis (PGNAA). NAA is most often used to analyze small samples of materials in a nuclear reactor whilst PGNAA is most often used to analyze subterranean rocks around bore holes and industrial bulk materials on conveyor belts.
Another use of neutron emitters is the detection of light nuclei, in particular the hydrogen found in water molecules. When a fast neutron collides with a light nucleus, it loses a large fraction of its energy. By measuring the rate at which slow neutrons return to the probe after reflecting off of hydrogen nuclei, a neutron probe may determine the water content in soil.
Medical therapies[edit]
Because neutron radiation is both penetrating and ionizing, it can be exploited for medical treatments. However, neutron radiation can have the unfortunate side-effect of leaving the affected area radioactive. Neutron tomography is therefore not a viable medical application.
Fast neutron therapy uses high-energy neutrons typically greater than 20 MeV to treat cancer. Radiation therapy of cancers is based upon the biological response of cells to ionizing radiation. If radiation is delivered in small sessions to damage cancerous areas, normal tissue will have time to repair itself, while tumor cells often cannot.[96] Neutron radiation can deliver energy to a cancerous region at a rate an order of magnitude larger than gamma radiation.[97]
Beams of low-energy neutrons are used in boron neutron capture therapy to treat cancer. In boron neutron capture therapy, the patient is given a drug that contains boron and that preferentially accumulates in the tumor to be targeted. The tumor is then bombarded with very low-energy neutrons (although often higher than thermal energy) which are captured by the boron-10 isotope in the boron, which produces an excited state of boron-11 that then decays to produce lithium-7 and an alpha particle that have sufficient energy to kill the malignant cell, but insufficient range to damage nearby cells. For such a therapy to be applied to the treatment of cancer, a neutron source having an intensity of the order of a thousand million (109) neutrons per second per cm2 is preferred. Such fluxes require a research nuclear reactor.
Protection[edit]
Exposure to free neutrons can be hazardous, since the interaction of neutrons with molecules in the body can cause disruption to molecules and atoms, and can also cause reactions that give rise to other forms of radiation (such as protons). The normal precautions of radiation protection apply: Avoid exposure, stay as far from the source as possible, and keep exposure time to a minimum. But particular thought must be given to how to protect from neutron exposure. For other types of radiation, e.g., alpha particles, beta particles, or gamma rays, material of a high atomic number and with high density makes for good shielding; frequently, lead is used. However, this approach will not work with neutrons, since the absorption of neutrons does not increase straightforwardly with atomic number, as it does with alpha, beta, and gamma radiation. Instead one needs to look at the particular interactions neutrons have with matter (see the section on detection above). For example, hydrogen-rich materials are often used to shield against neutrons, since ordinary hydrogen both scatters and slows neutrons. This often means that simple concrete blocks or even paraffin-loaded plastic blocks afford better protection from neutrons than do far more dense materials. After slowing, neutrons may then be absorbed with an isotope that has high affinity for slow neutrons without causing secondary capture radiation, such as lithium-6.
Hydrogen-rich ordinary water affects neutron absorption in nuclear fission reactors: Usually, neutrons are so strongly absorbed by normal water that fuel enrichment with fissionable isotope is required.[clarification needed] The deuterium in heavy water has a very much lower absorption affinity for neutrons than does protium (normal light hydrogen). Deuterium is, therefore, used in CANDU-type reactors, in order to slow (moderate) neutron velocity, to increase the probability of nuclear fission compared to neutron capture.
Neutron temperature[edit]
Thermal neutrons[edit]
Thermal neutrons are free neutrons whose energies have a Maxwell–Boltzmann distribution with kT = 0.0253 eV (4.0×10−21 J) at room temperature. This gives characteristic (not average, or median) speed of 2.2 km/s. The name ‘thermal’ comes from their energy being that of the room temperature gas or material they are permeating. (see kinetic theory for energies and speeds of molecules). After a number of collisions (often in the range of 10–20) with nuclei, neutrons arrive at this energy level, provided that they are not absorbed.
In many substances, thermal neutron reactions show a much larger effective cross-section than reactions involving faster neutrons, and thermal neutrons can therefore be absorbed more readily (i.e., with higher probability) by any atomic nuclei that they collide with, creating a heavier – and often unstable – isotope of the chemical element as a result.
Most fission reactors use a neutron moderator to slow down, or thermalize the neutrons that are emitted by nuclear fission so that they are more easily captured, causing further fission. Others, called fast breeder reactors, use fission energy neutrons directly.
Cold neutrons[edit]
Cold neutrons are thermal neutrons that have been equilibrated in a very cold substance such as liquid deuterium. Such a cold source is placed in the moderator of a research reactor or spallation source. Cold neutrons are particularly valuable for neutron scattering experiments.[98]
The use of cold and very cold neutrons (VCN) have been a bit limited compared to the use of thermal neutrons due to the relatively lower flux and lack in optical components. However, Innovative solutions have been proposed to offer more options to the scientific community to promote the use of VCN.[99][100]
Cold neutron source providing neutrons at about the temperature of liquid hydrogen
Ultracold neutrons[edit]
Ultracold neutrons are produced by inelastic scattering of cold neutrons in substances with a low neutron absorption cross section at a temperature of a few kelvins, such as solid deuterium[101] or superfluid helium.[102] An alternative production method is the mechanical deceleration of cold neutrons exploiting the Doppler shift.[103][104]
Fission energy neutrons[edit]
A fast neutron is a free neutron with a kinetic energy level close to 1 MeV (1.6×10−13 J), hence a speed of ~14000 km/s (~ 5% of the speed of light). They are named fission energy or fast neutrons to distinguish them from lower-energy thermal neutrons, and high-energy neutrons produced in cosmic showers or accelerators. Fast neutrons are produced by nuclear processes such as nuclear fission. Neutrons produced in fission, as noted above, have a Maxwell–Boltzmann distribution of kinetic energies from 0 to ~14 MeV, a mean energy of 2 MeV (for 235U fission neutrons), and a mode of only 0.75 MeV, which means that more than half of them do not qualify as fast (and thus have almost no chance of initiating fission in fertile materials, such as 238U and 232Th).
Fast neutrons can be made into thermal neutrons via a process called moderation. This is done with a neutron moderator. In reactors, typically heavy water, light water, or graphite are used to moderate neutrons.
Fusion neutrons[edit]
The fusion reaction rate increases rapidly with temperature until it maximizes and then gradually drops off. The D–T rate peaks at a lower temperature (about 70 keV, or 800 million kelvins) and at a higher value than other reactions commonly considered for fusion energy.
D–T (deuterium–tritium) fusion is the fusion reaction that produces the most energetic neutrons, with 14.1 MeV of kinetic energy and traveling at 17% of the speed of light. D–T fusion is also the easiest fusion reaction to ignite, reaching near-peak rates even when the deuterium and tritium nuclei have only a thousandth as much kinetic energy as the 14.1 MeV that will be produced.
14.1 MeV neutrons have about 10 times as much energy as fission neutrons, and are very effective at fissioning even non-fissile heavy nuclei, and these high-energy fissions produce more neutrons on average than fissions by lower-energy neutrons. This makes D–T fusion neutron sources such as proposed tokamak power reactors useful for transmutation of transuranic waste. 14.1 MeV neutrons can also produce neutrons by knocking them loose from nuclei.
On the other hand, these very high-energy neutrons are less likely to simply be captured without causing fission or spallation. For these reasons, nuclear weapon design extensively uses D–T fusion 14.1 MeV neutrons to cause more fission. Fusion neutrons are able to cause fission in ordinarily non-fissile materials, such as depleted uranium (uranium-238), and these materials have been used in the jackets of thermonuclear weapons. Fusion neutrons also can cause fission in substances that are unsuitable or difficult to make into primary fission bombs, such as reactor grade plutonium. This physical fact thus causes ordinary non-weapons grade materials to become of concern in certain nuclear proliferation discussions and treaties.
Other fusion reactions produce much less energetic neutrons. D–D fusion produces a 2.45 MeV neutron and helium-3 half of the time, and produces tritium and a proton but no neutron the rest of the time. D–3He fusion produces no neutron.
Intermediate-energy neutrons[edit]
A fission energy neutron that has slowed down but not yet reached thermal energies is called an epithermal neutron.
Cross sections for both capture and fission reactions often have multiple resonance peaks at specific energies in the epithermal energy range. These are of less significance in a fast-neutron reactor, where most neutrons are absorbed before slowing down to this range, or in a well-moderated thermal reactor, where epithermal neutrons interact mostly with moderator nuclei, not with either fissile or fertile actinide nuclides. But in a partially moderated reactor with more interactions of epithermal neutrons with heavy metal nuclei, there are greater possibilities for transient changes in reactivity that might make reactor control more difficult.
Ratios of capture reactions to fission reactions are also worse (more captures without fission) in most nuclear fuels such as plutonium-239, making epithermal-spectrum reactors using these fuels less desirable, as captures not only waste the one neutron captured but also usually result in a nuclide that is not fissile with thermal or epithermal neutrons, though still fissionable with fast neutrons. The exception is uranium-233 of the thorium cycle, which has good capture-fission ratios at all neutron energies.
High-energy neutrons[edit]
High-energy neutrons have much more energy than fission energy neutrons and are generated as secondary particles by particle accelerators or in the atmosphere from cosmic rays. These high-energy neutrons are extremely efficient at ionization and far more likely to cause cell death than X-rays or protons.[105][106]
See also[edit]
Wikimedia Commons has media related to Neutrons.
- Ionizing radiation
- Isotope
- List of particles
- Neutron radiation and the Sievert radiation scale
- Neutronium
- Nuclear reaction
- Nucleosynthesis
- Neutron capture nucleosynthesis
- R-process
- S-process
- Thermal reactor
Neutron sources[edit]
- Neutron generator
- Neutron source
Processes involving neutrons[edit]
- Neutron bomb
- Neutron diffraction
- Neutron flux
- Neutron transport
- Cosmogenic radionuclide dating
References[edit]
- ^ Ernest Rutherford Archived 2011-08-03 at the Wayback Machine. Chemed.chem.purdue.edu. Retrieved on 2012-08-16.
- ^ a b 1935 Nobel Prize in Physics Archived 2017-10-03 at the Wayback Machine. Nobelprize.org. Retrieved on 2012-08-16.
- ^ a b «2018 CODATA recommended values» https://physics.nist.gov/cuu/Constants/index.html Archived 2018-01-22 at the Wayback Machine
- ^ a b c d e f Mohr, P.J.; Taylor, B.N. and Newell, D.B. (2014), «The 2014 CODATA Recommended Values of the Fundamental Physical Constants» Archived 2013-10-09 at the Wayback Machine (Web Version 7.0). The database was developed by J. Baker, M. Douma, and S. Kotochigova. (2014). National Institute of Standards and Technology, Gaithersburg, Maryland 20899.
- ^ a b Zyla, P. A. (2020). «n MEAN LIFE». PDG Live: 2020 Review of Particle Physics. Particle Data Group. Archived from the original on 17 January 2021. Retrieved 25 February 2021.
- ^ a b Olive, K.A.; (Particle Data Group); et al. (2014). «Review of Particle Physics» (PDF). Chinese Physics C. 38 (9): 1–708. arXiv:1412.1408. Bibcode:2014ChPhC..38i0001O. doi:10.1088/1674-1137/38/9/090001. PMID 10020536. S2CID 118395784. Archived (PDF) from the original on 2020-06-01. Retrieved 2017-10-26.
- ^ Thomas, A.W.; Weise, W. (2001), The Structure of the Nucleon, Wiley-WCH, Berlin, ISBN 978-3-527-40297-7
- ^ a b
Chadwick, James (1932). «Possible Existence of a Neutron». Nature. 129 (3252): 312. Bibcode:1932Natur.129Q.312C. doi:10.1038/129312a0. S2CID 4076465. - ^ Hahn, O. & Strassmann, F. (1939). «Über den Nachweis und das Verhalten der bei der Bestrahlung des Urans mittels Neutronen entstehenden Erdalkalimetalle» [On the detection and characteristics of the alkaline earth metals formed by irradiation of uranium with neutrons]. Die Naturwissenschaften. 27 (1): 11–15. Bibcode:1939NW…..27…11H. doi:10.1007/BF01488241. S2CID 5920336.
- ^ a b c Glasstone, Samuel; Dolan, Philip J., eds. (1977), The Effects of Nuclear Weapons (3rd ed.), U.S. Dept. of Defense and Energy Research and Development Administration, U.S. Government Printing Office, ISBN 978-1-60322-016-3
- ^ a b c Nakamura, K (2010). «Review of Particle Physics». Journal of Physics G. 37 (7A): 1–708. Bibcode:2010JPhG…37g5021N. doi:10.1088/0954-3899/37/7A/075021. PMID 10020536. PDF with 2011 partial update for the 2012 edition Archived 2012-09-20 at the Wayback Machine.
The exact value of the mean lifetime is still uncertain, due to conflicting results from experiments.
The Particle Data Group reports values up to six seconds apart (more than four standard deviations), commenting that «our 2006, 2008, and 2010 Reviews stayed with 885.7±0.8 s; but we noted that in light of SEREBROV 05 our value should be regarded as suspect until further experiments clarified matters. Since our 2010 Review, PICHLMAIER 10 has obtained a mean life of 880.7±1.8 s, closer to the value of SEREBROV 05 than to our average. And SEREBROV 10B[…] claims their values should be lowered by about 6 s, which would bring them into line with the two lower values. But those re-evaluations have not received an enthusiastic response from the experimenters in question; and in any case the Particle Data Group would have to await published changes (by those experimenters) of published values.At this point, we can think of nothing better to do than to average the seven best but discordant measurements, getting 881.5±1.5 s. Note that the error includes a scale factor of 2.7. This is a jump of 4.2 old (and 2.8 new) standard deviations. This state of affairs is a particularly unhappy one, because the value is so important. We again call upon the experimenters to clear this up.»
- ^ a b
Carson, M.J.; et al. (2004). «Neutron background in large-scale xenon detectors for dark matter searches». Astroparticle Physics. 21 (6): 667–687. arXiv:hep-ex/0404042. Bibcode:2004APh….21..667C. doi:10.1016/j.astropartphys.2004.05.001. S2CID 17887096. - ^ Nudat 2 Archived 2009-08-17 at the Wayback Machine. Nndc.bnl.gov. Retrieved on 2010-12-04.
- ^ Povh, B.; Rith, K.; Scholz, C.; Zetsche, F. (2002). Particles and Nuclei: An Introduction to the Physical Concepts. Berlin: Springer-Verlag. p. 73. ISBN 978-3-540-43823-6.
- ^
Basdevant, J.-L.; Rich, J.; Spiro, M. (2005). Fundamentals in Nuclear Physics. Springer. p. 155. ISBN 978-0-387-01672-6. - ^ Tipler, Paul Allen; Llewellyn, Ralph A. (2002). Modern Physics (4 ed.). Macmillan. p. 310. ISBN 978-0-7167-4345-3. Archived from the original on 2022-04-07. Retrieved 2020-08-27.
- ^
Adair, R.K. (1989). The Great Design: Particles, Fields, and Creation. Oxford University Press. p. 214. Bibcode:1988gdpf.book…..A. - ^
Cottingham, W.N.; Greenwood, D.A. (1986). An Introduction to Nuclear Physics. Cambridge University Press. ISBN 9780521657334. - ^ a b
Rutherford, E. (1920). «Nuclear Constitution of Atoms». Proceedings of the Royal Society A. 97 (686): 374–400. Bibcode:1920RSPSA..97..374R. doi:10.1098/rspa.1920.0040. - ^ Harkins, William (1921). «The constitution and stability of atomic nuclei. (A contribution to the subject of inorganic evolution.)». Philos. Mag. 42 (249): 305. doi:10.1080/14786442108633770.
- ^ a b Feather, N. (1960). «A history of neutrons and nuclei. Part 1». Contemporary Physics. 1 (3): 191–203. Bibcode:1960ConPh…1..191F. doi:10.1080/00107516008202611.
- ^ Pauli, Wolfgang; Hermann, A.; Meyenn, K.v; Weisskopff, V.F (1985). «Das Jahr 1932 Die Entdeckung des Neutrons». Wolfgang Pauli. Sources in the History of Mathematics and Physical Sciences. Vol. 6. pp. 105–144. doi:10.1007/978-3-540-78801-0_3. ISBN 978-3-540-13609-5.
- ^ Hendry, John, ed. (1984). Cambridge Physics in the Thirties. Bristol: Adam Hilger. ISBN 978-0852747612.
- ^ Brown, Laurie M. (1978). «The idea of the neutrino». Physics Today. 31 (9): 23–28. Bibcode:1978PhT….31i..23B. doi:10.1063/1.2995181.
- ^ Friedlander G., Kennedy J.W. and Miller J.M. (1964) Nuclear and Radiochemistry (2nd edition), Wiley, pp. 22–23 and 38–39
- ^ a b Stuewer, Roger H. (1985). «Niels Bohr and Nuclear Physics». In French, A.P.; Kennedy, P.J. (eds.). Niels Bohr: A Centenary Volume. Harvard University Press. pp. 197–220. ISBN 978-0674624160.
- ^ Pais, Abraham (1986). Inward Bound. Oxford: Oxford University Press. p. 299. ISBN 978-0198519973.
- ^ Klein, O. (1929). «Die Reflexion von Elektronen an einem Potentialsprung nach der relativistischen Dynamik von Dirac». Zeitschrift für Physik. 53 (3–4): 157–165. Bibcode:1929ZPhy…53..157K. doi:10.1007/BF01339716. S2CID 121771000.
- ^ Bothe, W.; Becker, H. (1930). «Künstliche Erregung von Kern-γ-Strahlen» [Artificial excitation of nuclear γ-radiation]. Zeitschrift für Physik. 66 (5–6): 289–306. Bibcode:1930ZPhy…66..289B. doi:10.1007/BF01390908. S2CID 122888356.
- ^ Becker, H.; Bothe, W. (1932). «Die in Bor und Beryllium erregten γ-Strahlen» [Γ-rays excited in boron and beryllium]. Zeitschrift für Physik. 76 (7–8): 421–438. Bibcode:1932ZPhy…76..421B. doi:10.1007/BF01336726. S2CID 121188471.
- ^ Joliot-Curie, Irène & Joliot, Frédéric (1932). «Émission de protons de grande vitesse par les substances hydrogénées sous l’influence des rayons γ très pénétrants» [Emission of high-speed protons by hydrogenated substances under the influence of very penetrating γ-rays]. Comptes Rendus. 194: 273. Archived from the original on 2022-03-04. Retrieved 2012-06-16.
- ^ Brown, Andrew (1997). The Neutron and the Bomb: A Biography of Sir James Chadwick. Oxford University Press. ISBN 978-0-19-853992-6.
- ^ «Atop the Physics Wave: Rutherford Back in Cambridge, 1919–1937». Rutherford’s Nuclear World. American Institute of Physics. 2011–2014. Archived from the original on 21 October 2014. Retrieved 19 August 2014.
- ^ Chadwick, J. (1933). «Bakerian Lecture. The Neutron». Proceedings of the Royal Society A. 142 (846): 1–25. Bibcode:1933RSPSA.142….1C. doi:10.1098/rspa.1933.0152.
- ^ Heisenberg, W. (1932). «Über den Bau der Atomkerne. I». Zeitschrift für Physik. 77 (1–2): 1–11. Bibcode:1932ZPhy…77….1H. doi:10.1007/BF01342433. S2CID 186218053.
- ^ Heisenberg, W. (1932). «Über den Bau der Atomkerne. II». Zeitschrift für Physik. 78 (3–4): 156–164. Bibcode:1932ZPhy…78..156H. doi:10.1007/BF01337585. S2CID 186221789.
- ^ Heisenberg, W. (1933). «Über den Bau der Atomkerne. III». Zeitschrift für Physik. 80 (9–10): 587–596. Bibcode:1933ZPhy…80..587H. doi:10.1007/BF01335696. S2CID 126422047.
- ^ Iwanenko, D. (1932). «The Neutron Hypothesis». Nature. 129 (3265): 798. Bibcode:1932Natur.129..798I. doi:10.1038/129798d0. S2CID 4096734.
- ^ Miller A.I. (1995) Early Quantum Electrodynamics: A Sourcebook, Cambridge University Press, Cambridge, ISBN 0521568919, pp. 84–88.
- ^ Wilson, Fred L. (1968). «Fermi’s Theory of Beta Decay». American Journal of Physics. 36 (12): 1150–1160. Bibcode:1968AmJPh..36.1150W. doi:10.1119/1.1974382.
- ^ Chadwick, J.; Goldhaber, M. (1934). «A nuclear photo-effect: disintegration of the diplon by gamma rays». Nature. 134 (3381): 237–238. Bibcode:1934Natur.134..237C. doi:10.1038/134237a0. S2CID 4137231.
- ^ Chadwick, J.; Goldhaber, M. (1935). «A nuclear photoelectric effect». Proceedings of the Royal Society of London A. 151 (873): 479–493. Bibcode:1935RSPSA.151..479C. doi:10.1098/rspa.1935.0162.
- ^ Cooper, Dan (1999). Enrico Fermi: And the Revolutions in Modern physics. New York: Oxford University Press. ISBN 978-0-19-511762-2. OCLC 39508200.
- ^ Hahn, O. (1958). «The Discovery of Fission». Scientific American. 198 (2): 76–84. Bibcode:1958SciAm.198b..76H. doi:10.1038/scientificamerican0258-76.
- ^ Rife, Patricia (1999). Lise Meitner and the dawn of the nuclear age. Basel, Switzerland: Birkhäuser. ISBN 978-0-8176-3732-3.
- ^ Hahn, O.; Strassmann, F. (10 February 1939). «Proof of the Formation of Active Isotopes of Barium from Uranium and Thorium Irradiated with Neutrons; Proof of the Existence of More Active Fragments Produced by Uranium Fission». Die Naturwissenschaften. 27 (6): 89–95. Bibcode:1939NW…..27…89H. doi:10.1007/BF01488988. S2CID 33512939.
- ^ «The Nobel Prize in Chemistry 1944». Nobel Foundation. Archived from the original on 2018-12-26. Retrieved 2007-12-17.
- ^ Bernstein, Jeremy (2001). Hitler’s uranium club: the secret recordings at Farm Hall. New York: Copernicus. p. 281. ISBN 978-0-387-95089-1.
- ^ «The Nobel Prize in Chemistry 1944: Presentation Speech». Nobel Foundation. Archived from the original on 2007-10-25. Retrieved 2008-01-03.
- ^ Sir James Chadwick’s Discovery of Neutrons Archived 2011-10-26 at the Wayback Machine. ANS Nuclear Cafe. Retrieved on 2012-08-16.
- ^ Particle Data Group Summary Data Table on Baryons Archived 2011-09-10 at the Wayback Machine. lbl.gov (2007). Retrieved on 2012-08-16.
- ^ Tanabashi, M. (2018). «The Review of Particle Physics». Physical Review D. 54 (1): 1653. doi:10.1103/physrevd.54.1. PMID 10020536. Archived from the original on 2020-10-19. Retrieved 2020-10-14.
- ^ Basic Ideas and Concepts in Nuclear Physics: An Introductory Approach, Third Edition; K. Heyde Taylor & Francis 2004. Print ISBN 978-0-7503-0980-6, 978-1-4200-5494-1. doi:10.1201/9781420054941. full text[permanent dead link]
- ^ Greene, GL; et al. (1986). «New determination of the deuteron binding energy and the neutron mass». Physical Review Letters. 56 (8): 819–822. Bibcode:1986PhRvL..56..819G. doi:10.1103/PhysRevLett.56.819. PMID 10033294.
- ^ Byrne, J. Neutrons, Nuclei, and Matter, Dover Publications, Mineola, New York, 2011, ISBN 0486482383, pp. 18–19
- ^ Alvarez, L.W; Bloch, F. (1940). «A quantitative determination of the neutron magnetic moment in absolute nuclear magnetons». Physical Review. 57 (2): 111–122. Bibcode:1940PhRv…57..111A. doi:10.1103/physrev.57.111.
- ^ a b Gell, Y.; Lichtenberg, D.B. (1969). «Quark model and the magnetic moments of proton and neutron». Il Nuovo Cimento A. Series 10. 61 (1): 27–40. Bibcode:1969NCimA..61…27G. doi:10.1007/BF02760010. S2CID 123822660.
- ^ a b c Perkins, Donald H. (1982). Introduction to High Energy Physics. Addison Wesley, Reading, Massachusetts. pp. 201–202. ISBN 978-0-201-05757-7.
- ^
Greenberg, O.W. (2009), «Color charge degree of freedom in particle physics», Compendium of Quantum Physics, Springer Berlin Heidelberg, pp. 109–111, arXiv:0805.0289, doi:10.1007/978-3-540-70626-7_32, ISBN 978-3-540-70622-9, S2CID 17512393 - ^ Beg, M.A.B.; Lee, B.W.; Pais, A. (1964). «SU(6) and electromagnetic interactions». Physical Review Letters. 13 (16): 514–517, erratum 650. Bibcode:1964PhRvL..13..514B. doi:10.1103/physrevlett.13.514.
- ^ Sakita, B. (1964). «Electromagnetic properties of baryons in the supermultiplet scheme of elementary particles». Physical Review Letters. 13 (21): 643–646. Bibcode:1964PhRvL..13..643S. doi:10.1103/physrevlett.13.643.
- ^ a b Cho, Adrian (2 April 2010). «Mass of the Common Quark Finally Nailed Down». Science. American Association for the Advancement of Science. Archived from the original on 27 August 2015. Retrieved 27 September 2014.
- ^ Wilczek, F. (2003). «The Origin of Mass» (PDF). MIT Physics Annual: 24–35. Archived (PDF) from the original on June 20, 2015. Retrieved May 8, 2015.
- ^
Ji, Xiangdong (1995). «A QCD Analysis of the Mass Structure of the Nucleon». Physical Review Letters. 74 (7): 1071–1074. arXiv:hep-ph/9410274. Bibcode:1995PhRvL..74.1071J. doi:10.1103/PhysRevLett.74.1071. PMID 10058927. S2CID 15148740. - ^ Martinelli, G.; Parisi, G.; Petronzio, R.; Rapuano, F. (1982). «The proton and neutron magnetic moments in lattice QCD» (PDF). Physics Letters B. 116 (6): 434–436. Bibcode:1982PhLB..116..434M. doi:10.1016/0370-2693(82)90162-9. Archived (PDF) from the original on 2020-04-20. Retrieved 2019-08-25.
- ^ Kincade, Kathy (2 February 2015). «Pinpointing the magnetic moments of nuclear matter». Phys.org. Archived from the original on 2 May 2015. Retrieved May 8, 2015.
- ^ a b J. Byrne (2011). Neutrons, Nuclei and Matter: An exploration of the physics of slow neutrons. Mineola, NY: Dover Publications. pp. 28–31. ISBN 978-0486482385.
- ^ Hughes, D.J.; Burgy, M.T. (1949). «Reflection and polarization of neutrons by magnetized mirrors» (PDF). Physical Review. 76 (9): 1413–1414. Bibcode:1949PhRv…76.1413H. doi:10.1103/PhysRev.76.1413. Archived from the original (PDF) on 2016-08-13. Retrieved 2016-06-26.
- ^ Sherwood, J.E.; Stephenson, T.E.; Bernstein, S. (1954). «Stern-Gerlach experiment on polarized neutrons». Physical Review. 96 (6): 1546–1548. Bibcode:1954PhRv…96.1546S. doi:10.1103/PhysRev.96.1546.
- ^
Miller, G.A. (2007). «Charge Densities of the Neutron and Proton». Physical Review Letters. 99 (11): 112001. arXiv:0705.2409. Bibcode:2007PhRvL..99k2001M. doi:10.1103/PhysRevLett.99.112001. PMID 17930428. S2CID 119120565. - ^ «Pear-shaped particles probe big-bang mystery» (Press release). University of Sussex. 20 February 2006. Archived from the original on 2011-06-07. Retrieved 2009-12-14.
- ^ A cryogenic experiment to search for the EDM of the neutron Archived 2012-02-16 at the Wayback Machine. Hepwww.rl.ac.uk. Retrieved on 2012-08-16.
- ^ Search for the neutron electric dipole moment: nEDM Archived 2015-09-25 at the Wayback Machine. Nedm.web.psi.ch (2001-09-12). Retrieved on 2012-08-16.
- ^ US nEDM ORNL experiment public page Archived 2017-04-30 at the Wayback Machine. Retrieved on 2017-02-08.
- ^ SNS Neutron EDM Experiment Archived 2011-02-10 at the Wayback Machine. P25ext.lanl.gov. Retrieved on 2012-08-16.
- ^ Measurement of the Neutron Electric Dipole Moment Archived 2011-08-23 at the Wayback Machine. Nrd.pnpi.spb.ru. Retrieved on 2012-08-16.
- ^ Kisamori, K.; et al. (2016). «Candidate Resonant Tetraneutron State Populated by the He4(He8,Be8) Reaction». Physical Review Letters. 116 (5): 052501. Bibcode:2016PhRvL.116e2501K. doi:10.1103/PhysRevLett.116.052501. PMID 26894705.
- ^ «Physicists find signs of four-neutron nucleus». 2016-02-24. Archived from the original on 2017-07-29. Retrieved 2017-06-27.
- ^ Orr, Nigel (2016-02-03). «Can Four Neutrons Tango?». Physics. 9: 14. Bibcode:2016PhyOJ…9…14O. doi:10.1103/Physics.9.14.
- ^ Spyrou, A.; et al. (2012). «First Observation of Ground State Dineutron Decay: 16Be». Physical Review Letters. 108 (10): 102501. Bibcode:2012PhRvL.108j2501S. doi:10.1103/PhysRevLett.108.102501. PMID 22463404.
- ^ Llanes-Estrada, Felipe J.; Moreno Navarro, Gaspar (2012). «Cubic neutrons». Modern Physics Letters A. 27 (6): 1250033–1–1250033–7. arXiv:1108.1859. Bibcode:2012MPLA…2750033L. doi:10.1142/S0217732312500332. S2CID 118407306.
- ^ Knoll, Glenn F. (1979). «Ch. 14». Radiation Detection and Measurement. John Wiley & Sons. ISBN 978-0471495451.
- ^ Ghosh, P.; W. Fu; M. J. Harrison; P. K. Doyle; N. S. Edwards; J. A. Roberts; D. S. McGregor (2018). «A high-efficiency, low-Ĉerenkov Micro-Layered Fast-Neutron Detector for the TREAT hodoscope». Nuclear Instruments and Methods in Physics: A. 904: 100–106. Bibcode:2018NIMPA.904..100G. doi:10.1016/j.nima.2018.07.035. S2CID 126130994. Archived from the original on 2022-04-12. Retrieved 2020-04-14.
- ^ Ghosh, P.; D. M. Nichols; W. Fu; J. A. Roberts; D. S. McGregor (2020). «Gamma-Ray Rejection of the SiPM-coupled Micro-Layered Fast-Neutron Detector». 2019 IEEE Nuclear Science Symposium and Medical Imaging Conference (NSS/MIC): 1–3. doi:10.1109/NSS/MIC42101.2019.9059869. ISBN 978-1-7281-4164-0. S2CID 204877955.
- ^ Köhn, C.; Ebert, U. (2015). «Calculation of beams of positrons, neutrons and protons associated with terrestrial gamma-ray flashes» (PDF). Journal of Geophysical Research: Atmospheres. 23 (4): 1620–1635. Bibcode:2015JGRD..120.1620K. doi:10.1002/2014JD022229. Archived (PDF) from the original on 2019-12-23. Retrieved 2019-08-25.
- ^ Köhn, C.; Diniz, G.; Harakeh, Muhsin (2017). «Production mechanisms of leptons, photons, and hadrons and their possible feedback close to lightning leaders». Journal of Geophysical Research: Atmospheres. 122 (2): 1365–1383. Bibcode:2017JGRD..122.1365K. doi:10.1002/2016JD025445. PMC 5349290. PMID 28357174.
- ^ Clowdsley, MS; Wilson, JW; Kim, MH; Singleterry, RC; Tripathi, RK; Heinbockel, JH; Badavi, FF; Shinn, JL (2001). «Neutron Environments on the Martian Surface» (PDF). Physica Medica. 17 (Suppl 1): 94–96. PMID 11770546. Archived from the original (PDF) on 2005-02-25.
- ^ Byrne, J. Neutrons, Nuclei, and Matter, Dover Publications, Mineola, New York, 2011, ISBN 0486482383, pp. 32–33.
- ^ «Isotopes and Radioactivity Tutorial». Archived from the original on 2020-02-14. Retrieved 2020-04-16.
- ^ Science/Nature |Q&A: Nuclear fusion reactor Archived 2022-02-25 at the Wayback Machine. BBC News (2006-02-06). Retrieved on 2010-12-04.
- ^ Byrne, J. Neutrons, Nuclei, and Matter, Dover Publications, Mineola, New York, 2011, ISBN 0486482383, p. 453.
- ^ Kumakhov, M.A.; Sharov, V.A. (1992). «A neutron lens». Nature. 357 (6377): 390–391. Bibcode:1992Natur.357..390K. doi:10.1038/357390a0. S2CID 37062511.
- ^ Physorg.com, «New Way of ‘Seeing’: A ‘Neutron Microscope'» Archived 2012-01-24 at the Wayback Machine. Physorg.com (2004-07-30). Retrieved on 2012-08-16.
- ^ «NASA Develops a Nugget to Search for Life in Space» Archived 2014-03-08 at the Wayback Machine. NASA.gov (2007-11-30). Retrieved on 2012-08-16.
- ^ Ioffe, A.; Dabagov, S.; Kumakhov, M. (1995-01-01). «Effective neutron bending at large angles». Neutron News. 6 (3): 20–21. doi:10.1080/10448639508217696. ISSN 1044-8632.
- ^ Hall EJ (2000). Radiobiology for the Radiologist. Lippincott Williams & Wilkins; 5th edition
- ^ Johns HE and Cunningham JR (1978). The Physics of Radiology. Charles C Thomas 3rd edition
- ^ brian.maranville@nist.gov (2017-04-17). «How neutrons are useful». NIST. Archived from the original on 2021-01-25. Retrieved 2021-01-21.
- ^ E Hadden; Y Iso; A Kume; K Umemoto; T Jenke; M Fally; J Klepp; Y Tomita (2022). «HIGHLY EFFICIENT HOLOGRAPHIC OPTICAL ELEMENTS FOR COLD NEUTRON EXPERIMENTS». doi:10.13140/RG.2.2.26033.04963.
- ^ Hadden, Elhoucine; Iso, Yuko; Kume, Atsushi; Umemoto, Koichi; Jenke, Tobias; Fally, Martin; Klepp, Jürgen; Tomita, Yasuo (2022-05-24). McLeod, Robert R; Tomita, Yasuo; Sheridan, John T; Pascual Villalobos, Inmaculada (eds.). «Nanodiamond-based nanoparticle-polymer composite gratings with extremely large neutron refractive index modulation». Photosensitive Materials and Their Applications II. SPIE. 12151: 70–76. Bibcode:2022SPIE12151E..09H. doi:10.1117/12.2623661. ISBN 9781510651784. S2CID 249056691.
- ^ B. Lauss (May 2012). «Startup of the high-intensity ultracold neutron source at the Paul Scherrer Institute». Hyperfine Interact. 211 (1): 21–25. arXiv:1202.6003. Bibcode:2012HyInt.211…21L. doi:10.1007/s10751-012-0578-7. S2CID 119164071.
- ^ R. Golub & J. M. Pendlebury (1977). «The interaction of Ultra-Cold Neutrons (UCN) with liquid helium and a superthermal UCN source». Phys. Lett. A. 62 (5): 337–339. Bibcode:1977PhLA…62..337G. doi:10.1016/0375-9601(77)90434-0.
- ^ A. Steyerl; H. Nagel; F.-X. Schreiber; K.-A. Steinhauser; R. Gähler; W. Gläser; P. Ageron; J. M. Astruc; W. Drexel; G. Gervais & W. Mampe (1986). «A new source of cold and ultracold neutrons». Phys. Lett. A. 116 (7): 347–352. Bibcode:1986PhLA..116..347S. doi:10.1016/0375-9601(86)90587-6.
- ^ Stefan Döge; Jürgen Hingerl & Christoph Morkel (Feb 2020). «Measured velocity spectra and neutron densities of the PF2 ultracold-neutron beam ports at the Institut Laue–Langevin». Nucl. Instrum. Methods A. 953: 163112. arXiv:2001.04538. Bibcode:2020NIMPA.95363112D. doi:10.1016/j.nima.2019.163112. S2CID 209942845. Archived from the original on 2021-02-24. Retrieved 2020-04-24.
- ^ Freeman, Tami (May 23, 2008). «Facing up to secondary neutrons». Medical Physics Web. Archived from the original on 2010-12-20. Retrieved 2011-02-08.
- ^ Heilbronn, L.; Nakamura, T; Iwata, Y; Kurosawa, T; Iwase, H; Townsend, LW (2005). «Expand+Overview of secondary neutron production relevant to shielding in space». Radiation Protection Dosimetry. 116 (1–4): 140–143. doi:10.1093/rpd/nci033. PMID 16604615. Archived from the original on 2019-01-26. Retrieved 2019-01-25.
Further reading[edit]
- James Byrne, Neutrons, Nuclei and Matter: An Exploration of the Physics of Slow Neutrons. Mineola, New York: Dover Publications, 2011. ISBN 0486482383.
- Abraham Pais, Inward Bound, Oxford: Oxford University Press, 1986. ISBN 0198519974.
- Sin-Itiro Tomonaga, The Story of Spin, The University of Chicago Press, 1997
- Herwig Schopper, Weak interactions and nuclear beta decay, Publisher, North-Holland Pub. Co., 1966.
- Annotated bibliography for neutrons from the Alsos Digital Library for Nuclear Issues
(англ. neutron, от лат. neuter-ни тот, ни другой), электрически нейтральная элементарная частица (символ п), входящая наряду с протонами (р)в состав практически всех атомных ядер. Общее название Н. и протонов в атомном ядре-нуклоны. Н. открыт в 1932 Дж. Чедвиком. Число Н. Nв атомном ядре равно разности массового числа Аи заряда ядра Z: N = А ЧZ; для стабильных ядер легких и средних элементов Nпримерно равно числу протонов Z; для тяжелых стабильных ядер Nв 1,3-1,5 раз больше Z.
Масса покоя Н. немного больше, чем масса р, и равна 1,6749543(86) 10-24 г, то есть 1,008665012(37) атомных единиц массы (данные на 1976). Электрич. заряд Н. Qпринимают равным 0; прямые эксперименты по отклонению пучка Н. в сильном электрич. поле дают значение Q, меньшее 10-20 е (е — элементарный электрич. заряд). Спин Н. равен 1/2 (в единицах постоянной Планка), магн. дипольный момент m Н, определенный методом ЯМР, равен Ч 1,91315 (7) m Я (m Я -ядерный магнетон).
Н. устойчивы только в составе стабильных атомных ядер. Свободные Н. нестабильны, схема распада Н.: п 


Отсутствие у Н. электрич. заряда приводит к тому, что они взаимод. непосредственно с атомными ядрами, либо вызывая ядерные реакции, либо рассеиваясь на ядрах. Характер и интенсивность взаимод. пучка Н. с в-вом существенно зависят от энергии Н. Различают релятивистские (энергия больше 1010 эВ), высокоэнергетические (108-1010 эВ), быстрые (105-108 эВ), промежуточные (104-105 эВ), резонансные (0,5-104 эВ), тепловые (5.10-3-0,5 эВ), холодные (10-4-5.10-3 эВ), очень холодные (10-7-10-4 эВ) и ультрахолодные (энергия меньше 10-7 эВ) Н. Медленные Н. (энергия ниже 105 эВ) в осн. упруго рассеиваются на атомных ядрах или вызывают ядерные р-ции типа (n, g) (радиационный захват H.). С участием медленных Н. возможны также экзотермич. ядерные р-ции типа ( п, р), (п,a) или деление атомных ядер. Для снижения энергии Н. используют разл. замедлители нейтронов (графит, вода и т. д.), ядра к-рых не поглощают Н.
Для исследований строения в-ва используют тепловые Н., энергия к-рых сравнима с энергией тепловых колебаний атомов в твердом теле. При рассеянии тепловых Н. на монокристаллах имеет место дифракция Н. (см. Дифракционные методы). Наличие у Н. магн. дипольного момента вызывает рассеяние Н. на атомах, что дает возможность изучать магн. структуру материалов (см. Нейтронография).
Для регистрации Н. применяют детекторы, в материале к-рых Н. вызывают ядерные р-ции, сопровождающиеся образованием вторичных заряженных частиц, к-рые далее и регистрируют [напр., в детекторе на основе В при ядерной р-ции 10 В ( п,a)7Li возникают a-частицы].
Нейтронные пучки практически используются при синтезе радионуклидов, получении трансурановых элементов, в хим. анализе (см. Нейтронно-абсорбционный анализ, Актива-ционный анализ), горном деле (нейтронный каротаж), нейтронной авторадиографии (см. Радиография). В земной атмосфере свободные Н. непрерывно образуются в результате взаимод. космич. излучения с ядрами атомов, входящих в состав воздуха. Эти Н. приводят к непрерывному образованию в атмосфере радиоактивного 14 С при ядерной р-ции 14N(n, p)14C, на чем основан радиоуглеродный метод геохронологии. Об имеющих практич. значение источниках Н. см. в ст. Нейтронные источники.
Лит.: Власов Н. А., Нейтроны, 2 изд., М., 1971. С. С. Бердоносов.
Химическая энциклопедия. — М.: Советская энциклопедия.
.
1988.
Химический элемент
Химический элемент — совокупность атомов с одним и тем же зарядом ядра, числом протонов в ядре и электронов
в электронной оболочке. Закономерную связь химических элементов отражает периодическая таблица Д.И. Менделеева.

Изучая подобную карточку химического элемента, можно узнать о нем многое:
- Обозначение химического элемента
- Русское наименование
- Порядковый номер = заряд атома = число электронов = число протонов
- Атомная масса
- Распределение электронов по энергетическим уровням
- Электронная конфигурация внешнего уровня
Надо заметить, что на экзамене часто из карточки элемента скрывают распределение электронов и конфигурацию внешнего
уровня. Тем не менее, если вы успешно освоили предыдущую тему, то для вас не составит труда написать электронную
конфигурацию атома зная его порядковый номер в таблице Д.И. Менделеева (номер уж точно не тронут!))
Протоны, нейтроны и электроны
Вы уже знаете, что порядковый номер элемента в периодической таблице Д.И. Менделеева равен числу протонов, а число протонов
равно числу электронов.

Для того чтобы найти число нейтронов в атоме алюминия, необходимо вычесть из атомной массы число протонов:
27 — 13 = 14
Получается, что в атоме алюминия 14 нейтронов. Посчитайте число нейтронов, электронов и протонов самостоятельно для атомов бериллия,
кислорода, меди. Решение вы найдете ниже.

Если вы поняли суть и научились считать протоны, нейтроны и электроны, самое время приступать к следующей теме.
Изотопы
Изотопы (греч. isos — одинаковый + topos — место) — общее название разновидностей одного и того же химического элемента,
имеющих одинаковый заряд ядра (число протонов), но разное число нейтронов.
Вероятно, вы не задумывались, но вся таблица Д.И. Менделеева и представленные в ней химические элементы — это самые распространенные
на земле изотопы.
Лучше всего объяснить, что такое изотопы наглядным примером. Широко известны три изотопа водорода: протий, дейтерий и тритий.

В таблице Д.И. Менделеева представлен самый распространенный из трех — протий. Он содержит 1 протон и 1 электрон, нейтроны отсутствуют. У
дейтерия 1 протон, 1 нейтрон и 1 электрон. У трития 1 протон, 2 нейтрона, 1 электрон.
Теперь очевидно, что изотопы — атомы одного и того же химического элемента, различающиеся числом нейтронов.
Рассмотрим пример с изотопами лития. Самостоятельно посчитайте количество нейтронов у каждого изотопа. Найдите тот, который
включен в таблицу Д.И. Менделеева.

© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Субатомная частица без электрического заряда
 кварк, содержащийся в нейтроне. Назначение цвета отдельных кварков произвольно, но все три цвета должны присутствовать. Силы между кварками опосредуются глюонами. кварк, содержащийся в нейтроне. Назначение цвета отдельных кварков произвольно, но все три цвета должны присутствовать. Силы между кварками опосредуются глюонами. |
|
| Классификация | Барион |
|---|---|
| Состав | 1 верхний кварк, 2 нижние кварки |
| Статистика | Фермионные |
| взаимодействия | Гравитация, слабая, сильная, электромагнитная |
| Символ | . n.,. n.,. N. |
| Античастица | Антинейтрон |
| Теоретически | Эрнест Резерфорд (1920) |
| Обнаружен | Джеймс Чедвик (1932) |
| Масса | 1,67492749804 (95) × 10 kg. 939,56542052 (54) МэВ / c. 1,00866491588 (49) u |
| Средний срок службы | 881,5 (15) с (в свободном состоянии) |
| Электрический заряд | 0 e. (−2 ±  × 10 e (экспериментальные пределы) × 10 e (экспериментальные пределы) |
| Электрический дипольный момент | < 2.9×10 e⋅cm (experimental upper limit) |
| Электрическая поляризуемость | 1,16 (15) × 10 фм |
| Магнитный момент | −0,96623650 (23) × 10 J ·T. −1,04187563 (25) × 10 μB. — 1,91304273 (45) μN |
| Магнитная поляризуемость | 3,7 (20) × 10 фм |
| Спин | 1/2 |
| Изоспин | -1/2 |
| Четность | +1 |
| Конденсированный | I (J ) = 1/2 (1/2) |
нейтрон — это субатомная частица, символ. n. или. n., которая имеет нейтральный (не положительный или негр активный) заряд и масса немного больше, чем у протона. Протоны и нейтроны составляют ядра из атомов. Поскольку протоны и нейтроны ведут себя в ядре одинаково и каждый имеет массу приблизительно одну атомную единицу массы, они оба упоминаются как нуклоны. Их свойства и взаимодействия описываются ядерной физикой.
химические свойства атома в основном определяются конфигурацией электронов, которые вращаются вокруг атома тяжелое ядро. Электронная конфигурация определяется зарядом ядра, задаваемым числом протонов или атомным номером. Нейтроны не влияют на электронную конфигурацию, но сумма атомного номера и количества нейтронов, или нейтронное число, составляет массу ядра.
Атомы химического элемента, которые отличаются только числом нейтронов, называются изотопами. Например, углерод с атомным номером 6 содержит обильный изотоп углерод-12 с 6 нейтронами и редкий изотоп углерод-13 с 7 нейтронами. Некоторые элементы встречаются в природе только с одним стабильным изотопом, например, фтором. Другие элементы встречаются со многими стабильными изотопами, например олово с десятью стабильными изотопами.
Свойства атомного ядра зависят как от атомного, так и от нейтронного числа. Обладая положительным зарядом, протоны в ядре отталкиваются дальнодействующей электромагнитной силой, но гораздо более сильная, но короткодействующая ядерная сила тесно связывает нуклоны друг с другом. Нейтроны необходимы для стабильности ядер, за исключением однопротонного ядра водорода. Нейтроны в больших количествах образуются при делении ядер и синтезе. Они вносят основной вклад в нуклеосинтез химических элементов внутри звезд посредством процессов деления, слияния и нейтронного захвата.
Нейтрон необходим для производства ядерной энергии. Спустя десятилетие после того, как нейтрон был открыт Джеймсом Чедвиком в 1932 году, нейтроны были использованы для индукции многих различных типов ядерных трансмутаций. С открытием ядерного деления в 1938 году было быстро осознано, что если в результате деления будут образовываться нейтроны, каждый из этих нейтронов может вызвать дальнейшие процессы деления в каскаде, известном как цепная ядерная реакция.. Эти события и открытия привели к созданию первого автономного ядерного реактора (Chicago Pile-1, 1942) и первого ядерного оружия (Trinity, 1945).
Свободные нейтроны, хотя и не непосредственно ионизируют атомы, вызывают ионизирующее излучение. Как таковые, они могут представлять биологическую опасность в зависимости от дозы. На Земле существует небольшой естественный «нейтронный фон» поток свободных нейтронов, вызванный ливнями космических лучей и естественной радиоактивностью спонтанно делящихся элементов в земной коре. Выделенные источники нейтронов, такие как генераторы нейтронов, исследовательские реакторы и источники расщепления, производят свободные нейтроны для использования в облучении и в экспериментах по рассеянию нейтронов.
Содержание
- 1 Описание
- 2 Discovery
- 3 Бета-распад и стабильность ядра
- 3.1 Распад свободного нейтрона
- 3.2 Распад связанного нейтрона
- 3.3 Конкуренция типов бета-распада
- 4 Распад нейтрона по физике элементарных частиц
- 5 Внутренние свойства
- 5.1 Масса
- 5.2 Электрический заряд
- 5.3 Магнитный момент
- 5.4 Спин
- 5.5 Структура и геометрия распределения заряда
- 5.6 Электрический дипольный момент
- 5.7 Антинейтрон
- 6 Нейтронные соединения
- 6.1 Динейтроны и тетранейтроны
- 6.2 Нейтрониевые и нейтронные звезды
- 7 Обнаружение
- 7.1 Детектирование нейтронов путем захвата нейтронов
- 7.2 Обнаружение нейтронов посредством упругого рассеяния
- 8 Источники и производство
- 8.1 Нейтронные пучки и модификация пучков после производства
- 9 Области применения
- 10 Медицинские методы лечения
- 11 Защита
- 12 Температура нейтронов
- 12.1 Тепловые нейтроны
- 12,2 Холодные нейтроны
- 12,3 Ультрахолодные нейтроны
- 12,4 Нейтроны с энергией деления
- 12,5 Нейтроны термоядерного синтеза
- 12,6 Промежуточные Нейтроны с высокой энергией
- 12.7 Нейтроны высоких энергий
- 13 См. также
- 13.1 Источники нейтронов
- 13.2 Процессы с участием нейтронов
- 14 Ссылки
- 15 Дополнительная литература
Описание
Атомное ядро образовано количеством протонов Z (атомный номер ) и количеством нейтронов N (нейтронное число ), связанные вместе ядерной силой. Атомный номер определяет химические свойства атома, а нейтронный номер определяет изотоп или нуклид. Термины изотоп и нуклид часто используются как синонимы, но они относятся к химическим и ядерным свойствам соответственно. Изотопы — это нуклиды с одним и тем же атомным номером, но с другим числом нейтронов. Нуклиды с одинаковым числом нейтронов, но разным атомным номером, называются изотонами. Атомное массовое число, A, равно сумме атомного и нейтронного номеров. Нуклиды с одинаковыми атомными массовыми числами, но разными атомными и нейтронными числами, называются изобарами.
Ядро наиболее распространенного изотопа атома водорода (с химический символ H) — одиночный протон. Ядра тяжелых изотопов водорода дейтерия (D или H) и трития (T или H) содержат один протон, связанный с одним и двумя нейтронами, соответственно. Все другие типы атомных ядер состоят из двух или более протонов и различного количества нейтронов. Например, самый распространенный нуклид обычного химического элемента свинца, Pb, имеет 82 протона и 126 нейтронов. Таблица нуклидов включает все известные нуклиды. Несмотря на то, что это не химический элемент, нейтрон включен в эту таблицу.
Свободный нейтрон имеет массу 939,565,413,3 эВ / c, или 1,674927471 × 10 кг или 1.00866491588 u. Нейтрон имеет средний квадрат радиус примерно 0,8 × 10 м, или 0,8 фм, и это спин-½ фермион. У нейтрона нет измеримого электрического заряда. Обладая положительным электрическим зарядом, протон испытывает непосредственное влияние электрических полей, тогда как на нейтрон электрические поля не действуют. Однако нейтрон имеет магнитный момент , поэтому на нейтрон влияют магнитные поля. Магнитный момент нейтрона имеет отрицательное значение, поскольку его ориентация противоположна спину нейтрона.
Свободный нейтрон нестабилен, распадается на протон, электрон и антинейтрино со средним сроком службы чуть менее 15 минут (879,6 ± 0,8 с). Этот радиоактивный распад, известный как бета-распад, возможен, потому что масса нейтрона немного больше, чем масса протона. Свободный протон стабилен. Однако нейтроны или протоны, связанные в ядре, могут быть стабильными или нестабильными, в зависимости от нуклида . Бета-распад, при котором нейтроны распадаются на протоны или наоборот, регулируется слабой силой и требует испускания или поглощения электронов и нейтрино или их античастиц.

Протоны и нейтроны ведут себя почти одинаково под влиянием ядерной силы внутри ядра. Концепция изоспина, в которой протон и нейтрон рассматриваются как два квантовых состояния одной и той же частицы, используется для моделирования взаимодействий нуклонов посредством ядерных или слабых сил. Из-за силы ядерной силы на коротких расстояниях, энергия связи нуклонов более чем на семь порядков больше, чем электромагнитная энергия, связывающая электроны в атомах. Ядерные реакции (такие как деление ядер ), следовательно, имеют плотность энергии, которая более чем в десять миллионов раз превышает плотность химических реакций. Из-за эквивалентности массы и энергии, энергии связи ядер уменьшают массу ядер. В конечном счете, способность ядерных сил накапливать энергию, возникающую в результате электромагнитного отталкивания ядерных компонентов, является основой большей части энергии, которая делает возможными ядерные реакторы или бомбы. При ядерном делении поглощение нейтрона тяжелым нуклидом (например, уран-235 ) приводит к тому, что нуклид становится нестабильным и распадается на легкие нуклиды и дополнительные нейтроны. Положительно заряженные легкие нуклиды затем отталкиваются, высвобождая электромагнитную потенциальную энергию.
. Нейтрон классифицируется как адрон, потому что это составная частица, состоящая из кварков.. Нейтрон также классифицируется как барион, потому что он состоит из трех валентных кварков . Конечный размер нейтрона и его магнитный момент указывают на то, что нейтрон является составной, а не элементарной частицей. Нейтрон содержит два нижних кварка с зарядом — ⁄ 3e и один верхний кварк с зарядом + ⁄ 3 e.
Подобно протонам кварки нейтрона удерживаются вместе сильной силой, опосредованной глюонами. Ядерное взаимодействие является результатом вторичных эффектов более фундаментального сильного взаимодействия.
Discovery
История открытия нейтрона и его свойств занимает центральное место в необычных достижениях в атомной физике, которые произошли в Первая половина 20-го века, что в конечном итоге привело к атомной бомбе в 1945 году. В модели Резерфорда 1911 года атом состоял из небольшого положительно заряженного массивного ядра, окруженного гораздо большим облаком отрицательно заряженных электронов. В 1920 году Резерфорд предположил, что ядро состоит из положительных протонов и нейтрально заряженных частиц, предположительно, это протон и электрон, каким-то образом связанные. Предполагалось, что электроны находятся внутри ядра, потому что было известно, что бета-излучение состоит из электронов, испускаемых ядром. Резерфорд назвал эти незаряженные частицы нейтронами, используя латинский корень для нейтралис (средний) и греческий суффикс -on (суффикс, используемый в названиях субатомных частиц, то есть электрона и протона).. Ссылки на слово нейтрон в связи с атомом можно найти в литературе еще в 1899 году.
На протяжении 1920-х годов физики предполагали, что атомное ядро состоит из протонов и «ядерных электронов», но там были очевидные проблемы. Было трудно согласовать протон-электронную модель ядер с соотношением неопределенностей Гейзенберга квантовой механики. Парадокс Клейна, открытый Оскаром Клейном в 1928 году, представил дальнейшие квантово-механические возражения против идеи электрона, заключенного в ядре. Наблюдаемые свойства атомов и молекул не соответствовали ядерному спину, ожидаемому из протон-электронной гипотезы. И протоны, и электроны несут собственный спин 1/2. Изотопы одного и того же вида (т.е. имеющие одинаковое количество протонов) могут иметь как целочисленный, так и дробный спин, то есть спин нейтрона также должен быть дробным (½ ħ). Однако нет способа расположить спины электрона и протона (предполагается, что они соединяются с образованием нейтрона), чтобы получить дробный спин нейтрона.
В 1931 году Вальтер Боте и Герберт Беккер обнаружили, что если альфа-частица излучение полония падает на бериллий, бор или литий, было получено необычно проникающее излучение. На излучение не влияло электрическое поле, поэтому Боте и Беккер предположили, что это было гамма-излучение. В следующем году Ирен Жолио-Кюри и Фредерик Жолио-Кюри в Париже показали, что если это «гамма-излучение попадет на парафин или любой другой водород -содержащее соединение, оно выбрасывает протоны очень высокой энергии. Ни Резерфорд, ни Джеймс Чедвик из Кавендишской лаборатории в Кембридже не были убеждены в интерпретации гамма-лучей. Чедвик быстро провел серию экспериментов, которые показали, что новое излучение состоит из незаряженных частиц с массой примерно такой же, как и у протона. Эти частицы были нейтронами. За это открытие Чедвик в 1935 г. получил Нобелевскую премию по физике.
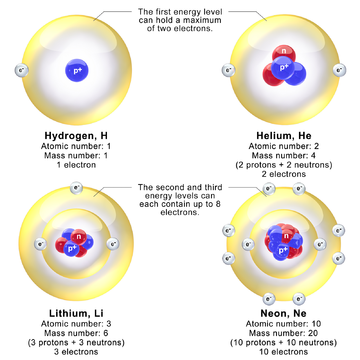
Модели атомного ядра, состоящие из протонов и нейтронов, были быстро разработаны Вернером Гейзенбергом и другими. Протон-нейтронная модель объяснила загадку ядерных спинов. Энрико Ферми в 1934 г. объяснил происхождение бета-излучения процессом бета-распада, в котором нейтрон распадается на протон, создавая электрон и (пока не обнаруженный) нейтрино. В 1935 году Чедвик и его докторант Морис Голдхабер сообщили о первом точном измерении массы нейтрона.
К 1934 году Ферми бомбардировал более тяжелые элементы нейтронами, чтобы вызвать радиоактивность в элементах высокий атомный номер. В 1938 году Ферми получил Нобелевскую премию по физике «за демонстрацию существования новых радиоактивных элементов, производимых нейтронным облучением, а также за связанное с ним открытие ядерных реакций, вызываемых медленными нейтронами». В 1938 Отто Хан, Лиз Мейтнер и Фриц Штрассманн открыли ядерное деление, или разделение ядер урана на легкие элементы, вызванное нейтронной бомбардировкой. В 1945 году Хан получил в 1944 г. Нобелевскую премию по химии «за открытие деления тяжелых ядер атомов». Открытие ядерного деления приведет к развитию ядерной энергетики и атомной бомбы к концу Второй мировой войны.
Бета-распад и стабильность ядра
Поскольку взаимодействующие протоны имеют взаимное электромагнитное отталкивание, которое сильнее их притягивающего ядерного взаимодействия, нейтроны являются необходимой составляющей любого атомного ядра, которое содержит более одного протона (см. дипротон и нейтрон-протонное отношение ). Нейтроны связываются с протонами и друг с другом в ядре посредством ядерной силы, эффективно уменьшая силы отталкивания между протонами и стабилизируя ядро.
Нейтроны и протоны, связанные в ядре, образуют квантово-механическую систему, в которой каждый нуклон связан в определенном иерархическом квантовом состоянии. Протоны могут распадаться на нейтроны или наоборот внутри ядра. Этот процесс, называемый бета-распадом, требует испускания электрона или позитрона и связанного с ним нейтрино. Эти испускаемые частицы уносят избыток энергии, когда нуклон падает из одного квантового состояния в состояние с более низкой энергией, в то время как протон (или нейтрон) превращается в нейтрон (или протон). Такие процессы распада могут происходить только в том случае, если это разрешено основными законами сохранения энергии и квантово-механическими ограничениями. От этих ограничений зависит стабильность ядер.
Распад свободного нейтрона
Вне ядра свободные нейтроны нестабильны и имеют среднее время жизни 879,6 ± 0,8 с (около 14 минут 40 секунд); поэтому период полураспада для этого процесса (который отличается от среднего времени жизни на коэффициент ln (2) = 0,693) составляет 610,1 ± 0,7 с (около 10 минут, 10 секунд). Этот распад возможен только потому, что масса протона меньше массы нейтрона. По эквивалентности массы и энергии, когда нейтрон распадается на протон таким образом, он достигает более низкого энергетического состояния. Бета-распад нейтрона, описанный выше, может быть обозначен радиоактивным распадом :
- . n. →. p. +. e. +. ν. e
, где. p.,. e. и. ν. eобозначают протон, электрон и электронный антинейтрино, соответственно. Для свободного нейтрона энергия распада для этого процесса (основанная на массах нейтрона, протона и электрона) составляет 0,782343 МэВ. Максимальная энергия бета-распада электрона (в процессе, когда нейтрино получает исчезающе малую кинетическую энергию) была измерена на уровне 0,782 ± 0,013 МэВ. Последнее число недостаточно хорошо измерено, чтобы определить сравнительно крошечную массу покоя нейтрино (которую теоретически необходимо вычесть из максимальной кинетической энергии электрона), так как масса нейтрино ограничивается многими другими методами.
Небольшая часть (примерно одна из 1000) свободных нейтронов распадается с теми же продуктами, но с добавлением дополнительной частицы в виде испускаемого гамма-луча:
- . n. →. p. +. e. +. ν. e+. γ.
Этот гамма-луч можно рассматривать как «внутреннее тормозное излучение », которое возникает в результате электромагнитного взаимодействия испускаемой бета-частицы с протоном. Образование внутреннего тормозного гамма-излучения также является второстепенным признаком бета-распада связанных нейтронов (как обсуждается ниже).
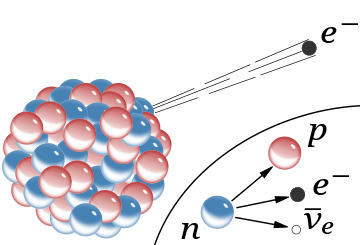
Очень небольшая часть нейтронных распадов (около четырех на миллион) — это так называемые «двухчастичные (нейтронные) распады», в которых образуются протон, электрон и антинейтрино как обычно, но электрон не может набрать энергию 13,6 эВ, необходимую для выхода из протона (энергия ионизации водорода ), и поэтому просто остается связанным с ним как нейтральный атом водорода (одно из «двух тел»). В этом типе распада свободного нейтрона почти вся энергия распада нейтрона уносится антинейтрино (другим «телом»). (Атом водорода отскакивает со скоростью, умноженной на (энергия распада) / (энергия покоя водорода) скорости света, или 250 км / с.)
Превращение свободного протона в нейтрон ( плюс позитрон и нейтрино) энергетически невозможно, так как свободный нейтрон имеет большую массу, чем свободный протон. Но столкновение протона с электроном или нейтрино при высоких энергиях может привести к образованию нейтрона.
Распад связанного нейтрона
В то время как свободный нейтрон имеет период полураспада около 10,2 мин, большинство нейтронов в ядрах стабильны. Согласно модели ядерной оболочки, протоны и нейтроны нуклида представляют собой квантово-механическую систему, организованную в дискретные энергетические уровни с уникальными квантовые числа. Для распада нейтрона образовавшемуся протону требуется доступное состояние с меньшей энергией, чем исходное состояние нейтрона. В стабильных ядрах все возможные состояния с более низкой энергией заполнены, что означает, что каждое из них занято двумя протонами со спином вверх и вниз. Принцип исключения Паули поэтому запрещает распад нейтрона на протон в стабильных ядрах. Ситуация аналогична электронам в атоме, где электроны имеют различные атомные орбитали и не могут распадаться на более низкие энергетические состояния с испусканием фотона в соответствии с принципом исключения.
Нейтроны в нестабильных ядрах могут распадаться посредством бета-распада, как описано выше. В этом случае для протона, образовавшегося в результате распада, доступно энергетически разрешенное квантовое состояние. Одним из примеров этого распада является углерод-14 (6 протонов, 8 нейтронов), который распадается до азота-14 (7 протонов, 7 нейтронов) с периодом полураспада около 5730 лет..
Внутри ядра протон может превратиться в нейтрон посредством обратного бета-распада, если для нейтрона доступно энергетически разрешенное квантовое состояние. Это преобразование происходит путем испускания позитрона и электронного нейтрино:
- . p. →. n. +. e. +. ν. e
Преобразование протона в нейтрон внутри ядра также возможно посредством захвата электрона :
- . p. +. e. →. n. +. ν. e
захвата позитрона нейтронами в ядрах, содержащих избыток нейтронов также возможен, но это затруднено, потому что позитроны отталкиваются положительным ядром и быстро аннигилируют при встрече с электронами.
Конкуренция типов бета-распада
Три конкурирующих типа бета-распада иллюстрируются одним изотопом меди-64 (29 протонов, 35 нейтронов), который имеет период полувыведения около 12,7 часов. У этого изотопа один неспаренный протон и один неспаренный нейтрон, поэтому либо протон, либо нейтрон могут распадаться. Этот конкретный нуклид почти с равной вероятностью подвергнется распаду протона (посредством эмиссии позитронов, 18% или захвата электронов, 43%) или нейтронного распада (посредством эмиссии электронов, 39%).
Распад нейтрона по физике элементарных частиц

В теоретических рамках Стандартной модели для физики элементарных частиц нейтрон состоит из двух нижних кварков и верхнего кварка. Единственно возможный режим распада нейтрона, который сохраняет барионное число, — это для одного из кварков нейтрона изменение аромата через слабое взаимодействие. Распад одного из нижних кварков нейтрона в более легкий верхний кварк может быть достигнут за счет испускания бозона W. Посредством этого процесса, описываемого Стандартной моделью бета-распада, нейтрон распадается на протон (который содержит один нижний и два верхних кварка), электрон и электронный антинейтрино.

Распад протона на нейтрон происходит аналогично через электрослабый сила. Распад одного из верхних кварков протона на нижний кварк может быть осуществлен путем испускания W-бозона. Протон распадается на нейтрон, позитрон и электронное нейтрино. Эта реакция может происходить только внутри атомного ядра, которое имеет квантовое состояние с более низкой энергией, доступной для созданного нейтрона.
Внутренние свойства
Масса
Масса нейтрона не может быть напрямую определена с помощью масс-спектрометрии из-за отсутствия электрического заряда. Однако, поскольку массы протона и дейтрона могут быть измерены с помощью масс-спектрометра, масса нейтрона может быть вычислена путем вычитания массы протона из массы дейтрона, с разницей в массе нейтрон плюс энергия связи дейтерия (выраженная как положительная излучаемая энергия). Последний может быть непосредственно измерен путем измерения энергии (B d { displaystyle B_ {d}}

- mn = md — mp + B d — E rd { displaystyle m_ {n} = m_ {d} -m_ {p} + B_ {d} -E_ {rd}}
Энергия гаммы луч может быть измерен с высокой точностью методами дифракции рентгеновских лучей, как это было впервые сделано Беллом и Эллиотом в 1948 году. Лучшие современные (1986) значения массы нейтрона с помощью этого метода предоставлены Greene et al. Они дают массу нейтрона:
- mнейтрон = 1,008644904 (14) u
Значение массы нейтрона в МэВ известно менее точно из-за меньшей точности известного преобразования u до МэВ:
- mнейтрон = 939,56563 (28) МэВ / c.
Другой метод определения массы нейтрона начинается с бета-распада нейтрона, когда импульсы образующегося протона и электрон измеряются.
Электрический заряд
Полный электрический заряд нейтрона равен 0 e. Это нулевое значение было проверено экспериментально, и текущий экспериментальный предел для заряда нейтрона составляет -2 (8) × 10 e, или -3 (13) × 10 C. Это значение соответствует нулю, учитывая экспериментальные неопределенности (указанные в скобках). Для сравнения, заряд протона равен +1 e.
Магнитный момент
. Хотя нейтрон является нейтральной частицей, магнитный момент нейтрона не равен нулю. На нейтрон не действуют электрические поля, но на него действуют магнитные поля. Магнитный момент нейтрона указывает на его кварковую субструктуру и распределение внутреннего заряда. Значение магнитного момента нейтрона было впервые непосредственно измерено Луисом Альваресом и Феликсом Блохом в Беркли, Калифорния в 1940 году. Альварес и Блох определили магнитный момент нейтрона должно быть μ n = −1.93 (2) μ N, где μ N — ядерный магнетон.
В кварковая модель для адронов, нейтрон состоит из одного верхнего кварка (заряд +2/3 e) и двух нижних кварков (заряд -1/3 e). Магнитный момент нейтрона можно смоделировать как сумму магнитных моментов составляющих кварков. Расчет предполагает, что кварки ведут себя как точечные дираковские частицы, каждая из которых имеет свой магнитный момент. Упрощенно, магнитный момент нейтрона можно рассматривать как результат векторной суммы трех магнитных моментов кварков плюс орбитальные магнитные моменты, вызванные движением трех заряженных кварков внутри нейтрона.
В одном из первых успехов Стандартной модели (теория SU (6), теперь понимаемая в терминах поведения кварков) в 1964 году Мирза А.Б. Бег, Бенджамин В. Ли и Абрахам Пайс теоретически рассчитали отношение магнитных моментов протона к нейтрону, равное −3/2, что согласуется с экспериментальным значением с точностью до 3%. Измеренное значение этого отношения составляет -1,45989805 (34). Противоречие квантово-механической основы этого расчета с принципом исключения Паули привело к открытию цветового заряда кварков Оскаром В.. Гринберг в 1964 году.
Вышеупомянутая трактовка сравнивает нейтроны с протонами, позволяя вычесть сложное поведение кварков между моделями и просто исследуя, каковы будут эффекты различных зарядов кварков (или кварков). тип). Таких вычислений достаточно, чтобы показать, что внутренняя часть нейтронов очень похожа на внутреннюю часть протонов, за исключением разницы в составе кварков с нижним кварком в нейтроне, заменяющим верхний кварк в протоне.
Магнитный момент нейтрона можно грубо вычислить, приняв простую нерелятивистскую, квантово-механическую волновую функцию для барионов, состоящих из трех кварков. Прямой расчет дает довольно точные оценки магнитных моментов нейтронов, протонов и других барионов. Для нейтрона конечным результатом этого расчета является то, что магнитный момент нейтрона определяется выражением μ n = 4/3 μ d — 1/3 μ u., где μ d и μ u — магнитные моменты для нижнего и верхнего кварков соответственно. Этот результат объединяет собственные магнитные моменты кварков с их орбитальными магнитными моментами и предполагает, что три кварка находятся в конкретном доминирующем квантовом состоянии.
| Барион | Магнитный момент. модели кварков | Вычислено. (μ N { displaystyle mu _ { mathrm {N}}} ) ) |
Наблюдаемое. (μ N { displaystyle mu _ { mathrm {N}}} ) ) |
|---|---|---|---|
| p | 4/3 μ u — 1/3 μ d | 2,79 | 2,793 |
| n | 4/3 μ d — 1/3 μ u | -1,86 | -1,913 |
Результаты этого расчета обнадеживают, но Предполагалось, что массы верхних или нижних кварков равны 1/3 массы нуклона. На самом деле массы кварков составляют всего около 1% от массы нуклона. Несоответствие проистекает из сложности Стандартной модели для нуклонов, где большая часть их массы происходит от полей глюонов, виртуальных частиц и связанной с ними энергии, которые являются важными аспектами сильного взаимодействия. Кроме того, сложная система кварков и глюонов, составляющих нейтрон требует релятивистского подхода. Магнитный момент нуклона был успешно вычислен численно из первых принципов, однако, включая все t Он упоминает эффекты и использует более реалистичные значения масс кварков. Расчет дал результаты, которые хорошо согласовывались с измерениями, но потребовали значительных вычислительных ресурсов.
Спин
Нейтрон — частица со спином 1/2, то есть фермион с собственным угловым моментом, равным 1/2 ħ, где ħ — приведенная постоянная Планка. В течение многих лет после открытия нейтрона его точный спин был неоднозначным. Хотя предполагалось, что это частица Дирака со спином 1/2 , возможность того, что нейтрон был частицей со спином 3/2, сохранялась. Взаимодействие магнитного момента нейтрона с внешним магнитным полем было использовано, чтобы окончательно определить спин нейтрона. В 1949 году Хьюз и Берги измерили нейтроны, отраженные от ферромагнитного зеркала, и обнаружили, что угловое распределение отражений соответствует спину 1/2. В 1954 году Шервуд, Стефенсон и Бернштейн использовали нейтроны в эксперименте Штерна-Герлаха, в котором для разделения спиновых состояний нейтронов использовалось магнитное поле. Они зарегистрировали два таких спиновых состояния, соответствующих частице со спином 1/2.
Как фермион, нейтрон подчиняется принципу исключения Паули ; два нейтрона не могут иметь одинаковые квантовые числа. Это источник давления вырождения, который делает возможными нейтронные звезды.
Структура и геометрия распределения заряда
В статье, опубликованной в 2007 году, с независимым от модели анализом сделан вывод о том, что нейтрон имеет отрицательно заряженную внешнюю поверхность, положительно заряженную середину и отрицательное ядро. В упрощенном классическом представлении отрицательная «кожа» нейтрона помогает ему притягиваться к протонам, с которыми он взаимодействует в ядре. (Однако основное притяжение между нейтронами и протонами осуществляется посредством ядерной силы, которая не связана с электрическим зарядом.)
Упрощенный классический взгляд на распределение заряда нейтрона также «объясняет» Дело в том, что магнитный диполь нейтрона направлен в противоположную сторону от вектора его спинового момента импульса (по сравнению с протоном). По сути, это придает нейтрону магнитный момент, который напоминает отрицательно заряженную частицу. Классически это может быть согласовано с нейтральным нейтроном, состоящим из распределения заряда, в котором отрицательные части нейтрона имеют больший средний радиус распределения и, следовательно, вносят больший вклад в магнитный дипольный момент частицы, чем положительные части, которые являются, в среднем, ближе к ядру.
Электрический дипольный момент
Стандартная модель физики элементарных частиц предсказывает крошечное разделение положительного и отрицательного заряда внутри нейтрона, что приводит к постоянному электрическому дипольному моменту. Однако предсказанное значение намного ниже текущей чувствительности экспериментов. Из нескольких нерешенных загадок в физике элементарных частиц становится ясно, что Стандартная модель не является окончательным и полным описанием всех частиц и их взаимодействий. Новые теории, выходящие за рамки Стандартной модели, обычно приводят к гораздо более крупным предсказаниям электрического дипольного момента нейтрона. В настоящее время проводится как минимум четыре эксперимента по измерению конечного электрического дипольного момента нейтрона, в том числе:
- Эксперимент EDM криогенного нейтрона, проводимый в Институте Лауэ – Ланжевена
- nEDM. эксперимент на новом источнике УХН в Институте Пола Шерера
- Эксперимент с nEDM планируется на Источник нейтронов расщепления
- Эксперимент с nEDM, проводимый в Институте Лауэ – Ланжевена
Антинейтрон
Антинейтрон — это античастица нейтрона. Он был открыт Брюсом Корком в 1956 году, через год после открытия антипротона. CPT-симметрия налагает сильные ограничения на относительные свойства частиц и античастиц, поэтому изучение антинейтронов обеспечивает строгие тесты на CPT-симметрию. Относительная разница масс нейтрона и антинейтрона составляет (9 ± 6) × 10. Поскольку разница составляет всего два стандартных отклонения от нуля, это не дает убедительных доказательств нарушения СРТ.
Нейтронные соединения
Динейтроны и тетранейтроны
Существование стабильных кластеров из 4 нейтронов, или тетранейтронов, было выдвинуто группой под руководством Франсиско-Мигеля Маркеса из Лаборатории ядерной физики CNRS на основании наблюдений за распадом бериллий -14 ядер. Это особенно интересно, потому что современная теория предполагает, что эти кластеры не должны быть стабильными.
В феврале 2016 года японский физик Сусуму Шимура из Токийского университета и его коллеги сообщили, что они впервые наблюдали предполагаемые тетранейтроны экспериментально. Физики-ядерщики всего мира говорят, что это открытие, если оно подтвердится, станет важной вехой в области ядерной физики и ядерной физики. безусловно, углубит наше понимание ядерных сил.
динейтрон — еще одна гипотетическая частица. В 2012 году Артемис Спайро из Университета штата Мичиган и его коллеги сообщили, что они впервые наблюдали эмиссию динейтрона при распаде Be. О динейтронном характере свидетельствует малый угол вылета между двумя нейтронами. Авторы измерили энергию разделения двух нейтронов, равную 1,35 (10) МэВ, что хорошо согласуется с расчетами модели оболочки, используя стандартные взаимодействия для этой области масс.
Нейтроний и нейтронные звезды
При При чрезвычайно высоких давлениях и температурах нуклоны и электроны, как полагают, коллапсируют в объемную нейтронную материю, называемую нейтронием. Предполагается, что это происходит в нейтронных звездах.
Экстремальное давление внутри нейтронной звезды может деформировать нейтроны до кубической симметрии, позволяя более плотно упаковывать нейтроны.
Обнаружение
Обычные средства обнаружения заряженной частицы путем поиска следа ионизации (например, в камере Вильсона ) не работают напрямую для нейтронов. Нейтроны, которые упруго рассеиваются на атомах, могут образовывать ионизационный трек, который можно обнаружить, но эксперименты не так просты; Чаще используются другие средства обнаружения нейтронов, заключающиеся в их взаимодействии с атомными ядрами. Таким образом, обычно используемые методы обнаружения нейтронов можно разделить на категории в соответствии с ядерными процессами, на которые опираются, в основном захват нейтронов или упругое рассеяние.
Обнаружение нейтронов путем захвата нейтронов
Метод обнаружения нейтронов включает преобразование энергии, высвобождаемой в реакциях захвата нейтронов, в электрические сигналы. Некоторые нуклиды имеют высокое сечение захвата нейтрона , которое представляет собой вероятность поглощения нейтрона. При захвате нейтронов составное ядро испускает более легко обнаруживаемое излучение, например альфа-частицу, которое затем обнаруживается. Для этой цели пригодны нуклиды. He.,. Li.,. B.,. U.,. U.,. Np. и. Pu..
Обнаружение нейтронов с помощью упругого рассеяния
Нейтроны могут упруго рассеиваться от ядер, вызывая отдачу пораженного ядра. Кинематически нейтрон может передать больше энергии легкому ядру, такому как водород или гелий, чем более тяжелому ядру. Детекторы, основанные на упругом рассеянии, называются детекторами быстрых нейтронов. Ядра отдачи могут ионизировать и возбуждать другие атомы посредством столкновений. Полученный таким образом заряд и / или сцинтилляционный свет можно собрать для получения детектируемого сигнала. Основная проблема при обнаружении быстрых нейтронов — отличить такие сигналы от ошибочных сигналов, создаваемых гамма-излучением в том же детекторе. Такие методы, как распознавание формы импульса, могут использоваться для различения нейтронных сигналов от сигналов гамма-излучения, хотя некоторые детекторы на основе неорганических сцинтилляторов были разработаны для избирательного обнаружения нейтронов в полях смешанного излучения, по сути, без каких-либо дополнительных методов.
Детекторы быстрых нейтронов имеют то преимущество, что не требуют замедлителя и, следовательно, способны измерять энергию нейтрона, время прибытия и, в некоторых случаях, направление падения.
Источники и производство
Свободные нейтроны нестабильны, хотя у них самый длительный период полураспада из всех нестабильных субатомных частиц на несколько порядков. Однако их период полураспада составляет всего около 10 минут, поэтому их можно получить только из источников, которые производят их непрерывно.
Естественный нейтронный фон. Небольшой естественный фоновый поток свободных нейтронов существует повсюду на Земле. В атмосфере и глубоко в океане «нейтронный фон» вызывается мюонами, возникающими при взаимодействии космических лучей с атмосферой. Эти высокоэнергетические мюоны способны проникать на значительные глубины в воду и почву. Там, поражая атомные ядра, среди других реакций они вызывают реакции расщепления, в которых нейтрон высвобождается из ядра. В земной коре вторым источником являются нейтроны, образующиеся в основном в результате спонтанного деления урана и тория, присутствующих в минералах земной коры. Нейтронный фон недостаточно силен, чтобы представлять биологическую опасность, но он важен для детекторов частиц с очень высоким разрешением, которые ищут очень редкие события, такие как (предполагаемые) взаимодействия, которые могут быть вызваны частицами темной материи.. Недавние исследования показали, что даже грозы могут производить нейтроны с энергией до нескольких десятков МэВ. Недавние исследования показали, что флюенс этих нейтронов составляет от 10 до 10 на мс и на м в зависимости от высоты обнаружения. Энергия большинства этих нейтронов, даже с начальной энергией 20 МэВ, снижается до диапазона кэВ в течение 1 мс.
Еще более сильное нейтронное фоновое излучение возникает на поверхности Марса, где атмосфера толстая. достаточно, чтобы генерировать нейтроны от образования мюонов космических лучей и отщепления нейтронов, но не достаточно толстым, чтобы обеспечить значительную защиту от образовавшихся нейтронов. Эти нейтроны не только создают опасность нейтронного излучения на поверхности Марса из-за прямого нисходящего нейтронного излучения, но также могут создавать значительную опасность из-за отражения нейтронов от поверхности Марса, что приведет к возникновению отраженного нейтронного излучения, проникающего вверх в марсианский корабль или среду обитания с моря. этаж.
Источники нейтронов для исследований. К ним относятся определенные типы радиоактивного распада (спонтанное деление и нейтронное излучение ), а также некоторые ядерные реакции. Удобные ядерные реакции включают в себя настольные реакции, такие как естественная альфа- и гамма-бомбардировка определенных нуклидов, часто бериллия или дейтерия, и индуцированное ядерное деление, такое как происходит в ядерных реакторах. Кроме того, высокоэнергетические ядерные реакции (такие как ливни космической радиации или столкновения ускорителей) также производят нейтроны в результате распада ядер-мишеней. Небольшие (настольные) ускорители элементарных частиц, оптимизированные для получения свободных нейтронов таким образом, называются нейтронными генераторами.
На практике наиболее часто используемые небольшие лабораторные источники нейтронов используют радиоактивный распад для производства нейтронов.. Один отметил вырабатывающий нейтроны радиоизотоп, калифорний -252 распада (период полураспада 2,65 года) в результате спонтанного деления в 3% случаев с образованием 3,7 нейтронов на деление, и используется только как источник нейтронов от этого процесса. источники ядерной реакции (состоящие из двух материалов), работающие на радиоизотопах, используют источник альфа-распада плюс бериллиевую мишень или источник высокоэнергетического гамма-излучения от источника, подвергающегося бета-распад с последующим гамма-распадом, который производит фотонейтроны при взаимодействии высокоэнергетического гамма-кванта с обычным стабильным бериллием или с дейтерий в тяжелой воде. Популярным источником последнего типа является радиоактивный сурьма-124 плюс бериллий, система с периодом полураспада 60,9 дней, которую можно построить из природной сурьмы (что составляет 42,8%). стабильная сурьма-123), активируя ее нейтронами в ядерном реакторе, а затем транспортируют туда, где необходим источник нейтронов.

Реакторы ядерного деления естественным образом производят свободные нейтроны; их роль — поддерживать производящую энергию цепную реакцию. Интенсивное нейтронное излучение также может быть использовано для получения различных радиоизотопов в процессе активации нейтронов, который представляет собой тип захвата нейтронов.
Экспериментальный ядерный синтез. реакторы производят свободные нейтроны как отходы. Однако именно эти нейтроны обладают большей частью энергии, и преобразование этой энергии в полезную форму оказалось сложной инженерной задачей. В термоядерных реакторах, вырабатывающих нейтроны, вероятно, образуются радиоактивные отходы, но отходы состоят из активированных нейтронами более легких изотопов, которые имеют относительно короткие периоды распада (50–100 лет) по сравнению с типичным периодом полураспада в 10 000 лет для отходов деления. который является долгим в первую очередь из-за длительного периода полураспада трансурановых актинидов, излучающих альфа.
Нейтронные пучки и модификация пучков после получения
Свободные нейтронные пучки получают от источников нейтронов посредством переноса нейтронов. Чтобы получить доступ к интенсивным источникам нейтронов, исследователи должны обратиться в специализированную нейтронную установку, на которой работает исследовательский реактор или расщепленный источник.
Отсутствие у нейтронов полного электрического заряда затрудняет их управление или ускорение. Заряженные частицы могут ускоряться, замедляться или отклоняться электрическими или магнитными полями. Эти методы мало влияют на нейтроны. Однако некоторые эффекты могут быть достигнуты при использовании неоднородных магнитных полей из-за магнитного момента нейтрона. Нейтронами можно управлять с помощью методов, включающих в себя замедление, отражение и выбор скорости. Тепловые нейтроны могут быть поляризованы путем прохождения через магнитные материалы способом, аналогичным эффекту Фарадея для фотонов. Холодные нейтроны с длинами волн 6–7 ангстрем могут образовываться в пучках с высокой степенью поляризации с помощью магнитных зеркал и намагниченных интерференционных фильтров.
Применения
Нейтрон играет важную роль во многих ядерных реакциях. Например, захват нейтронов часто приводит к активации нейтронов, вызывая радиоактивность. В частности, знание нейтронов и их поведения было важным при разработке ядерных реакторов и ядерного оружия. Деление таких элементов, как уран-235 и плутоний-239, вызвано их поглощением нейтронов.
Холодное, тепловое и горячее нейтронное излучение обычно используется в устройствах для рассеяния нейтронов, где излучение используется аналогичным образом, как используется X- лучи для анализа конденсированного состояния. Нейтроны дополняют последние с точки зрения атомных контрастов различными сечениями рассеяния ; чувствительность к магнетизму; диапазон энергий для неупругой нейтронной спектроскопии; и глубокое проникновение в материю.
Разработка «нейтронных линз», основанных на полном внутреннем отражении внутри полых стеклянных капиллярных трубок или отражении от алюминиевых пластин с углублениями, стимулировала продолжающиеся исследования в области нейтронной микроскопии и нейтронной / гамма-томографии.
В основном нейтроны используются для возбуждения запаздывающих и побуждающих гамма-лучей от элементов в материалах. Это составляет основу нейтронно-активационного анализа (NAA) и мгновенного активационного гамма-нейтронного анализа (PGNAA). NAA чаще всего используется для анализа небольших образцов материалов в ядерном реакторе , в то время как PGNAA чаще всего используется для анализа подземных горных пород вокруг скважин и промышленных сыпучих материалов на конвейерных лентах.
Еще одно применение нейтронных излучателей — обнаружение легких ядер, в частности водорода, содержащегося в молекулах воды. Когда быстрый нейтрон сталкивается с легким ядром, он теряет большую часть своей энергии. Измеряя скорость, с которой медленные нейтроны возвращаются в зонд после отражения от ядер водорода, нейтронный зонд может определять содержание воды в почве.
Лечебные методы лечения
Поскольку нейтронное излучение проникающее и ионизирующее, оно может быть использовано для лечения. Однако нейтронное излучение может иметь нежелательный побочный эффект, поскольку пораженный участок остается радиоактивным. Нейтронная томография поэтому не является жизнеспособным медицинским приложением.
Терапия быстрыми нейтронами использует нейтроны высокой энергии, обычно более 20 МэВ, для лечения рака. Лучевая терапия рака основана на биологической реакции клеток на ионизирующее излучение. Если излучение доставляется небольшими сеансами для повреждения раковых участков, нормальные ткани успевают восстановиться, а опухолевые клетки часто не могут. Нейтронное излучение может доставлять энергию в злокачественную область со скоростью, на порядок превышающей гамма-излучение.
Пучки нейтронов низкой энергии используются в терапии с захватом бора для лечения рака. При терапии с захватом бора пациенту дают лекарство, которое содержит бор и который предпочтительно накапливается в опухоли, на которую она направлена. Затем опухоль бомбардируется нейтронами очень низкой энергии (хотя часто с более высокой, чем тепловая энергия), которые захватываются изотопом бор-10 в боре, что создает возбужденное состояние бор-11, который затем распадается. для производства лития-7 и альфа-частицы, обладающих достаточной энергией для уничтожения злокачественной клетки, но недостаточной дальностью действия для повреждения соседних клеток. Для применения такой терапии для лечения рака предпочтительным является источник нейтронов с интенсивностью порядка тысячи миллионов (10) нейтронов в секунду на 1 см. Такие потоки требуют исследовательского ядерного реактора.
Защита
Воздействие свободных нейтронов может быть опасным, поскольку взаимодействие нейтронов с молекулами в организме может вызвать разрушение молекул и атомов, а также может вызывать реакции, вызывающие другие формы излучения (например, протоны). Применяются обычные меры радиационной защиты: избегать облучения, держаться как можно дальше от источника и сводить время воздействия к минимуму. Однако следует подумать о том, как защитить себя от воздействия нейтронов. Для других типов излучения, например, альфа-частиц, бета-частиц или гамма-лучей, материал с высоким атомным номером и высокой плотностью обеспечивает хорошее экранирование. ; часто используется отведение. Однако этот подход не будет работать с нейтронами, поскольку поглощение нейтронов не увеличивается напрямую с атомным номером, как это происходит с альфа-, бета- и гамма-излучением. Вместо этого нужно посмотреть на конкретные взаимодействия нейтронов с веществом (см. Раздел об обнаружении выше). Например, водород -содержащие материалы часто используются для защиты от нейтронов, так как обычный водород и рассеивает, и замедляет нейтроны. Это часто означает, что простые бетонные блоки или даже наполненные парафином пластиковые блоки обеспечивают лучшую защиту от нейтронов, чем гораздо более плотные материалы. После замедления нейтроны могут быть поглощены изотопом, который имеет высокое сродство к медленным нейтронам, не вызывая вторичного захватывающего излучения, такого как литий-6.
Богатая водородом обычная вода влияет на поглощение нейтронов в реакторах ядерного деления : Обычно нейтроны настолько сильно поглощаются обычной водой, что требуется обогащение топлива делящимся изотопом. дейтерий в тяжелой воде имеет гораздо более низкое сродство к поглощению нейтронов, чем протий (нормальный легкий водород). Следовательно, дейтерий используется в реакторах типа CANDU, чтобы замедлить (умеренную ) скорость нейтронов, чтобы увеличить вероятность ядерного деления по сравнению с захват нейтронов.
Температура нейтронов
Тепловые нейтроны
Тепловые нейтроны — это свободные нейтроны, энергии которых имеют распределение Максвелла – Больцмана с kT = 0,0253 эВ (4,0 × 10 Дж ) при комнатной температуре. Это дает характеристическую (не среднюю и не среднюю) скорость 2,2 км / с. Название «термический» происходит от того, что их энергия — это энергия газа или материала комнатной температуры, через которые они проникают. (энергии и скорости молекул см. в кинетической теории ). После ряда столкновений (часто в диапазоне 10–20) с ядрами нейтроны попадают на этот энергетический уровень при условии, что они не поглощаются.
Во многих веществах реакции тепловых нейтронов имеют гораздо большее эффективное сечение, чем реакции с участием более быстрых нейтронов, и поэтому тепловые нейтроны могут легче (т. Е. С большей вероятностью) поглощаться любыми атомными ядрами., с которым они сталкиваются, создавая в результате более тяжелый — и часто нестабильный — изотоп химического элемента.
В большинстве реакторов деления используется замедлитель нейтронов для замедления или термализации нейтронов, испускаемых ядерным делением, чтобы они были больше легко захватывается, вызывая дальнейшее деление. Другие, называемые реакторами на быстрых нейтронах, напрямую используют нейтроны энергии деления.
Холодные нейтроны
Холодные нейтроны — это тепловые нейтроны, уравновешенные в очень холодном веществе, таком как жидкий дейтерий. Такой источник холода помещается в замедлитель исследовательского реактора или источник скола. Холодные нейтроны особенно ценны для экспериментов по рассеянию нейтронов.

Ультрахолодные нейтроны
Ультрахолодные нейтроны получаются путем неупругого рассеяния холодные нейтроны в веществах с низким сечением поглощения нейтронов при температуре в несколько кельвинов, таких как твердый дейтерий или сверхтекучий гелий. Альтернативным методом производства является механическое замедление холодных нейтронов с использованием доплеровского сдвига.
Нейтроны с энергией деления
Быстрый нейтрон — это свободный нейтрон с уровнем кинетической энергии, близким к 1 МэВ (1,6 × 10 J ), следовательно, скорость ~ 14000 км / с (~ 5% скорости света). Их называют энергией деления или быстрыми нейтронами, чтобы отличить их от тепловых нейтронов с более низкой энергией и нейтронов высокой энергии, образующихся в космических ливнях или ускорителях. Быстрые нейтроны производятся ядерными процессами, такими как деление ядра. Нейтроны, образующиеся при делении, как отмечалось выше, имеют распределение Максвелла – Больцмана кинетических энергий от 0 до ~ 14 МэВ, среднюю энергию 2 МэВ (для нейтронов деления U) и режим . всего 0,75 МэВ, что означает, что более половины из них не квалифицируются как быстрые (и, таким образом, почти не имеют шансов инициировать деление в фертильных материалах, таких как U и Th).
Быстрые нейтроны можно превратить в тепловые нейтроны с помощью процесса, называемого замедлением. Это делается с помощью замедлителя нейтронов. В реакторах для замедления нейтронов обычно используются тяжелая вода, легкая вода или графит.
Нейтроны термоядерного синтеза
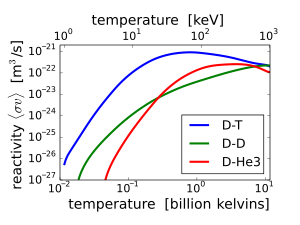
D – T (дейтерий — тритий ) термоядерный синтез — это реакция синтеза, которая производит нейтроны с наибольшей энергией, с 14,1 МэВ из кинетической энергии и движущиеся со скоростью 17% скорость света. D – T-синтез также является самой простой реакцией синтеза для воспламенения, достигающей почти пиковых скоростей, даже когда ядра дейтерия и трития имеют кинетическую энергию в тысячную раз меньше, чем 14,1 МэВ, которые будут произведены.
14,1 МэВ нейтроны имеют примерно в 10 раз больше энергии, чем нейтроны деления, и очень эффективны при делении даже не делящихся тяжелых ядер, и эти высокоэнергетические деление дает в среднем больше нейтронов, чем деление нейтронами с меньшей энергией. Это делает источники нейтронов термоядерного синтеза, такие как предлагаемые токамак энергетические реакторы, полезными для трансмутации трансурановых отходов. Нейтроны с энергией 14,1 МэВ также могут производить нейтроны, выбивая их из ядер.
. С другой стороны, эти нейтроны очень высоких энергий с меньшей вероятностью просто будут захвачены, не вызывая деления или расщепления. По этим причинам конструкция ядерного оружия широко использует D – T-синтез нейтронов с энергией 14,1 МэВ, чтобы вызвать большее деление. Нейтроны термоядерного синтеза способны вызывать деление в обычно неделящихся материалах, таких как обедненный уран (уран-238), и эти материалы использовались в оболочках термоядерного оружия. Нейтроны термоядерного синтеза также могут вызывать деление в веществах, которые непригодны или трудны для превращения в бомбы первичного деления, таких как плутоний реакторного качества. Этот физический факт, таким образом, заставляет обычные материалы, не относящиеся к оружию, вызывать озабоченность в некоторых обсуждениях и договорах ядерного распространения.
Другие реакции синтеза производят нейтроны с гораздо меньшей энергией. D – D термоядерный синтез производит нейтрон с энергией 2,45 МэВ и гелий-3 половину времени и производит тритий и протон, но не нейтрон в остальное время. Синтез D – He не производит нейтронов.
Нейтроны промежуточной энергии

Нейтрон энергии деления, который замедлился, но еще не достиг тепловой энергии называется эпитепловым нейтроном.
Сечения для реакций захвата и деления часто имеют множественные резонансные пики при определенных энергиях в надтепловом диапазоне энергий. Они имеют меньшее значение в реакторе на быстрых нейтронах, где большая часть нейтронов поглощается перед замедлением до этого диапазона, или в охлаждаемом тепловом реакторе, где надтепловые нейтроны взаимодействуют в основном с ядрами замедлителей, а не с делящимися или плодородными нуклидами актинидов. Однако в реакторе с частичным замедлителем с большим количеством взаимодействий надтепловых нейтронов с ядрами тяжелых металлов существует больше возможностей для переходных изменений реактивности, которые могут затруднить управление реактором.
Отношение реакций захвата к реакциям деления также хуже (больше захватов без деления) в большинстве ядерных топлив, таких как плутоний-239, что делает реакторы эпитеплового спектра, использующие эти виды топлива менее желательны, так как улавливает не только один нейтрон, но и обычно приводит к нуклиду, который не делящийся с тепловыми или надтепловыми нейтронами, но все же делится с быстрыми нейтронами. Исключением является уран-233 из ториевого цикла, который имеет хорошие отношения захвата-деления при всех энергиях нейтронов.
Нейтроны высоких энергий
Нейтроны высоких энергий имеют гораздо большую энергию, чем нейтроны энергии деления, и генерируются в виде вторичных частиц ускорителями частиц или в атмосфере из космические лучи. Эти нейтроны высокой энергии чрезвычайно эффективны при ионизации и с гораздо большей вероятностью могут вызвать смерть клетки, чем рентгеновские лучи или протоны.
См. также
| Викискладе есть материалы, связанные с нейтронами. |
- Ионизирующим излучением
- Изотопом
- Список частиц
- Магнитным моментом нейтрона
- Нейтронным излучением и Шкала излучения Сиверта
- Нейтроний
- Ядерная реакция
- Нуклеосинтез
- Нуклеосинтез нейтронного захвата
- R-процесс
- S-процесс
- Тепловой реактор
Источники нейтронов
- Генератор нейтронов
- Источник нейтронов
Процессы с участием нейтронов
- Нейтронная бомба
- Дифракция нейтронов
- Поток нейтронов
- Транспорт нейтронов
- Датирование космогенных радионуклидов
Ссылки
Дополнительная литература
- Джеймс Бирн, Нейтроны, ядра и материя: исследование физики медленных нейтронов. Mineola, New York: Dover Publications, 2011. ISBN 0486482383.
- Abraham Pais, Inward Bound, Oxford: Oxford University Press, 1986. ISBN 0198519974.
- Син-Итиро Томонага, The Story of Spin, The University of Chicago Press, 1997
- Хервиг Шоппер, Слабые взаимодействия и бета-распад ядер, Издательство, Север -Holland Pub. Co., 1966.
- Аннотированная библиография по нейтронам из Цифровой библиотеки по ядерным вопросам Алсос
Вспомните:
- что такое атом;
- из чего состоит атом;
- изменяется ли атом в химических реакциях?
АТОМ — это электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов.
Число электронов в ходе химических процессов может изменяться, но заряд ядра всегда остается неизменным. Зная распределение электронов в атоме (строение атома), можно предсказать многие свойства данного химического элемента, а также простых и сложных веществ, в состав которых этот элемент входит.
Содержание
- Структура Периодической системы Менделеева
- Ядро атома. Изотопы
- Распределение электронов в поле ядра атома
- Строение атома и свойства элементов
- Выводы
Структура Периодической системы Менделеева
Строение атома, т. е. состав ядра, распределение электронов вокруг ядра, несложно определить по положению элемента в Периодической системе. В Периодической системе Менделеева химические элементы располагаются в определённой последовательности. Эта последовательность тесно связана со строением атома этих элементов. Каждому химическому элементу в системе присвоен порядковый номер, кроме того, для него можно указать:
- номер периода;
- номер группы;
- вид подгруппы.
Зная точный «адрес» химического элемента, т. е. его группу, подгруппу и номер периода, можно однозначно определить строение его атома.
Период — это горизонтальный ряд химических элементов. В современной Периодической системе семь периодов. Первые три — малые, так как они содержат 2 или 8 элементов:
- 1-й период — Н, Не — 2 элемента;
- 2-й период — Li…Nе — 8 элементов;
- 3-й период — Na…Аr — 8 элементов.
Остальные периоды — большие. Каждый из них содержит 2–3 ряда элементов:
- 4-й период (2 ряда) — К…Кr — 18 элементов;
- 6-й период (3 ряда) — Сs…Rn — 32 элемента. В этот период входит ряд лантаноидов.
Группа — вертикальный ряд химических элементов. Всего групп восемь. Каждая группа состоит из двух подгрупп: главной подгруппы и побочной подгруппы (см. рис. 5).
Главную подгруппу (подгруппу А) образуют химические элементы малых периодов и больших периодов. На рисунке 5 показано, что главную подгруппу пятой группы составляют элементы малых периодов (N, P) и больших периодов (As, Sb, Bi).
Побочную подгруппу (подгруппу Б) образуют химические элементы только больших периодов. В нашем случае это V, Nb, Ta.
Визуально эти подгруппы различить легко: главная подгруппа «высокая», начинается с первого или второго периода. Побочная подгруппа — «низкая», начинается с 4-го периода.
Итак, каждый химический элемент Периодической системы имеет свой адрес:
- период;
- группу;
- подгруппу;
- порядковый номер.
Например, ванадий (V) — это химический элемент 4-го периода, V группы, побочной подгруппы, порядковый номер 23.
Задание 3.1. Укажите период, группу и подгруппу для химических элементов с порядковыми номерами 8, 26, 31, 35, 54.
Задание 3.2. Укажите порядковый номер и название химического элемента, если известно, что он находится:
- в 4-м периоде, VI группе, побочной подгруппе;
- в 5-м периоде, IV группе, главной подгруппе.
Каким образом можно связать эти сведения об элементе со строением его атома?
Ядро атома. Изотопы
Атом состоит из ядра, которое имеет положительный заряд, и электронов, которые имеют отрицательный заряд. В целом атом электронейтрален.
Положительный заряд ядра атома равен порядковому номеру химического элемента.
Ядро атома — сложная частица. В ней сосредоточена почти вся масса атома. Поскольку химический элемент — совокупность атомов с одинаковым зарядом ядра, то около символа элемента указывают (рис. 6).
По этим данным можно определить состав ядра. Ядро состоит из протонов и нейтронов.
- Протон (р) имеет массу, равную 1 (1,0073 а. е. м.) и заряд, равный +1.
- Нейтрон (n) заряда не имеет (нейтрален), а масса его приблизительно равна массе протона (1,0087 а. е. м.).
Какие частицы определяют заряд ядра? Протоны! Причём число протонов равно (по величине) заряду ядра атома, т. е. порядковому номеру:
Число нейтронов определяют по разности между величинами: «масса ядра» и «порядковый номер».
Задание 3.3. Определите состав ядер атомов, если химический элемент находится в:
- 3-м периоде, VII группе, главной подгруппе;
- 4-м периоде, IV группе, побочной подгруппе;
- 5-м периоде, I группе, главной подгруппе.
Обратите внимание, что при определении массового числа ядра атома приходится округлять атомную массу, указанную в Периодической системе! Почему? Ведь массы протона и нейтрона практически целочисленны, а массой электронов можно пренебречь.
Для того,чтобы ответить на этот вопрос, нужно понять:
- Что происходит с атомом в ходе химических процессов;
- Что такое «химический элемент».
В химических процессах обязательно изменяется распределение электронов вокруг ядра или даже изменяется их число. В последнем случае атом отдаёт или принимает электроны и превращается в заряженную частицу — ион. Но в химических реакциях никогда не меняется состав ядра атома, его заряд. Поэтому заряд ядра атома является своеобразным «паспортом» химического элемента.
Химический элемент — совокупность атомов или ионов с одинаковым зарядом ядра.
Для того чтобы разобраться, попробуйте определить, какие из ядер, состав которых указан ниже, принадлежат одному и тому же химическому элементу:
Атомам одного химического элемента принадлежат ядра А и В, так как они содержат одинаковое число протонов, т. е. заряд этих ядер одинаковый. Но ведь у них разная масса! Исследования показывают, что масса атома не оказывает существенного влияния на его химические свойства. Поэтому атомы одного и того же химического элемента (одинаковое число протонов), но с разной массой (разное число нейтронов) являются ИЗОТОПАМИ* этого элемента.
* Слово «изотоп» означает по смыслу «одно место», т. е. все изотопы данного химического элемента находятся в одной клетке ПСХЭ.
В таблице Менделеева указана средняя атомная масса всех природных изотопов данного элемента (Аr). Изотопы и их химические соединения отличаются друг от друга по физическим свойствам, но химические свойства у изотопов одного химического элемента одинаковы. Так, изотоп углерода-14 (14С) имеет такие же химические свойства, как и углерод-12 (12С), который входит в ткани любого живого организма, отличаясь от него только радиоактивностью. Поэтому изотопы применяют для диагностики и лечения различных заболеваний, для научных исследований.
Элемент «водород» встречается в природе в виде трёх изотопов:
Химический элемент «кислород» также представлен тремя природными изотопами:
Задание 3.4. Укажите состав ядер этих изотопов водорода и кислорода.
Если разные вещества содержат атомы одного и того же химического элемента, это не означает, что эти вещества имеют одни те же свойства. Например, химический элемент «хлор» в виде атомарного хлора Cl• разрушает метан, а также атмосферный озон. Тот же элемент в виде молекулярного хлора Cl2 ядовит, активно реагирует с водой, многими металлами, а ионы хлора (химический элемент — тот же!) в составе NaCl химически инертен, а с биологической точки зрения не только безвреден, но и полезен для нас. Эти ионы являются макроэлементами нашей пищи, которые входят в состав крови, желудочного сока. Суточная потребность — до 6 граммов.
Но вернемся к описанию строения атома.
Распределение электронов в поле ядра атома
Как известно, ядро атома в химических процессах не меняется. А что меняется? Общее число электронов и распределение электронов. Общее число электронов определить несложно: оно равно порядковому номеру, т. е. заряду ядра атома:
Электроны имеют отрицательный заряд –1, а масса их ничтожна: 1/1840 от массы протона.
Отрицательно заряженные электроны отталкиваются и поэтому находятся на разных расстояниях от ядра. При этом электроны, имеющие приблизительно равный запас энергии, образуют энергетический уровень.
Число энергетических уровней в атоме равно номеру периода, в котором находится химический элемент. Энергетические уровни условно обозначают так (рис. 7).
Задание 3.5. Определите число энергетических уровней в атомах кислорода, магния, кальция, свинца.
На каждом энергетическом уровне может находиться ограниченное число электронов:
- на первом энергетическом уровне не более 2 электронов;
- на втором энергетическом уровне не более 8 электронов;
- на третьем энергетическом уровне не более 18 электронов.
ЗАПОМНИТЕ ЭТИ ЧИСЛА!
Они показывают, что, например, на втором энергетическом уровне может находиться 2 или 5 или 7 электронов, но не может быть 9 или 12 электронов.
Важно знать, что, независимо от номера энергетического уровня, на внешнем (последнем) уровне не может быть больше восьми электронов. Внешний восьмиэлектронный энергетический уровень является наиболее устойчивым и называется завершённым. Такие энергетические уровни имеются у самых неактивных элементов — благородных газов.
Как определить число электронов на внешнем уровне остальных атомов? Для этого существует простое правило – число внешних электронов равно:
- для элементов главных подгрупп — номеру группы;
- для элементов побочных подгрупп — оно не может быть больше двух (рис. 8).
Например:
Задание 3.6. Укажите число внешних электронов для химических элементов с порядковыми номерами 15, 25, 30, 53.
Задание 3.7. Найдите в Периодической системе химические элементы, в атомах которых имеется завершённый внешний уровень.
Очень важно правильно определять число внешних электронов, так как именно с ними связаны важнейшие свойства атома. Так, в химических реакциях атомы стремятся «приобрести» устойчивый, завершённый внешний уровень (8ē). Для этого атомы, на внешнем уровне которых мало электронов, «предпочитают» их отдать.
Химические элементы, атомы которых способны только отдавать электроны, относятся к МЕТАЛЛАМ. Очевидно, что на внешнем уровне атома металла должно быть мало электронов: 1, 2, 3.
Если на внешнем энергетическом уровне атома много электронов, то такие атомы стремятся принять электроны до завершения внешнего энергетического уровня, т. е. до восьми электронов. Такие элементы относятся к НЕМЕТАЛЛАМ.
Вопрос. К каким элементам (металлам или неметаллам) относятся химические элементы побочных подгрупп? Почему?
Металлы и неметаллы главных подгрупп в таблице Менделеева отделяет линия, которую можно провести от бора к астату. Выше этой линии (и на линии) располагаются неметаллы, ниже — металлы.
Задание 3.8. Определить, к металлам или неметаллам относятся: фосфор, ванадий, кобальт, селен, висмут. Вывод сделайте, определив положение элемента в Периодической системе химических элементов и число электронов на внешнем уровне.
Для того чтобы составить распределение электрона по остальным уровням и подуровням, следует воспользоваться следующим АЛГОРИТМОМ:
- Определить общее число электронов в атоме (по порядковому номеру).
- Определить число энергетических уровней (по номеру периода).
- Определить число внешних электронов (по виду подгруппы и номеру группы).
- Указать число электронов на всех уровнях, кроме предпоследнего.
- Рассчитать число электронов на предпоследнем уровне.
Например, согласно пунктам 1…4 для атома марганца определено:
Получили распределение электронов в атоме марганца (рис. 9):
Задание 3.9. Отработайте алгоритм, составив схемы строения атомов для элементов № 16, 26, 33, 37. Укажите: металлы это или неметаллы? Ответ поясните.
Составляя вышеприведенные схемы строения атома, мы не учитывали, что электроны в атоме занимают не только определённые уровни, но и определённые подуровни каждого уровня. Вид подуровня обозначается латинской буквой: s, p, d.
Число возможных подуровней равно номеру уровня, т. е.
- первый уровень состоит из одного s-подуровня;
- второй уровень состоит из двух подуровней: s и р и т. д.
На каждом подуровне может находиться строго ограниченное число электронов:
- на s-подуровне — не больше 2ē;
- на р-подуровне — не больше 6ē;
- на d-подуровне — не больше 10ē.
Подуровни одного уровня заполняются в строго определённом порядке:
Таким образом, р-подуровнь не может начать заполняться, если не заполнен s-подуровень данного энергетического уровня и т. д. Исходя из этого правила, несложно составить электронную конфигурацию атома марганца (рис. 10).
В целом электронная конфигурация атома марганца выглядит так:
Здесь и далее приняты обозначения (рис. 11).
Задание 3.10. Составьте электронные конфигурации атомов для химических элементов № 16, 26, 33, 37.
Для чего необходимо составлять электронные конфигурации атомов? Для того чтобы определять свойства этих химических элементов!
Для этого следует помнить: в химических процессах участвуют только валентные электроны.
Валентные электроны находятся на внешнем энергетическом уровне и незавершённом d-подуровне предвнешнего уровня.
Определим число валентных электронов для марганца:
или сокращённо:
Строение атома и свойства элементов
Мы получили краткую электронную формулу атома марганца, которая отражает распределение его валентных электронов. Что можно определить по этой формуле?
1. Какие свойства — металла или неметалла — преобладают у этого элемента? Ответ: марганец — металл, так как на внешнем (четвёртом) уровне 2 электрона.
2. Какой процесс характерен для металла? Ответ: всегда только отдача электронов.
3. Какие электроны и сколько их будет отдавать атом марганца? Ответы:
- два внешних электрона (они дальше всех от ядра и слабее притягиваются им);
- семь (2+5) валентных электронов (так как в этом случае на третьем уровне атома останется восемь электронов, т. е. образуется завершённый уже внешний уровень).
Все эти рассуждения и заключения можно отразить при помощи схемы (рис. 12).
Полученные условные заряды атома называются степенью окисления.
Рассматривая строение атомов кислорода и водорода и рассуждая аналогично, можно показать, что типичными степенями окисления для кислорода является –2, а для водорода +1.
Вопрос. С каким из этих химических элементов может образовывать соединения марганец, если учесть полученные выше степени окисления его?
Только с кислородом, так как его атом имеет противоположную по заряду (знаку) степень окисления. В этом случае несложно составить формулы соответствующих оксидов марганца (здесь степени окисления соответствуют валентностям этих химических элементов):
Строение атома марганца подсказывает, что большей степени окисления, чем +7, у марганца быть не может, так как в этом случае пришлось бы затрагивать устойчивый, теперь уже завершённый предвнешний уровень. Поэтому степень окисления +7 является высшей, а соответствующий оксид Мn2О7 — высшим оксидом марганца.
Для закрепления всех этих понятий рассмотрим строение атома теллура и некоторые его свойства (см. рис. 13). Этот рисунок показывает, что теллур относится к неметаллам, так как, во-первых, у него на внешнем уровне шесть электронов и, во-вторых, его символ находится в главной подгруппе выше линии В — At. Поэтому его атом может и принимать (до завершения внешнего уровня, и отдавать электроны. В результате, в отличие от металлов, неметалл теллур может проявлять низшую степень окисления (–2) и образовывать летучие водородные соединения с водородом (Н2Те). Высшая степень окисления атома теллура (+6), как и у металлов соответствует номеру группы и, находясь в этой степени окисления, теллур образует высший оксид ТеО3.
Задание 3.11. Изобразить электронные конфигурации атомов Nа, Rb, Сl, I, Si, Sn. Определить свойства этих химических элементов, формулы их простейших соединений (с кислородом и с водородом).
Сделаем выводы.
- В химических реакциях участвуют только валентные электроны, которые могут находиться только на последних двух уровнях.
- Атомы металлов могут только отдавать эти электроны (все или несколько), принимая положительные степени окисления.
- Атомы неметаллов могут принимать (недостающие до восьми) электроны, получая при этом отрицательные степени окисления, и отдавать валентные электроны (все или несколько), принимая при этом положительные степени окисления.
Возникает вопрос: как составить краткую электронную формулу (распределение валентных электронов), сразу, не составляя длинных электронных конфигураций? Для этого нужно помнить несколько простых правил.
1. Номер периода соответствует числу энергетических уровней у атомов химических элементов этого периода.
2. Номер группы, как правило, совпадает с числом валентных электронов, (исключение составляют только подгруппы меди и железа).
3. Подгруппа (главная или побочная) включает химические элементы, у которых имеется одинаковое распределение валентных электронов, причём в атомах элементов главной и побочной подгруппы электроны распределяются по-разному.
3.1. У элементов главных подгрупп все валентные электроны находятся на внешнем уровне, например:
V группа, главная → 5 валентных электронов
Поэтому для всех химических элементов главной подгруппы пятой группы (пять валентных электронов) распределение этих электронов следующее:
3.2. У элементов побочных подгрупп число внешних электронов не превышает двух, например:
5 валентных электронов ← V группа, побочная → 2 электрона на внешнем уровне*.
* За счёт «провала электрона» число внешних электронов может быть меньше. Но число валентных электронов при этом не меняется, поэтому свойства элемента будут такими же. Эти случаи рассмотрены в Самоучителе второго уровня, часть 1.
Для большинства химических элементов побочных подгрупп, у которых на внешнем энергетическом уровне два электрона, остальные (N – 2) валентные электроны будут находиться на d-подуровне предвнешнего уровня (N – номер группы), например:
Вопрос. Для элементов какой группы составлена такая запись?
Задание 3.12. Составьте краткие электронные формулы для атомов химических элементов № 35 и 42, а затем составьте распределение электронов в этих атомах по алгоритму. Убедитесь, что ваше «предсказание» сбылось.
Сравним теперь свойства химических элементов одной подгруппы, например:
Что общего в строении атомов этих элементов? На внешнем уровне каждого атома по одному электрону — это активные металлы. Металлическая активность связана со способностью отдавать электроны: чем легче отдает электроны атом, тем сильнее выражены его металлические свойства.
Что удерживает электроны в атоме? Притяжение их к ядру. Чем ближе электроны к ядру, тем сильнее они притягиваются ядром атома, тем труднее их «оторвать».
Исходя из этого, сделаем вывод: какой элемент — Nа или Rb — легче отдает внешний электрон? Какой из них является более активным металлом? Очевидно, рубидий, так как его валентные электроны находятся дальше от ядра (и слабее удерживаются ядром).
Вывод. В главных подгруппах сверху вниз металлические свойства усиливаются, так как возрастает радиус атома и валентные электроны слабее притягиваются к ядру.
Сравним свойства:
Оба химических элемента — неметаллы, так как до завершения внешнего уровня не хватает одного электрона, и эти атомы будут активно притягивать недостающий электрон. При этом, чем сильнее притягивает атом неметалла недостающий электрон, тем сильнее проявляются его неметаллические свойства (способность принимать электроны).
За счёт чего происходит притяжение электрона? За счёт положительного заряда ядра атома. Но в таком случае чем ближе электрон к ядру, тем сильнее их взаимное притяжение, тем активнее неметалл.
Сделаем вывод, у какого элемента сильнее выражены неметаллические свойства: у хлора или у йода? Очевидно, у хлора, так как его валентные электроны ближе к ядру.
Вывод. Активность неметаллов в подгруппах сверху вниз убывает, так как возрастает радиус атома и все труднее притянуть недостающие электроны.
Сравним свойства кремния и олова:
На внешнем уровне обоих атомов по четыре электрона. Тем не менее эти элементы в Периодической системе находятся по разные стороны от линии, соединяющей бор и астат (см. правило в уроке 2.1.). Поэтому:
- у кремния, символ которого находится выше линии В–At, сильнее проявляются неметаллические свойства;
- у олова, символ которого находится ниже линии В–At, сильнее проявляются металлические свойства;
Почему? Потому что в атоме олова четыре валентных электрона находятся так далеко от ядра, что присоединение недостающих четырех электронов затруднено, в то время как отдача электронов с пятого энергетического уровня происходит достаточно легко. Для кремния возможны оба процесса, причём первый (приём электронов) — преобладает.
Выводы:
- чем меньше электронов в атоме и чем дальше они от ядра, тем сильнее проявляются металлические свойства;
- чем больше внешних электронов в атоме, чем ближе они к ядру, тем сильнее проявляются неметаллические свойства.
Сравним строение атомов и свойства химических элементов одного периода:
Вопрос. О каком периоде и каких элементах идёт речь?
Видно, что металлические свойства убывают, так как увеличивается число внешних электронов, а неметаллические свойства — возрастают. Если речь идёт о большом периоде, где большинство элементов имеет 2 электрона на внешнем уровне (элементы побочных подгрупп), то в этом случае главной причиной убывания металлических свойств в периоде является уменьшение радиуса атома. Дело в том, что за счёт увеличения заряда ядра в периоде увеличивается сила притяжения электронов к нему и уменьшается радиус атома:
Сравните: r (Ca) = 0,197 нм и r (Zn) = 0,139 нм
Вопрос. Какой из металлов более активен?
Основываясь на этих и других выводах, сформулированных в этой главе, можно для любого химического элемента Периодической системы составить алгоритм описания свойств химического элемента по его положению в Периодической системе.
1. Составить схему строения атома, т. е. определить состав ядра, распределение электронов по энергетическим уровням и подуровням:
- определить общее число электронов в атоме (по порядковому номеру);
- определить число энергетических уровней (по номеру периода);
- определить число внешних электронов (по виду подгруппы и номеру группы);
- указать число электронов на всех энергетических уровнях, кроме предпоследнего;
- рассчитать число электронов на предпоследнем уровне.
2. Определить число валентных электронов и число внешних электронов.
3. Определить, какие свойства — металла или неметалла — сильнее проявляются у данного химического элемента (по положению в ПСХЭ).
4. Определить число отдаваемых (принимаемых) электронов.
5. Определить высшую и низшую степени окисления химического элемента.
6. Составить для этих степеней окисления химические формулы простейших соединений с кислородом и водородом.
7. Определить характер оксида (см. урок 2.1.) и составить уравнения его реакции с водой.
8. Для указанных (пункт 6) веществ составить уравнения характерных реакций (см. урок 2).
Задание 3.13. Составить по данной схеме описания атомов серы, селена, кальция и стронция и свойства этих химических элементов. Какие общие свойства имеют их оксиды? Гидроксиды?
Если вы выполнили упражнения 3.11 и 3.12, то легко заметить, что не только атомы элементов одной подгруппы, но и их соединения имеют общие свойства и похожий состав. Это отражено в Периодическом законе Менделеева: Свойства химических элементов, а также свойства простых и сложных веществ, образованных ими, находятся в периодической зависимости от ЗАРЯДА ЯДЕР ИХ АТОМОВ.
Физический смысл Периодического закона ясен: свойства химических элементов периодически повторяются потому, что периодически повторяются конфигурации валентных электронов (распределение электронов внешнего и предпоследнего уровней).
Так, у химических элементов одной и той же подгруппы одинаковое распределение валентных электронов и, значит, похожие свойства.
Выводы
Строение атома связано с положением элемента в Периодической системе. Зная строение атома, можно предсказать свойства элемента и его соединений. Эти свойства находятся в периодической зависимости от заряда ядер атомов элементов, в соответствии с Периодическим законом Менделеева.
В древние времена считалось, что все состоит из земли, воды и воздуха, другого — нет. И сравнительно недавно люди смогли показать всю составляющую нашего мира. Важным вопросом было: что из себя представляет вещество?
Вещество — это материя, которая есть во всех физических телах на нашей планете.
Оно может быть простым и сложным.
Различие этих двух групп состоит в том, что простые вещества состоят из одного вида атомов, а сложные — из нескольких, поэтому впервые в ходе реакций не могут раскладываться на другие атомы, как это делают вторые.
Образцом сложного вещества можно назвать воду (H2O). Если провести химическую реакцию, то оно образует 2 элемента — водород (Н) и кислород (О). То, что получилось, — простые вещества, без последующего разложения.
В 19 веке считалось, что сами элементы не поддаются изменениям и независимы от объединения. Но такие высказывания были опровергнуты русским химиком Дмитрием Ивановичем Менделеевым, который доказал обратное, при этом указав на то, что качественная характеристика каждого элемента влияет на его атомный вес, из-за чего происходит повтор их свойств. Это умозаключение он олицетворил в своей периодической системе, назвав в честь себя.
Атом
Атом — мелкая частица, которая не разлагается в реакции на другие компоненты.
Есть что-то меньше вещества — это атомы.
Атомы можно различать по нескольким параметрам (приведем самые распространенные):
- Масса;
- Размер;
- Физические хар-ки;
- Химические хар-ки;
- Энергия;
- Вес атома.
Любой атом отличается от частицы другого элемента. Если сравнить атом водорода (Н) с атомом кислорода (О), то, очевидно, что у них будет несоответствие по многим характеристикам.
Размер атома
Если сравнить размеры атома и составляющих его частиц, то первый преобладает по своим масштабам. Ядро атома — ничто, по сравнению с ним самим. Взяв один кубический метр платины (Pt) и сплюснув его до такого состояния, где атомные расстояния просто бы исчезли, то он его кубический метр превратился бы в кубический миллиметр.
Из определения атома следует, что это маленькая частица. По форме они напоминают шар, а размер их поперечников составляет стомиллионную долю сантиметра. Чтобы это было нагляднее, рассмотрим поперечник атома водорода (Н), считающийся самым маленьким. Его размер составляет 10-8 доле сантиметра. Большим атомом является уран (U), чья величина составляет 3 х10-8 долей сантиметра.
Масштаб и вес атомов небольшие.
Вес атома
Чтобы посчитать вес какого-либо элемента, принято использовать 0,0625 долю кислорода (О), которая показывает насколько значение этого элемента больше. Если обратиться к таблице Менделеева, то можно увидеть под номерами всех элементов цифру, обозначающую атомный вес. Например, у водорода (Н) он составляет 1,008 (значение округляется, поэтому 1),а у радия — 226,025 (или же 226).Тут можно проследить разницу веса.
На заметку: при работе с периодической таблицей учтите, что если у вещества номер выше, тем вес атома будет больше.
Чаще всего у многих их вес будет дробный. Это объясняется тем, что они вмещают определенное количество частиц со своим весом, но признаки у всех абсолютно идентичны. Но такое не только у атомов. То же самое есть и самих элементов. Их называют изотопами.
Изотопы — химические элементы, занимающие один порядковый номер, но разную массу ядер.
Изотопы есть практически у каждого элемента (у кальция (Са) их целых четыре), при этом, чаще всего, их выводят искусственным путем.
Элементарные частицы
Протоны, нейтроны
Протоны — положительно заряженные части ядра. Заряд равен заряду электрона. Вес составляет 0,0625 грамм.
Нейтроны — нейтральная часть ядра. Чтобы узнать их значение, нужно из атомного веса элемента вычесть значение протонов (= электронов).
Поскольку электроны отделены от своих “напарников”, кружась вокруг них, стоит уделить им отдельное внимание.
Электроны
Электроны — частицы, у которых самый маленький отрицательный электрический заряд.
До настоящего времени считалось, что атомы, разложенные из элементов, являются конечным продуктом. На сегодняшний день эта мысль была развеяна учеными, которые доказали, что даже эти разложенные атомы содержат в себе крохотные молекулы.
Обратимся к одной из гипотез, объясняющую вещественную структуру. Там говорится, что элементный атом — некая совокупность, где есть центр, вокруг которого происходит вращение других крупинок.
Начнем с рассмотрения окраин центра, а именно с электронных уровней и электронов.
Как и говорилось ранее, значение электронов такое же, как и у протонов.
Их можно сравнить с шаром , а диаметр 40-13 сантиметров (что доказывает свою мизерность по сравнению с обычными атомами).
Электроны способны находиться в бездействии. Их масса при этом составляет 91-27 грамм. Это подчеркивает скудность инертных свойств, благодаря которым электроны способны быстро вращаться вокруг свой оси.
Масса электрона зависит от его скорости. Поговорив про массу “покоя”, которая есть у всех тел на Земле, нужно посмотреть и на массу “скорости”. Когда электрон занимается перемещением, то он образовывает электромагнитное поле. Оно играет большую роль, ибо именно из-за проявления ее инертных свойств набирается масса и энергия, передавая это все частицам. Сделаем вывод, что ускоренный динамизм этой частицы, приводит к набору его веса.
Но перемещение электронов не происходит ровно. Научно доказано, что эти частицы двигаются волнообразно из-за интерференции и дифракции.
Интерференция электронов — слияние нескольких волн электронов.
Дифракция электронов — волновое обтекание области места, через которое проходит ток.
Помимо того, что электроны двигаются волнами, так еще они крутят вокруг самих себя. Крутящееся и волновое движение говорит о нем (электроне) как о некоем магните.
Все три вида элементарных частиц фигурируют в постоянном обменивающемся контакте. Между электроном и протоном возникает связь, заставляющая их содействовать, поскольку их заряды противоположны, а вот две одинаковые частицы (например, два электрона) отталкиваются, т.к. заряды одинаковы (так же и у протона).
Нахождение частиц у элемента
Найти у какого-либо элемента эти частицы несложно. Разберем это на примере алюминия (Al).
Его порядковый номер — 13, соответственно, это есть ядро. Атомная масса алюминия составляет 26,98154 (значение округляется, поэтому 27). Протоны равны массе заряда (р=13), так же и электроны (е=13). Чтобы узнать значение нейтронов, нужно из атомной массы вычесть значение заряда ядра (n=27-13=14).
Взаимосвязь частиц
Каждая частица имеет свое электрическое поле, через которое оно “соприкасается” с остальными. Такие поля можно обозначить определенной материей, в которой, помимо этих частиц, есть и другие, наполняющие эту материю — фотоны.
Фотон — частица, не имеющая массы. Является переносчиком электромагнитного “общения”.
Все они имеют конкретный запас энергии. Именно через фотоны происходит коммуникация частиц. В такой связи происходит “бартер” фотонами, что служит для хорошей энергетической силы, то есть взаимосвязи частиц.
И в самом ядре происходит “общение” протона и нейтрона, но здесь уже нет электрического поля, поскольку нейтрон его не образовывает. Здесь все проходит при помощи особого поля, исходящего от ядра.
Ядерное поле — вид материи, который состоит из протонов, нейтронов и мезонов.
Мезон — частица, которая способствует взаимодействию протонов и нейтронов, а также влияет на то, чтобы эти частицы оставались в ядре.
Благодаря мезонам, протоны и нейтроны способны внутри своего ядра передавать определенную информацию путем ядерной силы. Ее работа в ядре происходит на определенной дистанции (приблизительно сантиметров).
Ядерная сила — сила влияния протона и нейтрона друг на друга.
Ядерные силы, происходящие внутри ядра, способны делать из протонов нейтроны и наоборот при помощи мезонов.
Можно сказать, что ядерные силы намного мощнее электрических, но вместе они не дают протонам выйти за границы ядра. Несмотря на то, что частицы сопротивляются, объединение двойной силы подавляет их, при этом создавая крепкое ядро. Из-за них и зависит его прочность.
Все три частицы называются элементарными, потому что их невозможно разложить на другие упрощенные элементы, но они могут становиться и образовываться друг из друга.
Химическое строение атомов
Работа электрона
Структура водорода (Н) заслуживает внимания. Это единственный элемент, который содержит в себе две частицы — один протон, находящийся в ядре, и один электрон, вращающийся вокруг него. Но даже тут есть нюанс: у электрона нет определенного барьера, отгораживающего его от окружающей среды.
Путь электрона вокруг ядра достаточно пластичен и поддается изменениям (причиной может стать увеличение массы электрона). А поскольку в ядре и на оболочке противоположно заряженные частицы, то они имеют свойство присоединяться. Но есть один момент: когда отрицательно заряженная частица облетает ядро, то образовывается центробежная сила, которая пытается максимально отдалить частицу. Все эти моменты создают спорную ситуацию.
Самое важное, чтобы была стабильность, тогда электрон будет спокойно находиться на своем месте. Поскольку вес орбитальной частицы небольшой, то для стабилизации ему придется летать возле ядра намного быстрее (примерно 60 15 облетов).
Получается, что электрон водорода (Н) находится неподалеку от протона, сохраняя минимум своей энергии. Но если какая-либо частица вторгнется в данную схему, и водород (Н) отдалится от ядра, то его энергия станет больше, но не надолго. Дело в том, что электрон все равно будет пытаться вернуться на место, приближенное к ядру. Электрон таким действием (переходом на другую орбиту) предоставил определенную часть своей энергии — лучистой энергии.
Если электрону дадут энергию, то он перейдет на другое место (чем больше энергии, тем дальше от протона). При этом, когда он будет возвращаться к ядру, то будет происходить активная выработка электромагнитной энергии с последующем излучением.
Когда ученые наблюдали за такими переходами этой частицы, они сделали вывод, что как и в любом элементе, так и в водороде (Н) электрон может совершать отойти только на конкретный круг, опираясь на полученное извне питание.Слои, на которых электрон способен перемещаться, называют дозволенными.
Работа протона и нейтрона в ядре
Как говорилось ранее, протон и электрон водорода (Н) — разноименные и аналогичные по значениям, поэтому их совместный заряд составляет — ноль. Из этого выходит, что водород (в обычном его состоянии) — нейтральная частица.
Такой вывод относится ко всем элементам из таблицы Менделеева. Все их атомы в нормальном состоянии нейтральны из-за равновесия разных зарядов.
Вернемся к ядру водорода (Н). Известно, что в нем находится только один протон. Обратимся к массе ядра.
Масса ядра — общее число протонов и нейтронов внутри ядра. Ее можно найти у всех элементов периодической таблицы.
Согласно этому, масса ядра водорода тоже будет составлять один (так как есть 1 протон и полностью отсутствуют нейтроны).
Что говорилось выше, относилось к природному водороду (Н), равному единице. Но существует еще и тяжелый водород (Н) — он же изотоп дейтерий (2H, имеет название тяжелого водорода). Масса равна двум. Если в ядре простого водорода (Н) всего лишь один протон, то у дейтерия — дейтоны.
Дейтон — объединение протона и нейтрона в ядре.
Водород и его изотопы
В природе обычный водород (Н) может вмещать в себя дейтерий, но в очень маленьком количестве (на 6 000 атомов Н один 2H). Но есть еще более тяжелый изотоп водорода (Н) — тритий (³Н, сверхтяжелый водород). В его ядре уже не одна, и не две частицы, а три — два нейтрона и один протон, между которыми есть ядерная сила. Масса трития составляет три. Получается, что он в целых три раза превосходит самый легкий водород.
Несмотря на то, что вес водорода и его изотопов различается, их объединяют некоторые общие свойства. Например, если самый простой водород (Н) вступит в связь с кислородом (О), то получится вода (Н2О). То же самое происходит и в цепи дейтерия ( 2H) и кислорода (О). У этого изотопа тоже на выходе получается вода, но тяжелая, которая пользуется спросом в производстве атомной энергии.
Читайте про свойства магнитного поля.
Из примера можно сделать вывод, главную роль в химических свойствах играет электронная оболочка и ее устройство, а не массу ядра. Водород и его изотопы несут в себе разную массу, но общее у них — это электроны возле ядра, которые и сохраняют идентичные свойства.
Водород (Н) взял первое место в менделеевской таблице. Такое решение было неслучайным. Как мы знаем, порядковый номер напрямую зависит от числа заряда ядра. То же самое и у водорода (Н) (номер в таблице — один = заряд ядра — один). Если правильно сказать, то: всякое вещество, занимающее место в периодической таблице Менделеева, имеет свой порядковый номер, соотносящийся заряду ядра и числу электронов на его оболочках.
Из всего сказанного получается, что водород (Н), занимающий первое место, имеет заряд ядра — +1 и один электрон на орбите.
Гелий и его изотопы
На втором месте в таблице стоит гелий (Не). Как и говорилось ранее про все элементы, его номер и заряд ядра однозначны, поэтому второй будет равен +2 (внутри ядра два протона), а оболочка будет содержать два электрона.
Как и все составляющие таблицы, гелий (Не) имеет изотопы. Их целых девять, но самыми стабильными из них считаются легкий и тяжелый, поэтому ими пользуются чаще. Рассмотрим первый.
Легкий гелий (³Не, еще имеет название гелион). Масса его ядра составляет 3, состоит из двух протонов, одного нейтрона и трех электронов на оболочке. Считается, что содержание гелиона в природном гелии 1/1 000 000 тяжелого гелия. Выводится искусственным путем.
Тяжелый гелий (⁴Не). Считается самым востребованным из всех изотопов гелия (Не). Ядро содержит два протона и два нейтрона, а на орбитах расположены четыре электрона.Образовывает около 99% гелия на нашей планете. Есть забавный факт про это вещество: если охладить его (-271 ºС) и поместить в открытую емкость, то этот изотоп вытечет из нее.
Затруднение состава атома в элементе обусловлено возрастанием объема элементарных частиц: протонов и нейтронов в ядре и электронов на оболочке. При помощи таблицы Менделеева можно узнать все эти необходимые данные об элементе (а именно про частицы).
В науке доказано, что легкие элементы имеют большое преимущество: их ядра, содержащие одинаковое количество протонов и нейтронов, считаются самыми крепкими, поскольку ядерная сила превышена, чем у остальных. Рассмотрим тяжелый гелий (⁴Не). В его составе располагаются два протона и два нейтрона, соответственно, у него неплохая прочность, точно так же, как и возникающая сила ядра.
Такие тяжелые вещества содержат разное количество частиц (протонов, нейтронов и электронов), из-за чего в ядре контакт между ними теряется, чего не происходит в легких. В тяжелых элементах возможно расщепить их ядра при разрыве атомных бомб.
Радиоактивные элементы
У тяжелых элементов есть и подразделение радиоактивных. Они отличаются тем, что их ядра настолько непрочны, что они способны самостоятельно расщепляться на отдельные частицы. Радий (Ra) — самый известный радиоактивный химический элемент. Его порядковый номер — 88. Масса атома равна 226 (если быть точнее, то 226,025).
Состав протонов в ядре — 88, а нейтронов — 138. Все они занимаются распадом, где позже они трансформируются в атомы радона (Rn, радиоактивный газ, номер в периодической таблице — 86). Все происходит точно так же: атомы радона (Rn) занимаются распадом, после чего тоже преобразовываясь в другие элементы.
Электронные оболочки
Электронные оболочки — это тоже важная часть, без которой представление какого-то химического элемента просто не было бы. Как было рассмотрено ранее, электроны единственные, кто размещен за ядром, при этом крутится вокруг него, собираясь определенными группами по разным “отсекам”.
Познание с ядрами и их частицами подошло к концу, поэтому теперь стоит уделить внимание тому, что находится за пределами этой главной точки.
Нахождение электронных оболочек и его содержимого
Чтобы определить количество электронных слоев элемента, нужно обратиться к его номеру периода. Например, алюминий (Al) с порядковым номером 13, находится в третьем периоде, поэтому число его слоев равно 3.
Еще одной удивительной характеристикой оболочек является закрепленное число электронов, которые могут находиться на слое. На первой орбите могут расположиться два электрона, на втором — восемь, на третьем — 16 и т.д. (с каждым разом нужно умножать на четыре).
Завершенным считается тот слой, который достиг окончательного предела. Электроны, которые расположены дальше всего от ядра, более активны, поэтому предпочитают вступать в контакт с другими атомами (научно это можно назвать валентностью). Число электронов на внешней оболочке зависит от номера группы. Например, бор (В) имеет заряд — +5, он находится во втором периоде, поэтому количество электронных слоев равно двум. Первый слой равен двум, а второй — трем, поскольку бор (В) находится в 3 группе.
Когда электронный слой полностью заполнен, то он считается стабилизированным. Это говорит о том, что атому не требуется брать дополнительные силы (электроны) из окружающей среды или других веществ. Если взять гелий (Не), у которого два электрона, находящиеся на одной оболочке, а у неона (Ne) электронов десять, располагающиеся на двух электронных слоях(на первом — 2, на втором — 8). Из этого выходит, что и гелий, и неон полностью заполнены, поэтому они не нуждаются в посторонней помощи, так как их оболочки завершенные. Такие элементы являются инертными в химическом плане (не идут на контакт с другими элементами, чтобы “занять” или “обменяться” этими частицами).
Но таких самодостаточных элементов достаточно мало, больше всего тех, где на внешней оболочке будет не хватать электронов, поэтому такие элементы охотнее прибегают к воздействию с другими. Калий (К) имеет 19 электронов, находящихся на четырех слоях (первый — 2, второй — 8, третий — 8, четвертый — 1). Больше всего интересует последняя оболочка. Поскольку там всего лишь один электрон, который очень далеко от ядра, то последнее не в силах удержать электрон, поэтому он с легкостью может перейти к другому элементу.
Если же взять кислород (О), у которого восемь электронов и две электрические оболочки (на первом — 2, на втором — 6). Как видно, второй слой является незавершенным, до предела ему не хватает еще двух частиц. Кислород пытается сохранить недостающее число, а также найти два электрона, чтобы завершить свой последний круг. Это может произойти в реакции с другими элементами, у которых внешний слой тоже является незавершенным и достаточно отдаленным от ядра, чтобы тот, в свою очередь, не пытался что-либо удержать.
Элементы с проблемой недостатка электронов довольно энергичны в реакциях друг с другом, поскольку у них есть потребность в присоединении или отдаче нужного числа электронов.
Распределение электронов по слоям
Размещение электронов на оболочках происходит в установленном для них порядке. Если же получается, что частица изменяет свое местонахождение или число, то электронный слой просто меняется (а именно его физические и химические свойства).
Одинаковое число протонов и электронов в элементе является доказательством того, что общий заряд (электрический) равняется нулю.
Ионы
Изменение количества двух этих частиц способно привести к тому, что атом преобразуется в электрически заряженный.
Если же у атома возникает проблема с большим объемом электронов, он меняется на отрицательный ион.
Ион — заряженная молекула. Ионы бывают катионами и анионами. Есть во всех веществах.
Катион — положительный ион.
Анион — отрицательный ион.
Хлор (Cl), который вобрал в себя всего лишь один электрон, превращается отрицательным ионом (или же анионом). Такой ион будет считаться однозарядным, так как вместил в себя одну частицу. Писаться он будет уже так: Cl⁻.
Кислороду (О), чтобы стать отрицательным ионом, нужно присоединить два электрона. Он будет считаться двухзарядным. Записываться будет вот так: О⁻.
Когда атом превращается в ион, то для окружающего мира он является системой, которая электрически заряжена, что подразумевает появление определенного электрического поля, объединяющее и сам атом, и все происходящее в его зоне контроля. Это электрическое поле позволяет атому контактировать с другими такими же частицами, имеющими заряженность (ионы, электроны и т.д.).
Как и в остальных случаях, ионы, обладающие разными зарядами, притягиваются химически, что приводит к появлению новых, сложных частиц. Ими считаются молекулы.
Окисление
Степень окисления — заряд элемента, находящегося в соединении, который вычислен путем того, что в соединении ковалентная полярная связь превратилась в ионную.
Окисление — важная часть в образовании новых соединений.
Частицы в реакциях
Когда происходит химическая реакция, электроны либо объединяются, либо переходят к более отрицательному атому, чтобы стать заряженными.
Если бы вещества состояли только из ионов, то их заряды имели целые числа, которые равнялись бы количеству электронов (отданных или не отданных). Рассмотрим хлорид натрия (NaCl). Хлор (Cl) отнимает у натрия (Na) один электрон, при этом два элемента становятся ионами, но с разными зарядами. Натрий (Na) становится положительным, то есть катионом (записывается Na⁺¹), а хлор (Cl) — отрицательным, то есть анионом (записывается Cl⁻¹). Перейдем к соляной кислоте (HCl).
В этой паре хлор (Cl) считается самым отрицательным в электрическом плане, поэтому все два электрона (от водорода (Н) и от него) больше направлены к хлору (Cl), а если электрон водорода (Н) перейдет к хлору, что заряды будут полными, а не частичными как в первом случае. Правильная запись выглядит вот так: H+1CI-1.
Эти надстрочные значки и являются степенью окисления.
Правила записи степени окисления
Чтобы правильно записать степень окисления, нужно знать несколько правил:
- Степень окисления располагается над элементом справа;
- Первым делом записывается знак заряда (плюс или минус), не записывать его нельзя, это считается грубой ошибкой;
- После знака следует само значение;
- Даже если степень окисления равна +1 или -1, то она так и записывается без сокращения ( с сокращением, то есть + или -, пишутся только ионы);
- Заряд ионов записывается над ними справа;
- На первом месте в написании заряда стоит значение, а уже только потом знак.
Пример степени окисления: H+2O-2
Пример заряда иона: AL3+ii.
Вычисление степени окисления
Вычисление степени окисления проводится по некоторым пунктам, которых стоит придерживаться:
1.Есть элементы, у которых степень окисления неизменна, к ним относятся:
- щелочные металлы (степень окисления всегда +1);
- металлы из 2А группы (+2);
- алюминий (FI+3) и бор (B+3);
- фтор (F-1);
- часто кислород (О) имеет степень окисления — 2, но есть исключение у пероксидов, где у кислорода (О) -1;
- водород (Н). С неметаллами его степень равна +1, с металлами — -2.
2. Остальное в периодической таблице с плавающей степенью. Если рассмотреть хлор (Cl), то его значения нечетны: начиная от -1, заканчивая +7 (сюда входит +1, +3, +5). А вот у серы (S) все наоборот — она имеет лишь четные: от -2 до +6 (входит +2, +4).
Главное правило: если сложить все степени из соединения, то должен получиться ноль. Также, если состав какого-либо вещества из одного элемента, то его степень будет нулем.
Бывает такое, что соединение из трех составляющих. Ни в коем случае нельзя делать так, как в соединении двух элементов. Значение первого и последнего элементов известны, а значение третьего нужно считать по специальной формуле.
Пример
Возьмем Н3РО4 (фосфорная кислота).
Из правила водород (Н) будет +1, а кислород (О) — -2, осталось узнать о фосфоре (Р). Мы должны сложить все известные значения.
Здесь будем использовать уравнение.
(+1) × 3 + Х + (-2) × 4 = 0
Х = +5
Мы знаем, что сумма всех элементов должна быть нулем, поэтому приравниваем весь пример ему. Перед водородом (Н) стоит цифра 3, поэтому его степень умножаем на это число, то же самое и с кислородом (О). Фосфор (Р) у нас неизвестен, поэтому обозначаем его иксом. Дальше решаем обычным уравнением и вписываем полученное значение над ним.
Если говорить про степень окисления и валентность, то это абсолютно разные вещи. Первое имеет отрицательное или нулевое значения, а второе только положительное.
Ключевые мометы
Эта тема переплела два ответвления — физику и химию, показывая всю многогранность нашей природы и взаимосвязь этих наук. Как мы поняли, некоторые моменты до сих пор непонятны нам, но ученые не останавливаются на достигнутом, продвигаясь дальше. Данный предмет обсуждения, находящийся в этой работе — базовые понятия, написанные доступным языком.
Этот материал разбирал такие маленькие, но важные для нас моменты — атомы, которых мы не видим, хотя они влияют на все вокруг, даже на нас самих.
Чтобы лучше усвоить материал, здесь собраны ключевые моменты из текста, требующие особого внимания:
- Вещества бывают простыми и сложными;
- Атомы — это неразлагающиеся мелкие частицы;
- Чем выше порядковый номер у элемента, тем больше его атомный вес;
- Изотопы — химические элементы под одним порядковым номером, но с разной массой ядер. Есть у любого элемента;
- У атомов есть частицы (элементарные): протоны, нейтроны, электроны;
- Протоны — положительно заряженные частицы, находящиеся в ядре;
- Нейтроны — беззарядные частицы;
- Электроны — частицы, с самым маленьким отрицательным электрическим зарядом;
- Значение протона равно значению электрона;
- Чем быстрее скорость электрона, тем его масса больше;
- Движение электрона волнообразное, упорядоченное, при этом он вращается;
- Интерференция электронов — слияние нескольких волн электронов;
- Дифракция электронов — волновое обтекание области места, через которое проходит ток;
- Порядковый номер — это заряд ядра;
- У каждой частицы есть электрическое поле, позволяющее взаимодействовать с другими частицами;
- Фотон — переносчик электромагнитного “общения” частиц;
- Ядерное поле — вид материи, который состоит из протонов, нейтронов и мезонов.
- Мезон — частица, позволяющая протонам и нейтронам контактировать, а также удерживает их внутри ядра ядерной силой;
- Ядерная сила — сила влияния протона и нейтрона друг на друга;
- Ядерные силы могут из протонов нейтроны и наоборот при помощи мезонов;
- Ядерные силы мощнее электрических;
- Протон, нейтрон и электрон называются элементарными, потому что их невозможно разложить на более простые частицы, но они могут становиться друг другом и образовываться друг из друга;
- Если электрон отдалится от ядра, то он ненадолго образует энергию, но все равно вернется на свое место, тоже образовывая энергию, переходящую в излучение;
- Дозволенные слои — орбиты, на которые электрон может переходить;
- Дейтон — объединение протона и нейтрона в ядре;
- Легкие элементы считаются лучше, потому что их ядра прочнее из-за одинакового числа частиц;
- Число электронных слоев = номер периода;
- У каждой электронной оболочки есть определенное конечное число электронов, которое оно способно вместить;
- Те элементы, у которых оболочки не полностью заполнены, лучше вступают в контакт с другими элементами;
- Ион — заряженная молекула.
- Катион — положительный ион.
- Анион — отрицательный ион;
- Степень окисления — заряд элемента, который вычислен путем того, что в соединении ковалентная полярная связь превратилась в ионную;
- Есть элементы, чья степень окисления постоянна, а есть те, у кого она изменяется;
- Если сложить все степени окисления в соединении, то всё будет равно нулю.
Короткое, но познавательное видео про элементарные частицы:
Элементарные частицы: нейтроны, протоны, электроны. Действительно элементарные?
Когда речь заходит о том, из чего состоят различные окружающие нас объекты, мы сразу начинаем говорить о молекулах, затем об атомах. А из чего же состоят сами атомы? Так ли просто они устроены, как шарик, который мы видели на уроках химии и физике в школе? На самом деле, все не так уж и просто. Для простоты в самом начале скажем, что абсолютное большинство всех вещей в мире состоит из элементарных частиц. Почему не все? Дело в том, что далеко не вся Вселенная изучена человеком, поэтому мы не можем однозначно сказать, все ли состоит из частиц.
Например, свет — это волна, состоящая из элементарных частиц — фотонов, но раньше наука не могла такое сказать.
Теперь об этих самых частицах. Элементарные частицы — это такие частицы, которые человек сейчас расщепить на более маленькие не может, поэтому пока считается, что из них все и состоит. Таких частиц бывает огромное множество, но сегодня же мы будем больше говорить о наиболее популярных из них, а именно — нейтроны, протоны, электроны.
Где встречаются нейтроны, протоны, электроны?
Почему мы сказали выше, что эти три элементарные частицы считаются наиболее популярными? Все просто — из них состоит абсолютно любой атом. Если говорить об этом чуть более подробно, то атом состоит из двух частей:
- ядро атома
- электроны
В свою же очередь ядро атома включает в себя протоны и нейтроны. Таким образом, атом состоит из трех элементарных частиц, две из которых составляют ядро, а множество третьих вращается вокруг этого ядра.
Классификация элементарных частиц
Чтобы получше разобраться в том, какие бывают элементарные частицы и как они взаимодействуют друг с другом, нам нужно разделить их на группы по принципу схожести определенных свойств. Это и называется классификация. Сейчас все поймете.
Разделим по времени жизни
Делить какие-то там частицы по времени жизни звучит очень странно, ведь это неодушевленные предметы и о жизни здесь речь идти не должна. Вы будете абсолютно правы, имея такую точку зрения. Однако в данном случае имеется в виду не жизнь, как существование живого организма, а скорей пребывание в одном и том же состоянии. Если говорить проще, то не все из элементарных частиц могут сохранять свои свойства в течение большого отрезка времени, поэтому мы и решили их так разделить. Итак, разделить в данном случае можно на две группы:
- стабильные (это те частицы, которые как раз могут очень долго сохранять свойства, некоторые даже говорят бесконечно долго). Сюда относятся электроны, фотоны, протоны и другие частицы)
- нестабильные (а это те, которые через некоторый промежуток времени меняют свои свойства и переходят в другие формы). Сюда относятся все остальные виды частиц.
Разделим по тому, как они взаимодействуют
Интересно, что при довольно схожем строении, разные частицы могут взаимодействовать друг с другом совсем по-разному. Давайте посмотрим, как можно разделить элементарные частицы по такому принципу:
- составные
- бесструктурные
Действительно, частицы тоже бывают составные и фундаментальные (по сути самые простые), и от этого многое зависит. Давайте подробно разберемся с каждым из этих видов.
Составные частицы, которые по-другому еще называются адронами (вы наверняка слышали про Адронный коллайдер в Швейцарии) взаимодействуют со всеми частицами. Такое взаимодействие еще называют фундаментальным. Они в свою очередь тоже подразделяются на мезоны и барионы.
Теперь давайте поговорим о фундаментальных частицах. Здесь все гораздо более интересно, ведь таких частиц в мире открыто великое множество. Давайте для начала узнаем, на какие виды разделяются фундаментальные или же бесструктурные частицы:
- кварки
- лептоны
- калибровочные бозоны
Теперь давайте остановимся на каждом виде отдельно и поговорим о нем более подробно. А начать предлагаем с кварков.
Кварки — это такие частицы, которые находятся в составе адронов. Отдельно их встретить ученым пока не удавалось, только в составе других частиц. Для того, чтобы их изучать, ученым приходится использовать различные хитрые методы. Они подразделяются еще на шесть подтипов, но о них сегодня мы говорить не будем. Интересной особенностью кварков является то, что они, являясь фундаментальными частицами, все же участвуют в сильных взаимодействиях.
Теперь давайте перейдем к лептонам (точечным частицам). Это тоже довольно важный вид бесструктурных частиц. Они в отличие от кварков уже не участвуют в сильных взаимодействиях. Однако именно заряженные лептоны все же могут принимать участие в взаимодействии электромагнитном. Здесь так же, как и в кварках, отмечается целых шесть подтипов.
Ну а теперь последний тип с довольно странным для многих названием — калибровочные бозоны. Это тоже немаловажный тип, ведь именно он служит своего рода посредником в различных взаимодействиях между частицами. Чтобы вам было легче запомнить, приведем несколько примеров таких частиц: фотон, гравитон и глюон.
Ядро протон нейтрон электрон
Отлично, когда мы уже знаем довольно много про то, как устроены остальные элементарные частицы, давайте вернемся обратно к протону, нейтрону и электрону. Теперь самое время поговорить об устройстве ядра атома.
Начнем с того, что в ядре атома собран весь его положительный заряд, который обеспечивается протонами. Несмотря на большой заряд, размеры ядра очень малы по сравнению с электронными орбитами (орбиты, по которым вращается электрон вокруг ядра). В среднем они колеблются от 10 в минус 15 степени до 10 в минус 14 степени. Как мы помним из школьного курса химии количество протонов атома — это номер Z атома и порядковый номер элемента в таблице Менделеева. Примечательно также то, что количество протонов и электронов в атоме всегда одинаково.
Наверняка вам очень интересно, почему ядро атома, которое тоже состоит из элементарных частиц, такое плотное. Дело в том, что связь между протонами и нейтронами не является ни гравитационной, и электромагнитной, но при этом она в несколько раз сильнее, чем связь между ядром и электроном.
Число протонов нейтронов и электронов
Как мы уже поняли выше, в атоме абсолютно всегда количество протонов и электронов равно. Это обусловлено тем, что заряд должен быть нейтрален, а значит и количество положительных должно равняться количеству отрицательных частиц (отметим, что заряд протона +1, а заряд электрона -1). Также напомним, что количество протонов дает нам порядковый номер в таблице Менделеева этого атома. Теперь поговорим о нейтронах. Можно ли каким-то образом определить их количество внутри атома? Конечно можно. Это можно сделать, зная массу атома и количество протонов. Нужно просто вычесть из массы атома количество протонов и мы получим количество нейтронов (иногда нужно округлять). Для примера возьмем Медь (Cu). Ее атомная масса примерно равна 64, а номер в таблице 29, значит количество нейтронов будет равно 64 — 29 = 35. Все очень просто.
3 протона 3 нейтрона 3 электрона
Теперь для того, чтобы получше разобраться в этой теме, давайте попробуем все понять на примере другого атома. Это, как вы могли уже догадаться, атом Лития. У него 3 протона, 3 нейтрона и 3 электрона. По той формуле, которую мы уже узнали выше, тут сразу можно понять, что примерная масса атома Лития будет равна 6 (3 нейтрона + 3 протона). Также мы сходу можем сказать, что номер Лития в таблице Менделеева тоже 3 (количество протонов).
Теперь давайте посмотрим на таблицу Менделеева, представленную выше. Действительно, у Лития именно 3 номер и масса равна 6,941.
Видите, как все легко и просто. Однако особенно внимательный читатель уже давно заметил ошибку. Действительно, округлив массу Лития мы понимаем, что здесь количество нейтронов будет равно 4. Как же так получается, что у нас 3 нейтрона. Это подводит нас к следующей теме, о которой мы сейчас и поговорим.
Протон изотоп нейтрон электрон
Наверное, на одном из школьных уроков вы слышали такой термин, как изотоп. В школе это была та самая тема, после которой я полюбил естественные науки. Сейчас я не могу дать однозначный ответ, почему, просто было очень интересно. Итак, изотопы.
Что такое изотоп
Если говорить просто, то Изотопы представляют собой измененную модель обычного атома какого-то вещества. То есть возьмем любой атом какого-то вещества. У него есть фиксированное количество электронов, протонов и электронов. Однако, как мы уже заметили выше, это количество может быть и другим благодаря существованию изотопов. У изотопов такой же порядковый номер элемента в таблице Менделеева, а значит, как мы уже поняли, у них точно такое же количество протонов. Однако, есть отличия в массе элемента, а значит и в количестве нейтронов. Теперь давайте узнаем, как нам пригодится эта информация и как определить, что перед нами изотоп какого-то элемента.
Как определить, что перед нами изотоп
Наверняка самые догадливые и внимательные из вас уже догадались, что обычная формула с определением количества нейтронов с изотопами не работает от слова совсем, ведь это уже измененная модель обыкновенного элемента. Раз так, то мы можем просто попробовать подставить данные по атому в нашу формулу и понять, работает она или нет. Если нет, то перед нами изотоп. Но естественно, для удобства ученые придумали специальные обозначения для изотопов, чтобы нам, обычным людям, было удобнее с ними работать и изучать их. Как же эти обозначения работаю. А очень просто!
У изотопов после названия еще дописывается количество нуклонов в ядре (то есть количество элементарных частиц внутри ядра, сумма протонов и нейтронов). Давайте разберемся на примере очень популярного изотопа урана-235, радиоактивного урана. Обычный же уран по сути называется уран-238.
Зачем нам это знать?
Как вы уже могли понять, все многообразие элементарных частиц не ограничивается таблицей Менделеева и элементами, которые в ней представлены. У некоторых элементов бывает сразу несколько популярных изотопов, поэтому если вы хотите действительно хорошо разбираться в этой теме, то и запоминание всех популярных изотопов не будет лишним. А эта таблица вам в этом поможет:
Отлично, теперь мы уже неплохо разобрались с массой атома, таблицей Менделеева и разобрали основные типы элементарных частиц. Пришло время поговорить о более серьезных вещах. О чем же?
Радиоактивность
Для многих, кто в школе проходил эту тему лишь вскользь, это понятие выглядит очень страшным и непонятным. Кроме того, у многих на ум приходят различные катастрофы, косвенно связанные с этим понятием. Ну кто из вас сейчас не подумал о Хиросиме или о Чернобыле? Однако мы сейчас будем развеивать все эти мифы и стереотипы и хорошенько разберемся в этой далеко не легкой, но при этом очень интересной теме.
Как это работает?
Для того, чтобы разобраться в чем-либо, нужно сначала понять, с чего все начинается. В данном случае все идет от превращения атомов, а точнее от превращения их ядер. Интересно здесь то, что процесс этот самопроизвольный, то есть для того, чтобы он начался, нужно все-таки воздействовать извне, но как только превращения ядер начались, их уже не остановить! Да, далее произойдет именно то, о чем вы думаете. Ядро, с которого и начнется этот необыкновенно интересный с одной стороны и ужасно опасный с другой процесс называется материнским. Соответственно, если радиоактивный процесс затрагивает какое-то ядро помимо материнского, оно будет считаться дочерним, а 2 ядра, между которыми произошел обмен, называют генетически связанными — все как у людей.
Что такое радиоактивный распад?
Разумеется, радиоактивный распад встречается и в природе, однако происходит он крайне редко и не приносит никакого весомого вреда. А вот искусственный распад — штука очень опасная, если уметь ей управлять. Вся суть в том, что самопроизвольно меняется количество элементарных частиц. Существует несколько типов распадов и зависит этот тип от того, какие частицы будет испускать наш атом. Если это будут 2 протона и 2 нейтрона, то это положительно заряженная частица, называемая альфа-частицей. Соответственно, такой распад будет называться альфа-распадом. А вот с бета-частицами все немного посложнее.
Существует сразу 2 типа таких частиц: электроны и позитроны. Если эта частица электрон, то она обязательно образована нейтроном, распавшимся на протон и электрон. Если же эта бета-частица позитрон, то она всегда образована протоном, который распался на нейтрон и электрон. Распад, при котором из атома вылетает бета-частица — это уже бета-распад. Существует еще и менее популярный тип распада (изомерный переход или гамма-распад), при котором из атома вылетают гамма-кванты. Тут все еще сложнее, ведь такой изомерный переход никогда не бывает один. О чем я говорю? Дело в том, что гамма-распад очень часто сопровождают и другие типы распада. Это происходит в тот момент, когда частица распадается в первый раз. На этом этапе могут произойти другие виды распадов, а уж только потом процесс переходит непосредственно к гамма-распаду.
А в природе где это все можно встретить?
Как мы уже сказали выше, в природе тоже встречается радиоактивность. Если немного подумать, то оказывается, что радиоактивны по сути все вещества, у которых нет стабильных изотопов (кто еще не знает, что это, почитайте о них выше). Так вот, ученые пошли еще дальше и подошли к этому вопросу системно. В итоге они получили, что оказывается по таблице менделеева радиоактивны по своей природе вещества, у которых номер 83 или больше. Однако это если мы говорим о тех веществах, которые однозначно радиоактивны.
А ведь встречаются и немного другие. Например среди элементов с атомной массой поменьше встречаются такие, у изотопов которых очень большой период полураспада. Для примера возьмем теллур-128. У обычного теллура номер в таблице Менделеева 52, а значит он не подходит под первую группу, верно? И это неудивительно, ведь его изотоп теллур-128 так стабилен, что его период полураспада примерно в 2 раза больше, чем( 10 в степени 15 миллиардов лет). Неплохо, верно? Спешим вас успокоить, это элемент с самым большим периодом полураспада, но все-таки это очень много, ведь наша земля в миллиарды раз моложе. А для чего нужны все эти цифры? Это как-то практически применимо? Ну конечно, с помощью этих данных можно определять возраст многих минералов, горных пород и даже возраст планет в космосе! А ведь вы еще не знаете, что же такое период полураспада. Давайте разберемся с этим важнейшим понятием.
А что такое период полураспада?
Говоря о том, где можно встретить радиоактивность в природе, мы затронули такой термин, о котором еще не говорили. Что-ж, это неплохой повод, что это сделать сейчас. Так вот, период полураспада — это такое время, за которое частица распадается.
Но почему же именно ПОЛУраспад? Ну да, здесь все не так просто. Если говорить точнее, то это время, за которое она (частица) распадается с вероятностью 50 процентов. Теперь более понятно, верно?
Как вы уже могли догадаться у одной и той же частицы периоды полураспада могут отличаться в зависимости от изотопов. Однако для изотопа частицы это число постоянно.
Заключение
Как вы уже поняли, об элементарных частицах можно говорить очень много и говорить о них можно бесконечно много. Однако на этом наше небольшое вводное повествование о них предлагаем закончить. Если вам понравилась эта статья и вы хотите, чтобы мы публиковали больше материала на эту тему, то не забудьте проявить немного активности ниже. Напомним также, что на нашем сайте есть множество статей на смежные тематики, поэтому предлагаем вам с ними ознакомиться. До скорых встреч!
НЕЙТРО́Н (от лат. neuter – ни тот ни другой; символ n), элементарная частица с нулевым электрич. зарядом и массой, незначительно большей массы протона. Н. является фермионом и входит в группу барионов. Наряду с протоном Н. относится к нуклонам и входит в состав атомных ядер. Открыт в 1932 Дж. Чедвиком. Т. к. Н. электрически нейтрален, он легко проникает в атомные ядра при любой энергии и с большой вероятностью вызывает ядерные реакции. Способность Н. вызывать деление тяжёлых ядер в цепной ядерной реакции послужила основой для создания ядерного оружия и ядерной энергетики. Масса Н. $$m_n=939,565379(21): МэВ=1,00866491600(43): а. е. м.=1,674927351(74)·10^{–24}: г.$$
Н. тяжелее протона на $1,293332: МэВ$. Спин Н. равен 1/2. В свободном состоянии Н. нестабилен – распадается на протон, электрон и антинейтрино (см. Бета-распад нейтрона); время жизни составляет $885,7(8)$ с. В связанном состоянии в составе стабильных ядер Н. стабилен. Несмотря на электронейтральность Н., его магнитный момент существенно отличен от нуля: $μ_n=–1,91304272(45)μ_{яд}$, где $μ_{яд}$ – ядерный магнетон, знак магнитного момента определяется относительно направления его спина. Отношение к магнитному моменту протона равно примерно –2/3, что согласуется с кварковой структурой нуклонов.
Статич. электрич. дипольный момент точечной частицы должен быть тождественно равен нулю. Стандартная модель элементарных частиц предполагает малое разделение положительного и отрицательного заряда внутри Н. и предсказывает существование электрич. дипольного момента, но его расчётная величина мала и остаётся за пределами эксперим. обнаружения.
Согласно совр. кварковой модели, Н. состоит из трёх кварков: одного $u$-кварка с электрич. зарядом +2/3$e$ и двух $d$-кварков с зарядами –1/3$e$, связанных между собой глюонами. Квантовые числа Н. целиком определяются набором составляющих его кварков, а пространственная структура – динамикой взаимодействия кварков и глюонов. Особенностью этого взаимодействия является его рост с увеличением расстояния, так что размер Н. ограничен областью порядка 10–13 см – областью конфайнмента кварков. Античастица Н. – антинейтрон $(ñ)$ – открыт в 1956; в пределах точности измерений массы обеих частиц равны.
Свободные Н. в природе образуются в ядерных реакциях, вызываемых $α$-частицами радиоактивного распада, космич. лучами, и в результате спонтанного или вынужденного деления тяжёлых ядер. Искусств. источники Н. – ядерные реакторы, ядерные взрывы, ускорители протонов и электронов с мишенями из тяжёлых элементов (см. Нейтронные источники).
Поскольку Н. не имеет электрич. заряда, детектирование его посредством ионизации атомов вещества невозможно. Для регистрации Н. обычно используются два косвенных метода: захват Н. атомными ядрами с последующим излучением ядром $α$-частицы или $γ$-кванта и рассеяние Н. на ядрах вещества с последующей регистрацией ядра отдачи (см. Нейтронные детекторы).
Методы использования Н. в науч. и прикладных исследованиях зависят от их кинетич. энергии. Н. с кинетич. энергией св. 100 кэВ называют быстрыми, с энергией до 100 кэВ – медленными. Быстрые Н. образуются в ядерных реакциях при бомбардировке разл. ядер заряженными частицами или $γ$-квантами высокой энергии, а также при делении ядер. Медленные нейтроны подразделяют на промежуточные (с энергиями 104–105 эВ), резонансные (0,5–104 эВ), тепловые нейтроны (5·10–3–0,5 эВ), холодные нейтроны (10–7–5·10–3 эВ) и ультрахолодные нейтроны (<10–7 эВ). Тепловые Н. с большой вероятностью захватываются веществом с образованием, как правило, нестабильных, более тяжёлых изотопов атомных ядер. Холодные Н. образуются из тепловых при прохождении через холодные вещества, напр. через жидкий дейтерий. Ультрахолодные нейтроны формируются при упругом рассеянии на твёрдом дейтерии или на жидком сверхтекучем гелии.
Для медленных Н. определяющим фактором становятся их волновые свойства. Н. с длиной волны, близкой к межатомным расстояниям (ок. 0,1 нм), являются важнейшим средством исследования структуры твёрдых тел (см. Нейтронография структурная). Медленные нейтроны, подобно фотонам, рассеиваясь на атомах твёрдого вещества, интерферируют (см. Нейтронная интерферометрия). Структура наблюдаемой дифракции нейтронов связана со строением исследуемой среды. Наличие у Н. магнитного момента делает пучки поляризованных нейтронов чрезвычайно чувствительным инструментом для исследования распределения намагниченности в веществе.
Особенностью взаимодействия Н. с веществом является показатель преломления, меньший единицы. Благодаря этому Н., падающие из вакуума на границу вещества, могут испытывать полное внутр. отражение. Ультрахолодные Н. при скорости менее 5–8 м/с испытывают полное внутр. отражение от границы с углеродом, никелем, бериллием и др. при любом угле падения и могут удерживаться в замкнутых объёмах. Это свойство ультрaхолодных Н. используется в экспериментах и позволяет реализовать нейтронно-оптич. устройства, аналоги оптич. линз и призм (см. Нейтронная оптика).
Способность Н. при облучении вещества вызывать последующее излучение $γ$-квантов используется для активационного анализа. Спектр испущенных $γ$-квантов сопоставляется с таблицей линий излучения известных химич. элементов и позволяет с высокой точностью определить химич. состав вещества.
Н. – одна из немногих элементарных частиц, падение которой в гравитац. поле Земли можно наблюдать экспериментально. Прямое измерение ускорения свободного падения для Н. выполнено с погрешностью 0,3% и не отличается от ускорения свободного падения для макроскопич. тел. Гравитац. ускорение и замедление Н. широко используются в опытах с ультрахолодными нейтронами.
Согласно совр. представлениям, в модели горячей Вселенной (см. Горячей Вселенной теория) образование барионов, в т. ч. протонов и H., происходит в первые минуты жизни Вселенной. В дальнейшем некоторая часть Н., не успевших распасться, захватывается протонами с образованием ядер $ce{^4He}$. По астрономич. оценкам, 15% видимого вещества Вселенной представлено Н., входящими в состав ядер $ce{^4He}$.