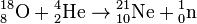This article is about the chemical element. For other uses, see Neon (disambiguation).
 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Neon | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Appearance | colorless gas exhibiting an orange-red glow when placed in an electric field | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Standard atomic weight Ar°(Ne) |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Neon in the periodic table | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic number (Z) | 10 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Group | group 18 (noble gases) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Period | period 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Block | p-block | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electron configuration | [He] 2s2 2p6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrons per shell | 2, 8 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physical properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase at STP | gas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Melting point | 24.56 K (−248.59 °C, −415.46 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Boiling point | 27.104 K (−246.046 °C, −410.883 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Density (at STP) | 0.9002 g/L | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| when liquid (at b.p.) | 1.207 g/cm3[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Triple point | 24.556 K, 43.37 kPa[3][4] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Critical point | 44.4918 K, 2.7686 MPa[4] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of fusion | 0.335 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of vaporization | 1.71 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar heat capacity | 20.79[5] J/(mol·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Vapor pressure
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidation states | 0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ionization energies |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Covalent radius | 58 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waals radius | 154 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Spectral lines of neon |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Other properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Natural occurrence | primordial | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | face-centered cubic (fcc)
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Speed of sound | 435 m/s (gas, at 0 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermal conductivity | 49.1×10−3 W/(m⋅K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetic ordering | diamagnetic[6] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar magnetic susceptibility | −6.74×10−6 cm3/mol (298 K)[7] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bulk modulus | 654 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS Number | 7440-01-9 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| History | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Prediction | William Ramsay (1897) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Discovery and first isolation | William Ramsay & Morris Travers[8][9] (1898) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Main isotopes of neon
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| references |
Neon is a chemical element with the symbol Ne and atomic number 10. It is a noble gas.[10] Neon is a colorless, odorless, inert monatomic gas under standard conditions, with about two-thirds the density of air. It was discovered (along with krypton and xenon) in 1898 as one of the three residual rare inert elements remaining in dry air, after nitrogen, oxygen, argon and carbon dioxide were removed. Neon was the second of these three rare gases to be discovered and was immediately recognized as a new element from its bright red emission spectrum. The name neon is derived from the Greek word, νέον, neuter singular form of νέος (neos), meaning ‘new’. Neon is chemically inert, and no uncharged neon compounds are known. The compounds of neon currently known include ionic molecules, molecules held together by van der Waals forces and clathrates.
During cosmic nucleogenesis of the elements, large amounts of neon are built up from the alpha-capture fusion process in stars. Although neon is a very common element in the universe and solar system (it is fifth in cosmic abundance after hydrogen, helium, oxygen and carbon), it is rare on Earth. It composes about 18.2 ppm of air by volume (this is about the same as the molecular or mole fraction) and a smaller fraction in Earth’s crust. The reason for neon’s relative scarcity on Earth and the inner (terrestrial) planets is that neon is highly volatile and forms no compounds to fix it to solids. As a result, it escaped from the planetesimals under the warmth of the newly ignited Sun in the early Solar System. Even the outer atmosphere of Jupiter is somewhat depleted of neon, although for a different reason.[11]
Neon gives a distinct reddish-orange glow when used in low-voltage neon glow lamps, high-voltage discharge tubes and neon advertising signs.[12][13] The red emission line from neon also causes the well known red light of helium–neon lasers. Neon is used in some plasma tube and refrigerant applications but has few other commercial uses. It is commercially extracted by the fractional distillation of liquid air. Since air is the only source, it is considerably more expensive than helium.
History[edit]
Neon was discovered in 1898 by the British chemists Sir William Ramsay (1852–1916) and Morris Travers (1872–1961) in London.[14] Neon was discovered when Ramsay chilled a sample of air until it became a liquid, then warmed the liquid and captured the gases as they boiled off. The gases nitrogen, oxygen, and argon had been identified, but the remaining gases were isolated in roughly their order of abundance, in a six-week period beginning at the end of May 1898. First to be identified was krypton. The next, after krypton had been removed, was a gas which gave a brilliant red light under spectroscopic discharge. This gas, identified in June, was named «neon», the Greek analogue of the Latin novum (‘new’)[15] suggested by Ramsay’s son. The characteristic brilliant red-orange color emitted by gaseous neon when excited electrically was noted immediately. Travers later wrote: «the blaze of crimson light from the tube told its own story and was a sight to dwell upon and never forget.»[16]
A second gas was also reported along with neon, having approximately the same density as argon but with a different spectrum – Ramsay and Travers named it metargon.[17][18] However, subsequent spectroscopic analysis revealed it to be argon contaminated with carbon monoxide. Finally, the same team discovered xenon by the same process, in September 1898.[17]
Neon’s scarcity precluded its prompt application for lighting along the lines of Moore tubes, which used nitrogen and which were commercialized in the early 1900s. After 1902, Georges Claude’s company Air Liquide produced industrial quantities of neon as a byproduct of his air-liquefaction business. In December 1910 Claude demonstrated modern neon lighting based on a sealed tube of neon. Claude tried briefly to sell neon tubes for indoor domestic lighting, due to their intensity, but the market failed because homeowners objected to the color. In 1912, Claude’s associate began selling neon discharge tubes as eye-catching advertising signs and was instantly more successful. Neon tubes were introduced to the U.S. in 1923 with two large neon signs bought by a Los Angeles Packard car dealership. The glow and arresting red color made neon advertising completely different from the competition.[19] The intense color and vibrancy of neon equated with American society at the time, suggesting a «century of progress» and transforming cities into sensational new environments filled with radiating advertisements and «electro-graphic architecture».[20][21]
Neon played a role in the basic understanding of the nature of atoms in 1913, when J. J. Thomson, as part of his exploration into the composition of canal rays, channeled streams of neon ions through a magnetic and an electric field and measured the deflection of the streams with a photographic plate. Thomson observed two separate patches of light on the photographic plate (see image), which suggested two different parabolas of deflection. Thomson eventually concluded that some of the atoms in the neon gas were of higher mass than the rest. Though not understood at the time by Thomson, this was the first discovery of isotopes of stable atoms. Thomson’s device was a crude version of the instrument we now term a mass spectrometer.
Isotopes[edit]
The first evidence for isotopes of a stable element was provided in 1913 by experiments on neon plasma. In the bottom right corner of J. J. Thomson’s photographic plate are the separate impact marks for the two isotopes neon-20 and neon-22.
Neon has three stable isotopes: 20Ne (90.48%), 21Ne (0.27%) and 22Ne (9.25%).
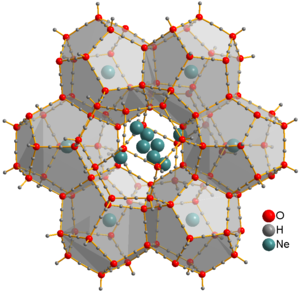
21Ne and 22Ne are partly primordial and partly nucleogenic (i.e. made by nuclear reactions of other nuclides with neutrons or other particles in the environment) and their variations in natural abundance are well understood. In contrast, 20Ne (the chief primordial isotope made in stellar nucleosynthesis) is not known to be nucleogenic or radiogenic, except from the decay of oxygen-20, which is produced in very rare cases of cluster decay by thorium-228. The causes of the variation of 20Ne in the Earth have thus been hotly debated.[22][23]
The principal nuclear reactions generating nucleogenic neon isotopes start from 24Mg and 25Mg, which produce 21Ne and 22Ne respectively, after neutron capture and immediate emission of an alpha particle. The neutrons that produce the reactions are mostly produced by secondary spallation reactions from alpha particles, in turn derived from uranium-series decay chains. The net result yields a trend towards lower 20Ne/22Ne and higher 21Ne/22Ne ratios observed in uranium-rich rocks such as granites.[23]
In addition, isotopic analysis of exposed terrestrial rocks has demonstrated the cosmogenic (cosmic ray) production of 21Ne. This isotope is generated by spallation reactions on magnesium, sodium, silicon, and aluminium. By analyzing all three isotopes, the cosmogenic component can be resolved from magmatic neon and nucleogenic neon. This suggests that neon will be a useful tool in determining cosmic exposure ages of surface rocks and meteorites.[24]
Neon in solar wind contains a higher proportion of 20Ne than nucleogenic and cosmogenic sources.[23] Neon content observed in samples of volcanic gases and diamonds is also enriched in 20Ne, suggesting a primordial, possibly solar origin.[25]
Characteristics[edit]
Neon is the second-lightest noble gas, after helium. It glows reddish-orange in a vacuum discharge tube. It has over 40 times the refrigerating capacity (per unit volume) of liquid helium and three times that of liquid hydrogen.[2] In most applications it is a less expensive refrigerant than helium.[26][27]
Spectrum of neon with ultraviolet (at left) and infrared (at right) lines shown in white
Neon plasma has the most intense light discharge at normal voltages and currents of all the noble gases. The average color of this light to the human eye is red-orange due to many lines in this range; it also contains a strong green line, which is hidden, unless the visual components are dispersed by a spectroscope.[28]
Two quite different kinds of neon lighting are in common use. Neon glow lamps are generally tiny, with most operating between 100 and 250 volts.[29] They have been widely used as power-on indicators and in circuit-testing equipment, but light-emitting diodes (LEDs) now dominate in those applications. These simple neon devices were the forerunners of plasma displays and plasma television screens.[30][31] Neon signs typically operate at much higher voltages (2–15 kilovolts), and the luminous tubes are commonly meters long.[32] The glass tubing is often formed into shapes and letters for signage, as well as architectural and artistic applications.
Occurrence[edit]
Stable isotopes of neon are produced in stars. Neon’s most abundant isotope 20Ne (90.48%) is created by the nuclear fusion of carbon and carbon in the carbon-burning process of stellar nucleosynthesis. This requires temperatures above 500 megakelvins, which occur in the cores of stars of more than 8 solar masses.[33][34]
Neon is abundant on a universal scale; it is the fifth most abundant chemical element in the universe by mass, after hydrogen, helium, oxygen, and carbon (see chemical element).[35] Its relative rarity on Earth, like that of helium, is due to its relative lightness, high vapor pressure at very low temperatures, and chemical inertness, all properties which tend to keep it from being trapped in the condensing gas and dust clouds that formed the smaller and warmer solid planets like Earth.
Neon is monatomic, making it lighter than the molecules of diatomic nitrogen and oxygen which form the bulk of Earth’s atmosphere; a balloon filled with neon will rise in air, albeit more slowly than a helium balloon.[36]
Neon’s abundance in the universe is about 1 part in 750; in the Sun and presumably in the proto-solar system nebula, about 1 part in 600. The Galileo spacecraft atmospheric entry probe found that even in the upper atmosphere of Jupiter, the abundance of neon is reduced (depleted) by about a factor of 10, to a level of 1 part in 6,000 by mass. This may indicate that even the ice-planetesimals, which brought neon into Jupiter from the outer solar system, formed in a region which was too warm to retain the neon atmospheric component (abundances of heavier inert gases on Jupiter are several times that found in the Sun).[37]
Neon comprises 1 part in 55,000 in the Earth’s atmosphere, or 18.2 ppm by volume (this is about the same as the molecule or mole fraction), or 1 part in 79,000 of air by mass. It comprises a smaller fraction in the crust. It is industrially produced by cryogenic fractional distillation of liquefied air.[2]
On 17 August 2015, based on studies with the Lunar Atmosphere and Dust Environment Explorer (LADEE) spacecraft, NASA scientists reported the detection of neon in the exosphere of the moon.[38]
Chemistry[edit]
Neon is the first p-block noble gas, and the first element with a true octet of electrons. It is inert: as is the case with its lighter analogue, helium, no strongly bound neutral molecules containing neon have been identified. The ions [NeAr]+, [NeH]+, and [HeNe]+ have been observed from optical and mass spectrometric studies.[2] Solid neon clathrate hydrate was produced from water ice and neon gas at pressures 350–480 MPa and temperatures about −30 °C.[40] Ne atoms are not bonded to water and can freely move through this material. They can be extracted by placing the clathrate into a vacuum chamber for several days, yielding ice XVI, the least dense crystalline form of water.[39]
The familiar Pauling electronegativity scale relies upon chemical bond energies, but such values have obviously not been measured for inert helium and neon. The Allen electronegativity scale, which relies only upon (measurable) atomic energies, identifies neon as the most electronegative element, closely followed by fluorine and helium.
The triple point temperature of neon (24.5561 K) is a defining fixed point in the International Temperature Scale of 1990.[41]
Production[edit]
Neon is produced from air in cryogenic air-separation plants. A gas-phase mixture mainly of nitrogen, neon, and helium is withdrawn from the main condenser at the top of the high-pressure air-separation column and fed to the bottom of a side column for rectification of the neon.[42] It can then be further purified from helium.
About 70% of global neon supply is produced in Ukraine[43] as a by-product of steel production in Russia.[44] As of 2020, the company Iceblick, with plants in Odessa and Moscow, supplies 65 per cent of the world’s production of neon, as well as 15% of the krypton and xenon.[45][46]
2022 shortage[edit]
Global neon prices jumped by about 600% after the 2014 Russian annexation of Crimea,[47] spurring some chip manufacturers to start shifting away from Russian and Ukrainian suppliers[48] and toward suppliers in China.[46] The 2022 Russian invasion of Ukraine also shut down two companies in Ukraine: LLC «Cryoin engineering» (Ukrainian: ТОВ «Кріоін Інжинірінг») and LLC «Inhaz» (Ukrainian: ТОВ «ІНГАЗ») located in Odessa and Mariupol respectively; that produced about half of the global supply.[47][49] The closure was predicted to likely exacerbate COVID-19 chip shortage,[46][45] which may further shift neon production to China.[48]
Applications[edit]
Neon is often used in signs and produces an unmistakable bright reddish-orange light. Although tube lights with other colors are often called «neon», they use different noble gases or varied colors of fluorescent lighting.
Neon is used in vacuum tubes, high-voltage indicators, lightning arresters, wavemeter tubes, television tubes, and helium–neon lasers. Liquefied neon is commercially used as a cryogenic refrigerant in applications not requiring the lower temperature range attainable with more extreme liquid-helium refrigeration.
Neon, as liquid or gas, is relatively expensive – for small quantities, the price of liquid neon can be more than 55 times that of liquid helium. Driving neon’s expense is the rarity of neon, which, unlike helium, can only be obtained in usable quantities by filtering it out of the atmosphere.
Semiconductor industry[edit]
As of 2022 gas mixtures that include neon are used to power lasers for EUV lithography.[47]
See also[edit]
- Expansion ratio
- Neon sign
- Neon lamp
References[edit]
- ^ «Standard Atomic Weights: Neon». CIAAW. 1985.
- ^ a b c d Hammond, C. R. (2000). The Elements, in Handbook of Chemistry and Physics 81st edition (PDF). CRC press. p. 19. ISBN 0849304814.
- ^ Preston-Thomas, H. (1990). «The International Temperature Scale of 1990 (ITS-90)». Metrologia. 27 (1): 3–10. Bibcode:1990Metro..27….3P. doi:10.1088/0026-1394/27/1/002.
- ^ a b Haynes, William M., ed. (2011). CRC Handbook of Chemistry and Physics (92nd ed.). Boca Raton, FL: CRC Press. p. 4.122. ISBN 1-4398-5511-0.
- ^ Shuen-Chen Hwang, Robert D. Lein, Daniel A. Morgan (2005). «Noble Gases». in Kirk Othmer Encyclopedia of Chemical Technology, pages 343–383. Wiley. doi:10.1002/0471238961.0701190508230114.a01.pub2
- ^ Magnetic susceptibility of the elements and inorganic compounds, in Lide, D. R., ed. (2005). CRC Handbook of Chemistry and Physics (86th ed.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ^ Weast, Robert (1984). CRC, Handbook of Chemistry and Physics. Boca Raton, Florida: Chemical Rubber Company Publishing. pp. E110. ISBN 0-8493-0464-4.
- ^ Ramsay, William; Travers, Morris W. (1898). «On the Companions of Argon». Proceedings of the Royal Society of London. 63 (1): 437–440. doi:10.1098/rspl.1898.0057.
- ^ «Neon: History». Softciências. Retrieved 2007-02-27.
- ^ Group 18 refers to the modern numbering of the periodic table. Older numberings described the rare gases as Group 0 or Group VIIIA (sometimes shortened to 8). See also Group (periodic table).
- ^ Wilson, Hugh F.; Militzer, Burkhard (March 2010), «Sequestration of Noble Gases in Giant Planet Interiors», Physical Review Letters, 104 (12): 121101, arXiv:1003.5940, Bibcode:2010PhRvL.104l1101W, doi:10.1103/PhysRevLett.104.121101, PMID 20366523, S2CID 9850759, 121101.
- ^ Coyle, Harold P. (2001). Project STAR: The Universe in Your Hands. Kendall Hunt. p. 464. ISBN 978-0-7872-6763-6.
- ^ Kohmoto, Kohtaro (1999). «Phosphors for lamps». In Shionoya, Shigeo; Yen, William M. (eds.). Phosphor Handbook. CRC Press. p. 940. ISBN 978-0-8493-7560-6.
- ^ Ramsay, William, Travers, Morris W. (1898). «On the Companions of Argon». Proceedings of the Royal Society of London. 63 (1): 437–440. doi:10.1098/rspl.1898.0057. S2CID 98818445.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ «Neon: History». Softciências. Archived from the original on 2007-03-14. Retrieved 2007-02-27.
- ^ Weeks, Mary Elvira (2003). Discovery of the Elements: Third Edition (reprint). Kessinger Publishing. p. 287. ISBN 978-0-7661-3872-8. Archived from the original on 2015-03-22.
- ^ a b
Ramsay, Sir William (December 12, 1904). «Nobel Lecture – The Rare Gases of the Atmosphere». nobelprize.org. Nobel Media AB. Archived from the original on 13 November 2015. Retrieved 15 November 2015. - ^ Ramsay, William; Travers, Morris W. (1898). «On the Companions of Argon». Proceedings of the Royal Society of London. 63 (1): 437–440. doi:10.1098/rspl.1898.0057. ISSN 0370-1662. S2CID 98818445.
- ^ Mangum, Aja (December 8, 2007). «Neon: A Brief History». New York Magazine. Archived from the original on April 15, 2008. Retrieved 2008-05-20.
- ^ Golec, Michael J. (2010). «Logo/Local Intensities: Lacan, the Discourse of the Other, and the Solicitation to «Enjoy»«. Design and Culture. 2 (2): 167–181. doi:10.2752/175470710X12696138525622. S2CID 144257608.
- ^ Wolfe, Tom (October 1968). «Electro-Graphic Architecture». Architecture Canada.
- ^ Dickin, Alan P (2005). «Neon». Radiogenic isotope geology. p. 303. ISBN 978-0-521-82316-6.
- ^ a b c Resources on Isotopes Periodic Table—Neon at the U.S. Geological Survey, by Eric Caldwell, posted January 2004, retrieved February 10, 2011
- ^ «Neon: Isotopes». Softciências. Archived from the original on 2012-11-15. Retrieved 2007-02-27.
- ^ Anderson, Don L. «Helium, Neon & Argon». Mantleplumes.org. Archived from the original on 2006-05-28. Retrieved 2006-07-02.
- ^ «NASSMC: News Bulletin». December 30, 2005. Archived from the original on February 13, 2007. Retrieved 2007-03-05.
- ^ Mukhopadhyay, Mamata (2012). Fundamentals of Cryogenic Engineering. p. 195. ISBN 9788120330573. Archived from the original on 2017-11-16.
- ^ «Plasma». Archived from the original on 2007-03-07. Retrieved 2007-03-05.
- ^ Baumann, Edward (1966). Applications of Neon Lamps and Gas Discharge Tubes. Carlton Press.
- ^ Myers, Robert L. (2002). Display interfaces: fundamentals and standards. John Wiley and Sons. pp. 69–71. ISBN 978-0-471-49946-6. Archived from the original on 2016-06-29.
Plasma displays are closely related to the simple neon lamp.
- ^ Weber, Larry F. (April 2006). «History of the plasma display panel». IEEE Transactions on Plasma Science. 34 (2): 268–278. Bibcode:2006ITPS…34..268W. doi:10.1109/TPS.2006.872440. S2CID 20290119. Paid access.
- ^ «ANSI Luminous Tube Footage Chart» (PDF). American National Standards Institute (ANSI). Archived (PDF) from the original on 2011-02-06. Retrieved 2010-12-10. Reproduction of a chart in the catalog of a lighting company in Toronto; the original ANSI specification is not given.
- ^ Clayton, Donald (2003). Handbook of Isotopes in the Cosmos: Hydrogen to Gallium. Cambridge University Press. pp. 106–107. ISBN 978-0521823814.
- ^ Ryan, Sean G.; Norton, Andrew J. (2010). Stellar Evolution and Nucleosynthesis. Cambridge University Press. p. 135. ISBN 978-0-521-13320-3.
- ^ Asplund, Martin; Grevesse, Nicolas; Sauval, A. Jacques; Scott, Pat (2009). «The Chemical Composition of the Sun». Annual Review of Astronomy and Astrophysics. 47 (1): 481–522. arXiv:0909.0948. Bibcode:2009ARA&A..47..481A. doi:10.1146/annurev.astro.46.060407.145222. S2CID 17921922.
- ^ Gallagher, R.; Ingram, P. (2001-07-19). Chemistry for Higher Tier. University Press. p. 282. ISBN 978-0-19-914817-2.
- ^ Morse, David (January 26, 1996). «Galileo Probe Science Result». Galileo Project. Archived from the original on February 24, 2007. Retrieved 2007-02-27.
- ^ Steigerwald, William (17 August 2015). «NASA’s LADEE Spacecraft Finds Neon in Lunar Atmosphere». NASA. Archived from the original on 19 August 2015. Retrieved 18 August 2015.
- ^ a b Falenty, Andrzej; Hansen, Thomas C.; Kuhs, Werner F. (2014). «Formation and properties of ice XVI obtained by emptying a type sII clathrate hydrate». Nature. 516 (7530): 231–3. Bibcode:2014Natur.516..231F. doi:10.1038/nature14014. PMID 25503235. S2CID 4464711.
- ^ Yu, X.; Zhu, J.; Du, S.; Xu, H.; Vogel, S. C.; Han, J.; Germann, T. C.; Zhang, J.; Jin, C.; Francisco, J. S.; Zhao, Y. (2014). «Crystal structure and encapsulation dynamics of ice II-structured neon hydrate». Proceedings of the National Academy of Sciences of the United States of America. 111 (29): 10456–61. Bibcode:2014PNAS..11110456Y. doi:10.1073/pnas.1410690111. PMC 4115495. PMID 25002464.
- ^ «The Internet resource for the International Temperature Scale of 1990». Archived from the original on 2009-08-15. Retrieved 2009-07-07.
- ^ R. Norris Shreve; Joseph Brink (1977). Chemical Process Industries (4th ed.). p. 113. ISBN 0-07-057145-7.
- ^ «Explained: Why the Russia-Ukraine crisis may lead to a shortage in semiconductors». MSN. The Indian Express.
- ^ Alper, Alexandra (2022-03-11). «Exclusive: Russia’s attack on Ukraine halts half of world’s neon output for chips». Reuters. Retrieved 2022-03-16.
- ^ a b «Rare Gasses Supplier Known for Innovation». The European Times. 2020.
- ^ a b c Ukraine war flashes neon warning lights for chips, Reuters, 2022-02-25
- ^ a b c Times, Financial (4 March 2022). «Low on gas: Ukraine invasion chokes supply of neon needed for chipmaking». Ars Technica. Retrieved 13 March 2022.
- ^ a b «Chipmakers see limited impact for now, as Russia invades Ukraine». CNBC. 24 February 2022.
- ^ «Россия и Украина обрушили мировое производство микросхем». CNews.ru (in Russian). March 11, 2022. Retrieved 2022-04-17.
External links[edit]
- Neon at The Periodic Table of Videos (University of Nottingham)
- WebElements.com – Neon.
- It’s Elemental – Neon
- USGS Periodic Table – Neon
- Atomic Spectrum of Neon
- Neon Museum, Las Vegas
This article is about the chemical element. For other uses, see Neon (disambiguation).
 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Neon | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Appearance | colorless gas exhibiting an orange-red glow when placed in an electric field | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Standard atomic weight Ar°(Ne) |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Neon in the periodic table | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic number (Z) | 10 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Group | group 18 (noble gases) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Period | period 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Block | p-block | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electron configuration | [He] 2s2 2p6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrons per shell | 2, 8 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physical properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase at STP | gas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Melting point | 24.56 K (−248.59 °C, −415.46 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Boiling point | 27.104 K (−246.046 °C, −410.883 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Density (at STP) | 0.9002 g/L | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| when liquid (at b.p.) | 1.207 g/cm3[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Triple point | 24.556 K, 43.37 kPa[3][4] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Critical point | 44.4918 K, 2.7686 MPa[4] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of fusion | 0.335 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of vaporization | 1.71 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar heat capacity | 20.79[5] J/(mol·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Vapor pressure
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidation states | 0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ionization energies |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Covalent radius | 58 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waals radius | 154 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Spectral lines of neon |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Other properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Natural occurrence | primordial | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | face-centered cubic (fcc)
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Speed of sound | 435 m/s (gas, at 0 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermal conductivity | 49.1×10−3 W/(m⋅K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetic ordering | diamagnetic[6] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar magnetic susceptibility | −6.74×10−6 cm3/mol (298 K)[7] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bulk modulus | 654 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS Number | 7440-01-9 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| History | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Prediction | William Ramsay (1897) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Discovery and first isolation | William Ramsay & Morris Travers[8][9] (1898) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Main isotopes of neon
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| references |
Neon is a chemical element with the symbol Ne and atomic number 10. It is a noble gas.[10] Neon is a colorless, odorless, inert monatomic gas under standard conditions, with about two-thirds the density of air. It was discovered (along with krypton and xenon) in 1898 as one of the three residual rare inert elements remaining in dry air, after nitrogen, oxygen, argon and carbon dioxide were removed. Neon was the second of these three rare gases to be discovered and was immediately recognized as a new element from its bright red emission spectrum. The name neon is derived from the Greek word, νέον, neuter singular form of νέος (neos), meaning ‘new’. Neon is chemically inert, and no uncharged neon compounds are known. The compounds of neon currently known include ionic molecules, molecules held together by van der Waals forces and clathrates.
During cosmic nucleogenesis of the elements, large amounts of neon are built up from the alpha-capture fusion process in stars. Although neon is a very common element in the universe and solar system (it is fifth in cosmic abundance after hydrogen, helium, oxygen and carbon), it is rare on Earth. It composes about 18.2 ppm of air by volume (this is about the same as the molecular or mole fraction) and a smaller fraction in Earth’s crust. The reason for neon’s relative scarcity on Earth and the inner (terrestrial) planets is that neon is highly volatile and forms no compounds to fix it to solids. As a result, it escaped from the planetesimals under the warmth of the newly ignited Sun in the early Solar System. Even the outer atmosphere of Jupiter is somewhat depleted of neon, although for a different reason.[11]
Neon gives a distinct reddish-orange glow when used in low-voltage neon glow lamps, high-voltage discharge tubes and neon advertising signs.[12][13] The red emission line from neon also causes the well known red light of helium–neon lasers. Neon is used in some plasma tube and refrigerant applications but has few other commercial uses. It is commercially extracted by the fractional distillation of liquid air. Since air is the only source, it is considerably more expensive than helium.
History[edit]
Neon was discovered in 1898 by the British chemists Sir William Ramsay (1852–1916) and Morris Travers (1872–1961) in London.[14] Neon was discovered when Ramsay chilled a sample of air until it became a liquid, then warmed the liquid and captured the gases as they boiled off. The gases nitrogen, oxygen, and argon had been identified, but the remaining gases were isolated in roughly their order of abundance, in a six-week period beginning at the end of May 1898. First to be identified was krypton. The next, after krypton had been removed, was a gas which gave a brilliant red light under spectroscopic discharge. This gas, identified in June, was named «neon», the Greek analogue of the Latin novum (‘new’)[15] suggested by Ramsay’s son. The characteristic brilliant red-orange color emitted by gaseous neon when excited electrically was noted immediately. Travers later wrote: «the blaze of crimson light from the tube told its own story and was a sight to dwell upon and never forget.»[16]
A second gas was also reported along with neon, having approximately the same density as argon but with a different spectrum – Ramsay and Travers named it metargon.[17][18] However, subsequent spectroscopic analysis revealed it to be argon contaminated with carbon monoxide. Finally, the same team discovered xenon by the same process, in September 1898.[17]
Neon’s scarcity precluded its prompt application for lighting along the lines of Moore tubes, which used nitrogen and which were commercialized in the early 1900s. After 1902, Georges Claude’s company Air Liquide produced industrial quantities of neon as a byproduct of his air-liquefaction business. In December 1910 Claude demonstrated modern neon lighting based on a sealed tube of neon. Claude tried briefly to sell neon tubes for indoor domestic lighting, due to their intensity, but the market failed because homeowners objected to the color. In 1912, Claude’s associate began selling neon discharge tubes as eye-catching advertising signs and was instantly more successful. Neon tubes were introduced to the U.S. in 1923 with two large neon signs bought by a Los Angeles Packard car dealership. The glow and arresting red color made neon advertising completely different from the competition.[19] The intense color and vibrancy of neon equated with American society at the time, suggesting a «century of progress» and transforming cities into sensational new environments filled with radiating advertisements and «electro-graphic architecture».[20][21]
Neon played a role in the basic understanding of the nature of atoms in 1913, when J. J. Thomson, as part of his exploration into the composition of canal rays, channeled streams of neon ions through a magnetic and an electric field and measured the deflection of the streams with a photographic plate. Thomson observed two separate patches of light on the photographic plate (see image), which suggested two different parabolas of deflection. Thomson eventually concluded that some of the atoms in the neon gas were of higher mass than the rest. Though not understood at the time by Thomson, this was the first discovery of isotopes of stable atoms. Thomson’s device was a crude version of the instrument we now term a mass spectrometer.
Isotopes[edit]
The first evidence for isotopes of a stable element was provided in 1913 by experiments on neon plasma. In the bottom right corner of J. J. Thomson’s photographic plate are the separate impact marks for the two isotopes neon-20 and neon-22.
Neon has three stable isotopes: 20Ne (90.48%), 21Ne (0.27%) and 22Ne (9.25%).
21Ne and 22Ne are partly primordial and partly nucleogenic (i.e. made by nuclear reactions of other nuclides with neutrons or other particles in the environment) and their variations in natural abundance are well understood. In contrast, 20Ne (the chief primordial isotope made in stellar nucleosynthesis) is not known to be nucleogenic or radiogenic, except from the decay of oxygen-20, which is produced in very rare cases of cluster decay by thorium-228. The causes of the variation of 20Ne in the Earth have thus been hotly debated.[22][23]
The principal nuclear reactions generating nucleogenic neon isotopes start from 24Mg and 25Mg, which produce 21Ne and 22Ne respectively, after neutron capture and immediate emission of an alpha particle. The neutrons that produce the reactions are mostly produced by secondary spallation reactions from alpha particles, in turn derived from uranium-series decay chains. The net result yields a trend towards lower 20Ne/22Ne and higher 21Ne/22Ne ratios observed in uranium-rich rocks such as granites.[23]
In addition, isotopic analysis of exposed terrestrial rocks has demonstrated the cosmogenic (cosmic ray) production of 21Ne. This isotope is generated by spallation reactions on magnesium, sodium, silicon, and aluminium. By analyzing all three isotopes, the cosmogenic component can be resolved from magmatic neon and nucleogenic neon. This suggests that neon will be a useful tool in determining cosmic exposure ages of surface rocks and meteorites.[24]
Neon in solar wind contains a higher proportion of 20Ne than nucleogenic and cosmogenic sources.[23] Neon content observed in samples of volcanic gases and diamonds is also enriched in 20Ne, suggesting a primordial, possibly solar origin.[25]
Characteristics[edit]
Neon is the second-lightest noble gas, after helium. It glows reddish-orange in a vacuum discharge tube. It has over 40 times the refrigerating capacity (per unit volume) of liquid helium and three times that of liquid hydrogen.[2] In most applications it is a less expensive refrigerant than helium.[26][27]
Spectrum of neon with ultraviolet (at left) and infrared (at right) lines shown in white
Neon plasma has the most intense light discharge at normal voltages and currents of all the noble gases. The average color of this light to the human eye is red-orange due to many lines in this range; it also contains a strong green line, which is hidden, unless the visual components are dispersed by a spectroscope.[28]
Two quite different kinds of neon lighting are in common use. Neon glow lamps are generally tiny, with most operating between 100 and 250 volts.[29] They have been widely used as power-on indicators and in circuit-testing equipment, but light-emitting diodes (LEDs) now dominate in those applications. These simple neon devices were the forerunners of plasma displays and plasma television screens.[30][31] Neon signs typically operate at much higher voltages (2–15 kilovolts), and the luminous tubes are commonly meters long.[32] The glass tubing is often formed into shapes and letters for signage, as well as architectural and artistic applications.
Occurrence[edit]
Stable isotopes of neon are produced in stars. Neon’s most abundant isotope 20Ne (90.48%) is created by the nuclear fusion of carbon and carbon in the carbon-burning process of stellar nucleosynthesis. This requires temperatures above 500 megakelvins, which occur in the cores of stars of more than 8 solar masses.[33][34]
Neon is abundant on a universal scale; it is the fifth most abundant chemical element in the universe by mass, after hydrogen, helium, oxygen, and carbon (see chemical element).[35] Its relative rarity on Earth, like that of helium, is due to its relative lightness, high vapor pressure at very low temperatures, and chemical inertness, all properties which tend to keep it from being trapped in the condensing gas and dust clouds that formed the smaller and warmer solid planets like Earth.
Neon is monatomic, making it lighter than the molecules of diatomic nitrogen and oxygen which form the bulk of Earth’s atmosphere; a balloon filled with neon will rise in air, albeit more slowly than a helium balloon.[36]
Neon’s abundance in the universe is about 1 part in 750; in the Sun and presumably in the proto-solar system nebula, about 1 part in 600. The Galileo spacecraft atmospheric entry probe found that even in the upper atmosphere of Jupiter, the abundance of neon is reduced (depleted) by about a factor of 10, to a level of 1 part in 6,000 by mass. This may indicate that even the ice-planetesimals, which brought neon into Jupiter from the outer solar system, formed in a region which was too warm to retain the neon atmospheric component (abundances of heavier inert gases on Jupiter are several times that found in the Sun).[37]
Neon comprises 1 part in 55,000 in the Earth’s atmosphere, or 18.2 ppm by volume (this is about the same as the molecule or mole fraction), or 1 part in 79,000 of air by mass. It comprises a smaller fraction in the crust. It is industrially produced by cryogenic fractional distillation of liquefied air.[2]
On 17 August 2015, based on studies with the Lunar Atmosphere and Dust Environment Explorer (LADEE) spacecraft, NASA scientists reported the detection of neon in the exosphere of the moon.[38]
Chemistry[edit]
Neon is the first p-block noble gas, and the first element with a true octet of electrons. It is inert: as is the case with its lighter analogue, helium, no strongly bound neutral molecules containing neon have been identified. The ions [NeAr]+, [NeH]+, and [HeNe]+ have been observed from optical and mass spectrometric studies.[2] Solid neon clathrate hydrate was produced from water ice and neon gas at pressures 350–480 MPa and temperatures about −30 °C.[40] Ne atoms are not bonded to water and can freely move through this material. They can be extracted by placing the clathrate into a vacuum chamber for several days, yielding ice XVI, the least dense crystalline form of water.[39]
The familiar Pauling electronegativity scale relies upon chemical bond energies, but such values have obviously not been measured for inert helium and neon. The Allen electronegativity scale, which relies only upon (measurable) atomic energies, identifies neon as the most electronegative element, closely followed by fluorine and helium.
The triple point temperature of neon (24.5561 K) is a defining fixed point in the International Temperature Scale of 1990.[41]
Production[edit]
Neon is produced from air in cryogenic air-separation plants. A gas-phase mixture mainly of nitrogen, neon, and helium is withdrawn from the main condenser at the top of the high-pressure air-separation column and fed to the bottom of a side column for rectification of the neon.[42] It can then be further purified from helium.
About 70% of global neon supply is produced in Ukraine[43] as a by-product of steel production in Russia.[44] As of 2020, the company Iceblick, with plants in Odessa and Moscow, supplies 65 per cent of the world’s production of neon, as well as 15% of the krypton and xenon.[45][46]
2022 shortage[edit]
Global neon prices jumped by about 600% after the 2014 Russian annexation of Crimea,[47] spurring some chip manufacturers to start shifting away from Russian and Ukrainian suppliers[48] and toward suppliers in China.[46] The 2022 Russian invasion of Ukraine also shut down two companies in Ukraine: LLC «Cryoin engineering» (Ukrainian: ТОВ «Кріоін Інжинірінг») and LLC «Inhaz» (Ukrainian: ТОВ «ІНГАЗ») located in Odessa and Mariupol respectively; that produced about half of the global supply.[47][49] The closure was predicted to likely exacerbate COVID-19 chip shortage,[46][45] which may further shift neon production to China.[48]
Applications[edit]
Neon is often used in signs and produces an unmistakable bright reddish-orange light. Although tube lights with other colors are often called «neon», they use different noble gases or varied colors of fluorescent lighting.
Neon is used in vacuum tubes, high-voltage indicators, lightning arresters, wavemeter tubes, television tubes, and helium–neon lasers. Liquefied neon is commercially used as a cryogenic refrigerant in applications not requiring the lower temperature range attainable with more extreme liquid-helium refrigeration.
Neon, as liquid or gas, is relatively expensive – for small quantities, the price of liquid neon can be more than 55 times that of liquid helium. Driving neon’s expense is the rarity of neon, which, unlike helium, can only be obtained in usable quantities by filtering it out of the atmosphere.
Semiconductor industry[edit]
As of 2022 gas mixtures that include neon are used to power lasers for EUV lithography.[47]
See also[edit]
- Expansion ratio
- Neon sign
- Neon lamp
References[edit]
- ^ «Standard Atomic Weights: Neon». CIAAW. 1985.
- ^ a b c d Hammond, C. R. (2000). The Elements, in Handbook of Chemistry and Physics 81st edition (PDF). CRC press. p. 19. ISBN 0849304814.
- ^ Preston-Thomas, H. (1990). «The International Temperature Scale of 1990 (ITS-90)». Metrologia. 27 (1): 3–10. Bibcode:1990Metro..27….3P. doi:10.1088/0026-1394/27/1/002.
- ^ a b Haynes, William M., ed. (2011). CRC Handbook of Chemistry and Physics (92nd ed.). Boca Raton, FL: CRC Press. p. 4.122. ISBN 1-4398-5511-0.
- ^ Shuen-Chen Hwang, Robert D. Lein, Daniel A. Morgan (2005). «Noble Gases». in Kirk Othmer Encyclopedia of Chemical Technology, pages 343–383. Wiley. doi:10.1002/0471238961.0701190508230114.a01.pub2
- ^ Magnetic susceptibility of the elements and inorganic compounds, in Lide, D. R., ed. (2005). CRC Handbook of Chemistry and Physics (86th ed.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ^ Weast, Robert (1984). CRC, Handbook of Chemistry and Physics. Boca Raton, Florida: Chemical Rubber Company Publishing. pp. E110. ISBN 0-8493-0464-4.
- ^ Ramsay, William; Travers, Morris W. (1898). «On the Companions of Argon». Proceedings of the Royal Society of London. 63 (1): 437–440. doi:10.1098/rspl.1898.0057.
- ^ «Neon: History». Softciências. Retrieved 2007-02-27.
- ^ Group 18 refers to the modern numbering of the periodic table. Older numberings described the rare gases as Group 0 or Group VIIIA (sometimes shortened to 8). See also Group (periodic table).
- ^ Wilson, Hugh F.; Militzer, Burkhard (March 2010), «Sequestration of Noble Gases in Giant Planet Interiors», Physical Review Letters, 104 (12): 121101, arXiv:1003.5940, Bibcode:2010PhRvL.104l1101W, doi:10.1103/PhysRevLett.104.121101, PMID 20366523, S2CID 9850759, 121101.
- ^ Coyle, Harold P. (2001). Project STAR: The Universe in Your Hands. Kendall Hunt. p. 464. ISBN 978-0-7872-6763-6.
- ^ Kohmoto, Kohtaro (1999). «Phosphors for lamps». In Shionoya, Shigeo; Yen, William M. (eds.). Phosphor Handbook. CRC Press. p. 940. ISBN 978-0-8493-7560-6.
- ^ Ramsay, William, Travers, Morris W. (1898). «On the Companions of Argon». Proceedings of the Royal Society of London. 63 (1): 437–440. doi:10.1098/rspl.1898.0057. S2CID 98818445.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ «Neon: History». Softciências. Archived from the original on 2007-03-14. Retrieved 2007-02-27.
- ^ Weeks, Mary Elvira (2003). Discovery of the Elements: Third Edition (reprint). Kessinger Publishing. p. 287. ISBN 978-0-7661-3872-8. Archived from the original on 2015-03-22.
- ^ a b
Ramsay, Sir William (December 12, 1904). «Nobel Lecture – The Rare Gases of the Atmosphere». nobelprize.org. Nobel Media AB. Archived from the original on 13 November 2015. Retrieved 15 November 2015. - ^ Ramsay, William; Travers, Morris W. (1898). «On the Companions of Argon». Proceedings of the Royal Society of London. 63 (1): 437–440. doi:10.1098/rspl.1898.0057. ISSN 0370-1662. S2CID 98818445.
- ^ Mangum, Aja (December 8, 2007). «Neon: A Brief History». New York Magazine. Archived from the original on April 15, 2008. Retrieved 2008-05-20.
- ^ Golec, Michael J. (2010). «Logo/Local Intensities: Lacan, the Discourse of the Other, and the Solicitation to «Enjoy»«. Design and Culture. 2 (2): 167–181. doi:10.2752/175470710X12696138525622. S2CID 144257608.
- ^ Wolfe, Tom (October 1968). «Electro-Graphic Architecture». Architecture Canada.
- ^ Dickin, Alan P (2005). «Neon». Radiogenic isotope geology. p. 303. ISBN 978-0-521-82316-6.
- ^ a b c Resources on Isotopes Periodic Table—Neon at the U.S. Geological Survey, by Eric Caldwell, posted January 2004, retrieved February 10, 2011
- ^ «Neon: Isotopes». Softciências. Archived from the original on 2012-11-15. Retrieved 2007-02-27.
- ^ Anderson, Don L. «Helium, Neon & Argon». Mantleplumes.org. Archived from the original on 2006-05-28. Retrieved 2006-07-02.
- ^ «NASSMC: News Bulletin». December 30, 2005. Archived from the original on February 13, 2007. Retrieved 2007-03-05.
- ^ Mukhopadhyay, Mamata (2012). Fundamentals of Cryogenic Engineering. p. 195. ISBN 9788120330573. Archived from the original on 2017-11-16.
- ^ «Plasma». Archived from the original on 2007-03-07. Retrieved 2007-03-05.
- ^ Baumann, Edward (1966). Applications of Neon Lamps and Gas Discharge Tubes. Carlton Press.
- ^ Myers, Robert L. (2002). Display interfaces: fundamentals and standards. John Wiley and Sons. pp. 69–71. ISBN 978-0-471-49946-6. Archived from the original on 2016-06-29.
Plasma displays are closely related to the simple neon lamp.
- ^ Weber, Larry F. (April 2006). «History of the plasma display panel». IEEE Transactions on Plasma Science. 34 (2): 268–278. Bibcode:2006ITPS…34..268W. doi:10.1109/TPS.2006.872440. S2CID 20290119. Paid access.
- ^ «ANSI Luminous Tube Footage Chart» (PDF). American National Standards Institute (ANSI). Archived (PDF) from the original on 2011-02-06. Retrieved 2010-12-10. Reproduction of a chart in the catalog of a lighting company in Toronto; the original ANSI specification is not given.
- ^ Clayton, Donald (2003). Handbook of Isotopes in the Cosmos: Hydrogen to Gallium. Cambridge University Press. pp. 106–107. ISBN 978-0521823814.
- ^ Ryan, Sean G.; Norton, Andrew J. (2010). Stellar Evolution and Nucleosynthesis. Cambridge University Press. p. 135. ISBN 978-0-521-13320-3.
- ^ Asplund, Martin; Grevesse, Nicolas; Sauval, A. Jacques; Scott, Pat (2009). «The Chemical Composition of the Sun». Annual Review of Astronomy and Astrophysics. 47 (1): 481–522. arXiv:0909.0948. Bibcode:2009ARA&A..47..481A. doi:10.1146/annurev.astro.46.060407.145222. S2CID 17921922.
- ^ Gallagher, R.; Ingram, P. (2001-07-19). Chemistry for Higher Tier. University Press. p. 282. ISBN 978-0-19-914817-2.
- ^ Morse, David (January 26, 1996). «Galileo Probe Science Result». Galileo Project. Archived from the original on February 24, 2007. Retrieved 2007-02-27.
- ^ Steigerwald, William (17 August 2015). «NASA’s LADEE Spacecraft Finds Neon in Lunar Atmosphere». NASA. Archived from the original on 19 August 2015. Retrieved 18 August 2015.
- ^ a b Falenty, Andrzej; Hansen, Thomas C.; Kuhs, Werner F. (2014). «Formation and properties of ice XVI obtained by emptying a type sII clathrate hydrate». Nature. 516 (7530): 231–3. Bibcode:2014Natur.516..231F. doi:10.1038/nature14014. PMID 25503235. S2CID 4464711.
- ^ Yu, X.; Zhu, J.; Du, S.; Xu, H.; Vogel, S. C.; Han, J.; Germann, T. C.; Zhang, J.; Jin, C.; Francisco, J. S.; Zhao, Y. (2014). «Crystal structure and encapsulation dynamics of ice II-structured neon hydrate». Proceedings of the National Academy of Sciences of the United States of America. 111 (29): 10456–61. Bibcode:2014PNAS..11110456Y. doi:10.1073/pnas.1410690111. PMC 4115495. PMID 25002464.
- ^ «The Internet resource for the International Temperature Scale of 1990». Archived from the original on 2009-08-15. Retrieved 2009-07-07.
- ^ R. Norris Shreve; Joseph Brink (1977). Chemical Process Industries (4th ed.). p. 113. ISBN 0-07-057145-7.
- ^ «Explained: Why the Russia-Ukraine crisis may lead to a shortage in semiconductors». MSN. The Indian Express.
- ^ Alper, Alexandra (2022-03-11). «Exclusive: Russia’s attack on Ukraine halts half of world’s neon output for chips». Reuters. Retrieved 2022-03-16.
- ^ a b «Rare Gasses Supplier Known for Innovation». The European Times. 2020.
- ^ a b c Ukraine war flashes neon warning lights for chips, Reuters, 2022-02-25
- ^ a b c Times, Financial (4 March 2022). «Low on gas: Ukraine invasion chokes supply of neon needed for chipmaking». Ars Technica. Retrieved 13 March 2022.
- ^ a b «Chipmakers see limited impact for now, as Russia invades Ukraine». CNBC. 24 February 2022.
- ^ «Россия и Украина обрушили мировое производство микросхем». CNews.ru (in Russian). March 11, 2022. Retrieved 2022-04-17.
External links[edit]
- Neon at The Periodic Table of Videos (University of Nottingham)
- WebElements.com – Neon.
- It’s Elemental – Neon
- USGS Periodic Table – Neon
- Atomic Spectrum of Neon
- Neon Museum, Las Vegas
| Неон | |
|---|---|
| Атомный номер | 10 |
| Внешний вид простого вещества | инертный газ без цвета, вкуса и запаха |
| Свойства атома | |
|
Атомная масса (молярная масса) |
20,1797 а. е. м. (г/моль) |
| Радиус атома | ? (38) пм |
|
Энергия ионизации (первый электрон) |
2079,4(21,55) кДж/моль (эВ) |
| Электронная конфигурация | [He] 2s2 2p6 |
| Химические свойства | |
| Ковалентный радиус | 58 пм |
| Радиус иона | 112 пм |
|
Электроотрицательность (по Полингу) |
0,0 |
| Электродный потенциал | 0 |
| Степени окисления | n/a |
| Термодинамические свойства простого вещества | |
| Плотность | ( при −246 °C)1,204 г/см³ |
| Молярная теплоёмкость | 20,79[2] Дж/(K·моль) |
| Теплопроводность | (0,0493) Вт/(м·K) |
| Температура плавления | 24,55 K |
| Теплота плавления | n/a кДж/моль |
| Температура кипения | 27,1 K |
| Теплота испарения | 1,74 кДж/моль |
| Молярный объём | 16,8 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | кубическая гранецентрированная |
| Параметры решётки | 4,430 Å |
| Отношение c/a | — |
| Температура Дебая | 63,00 K |
| Ne | 10 |
| 20,1797 | |
| [He]2s22p6 | |
| Неон |
Неон — элемент главной подгруппы восьмой группы, второго периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 10. Обозначается символом Ne (Neon). Пятый по распространённости элемент во Вселенной (после водорода, гелия, кислорода и углерода). Простое вещество неон (CAS-номер: 7440-01-9) — инертный одноатомный газ без цвета, вкуса и запаха.
Схема атома неона
Неон открыли в июне 1898 года шотландский химик Уильям Рамзай и английский химик Морис Траверс. Они выделили этот инертный газ «методом исключения», после того, как кислород, азот, и все более тяжёлые компоненты воздуха были превращены в жидкость. Элементу дали незамысловатое название «неон», что в переводе с греческого означает «новый». В декабре 1910 года французский изобретатель Жорж Клод сделал газоразрядную лампу, заполненную неоном.
Происхождение названия
Название происходит от греч. νέος — новый.
Существует легенда, согласно которой название элементу дал тринадцатилетний сын Рамзая — Вилли, который спросил у отца, как тот собирается назвать новый газ, заметив при этом, что хотел бы дать ему имя novum (лат. — новый). Его отцу понравилась эта идея, однако он посчитал, что название neon, образованное от греческого синонима, будет звучать лучше.
Распространение
В мировой материи неон распределен неравномерно, однако в целом по распространенности во Вселенной он занимает пятое место среди всех элементов — около 0,13 % по массе. Наибольшая концентрация неона наблюдается на Солнце и других горячих звездах, в газовых туманностях, в атмосфере внешних планет Солнечной системы — Юпитера, Сатурна, Урана, Нептуна. В атмосфере многих звезд неон занимает третье место после водорода и гелия.
Земная кора
Из всех элементов второго периода неон — самый малочисленный на Земле. В рамках восьмой группы неон по содержанию в земной коре занимает третье место — после аргона и гелия. Газовые туманности и некоторые звезды содержат неона во много раз больше, чем его находится на Земле.
На Земле наибольшая концентрация неона наблюдается в атмосфере — 1,82·10−3% по объему, а его общие запасы оцениваются в 7,8·1014 м³. В 1 м³ воздуха содержится около 18,2 см³ неона (для сравнения: в том же объеме воздуха содержится только 5,2 см³ гелия). Среднее содержание неона в земной коре мало − 7·10−9% по массе. Всего на нашей планете около 6,6·1010 т неона. В изверженных породах находится около 109 т этого элемента. По мере разрушения пород газ улетучивается в атмосферу. В меньшей мере атмосферу снабжают неоном и природные воды.
Причину неоновой бедности нашей планеты ученые усматривают в том, что некогда Земля потеряла свою первичную атмосферу, которая и унесла с собой основную массу инертных газов, которые не могли, как кислород и другие газы, химически связаться с другими элементами в минералы и тем самым закрепиться на планете.
Определение
Качественно неон определяют по спектрам испускания (характеристические линии 585,25 нм и 540,05 нм), количественно — масс-спектрометрическими и хроматографическими методами анализа.
Физические свойства
- Благородные газы — бесцветные одноатомные газы без цвета и запаха.
- Инертные газы обладают более высокой электропроводностью по сравнению с другими газами и при прохождении через них тока ярко светятся, в частности неон огненно-красным светом, так как самые яркие его линии лежат в красной части спектра.
Эмиссионный спектр неона (слева направо: от ультрафиолетовых до инфракрасных линий, показанных белым цветом)
- Насыщенный характер атомных молекул инертных газов сказывается и в том, что инертные газы имеют более низкие точки сжижения и замерзания, чем другие газы с тем же молекулярным весом.
Химические свойства
Все благородные газы имеют завершенную электронную оболочку, поэтому они химически инертны. Химическая инертность неона исключительна, в этом с ним может конкурировать только гелий. Пока не получено ни одного его валентного соединения. Даже так называемые клатратные соединения неона с водой (Ne·6Н2О), гидрохиноном и другими веществами (подобные соединения тяжелых благородных газов — радона, ксенона, криптона и даже аргона — широко известны) получить и сохранить очень трудно.
Однако, с помощью методов оптической спектроскопии и масс-спектрометрии установлено существование ионов Ne+, (NeAr)+, (NeH)+, и (HeNe)+.
Изотопы неона
Существует три стабильных изотопа неона: 20Ne (изотопная распространённость 90,48 %), 21Ne (0,27 %) и 22Ne (9,25 %)[10]. Повсеместно преобладает легкий 20Ne.
Во многих альфа-активных минералах относительное содержание тяжелых 21Ne и 22Ne в десятки и сотни раз больше содержания их в воздухе. Это вызвано тем, что основными механизмами образования этих изотопов являются ядерные реакции, происходящие при бомбардировке ядер алюминия, натрия, магния и кремния продуктами распада ядер тяжёлых элементов. Кроме того, подобные реакции происходят в земной коре и атмосфере под воздействием космического излучения.
Зафиксирован также ряд малопродуктивных ядерных реакций, при которых образуются 21Ne и 22Ne — это захват альфа-частиц ядрами тяжелого кислорода 18О и фтора 19F:
Источник преобладающего на Земле лёгкого нуклида 20Ne до сих пор не установлен.
Считается, что в космическом пространстве неон также преимущественно представлен лёгким нуклидом 20Ne. В метеоритах обнаруживают немало 21Ne и 22Ne, но эти нуклиды предположительно образуются в самих метеоритах под воздействием космических лучей за время странствий во Вселенной.
Кроме трех стабильных нуклидов неона, существует еще шестнадцать нестабильных.
Получение
Неон получают совместно с гелием в качестве побочного продукта в процессе сжижения и разделения воздуха. Разделение гелия и неона осуществляется за счет адсорбции и конденсации. Адсорбционный метод основан на способности неона в отличие от гелия адсорбироваться активированным углем, охлаждаемым жидким азотом. Конденсационный способ основан на вымораживании неона при охлаждении смеси жидким водородом.
Неон извлекают из воздуха в аппаратах двукратной ректификации жидкого воздуха. Газообразные неон и гелий скапливаются в верхней части колонны высокого давления, то есть в конденсаторе-испарителе, откуда под давлением около 0.55 МПа подаются в трубное пространство дефлегматора, охлаждаемое жидким N2. Из дефлегматора обогащенная смесь Ne и Не направляется для очистки от N2 в адсорберы с активированным углем, из которых после нагревания поступает в газгольдер (содержание Ne + He до 70 %); степень извлечения смеси газов 0.5-0.6. Последнюю очистку от N2 и разделение Ne и Не можно осуществлять либо селективной адсорбцией при температуре жидкого N2, либо конденсационными методами — с помощью жидких Н2 или Ne. При использовании жидкого водорода дополнительно проводят очистку от примеси водорода с помощью CuO при 700 °С. В результате получают неон 99,9%-ной чистоты по объему.
Применение
Неоновая вывеска
Жидкий неон используют в качестве охладителя в криогенных установках. Ранее неон применялся в промышленности в качестве инертной среды, но был вытеснен более дешёвым аргоном.
Символ элемента, выполненный из неоновых трубок
Неоном наполняют газоразрядные лампы, сигнальные лампы в радиотехнической аппаратуре, фотоэлементы, выпрямители.
Смесь неона и гелия используют как рабочую среду в газовых лазерах (гелий-неоновый лазер).
Трубки, заполненные смесью неона и азота, при пропускании через них электрического разряда дают красно-оранжевое свечение, в связи с чем они широко используются в рекламе.
Неоновые лампы используют для сигнальных целей на маяках и аэродромах, так как их красный цвет очень мало рассеивается туманом и мглой.
Биологическая роль
Неон не играет никакой биологической роли.
Физиологическое действие
Инертные газы обладают физиологическим действием, которое проявляется в их наркотическом воздействии на организм. Наркотическое воздействие неона (как и гелия) при нормальном давлении в опытах не регистрируется, в то время как при повышении давления раньше возникают симптомы «нервного синдрома высокого давления» (НСВД).
В связи с этим, наряду с гелием, неон в составе неоно-гелиевой смеси используется для дыхания океанавтов, водолазов, людей, работающих при повышенных давлениях, чтобы избежать газовой эмболии и азотного наркоза. Преимущество смеси в том, что она меньше охлаждает организм, так как теплопроводность неона меньше, чем гелия.
Лёгкий неоно-гелиевый воздух облегчает также состояние больных, страдающих расстройствами дыхания.
Содержание неона в высоких концентрациях во вдыхаемом воздухе может вызвать головокружение, тошноту, рвоту, потерю сознания и смерть от асфиксии.
Интересные факты
«Неоновые огни» оправдывают своё название только в случае свечения красного цвета. Для получения других цветов используют ртуть и фосфор в определённых пропорциях или другие благородные газы.
Неон, Neon, Nе (10)
Химический элемент неон был открыт Рамзаем и Траверсом в 1898 г., через несколько дней после открытия криптона. Ученые отобрали первые пузырьки газа, образующегося при испарении жидкого аргона, и установили, что спектр этого газа указывает на присутствие нового элемента. Рамзай так рассказывает о выборе названия для этого элемента: «Когда мы впервый раз рассматривали его спектр, при этом находился мой 12-летний сын.»
Отец, — сказал он — как называется этот красивый газ?
Это еще не решено — ответил я.
Он новый? — полюбопытствовал сын.
Новооткрытый — возразил я.
Почему бы в таком случае не назвать его Novum, отец?
Это не подходит, потому что novum не греческое слово — ответил я.
Мы назовем его неоном, что по гречески значит новый, таким то образом газ получил свое название.
У этого термина существуют и другие значения, см. Неон (значения).
|
|||
| Внешний вид простого вещества | |||
|---|---|---|---|
|
|
|||
| Свойства атома | |||
| Имя, символ, номер |
Неон / Neon (Ne), 10 |
||
| Атомная масса (молярная масса) |
20,1797 а. е. м. (г/моль) |
||
| Электронная конфигурация |
[He] 2s2 2p6 |
||
| Радиус атома |
? (38)[1] пм |
||
| Химические свойства | |||
| Ковалентный радиус |
58[1] пм |
||
| Радиус иона |
112[1] пм |
||
| Электроотрицательность |
4,4 (шкала Полинга) |
||
| Электродный потенциал |
0 |
||
| Энергия ионизации (первый электрон) |
2079,4(21,55) кДж/моль (эВ) |
||
| Термодинамические свойства простого вещества | |||
| Плотность (при н. у.) |
(при −246 °C)1,204 г/см³ |
||
| Температура плавления |
24,55 K |
||
| Температура кипения |
27,1 K |
||
| Теплота испарения |
1,74 кДж/моль |
||
| Молярная теплоёмкость |
20,79[2] Дж/(K·моль) |
||
| Молярный объём |
16,8 см³/моль |
||
| Кристаллическая решётка простого вещества | |||
| Структура решётки |
кубическая гранецентрированная |
||
| Параметры решётки |
4,430 Å |
||
| Температура Дебая |
63,00 K |
||
| Прочие характеристики | |||
| Теплопроводность |
(300 K) (0,0493) Вт/(м·К) |
Нео́н (лат. Neon; обозначается символом Ne) — элемент главной подгруппы восьмой группы, второго периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 10. Пятый по распространённости элемент во Вселенной (после водорода, гелия, кислорода и углерода). Простое вещество неон (CAS-номер: 7440-01-9) — инертный одноатомный газ без цвета и запаха.
Содержание
- 1 История
- 1.1 Происхождение названия
- 2 Распространённость
- 2.1 Во Вселенной
- 2.2 Земная кора
- 3 Определение
- 4 Физические свойства
- 5 Химические свойства
- 6 Изотопы
- 7 Получение
- 8 Применение
- 9 Биологическая роль
- 9.1 Физиологическое действие
- 10 Интересные факты
- 11 Примечания
- 12 Ссылки
История
Неон открыли в июне 1898 года шотландский химик Уильям Рамзай и английский химик Морис Траверс[3]. Они выделили этот инертный газ «методом исключения», после того, как кислород, азот, и все более тяжёлые компоненты воздуха были превращены в жидкость. Элементу дали незамысловатое название «неон», что в переводе с греческого означает «новый». В декабре 1910 года французский изобретатель Жорж Клод сделал газоразрядную лампу, заполненную неоном.
Происхождение названия
Название происходит от греч. νέος — новый.
Существует легенда, согласно которой название элементу дал тринадцатилетний сын Рамзая — Вилли, который спросил у отца, как тот собирается назвать новый газ, заметив при этом, что хотел бы дать ему имя novum (лат. — новый). Его отцу понравилась эта идея, однако он посчитал, что название neon, образованное от греческого синонима, будет звучать лучше[4].
Распространённость
Во Вселенной
В мировой материи неон распределен неравномерно, однако в целом по распространенности во Вселенной он занимает пятое место среди всех элементов — около 0,13 %[5] по массе. Наибольшая концентрация неона наблюдается на Солнце и других горячих звездах, в газовых туманностях, в атмосфере внешних планет Солнечной системы — Юпитера, Сатурна, Урана, Нептуна[2]. В атмосфере многих звезд неон занимает третье место после водорода и гелия[6].
Земная кора
Из всех элементов второго периода неон — самый малочисленный на Земле[7]. В рамках восьмой группы неон по содержанию в земной коре занимает третье место — после аргона и гелия[7]. Газовые туманности и некоторые звезды содержат неона во много раз больше, чем его находится на Земле.
На Земле наибольшая концентрация неона наблюдается в атмосфере — 1,82·10−3%[2][8] по объему, а его общие запасы оцениваются в 7,8·1014 м³[2]. В 1 м³ воздуха содержится около 18,2 см³ неона (для сравнения: в том же объеме воздуха содержится только 5,2 см³ гелия)[8]. Среднее содержание неона в земной коре мало − 7·10−9% по массе[2]. Всего на нашей планете около 6,6·1010 т неона[источник не указан 1254 дня]. В изверженных породах находится около 109 т этого элемента[9]. По мере разрушения пород газ улетучивается в атмосферу. В меньшей мере атмосферу снабжают неоном и природные воды.
Причину неоновой бедности нашей планеты ученые усматривают в том, что некогда Земля потеряла свою первичную атмосферу, которая и унесла с собой основную массу инертных газов, которые не могли, как кислород и другие газы, химически связаться с другими элементами в минералы и тем самым закрепиться на планете[источник не указан 1254 дня].
Определение
Качественно неон определяют по спектрам испускания (характеристические линии 585,25 нм и 540,05 нм), количественно — масс-спектрометрическими и хроматографическими методами анализа[2].
Физические свойства
Неон в разрядной трубке
- Благородные газы — бесцветные одноатомные газы без вкуса и запаха.
- Инертные газы обладают более высокой электропроводностью по сравнению с другими газами и при прохождении через них тока ярко светятся, в частности неон огненно-красным светом, так как самые яркие его линии лежат в красной части спектра.
Эмиссионный спектр неона (слева направо: от ультрафиолетовых до инфракрасных линий, показанных белым цветом)
- Насыщенный характер атомных молекул инертных газов сказывается и в том, что инертные газы имеют более низкие точки сжижения и замерзания, чем другие газы с тем же молекулярным весом.
Химические свойства
Все благородные газы имеют завершенную электронную оболочку, поэтому они химически инертны. Химическая инертность неона исключительна, в этом с ним может конкурировать только гелий. Пока не получено ни одного его валентного соединения. Даже так называемые клатратные соединения неона с водой (Ne·6Н2О), гидрохиноном и другими веществами (подобные соединения тяжелых благородных газов — радона, ксенона, криптона и даже аргона — широко известны) получить и сохранить очень трудно.
Однако, с помощью методов оптической спектроскопии и масс-спектрометрии установлено существование ионов Ne+, (NeAr)+, (NeH)+, и (HeNe)+.
Изотопы
Существует три стабильных изотопа неона: 20Ne (изотопная распространённость 90,48 %), 21Ne (0,27 %) и 22Ne (9,25 %)[10]. Повсеместно преобладает легкий 20Ne.
Во многих альфа-активных минералах относительное содержание тяжелых 21Ne и 22Ne в десятки и сотни раз больше содержания их в воздухе. Это вызвано тем, что основными механизмами образования этих изотопов являются ядерные реакции, происходящие при бомбардировке ядер алюминия, натрия, магния и кремния продуктами распада ядер тяжёлых элементов. Кроме того, подобные реакции происходят в земной коре и атмосфере под воздействием космического излучения.
Зафиксирован также ряд малопродуктивных ядерных реакций[11], при которых образуются 21Ne и 22Ne — это захват альфа-частиц ядрами тяжелого кислорода 18О и фтора 19F:
Источник преобладающего на Земле лёгкого нуклида 20Ne до сих пор не установлен.
Считается, что в космическом пространстве неон также преимущественно представлен лёгким нуклидом 20Ne. В метеоритах обнаруживают немало 21Ne и 22Ne, но эти нуклиды предположительно образуются в самих метеоритах под воздействием космических лучей за время странствий во Вселенной.
Кроме трех стабильных нуклидов неона, существует еще шестнадцать нестабильных.
Получение
Неон получают совместно с гелием в качестве побочного продукта в процессе сжижения и разделения воздуха на крупных промышленных установках. Разделение «неоно-гелиевой» смеси осуществляется несколькими способами за счет адсорбции и конденсации и низкотемпературной ректификации. Адсорбционный метод основан на способности неона в отличие от гелия адсорбироваться активированным углем, охлаждаемым жидким азотом. Конденсационный способ основан на вымораживании неона при охлаждении смеси жидким водородом, ректификационный способ основан на разнице температур кипения гелия и азота. Неон извлекают из воздуха в аппаратах двукратной ректификации жидкого воздуха. Газообразные неон и гелий скапливаются в верхней части колонны высокого давления, то есть в конденсаторе-испарителе, откуда под давлением около 0.55 МПа подаются в трубное пространство дефлегматора, охлаждаемое жидким N2. Из дефлегматора обогащенная смесь Ne и Не направляется для очистки от N2 в адсорберы с активированным углем, из которых после нагревания поступает в газгольдер (содержание Ne + He до 70 %); степень извлечения смеси газов 0.5-0.6. Последнюю очистку от N2 и разделение Ne и Не можно осуществлять либо селективной адсорбцией при температуре жидкого N2, либо конденсационными методами — с помощью жидких Н2 или Ne. При использовании жидкого водорода дополнительно проводят очистку от примеси водорода с помощью CuO при 700 °C. В результате получают неон 99,9%-ной чистоты по объему[2]. Основным промышленным способом получения неона (в последнее десятилетие) является разделение неоно-гелиевой смеси путём низкотемпературной ректификации — смесь неона и гелия предварительно очищают от примеси азота и водорода(водород выжигают в печи заполненной катализатором), а азот в низкотемпературных аппаратах -«дефлегматор» и в блоке криогенных адсорберов заполненных активированным углём(уголь охлаждается змеевиками с кипящим в них под вакуумом азотом).После удаления азота неоно-гелиевая смесь сжимается компрессором и поступает в ректификационную колонну (предварительно охлаждаемая до температуры кипящего под вакуумом азота) для разделения. Для понижения температуры охлаждённая смесь дросселируется с 25МПа. до 0,2-0,3 МПа (в зависимости от режима работы установки).В верхней части колонны, из под крышки конденсатора, отбирается гелий с примесью до 20 % неона, в нижней части колонны в жидком виде получается неон. В качестве холодильного цикла используется дроссельный холодильный цикл с рабочей средой-хладогентом чистым неоном. Ректификационный метод разделения неоно-гелиевой смеси позволяет получить неон чистотой до 99,9999 %. Промышленные установки по получению неона высокой чистоты построены и успешно эксплуатируются на Украине — г. Мариуполь (предприятие «Ингаз») и г. Одесса (предприятие «Айсблик»), в Российской Федерации — г. Москва.
Применение
«Неоновая» вывеска
Жидкий неон используют в качестве охладителя в криогенных установках. Ранее неон применялся в промышленности в качестве инертной среды, но был вытеснен более дешёвым аргоном.
Символ элемента, выполненный из неоновых трубок
Неоном наполняют газоразрядные лампы, сигнальные лампы в радиотехнической аппаратуре, фотоэлементы, выпрямители.
Смесь неона и гелия используют как рабочую среду в газовых лазерах (гелий-неоновый лазер).
Трубки, заполненные смесью неона и азота, при пропускании через них электрического разряда дают красно-оранжевое свечение, в связи с чем они широко используются в рекламе. По традиции «неоновыми» часто называют также разрядные трубки других цветов, в реальности использующие свечение других благородных газов или флуоресцирующего покрытия (см. справа).
Неоновые лампы используют для сигнальных целей на маяках и аэродромах, так как их красный цвет очень слабо рассеивается туманом и мглой.
Биологическая роль
Неон не играет никакой биологической роли.
Физиологическое действие
Инертные газы обладают физиологическим действием, которое проявляется в их наркотическом воздействии на организм. Наркотическое воздействие неона (как и гелия) при нормальном давлении в опытах не регистрируется, в то время как при повышении давления раньше возникают симптомы «нервного синдрома высокого давления» (НСВД)[12].
В связи с этим, наряду с гелием, неон в составе неоно-гелиевой смеси используется для дыхания океанавтов, водолазов, людей, работающих при повышенных давлениях, чтобы избежать газовой эмболии и азотного наркоза. Преимущество смеси в том, что она меньше охлаждает организм, так как теплопроводность неона меньше, чем гелия.
Лёгкий неоно-гелиевый воздух облегчает также состояние больных, страдающих расстройствами дыхания.
Содержание неона в высоких концентрациях во вдыхаемом воздухе может вызвать головокружение, тошноту, рвоту, потерю сознания и смерть от асфиксии[13][14].
Интересные факты
- «Неоновые огни» оправдывают своё название только в случае свечения красного цвета. Для получения других цветов используют электрический разряд в парах ртути в газоразрядных трубках, изнутри покрытых люминофором нужного цвета свечения, преобразующих ультрафиолетовое излучение разряда в видимый свет, или разряд в смеси других благородных газов.
Примечания
- ↑ 1 2 3 Size of neon in several environments (англ.). www.webelements.com. Проверено 8 июля 2009.
- ↑ 1 2 3 4 5 6 7 Редкол.:Кнунянц И. Л. (гл. ред.) Химическая энциклопедия: в 5 т. — Москва: Большая Российская энциклопедия, 1992. — Т. 3. — С. 209-210. — 639 с. — 50 000 экз. — ISBN 5—85270—039—8
- ↑ William Ramsay, Morris W. Travers On the Companions of Argon (англ.) // Proceedings of the Royal Society of London. — 1898. — Т. 63.878. — С. 437–440.
- ↑ Mary Elvira Weeks. XVIII. The inert gases // Discovery of the elements : collected reprints of a series of articles published in the Journal of Chemical Education. — 3rd ed. rev. — Kila, MT: Kessinger Publishing, 2003. — P. 286-288. — 380 p. — ISBN 0766138720 9780766138728
- ↑ Neon: geological information (англ.). www.webelements.com. Проверено 8 июля 2009.
- ↑ Финкельштейн Д.Н. Глава IV. Инертные газы на Земле и в космосе // Инертные газы. — Изд. 2-е. — М.: Наука, 1979. — С. 106. — 200 с. — («Наука и технический прогресс»). — 19 000 экз.
- ↑ 1 2 Abundance in Earth’s crust (англ.). www.webelements.com. Проверено 8 июля 2009.
- ↑ 1 2 Финкельштейн Д.Н. Глава IV. Инертные газы на Земле и в космосе // Инертные газы. — Изд. 2-е. — М.: Наука, 1979. — С. 78. — 200 с. — («Наука и технический прогресс»). — 19 000 экз.
- ↑ Финкельштейн Д.Н. Глава IV. Инертные газы на Земле и в космосе // Инертные газы. — Изд. 2-е. — М.: Наука, 1979. — С. 95. — 200 с. — («Наука и технический прогресс»). — 19 000 экз.
- ↑ Isotopes of neon (англ.). www.webelements.com. Проверено 8 июля 2009.
- ↑ Финкельштейн Д.Н. Глава IV. Инертные газы на Земле и в космосе // Инертные газы. — Изд. 2-е. — М.: Наука, 1979. — С. 83. — 200 с. — («Наука и технический прогресс»). — 19 000 экз.
- ↑ Павлов Б.Н. Проблема защиты человека в экстремальных условиях гипербарической среды обитания (рус.). www.argonavt.com (15 мая 2007). Архивировано из первоисточника 22 августа 2011. Проверено 22 мая 2010.
- ↑ Neon (Ne) — Chemical properties, Health and Environmental effects (англ.). www.lenntech.com. Архивировано из первоисточника 22 августа 2011. Проверено 8 июля 2009.
- ↑ Neon (ICSC) (англ.). www.inchem.org. Архивировано из первоисточника 22 августа 2011. Проверено 19 сентября 2009.
Ссылки
| Неон на Викискладе? |
- Неон на Webelements
- Неон в Популярной библиотеке химических элементов
| Периодическая система химических элементов Д. И. Менделеева | ||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||
| 1 | H | He | ||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Fl | Uup | Lv | Uus | Uuo |
|
Неон – один из элементов периодической системы химических элементов. Этот инертный газ, относится к группе благородных инертных газов, в которую входят еще ксенон, гелий и аргон. На Земле этот элемент содержится в воздухе атмосферы. Современная наука оценивает его запасы около 7,1·1011 тонн, это означает, что 1 куб воздуха содержит 16 кубических сантиметров неона. Неон является шестым по распространённости на Земле. Перед ним углерод, кислород, гелий, водород и азот.
Немного из истории открытия неона
История открытия неона уходит в далёкий XIX век. Открытие этого газа было бы невозможно без двух знаменательных событий, это изобретение в 1859 году метода спектрального анализа и опубликование в 1869 году, русским химиком Менделеевым, периодической системы химических элементов (таблицы). В опубликованной таблице тогда было всего 63 элемента из известных сейчас 118. Неона тоже не было в этой таблице, а был неоткрытый элемент под номером 10. Лишь только в 1898 году ученые из Англии – Уильям Рамзай и Моррис Трэверс догадались провести спектральный анализ испаряющихся остатков жидкого воздуха, для того чтобы обнаружить предсказанный Менделеевым элемент под номером 10. В том же году этому элементу было дано название неон, от греческого слова « νέος» – новый, и присвоен символ «Ne».
Свойства неона
Одной из главных особенностей инертных газов является отсутствие вступления их, в какие либо химические реакции с другими элементами таблицы Менделеева. Неон это одноатомный газ, без цвета и запаха, в 1,44 раза легче воздуха, относящийся к группе лёгких инертных газов, куда входят также гелий. Неон, содержится, в атмосфере воздуха состоящей из трёх из трех изотопов 20Ne, 21Ne и 22Ne с преобладанием 20Ne (90,92%). Этот элемент обладает исключительной химической инертностью, сравнимой только с гелием. До настоящего времени не удалось получить ни одного соединения неона, с другими элементами таблицы Менделеева Инертность неона обусловлена тем, что он имеет электронную оболочку с восемью электронами на орбитах вокруг ядра атома. Такую оболочку называют завершённой.
Неон обладает низкой абсорбцией и растворимостью в воде, так в 100 граммах воды можно растворить всего лишь 1,56 мг этого газа. Температура его кипения -2460С, а температура плавления -248,60С. При всём этом неон, в отличии от гелия, хорошо абсорбируется активированным углём, который охлаждён жидким азотом.
Тяжёлые инертные газы такие как криптон, аргон и пр. при вдыхании их человеком иди животным оказывают наркотическое действие. Не лишён этого свойства и неон, только для того что бы появились первые симптомы наркотического опьянения смесь кислорода и неона должна быть под давлением не менее 25кг/см2. При более низком давлении неон, из-за своей низкой растворяемости в жирах и крови живого организма такого действия не оказывает.
Неон обладает хорошей электропроводностью и свечением яркого красного цвета при пропускании через него электрического тока, при этом насыщенность, оттенки и яркость этого свечения зависят от величины приложенного напряжения и силы протекающего через газ тока. По этому цвету определяют неон при проведении спектрального анализа воздуха.
Применение неона
Ещё относительно недавно свойство неона светиться ярким красным цветом находило применение в газоразрядных лампах, из которых делами красивую рекламу. Но на смену таким лампам пришли светодиодные источники света, как более дешёвые и экономичные.
Так как неон взрывобезопасен и в сжиженном состоянии тяжелее воды он имеет теплоту испарения больше чем у водорода и гелия, а также малые потери при хранении его в сжиженном состоянии при давлении 150 кн/см2, эти его особенности всё больше и больше находят применение во всевозможной криогенной технике, в качестве хладагента. Так жидким неоном можно создать температуру для хранения ракетного топлива, консервации тканей животных или имитации условий космоса. В химической промышленности применение жидкого неона позволяет проводить реакции прямого синтеза и также получать фториды кислорода.
Малая растворимость неона находит свое применение в неоногелиевых смесях для дыхания, водолазов и больных людей, страдающих заболеваниями органов дыхания. Применение этих смесей для дыхания позволяет избежать азотной эмболии и азотного наркоза, с меньшим охлаждением организма во время дыхания. Смесь неона и гелия используется не только для дыхания, но и как основ для создания излучения в газовых лазерах.
Интересен тот факт, что элемент под номером 10 помог в открытии нового вещества из периодической таблицы химических элементов Менделеева. Этот открытый в 1964 году элемент, имеет № 104 и сейчас называется курчатовий. Открыт он был в городе Дубна при помощи циклотрона.
Получение неона
Для промышленных целей неон выделяют из воздуха, как побочный продукт при выделении из воздуха жидкого азота и кислорода, двумя способами: адсорбционным или конденсационным. Первый способ основан на адсорбции неона на активированном угле при выделении из воздуха жидкого азота и кислорода и многократного повторения этого процесса. Второй основан на охлаждении воздуха до температуры жидкого водорода, при которой неон, находящийся в воздухе кристаллизуется, а гелий остаётся в газообразном состоянии и отсасывается специальными насосами.
Глоссарий. Химия
Неон
Нео́н (лат. Neon; обозначается символом Ne) — элемент главной подгруппы восьмой группы, второго периода периодической системы химических элементов, с атомным номером 10. Пятый по распространённости элемент во Вселенной (после водорода, гелия, кислорода и углерода). Простое вещество неон (CAS-номер: 7440-01-9) — инертный одноатомный газ без цвета и запаха.
История
Неон открыли в июне 1898 года шотландский химик Уильям Рамзай и английский химик Морис Траверс. Они выделили этот инертный газ «методом исключения», после того, как кислород, азот, и все более тяжёлые компоненты воздуха были превращены в жидкость. Элементу дали незамысловатое название «неон», что в переводе с греческого означает «новый». В декабре 1910 года французский изобретатель Жорж Клод сделал газоразрядную лампу, заполненную неоном.
Происхождение названия
Название происходит от греч. νέος — новый.
Существует легенда, согласно которой название элементу дал тринадцатилетний сын Рамзая — Вилли, который спросил у отца, как тот собирается назвать новый газ, заметив при этом, что хотел бы дать ему имя novum (лат. — новый). Его отцу понравилась эта идея, однако он посчитал, что название neon, образованное от греческого синонима, будет звучать лучше.
Распространённость
Во Вселенной
В мировой материи неон распределен неравномерно, однако в целом по распространенности во Вселенной он занимает пятое место среди всех элементов — около 0,13 % по массе. Наибольшая концентрация неона наблюдается на Солнце и других горячих звездах, в газовых туманностях, в атмосфере внешних планет Солнечной системы — Юпитера, Сатурна, Урана, Нептуна. В атмосфере многих звезд неон занимает третье место после водорода и гелия.
Земная кора
Из всех элементов второго периода неон — самый малочисленный на Земле. В рамках восьмой группы неон по содержанию в земной коре занимает третье место — после аргона и гелия. Газовые туманности и некоторые звезды содержат неона во много раз больше, чем его находится на Земле.
На Земле наибольшая концентрация неона наблюдается в атмосфере — 1,82×10-3% по объему, а его общие запасы оцениваются в 7,8×1014 м³. В 1 м³ воздуха содержится около 18,2 см³ неона (для сравнения: в том же объеме воздуха содержится только 5,2 см³ гелия). Среднее содержание неона в земной коре мало − 7×10-9% по массе. Всего на нашей планете около 6,6×1010 т неона. В изверженных породах находится около 109 т этого элемента. По мере разрушения пород газ улетучивается в атмосферу. В меньшей мере атмосферу снабжают неоном и природные воды.
Причину неоновой бедности нашей планеты ученые усматривают в том, что некогда Земля потеряла свою первичную атмосферу, которая и унесла с собой основную массу инертных газов, которые не могли, как кислород и другие газы, химически связаться с другими элементами в минералы и тем самым закрепиться на планете.
Физические свойства
1. Благородные газы — бесцветные одноатомные газы без вкуса и запаха.
2. Инертные газы обладают более высокой электропроводностью по сравнению с другими газами и при прохождении через них тока ярко светятся, в частности неон огненно-красным светом, так как самые яркие его линии лежат в красной части спектра.
3. Насыщенный характер атомных молекул инертных газов сказывается и в том, что инертные газы имеют более низкие точки сжижения и замерзания, чем другие газы с тем же молекулярным весом.
Химические свойства
Все благородные газы имеют завершенную электронную оболочку, поэтому они химически инертны. Химическая инертность неона исключительна, в этом с ним может конкурировать только гелий. Пока не получено ни одного его валентного соединения. Даже так называемые клатратные соединения неона с водой (Ne·6Н2О), гидрохиноном и другими веществами (подобные соединения тяжелых благородных газов — радона, ксенона, криптона и даже аргона — широко известны) получить и сохранить очень трудно.
Однако, с помощью методов оптической спектроскопии и масс-спектрометрии установлено существование ионов Ne+, (NeAr)+, (NeH)+, и (HeNe)+.
Источник: Википедия
Другие заметки по химии
| Неон | |||
|---|---|---|---|
| ← Фтор (b) | Натрий (b) → | |||
|
|||
| Внешний вид простого вещества | |||

Свечение неона в газоразрядной трубке |
|||
| Свойства атома | |||
| Название, символ, номер (b) | Неон / Neon (Ne), 10 | ||
| Группа (b) , период (b) , блок | 18 (устар. 8), 2, p-элемент (b) |
||
| Атомная масса (b) (молярная масса (b) ) |
20,1797(6)[1] а. е. м. (b) (г (b) /моль (b) ) | ||
| Электронная конфигурация (b) | [He] 2s22p6 1s22s22p6 |
||
| Радиус атома (b) | ? (38)[2]пм (b) | ||
| Химические свойства | |||
| Ковалентный радиус (b) | 58[2] пм (b) | ||
| Радиус иона (b) | 112[2] пм (b) | ||
| Электроотрицательность (b) | 4,4 (шкала Полинга) | ||
| Электродный потенциал (b) | 0 | ||
| Степени окисления (b) | 0 | ||
| Энергия ионизации (b) (первый электрон) |
2079,4(21,55) кДж (b) /моль (b) (эВ (b) ) | ||
| Термодинамические свойства простого вещества | |||
| Плотность (b) (при н. у.) |
Твердая фаза: 1,444 г/см3 (при −248,49 °C); Газ: 0,90035 кг/м3[3] (при 0 °C, 101,325 кПа) г/см³ |
||
| Температура плавления (b) | 24,55 К; −248,6 °C | ||
| Температура кипения (b) | 27,1 К; −246,05 °C | ||
| Критическая точка (b) | 44,4 К (b) , 2,65 МПа | ||
| Уд. теплота испарения (b) | 1,74 кДж/моль | ||
| Молярная теплоёмкость (b) | 20,79[3] Дж/(K·моль) | ||
| Молярный объём (b) | 22,4⋅103 см (b) ³/моль (b) | ||
| Кристаллическая решётка (b) простого вещества | |||
| Структура решётки | Кубическая гранецентрированная | ||
| Параметры решётки (b) | 4,430 Å (b) | ||
| Температура Дебая (b) | 63,00 K (b) | ||
| Прочие характеристики | |||
| Теплопроводность (b) | (300 K) 0,0493 Вт/(м·К) | ||
| Номер CAS (b) | 7440-01-9 |
Нео́н (химический символ (b) — Ne, от лат. (b) Neon) — химический элемент (b) 18-й группы (b) (по устаревшей классификации (b) — главной подгруппы восьмой группы, VIIIA) второго периода (b) периодической системы (b) Д. И. Менделеева (b) , с атомным номером (b) 10.
Пятый по распространённости элемент Вселенной (b) после водорода (b) , гелия (b) , кислорода (b) и углерода (b) .
Простое вещество (b) неон — это инертный (b) одноатомный газ без цвета (b) и запаха (b) . Обнаружен (наряду с ксеноном (b) и криптоном (b) ) в 1898 году (b) в виде остатка после извлечения из жидкого воздуха азота (b) , кислорода (b) , водорода (b) , аргона (b) и углекислого газа (b) .
История
Неон открыли в июне 1898 года (b) английские химики Уильям Рамзай (b) и Морис Траверс (b) [4]. Они выделили этот инертный газ «методом исключения» после того, как кислород, азот (b) , аргон (b) и все более тяжёлые компоненты воздуха были сжижены. В декабре 1910 года французский изобретатель Жорж Клод (b) изобрёл газоразрядную лампу (b) , заполненную неоном.
Происхождение названия
Название происходит от греч. (b) νέος — новый.
Существует легенда, согласно которой название элементу дал тринадцатилетний сын Рамзая — Вилли, который спросил у отца, как тот собирается назвать новый газ, заметив при этом, что хотел бы дать ему имя novum (лат. — новый). Его отцу понравилась эта идея, однако он посчитал, что название neon, образованное от греческого синонима, будет звучать лучше[5].
Распространённость
Во Вселенной
В мировой материи неон распределён неравномерно, однако в целом по распространенности во Вселенной (b) он занимает пятое место среди всех элементов — около 0,13 %[6] по массе. Наибольшая концентрация неона наблюдается на Солнце (b) и других горячих звёздах (b) , в газовых туманностях (b) , в атмосфере планет-гигантов (b) , находящихся в Солнечной системе (b) : Юпитера (b) , Сатурна (b) , Урана (b) , Нептуна (b) [3]. В атмосфере многих звёзд неон занимает третье место после водорода и гелия[7].
Земная кора
Из всех стабильных элементов второго периода неон — один из самых малораспространённых на Земле (b) [8]. В 18-й группе неон по содержанию в земной коре занимает третье место после аргона (b) и гелия[8]. В газовых туманностях (b) и некоторых звёздах неона во много раз больше, чем на Земле.
На Земле наибольшая концентрация неона наблюдается в атмосфере — 1,82⋅10−3 %[3][9] по объёму, а его общие запасы оцениваются в 7,8⋅1014 м³[3]. В 1 м³ воздуха содержится около 18,2 см³ неона (и, для сравнения, лишь 5,2 см³ гелия)[9]. Среднее содержание неона в земной коре мало — 7⋅10−9 % по массе[3]. Всего в атмосфере Земли около 6,5⋅1010 т неона[10]. В изверженных породах находится около 109 т этого элемента[11]. По мере разрушения пород газ улетучивается в атмосферу. В меньшей мере в атмосферу неон выделяется из природных вод.
Причину низкого содержания неона на Земле учёные объясняют тем, что она некогда потеряла первичную атмосферу, и вместе с ней основную массу инертных газов, которые не могли, как кислород и другие газы, химически связаться с другими элементами в минералы и тем самым остаться на планете[источник не указан 4923 дня].
Определение
Качественно неон определяют по спектрам испускания (b) (характеристические линии 585,25 нм и 540,05 нм), количественно — масс-спектрометрическими (b) и хроматографическими (b) методами анализа[3].
Физические свойства
- Неон, как и все благородные газы — бесцветный одноатомный газ без вкуса и запаха.
- Инертные газы обладают более высокой электропроводностью (b) в электрическом разряде по сравнению с другими газами и при прохождении через них электрического тока светятся, в частности, неон — оранжево-красным светом, так как его самые интенсивные спектральные линии лежат в красной части спектра.
- Заполненность внешних электронных оболочек атомов инертных газов обусловливает более низкие температуры сжижения и отвердевания, чем у других газов с близкими молекулярными массами.
Химические свойства
Все благородные газы имеют завершённую электронную оболочку (b) , поэтому они химически инертны. Неон по химической инертности уступает лишь гелию. Пока не получено ни одного валентного соединения неона. Даже так называемые клатратные соединения (b) неона с водой (b) (Ne·6Н2О), гидрохиноном (b) и другими веществами (подобные соединения тяжелых благородных газов — радона (b) , ксенона (b) , криптона (b) и даже аргона (b) — известны и устойчивы) получить и сохранить очень трудно. С помощью методов оптической спектроскопии (b) и масс-спектрометрии (b) установлено существование молекулярных ионов (b) (NeAr)+, (NeH)+, и (HeNe)+.
Изотопы
Существует три стабильных изотопа (b) неона: 20Ne (b) (изотопная распространённость (b) 90,48 %),21Ne (b) (0,27 %) и 22Ne (b) (9,25 %)[12].
Кроме трёх стабильных нуклидов неона, существует ещё 16 нестабильных изотопов. На Земле преобладает лёгкий изотоп 20Ne.
Во многих минералах с повышенным содержанием альфа-активных элементов относительное содержание тяжелых 21Ne и 22Ne в десятки и сотни раз больше содержания их в воздухе. Это вызвано тем, что основными механизмами образования этих изотопов (b) являются ядерные реакции, происходящие при бомбардировке ядер алюминия (b) , натрия (b) , магния (b) и кремния (b) продуктами распада ядер тяжёлых элементов. Кроме того, подобные реакции происходят в земной коре и атмосфере под воздействием космического излучения (b) .
Известен также ряд ядерных реакций с малой вероятностью протекания[13], при которых образуются 21Ne и 22Ne — это захват альфа-частиц (b) ядрами тяжёлого стабильного изотопа кислорода 18О и природного фтора (b) 19F:
- .
Источник преобладающего на Земле лёгкого нуклида (b) 20Ne до сих пор не установлен.
Обычно Неон-20 (b) образуется в звёздах вследствие альфа-процесса (b) , при котором альфа-частица (b) поглощается ядром атома кислорода-16 с образованием неона-20 и излучением гамма-кванта (b) :
- .
Однако этот процесс требует температуры более 100 миллионов градусов и массы звезды более трёх солнечных.
Вполне возможно, что источником этого изотопа была сверхновая, после взрыва которой образовалось газопылевое облако (b) , из части которого сформировалась Солнечная система.
Считается, что в космическом пространстве неон также преимущественно представлен лёгким нуклидом 20Ne. В метеоритах (b) обнаруживают немало 21Ne и 22Ne, но эти нуклиды, предположительно, образуются в самих метеоритах под воздействием космических лучей за время странствий во Вселенной.
Получение
Неон получают совместно с гелием (b) в качестве побочного продукта при сжижении и разделении воздуха (b) на крупных промышленных установках. Разделение неоно-гелиевой смеси осуществляется несколькими способами за счёт адсорбции (b) , конденсации (b) и низкотемпературной ректификации (b) .
Адсорбционный метод основан на том, что неон, в отличие от гелия, способен адсорбироваться активированным углём (b) , охлаждаемым жидким азотом (b) . Конденсационный способ основан на вымораживании неона при охлаждении смеси жидким водородом. Ректификационный способ основан на разнице температур кипения гелия и азота.
Неон извлекают из воздуха в аппаратах двукратной ректификации жидкого воздуха. Газообразные неон и гелий скапливаются в верхней части колонны высокого давления, то есть в конденсаторе-испарителе, откуда под давлением около 0,55 МПа подаются в трубное пространство дефлегматора (b) , охлаждаемое жидким N2 (b) . Из дефлегматора обогащенная смесь Ne и Не направляется для очистки от N2 в адсорберы с активированным углем, из которых после нагревания поступает в газгольдер (b) (содержание Ne + He до 70 %); степень извлечения смеси газов 0,5—0,6. Последнюю очистку от N2 и разделение Ne и Не можно осуществлять либо селективной адсорбцией при температуре жидкого N2, либо конденсационными методами — с помощью жидких Н2 или Ne. При использовании жидкого водорода (b) дополнительно проводят очистку от примеси водорода с помощью CuO (b) при 700 °C (b) . В результате получают неон 99,9%-ной чистоты по объёму[3].
Основным промышленным способом получения неона (в последнее десятилетие) является разделение неоно-гелиевой смеси путём низкотемпературной ректификации. Смесь неона и гелия предварительно очищают от примеси азота и водорода (водород выжигают в печи, заполненной катализатором), а азот удаляют в низкотемпературных дефлегматорах (b) и в блоке криогенных адсорберов (b) , заполненных активированным углём (уголь охлаждается змеевиками с кипящим в них под вакуумом азотом). После удаления азота неоно-гелиевая смесь сжимается компрессором и поступает для разделения в ректификационную колонну, предварительно охлаждаемую до температуры кипящего под вакуумом азота. Для понижения температуры охлаждённая смесь дросселируется с 25 МПа до 0,2—0,3 МПа (в зависимости от режима работы установки). В верхней части колонны, из-под крышки конденсатора, отбирается гелий с примесью до 20 % неона, в нижней части колонны получается неон в жидком виде. В качестве холодильного цикла используется дроссельный холодильный цикл с рабочей средой-хладагентом из чистого неона. Ректификационный метод разделения неоно-гелиевой смеси позволяет получить неон чистотой до 99,9999 %.
Стабильный изотоп неон-20, также может быть получен из стабильного натрия-23, в ходе протон-гелиевой реакции 23Na(p,α)20Ne[14]:
Промышленные установки по очистке неона на Украине (b) на двух заводах — «Ингаз» и «Айсблик»[уточнить] (Одесса (b) , Москва (b) ), также «Криоин» в Мариуполе (b) (5 % мирового неона до войны 2022 года) — суммарно 65 % мирового объёма неона (540 тонн) в 2020 г., 54 % в 2021; с февраля 2022 г. (b) производство в стране полностью прекращено, высокочистый неон тут же подорожал на 600 %.
Остальные 50 % мирового объема неона высокой степени очистки производят компании из других стран (в частности, Китай (b) ) .
Россия (b) намерена в течение года нарастить выпуск неона до 25 % мировых объемов.[15]
Применение
Жидкий неон используют в качестве охладителя (b) в криогенных установках (b) . Ранее неон применялся в промышленности в качестве инертной среды, но был вытеснен более дешёвым аргоном (b) . Неоном наполняют газоразрядные лампы (b) , сигнальные лампы в радиотехнической аппаратуре, фотоэлементы, выпрямители. Смесь неона и гелия используют как рабочую среду в газовых лазерах (гелий-неоновый лазер (b) ).
Трубки, заполненные смесью неона и азота, при пропускании через них электрического разряда дают красно-оранжевое свечение, в связи с чем они широко используются в рекламе. По традиции «неоновыми» часто называют и газоразрядные трубки других цветов, хотя в них используется свечение не неона, а других благородных газов или флуоресцирующего покрытия (см. справа). Для получения цветов, отличных от красного, используют либо электрический разряд в смеси других благородных газов (b) , либо разряд в аргоне (b) с добавкой небольших количеств паров ртути (b) , при этом газоразрядную трубку изнутри покрывают люминофором (b) , преобразующим ультрафиолетовое излучение разряда в видимый свет требуемого цвета.
Неоновые лампы применяются для сигнальных целей на маяках и аэродромах, так как их красный свет очень слабо рассеивается туманом и мглой.
С 1999 г. неон — важный элемент в производстве интегральных микросхем, где он используется в ультрафиолетовой фотолитографии (b) при изготовлении схем с проектными нормами (b) 180 нанометров и менее[16].
Физиологическое действие
Инертные газы обладают физиологическим действием, которое проявляется в наркотическом воздействии на организм. Наркотическое воздействие неона (как и гелия) при нормальном давлении в опытах не регистрируется, а при повышении давления первыми возникают симптомы «неврологического синдрома высокого давления» (НСВД)[17].
В связи с этим, наряду с гелием, неон в составе неоно-гелиевой смеси используется для дыхания океанавтов, водолазов, людей, работающих при повышенных давлениях, чтобы избежать газовой эмболии (b) и азотного наркоза (b) . Преимущество дыхательных смесей с неоном в том, что они меньше охлаждают организм, так как теплопроводность (b) неона меньше, чем гелия.
Лёгкая смесь неона и гелия облегчает состояние больных, страдающих расстройствами дыхания.
Очень высокая концентрация неона во вдыхаемом воздухе может вызвать головокружение, тошноту, рвоту, потерю сознания и смерть от асфиксии (b) [18][19].
Примечания
- ↑ MichaelE. Wieser, Norman Holden, Tyler B. Coplen, John K. Böhlke, Michael Berglund, Willi A. Brand, Paul De Bièvre, Manfred Gröning, Robert D. Loss, Juris Meija, Takafumi Hirata, Thomas Prohaska, Ronny Schoenberg, Glenda O’Connor, Thomas Walczyk, Shige Yoneda, Xiang‑Kun Zhu. Atomic weights of the elements 2011 (IUPAC Technical Report) (англ.) // Pure and Applied Chemistry (b) . — 2013. — Vol. 85, no. 5. — P. 1047—1078. — doi (b) :10.1351/PAC-REP-13-03-02.
- 1 2 3 Size of neon in several environments (англ.). www.webelements.com. Дата обращения: 8 июля 2009. Архивировано 1 мая 2009 года.
- 1 2 3 4 5 6 7 8 Химическая энциклопедия: в 5 т / Редкол.: Кнунянц И. Л. (гл. ред.). — Москва: Большая Российская энциклопедия, 1992. — Т. 3. — С. 209—210. — 639 с. — 50 000 экз. — ISBN 5—85270—039—8.
- ↑ William Ramsay (b) , Morris W. Travers (b) . On the Companions of Argon (англ.) // Proceedings of the Royal Society of London. — 1898. — Vol. 63.878. — P. 437–440.
- ↑ Mary Elvira Weeks. XVIII. The inert gases // Discovery of the elements : collected reprints of a series of articles published in the Journal of Chemical Education. — 3rd ed. rev. — Kila, MT: Kessinger Publishing, 2003. — P. 286—288. — 380 p. — ISBN 0766138720 9780766138728.
- ↑ Neon: geological information (англ.). www.webelements.com. Дата обращения: 8 июля 2009. Архивировано 3 июля 2009 года.
- ↑ Финкельштейн Д. Н. Глава IV. Инертные газы на Земле и в космосе // Инертные газы. — Изд. 2-е. — М.: Наука, 1979. — С. 106. — 200 с. — («Наука и технический прогресс»). — 19 000 экз.
- 1 2 Abundance in Earth’s crust (англ.). www.webelements.com. Дата обращения: 8 июля 2009. Архивировано из оригинала 23 мая 2008 года.
- 1 2 Финкельштейн Д. Н. Глава IV. Инертные газы на Земле и в космосе // Инертные газы. — Изд. 2-е. — М.: Наука, 1979. — С. 78. — 200 с. — («Наука и технический прогресс»). — 19 000 экз.
- ↑ НЕОН • Большая российская энциклопедия — электронная версия. Дата обращения: 8 ноября 2021. Архивировано 15 июня 2021 года.
- ↑ Финкельштейн Д. Н. Глава IV. Инертные газы на Земле и в космосе // Инертные газы. — Изд. 2-е. — М.: Наука, 1979. — С. 95. — 200 с. — («Наука и технический прогресс»). — 19 000 экз.
- ↑ Isotopes of neon (англ.). www.webelements.com. Дата обращения: 8 июля 2009. Архивировано 1 мая 2009 года.
- ↑ Финкельштейн Д. Н. Глава IV. Инертные газы на Земле и в космосе // Инертные газы. — Изд. 2-е. — М.: Наука, 1979. — С. 83. — 200 с. — («Наука и технический прогресс»). — 19 000 экз.
- ↑ Архивированная копия. Дата обращения: 12 марта 2022. Архивировано 31 марта 2022 года.
- ↑ Российский неон больше не нужен. Крупнейший поставщик микросхем придумал, как обойтись без него // CNews (b) , 11 Ноября 2022
- ↑ В. Орлов Чистый неон: «секретное оружие» Одессы, Одесса будущего, 18.03.2022. Дата обращения: 21 марта 2022. Архивировано 1 мая 2022 года.
- ↑ Павлов Б. Н. Проблема защиты человека в экстремальных условиях гипербарической среды обитания. www.argonavt.com (15 мая 2007). Дата обращения: 22 мая 2010. Архивировано из оригинала 22 августа 2011 года.
- ↑ Neon (Ne) — Chemical properties, Health and Environmental effects (англ.). www.lenntech.com. Дата обращения: 8 июля 2009. Архивировано 22 августа 2011 года.
- ↑ Neon (ICSC) (англ.). www.inchem.org. Дата обращения: 19 сентября 2009. Архивировано 22 августа 2011 года.
Ссылки
- Неон на WebelementsАрхивная копия от 28 августа 2004 на Wayback Machine (b)
- Неон в Популярной библиотеке химических элементовАрхивная копия от 27 сентября 2007 на Wayback Machine (b)
Химический элемент с атомным номером 10
Химический элемент с атомным номером 10
 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Неон | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Внешний вид | бесцветный газ, проявляющий оранжево-красное свечение при помещении в электрическое поле | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Стандартный атомный вес A r, std (Ne) | 20,1797 ( 6) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Неон в таблице Менделеева | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Атомный номер (Z) | 10 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Группа | группа 18 (благородный газ es) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Период | период 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Блок | p-блок | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Категория элемента | Благородный газ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Конфигурация электронов | [He ] 2s 2p | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Электронов на оболочку | 2, 8 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Физические свойства | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Фаза при STP | газ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Точка плавления | 24,56 K (- 248,59 ° C, -415,46 ° F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Точка кипения | 27,104 K (-246,046 ° C, -410,883 ° F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Плотность (при стандартном давлении) | 0,9002 г / л | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| в жидком состоянии (при bp ) | 1,207 г / см | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| тройная точка | 24,556 K, 43,37 кПа | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Критическая точка | 44,4918 K, 2,7686 МПа | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Теплота плавления | 0,335 кДж / моль | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Теплота испарения | 1,71 кДж / моль | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Молярная теплоемкость | 20,79 Дж / (моль · К) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Давление пара
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Атомные свойства | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Состояния окисления | 0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Энергии ионизации |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ковалентный радиус | 58 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Радиус Ван-дер-Ваальса | 154 мкм | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Другие свойства | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Естественное происхождение | изначальный | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Кристалл структура | гранецентрированная кубическая (fcc)  |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Скорость звука | 435 м / с (газ, при 0 ° C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Теплопроводность | 49,1 × 10 Вт / (м · К) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Магнитное упорядочение | диамагнитное | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Магнитная восприимчивость | −6,74 · 10 см / моль (298 К) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Объемный модуль | 654 ГПа | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Номер CAS | 7440-01-9 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| История | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Прогноз | Уильям Рамзи (1897) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Открытие и первая изоляция | Уильям Рамзи Моррис Траверс (1898) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Основные изотопы неона | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ссылки |
Неон — это химический элемент с символом Neи атомный номер 10. Это благородный газ. Неон — это бесцветный, без запаха, инертный одноатомный газ в стандартных условиях, плотность которого составляет примерно две трети плотности воздуха. Он был открыт (вместе с криптоном и ксеноном ) в 1898 году как один из трех остаточных редких инертных элементов, остающихся в сухом воздухе после азота, кислород, аргон и диоксид углерода удаляли. Неон был вторым из этих трех инертных газов, который был открыт, и сразу же был признан новым элементом благодаря его ярко-красному спектру излучения. Название неон происходит от греческого слова νέον, среднего единственного числа от νέος (neos), что означает новый. Неон химически инертен, и незаряженные соединения неона неизвестны. соединения неона, известные в настоящее время, включают ионные молекулы, молекулы, удерживаемые вместе силами Ван-дер-Ваальса и клатратами.
во время космического нуклеогенеза элементов, большое количество неона образуется в процессе синтеза альфа-захвата в звездах. Хотя неон — очень распространенный элемент во Вселенной и Солнечной системе (он пятый по количеству в космосе после водорода, гелия, кислорода и углерода ), на Земле он встречается редко. Он составляет около 18,2 частей на миллион воздуха по объему (это примерно столько же, сколько молекулярная или мольная доля) и меньшую долю в земной коре. Причина относительной редкости неона на Земле и внутренних (земных) планетах заключается в том, что неон очень летуч и не образует соединений, которые могли бы закрепить его на твердых телах. В результате он ускользнул из планетезималей под теплом только что зажженного Солнца в ранней Солнечной системе. Даже внешняя атмосфера Юпитера несколько обеднена неоном, хотя и по другой причине.
Неон дает отчетливое красновато-оранжевое свечение при использовании в низком напряжении неоновые лампы накаливания, высоковольтные газоразрядные трубки и неоновые рекламные вывески. Красная линия излучения неона также вызывает хорошо известный красный свет гелий-неоновых лазеров. Неон используется в некоторых плазменных трубках и хладагентах, но имеет несколько других коммерческих применений. В промышленных масштабах он извлекается с помощью фракционной перегонки жидкого воздуха . Поскольку воздух является единственным источником, он значительно дороже гелия.
Содержание
- 1 История
- 2 Изотопы
- 3 Характеристики
- 4 Возникновение
- 5 Химия
- 6 Приложения
- 7 См. Также
- 8 Ссылки
- 9 Внешние ссылки
История

Неон был открыт в 1898 году британскими химиками сэром Уильямом Рамзи (1852–1916) и Моррис В. Трэверс (1872–1961) в Лондоне. Неон был обнаружен, когда Рамзи охладил образец воздуха до тех пор, пока он не превратился в жидкость, затем нагрел жидкость и захватил газы по мере их выкипания. Газы азот, кислород и аргон были идентифицированы, но оставшиеся газы были изолированы примерно в порядке их содержания в течение шестинедельного периода, начинающегося с в конце мая 1898 года. Первым был идентифицирован криптон. Следующим, после того как был удален криптон, был газ, который давал ярко-красный свет при спектроскопическом разряде. Этот газ, обнаруженный в июне, был назван «неон», греческий аналог латинского novum («новый»), предложенный сыном Рамзи. Сразу же был отмечен характерный яркий красно-оранжевый цвет, излучаемый газообразным неоном при электрическом возбуждении. Позже Трэверс писал: «Вспышка малинового света из трубки рассказывала свою собственную историю и была зрелищем, на котором можно остановиться и никогда не забыть».
Сообщалось также о втором газе, наряду с неоном, примерно такой же плотности. как аргон, но с другим спектром — Рамзи и Трэверс назвали его метаргоном. Однако последующий спектроскопический анализ показал, что он загрязнен аргоном монооксидом углерода. Наконец, та же команда обнаружила ксенон тем же способом в сентябре 1898 года.
Дефицит Неона препятствовал его быстрому применению для освещения по линиям трубок Мура, которые использовали азот и начали коммерциализацию в начале 1900-х годов. После 1902 года компания Жоржа Клода Air Liquide производила промышленное количество неона в качестве побочного продукта своего бизнеса по сжижению воздуха. В декабре 1910 года Клод продемонстрировал современное неоновое освещение на основе запаянной неоновой трубки. Клод ненадолго попытался продать неоновые лампы для внутреннего домашнего освещения из-за их интенсивности, но рынок потерпел неудачу, потому что домовладельцы возражали против цвета. В 1912 году партнер Клода начал продавать неоновые газоразрядные трубки в качестве привлекательных рекламных вывесок и сразу же добился большего успеха. Неоновые трубки были представлены в США в 1923 году с двумя большими неоновыми вывесками, купленными автомобильным дилером Packard в Лос-Анджелесе. Свечение и привлекательный красный цвет сделали неоновую рекламу совершенно отличной от конкурентов. Интенсивный цвет и яркость неона приравнивались к американскому обществу того времени, предлагая «век прогресса» и превращая города в сенсационные новые среды, наполненные сияющей рекламой и «электро-графической архитектурой».
Неон сыграл роль роль в основных представлениях о природе атомов в 1913 году, когда Дж. Дж. Томсон, в рамках своего исследования состава лучей канала, направил потоки неоновых ионов через магнитное и электрическое поля и измерил отклонение потоков с помощью фотографической пластинки. Томсон наблюдал два отдельных пятна света на фотографической пластинке (см. Изображение), что предполагало две разные параболы отклонения. В конце концов Томсон пришел к выводу, что некоторые из атомов в неоновом газе имеют более высокую массу, чем остальные. Хотя в то время Томсон не понял этого, это было первое открытие изотопов из стабильных атомов. Устройство Томсона было грубой версией прибора, который мы сейчас называем масс-спектрометром.
Изотопами
. Первые доказательства наличия изотопов стабильного элемента были получены в 1913 году в экспериментах с неоновой плазмой. В правом нижнем углу J. Фотопластинка Дж. Томсона представляет собой отдельные следы ударов для двух изотопов неона-20 и неона-22.
Неон — второй по легкости инертный газ. Неон имеет три стабильных изотопа : Ne (90,48%), Ne (0,27%) и Ne (9,25%). Ne и Ne частично первичны и частично нуклеогенны (т.е. образуются в результате ядерных реакций других нуклидов с нейтронами или другими частицами в окружающей среде) и их вариации в естественном содержании Хорошо поняли. Напротив, Ne (главный первичный изотоп, образованный в звездном нуклеосинтезе ), как известно, не является нуклеогенным или радиогенным. Таким образом, горячо обсуждаются причины изменения Ne на Земле.
Основные ядерные реакции, генерирующие нуклеогенные неоновые изотопы, начинаются с Mg и Mg, которые производят Ne и Ne соответственно, после захвата нейтронов и немедленного выброса альфа-частицы. нейтроны, которые вызывают реакции, в основном образуются в результате вторичных реакций расщепления от альфа-частиц, которые, в свою очередь, происходят из цепочек распада урана серии . Конечный результат дает тенденцию к более низким отношениям Ne / Ne и более высоким отношениям Ne / Ne, наблюдаемым в богатых ураном породах, таких как граниты. Ne также может образовываться в нуклеогенной реакции, когда Ne поглощает нейтрон от различных естественные земные источники нейтронов.
Кроме того, изотопный анализ обнаженных земных горных пород продемонстрировал космогенное (космические лучи) образование Ne. Этот изотоп образуется в результате реакций расщепления на магнии, натрия, кремнии и алюминии. Анализируя все три изотопа, можно выделить космогенный компонент из магматического неона и нуклеогенного неона. Это говорит о том, что неон будет полезным инструментом для определения возраста космического воздействия поверхностных пород и метеоритов.
Подобно ксенону, содержание неона, наблюдаемое в образцах вулканических газы обогащены Ne и нуклеогенным Ne по отношению к содержанию Ne. Изотопное содержание неона в этих образцах, полученных из мантии, представляет собой внеатмосферный источник неона. Компоненты, обогащенные Ne, относятся к экзотическим первичным компонентам инертного газа на Земле, возможно, представляющим солнечный неон. Повышенное содержание Ne обнаружено в алмазах, что дополнительно указывает на наличие солнечно-неонового резервуара на Земле.
Характеристики
Неон является вторым по легкости благородным газом после гелий. Он светится красновато-оранжевым светом в вакуумной газоразрядной трубке . Кроме того, у неона самый узкий диапазон жидкостей из всех элементов: от 24,55 до 27,05 К (от -248,45 ° C до -245,95 ° C или от -415,21 ° F до -410,71 ° F). Его холодопроизводительность (на единицу объема) более чем в 40 раз выше, чем у жидкого гелия и в три раза больше, чем у жидкого водорода. В большинстве случаев это менее дорогой хладагент, чем гелий.

Неоновая плазма имеет наиболее интенсивный свет разряд при нормальных напряжениях и токах всех благородных газов. Средний цвет этого света для человеческого глаза красно-оранжевый из-за множества линий в этом диапазоне; он также содержит яркую зеленую линию, которая скрыта, если визуальные компоненты не рассредоточены с помощью спектроскопа.
Обычно используются два совершенно разных типа неонового освещения. Неоновые лампы накаливания, как правило, крошечные, большинство из которых работают от 100 до 250 вольт. Они широко используются в качестве индикаторов включения и в оборудовании для тестирования цепей, но светодиоды (светодиоды) сейчас преобладают в этих приложениях. Эти простые неоновые устройства были предшественниками плазменных дисплеев и экранов плазменных телевизоров. Неоновые вывески обычно работают при гораздо более высоких напряжениях (2–15 киловольт ), а световые трубки обычно имеют длину в несколько метров. Стеклянные трубки часто имеют формы и буквы для вывесок, а также для архитектурных и художественных приложений.

Происхождение
Стабильные изотопы неона образуются в звездах. Самый распространенный изотоп неона Ne (90,48%) создается в результате ядерного синтеза углерода и углерода в процессе сжигания углерода звездного нуклеосинтеза. Для этого требуются температуры выше 500 мегакельвинов, которые встречаются в ядрах звезд с массой более 8 солнечных масс.
Неон широко распространен в мировом масштабе; это пятый по численности химический элемент во Вселенной по массе после водорода, гелия, кислорода и углерода (см. химический элемент ). Его относительная редкость на Земле, как и гелий, объясняется его относительной легкостью, высоким давлением пара при очень низких температурах и химической инертностью — всеми свойствами, которые не позволяют ему попасть в конденсирующиеся газовые и пылевые облака, которые сформировали меньшие и более теплые твердые планеты, такие как Земля.

Неон одноатомный, что делает его легче, чем молекулы двухатомного азота и кислорода, которые составляют основную часть атмосферы Земли; воздушный шар, наполненный неоном, поднимется в воздух, хотя и медленнее, чем гелиевый шар.
Обилие неона во Вселенной составляет примерно 1 часть из 750; на Солнце и, предположительно, в туманности прото-Солнечной системы, примерно 1 часть из 600. Космический аппарат Galileo атмосферный входной зонд обнаружил, что даже в верхних слоях атмосферы Юпитера количество неона уменьшается (истощается) примерно в 10 раз, до уровня 1 части на 6000 по массе. Это может указывать на то, что даже ледяные планетезимали, которые принесли неон на Юпитер из внешней солнечной системы, сформировались в области, которая была слишком теплой, чтобы удерживать неоновую атмосферную составляющую (содержание более тяжелых инертных газов на Юпитере несколько раз больше, чем на Солнце).
Неон составляет 1 часть из 55000 в атмосфере Земли, или 18,2 частей на миллион по объему (это примерно столько же, сколько молекула или мольная доля), или 1 часть на 79 000 воздуха по массе. Он составляет меньшую долю корки. Промышленно он производится путем криогенной фракционной перегонки сжиженного воздуха.
17 августа 2015 года, на основе исследований с космическим кораблем Lunar Atmosphere and Dust Environment Explorer (LADEE), Ученые НАСА сообщили об обнаружении неона в экзосфере луны.
Химия
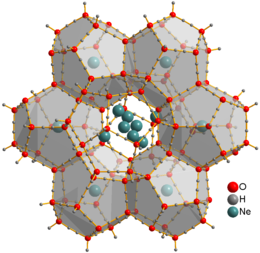
Неон является первым p -блок благородный газ и первый элемент с истинным октетом электронов. Он инертен : как и его более легкий аналог, гелий, прочно связанные нейтральные молекулы, содержащие неон, не идентифицированы. Ионы [Ne Ar ], [Ne H ] и [HeNe] наблюдались с помощью оптических и масс-спектрометрических исследований. Твердый гидрат клатрата неона был получен из водяного льда и неонового газа при давлениях 0,35–0,48 ГПа и температурах около -30 ° C. Атомы Ne не связаны с водой и могут свободно перемещаться через этот материал. Их можно извлечь, поместив клатрат в вакуумную камеру на несколько дней, получив лед XVI, наименее плотную кристаллическую форму воды.
Знакомая шкала электроотрицательности Полинга зависит от энергий химической связи, но такие значения, очевидно, не измерялись для инертного гелия и неона. Шкала электроотрицательности Аллена, которая полагается только на (измеримые) атомные энергии, определяет неон как наиболее электроотрицательный элемент, за которым следуют фтор и гелий.
Приложения
Неон часто используется в знаках и дает безошибочно яркий красновато-оранжевый свет. Хотя ламповые светильники других цветов часто называют «неоновыми», они используют различные благородные газы или различные цвета флуоресцентного освещения.
Неон используется в электронных лампах, высоковольтных индикаторах, молниеотводах, измерителях волн, телевизионных лампах, и гелий-неоновые лазеры. Сжиженный неон коммерчески используется в качестве криогенного хладагента в приложениях, не требующих более низкого диапазона температур, достигаемого при более экстремальном охлаждении жидким гелием.
Неон, как жидкость или газ, относительно дорог — при небольших количествах цена жидкого неона может быть более чем в 55 раз дороже жидкого гелия. Расходы на неон — это редкость неона, который, в отличие от гелия, можно получить только из воздуха.
Тройная точка температура неона (24,5561 K) является определяющей фиксированной точкой в Международной температурной шкале 1990 г..
См. Также
- Коэффициент расширения
- Неоновая вывеска
- Неоновая лампа
Ссылки
Внешние ссылки
- Неон на Периодическая таблица видео (Университет Ноттингема)
- WebElements.com — Неон.
- Это элементаль — Неон
- Периодическая таблица Геологической службы США — Неон
- Атомный спектр неона
- Музей неона, Лас-Вегас