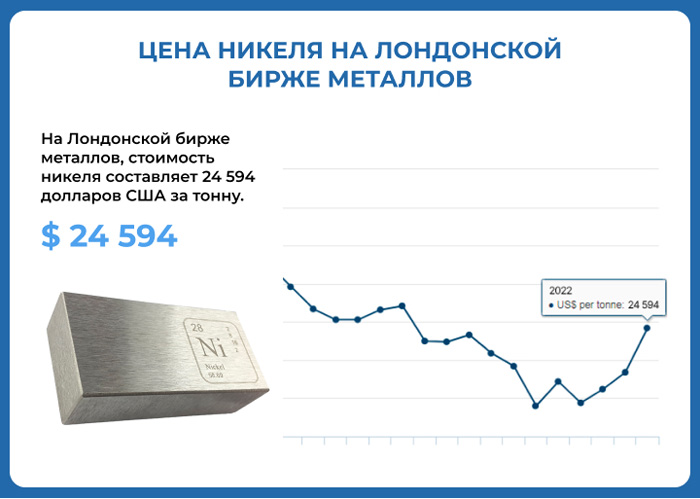
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nickel | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
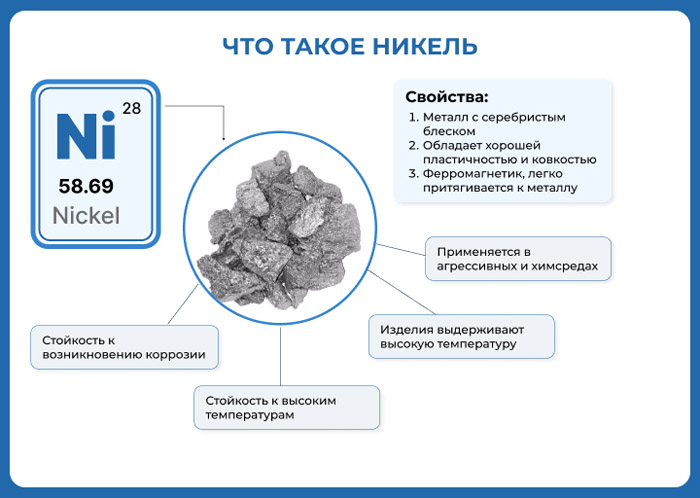
| Appearance | lustrous, metallic, and silver with a gold tinge | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Standard atomic weight Ar°(Ni) |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nickel in the periodic table | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic number (Z) | 28 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Group | group 10 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Period | period 4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Block | d-block | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electron configuration | [Ar] 3d8 4s2 or [Ar] 3d9 4s1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrons per shell | 2, 8, 16, 2 or 2, 8, 17, 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physical properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase at STP | solid | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Melting point | 1728 K (1455 °C, 2651 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Boiling point | 3003 K (2730 °C, 4946 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Density (near r.t.) | 8.908 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| when liquid (at m.p.) | 7.81 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of fusion | 17.48 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of vaporization | 379 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar heat capacity | 26.07 J/(mol·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Vapor pressure
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidation states | −2, −1, 0, +1,[2] +2, +3, +4[3] (a mildly basic oxide) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegativity | Pauling scale: 1.91 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ionization energies |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic radius | empirical: 124 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Covalent radius | 124±4 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waals radius | 163 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Spectral lines of nickel |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Other properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Natural occurrence | primordial | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
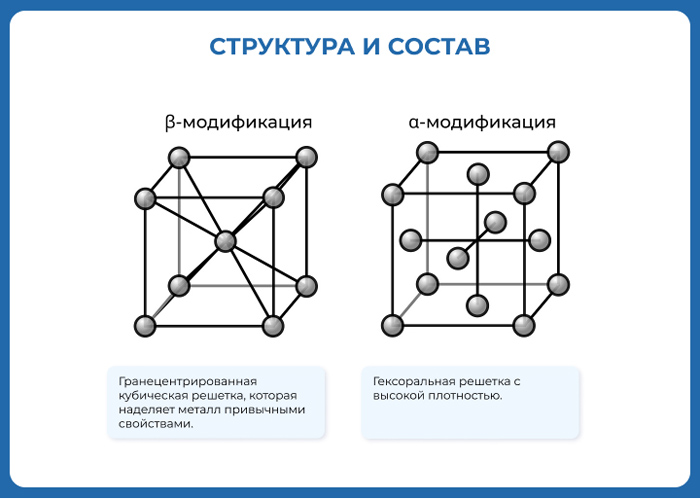
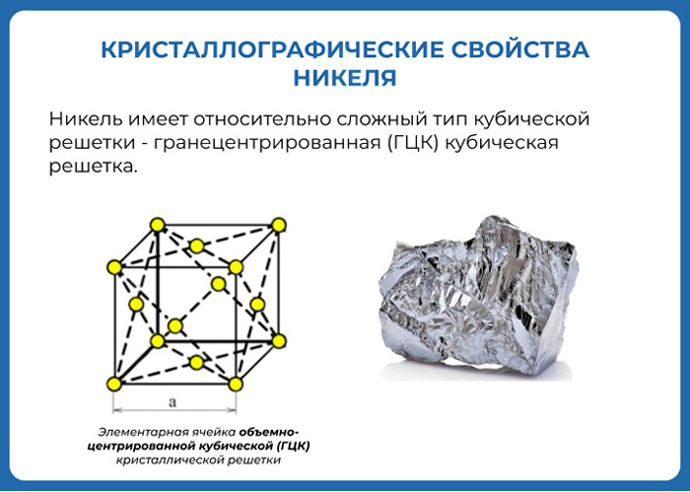
| Crystal structure | face-centered cubic (fcc)
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Speed of sound thin rod | 4900 m/s (at r.t.) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermal expansion | 13.4 µm/(m⋅K) (at 25 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermal conductivity | 90.9 W/(m⋅K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrical resistivity | 69.3 nΩ⋅m (at 20 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetic ordering | ferromagnetic | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Young’s modulus | 200 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Shear modulus | 76 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bulk modulus | 180 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Poisson ratio | 0.31 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mohs hardness | 4.0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vickers hardness | 638 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Brinell hardness | 667–1600 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS Number | 7440-02-0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| History | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Discovery and first isolation | Axel Fredrik Cronstedt (1751) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Main isotopes of nickel
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| references |
Nickel is a chemical element with symbol Ni and atomic number 28. It is a silvery-white lustrous metal with a slight golden tinge. Nickel is a hard and ductile transition metal. Pure nickel is chemically reactive but large pieces are slow to react with air under standard conditions because a passivation layer of nickel oxide forms on the surface that prevents further corrosion. Even so, pure native nickel is found in Earth’s crust only in tiny amounts, usually in ultramafic rocks,[4][5] and in the interiors of larger nickel–iron meteorites that were not exposed to oxygen when outside Earth’s atmosphere.
Meteoric nickel is found in combination with iron, a reflection of the origin of those elements as major end products of supernova nucleosynthesis. An iron–nickel mixture is thought to compose Earth’s outer and inner cores.[6]
Use of nickel (as natural meteoric nickel–iron alloy) has been traced as far back as 3500 BCE. Nickel was first isolated and classified as an element in 1751 by Axel Fredrik Cronstedt, who initially mistook the ore for a copper mineral, in the cobalt mines of Los, Hälsingland, Sweden. The element’s name comes from a mischievous sprite of German miner mythology, Nickel (similar to Old Nick), who personified the fact that copper-nickel ores resisted refinement into copper. An economically important source of nickel is the iron ore limonite, which is often 1–2% nickel. Other important nickel ore minerals include pentlandite and a mix of Ni-rich natural silicates known as garnierite. Major production sites include the Sudbury region, Canada (which is thought to be of meteoric origin), New Caledonia in the Pacific, and Norilsk, Russia.
Nickel is one of four elements (the others are iron, cobalt, and gadolinium)[7] that are ferromagnetic at about room temperature. Alnico permanent magnets based partly on nickel are of intermediate strength between iron-based permanent magnets and rare-earth magnets. The metal is used chiefly in alloys and corrosion-resistant plating. About 68% of world production is used in stainless steel. A further 10% is used for nickel-based and copper-based alloys, 9% for plating, 7% for alloy steels, 3% in foundries, and 4% in other applications such as in rechargeable batteries,[8] including those in electric vehicles (EVs).[9] Nickel is widely used in coins, though nickel-plated objects sometimes provoke nickel allergy. As a compound, nickel has a number of niche chemical manufacturing uses, such as a catalyst for hydrogenation, cathodes for rechargeable batteries, pigments and metal surface treatments.[10] Nickel is an essential nutrient for some microorganisms and plants that have enzymes with nickel as an active site.[11]
Properties
Atomic and physical properties
Nickel is a silvery-white metal with a slight golden tinge that takes a high polish. It is one of only four elements that are ferromagnetic at or near room temperature; the others are iron, cobalt and gadolinium. Its Curie temperature is 355 °C (671 °F), meaning that bulk nickel is non-magnetic above this temperature.[13][7] The unit cell of nickel is a face-centered cube with the lattice parameter of 0.352 nm, giving an atomic radius of 0.124 nm. This crystal structure is stable to pressures of at least 70 GPa. Nickel is hard, malleable and ductile, and has a relatively high electrical and thermal conductivity for transition metals.[14] The high compressive strength of 34 GPa, predicted for ideal crystals, is never obtained in the real bulk material due to formation and movement of dislocations. However, it has been reached in Ni nanoparticles.[15]
Electron configuration dispute
Nickel has two atomic electron configurations, [Ar] 3d8 4s2 and [Ar] 3d9 4s1, which are very close in energy; [Ar] denotes the complete argon core structure. There is some disagreement on which configuration has the lower energy.[16] Chemistry textbooks quote nickel’s electron configuration as [Ar] 4s2 3d8,[17] also written [Ar] 3d8 4s2.[18] This configuration agrees with the Madelung energy ordering rule, which predicts that 4s is filled before 3d. It is supported by the experimental fact that the lowest energy state of the nickel atom is a 3d8 4s2 energy level, specifically the 3d8(3F) 4s2 3F, J = 4 level.[19]
However, each of these two configurations splits into several energy levels due to fine structure,[19] and the two sets of energy levels overlap. The average energy of states with [Ar] 3d9 4s1 is actually lower than the average energy of states with [Ar] 3d8 4s2. Therefore, the research literature on atomic calculations quotes the ground state configuration as [Ar] 3d9 4s1.[16]
Isotopes
The isotopes of nickel range in atomic weight from 48 u (48
Ni) to 78 u (78
Ni).[20]
Natural nickel is composed of five stable isotopes, 58
Ni, 60
Ni, 61
Ni, 62
Ni and 64
Ni, of which 58
Ni is the most abundant (68.077% natural abundance).[20]
Nickel-62 has the highest binding energy per nucleon of any nuclide: 8.7946 MeV/nucleon.[21][22] Its binding energy is greater than both 56
Fe and 58
Fe, more abundant nuclides often incorrectly cited as having the highest binding energy.[23] Though this would seem to predict nickel as the most abundant heavy element in the universe, the high rate of photodisintegration of nickel in stellar interiors causes iron to be by far the most abundant.[23]
Nickel-60 is the daughter product of the extinct radionuclide 60
Fe (half-life 2.6 million years). Due to the long half-life of 60
Fe, its persistence in materials in the Solar System may generate observable variations in the isotopic composition of 60
Ni. Therefore, the abundance of 60
Ni in extraterrestrial material may give insight into the origin of the Solar System and its early history.[24]
At least 26 nickel radioisotopes have been characterized; the most stable are 59
Ni with half-life 76,000 years, 63
Ni (100 years), and 56
Ni (6 days). All other radioisotopes have half-lives less than 60 hours and most these have half-lives less than 30 seconds. This element also has one meta state.[20]
Radioactive nickel-56 is produced by the silicon burning process and later set free in large amounts in type Ia supernovae. The shape of the light curve of these supernovae at intermediate to late-times corresponds to the decay via electron capture of 56
Ni to cobalt-56 and ultimately to iron-56.[25] Nickel-59 is a long-lived cosmogenic radionuclide; half-life 76,000 years. 59
Ni has found many applications in isotope geology. 59
Ni has been used to date the terrestrial age of meteorites and to determine abundances of extraterrestrial dust in ice and sediment. The half-life of nickel-78 was recently measured at 110 milliseconds, and is believed an important isotope in supernova nucleosynthesis of elements heavier than iron.[26] 48Ni, discovered in 1999, is the most proton-rich heavy element isotope known. With 28 protons and 20 neutrons, 48Ni is «doubly magic», as is 78Ni with 28 protons and 50 neutrons. Both are therefore unusually stable for nuclei with so large a proton–neutron imbalance.[20][27]
Nickel-63 is a contaminant found in the support structure of nuclear reactors. It is produced through neutron capture by nickel-62. Small amounts have also been found near nuclear weapon test sites in the South Pacific.[28]
Occurrence
Widmanstätten pattern showing the two forms of nickel-iron, kamacite and taenite, in an octahedrite meteorite
On Earth, nickel occurs most often in combination with sulfur and iron in pentlandite, with sulfur in millerite, with arsenic in the mineral nickeline, and with arsenic and sulfur in nickel galena.[29] Nickel is commonly found in iron meteorites as the alloys kamacite and taenite. Nickel in meteorites was first detected in 1799 by Joseph-Louis Proust, a French chemist who then worked in Spain. Proust analyzed samples of the meteorite from Campo del Cielo (Argentina), which had been obtained in 1783 by Miguel Rubín de Celis, discovering the presence in them of nickel (about 10%) along with iron.[30]
The bulk of nickel is mined from two types of ore deposits. The first is laterite, where the principal ore mineral mixtures are nickeliferous limonite, (Fe,Ni)O(OH), and garnierite (a mixture of various hydrous nickel and nickel-rich silicates). The second is magmatic sulfide deposits, where the principal ore mineral is pentlandite: (Ni,Fe)9S8.[31]
Indonesia and Australia have the biggest estimated reserves, at 43.6% of world total.[32]
Identified land-based resources throughout the world averaging 1% nickel or greater comprise at least 130 million tons of nickel (about the double of known reserves). About 60% is in laterites and 40% in sulfide deposits.[33]
On geophysical evidence, most of the nickel on Earth is believed to be in Earth’s outer and inner cores. Kamacite and taenite are naturally occurring alloys of iron and nickel. For kamacite, the alloy is usually in the proportion of 90:10 to 95:5, though impurities (such as cobalt or carbon) may be present. Taenite is 20% to 65% nickel. Kamacite and taenite are also found in nickel iron meteorites.[34]
Compounds
The most common oxidation state of nickel is +2, but compounds of Ni0, Ni+, and Ni3+ are well known, and the exotic oxidation states Ni2− and Ni− have been produced and studied.[35]
Nickel(0)
Nickel tetracarbonyl (Ni(CO)4), discovered by Ludwig Mond,[36] is a volatile, highly toxic liquid at room temperature. On heating, the complex decomposes back to nickel and carbon monoxide:
- Ni(CO)4 ⇌ Ni + 4 CO
This behavior is exploited in the Mond process for purifying nickel, as described above. The related nickel(0) complex bis(cyclooctadiene)nickel(0) is a useful catalyst in organonickel chemistry because the cyclooctadiene (or cod) ligands are easily displaced.
Nickel(I)
Structure of
[Ni2(CN)6]4− ion[37]
Nickel(I) complexes are uncommon, but one example is the tetrahedral complex NiBr(PPh3)3. Many nickel(I) complexes have Ni–Ni bonding, such as the dark red diamagnetic K4[Ni2(CN)6] prepared by reduction of K2[Ni2(CN)6] with sodium amalgam. This compound is oxidized in water, liberating H2.[37]
It is thought that the nickel(I) oxidation state is important to nickel-containing enzymes, such as [NiFe]-hydrogenase, which catalyzes the reversible reduction of protons to H2.[38]
Nickel(II)
Color of various Ni(II) complexes in aqueous solution. From left to right,
[Ni(NH3)6]2+,
[Ni(NH2CH2CH2NH2)]2+,
[NiCl4]2−,
[Ni(H2O)6]2+
Nickel(II) forms compounds with all common anions, including sulfide, sulfate, carbonate, hydroxide, carboxylates, and halides. Nickel(II) sulfate is produced in large amounts by dissolving nickel metal or oxides in sulfuric acid, forming both a hexa- and heptahydrate[39] useful for electroplating nickel. Common salts of nickel, such as chloride, nitrate, and sulfate, dissolve in water to give green solutions of the metal aquo complex [Ni(H2O)6]2+.[40]
The four halides form nickel compounds, which are solids with molecules with octahedral Ni centres. Nickel(II) chloride is most common, and its behavior is illustrative of the other halides. Nickel(II) chloride is made by dissolving nickel or its oxide in hydrochloric acid. It is usually found as the green hexahydrate, whose formula is usually written NiCl2·6H2O. When dissolved in water, this salt forms the metal aquo complex [Ni(H2O)6]2+. Dehydration of NiCl2·6H2O gives yellow anhydrous NiCl2.[41]
Some tetracoordinate nickel(II) complexes, e.g. bis(triphenylphosphine)nickel chloride, exist both in tetrahedral and square planar geometries. The tetrahedral complexes are paramagnetic; the square planar complexes are diamagnetic. In having properties of magnetic equilibrium and formation of octahedral complexes, they contrast with the divalent complexes of the heavier group 10 metals, palladium(II) and platinum(II), which form only square-planar geometry.[35]
Nickelocene is known; it has an electron count of 20, making it relatively unstable.[citation needed][42]
Nickel(III) and (IV)
Many Ni(III) compounds are known. The first such compounds are [Ni(PR3)2X2], where X = Cl, Br, I and R = ethyl, propyl, butyl.[43] Further, Ni(III) forms simple salts with fluoride[44] or oxide ions. Ni(III) can be stabilized by σ-donor ligands such as thiols and organophosphines.[37]
Ni(III) occurs in nickel oxide hydroxide, which is used as the cathode in many rechargeable batteries, including nickel-cadmium, nickel-iron, nickel hydrogen, and nickel-metal hydride, and used by certain manufacturers in Li-ion batteries.[45]
Ni(IV) occurs in the mixed oxide BaNiO3. Ni(IV) remains a rare oxidation state and very few compounds are known.[46][47][48][49]
History
Because nickel ores are easily mistaken for ores of silver and copper, understanding of this metal and its use, is relatively recent. But unintentional use of nickel is ancient, and can be traced back as far as 3500 BCE. Bronzes from what is now Syria have been found to contain as much as 2% nickel.[50] Some ancient Chinese manuscripts suggest that «white copper» (cupronickel, known as baitong) was used there in 1700-1400 BCE. This Paktong white copper was exported to Britain as early as the 17th century, but the nickel content of this alloy was not discovered until 1822.[51] Coins of nickel-copper alloy were minted by Bactrian kings Agathocles, Euthydemus II, and Pantaleon in the 2nd century BCE, possibly out of the Chinese cupronickel.[52]
In medieval Germany, a metallic yellow mineral was found in the Erzgebirge (Ore Mountains) that resembled copper ore. But when miners were unable to get any copper from it, they blamed a mischievous sprite of German mythology, Nickel (similar to Old Nick), for besetting the copper. They called this ore Kupfernickel from German Kupfer ‘copper’.[53][54][55][56] This ore is now known as the mineral nickeline (formerly niccolite[57]), a nickel arsenide. In 1751, Baron Axel Fredrik Cronstedt tried to extract copper from kupfernickel at a cobalt mine in the village of Los, Sweden, and instead produced a white metal that he named nickel after the spirit that had given its name to the mineral.[58] In modern German, Kupfernickel or Kupfer-Nickel designates the alloy cupronickel.[14]
Originally, the only source for nickel was the rare Kupfernickel. Beginning in 1824, nickel was obtained as a byproduct of cobalt blue production. The first large-scale smelting of nickel began in Norway in 1848 from nickel-rich pyrrhotite. The introduction of nickel in steel production in 1889 increased the demand for nickel; the nickel deposits of New Caledonia, discovered in 1865, provided most of the world’s supply between 1875 and 1915. The discovery of the large deposits in the Sudbury Basin, Canada in 1883, in Norilsk-Talnakh, Russia in 1920, and in the Merensky Reef, South Africa in 1924, made large-scale nickel production possible.[51]
Coinage
Aside from the aforementioned Bactrian coins, nickel was not a component of coins until the mid-19th century.[citation needed]
Canada
99.9% nickel five-cent coins were struck in Canada (the world’s largest nickel producer at the time) during non-war years from 1922 to 1981; the metal content made these coins magnetic.[59] During the war years 1942–45, most or all nickel was removed from Canadian and US coins to save it for making armor.[54][60] Canada used 99.9% nickel from 1968 in its higher-value coins until 2000.[citation needed]
Switzerland
Coins of nearly pure nickel were first used in 1881 in Switzerland.[61]
United Kingdom
Birmingham forged nickel coins in c. 1833 for trading in Malaysia.[62]
United States
In the United States, the term «nickel» or «nick» originally applied to the copper-nickel Flying Eagle cent, which replaced copper with 12% nickel 1857–58, then the Indian Head cent of the same alloy from 1859 to 1864. Still later, in 1865, the term designated the three-cent nickel, with nickel increased to 25%. In 1866, the five-cent shield nickel (25% nickel, 75% copper) appropriated the designation, which has been used ever since for the subsequent 5-cent pieces. This alloy proportion is not ferromagnetic.
The US nickel coin contains 0.04 ounces (1.1 g) of nickel, which at the April 2007 price was worth 6.5 cents, along with 3.75 grams of copper worth about 3 cents, with a total metal value of more than 9 cents. Since the face value of a nickel is 5 cents, this made it an attractive target for melting by people wanting to sell the metals at a profit. The United States Mint, anticipating this practice, implemented new interim rules on December 14, 2006, subject to public comment for 30 days, which criminalized the melting and export of cents and nickels.[63] Violators can be punished with a fine of up to $10,000 and/or a maximum of five years in prison.[64] As of September 19, 2013, the melt value of a US nickel (copper and nickel included) is $0.045 (90% of the face value).[65]
Current use
In the 21st century, the high price of nickel has led to some replacement of the metal in coins around the world. Coins still made with nickel alloys include one- and two-euro coins, 5¢, 10¢, 25¢, 50¢, and $1 U.S. coins,[66] and 20p, 50p, £1, and £2 UK coins. From 2012 on the nickel-alloy used for 5p and 10p UK coins was replaced with nickel-plated steel. This ignited a public controversy regarding the problems of people with nickel allergy.[61]
World production
Time trend of nickel production[67]
Nickel ores grade evolution in some leading nickel producing countries or regions.
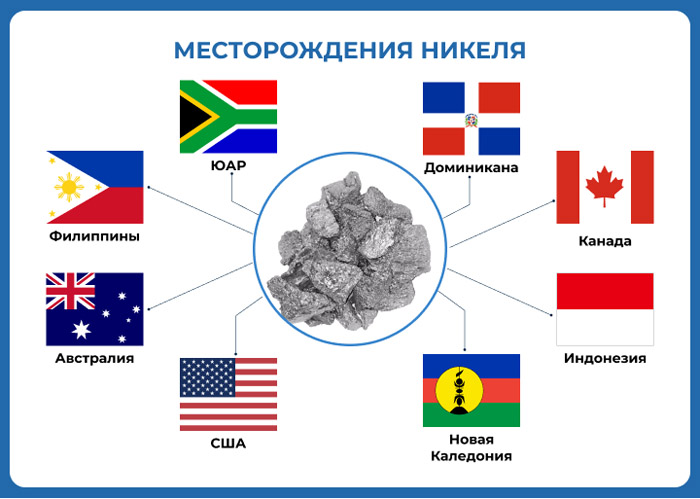
An estimated 2.7 million tonnes (t) of nickel per year are mined worldwide; Indonesia (1,000,000 t), the Philippines (370,000 t), Russia (250,000 t), New Caledonia (France) (190,000 t), Australia (160,000 t) and Canada (130,000 t) are the largest producers as of 2021.[68] The largest nickel deposits in non-Russian Europe are in Finland and Greece. Identified land-based sources averaging at least 1% nickel contain at least 130 million tonnes of nickel. About 60% is in laterites and 40% is in sulfide deposits. Also, extensive nickel sources are found in the depths of the Pacific Ocean, especially in an area called the Clarion Clipperton Zone in the form of polymetallic nodules peppering the seafloor at 3.5–6 km below sea level.[69][70] These nodules are composed of numerous rare-earth metals and are estimated to be 1.7% nickel.[71] With advances in science and engineering, regulation is currently being set in place by the International Seabed Authority to ensure that these nodules are collected in an environmentally conscientious manner while adhering to the United Nations Sustainable Development Goals.[72]
The one place in the United States where nickel has been profitably mined is Riddle, Oregon, with several square miles of nickel-bearing garnierite surface deposits. The mine closed in 1987.[73][74] The Eagle mine project is a new nickel mine in Michigan’s Upper Peninsula. Construction was completed in 2013, and operations began in the third quarter of 2014.[75] In the first full year of operation, the Eagle Mine produced 18,000 t.[75]
Production
Evolution of the annual nickel extraction, according to ores.
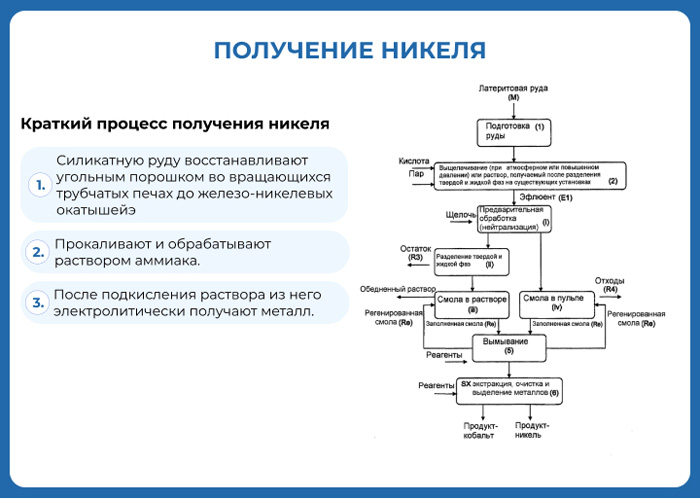
Nickel is obtained through extractive metallurgy: it is extracted from ore by conventional roasting and reduction processes that yield metal of greater than 75% purity. In many stainless steel applications, 75% pure nickel can be used without further purification, depending on impurities.[39]
Traditionally, most sulfide ores are processed using pyrometallurgical techniques to produce a matte for further refining. Recent advances in hydrometallurgical techniques result in significantly purer metallic nickel product. Most sulfide deposits have traditionally been processed by concentration through a froth flotation process followed by pyrometallurgical extraction. In hydrometallurgical processes, nickel sulfide ores are concentrated with flotation (differential flotation if Ni/Fe ratio is too low) and then smelted. The nickel matte is further processed with the Sherritt-Gordon process. First, copper is removed by adding hydrogen sulfide, leaving a concentrate of cobalt and nickel. Then, solvent extraction is used to separate the cobalt and nickel, with the final nickel content greater than 99%.[citation needed]
Electrorefining
A second common refining process is leaching the metal matte into a nickel salt solution, followed by electrowinning the nickel from solution by plating it onto a cathode as electrolytic nickel.[76]
Mond process
The purest metal is obtained from nickel oxide by the Mond process, which gives a purity of over 99.99%.[77] The process was patented by Ludwig Mond and has been in industrial use since before the beginning of the 20th century. In this process, nickel is reacted with carbon monoxide in the presence of a sulfur catalyst at around 40–80 °C to form nickel carbonyl. In a similar reaction with iron, iron pentacarbonyl can form, though this reaction is slow. If necessary, the nickel may be separated by distillation. Dicobalt octacarbonyl is also formed in nickel distillation as a by-product, but it decomposes to tetracobalt dodecacarbonyl at the reaction temperature to give a non-volatile solid.[78]
Nickel is obtained from nickel carbonyl by one of two processes. It may be passed through a large chamber at high temperatures in which tens of thousands of nickel spheres (pellets) are constantly stirred. The carbonyl decomposes and deposits pure nickel onto the spheres. In the alternate process, nickel carbonyl is decomposed in a smaller chamber at 230 °C to create a fine nickel powder. The byproduct carbon monoxide is recirculated and reused. The highly pure nickel product is known as «carbonyl nickel».[79]
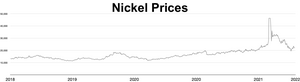
Market value
The market price of nickel surged throughout 2006 and the early months of 2007; as of April 5, 2007, the metal was trading at US$52,300/tonne or $1.47/oz.[80] The price later fell dramatically; as of September 2017, the metal was trading at $11,000/tonne, or $0.31/oz.[81] During the 2022 Russian invasion of Ukraine, worries about sanctions on Russian nickel exports triggered a short squeeze, causing the price of nickel to quadruple in just two days, reaching US$100,000 per tonne.[82][83] The London Metal Exchange cancelled contracts worth $3.9 billion and suspended nickel trading for over a week.[84] Analyst Andy Home argued that such price shocks are exacerbated by the purity requirements imposed by metal markets: only Grade I (99.8% pure) metal can be used as a commodity on the exchanges, but most of the world’s supply is either in ferro-nickel alloys or lower-grade purities.[85]
Applications
Nickel foam (top) and its internal structure (bottom)
Global use of nickel is currently 68% in stainless steel, 10% in nonferrous alloys, 9% electroplating, 7% alloy steel, 3% foundries, and 4% other (including batteries).[8]
Nickel is used in many recognizable industrial and consumer products, including stainless steel, alnico magnets, coinage, rechargeable batteries (e.g. nickel-iron), electric guitar strings, microphone capsules, plating on plumbing fixtures,[86] and special alloys such as permalloy, elinvar, and invar. It is used for plating and as a green tint in glass. Nickel is preeminently an alloy metal, and its chief use is in nickel steels and nickel cast irons, in which it typically increases the tensile strength, toughness, and elastic limit. It is widely used in many other alloys, including nickel brasses and bronzes and alloys with copper, chromium, aluminium, lead, cobalt, silver, and gold (Inconel, Incoloy, Monel, Nimonic).[76]
A «horseshoe magnet» made of alnico nickel alloy.
Because nickel is resistant to corrosion, it was occasionally used as a substitute for decorative silver. Nickel was also occasionally used in some countries after 1859 as a cheap coinage metal (see above), but in the later years of the 20th century, it was replaced by cheaper stainless steel (i.e., iron) alloys, except in the United States and Canada.[citation needed]
Nickel is an excellent alloying agent for certain precious metals and is used in the fire assay as a collector of platinum group elements (PGE). As such, nickel can fully collect all six PGEs from ores, and can partially collect gold. High-throughput nickel mines may also do PGE recovery (mainly platinum and palladium); examples are Norilsk, Russia and the Sudbury Basin, Canada.[87]
Nickel foam or nickel mesh is used in gas diffusion electrodes for alkaline fuel cells.[88][89]
Nickel and its alloys are often used as catalysts for hydrogenation reactions. Raney nickel, a finely divided nickel-aluminium alloy, is one common form, though related catalysts are also used, including Raney-type catalysts.[citation needed]
Nickel is naturally magnetostrictive: in the presence of a magnetic field, the material undergoes a small change in length.[90][91] The magnetostriction of nickel is on the order of 50 ppm and is negative, indicating that it contracts.[92]
Nickel is used as a binder in the cemented tungsten carbide or hardmetal industry and used in proportions of 6% to 12% by weight. Nickel makes the tungsten carbide magnetic and adds corrosion-resistance to the cemented parts, though the hardness is less than those with cobalt binder.[93]
63
Ni, with half-life 100.1 years, is useful in krytron devices as a beta particle (high-speed electron) emitter to make ionization by the keep-alive electrode more reliable.[94] It is being investigated as a power source for betavoltaic batteries.[95][96]
Around 27% of all nickel production is used for engineering, 10% for building and construction, 14% for tubular products, 20% for metal goods, 14% for transport, 11% for electronic goods, and 5% for other uses.[8]
Raney nickel is widely used for hydrogenation of unsaturated oils to make margarine, and substandard margarine and leftover oil may contain nickel as a contaminant. Forte et al. found that type 2 diabetic patients have 0.89 ng/mL of Ni in the blood relative to 0.77 ng/mL in control subjects.[97]
Biological role
It was not recognized until the 1970s, but nickel is known to play an important role in the biology of some plants, bacteria, archaea, and fungi.[98][99][100] Nickel enzymes such as urease are considered virulence factors in some organisms.[101][102] Urease catalyzes hydrolysis of urea to form ammonia and carbamate.[99][98] NiFe hydrogenases can catalyze oxidation of H2 to form protons and electrons; and also the reverse reaction, the reduction of protons to form hydrogen gas.[99][98] A nickel-tetrapyrrole coenzyme, cofactor F430, is present in methyl coenzyme M reductase, which can catalyze the formation of methane, or the reverse reaction, in methanogenic archaea (in +1 oxidation state).[103] One of the carbon monoxide dehydrogenase enzymes consists of an Fe-Ni-S cluster.[104] Other nickel-bearing enzymes include a rare bacterial class of superoxide dismutase[105] and glyoxalase I enzymes in bacteria and several eukaryotic trypanosomal parasites[106] (in other organisms, including yeast and mammals, this enzyme contains divalent Zn2+).[107][108][109][110][111]
Dietary nickel may affect human health through infections by nickel-dependent bacteria, but nickel may also be an essential nutrient for bacteria living in the large intestine, in effect functioning as a prebiotic.[112] The US Institute of Medicine has not confirmed that nickel is an essential nutrient for humans, so neither a Recommended Dietary Allowance (RDA) nor an Adequate Intake have been established. The tolerable upper intake level of dietary nickel is 1 mg/day as soluble nickel salts. Estimated dietary intake is 70 to 100 µg/day; less than 10% is absorbed. What is absorbed is excreted in urine.[113] Relatively large amounts of nickel – comparable to the estimated average ingestion above – leach into food cooked in stainless steel. For example, the amount of nickel leached after 10 cooking cycles into one serving of tomato sauce averages 88 µg.[114][115]
Nickel released from Siberian Traps volcanic eruptions is suspected of helping the growth of Methanosarcina, a genus of euryarchaeote archaea that produced methane in the Permian–Triassic extinction event, the biggest known mass extinction.[116]
Toxicity
| Hazards | |
|---|---|
| GHS labelling: | |
|
Pictograms |
  
|
|
Signal word |
Danger |
|
Hazard statements |
H317, H351, H372, H412 |
|
Precautionary statements |
P201, P202, P260, P264, P270, P272, P273, P280, P302+P352, P308+P313, P333+P313, P363, P405, P501[117] |
| NFPA 704 (fire diamond) |
2 0 0 |
The major source of nickel exposure is oral consumption, as nickel is essential to plants.[118] Typical background concentrations of nickel do not exceed 20 ng/m3 in air, 100 mg/kg in soil, 10 mg/kg in vegetation, 10 μg/L in freshwater and 1 μg/L in seawater.[119] Environmental concentrations may be increased by human pollution. For example, nickel-plated faucets may contaminate water and soil; mining and smelting may dump nickel into wastewater; nickel–steel alloy cookware and nickel-pigmented dishes may release nickel into food. Air may be polluted by nickel ore refining and fossil fuel combustion. Humans may absorb nickel directly from tobacco smoke and skin contact with jewelry, shampoos, detergents, and coins. A less common form of chronic exposure is through hemodialysis as traces of nickel ions may be absorbed into the plasma from the chelating action of albumin.[citation needed]
The average daily exposure is not a threat to human health. Most nickel absorbed by humans is removed by the kidneys and passed out of the body through urine or is eliminated through the gastrointestinal tract without being absorbed. Nickel is not a cumulative poison, but larger doses or chronic inhalation exposure may be toxic, even carcinogenic, and constitute an occupational hazard.[120]
Nickel compounds are classified as human carcinogens[121][122][123][124] based on increased respiratory cancer risks observed in epidemiological studies of sulfidic ore refinery workers.[125] This is supported by the positive results of the NTP bioassays with Ni sub-sulfide and Ni oxide in rats and mice.[126][127] The human and animal data consistently indicate a lack of carcinogenicity via the oral route of exposure and limit the carcinogenicity of nickel compounds to respiratory tumours after inhalation.[128][129] Nickel metal is classified as a suspect carcinogen;[121][122][123] there is consistency between the absence of increased respiratory cancer risks in workers predominantly exposed to metallic nickel[125] and the lack of respiratory tumours in a rat lifetime inhalation carcinogenicity study with nickel metal powder.[130] In the rodent inhalation studies with various nickel compounds and nickel metal, increased lung inflammations with and without bronchial lymph node hyperplasia or fibrosis were observed.[124][126][130][131] In rat studies, oral ingestion of water-soluble nickel salts can trigger perinatal mortality in pregnant animals.[132] Whether these effects are relevant to humans is unclear as epidemiological studies of highly exposed female workers have not shown adverse developmental toxicity effects.[133]
People can be exposed to nickel in the workplace by inhalation, ingestion, and contact with skin or eye. The Occupational Safety and Health Administration (OSHA) has set the legal limit (permissible exposure limit) for the workplace at 1 mg/m3 per 8-hour workday, excluding nickel carbonyl. The National Institute for Occupational Safety and Health (NIOSH) sets the recommended exposure limit (REL) at 0.015 mg/m3 per 8-hour workday. At 10 mg/m3, nickel is immediately dangerous to life and health.[134] Nickel carbonyl [Ni(CO)4] is an extremely toxic gas. The toxicity of metal carbonyls is a function of both the toxicity of the metal and the off-gassing of carbon monoxide from the carbonyl functional groups; nickel carbonyl is also explosive in air.[135][136]
Sensitized persons may show a skin contact allergy to nickel known as a contact dermatitis. Highly sensitized persons may also react to foods with high nickel content.[137] Patients with pompholyx may also be sensitive to nickel. Nickel is the top confirmed contact allergen worldwide, partly due to its use in jewelry for pierced ears.[138] Nickel allergies affecting pierced ears are often marked by itchy, red skin. Many earrings are now made without nickel or with low-release nickel[139] to address this problem. The amount allowed in products that contact human skin is now regulated by the European Union. In 2002, researchers found that the nickel released by 1 and 2 euro coins, far exceeded those standards. This is believed to be due to a galvanic reaction.[140] Nickel was voted Allergen of the Year in 2008 by the American Contact Dermatitis Society.[141] In August 2015, the American Academy of Dermatology adopted a position statement on the safety of nickel: «Estimates suggest that contact dermatitis, which includes nickel sensitization, accounts for approximately $1.918 billion and affects nearly 72.29 million people.»[137]
Reports show that both the nickel-induced activation of hypoxia-inducible factor (HIF-1) and the up-regulation of hypoxia-inducible genes are caused by depletion of intracellular ascorbate. The addition of ascorbate to the culture medium increased the intracellular ascorbate level and reversed both the metal-induced stabilization of HIF-1- and HIF-1α-dependent gene expression.[142][143]
References
- ^ «Standard Atomic Weights: Nickel». CIAAW. 2007.
- ^ Pfirrmann, Stefan; Limberg, Christian; Herwig, Christian; Stößer, Reinhard; Ziemer, Burkhard (2009). «A Dinuclear Nickel(I) Dinitrogen Complex and its Reduction in Single-Electron Steps». Angewandte Chemie International Edition. 48 (18): 3357–61. doi:10.1002/anie.200805862. PMID 19322853.
- ^ Carnes, Matthew; Buccella, Daniela; Chen, Judy Y.-C.; Ramirez, Arthur P.; Turro, Nicholas J.; Nuckolls, Colin; Steigerwald, Michael (2009). «A Stable Tetraalkyl Complex of Nickel(IV)». Angewandte Chemie International Edition. 48 (2): 290–4. doi:10.1002/anie.200804435. PMID 19021174.
- ^ Anthony, John W.; Bideaux, Richard A.; Bladh, Kenneth W.; Nichols, Monte C., eds. (1990). «Nickel» (PDF). Handbook of Mineralogy. Vol. I. Chantilly, VA, US: Mineralogical Society of America. ISBN 978-0962209703.
- ^ «Nickel: Nickel mineral information and data». Mindat.org. Archived from the original on March 3, 2016. Retrieved March 2, 2016.
- ^ Stixrude, Lars; Waserman, Evgeny; Cohen, Ronald (November 1997). «Composition and temperature of Earth’s inner core». Journal of Geophysical Research. 102 (B11): 24729–24740. Bibcode:1997JGR…10224729S. doi:10.1029/97JB02125.
- ^ a b Coey, J. M. D.; Skumryev, V.; Gallagher, K. (1999). «Rare-earth metals: Is gadolinium really ferromagnetic?». Nature. 401 (6748): 35–36. Bibcode:1999Natur.401…35C. doi:10.1038/43363. S2CID 4383791.
- ^ a b c «Nickel Use In Society». Nickel Institute. Archived from the original on September 21, 2017.
- ^ Treadgold, Tim. «Gold Is Hot But Nickel Is Hotter As Demand Grows For Batteries In Electric Vehicles». Forbes. Retrieved October 14, 2020.
- ^ «Nickel Compounds – The Inside Story». Nickel Institute. Archived from the original on August 31, 2018.
- ^ Mulrooney, Scott B.; Hausinger, Robert P. (June 1, 2003). «Nickel uptake and utilization by microorganisms». FEMS Microbiology Reviews. 27 (2–3): 239–261. doi:10.1016/S0168-6445(03)00042-1. ISSN 0168-6445. PMID 12829270.
- ^ Shiozawa, Hidetsugu; Briones-Leon, Antonio; Domanov, Oleg; Zechner, Georg; et al. (2015). «Nickel clusters embedded in carbon nanotubes as high performance magnets». Scientific Reports. 5: 15033. Bibcode:2015NatSR…515033S. doi:10.1038/srep15033. PMC 4602218. PMID 26459370.
- ^ Kittel, Charles (1996). Introduction to Solid State Physics. Wiley. p. 449. ISBN 978-0-471-14286-7.
- ^ a b Hammond, C.R.; Lide, C. R. (2018). «The elements». In Rumble, John R. (ed.). CRC Handbook of Chemistry and Physics (99th ed.). Boca Raton, FL: CRC Press. p. 4.22. ISBN 9781138561632.
- ^ Sharma, A.; Hickman, J.; Gazit, N.; Rabkin, E.; Mishin, Y. (2018). «Nickel nanoparticles set a new record of strength». Nature Communications. 9 (1): 4102. Bibcode:2018NatCo…9.4102S. doi:10.1038/s41467-018-06575-6. PMC 6173750. PMID 30291239.
- ^ a b Scerri, Eric R. (2007). The periodic table: its story and its significance. Oxford University Press. pp. 239–240. ISBN 978-0-19-530573-9.
- ^ Miessler, G.L. and Tarr, D.A. (1999) Inorganic Chemistry 2nd ed., Prentice–Hall. p. 38. ISBN 0138418918.
- ^ Petrucci, R.H. et al. (2002) General Chemistry 8th ed., Prentice–Hall. p. 950. ISBN 0130143294.
- ^ a b NIST Atomic Spectrum Database Archived March 20, 2011, at the Wayback Machine To read the nickel atom levels, type «Ni I» in the Spectrum box and click on Retrieve data.
- ^ a b c d Kondev, F. G.; Wang, M.; Huang, W. J.; Naimi, S.; Audi, G. (2021). «The NUBASE2020 evaluation of nuclear properties» (PDF). Chinese Physics C. 45 (3): 030001. doi:10.1088/1674-1137/abddae.
- ^ Shurtleff, Richard; Derringh, Edward (1989). «The Most Tightly Bound Nuclei». American Journal of Physics. 57 (6): 552. Bibcode:1989AmJPh..57..552S. doi:10.1119/1.15970. Archived from the original on May 14, 2011. Retrieved November 19, 2008.
- ^ «Nuclear synthesis». hyperphysics.phy-astr.gsu.edu. Retrieved October 15, 2020.
- ^ a b Fewell, M. P. (1995). «The atomic nuclide with the highest mean binding energy». American Journal of Physics. 63 (7): 653. Bibcode:1995AmJPh..63..653F. doi:10.1119/1.17828.
- ^ Caldwell, Eric. «Resources on Isotopes». United States Geological Survey. Retrieved May 20, 2022.
- ^ Pagel, Bernard Ephraim Julius (1997). «Further burning stages: evolution of massive stars». Nucleosynthesis and chemical evolution of galaxies. pp. 154–160. ISBN 978-0-521-55958-4.
- ^ Castelvecchi, Davide (April 22, 2005). «Atom Smashers Shed Light on Supernovae, Big Bang». Archived from the original on July 23, 2012. Retrieved November 19, 2008.
- ^ W, P. (October 23, 1999). «Twice-magic metal makes its debut – isotope of nickel». Science News. Archived from the original on May 24, 2012. Retrieved September 29, 2006.
- ^ Carboneau, M. L.; Adams, J. P. (1995). «Nickel-63». National Low-Level Waste Management Program Radionuclide Report Series. 10. doi:10.2172/31669.
- ^ National Pollutant Inventory – Nickel and compounds Fact Sheet Archived December 8, 2011, at the Wayback Machine. Npi.gov.au. Retrieved on January 9, 2012.
- ^ Calvo, Miguel (2019). Construyendo la Tabla Periódica. Zaragoza, Spain: Prames. p. 118. ISBN 978-84-8321-908-9.
- ^ Mudd, Gavin M. (2010). «Global trends and environmental issues in nickel mining: Sulfides versus laterites». Ore Geology Reviews. Elsevier BV. 38 (1–2): 9–26. doi:10.1016/j.oregeorev.2010.05.003. ISSN 0169-1368.
- ^ «Nickel reserves worldwide by country 2020». Statista. Retrieved March 29, 2021.
- ^ Kuck, Peter H. «Mineral Commodity Summaries 2019: Nickel» (PDF). United States Geological Survey. Archived (PDF) from the original on April 21, 2019. Retrieved March 18, 2019.
- ^ Rasmussen, K. L.; Malvin, D. J.; Wasson, J. T. (1988). «Trace element partitioning between taenite and kamacite – Relationship to the cooling rates of iron meteorites». Meteoritics. 23 (2): a107–112. Bibcode:1988Metic..23..107R. doi:10.1111/j.1945-5100.1988.tb00905.x.
- ^ a b Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ^ «The Extraction of Nickel from its Ores by the Mond Process». Nature. 59 (1516): 63–64. 1898. Bibcode:1898Natur..59…63.. doi:10.1038/059063a0.
- ^ a b c Housecroft, C. E.; Sharpe, A. G. (2008). Inorganic Chemistry (3rd ed.). Prentice Hall. p. 729. ISBN 978-0-13-175553-6.
- ^ Housecroft, C. E.; Sharpe, A. G. (2012). Inorganic Chemistry (4th ed.). Prentice Hall. p. 764. ISBN 978-0273742753.
- ^ a b Lascelles, Keith; Morgan, Lindsay G.; Nicholls, David and Beyersmann, Detmar (2019) «Nickel Compounds» in Ullmann’s Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim. doi:10.1002/14356007.a17_235.pub3
- ^ «A Review on the Metal Complex of Nickel (Ii) Salicylhydroxamic Acid and its Aniline Adduct». www.heraldopenaccess.us. Retrieved July 19, 2022.
- ^ «metal — The Reaction Between Nickel and Hydrochloric Acid». Chemistry Stack Exchange. Retrieved July 19, 2022.
- ^ «course hero».
- ^ Jensen, K. A. (1936). «Zur Stereochemie des koordinativ vierwertigen Nickels». Zeitschrift für Anorganische und Allgemeine Chemie. 229 (3): 265–281. doi:10.1002/zaac.19362290304.
- ^ Court, T. L.; Dove, M. F. A. (1973). «Fluorine compounds of nickel(III)». Journal of the Chemical Society, Dalton Transactions (19): 1995. doi:10.1039/DT9730001995.
- ^ «Imara Corporation Launches; New Li-ion Battery Technology for High-Power Applications». Green Car Congress. December 18, 2008. Archived from the original on December 22, 2008. Retrieved January 22, 2009.
- ^ Spokoyny, Alexander M.; Li, Tina C.; Farha, Omar K.; Machan, Charles M.; She, Chunxing; Stern, Charlotte L.; Marks, Tobin J.; Hupp, Joseph T.; Mirkin, Chad A. (June 28, 2010). «Electronic Tuning of Nickel-Based Bis(dicarbollide) Redox Shuttles in Dye-Sensitized Solar Cells». Angew. Chem. Int. Ed. 49 (31): 5339–5343. doi:10.1002/anie.201002181. PMID 20586090.
- ^ Hawthorne, M. Frederick (1967). «(3)-1,2-Dicarbollyl Complexes of Nickel(III) and Nickel(IV)». Journal of the American Chemical Society. 89 (2): 470–471. doi:10.1021/ja00978a065.
- ^ Camasso, N. M.; Sanford, M. S. (2015). «Design, synthesis, and carbon-heteroatom coupling reactions of organometallic nickel(IV) complexes». Science. 347 (6227): 1218–20. Bibcode:2015Sci…347.1218C. CiteSeerX 10.1.1.897.9273. doi:10.1126/science.aaa4526. PMID 25766226. S2CID 206634533.
- ^ Baucom, E. I.; Drago, R. S. (1971). «Nickel(II) and nickel(IV) complexes of 2,6-diacetylpyridine dioxime». Journal of the American Chemical Society. 93 (24): 6469–6475. doi:10.1021/ja00753a022.
- ^ Rosenberg, Samuel J. (1968). Nickel and Its Alloys. National Bureau of Standards. Archived from the original on May 23, 2012.
- ^ a b McNeil, Ian (1990). «The Emergence of Nickel». An Encyclopaedia of the History of Technology. Taylor & Francis. pp. 96–100. ISBN 978-0-415-01306-2.
- ^ Needham, Joseph; Wang, Ling; Lu, Gwei-Djen; Tsien, Tsuen-hsuin; Kuhn, Dieter and Golas, Peter J. (1974) Science and civilisation in China Archived May 3, 2016, at the Wayback Machine. Cambridge University Press. ISBN 0-521-08571-3, pp. 237–250.
- ^ Chambers Twentieth Century Dictionary, p888, W&R Chambers Ltd., 1977.
- ^ a b Baldwin, W. H. (1931). «The story of Nickel. I. How «Old Nick’s» gnomes were outwitted». Journal of Chemical Education. 8 (9): 1749. Bibcode:1931JChEd…8.1749B. doi:10.1021/ed008p1749.
- ^ Baldwin, W. H. (1931). «The story of Nickel. II. Nickel comes of age». Journal of Chemical Education. 8 (10): 1954. Bibcode:1931JChEd…8.1954B. doi:10.1021/ed008p1954.
- ^ Baldwin, W. H. (1931). «The story of Nickel. III. Ore, matte, and metal». Journal of Chemical Education. 8 (12): 2325. Bibcode:1931JChEd…8.2325B. doi:10.1021/ed008p2325.
- ^ Fleisher, Michael and Mandarino, Joel. Glossary of Mineral Species. Tucson, Arizona: Mineralogical Record, 7th ed. 1995.
- ^ Weeks, Mary Elvira (1932). «The discovery of the elements: III. Some eighteenth-century metals». Journal of Chemical Education. 9 (1): 22. Bibcode:1932JChEd…9…22W. doi:10.1021/ed009p22.
- ^ «Industrious, enduring–the 5-cent coin». Royal Canadian Mint. 2008. Archived from the original on January 26, 2009. Retrieved January 10, 2009.
- ^ Molloy, Bill (November 8, 2001). «Trends of Nickel in Coins – Past, Present and Future». The Nickel Institute. Archived from the original on September 29, 2006. Retrieved November 19, 2008.
- ^ a b Lacey, Anna (June 22, 2013). «A bad penny? New coins and nickel allergy». BBC Health Check. Archived from the original on August 7, 2013. Retrieved July 25, 2013.
- ^ «nikkelen dubbele wapenstuiver Utrecht». nederlandsemunten.nl. Archived from the original on January 7, 2015. Retrieved January 7, 2015.
- ^ United States Mint Moves to Limit Exportation & Melting of Coins Archived May 27, 2016, at the Wayback Machine, The United States Mint, press release, December 14, 2006
- ^ «Prohibition on the Exportation, Melting, or Treatment of 5-Cent and One-Cent Coins». Federal Register. April 16, 2007. Retrieved August 28, 2021.
- ^ «United States Circulating Coinage Intrinsic Value Table». Coininflation.com. Archived from the original on June 17, 2016. Retrieved September 13, 2013.
- ^ «Coin Specifications». usmint.gov. Retrieved October 13, 2021.
- ^ Kelly, T. D.; Matos, G. R. «Nickel Statistics» (PDF). U.S. Geological Survey. Archived (PDF) from the original on August 12, 2014. Retrieved August 11, 2014.
- ^ «Mineral Commodity Summaries 2022 — Nickel» (PDF). US Geological Survey. Retrieved May 16, 2022.
- ^ «Nickel» (PDF). U.S. Geological Survey, Mineral Commodity Summaries. January 2013. Archived (PDF) from the original on May 9, 2013. Retrieved September 20, 2013.
- ^ Gazley, Michael F.; Tay, Stephie; Aldrich, Sean. «Polymetallic Nodules». Research Gate. New Zealand Minerals Forum. Retrieved January 27, 2021.
- ^ Mero, J. L. (January 1, 1977). «Chapter 11 Economic Aspects of Nodule Mining». Marine Manganese Deposits. Elsevier Oceanography Series. Vol. 15. pp. 327–355. doi:10.1016/S0422-9894(08)71025-0. ISBN 9780444415240.
- ^ International Seabed Authority. «Strategic Plan 2019-2023» (PDF). isa.org. International Seabed Authority. Retrieved January 27, 2021.
- ^ «The Nickel Mountain Project» (PDF). Ore Bin. 15 (10): 59–66. 1953. Archived from the original (PDF) on February 12, 2012. Retrieved May 7, 2015.
- ^ «Environment Writer: Nickel». National Safety Council. 2006. Archived from the original on August 28, 2006. Retrieved January 10, 2009.
- ^ a b «Operations & Development». Lundin Mining Corporation. Archived from the original on November 18, 2015. Retrieved August 10, 2014.
- ^ a b Davis, Joseph R. (2000). «Uses of Nickel». ASM Specialty Handbook: Nickel, Cobalt, and Their Alloys. ASM International. pp. 7–13. ISBN 978-0-87170-685-0.
- ^ Mond, L.; Langer, K.; Quincke, F. (1890). «Action of carbon monoxide on nickel». Journal of the Chemical Society. 57: 749–753. doi:10.1039/CT8905700749.
- ^ Kerfoot, Derek G. E. (2005). «Nickel». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a17_157.
- ^ Neikov, Oleg D.; Naboychenko, Stanislav; Gopienko, Victor G & Frishberg, Irina V (January 15, 2009). Handbook of Non-Ferrous Metal Powders: Technologies and Applications. Elsevier. pp. 371–. ISBN 978-1-85617-422-0. Archived from the original on May 29, 2013. Retrieved January 9, 2012.
- ^ «LME nickel price graphs». London Metal Exchange. Archived from the original on February 28, 2009. Retrieved June 6, 2009.
- ^ «London Metal Exchange». LME.com. Archived from the original on September 20, 2017.
- ^ Hume, Neil; Lockett, Hudson (March 8, 2022). «LME introduces emergency measures as nickel hits $100,000 a tonne». Financial Times. Archived from the original on December 10, 2022. Retrieved March 8, 2022.
- ^ Burton, Mark; Farchy, Jack; Cang, Alfred. «LME Halts Nickel Trading After Unprecedented 250% Spike». Bloomberg News. Retrieved March 8, 2022.
- ^ Farchy, Jack; Cang, Alfred; Burton, Mark (March 14, 2022). «The 18 Minutes of Trading Chaos That Broke the Nickel Market». Bloomberg News.
- ^ Home, Andy (March 10, 2022). «Column: Nickel, the devil’s metal with a history of bad behaviour». Reuters. Retrieved March 10, 2022.
- ^ American Plumbing Practice: From the Engineering Record (Prior to 1887 the Sanitary Engineer.) A Selected Reprint of Articles Describing Notable Plumbing Installations in the United States, and Questions and Answers on Problems Arising in Plumbing and House Draining. With Five Hundred and Thirty-six Illustrations. Engineering record. 1896. p. 119. Retrieved May 28, 2016.
- ^ «Platinum-Group Element — an overview | ScienceDirect Topics». www.sciencedirect.com. Retrieved October 18, 2022.
- ^ Kharton, Vladislav V. (2011). Solid State Electrochemistry II: Electrodes, Interfaces and Ceramic Membranes. Wiley-VCH. pp. 166–. ISBN 978-3-527-32638-9. Archived from the original on September 10, 2015. Retrieved June 27, 2015.
- ^ Bidault, F.; Brett, D. J. L.; Middleton, P. H.; Brandon, N. P. «A New Cathode Design for Alkaline Fuel Cells (AFCs)» (PDF). Imperial College London. Archived from the original (PDF) on July 20, 2011.
- ^ Magnetostrictive Materials Overview. University of California, Los Angeles.
- ^ Angara, Raghavendra (2009). High Frequency High Amplitude Magnetic Field Driving System for Magnetostrictive Actuators. Umi Dissertation Publishing. p. 5. ISBN 9781109187533.
- ^ Sofronie, Mihaela; Tolea, Mugurel; Popescu, Bogdan; Enculescu, Monica; Tolea, Felicia (September 7, 2021). «Magnetic and Magnetostrictive Properties of Ni50Mn20Ga27Cu3 Rapidly Quenched Ribbons». Materials. 14 (18): 5126. Bibcode:2021Mate…14.5126S. doi:10.3390/ma14185126. ISSN 1996-1944. PMC 8471753. PMID 34576350.
- ^ Cheburaeva, R. F.; Chaporova, I. N.; Krasina, T. I. (1992). «Structure and properties of tungsten carbide hard alloys with an alloyed nickel binder». Soviet Powder Metallurgy and Metal Ceramics. 31 (5): 423–425. doi:10.1007/BF00796252. S2CID 135714029.
- ^ «Krytron Pulse Power Switching Tubes». Silicon Investigations. 2011. Archived from the original on July 16, 2011.
- ^ Uhm, Y. R.; et al. (June 2016). «Study of a Betavoltaic Battery Using Electroplated Nickel-63 on Nickel Foil as a Power Source». Nuclear Engineering and Technology. 48 (3): 773–777. doi:10.1016/j.net.2016.01.010.
- ^ Bormashov, V. S.; et al. (April 2018). «High power density nuclear battery prototype based on diamond Schottky diodes». Diamond and Related Materials. 84: 41–47. Bibcode:2018DRM….84…41B. doi:10.1016/j.diamond.2018.03.006.
- ^ Khan, Abdul Rehman; Awan, Fazli Rabbi (January 8, 2014). «Metals in the pathogenesis of type 2 diabetes». Journal of Diabetes and Metabolic Disorders. 13 (1): 16. doi:10.1186/2251-6581-13-16. PMC 3916582. PMID 24401367.
- ^ a b c Astrid Sigel; Helmut Sigel; Roland K. O. Sigel, eds. (2008). Nickel and Its Surprising Impact in Nature. Metal Ions in Life Sciences. Vol. 2. Wiley. ISBN 978-0-470-01671-8.
- ^ a b c Sydor, Andrew; Zamble, Deborah (2013). Banci, Lucia (ed.). Nickel Metallomics: General Themes Guiding Nickel Homeostasis. Metal Ions in Life Sciences. Vol. 12. Dordrecht: Springer. pp. 375–416. doi:10.1007/978-94-007-5561-1_11. ISBN 978-94-007-5561-1. PMID 23595678.
- ^ Zamble, Deborah; Rowińska-Żyrek, Magdalena; Kozlowski, Henryk (2017). The Biological Chemistry of Nickel. Royal Society of Chemistry. ISBN 978-1-78262-498-1.
- ^ Covacci, Antonello; Telford, John L.; Giudice, Giuseppe Del; Parsonnet, Julie; Rappuoli, Rino (May 21, 1999). «Helicobacter pylori Virulence and Genetic Geography». Science. 284 (5418): 1328–1333. Bibcode:1999Sci…284.1328C. doi:10.1126/science.284.5418.1328. PMID 10334982. S2CID 10376008.
- ^ Cox, Gary M.; Mukherjee, Jean; Cole, Garry T.; Casadevall, Arturo; Perfect, John R. (February 1, 2000). «Urease as a Virulence Factor in Experimental Cryptococcosis». Infection and Immunity. 68 (2): 443–448. doi:10.1128/IAI.68.2.443-448.2000. PMC 97161. PMID 10639402.
- ^
Stephen W., Ragdale (2014). «Chapter 6. Biochemistry of Methyl-Coenzyme M Reductase: The Nickel Metalloenzyme that Catalyzes the Final Step in Synthesis and the First Step in Anaerobic Oxidation of the Greenhouse Gas Methane«. In Peter M.H. Kroneck; Martha E. Sosa Torres (eds.). The Metal-Driven Biogeochemistry of Gaseous Compounds in the Environment. Metal Ions in Life Sciences. Vol. 14. Springer. pp. 125–145. doi:10.1007/978-94-017-9269-1_6. ISBN 978-94-017-9268-4. PMID 25416393. - ^
Wang, Vincent C.-C.; Ragsdale, Stephen W.; Armstrong, Fraser A. (2014). «Chapter 4. Investigations of the Efficient Electrocatalytic Interconversions of Carbon Dioxide and Carbon Monoxide by Nickel-Containing Carbon Monoxide Dehydrogenases». In Peter M.H. Kroneck; Martha E. Sosa Torres (eds.). The Metal-Driven Biogeochemistry of Gaseous Compounds in the Environment. Metal Ions in Life Sciences. Vol. 14. Springer. pp. 71–97. doi:10.1007/978-94-017-9269-1_4. ISBN 978-94-017-9268-4. PMC 4261625. PMID 25416391. - ^ Szilagyi, R. K.; Bryngelson, P. A.; Maroney, M. J.; Hedman, B.; et al. (2004). «S K-Edge X-ray Absorption Spectroscopic Investigation of the Ni-Containing Superoxide Dismutase Active Site: New Structural Insight into the Mechanism». Journal of the American Chemical Society. 126 (10): 3018–3019. doi:10.1021/ja039106v. PMID 15012109.
- ^ Greig N; Wyllie S; Vickers TJ; Fairlamb AH (2006). «Trypanothione-dependent glyoxalase I in Trypanosoma cruzi». Biochemical Journal. 400 (2): 217–23. doi:10.1042/BJ20060882. PMC 1652828. PMID 16958620.
- ^ Aronsson A-C; Marmstål E; Mannervik B (1978). «Glyoxalase I, a zinc metalloenzyme of mammals and yeast». Biochemical and Biophysical Research Communications. 81 (4): 1235–1240. doi:10.1016/0006-291X(78)91268-8. PMID 352355.
- ^ Ridderström M; Mannervik B (1996). «Optimized heterologous expression of the human zinc enzyme glyoxalase I». Biochemical Journal. 314 (Pt 2): 463–467. doi:10.1042/bj3140463. PMC 1217073. PMID 8670058.
- ^ Saint-Jean AP; Phillips KR; Creighton DJ; Stone MJ (1998). «Active monomeric and dimeric forms of Pseudomonas putida glyoxalase I: evidence for 3D domain swapping». Biochemistry. 37 (29): 10345–10353. doi:10.1021/bi980868q. PMID 9671502.
- ^ Thornalley, P. J. (2003). «Glyoxalase I—structure, function and a critical role in the enzymatic defence against glycation». Biochemical Society Transactions. 31 (Pt 6): 1343–1348. doi:10.1042/BST0311343. PMID 14641060.
- ^ Vander Jagt DL (1989). «Unknown chapter title». In D Dolphin; R Poulson; O Avramovic (eds.). Coenzymes and Cofactors VIII: Glutathione Part A. New York: John Wiley and Sons.
- ^ Zambelli, Barbara; Ciurli, Stefano (2013). «Chapter 10. Nickel: and Human Health». In Astrid Sigel; Helmut Sigel; Roland K. O. Sigel (eds.). Interrelations between Essential Metal Ions and Human Diseases. Metal Ions in Life Sciences. Vol. 13. Springer. pp. 321–357. doi:10.1007/978-94-007-7500-8_10. ISBN 978-94-007-7499-5. PMID 24470096.
- ^ Nickel. IN: Dietary Reference Intakes for Vitamin A, Vitamin K, Arsenic, Boron, Chromium, Copper, Iodine, Iron, Manganese, Molybdenum, Nickel, Silicon, Vanadium, and Copper Archived September 22, 2017, at the Wayback Machine. National Academy Press. 2001, PP. 521–529.
- ^ Kamerud KL; Hobbie KA; Anderson KA (August 28, 2013). «Stainless Steel Leaches Nickel and Chromium into Foods During Cooking». Journal of Agricultural and Food Chemistry. 61 (39): 9495–501. doi:10.1021/jf402400v. PMC 4284091. PMID 23984718.
- ^ Flint GN; Packirisamy S (1997). «Purity of food cooked in stainless steel utensils». Food Additives & Contaminants. 14 (2): 115–26. doi:10.1080/02652039709374506. PMID 9102344.
- ^
Schirber, Michael (July 27, 2014). «Microbe’s Innovation May Have Started Largest Extinction Event on Earth». Space.com. Astrobiology Magazine. Archived from the original on July 29, 2014. Retrieved July 29, 2014.…. That spike in nickel allowed methanogens to take off.
- ^ «Nickel 203904». Sigma Aldrich. Archived from the original on January 26, 2020. Retrieved January 26, 2020.
- ^ Haber, Lynne T; Bates, Hudson K; Allen, Bruce C; Vincent, Melissa J; Oller, Adriana R (2017). «Derivation of an oral toxicity reference value for nickel». Regulatory Toxicology and Pharmacology. 87: S1–S18. doi:10.1016/j.yrtph.2017.03.011. PMID 28300623.
- ^ Rieuwerts, John (2015). The Elements of Environmental Pollution. London and New York: Earthscan Routledge. p. 255. ISBN 978-0-415-85919-6. OCLC 886492996.
- ^ Butticè, Claudio (2015). «Nickel Compounds». In Colditz, Graham A. (ed.). The SAGE Encyclopedia of Cancer and Society (Second ed.). Thousand Oaks: SAGE Publications, Inc. pp. 828–831. ISBN 9781483345734.
- ^ a b IARC (2012). «Nickel and nickel compounds» Archived September 20, 2017, at the Wayback Machine in IARC Monogr Eval Carcinog Risks Hum. Volume 100C. pp. 169–218..
- ^ a b Regulation (EC) No 1272/2008 of the European Parliament and of the Council of 16 December 2008 on Classification, Labelling and Packaging of Substances and Mixtures, Amending and Repealing Directives 67/548/EEC and 1999/45/EC and amending Regulation (EC) No 1907/2006 [OJ L 353, 31.12.2008, p. 1]. Annex VI Archived March 14, 2019, at the Wayback Machine. Accessed July 13, 2017.
- ^ a b Globally Harmonised System of Classification and Labelling of Chemicals (GHS) Archived August 29, 2017, at the Wayback Machine, 5th ed., United Nations, New York and Geneva, 2013..
- ^ a b National Toxicology Program. (2016). «Report on Carcinogens» Archived September 20, 2017, at the Wayback Machine, 14th ed. Research Triangle Park, NC: U.S. Department of Health and Human Services, Public Health Service..
- ^ a b «Report of the International Committee on Nickel Carcinogenesis in Man». Scandinavian Journal of Work, Environment & Health. 16 (1 Spec No): 1–82. 1990. doi:10.5271/sjweh.1813. JSTOR 40965957. PMID 2185539.
- ^ a b National Toxicology Program (1996). «NTP Toxicology and Carcinogenesis Studies of Nickel Subsulfide (CAS No. 12035-72-2) in F344 Rats and B6C3F1 Mice (Inhalation Studies)». National Toxicology Program Technical Report Series. 453: 1–365. PMID 12594522.
- ^ National Toxicology Program (1996). «NTP Toxicology and Carcinogenesis Studies of Nickel Oxide (CAS No. 1313-99-1) in F344 Rats and B6C3F1 Mice (Inhalation Studies)». National Toxicology Program Technical Report Series. 451: 1–381. PMID 12594524.
- ^ Cogliano, V. J; Baan, R; Straif, K; Grosse, Y; Lauby-Secretan, B; El Ghissassi, F; Bouvard, V; Benbrahim-Tallaa, L; Guha, N; Freeman, C; Galichet, L; Wild, C. P (2011). «Preventable exposures associated with human cancers». JNCI Journal of the National Cancer Institute. 103 (24): 1827–39. doi:10.1093/jnci/djr483. PMC 3243677. PMID 22158127.
- ^ Heim, K. E; Bates, H. K; Rush, R. E; Oller, A. R (2007). «Oral carcinogenicity study with nickel sulfate hexahydrate in Fischer 344 rats». Toxicology and Applied Pharmacology. 224 (2): 126–37. doi:10.1016/j.taap.2007.06.024. PMID 17692353.
- ^ a b Oller, A. R; Kirkpatrick, D. T; Radovsky, A; Bates, H. K (2008). «Inhalation carcinogenicity study with nickel metal powder in Wistar rats». Toxicology and Applied Pharmacology. 233 (2): 262–75. doi:10.1016/j.taap.2008.08.017. PMID 18822311.
- ^ National Toxicology Program (1996). «NTP Toxicology and Carcinogenesis Studies of Nickel Sulfate Hexahydrate (CAS No. 10101-97-0) in F344 Rats and B6C3F1 Mice (Inhalation Studies)». National Toxicology Program Technical Report Series. 454: 1–380. PMID 12587012.
- ^ Springborn Laboratories Inc. (2000). «An Oral (Gavage) Two-generation Reproduction Toxicity Study in Sprague-Dawley Rats with Nickel Sulfate Hexahydrate.» Final Report. Springborn Laboratories Inc., Spencerville. SLI Study No. 3472.4.
- ^ Vaktskjold, A; Talykova, L. V; Chashchin, V. P; Odland, J. O; Nieboer, E (2008). «Maternal nickel exposure and congenital musculoskeletal defects». American Journal of Industrial Medicine. 51 (11): 825–33. doi:10.1002/ajim.20609. PMID 18655106.
- ^ «CDC – NIOSH Pocket Guide to Chemical Hazards – Nickel metal and other compounds (as Ni)». www.cdc.gov. Archived from the original on July 18, 2017. Retrieved November 20, 2015.
- ^ Stellman, Jeanne Mager (1998). Encyclopaedia of Occupational Health and Safety: Chemical, industries and occupations. International Labour Organization. pp. 133–. ISBN 978-92-2-109816-4. Archived from the original on May 29, 2013. Retrieved January 9, 2012.
- ^ Barceloux, Donald G.; Barceloux, Donald (1999). «Nickel». Clinical Toxicology. 37 (2): 239–258. doi:10.1081/CLT-100102423. PMID 10382559.
- ^ a b Position Statement on Nickel Sensitivity Archived September 8, 2015, at the Wayback Machine. American Academy of Dermatology(August 22, 2015)
- ^ Thyssen J. P.; Linneberg A.; Menné T.; Johansen J. D. (2007). «The epidemiology of contact allergy in the general population—prevalence and main findings». Contact Dermatitis. 57 (5): 287–99. doi:10.1111/j.1600-0536.2007.01220.x. PMID 17937743. S2CID 44890665.
- ^ Dermal Exposure: Nickel Alloys Archived February 22, 2016, at the Wayback Machine Nickel Producers Environmental Research Association (NiPERA), accessed 2016 Feb.11
- ^ Nestle, O.; Speidel, H.; Speidel, M. O. (2002). «High nickel release from 1- and 2-euro coins». Nature. 419 (6903): 132. Bibcode:2002Natur.419..132N. doi:10.1038/419132a. PMID 12226655. S2CID 52866209.
- ^ Dow, Lea (June 3, 2008). «Nickel Named 2008 Contact Allergen of the Year». Nickel Allergy Information. Archived from the original on February 3, 2009.
- ^ Salnikow, k.; Donald, S. P.; Bruick, R. K.; Zhitkovich, A.; et al. (September 2004). «Depletion of intracellular ascorbate by the carcinogenic metal nickel and cobalt results in the induction of hypoxic stress». Journal of Biological Chemistry. 279 (39): 40337–44. doi:10.1074/jbc.M403057200. PMID 15271983.
- ^ Das, K. K.; Das, S. N.; Dhundasi, S. A. (2008). «Nickel, its adverse health effects and oxidative stress» (PDF). Indian Journal of Medical Research. 128 (4): 117–131. PMID 19106437. Archived from the original (PDF) on April 10, 2009. Retrieved August 22, 2011.
External links
Wikimedia Commons has media related to Nickel.
Look up nickel in Wiktionary, the free dictionary.
- Nickel at The Periodic Table of Videos (University of Nottingham)
- CDC – Nickel – NIOSH Workplace Safety and Health Topic
- An occupational hygiene assessment of dermal nickel exposures in primary production industries by GW Hughson. Institute of Occupational Medicine Research Report TM/04/05
- An occupational hygiene assessment of dermal nickel exposures in primary production and primary user industries. Phase 2 Report by GW Hughson. Institute of Occupational Medicine Research Report TM/05/06
- «The metal that brought you cheap flights», BBC News
 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nickel | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Appearance | lustrous, metallic, and silver with a gold tinge | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Standard atomic weight Ar°(Ni) |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nickel in the periodic table | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic number (Z) | 28 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Group | group 10 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Period | period 4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Block | d-block | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electron configuration | [Ar] 3d8 4s2 or [Ar] 3d9 4s1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrons per shell | 2, 8, 16, 2 or 2, 8, 17, 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physical properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase at STP | solid | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Melting point | 1728 K (1455 °C, 2651 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Boiling point | 3003 K (2730 °C, 4946 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Density (near r.t.) | 8.908 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| when liquid (at m.p.) | 7.81 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of fusion | 17.48 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of vaporization | 379 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar heat capacity | 26.07 J/(mol·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Vapor pressure
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidation states | −2, −1, 0, +1,[2] +2, +3, +4[3] (a mildly basic oxide) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegativity | Pauling scale: 1.91 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ionization energies |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic radius | empirical: 124 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Covalent radius | 124±4 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waals radius | 163 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Spectral lines of nickel |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Other properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Natural occurrence | primordial | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | face-centered cubic (fcc)
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Speed of sound thin rod | 4900 m/s (at r.t.) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermal expansion | 13.4 µm/(m⋅K) (at 25 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermal conductivity | 90.9 W/(m⋅K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrical resistivity | 69.3 nΩ⋅m (at 20 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetic ordering | ferromagnetic | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Young’s modulus | 200 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Shear modulus | 76 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bulk modulus | 180 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Poisson ratio | 0.31 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mohs hardness | 4.0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vickers hardness | 638 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Brinell hardness | 667–1600 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS Number | 7440-02-0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| History | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Discovery and first isolation | Axel Fredrik Cronstedt (1751) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Main isotopes of nickel
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| references |
Nickel is a chemical element with symbol Ni and atomic number 28. It is a silvery-white lustrous metal with a slight golden tinge. Nickel is a hard and ductile transition metal. Pure nickel is chemically reactive but large pieces are slow to react with air under standard conditions because a passivation layer of nickel oxide forms on the surface that prevents further corrosion. Even so, pure native nickel is found in Earth’s crust only in tiny amounts, usually in ultramafic rocks,[4][5] and in the interiors of larger nickel–iron meteorites that were not exposed to oxygen when outside Earth’s atmosphere.
Meteoric nickel is found in combination with iron, a reflection of the origin of those elements as major end products of supernova nucleosynthesis. An iron–nickel mixture is thought to compose Earth’s outer and inner cores.[6]
Use of nickel (as natural meteoric nickel–iron alloy) has been traced as far back as 3500 BCE. Nickel was first isolated and classified as an element in 1751 by Axel Fredrik Cronstedt, who initially mistook the ore for a copper mineral, in the cobalt mines of Los, Hälsingland, Sweden. The element’s name comes from a mischievous sprite of German miner mythology, Nickel (similar to Old Nick), who personified the fact that copper-nickel ores resisted refinement into copper. An economically important source of nickel is the iron ore limonite, which is often 1–2% nickel. Other important nickel ore minerals include pentlandite and a mix of Ni-rich natural silicates known as garnierite. Major production sites include the Sudbury region, Canada (which is thought to be of meteoric origin), New Caledonia in the Pacific, and Norilsk, Russia.
Nickel is one of four elements (the others are iron, cobalt, and gadolinium)[7] that are ferromagnetic at about room temperature. Alnico permanent magnets based partly on nickel are of intermediate strength between iron-based permanent magnets and rare-earth magnets. The metal is used chiefly in alloys and corrosion-resistant plating. About 68% of world production is used in stainless steel. A further 10% is used for nickel-based and copper-based alloys, 9% for plating, 7% for alloy steels, 3% in foundries, and 4% in other applications such as in rechargeable batteries,[8] including those in electric vehicles (EVs).[9] Nickel is widely used in coins, though nickel-plated objects sometimes provoke nickel allergy. As a compound, nickel has a number of niche chemical manufacturing uses, such as a catalyst for hydrogenation, cathodes for rechargeable batteries, pigments and metal surface treatments.[10] Nickel is an essential nutrient for some microorganisms and plants that have enzymes with nickel as an active site.[11]
Properties
Atomic and physical properties
Nickel is a silvery-white metal with a slight golden tinge that takes a high polish. It is one of only four elements that are ferromagnetic at or near room temperature; the others are iron, cobalt and gadolinium. Its Curie temperature is 355 °C (671 °F), meaning that bulk nickel is non-magnetic above this temperature.[13][7] The unit cell of nickel is a face-centered cube with the lattice parameter of 0.352 nm, giving an atomic radius of 0.124 nm. This crystal structure is stable to pressures of at least 70 GPa. Nickel is hard, malleable and ductile, and has a relatively high electrical and thermal conductivity for transition metals.[14] The high compressive strength of 34 GPa, predicted for ideal crystals, is never obtained in the real bulk material due to formation and movement of dislocations. However, it has been reached in Ni nanoparticles.[15]
Electron configuration dispute
Nickel has two atomic electron configurations, [Ar] 3d8 4s2 and [Ar] 3d9 4s1, which are very close in energy; [Ar] denotes the complete argon core structure. There is some disagreement on which configuration has the lower energy.[16] Chemistry textbooks quote nickel’s electron configuration as [Ar] 4s2 3d8,[17] also written [Ar] 3d8 4s2.[18] This configuration agrees with the Madelung energy ordering rule, which predicts that 4s is filled before 3d. It is supported by the experimental fact that the lowest energy state of the nickel atom is a 3d8 4s2 energy level, specifically the 3d8(3F) 4s2 3F, J = 4 level.[19]
However, each of these two configurations splits into several energy levels due to fine structure,[19] and the two sets of energy levels overlap. The average energy of states with [Ar] 3d9 4s1 is actually lower than the average energy of states with [Ar] 3d8 4s2. Therefore, the research literature on atomic calculations quotes the ground state configuration as [Ar] 3d9 4s1.[16]
Isotopes
The isotopes of nickel range in atomic weight from 48 u (48
Ni) to 78 u (78
Ni).[20]
Natural nickel is composed of five stable isotopes, 58
Ni, 60
Ni, 61
Ni, 62
Ni and 64
Ni, of which 58
Ni is the most abundant (68.077% natural abundance).[20]
Nickel-62 has the highest binding energy per nucleon of any nuclide: 8.7946 MeV/nucleon.[21][22] Its binding energy is greater than both 56
Fe and 58
Fe, more abundant nuclides often incorrectly cited as having the highest binding energy.[23] Though this would seem to predict nickel as the most abundant heavy element in the universe, the high rate of photodisintegration of nickel in stellar interiors causes iron to be by far the most abundant.[23]
Nickel-60 is the daughter product of the extinct radionuclide 60
Fe (half-life 2.6 million years). Due to the long half-life of 60
Fe, its persistence in materials in the Solar System may generate observable variations in the isotopic composition of 60
Ni. Therefore, the abundance of 60
Ni in extraterrestrial material may give insight into the origin of the Solar System and its early history.[24]
At least 26 nickel radioisotopes have been characterized; the most stable are 59
Ni with half-life 76,000 years, 63
Ni (100 years), and 56
Ni (6 days). All other radioisotopes have half-lives less than 60 hours and most these have half-lives less than 30 seconds. This element also has one meta state.[20]
Radioactive nickel-56 is produced by the silicon burning process and later set free in large amounts in type Ia supernovae. The shape of the light curve of these supernovae at intermediate to late-times corresponds to the decay via electron capture of 56
Ni to cobalt-56 and ultimately to iron-56.[25] Nickel-59 is a long-lived cosmogenic radionuclide; half-life 76,000 years. 59
Ni has found many applications in isotope geology. 59
Ni has been used to date the terrestrial age of meteorites and to determine abundances of extraterrestrial dust in ice and sediment. The half-life of nickel-78 was recently measured at 110 milliseconds, and is believed an important isotope in supernova nucleosynthesis of elements heavier than iron.[26] 48Ni, discovered in 1999, is the most proton-rich heavy element isotope known. With 28 protons and 20 neutrons, 48Ni is «doubly magic», as is 78Ni with 28 protons and 50 neutrons. Both are therefore unusually stable for nuclei with so large a proton–neutron imbalance.[20][27]
Nickel-63 is a contaminant found in the support structure of nuclear reactors. It is produced through neutron capture by nickel-62. Small amounts have also been found near nuclear weapon test sites in the South Pacific.[28]
Occurrence
Widmanstätten pattern showing the two forms of nickel-iron, kamacite and taenite, in an octahedrite meteorite
On Earth, nickel occurs most often in combination with sulfur and iron in pentlandite, with sulfur in millerite, with arsenic in the mineral nickeline, and with arsenic and sulfur in nickel galena.[29] Nickel is commonly found in iron meteorites as the alloys kamacite and taenite. Nickel in meteorites was first detected in 1799 by Joseph-Louis Proust, a French chemist who then worked in Spain. Proust analyzed samples of the meteorite from Campo del Cielo (Argentina), which had been obtained in 1783 by Miguel Rubín de Celis, discovering the presence in them of nickel (about 10%) along with iron.[30]
The bulk of nickel is mined from two types of ore deposits. The first is laterite, where the principal ore mineral mixtures are nickeliferous limonite, (Fe,Ni)O(OH), and garnierite (a mixture of various hydrous nickel and nickel-rich silicates). The second is magmatic sulfide deposits, where the principal ore mineral is pentlandite: (Ni,Fe)9S8.[31]
Indonesia and Australia have the biggest estimated reserves, at 43.6% of world total.[32]
Identified land-based resources throughout the world averaging 1% nickel or greater comprise at least 130 million tons of nickel (about the double of known reserves). About 60% is in laterites and 40% in sulfide deposits.[33]
On geophysical evidence, most of the nickel on Earth is believed to be in Earth’s outer and inner cores. Kamacite and taenite are naturally occurring alloys of iron and nickel. For kamacite, the alloy is usually in the proportion of 90:10 to 95:5, though impurities (such as cobalt or carbon) may be present. Taenite is 20% to 65% nickel. Kamacite and taenite are also found in nickel iron meteorites.[34]
Compounds
The most common oxidation state of nickel is +2, but compounds of Ni0, Ni+, and Ni3+ are well known, and the exotic oxidation states Ni2− and Ni− have been produced and studied.[35]
Nickel(0)
Nickel tetracarbonyl (Ni(CO)4), discovered by Ludwig Mond,[36] is a volatile, highly toxic liquid at room temperature. On heating, the complex decomposes back to nickel and carbon monoxide:
- Ni(CO)4 ⇌ Ni + 4 CO
This behavior is exploited in the Mond process for purifying nickel, as described above. The related nickel(0) complex bis(cyclooctadiene)nickel(0) is a useful catalyst in organonickel chemistry because the cyclooctadiene (or cod) ligands are easily displaced.
Nickel(I)
Structure of
[Ni2(CN)6]4− ion[37]
Nickel(I) complexes are uncommon, but one example is the tetrahedral complex NiBr(PPh3)3. Many nickel(I) complexes have Ni–Ni bonding, such as the dark red diamagnetic K4[Ni2(CN)6] prepared by reduction of K2[Ni2(CN)6] with sodium amalgam. This compound is oxidized in water, liberating H2.[37]
It is thought that the nickel(I) oxidation state is important to nickel-containing enzymes, such as [NiFe]-hydrogenase, which catalyzes the reversible reduction of protons to H2.[38]
Nickel(II)
Color of various Ni(II) complexes in aqueous solution. From left to right,
[Ni(NH3)6]2+,
[Ni(NH2CH2CH2NH2)]2+,
[NiCl4]2−,
[Ni(H2O)6]2+
Nickel(II) forms compounds with all common anions, including sulfide, sulfate, carbonate, hydroxide, carboxylates, and halides. Nickel(II) sulfate is produced in large amounts by dissolving nickel metal or oxides in sulfuric acid, forming both a hexa- and heptahydrate[39] useful for electroplating nickel. Common salts of nickel, such as chloride, nitrate, and sulfate, dissolve in water to give green solutions of the metal aquo complex [Ni(H2O)6]2+.[40]
The four halides form nickel compounds, which are solids with molecules with octahedral Ni centres. Nickel(II) chloride is most common, and its behavior is illustrative of the other halides. Nickel(II) chloride is made by dissolving nickel or its oxide in hydrochloric acid. It is usually found as the green hexahydrate, whose formula is usually written NiCl2·6H2O. When dissolved in water, this salt forms the metal aquo complex [Ni(H2O)6]2+. Dehydration of NiCl2·6H2O gives yellow anhydrous NiCl2.[41]
Some tetracoordinate nickel(II) complexes, e.g. bis(triphenylphosphine)nickel chloride, exist both in tetrahedral and square planar geometries. The tetrahedral complexes are paramagnetic; the square planar complexes are diamagnetic. In having properties of magnetic equilibrium and formation of octahedral complexes, they contrast with the divalent complexes of the heavier group 10 metals, palladium(II) and platinum(II), which form only square-planar geometry.[35]
Nickelocene is known; it has an electron count of 20, making it relatively unstable.[citation needed][42]
Nickel(III) and (IV)
Many Ni(III) compounds are known. The first such compounds are [Ni(PR3)2X2], where X = Cl, Br, I and R = ethyl, propyl, butyl.[43] Further, Ni(III) forms simple salts with fluoride[44] or oxide ions. Ni(III) can be stabilized by σ-donor ligands such as thiols and organophosphines.[37]
Ni(III) occurs in nickel oxide hydroxide, which is used as the cathode in many rechargeable batteries, including nickel-cadmium, nickel-iron, nickel hydrogen, and nickel-metal hydride, and used by certain manufacturers in Li-ion batteries.[45]
Ni(IV) occurs in the mixed oxide BaNiO3. Ni(IV) remains a rare oxidation state and very few compounds are known.[46][47][48][49]
History
Because nickel ores are easily mistaken for ores of silver and copper, understanding of this metal and its use, is relatively recent. But unintentional use of nickel is ancient, and can be traced back as far as 3500 BCE. Bronzes from what is now Syria have been found to contain as much as 2% nickel.[50] Some ancient Chinese manuscripts suggest that «white copper» (cupronickel, known as baitong) was used there in 1700-1400 BCE. This Paktong white copper was exported to Britain as early as the 17th century, but the nickel content of this alloy was not discovered until 1822.[51] Coins of nickel-copper alloy were minted by Bactrian kings Agathocles, Euthydemus II, and Pantaleon in the 2nd century BCE, possibly out of the Chinese cupronickel.[52]
In medieval Germany, a metallic yellow mineral was found in the Erzgebirge (Ore Mountains) that resembled copper ore. But when miners were unable to get any copper from it, they blamed a mischievous sprite of German mythology, Nickel (similar to Old Nick), for besetting the copper. They called this ore Kupfernickel from German Kupfer ‘copper’.[53][54][55][56] This ore is now known as the mineral nickeline (formerly niccolite[57]), a nickel arsenide. In 1751, Baron Axel Fredrik Cronstedt tried to extract copper from kupfernickel at a cobalt mine in the village of Los, Sweden, and instead produced a white metal that he named nickel after the spirit that had given its name to the mineral.[58] In modern German, Kupfernickel or Kupfer-Nickel designates the alloy cupronickel.[14]
Originally, the only source for nickel was the rare Kupfernickel. Beginning in 1824, nickel was obtained as a byproduct of cobalt blue production. The first large-scale smelting of nickel began in Norway in 1848 from nickel-rich pyrrhotite. The introduction of nickel in steel production in 1889 increased the demand for nickel; the nickel deposits of New Caledonia, discovered in 1865, provided most of the world’s supply between 1875 and 1915. The discovery of the large deposits in the Sudbury Basin, Canada in 1883, in Norilsk-Talnakh, Russia in 1920, and in the Merensky Reef, South Africa in 1924, made large-scale nickel production possible.[51]
Coinage
Aside from the aforementioned Bactrian coins, nickel was not a component of coins until the mid-19th century.[citation needed]
Canada
99.9% nickel five-cent coins were struck in Canada (the world’s largest nickel producer at the time) during non-war years from 1922 to 1981; the metal content made these coins magnetic.[59] During the war years 1942–45, most or all nickel was removed from Canadian and US coins to save it for making armor.[54][60] Canada used 99.9% nickel from 1968 in its higher-value coins until 2000.[citation needed]
Switzerland
Coins of nearly pure nickel were first used in 1881 in Switzerland.[61]
United Kingdom
Birmingham forged nickel coins in c. 1833 for trading in Malaysia.[62]
United States
In the United States, the term «nickel» or «nick» originally applied to the copper-nickel Flying Eagle cent, which replaced copper with 12% nickel 1857–58, then the Indian Head cent of the same alloy from 1859 to 1864. Still later, in 1865, the term designated the three-cent nickel, with nickel increased to 25%. In 1866, the five-cent shield nickel (25% nickel, 75% copper) appropriated the designation, which has been used ever since for the subsequent 5-cent pieces. This alloy proportion is not ferromagnetic.
The US nickel coin contains 0.04 ounces (1.1 g) of nickel, which at the April 2007 price was worth 6.5 cents, along with 3.75 grams of copper worth about 3 cents, with a total metal value of more than 9 cents. Since the face value of a nickel is 5 cents, this made it an attractive target for melting by people wanting to sell the metals at a profit. The United States Mint, anticipating this practice, implemented new interim rules on December 14, 2006, subject to public comment for 30 days, which criminalized the melting and export of cents and nickels.[63] Violators can be punished with a fine of up to $10,000 and/or a maximum of five years in prison.[64] As of September 19, 2013, the melt value of a US nickel (copper and nickel included) is $0.045 (90% of the face value).[65]
Current use
In the 21st century, the high price of nickel has led to some replacement of the metal in coins around the world. Coins still made with nickel alloys include one- and two-euro coins, 5¢, 10¢, 25¢, 50¢, and $1 U.S. coins,[66] and 20p, 50p, £1, and £2 UK coins. From 2012 on the nickel-alloy used for 5p and 10p UK coins was replaced with nickel-plated steel. This ignited a public controversy regarding the problems of people with nickel allergy.[61]
World production
Time trend of nickel production[67]
Nickel ores grade evolution in some leading nickel producing countries or regions.
An estimated 2.7 million tonnes (t) of nickel per year are mined worldwide; Indonesia (1,000,000 t), the Philippines (370,000 t), Russia (250,000 t), New Caledonia (France) (190,000 t), Australia (160,000 t) and Canada (130,000 t) are the largest producers as of 2021.[68] The largest nickel deposits in non-Russian Europe are in Finland and Greece. Identified land-based sources averaging at least 1% nickel contain at least 130 million tonnes of nickel. About 60% is in laterites and 40% is in sulfide deposits. Also, extensive nickel sources are found in the depths of the Pacific Ocean, especially in an area called the Clarion Clipperton Zone in the form of polymetallic nodules peppering the seafloor at 3.5–6 km below sea level.[69][70] These nodules are composed of numerous rare-earth metals and are estimated to be 1.7% nickel.[71] With advances in science and engineering, regulation is currently being set in place by the International Seabed Authority to ensure that these nodules are collected in an environmentally conscientious manner while adhering to the United Nations Sustainable Development Goals.[72]
The one place in the United States where nickel has been profitably mined is Riddle, Oregon, with several square miles of nickel-bearing garnierite surface deposits. The mine closed in 1987.[73][74] The Eagle mine project is a new nickel mine in Michigan’s Upper Peninsula. Construction was completed in 2013, and operations began in the third quarter of 2014.[75] In the first full year of operation, the Eagle Mine produced 18,000 t.[75]
Production
Evolution of the annual nickel extraction, according to ores.
Nickel is obtained through extractive metallurgy: it is extracted from ore by conventional roasting and reduction processes that yield metal of greater than 75% purity. In many stainless steel applications, 75% pure nickel can be used without further purification, depending on impurities.[39]
Traditionally, most sulfide ores are processed using pyrometallurgical techniques to produce a matte for further refining. Recent advances in hydrometallurgical techniques result in significantly purer metallic nickel product. Most sulfide deposits have traditionally been processed by concentration through a froth flotation process followed by pyrometallurgical extraction. In hydrometallurgical processes, nickel sulfide ores are concentrated with flotation (differential flotation if Ni/Fe ratio is too low) and then smelted. The nickel matte is further processed with the Sherritt-Gordon process. First, copper is removed by adding hydrogen sulfide, leaving a concentrate of cobalt and nickel. Then, solvent extraction is used to separate the cobalt and nickel, with the final nickel content greater than 99%.[citation needed]
Electrorefining
A second common refining process is leaching the metal matte into a nickel salt solution, followed by electrowinning the nickel from solution by plating it onto a cathode as electrolytic nickel.[76]
Mond process
The purest metal is obtained from nickel oxide by the Mond process, which gives a purity of over 99.99%.[77] The process was patented by Ludwig Mond and has been in industrial use since before the beginning of the 20th century. In this process, nickel is reacted with carbon monoxide in the presence of a sulfur catalyst at around 40–80 °C to form nickel carbonyl. In a similar reaction with iron, iron pentacarbonyl can form, though this reaction is slow. If necessary, the nickel may be separated by distillation. Dicobalt octacarbonyl is also formed in nickel distillation as a by-product, but it decomposes to tetracobalt dodecacarbonyl at the reaction temperature to give a non-volatile solid.[78]
Nickel is obtained from nickel carbonyl by one of two processes. It may be passed through a large chamber at high temperatures in which tens of thousands of nickel spheres (pellets) are constantly stirred. The carbonyl decomposes and deposits pure nickel onto the spheres. In the alternate process, nickel carbonyl is decomposed in a smaller chamber at 230 °C to create a fine nickel powder. The byproduct carbon monoxide is recirculated and reused. The highly pure nickel product is known as «carbonyl nickel».[79]
Market value
The market price of nickel surged throughout 2006 and the early months of 2007; as of April 5, 2007, the metal was trading at US$52,300/tonne or $1.47/oz.[80] The price later fell dramatically; as of September 2017, the metal was trading at $11,000/tonne, or $0.31/oz.[81] During the 2022 Russian invasion of Ukraine, worries about sanctions on Russian nickel exports triggered a short squeeze, causing the price of nickel to quadruple in just two days, reaching US$100,000 per tonne.[82][83] The London Metal Exchange cancelled contracts worth $3.9 billion and suspended nickel trading for over a week.[84] Analyst Andy Home argued that such price shocks are exacerbated by the purity requirements imposed by metal markets: only Grade I (99.8% pure) metal can be used as a commodity on the exchanges, but most of the world’s supply is either in ferro-nickel alloys or lower-grade purities.[85]
Applications
Nickel foam (top) and its internal structure (bottom)
Global use of nickel is currently 68% in stainless steel, 10% in nonferrous alloys, 9% electroplating, 7% alloy steel, 3% foundries, and 4% other (including batteries).[8]
Nickel is used in many recognizable industrial and consumer products, including stainless steel, alnico magnets, coinage, rechargeable batteries (e.g. nickel-iron), electric guitar strings, microphone capsules, plating on plumbing fixtures,[86] and special alloys such as permalloy, elinvar, and invar. It is used for plating and as a green tint in glass. Nickel is preeminently an alloy metal, and its chief use is in nickel steels and nickel cast irons, in which it typically increases the tensile strength, toughness, and elastic limit. It is widely used in many other alloys, including nickel brasses and bronzes and alloys with copper, chromium, aluminium, lead, cobalt, silver, and gold (Inconel, Incoloy, Monel, Nimonic).[76]
A «horseshoe magnet» made of alnico nickel alloy.
Because nickel is resistant to corrosion, it was occasionally used as a substitute for decorative silver. Nickel was also occasionally used in some countries after 1859 as a cheap coinage metal (see above), but in the later years of the 20th century, it was replaced by cheaper stainless steel (i.e., iron) alloys, except in the United States and Canada.[citation needed]
Nickel is an excellent alloying agent for certain precious metals and is used in the fire assay as a collector of platinum group elements (PGE). As such, nickel can fully collect all six PGEs from ores, and can partially collect gold. High-throughput nickel mines may also do PGE recovery (mainly platinum and palladium); examples are Norilsk, Russia and the Sudbury Basin, Canada.[87]
Nickel foam or nickel mesh is used in gas diffusion electrodes for alkaline fuel cells.[88][89]
Nickel and its alloys are often used as catalysts for hydrogenation reactions. Raney nickel, a finely divided nickel-aluminium alloy, is one common form, though related catalysts are also used, including Raney-type catalysts.[citation needed]
Nickel is naturally magnetostrictive: in the presence of a magnetic field, the material undergoes a small change in length.[90][91] The magnetostriction of nickel is on the order of 50 ppm and is negative, indicating that it contracts.[92]
Nickel is used as a binder in the cemented tungsten carbide or hardmetal industry and used in proportions of 6% to 12% by weight. Nickel makes the tungsten carbide magnetic and adds corrosion-resistance to the cemented parts, though the hardness is less than those with cobalt binder.[93]
63
Ni, with half-life 100.1 years, is useful in krytron devices as a beta particle (high-speed electron) emitter to make ionization by the keep-alive electrode more reliable.[94] It is being investigated as a power source for betavoltaic batteries.[95][96]
Around 27% of all nickel production is used for engineering, 10% for building and construction, 14% for tubular products, 20% for metal goods, 14% for transport, 11% for electronic goods, and 5% for other uses.[8]
Raney nickel is widely used for hydrogenation of unsaturated oils to make margarine, and substandard margarine and leftover oil may contain nickel as a contaminant. Forte et al. found that type 2 diabetic patients have 0.89 ng/mL of Ni in the blood relative to 0.77 ng/mL in control subjects.[97]
Biological role
It was not recognized until the 1970s, but nickel is known to play an important role in the biology of some plants, bacteria, archaea, and fungi.[98][99][100] Nickel enzymes such as urease are considered virulence factors in some organisms.[101][102] Urease catalyzes hydrolysis of urea to form ammonia and carbamate.[99][98] NiFe hydrogenases can catalyze oxidation of H2 to form protons and electrons; and also the reverse reaction, the reduction of protons to form hydrogen gas.[99][98] A nickel-tetrapyrrole coenzyme, cofactor F430, is present in methyl coenzyme M reductase, which can catalyze the formation of methane, or the reverse reaction, in methanogenic archaea (in +1 oxidation state).[103] One of the carbon monoxide dehydrogenase enzymes consists of an Fe-Ni-S cluster.[104] Other nickel-bearing enzymes include a rare bacterial class of superoxide dismutase[105] and glyoxalase I enzymes in bacteria and several eukaryotic trypanosomal parasites[106] (in other organisms, including yeast and mammals, this enzyme contains divalent Zn2+).[107][108][109][110][111]
Dietary nickel may affect human health through infections by nickel-dependent bacteria, but nickel may also be an essential nutrient for bacteria living in the large intestine, in effect functioning as a prebiotic.[112] The US Institute of Medicine has not confirmed that nickel is an essential nutrient for humans, so neither a Recommended Dietary Allowance (RDA) nor an Adequate Intake have been established. The tolerable upper intake level of dietary nickel is 1 mg/day as soluble nickel salts. Estimated dietary intake is 70 to 100 µg/day; less than 10% is absorbed. What is absorbed is excreted in urine.[113] Relatively large amounts of nickel – comparable to the estimated average ingestion above – leach into food cooked in stainless steel. For example, the amount of nickel leached after 10 cooking cycles into one serving of tomato sauce averages 88 µg.[114][115]
Nickel released from Siberian Traps volcanic eruptions is suspected of helping the growth of Methanosarcina, a genus of euryarchaeote archaea that produced methane in the Permian–Triassic extinction event, the biggest known mass extinction.[116]
Toxicity
| Hazards | |
|---|---|
| GHS labelling: | |
|
Pictograms |
  
|
|
Signal word |
Danger |
|
Hazard statements |
H317, H351, H372, H412 |
|
Precautionary statements |
P201, P202, P260, P264, P270, P272, P273, P280, P302+P352, P308+P313, P333+P313, P363, P405, P501[117] |
| NFPA 704 (fire diamond) |
2 0 0 |
The major source of nickel exposure is oral consumption, as nickel is essential to plants.[118] Typical background concentrations of nickel do not exceed 20 ng/m3 in air, 100 mg/kg in soil, 10 mg/kg in vegetation, 10 μg/L in freshwater and 1 μg/L in seawater.[119] Environmental concentrations may be increased by human pollution. For example, nickel-plated faucets may contaminate water and soil; mining and smelting may dump nickel into wastewater; nickel–steel alloy cookware and nickel-pigmented dishes may release nickel into food. Air may be polluted by nickel ore refining and fossil fuel combustion. Humans may absorb nickel directly from tobacco smoke and skin contact with jewelry, shampoos, detergents, and coins. A less common form of chronic exposure is through hemodialysis as traces of nickel ions may be absorbed into the plasma from the chelating action of albumin.[citation needed]
The average daily exposure is not a threat to human health. Most nickel absorbed by humans is removed by the kidneys and passed out of the body through urine or is eliminated through the gastrointestinal tract without being absorbed. Nickel is not a cumulative poison, but larger doses or chronic inhalation exposure may be toxic, even carcinogenic, and constitute an occupational hazard.[120]
Nickel compounds are classified as human carcinogens[121][122][123][124] based on increased respiratory cancer risks observed in epidemiological studies of sulfidic ore refinery workers.[125] This is supported by the positive results of the NTP bioassays with Ni sub-sulfide and Ni oxide in rats and mice.[126][127] The human and animal data consistently indicate a lack of carcinogenicity via the oral route of exposure and limit the carcinogenicity of nickel compounds to respiratory tumours after inhalation.[128][129] Nickel metal is classified as a suspect carcinogen;[121][122][123] there is consistency between the absence of increased respiratory cancer risks in workers predominantly exposed to metallic nickel[125] and the lack of respiratory tumours in a rat lifetime inhalation carcinogenicity study with nickel metal powder.[130] In the rodent inhalation studies with various nickel compounds and nickel metal, increased lung inflammations with and without bronchial lymph node hyperplasia or fibrosis were observed.[124][126][130][131] In rat studies, oral ingestion of water-soluble nickel salts can trigger perinatal mortality in pregnant animals.[132] Whether these effects are relevant to humans is unclear as epidemiological studies of highly exposed female workers have not shown adverse developmental toxicity effects.[133]
People can be exposed to nickel in the workplace by inhalation, ingestion, and contact with skin or eye. The Occupational Safety and Health Administration (OSHA) has set the legal limit (permissible exposure limit) for the workplace at 1 mg/m3 per 8-hour workday, excluding nickel carbonyl. The National Institute for Occupational Safety and Health (NIOSH) sets the recommended exposure limit (REL) at 0.015 mg/m3 per 8-hour workday. At 10 mg/m3, nickel is immediately dangerous to life and health.[134] Nickel carbonyl [Ni(CO)4] is an extremely toxic gas. The toxicity of metal carbonyls is a function of both the toxicity of the metal and the off-gassing of carbon monoxide from the carbonyl functional groups; nickel carbonyl is also explosive in air.[135][136]
Sensitized persons may show a skin contact allergy to nickel known as a contact dermatitis. Highly sensitized persons may also react to foods with high nickel content.[137] Patients with pompholyx may also be sensitive to nickel. Nickel is the top confirmed contact allergen worldwide, partly due to its use in jewelry for pierced ears.[138] Nickel allergies affecting pierced ears are often marked by itchy, red skin. Many earrings are now made without nickel or with low-release nickel[139] to address this problem. The amount allowed in products that contact human skin is now regulated by the European Union. In 2002, researchers found that the nickel released by 1 and 2 euro coins, far exceeded those standards. This is believed to be due to a galvanic reaction.[140] Nickel was voted Allergen of the Year in 2008 by the American Contact Dermatitis Society.[141] In August 2015, the American Academy of Dermatology adopted a position statement on the safety of nickel: «Estimates suggest that contact dermatitis, which includes nickel sensitization, accounts for approximately $1.918 billion and affects nearly 72.29 million people.»[137]
Reports show that both the nickel-induced activation of hypoxia-inducible factor (HIF-1) and the up-regulation of hypoxia-inducible genes are caused by depletion of intracellular ascorbate. The addition of ascorbate to the culture medium increased the intracellular ascorbate level and reversed both the metal-induced stabilization of HIF-1- and HIF-1α-dependent gene expression.[142][143]
References
- ^ «Standard Atomic Weights: Nickel». CIAAW. 2007.
- ^ Pfirrmann, Stefan; Limberg, Christian; Herwig, Christian; Stößer, Reinhard; Ziemer, Burkhard (2009). «A Dinuclear Nickel(I) Dinitrogen Complex and its Reduction in Single-Electron Steps». Angewandte Chemie International Edition. 48 (18): 3357–61. doi:10.1002/anie.200805862. PMID 19322853.
- ^ Carnes, Matthew; Buccella, Daniela; Chen, Judy Y.-C.; Ramirez, Arthur P.; Turro, Nicholas J.; Nuckolls, Colin; Steigerwald, Michael (2009). «A Stable Tetraalkyl Complex of Nickel(IV)». Angewandte Chemie International Edition. 48 (2): 290–4. doi:10.1002/anie.200804435. PMID 19021174.
- ^ Anthony, John W.; Bideaux, Richard A.; Bladh, Kenneth W.; Nichols, Monte C., eds. (1990). «Nickel» (PDF). Handbook of Mineralogy. Vol. I. Chantilly, VA, US: Mineralogical Society of America. ISBN 978-0962209703.
- ^ «Nickel: Nickel mineral information and data». Mindat.org. Archived from the original on March 3, 2016. Retrieved March 2, 2016.
- ^ Stixrude, Lars; Waserman, Evgeny; Cohen, Ronald (November 1997). «Composition and temperature of Earth’s inner core». Journal of Geophysical Research. 102 (B11): 24729–24740. Bibcode:1997JGR…10224729S. doi:10.1029/97JB02125.
- ^ a b Coey, J. M. D.; Skumryev, V.; Gallagher, K. (1999). «Rare-earth metals: Is gadolinium really ferromagnetic?». Nature. 401 (6748): 35–36. Bibcode:1999Natur.401…35C. doi:10.1038/43363. S2CID 4383791.
- ^ a b c «Nickel Use In Society». Nickel Institute. Archived from the original on September 21, 2017.
- ^ Treadgold, Tim. «Gold Is Hot But Nickel Is Hotter As Demand Grows For Batteries In Electric Vehicles». Forbes. Retrieved October 14, 2020.
- ^ «Nickel Compounds – The Inside Story». Nickel Institute. Archived from the original on August 31, 2018.
- ^ Mulrooney, Scott B.; Hausinger, Robert P. (June 1, 2003). «Nickel uptake and utilization by microorganisms». FEMS Microbiology Reviews. 27 (2–3): 239–261. doi:10.1016/S0168-6445(03)00042-1. ISSN 0168-6445. PMID 12829270.
- ^ Shiozawa, Hidetsugu; Briones-Leon, Antonio; Domanov, Oleg; Zechner, Georg; et al. (2015). «Nickel clusters embedded in carbon nanotubes as high performance magnets». Scientific Reports. 5: 15033. Bibcode:2015NatSR…515033S. doi:10.1038/srep15033. PMC 4602218. PMID 26459370.
- ^ Kittel, Charles (1996). Introduction to Solid State Physics. Wiley. p. 449. ISBN 978-0-471-14286-7.
- ^ a b Hammond, C.R.; Lide, C. R. (2018). «The elements». In Rumble, John R. (ed.). CRC Handbook of Chemistry and Physics (99th ed.). Boca Raton, FL: CRC Press. p. 4.22. ISBN 9781138561632.
- ^ Sharma, A.; Hickman, J.; Gazit, N.; Rabkin, E.; Mishin, Y. (2018). «Nickel nanoparticles set a new record of strength». Nature Communications. 9 (1): 4102. Bibcode:2018NatCo…9.4102S. doi:10.1038/s41467-018-06575-6. PMC 6173750. PMID 30291239.
- ^ a b Scerri, Eric R. (2007). The periodic table: its story and its significance. Oxford University Press. pp. 239–240. ISBN 978-0-19-530573-9.
- ^ Miessler, G.L. and Tarr, D.A. (1999) Inorganic Chemistry 2nd ed., Prentice–Hall. p. 38. ISBN 0138418918.
- ^ Petrucci, R.H. et al. (2002) General Chemistry 8th ed., Prentice–Hall. p. 950. ISBN 0130143294.
- ^ a b NIST Atomic Spectrum Database Archived March 20, 2011, at the Wayback Machine To read the nickel atom levels, type «Ni I» in the Spectrum box and click on Retrieve data.
- ^ a b c d Kondev, F. G.; Wang, M.; Huang, W. J.; Naimi, S.; Audi, G. (2021). «The NUBASE2020 evaluation of nuclear properties» (PDF). Chinese Physics C. 45 (3): 030001. doi:10.1088/1674-1137/abddae.
- ^ Shurtleff, Richard; Derringh, Edward (1989). «The Most Tightly Bound Nuclei». American Journal of Physics. 57 (6): 552. Bibcode:1989AmJPh..57..552S. doi:10.1119/1.15970. Archived from the original on May 14, 2011. Retrieved November 19, 2008.
- ^ «Nuclear synthesis». hyperphysics.phy-astr.gsu.edu. Retrieved October 15, 2020.
- ^ a b Fewell, M. P. (1995). «The atomic nuclide with the highest mean binding energy». American Journal of Physics. 63 (7): 653. Bibcode:1995AmJPh..63..653F. doi:10.1119/1.17828.
- ^ Caldwell, Eric. «Resources on Isotopes». United States Geological Survey. Retrieved May 20, 2022.
- ^ Pagel, Bernard Ephraim Julius (1997). «Further burning stages: evolution of massive stars». Nucleosynthesis and chemical evolution of galaxies. pp. 154–160. ISBN 978-0-521-55958-4.
- ^ Castelvecchi, Davide (April 22, 2005). «Atom Smashers Shed Light on Supernovae, Big Bang». Archived from the original on July 23, 2012. Retrieved November 19, 2008.
- ^ W, P. (October 23, 1999). «Twice-magic metal makes its debut – isotope of nickel». Science News. Archived from the original on May 24, 2012. Retrieved September 29, 2006.
- ^ Carboneau, M. L.; Adams, J. P. (1995). «Nickel-63». National Low-Level Waste Management Program Radionuclide Report Series. 10. doi:10.2172/31669.
- ^ National Pollutant Inventory – Nickel and compounds Fact Sheet Archived December 8, 2011, at the Wayback Machine. Npi.gov.au. Retrieved on January 9, 2012.
- ^ Calvo, Miguel (2019). Construyendo la Tabla Periódica. Zaragoza, Spain: Prames. p. 118. ISBN 978-84-8321-908-9.
- ^ Mudd, Gavin M. (2010). «Global trends and environmental issues in nickel mining: Sulfides versus laterites». Ore Geology Reviews. Elsevier BV. 38 (1–2): 9–26. doi:10.1016/j.oregeorev.2010.05.003. ISSN 0169-1368.
- ^ «Nickel reserves worldwide by country 2020». Statista. Retrieved March 29, 2021.
- ^ Kuck, Peter H. «Mineral Commodity Summaries 2019: Nickel» (PDF). United States Geological Survey. Archived (PDF) from the original on April 21, 2019. Retrieved March 18, 2019.
- ^ Rasmussen, K. L.; Malvin, D. J.; Wasson, J. T. (1988). «Trace element partitioning between taenite and kamacite – Relationship to the cooling rates of iron meteorites». Meteoritics. 23 (2): a107–112. Bibcode:1988Metic..23..107R. doi:10.1111/j.1945-5100.1988.tb00905.x.
- ^ a b Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ^ «The Extraction of Nickel from its Ores by the Mond Process». Nature. 59 (1516): 63–64. 1898. Bibcode:1898Natur..59…63.. doi:10.1038/059063a0.
- ^ a b c Housecroft, C. E.; Sharpe, A. G. (2008). Inorganic Chemistry (3rd ed.). Prentice Hall. p. 729. ISBN 978-0-13-175553-6.
- ^ Housecroft, C. E.; Sharpe, A. G. (2012). Inorganic Chemistry (4th ed.). Prentice Hall. p. 764. ISBN 978-0273742753.
- ^ a b Lascelles, Keith; Morgan, Lindsay G.; Nicholls, David and Beyersmann, Detmar (2019) «Nickel Compounds» in Ullmann’s Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim. doi:10.1002/14356007.a17_235.pub3
- ^ «A Review on the Metal Complex of Nickel (Ii) Salicylhydroxamic Acid and its Aniline Adduct». www.heraldopenaccess.us. Retrieved July 19, 2022.
- ^ «metal — The Reaction Between Nickel and Hydrochloric Acid». Chemistry Stack Exchange. Retrieved July 19, 2022.
- ^ «course hero».
- ^ Jensen, K. A. (1936). «Zur Stereochemie des koordinativ vierwertigen Nickels». Zeitschrift für Anorganische und Allgemeine Chemie. 229 (3): 265–281. doi:10.1002/zaac.19362290304.
- ^ Court, T. L.; Dove, M. F. A. (1973). «Fluorine compounds of nickel(III)». Journal of the Chemical Society, Dalton Transactions (19): 1995. doi:10.1039/DT9730001995.
- ^ «Imara Corporation Launches; New Li-ion Battery Technology for High-Power Applications». Green Car Congress. December 18, 2008. Archived from the original on December 22, 2008. Retrieved January 22, 2009.
- ^ Spokoyny, Alexander M.; Li, Tina C.; Farha, Omar K.; Machan, Charles M.; She, Chunxing; Stern, Charlotte L.; Marks, Tobin J.; Hupp, Joseph T.; Mirkin, Chad A. (June 28, 2010). «Electronic Tuning of Nickel-Based Bis(dicarbollide) Redox Shuttles in Dye-Sensitized Solar Cells». Angew. Chem. Int. Ed. 49 (31): 5339–5343. doi:10.1002/anie.201002181. PMID 20586090.
- ^ Hawthorne, M. Frederick (1967). «(3)-1,2-Dicarbollyl Complexes of Nickel(III) and Nickel(IV)». Journal of the American Chemical Society. 89 (2): 470–471. doi:10.1021/ja00978a065.
- ^ Camasso, N. M.; Sanford, M. S. (2015). «Design, synthesis, and carbon-heteroatom coupling reactions of organometallic nickel(IV) complexes». Science. 347 (6227): 1218–20. Bibcode:2015Sci…347.1218C. CiteSeerX 10.1.1.897.9273. doi:10.1126/science.aaa4526. PMID 25766226. S2CID 206634533.
- ^ Baucom, E. I.; Drago, R. S. (1971). «Nickel(II) and nickel(IV) complexes of 2,6-diacetylpyridine dioxime». Journal of the American Chemical Society. 93 (24): 6469–6475. doi:10.1021/ja00753a022.
- ^ Rosenberg, Samuel J. (1968). Nickel and Its Alloys. National Bureau of Standards. Archived from the original on May 23, 2012.
- ^ a b McNeil, Ian (1990). «The Emergence of Nickel». An Encyclopaedia of the History of Technology. Taylor & Francis. pp. 96–100. ISBN 978-0-415-01306-2.
- ^ Needham, Joseph; Wang, Ling; Lu, Gwei-Djen; Tsien, Tsuen-hsuin; Kuhn, Dieter and Golas, Peter J. (1974) Science and civilisation in China Archived May 3, 2016, at the Wayback Machine. Cambridge University Press. ISBN 0-521-08571-3, pp. 237–250.
- ^ Chambers Twentieth Century Dictionary, p888, W&R Chambers Ltd., 1977.
- ^ a b Baldwin, W. H. (1931). «The story of Nickel. I. How «Old Nick’s» gnomes were outwitted». Journal of Chemical Education. 8 (9): 1749. Bibcode:1931JChEd…8.1749B. doi:10.1021/ed008p1749.
- ^ Baldwin, W. H. (1931). «The story of Nickel. II. Nickel comes of age». Journal of Chemical Education. 8 (10): 1954. Bibcode:1931JChEd…8.1954B. doi:10.1021/ed008p1954.
- ^ Baldwin, W. H. (1931). «The story of Nickel. III. Ore, matte, and metal». Journal of Chemical Education. 8 (12): 2325. Bibcode:1931JChEd…8.2325B. doi:10.1021/ed008p2325.
- ^ Fleisher, Michael and Mandarino, Joel. Glossary of Mineral Species. Tucson, Arizona: Mineralogical Record, 7th ed. 1995.
- ^ Weeks, Mary Elvira (1932). «The discovery of the elements: III. Some eighteenth-century metals». Journal of Chemical Education. 9 (1): 22. Bibcode:1932JChEd…9…22W. doi:10.1021/ed009p22.
- ^ «Industrious, enduring–the 5-cent coin». Royal Canadian Mint. 2008. Archived from the original on January 26, 2009. Retrieved January 10, 2009.
- ^ Molloy, Bill (November 8, 2001). «Trends of Nickel in Coins – Past, Present and Future». The Nickel Institute. Archived from the original on September 29, 2006. Retrieved November 19, 2008.
- ^ a b Lacey, Anna (June 22, 2013). «A bad penny? New coins and nickel allergy». BBC Health Check. Archived from the original on August 7, 2013. Retrieved July 25, 2013.
- ^ «nikkelen dubbele wapenstuiver Utrecht». nederlandsemunten.nl. Archived from the original on January 7, 2015. Retrieved January 7, 2015.
- ^ United States Mint Moves to Limit Exportation & Melting of Coins Archived May 27, 2016, at the Wayback Machine, The United States Mint, press release, December 14, 2006
- ^ «Prohibition on the Exportation, Melting, or Treatment of 5-Cent and One-Cent Coins». Federal Register. April 16, 2007. Retrieved August 28, 2021.
- ^ «United States Circulating Coinage Intrinsic Value Table». Coininflation.com. Archived from the original on June 17, 2016. Retrieved September 13, 2013.
- ^ «Coin Specifications». usmint.gov. Retrieved October 13, 2021.
- ^ Kelly, T. D.; Matos, G. R. «Nickel Statistics» (PDF). U.S. Geological Survey. Archived (PDF) from the original on August 12, 2014. Retrieved August 11, 2014.
- ^ «Mineral Commodity Summaries 2022 — Nickel» (PDF). US Geological Survey. Retrieved May 16, 2022.
- ^ «Nickel» (PDF). U.S. Geological Survey, Mineral Commodity Summaries. January 2013. Archived (PDF) from the original on May 9, 2013. Retrieved September 20, 2013.
- ^ Gazley, Michael F.; Tay, Stephie; Aldrich, Sean. «Polymetallic Nodules». Research Gate. New Zealand Minerals Forum. Retrieved January 27, 2021.
- ^ Mero, J. L. (January 1, 1977). «Chapter 11 Economic Aspects of Nodule Mining». Marine Manganese Deposits. Elsevier Oceanography Series. Vol. 15. pp. 327–355. doi:10.1016/S0422-9894(08)71025-0. ISBN 9780444415240.
- ^ International Seabed Authority. «Strategic Plan 2019-2023» (PDF). isa.org. International Seabed Authority. Retrieved January 27, 2021.
- ^ «The Nickel Mountain Project» (PDF). Ore Bin. 15 (10): 59–66. 1953. Archived from the original (PDF) on February 12, 2012. Retrieved May 7, 2015.
- ^ «Environment Writer: Nickel». National Safety Council. 2006. Archived from the original on August 28, 2006. Retrieved January 10, 2009.
- ^ a b «Operations & Development». Lundin Mining Corporation. Archived from the original on November 18, 2015. Retrieved August 10, 2014.
- ^ a b Davis, Joseph R. (2000). «Uses of Nickel». ASM Specialty Handbook: Nickel, Cobalt, and Their Alloys. ASM International. pp. 7–13. ISBN 978-0-87170-685-0.
- ^ Mond, L.; Langer, K.; Quincke, F. (1890). «Action of carbon monoxide on nickel». Journal of the Chemical Society. 57: 749–753. doi:10.1039/CT8905700749.
- ^ Kerfoot, Derek G. E. (2005). «Nickel». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a17_157.
- ^ Neikov, Oleg D.; Naboychenko, Stanislav; Gopienko, Victor G & Frishberg, Irina V (January 15, 2009). Handbook of Non-Ferrous Metal Powders: Technologies and Applications. Elsevier. pp. 371–. ISBN 978-1-85617-422-0. Archived from the original on May 29, 2013. Retrieved January 9, 2012.
- ^ «LME nickel price graphs». London Metal Exchange. Archived from the original on February 28, 2009. Retrieved June 6, 2009.
- ^ «London Metal Exchange». LME.com. Archived from the original on September 20, 2017.
- ^ Hume, Neil; Lockett, Hudson (March 8, 2022). «LME introduces emergency measures as nickel hits $100,000 a tonne». Financial Times. Archived from the original on December 10, 2022. Retrieved March 8, 2022.
- ^ Burton, Mark; Farchy, Jack; Cang, Alfred. «LME Halts Nickel Trading After Unprecedented 250% Spike». Bloomberg News. Retrieved March 8, 2022.
- ^ Farchy, Jack; Cang, Alfred; Burton, Mark (March 14, 2022). «The 18 Minutes of Trading Chaos That Broke the Nickel Market». Bloomberg News.
- ^ Home, Andy (March 10, 2022). «Column: Nickel, the devil’s metal with a history of bad behaviour». Reuters. Retrieved March 10, 2022.
- ^ American Plumbing Practice: From the Engineering Record (Prior to 1887 the Sanitary Engineer.) A Selected Reprint of Articles Describing Notable Plumbing Installations in the United States, and Questions and Answers on Problems Arising in Plumbing and House Draining. With Five Hundred and Thirty-six Illustrations. Engineering record. 1896. p. 119. Retrieved May 28, 2016.
- ^ «Platinum-Group Element — an overview | ScienceDirect Topics». www.sciencedirect.com. Retrieved October 18, 2022.
- ^ Kharton, Vladislav V. (2011). Solid State Electrochemistry II: Electrodes, Interfaces and Ceramic Membranes. Wiley-VCH. pp. 166–. ISBN 978-3-527-32638-9. Archived from the original on September 10, 2015. Retrieved June 27, 2015.
- ^ Bidault, F.; Brett, D. J. L.; Middleton, P. H.; Brandon, N. P. «A New Cathode Design for Alkaline Fuel Cells (AFCs)» (PDF). Imperial College London. Archived from the original (PDF) on July 20, 2011.
- ^ Magnetostrictive Materials Overview. University of California, Los Angeles.
- ^ Angara, Raghavendra (2009). High Frequency High Amplitude Magnetic Field Driving System for Magnetostrictive Actuators. Umi Dissertation Publishing. p. 5. ISBN 9781109187533.
- ^ Sofronie, Mihaela; Tolea, Mugurel; Popescu, Bogdan; Enculescu, Monica; Tolea, Felicia (September 7, 2021). «Magnetic and Magnetostrictive Properties of Ni50Mn20Ga27Cu3 Rapidly Quenched Ribbons». Materials. 14 (18): 5126. Bibcode:2021Mate…14.5126S. doi:10.3390/ma14185126. ISSN 1996-1944. PMC 8471753. PMID 34576350.
- ^ Cheburaeva, R. F.; Chaporova, I. N.; Krasina, T. I. (1992). «Structure and properties of tungsten carbide hard alloys with an alloyed nickel binder». Soviet Powder Metallurgy and Metal Ceramics. 31 (5): 423–425. doi:10.1007/BF00796252. S2CID 135714029.
- ^ «Krytron Pulse Power Switching Tubes». Silicon Investigations. 2011. Archived from the original on July 16, 2011.
- ^ Uhm, Y. R.; et al. (June 2016). «Study of a Betavoltaic Battery Using Electroplated Nickel-63 on Nickel Foil as a Power Source». Nuclear Engineering and Technology. 48 (3): 773–777. doi:10.1016/j.net.2016.01.010.
- ^ Bormashov, V. S.; et al. (April 2018). «High power density nuclear battery prototype based on diamond Schottky diodes». Diamond and Related Materials. 84: 41–47. Bibcode:2018DRM….84…41B. doi:10.1016/j.diamond.2018.03.006.
- ^ Khan, Abdul Rehman; Awan, Fazli Rabbi (January 8, 2014). «Metals in the pathogenesis of type 2 diabetes». Journal of Diabetes and Metabolic Disorders. 13 (1): 16. doi:10.1186/2251-6581-13-16. PMC 3916582. PMID 24401367.
- ^ a b c Astrid Sigel; Helmut Sigel; Roland K. O. Sigel, eds. (2008). Nickel and Its Surprising Impact in Nature. Metal Ions in Life Sciences. Vol. 2. Wiley. ISBN 978-0-470-01671-8.
- ^ a b c Sydor, Andrew; Zamble, Deborah (2013). Banci, Lucia (ed.). Nickel Metallomics: General Themes Guiding Nickel Homeostasis. Metal Ions in Life Sciences. Vol. 12. Dordrecht: Springer. pp. 375–416. doi:10.1007/978-94-007-5561-1_11. ISBN 978-94-007-5561-1. PMID 23595678.
- ^ Zamble, Deborah; Rowińska-Żyrek, Magdalena; Kozlowski, Henryk (2017). The Biological Chemistry of Nickel. Royal Society of Chemistry. ISBN 978-1-78262-498-1.
- ^ Covacci, Antonello; Telford, John L.; Giudice, Giuseppe Del; Parsonnet, Julie; Rappuoli, Rino (May 21, 1999). «Helicobacter pylori Virulence and Genetic Geography». Science. 284 (5418): 1328–1333. Bibcode:1999Sci…284.1328C. doi:10.1126/science.284.5418.1328. PMID 10334982. S2CID 10376008.
- ^ Cox, Gary M.; Mukherjee, Jean; Cole, Garry T.; Casadevall, Arturo; Perfect, John R. (February 1, 2000). «Urease as a Virulence Factor in Experimental Cryptococcosis». Infection and Immunity. 68 (2): 443–448. doi:10.1128/IAI.68.2.443-448.2000. PMC 97161. PMID 10639402.
- ^
Stephen W., Ragdale (2014). «Chapter 6. Biochemistry of Methyl-Coenzyme M Reductase: The Nickel Metalloenzyme that Catalyzes the Final Step in Synthesis and the First Step in Anaerobic Oxidation of the Greenhouse Gas Methane«. In Peter M.H. Kroneck; Martha E. Sosa Torres (eds.). The Metal-Driven Biogeochemistry of Gaseous Compounds in the Environment. Metal Ions in Life Sciences. Vol. 14. Springer. pp. 125–145. doi:10.1007/978-94-017-9269-1_6. ISBN 978-94-017-9268-4. PMID 25416393. - ^
Wang, Vincent C.-C.; Ragsdale, Stephen W.; Armstrong, Fraser A. (2014). «Chapter 4. Investigations of the Efficient Electrocatalytic Interconversions of Carbon Dioxide and Carbon Monoxide by Nickel-Containing Carbon Monoxide Dehydrogenases». In Peter M.H. Kroneck; Martha E. Sosa Torres (eds.). The Metal-Driven Biogeochemistry of Gaseous Compounds in the Environment. Metal Ions in Life Sciences. Vol. 14. Springer. pp. 71–97. doi:10.1007/978-94-017-9269-1_4. ISBN 978-94-017-9268-4. PMC 4261625. PMID 25416391. - ^ Szilagyi, R. K.; Bryngelson, P. A.; Maroney, M. J.; Hedman, B.; et al. (2004). «S K-Edge X-ray Absorption Spectroscopic Investigation of the Ni-Containing Superoxide Dismutase Active Site: New Structural Insight into the Mechanism». Journal of the American Chemical Society. 126 (10): 3018–3019. doi:10.1021/ja039106v. PMID 15012109.
- ^ Greig N; Wyllie S; Vickers TJ; Fairlamb AH (2006). «Trypanothione-dependent glyoxalase I in Trypanosoma cruzi». Biochemical Journal. 400 (2): 217–23. doi:10.1042/BJ20060882. PMC 1652828. PMID 16958620.
- ^ Aronsson A-C; Marmstål E; Mannervik B (1978). «Glyoxalase I, a zinc metalloenzyme of mammals and yeast». Biochemical and Biophysical Research Communications. 81 (4): 1235–1240. doi:10.1016/0006-291X(78)91268-8. PMID 352355.
- ^ Ridderström M; Mannervik B (1996). «Optimized heterologous expression of the human zinc enzyme glyoxalase I». Biochemical Journal. 314 (Pt 2): 463–467. doi:10.1042/bj3140463. PMC 1217073. PMID 8670058.
- ^ Saint-Jean AP; Phillips KR; Creighton DJ; Stone MJ (1998). «Active monomeric and dimeric forms of Pseudomonas putida glyoxalase I: evidence for 3D domain swapping». Biochemistry. 37 (29): 10345–10353. doi:10.1021/bi980868q. PMID 9671502.
- ^ Thornalley, P. J. (2003). «Glyoxalase I—structure, function and a critical role in the enzymatic defence against glycation». Biochemical Society Transactions. 31 (Pt 6): 1343–1348. doi:10.1042/BST0311343. PMID 14641060.
- ^ Vander Jagt DL (1989). «Unknown chapter title». In D Dolphin; R Poulson; O Avramovic (eds.). Coenzymes and Cofactors VIII: Glutathione Part A. New York: John Wiley and Sons.
- ^ Zambelli, Barbara; Ciurli, Stefano (2013). «Chapter 10. Nickel: and Human Health». In Astrid Sigel; Helmut Sigel; Roland K. O. Sigel (eds.). Interrelations between Essential Metal Ions and Human Diseases. Metal Ions in Life Sciences. Vol. 13. Springer. pp. 321–357. doi:10.1007/978-94-007-7500-8_10. ISBN 978-94-007-7499-5. PMID 24470096.
- ^ Nickel. IN: Dietary Reference Intakes for Vitamin A, Vitamin K, Arsenic, Boron, Chromium, Copper, Iodine, Iron, Manganese, Molybdenum, Nickel, Silicon, Vanadium, and Copper Archived September 22, 2017, at the Wayback Machine. National Academy Press. 2001, PP. 521–529.
- ^ Kamerud KL; Hobbie KA; Anderson KA (August 28, 2013). «Stainless Steel Leaches Nickel and Chromium into Foods During Cooking». Journal of Agricultural and Food Chemistry. 61 (39): 9495–501. doi:10.1021/jf402400v. PMC 4284091. PMID 23984718.
- ^ Flint GN; Packirisamy S (1997). «Purity of food cooked in stainless steel utensils». Food Additives & Contaminants. 14 (2): 115–26. doi:10.1080/02652039709374506. PMID 9102344.
- ^
Schirber, Michael (July 27, 2014). «Microbe’s Innovation May Have Started Largest Extinction Event on Earth». Space.com. Astrobiology Magazine. Archived from the original on July 29, 2014. Retrieved July 29, 2014.…. That spike in nickel allowed methanogens to take off.
- ^ «Nickel 203904». Sigma Aldrich. Archived from the original on January 26, 2020. Retrieved January 26, 2020.
- ^ Haber, Lynne T; Bates, Hudson K; Allen, Bruce C; Vincent, Melissa J; Oller, Adriana R (2017). «Derivation of an oral toxicity reference value for nickel». Regulatory Toxicology and Pharmacology. 87: S1–S18. doi:10.1016/j.yrtph.2017.03.011. PMID 28300623.
- ^ Rieuwerts, John (2015). The Elements of Environmental Pollution. London and New York: Earthscan Routledge. p. 255. ISBN 978-0-415-85919-6. OCLC 886492996.
- ^ Butticè, Claudio (2015). «Nickel Compounds». In Colditz, Graham A. (ed.). The SAGE Encyclopedia of Cancer and Society (Second ed.). Thousand Oaks: SAGE Publications, Inc. pp. 828–831. ISBN 9781483345734.
- ^ a b IARC (2012). «Nickel and nickel compounds» Archived September 20, 2017, at the Wayback Machine in IARC Monogr Eval Carcinog Risks Hum. Volume 100C. pp. 169–218..
- ^ a b Regulation (EC) No 1272/2008 of the European Parliament and of the Council of 16 December 2008 on Classification, Labelling and Packaging of Substances and Mixtures, Amending and Repealing Directives 67/548/EEC and 1999/45/EC and amending Regulation (EC) No 1907/2006 [OJ L 353, 31.12.2008, p. 1]. Annex VI Archived March 14, 2019, at the Wayback Machine. Accessed July 13, 2017.
- ^ a b Globally Harmonised System of Classification and Labelling of Chemicals (GHS) Archived August 29, 2017, at the Wayback Machine, 5th ed., United Nations, New York and Geneva, 2013..
- ^ a b National Toxicology Program. (2016). «Report on Carcinogens» Archived September 20, 2017, at the Wayback Machine, 14th ed. Research Triangle Park, NC: U.S. Department of Health and Human Services, Public Health Service..
- ^ a b «Report of the International Committee on Nickel Carcinogenesis in Man». Scandinavian Journal of Work, Environment & Health. 16 (1 Spec No): 1–82. 1990. doi:10.5271/sjweh.1813. JSTOR 40965957. PMID 2185539.
- ^ a b National Toxicology Program (1996). «NTP Toxicology and Carcinogenesis Studies of Nickel Subsulfide (CAS No. 12035-72-2) in F344 Rats and B6C3F1 Mice (Inhalation Studies)». National Toxicology Program Technical Report Series. 453: 1–365. PMID 12594522.
- ^ National Toxicology Program (1996). «NTP Toxicology and Carcinogenesis Studies of Nickel Oxide (CAS No. 1313-99-1) in F344 Rats and B6C3F1 Mice (Inhalation Studies)». National Toxicology Program Technical Report Series. 451: 1–381. PMID 12594524.
- ^ Cogliano, V. J; Baan, R; Straif, K; Grosse, Y; Lauby-Secretan, B; El Ghissassi, F; Bouvard, V; Benbrahim-Tallaa, L; Guha, N; Freeman, C; Galichet, L; Wild, C. P (2011). «Preventable exposures associated with human cancers». JNCI Journal of the National Cancer Institute. 103 (24): 1827–39. doi:10.1093/jnci/djr483. PMC 3243677. PMID 22158127.
- ^ Heim, K. E; Bates, H. K; Rush, R. E; Oller, A. R (2007). «Oral carcinogenicity study with nickel sulfate hexahydrate in Fischer 344 rats». Toxicology and Applied Pharmacology. 224 (2): 126–37. doi:10.1016/j.taap.2007.06.024. PMID 17692353.
- ^ a b Oller, A. R; Kirkpatrick, D. T; Radovsky, A; Bates, H. K (2008). «Inhalation carcinogenicity study with nickel metal powder in Wistar rats». Toxicology and Applied Pharmacology. 233 (2): 262–75. doi:10.1016/j.taap.2008.08.017. PMID 18822311.
- ^ National Toxicology Program (1996). «NTP Toxicology and Carcinogenesis Studies of Nickel Sulfate Hexahydrate (CAS No. 10101-97-0) in F344 Rats and B6C3F1 Mice (Inhalation Studies)». National Toxicology Program Technical Report Series. 454: 1–380. PMID 12587012.
- ^ Springborn Laboratories Inc. (2000). «An Oral (Gavage) Two-generation Reproduction Toxicity Study in Sprague-Dawley Rats with Nickel Sulfate Hexahydrate.» Final Report. Springborn Laboratories Inc., Spencerville. SLI Study No. 3472.4.
- ^ Vaktskjold, A; Talykova, L. V; Chashchin, V. P; Odland, J. O; Nieboer, E (2008). «Maternal nickel exposure and congenital musculoskeletal defects». American Journal of Industrial Medicine. 51 (11): 825–33. doi:10.1002/ajim.20609. PMID 18655106.
- ^ «CDC – NIOSH Pocket Guide to Chemical Hazards – Nickel metal and other compounds (as Ni)». www.cdc.gov. Archived from the original on July 18, 2017. Retrieved November 20, 2015.
- ^ Stellman, Jeanne Mager (1998). Encyclopaedia of Occupational Health and Safety: Chemical, industries and occupations. International Labour Organization. pp. 133–. ISBN 978-92-2-109816-4. Archived from the original on May 29, 2013. Retrieved January 9, 2012.
- ^ Barceloux, Donald G.; Barceloux, Donald (1999). «Nickel». Clinical Toxicology. 37 (2): 239–258. doi:10.1081/CLT-100102423. PMID 10382559.
- ^ a b Position Statement on Nickel Sensitivity Archived September 8, 2015, at the Wayback Machine. American Academy of Dermatology(August 22, 2015)
- ^ Thyssen J. P.; Linneberg A.; Menné T.; Johansen J. D. (2007). «The epidemiology of contact allergy in the general population—prevalence and main findings». Contact Dermatitis. 57 (5): 287–99. doi:10.1111/j.1600-0536.2007.01220.x. PMID 17937743. S2CID 44890665.
- ^ Dermal Exposure: Nickel Alloys Archived February 22, 2016, at the Wayback Machine Nickel Producers Environmental Research Association (NiPERA), accessed 2016 Feb.11
- ^ Nestle, O.; Speidel, H.; Speidel, M. O. (2002). «High nickel release from 1- and 2-euro coins». Nature. 419 (6903): 132. Bibcode:2002Natur.419..132N. doi:10.1038/419132a. PMID 12226655. S2CID 52866209.
- ^ Dow, Lea (June 3, 2008). «Nickel Named 2008 Contact Allergen of the Year». Nickel Allergy Information. Archived from the original on February 3, 2009.
- ^ Salnikow, k.; Donald, S. P.; Bruick, R. K.; Zhitkovich, A.; et al. (September 2004). «Depletion of intracellular ascorbate by the carcinogenic metal nickel and cobalt results in the induction of hypoxic stress». Journal of Biological Chemistry. 279 (39): 40337–44. doi:10.1074/jbc.M403057200. PMID 15271983.
- ^ Das, K. K.; Das, S. N.; Dhundasi, S. A. (2008). «Nickel, its adverse health effects and oxidative stress» (PDF). Indian Journal of Medical Research. 128 (4): 117–131. PMID 19106437. Archived from the original (PDF) on April 10, 2009. Retrieved August 22, 2011.
External links
Wikimedia Commons has media related to Nickel.
Look up nickel in Wiktionary, the free dictionary.
- Nickel at The Periodic Table of Videos (University of Nottingham)
- CDC – Nickel – NIOSH Workplace Safety and Health Topic
- An occupational hygiene assessment of dermal nickel exposures in primary production industries by GW Hughson. Institute of Occupational Medicine Research Report TM/04/05
- An occupational hygiene assessment of dermal nickel exposures in primary production and primary user industries. Phase 2 Report by GW Hughson. Institute of Occupational Medicine Research Report TM/05/06
- «The metal that brought you cheap flights», BBC News
Никель (niccolum) относится к 10-группе периодической таблицы Менделеева, компонент обозначается Ni. Его атомный номер (число) 28. В жизни человека Ni стал широко известен относительно недавно — в 1751 году получили первые данные. Используют Ni в металлургии, когда нужна работа с широкой разнообразностью высоких температур. В статье ниже разберем основные моменты, связанные с путем обработки, свойствами и применением никелевых сплавов, а также историю никелевого элемента.
Что такое Никель
Характерной особенностью элемента Ni является стойкость к возникновению коррозии в условиях агрессивной среды и стойкость к высокотемпературному режиму. Детали, которые изготавливаются из данного материала, отличаются устойчивостью к воздействию высокотемпературного режима, также используют вещество Ni как покрытие порошком. При этом конструкция не теряет первоначальной прочности. Возможно применение таких сплавов в агрессивных и химических средах, изделия выдерживают высокую температуру (зависит от того, из чего сплав состоит).
Визуально элемент выглядит как металл с типичным серебристым блеском. Присутствует небольшой желтоватый оттенок. Обладает хорошей пластичностью и ковкостью. Это мощный природный ферромагнетик, который легко притягивается к металлу.
В природе никель имеет обширное распространение. Доля в земной коре составляет 0,01%. Совместно с сульфидами и мышьяком, кремнием принимает участие в образовании некоторых солей.
В некоторых метеоритах его концентрация варьируется в диапазоне 5-25%. По последним данным у Никеля присутствует 5 изотопов естественного происхождения. Также представлен целый ряд искусственного синтезированных.
Структура и состав никеля
Никель – это чистый металл, обладающий однородной упорядоченной структурой. Поэтому он имеет отличную способность проведения тока. Однако определяются способности материала фазовым составом.
- β-модификация применяется при нормальных условиях. Отличительной особенностью является гранецентрированная кубическая решетка, которая наделяет металл привычными свойствами (пластичностью, стойкостью к механическим повреждениям, ковкостью и т.д.);
- α-модификацию. Появляется случае катодного распыления в водородной атмосфере. Модификация не начинает реагировать, но при этом изменяется структура. Отличается наличием гексоральной решетки с высокой плотностью. Перед в β-модификацию происходит только при нагревании в 200 градусов.
Как правило, в промышленной сфере используется преимущественно β-модификация.
История открытия никеля
С давних времен, рудокопы на юго-Востоке Германии, заметили, что в процессе работы встречаются странные камни горной руды, визуально похожие на медную руду. Однако ни одна попытка извлечения руды и других соединений не закончилась благополучно. Этот металл, как и руды, называли по-разному. В связи с этим, среди профессиональных шахтеров появилось название «бездельник», так как серебристо-белый материал не пригоден для использования, изготовления изделий.
По одной из легенд элемент получил свое название от имени коварного гнома. Nickel — бранное слово саксонских горняков в средние века, что значило тролль или гном. По верованиям, он подбрасывал горнякам минерал, в составе которого присутствует мышьяк и никель.
Также некоторые статьи рассказывают о духе гор Nickel («озорник»). Данное название имеет и другое народное созвучие Nicolaus (что означает очень опасного дьявола). Но сама руда первоначально получила название «Купферникель».
Преобладающая масса сульфидных медно-никелевых месторождений руды сформировалась на стадии активизации древних платформ в связи с трапповым магматизмом. Адсорбция меди, никеля и железа, а также элемента кобальт цеолитом из водных растворов в динамическом режиме дало хороший результат.
Первые результаты дало исследование металла в 1751 году. Шведский химик Аксель Кронстедт занимался изучением свойств различных минералов. В результате лабораторных исследований, ученому удалось выделить странный оксид ярко-зеленного оттенка из купферникеля. За счет реакции восстановления, удалось получить неизвестный металл с белым, а не с желтым оттенком. Таких сталей было немного.
Подтвердил теорию о том, что новое вещество включает целую смесь металлов, еще один химик из Швеции Т. Бергман. Выделить чистый никель без присадок получилось только через 50 лет немецкому ученому И. Рихтеру. Никелевый купорос использовался как основное сырье для проведения работы в лабораторных условиях.
В настоящее время специалисты, работающие в химической промышленности, с точностью могут объяснить, почему рудокопы не смогли изъять медь и железо из этой руды. Согласно современной номенклатуре, это Никелин (арсенид никеля).
Свойства и характеристики
Физические свойства никеля
Никель является ферромагнетиком, поэтому при отсутствии внешнего магнитного поля обладает намагниченностью. Точки Кюри для никеля равна 358 градусов. Находясь на открытом воздухе металл сохраняет первоначальную яркость цвета. Также известно, что при обычных температурах на воздухе покрывается тонкой плёнкой.
С основными физическими свойствами на открытом воздухе и температурами можно ознакомиться в следующей таблице:
|
Характеристика |
Показатель |
|
Решетка |
Кубическая гранецентрированная |
|
Плотность, в г/см3 |
8,902 |
|
1453 |
|
|
Удельная температура плавления, в кДж/моль |
17,61 |
|
Коэффициент упругости поверхности |
196−210 ГПа или 20000 кГ/мм2 |
|
Кипение, в градусах |
3000 |
|
Удельная температура испарения, в кДж/моль |
378,6 |
|
Молярная (атомная) теплоемкость, Дж/(K*моль) |
26,1 |
|
Удельная теплоемкость, кдж/(кг*К) |
0,440 |
|
Теплопроводность, Вт/(м*К) |
90,9 |
|
Удельное электрическое сопротивление, мкОм*м |
0,0684 |
|
ПДК соединений никеля в воздухе |
0,0002 до 0,001 мг/м3 (для различных соединений) |
Химические свойства никеля
Никель относится к группе малоактивных химических веществ. На поверхности происходит образование оксидной пленки, за счет чего элемент проявляет стойкость в различных средах: щелочи, кислоте, воде. Не подвергается воздействию коррозии.
С участием никеля образуется 3 вида соли, которые растворяются в воде (хлорид, сульфат, нитрат). Так как у них присутствует желтоватый цвет с коричневатым оттенком, раствор приобретает зеленоватый оттенок. К нерастворимым солям относят: фосфат, оксалат и сульфид. Окрашены в черный, зеленый и бронзовый оттенки.
Никель имеет способность к поглощению газов, что приводит к ухудшению первоначальных механических характеристик. Реакция с кислородом происходит при температуре в 500 градусов. Когда никель находится в мелкой дисперсии, то может самостоятельно воспламеняться на открытом воздухе. При нагревании никель способен объединяться с галогенами.
Когда происходит горение в сере, возникает сульфид, а при нагревании оксида никеля – моносульфид. Нитрат или оксид образуется в результате реакции с азотной кислотой.
Никель имеет схожие химические свойства с кобальтом и железом. Меньше схожих характеристик присутствует с медью, железом или благородными металлами. Возгорание происходит только в порошкообразном состоянии. Имеет переменную валентность.
Химия никеля:
- Молярный (атомный) объём: 6,6 см³/моль
- Молярная масса: 58,6934 а. е. м.
- Радиус атома: 124 пм
- Ядро никеля содержит 58 нуклонов, из которых 28 протонов
- Содержит смеси пяти стабильных изотопов: 58Ni (67,76%), 60Ni (26,16%), 61Ni (1,25%), 63Ni (3,66%), 64Ni (1,16%).
Оптические свойства никеля
Ознакомиться с оптическими свойствами можно из содержания следующей таблицы:
|
Параметр |
Показатель |
|
Тип |
Изотроп |
|
Отраженный свет |
Белый с голубоватым оттенком |
|
Плеохроизм |
Нет |
|
Люминесценция в ультрафиолете |
нет |
Кристаллографические свойства никеля
|
Параметр |
Показатель |
|
Точечная группа |
Изометрический гексаоктаэдральный |
|
Пространственная группа |
Fm3m |
|
Сингония |
Кубическая |
|
Значение ячейки |
3,5238Å |
|
Двойникование |
Отсутствует |
Магнитные свойства никеля
Никель обладает магнитными свойствами, которые получили описание Дж. П. Джоулем в 1842 году. В это время ученый наблюдал, как увеличивается длина стального прутка при намагничивании. Спустя 35 лет ученые решили подробно рассмотреть свойства кобальта, никеля. По результатам наблюдений был сделан вывод, что длина кобальтового прутка также увеличивается, а у никеля такой эффект не возникает в рамках магнитного поля.
В 1882 году ученые сделали вывод, что металл не удлиняется, а напротив, укорачивается (магнитострикция). Принцип данного явления заключается в том, чтобы на внешнее магнитное поле накладывать домены (микромагниты металла), выстраивание которых происходит в одном направлении, что способствует деформации решетки.
Соответственно в ферромагнитных материалах происходит более быстрое затухание в сравнении с неферромагнитными: когда происходит изменение намагниченности, то энергия расходуется в несколько раз быстрее. Благодаря появлению термина «магнитомеханического затухания» появилась возможность создавать более прочные сплавы, которые используются при изготовлении турбин и других элементов, подвергающихся сильным вибрациям.
Никелевый стержень часто становится главным источником ультразвука. При раскачивании достигается максимальная амплитуда колебаний до 0,01%. За счет ультразвука возникает плотное, блестящее покрытие из металла.
Не менее интересный факт, что при изучении состава метеорита, никель был обнаружен в метеорите, который упал в хорватской деревне Грашина. Вес объекта составил 71 венский фунт.
Месторождения никеля
Месторождение металла имеет взаимосвязь лополитоподобными или плитообразными массивами габброидов. Характерной особенностью никелевых месторождений является наличие точного состава руды (пирротина, самородного золота, халькопирита, пентландита). Присутствуют и другие вещества в руде, например, минеральная группа платины, гарниерит. Приблизительный химический состав минерала гарниерита: окись никеля (NiO) 30 — 38%, кремнезем (SiO2) 44,1%, вода (Н2О) 12,9 — 17%.
Экзогенные виды месторождений руды с Ni имеют прямую взаимосвязь с выветриванием серпентинитов. Из-за чего происходит разложение минералов в несколько стадий, как и перенос движущихся элементов за счет воды. Далее происходит выпад данных элементов в качестве вторичного осадка.
По последней информации, общий мировой запас никеля 75 млн. тонн. Большая концентрация металла находится в следующих государствах:
- Доминикана;
- ЮАР;
- США;
- Канада;
- Индонезия;
- Филиппины;
- Австралия;
- Новая Каледония.
На территории России находится обширный запах никелевой руды. Самые крупные месторождения находятся в Мурманской области (Мончегорское), Среднем Урале (Елизаветинское), Норильском районе (Талнахское).
Получение никеля
При наличии в магме серы никель наряду с медью и железом, обособляется в виде сульфидов. В процессе раскристаллизации сульфидного расплава возникают магматические месторождения сульфидных медно-никелевых руд. Добыча руды происходит двумя способами:
- Открытым.
- Шахтным.
Выбор метода зависит от того, на какой глубине находятся залежи никеля и какова мощность обнаруженного пласта. Разработка на большинстве карьеров была приостановлена в связи с тем, что запасы были истощены. Соответственно подземная добыча стала наиболее распространенным методом Ni.
Перед тем, как сделать окончательный выбор в пользу конкретного метода добычи, учитывается состав, который часто включает другие химические элементы. Чаще всего встречается фосфор, цинк, мышьяк, сера.
Промышленная переработка начинается с этапа обогащения, когда пустая порода отделяется и формируется концентрат. Его специально прокаливают при помощи углеродной пыли. Далее выщелачивание посредством аммиака, где затем раствор начинает осаждаться.
Когда очистка подходит к завершению, получается промежуточный продукт, в котором количество примесей в несколько раз меньше в сравнении с исходным материалом. Сюда относят штейны и файнштейны.
Алюминотермический способ предполагает обработку оксидную руду цветметаллов посредством порошкообразного (порошок) алюминия.
На завершающем этапе на предприятиях используется электромеханический способ, либо газовый перенос. Не менее популярным является карбонильный способ (метод Монда), где в качестве промежуточного результата происходило образование тетракарбонила. Далее происходит реакция разложения до выделения чистого металла в специальном оборудовании с высоким давлением.
Если кратко, то основную массу никеля получают из гарниерита и магнитного колчедана.
- Силикатную руду восстанавливают угольным порошком во вращающихся трубчатых печах до железо-никелевых окатышей, которые, как известно, очищают от серы, прокаливают и обрабатывают раствором аммиака. После подкисления раствора из него электролитически получают металл.
- Можно использовать и карбонильный способ (метод Монда). Вначале из сульфидной руды получают медно-никелевый штейн, над которым пропускают СО под высоким давлением. Затем термическим разложением которого выделяют особо чистый металл.
- Получают также алюминотермическим методом восстановления никеля из оксидной руды. Это вариант используют реже.
Классификация никеля
В статье мы разобрали где и что содержит Ni, его цвет, тип поверхности и его содержание в сплавах. Теперь важно понять его классификацию. Никель можно поделить на два типа:
- Кислотостойкие. Это тип сплава легированный другими металлами. Например, хромом, вольфрамом, которые придают стойкости в агрессивных окислительных средах. Или добавляют медь или молибден для агрессивных неокислительных средах. Высокую коррозионную стойкость обеспечивают кремний, алюминий.
- Жаропрочные. Это соединения формата «никель + хром + другие легирующие элементы». Обычно в качестве легирующих используются алюминий, вольфрам, титан, молибден, стронций.
Современная классификация никеля включает следующие виды марок, согласно ГОСТ:
- H0, H1. Это первичный металл, где содержание никеля составляет 99%. Для получения металла используется метод электролиза;
- H2, H3, H4. Концентрация никеля и кобальта 99,8, 98,7 процентов. Для получения качественных сплавов, используется электролиз, огневое рафинирование;
- полуфабрикатным считается НП1, НП2, НП3, НП4. Материал с вместимостью 99,9-99,3%. Производство осуществляется в виде листов, лент и проволоки;
- анодные сплавы НПА1, НПА 2. Материал преимущественно выпускается в виде стержней и листов;
- НПАН. Концентрация металла 99,4%. Непассивирующийся сплав;
- НК0,2. Как правило, производится в форме проволоки. Кремниевый состав, который включает 99,4%;
- НMц1, НMц2, HМц2,5, НMц5. Марганцевые сплавы, где уровень никеля не должен быть менее 89,5%.
В составе этих типов никеля содержится от 97,6 до 99,99 % в сумме с небольшим процентом кобальта (Co) — от 0,005 до 0,7 %. В остальную массу входит смесь этих элементов, в зависимости от степени очистки:
- Углерод (C) — есть во всех марках никеля.
- Магний (Mg).
- Алюминий (Al).
- Кремний (Si).
- Фосфор (P).
- Сера (S) — есть во всех марках.
- Марганец (Mn).
- Железо (Fe).
- Медь (Cu) — есть во всех марках.
- Цинк (Zn).
- Мышьяк (As)
- Кадмий Cd).
- Олово (Sn).
- Сурьма (Sb).
- Свинец (Pb).
- Висмут (Bi).
Применение никеля
В основном Ni и никелевые изделия применяют в металлургии. Чистый никель популярен как катализатор. Он представляет собой пластичный, ковкий, серебристо-белый металл, стабилен. Однако наиболее известно его применение для изготовления сплавов. Никельсодержащие сплавы имеют комплексные преимущества для работы в щелочных средах без страха окисления. Никелевые сплавы необходимы для создания аппаратуры, электронных приборов, а в некоторых странах его применяют для монет вместе с серебром. Сплавы, которые содержат достаточно никеля и выполнены по технологии необходимы почти во всех сферах жизни. Никелевые сплавы обладают коррозионной стойкостью, высокой прочностью и пластичностью, увеличенной прокаливаемостью, проходят при добавлении Ni через изменение коэффициента теплового расширения.
Есть и другая процедура — нанесение никеля, который превращают в порошок, и распыляют на поверхности твердых сплавов тонкой пленкой. Эта процедура называется “никелирование”, благодаря ей изделия получают устойчивость от термического воздействия, коррозии. Наиболее распространены электролитическое (гальваническое) и химическое никелирование.
До официального признания никеля и никелевых сплавов, которые он образует, его применяли совсем для других целей — в стекловарении для окраски стекол в зеленый цвет.
Никелевые сплавы популярны в таких сферах:
- в бытовой сфере: многие покупатели предпочитают краны, фурнитуру для мебели, смесители. Многие металлические конструкции имеют слой серебристого металла. Также встречаются столовые приборы;
- производство белого золота. В составе присутствует никелевый сплав конкретной пробы;
- электротехника: в большом количестве изготавливаются никель-кадмиевые АКБ. Никель-цинковые АКБ составляют высокую конкуренцию свинцовым аккумуляторам. Но больше всего в никеле нуждается цветная и черная металлургия. Чтобы получить нержавейку, требуется 67% никеля. Для изготовления других сплавов 17%.
- нержавеющая сталь используется практически повсеместно: в машиностроении, производстве трубопроводов, медицине. Никель обеспечивает высокую устойчивость к коррозии и негативным внешним факторам;
- никель-медные конструкции используются в производстве прочных конструкций, которые должны работать в химически-агрессивных условиях;
- не существует аналогов для изготовления газовых турбин.
Биологическая роль никеля
Никель является жизненно важным микроэлементом. В растениях концентрация составляет 0,00005 %, у наземных животных — 0,000001 %, для морских животных – 0,00016%.
Что касается человеческого организма, то до сих пор данная тема остается не до конца изученной. Никель принимает участие в ферментативных реакциях. Небольшая концентрация содержится в головном мозге и многих внутренних органах: печени, поджелудочной, щитовидке. Но он необходим организму наряду с железом.
Преимущества и недостатки никеля
По отношению к сельскохозяйственной сфере, никель обладает только преимуществами. К основным достоинствам никеля можно отнести следующие аспекты:
- имеет высокий уровень прочности и твердости. Металл сохраняет высокую вязкость;
- металл проявляет стойкость к возникновению коррозии;
- используется при производстве прочных конструкций атомных реакторов;
- в сплавах никель используется в изготовлении и производстве станков, пищевом производстве и других сферах, где требуется применение огнеупорного металла;
- благодаря самопроизвольному намагничиванию, используется в производстве магнитов;
- является безопасным аналогом свинца.
Что касается недостатков, то можно отметить только способ извлечения из земли, о котором выше в статье.
Цена
Согласно последней информации на Лондонской бирже металлов, стоимость никеля составляет 24 594 долларов США за тонну. Что довольно дорого для металлов.
Мы предлагаем качественную сталь и металлы по доступной стоимости с доставкой по всей России. На всю продукцию имеются сертификаты соответствия качеству. Поэтому каждый клиент может рассчитывать на лучшие условия сотрудничества. Для оформления заказа или уточнения цены — звоните, наши менеджеры быстро сориентируют по наличию и другим вопросам. Также можете оформить заказ через корзину сайта.
Никель — металл с атомным номером 28. Обозначается символом Ni. Он имеет серебристо-белый оттенок, в нормальных условиях покрывается оксидной пленкой. Благодаря своей пластичности, никель легко поддается ковке.
Физические свойства
Никель — ферромагнетик, то есть при температуре ниже точки Кюри он обладает намагниченностью при отсутствии внешнего магнитного поля. Для никеля точка Кюри составляет 358 ⁰С. Металл не тускнеет на открытом воздухе.
Основные физические свойства никеля:
- Структура решетки — кубическая гранецентрированая.
- Плотность при нормальных условиях — 8,902 г/см3.
- Температура плавления — 1453 ⁰С.
- Удельная теплота плавления — 17,61 кДж/моль.
- Температура кипения – 3000 ⁰С.
- Удельная теплота испарения — 378,6 кДж/моль.
- Молярная теплоемкость — 26,1 Дж/(K*моль)
- Удельная теплоемкость — 0,440 кдж/(кг*К).
- Теплопроводность — 90,9 Вт/(м*К).
- Удельное электрическое сопротивление — 0,0684 мкОм*м.
История
Никель был официально открыт в 1751 году химиком Акселем Кронстедтом, который нашел его в кобальтовой земле. Однако еще раньше его раскапывали в горах Саксонии. Горняки использовали руду, содержащую никель, для изготовления стекла. По внешним признакам саксонцы сначала принимали эту руду за серебряную и пытались переплавить ее в драгоценный металл, но этого не получалось. Кроме того, при плавлении из руды выделялся ядовитый газ, который наносил вред горнякам. Неудачу потерпели и попытки добыть из этой руды медь.
В итоге в конце XVII в. саксонцы назвали руду «купферникель», что в переводе означает «медный дьявол». Это связано с тем, что горняки считали выделение ядовитого газа происками злых духов, обитавших в горах. Именно купферникель исследовал Аксель Кронстедт в 1751 году. Он получил из него окисел зеленого цвета и восстановил его до металла, который до этого не был известен науке. Химик назвал этот металл никелем.
В 1775 году Торберн Улаф Бергман получил никель в более чистом виде и подробнее описал его свойства. Он выяснил, что по своему составу этот металл больше похож на железо, чем на медь. В конце XVIII – начале XIX вв. многие химики, начиная с Жозефа Луи Пруста, детально изучали никель. В 1804 году немецкий химик Иеремия Вениамин Рихтер получил наконец чистый металл, и никель окончательно утвердился как химический элемент.
Биологическая роль
Никель — микроэлемент, который необходим всем живым организмам. Его среднее содержание в растениях — 0,00005 %, в наземных животных — 0,000001 %, в морских — 0,00016 % массы тела.
Роль никеля в организме изучена не до конца. Известно, что он участвует в ферментативных реакциях и влияет на окислительные процессы. Он содержится в легких, печени, мышцах, поджелудочной и щитовидной железах, некоторых отделах головного мозга. Микроэлемент также накапливается в ороговевших тканях человека, животных и птиц, в том числе в волосах и перьях.
Избыточное содержание никеля в растениях приводит к уродливым формам, в организме животных — к различным глазным заболеваниям (кератоконъюнктивитам, кератитам).
Пары и пыль никеля токсичны и могут вызывать поражения кожи, легких и носоглотки, а частое вдыхание паров металла опасно появлением злокачественных новообразований.
Нахождение в природе и производство
Больше всего никеля содержится в глубоких слоях. В земной коре — его 0,0058%, в ультраосновных породах — 0,2 %. Если верить гипотезе, что земное ядро состоит из никелистого железа, общее содержание никеля в земле составляет примерно 3%. Никель также обнаружен в некоторых метеоритах.
В земной коре этот металл соседствует с железом и магнием, с которыми он имеет сходную валентность. В минералах магния и железа никель содержится в виде изоморфной примеси. Также существует 53 известных науке минерала никеля. Большая часть из них была образована под воздействием давления и высоких температур, например, при застывании магмы. Сульфидные руды, содержащие данный металл, имеют в своем составе медь. Некоторые руды никеля включают железо, серу, мышьяк, кобальт, магний.
Больше всего этого металла добывается на территории России. Крупные никелевые рудники также находятся в Канаде, Австралии, Новой Каледонии, Индонезии и на Кубе.
Больше всего никеля (около 80%) получают из сульфидных медно-никелевых руд, значительно меньше — из силикатных (окисленных) руд.
Химические свойства
Никель химически малоактивен. Он образует поверхностную оксидную пленку, из-за чего устойчив в атмосфере, щелочи, многих кислотах и воде. Металл не подвергается коррозии. Образует два оксида (NiO и Ni2O3) и два гидроксида (Ni(OH)2 и Ni(OH)3).
Хлорид, нитрат, сульфат и нитрат никеля — четыре растворимые соли. Они имеют желтый или желто-коричневый оттенок и окрашивают растворы в зеленый цвет. Фосфат, оксалат и сульфиды никеля (черный, зеленый и бронзовый) — нерастворимые соли.
Металл поглощает газы (углерод, водород и многие другие), которые ухудшают его механические свойства. С кислородом взаимодействует при температуре выше 500 ⁰С.
В мелкодисперсном состоянии никель самовоспламеняется на воздухе. При нагревании соединяется с галогенами. Образует сульфид при горении в сере, а при нагревании оксида NiO с серой получается моносульфид. Металл также вступает в реакцию с азотной кислотой: образуются нитрат никеля и оксид азота.
По химическим свойствам больше всего похож на железо и кобальт, в меньшей степени — на благородные металлы и медь. Он горит только в виде порошка, проявляет переменную валентность в соединениях (чаще всего двухвалентен). Образует комплексные и координационные соединения.
Применение
Наиболее широкая область применения никеля — изготовление сплавов различных металлов. Его сплавляют:
- Со сталью. Это повышает химическую стойкость сплава: все нержавеющие стали содержат в своем составе никель.
- С железом. Этот сплав имеет низкий коэффициент термического расширения, благодаря чему он успешно используется для изготовления различных деталей для электроприборов.
- С кобальтом и магнием. Образуется жаростойкий сплав, который выдерживает высокие температуры до 500 ⁰С и отличается устойчивостью к коррозии.
- С золотом и серебром. Это так называемое «белое золото» — прочный ювелирный сплав.
- С хромом. В результате образуется нихром — жаропрочный, крипоустойчивый, пластичный сплав, который хорошо держит форму.
- С железом, медью и хромом. Этот сплав характеризуется высокой магнитной восприимчивостью.
Сплавы никеля отличаются высокой степенью вязкости, благодаря чему находят применение при изготовлении брони. Многие сплавы используются в газотурбинных установках, конструкциях атомных реакторов. Из них также делают нагревательные элементы и монеты. Сплавы получили широкое применение в производстве аккумуляторов.
Никель используется и в чистом виде: из него изготавливают трубы, листы и др., а в химических лабораториях он служит катализатором многих реакций. Из металла также производят специализированную химическую аппаратуру. Оксид никеля применяется в производстве стекла, керамики и глазурей. Для многих металлов используется никелирование — создание никелевого покрытия с целью защитить от коррозии.
Из никеля делают спирали электронных сигарет, им обматывают струны музыкальных инструментов. В медицине этот элемент используется для протезирования и изготовления брекет-систем.
химический элемент с атомным номером 28 Химический элемент с атомным номером 28
 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Никель | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Внешний вид | блестящий, металлический и серебристый с золотым оттенком | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Стандартный атомный вес A r, std (Ni) | 58,6934 ( 4) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Никель в таблице Менделеева | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Атомный номер (Z) | 28 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Группа | группа 10 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Период | пери od 4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Блок | d-блок | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Категория элемента | Переходный металл | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Электронная конфигурация | [Ar ] 3d 4s или [Ar] 3d 4s | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Электронов на оболочку | 2, 8, 16, 2 или 2, 8, 17, 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Физические свойства | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Фаза при STP | твердое тело | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Точка плавления | 1728 K (1455 ° C, 2651 ° F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Точка кипения | 3003 K (2730 ° C, 4946 ° F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Плотность (около rt ) | 8,908 г / см | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| в жидком состоянии (при т.пл. ) | 7,81 г / см | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Теплота плавления | 17,48 кДж / моль | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Теплота испарения | 379 кДж / моль | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Молярная теплоемкость | 26,07 Дж / (моль · К) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Давление пара
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Атомные свойства | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Степени окисления | −2, −1, 0, +1, +2, +3, +4 (умеренно основной оксид) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Электроотрицательность | Шкала Полинга: 1,91 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Энергии ионизации |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Атомный радиус | эмпирический: 124 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ковалентный радиус | 124 ± 4 пм | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Радиус Ван-дер-Ваальса | 163 мкм | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Другие свойства | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Естественное происхождение | изначальное | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Кристаллическая структура | гранецентрированная кубическая (fcc)  |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Скорость звука тонкий стержень | 4900 м / с (при rt ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Тепловое расширение | 13,4 мкм / (м · К) (при 25 ° C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Теплопроводность | 90,9 Вт / (м · К) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Удельное электрическое сопротивление | 69,3 нОм · м (при 20 ° C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Магнитное упорядочение | ферромагнетик | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Юнга модуль | 200 ГПа | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Модуль сдвига | 76 ГПа | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Объемный модуль | 180 ГПа | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Коэффициент Пуассона | 0,31 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Твердость по Моосу | 4,0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Твердость по Виккерсу | 638 МПа | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Твердость по Бринеллю | 667–1600 МПа | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Номер CAS | 7440-02-0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| История | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Открытие и первая изоляция | Axel Fredrik Cronstedt (1751) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Основные изотопы никеля | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ссылки |
Никель — это химический элемент с символом Niи атомным номером 28. Это серебристо-белый блестящий металл с легким золотистым оттенком. Никель относится к переходным металлам и является твердым и пластичным. Чистый никель, порошкообразный для максимизации реактивной площади поверхности, проявляет значительную химическую активность, но более крупные куски медленно реагируют с воздухом в стандартных условиях, потому что оксид слой образуется на поверхности и предотвращает дальнейшую коррозию (пассивация ). Даже в этом случае чистый самородный никель содержится в земной коре лишь в незначительных количествах, обычно в ультраосновных породах и в недрах более крупных никель-железных метеоритов, которые не подвергались воздействию кислорода вне атмосферы Земли.
Метеоритный никель обнаружен в комбинации с железом, что отражает происхождение этих элементов как основных конечных продуктов нуклеосинтеза сверхновых. Считается, что смесь железа и никеля составляет внешнее и внутреннее ядро Земли.
Использование никеля (в качестве природного метеоритного сплава никель-железо) прослеживалось до сих пор. еще в 3500 г. до н.э. Никель был впервые выделен и классифицирован как химический элемент в 1751 году Акселем Фредриком Кронштедтом, который первоначально принял руду за медь минерал, в кобальтовых рудниках Лос, Хельсингланд, Швеция. Название элемента происходит от озорного спрайта немецкой шахтерской мифологии, Никеля (похожего на Старый Ник ), который олицетворял тот факт, что медно-никелевые руды сопротивляются переработке в медь. Экономически важным источником никеля является железная руда лимонит, которая часто содержит 1–2% никеля. Другие важные рудные минералы никеля включают пентландит и смесь богатых никелем природных силикатов, известных как гарниерит. Основные производственные площадки включают регион Садбери в Канаде (который предположительно имеет метеоритное происхождение), Новая Каледония в Тихий океан и Норильск в России.
Никель медленно окисляется воздухом при комнатной температуре и считается коррозионно-стойким. Исторически он использовался для металлизации железа и латуни, нанесения покрытий на химическое оборудование и для производства некоторых сплавов , которые сохраняют высокий уровень серебристого блеска, например, немецкое серебро. Около 9% мирового производства никеля по-прежнему используется для антикоррозийного никелирования. Никелированные предметы иногда вызывают аллергию на никель. Никель широко использовался в монетах, хотя его растущая цена привела к некоторой замене его более дешевыми металлами в последние годы.
Никель является одним из четырех элементов (другие — железо, кобальт и гадолиний ), которые являются ферромагнитными примерно при комнатной температуре. Альнико постоянные магниты , частично на основе никеля, имеют промежуточную прочность между постоянными магнитами на основе железа и редкоземельными магнитами. Металл ценен в наше время главным образом сплавами ; Около 68% мирового производства используется в производстве нержавеющей стали. Еще 10% используется для сплавов на основе никеля и меди, 7% для легированных сталей, 3% в литейных цехах, 9% в гальванических покрытиях и 4% в других приложениях, включая быстрорастущий сектор аккумуляторов, в том числе в электромобили (электромобили). В качестве соединения никель имеет ряд нишевых применений в химической промышленности, таких как катализатор гидрирования, катоды для батарей, пигменты и обработка металлических поверхностей. Никель является важным питательным веществом для некоторых микроорганизмов и растений, которые имеют ферменты с никелем в качестве активного центра.
Содержание
- 1 Свойства
- 1.1 Атомные и физические свойства
- 1.1. 1 Спор о конфигурации электронов
- 1.2 Изотопы
- 1.3 Встречаемость
- 1.1 Атомные и физические свойства
- 2 Соединения
- 2.1 Никель (0)
- 2.2 Никель (I)
- 2.3 Никель (II)
- 2.4 Никель (III) и (IV)
- 3 История
- 4 Чеканка
- 4,1 Канада
- 4,2 Швейцария
- 4,3 Соединенное Королевство
- 4,4 США
- 4,5 Текущее использование
- 5 Мировое производство
- 6 Экстракция и очистка
- 6.1 Электрорафинирование
- 6.2 Процесс Mond
- 6.3 Значение металла
- 7 Области применения
- 8 Биологическая роль
- 9 Токсичность
- 10 Ссылки
- 11 Внешние ссылки
Свойства
Атомные и физические свойства

Никель — это серебристо-белый металл с легким золотистым оттенком, который требует полировки. Это один из четырех элементов, которые обладают магнитным полем при комнатной температуре или близкой к ней, другие — это железо, кобальт и гадолиний. Его температура Кюри составляет 355 ° C (671 ° F), что означает, что объемный никель немагнитен выше этой температуры. Элементарная ячейка никеля представляет собой гранецентрированный куб с параметром решетки 0,352 нм, что дает атомный радиус 0,124 нм. Эта кристаллическая структура устойчива к давлению не менее 70 ГПа. Никель относится к переходным металлам. Он твердый, податливый и пластичный и имеет относительно высокую электрическую и теплопроводность для переходных металлов. Высокая прочность на сжатие , равная 34 ГПа, предсказанная для идеальных кристаллов, никогда не достигается в реальном массивном материале из-за образования и движения дислокаций . Однако она была достигнута в Ni наночастицы.
Электронная конфигурация спор
Атом никеля имеет две электронные конфигурации, [Ar] 3d 4s и [Ar] 3d 4s, которые очень близки по энергии — символ [Ar] относится к аргоноподобной -подобной структуре ядра. Есть некоторые разногласия по поводу того, какая конфигурация имеет наименьшую энергию. В учебниках химии электронная конфигурация никеля цитируется как [Ar] 4s 3d, что также может быть записано как [Ar] 3d 4s. Эта конфигурация согласуется с правилом упорядочения энергии Маделунга, которое предсказывает, что 4s заполняются раньше 3d. Это подтверждается экспериментальным фактом, что самое низкоэнергетическое состояние атома никеля представляет собой энергетический уровень 3d 4s, в частности уровень 3d (F) 4sF, J = 4.
Однако каждая из этих двух конфигураций расщепляется на несколько энергетических уровней из-за тонкой структуры, и два набора энергетических уровней перекрываются. Средняя энергия состояний с конфигурацией [Ar] 3d 4s фактически ниже, чем средняя энергия состояний с конфигурацией [Ar] 3d 4s. По этой причине в исследовательской литературе по атомным расчетам конфигурация основного состояния никеля цитируется как [Ar] 3d 4s.
Изотопы
Изотопы никеля находятся в диапазоне атомной массы с 48 u (. Ni) до 78 u (. Ni).
Природный никель состоит из пяти стабильных изотопов ;. Ni,. Ni,. Ni,. Ni и. Ni, причем. Ni является самая многочисленная (68,077% естественная численность ). Изотопы тяжелее. Ni не могут быть образованы ядерным синтезом без потери энергии.
Никель-62 имеет самую высокую среднюю энергию связи ядра на нуклон из всех нуклид, при 8,7946 МэВ / нуклон. Его энергия связи больше, чем у . Fe и . Fe, более распространенные элементы, которые часто ошибочно упоминаются как имеющие наиболее прочно связанные нуклиды. Хотя это, казалось бы, предсказывает, что никель-62 является самым распространенным тяжелым элементом во Вселенной, относительно высокая скорость фотораспада никеля в недрах звезд делает железо самым распространенным.
Стабильный изотоп никель-60 является дочерним продуктом потухшего радионуклида . Fe, который распадается с периодом полураспада 2,6 миллиона лет. Поскольку. Fe имеет такой длительный период полураспада, его стойкость в материалах в солнечной системе может вызывать наблюдаемые вариации изотопного состава. Ni. Следовательно, обилие. Ni, присутствующего во внеземном материале, может дать представление о происхождении Солнечной системы и ее ранней истории.
Было охарактеризовано не менее 26 радиоизотопов никеля , наиболее стабильным является. Ni с периодом полураспада 76000 лет,. Ni со 100 годами и. Ni с 6 днями. Все оставшиеся радиоактивные изотопы имеют период полураспада менее 60 часов, а у большинства из них период полураспада менее 30 секунд. Этот элемент также имеет одно мета-состояние ..
Радиоактивный никель-56 образуется в процессе сжигания кремния, а затем высвобождается в больших количествах во время сверхновых типа Ia .. Форма кривой блеска этих сверхновых на промежуточных и поздних временах соответствует распаду никеля-56 через захват электронов на кобальт -56 и в конечном итоге к утюгу-56. Никель-59 — долгоживущий космогенный радионуклид с периодом полураспада 76000 лет.. Ni нашел множество применений в изотопной геологии.. Ni использовался для определения земного возраста метеоритов и для определения содержания внеземной пыли во льду и отложениях. Период полураспада никеля-78 был недавно измерен в 110 миллисекунд, и он считается важным изотопом в нуклеосинтезе сверхновых элементов, более тяжелых, чем железо. Нуклид Ni, открытый в 1999 году, является наиболее богатым протонами изотопом тяжелых элементов из известных. С 28 протонами и 20 нейтронами Ni является «дважды магическим », как и. Ni с 28 протонами и 50 нейтронами. Поэтому оба они необычайно стабильны для нуклидов с таким большим протон-нейтронным дисбалансом.
Возникновение

На Земле никель чаще всего встречается в сочетании с серой и железом в пентландите, с серой в миллерите, с мышьяком. в минерале никелин и с мышьяком и серой в никеле галенит. Никель обычно содержится в железных метеоритах в виде сплавов камасита и тэнита. Присутствие никеля в метеоритах было впервые обнаружено в 1799 году Жозефом-Луи Прустом, французским химиком, который тогда работал в Испании. Пруст проанализировал образцы метеорита из Кампо-дель-Сьело (Аргентина), которые были получены в 1783 году Мигелем Рубином де Селисом, и обнаружил в них присутствие никеля (около 10%) наряду с железом.
Основная часть никеля добывается из месторождений руды двух типов. Первый — это латерит, где основными рудными минеральными смесями являются никелевый лимонит, (Fe, Ni) O (OH) и гарниерит (смесь различных водный никель и силикаты, богатые никелем). Второе — это магматические месторождения сульфидов, где основным рудным минералом является пентландит : (Ni, Fe). 9S. 8.
Индонезия и Австралия имеют самые большие оценочные запасы, составляющие 46% от мировых.
Выявленные наземные ресурсы во всем мире, содержащие в среднем 1% никеля или больше, содержат не менее 130 миллионов тонн никеля (примерно вдвое больше известных запасов). Около 60% находится в латеритах и 40% в сульфидных месторождениях.
Согласно геофизическим данным, большая часть никеля на Земле, как полагают, находится в внешние и внутренние сердечники. Камасит и тенит представляют собой встречающиеся в природе сплавы железа и никеля. Для камасита соотношение сплава обычно составляет от 90:10 до 95: 5, хотя могут присутствовать примеси (такие как кобальт или углерод ), в то время как для тэнита содержание никеля составляет от 20% до 65%. Камасит и тэнит также встречаются в железо-никелевых метеоритах.
Соединения
Наиболее распространенная степень окисления никеля +2, но соединения Ni, Ni и Ni являются хорошо известны, и экзотические степени окисления Ni, Ni и Ni были получены и изучены.
Никель (0)

Тетракарбонил никеля (Ni (CO). 4), обнаруженный Людвигом Мондом, представляет собой летучую, высокотоксичную жидкость при комнатной температуре. При нагревании комплекс снова разлагается на никель и окись углерода:
- Ni (CO). 4⇌ Ni + 4 CO
Это поведение используется в процессе Монда для очистки никеля, поскольку описано выше. Родственный комплекс никеля (0) бис (циклооктадиен) никель (0) является полезным катализатором в никелевой химии, поскольку лиганды циклооктадиена (или трески) легко образуются
Никель (I)

Комплексы никеля (I) встречаются редко, но одним из примеров является тетраэдрический комплекс NiBr (PPh 3)3Многие комплексы никеля (I) имеют связи Ni-Ni, такие как темно-красный диамагнитный K. 4[Ni. 2(CN). 6], полученный восстановлением K. 2[Ni. 2(CN). 6] с амальгамой натрия. Это соединение окисляется в воде с выделением H. 2.
Считается, что степень окисления никеля (I) важна для никельсодержащих ферментов, таких как [NiFe] -гидрогеназа, которая катализирует обратимое восстановление протонов до H. 2.
Никель (II)


Никель (II) образует соединения со всеми распространенными анионами, включая сульфид, сульфат, карбонат, гидроксид, карбоксилаты и галогениды. Сульфат никеля (II) получают в больших количествах путем растворения металлического никеля или его оксидов в серной кислоте с образованием как гекса-, так и гептагидратов, полезных для гальваники никеля. Обычные соли никеля, такие как хлорид, нитрат и сульфат, растворяются в воде с образованием зеленых растворов аквокомплекса металла [Ni (H. 2O). 6]..
Четыре галогенида образуют соединения никеля, которые являются твердыми веществами с молекулы с октаэдрическими центрами Ni. Хлорид никеля (II) является наиболее распространенным, и его поведение иллюстрирует поведение других галогенидов. Хлорид никеля (II) получают растворением никеля или его оксида в соляной кислота. Обычно встречается в виде зеленого гексагидрата, формула которого обычно записывается как NiCl 2 • 6H 2 O. При растворении в воде эта соль образует водный комплекс металла [Ni (H. 2O). 6].. Дегидратация NiCl 2 • 6H 2 O дает желтый безводный NiCl. 2.
Некоторое количество тетракоординированного никеля (II) Комплексы, например, бис (трифенилфосфин) хлорид никеля, существуют как в тетраэдрической, так и в плоской квадратной геометрии. Тетраэдрические комплексы парамагнитны, тогда как квадратные плоские комплексы диамагнитный. Обладая свойствами магнитного равновесия и образования октаэдрических комплексов, они контрастируют с двухвалентными комплексами более тяжелых металлов 10 группы, палладия (II) и платины (II), которые образуют только плоско-квадратную геометрию.
Никелоцен известен; он имеет количество электронов, равное 20, что делает его относительно нестабильным.
Никель (III) и (IV)

Известно множество соединений Ni (III), первыми такими примерами являются тригалофосфины никеля (III) (Ni III (PPh 3)X3). Кроме того, Ni (III) образует простые соли с ионами фторида или оксида. Ni (III) может быть стабилизирован σ-донорными лигандами, такими как тиолы и фосфины.
Ni (IV) присутствует в смешанном оксиде BaNiO. 3, тогда как Ni (III) присутствует в гидроксиде оксида никеля, который используется в качестве катода. во многих аккумуляторных батареях, включая никель-кадмиевые, никель-железные, никель-водородные и никель- металлогидрид, и используется некоторыми производителями в литий-ионных батареях. Ni (IV) остается редкой степенью окисления никеля, и на сегодняшний день известно очень мало соединений.
История
Поскольку никелевые руды легко ошибочно принять за руды серебра, понимание этого металла и его использования датируется относительно недавним временем. Преднамеренное использование никеля является древним, и его можно проследить еще с 3500 г. до н. э. В бронзе из современной Сирии обнаружено до 2% никеля. Некоторые древние китайские рукописи предполагают, что «белая медь» (мельхиор, известный как байтонг) использовалась там между 1700 и 1400 годами до нашей эры. Эта белая медь из пактонга экспортировалась в Великобританию еще в 17 веке, но содержание никеля в этом сплаве не было обнаружено до 1822 года. Монеты из медно-никелевого сплава чеканили бактрийские короли Агафокл, Евтидем II и Панталеон во II веке до нашей эры, возможно, из китайского мельхиора.

В средневековой Германии красный минерал был найден в Рудные горы (Рудные горы), напоминавшие медную руду. Однако, когда горняки не смогли извлечь из него медь, они обвинили озорного спрайта немецкой мифологии Никель (похожего на Старый Ник ) в том, что он окружал медь. Они назвали эту руду Купферникель от немецкого Kupfer для меди. В настоящее время известно, что эта руда представляет собой никелин, арсенид никеля . В 1751 году барон Аксель Фредрик Кронштедт пытался добыть медь из купферникеля на кобальтовой шахте в шведской деревне Лос, и вместо этого произвел белый металл, который он назвал в честь духа, давшего название минералу никель. В современном немецком языке «купферникель» или «купферникель» обозначает сплав мельхиор.
. Первоначально единственным источником никеля был редкий купферникель. Начиная с 1824 года никель получали как побочный продукт производства кобальтового синего. Первая крупномасштабная выплавка никеля началась в Норвегии в 1848 году из богатого никелем пирротина. Введение никеля в производство стали в 1889 году увеличило спрос на никель, и месторождения никеля Новой Каледонии, открытые в 1865 году, обеспечивали большую часть мирового предложения в период с 1875 по 1915 год. Открытие крупных месторождений. в бассейне Садбери, Канада в 1883 г., в Норильске-Талнахе, Россия в 1920 г., и в рифе Меренского, Южная Африка в 1924 г. Возможно масштабное производство никеля.
Чеканка

Помимо вышеупомянутых бактрийских монет, никель не входил в состав монет до середины 19 века.
Канада
монеты достоинством в пять центов с содержанием никеля 99,9% были отчеканены в Канаде (крупнейшем в мире производителе никеля в то время) в невоенные годы с 1922 по 1981 год; содержание металла сделало эти монеты магнитными. В период военного времени 1942–45 никель был удален из канадских и американских монет, чтобы сохранить его для производства брони. Канада использовала 99,9% никеля с 1968 года в своих более дорогих монетах до 2000 года.
Швейцария
Монеты из почти чистого никеля были впервые использованы в 1881 году в Швейцарии.
Соединенное Королевство.
Бирмингем подделал никелевые монеты в ок. 1833 г. для торговли в Малайе.
США
В Соединенных Штатах термин «никель» или «ник» первоначально относился к медно-никелевому центу Flying Eagle, который заменил медь на 12% никель 1857–58, затем центу Indian Head из того же сплава с 1859 по 1864 год. Еще позже, в 1865 году, термин, обозначаемый трехцентовым никелем, повысился до 25%. В 1866 году это обозначение было присвоено пятицентовому никелю (25% никеля, 75% меди). Наряду с пропорцией сплава этот термин используется до сих пор в Соединенных Штатах.
Текущее использование
В 21 веке высокая цена на никель привела к некоторой замене металла в монетах по всему миру. Монеты, все еще изготовленные из никелевых сплавов, включают монеты в одну и две евро, 5 ¢, 10, 25 ¢ и 50 ¢ США. монеты и монеты Великобритании 20p, 50p, £ 1 и £ 2 . Никелевый сплав в британских монетах номиналом 5 и 10 пенсов был заменен на никелированную сталь, начатую в 2012 году, что вызвало у некоторых людей проблемы с аллергией и вызвало общественные споры.
Мировое производство


По оценкам, во всем мире добывается более 2,7 миллионов тонн (т) никеля в год, в том числе Индонезия (800000 т), Филиппины (420,000 т), Россия (270,000 т), Новая Каледония (220,000 т), Австралия (180,000 т) и Канада (180 000 т), являющиеся крупнейшими производителями на 2019 год. Крупнейшие месторождения никеля за пределами России находятся в Финляндии и Греции. Выявленные наземные ресурсы, содержащие в среднем 1% никеля или более, содержат не менее 130 миллионов тонн никеля. Примерно 60% находится в латеритах и 40% — в сульфидных месторождениях. Кроме того, обширные глубоководные ресурсы никеля находятся в марганцевых корках и конкрециях, покрывающих большие площади океанского дна, особенно в Тихом океане.
Единственным местом в Соединенных Штатах, где добыча никеля была прибыльной, является Риддл, Орегон, где находится несколько квадратных миль никельсодержащих гарниеритов поверхностных отложений. Рудник закрылся в 1987 году. Проект рудника Игл — это новый никелевый рудник в Мичигане на верхнем полуострове. Строительство было завершено в 2013 году, а эксплуатация началась в третьем квартале 2014 года. За первый полный год эксплуатации рудник Игл произвел 18 000 т.
Добыча и очистка

Никель получают с помощью экстрактивной металлургии : его извлекают из руды обычными процессами обжига и восстановления, которые дают металл с чистотой более 75%. Во многих случаях применения нержавеющей стали никель чистотой 75% может использоваться без дополнительной очистки, в зависимости от примесей.
Традиционно большая часть сульфидных руд перерабатывалась с использованием пирометаллургических технологий для получения штейна для дальнейшей переработки. Последние достижения в гидрометаллургических технологиях привели к получению значительно более чистого продукта из металлического никеля. Большинство сульфидных месторождений традиционно обрабатывались путем концентрирования посредством процесса пенной флотации с последующей пирометаллургической экстракцией. В гидрометаллургических процессах сульфидные никелевые руды концентрируются путем флотации (дифференциальная флотация, если соотношение Ni / Fe слишком низкое), а затем плавятся. Никелевый штейн дополнительно обрабатывается с помощью процесса Шерритта-Гордона. Сначала удаляют медь путем добавления сероводорода, в результате чего остается концентрат кобальта и никеля. Затем для разделения кобальта и никеля используется экстракция растворителем, при этом конечное содержание никеля превышает 99%.

Электрорафинирование
Второй распространенный процесс рафинирования — выщелачивание металлического штейна в раствор соли никеля, с последующим электролитическим выделением никеля из раствора путем нанесения его на катод в качестве электролитического никеля.
процесс Монда

Самый чистый металл получают из оксида никеля с помощью процесса Монда, который обеспечивает чистоту более 99,99%. Процесс был запатентован Людвигом Мондом и использовался в промышленности еще до начала 20-го века. В этом процессе никель реагирует с монооксидом углерода в присутствии серного катализатора при температуре около 40–80 ° C с образованием карбонила никеля. Железо дает также пентакарбонил железа, но эта реакция протекает медленно. При необходимости никель можно отделить перегонкой. Дикобальт октакарбонил также образуется при перегонке никеля в качестве побочного продукта, но он разлагается до тетракобальтдодекакарбонил при температуре реакции с образованием нелетучего твердого вещества.
Никель получают из карбонила никеля одним из двух способов. Его можно пропускать через большую камеру при высоких температурах, в которой постоянно перемешиваются десятки тысяч никелевых сфер, называемых гранулами. Карбонил разлагается и осаждает чистый никель на никелевых сферах. В альтернативном процессе карбонил никеля разлагается в меньшей камере при 230 ° C с образованием мелкодисперсного никелевого порошка. Окись углерода как побочный продукт рециркулируется и используется повторно. Продукт из высокочистого никеля известен как «карбонильный никель».
Стоимость металла
Рыночная цена никеля росла в течение 2006 года и в первые месяцы 2007 года; по состоянию на 5 апреля 2007 г. металл торговался по долл. США / тонна или 1,47 долл. США за унцию. Цена впоследствии резко упала, и по состоянию на сентябрь 2017 года металл торговался по цене 11000 долларов за тонну, или 0,31 доллара за унцию.
никелевая монета США содержит 0,04 унции (1,1 г) никель, который по цене апреля 2007 года стоил 6,5 цента, а также 3,75 грамма меди стоимостью около 3 центов, при общей стоимости металла более 9 центов. Поскольку номинальная стоимость никеля составляет 5 центов, это сделало его привлекательной целью для плавки для людей, желающих продать металлы с прибылью. Однако Монетный двор США, предвидя эту практику, 14 декабря 2006 г. ввел новые временные правила, подлежащие общественному обсуждению в течение 30 дней, которые криминализировали плавку и экспорт центов и никелей. Нарушители могут быть наказаны штрафом до 10 000 долларов и / или лишены свободы на срок до пяти лет.
По состоянию на 19 сентября 2013 г. стоимость плавления американского никеля (включая медь и никель) составляет 0,045 доллара США, что составляет 90% от номинальной стоимости.
Применения

В настоящее время мировое производство никеля составляет: 68% из нержавеющей стали; 10% в сплавах цветных металлов ; 9% в гальванике ; 7% в легированной стали; 3% в литейных цехах; и 4% других применений (включая батареи).
Никель используется во многих конкретных и узнаваемых промышленных и потребительских товарах, включая нержавеющую сталь, алнико магниты, монеты и т. д. аккумуляторные батареи, струны электрогитары, капсюли микрофонов, покрытие сантехники и специальные сплавы, такие как пермаллой, элинвар и инвар. Используется для гальваники и как зеленый оттенок в стекле. Никель в первую очередь является легирующим металлом, и его основное применение — в никелевых сталях и никелевых чугунах, в которых он обычно увеличивает предел прочности на разрыв, ударную вязкость и предел упругости. Он широко используется во многих других сплавах, включая никелевые латуни и бронзы, а также сплавы с медью, хромом, алюминием, свинцом, кобальтом, серебром и золотом (Inconel, Incoloy, Монель, Нимоник ).

Поскольку он устойчив к коррозии, никель иногда использовался вместо декоративного серебра.. Никель также иногда использовался в некоторых странах после 1859 года в качестве дешевого металла для чеканки монет (см. Выше), но в последние годы 20-го века его заменили более дешевыми сплавами из нержавеющей стали (т.е. железа), за исключением США и Канады.
Никель является отличным легирующим агентом для некоторых драгоценных металлов и используется в пробирных пробах в качестве сборщика элементов платиновой группы (PGE). Таким образом, никель способен полностью собирать все шесть элементов PGE из руд и частично собирать золото. Высокопроизводительные никелевые рудники также могут участвовать в извлечении PGE (стр. обычно платина и палладий ); примерами являются Норильск в России и бассейн Садбери в Канаде.
Никелевая пена или никелевая сетка используется в газодиффузионных электродах для щелочных топливных элементов.
Никель и его сплавы часто используются в качестве катализаторов для гидрогенизации реакции. Никель Ренея, тонкодисперсный никель-алюминиевый сплав, является одной из распространенных форм, хотя также используются родственные катализаторы, включая катализаторы типа Ренея.
Никель является природным магнитострикционным материалом, что означает, что в присутствии магнитного поля материал претерпевает небольшое изменение длины. Магнитострикция никеля порядка 50 ppm и является отрицательной, что указывает на его сжатие.
Никель используется в качестве связующего в производстве цементированного карбида вольфрама или твердых металлов и используется в пропорциях от 6% до 12% по весу. Никель делает карбид вольфрама магнитным и повышает коррозионную стойкость склеенных деталей, хотя твердость меньше, чем у деталей с кобальтовым связующим.
. Ni с его периодом полураспада 100,1 лет полезен в устройствах krytron в качестве эмиттера бета-частиц (высокоскоростных электронов ), чтобы сделать ионизацию с помощью поддерживающего электрода более надежной.
Около 27% всего производства никеля предназначено для машиностроения, 10% — для строительства, 14% — для трубных изделий, 20% — для металлических изделий, 14% — для транспорта, 11% — для электронных товаров и 5 % для других целей.
Никель Ренея широко используется для гидрогенизации ненасыщенных масел с целью получения маргарина, а некондиционный маргарин и остатки масла могут содержат никель в качестве загрязнителя. Forte et al. обнаружили, что пациенты с диабетом 2 типа имеют 0,89 нг / мл Ni в крови по сравнению с 0,77 нг / мл у контрольных субъектов.
Биологическая роль
Хотя это не было признано до 1970-х годов, Известно, что никель играет важную роль в биологии некоторых растений, эубактерий, архебактерий и грибов. Никелевые ферменты, такие как уреаза, считаются факторами вирулентности у некоторых организмов. Уреаза катализирует гидролиз мочевины с образованием аммиака и карбамата. Гидрогеназы NiFe могут катализировать окисление H. 2с образованием протонов и электронов, а также могут катализировать обратную реакцию, восстановление протонов с образованием газообразного водорода. Кофермент никель-тетрапиррол, кофактор F430, присутствует в метил коферменте M редуктазе, который может катализировать образование метана или обратную реакцию в метаногенном архей (в степени окисления +1 ). Один из ферментов дегидрогеназы монооксида углерода состоит из кластера Fe-Ni-S. Другие никельсодержащие ферменты включают редкий бактериальный класс супероксиддисмутазы и глиоксалазы I у бактерий и несколько паразитических эукариотических трипаносомальных паразитов (у высших организмов, в т.ч. У дрожжей и млекопитающих этот фермент содержит двухвалентный Zn).
Никель, получаемый с пищей, может повлиять на здоровье человека из-за заражения никельсодержащими бактериями, но также возможно, что никель является важным питательным веществом для бактерий, проживающих в толстом кишечнике., фактически действующий как пребиотик . Институт медицины США не подтвердил, что никель является важным питательным веществом для человека, поэтому ни Рекомендуемая диета (RDA), ни Адекватное потребление не установлены. Верхний допустимый уровень потребления диетического никеля составляет 1000 мкг / день в виде растворимых солей никеля. Потребление с пищей оценивается от 70 до 100 мкг / день, при этом всасывается менее 10%. То, что всасывается, выводится с мочой. Относительно большие количества никеля — сравнимые с приведенным выше расчетным средним уровнем потребления — выщелачивают в пищу, приготовленную из нержавеющей стали. Например, количество никеля, выщелоченного после 10 циклов варки в одной порции томатного соуса, составляет в среднем 88 мкг.
Никель, выделяющийся в результате вулканических извержений сибирских ловушек, предположительно способствует росту Methanosarcina, род эвриархеотических архей, которые производили метан во время пермско-триасового вымирания, самого большого вымирания в истории наблюдений.
Токсичность
| Опасности | |
|---|---|
| Пиктограммы GHS |    |
| Сигнальное слово GHS | Опасно |
| Краткая характеристика опасности GHS | H317, H351, H372, H402, H412 |
| Меры предосторожности GHS | P201, P202, P260, P264, P270, P272, P273, P280, P302 + 352, P308 + 313, P333 + 313, P363, P405, P501 |
| NFPA 704 (огненный алмаз) |  0 2 0 0 2 0 |
Основной источник никеля Воздействие — это пероральное употребление, поскольку никель необходим для растений. Никель естественным образом содержится как в пище, так и в воде, и его содержание может повышаться в результате загрязнения человеком . Например, никелированные смесители могут загрязнять воду и почву; горнодобывающая промышленность и плавка могут сбрасывать никель в сточные воды ; Никель – сталь сплав посуда и посуда с никелевым пигментом могут выделять никель в пищу. Атмосфера может быть загрязнена переработкой никелевой руды и сжиганием ископаемого топлива. Люди могут поглощать никель непосредственно из табачного дыма и контакта кожи с драгоценностями, шампунями, моющими средствами и монетами. Менее распространенной формой хронического воздействия является гемодиализ, поскольку следы ионов никеля могут абсорбироваться в плазму в результате хелатирующего действия альбумина.
Среднесуточное воздействие не представляет угрозы для здоровья человека. Большая часть никеля, ежедневно всасываемого людьми, удаляется почками и выводится из организма с мочой или выводится через желудочно-кишечный тракт, не всасываясь. Никель не является кумулятивным ядом, но большие дозы или хроническое ингаляционное воздействие могут быть токсичными, даже канцерогенными и представлять профессиональную опасность.
Соединения никеля классифицируются как канцерогены для человека в связи с повышенной частотой рака дыхательных путей риски, наблюдаемые при эпидемиологических исследованиях у рабочих завода по переработке сульфидных руд. Это подтверждается положительными результатами биотестов NTP с субсульфидом никеля и оксидом никеля на крысах и мышах. Данные о людях и животных неизменно указывают на отсутствие канцерогенности при пероральном пути воздействия и ограничивают канцерогенность соединений никеля для респираторных опухолей после вдыхания. Металлический никель классифицируется как подозреваемый канцероген; существует согласованность между отсутствием повышенного риска рака дыхательных путей у рабочих, преимущественно подвергающихся воздействию металлического никеля, и отсутствием респираторных опухолей в исследовании канцерогенности при вдыхании порошка металлического никеля на крысах в течение всей жизни. В исследованиях ингаляций на грызунах с различными соединениями никеля и металлическим никелем наблюдалось усиление воспалений легких с гиперплазией или фиброзом бронхиальных лимфатических узлов и без них. В исследованиях на крысах пероральный прием водорастворимых солей никеля может вызвать эффекты перинатальной смертности у беременных животных. Неясно, имеют ли эти эффекты отношение к людям, поскольку эпидемиологические исследования высоконадежных работающих женщин не показали неблагоприятных эффектов токсичности для развития.
Люди могут подвергаться воздействию никеля на рабочем месте при вдыхании, проглатывании и контакте с кожей или глаз. Управление по охране труда (OSHA) установило юридический предел (допустимый предел воздействия ) для рабочего места на уровне 1 мг / м3 за 8-часовой рабочий день, за исключением карбонила никеля. Национальный институт охраны труда (NIOSH) определяет рекомендуемый предел воздействия (REL) 0,015 мг / м3 на 8-часовой рабочий день. При концентрации 10 мг / м3 никель немедленно опасен для жизни и здоровья. Карбонил никеля [Ni (CO). 4] является чрезвычайно токсичным газом. Токсичность карбонилов металлов зависит как от токсичности металла, так и от выделения газа монооксида углерода из карбонильных функциональных групп; Карбонил никеля также взрывоопасен на воздухе.
Сенсибилизированные люди могут проявлять контактную аллергию на никель, известную как контактный дерматит. Сильно сенсибилизированные люди также могут реагировать на продукты с высоким содержанием никеля. Чувствительность к никелю также может быть у пациентов с помфоликсом. Никель является наиболее подтвержденным контактным аллергеном во всем мире, отчасти из-за его использования в украшениях для проколотых ушей. Аллергия на никель, поражающая проколотые уши, часто проявляется зудом и покраснением кожи. Многие серьги теперь изготавливаются без никеля или с никелем с низким уровнем высвобождения, чтобы решить эту проблему. Допустимое количество продуктов, контактирующих с кожей человека, теперь регулируется Европейским Союзом. В 2002 году исследователи обнаружили, что никель, выпускаемый монетами достоинством 1 и 2 евро, намного превышает эти стандарты. Считается, что это результат гальванической реакции. Никель был признан аллергеном года в 2008 году Американским обществом контактного дерматита. В августе 2015 года Американская академия дерматологии приняла заявление о безопасности никеля: «По оценкам, контактный дерматит, включающий сенсибилизацию никелем, составляет примерно 1,918 миллиарда долларов и затрагивает почти 72,29 миллиона человек».
Отчеты показывают, что как индуцированная никелем активация фактора, индуцируемого гипоксией (HIF-1), так и повышающая регуляция индуцируемых гипоксией генов вызываются истощением внутриклеточного аскорбата. Добавление аскорбата в культуральную среду увеличивало внутриклеточный уровень аскорбата и обращало вспять как индуцированную металлами стабилизацию HIF-1- и HIF-1α-зависимой экспрессии гена.
Ссылки
Внешние ссылки
| На Викискладе есть материалы, связанные с никелем. |
| Найдите никель в Викисловаре, бесплатном словаре. |
- Никель на Периодическая таблица видео (Университет Ноттингема)
- CDC — Никель — Тема безопасности и здоровья NIOSH на рабочем месте
- Гигиеническая оценка воздействия никеля на кожу в отраслях первичного производства, выполненная GW Hughson. Институт медицины труда Отчет об исследовании TM / 04/05
- Гигиеническая оценка воздействия никеля на кожу в первичном производстве и отраслях первичного потребления. Отчет по фазе 2, автор — Г.В. Хьюсон. Институт медицины труда Отчет об исследовании TM / 05/06
- «Металл, который принес вам дешевые авиабилеты», BBC
У этого термина существуют и другие значения, см. Никель (значения).
| Никель / Niccolum (Ni) | |
|---|---|
| Атомный номер | 28 |
| Внешний вид | Никель |
| Свойства атома | |
| Атомная масса (молярная масса) |
58,6934 а. е. м. (г/моль) |
| Радиус атома | 124 пм |
| Энергия ионизации (первый электрон) |
736,2 (7,63) кДж/моль (эВ) |
| Электронная конфигурация | [Ar] 3d8 4s2 |
| Химические свойства | |
| Ковалентный радиус | 115 пм |
| Радиус иона | (+2e) 69 пм |
| Электроотрицательность (по Полингу) |
1,91 |
| Электродный потенциал | 0 |
| Степени окисления | 3, 2, 0 |
| Термодинамические свойства | |
| Плотность | 8,902 г/см³ |
| Удельная теплоёмкость | 0,443 Дж/(K·моль) |
| Теплопроводность | 90,9 Вт/(м·K) |
| Температура плавления | 1 726 K |
| Теплота плавления | 17,61 кДж/моль |
| Температура кипения | 3 005 K |
| Теплота испарения | 378,6 кДж/моль |
| Молярный объём | 6,6 см³/моль |
| Кристаллическая решётка | |
| Структура решётки | кубическая гранецентрированая |
| Период решётки | 3,520 Å |
| Отношение c/a | n/a |
| Температура Дебая | 375,00 K |
История открытия
Уже с 17 в. рудокопам Саксонии (Германия) была известна руда, которая по внешнему виду напоминала медные руды, но меди при выплавке не давала. Ее называли купферникель (нем. Kupfer — медь, а Nickel — имя гнома, подсовывавшего горнякам вместо медной руды пустую породу). Как оказалось впоследствии, купферникель — соединения никеля и мышьяка, NiAs. История открытия никеля растянулась почти на полвека. Первым вывод о присутствии в купферникеле нового «полуметалла» (то есть, по тогдашней терминологии, простого вещества, промежуточного по свойствам между металлами и неметаллами) сделал шведский металлург А. Ф. Кронштедт в 1751 году. Однако, более двадцати лет это открытие оспаривалось, и господствовала точка зрения, что Кронстедт получил не новое простое вещество, а какое-то соединение с серой то ли железа, то ли висмута, то ли кобальта, то ли какого-то другого металла.
Только в 1775 г., через 10 лет после смерти Кронштедта, швед Т. Бергман выполнил исследования, позволявшие заключить, что никель — это простое вещество. Но окончательно никель как элемент утвердился только в начале 19-го века, в 1804 году, после скрупулезных исследований немецкого химика И.Рихтера, который для очистки провел 32 перекристаллизации никелевого купороса (сульфата никеля) и в результате восстановления получил чистый металл.
Нахождение в природе
В земной коре содержание никеля составляет около 8·10−3% по массе. Возможно, громадные количества никеля — около 17·1019т — заключены в ядре Земли, которое, по одной из распространенных гипотез, состоит из железоникелевого сплава. Если это так, то Земля примерно на 3 % состоит из никеля, а среди составляющих планету элементов никель занимает пятое место — после железа, кислорода, кремния и магния. Никель содержится в некоторых метеоритах, которые по составу представляют собой сплав никеля и железа (так называемые железоникелевые метеориты). Разумеется, как практический источник никеля такие метеориты значения не имеют. Важнейшие минералы никеля: никелин (современное название купферникеля) NiAs, пентландит [сульфид никеля и железа состава (Fe,Ni)9S8], миллерит NiS, гарниерит(Ni, Mg)6Si4O10(OH)2 и другие никельсодержащие силикаты. В морской воде содержание никеля составляет примерно 1·10−8-5·10−8%.
Получение
Общие запасы никеля в рудах на начало 1998 г. оцениваются в количестве 135 млн. т., в том числе достоверные — 49 млн.т.
Из достоверных запасов, по разным данным, от 40 до 66% никеля находится в окисленных рудах (ОНР), 33% — в сульфидных, 0,7% — в прочих. По состоянию на 1997 г. доля никеля, произведенного переработкой ОНР, составила порядка 40% от общемирового объема производства.
В промышленных условиях ОНР делят на два типа: магнезиальные и железистые.
Тугоплавкие магнезиальные руды, как правило, подвергают электроплавке на ферроникель (5-50% Ni+Co, в зависимости от состава сырья и технологических особенностей).
Наиболее железистые — латеритовые руды перерабатывают гидрометаллургическими методами с применением аммиачно-карбонатного выщелачивания или сернокислотного автоклавного выщелачивания. В зависимости от состава сырья и применяемых технологических схем конечными продуктами этих технологий являются: закись никеля (76-90% Ni), синтер (89% Ni), сульфидные концентраты различного состава, а также металлические никель электролитный, никелевые порошки и кобальт.
Менее железистые — нонтронитовые руды плавят на штейн. На предприятиях, работающих по полному циклу, дальнейшая схема переработки включает конвертирование, обжиг файнштейна, электроплавку закиси никеля с получением металлического никеля. Попутно извлекаемый кобальт выпускают в виде металла и/или солей.
Источник: {{Никель: в 3-х томах. Т. 2. Окисленные никелевые руды. Характеристика руд. Пирометаллургия и гидрометаллургия окисленных никелевых руд/ И. Д. Резник, Г. П. Ермаков, Я. М. Шнеерсон. — М.: 000 «Наука и технологии». 2004 — 468 с.
— ISBN 5-93952-004-9}}
подробнее см. на сайте «Никель»
Значительную часть никеля получают из сульфидных медно-никелевых руд. Из обогащенного сырья сначала готовят штейн — сульфидный материал, содержащий, кроме никеля, еще и примеси железа, кобальта, меди и ряда других металлов. Методом флотации получают никелевый концентрат. Далее штейн обычно подвергают обработке для отделения примесей железа и меди, а затем обжигают и образовавшийся оксид восстанавливают до металла. Существуют и гидрометаллургические методы получения никеля, в которых для его извлечения из руды используют раствор аммиака или серной кислоты. Для дополнительной очистки черновой никель подвергают электрохимическому рафинированию.
Физические и химические свойства
Никель — ковкий и пластичный металл. Имеет серебристый цвет с желтоватым оттенком, очень тверд, хорошо полируется, притягивается магнитом. Является ферромагнетиком, точка Кюри около 358 °C. На воздухе компактный никель стабилен, а высокодисперсный никель пирофорен. Поверхность никеля покрыта тонкой пленкой оксида NiO, которая прочно предохраняет металл от дальнейшего окисления. С водой и парами воды, содержащимися в воздухе, никель тоже не реагирует. Практически не взаимодействует никель и с такими кислотами, как серная, фосфорная, плавиковая и некоторыми другими. Химическая стойкость никеля обусловлена его склонностью к пассивированию — образованию на поверхности оксидных пленок, обладающих сильным защитным действием.
Металлический никель активно реагирует с азотной кислотой, причем в результате образуется нитрат никеля (II) Ni(NO3)2 и выделяется соответствующий оксид азота, например: 3Ni + 8HNO3 = 3Ni(NO3)2 + 2NO + 4H2O. Только при нагревании на воздухе до температуры выше 800 °C металлический никель начинает реагировать с кислородом с образованием оксида NiO.
Оксид никеля обладает основными свойствами. Он существует в двух полиморфных модификациях: низкотемпературной (гексагональная решетка) и высокотемпературной (кубическая решетка, устойчива при температуре выше 252 °C). Имеются сообщения о синтезе оксидных фаз никеля состава NiO1,33—2,0.
При нагревании никель реагирует со всеми галогенами с образованием дигалогенидов NiHal2. Нагревание порошков никеля и серы приводит к образованию сульфида никеля NiS. И растворимые в воде дигалогениды никеля, и нерастворимый в воде сульфид никеля могут быть получены не только «сухим», но и «мокрым» путем, из водных растворов.
С графитом никель образует карбид Ni3C, c фосфором — фосфиды составов Ni5P2, Ni2P, Ni3P. Никель реагирует и с другими неметаллами, в том числе (при особых условиях) с азотом. Интересно, что никель способен поглощать большие объемы водорода, причем в результате образуются твердые растворы водорода в никеле.
Известны такие растворимые в воде соли никеля, как сульфат NiSO4, нитрат Ni(NO3)2 и многие другие. Большинство этих солей при кристаллизации из водных растворов образует кристаллогидраты, например, NiSO4·7Н2О, Ni(NO3)2·6Н2О. К числу нерастворимых соединений никеля относятся фосфат Ni3(PO4)2 и силикат Ni2SiO4.
При добавлении щелочи к раствору соли никеля(II) выпадает зеленый осадок гидроксида никеля:
Ni(NO3)2 + 2NaOH = Ni(OH)2 + 2NaNO3. Ni(OH)2 обладает слабоосновными свойствами. Если на суспензию Ni(OH)2 в щелочной среде воздействовать сильным окислителем, например, бромом, то возникает гидроксид никеля(III):
2Ni(OH)2 + 2NaOH + Br2 = 2Ni(OH)3 + 2NaBr.
Для никеля характерно образование комплексов. Так, катион Ni2+ с аммиаком образует гексаамминовый комплекс [Ni(NH3)6]2+ и диакватетраамминовый комплекс [Ni(NH3)4(Н2О)2]2+. Эти комплексы с анионами образуют синие или фиолетовые соединения.
При действии фтора F2 на смесь NiCl2 и КСl возникают комплексные соединения, содержащие никель в высоких степенях окисления: +3 — (K3[NiF6]) и +4 — (K2[NiF6]). Порошок никеля реагирует с оксидом углерода(II) СО, причем образуется легко летучий тетракарбонил Ni(CO)4, который находит большое практическое применение при нанесении никелевых покрытий, приготовлении высокочистого дисперсного никеля и т. д.
Характерна реакция ионов Ni2+ с диметилглиоксимом, приводящая к образованию розово-красного диметилглиоксимата никеля. Эту реакцию используют при количественном определении никеля, а продукт реакции — как пигмент косметических материалов и для других целей.
Применение
Основная доля выплавляемого никеля расходуется на приготовление различных сплавов. Так, добавление никеля в стали позволяет повысить химическую стойкость сплава, и все нержавеющие стали обязательно содержат никель. Кроме того, сплавы никеля характеризуются высокой вязкостью и используются при изготовлении прочной брони. Сплав железа и никеля, содержащий 36—38 % никеля, обладает удивительно низким коэффициентом термического расширения (это — так называемый сплав инвар (сплав)), и его применяют при изготовлении ответственных деталей различных приборов.
При изготовлении сердечникиов электромагнитов широкое применение находят сплавы под общим названием пермаллои. Эти сплавы, кроме железа, содержат от 40 до 80 % никеля. Общеизвестны применяемые в различных нагревателях нихромовые спирали, которые состоят из хрома (10—30 %) и никеля. Из никелевых сплавов чеканятся монеты. Общее число различных сплавов никеля, находящих практическое применение, достигает нескольких тысяч.
Высокая коррозионная стойкость никелевых покрытий позволяет использовать тонкие никелевые слои для защиты различных металлов от коррозии путем их никелирования. Одновременно никелирование придает изделиям красивый внешний вид. В этом случае для проведения электролиза используют водный раствор двойного сульфата аммония и никеля (NH4)2Ni(SO4)2.
Никель широко используют при изготовлении различной химической аппаратуры, в кораблестроении, в электротехнике, при изготовлении щелочных аккумуляторов, для многих других целей. Специально приготовленный дисперсный никель (так называемый никель Ренея) находит широкое применение как катализатор самых разных химических реакций. Оксиды никеля используют при производстве ферритных материалов и как пигмент для стекла, глазурей и керамики; оксиды и некоторые соли служат катализаторами различных процессов.
Производство железо-никелевых, никель-кадмиевых, никель-цинковых, никель-водородных аккумуляторов.
Биологическая роль
Никель относится к числу микроэлементов, необходимых для нормального развития живых организмов. Однако о его роли в живых организмах известно немного. Известно, что никель принимает участие в ферментативных реакциях у животных и растений. В организме животных он накапливается в ороговевших тканях, например, в перьях.
Повышенное содержание никеля в почвах приводят к эндемическим заболеваниям — у растений появляются уродливые формы, у животных — заболевания глаз, связанные с накоплением никеля в роговице.
Цельный металлический никель не опасен. Пыль, пары никеля и его соединений токсичны. Как было сказано выше, никель способен накапливаться в роговице, поэтому отравление им может привести к значительному ухудшению зрения. Никель — канцерогенное вещество. Токсическая доза никеля (для крыс) — 50 мг. Особенно вредны летучие соединения никеля, в частности, его тетракарбонил Ni(CO)4. ПДК никеля в воздухе составляет от 0,0002 до 0,001 мг/м3 (для различных соединений).
См. также
- Категория:Соединения никеля
- Монель-металл
- Руды Ni
Ссылки
- Никель на Webelements
- Никель в Популярной библиотеке химических элементов
- «Никель» — статья в Физической энциклопедии
| H | He | |||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | |||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |
| Cs | Ba | * | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| Fr | Ra | ** | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Uub | Uut | Uuq | Uup | Uuh | Uus | Uuo | |
| * | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | |||
| ** | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr |
af:Nikkel
ar:نيكل
az:Nikel
bg:Никел
bs:Nikl
ca:Níquel
co:Nichele
cs:Nikl
da:Nikkel
de:Nickel
el:Νικέλιο
en:Nickel
eo:Nikelo
es:Níquel
et:Nikkel
fi:Nikkeli
fr:Nickel
gl:Níquel (elemento)
he:ניקל
hr:Nikal
hu:Nikkel
hy:Նիկել
id:Nikel
io:Nikelo
is:Nikkel
it:Nichel
ja:ニッケル
jbo:nikle
ko:니켈
ku:Nîkel
la:Niccolum
lb:Néckel
lt:Nikelis
lv:Niķelis
mi:Konukōreko
ml:നിക്കല്
nds:Nickel (Metall)
nl:Nikkel
nn:Nikkel
no:Nikkel
oc:Niquèl
pl:Nikiel
pt:Níquel
ro:Nichel
sh:Nikl
simple:Nickel
sk:Nikel
sl:Nikelj
sr:Никл
sv:Nickel
sw:Nikeli
tg:Никел
th:นิกเกิล
tr:Nikel
ug:نىكېل
uk:Нікель
uz:Nikel
vi:Niken
zh:镍
Этот металл известен людям не так давно, но без него современной промышленности не обойтись. Он равнодушен к агрессивной химии, супернагрузкам и температурам.
«Эру никеля» может породить производство транспорта будущего электромобилей.
Содержание
- Что представляет собой
- История
- Физико-химические характеристики
- Месторождения
- Способы добычи и переработки
- Классификация сплавов
- Кислотостойкие
- Жаропрочные
- Сферы применения
- Чистый никель
- Сплавы
- Предостережения
- Перспективы
Что представляет собой
Никель – это металл серебристо-белого цвета с желтоватым оттенком. Наделен ковкостью, пластичностью, хорошей полируемостью.
Относится к группе тяжелых металлов. Представляет собой смесь пяти природных изотопов плюс шесть созданных.
Химический элемент системы Менделеева (№28), международное обозначение – Ni, Niccolum.
Нанодоли процентов никеля содержат моря, растения, животные, организм человека.
История
Название металла имеет немецкое происхождение. Так именуют в немецком фольклоре духа гор. Он подбрасывал старателям, разыскивающим медь, ее имитацию (никелин).
Nickel по-немецки – озорник.
Путь к признанию был извилистым:
- Промышленники обнаружили присутствие металла в «купферникеле» (по-немецки – «упрямая» медь) в 1751 году. Шведский металлург Август Кронштедт опознал соединение как никелево-мышьяковое.
- Никель классифицировали как «полуметалл».
- Спустя 24 года швед Томас Бергман доказал, что это просто металл.
- Немецкий химик Иоганн Рихтер получил чистый никель восстановлением никелевого купороса (1804 год), дал его научное описание.
Металл обрел международный статус.
Физико-химические характеристики
Никель устойчив к окислению. Это свойство обеспечивает тонкая поверхностная пленка оксида NiO, появляющаяся при обычных температурах.
| Свойства атома | |
|---|---|
| Название, символ, номер | Ни́кель / Niccolum (Ni), 28 |
| Атомная масса (молярная масса) |
58,6934(4) а. е. м. (г/моль) |
| Электронная конфигурация | [Ar] 3d8 4s2 |
| Радиус атома | 124 пм |
| Химические свойства | |
| Ковалентный радиус | 115 пм |
| Радиус иона | (+2e) 69 пм |
| Электроотрицательность | 1,91 (шкала Полинга) |
| Электродный потенциал | -0,25 В |
| Степени окисления | 0, +2, +3 |
| Энергия ионизации (первый электрон) |
736,2 (7,63) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | 8,902 г/см³ |
| Температура плавления | 1726 K (1453 °C, 2647 °F) |
| Температура кипения | 3005 K (2732 °C, 4949 °F) |
| Уд. теплота плавления | 17,61 кДж/моль |
| Уд. теплота испарения | 378,6 кДж/моль |
| Молярная теплоёмкость | 26,1 Дж/(K·моль) |
| Молярный объём | 6,6 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | кубическая гранецентрированая |
| Параметры решётки | 3,524 Å |
| Температура Дебая | 375 K |
| Прочие характеристики | |
| Теплопроводность | (300 K) 90,9 Вт/(м·К) |
| Номер CAS | 7440-02-0 |
Центрированная по граням структура обуславливает стойкость к нагрузкам, а особенности строения электронных оболочек атомов – свойство намагничивания.
Месторождения
Никель не относится к редкоземельным металлам – на планете его достаточно (0,01% по массе). В земной коре обнаружен исключительно в связанном виде.
Предполагается, что из его сплава с железом состоит земное ядро.
Второй источник самородного металла – железные метеориты.
Крупными залежами располагают страны Тихоокеанского бассейна:
- Австралия;
- Индонезия;
- Новая Каледония;
- Филиппины.
Мировые запасы никелевых руд исчисляются миллионами тонн.
Российские месторождения сосредоточены на Урале, в Воронежской и Мурманской областях, возле Норильска.
Медно-никелевые руды залегают в зонах глубинных разломов на древних щитах. Их характерная особенность – постоянный минеральный состав руд, среди которых кобальт, платиноиды, золото.
Втрое богаче по запасам месторождения экзогенного типа.
Способы добычи и переработки
Почти весь никель получают из гарниерита (зеленой никелевой руды) и колчедана.
Добыча проходит стандартным для большинства руд закрытым (шахтным) способом.
Извлеченное сырье восстанавливают тремя методами:
- Взаимодействием с угольной пылью во вращающихся печах-трубах. Полученные железо-никелевые окатыши избавляют от серы, затем прокаливают, обрабатывают раствором аммиака. На подкисленный раствор воздействуют электролитом, получая металл.
- Из оксидной руды металл восстанавливают алюминотермическим способом.
- Карбонильный метод. Из руды получают медно-никелевый штейн, над которым под давлением запускают СО. Получается тетракарбонилникель. Это летучее соединение, поэтому разлагается от воздействия тепла. Металл получается особо чистым.
Карбонильный способ фигурирует в литературе также как метод Монда.
Классификация сплавов
Классификация никелевых сплавов основывается на составе и свойствах.
Кислотостойкие
Сплавы с присадкой-легированием другими металлами:
- Хром, вольфрам придают сплаву стойкости в агрессивных окислительных средах.
- Соединения с медью или молибденом используются в агрессивных неокислительных средах.
Стойкость к коррозии обеспечивают кремний, алюминий.
Жаропрочные
Сплавы типа «никель + хром + присадка других легирующих элементов». Такими элементами выступают алюминий, вольфрам, титан, молибден, стронций, другие.
Такие сплавы металлов востребованы для изготовления узлов силовых установок, подверженных максимальным нагрузкам.
Сферы применения
О руде, по описанию похожей на медь, знали еще саксонские горняки в Средние века. Она использовалась как зеленый пигмент для окраски стекол.
С тех пор, благодаря изучению свойств и характеристик металла, область применения расширилась.
Никель – один из лучших металлов-катализаторов. Другие плюсы: малая активность, устойчивость к агрессивной химии, вязкость, пластичность, ковкость.
Его применяют самостоятельно и в сплавах.
Чистый никель
Беспримесный никель востребован промышленным производством:
- Покрытие, стойкое коррозии. Применяется для защиты железа, алюминия, магния, цинка, чугуна, нелегированных сталей. Попутно снижает стоимость изделий.
- Приборы, котлы, тигли с постоянными физико-химическими характеристиками, устойчивые к коррозии.
- Резервуары для перевозки и хранения химических реагентов (включая едкие щелочи), эфирных масел.
- Трубы для перекачки щелочей, других агрессивных субстанций на предприятиях химического комплекса.
- Инструментарий для науки, медицины.
- Детали приборов радиолокации, телевидения, дистанционного управления процессами на атомных станциях.
Порошкообразный никель используют как катализатор при производстве спиртов, ароматических углеводородов, других соединений. Это связка при изготовлении сверхтвердых материалов, засыпка для фильтрования газообразных химических продуктов.
Сплавы
Известно более трех тысяч композиций никеля с металлами:
- Самые распространенные – с железом, кобальтом, хромом, молибденом, алюминием, титаном, бериллием.
Все нержавеющие стали содержат никель, поскольку этот металл повышает химическую стойкость сплава.
- Медно-никелевое соединение монель (никеля – две трети): химия, электротехника, медицина. А также оснастка для океанских лайнеров, морских судов, портов, защитные кожухи атомных реакторов, газовые турбины, двигатели реактивных самолетов.
- Сплавы никеля вязкие, с малым коэффициентом термического расширения. Из них делают броню для нужд военно-промышленного комплекса.
- Особая группа – сплавы на медной основе (нейзильбер, латунь, бронза, другие).
- Никелевые сплавы – основа современных монет (например, пятицентовика в США), обмотки струн музыкальных инструментов, брекетов.
Продукция металлургических предприятий поставляется в виде трубки, проволоки, нити, фольги, ленты, порошка, других конфигураций.
Продукция из никеля востребована там, где обязательна стойкость материалов к коррозии в агрессивных средах.
Предостережения
В составе никеля содержатся природные и искусственно созданные радиоактивные изотопы.
Это чревато проблемами со здоровьем, на бытовом уровне:
- Это аллерген, что учитывают, выбирая украшения, часы, другие изделия, контактирующие с кожей. Они могут спровоцировать контактный дерматит.
- Наличие никеля в организме человека снижает артериальное давление, провоцирует витилиго.
- Избыток металла в почве – причина болезней животных, растений.
- Особо опасны летучие соединения вещества.
Мелкодисперсный никелевый порошок самовоспламеняется при комнатной температуре.
Эти минусы не фатальны, но ими не стоит пренебрегать.
Перспективы
Одна из главных сфер потребления никеля – щелочные батареи (аккумуляторы). Она актуализируется на волне интереса к выпуску электромобилей. Сегодня главный аккумуляторный компонент – кобальт, но он дорог, поставки из Африки проблемны. Разработаны более эффективные образцы с доминированием лития и никеля. Установлено, что благодаря никелю мощность аккумуляторов увеличивается. При этом его цена в шесть раз меньше кобальта, а предложение в 20 раз выше.
Специалисты прогнозируют рост спроса на никель к 2025 году до 400 000 тонн (с 75 000 тонн в 2016 году).
Металл никель
Никель является жарпочрочным, жаростойким и коррозионностойким металлом, что определяет его применение в качестве конструкционного материала для изделий, подверженных воздействию различных агрессивных сред в том числе при повышенных температурах, а также подверженных механическим нагрузкам при высоких температурах. Помимо этого никель служит является популярным легирующим элементом для сталей и сплавов. На странице представлено описание данного металла: физические свойства, области применения, марки никеля, виды продукции.
Основные сведения о никеле
Никель (Ni) (Niccolum) — химический элемент с атомным номером 28 в периодической системе, ковкий и пластичный металл. Имеет серебристый цвет с желтоватым оттенком, хорошо полируется, притягивается магнитом. Плотность никеля составляет 8,902 г/см3, температура плавления tпл. = 1453°С, температура кипения tкип. = 2730-2915°С, данный металл является ферромагнетиком, точка Кюри около 358 °C. На воздухе компактный никель стабилен. Поверхность никеля покрыта тонкой пленкой оксида NiO, которая прочно предохраняет металл от дальнейшего окисления.
В земной коре содержание никеля составляет около 8·10-3% по массе. Возможно, громадные количества никеля — около 17·1019тонн — заключены в ядре Земли, которое, по одной из распространенных гипотез, состоит из железоникелевого сплава. В морской воде содержание никеля составляет примерно 1·10-8-5·10-8%.
История открытия никеля
Впервые присутствие никеля в соединении никеля и мышьяка NiAs («купферникель») обнаружил шведский металлург А.Ф. Кронштедт в 1751 году. Тогда никель относили к «полуметаллу» — простому веществу, обладающему как свойствами металлов, так и неметаллов. Данная точка зрения подвергалась серьезным сомнениям. Но в 1775 году швед Т. Бергман доказал, что никель — простое вещество. Окончательное утверждение никеля произошло в 1804 году, когда немецкий химик И. Рихтер получил чистый никель путем восстановления никелевого купороса.
Свойства никеля
Физические свойства никеля
| Свойство | Никель |
|---|---|
| Атомный номер | 28 |
| Атомная масса, а.е.м | 58,69 |
| Атомный диаметр, пм | 248 |
| Плотность, г/см³ | 8,902 |
| Удельная теплоемкость, Дж/(K·моль) | 0,443 |
| Теплопроводность, Вт/(м·K) | 90,9 |
| Температура плавления, °С | 1453 |
| Температура кипения, °С | 2730-2915 |
| Теплота плавления, кДж/моль | 17,61 |
| Теплота испарения, кДж/моль | 378,6 |
| Молярный объем, см³/моль | 6,6 |
| Группа металлов | Тяжелый металл |
Химические свойства никеля
| Свойство | Никель |
|---|---|
| Ковалентный радиус, пм | 115 |
| Радиус иона, пм | (+2e) 69 |
| Электроотрицательность (по Полингу): | 1,91 |
| Электродный потенциал: | 0 |
| Степени окисления: | 3, 2, 0 |
Марки никеля и сплавов
Современная промышленность выпускает большое количество различных марок никеля.
- Н0, Н1 — никель первичный, содержание Ni+Co — не менее 99,99% и 99,93% соответственно. Никель данных марок выпускается в виде катодных листов, пластин, полос. Эту продукцию получают с помощью электролиза.
- Н2, Н3, Н4 — никель первичный, содержание Ni+Co — не менее 99,8%, 98,6% и 97,6% соответственно. Никель этих марок выпускается в виде пластин, полос, катодных листов, гранул, обрезов и слитков. Данную продукцию получают с помощью электролиза, переплава, прессования отходов никеля, огневого рафинирования.
- НП1, НП2, НП3, НП4 — никель полуфабрикатный, содержание Ni+Co — не менее 99,99%, 99,5%, 99,3% и 99,0% соответственно. Никель приведенных марок выпускается в виде никелевой проволоки, прутков, листов, полос и лент.
- НПА1, НПА2 — никель полуфабрикатный анодный, содержание Ni+Co — не менее 99,7%, 99,0% соответственно. Никель представленных марок выпускается в виде листов и стержней.
- НПАН — Никель полуфабрикатный анодный непассивирующийся (на поверхности изделий из никеля данной марки не образуется тонкая пленка с высоким сопротивлением), содержание Ni+Co — не менее 99,4%. Никель этой марки выпускается в виде стержней и листов.
- НК0,2 — Никель кремнистый, содержание Ni+Co — не менее 99,4%. Никель данной марки выпускается в виде проволоки.
- НМц1, НМц2, НМц2,5, НМц5 — никель марганцевый, содержит до 98,5% Ni+Co (марка НМц1). Никель приведенных марок выпускается в виде проволоки.
Достоинства / недостатки никеля
- Достоинства:
- обладает высокой жаропрочностью и жаростойкостью;
- имеет высокую коррозионную стойкость во многих агрессивных средах.
- Недостатки:
- имеет высокую стоимость.
Применение никеля
Никель по большей части является составным компонентом различных сплавов. Все нержавеющие стали обязательно содержат никель, так как никель повышает химическую стойкость сплава. Также сплавы никеля характеризуются высокой вязкостью и используются при изготовлении прочной брони. При изготовлении важнейших деталей различных приборов используется сплав никеля с железом (36-38% никеля), обладающий низким коэффициентом термического расширения.
При изготовлении сердечников электромагнитов широкое применение находят сплавы под общим названием пермаллои. Эти сплавы, кроме железа, содержат от 40 до 80% никеля. Из никелевых сплавов чеканятся монеты. Общее число различных сплавов никеля, находящих практическое применение, достигает нескольких тысяч.
Различные металлы никелируют, что позволяет защитить их от коррозии. На металл наносится тонкий никелевый слой, обладающий высокой коррозионной стойкостью. Вместе с этим никелирование придает изделиям красивый внешний вид.
Никель широко используют при изготовлении различной химической аппаратуры, в кораблестроении, в электротехнике, при изготовлении щелочных аккумуляторов, для многих других целей. Специально приготовленный дисперсный никель находит широкое применение как катализатор самых разных химических реакций. Оксиды никеля используют при производстве ферритных материалов и как пигмент для стекла, глазурей и керамики; оксиды и некоторые соли служат катализаторами различных процессов. Производство железо-никелевых, никель-кадмиевых, никель-цинковых, никель-водородных аккумуляторов.
Продукция из никеля
Современная промышленность выпускает разнообразную продукцию из никеля. Наиболее распространены никелевая проволока и нить, лента и фольга, прутки и круги, листы и полосы, трубки, порошок.
Достаточное широкое применение в промышленности получили никелевые аноды, которые используются при никелировании поверхностей различных изделий. Также для никелирования применяют порошок никеля. Другой вид никелевых листов, катоды, используются в качестве шихты в производстве никельсодержащих сплавов. Помимо катодов в качестве легирующей добавки к сплава применяют и никелевый порошок. В целом продукция из никеля активно применяется в тех областях промышленности, в которых предъявляются повышенные требования к коррозионной стойкости материалов в агрессивных средах.
Никель и его характеристики
Общая характеристика никеля
Подобно кобальту, никель встречается в природе преимущественно в виде соединений с мышьяком или серой; таковы, например, минералы купферникель NiAs, мышьяковоникелевый блеск NiAsS и др. Никель более распространен, чем кобальт [около 0,01% (масс.) земной коры].
Металлический никель имеет серебристый цвет с желтоватым оттенком (рис. 1), очень тверд, хорошо полируется, притягивается магнитом. Он характеризуется высокой коррозионной стойкостью – устойчив в атмосфере, в воде, в щелочах и ряде кислот. Активно растворяется в азотной кислоте. Химическая стойкость никеля обусловлена его склонностью к пассивированию – к образованию на поверхности оксидных пленок, обладающих сильным защитным действием.
Рис. 1. Никель. Внешний вид.
Атомная и молекулярная масса никеля
Поскольку в свободном состоянии никель существует в виде одноатомных молекул Ni, значения его атомной и молекулярной масс совпадают. Они равны 58,6934.
Изотопы никеля
Известно, что в природе никель может находиться в виде пяти стабильных изотопов 58Ni, 60Ni, 61Ni,62Niи 64Ni. Их массовые числа равны 58, 60, 61, 62 и 64 соответственно. Ядро атома изотопа никеля 58Ni содержит двадцать восемь протонов и тридцать нейтронов, а остальные изотопы отличаются от него только числом нейтронов.
Существуют искусственные нестабильные изотопы никеля с массовыми числами от 48-ми до 78-ми, а также восемь мета стабильных состояний, среди которых наиболее долгоживущим является изотоп 59Ni с периодом полураспада равным 76 тысяч лет.
Ионы никеля
Электронная формула, демонстрирующая распределение по орбиталям электронов никеля выглядит следующим образом:
1s22s22p63s23p63d84s2.
В результате химического взаимодействия никель отдает свои валентные электроны, т.е. является их донором, и превращается в положительно заряженный ион:
Ni0 -2e → Ni2+;
Ni0 -3e → Ni3+.
Молекула и атом никеля
В свободном состоянии никель существует в виде одноатомных молекул Ni. Приведем некоторые свойства, характеризующие атом и молекулу никеля:
|
Энергия ионизации атома, эВ |
7,63 |
|
Относительная электроотрицательность |
1,91 |
|
Радиус атома, нм |
0,124 |
Сплавы никеля
Главная масса никеля идет на производство различных сплавов с железом, медью, цинком и др. Металлами. Присадка никеля к стали повышает её вязкость и стойкость против коррозии.
Сплавы на основе никеля можно разделить на жаропрочные (нимоник, инконель, хастелла [свыше 60% никеля, 15-20% хрома и др. металлы]), магнитные (пермаллой [78,5% никеля и 2,5% железа]) и сплавы с особыми свойствами (монель-металл, никелин, константан, инвар, платинит).