(Redirected from Barium dinitrate)

|
|

|
|
| Names | |
|---|---|
| Other names
Barium dinitrate, |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChEBI |
|
| ChEMBL |
|
| ChemSpider |
|
| ECHA InfoCard | 100.030.006 |
| EC Number |
|
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
| UN number | 1446 |
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
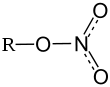
SMILES
|
|
| Properties | |
|
Chemical formula |
Ba(NO3)2 |
| Molar mass | 261.337 g/mol |
| Appearance | white, lustrous crystals |
| Odor | odorless |
| Density | 3.24 g/cm3 |
| Melting point | 592 °C (1,098 °F; 865 K) (decomposes) |
|
Solubility in water |
4.95 g/100 mL (0 °C) 10.5 g/100 mL (25 °C) 34.4 g/100 mL (100 °C) |
| Solubility | slightly soluble in acetone, and ethanol[1] |
|
Magnetic susceptibility (χ) |
-66.5·10−6 cm3/mol |
|
Refractive index (nD) |
1.5659 |
| Structure | |
|
Crystal structure |
cubic |
| Hazards | |
| GHS labelling: | |
|
Pictograms |
  
|
|
Signal word |
Danger |
|
Hazard statements |
H272, H301, H302, H319, H332 |
|
Precautionary statements |
P210, P220, P221, P261, P264, P270, P271, P280, P301+P310, P301+P312, P304+P312, P304+P340, P305+P351+P338, P312, P321, P330, P337+P313, P370+P378, P405, P501 |
| NFPA 704 (fire diamond) |
3 0 3 |
| Flash point | noncombustible[2] |
| Lethal dose or concentration (LD, LC): | |
|
LD50 (median dose) |
355 mg/kg (oral, rat)[citation needed] 187 mg/kg (rat, oral)[3] |
|
LDLo (lowest published) |
79 mg Ba/kg (rabbit, oral) 421 mg Ba/kg (dog, oral)[3] |
| NIOSH (US health exposure limits): | |
|
PEL (Permissible) |
TWA 0.5 mg/m3[2] |
|
REL (Recommended) |
TWA 0.5 mg/m3[2] |
|
IDLH (Immediate danger) |
50 mg/m3[2] |
| Supplementary data page | |
| Barium nitrate (data page) | |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Barium nitrate is the inorganic compound with the chemical formula Ba(NO3)2. It, like most barium salts, is colorless, toxic, and water-soluble. It burns with a green flame and is an oxidizer; the compound is commonly used in pyrotechnics.[4]
Manufacture, occurrence, and reactions[edit]
Barium nitrate is manufactured by two processes that start with the main source material for barium, the carbonate. The first involves dissolving barium carbonate in nitric acid, allowing any iron impurities to precipitate, then filtered, evaporated, and crystallized. The second requires combining barium sulfide with nitric acid.[4]
It occurs naturally as the very rare mineral nitrobarite.[5][6]
At elevated temperatures, barium nitrate decomposes to barium oxide:
- 2Ba(NO3)2 → 2BaO + 4NO2 + O2
Applications[edit]
Barium nitrate is used in the production of BaO-containing materials.
Military[edit]
Although no longer produced, Baratol is an explosive composed of barium nitrate, TNT and binder; the high density of barium nitrate results in baratol being quite dense as well. Barium nitrate mixed with aluminium powder, a formula for flash powder, is highly explosive. It is mixed with thermite to form Thermate-TH3, used in military thermite grenades. Barium nitrate was also a primary ingredient in the «SR 365» incendiary charge used by the British in the De Wilde incendiary ammunition with which they armed their interceptor fighters, such as the Hawker Hurricane and Supermarine Spitfire, during the Battle of Britain.[7] It is also used in the manufacturing process of barium oxide, the vacuum tube industry and for green fire in pyrotechnics.
Safety[edit]
Like all soluble barium compounds, barium nitrate is toxic by ingestion or inhalation.[8]
Solutions of sulfate salts such as Epsom salts or sodium sulfate may be given as first aid for barium poisoning, as they precipitate the barium as the insoluble (and non-toxic) barium sulfate.
Inhalation may also cause irritation to the respiratory tract.
While skin or eye contact is less harmful than ingestion or inhalation, it can still result in irritation, itching, redness, and pain.
The Occupational Safety and Health Administration and the National Institute for Occupational Safety and Health have set occupational exposure limits at 0.5 mg/m3 over an eight-hour time-weighted average.[9]
References[edit]
- ^ John Rumble (June 18, 2018). CRC Handbook of Chemistry and Physics (99th ed.). CRC Press. pp. 4–41. ISBN 978-1138561632.
- ^ a b c d NIOSH Pocket Guide to Chemical Hazards. «#0046». National Institute for Occupational Safety and Health (NIOSH).
- ^ a b «Barium (soluble compounds, as Ba)». Immediately Dangerous to Life or Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ^ a b Kresse, Robert; Baudis, Ulrich; Jäger, Paul; Riechers, H. Hermann; Wagner, Heinz; Winkler, Jocher; Wolf, Hans Uwe (2007). «Barium and Barium Compounds». In Ullman, Franz (ed.). Ullmann’s Encyclopedia of Industrial Chemistry. Wiley-VCH. doi:10.1002/14356007.a03_325.pub2. ISBN 978-3527306732.
- ^ Mindat, http://www.mindat.org/min-2918.html
- ^ «List of Minerals». 21 March 2011.
- ^ Williams, Anthony G; Emmanuel Gustin (2004). «THE BATTLE OF BRITAIN: ARMAMENT OF THE COMPETING FIGHTERS». Flying Guns: World War 2. Crowood Press. Archived from the original on 5 January 2013. Retrieved 23 December 2012.
The B. Mk VI ‘De Wilde’ incendiary (named after the original Belgian inventor but in fact completely redesigned by Major Dixon), which contained 0.5 grams of SR 365 (a composition including barium nitrate which ignited on impact with the target) was twice as effective as these, scoring one in five.
- ^ Barium Nitrate
- ^ CDC — NIOSH Pocket Guide to Chemical Hazards
- v
- t
- e
Salts and covalent derivatives of the nitrate ion
(Redirected from Barium dinitrate)

|
|

|
|
| Names | |
|---|---|
| Other names
Barium dinitrate, |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChEBI |
|
| ChEMBL |
|
| ChemSpider |
|
| ECHA InfoCard | 100.030.006 |
| EC Number |
|
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
| UN number | 1446 |
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
Ba(NO3)2 |
| Molar mass | 261.337 g/mol |
| Appearance | white, lustrous crystals |
| Odor | odorless |
| Density | 3.24 g/cm3 |
| Melting point | 592 °C (1,098 °F; 865 K) (decomposes) |
|
Solubility in water |
4.95 g/100 mL (0 °C) 10.5 g/100 mL (25 °C) 34.4 g/100 mL (100 °C) |
| Solubility | slightly soluble in acetone, and ethanol[1] |
|
Magnetic susceptibility (χ) |
-66.5·10−6 cm3/mol |
|
Refractive index (nD) |
1.5659 |
| Structure | |
|
Crystal structure |
cubic |
| Hazards | |
| GHS labelling: | |
|
Pictograms |
  
|
|
Signal word |
Danger |
|
Hazard statements |
H272, H301, H302, H319, H332 |
|
Precautionary statements |
P210, P220, P221, P261, P264, P270, P271, P280, P301+P310, P301+P312, P304+P312, P304+P340, P305+P351+P338, P312, P321, P330, P337+P313, P370+P378, P405, P501 |
| NFPA 704 (fire diamond) |
3 0 3 |
| Flash point | noncombustible[2] |
| Lethal dose or concentration (LD, LC): | |
|
LD50 (median dose) |
355 mg/kg (oral, rat)[citation needed] 187 mg/kg (rat, oral)[3] |
|
LDLo (lowest published) |
79 mg Ba/kg (rabbit, oral) 421 mg Ba/kg (dog, oral)[3] |
| NIOSH (US health exposure limits): | |
|
PEL (Permissible) |
TWA 0.5 mg/m3[2] |
|
REL (Recommended) |
TWA 0.5 mg/m3[2] |
|
IDLH (Immediate danger) |
50 mg/m3[2] |
| Supplementary data page | |
| Barium nitrate (data page) | |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Barium nitrate is the inorganic compound with the chemical formula Ba(NO3)2. It, like most barium salts, is colorless, toxic, and water-soluble. It burns with a green flame and is an oxidizer; the compound is commonly used in pyrotechnics.[4]
Manufacture, occurrence, and reactions[edit]
Barium nitrate is manufactured by two processes that start with the main source material for barium, the carbonate. The first involves dissolving barium carbonate in nitric acid, allowing any iron impurities to precipitate, then filtered, evaporated, and crystallized. The second requires combining barium sulfide with nitric acid.[4]
It occurs naturally as the very rare mineral nitrobarite.[5][6]
At elevated temperatures, barium nitrate decomposes to barium oxide:
- 2Ba(NO3)2 → 2BaO + 4NO2 + O2
Applications[edit]
Barium nitrate is used in the production of BaO-containing materials.
Military[edit]
Although no longer produced, Baratol is an explosive composed of barium nitrate, TNT and binder; the high density of barium nitrate results in baratol being quite dense as well. Barium nitrate mixed with aluminium powder, a formula for flash powder, is highly explosive. It is mixed with thermite to form Thermate-TH3, used in military thermite grenades. Barium nitrate was also a primary ingredient in the «SR 365» incendiary charge used by the British in the De Wilde incendiary ammunition with which they armed their interceptor fighters, such as the Hawker Hurricane and Supermarine Spitfire, during the Battle of Britain.[7] It is also used in the manufacturing process of barium oxide, the vacuum tube industry and for green fire in pyrotechnics.
Safety[edit]
Like all soluble barium compounds, barium nitrate is toxic by ingestion or inhalation.[8]
Solutions of sulfate salts such as Epsom salts or sodium sulfate may be given as first aid for barium poisoning, as they precipitate the barium as the insoluble (and non-toxic) barium sulfate.
Inhalation may also cause irritation to the respiratory tract.
While skin or eye contact is less harmful than ingestion or inhalation, it can still result in irritation, itching, redness, and pain.
The Occupational Safety and Health Administration and the National Institute for Occupational Safety and Health have set occupational exposure limits at 0.5 mg/m3 over an eight-hour time-weighted average.[9]
References[edit]
- ^ John Rumble (June 18, 2018). CRC Handbook of Chemistry and Physics (99th ed.). CRC Press. pp. 4–41. ISBN 978-1138561632.
- ^ a b c d NIOSH Pocket Guide to Chemical Hazards. «#0046». National Institute for Occupational Safety and Health (NIOSH).
- ^ a b «Barium (soluble compounds, as Ba)». Immediately Dangerous to Life or Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ^ a b Kresse, Robert; Baudis, Ulrich; Jäger, Paul; Riechers, H. Hermann; Wagner, Heinz; Winkler, Jocher; Wolf, Hans Uwe (2007). «Barium and Barium Compounds». In Ullman, Franz (ed.). Ullmann’s Encyclopedia of Industrial Chemistry. Wiley-VCH. doi:10.1002/14356007.a03_325.pub2. ISBN 978-3527306732.
- ^ Mindat, http://www.mindat.org/min-2918.html
- ^ «List of Minerals». 21 March 2011.
- ^ Williams, Anthony G; Emmanuel Gustin (2004). «THE BATTLE OF BRITAIN: ARMAMENT OF THE COMPETING FIGHTERS». Flying Guns: World War 2. Crowood Press. Archived from the original on 5 January 2013. Retrieved 23 December 2012.
The B. Mk VI ‘De Wilde’ incendiary (named after the original Belgian inventor but in fact completely redesigned by Major Dixon), which contained 0.5 grams of SR 365 (a composition including barium nitrate which ignited on impact with the target) was twice as effective as these, scoring one in five.
- ^ Barium Nitrate
- ^ CDC — NIOSH Pocket Guide to Chemical Hazards
- v
- t
- e
Salts and covalent derivatives of the nitrate ion
| Нитрат бария | |
|---|---|
 |
|
 |
|
| Общие | |
| Систематическое наименование |
Нитрат бария |
| Традиционные названия | Нитрат бария; бариевая селитра, азотнокислый барий, динитрат бария; нитрат бария(2+); нитробарит |
| Хим. формула | Ba(NO3)2 |
| Рац. формула | Ba(NO3)2 |
| Физические свойства | |
| Состояние | кристаллическое |
| Молярная масса | 261,337 г/моль |
| Плотность | 3,24 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 595 °C |
| Мол. теплоёмк. | 151,6 Дж/(моль·К) |
| Энтальпия | |
| • образования | −978,6 кДж/моль |
| Химические свойства | |
| Растворимость | |
| • в воде |
4,95 г/100 мл (при 0 °C) 34,4 (при 100 °C) |
| • в | спирте: нерастворим |
| Классификация | |
| Рег. номер CAS | 10022-31-8 |
| RTECS | CQ9625000 |
| Безопасность | |
| Предельная концентрация | 0,5 г/см3 |
| ЛД50 | (перорально, крысы) 355 мг/кг |
| Токсичность | умеренно-токсичен, ирритант, опасен для окружающей среды, окислитель |
| Пиктограммы СГС |
|
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Нитра́т ба́рия (в просторечии — азотнокислый бáрий, бáриевая селитра, нитрáт бáрия(2+), динитрáт бáрия) — неорганическое соединение, бариевая соль азотной кислоты. Химическая формула — Ba(NO3)2.
Распространение в природе
Нитрат бария встречается в природе в виде редкого минерала нитробаритa.
Физико-химические свойства
Нитрат бария представляет собой бесцветные кристаллы с кубической решеткой.
Термодинамические параметры
- Энтропия образования (298К): 96,4 Дж/(моль·К)
- Энтальпия плавления: 53,1 кДж/моль
Растворимость
- В воде
- растворим (9,2 г/100мл при +20 °C; 34,2 г/100мл при +100 °C);
- не растворим в спирте и концентрированной азотной кислоте.
С нитратом калия образует Ba(NO3)2•2KNO3.
Методы получения
- В лаборатории методом получения нитрата бария является взаимодействие гидроксида бария с азотной кислотой:
- [1]
- ↑ ICSC 1480 — НИТРАТ БАРИЯ. www.ilo.org. Дата обращения: 30 июня 2020. Архивировано 30 июня 2020 года.
[math]displaystyle{ mathsf{Ba(OH)_2+2HNO_3 longrightarrow Ba(NO_3)_2+2H_2O} }[/math]
- В промышленности обычно используют для этих целей BaCO3:
- [math]displaystyle{ mathsf{BaCO_3+2HNO_3longrightarrow Ba(NO_3)_2+H_2O+CO_2 uparrow } }[/math]
Химические свойства
- В водном растворе подвергается диссоциации:
- [math]displaystyle{ mathsf{Ba(NO_3)_2 leftrightarrow Ba^{2+}+2NO_3^-} }[/math]
- При температуре выше 595 °C разлагается до нитрита:
- [math]displaystyle{ mathsf{Ba(NO_3)_2 longrightarrow Ba(NO_2)_2+O_2uparrow } }[/math]
- При температуре свыше 670 °C разлагается до оксида бария.
[math]displaystyle{ mathsf{2Ba(NO_3)_2 longrightarrow 2BaO+4NO_2uparrow +O_2uparrow } }[/math]
- При температуре свыше 670 °C разлагается до оксида бария.
- В водном растворе реагирует с серной кислотой и сульфатами с выпадением белого осадка сульфата бария
- [math]displaystyle{ mathsf{Ba(NO_3)_2 + Na_2SO_4 rightarrow BaSO_4downarrow + 2NaNO_3} }[/math]
- [math]displaystyle{ mathsf{Ba(NO_3)_2 + H_2SO_4 rightarrow BaSO_4downarrow + 2HNO_3} }[/math]
- Является сильным окислителем, реагирует с горючими материалами и восстановителями, при измельчении активно и нередко со взрывом. Смеси нитрата бария с некоторыми органическими материалами склонны к самовоспламенению.
- Ионы бария образуют устойчивые соединения с краун эфирами.
Применение
- Для получения оксида и пероксида бария.
- Компонент эмалей и глазурей.
- В пиротехнике негигроскопичный нитрат бария широко используется для окрашивания пламени в зелёный цвет (большинство соединений других металлов, способных на это, мало пригодны из-за гигроскопичности).
- В специальных пулях к стрелковому оружию как окислитель в зажигательных и трассирующих составах.
Физиологическое значение
- Динитрат бария обладает умеренно-токсическим действием. ЛД50 для крыс при пероральном введении составляет 355 мг на 1 кг живого веса.
- Предельно допустимая концентрация азотнокислого бария в воздухе рабочих помещений составляет 0,5 г/см3[1] с обязательным контролем по ионам бария[2][3].
- Передозировка нитрата бария(2+) и других неорганических соединений этого щёлочноземельного металла в живых организмах — не безопасна.
Примечания
- ↑ name=https://docs.cntd.ru_ГОСТ (недоступная ссылка) 3777-76 Барий азотнокислый. Технические условия (с Изменениями 1, 2)
- ↑ name=https://docs.cntd.ru_ГОСТ (недоступная ссылка) 1713-79 Барий азотно-кислый технический. Технические условия (с Изменениями N 1, 2, 3)
- ↑ name=https://www.safework.ru Архивная копия от 8 марта 2022 на Wayback Machine
Поиск химических веществ по названиям или формулам.
Справочник содержит названия веществ и описания химических формул (в т.ч. структурные формулы и скелетные формулы).
Введите часть названия или формулу для поиска:
Языки:
По умолчанию |
Все возможные |
Из списка
|
Применить к найденному
Нитрат бария
Брутто-формула:
BaN2O6
CAS# 10022-31-8
Категории:
Неорганические соли
PubChem CID: 24798
| ChemSpider ID: 23184
Названия
Русский:
- Нитрат бария [Wiki]
- азотнокислый барий
- бариевая селитра
English:
- Barium dinitrate
- Barium nitrate [Wiki]
- Barium nitrate (Ba(NO3)2)
- Barium(II) nitrate (1:2)
- Dusicnan barnaty
- EINECS:233-020-5
- HSDB 401
- Nitrato barico
- Nitric acid, barium salt
- Nitrobarite
- barium(2+);dinitrate(IUPAC)
Варианты формулы:
Ba(NO3)2
O`^-/N^+`|O|O^-/0Ba^++O`^-/N^+`|O|O^-
Химический состав
Реакции, в которых участвует Нитрат бария
-
{M}O + 2H{X} -> {M}({X})2 + H2O
, где M =
Ca Cu Mg Ba Sr Pb; X =
NO3 -
{M}(NO3)2 + H2SO4 -> {M}SO4 + 2HNO3
, где M =
Mg Ca Ba Sr Zn Cd Mn Cu Hg Ni -
{M}(NO3)2 «T»-> {M}(NO2)2 + O2″|^»
, где M =
Ca Ba Sr -
{M}(OH)2 + 2H{X} -> {M}({X})2 + 2H2O
, где M =
Mg Ca Ba Sr Pb Cu Fe Zn Ni; X =
NO3 -
{M}{X}2 + 2AgNO3 -> 2Ag{X}»|v» + {M}(NO3)2
, где M =
Ca Mg Sr Ba; X =
Cl Br I
И ещё 11 реакций…
| Нитрат бария | |
|---|---|
 |
|
 |
|
| Систематическое наименование |
Нитрат бария |
| Хим. формула | Ba(NO3)2 |
| Состояние | кристаллическое |
| Молярная масса | 261,337 г/моль |
| Плотность | 3,24 г/см³ |
| Т. плав. | 595 °C |
| Мол. теплоёмк. | 151,6 Дж/(моль·К) |
| Энтальпия образования | −978,6 кДж/моль |
| Растворимость в воде |
4,95 г/100 мл (при 0 °C) 10,5 г/100 мл (при +25 °C) 34,4 (при 100 °C) |
| Растворимость в | спирте: нерастворим |
| ГОСТ | ГОСТ 3777-76 ГОСТ 1713-79 |
| Рег. номер CAS | 10022-31-8 |
| PubChem | 24798 |
| Рег. номер EINECS | 233-020-5 |
| SMILES |
[N+](=O)([O-])[O-].[N+](=O)([O-])[O-].[Ba+2] |
| InChI |
1S/Ba.2NO3/c;2*2-1(3)4/q+2;2*-1 IWOUKMZUPDVPGQ-UHFFFAOYSA-N |
| RTECS | CQ9625000 |
| ChemSpider | 23184 |
| ЛД50 | (перорально, крысы) 355 мг/кг |
| Токсичность | среднетоксичен |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. |
Нитрат бария (азотнокислый барий, бариевая селитра) — бариевая соль азотной кислоты. Химическая формула — Ba(NO3)2.
Содержание
- 1 Распространение в природе
- 2 Физико-химические свойства
- 2.1 Термодинамические параметры
- 2.2 Растворимость
- 3 Методы получения
- 4 Химические свойства
- 5 Применение
- 6 Токсичность
Распространение в природе
Нитрат бария встречается в природе в виде минерала нитробарита.
Физико-химические свойства
Нитрат бария представляет собой бесцветные кристаллы с кубической решеткой.
Термодинамические параметры
- Энтропия образования (298К): 96,4 Дж/(моль·К)
- Энтальпия плавления: 53,1 кДж/моль
Растворимость
- В воде
- растворим (9,2 г/100 мл при +20 °C; 34,2 г/100 мл при +100 °C);
- не растворим в спирте и концентрированной азотной кислоте.
С нитратом калия образует Ba(NO3)2•2KNO3.
Методы получения
- В лаборатории методом получения нитрата бария является взаимодействие гидроксида бария с азотной кислотой:
- Ba(OH)2 + 2HNO3 ⟶ Ba(NO3)2 + 2H2O
- В промышленности обычно используют для этих целей BaCO3:
- BaCO3 + 2HNO3 ⟶ Ba(NO3)2 + H2O + CO2↑
Химические свойства
- В водном растворе подвергается диссоциации:
- Ba(NO3)2 ↔ Ba2+ + 2NO3−
- При температуре выше 595 °C разлагается до нитрита:
- Ba(NO3)2 ⟶ Ba(NO2)2 + O2↑
При температуре свыше 670 °C разлагается до оксида бария.
2Ba(NO3)2 = 2BaO + 4NO2 + O2
Применение
- Для получения оксида и пероксида бария.
- Компонент эмалей и глазурей.
- В пиротехнике не гигроскопичный нитрат бария широко используется для окрашивания пламени в зелёный цвет (большинство соединений других металлов, способных на это, мало пригодны из-за гигроскопичности).
Токсичность
Токсичен, ПДК 0,5 мг/м³.
|
Соединения бария |
|---|
|
|
Нитраты |
|
|---|---|
|
|
| Нитрат бария | |
|---|---|
 |
|
 |
|
| Общие | |
| Систематическое наименование (b) |
Нитрат бария |
| Традиционные названия | Нитрат бария; бариевая селитра, азотнокислый барий, динитрат бария; нитрат бария(2+); нитробарит (b) |
| Хим. формула (b) | Ba(NO3)2 |
| Рац. формула (b) | Ba(NO3)2 |
| Физические свойства | |
| Состояние (b) | кристаллическое |
| Молярная масса (b) | 261,337 г/моль (b) |
| Плотность (b) | 3,24 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления (b) | 595 °C |
| Мол. теплоёмк. (b) | 151,6 Дж/(моль·К) |
| Энтальпия | |
| • образования | −978,6 кДж/моль |
| Химические свойства | |
| Растворимость (b) | |
| • в воде |
4,95 г/100 мл (при 0 °C) 10,5 г/100 мл (при +25 °C) 34,4 (при 100 °C) |
| • в | спирте: нерастворим |
| Классификация | |
| Рег. номер CAS (b) | 10022-31-8 |
| PubChem (b) | 24798 |
| Рег. номер EINECS (b) | 233-020-5 |
| SMILES (b) |
[N+](=O)([O-])[O-].[N+](=O)([O-])[O-].[Ba+2] |
| InChI (b) |
InChI=1S/Ba.2NO3/c;2*2-1(3)4/q+2;2*-1 IWOUKMZUPDVPGQ-UHFFFAOYSA-N |
| RTECS (b) | CQ9625000 |
| ChEBI | 190440 |
| ChemSpider (b) | 23184 |
| Безопасность | |
| Предельная концентрация (b) | 0,5 г/см3 |
| ЛД50 (b) | (перорально, крысы) 355 мг/кг |
| Токсичность (b) | умеренно-токсичен, ирритант (b) , опасен для окружающей среды, окислитель (b) |
| Пиктограммы СГС (b) | |
| NFPA 704 (b) |
 0 3 3 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Нитра́т ба́рия (в просторечии — азотнокислый бáрий (b) , бáриевая селитра (b) , нитрáт бáрия(2+), динитрáт бáрия) — неорганическое соединение (b) , бариевая (b) соль (b) азотной кислоты (b) . Химическая формула — Ba(NO3)2.
Распространение в природе
Нитрат бария встречается в природе в виде редкого минерала (b) нитробаритa (b) .
Физико-химические свойства
Нитрат бария представляет собой бесцветные кристаллы с кубической решеткой.
Термодинамические параметры
- Энтропия образования (b) (298К): 96,4 Дж/(моль·К)
- Энтальпия плавления (b) : 53,1 кДж/моль
Растворимость
- В воде
- растворим (9,2 г/100мл при +20 °C; 34,2 г/100мл при +100 °C);
- не растворим в спирте и концентрированной азотной кислоте (b) .
С нитратом калия (b) образует Ba(NO3)2•2KNO3.
Методы получения
- В лаборатории методом получения нитрата бария является взаимодействие гидроксида бария (b) с азотной кислотой (b) :
- [1]
- ↑ ICSC 1480 — НИТРАТ БАРИЯ. www.ilo.org. Дата обращения: 30 июня 2020. Архивировано 30 июня 2020 года.
- В промышленности обычно используют для этих целей BaCO3 (b) :
Химические свойства
- В водном растворе подвергается диссоциации:
- При температуре выше 595 °C разлагается до нитрита (b) :
-
- При температуре свыше 670 °C разлагается до оксида бария (b) .
- При температуре свыше 670 °C разлагается до оксида бария (b) .
- В водном растворе реагирует с серной кислотой (b) и сульфатами (b) с выпадением белого осадка сульфата бария (b)
- Является сильным окислителем (b) , реагирует с горючими материалами и восстановителями, при измельчении активно и нередко со взрывом. Смеси нитрата бария с некоторыми органическими материалами склонны к самовоспламенению.
- Ионы бария образуют устойчивые соединения с краун эфирами.
Применение
- Для получения оксида (b) и пероксида бария (b) .
- Компонент эмалей и глазурей.
- В пиротехнике негигроскопичный нитрат бария широко используется для окрашивания пламени в зелёный цвет (большинство соединений других металлов, способных на это, мало пригодны из-за гигроскопичности).
- В специальных пулях к стрелковому оружию как окислитель в зажигательных и трассирующих составах.
Физиологическое значение
- Динитрат бария (b) обладает умеренно-токсическим действием (b) . ЛД50 (b) для крыс (b) при пероральном (b) введении составляет 355 мг на 1 кг живого веса (b) .
- Предельно допустимая концентрация (b) азотнокислого бария в воздухе рабочих помещений составляет 0,5 г/см3[1] с обязательным контролем по ионам (b) бария (b) [2][3].
- Передозировка (b) нитрата бария(2+) и других неорганических соединений (b) этого щёлочноземельного металла (b) в живых организмах (b) — не безопасна.
Примечания
Нитраты (b) |
|
|---|---|
|
|
- ↑ name=https://docs.cntd.ru_ГОСТ(недоступная+ссылка) 3777-76 Барий азотнокислый. Технические условия (с Изменениями 1, 2)
- ↑ name=https://docs.cntd.ru_ГОСТ(недоступная+ссылка) 1713-79 Барий азотно-кислый технический. Технические условия (с Изменениями N 1, 2, 3)
- ↑ name=https://www.safework.ruАрхивная копия от 8 марта 2022 на Wayback Machine (b)
Физические свойства
Нитрат бария Ba(NO3)2 — соль металла бария и азотной кислоты. Белый, при нагревании плавится и разлагается. Хорошо растворяется в воде (гидролиза нет). Вступает в реакции обмена.
Относительная молекулярная масса Mr = 261,34; относительная плотность для тв. и ж. состояния d = 3,23; tпл = 594º C (разлагается).
Способ получения
1. Нитрат бария можно путем взаимодействия бария и разбавленной азотной кислоты, образуется нитрат бария, оксид азота (I) и вода:
4Ba + 10HNO3 = 4Ba(NO3)2 + N2O↑ + 5H2O,
если барий будет взаимодействовать с очень разбавленной азотной кислотой, то образуются нитрат бария, нитрат аммония и вода:
4Ba + 10HNO3 = 4Ba(NO3)2 + NH4NO3 + 3H2O
2. В результате взаимодействия сульфида бария и концентрированной азотной кислоты образуется нитрат бария, сера, оксид азота (IV) и вода:
BaS + 4HNO3 = Ba(NO3)2 + S↓ + 2NO2↑ + 2H2O
Качественная реакция
Качественная реакция на нитрат бария — взаимодействие с медью при нагревании в присутствии концентрированной кислоты:
1. При взаимодействии с серной кислотой и медью, нитрат бария образует сульфат бария, нитрат меди, бурый газ оксид азота и воду:
Cu + 2Ba(NO3)2 + 2H2SO4 = Cu(NO3)2 + 2BaSO4 + 2NO2 ↑ + 2H2O
Химические свойства
1. Hитрат бария разлагается при температуре 594 — 620º С с образованием нитрита бария и кислорода:
Ba(NO3)2 = Ba(NO2)2 + O2,
а если температуре поднимется до 620 — 670о С, то на выходе реакции будут образовываться оксид бария, оксид азота (IV) и кислород:
2Ba(NO3)2 = 2BaO + 4NO2 + O2
2. Нитрат бария реагирует с простыми веществами:
2.1. Нитрат бария вступает в реакцию с атомным водородом (цинком и в присутствии соляной кислоты). В результате реакции образуется нитрат бария, хлорид цинка и вода:
Ba(NO3)2 + 2Zn + 4HCl = Ba(NO2)2 + 2ZnCl2 + 2H2O
3. Возможны реакции между нитратом бария и сложными веществами:
3.1. Нитрат бария вступает в реакцию с кислотами:
В результате реакции между нитратом бария и разбавленной серной кислотой образуется сульфат бария и азотная кислота:
Ba(NO3)2 + H2SO4 = BaSO4↓ + 2HNO3
3.2. Нитрат бария вступает в реакцию с солями:
Нитрат бария вступает в взаимодействие с гидрофосфатом натрия при кипении. В результате реакции образуется фосфат бария, нитрат натрия и азотная кислота:
3Ba(NO3)2 + 2Na2HPO4 = Ba3(PO4)2↓ + 4NaNO3 + 2HNO3
| Нитрат бария | |
 |
|
 |
|
| Общие | |
|---|---|
| Систематическое наименование | Нитрат бария |
| Химическая формула | Ba(NO3)2 |
| Физические свойства | |
| Состояние (ст. усл.) | твердое тело |
| Молярная масса | 261.337 г/моль |
| Плотность | 3,24 г/см³ |
| Термические свойства | |
| Температура плавления | 595 °C |
| Молярная теплоёмкость (ст. усл.) | 151,6 Дж/(моль·К) |
| Энтальпия образования (ст. усл.) | −978,6 кДж/моль |
| Химические свойства | |
| Растворимость в воде | 4.95 г/100 мл (при 0 °C)
10.5 г/100 мл (при 25 °C) 34.4 (при 100 °C) |
| Растворимость в | спирте: нерастворим |
| Классификация | |
| Рег. номер CAS | 10022-31-8 |
| RTECS | CQ9625000 |
| Безопасность | |
| ЛД50 | (перорально, крысы) 355 мг/кг |
| Токсичность | среднетоксичен |
Нитра́т ба́рия (азотнокислый барий, бариевая селитра) — бариевая соль азотной кислоты. Химическая формула — Ba(NO3)2.
Содержание
- 1 Распространение в природе
- 2 Физико-химические свойства
- 2.1 Термодинамические параметры
- 2.2 Растворимость
- 3 Методы получения
- 4 Химические свойства
- 5 Применение
- 6 Токсичность
Распространение в природе
Нитрат бария встречается в природе в виде минерала нитробаритa.
Физико-химические свойства
Нитрат бария представляет собой бесцветные кристаллы с кубической решеткой.
Термодинамические параметры
- Энтропия образования (298К): 96,4 Дж/(моль·К)
- Энтальпия плавления: 53,1 кДж/моль
Растворимость
- В воде
- растворим (9,2 г/100мл при 20 °C; 34,2 г/100мл при 100 °C);
- не растворим в спирте и концентрированной азотной кислоте.
С нитратом калия образует Ba(NO3)2•2KNO3.
Методы получения
- В лаборатории методом получения нитрата бария является взаимодействие гидроксида бария с азотной кислотой:
- В промышленности обычно используют для этих целей BaCO3:
Химические свойства
- В водном растворе подвергается диссоциации:
- При температуре выше 595 °C разлагается до нитрита:
При температуре свыше 670 °C разлагается до оксида бария.
Применение
- Для получения оксида и пероксида бария.
- Компонент эмалей и глазурей.
- В пиротехнике негигроскопичный нитрата бария широко используется для окрашивания пламени в зеленый цвет (большинство соединений других металлов, способных на это, мало пригодны из-за гигроскопичности).
Токсичность
Токсичен, ПДК 0,5 мг/м³.
|
Растворимость кислот, оснований и солей в воде |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
Соединения бария |
|---|
|
Амид бария (Ba(NH2)2) • Ацетат бария (Ba(CH3COO)2) • Бромид бария (BaBr2) • Гидрид бария (BaH2) • Гидроксид бария (Ba(OH)2) • Гидросульфид бария (Ba(HS)2) • Дитионат бария (BaS2O6) • Иодат бария (Ba(IO3)2) • Иодид бария (BaI2) • Карбид бария (BaC2) • Карбонат бария (BaCO3) • Манганат бария (BaMnO4) • Метаборат бария (Ba(BO2)2) • Нитрат бария (Ba(NO3)2) • Нитрид бария (Ba3N2) • Нитрит бария (Ba(NO2)2) • Оксалат бария (BaC2O4) • Оксид бария (BaO) • Пероксид бария (BaO2) • Перхлорат бария (BaClO4) • Силикат бария (ВаSiO3) • Сульфат бария (BaSO4) • Сульфид бария (BaS) • Сульфит бария (BaSO3) • Титанат бария (BaTiO3) • Феррат бария (BaFeO4) • Феррит бария (BaFe2O4) • Фосфат бария (Ba3(PO4)2) • Фосфид бария (Ba3P2) • Фторид бария (BaF2) • Хлорат бария (Ba(ClO3)2) • Хлорид бария (BaCl2) • Хромат бария (BaCrO4) • Хромат(V) бария (Ba3(CrO4)2) • Цианид бария (Ba(CN)2) • Цирконат бария (BaZrO3) |
|
Нитраты |
|
|---|---|
|
Динитрат гидразина (N2H6(NO3)2) • Изопентилнитрат ((CH3)2CHCH2CH2ONO2) • Метилнитрат (CH3ONO2) • Нитрат актиния(III) (Ac(NO3)3) • Нитрат алюминия (Al(NO3)3) • Нитрат аммония (NH4NO3) • Нитрат бария (Ba(NO3)2) • Нитрат берилия (Be(NO3)2) • Нитрат висмута (Bi(NO3)3) • Нитрат гадолиния (Gd(NO3)3) • Нитрат гидразина (N2H5NO3) • Нитрат гидроксиламина ((NH3OH)NO3) • Нитрат гуанидина (C(NH2)3NO3) • Нитрат железа(III) (Fe(NO3)3) • Нитрат кадмия (Cd(NO3)2) • Нитрат калия (KNO3) • Нитрат кальция (Са(NО3)2) • Нитрат кобальта(II) (Co(NO3)2) • Нитрат кобальта(III) (Co(NO3)3) • Нитрат лития (LiNO3) • Нитрат магния (Mg(NO3)2) • Нитрат марганца (Mn(NO3)2) • Нитрат меди(II) (Cu(NO3)2) • Нитрат мочевины ((NH2)2CO•HNO3) • Нитрат натрия (NaNO3) • Нитрат неодима (Nd(NO3)3) • Нитрат никеля(II) (Ni(NO3)2) • Нитрат палладия(II) (Pd(NO3)3) • Нитрат ртути(I) (Hg2(NO3)2) • Нитрат ртути(II) (Hg(NO3)2) • Нитрат рубидия (RbNO3) • Нитрат свинца(II) (Pb(NO3)2) • Нитрат серебра(I) (AgNO3) • Нитрат скандия(III) (Sc(NO3)3) • Нитрат стронция (Sr(NO3)2) • Нитрат урана (U(NO3)2) • Нитрат уранила (UO2(NO3)2) • Нитрат хлорина (ClONO3) • Нитрат хрома (Cr(NO3)3) • Нитрат цезия (CsNO3) • Нитрат цинка (Zn(NO3)2) • Нитраты целлюлозы ([C6H7O2(OH)3-x(ONO2)x]n) • Нитроглицерин (O2NOCH(CH2ONO2)2) • Пропилнитрат (C3H7ONO2) • Церий-аммоний нитрат ((NH4)2Ce(NO3)6) • Этилнитрат (C2H5ONO2) |
 |










