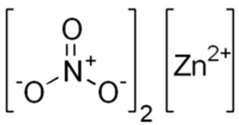(Redirected from Zn(NO3)2)

|
|

|
|
| Names | |
|---|---|
| IUPAC name
Zinc nitrate |
|
| Other names
Zinc dinitrate |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChemSpider |
|
| ECHA InfoCard | 100.029.039 |
| EC Number |
|
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
| UN number | 1514 |
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
Zn(NO3)2 |
| Molar mass | 189.36 g/mol (anhydrous) 297.49 g/mol (hexahydrate) |
| Appearance | colorless, deliquescent crystals |
| Density | 2.065 g/cm3 (hexahydrate) |
| Melting point | 110 °C (230 °F; 383 K) (anhydrous) 45.5 °C (trihydrate) 36.4 °C (hexahydrate) |
| Boiling point | ~ 125 °C (257 °F; 398 K) decomposes (hexahydrate) |
|
Solubility in water |
327 g/(100 mL), 40 °C (trihydrate) 184.3 g/(100 mL), 20 °C (hexahydrate) |
| Solubility | very soluble in alcohol |
|
Magnetic susceptibility (χ) |
−63.0·10−6 cm3/mol |
| Hazards | |
| Occupational safety and health (OHS/OSH): | |
|
Main hazards |
Oxidant, may explode on heating |
| GHS labelling: | |
|
Pictograms |
 
|
| Flash point | Non-flammable |
| Safety data sheet (SDS) | ICSC 1206 |
| Related compounds | |
|
Other anions |
Zinc sulfate Zinc chloride |
|
Other cations |
Cadmium nitrate Mercury(II) nitrate |
|
Related compounds |
Copper(II) nitrate |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Zinc nitrate is an inorganic chemical compound with the formula Zn(NO3)2. This colorless, crystalline salt is highly deliquescent. It is typically encountered as a hexahydrate Zn(NO3)2·6H2O. It is soluble in both water and alcohol.
Synthesis[edit]
Zinc nitrate is usually prepared by dissolving zinc metal, zinc oxide, or related materials in nitric acid:
- Zn + 2 HNO3 → Zn(NO3)2 + H2
- ZnO + 2 HNO3 → Zn(NO3)2 + H2O
These reactions are accompanied by the hydration of the zinc nitrate.
The anhydrous salt arises by the reaction of anhydrous zinc chloride with nitrogen dioxide:[1]
- ZnCl2 + 4 NO2 → Zn(NO3)2 + 2 NOCl
Reactions[edit]
Treatment of zinc nitrate with acetic anhydride gives zinc acetate.[2]
On heating, zinc nitrate undergoes thermal decomposition to form zinc oxide, nitrogen dioxide and Oxygen:
- Zn(NO3)2 → ZnO + NO2 + O2
Applications[edit]
Zinc nitrate has no large scale application but is used on a laboratory scale for the synthesis of coordination polymers.[3] Its controlled decomposition to zinc oxide has also been used for the generation of various ZnO based structures, including nanowires.[4]
It can be used as a mordant in dyeing. An example reaction gives a precipitate of zinc carbonate:
- Zn(NO3)2 + Na2CO3 → ZnCO3 + 2 NaNO3
References[edit]
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. p. 455. ISBN 978-0-08-037941-8.
- ^ O. F. Wagenknecht; R. Juza (1963). «Zinc Acetate». In G. Brauer (ed.). Handbook of Preparative Inorganic Chemistry, 2nd Ed. Vol. 2. NY,NY: Academic Press. p. 1087.
- ^ Barnett, Sarah A; Champness, Neil R (November 2003). «Structural diversity of building-blocks in coordination framework synthesis—combining M(NO3)2 junctions and bipyridyl ligands». Coordination Chemistry Reviews. 246 (1–2): 145–168. doi:10.1016/S0010-8545(03)00121-8.
- ^ Greene, Lori E.; Yuhas, Benjamin D.; Law, Matt; Zitoun, David; Yang, Peidong (September 2006). «Solution-Grown Zinc Oxide Nanowires». Inorganic Chemistry. 45 (19): 7535–7543. doi:10.1021/ic0601900. PMID 16961338.
- v
- t
- e
Salts and covalent derivatives of the nitrate ion
(Redirected from Zn(NO3)2)

|
|

|
|
| Names | |
|---|---|
| IUPAC name
Zinc nitrate |
|
| Other names
Zinc dinitrate |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChemSpider |
|
| ECHA InfoCard | 100.029.039 |
| EC Number |
|
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
| UN number | 1514 |
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
Zn(NO3)2 |
| Molar mass | 189.36 g/mol (anhydrous) 297.49 g/mol (hexahydrate) |
| Appearance | colorless, deliquescent crystals |
| Density | 2.065 g/cm3 (hexahydrate) |
| Melting point | 110 °C (230 °F; 383 K) (anhydrous) 45.5 °C (trihydrate) 36.4 °C (hexahydrate) |
| Boiling point | ~ 125 °C (257 °F; 398 K) decomposes (hexahydrate) |
|
Solubility in water |
327 g/(100 mL), 40 °C (trihydrate) 184.3 g/(100 mL), 20 °C (hexahydrate) |
| Solubility | very soluble in alcohol |
|
Magnetic susceptibility (χ) |
−63.0·10−6 cm3/mol |
| Hazards | |
| Occupational safety and health (OHS/OSH): | |
|
Main hazards |
Oxidant, may explode on heating |
| GHS labelling: | |
|
Pictograms |
 
|
| Flash point | Non-flammable |
| Safety data sheet (SDS) | ICSC 1206 |
| Related compounds | |
|
Other anions |
Zinc sulfate Zinc chloride |
|
Other cations |
Cadmium nitrate Mercury(II) nitrate |
|
Related compounds |
Copper(II) nitrate |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Zinc nitrate is an inorganic chemical compound with the formula Zn(NO3)2. This colorless, crystalline salt is highly deliquescent. It is typically encountered as a hexahydrate Zn(NO3)2·6H2O. It is soluble in both water and alcohol.
Synthesis[edit]
Zinc nitrate is usually prepared by dissolving zinc metal, zinc oxide, or related materials in nitric acid:
- Zn + 2 HNO3 → Zn(NO3)2 + H2
- ZnO + 2 HNO3 → Zn(NO3)2 + H2O
These reactions are accompanied by the hydration of the zinc nitrate.
The anhydrous salt arises by the reaction of anhydrous zinc chloride with nitrogen dioxide:[1]
- ZnCl2 + 4 NO2 → Zn(NO3)2 + 2 NOCl
Reactions[edit]
Treatment of zinc nitrate with acetic anhydride gives zinc acetate.[2]
On heating, zinc nitrate undergoes thermal decomposition to form zinc oxide, nitrogen dioxide and Oxygen:
- Zn(NO3)2 → ZnO + NO2 + O2
Applications[edit]
Zinc nitrate has no large scale application but is used on a laboratory scale for the synthesis of coordination polymers.[3] Its controlled decomposition to zinc oxide has also been used for the generation of various ZnO based structures, including nanowires.[4]
It can be used as a mordant in dyeing. An example reaction gives a precipitate of zinc carbonate:
- Zn(NO3)2 + Na2CO3 → ZnCO3 + 2 NaNO3
References[edit]
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. p. 455. ISBN 978-0-08-037941-8.
- ^ O. F. Wagenknecht; R. Juza (1963). «Zinc Acetate». In G. Brauer (ed.). Handbook of Preparative Inorganic Chemistry, 2nd Ed. Vol. 2. NY,NY: Academic Press. p. 1087.
- ^ Barnett, Sarah A; Champness, Neil R (November 2003). «Structural diversity of building-blocks in coordination framework synthesis—combining M(NO3)2 junctions and bipyridyl ligands». Coordination Chemistry Reviews. 246 (1–2): 145–168. doi:10.1016/S0010-8545(03)00121-8.
- ^ Greene, Lori E.; Yuhas, Benjamin D.; Law, Matt; Zitoun, David; Yang, Peidong (September 2006). «Solution-Grown Zinc Oxide Nanowires». Inorganic Chemistry. 45 (19): 7535–7543. doi:10.1021/ic0601900. PMID 16961338.
- v
- t
- e
Salts and covalent derivatives of the nitrate ion
| Нитрат цинка | |
 |
|
 |
|
| Общие | |
|---|---|
| Систематическое наименование | Нитрат цинка |
| Традиционные названия | Азотнокислый цинк |
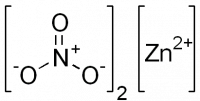
| Химическая формула | Zn(NO3)2 |
| Физические свойства | |
| Состояние (ст. усл.) | бесцветные кристаллы |
| Молярная масса | 189,40 г/моль |
| Химические свойства | |
| Растворимость в воде | 12825; 125073 г/100 мл |
| Классификация | |
| Рег. номер CAS | 7779-88-6 |
| Рег. номер PubChem | 24518 |
| SMILES | [N+](=O)([O-])[O-].[N+](=O)([O-])[O-].[Zn+2] |
| Регистрационный номер EC | 231-943-8 |
| RTECS | ZH4772000 |
| Номер ООН | 1514 |
Нитрат цинка — неорганическое соединение, соль металла цинка и азотной кислоты с формулой Zn(NO3)2, бесцветные кристаллы, растворяется в воде, образует кристаллогидраты.
Получение
- Кристаллогидраты получают реакцией оксида, гидроксида или карбоната цинка с азотной кислотой:
- Безводную соль получают реакцией металлического цинка с диоксидом азота:
Физические свойства
Нитрат цинка образует бесцветные кристаллы.
Хорошо растворяется в воде и этаноле.
Образует кристаллогидраты состава Zn(NO3)2•n H2O, где n = 1, 2, 4, 6 и 9.
С аммиаком образует аддукты с общей формулой Zn(NO3)2•n NH3.
Применение
- Протрава при крашении тканей.
Литература
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1972. — Т. 2. — 871 с.
|
Соединения цинка |
|---|
|
Амид цинка (Zn(NH2)2) • Антимонид цинка (ZnSb) • Арсенид цинка (Zn3As2) • Ацетат цинка ((CH3COO)2Zn) • Борогидрид цинка (Zn(BH4)2) • Бромид цинка (ZnBr2) • Гидрид цинка (ZnH2) • Гидроксид цинка (Zn(OH)2) • Диметилцинк (Zn(СH3)2) • Дитизонат цинка (Zn(С13H11N4S)2) • Дитионит цинка (ZnS2O4) • Дифенилцинк (Zn(С6H5)2) • Диэтилцинк (Zn(С2H5)2) • Иодид цинка (ZnI2) • Иодид этилцинка (С2H5ZnI) • Карбид цинка (ZnC2) • Карбонат цинка (ZnCO3) • Молибдат цинка (ZnMoO4) • Нитрат цинка (Zn(NO3)2) • Нитрид цинка (Zn3N2) • Оксид цинка (ZnO) • Ортофосфат цинка (Zn3(PO4)2) • Пероксид цинка (ZnO2) • Пирофосфат цинка (Zn2P2O7) • Селенид цинка (ZnSe) • Сульфат цинка (ZnSO4) • Сульфид цинка (ZnS) • Теллурид цинка (ZnTe) • Фосфид цинка (Zn3P2) • Фторид цинка (ZnF2) • Хлорат цинка (Zn(ClO3)2) • Хлорид цинка (ZnCl2) • Хромат цинка (ZnCrO4) • Цианид цинка (Zn(CN)2) • |
|
Растворимость кислот, оснований и солей в воде |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
Морфемный разбор слова:
Однокоренные слова к слову:
Нитрат цинка
| Нитрат цинка | |
 |
|
 |
|
| Общие | |
|---|---|
| Систематическое наименование | Нитрат цинка |
| Традиционные названия | Азотнокислый цинк |
| Химическая формула | Zn(NO3)2 |
| Физические свойства | |
| Состояние (ст. усл.) | бесцветные кристаллы |
| Молярная масса | 189,40 г/моль |
| Химические свойства | |
| Растворимость в воде | 128 25 ; 1250 73 г/100 мл |
| Классификация | |
| Рег. номер CAS | 7779-88-6 |
| Рег. номер PubChem | 24518 |
| SMILES | [N+](=O)([O-])[O-].[N+](=O)([O-])[O-].[Zn+2] |
| Регистрационный номер EC | 231-943-8 |
| RTECS | ZH4772000 |
| Номер ООН | 1514 |
Нитрат цинка — неорганическое соединение, соль металла цинка и азотной кислоты с формулой Zn(NO3)2, бесцветные кристаллы, растворяется в воде, образует кристаллогидраты.
Содержание
Получение
Физические свойства
Нитрат цинка образует бесцветные кристаллы.
Хорошо растворяется в воде и этаноле.
Образует кристаллогидраты состава Zn(NO3)2•n H2O, где n = 1, 2, 4, 6 и 9.
Применение
Литература
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Hg2 2+ | Pb 2+ | Sn 2+ | Cu + | Cu 2+ | |
| OH − | P | P | P | — | P | М | Н | М | Н | Н | Н | — | Н | Н | Н | Н | Н | — | — | Н | Н | Н | Н | |
| F − | P | Н | P | P | Р | М | Н | Н | М | Р | Н | Н | Н | Р | Р | М | Р | Р | М | М | Н | Р | Н | Р |
| Cl − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | Н | М | — | Н | Р |
| Br − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | Н | М | Р | H | Р |
| I − | P | P | P | P | Р | Р | Р | Р | Р | Р | ? | Р | — | Р | Р | Р | Р | Н | Н | Н | Н | М | Н | — |
| S 2− | P | P | P | P | — | Р | М | Н | Р | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| SO3 2− | P | P | P | P | Р | М | М | М | Н | ? | ? | М | ? | Н | Н | Н | М | Н | Н | Н | Н | ? | Н | ? |
| SO4 2− | P | P | P | P | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Н | Р | Р | Р |
| NO3 − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | — | Р | Р |
| NO2 − | P | P | P | P | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? | ? | ? |
| PO4 3− | P | Н | P | P | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | ? | Н | Н | Н | Н |
| CO3 2− | М | Р | P | P | Р | Н | Н | Н | Н | — | — | Н | — | Н | Н | — | Н | Н | — | Н | — | — | ? | — |
| CH3COO − | P | Р | P | P | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | М | Р | — | Р | Р |
| CN − | P | Р | P | P | Р | Р | Р | Р | Р | ? | Н | Н | — | Н | Н | Н | Н | Н | Р | Н | Р | — | — | Н |
| SiO3 2− | H | Н | P | P | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | ? | Н | ? | ? | ? |
Полезное
Смотреть что такое «Нитрат цинка» в других словарях:
Нитрат аммония — Нитрат аммония … Википедия
Нитрат калия — Нитрат калия … Википедия
Нитрат алюминия — Нитрат алюминия … Википедия
Нитрат кальция — Нитрат кальция … Википедия
Нитрат железа(III) — Нитрат железа(III) … Википедия
Нитрат меди(II) — Нитрат меди(II) … Википедия
Нитрат рубидия — Общие Систематическое наименование Нитрат рубидия Традиционные названия Азотнокислый рубидий Химическая формула RbNO3 Физические свойства Состояние … Википедия
Нитрат цезия — Общие Систематическое наименование Нитрат цезия Традиционные названия Азотнокислый цезий Химическая формула CsNO3 Физические свойства Состояние ( … Википедия
Нитрат натрия — Нитрат натрия … Википедия
Нитрат бария — Нитрат бария … Википедия
Источник
Формула нитрата цинка
Определение и формула нитрата цинка
Рис. 1. Нитрат цинка. Внешний вид.
Химическая формула нитрата цинка
Химическая формула нитрата цинка Zn(NO3)2. Она показывает, что в составе молекулы этого вещества находится один атом цинка (Ar = 65 а.е.м.), два атома азота (Ar = 14 а.е.м.) и шесть атомов кислорода (Ar = 16 а.е.м.). По химической формуле можно вычислить молекулярную массу нитрата цинка:
Mr(Zn(NO3)2) = 65 + 2×14 + 6×16 = 65 + 28 + 96 = 189.
Структурная (графическая) формула нитрата цинка
Структурная (графическая) формула нитрата цинка является более наглядной. Она показывает то, как связаны атомы между собой внутри молекулы:
Ионная формула
Нитрат цинка является электролитом, т.е. в водном растворе диссоциирует на ионы согласно следующему уравнению:
Примеры решения задач
| Задание | При полном сгорании некоторого количества углеводорода образовалось 14,08 г оксида углерода (IV) и 3,6 г воды. Найдите молекулярную формулу вещества, если относительная плотность его паров по водороду равна 39. |
| Решение | Составим схему реакции сгорания аминокислоты обозначив количество атомов углерода, водорода, кислорода и азота за «x», «у», «z» и «k» соответственно: |
Определим массы элементов, входящих в состав этого вещества. Значения относительных атомных масс, взятые из Периодической таблицы Д.И. Менделеева, округлим до целых чисел: Ar(C) = 12 а.е.м., Ar(H) = 1 а.е.м., Ar(O) = 16 а.е.м.
Рассчитаем молярные массы углекислого газа и воды. Как известно, молярная масса молекулы равна сумме относительных атомных масс атомов, входящих в состав молекулы (M = Mr):
M(CO2) = Ar(C) + 2×Ar(O) = 12+ 2×16 = 12 + 32 = 44 г/моль;
M(H2O) = 2×Ar(H) + Ar(O) = 2×1+ 16 = 2 + 16 = 18 г/моль.
m(C) = [14,8 / 44]×12 = 4,04 г;
m(H) = 2×3,6 / 18 ×1= 0,4 г.
Определим химическую формулу углеводорода:
Значит его простейшая формула CH, а молярная масса 13 г/моль [M(CH) = Ar(C) + Ar(H) = 12 + 1 =13 / моль].
Значение молярной массы органического вещества можно определить при помощи его плотности по водороду:
Msubstance = 2 × 39 = 78 г/моль.
Чтобы найти истинную формулу органического соединения найдем отношение полученных молярных масс:
Msubstance / M(CH) = 78 / 13 = 6.
Значит индексы атомов углерода и водорода должны быть в 6 раз выше, т.е. формула вещества будет иметь вид C6H6.Это бензол.
| Задание | При полном сгорании на воздухе 7,4 г кислородсодержащего органического соединения образовалось 6,72 л (н.у.) углекислого газа и 5,4 мл воды. Выведите формулу этого соединения. |
| Решение | Составим схему реакции сгорания органического соединения обозначив количество атомов углерода, водорода и кислорода за «x», «у»и «z» соответственно: |
Определим массы элементов, входящих в состав этого вещества. Значения относительных атомных масс, взятые из Периодической таблицы Д.И. Менделеева, округлим до целых чисел: Ar(C) = 12 а.е.м., Ar(H) = 1 а.е.м., Ar(O) = 16 а.е.м.
Рассчитаем молярные массы углекислого газа и воды. Как известно, молярная масса молекулы равна сумме относительных атомных масс атомов, входящих в состав молекулы (M = Mr):
M(CO2) = Ar(C) + 2×Ar(O) = 12+ 2×16 = 12 + 32 = 44 г/моль;
M(H2O) = 2×Ar(H) + Ar(O) = 2×1+ 16 = 2 + 16 = 18 г/моль.
m(C) = [6,72 / 22,4]×12 = 3,6 г;
m(H) = [2×5,4 ×1 / 18 ×1 (г/мл)] = 0,6 г.
Определим химическую формулу соединения:
x:y:z = m(C)/Ar(C) : m(H)/Ar(H) : m(O)/Ar(O);
x:y:z= 0,3 : 0,6 : 0,2 = 1,5: 3 : 1 = 3 : 6 : 2.
Значит простейшая формула соединения C3H6O2 и молярная масса 64 г/моль
Источник
Нитрат цинка: состав, свойства, получение, применение.
Содержание:
Он служит ускорителем реакций органической химии и позволяет получать композитные полимеры с электропроводящими свойствами. Он используется для формирования слоев материалов, используемых в электронике.
Он входит в состав некоторых жидких удобрений и некоторых гербицидов с медленным высвобождением. Помогает в получении сложных оксидов, улучшая их плотность и электропроводность.
Он был успешно протестирован при получении структур, которые служат основой для регенерации и роста костной ткани, улучшают этот процесс и являются эффективным антибактериальным средством.
Хотя он негорючий, он может ускорить горение таких веществ, как уголь или органические материалы. Он раздражает кожу, глаза и слизистые оболочки и очень токсичен для водных организмов.
Состав
Номенклатура
Свойства
Физическое состояние
Бесцветное или белое кристаллическое твердое вещество.
Молекулярный вес
Температура плавления
Точка кипения
Плотность
Растворимость
Растворим в воде: 120 г / 100 г H2Или при 25 ° С. Растворим в спирте.
pH
Его водные растворы кислые. 5% раствор имеет pH примерно 5.
Химические свойства
Будучи нитратом, это соединение является сильным окислителем. Реагирует бурно с углеродом, медью, сульфидами металлов, органическими веществами, фосфором и серой. Если его распылить на раскаленный уголь, он взорвется.
С другой стороны, он гигроскопичен и впитывает воду из окружающей среды. При нагревании образует оксид цинка, диоксид азота и кислород:
В щелочных растворах, таких как NaOH, цинк в этом соединении образует гидроксид и другие сложные формы:
Получение
Его можно получить обработкой цинка или оксида цинка разбавленной азотной кислотой. В этой реакции образуется газообразный водород.
Приложения
В катализе реакций
Он используется в качестве катализатора для получения других химических соединений, таких как смолы и полимеры. Это кислотный катализатор.
В композитных полимерах
Полиметилметакрилат и Zn (NO3)2 со свойствами электропроводности, которые делают их подходящими кандидатами для использования в суперконденсаторах и высокоскоростных компьютерах.
В оксидных цементах
С помощью водных растворов нитрата цинка и порошка оксида цинка получают материалы, которые относятся к классу цементов, образующихся в результате кислотно-щелочной реакции.
Они обладают разумной устойчивостью к растворению в разбавленных кислотах и щелочах, развивая сопротивление сжатию, сравнимое с сопротивлением других цементов, таких как оксихлориды цинка.
Это свойство увеличивается по мере того, как ZnO / Zn (NO3)2, а как концентрация Zn (NO3)2 в растворе. Полученные цементы полностью аморфны, то есть не имеют кристаллов.
В покрытиях из оксида цинка и наноматериалах
Zn (НЕТ3)2 Он используется для электролитического осаждения очень тонких слоев оксида цинка (ZnO) на различные подложки. Наноструктуры из этого оксида также изготавливаются на поверхностях.
ZnO представляет собой материал, представляющий большой интерес из-за множества применений в области оптоэлектроники, он также обладает полупроводниковыми свойствами и используется в датчиках и преобразователях.
В гербицидах
Нитрат цинка использовался в сочетании с некоторыми органическими соединениями для замедления скорости высвобождения определенных гербицидов в воду. Медленный выпуск этих продуктов позволяет им оставаться доступными в течение более длительного времени и требует меньшего количества приложений.
В производстве анодов
Испытанные материалы представляют собой сложные оксиды стронция, иридия, железа и титана. Присутствие цинка значительно увеличивает их электропроводность.
Другие приложения
Используется при получении лекарств. Он действует как протрава при нанесении чернил и красителей. Служит латексным коагулянтом. Это источник цинка и азота в жидких удобрениях.
Возможное использование в инженерии костной ткани
Этот состав использовался в качестве добавки при разработке каркасов или каркасов для регенерации костных волокон, поскольку он позволяет улучшить механическое сопротивление этих структур.
Было обнаружено, что цинкосодержащий каркас не токсичен для клеток-остеопрогениторов, поддерживает активность остеобластов, клеток, образующих кость, и улучшает их адгезию и пролиферацию.
Он способствует образованию апатита, минерала, образующего кости, а также обладает антибактериальным действием.
Риски
Это материал с потенциальной опасностью пожара и взрыва.
При воздействии сильной жары выделяются токсичные газы оксидов азота. А если выдерживать длительное время, она может взорваться.
Он раздражает кожу, может вызвать серьезное повреждение глаз, раздражение дыхательных путей, токсичен при проглатывании и вызывает повреждение пищеварительного тракта.
Очень токсично для водных организмов с долгосрочными последствиями.
Ссылки
Что такое делитель напряжения? (с примерами)
Источник
Нитрат цинка
| Нитрат цинка | |
|---|---|
 |
|
| Систематическое наименование |
Нитрат цинка |
| Традиционные названия | Азотнокислый цинк |
| Хим. формула | Zn(NO3)2 |
| Состояние | бесцветные кристаллы |
| Молярная масса | 189,40 г/моль |
| Растворимость | |
| • в воде | 128 25 ; 1250 73 г/100 мл |
| ГОСТ | ГОСТ 5106-77 |
| Рег. номер CAS | 7779-88-6 |
| PubChem | 24518 |
| Рег. номер EINECS | 231-943-8 |
| SMILES | |
| RTECS | ZH4772000 |
| Номер ООН | 1514 |
| ChemSpider | 22926 и 57426206 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Нитрат цинка — неорганическое соединение, соль металла цинка и азотной кислоты с формулой Zn(NO3)2, бесцветные кристаллы, растворяется в воде, образует кристаллогидраты.
Содержание
Получение
Физические свойства
Нитрат цинка образует бесцветные кристаллы.
Хорошо растворяется в воде и этаноле.
Образует кристаллогидраты состава Zn(NO3)2•n H2O, где n = 1, 2, 4, 6 и 9.
С аммиаком образует аддукты с общей формулой Zn(NO3)2•n NH3.
Источник
Соли цинка
Соли цинка
Нитрат и сульфат цинка
Нитрат цинка при нагревании разлагается на оксид цинка, оксид азота (IV) и кислород:
Сульфат цинка при сильном нагревании разлагается аналогично — на оксид цинка, сернистый газ и кислород:
Комплексные соли цинка
Для описания свойств комплексных солей цинка — гидроксоцинкатов, удобно использоваться следующий прием: мысленно разбейте тетрагидроксоцинкат на две отдельные частицы — гидроксид цинка и гидроксид щелочного металла.
Na2[Zn(OH)4] разбиваем на NaOH и Zn(OH)2
Свойства всего комплекса можно определять, как свойства этих отдельных соединений.
Аналогично тетрагидроксоцинкат калия реагирует с углекислым газом:
А вот под действием избытка сильной кислоты осадок не выпадает, т.к. амфотерный гидроксид цинка реагирует с сильными кислотами.
Правда, под действием небольшого количества ( недостатка ) сильной кислоты осадок все-таки выпадет, для растворения гидроксида цинка кислоты не будет хватать:
Аналогично с недостатком азотной кислоты выпадает гидроксид цинка:
Если выпарить воду из раствора комплексной соли и нагреть образующееся вещество, то останется обычная соль-цинкат:
Гидролиз солей цинка
Растворимые соли цинка и сильных кислот гидролизуются по катиону. Гидролиз протекает ступенчато и обратимо, т.е. чуть-чуть:
I ступень: Zn 2+ + H2O = ZnOH + + H +
II ступень: ZnOH + + H2O = Zn(OH )2 + H +
Более подробно про гидролиз можно прочитать в соответствующей статье.
Цинкаты
Соли, в которых цинк образует кислотный остаток (цинкаты) — образуются из оксида цинка при сплавлении с щелочами и основными оксидами:
Для понимания свойств цинкатов их также можно мысленно разбить на два отдельных вещества.
Например, цинкат натрия мы разделим мысленно на два вещества: оксид цинка и оксид натрия.
Na2ZnO2 разбиваем на Na2O и ZnO
Тогда нам станет очевидно, что цинкаты реагируют с кислотами с образованием солей цинка :
Под действием избытка воды цинкаты переходят в комплексные соли:
Сульфид цинка
Сульфид цинка — так называемый «белый сульфид». В воде сульфид цинка нерастворим, зато минеральные кислоты вытесняют из сульфида цинка сероводород (например, соляная кислота):
ZnS + 2HCl → ZnCl2 + H2S
Под действием азотной кислоты сульфид цинка окисляется до сульфата:
(в продуктах также можно записать нитрат цинка и серную кислоту).
Концентрированная серная кислота также окисляет сульфид цинка:
При окислении сульфида цинка сильными окислителями в щелочной среде образуется комплексная соль:
ZnS + 4NaOH + Br2 = Na2[Zn(OH)4] + S + 2NaBr
Источник
Теперь вы знаете какие однокоренные слова подходят к слову Как пишется нитрат цинка, а так же какой у него корень, приставка, суффикс и окончание. Вы можете дополнить список однокоренных слов к слову «Как пишется нитрат цинка», предложив свой вариант в комментариях ниже, а также выразить свое несогласие проведенным с морфемным разбором.
Поиск химических веществ по названиям или формулам.
Справочник содержит названия веществ и описания химических формул (в т.ч. структурные формулы и скелетные формулы).
Введите часть названия или формулу для поиска:
Языки:
По умолчанию |
Все возможные |
Из списка
[▼]
|
Применить к найденному
Нитрат цинка
Брутто-формула:
N2O6Zn
CAS# 7779-88-6
Категории:
Неорганические соли
PubChem CID: 24518
Названия
Русский:
- Азотнокислый цинк
- Нитрат цинка [Wiki]
Варианты формулы:
Zn(NO3)2
Zn(+2)(N(+5)O(-2)3)2
O`^-/N^+`|O|O^-/0Zn^++O`^-/N^+`|O|O^-
Химический состав
Реакции, в которых участвует Нитрат цинка
-
Zn + 4HNO3″(60%)» = Zn(NO3)2 + 2NO2″|^» + 2H2O
-
3Zn + 8HNO3″(30%)» = 3Zn(NO3)2 + 2NO»|^» + 4H2O
-
4Zn + 10HNO3″(20%)» = 4Zn(NO3)2 + N2O»|^» + 5H2O
-
5Zn + 12HNO3″(10%)» = 5Zn(NO3)2 + N2″|^» + 6H2O
-
4Zn + 10HNO3″(3%)» = 4Zn(NO3)2 + NH4NO3 + 3H2O
И ещё 6 реакций…
1. найди что-нибудь интересное >>> 2. нажми/кликни на какую-нибудь картинку >>> 3. сыграй в пазл 

химическое соединение … Нитрат цинка — неорганическое соединение, соль металла цинка и азотной кислоты с формулой Zn(NO3)2,
бесцветные …
| Нитрат цинка | |
|---|---|
 |
|
 |
|
| Общие | |
| Систематическое наименование (b) |
Нитрат цинка |
| Традиционные названия | Азотнокислый цинк |
| Хим. формула (b) | Zn(NO3)2 |
| Физические свойства | |
| Состояние (b) | бесцветные кристаллы |
| Молярная масса (b) | 189,40 г/моль (b) |
| Химические свойства | |
| Растворимость (b) | |
| • в воде | 12825; 125073 г/100 мл |
| Классификация | |
| Рег. номер CAS (b) | 7779-88-6 |
| PubChem (b) | 24518 |
| Рег. номер EINECS (b) | 231-943-8 |
| SMILES (b) |
[N+](=O)([O-])[O-].[N+](=O)([O-])[O-].[Zn+2] |
| InChI (b) |
InChI=1S/2NO3.Zn/c2*2-1(3)4;/q2*-1;+2 ONDPHDOFVYQSGI-UHFFFAOYSA-N |
| RTECS (b) | ZH4772000 |
| Номер ООН (b) | 1514 |
| ChemSpider (b) | 22926 и 57426206 |
| Безопасность | |
| Пиктограммы СГС (b) | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Нитрат цинка — неорганическое соединение, соль металла цинка (b) и азотной кислоты (b) с формулой Zn(NO3)2, бесцветные кристаллы, растворяется в воде, образует кристаллогидраты (b) .
Получение
- Кристаллогидраты получают реакцией оксида (b) , гидроксида (b) или карбоната цинка (b) с азотной кислотой:
- Безводную соль получают реакцией металлического цинка с диоксидом азота (b) в ацетонитриле:
Физические свойства
Нитрат цинка образует бесцветные кристаллы.
Хорошо растворяется в воде и этаноле (b) .
Образует кристаллогидраты состава Zn(NO3)2•n H2O, где n = 1, 2, 4, 6 и 9.
С аммиаком образует аддукты (b) с общей формулой Zn(NO3)2•n NH3.
Применение
- Протрава при крашении тканей.
Литература
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1972. — Т. 2. — 871 с.
|
|
|
|---|
Эта статья опубликована с веб-сайта Wikipedia. Исходная статья может быть немного сокращена или изменена. Некоторые ссылки могли быть изменены. Текст находится под лицензией «Creative Commons — Attribution — Sharealike» [1], а часть текста также может быть лицензирована в соответствии с условиями «Лицензии свободной документации GNU» [2]. К медиафайлам могут применяться дополнительные условия. Используя этот сайт, вы соглашаетесь с нашими юридическими страницами[3] [4] [5] [6] [7]. Веб-ссылки: [1] [2]
W w W