| Оксид углерода (IV) | |
|---|---|
_   |
|
| Другие названия | углекислый газ, двуокись углерода, сухой лёд(твердый) |
| Формула | CO2 |
| Молярная масса | 44,0095(14) г/моль |
| В твердом виде | сухой лёд |
| Вид | бесцветный газ |
| Номер CAS | [124-38-9] |
| Свойства | |
| Плотность и фазовое состояние | 1,9769 кг/м³, при н.у.; 771 кг/м³, жидкий; 1512 кг/м³, твёрдый |
| Растворимость в воде | 1,45 кг/м³ |
| Удельная теплоемкость | 0,846 кДж/(кг*С) при 27 °C |
| Удельная теплота плавления | 25,13 кДж/моль |
| Точка плавления | −57 °C (216 K), под давлением |
| Точка кипения | −78 °C (195 K), возгоняется |
| Константа диссоциации кислоты (pKa) | 6,35 и 10,33 |
| Вязкость | 0,07 пз при −78 °C |
| Строение | |
| Форма молекулы | линейная |
| Кристаллическая решётка | молекулярная |
| Дипольный момент | ноль |
| Техника безопасности | |
| MSDS | External MSDS |
| Главные опасности | удушающее, раздражающее |
| NFPA 704 | |
| R-phrases | R: As, Fb [источник не указан 1315 дней] |
| S-phrases | S9, S23, S36 (ж) [источник не указан 1315 дней] |
| RTECS number | FF6400000 |
| Страница дополнительных сведений | |
| Структура и свойства | n, εr, и т. д. |
| Спектр | УФ, ИК, ЯМР, Масс-спектроскопия |
| Родственные соединения | |
| Оксиды | CO C3O2 стандартных условиях (25 °C, 100 кПа) Infobox disclaimer and references |
Оксид углерода(IV) (углекислый газ, диоксид углерода, двуокись углерода, угольный ангидрид) — CO2, бесцветный газ (в нормальных условиях), без запаха, со слегка кисловатым вкусом.
Концентрация углекислого газа в атмосфере Земли составляет в среднем 0,0395 %.[1]
Не следует путать с Диоксином.
Плотность при нормальных условиях 1,97 кг/м³. При атмосферном давлении диоксид углерода не существует в жидком состоянии, переходя непосредственно из твёрдого состояния в газообразное. Твёрдый диоксид углерода называют сухим льдом. При повышенном давлении и обычных температурах углекислый газ переходит в жидкость, что используется для его хранения.
Углекислый газ легко пропускает ультрафиолетовые лучи и лучи видимой части спектра, которые поступают на Землю от Солнца и обогревают её. В то же время он поглощает испускаемые Землёй инфракрасные лучи и является одним из парниковых газов, вследствие чего принимает участие в процессе глобального потепления. Постоянный рост уровня содержания этого газа в атмосфере наблюдается с начала индустриальной эпохи.
Содержание
- 1 Свойства
- 1.1 Физические
- 1.2 Химические
- 1.3 Биологические
- 2 Получение
- 3 Применение
- 4 Методы регистрации
- 5 Углекислый газ в природе
- 6 Токсичность
- 7 Интересные факты
- 8 См. также
- 9 Примечания
- 10 Литература
- 11 Ссылки
Свойства
Физические
Оксид углерода (IV) – углекислый газ, газ без цвета и запаха, тяжелее воздуха, растворим в воде, при сильном охлаждении кристаллизуется в виде белой снегообразной массы – «сухого льда». При атмосферном давлении он не плавится, а испаряется, температура сублимации -78 °С. Углекислый газ образуется при гниении и горении органических веществ. Содержится в воздухе и минеральных источниках, выделяется при дыхании животных и растений. Мало растворим в воде (1 объем углекислого газа в одном объеме воды при 15 °С).
Химические
По химическим свойствам диоксид углерода относится к кислотным оксидам. При растворении в воде образует угольную кислоту. Реагирует со щёлочами с образованием карбонатов и гидрокарбонатов. Вступает в реакции электрофильного замещения (например, с фенолом ) и нуклеофильного присоединения (например, с магнийорганическими соединениями).
Биологические
Диоксид углерода играет одну из главных ролей в живой природе, участвуя во многих процессах метаболизма живой клетки. Диоксид углерода получается в результате множества окислительных реакций у животных, и выделяется в атмосферу с дыханием. Углекислый газ атмосферы — основной источник углерода для растений. Однако, ошибкой будет утверждение, что животные только выделяют углекислый газ, а растения — только поглощают его. Растения поглощают углекислый газ в процессе фотосинтеза, а без освещения они тоже его выделяют.
Диоксид углерода не токсичен[источник не указан 60 дней], но не поддерживает дыхание. Большая концентрация в воздухе вызывает удушье (см. Гиперкапния). Однако недостаток углекислого газа тоже опасен (см. Гипокапния)[источник не указан 60 дней].
Углекислый газ в организмах животных имеет и физиологическое значение, например, участвует в регуляции сосудистого тонуса (см. Артериолы).
Получение
В промышленных количествах углекислота выделяется из дымовых газов, или как побочный продукт химических процессов, например, при разложении природных карбонатов (известняк, доломит) или при производстве алкоголя. Смесь полученных газов, промывают раствором карбоната калия, которые поглощают углекислый газ, переходя в гидрокарбонат. Раствор гидрокарбоната при нагревании или при пониженном давлении разлагается, высвобождая углекислоту. В современных установках получения углекислого газа вместо гидрокарбоната, чаще применяется водный раствор моноэтаноламина, который при определённых условиях способен абсорбировать СО₂, содержащийся в дымовом газе, а при нагреве отдавать его, таким образом, отделяется готовый продукт от других веществ.
Также углекислый газ получают на установках разделения воздуха, как побочный продукт получения чистого кислорода, азота и аргона.
В лабораторных условиях небольшие количества получают взаимодействием карбонатов и гидрокарбонатов с кислотами, например мрамора, мела или соды с соляной кислотой. Использование реакции серной кислоты с мелом или мрамором приводит к образованию малорастворимого сульфата кальция, который мешает реакции, и который удаляется значительным избытком кислоты.
Для приготовления напитков может быть использована реакция пищевой соды с лимонной кислотой или с кислым лимонным соком. Именно в таком виде появились первые газированные напитки. Их изготовлением и продажей занимались аптекари.
Применение
В пищевой промышленности углекислота используется как консервант и разрыхлитель, обозначается на упаковке кодом Е290.
Жидкая углекислота широко применяется в системах пожаротушения, в огнетушителях и для производства газированной воды и лимонада.
Углекислый газ используется в качестве защитной среды при сварке проволокой, но при высоких температурах происходит его диссоциация с выделением кислорода. Выделяющийся кислород окисляет металл. В связи с этим приходится в сварочную проволоку вводить раскислители, такие как марганец и кремний. Другим следствием влияния кислорода, также связанного с окислением, является резкое снижение поверхностного натяжения, что приводит, среди прочего, к более интенсивному разбрызгиванию металла, чем при сварке в аргоне или гелии.
Углекислота в баллончиках применяется в пневматическом оружии (в газобаллонной пневматике) и в качестве источника энергии для двигателей в авиамоделировании, а также для накачивания шин/камер велосипедных колес.[источник не указан 85 дней].
Когда углекислота применяется в газовой фазе, то для хранения она используется под давлением, как сжиженный газ, в виде жидкой фазы. Хранение углекислоты в баллоне в сжиженном состоянии намного выгоднее, чем в виде газа. Углекислота имеет сравнительно низкую критическую температуру 31°С. Когда в 40-литровый баллон с нормальным давлением 100 кгс/сm² залито 30 кг сжиженного углекислого газа, то при температуре 31°С в баллоне будет только жидкая фаза с давлением 100 кгс/сm². Если температура будет выше, то следует уменьшить заполнение баллона или использовать баллоны с более высоким рабочим давлением. Если углекислота будет охлаждаться, то при температуре 21°С при нормальном заполнении в баллоне появиться газовая фаза.
Твёрдая углекислота — «сухой лёд» — используется в качестве хладагента в лабораторных исследованиях, в розничной торговле и т.д.
Методы регистрации
Измерение парциального давления углекислого газа требуется в технологических процессах, в медицинских применениях — анализ дыхательных смесей при искусственной вентиляции лёгких и в замкнутых системах жизнеобеспечения. Анализ концентрации CO2 в атмосфере используется для экологических и научных исследований, для изучения парникового эффекта. Углекислый газ регистрируют с помощью газоанализаторов основанных на принципе инфракрасной спектроскопии и других газоизмерительных систем. Медицинский газоанализатор для регистрации содержания углекислоты в выдыхаемом воздухе называется капнограф.
Углекислый газ в природе
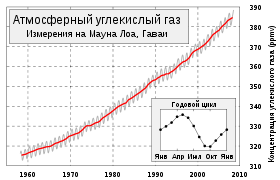
Изменения концентрации атмосферного углекислого газа (кривая Килинга). Измерения в обсерватории на горе Мауна-Лоа, Гавайи.
Ежегодные колебания концентрации атмосферной углекислоты на планете определяются, главным образом, растительностью средних (40—70°) широт Северного полушария.
Вегетация в тропиках практически не зависит от сезона, сухой пояс пустынь 20—30° (обоих полушарий) дает малый вклад в круговорот углекислоты, а полосы суши, наиболее покрытые растительностью, расположены на Земле асимметрично (в Южном полушарии в средних широтах находится океан).
Поэтому с марта по сентябрь вследствие фотосинтеза содержание СО2 в атмосфере падает, а с октября по февраль — повышается. Вклад в зимний прирост дают как окисление древесины (гетеротрофное дыхание растений, гниение, разложение гумуса, лесные пожары), так и сжигание ископаемых топлив (угля, нефти, газа), заметно увеличивающееся в зимний сезон[2].
Большое количество углекислоты растворено в океане.
Углекислый газ составляет значительную часть атмосфер некоторых планет Солнечной системы: Венеры, Марса.
Токсичность
Углекислый газ является тяжелым, по сравнению с воздухом, газом без цвета и запаха. Воздействие его повышенных концентраций на живые организмы относит его к удушающим газам (англ.)русск.. Незначительные повышения концентрации до 2-4% в непроветриваемых помещениях приводят к развитию сонливости и слабости. Опасными концентрациями считаются уровни 7-10%, при которых развивается удушье, проявляющее себя в головной боли, головокружении, расстройстве слуха и в потери сознания в течение периода времени от нескольких минут до одного часа.[3] Отравление этим газом не приводит к долговременным последствиям и после его завершения происходит полное восстановление организма.[4]
Интересные факты
- Подземное животное голый землекоп отличается терпимостью к большим (смертельным для других животных) концентрациям углекислого газа.[5]
- Бо́льшая, по сравнению с человеком, чувствительность других животных к изменениям концентрации этого газа использовалась в качестве естественного детектора опасных концентраций этого газа. Повышенная чувствительность к углекислоте канареек использовалась шахтерами для определения начала скопления этого газа под землей.
- В результате обычного функционирования организма каждого человека в среднем в течение одного дня образуется 1 кг углекислого газа (300 гр углерода).[6]
См. также
- Выхлопные газы
Примечания
- ↑ Trends in Carbon Dioxide
- ↑ А. В. Бялко. Растения убыстряют рост. «Природа». No 10, 1996. (по Keeling C.D., Whorf Т.P., Wahlen M., van der Plicht J. // Nature. 1995. V. 375, № 6533. P.666-670)
- ↑ (англ.) Carbon Dioxide as a Fire Suppressant: Examining the Risks, U.S. Environmental Protection Agency:.
- ↑ (англ.) Glatte Jr H. A., Motsay G. J., Welch B. E. (1967). «Carbon Dioxide Tolerance Studies». Brooks AFB, TX School of Aerospace Medicine Technical Report SAM-TR-67-77. Проверено 2008-05-02.
- ↑ А. Шиндер. Животное, не чувствующее боли. 2000-Аспекты-Проблемы № 26(420), 27 июня-3 июля 2008
- ↑ (англ.) How much carbon dioxide do humans contribute through breathing?.(недоступная ссылка — история) Проверено 30 апреля 2009.
Литература
- Вукалович М.П., Алтунин В.В., Теплофизические свойства двуокиси углерода, Атомиздат, Москва, 1965. 456 с.
- Тезиков А.Д., Производство и применение сухого льда, Госторгиздат, Москва, 1960. 86 с.
- Гродник М.Г., Величанский А.Я., Проектирование и эксплуатация углеслотных установок, ″Пищевая промышленность″, Москва, 1966. 275 с.
- Талянкер Ю.Е., Особенности хранения баллонов со сжиженным газом, Журнал «Сварочное производство», №11, 1972, Москва.
Ссылки
- International Chemical Safety Card 0021 (англ.)
- CID 280 с сайта PubChem (англ.)
- CO2 Диоксид углерода, свойства, применение (англ.)
- Фазовая диаграмма (давление-температура)для диоксида углерода
- Molview from bluerhinos.co.uk Диоксид углерода в 3D
- Dry Ice information (англ.)
- Trends in Atmospheric Carbon Dioxide (NOAA)
- Phase Diagram of Carbon Dioxide(англ.)
- Experiment 071 — Triple Point Phase Transition for Carbon Dioxide
- CO2 как природный рефрежерант — FAQs (англ.)
- Великобритания разрабатывает метод сохранения двуокиси углерода
- Он-лайн калькулятор свойств CO2 (англ.)
|
Климат, Климатология |
|
|---|---|
| Изменение климата | Палеоклиматология • Эль-Ниньо • Геохимический цикл углерода • Протерозойское оледенение, Ледниковый период, Малый ледниковый период • Термальный максимум (Позднепалеоценовый термальный максимум, Последний ледниковый максимум) • Ледники • Теплооборот |
| Глобальное потепление | Вырубка лесов • Противодействие изменению климата • Глобальная климатическая модель • Глобальное похолодание • Глобальное затемнение • Озоновая дыра • Парниковый эффект • Диоксид углерода • Парниковые газы • Межправительственная группа экспертов по изменению климата • Рамочная конвенция ООН об изменении климата (Киотский протокол) • Пик нефти • Возобновляемая энергия • Температурный тренд • Повышение уровня моря • Копенгагенский консенус |
| |
||
|---|---|---|
| Оксиды | CO2 · CO |  |
| Экзотические оксиды | Карбонилы металлов · Угольная кислота · Гидрокарбонаты · Карбонаты · Дикарбонаты · Трикарбонаты |
Оксид углерода((II)), или угарный газ
Оксид углерода((II))
CO
образуется при неполном сгорании топлива. Это бесцветный газ без запаха. Он плохо растворяется в воде ((2,3) см³ в (100) см³ при (20) °С). Оксид углерода((II)) очень ядовит. При вдыхании его молекулы связываются с гемоглобином крови и препятствуют переносу кислорода.
Оксид углерода((II)) относится к несолеобразующим оксидам. При обычных условиях он не реагирует с водой, кислотами и основаниями.
Является сильным восстановителем. Восстановительные свойства проявляет в реакциях с оксидами металлов и кислородом. Оксид углерода((II)) отнимает кислород от оксидов металлов. В результате реакции образуются металл и углекислый газ:
Оксид углерода((II)) горит на воздухе голубым пламенем:
В реакции выделяется большое количество тепла.
Оксид углерода((IV)), или углекислый газ
Оксид углерода((IV))
CO2
— бесцветный газ без запаха. Он примерно в (1,5) раза тяжелее воздуха. Малорастворим в воде (при комнатной температуре в (1) объёме воды растворяется (0,88) объёма
CO2
). При охлаждении и повышенном давлении углекислый газ превращается в твёрдое вещество — «сухой лёд», который способен возгоняться, т. е. из твёрдого состояния переходить сразу в газообразное.
Рис. (1). Сухой лёд
Оксид углерода((IV)) — типичный кислотный оксид. Он взаимодействует с водой, основными оксидами и щелочами. В реакции с водой образуется неустойчивая угольная кислота:
В реакциях с основными оксидами и щелочами образуются карбонаты:
При взаимодействии щёлочи с избытком углекислого газа образуются гидрокарбонаты:
В углекислом газе степень окисления углерода максимальная, поэтому он может проявлять окислительные свойства. Так, магний горит в атмосфере углекислого газа:
Получение:
- в лаборатории углекислый газ получают действием кислот на карбонаты:
.
- В промышленности для его получения используют прокаливание известняка:
В природе углекислый газ образуется при дыхании и сгорании топлива, при гниении и тлении органических веществ, а поглощается растениями в процессе фотосинтеза.
Угарный газ используется:
- в качестве топлива;
- как восстановитель в производстве чугуна;
- для получения метанола.
Углекислый газ применяется:
- в производстве газированных напитков;
- для тушения пожаров;
- для охлаждения пищевых продуктов («сухой лёд»).
Источники:
Рис. 1. Сухой лёд © ЯКласс
Поиск химических веществ по названиям или формулам.
Справочник содержит названия веществ и описания химических формул (в т.ч. структурные формулы и скелетные формулы).
Введите часть названия или формулу для поиска:
Общее число найденных записей: 6.
Показано записей: 6.
1. Углекислый газ
Брутто-формула:
CO2
Названия
Русский:
- Оксид углерода(IV)(IUPAC)
- Углекислый газ
- двуокись углерода
- диоксид углерода
- угольный ангидрид
;
;
;
;
;
English:
- Carbon dioxide
- Carbon oxide
- Carbon(IV) oxide
- Carbonic acid gas
- Carbonic anhydride
- Carbonic oxide
- Dry ice
;
;
;
;
;
;
;
2. Фосген
Брутто-формула:
CCl2O
CAS# 75-44-5
Названия
Русский:
- Фосген [Wiki]
- дихлорангидрид угольной кислоты
- карбонилхлорид
- оксид-дихлорид углерода
- хлорокись углерода
;
;
;
;
;
English:
- CG
- Carbonic dichloride(CAS)
- Carbonyl dichloride(IUPAC)
- Chloroformyl chloride
- Phosgene [Wiki]
- carbon dichloride oxide
- carbon oxychloride
- dichloroformaldehyde
- dichloromethanone
;
;
;
;
;
;
;
;
;
3. Диоксид триуглерода
Брутто-формула:
C3O2
CAS# 504-64-3
Названия
Русский:
- 1,3-диоксопропадиен
- Диоксид триуглерода [Wiki]
- недокись углерода
- недоксид углерода
- трикарбодиоксид
;
;
;
;
;
English:
- 1,2-Propadiene-1,3-dione
- 1,2-Propadiene-1,3-dione(9CI)(CAS)
- AC1L389W
- Carbon suboxide [Wiki]
- Carbon suboxide (C3O2)
- Carbonoxide (C3O2) (6CI,8CI)
- O=C=C=C=O
- Propa-1,2-diona-1,3-dieno(IUPAC)
- propa-1,2-diene-1,3-dione
- propadiene-1,3-dione
- tricarbon dioxide
;
;
;
;
;
;
;
;
;
;
;
4. Монооксид углерода
Брутто-формула:
CO
CAS# 630-08-0
Названия
Русский:
- Монооксид углерода [Wiki]
- окись углерода
- угарный газ
;
;
;
English:
- Carbon monooxide
- Carbon monoxide(IUPAC) [Wiki]
- Carbon(II) oxide
- Carbonous oxide
- Carbonyl
- EINECS:211-128-3
;
;
;
;
;
;
$dots(L)C_(x1,N3)$dots(R)O
5. сероксид углерода
Брутто-формула:
COS
CAS# 463-58-1
Названия
Русский:
- сероксид углерода
;
English:
- Carbon monoxide monosulfide
- Carbon oxide sulfide
- Carbon oxysulfide
- Carbon oxysulfide (COS)
- Carbonoxysulfide
- Carbonyl sulfide [Wiki]
- Carbonyl sulfide (COS)
- Carbonyl sulphide
- Carbonylsulfide (8CI)
- EINECS:207-340-0
- OCS
- Oxycarbon sulfide
- Oxycarbonsulfide (COS)
- Thiocarbonyl oxide
- methanone, thioxo-(CAS)
- oxo(thioxo)methane
- sulfanylidenemethanone(IUPAC)
- thioxomethanone
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
6. Хлорид-фторид карбонила
Брутто-формула:
CClFO
CAS# 353-49-1
Названия
Русский:
- Хлорид-фторид карбонила
- углерода оксид-фторид-хлорид
;
;
English:
- Carbonic chloride fluoride(CAS)
- Carbonyl chloride fluoride(IUPAC)
- EINECS:206-533-7
;
;
;
1. Положение углерода в периодической системе химических элементов
2. Электронное строение углерода
3. Физические свойства и нахождение в природе
4. Качественные реакции
5. Химические свойства
5.1. Взаимодействие с простыми веществами
5.1.1. Взаимодействие с галогенами
5.1.2. Взаимодействие с серой и кремнием
5.1.3. Взаимодействие с водородом и фосфором
5.1.4. Взаимодействие с азотом
5.1.5. Взаимодействие с активными металлами
5.1.6. Горение
5.2. Взаимодействие со сложными веществами
5.2.1. Взаимодействие с водой
5.2.2. Взаимодействие с оксидами металлов
5.2.3. Взаимодействие с серной кислотой
5.2.4. Взаимодействие с азотной кислотой
5.2.5. Взаимодействие с солями
Бинарные соединения углерода — карбиды
Оксид углерода (II)
1. Строение молекулы и физические свойства
2. Способы получения
3. Химические свойства
3.1. Взаимодействие с кислородом
3.2. Взаимодействие с хлором
3.3. Взаимодействие с водородом
3.4. Взаимодействие с щелочами
3.5. Взаимодействие с оксидами металлов
3.6. Взаимодействие с прочими окислителями
Оксид углерода (IV)
1. Строение молекулы и физические свойства
2. Способы получения
3. Химические свойства
3.1. Взаимодействие с основными оксидами и основаниями
2.3. Взаимодействие с карбонатами и гидрокарбонатами
2.4. Взаимодействие с восстановителями
Карбонаты и гидрокарбонаты
Углерод
Положение в периодической системе химических элементов
Углерод расположен в главной подгруппе IV группы (или в 14 группе в современной форме ПСХЭ) и во втором периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение углерода
Электронная конфигурация углерода в основном состоянии:
+6С 1s22s22p2 1s 2s
2p
Электронная конфигурация углерода в возбужденном состоянии:
+6С* 1s22s12p3 1s 2s
2p
Атом углерода содержит на внешнем энергетическом уровне 2 неспаренных электрона и 1 неподеленную электронную пару в основном энергетическом состоянии и 4 неспаренных электрона в возбужденном энергетическом состоянии.
Степени окисления атома углерода — от -4 до +4. Характерные степени окисления -4, 0, +2, +4.
Физические свойства
Углерод в природе существует в виде нескольких аллотропных модификаций: алмаз, графит, карбин, фуллерен.
Алмаз — это модификация углерода с атомной кристаллической решеткой. Алмаз — самое твердое минеральное кристаллическое вещество, прозрачное, плохо проводит электрический ток и тепло. Атомы углерода в алмазе находятся в состоянии sp3-гибридизации.
Графит — это аллотропная модификация, в которой атомы углерода находятся в состоянии sp2-гибридизации. При этом атомы связаны в плоские слои, состоящие из шестиугольников, как пчелиные соты. Слои удерживаются между собой слабыми связями. Это наиболее устойчивая при нормальных условиях аллотропная модификация углерода.
Графит — мягкое вещество серо-стального цвета, с металлическим блеском. Хорошо проводит электрический ток. Жирный на ощупь.
Карбин — вещество, в составе которого атомы углерода находятся в sp-гибридизации. Состоит из цепочек и циклов, в которых атомы углерода соединены двойными и тройными связями. Карбин — мелкокристаллический порошок серого цвета.
[=C=C=C=C=C=C=]n или [–C≡C–C≡C–C≡C–]n
Фуллерен — это искусственно полученная модифицикация углерода. Молекулы фуллерена — выпуклые многогранники С60, С70 и др. Многогранники образованы пяти- и шестиугольниками, в вершинах которых расположены атомы углерода.
Фуллерены — черные вещества с металлическим блеском, обладающие свойствами полупроводников.
В природе углерод встречается как в виде простых веществ (алмаз, графит), так и в виде сложных соединений (органические вещества — нефть, природные газ, каменный уголь, карбонаты).
Качественные реакции
Качественная реакция на карбонат-ионы CO32- — взаимодействие солей-карбонатов с сильными кислотами. Более сильные кислоты вытесняют угольную кислоту из солей. При этом выделяется бесцветный газ, не поддерживающий горение – углекислый газ.
Например, карбонат кальция растворяется в соляной кислоте:
CaCO3 + 2HCl → CaCl2 + H2O + CO2
Видеоопыт взаимодействия карбоната кальция с соляной кислотой можно посмотреть здесь.
Качественная реакция на углекислый газ CO2 – помутнение известковой воды при пропускании через нее углекислого газа:
CO2 + Ca(OH)2 → CaCO3 + H2O
При дальнейшем пропускании углекислого газа осадок растворяется, т.к. карбонат кальция под действием избытка углекислого газа переходит в растворимый гидрокарбонат кальция:
CaCO3 + CO2 + H2O → Ca(HCO3)2
Видеоопыт взаимодействия гидроксида кальция с углекислым газом (качественная реакция на углекислый газ) можно посмотреть здесь.
Углекислый газ СО2 не поддерживает горение. Угарный газ CO горит голубым пламенем.
Соединения углерода
Основные степени окисления углерода — +4, +2, 0, -1 и -4.
Наиболее типичные соединения углерода:
| Степень окисления | Типичные соединения |
| +4 | оксид углерода (IV) CO2
угольная кислота H2CO3 карбонаты MeCO3 гидрокарбонаты MeHCO3 |
| +2 | оксид углерода (II) СО
муравьиная кислота HCOOH |
| -4 | метан CH4
карбиды металлов (карбид алюминия Al4C3) бинарные соединения с неметаллами (карбид кремния SiC) |
Химические свойства
При нормальных условиях углерод существует, как правило, в виде атомных кристаллов (алмаз, графит), поэтому химическая активность углерода — невысокая.
1. Углерод проявляет свойства окислителя (с элементами, которые расположены ниже и левее в Периодической системе) и свойства восстановителя (с элементами, расположенными выше и правее). Поэтому углерод реагирует и с металлами, и с неметаллами.
1.1. Из галогенов углерод при комнатной температуре реагирует с фтором с образованием фторида углерода:
C + 2F2 → CF4
1.2. При сильном нагревании углерод реагирует с серой и кремнием с образованием бинарного соединения сероуглерода и карбида кремния соответственно:
C + 2S → CS2
C + Si → SiC
1.3. Углерод не взаимодействует с фосфором.
При взаимодействии углерода с водородом образуется метан. Реакция идет в присутствии катализатора (никель) и при нагревании:
С + 2Н2 → СН4
1.4. С азотом углерод реагирует при действии электрического разряда, образуя дициан:
2С + N2 → N≡C–C≡N
1.5. В реакциях с активными металлами углерод проявляет свойства окислителя. При этом образуются карбиды:
4C + 3Al → Al4C3
2C + Ca → CaC2
1.6. При нагревании с избытком воздуха графит горит, образуя оксид углерода (IV):
C + O2 → CO2
при недостатке кислорода образуется угарный газ СО:
2C + O2 → 2CO
Алмаз горит при высоких температурах:
Горение алмаза в жидком кислороде:
Графит также горит:
Графит также горит, например, в жидком кислороде:
Графитовые стержни под напряжением:
2. Углерод взаимодействует со сложными веществами:
2.1. Раскаленный уголь взаимодействует с водяным паром с образованием угарного газа и водорода:
C0 + H2+O → C+2O + H20
2.2. Углерод восстанавливает многие металлы из основных и амфотерных оксидов. При этом образуются металл и угарный газ. Получение металлов из оксидов с помощью углерода и его соединений называют пирометаллургией.
Например, углерод взаимодействует с оксидом цинка с образованием металлического цинка и угарного газа:
ZnO + C → Zn + CO
Также углерод восстанавливает железо из железной окалины:
4С + Fe3O4 → 3Fe + 4CO
При взаимодействии с оксидами активных металлов углерод образует карбиды.
Например, углерод взаимодействует с оксидом кальция с образованием карбида кальция и угарного газа. Таким образом, углерод диспропорционирует в данной реакции:
3С + СаО → СаС2 + СО
9С + 2Al2O3 → Al4C3 + 6CO
2.3. Концентрированная серная кислота окисляет углерод при нагревании. При этом образуются оксид серы (IV), оксид углерода (IV) и вода:
C +2H2SO4(конц) → CO2 + 2SO2 + 2H2O
2.4. Концентрированная азотная кислотой окисляет углерод также при нагревании. При этом образуются оксид азота (IV), оксид углерода (IV) и вода:
C +4HNO3(конц) → CO2 + 4NO2 + 2H2O
2.5. Углерод проявляет свойства восстановителя и при сплавлении с некоторыми солями, в которых содержатся неметаллы с высокой степенью окисления.
Например, углерод восстанавливает сульфат натрия до сульфида натрия:
4C + Na2SO4 → Na2S + 4CO
Карбиды
Карбиды – это соединения элементов с углеродом. Карбиды разделяют на ковалентные и ионные в зависимости от типа химической связи между атомами.
| Ковалентные карбиды | Ионные карбиды | ||
| Метаниды | Ацетилениды | Пропиниды | |
| Это соединения углерода с неметаллами
Например: SiC, B4C |
Это соединения с металлами, в которых с.о. углерода равна -4
Например: Al4C3, Be2C |
Это соединения с металлами, в которых с.о. углерода равна -1
Например: Na2C2, CaC2 |
Это соединения с металлами, при гидролизе которых образуется пропин Например: Mg2C3 |
| Частицы связаны ковалентными связями и образуют атомные кристаллы. Поэтому ковалентные карбиды химически стойкие. Окисляются только сильными окислителями | Метаниды разлагаются водой или кислотами с образованием метана и гидроксида или соли:
Например: Al4C3 + 12H2O → 4Al(OH)3 + 3CH4 |
Ацетилениды разлагаются водой или кислотами с образованием ацетилена и гидроксида или соли:
Например: СаС2+ 2Н2O → Са(OH)2 + С2Н2 |
Пропиниды разлагаются водой или кислотами с образованием пропина и гидроксида или соли Например: Mg2C3 + 4HCl → 2MgCl2 + С3Н4 |
Все карбиды проявляют свойства восстановителей и могут быть окислены сильными окислителями.
Например, карбид кремния окисляется концентрированной азотной кислотой при нагревании до углекислого газа, оксида кремния (IV) и оксида азота (II):
SiC + 8HNO3 → 3SiO2 + 3CO2 + 8NO + 4H2O
Оксид углерода (II)
Строение молекулы и физические свойства
Оксид углерода (II) («угарный газ») – это газ без цвета и запаха. Сильный яд. Небольшая концентрация угарного газа в воздухе может вызвать сонливость и головокружение. Большие концентрации угарного газа вызывают удушье.
Строение молекулы оксида углерода (II) – линейное. Между атомами углерода и кислорода образуется тройная связь, за счет дополнительной донорно-акцепторной связи:
Способы получения
В лаборатории угарный газ можно получить действием концентрированной серной кислоты на муравьиную или щавелевую кислоты:
НСООН → CO + H2O
H2C2O4 → CO + CO2 + H2O
В промышленности угарный газ получают в газогенераторах при пропускании воздуха через раскаленный уголь:
C + O2 → CO2
CO2 + C → 2CO
Еще один важный промышленный способ получения угарного газа — паровая конверсия метана. При взаимодействии перегретого водяного пара с метаном образуется угарный газ и водород:
СН4 + Н2O → СО + 3Н2
Также возможна паровая конверсия угля:
C0 + H2+O → C+2O + H20
Угарный газ в промышленности также можно получать неполным окислением метана:
2СН4 + 3О2 → 2СО + 4Н2O
Химические свойства
Оксид углерода (II) – несолеобразующий оксид. За счет углерода со степенью окисления +2 проявляет восстановительные свойства.
1. Угарный газ горит в атмосфере кислорода. Пламя окрашено в синий цвет:
2СO + O2 → 2CO2
2. Оксид углерода (II) окисляется хлором в присутствии катализатора или под действием света с образованием фосгена. Фосген – ядовитый газ.
CO + Cl2 → COCl2
3. Угарный газ взаимодействует с водородом при повышенном давлении. Смесь угарного газа и водорода называется синтез-газ. В зависимости от условий из синтез-газа можно получить метанол, метан, или другие углеводороды.
Например, под давлением больше 20 атмосфер, при температуре 350°C и под действием катализатора угарный газ реагирует с водородом с образованием метанола:
СО + 2Н2 → СН3ОН
4. Под давлением оксид углерода (II) реагирует с щелочами. При этом образуется формиат – соль муравьиной кислоты.
Например, угарный газ реагирует с гидроксидом натрия с образованием формиата натрия:
CO + NaOH → HCOONa
5. Оксид углерода (II) восстанавливает металлы из оксидов.
Например, оксид углерода (II) реагирует с оксидом железа (III) с образованием железа и углекислого газа:
3CO + Fe2O3 → 2Fe + 3CO2
Оксиды меди (II) и никеля (II) также восстанавливаются угарным газом:
СО + CuO → Cu + CO2
СО + NiO → Ni + CO2
6. Угарный газ окисляется и другими сильными окислителями до углекислого газа или карбонатов.
Например, пероксидом натрия:
CO + Na2O2 → Na2CO3
Оксид углерода (IV)
Строение молекулы и физические свойства
Оксид углерода (IV) (углекислый газ) — газ без цвета и запаха. Тяжелее воздуха. Замороженный углекислый газ называют также «сухой лед». Сухой лед легко подвергается сублимации — переходит из твердого состояния в газообразное.
Смешивая сухой лед и различные вещества, можно получить интересные эффекты. Например, сухой лед в пиве:
Углекислый газ не горит, поэтому его применяют при пожаротушении.
Молекула углекислого газа линейная, атом углерода находится в состоянии sp-гибридизации, образует две двойных связи с атомами кислорода:
Обратите внимание! Молекула углекислого газа не полярна. Каждая химическая связь С=О по отдельности полярна, а вся молекула не будет полярна. Объяснить это очень легко. Обозначим направление смещения электронной плотности в полярных связях стрелочками (векторами):
Теперь давайте сложим эти векторы. Сделать это очень легко. Представьте, что атом углерода — это покупатель в магазине. А атомы кислорода — это консультанты, которые тянут его в разные стороны. В данном опыте консультанты одинаковые, и тянут покупателя в разные стороны с одинаковыми силами. Несложно увидеть, что покупатель двигаться не будет ни влево, ни вправо. Следовательно, сумма этих векторов равна нулю. Следовательно, полярность молекулы углекислого газа равна нулю.
Способы получения
В лаборатории углекислый газ можно получить разными способами:
1. Углекислый газ образуется при действии сильных кислот на карбонаты и гидрокарбонаты металлов. При этом взаимодействуют с кислотами и нерастворимые карбонаты, и растворимые.
Например, карбонат кальция растворяется в соляной кислоте:
CaCO3 + 2HCl → CaCl2 + H2O + CO2
Видеоопыт взаимодействия карбоната кальция с соляной кислотой можно посмотреть здесь.
Еще один пример: гидрокарбонат натрия реагирует с бромоводородной кислотой:
NaHCO3 + HBr → NaBr +H2O +CO2
2. Растворимые карбонаты реагируют с растворимыми солями алюминия, железа (III) и хрома (III). Карбонаты трехвалентных металлов необратимо гидролизуются в водном растворе.
Например: хлорид алюминия реагирует с карбонатом калия. При этом выпадает осадок гидроксида алюминия, выделяется углекислый газ и образуется хлорид калия:
2AlCl3 + 3K2CO3 + 3H2O → 2Al(OH)3↓ + CO2↑ + 6KCl
3. Углекислый газ также образуется при термическом разложении нерастворимых карбонатов и при разложении растворимых гидрокарбонатов.
Например, карбонат кальция разлагается при нагревании на оксид кальция и углекислый газ:
CaCO3 → CaO + CO2
Химические свойства
Углекислый газ — типичный кислотный оксид. За счет углерода со степенью окисления +4 проявляет слабые окислительные свойства.
1. Как кислотный оксид, углекислый газ взаимодействует с водой. Реакция очень сильно обратима, поэтому мы считаем, что в реакциях угольная кислота распадается почти полностью при образовании.
CO2 + H2O ↔ H2CO3
2. Как кислотный оксид, углекислый газ взаимодействует с основными оксидами и основаниями. При этом углекислый газ реагирует только с сильными основаниями (щелочами) и их оксидами. При взаимодействии углекислого газа с щелочами возможно образование как кислых, так и средних солей.
Например, гидроксид калия взаимодействует с углекислым газом. В избытке углекислого газа образуется кислая соль, гидрокарбонат калия:
KOH + CO2 → KHCO3
При избытке щелочи образуется средняя соль, карбонат калия:
2KOH + CO2 → K2CO3 + H2O
Помутнение известковой воды — качественная реакция на углекислый газ:
Ca(OH)2 + CO2 → CaCO3 + H2O
Видеоопыт взаимодействия гидроксида кальция (известковая вода) с углекислым газом можно посмотреть здесь.
3. Углекислый газ взаимодействует с карбонатами. При пропускании СО2 через раствор карбонатов образуются гидрокарбонаты.
Например, карбонат натрия взаимодействует с углекислым газом. В избытке углекислого газа образуется кислая соль, гидрокарбонат натрия:
Na2CO3 + CO2 + H2O → 2NaHCO3
4. Как слабый окислитель, углекислый газ взаимодействует с некоторыми восстановителями.
Например, углекислый газ взаимодействует с углеродом с образованием угарного газа:
CO2 + C → 2CO
Магний горит в атмосфере углекислого газа:
2Мg + CO2 → C + 2MgO
Видеоопыт взаимодействия магния с углекислым газом можно посмотреть здесь.
Поэтому углекислый газ нельзя применять для пожаротушения горящего магния.
Углекислый газ взаимодействует с пероксидом натрия. При этом пероксид натрия диспропорционирует:
2CO2 + 2Na2O2 → 2Na2CO3 + O2
Карбонаты и гидрокарбонаты
При нагревании карбонаты (все, кроме карбонатов щелочных металлов и аммония) разлагаются до оксида металла и оксида углерода (IV).
CaCO3 → CaO + CO2
Карбонат аммония при нагревании разлагается на аммиак, воду и углекислый газ:
(NH4)2CO3 → 2NH3 + 2H2O + CO2
Гидрокарбонаты при нагревании переходят в карбонаты:
2NaHCO3 → Na2CO3 + CO2 + H2O
Качественной реакцией на ионы СО32─ и НСО3− является их взаимодействие с более сильными кислотами, последние вытесняют угольную кислоту из солей, а та разлагается с выделением СО2.
Например, карбонат натрия взаимодействует с соляной кислотой:
Na2CO3 + 2HCl → 2NaCl + CO2 ↑ + H2O
Гидрокарбонат натрия также взаимодействует с соляной кислотой:
NaHCO3 + HCl → NaCl + CO2 ↑ + H2O
Гидролиз карбонатов и гидрокарбонатов
Растворимые карбонаты и гидрокарбонаты гидролизуются по аниону. Гидролиз протекает ступенчато и обратимо, т.е. чуть-чуть:
I ступень: CO32- + H2O = HCO3— + OH—
II ступень: HCO3— + H2O = H2CO3 + OH—
Однако карбонаты и гидрокарбонаты алюминия, хрома (III) и железа (III) гидролизуются необратимо, полностью, т.е. в водном растворе не существуют, а разлагаются водой:
Al2(SO4)3 + 6NaHCO3 → 2Al(OH)3 + 6CO2 + 3Na2SO4
2AlBr3 + 3Na2CO3 + 3H2O → 2Al(OH)3↓ + CO2↑ + 6NaBr
Al2(SO4)3 + 3K2CO3 + 3H2O → 2Al(OH)3↓ + 3CO2↑ + 3K2SO4
Более подробно про гидролиз можно прочитать в соответствующей статье.
| Диоксид углерода | ||
|---|---|---|
|
||
 |
||
| Общие | ||
| Систематическое наименование |
Оксид углерода(IV) | |
| Традиционные названия |
углекислый газ диоксид углерода углекислота двуокись углерода сухой лёд (в твёрдом состоянии) |
|
| Хим. формула | CO2 | |
| Рац. формула | CO2 | |
| Физические свойства | ||
| Состояние | Газообразное | |
| Молярная масса | 44,01 г/моль | |
| Плотность |
газ (0 °C): 1,9768 кг/м3 жидкость (0 °С, 35,5 ат): 925 кг/м3 тв. (−78,5 °C): 1560 кг/м3 г/см³ |
|
| Динамическая вязкость | 8,5⋅10−5 Па·с (10 °C, 5,7 МПа) | |
| Энергия ионизации | 2,2E−18 Дж | |
| Скорость звука в веществе | 269 м/с | |
| Термические свойства | ||
| Температура | ||
| • сублимации | −78,5 °C | |
| Тройная точка | −56,6 °C, 0,52 МПа [1] | |
| Критическая точка | 31 °C, 7,38 МПа | |
| Критическая плотность | 467 кг/м3 см³/моль | |
| Уд. теплоёмк. | 849 Дж/(кг·К) | |
| Теплопроводность | 0,0166 Вт/(м·K) | |
| Энтальпия | ||
| • образования | -394 кДж/моль | |
| • плавления | 9,02 кДж/моль | |
| • кипения | 16,7 кДж/моль | |
| • сублимации | 26 кДж/моль | |
| Удельная теплота испарения | 379,5 кДж/кг | |
| Удельная теплота плавления | 205 кДж/кг | |
| Давление пара | 5 724 862,5 Па | |
| Химические свойства | ||
| Растворимость | ||
| • в воде | 1,48 кг/м3 г/100 мл | |
| Классификация | ||
| Рег. номер CAS | 124-38-9 | |
| PubChem | 280 | |
| Рег. номер EINECS | 204-696-9 | |
| SMILES |
C(=O)=O |
|
| InChI |
InChI=1S/CO2/c2-1-3 CURLTUGMZLYLDI-UHFFFAOYSA-N |
|
| Кодекс Алиментариус | E290 | |
| RTECS | FF6400000 | |
| ChEBI | 16526 | |
| Номер ООН | 1013 | |
| ChemSpider | 274 | |
| Безопасность | ||
| Предельная концентрация |
9 г/м3 (5000 ppm) долговременное воздействие, 54 г/м3 (30 000 ppm) кратковременное воздействие (<15 мин.) [2] |
|
| ЛД50 | LC50: 90 000мг/м3*5 мин. (человек, ингаляция)[3] | |
| Токсичность | Нетоксичен. Опасен лишь в очень больших количествах (обладает удушающим действием). Негорюч. | |
| Фразы безопасности (S) | S9, S23, S36 | |
| NFPA 704 |
0 1 0 SA |
|
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | ||
Диокси́д углеро́да или двуо́кись углеро́да (также оксид углерода (IV), углеки́слый газ, у́гольный ангидри́д, углекислота́[4], химическая формула — CO2) — химическое соединение, представляющее собой кислотный оксид углерода, состоящий из одного атома углерода и двух атомов кислорода.
При нормальных условиях, диоксид углерода — это бесцветный газ, почти без запаха (в больших концентрациях с кисловатым «содовым» запахом).
Плотность при нормальных условиях — 1,98 кг/м3 (в 1,5 раза тяжелее воздуха). При атмосферном давлении диоксид углерода не существует в жидком состоянии, переходя непосредственно из твёрдого состояния в газообразное (возгонка). Твёрдый диоксид углерода называют сухим льдом. При повышенном давлении и обычных температурах углекислый газ переходит в жидкость, что используется для его хранения.
Концентрация углекислого газа в атмосфере Земли составляет в среднем 0,04 %[5]. Углекислый газ легко пропускает излучение в ультрафиолетовой и видимой частях спектра, которое поступает на Землю от Солнца и обогревает её. В то же время он поглощает испускаемое Землёй инфракрасное излучение и является одним из парниковых газов, вследствие чего должен участвовать в процессе глобального потепления[6]. Изначально, до появления жизни, углекислый газ составлял основу атмосферы Земли и его уровень снижался от десятков процентов до долей одного в результате процесса фотосинтеза. Постоянный рост содержания этого газа в атмосфере наблюдается с начала индустриальной эпохи. Деятельность человека, прежде всего сжигание ископаемого топлива, увеличила его долю в атмосфере Земли примерно с 280 ppm (частей на миллион) в начале индустриализации до 407,8 ppm в 2018 году[7][8]. Рост содержания углекислого газа выше, до определённой концентрации, приводит к появлению облаков из углекислоты, что ведёт к похолоданию[9][нет в источнике]. Оба эти явления объясняют, почему температурные условия существования жизни на Земле относительно стабильны в течение миллиардов лет.[источник не указан 462 дня]
История
Двуокись углерода была одним из первых газов, получивших название. В XVII веке фламандский химик Йохан Баптиста ван Гельмонт заметил, что масса древесного угля уменьшалась, когда он сжигался, потому что масса оставшейся золы была меньше массы используемого древесного угля. Его интерпретация заключалась в том, что остальная часть древесного угля превратилась в невидимое вещество, которое он назвал газом или spiritus sylvestre («лесной дух»)[10].
Свойства углекислого газа более тщательно изучил шотландский врач Джозеф Блэк. В 1754 году он обнаружил, что при смешивании растворов карбоната кальция с кислотами выделяется газ, который он назвал неподвижным воздухом[11]. Он понял, что он тяжелее воздуха и не поддерживает процессы горения. Когда этот газ вводили в раствор гидроксида кальция, он мог образовывать осадок. С помощью этого явления он показал, что углекислый газ содержится в дыхании млекопитающих и выделяется в результате микробиологической ферментации. Его работа доказала, что газы могут участвовать в химических реакциях, и внесла свой вклад в дело теории флогистона[12].
Джозефу Пристли удалось создать первую газированную воду в 1772 году, переведя серную кислоту в известковый раствор и растворив полученный диоксид углерода в стакане с водой[13]. Однако Уильям Браунригг[en] обнаружил связь между углекислым газом и угольной кислотой гораздо раньше. В 1823 году Гэмфри Дэви и Майкл Фарадей сжижали углекислый газ, увеличив давление[14]. Первое описание твёрдого углекислого газа принадлежит Адриену Тилорье, который открыл в 1834 году герметичный контейнер с жидким углекислым газом и обнаружил, что при самопроизвольном испарении происходит охлаждение, с образованием в результате твёрдого СО2[15].
Нахождение в природе
Углекислый газ содержится в атмосфере, гидросфере, литосфере и биосфере. Обмен углерода между ними происходит в основном за счёт двуокиси углерода. В 2015 году в атмосфере содержалось примерно около 830 гигатонн (830 миллиардов тонн) углерода в форме двуокиси углерода[16]. Гидросфера содержит около 38 тератонн углерода в виде физически растворённого диоксида углерода, а также растворённых гидрокарбонатов и карбонатов. Литосфера содержит самую большую долю химически связанного диоксида углерода. Карбонатные породы, такие как кальцит и доломит, содержат около 60 петатонн углерода[17]. Кроме того, большие количества углерода хранятся в районах вечной мерзлоты, таких как тундры арктических и полярных антарктических регионов, в бореальных хвойных лесах или высоких горах и на болотах[18][19][20].
Свойства
Физические
Фазовая диаграмма диоксида углерода. В области давлений ниже давления в тройной точке на диаграмме имеется только линия сублимации, то есть твёрдый и жидкий диоксид углерода сосуществовать не могут. Это объясняет, почему при атмосферном давлении сухой лёд не плавясь возгоняется и превращается сразу в углекислый газ
Диоксид углерода (IV) (углекислый газ) — бесцветный газ, при малых концентрациях в воздухе не имеет запаха, при больших концентрациях имеет характерный кисловатый запах газированной воды. Тяжелее воздуха приблизительно в 1,5 раза.
Молекула углекислого газа линейна, расстояние от центра центрального атома углерода до центров двух атомов кислорода 116,3 пм.
При температуре −78,3 °С кристаллизуется в виде белой снегообразной массы — «сухого льда». Сухой лёд при атмосферном давлении не плавится, а испаряется, не переходя в жидкое состояние, температура сублимации −78 °С. Жидкий углекислый газ можно получить при повышении давления. Так, при температуре 20 °С и давлении свыше 6 МПа (~60 атм) газ сгущается в бесцветную жидкость. В тлеющем электрическом разряде светится характерным бело-зелёным светом.
Негорюч, но в его атмосфере может поддерживаться горение активных металлов, например, щелочных металлов и щёлочноземельных — магния, кальция, бария.
Углекислый газ образуется при гниении и горении органических веществ. Содержится в воздухе и минеральных источниках, выделяется при дыхании животных и растений. Растворим в воде (0,738 объёмов углекислого газа в одном объёме воды при 15 °С).
Химические
По химическим свойствам диоксид углерода относится к кислотным оксидам. При растворении в воде образует нестойкую угольную кислоту. Реагирует со щелочами с образованием её солей — карбонатов и гидрокарбонатов. Вступает в реакции электрофильного замещения (например, с фенолом) и нуклеофильного присоединения (например, с магнийорганическими соединениями).
Оксид углерода(IV) останавливает горение, вытесняя кислород из зоны реакции. В нём горят только некоторые активные металлы[21]:
.
Взаимодействие с оксидом активного металла:
.
При растворении в воде образует равновесную смесь раствора диоксида углерода и угольной кислоты, причём равновесие сильно сдвинуто в сторону разложения кислоты:
.
Реагирует со щелочами с образованием карбонатов и гидрокарбонатов:
(качественная реакция на углекислый газ),
.
Биологические

Во вдыхаемом человеком воздухе углекислый газ практически отсутствует, а в выдыхаемом воздухе его содержится около 4 % (объёмных)
Организм человека выделяет приблизительно 1 кг углекислого газа в сутки[22].
Этот углекислый газ переносится от тканей, где он образуется в качестве одного из конечных продуктов метаболизма, по венозной системе и затем выделяется с выдыхаемым воздухом через лёгкие. Таким образом, содержание углекислого газа в крови велико в венозной системе, уменьшается в капиллярной сети лёгких, и мало в артериальной крови. Содержание углекислого газа в пробе крови часто выражают в терминах парциального давления, то есть давления, которое бы имел содержащийся в пробе крови в данном количестве углекислый газ, если бы весь объём пробы крови занимал только он[23].
Содержание углекислого газа в крови человека приблизительно таково:
-
Референтные значения или средние значения парциального давления углекислого газа в крови (pCO2)
Единицы измерения Газ венозной крови Альвеолярный лёгочный газ Газ артериальной крови кПа 5,5[24]—6,8[24] 4,8 4,7[24]—6,0[24] мм рт. ст. 41—51 36 35[25]—45[25]
Углекислый газ транспортируется в крови тремя различными способами (точное соотношение каждого из этих трёх способов транспортировки зависит от того, является ли кровь артериальной или венозной).
- Бо́льшая часть углекислого газа (от 70 % до 80 %) преобразуется ферментом карбоангидразой эритроцитов в ионы гидрокарбоната[26] при помощи реакции
.
- Около 5—10 % углекислого газа растворено в плазме крови[26].
- Около 5—10 % углекислого газа связано с гемоглобином в виде карбаминосоединений (карбогемоглобин)[26].
Гемоглобин, основной кислород-транспортирующий белок эритроцитов крови, способен транспортировать как кислород, так и углекислый газ. Однако углекислый газ связывается с гемоглобином в ином месте, чем кислород. Он связывается с N-терминальными концами цепей глобина, а не с гемом. Однако благодаря аллостерическим эффектам, которые приводят к изменению конфигурации молекулы гемоглобина при связывании, связывание углекислого газа понижает способность кислорода к связыванию с ним же, при данном парциальном давлении кислорода, и наоборот — связывание кислорода с гемоглобином понижает способность углекислого газа к связыванию с ним же, при данном парциальном давлении углекислого газа. Помимо этого, способность гемоглобина к преимущественному связыванию с кислородом или с углекислым газом зависит также и от pH среды. Эти особенности очень важны для успешного захвата и транспорта кислорода из лёгких в ткани и его успешного высвобождения в тканях, а также для успешного захвата и транспорта углекислого газа из тканей в лёгкие и его высвобождения там.
Углекислый газ является одним из важнейших медиаторов ауторегуляции кровотока. Он является мощным вазодилататором. Соответственно, если уровень углекислого газа в ткани или в крови повышается (например, вследствие интенсивного метаболизма — вызванного, скажем, физической нагрузкой, воспалением, повреждением тканей, или вследствие затруднения кровотока, ишемии ткани), то капилляры расширяются, что приводит к увеличению кровотока и соответственно к увеличению доставки к тканям кислорода и транспорта из тканей накопившейся углекислоты. Кроме того, углекислый газ в определённых концентрациях (повышенных, но ещё не достигающих токсических значений) оказывает положительное инотропное и хронотропное действие на миокард и повышает его чувствительность к адреналину, что приводит к увеличению силы и частоты сердечных сокращений, величины сердечного выброса и, как следствие, ударного и минутного объёма крови. Это также способствует коррекции тканевой гипоксии и гиперкапнии (повышенного уровня углекислоты)[источник не указан 989 дней].
Ионы гидрокарбоната очень важны для регуляции pH крови и поддержания нормального кислотно-щелочного равновесия. Частота дыхания влияет на содержание углекислого газа в крови. Слабое или замедленное дыхание вызывает респираторный ацидоз, в то время как учащённое и чрезмерно глубокое дыхание приводит к гипервентиляции и развитию респираторного алкалоза.
Кроме того, углекислый газ также важен в регуляции дыхания. Хотя организм человека требует кислорода для обеспечения метаболизма, низкое содержание кислорода в крови или в тканях обычно не стимулирует дыхание (вернее, стимулирующее влияние нехватки кислорода на дыхание слишком слабо и «включается» поздно, при очень низких уровнях кислорода в крови, при которых человек нередко уже теряет сознание). В норме дыхание стимулируется повышением уровня углекислого газа в крови. Дыхательный центр гораздо более чувствителен к повышению уровня углекислого газа, чем к нехватке кислорода. Как следствие этого, дыхание сильно разрежённым воздухом (с низким парциальным давлением кислорода) или газовой смесью, вообще не содержащей кислорода (например, 100 % азотом или 100 % закисью азота) может быстро привести к потере сознания без возникновения ощущения нехватки воздуха (поскольку уровень углекислоты в крови не повышается, ибо ничто не препятствует её выдыханию). Это особенно опасно для пилотов военных самолётов, летающих на больших высотах (в случае аварийной разгерметизации кабины пилоты могут быстро потерять сознание). Эта особенность системы регуляции дыхания также является причиной того, почему в самолётах стюардессы инструктируют пассажиров в случае разгерметизации салона самолёта в первую очередь надевать кислородную маску самим, прежде чем пытаться помочь кому-либо ещё — делая это, помогающий рискует быстро потерять сознание сам, причём даже не ощущая до последнего момента какого-либо дискомфорта и потребности в кислороде[26].

Датчик содержания углекислого газа в помещении
Углекислый газ накапливается в помещении при недостаточной вентиляции. При содержании его в воздухе выше 1000 ppm, то есть 0,1% объёмной концентрации, человек ощущает вялость, затруднённое дыхание («духота»). Превышением по санитарным нормативам считается уровень выше 1400 ppm. При таком показателе уже трудно выполнять работу, трудно нормально засыпать. При уровне более 3000 ppm (0,3%) человек испытывает тошноту, учащается пульс[27]. Углекислый газ при концентрации его в воздухе 7-10% (70,000-100,000 ppm) может привести к удушью и потере сознания даже при присутствии достаточного количества кислорода[28].
Дыхательный центр человека пытается поддерживать парциальное давление углекислого газа в артериальной крови не выше 50 мм ртутного столба. При сознательной гипервентиляции содержание углекислого газа в артериальной крови может снизиться до 10—20 мм ртутного столба, при этом содержание кислорода в крови практически не изменится или увеличится незначительно, а потребность сделать очередной вдох уменьшится как следствие уменьшения стимулирующего влияния углекислого газа на активность дыхательного центра. Это является причиной того, почему после некоторого периода сознательной гипервентиляции легче задержать дыхание надолго, чем без предшествующей гипервентиляции. Такая сознательная гипервентиляция с последующей задержкой дыхания может привести к потере сознания до того, как человек ощутит потребность сделать вдох. В безопасной обстановке такая потеря сознания ничем особенным не грозит (потеряв сознание, человек потеряет и контроль над собой, перестанет задерживать дыхание и сделает вдох, дыхание, а вместе с ним и снабжение мозга кислородом восстановятся, а затем восстановится и сознание). Однако в других ситуациях, например, перед нырянием, это может быть опасным (потеря сознания и потребность сделать вдох наступят на глубине, и в отсутствие сознательного контроля в дыхательные пути попадёт вода, что может привести к утоплению)[источник не указан 1924 дня]. Именно поэтому гипервентиляция перед нырянием опасна и не рекомендуется.
Получение
- В промышленных количествах углекислота выделяется из дымовых газов, или как побочный продукт химических процессов, например, при разложении природных карбонатов[29] (известняк, доломит) или при производстве алкоголя (спиртовое брожение). Смесь полученных газов промывают раствором карбоната калия, которые поглощают углекислый газ, переходя в гидрокарбонат. Раствор гидрокарбоната при нагревании или при пониженном давлении разлагается, высвобождая углекислоту. В современных установках получения углекислого газа вместо гидрокарбоната чаще применяется водный раствор моноэтаноламина, который при определённых условиях способен абсорбировать
, содержащийся в дымовом газе, а при нагреве отдавать его; таким образом отделяется готовый продукт от других веществ.
- Также углекислый газ получают на установках разделения воздуха как побочный продукт получения чистого кислорода, азота и аргона.

В лабораторных условиях небольшие количества получают взаимодействием карбонатов и гидрокарбонатов с кислотами, например мрамора, мела или соды с соляной кислотой, используя, например, аппарат Киппа[29]:
.
Использование реакции серной кислоты с мелом или мрамором приводит к образованию малорастворимого сульфата кальция, который замедляет реакцию, и который удаляется значительным избытком кислоты с образованием кислого сульфата кальция.
Для приготовления сухих напитков может быть использована реакция пищевой соды с лимонной кислотой или с кислым лимонным соком. Именно в таком виде появились первые газированные напитки. Их изготовлением и продажей занимались аптекари.
Также для получения углекислого газа применяется экзотермическая реакция горения углерода в кислороде[29]:
.
Применение
-
-
-
Бытовой баллончик со сжиженным углекислым газом
В пищевой промышленности углекислота используется как консервант и разрыхлитель, обозначается на упаковке кодом Е290.
В криохирургии используется как одно из основных веществ для криоабляции новообразований.
Жидкая углекислота широко применяется в системах пожаротушения и в огнетушителях. Автоматические углекислотные установки для пожаротушения различаются по системам пуска, которые бывают пневматическими, механическими или электрическими.
При сооружении московского метро в XX веке жидкая углекислота использовалась для заморозки грунта.
Устройство для подачи углекислого газа в аквариум может включать в себя резервуар с газом. Простейший и наиболее распространённый метод получения углекислого газа основан на конструкции для изготовления алкогольного напитка браги. При брожении выделяемый углекислый газ вполне может обеспечить подкормку аквариумных растений[30].
Углекислый газ используется для газирования лимонада, газированной воды и других напитков. Углекислый газ используется также в качестве защитной среды при сварке проволокой, но при высоких температурах происходит его распад с выделением кислорода. Выделяющийся кислород окисляет металл. В связи с этим приходится в сварочную проволоку вводить раскислители, такие как марганец и кремний. Другим следствием влияния кислорода, также связанного с окислением, является резкое снижение поверхностного натяжения, что приводит, среди прочего, к более интенсивному разбрызгиванию металла, чем при сварке в инертной среде.
Углекислота в баллончиках применяется в пневматическом оружии (в газобаллонной пневматике) и в качестве источника энергии для двигателей в авиамоделировании.
Хранение углекислоты в стальном баллоне в сжиженном состоянии выгоднее, чем в виде газа. Углекислота имеет сравнительно низкую критическую температуру +31 °С. В стандартный 40-литровый баллон заливают около 20 кг сжиженного углекислого газа, и при комнатной температуре в баллоне будет находиться жидкая фаза, а давление составит примерно 6 МПа (60 кгс/см2). Если температура будет выше +31 °С, то углекислота перейдёт в сверхкритическое состояние с давлением выше 7,36 МПа. Стандартное рабочее давление для обычного 40-литрового баллона составляет 15 МПа (150 кгс/см2), однако он должен безопасно выдерживать давление в 1,5 раза выше, то есть 22,5 МПа, — таким образом, работа с подобными баллонами может считаться вполне безопасной.
Твёрдая углекислота — «сухой лёд» — используется в качестве хладагента в лабораторных исследованиях, в розничной торговле, при ремонте оборудования (например: охлаждение одной из сопрягаемых деталей при их посадке внатяжку) и так далее. Для сжижения углекислого газа и получения сухого льда применяются углекислотные установки.
Методы регистрации
Измерение парциального давления углекислого газа требуется в технологических процессах, в медицинских применениях — анализ дыхательных смесей при искусственной вентиляции лёгких и в замкнутых системах жизнеобеспечения. Анализ концентрации СО2 в атмосфере используется для экологических и научных исследований, для изучения парникового эффекта.
Углекислый газ регистрируют с помощью газоанализаторов основанных на принципе инфракрасной спектроскопии и других газоизмерительных систем. Медицинский газоанализатор для регистрации содержания углекислоты в выдыхаемом воздухе называется капнограф. Для измерения низких концентраций СО2 (а также CO) в технологических газах или в атмосферном воздухе можно использовать газохроматографический метод с метанатором и регистрацией на пламенно-ионизационном детекторе[31].
Ежегодные колебания концентрации атмосферной углекислоты на планете определяются, главным образом, растительностью средних (40—70°) широт Северного полушария.
Вегетация в тропиках практически не зависит от сезона, сухой пояс пустынь 20—30° (обоих полушарий) даёт малый вклад в круговорот углекислоты, а полосы суши, наиболее покрытые растительностью, расположены на Земле асимметрично (в Южном полушарии в средних широтах находится океан).
Поэтому с марта по сентябрь вследствие фотосинтеза содержание СО2 в атмосфере падает, а с октября по февраль — повышается. Вклад в зимний прирост дают как окисление древесины (гетеротрофное дыхание растений, гниение, разложение гумуса, лесные пожары), так и сжигание ископаемого топлива (угля, нефти, газа), заметно увеличивающееся в зимний сезон[32].
Большое количество углекислоты растворено в океане.
Углекислый газ составляет значительную часть атмосфер некоторых планет Солнечной системы: Венеры, Марса.
Физиологическое действие
Углекислый газ[33] нетоксичен, однако при вдыхании его повышенных концентраций в воздухе по воздействию на воздуходышащие живые организмы его относят к удушающим газам (англ.) (рус..
В соответствии с ГОСТом 12.1.007-76 диоксид углерода относится к вредным веществам IV класса опасности[34][35].
Растворённый в крови углекислый газ активирует дыхательный центр мозга в физиологических и несколько повышенных концентрациях. Незначительные повышения концентрации, вплоть до 0,2−0,4 % (2000−4000 ppm), в помещениях приводят к развитию у людей сонливости и слабости. В значительно более высоких концентрациях он приводит к снижению или устранению рефлекторного респираторного раздражителя, сначала к угнетению дыхания и, наконец, к остановке дыхания[36]. От 5 % углекислого газа во вдыхаемом воздухе возникают головные боли и головокружение, при более высоких концентрациях учащённое сердцебиение (тахикардия), повышение артериального давления, одышка и потеря сознания, так называемая углекислотная анестезия. Концентрация углекислого газа свыше 8 % приводит к отравлению с последующим смертельным исходом в течение 30-60 минут[37][38]. Накопление углекислого газа в крови называется гиперкапнией.
Для помещений нормальным является уровень CO2 около 600 ppm (частей на миллион). Повышенные концентрации углекислого газа снижают когнитивные способности людей. Уже при 1200 ppm расширяются кровеносные сосуды в мозге, снижается активность нейронов и уменьшается объём коммуникации между регионами мозга[39]. В школьных классах типичной является концентрация 2000−2500, а общий разброс значений — от 1000 до 6000, это вызывает обеспокоенность у исследователей[40], поскольку выявлено снижение результатов учеников, выполняющих тестовые задания в душных помещениях[41].
| Влияние на взрослых здоровых людей | Концентрация углекислого газа, ppm |
|---|---|
| Нормальный уровень на открытом воздухе | 350—450 |
| Приемлемые уровни | <600 |
| Жалобы на несвежий воздух | >1200 |
| Общая вялость | 1000—2500 |
| Максимально допустимая концентрация в течение 8 часового рабочего дня | 5000 |
| Лёгкое отравление, учащается пульс и частота дыхания, тошнота и рвота | 30 000 |
| Добавляется головная боль и лёгкое нарушение сознания | 50 000 |
| Потеря сознания, в дальнейшем — отравление с последующим смертельным исходом | 100 000 |
Вдыхание воздуха с повышенной концентрацией этого газа не приводит к долговременным расстройствам здоровья. После удаления пострадавшего из атмосферы с высокой концентрацией углекислого газа быстро наступает полное восстановление здоровья и самочувствия[42].
Рекомендуемая ПДК в воздухе рабочей зоны для диоксида углерода составляет 9000 мг/м3[43].
В культуре
- CO2 — песня DJ Smash и Artik & Asti.
См. также
- Углекислый газ в атмосфере Земли
- Угольная кислота
- Выхлопные газы
- Лимнологическая катастрофа
- Глобальное потепление
- Торговля эмиссионными квотами
Примечания
- ↑ Carbon Dioxide - Thermophysical Properties. Дата обращения: 23 ноября 2018. Архивировано 24 ноября 2018 года.
- ↑ Carbon dioxide: Immediately Dangerous to Life or Health Concentrations (IDLH). Дата обращения: 7 марта 2020. Архивировано 20 апреля 2018 года.
- ↑ name=https://docs.cntd.ru_ГОСТ (недоступная ссылка) 12.1.007-76. Система стандартов безопасности труда. Вредные вещества. Классификация и общие требования
- ↑ Раков Э. Г., Углерода диоксид, 2016.
- ↑ Trends in Atmospheric Carbon Dioxide (англ.). National Oceanic and Atmospheric Administration. Дата обращения: 24 сентября 2013. Архивировано 5 февраля 2018 года.
- ↑ Jochem Marotzke; Martin Stratmann. Die Zukunft des Klimas : neue Erkenntnisse, neue Herausforderungen : ein Report der Max-Planck-Gesellschaft (нем.). — München: C. H. Beck, 2015. — S. 9—22. — ISBN 978-3-406-66968-2, 3-406-66968-9.
- ↑ Eggleton, R. A. A short introduction to climate change (англ.). — Cambridge: CUP, 2012. — 240 p. — ISBN 978-1-139-52435-3, 1-139-52435-6, 978-1-139-62739-9, 1-139-62739-2, 978-1-283-94302-4, 1-283-94302-6, 978-1-139-62794-8, 1-139-62794-5, 1-139-62705-8, 978-1-139-62705-4. Архивная копия от 21 апреля 2020 на Wayback Machine
- ↑ Treibhausgas-Konzentration erreicht neuen Rekordwert (нем.). klimareporter°. Дата обращения: 22 сентября 2020. Архивировано 21 октября 2020 года.
- ↑ Chen Zhou, Mark D. Zelinka & Stephen A. Klein. Impact of decadal cloud variations on the Earth’s energy budget (англ.). Nature Geoscience. Дата обращения: 4 декабря 2019. Архивировано 13 октября 2019 года.
- ↑ Brock, William H. 1936-. Viewegs Geschichte der Chemie. — Braunschweig. — С. 35. — XII, 472 S с. — ISBN 978-3-528-06645-1, 3-528-06645-8, 3-540-67033-5, 978-3-540-67033-9.
- ↑ Brock, William H. 1936-. Viewegs Geschichte der Chemie. — Braunschweig. — С. 50. — XII, 472 S с. — ISBN 978-3-528-06645-1, 3-528-06645-8, 3-540-67033-5, 978-3-540-67033-9.
- ↑ Brock, William H. 1936-. Viewegs Geschichte der Chemie. — Braunschweig. — С. 72. — XII, 472 S с. — ISBN 978-3-528-06645-1, 3-528-06645-8, 3-540-67033-5, 978-3-540-67033-9.
- ↑ Joseph Priestley. XIX. Observations on different kinds of air. // Philosophical Transactions of the Royal Society of London. — 1772-01-01. — Т. 62. — С. 147–264. — doi:10.1098/rstl.1772.0021. Архивировано 12 октября 2020 года.
- ↑ XVIII. On the application of liquids formed by the condensation of gases as mechanical agents (EN) // Philosophical Transactions of the Royal Society of London. — 1823-12-31. — Т. 113. — С. 199–205. — ISSN 2053-9223 0261-0523, 2053-9223. — doi:10.1098/rstl.1823.0020.
- ↑ Joost Mertens. Du côté d’un chimiste nommé Thilorier // L’Année balzacienne. — 2003. — Т. 4, вып. 1. — С. 251. — ISSN 0084-6473. — doi:10.3917/balz.004.0251.
- ↑ Die Zukunft des Klimas : neue Erkenntnisse, neue Herausforderungen : ein Report der Max-Planck-Gesellschaft. — München: C.H. Beck, 2015. — С. 125. — 123-136 с. — ISBN 978-3-406-66968-2, 3-406-66968-9.
- ↑ Kappas, M. (Martin). Klimatologie : Klimaforschung im 21. Jahrhundert - Herausforderung für Natur- und Sozialwissenschaften. — Heidelberg: Spektrum Akademischer Verlag, 2009. — С. 159. — 1 online resource с. — ISBN 978-3-8274-2242-2, 3-8274-2242-6.
- ↑ Permafrost - Auf dünnem Eis (нем.). Deutschlandfunk. Дата обращения: 22 сентября 2020. Архивировано 22 октября 2020 года.
- ↑ International Permafrost Association Country Reports (англ.). International Permafrost Association. Дата обращения: 22 сентября 2020. Архивировано 31 августа 2020 года.
- ↑ NABU - Moore und Klimawandel (нем.). NABU - Naturschutzbund Deutschland e.V.. Дата обращения: 22 сентября 2020. Архивировано 20 января 2021 года.
- ↑ Егоров А. С. Репетитор по химии — Ростов-на-Дону: «Феникс», 2009.
- ↑ 7. How much carbon dioxide do humans contribute through breathing?. Frequent Questions — Emissions (англ.). US EPA. Дата обращения: 4 декабря 2019. Архивировано 2 февраля 2011 года.
- ↑ Charles Henrickson. Chemistry (англ.). — Cliffs Notes, 2005. — ISBN 0-7645-7419-1.
- ↑ 1 2 3 4 Пересчитано из значений в мм. рт. ст. с использованием коэффициента пересчёта 0,133322 кПа/мм. рт. ст.
- ↑ 1 2 Таблица референсных значений. Юго-Западный медицинский центр при Университете Далласа.
- ↑ 1 2 3 4 Carbon dioxide. solarnavigator.net. Дата обращения: 12 октября 2007. Архивировано из оригинала 14 сентября 2008 года.
- ↑ Допустимое содержание СО2 в помещениях
- ↑ Carbon Dioxide as a Fire Suppressant: Examining the Risks, U.S. Environmental Protection Agency.
- ↑ 1 2 3 Glinka, Nikolaj Leonidovič (1882-1965). Obŝaâ himiâ. — Izd. 27-e ster. — Leningrad: «Himiâ», 1988. — 702, [2] s. с. — ISBN 5724500035, 9785724500036.
- ↑ Большая Энциклопедия Нефти и Газа.
- ↑ ГОСТ 31371.6-2008 (ИСО 6974-6:2002). Газ природный. Определение состава методом газовой хроматографии с оценкой неопределённости. Часть 6. Определение водорода, гелия, кислорода, азота, диоксида углерода и углеводородов C1 — C8 с использованием трёх капиллярных колонок. Docs.cntd.ru. — М.: Стандартинформ, 2009.. Дата обращения: 4 декабря 2019. Архивировано 4 декабря 2019 года.
- ↑ Бялко А. В. Растения убыстряют рост // Природа. — 1996. — № 10. (по Keeling C.D., Whorf Т.P., Wahlen M., van der Plicht J. // Nature. 1995. V. 375, № 6533. P.666-670)
- ↑ Carbon dioxide poisoning: a literature review of an often forgotten cause of intoxication in the emergency department. Дата обращения: 3 марта 2020. Архивировано 1 ноября 2020 года.
- ↑ name=https://docs.cntd.ru_ГОСТ (недоступная ссылка) 12.1.005-76. Воздух рабочей зоны. Общие санитарно-гигиенические требования
- ↑ name=https://docs.cntd.ru_ГОСТ (недоступная ссылка) 8050-85 Двуокись углерода
- ↑ Rauchvergiftungen/Vergiftungen durch Gase (TK). web.archive.org (4 июня 2010). Дата обращения: 22 сентября 2020.
- ↑ Deutsches Rotes Kreuz. Vergiftungen und Hilfe bei Erbrechen - Erste Hilfe (нем.). DRK e.V. (17 июня 2020). Дата обращения: 22 сентября 2020. Архивировано 23 октября 2020 года.
- ↑ Carbon Dioxide - Life and Death. web.archive.org (22 мая 2013). Дата обращения: 22 сентября 2020.
- ↑ Greenwood, Veronique. Is Conference Room Air Making You Dumber? : [англ.] // The New York Times : газ. — 2019. — 6 May.
- ↑ Ventilation rates and carbon dioxide concentrations in schools. — In: Ventilation with Outdoor Air : [англ.] // Berkeley Lab : [сайт]. — 2019.
- ↑ Сорокин, Андрей. «Глобальное потепление отупляет. От этого уже страдают школьники и офисные работники» // Republic : [сайт]. — 2020. — 7 января.
- ↑ (англ.) Glatte Jr H. A., Motsay G. J., Welch B. E. Carbon Dioxide Tolerance Studies (англ.) // Brooks AFB, TX School of Aerospace Medicine Technical Report. — 1967. — Vol. SAM—TR—67—77. Архивировано 9 мая 2008 года.
- ↑ name=https://docs.cntd.ru_ПДК (недоступная ссылка) вредных веществ в воздухе рабочих помещений
Литература
- Вукалович М. П., Алтунин В. В. Теплофизические свойства двуокиси углерода. — М.: Атомиздат, 1965. — 456 с.
- Гродник М. Г., Величанский А. Я. Проектирование и эксплуатация углекислотных установок. — М.: Пищевая промышленность, 1966. — 275 с.
- Раков Э. Г. Углерода диоксид // Большая российская энциклопедия. — М.: Большая российская энциклопедия, 2016. — Т. 32. — С. 662—663.
- Тезиков А. Д. Производство и применение сухого льда. — М.: Госторгиздат, 1960. — 128 с.
- Талянкер Ю. Е. Особенности хранения баллонов со сжиженным газом // Сварочное производство. — 1972. — № 11.
Ссылки
- International Chemical Safety Card 0021 Архивная копия от 13 февраля 2008 на Wayback Machine (англ.)
- CID 280 Архивная копия от 18 января 2012 на Wayback Machine — PubChem (англ.)
- CO2 Диоксид углерода, свойства, применение Архивная копия от 13 февраля 2021 на Wayback Machine (англ.)
- Фазовая диаграмма (давление-температура) для диоксида углерода
- Диоксид углерода в 3D
- Dry Ice information Архивная копия от 3 апреля 2004 на Wayback Machine (англ.)
- Phase Diagram of Carbon Dioxide (англ.)
- Experiment 071 — Triple Point Phase Transition for Carbon Dioxide
- CO2 как природный рефрежерант — FAQs (англ.)
- Великобритания разрабатывает метод сохранения двуокиси углерода
- Онлайн калькулятор свойств CO2 Архивная копия от 30 сентября 2011 на Wayback Machine (англ.)
| п • <abbr title=»Обсуждение этого шаблона»>о</abbr> • р Оксиды | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H2O | ||||||||||||||||
| Li2O LiCoO2 Li3PaO4 Li5PuO6 Ba2LiNpO6 LiAlO2 Li3NpO4 Li2NpO4 Li5NpO6 LiNbO3 |
BeO | B2O3 | С3О2 C12O9 CO C12O12 C4O6 CO2 |
N2O NO N2O3 N4O6 NO2 N2O4 N2O5 |
O | F | ||||||||||
| Na2O NaPaO3 NaAlO2 Na2PtO3 |
MgO | AlO Al2O3 NaAlO2 LiAlO2 AlO(OH) |
SiO SiO2 |
P4O P4O2 P2O3 P4O8 P2O5 |
S2O SO SO2 SO3 |
Cl2O ClO2 Cl2O6 Cl2O7 |
||||||||||
| K2O K2PtO3 KPaO3 |
CaO Ca3OSiO4 CaTiO3 |
Sc2O3 | TiO Ti2O3 TiO2 TiOSO4 CaTiO3 BaTiO3 |
VO V2O3 V3O5 VO2 V2O5 |
FeCr2O4 CrO Cr2O3 CrO2 CrO3 MgCr2O4 |
MnO Mn3O4 Mn2O3 MnO(OH) Mn5O8 MnO2 MnO3 Mn2O7 |
FeCr2O4 FeO Fe3O4 Fe2O3 |
CoFe2O4 CoO Co3O4 CoO(OH) Co2O3 CoO2 |
NiO NiFe2O4 Ni3O4 NiO(OH) Ni2O3 |
Cu2O CuO CuFe2O4 Cu2O3 CuO2 |
ZnO | Ga2O Ga2O3 |
GeO GeO2 |
As2O3 As2O4 As2O5 |
SeOCl2 SeOBr2 SeO2 Se2O5 SeO3 |
Br2O Br2O3 BrO2 |
| Rb2O RbPaO3 Rb4O6 |
SrO | Y2O3 YOF YOCl |
ZrO(OH)2 ZrO2 ZrOS Zr2О3Сl2 |
NbO Nb2O3 NbO2 Nb2O5 Nb2O3(SO4)2 LiNbO3 |
Mo2O3 Mo4O11 MoO2 Mo2O5 MoO3 |
TcO2 Tc2O7 |
Ru2O3 RuO2 Ru2O5 RuO4 |
RhO Rh2O3 RhO2 |
PdO Pd2O3 PdO2 |
Ag2O Ag2O2 |
Cd2O CdO |
In2O InO In2O3 |
SnO SnO2 |
Sb2O3 Sb2O4 Hg2Sb2O7 Sb2O5 |
TeO2 TeO3 |
I2O4 I4O9 I2O5 |
| Cs2O Cs2ReCl5O |
BaO BaPaO3 BaTiO3 BaPtO3 |
HfO(OH)2 HfO2 |
Ta2O TaO TaO2 Ta2O5 |
WO2Br2 WO2 WO2Cl2 WOBr4 WOF4 WOCl4 WO3 |
Re2O ReO Re2O3 ReO2 Re2O5 ReO3 Re2O7 |
OsO Os2O3 OsO2 OsO4 |
Ir2O3 IrO2 |
PtO Pt3O4 Pt2O3 PtO2 K2PtO3 Na2PtO3 PtO3 |
Au2O AuO Au2O3 |
Hg2O HgO (Hg3O2)SO4 Hg2O(CN)2 Hg2Sb2O7 Hg3O2Cl2 Hg5O4Cl2 |
Tl2O Tl2O3 |
Pb2O PbO Pb3O4 Pb2O3 PbO2 |
BiO Bi2O3 Bi2O4 Bi2O5 |
PoO PoO2 PoO3 |
At | |
| Fr | Ra | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | |
| ↓ | ||||||||||||||||
| La2O2S La2O3 |
Ce2O3 CeO2 |
PrO Pr2O2S Pr2O3 Pr6O11 PrO2 |
NdO Nd2O2S Nd2O3 NdHO |
Pm2O3 | SmO Sm2O3 |
EuO Eu3O4 Eu2O3 EuO(OH) Eu2O2S |
Gd2O3 | Tb | Dy2O3 | Ho2O3 Ho2O2S |
Er2O3 | Tm2O3 | YbO Yb2O3 |
Lu2O2S Lu2O3 LuO(OH) |
||
| Ac2O3 | UO2 UO3 U3O8 |
PaO PaO2 Pa2O5 PaOS |
ThO2 | NpO NpO2 Np2O5 Np3O8 NpO3 |
PuO Pu2O3 PuO2 PuO3 PuO2F2 |
AmO2 | Cm2O3 CmO2 |
Bk2O3 | Cf2O3 | Es | Fm | Md | No | Lr |
Эта страница в последний раз была отредактирована 28 ноября 2022 в 13:18.
Как только страница обновилась в Википедии она обновляется в Вики 2.
Обычно почти сразу, изредка в течении часа.