Кислота средней силы. Ее соли – фосфаты плохо растворимы в воде, кроме фосфатов щелочных металлов и аммония.
Альтернативные названия
Ортофосфорная кислота, гидроксид фосфора (V)
Формула
H3PO4
Свойства фосфорной кислоты
Физические свойства
Фосфорная кислота самая устойчивая при комнатной температуре фосфорных кислот. Кроме ортофосфорной кислоты H3PO4 существует метафосфорная кислота HPO3, пирофосфорная H4P2O7, трифосфорная H3P3O9 и тетрафосфорная H4P4O12. Последние три намного сильнее ортофосфорной кислоты (K1 = 7 ⋅cdot 10-3).
| Свойство | Описание |
|---|---|
| Внешний вид | Бесцветная жидкость в водном растворе, в чистом виде – гигроскопичные кристаллы |
| Молярная масса, г/моль | 98,0 |
| Плотность при 20°С, г/см3 | 1,83 |
| Температура плавления, °С | +42,35 |
| Температура кипения, °С | 213 (разл.) |
Химические свойства
В водных растворах фосфорная кислота диссоциирует на ионы:
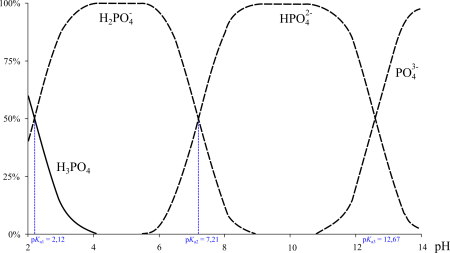
H3PO4 ⇄rightleftarrows H+ + H2PO4—, ⇄rightleftarrows 2H+ + HPO42- ⇄rightleftarrows 3H+ + PO43-.
K1 = 7,1·10-3,
K2 = 6,2·10-8,
K3 = 5,0·10-13.
При комнатной температуре фосфорная кислота реагирует лишь с активными металлами, оксидами и гидроксидами:
6Li + 2H3PO4 = 2Li3PO4 + 3H2↑,
3CaO + 2H3PO4 = Ca3(PO4)2 + 3H2O,
3KOH + H3PO4 = K3PO4 + 3H2O.
При нагревании она более активна:
3Zn + 2H3PO4 = 2Zn3(PO4)2 ↓+ 3H2↑,
Fe2O3 +2H3PO4 = 2FePO4↓+ 3H2O.
Фосфорная кислота разлагается при нагревании:
4H3PO4 = 2H4P2O7 + 2H2O.
Фосфорная кислота вступает в реакцию с хлорной кислотой, образуя соли фосфорила:
H3PO4 + HClO4= P(OH)4ClO4.
Поэтому можно считать фосфорную кислоту амфотерным гидроксидом фосфора (V) с преобладанием кислотных свойств.
Получение
Лабораторные способы получения
Фосфорную кислоту в лабораторных условиях получают из оксида фосфора (V):
P2O5 + 3H2O = 2H3PO4.
Реакция протекает бурно, поэтому ее лучше получать таким способом в промышленности.
Можно получить фосфорную кислоту из фосфатов действием соляной или серной кислоты:
Na3PO4 + 3HCI = 3NaCI + H3PO4.
Наконец, можно подвергнуть гидролизу хлорид фосфора (V):
2PCl5+ 8H2O = 2H3PO4 + 10HCl.
Получение в промышленности
В промышленности наиболее чистую фосфорную кислоту получают термическим способом, для чего фосфор сжигают:
4P +5O2 = 2P2O5.
Фосфорный ангидрид взаимодействует с водой слишком бурно, поэтому фосфорный ангидрид смешивают с нагретой до 200°С фосфорной кислотой в концентрации 50-60%. Полученную кислоту разводят и частично запускают вновь в процесс.
Есть экстракционный метод получения фосфорной кислоты непосредственно из руд, например, из апатита:
Ca5(PO4)3F + 5H2SO4 + n H3PO4 + 3H2O = (n+3) H3PO4+ 5CaSO4·H2O + HF.
Применение
Фосфорная кислота используется при производстве высококонцентрированных фосфорных удобрений, полифосфатов, синтетических моющих средств, умягчителей воды, а также в качестве катализатора.
В стекольном производстве ее добавляют при варке специальных стекол.
В медицине ее применяют при производстве многих лекарственных препаратов.
В химическом анализе из фосфорной кислоты и фосфатов готовят буферные растворы.
Пример решения задачи
Осуществите следующие превращения:
Na3PO4 → H3PO4 → HPO3 → KPO3→ AgPO3.
Решение
Na3PO4+3HCI = 3NaCI+H3PO4;
H3PO4 + P2O5 = 3HPO3;
HPO3 + KOH = KPO3 + Н2О,
KPO3 + AgNO3 = AgPO3↓ + KNO3.
Тест по теме «Фосфорная кислота»
(Redirected from Phosphoric Acid)
This article is about orthophosphoric acid. For other acids commonly called «phosphoric acid», see Phosphoric acids and phosphates.

|
||
|
||
| Names | ||
|---|---|---|
| IUPAC name
Phosphoric acid |
||
| Other names
Orthophosphoric acid |
||
| Identifiers | ||
|
CAS Number |
|
|
|
3D model (JSmol) |
|
|
| ChEBI |
|
|
| ChEMBL |
|
|
| ChemSpider |
|
|
| ECHA InfoCard | 100.028.758 |
|
| EC Number |
|
|
| E number | E338 (antioxidants, …) | |
| KEGG |
|
|
|
PubChem CID |
|
|
| RTECS number |
|
|
| UNII |
|
|
| UN number | 1805 | |
|
CompTox Dashboard (EPA) |
|
|
|
InChI
|
||
|
SMILES
|
||
| Properties | ||
|
Chemical formula |
H3PO4 | |
| Molar mass | 97.994 g·mol−1 | |
| Appearance | Colorless solid | |
| Odor | Odorless | |
| Density | 1.6845 g/cm3 (25 °C, 85%),[1] 1.834 g/cm3 (solid)[2] | |
| Melting point | 40–42.4 °C (104.0–108.3 °F; 313.1–315.5 K)[6] | |
| Boiling point |
|
|
|
Solubility in water |
|
|
| Solubility | Soluble in ethanol | |
| log P | −2.15[7] | |
| Vapor pressure | 0.03 mmHg (20 °C)[8] | |
| Conjugate base | Dihydrogen phosphate | |
|
Magnetic susceptibility (χ) |
−43.8·10−6 cm3/mol[10] | |
|
Refractive index (nD) |
|
|
| Viscosity | 2.4–9.4 cP (85% aq. soln.) 147 cP (100%) |
|
| Structure | ||
|
Crystal structure |
Monoclinic | |
|
Molecular shape |
Tetrahedral | |
| Thermochemistry[12] | ||
|
Heat capacity (C) |
145.0 J/(mol⋅K) | |
|
Std molar |
150.8 J/(mol⋅K) | |
|
Std enthalpy of |
−1271.7 kJ/mol | |
|
Gibbs free energy (ΔfG⦵) |
−1123.6 kJ/mol | |
| Hazards | ||
| GHS labelling: | ||
|
Pictograms |
 [13] [13]
|
|
|
Signal word |
Danger | |
|
Hazard statements |
H290, H314[13] | |
|
Precautionary statements |
P280, P305+P351+P338, P310[13] | |
| NFPA 704 (fire diamond) |
3 0 0 |
|
| Flash point | Non-flammable | |
| Lethal dose or concentration (LD, LC): | ||
|
LD50 (median dose) |
1530 mg/kg (rat, oral)[14] | |
| NIOSH (US health exposure limits): | ||
|
PEL (Permissible) |
TWA 1 mg/m3[8] | |
|
REL (Recommended) |
TWA 1 mg/m3 ST 3 mg/m3[8] | |
|
IDLH (Immediate danger) |
1000 mg/m3[8] | |
| Safety data sheet (SDS) | ICSC 1008 | |
| Related compounds | ||
|
Related phosphorus oxoacids |
|
|
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Phosphoric acid (orthophosphoric acid, monophosphoric acid or phosphoric(V) acid) is a colorless, odorless phosphorus-containing solid, and inorganic compound with the chemical formula H3PO4. It is commonly encountered as an 85% aqueous solution, which is a colourless, odourless, and non-volatile syrupy liquid. It is a major industrial chemical, being a component of many fertilizers.
The compound is an acid. Removal of all three H+ ions gives the phosphate ion PO3−4. Removal of one or two protons gives dihydrogen phosphate ion H2PO−4, and the hydrogen phosphate ion HPO2−4, respectively. Phosphoric acid forms esters, called organophosphates.[15]
The name «orthophosphoric acid» can be used to distinguish this specific acid from other «phosphoric acids», such as pyrophosphoric acid. Nevertheless, the term «phosphoric acid» often means this specific compound; and that is the current IUPAC nomenclature.
Production[edit]
Phosphoric acid is produced industrially by one of two routes, wet processes and dry.[16]
Wet process[edit]
In the wet process, a phosphate-containing mineral such as calcium hydroxyapatite and fluorapatite are treated with sulfuric acid.[17]
- Ca5(PO4)3OH + 5 H2SO4 → 3 H3PO4 + 5 CaSO4 + H2O
- Ca5(PO4)3F + 5 H2SO4 → 3 H3PO4 + 5 CaSO4 + HF
Calcium sulfate (gypsum, CaSO4) is a by-product, which is removed as phosphogypsum. The hydrogen fluoride (HF) gas is streamed into a wet (water) scrubber producing hydrofluoric acid. In both cases the phosphoric acid solution usually contains 23–33% P2O5 (32–46% H3PO4). It may be concentrated to produce commercial- or merchant-grade phosphoric acid, which contains about 54–62% P2O5 (75–85% H3PO4). Further removal of water yields superphosphoric acid with a P2O5 concentration above 70% (corresponding to nearly 100% H3PO4). The phosphoric acid from both processes may be further purified by removing compounds of arsenic and other potentially toxic impurities.
Dry process[edit]
To produce food-grade phosphoric acid, phosphate ore is first reduced with coke in an electric arc furnace, to give elemental phosphorus. Silica is also added, resulting in the production of calcium silicate slag. Elemental phosphorus is distilled out of the furnace and burned with air to produce high-purity phosphorus pentoxide, which is dissolved in water to make phosphoric acid.[18]
Acidic properties[edit]
In aqueous solution phosphoric acid behaves as a triprotic acid.
- H3PO4 ⇌ H2PO−4 + H+, pKa1 = 2.14
- H2PO−4 ⇌ HPO2−4 + H+, pKa2 = 7.20
- HPO2−4 ⇌ PO3−4 + H+, pKa3 = 12.37
The difference between successive pKa values is sufficiently large so that salts of either monohydrogen phosphate, HPO2−4 or dihydrogen phosphate, H2PO−4, can be prepared from a solution of phosphoric acid by adjusting the pH to be mid-way between the respective pK values.
Uses[edit]
The dominant use of phosphoric acid is for fertilizers, consuming approximately 90% of production.[19]
| Application | Demand (2006) in thousands of tons | Main phosphate derivatives |
|---|---|---|
| Soaps and detergents | 1836 | STPP |
| Food industry | 309 | STPP (Na5P3O10), SHMP, TSP, SAPP, SAlP, MCP, DSP (Na2HPO4), H3PO4 |
| Water treatment | 164 | SHMP, STPP, TSPP, MSP (NaH2PO4), DSP |
| Toothpastes | 68 | DCP (CaHPO4), IMP, SMFP |
| Other applications | 287 | STPP (Na3P3O9), TCP, APP, DAP, zinc phosphate (Zn3(PO4)2), aluminium phosphate (AlPO4), H3PO4 |
Food-grade phosphoric acid (additive E338[20]) is used to acidify foods and beverages such as various colas and jams, providing a tangy or sour taste. The phosphoric acid also serves as a preservative.[21] Soft drinks containing phosphoric acid, which would include Coca-Cola, are sometimes called phosphate sodas or phosphates. Phosphoric acid in soft drinks has the potential to cause dental erosion.[22] Phosphoric acid also has the potential to contribute to the formation of kidney stones, especially in those who have had kidney stones previously.[23]
Specific applications of phosphoric acid include:
- in anti-rust treatment by phosphate conversion coating or passivation
- to prevent iron oxidation by means of the Parkerization process
- as an external standard for phosphorus-31 nuclear magnetic resonance
- in phosphoric acid fuel cells
- in activated carbon production[24]
- in compound semiconductor processing, to etch Indium gallium arsenide selectively with respect to indium phosphide[25]
- in microfabrication to etch silicon nitride selectively with respect to silicon dioxide[26]
- in microfabrication to etch aluminum
- as a pH adjuster in cosmetics and skin-care products[27]
- as a sanitizing agent in the dairy, food, and brewing industries[28]
Safety[edit]
Phosphoric acid is not a strong acid. However, at moderate concentrations phosphoric acid solutions are irritating to the skin. Contact with concentrated solutions can cause severe skin burns and permanent eye damage.[29]
A link has been shown between long-term regular cola intake and osteoporosis in later middle age in women (but not men).[30]
See also[edit]
- Phosphate fertilizers, such as ammonium phosphate fertilizers
References[edit]
- ^ Christensen, J. H.; Reed, R. B. (1955). «Design and Analysis Data—Density of Aqueous Solutions of Phosphoric Acid Measurements at 25 °C». Ind. Eng. Chem. 47 (6): 1277–1280. doi:10.1021/ie50546a061.
- ^ «CAMEO Chemicals Datasheet – Phosphoric Acid». Archived from the original on 15 August 2019. Retrieved 15 August 2019.
- ^ «Phosphoric acid». www.chemspider.com. Archived from the original on 12 March 2020. Retrieved 3 March 2020.
- ^ Brown, Earl H.; Whitt, Carlton D. (1952). «Vapor Pressure of Phosphoric Acids». Industrial & Engineering Chemistry. 44 (3): 615–618. doi:10.1021/ie50507a050.
- ^ Seidell, Atherton; Linke, William F. (1952). Solubilities of Inorganic and Organic Compounds. Van Nostrand. Archived from the original on 11 March 2020. Retrieved 2 June 2014.
- ^ a b Haynes, p. 4.80
- ^ «phosphoric acid_msds». Archived from the original on 4 July 2017. Retrieved 2 May 2018.
- ^ a b c d NIOSH Pocket Guide to Chemical Hazards. «#0506». National Institute for Occupational Safety and Health (NIOSH).
- ^ Haynes, p. 5.92
- ^ Haynes, p. 4.134
- ^ Edwards, O. W.; Dunn, R. L.; Hatfield, J. D. (1964). «Refractive Index of Phosphoric Acid Solutions at 25 C.». J. Chem. Eng. Data. 9 (4): 508–509. doi:10.1021/je60023a010.
- ^ Haynes, p. 5.13
- ^ a b c Sigma-Aldrich Co., Phosphoric acid.
- ^ «Phosphoric acid». Immediately Dangerous to Life or Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ^ Westheimer, F.H. (6 June 1987). «Why nature chose phosphates». Science. 235 (4793): 1173–1178 (see pp. 1175–1176). Bibcode:1987Sci…235.1173W. CiteSeerX 10.1.1.462.3441. doi:10.1126/science.2434996. PMID 2434996.
- ^ Becker, Pierre (1988). Phosphates and phosphoric acid. New York: Marcel Dekker. ISBN 978-0824717124.
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. pp. 520–522. ISBN 978-0-08-037941-8.
- ^ Geeson, Michael B.; Cummins, Christopher C. (2020). «Let’s Make White Phosphorus Obsolete». ACS Central Science. 6 (6): 848–860. doi:10.1021/acscentsci.0c00332. PMC 7318074. PMID 32607432.
- ^ Schrödter, Klaus; Bettermann, Gerhard; Staffel, Thomas; Wahl, Friedrich; Klein, Thomas; Hofmann, Thomas (2008). «Phosphoric Acid and Phosphates». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a19_465.pub3.
- ^ «Current EU approved additives and their E Numbers». Foods Standards Agency. 14 March 2012. Archived from the original on 21 August 2013. Retrieved 22 July 2012.
- ^ «Why is phosphoric acid used in some Coca‑Cola drinks?| Frequently Asked Questions | Coca-Cola GB». www.coca-cola.co.uk. Archived from the original on 2 August 2021. Retrieved 31 August 2021.
- ^ Moynihan, P. J. (23 November 2002). «Dietary advice in dental practice». British Dental Journal. 193 (10): 563–568. doi:10.1038/sj.bdj.4801628. PMID 12481178.
- ^ Qaseem, A; Dallas, P; Forciea, MA; Starkey, M; et al. (4 November 2014). «Dietary and pharmacologic management to prevent recurrent nephrolithiasis in adults: A clinical practice guideline from the American College of Physicians». Annals of Internal Medicine. 161 (9): 659–67. doi:10.7326/M13-2908. PMID 25364887.
- ^ Toles, C.; Rimmer, S.; Hower, J. C. (1996). «Production of activated carbons from a washington lignite using phosphoric acid activation». Carbon. 34 (11): 1419. doi:10.1016/S0008-6223(96)00093-0.
- ^ Wet chemical etching. Archived 25 September 2012 at the Wayback Machine umd.edu.
- ^ Wolf, S.; R. N. Tauber (1986). Silicon processing for the VLSI era: Volume 1 – Process technology. p. 534. ISBN 978-0-9616721-6-4.
- ^ «Ingredient dictionary: P». Cosmetic ingredient dictionary. Paula’s Choice. Archived from the original on 18 January 2008. Retrieved 16 November 2007.
- ^ «STAR SAN» (PDF). Five Star Chemicals. Archived (PDF) from the original on 8 February 2016. Retrieved 17 August 2015.
- ^ «Phosphoric Acid, 85 wt.% SDS». Sigma-Aldrich. 5 May 2016. Archived from the original on 18 January 2017. Retrieved 16 January 2017.
- ^ Tucker KL, Morita K, Qiao N, Hannan MT, Cupples LA, Kiel DP (1 October 2006). «Colas, but not other carbonated beverages, are associated with low bone mineral density in older women: The Framingham Osteoporosis Study». American Journal of Clinical Nutrition. 84 (4): 936–942. doi:10.1093/ajcn/84.4.936. PMID 17023723.
Cited sources[edit]
- Haynes, William M., ed. (2011). CRC Handbook of Chemistry and Physics (92nd ed.). CRC Press. ISBN 978-1439855119.
External links[edit]
- National pollutant inventory – Phosphoric acid fact sheet
- NIOSH Pocket guide to chemical hazards
(Redirected from Phosphoric Acid)
This article is about orthophosphoric acid. For other acids commonly called «phosphoric acid», see Phosphoric acids and phosphates.

|
||
|
||
| Names | ||
|---|---|---|
| IUPAC name
Phosphoric acid |
||
| Other names
Orthophosphoric acid |
||
| Identifiers | ||
|
CAS Number |
|
|
|
3D model (JSmol) |
|
|
| ChEBI |
|
|
| ChEMBL |
|
|
| ChemSpider |
|
|
| ECHA InfoCard | 100.028.758 |
|
| EC Number |
|
|
| E number | E338 (antioxidants, …) | |
| KEGG |
|
|
|
PubChem CID |
|
|
| RTECS number |
|
|
| UNII |
|
|
| UN number | 1805 | |
|
CompTox Dashboard (EPA) |
|
|
|
InChI
|
||
|
SMILES
|
||
| Properties | ||
|
Chemical formula |
H3PO4 | |
| Molar mass | 97.994 g·mol−1 | |
| Appearance | Colorless solid | |
| Odor | Odorless | |
| Density | 1.6845 g/cm3 (25 °C, 85%),[1] 1.834 g/cm3 (solid)[2] | |
| Melting point | 40–42.4 °C (104.0–108.3 °F; 313.1–315.5 K)[6] | |
| Boiling point |
|
|
|
Solubility in water |
|
|
| Solubility | Soluble in ethanol | |
| log P | −2.15[7] | |
| Vapor pressure | 0.03 mmHg (20 °C)[8] | |
| Conjugate base | Dihydrogen phosphate | |
|
Magnetic susceptibility (χ) |
−43.8·10−6 cm3/mol[10] | |
|
Refractive index (nD) |
|
|
| Viscosity | 2.4–9.4 cP (85% aq. soln.) 147 cP (100%) |
|
| Structure | ||
|
Crystal structure |
Monoclinic | |
|
Molecular shape |
Tetrahedral | |
| Thermochemistry[12] | ||
|
Heat capacity (C) |
145.0 J/(mol⋅K) | |
|
Std molar |
150.8 J/(mol⋅K) | |
|
Std enthalpy of |
−1271.7 kJ/mol | |
|
Gibbs free energy (ΔfG⦵) |
−1123.6 kJ/mol | |
| Hazards | ||
| GHS labelling: | ||
|
Pictograms |
 [13] [13]
|
|
|
Signal word |
Danger | |
|
Hazard statements |
H290, H314[13] | |
|
Precautionary statements |
P280, P305+P351+P338, P310[13] | |
| NFPA 704 (fire diamond) |
3 0 0 |
|
| Flash point | Non-flammable | |
| Lethal dose or concentration (LD, LC): | ||
|
LD50 (median dose) |
1530 mg/kg (rat, oral)[14] | |
| NIOSH (US health exposure limits): | ||
|
PEL (Permissible) |
TWA 1 mg/m3[8] | |
|
REL (Recommended) |
TWA 1 mg/m3 ST 3 mg/m3[8] | |
|
IDLH (Immediate danger) |
1000 mg/m3[8] | |
| Safety data sheet (SDS) | ICSC 1008 | |
| Related compounds | ||
|
Related phosphorus oxoacids |
|
|
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Phosphoric acid (orthophosphoric acid, monophosphoric acid or phosphoric(V) acid) is a colorless, odorless phosphorus-containing solid, and inorganic compound with the chemical formula H3PO4. It is commonly encountered as an 85% aqueous solution, which is a colourless, odourless, and non-volatile syrupy liquid. It is a major industrial chemical, being a component of many fertilizers.
The compound is an acid. Removal of all three H+ ions gives the phosphate ion PO3−4. Removal of one or two protons gives dihydrogen phosphate ion H2PO−4, and the hydrogen phosphate ion HPO2−4, respectively. Phosphoric acid forms esters, called organophosphates.[15]
The name «orthophosphoric acid» can be used to distinguish this specific acid from other «phosphoric acids», such as pyrophosphoric acid. Nevertheless, the term «phosphoric acid» often means this specific compound; and that is the current IUPAC nomenclature.
Production[edit]
Phosphoric acid is produced industrially by one of two routes, wet processes and dry.[16]
Wet process[edit]
In the wet process, a phosphate-containing mineral such as calcium hydroxyapatite and fluorapatite are treated with sulfuric acid.[17]
- Ca5(PO4)3OH + 5 H2SO4 → 3 H3PO4 + 5 CaSO4 + H2O
- Ca5(PO4)3F + 5 H2SO4 → 3 H3PO4 + 5 CaSO4 + HF
Calcium sulfate (gypsum, CaSO4) is a by-product, which is removed as phosphogypsum. The hydrogen fluoride (HF) gas is streamed into a wet (water) scrubber producing hydrofluoric acid. In both cases the phosphoric acid solution usually contains 23–33% P2O5 (32–46% H3PO4). It may be concentrated to produce commercial- or merchant-grade phosphoric acid, which contains about 54–62% P2O5 (75–85% H3PO4). Further removal of water yields superphosphoric acid with a P2O5 concentration above 70% (corresponding to nearly 100% H3PO4). The phosphoric acid from both processes may be further purified by removing compounds of arsenic and other potentially toxic impurities.
Dry process[edit]
To produce food-grade phosphoric acid, phosphate ore is first reduced with coke in an electric arc furnace, to give elemental phosphorus. Silica is also added, resulting in the production of calcium silicate slag. Elemental phosphorus is distilled out of the furnace and burned with air to produce high-purity phosphorus pentoxide, which is dissolved in water to make phosphoric acid.[18]
Acidic properties[edit]
In aqueous solution phosphoric acid behaves as a triprotic acid.
- H3PO4 ⇌ H2PO−4 + H+, pKa1 = 2.14
- H2PO−4 ⇌ HPO2−4 + H+, pKa2 = 7.20
- HPO2−4 ⇌ PO3−4 + H+, pKa3 = 12.37
The difference between successive pKa values is sufficiently large so that salts of either monohydrogen phosphate, HPO2−4 or dihydrogen phosphate, H2PO−4, can be prepared from a solution of phosphoric acid by adjusting the pH to be mid-way between the respective pK values.
Uses[edit]
The dominant use of phosphoric acid is for fertilizers, consuming approximately 90% of production.[19]
| Application | Demand (2006) in thousands of tons | Main phosphate derivatives |
|---|---|---|
| Soaps and detergents | 1836 | STPP |
| Food industry | 309 | STPP (Na5P3O10), SHMP, TSP, SAPP, SAlP, MCP, DSP (Na2HPO4), H3PO4 |
| Water treatment | 164 | SHMP, STPP, TSPP, MSP (NaH2PO4), DSP |
| Toothpastes | 68 | DCP (CaHPO4), IMP, SMFP |
| Other applications | 287 | STPP (Na3P3O9), TCP, APP, DAP, zinc phosphate (Zn3(PO4)2), aluminium phosphate (AlPO4), H3PO4 |
Food-grade phosphoric acid (additive E338[20]) is used to acidify foods and beverages such as various colas and jams, providing a tangy or sour taste. The phosphoric acid also serves as a preservative.[21] Soft drinks containing phosphoric acid, which would include Coca-Cola, are sometimes called phosphate sodas or phosphates. Phosphoric acid in soft drinks has the potential to cause dental erosion.[22] Phosphoric acid also has the potential to contribute to the formation of kidney stones, especially in those who have had kidney stones previously.[23]
Specific applications of phosphoric acid include:
- in anti-rust treatment by phosphate conversion coating or passivation
- to prevent iron oxidation by means of the Parkerization process
- as an external standard for phosphorus-31 nuclear magnetic resonance
- in phosphoric acid fuel cells
- in activated carbon production[24]
- in compound semiconductor processing, to etch Indium gallium arsenide selectively with respect to indium phosphide[25]
- in microfabrication to etch silicon nitride selectively with respect to silicon dioxide[26]
- in microfabrication to etch aluminum
- as a pH adjuster in cosmetics and skin-care products[27]
- as a sanitizing agent in the dairy, food, and brewing industries[28]
Safety[edit]
Phosphoric acid is not a strong acid. However, at moderate concentrations phosphoric acid solutions are irritating to the skin. Contact with concentrated solutions can cause severe skin burns and permanent eye damage.[29]
A link has been shown between long-term regular cola intake and osteoporosis in later middle age in women (but not men).[30]
See also[edit]
- Phosphate fertilizers, such as ammonium phosphate fertilizers
References[edit]
- ^ Christensen, J. H.; Reed, R. B. (1955). «Design and Analysis Data—Density of Aqueous Solutions of Phosphoric Acid Measurements at 25 °C». Ind. Eng. Chem. 47 (6): 1277–1280. doi:10.1021/ie50546a061.
- ^ «CAMEO Chemicals Datasheet – Phosphoric Acid». Archived from the original on 15 August 2019. Retrieved 15 August 2019.
- ^ «Phosphoric acid». www.chemspider.com. Archived from the original on 12 March 2020. Retrieved 3 March 2020.
- ^ Brown, Earl H.; Whitt, Carlton D. (1952). «Vapor Pressure of Phosphoric Acids». Industrial & Engineering Chemistry. 44 (3): 615–618. doi:10.1021/ie50507a050.
- ^ Seidell, Atherton; Linke, William F. (1952). Solubilities of Inorganic and Organic Compounds. Van Nostrand. Archived from the original on 11 March 2020. Retrieved 2 June 2014.
- ^ a b Haynes, p. 4.80
- ^ «phosphoric acid_msds». Archived from the original on 4 July 2017. Retrieved 2 May 2018.
- ^ a b c d NIOSH Pocket Guide to Chemical Hazards. «#0506». National Institute for Occupational Safety and Health (NIOSH).
- ^ Haynes, p. 5.92
- ^ Haynes, p. 4.134
- ^ Edwards, O. W.; Dunn, R. L.; Hatfield, J. D. (1964). «Refractive Index of Phosphoric Acid Solutions at 25 C.». J. Chem. Eng. Data. 9 (4): 508–509. doi:10.1021/je60023a010.
- ^ Haynes, p. 5.13
- ^ a b c Sigma-Aldrich Co., Phosphoric acid.
- ^ «Phosphoric acid». Immediately Dangerous to Life or Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ^ Westheimer, F.H. (6 June 1987). «Why nature chose phosphates». Science. 235 (4793): 1173–1178 (see pp. 1175–1176). Bibcode:1987Sci…235.1173W. CiteSeerX 10.1.1.462.3441. doi:10.1126/science.2434996. PMID 2434996.
- ^ Becker, Pierre (1988). Phosphates and phosphoric acid. New York: Marcel Dekker. ISBN 978-0824717124.
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. pp. 520–522. ISBN 978-0-08-037941-8.
- ^ Geeson, Michael B.; Cummins, Christopher C. (2020). «Let’s Make White Phosphorus Obsolete». ACS Central Science. 6 (6): 848–860. doi:10.1021/acscentsci.0c00332. PMC 7318074. PMID 32607432.
- ^ Schrödter, Klaus; Bettermann, Gerhard; Staffel, Thomas; Wahl, Friedrich; Klein, Thomas; Hofmann, Thomas (2008). «Phosphoric Acid and Phosphates». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a19_465.pub3.
- ^ «Current EU approved additives and their E Numbers». Foods Standards Agency. 14 March 2012. Archived from the original on 21 August 2013. Retrieved 22 July 2012.
- ^ «Why is phosphoric acid used in some Coca‑Cola drinks?| Frequently Asked Questions | Coca-Cola GB». www.coca-cola.co.uk. Archived from the original on 2 August 2021. Retrieved 31 August 2021.
- ^ Moynihan, P. J. (23 November 2002). «Dietary advice in dental practice». British Dental Journal. 193 (10): 563–568. doi:10.1038/sj.bdj.4801628. PMID 12481178.
- ^ Qaseem, A; Dallas, P; Forciea, MA; Starkey, M; et al. (4 November 2014). «Dietary and pharmacologic management to prevent recurrent nephrolithiasis in adults: A clinical practice guideline from the American College of Physicians». Annals of Internal Medicine. 161 (9): 659–67. doi:10.7326/M13-2908. PMID 25364887.
- ^ Toles, C.; Rimmer, S.; Hower, J. C. (1996). «Production of activated carbons from a washington lignite using phosphoric acid activation». Carbon. 34 (11): 1419. doi:10.1016/S0008-6223(96)00093-0.
- ^ Wet chemical etching. Archived 25 September 2012 at the Wayback Machine umd.edu.
- ^ Wolf, S.; R. N. Tauber (1986). Silicon processing for the VLSI era: Volume 1 – Process technology. p. 534. ISBN 978-0-9616721-6-4.
- ^ «Ingredient dictionary: P». Cosmetic ingredient dictionary. Paula’s Choice. Archived from the original on 18 January 2008. Retrieved 16 November 2007.
- ^ «STAR SAN» (PDF). Five Star Chemicals. Archived (PDF) from the original on 8 February 2016. Retrieved 17 August 2015.
- ^ «Phosphoric Acid, 85 wt.% SDS». Sigma-Aldrich. 5 May 2016. Archived from the original on 18 January 2017. Retrieved 16 January 2017.
- ^ Tucker KL, Morita K, Qiao N, Hannan MT, Cupples LA, Kiel DP (1 October 2006). «Colas, but not other carbonated beverages, are associated with low bone mineral density in older women: The Framingham Osteoporosis Study». American Journal of Clinical Nutrition. 84 (4): 936–942. doi:10.1093/ajcn/84.4.936. PMID 17023723.
Cited sources[edit]
- Haynes, William M., ed. (2011). CRC Handbook of Chemistry and Physics (92nd ed.). CRC Press. ISBN 978-1439855119.
External links[edit]
- National pollutant inventory – Phosphoric acid fact sheet
- NIOSH Pocket guide to chemical hazards
Морфемный разбор слова:
Однокоренные слова к слову:
Ортофосфорная кислота
| Ортофосфорная кислота | |
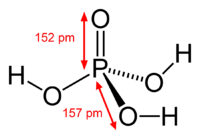 |
|
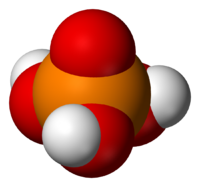 |
|
| Общие | |
|---|---|
| Систематическое наименование | Ортофосфорная кислота |
| Химическая формула | H3PO4 |
| Физические свойства | |
| Состояние (ст. усл.) | твердое |
| Отн. молек. масса | 98,0 а. е. м. |
| Молярная масса | 98,0 г/моль г/моль |
| Плотность | 1,685 (жидк) г/см³ |
| Динамическая вязкость (ст. усл.) | 2,4-9,4 сПуаз Па·с (при 20 °C) |
| Термические свойства | |
| Температура плавления | 42,35 °C |
| Температура кипения | 158 °C |
| Химические свойства | |
| pKa | 2,12, 7,21, 12,67 |
| Растворимость в воде | 548 г/100 мл |
| Классификация | |
| Рег. номер CAS | [7664-38-2] |
При температуре выше 213 °C она превращается в пирофосфорную кислоту H4P2O7. Очень хорошо растворима в воде. Обычно ортофосфорной (или просто фосфорной) кислотой называют 85 % водный раствор (бесцветная сиропообразная жидкость без запаха). Растворима также в этаноле и других растворителях.
Содержание
Получение
Фосфорную кислоту получают из фосфата:
Или взаимодействием с водой оксида фосфора(V), полученного сжиганием фосфора в кислороде:
С водой реакция идет очень бурно, поэтому оксид фосфора(V) обрабатывают нагретым до 200 °C концентрированным раствором ортофосфорной кислоты.
Расплавленная ортофосфорная кислота и ее концентрированные растворы обладают большой вязкостью, что обусловлено образованием межмолекулярных водородных связей.
Свойства
H3PO4 — трехосновная кислота средней силы. При взаимодействии с очень сильной кислотой, например, с хлорной HClO4, фосфорная кислота проявляет признаки амфотерности — образуются соли фосфорила, например [Р(ОН)4]·(ClO4).
Отличительной реакцией ортофосфорной кислоты от других фосфорных кислот является реакция с нитратом серебра — образуется жёлтый осадок:
Качественной реакцией на ион РО4 3− является образование ярко-жёлтого осадка молибденофосфата аммония:
Фосфаты
Соли фосфорной кислоты называются фосфатами. Фосфорная кислота образует одно-, двух- и трехзамещенные соли.



Дигидрофосфаты (однозамещенные фосфаты) имеют кислую реакцию, гидрофосфаты (двузамещенные фосфаты) — слабощелочную, средние (трехзамещенные фосфаты, или просто фосфаты) — щелочную.
Дигидрофосфаты обычно хорошо растворимы в воде, почти все гидрофосфаты и фосфаты растворимы мало. Прокаливание солей приводит к следующим превращениям:

Фосфаты при прокаливании не разлагаются, исключение составляет фосфат аммония (NH4)3PO4.
Органические фосфаты играют очень важную роль в биологических процессах. Фосфаты сахаров участвуют в фотосинтезе. Нуклеиновые кислоты также содержат остаток фосфорной кислоты.
Применение
Используется при пайке в качестве флюса (по окисленой меди, по чёрному металлу, по нержавеющей стали), для исследований в области молекулярной биологии. Применяется также для очищения от ржавчины металлических поверхностей. Образует на обработанной поверхности защитную плёнку, предотвращая дальнейшую коррозию. Также применяется в составе фреонов, в промышленных морозильных установках как связующее вещество.
Пищевая промышленность
Ортофосфорная кислота зарегистрирована в качестве пищевой добавки E338. Применяется как регулятор кислотности в газированных напитках.
Применение ортофосфорной кислоты в сельском хозяйстве. В звероводстве (в частности, при выращивании норок) используют выпойку раствора ортофосфорной кислоты для профилактики повышенного рН желудка и мочекаменной болезни.
Применение ортофосфорной кислоты в стоматологии. Ортофосфорная кислота применяется для снятия зубной эмали перед пломбированием зубов. При применении адгезивных материалов 2 и 3 поколения требуется тотальное протравливание зуба кислотой, с последующим промыванием и просушиванием. Кроме дополнительных временных затрат на проведение данные этапы несут в себе опасность возникновения различных ошибок и осложнений.
При нанесении ортофосфорной кислоты сложно проконтролировать степень и глубину деминерализации дентина и эмали. Это приводит к тому, что нанесенный адгезив не полностью (по всей глубине) заполняет открытые дентинные канальцы, а это в свою очередь не обеспечивает образование полноценного гибридного слоя.
Кроме того, не всегда удается полностью удалить ортофосфорную кислоту после ее нанесения на дентин. Это зависит от того, каким способом сгущена фосфорная кислота. Остатки ортофосфорной кислоты ухудшают прочность бондинга, а также приводят к образованию так называемой «кислотной мины».
Поэтому с появлением адгезивных материалов 5 и 6 поколения ортофосфорная кислота использоваться перестала.
См. также
Примечания
Литература
Ссылки
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Hg2 2+ | Pb 2+ | Sn 2+ | Cu + | Cu 2+ | |
| OH − | P | P | P | — | P | М | Н | М | Н | Н | Н | — | Н | Н | Н | Н | Н | — | — | Н | Н | Н | Н | |
| F − | P | Н | P | P | Р | М | Н | Н | М | Р | Н | Н | Н | Р | Р | М | Р | Р | М | М | Н | Р | Н | Р |
| Cl − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | Н | М | — | Н | Р |
| Br − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | Н | М | Р | H | Р |
| I − | P | P | P | P | Р | Р | Р | Р | Р | Р | ? | Р | — | Р | Р | Р | Р | Н | Н | Н | Н | М | Н | — |
| S 2− | P | P | P | P | — | Р | М | Н | Р | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| SO3 2− | P | P | P | P | Р | М | М | М | Н | ? | ? | М | ? | Н | Н | Н | М | Н | Н | Н | Н | ? | Н | ? |
| SO4 2− | P | P | P | P | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Н | Р | Р | Р |
| NO3 − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | — | Р | Р |
| NO2 − | P | P | P | P | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? | ? | ? |
| PO4 3− | P | Н | P | P | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | ? | Н | Н | Н | Н |
| CO3 2− | М | Р | P | P | Р | Н | Н | Н | Н | — | — | Н | — | Н | Н | — | Н | Н | — | Н | — | — | ? | — |
| CH3COO − | P | Р | P | P | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | М | Р | — | Р | Р |
| CN − | P | Р | P | P | Р | Р | Р | Р | Р | ? | Н | Н | — | Н | Н | Н | Н | Н | Р | Н | Р | — | — | Н |
| SiO3 2− | H | Н | P | P | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | ? | Н | ? | ? | ? |
Полезное
Смотреть что такое «Ортофосфорная кислота» в других словарях:
ОРТОФОСФОРНАЯ КИСЛОТА — ОРТОФОСФОРНАЯ КИСЛОТА, то же, что фосфорная кислота … Современная энциклопедия
ортофосфорная кислота — ortofosfato rūgštis statusas T sritis chemija formulė H₃PO₄ atitikmenys: angl. orthophosphoric acid; phosphoric acid rus. ортофосфорная кислота; фосфорная кислота ryšiai: sinonimas – vandenilio tetraoksofosfatas (3–) sinonimas – fosforo rūgštis … Chemijos terminų aiškinamasis žodynas
ортофосфорная кислота — Е338 – ортофосфорная кислота. В зависимости от концентрации применяют для производства фосфорных удобрений, в пищевой, текстильной, стекольной промышленности. Пропитка древесины ортофосфорной кислотой и ее солями делают дерево негорючим. На этой… … Универсальный дополнительный практический толковый словарь И. Мостицкого
ортофосфорная кислота — то же, что фосфорная кислота … Энциклопедический словарь
ОРТОФОСФОРНАЯ КИСЛОТА — то же, что фосфорная кислота … Естествознание. Энциклопедический словарь
ортофосфорная кислота — фосфорная кислота … Cловарь химических синонимов I
Ортофосфорная кислота — см. Фосфор … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Кислота — У этого термина существуют и другие значения, см. Кислота (значения) … Википедия
фосфорная кислота — ортофосфорная кислота … Cловарь химических синонимов I
Источник
Ортофосфорная кислота
| Ортофосфорная кислота | |
|---|---|
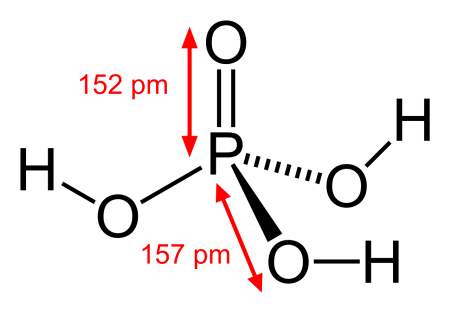 |
|
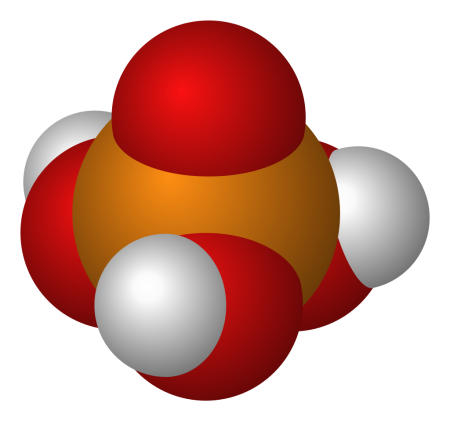 |
|
| Систематическое наименование |
Ортофосфорная кислота |
| Хим. формула | H3PO4 |
| Состояние | твёрдое |
| Молярная масса | 98,0 г/моль |
| Плотность | 1,685 (жидк) |
| Динамическая вязкость | 2,4-9,4 сПуаз |
| Т. плав. | +42,35 °C |
| Т. кип. | +158 °C |
| Давление пара | 0,03 ± 0,01 мм рт.ст. |
| pKa | 2,12; 7,21; 12,67 |
| Растворимость в воде | 548 г/100 мл |
| ГОСТ | ГОСТ 10678-76 ГОСТ 6552-80 |
| Рег. номер CAS | 7664-38-2 |
| PubChem | 1004 |
| Рег. номер EINECS | 231-633-2 |
| SMILES | |
| Кодекс Алиментариус | E338 |
| RTECS | TB6300000 |
| ChEBI | 26078 |
| Номер ООН | 1805 |
| ChemSpider | 979 |
| Сигнальное слово | Опасно |
| Пиктограммы СГС |  |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. |
Ортофосфорная кислота (фосфорная кислота) — неорганическая кислота средней силы с химической формулой H3PO4, которая при стандартных условиях представляет собой бесцветные гигроскопичные кристаллы. Обычно ортофосфорной (или просто фосфорной) кислотой называют 85 %-й водный раствор (бесцветная сиропообразная жидкость без запаха). Растворима в этаноле и других растворителях.
Содержание
Физические свойства
В чистом виде фосфорная кислота представляет собой бесцветное кристаллическое вещество с температурой плавления 42,35 °С. Кристаллы имеют моноклинную сингонию. Твёрдая фосфорная кислота гигроскопична и расплывается на воздухе; она смешивается с водой во всех соотношениях, но коммерчески обычно доступна в трёх концентрациях:
Из 85 %-ой фосфорной кислоты можно получить безводную при испарении воды в вакууме при 80 °С. Из концентрированных растворов она осаждается в виде гемигидрата H3PO4·0,5H2O.
В твёрдом состоянии и концентрированных растворах между молекулами фосфорной кислоты существуют водородные связи. При снижении концентрации до 40-50 % более устойчивой является водородная связь между фосфат-анионами и молекулами воды. Также в растворах фосфорная кислота обменивается атомами кислорода с водой.
Химические свойства
Фосфорная кислота — трёхосновная кислота средней силы. В водных растворах она подвергается диссоциации по трём ступеням c константами диссоциации K1 = 7,1⋅10 –3 (pKa1 2,12); K2 = 6,2⋅10 –8 (pKa2 7,20); K3 = 5,0⋅10 –13 (pKa3 12,32). Экзотермична только диссоциация по первой ступени; по второй и третьей ступени она эндотермична.
| H3PO4(aq) + H2O(l) ⇌ H3O(aq) + + H2PO4(aq) − |
| H2PO4(aq) − + H2O(l) ⇌ H3O(aq)+ + HPO4(aq) 2− |
| HPO4(aq) 2− + H2O(l) ⇌ H3O(aq) + + PO4(aq) 3− |
Как следствие, фосфорная кислота может образовывать как средние (фосфаты), так и кислые соли (гидрофосфаты и дигидрофосфаты). Однако при нормальных условиях она малоактивна и вступает в реакции только с карбонатами, гидроксидами и некоторыми металлами. Выше 80 °С фосфорная кислота реагирует также с неактивными оксидами, кремнезёмом и силикатами. Также фосфаты образуются в процессе фосфатирования, при помощи которого чёрные и цветные металлы покрывают защитной плёнкой для улучшения их характеристик.
Нагревание фосфорной кислоты приводит к отщеплению воды с образованием пирофосфорной кислоты и метафосфорной кислоты:
Отличительной реакцией ортофосфорной кислоты от других фосфорных кислот является реакция с нитратом серебра: при этом образуется жёлтый осадок, тогда как другие фосфорные кислоты дают белый осадок:
Качественной реакцией на ион H2PO4 − является образование ярко-жёлтого осадка молибденофосфата аммония:
H3PO4 + 12[NH4]2MoO4 + 21HNO3 → [NH4]3PMo12O40 ⋅ 6H2O↓ + 21NH4NO3 + 6H2O 
Получение
Впервые фосфорную кислоту из оксида фосфора(V) получил Роберт Бойль в 1694 году. Лабораторный метод получения заключается в окислении фосфора азотной кислотой:
Термический способ
В промышленности используют два основных способа получения фосфорной кислоты: термический и экстракционный. Термический способ заключается в сжигании фосфора до оксида фосфора(V) и реакции последнего с водой:
Технически этот процесс реализуется по-разному. В так называемом IG-процессе (от названия фирмы IG) обе реакции проводятся в одной реакционной колонне. Сверху в неё сжатым воздухом или паром под давлением 1,5 МПа через сопло подаётся фосфор, который сгорает при температуре >2000 °C. Полученный оксид фосфора(V) поглощается фосфорной кислотой, которая стекает сверху по стенкам колонны, целиком покрывая их. При этом она одновременно выполняет несколько функций: растворяет оксид фосфора(V), отводит теплоту из реакции сгорания и защищает стенки колонны от пламени. Полученная фосфорная кислота собирается под колонной, пропускается через теплообменник и подаётся в верхнюю часть колонны, откуда снова стекает по стенкам. Материалом для установки по получению фосфорной кислоты служит нержавеющая сталь с низким содержанием углерода. До 100 °C она устойчива к концентрированной фосфорной кислоте.
Получаемая этим способом фосфорная кислота практически не содержит примесей соединений фосфора в низших степенях окисления (содержание фосфористой кислоты H3PO3 составляет всего 0,1 %). Однако её необходимо очистить от примесного мышьяка, который в низких концентрациях содержится даже в очень чистом фосфоре. Эта очистка осуществляется воздействием сероводорода (для его получения в фосфорную кислоту вводят сульфид натрия) и осаждением сульфида мышьяка с последующим фильтрованием.
На этих реакциях основан также TVA-процесс (от Tennessee Valley Authority ), однако сжигание фосфора и поглощение оксида фосфора(V) проводится отдельно. Фосфор и воздух подаются в стальную камеру сгорания с внешним охлаждением, после чего продукты сгорания через верхнюю часть камеры подпадают в камеру поглощения, где и образуется фосфорная кислота. В Хёхст-процессе (от названия фирмы Hoechst) сгорание и поглощение проводятся отдельно, однако он отличается тем, что теплота сгорания фосфора там используется для генерирования пара.
Экстракционный способ
Экстракционный способ производства фосфорной кислоты заключается в обработке природных фосфатов неорганическими кислотами (в странах СНГ преимущественно хибинского апатитового концентрата и фосфоритов Каратау). Фосфаты обрабатывали серной кислотой ещё в середине 1880-х гг., однако развитие этой области началось после Второй мировой войны благодаря повышенному спросу на минеральные удобрения.
Разложение сырья происходит по следующей схеме (x от 0,1 до 2,2):
Побочным продуктом этой реакции является сульфат кальция, который в зависимости от температуры и концентрации фосфорной кислоты может выпадать в виде дигидрата (CaSO4·2H2O) или гемигидрата (CaSO4·0,5H2O). По этому признаку экстракционные процессы получения фосфорной кислоты делят на дигидратные, гемигидратные и комбинированные (дигидратно-гемигидратный и гемигидратно-дигидратный). Существует также ангидритный метод (с осаждением безводного сульфата кальция), который, однако, в промышленности не используется, так как он связан с серьёзными коррозионными проблемами.
Дигидратный процесс является классическим методом получения фосфорной кислоты. Его преимущества заключаются в относительно низкой температуре, благодаря чему удаётся избежать коррозии. Кроме того, можно использовать различное фосфатное сырьё и перерабатывать его в больших количествах. Для начала сырьё измельчают до размера частиц меньше 150 мкм. Фосфат и серная кислота подаются в реактор по отдельности, чтобы образование слоя сульфата кальция на частицах не затрудняло дальнейшего разложения. Температура процесса составляет 70-80 °С, а концентрация фосфорной кислоты в системе равна 28-31 % в пересчёте на P2O5. В этих условиях сульфат кальция образуется в виде дигидрата. Недостатком метода является то, что исходное сырьё необходимо перемалывать, а полученную фосфорную кислоту дополнительно концентрировать до 40-55 % и даже до 70 % P2O5.
Гемигидратный процесс был разработан для того, чтобы избежать необходимости концентрирования полученной фосфорной кислоты. Он проводится при более высокой температуре (80-100 °С) — в условиях, когда более устойчивой формой является гемигидрат сульфата кальция. Фосфорная кислота при этом получается в концентрации 40-48 %. Гемигидратно-дигидратный процесс разработан в Японии в связи с тем, что он позволяет получать практически чистый гипс, залежи которого в этой стране отсутствуют. Обработка сырья ведётся при высокой температуре, и образуется гемигидрат сульфата кальция, однако затем его перекристаллизовывают в дигидрат.
Концентрирование и очистка
Для концентрирования фосфорной кислоты, полученной дигидратным процессом, используют вакуумное испарение, хотя на старых заводах до сих пор применяют погружное горение. Иногда используют последовательно несколько испарителей, так что пары с одного испарителя используются для нагрева раствора в следующем испарителе. Кроме того, при испарении воды из фосфорной кислоты также удаляется фтор в виде смеси SiF4 и HF. Так, при повышении концентрации фосфорной кислоты с 30 до 50 % P2O5 из неё удаляется 50-60 % фтора. Поскольку выбросы фтора регулируются законами, эти вещества направляют на производство кремнефтористоводородной кислоты H2SiF6.
Разнообразные неорганические примеси удаляют осаждением и экстракцией. Осаждать необходимо примеси мышьяка (в виде сульфида мышьяка), кадмия (в виде комплекса с эфирами дитиофосфорной кислоты), а также примеси катионных металлов (обработкой гидроксидом натрия). Экстракция основана на переводе фосфорной кислоты в органическую фазу и промывках водой, разбавленной фосфорной кислотой и растворами фосфатов. При этом удаляются как катионные, так и анионные примеси. Сама фосфорная кислота отделяется от растворителя перегонкой. В качестве растворителей используют бутанол-1, амиловый спирт, метилизобутилкетон, трибутилфосфат, диизопропиловый эфир и др.
Экономические и экологические аспекты
Мировая потребность в фосфорной кислоте по состоянию на 1989 г. оценивается в 40,6 млн тонн в год в пересчёте на P2O5. Экстракционный способ производства является преобладающим (95 % от общего количества), поскольку он потребляет меньше энергии. Остальные 5 % производятся термическим способом. Основным производителем (и потребителем) экстракционной фосфорной кислоты являются США: их доля от общего производства фосфорной кислоты составляет 90 %.
В 1980-е гг. произошло сокращение производства фосфорной кислоты из-за отказа от фосфорсодержащих детергентов и минеральных удобрений. Это было связано с загрязнением фосфатными удобрениями грунтовых вод и эвтрофикацией водоёмов.
Экстракционное производство фосфорной кислоты связано с образованием отвалов сульфата кальция: на 1 т P2O5 производится 4,5-5,5 т загрязнённого сульфата кальция, который необходимо утилизировать. По состоянию на 2008 год существует три варианта:
При затоплении в водоёмах сульфат кальция быстро растворяется: его растворимость в морской воде составляет 3,5 г/л, а природное содержание — 1,6 г/л. Примеси оксида кремния и оксида алюминия остаются нерастворёнными. Загрязнение воды тяжёлыми металлами мало по сравнению с существующими концентрациями, однако загрязнение кадмием значительно.
Применение
Используется при пайке в качестве флюса (по окисленной меди, по чёрному металлу, по нержавеющей стали), для исследований в области молекулярной биологии. Применяется также для очищения от ржавчины металлических поверхностей. Образует на обработанной поверхности защитную плёнку, предотвращая дальнейшую коррозию. Также применяется в составе фреонов, в промышленных морозильных установках как связующее вещество.
Авиационная промышленность
В авиационной промышленности ортофосфорная кислота используется в составе гидрожидкости НГЖ-5У и её иностранных аналогов.
Пищевая промышленность
Ортофосфорная кислота зарегистрирована в качестве пищевой добавки E338. Применяется как регулятор кислотности в газированных напитках, например в Кока-Коле. По вкусу подслащённые слабые водные растворы ортофосфорной кислоты напоминают крыжовник.
Сельское хозяйство
В звероводстве (в частности, при выращивании норок) используют выпойку раствора ортофосфорной кислоты для профилактики повышенного pH желудка и мочекаменной болезни.
Также ее применяют в гидропонных системах для регулировки уровня pH питательного раствора.
Стоматология
Ортофосфорная кислота применяется для протравливания (снятия смазанного слоя) эмали и дентина перед пломбированием зубов. При применении адгезивных материалов 2-го и 3-го поколений требуется протравливание эмали зуба кислотой с последующим промыванием и просушиванием. Кроме дополнительных временных затрат на проведение, данные этапы несут в себе опасность возникновения различных ошибок и осложнений.
При нанесении ортофосфорной кислоты сложно проконтролировать степень и глубину деминерализации дентина и эмали. Это приводит к тому, что нанесённый адгезив не полностью (не по всей глубине) заполняет открытые дентинные канальцы, а это в свою очередь не обеспечивает образование полноценного гибридного слоя.
Кроме того, не всегда удаётся полностью удалить ортофосфорную кислоту после её нанесения на дентин. Это зависит от того, каким способом сгущена фосфорная кислота. Остатки ортофосфорной кислоты ухудшают прочность связывания, а также приводят к образованию так называемой «кислотной мины».
С появлением адгезивных материалов 4-го и 5-го поколений стали использовать технику тотального протравливания (дентин — эмаль). В адгезивных системах 6-го и 7-го поколений отдельный этап протравливания кислотой отсутствует, так как адгезивы являются самопротравливающимися. Однако некоторые производители всё же рекомендуют для усиления адгезии кратковременно протравливать эмаль даже при использовании самопротравливающих адгезивов.
Безопасность
Фосфорная кислота не оказывает специфического токсического действия. Системная токсичность низкая. Её растворы раздражают глаза, дыхательные пути и слизистые оболочки. При концентрации > 10 % она оказывает раздражающее действие, а выше 25 % — также коррозионное. При глотании большого количества возникает тошнота, рвота, диарея, кровавая рвота и гиповолемический шок. Концентрированные растворы вызывают ожоги слизистой оболочки рта, пищевода и желудка. При попадании рекомендуется промыть кожу или промыть глаза тёплой водой или физиологическим раствором. При глотании фосфорной кислоты в качестве первой помощи необходимо поддерживать дыхание и внутривенно восполнять жидкость.
У добровольцев, получавших фосфорную кислоту перорально в количестве 2-4 г/кг в день в течение 10 дней или 3,9 г/кг в день в течение 14 дней, не обнаружено негативных для метаболизма последствий. Допускается использовать 0,5–1 г/л фосфорной кислоты в напитках.
Источник
Теперь вы знаете какие однокоренные слова подходят к слову Как пишется ортофосфорная кислота, а так же какой у него корень, приставка, суффикс и окончание. Вы можете дополнить список однокоренных слов к слову «Как пишется ортофосфорная кислота», предложив свой вариант в комментариях ниже, а также выразить свое несогласие проведенным с морфемным разбором.
| Ортофосфорная кислота | |
 |
|
 |
|
| Общие | |
|---|---|
| Систематическое наименование | Ортофосфорная кислота |
| Химическая формула | H3PO4 |
| Физические свойства | |
| Состояние (ст. усл.) | твердое |
| Отн. молек. масса | 98,0 а. е. м. |
| Молярная масса | 98,0 г/моль г/моль |
| Плотность | 1,685 (жидк) г/см³ |
| Динамическая вязкость (ст. усл.) | 2,4-9,4 сПуаз Па·с (при 20 °C) |
| Термические свойства | |
| Температура плавления | 42,35 °C |
| Температура кипения | 158 °C |
| Химические свойства | |
| pKa | 2,12, 7,21, 12,67 |
| Растворимость в воде | 548 г/100 мл |
| Классификация | |
| Рег. номер CAS | [7664-38-2] |
Ортофо́сфорная кислота́ (фо́сфорная кислота́)[1] — неорганическая кислота средней силы, с химической формулой H3PO4, которая при стандартных условиях представляет собой бесцветные гигроскопичные кристаллы.
При температуре выше 213 °C она превращается в пирофосфорную кислоту H4P2O7. Очень хорошо растворима в воде. Обычно ортофосфорной (или просто фосфорной) кислотой называют 85 % водный раствор (бесцветная сиропообразная жидкость без запаха). Растворима также в этаноле и других растворителях.
Получение
Фосфорную кислоту получают из фосфата:
Можно получить гидролизом пентахлорида фосфора:
Или взаимодействием с водой оксида фосфора(V), полученного сжиганием фосфора в кислороде:
С водой реакция идет очень бурно, поэтому оксид фосфора(V) обрабатывают нагретым до 200 °C концентрированным раствором ортофосфорной кислоты.
Расплавленная ортофосфорная кислота и ее концентрированные растворы обладают большой вязкостью, что обусловлено образованием межмолекулярных водородных связей.
Свойства
H3PO4 — трехосновная кислота средней силы. При взаимодействии с очень сильной кислотой, например, с хлорной HClO4, фосфорная кислота проявляет признаки амфотерности — образуются соли фосфорила, например [Р(ОН)4]·(ClO4).
Отличительной реакцией ортофосфорной кислоты от других фосфорных кислот является реакция с нитратом серебра — образуется жёлтый осадок:
Качественной реакцией на ион РО43− является образование ярко-жёлтого осадка молибденофосфата аммония:
Фосфаты
Соли фосфорной кислоты называются фосфатами. Фосфорная кислота образует одно-, двух- и трехзамещенные соли.
-
(дигидрофосфат натрия)
(гидрофосфат натрия)
(фосфат натрия)
Дигидрофосфаты (однозамещенные фосфаты) имеют кислую реакцию, гидрофосфаты (двузамещенные фосфаты) — слабощелочную, средние (трехзамещенные фосфаты, или просто фосфаты) — щелочную.
Дигидрофосфаты обычно хорошо растворимы в воде, почти все гидрофосфаты и фосфаты растворимы мало. Прокаливание солей приводит к следующим превращениям:
Фосфаты при прокаливании не разлагаются, исключение составляет фосфат аммония (NH4)3PO4.
Органические фосфаты играют очень важную роль в биологических процессах. Фосфаты сахаров участвуют в фотосинтезе. Нуклеиновые кислоты также содержат остаток фосфорной кислоты.
Применение
Используется при пайке в качестве флюса (по окисленой меди, по чёрному металлу, по нержавеющей стали), для исследований в области молекулярной биологии. Применяется также для очищения от ржавчины металлических поверхностей. Образует на обработанной поверхности защитную плёнку, предотвращая дальнейшую коррозию. Также применяется в составе фреонов, в промышленных морозильных установках как связующее вещество.
Пищевая промышленность
Ортофосфорная кислота зарегистрирована в качестве пищевой добавки E338. Применяется как регулятор кислотности в газированных напитках.
Применение ортофосфорной кислоты в сельском хозяйстве. В звероводстве (в частности, при выращивании норок) используют выпойку раствора ортофосфорной кислоты для профилактики повышенного рН желудка и мочекаменной болезни.
Применение ортофосфорной кислоты в стоматологии. Ортофосфорная кислота применяется для снятия зубной эмали перед пломбированием зубов. При применении адгезивных материалов 2 и 3 поколения требуется тотальное протравливание зуба кислотой, с последующим промыванием и просушиванием. Кроме дополнительных временных затрат на проведение данные этапы несут в себе опасность возникновения различных ошибок и осложнений.
При нанесении ортофосфорной кислоты сложно проконтролировать степень и глубину деминерализации дентина и эмали. Это приводит к тому, что нанесенный адгезив не полностью (по всей глубине) заполняет открытые дентинные канальцы, а это в свою очередь не обеспечивает образование полноценного гибридного слоя.
Кроме того, не всегда удается полностью удалить ортофосфорную кислоту после ее нанесения на дентин. Это зависит от того, каким способом сгущена фосфорная кислота. Остатки ортофосфорной кислоты ухудшают прочность бондинга, а также приводят к образованию так называемой «кислотной мины».
Поэтому с появлением адгезивных материалов 5 и 6 поколения ортофосфорная кислота использоваться перестала.
См. также
- Фосфорные кислоты
- Фосфор
Примечания
Литература
- Карапетьянц М. Х. Дракин С. И. Общая и неорганическая химия. М.: Химия1994
- Блум У. Адгезивные системы обзор и сравнение// Дент. Арт.- 2003,№ 2.-С.5-11.
- Давыдова А. В. Характеристика адгезивных систем// Материалы научно-практической конференции «Новые технологии в стоматологии».- Ростов на Дону, 2004.-С.45-46
- Enamel-dentin adhesives, self-etching primers// CRA Newsletter.- Vol.24,№ 11.-2000.-P.1-2.
Ссылки
Фосфорная кислота
Фосфорные кислоты — соединения фосфора в степени окисления +5, имеющие общую формулу P2O5·nH2O.
При взаимодействии высшего оксида фосфора с водой на холоде получается метафосфорная кислота HPO3, представляющая собой прозрачную стекловидную массу. При разбавлении её водой образуется ортофосфорная кислота H3PO4.
При нагревании до 200—250 °C ортофосфорная кислота обезвоживается, и образуется пирофосфорная кислота H4P2O7, в результате дальнейшей дегидратации которой при 400—500 °C вновь образуется метафосфорная кислота.
и еще:
Orthophosphoric acid H3PO4
Pyrophosphoric acid H4P2O7
Tripolyphosphoric acid H5P3O10
Tetrapolyphosphoric acid H6P4O13
Trimetaphosphoric acid H3P3O9
Ортофосфорная кислота является неорганической кислотой средней силы.
Ее химическая формула – H3PO4, обозначение в качестве пищевой добавки – Е338.
Ортофосфорная кислота представляет собой бесцветные гигроскопичные кристаллы, хорошо растворимые в воде (как правило, ортофосфорной кислотой называют ее 85%-ный раствор).
Получение ортофосфорной кислоты
Получение ортофосфорной кислоты происходит:
- Гидролизом пентахлорида фосфора;
- Из фосфата;
- Взаимодействием оксида фосфора(V) с водой.
Свойства ортофосфорной кислоты
Основным свойством ортофосфорной кислоты является ее воздействие на кислотно-щелочной баланс организма, что приводит к увеличению кислотности.
Повышенная кислотность увеличивает риск развития многих заболеваний, включая кариес и ранний остеопороз.
Еще одним свойством ортофосфорной кислоты (в высоких концентрациях) является ее способность вызывать ожоги. Пары этой кислоты могут вызвать носовые кровотечения и атрофические процессы в слизистой носа, а в некоторых случаях могут привести к разрушению зубов и изменению формулы крови.
Взаимодействие ортофосфорной кислоты
Взаимодействие ортофосфорной кислоты происходит с:
- Металлами;
- Основными оксидами;
- Основаниями;
- Аммиаком;
- Солями слабых кислот.
Применение ортофосфорной кислоты
Ортофосфорная кислота широко используется в различных целях:
- Для очищения от ржавчины металлических поверхностей. Также она способствует дальнейшему предотвращению образования коррозии;
- В качестве флюса при пайке;
- В сельском хозяйстве – для производства минеральных удобрений;
- В составе фреонов (в промышленных морозильных установках);
- Для исследований в области молекулярной биологии;
- В производстве бытовых синтетических чистящих, моющих и смягчающих средств;
- В авиационной промышленности (в составе гидрожидкостей).
Применение ортофосфорной кислоты в медицине
Ортофосфорная кислота широко применяется в стоматологии при пломбировании зубов. Ею протравливают зубную эмаль перед процедурой.
Основной сложностью является невозможность проконтролировать глубину и степень деминерализации дентина и эмали, а также ее полное удаление перед началом пломбировки. Остатки ортофосфорной кислоты могут привести к снижению прочности бондинга и образованию «кислотной мины».
Также в незначительных количествах ортофосфорная кислота применяется в составах отбеливателей для зубов.
Применение ортофосфорной кислоты (Е338) в пищевой промышленности
Е338 (ортофосфорная кислота) относится к группе антиоксидантов – добавок, защищающих продукты питания от окисления и изменения цвета.
Ортофосфорная кислота применяется для подкисления продуктов питания и напитков. Она обеспечивает острый или кислый вкус. От природных подкислителей, например, лимонной кислоты, ее отличают низкая стоимость и легкость получения, что позволяет ее широко использовать при изготовлении:
- Хлебопекарных порошков;
- Плавленых сыров;
- Колбас;
- Сахара;
- Ароматизированных напитков – кока-колы, пепси-колы, спрайта.
Хотя ортофосфорная кислота как пищевая добавка разрешена к применению в большинстве стран, в результате многих исследований было установлено ее вредное воздействие на организм. Так, она нарушает кислотно-щелочной баланс, увеличивая его кислотность. Это может провоцировать развитие различных заболеваний, например, кариеса и остеопороза.
Частое употребление ортофосфорной кислоты в составе различных продуктов может вызывать нарушения работы пищеварения – рвоту, тошноту. Также длительное применение продуктов с этой пищевой добавкой может привести к отвращению к пище и потере веса.
Понравилась статья? Поделись с друзьями.
Ортофосфорная кислота (или, если использовать более привычный разговорный термин: фосфорная кислота) — это неорганическое соединение (H3PO4), которое в твердом виде представляет собой бесцветные кристаллы.
В промышленности чаще используют водные растворы H3PO4, (75% или 85%), которые и называют ортофосфорной кислотой. Это жидкость без запаха, по вязкости напоминающая сироп.
Ортофосфорная кислота зарегистрирована как пищевая добавка (Е338) и применяется во многих сферах хозяйственной деятельности человека.
В пищевой промышленности она востребована как регулятор кислотности, используется в производстве разнообразных газированных, шипучих напитков.
В сельском хозяйстве фосфорная кислота необходима, как важный компонент, применяющийся при изготовлении технических фосфатов, а также удобрений — фосфорных или комплексных.
В металлообработке ортофосфорная кислота служит как состав для очистки поверхностей от ржавчины, в холодильной промышленности — выступает компонентом фреонов для морозильных установок, в стоматологии — долгое время находила широкое применение, например, для снятия эмали перед пломбировкой, для приготовления зубного цемента.
Компания «Аквахим» реализует ортофосфорную кислоту (улучшенную, пищевую) для нужд промышленной и пищевой химии. Фасовка продукта: канистры по 10 и 20 литров, либо кубы.
Все вопросы по техническим характеристикам продукции, возможности ее заказа в нужных объемах и срокам поставок — задавайте нашим менеджерам-консультантам. Звоните или пишите в отдел продаж компании «Аквахим» в любой рабочий день, ждем Вас!
Быстрая навигация по каталогу
Координаты ООО «Аквахим»:
Тел.: 8 (495) 544-76-82
Адрес склада: Московская область,
пос. Старая Купавна, ул. Дорожная, д.4, к.1
Определение и формула ортофосфорной кислоты
Плавится без разложения (42,35oC). В жидком состоянии склонна к переохлаждению, при умеренном нагревании разлагается. Хорошо растворяется в воде. Является слабой кислотой.
Рис. 1. Ортофосфорная кислота. Внешний вид.
Химическая формула ортофосфорной кислоты
Химическая формула ортофосфорной кислоты H3PO4. Она показывает, что в состав данной молекулы входят три атома водорода (Ar = 1 а.е.м.), один атом фосфора (Ar = 31 а.е.м.) и четыре атома кислорода (Ar = 16 а.е.м.). По химической формуле можно вычислить молекулярную массу ортофосфорной кислоты:
Mr(H3PO4) = 3×Ar(H) + Ar(P) + 4×Ar(O);
Mr(H3PO4) = 3×1 + 31 + 4×16= 3 + 31 + 64 = 98
Графическая (структурная) формула ортофосфорной кислоты
Структурная (графическая) формула ортофосфорной кислоты является более наглядной. Она показывает то, как связаны атомы между собой внутри молекулы:
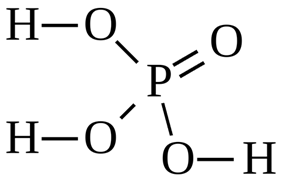
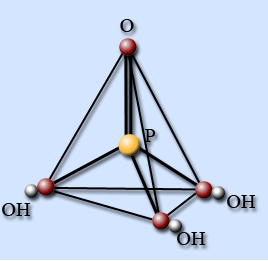
В зависимости от того, в каком агрегатном состоянии находится ортофосфорная кислота, её молекула может принимать в пространстве различную форму. Например, в газовой фазе это тетраэдр (рис. 2), а в кристаллической форме – молекулы состава PO(OH)3, которые связаны между собой водородными связями в двухмерные слои.
Рис. 2. Пространственное строение молекулы ортофосфорной кислоты.
Ионная формула
Ортофосфорная кислота представляет собой трехосновную кислоту, которая подвергается ступенчатой диссоциации в водном растворе согласно следующим уравнениям реакции:
H3PO4 ↔ H+ + H2PO4—;
H2PO4— ↔ H+ + HPO42-;
HPO42- ↔ H+ + PO43-
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |
| Ортофосфорная кислота | |
 |
|
 |
|
| Общие | |
|---|---|
| Систематическое наименование | Ортофосфорная кислота |
| Химическая формула | H3PO4 |
| Физические свойства | |
| Состояние (ст. усл.) | твердое |
| Отн. молек. масса | 98,0 а. е. м. |
| Молярная масса | 98,0 г/моль г/моль |
| Плотность | 1,685 (жидк) г/см³ |
| Динамическая вязкость (ст. усл.) | 2,4-9,4 сПуаз Па·с (при 20 °C) |
| Термические свойства | |
| Температура плавления | 42,35 °C |
| Температура кипения | 158 °C |
| Химические свойства | |
| pKa | 2,12, 7,21, 12,67 |
| Растворимость в воде | 548 г/100 мл |
| Классификация | |
| Рег. номер CAS | [7664-38-2] |
Ортофо́сфорная кислота́ (фо́сфорная кислота́)[1] — неорганическая кислота средней силы, с химической формулой H3PO4, которая при стандартных условиях представляет собой бесцветные гигроскопичные кристаллы.
При температуре выше 213 °C она превращается в пирофосфорную кислоту H4P2O7. Очень хорошо растворима в воде. Обычно ортофосфорной (или просто фосфорной) кислотой называют 85 % водный раствор (бесцветная сиропообразная жидкость без запаха). Растворима также в этаноле и других растворителях.
Содержание
- 1 Получение
- 2 Свойства
- 3 Фосфаты
- 4 Применение
- 4.1 Пищевая промышленность
- 5 См. также
- 6 Примечания
- 7 Литература
- 8 Ссылки
Получение
Фосфорную кислоту получают из фосфата:
Можно получить гидролизом пентахлорида фосфора:
Или взаимодействием с водой оксида фосфора(V), полученного сжиганием фосфора в кислороде:
С водой реакция идет очень бурно, поэтому оксид фосфора(V) обрабатывают нагретым до 200 °C концентрированным раствором ортофосфорной кислоты.
Расплавленная ортофосфорная кислота и ее концентрированные растворы обладают большой вязкостью, что обусловлено образованием межмолекулярных водородных связей.
Свойства
H3PO4 — трехосновная кислота средней силы. При взаимодействии с очень сильной кислотой, например, с хлорной HClO4, фосфорная кислота проявляет признаки амфотерности — образуются соли фосфорила, например [Р(ОН)4]·(ClO4).
Отличительной реакцией ортофосфорной кислоты от других фосфорных кислот является реакция с нитратом серебра — образуется жёлтый осадок:
Качественной реакцией на ион РО43− является образование ярко-жёлтого осадка молибденофосфата аммония:
Фосфаты
Соли фосфорной кислоты называются фосфатами. Фосфорная кислота образует одно-, двух- и трехзамещенные соли.
-
(дигидрофосфат натрия)
(гидрофосфат натрия)
(фосфат натрия)
Дигидрофосфаты (однозамещенные фосфаты) имеют кислую реакцию, гидрофосфаты (двузамещенные фосфаты) — слабощелочную, средние (трехзамещенные фосфаты, или просто фосфаты) — щелочную.
Дигидрофосфаты обычно хорошо растворимы в воде, почти все гидрофосфаты и фосфаты растворимы мало. Прокаливание солей приводит к следующим превращениям:
Фосфаты при прокаливании не разлагаются, исключение составляет фосфат аммония (NH4)3PO4.
Органические фосфаты играют очень важную роль в биологических процессах. Фосфаты сахаров участвуют в фотосинтезе. Нуклеиновые кислоты также содержат остаток фосфорной кислоты.
Применение
Используется при пайке в качестве флюса (по окисленой меди, по чёрному металлу, по нержавеющей стали), для исследований в области молекулярной биологии. Применяется также для очищения от ржавчины металлических поверхностей. Образует на обработанной поверхности защитную плёнку, предотвращая дальнейшую коррозию. Также применяется в составе фреонов, в промышленных морозильных установках как связующее вещество.
Пищевая промышленность
Ортофосфорная кислота зарегистрирована в качестве пищевой добавки E338. Применяется как регулятор кислотности в газированных напитках.
Применение ортофосфорной кислоты в сельском хозяйстве. В звероводстве (в частности, при выращивании норок) используют выпойку раствора ортофосфорной кислоты для профилактики повышенного рН желудка и мочекаменной болезни.
Применение ортофосфорной кислоты в стоматологии. Ортофосфорная кислота применяется для снятия зубной эмали перед пломбированием зубов. При применении адгезивных материалов 2 и 3 поколения требуется тотальное протравливание зуба кислотой, с последующим промыванием и просушиванием. Кроме дополнительных временных затрат на проведение данные этапы несут в себе опасность возникновения различных ошибок и осложнений.
При нанесении ортофосфорной кислоты сложно проконтролировать степень и глубину деминерализации дентина и эмали. Это приводит к тому, что нанесенный адгезив не полностью (по всей глубине) заполняет открытые дентинные канальцы, а это в свою очередь не обеспечивает образование полноценного гибридного слоя.
Кроме того, не всегда удается полностью удалить ортофосфорную кислоту после ее нанесения на дентин. Это зависит от того, каким способом сгущена фосфорная кислота. Остатки ортофосфорной кислоты ухудшают прочность бондинга, а также приводят к образованию так называемой «кислотной мины».
Поэтому с появлением адгезивных материалов 5 и 6 поколения ортофосфорная кислота использоваться перестала.
См. также
- Фосфорные кислоты
- Фосфор
Примечания
- ↑ Химия. Лекции и электронные учебники на Бобыч.Ру (рус.). Архивировано из первоисточника 7 февраля 2012. Проверено 13 сентября 2009.
Литература
- Карапетьянц М. Х. Дракин С. И. Общая и неорганическая химия. М.: Химия1994
- Блум У. Адгезивные системы обзор и сравнение// Дент. Арт.- 2003,№ 2.-С.5-11.
- Давыдова А. В. Характеристика адгезивных систем// Материалы научно-практической конференции «Новые технологии в стоматологии».- Ростов на Дону, 2004.-С.45-46
- Enamel-dentin adhesives, self-etching primers// CRA Newsletter.- Vol.24,№ 11.-2000.-P.1-2.
Ссылки
Фосфорная кислота
|
Растворимость кислот, оснований и солей в воде |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
Справочник содержит названия веществ и описания химических формул (в т.ч. структурные формулы и скелетные формулы).
Введите часть названия или формулу для поиска:
Ортофосфорная кислота
Брутто-формула:
H3O4P
CAS# 7664-38-2
Названия
Русский:
- Ортофосфорная кислота [Wiki]
- Фосфорная кислота
English:
- E-338
- E338
- Orthophosphoric acid
- Phosphoric acid(IUPAC) [Wiki]
- phosphoric(V) acid
- trihydroxidooxidophosphorus(IUPAC)
- trihydroxylphosphine oxide
Варианты формулы:
HO/P`|O|<_(A70,w+)O-H>_(A15,d+)O/H
Реакции, в которых участвует Ортофосфорная кислота
-
PCl5 + 4H2O -> H3PO4 + 5HCl
-
P + 5HNO3″(60%)» = H3PO4 + 5NO2″|^» + H2O
-
3P + 5HNO3″(30%)» + 2H2O = 3H3PO4 + 5NO»|^»
-
4H3C-CH2-OH + PBr5 -> 4H3C-CH2-Br + PO(OH)3 + HBr
-
Ca3(PO4)2 + 3H2SO4 -> 2H3PO4 + 3CaSO4
Фосфорная кислота
Строение молекулы и физические свойства
Фосфор в степени окисления +5 образует несколько кислот: орто-фосфорную H3PO4, мета-фосфорную HPO3, пиро-фосфорную H4P2O7.
Фосфорная кислота H3PO4 – это кислота средней силы, трехосновная, прочная и нелетучая. При обычных условиях фосфорная кислота – твердое вещество, хорошо растворимое в воде и гигроскопичное.
Валентность фосфора в фосфорной кислоте равна V.
При температуре выше +213 °C орто-фосфорная кислота переходит в пирофосфорную H4P2O7.
При взаимодействии высшего оксида фосфора с водой на холоде образуется метафосфорная кислота HPO3, представляющая собой прозрачную стекловидную массу.
Способы получения
Наибольшее практическое значение из фосфорных кислот имеет ортофосфорная кислота.
1. Получить орто-фосфорную кислоту можно взаимодействием оксида фосфора (V) с водой:
P2O5 + 3H2O → 2H3PO4
2. Еще один способ получения фосфорной кислоты — вытеснение фосфорной кислоты из солей (фосфатов, гидрофосфатов и дигидрофосфатов) под действием более сильных кислот (серной, азотной, соляной и др.).
Промышленный способ получения фосфорной кислоты обработка фосфорита концентрированной серной кислотой:
Ca3(PO4)2(тв) + 3H2SO4(конц) → 2H3PO4 + 3CaSO4
3. Фосфорную кислоту также можно получить жестким окислением соединений фосфора в водном растворе в присутствии кислот.
Например, концентрированная азотная кислота окисляет фосфор до фосфорной кислоты:
5HNO3 + P → H3PO4 + 5NO2↑ + H2O
Химические свойства
Фосфорная кислота – это кислота средней силы (по второй и третьей ступени слабая).
1. Фосфорная кислота частично и ступенчато диссоциирует в водном растворе.
H3PO4 ⇄ H+ + H2PO4–
H2PO4– ⇄ H+ + HPO42–
HPO42– ⇄ H+ + PO43–
2. Фосфорная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами.
Например, фосфорная кислота взаимодействует с оксидом магния:
2H3PO4 + 3MgO → Mg3(PO4)2 + 3H2O
Еще пример: при взаимодействии фосфорной кислоты с гидроксидом калия образуются фосфаты, гидрофосфаты или дигидрофосфаты:
H3PO4 + КОН → KH2РО4 + H2O
H3PO4 + 2КОН → К2НРО4 + 2H2O
H3PO4 + 3КОН → К3РО4 + 3H2O
3. Фосфорная кислота вытесняет более слабые кислоты из их солей (карбонатов, сульфидов и др.). Также фосфорная кислота вступает в обменные реакции с солями.
Например, фосфорная кислота взаимодействует с гидрокарбонатом натрия:
Н3PO4 + 3NaHCO3 → Na3PO4 + CO2 + 3H2O
4. При нагревании H3PO4 до 200°С происходит отщепление от нее молекулы воды с образованием пирофосфорной кислоты H2P2O7:
2H3PO4 → H2P2O7 + H2O
5. Фосфорная кислота взаимодействует с металлами, которые расположены в ряду активности металлов до водорода. При этом образуются соль и водород.
Например, фосфорная кислота реагирует с магнием:
2H3PO4 + 3Mg → Mg3(PO4)2 + 3H2
Фосфорная кислота взаимодействует также с аммиаком с образованием солей аммония:
2H3PO4 + 3NH3 → NH4H2PO4 + (NH4)2HPO4
7. Качественная реакция на фосфат-ионы и фосфорную кислоту — взаимодействие с нитратом серебра. При этом образуется ярко-желтый осадок фосфата серебра:
Н3PO4 + 3AgNO3 → Ag3PO4↓ + 3НNO3
Видеоопыт взаимодействия фосфата натрия и нитрата серебра в растворе (качественная реакция на фосфат-ион) можно посмотреть здесь.
Фосфорная (ортофосфорная) кислота
H3PO4
представляет собой твёрдое прозрачное кристаллическое вещество. Она очень хорошо растворяется в воде (смешивается в любых соотношениях) и обычно применяется в виде растворов.
Рис. (1). Раствор фосфорной кислоты
В водных растворах фосфорная кислота диссоциирует ступенчато:
Диссоциация на каждой следующей ступени протекает слабее, чем на предыдущей. Полностью на ионы фосфорная кислота не распадается и относится к кислотам средней силы. Она менее активна в химических реакциях по сравнению с серной, азотной, соляной кислотами.
Фосфорная кислота вступает в реакции:
- с металлами, расположенными в ряду активности до водорода:
;
- с основными оксидами:
- с основаниями:
- с солями, если выделяется газ или осадок:
;
- с аммиаком:
В реакциях могут образовываться не только средние соли фосфаты с кислотным остатком
PO43−
, но и кислые: гидрофосфаты (HPO42−) и дигидрофосфаты (
H2PO4−
). В названиях кислых солей приставка гидро- обозначает атом водорода, а дигидро- — два атома водорода. Состав соли зависит от мольных соотношений кислоты и реагирующего с ней вещества:
,
Средние соли фосфорной кислоты фосфаты (например,
Ca3(PO4)2
) нерастворимы в воде, кроме фосфатов щелочных металлов. Характерную жёлтую окраску имеет фосфат серебра. Это свойство используется для качественного определения растворимых фосфатов. При добавлении к ним раствора нитрата серебра выпадает жёлтый осадок, растворимый в азотной кислоте:
Рис. (2). Фосфат серебра
Большинство дигидрофосфатов (
CaH2PO4
и др.) растворяется в воде хорошо. Гидрофосфаты (
Ca(HPO4)2
и др.) растворяются лучше, чем фосфаты, но хуже по сравнению с дигидрофосфатами.
Фосфорная кислота используется:
- для производства минеральных удобрений,
- в качестве пищевой добавки в напитках,
- в производстве синтетических моющих средств,
- на производстве кормовых добавок для животных.
Соли фосфорной кислоты применяются в качестве минеральных удобрений.
Рис. (3). Суперфосфат
Источники:
Рис. 1. Раствор фосфорной кислоты https://www.shutterstock.com/ru/image-photo/selective-focus-phosphoric-acid-solution-brown-1806002407
Рис. 2. Фосфат серебра © ЯКласс
Рис. 3. Суперфосфат https://cdn.pixabay.com/photo/2017/12/28/12/29/fertilizer-3045121_960_720.jpg