Principle of chemical precipitation in aqueous solution
In an aqueous solution, precipitation is the process of transforming a dissolved substance into an insoluble solid from a super-saturated solution.[1][2] The solid formed is called the precipitate.[3] In case of an inorganic chemical reaction leading to precipitation, the chemical reagent causing the solid to form is called the precipitant.[4]
The clear liquid remaining above the precipitated or the centrifuged solid phase is also called the ‘supernate’ or ‘supernatant’.
The notion of precipitation can also be extended to other domains of chemistry (organic chemistry and biochemistry) and even be applied to the solid phases (e.g., metallurgy and alloys) when solid impurities segregate from a solid phase.
Supersaturation[edit]
The precipitation of a compound may occur when its concentration exceeds its solubility. This can be due to temperature changes, solvent evaporation, or by mixing solvents. Precipitation occurs more rapidly from a strongly supersaturated solution.
The formation of a precipitate can be caused by a chemical reaction. When a barium chloride solution reacts with sulphuric acid, a white precipitate of barium sulfate is formed. When a potassium iodide solution reacts with a lead(II) nitrate solution, a yellow precipitate of lead(II) iodide is formed.
Nucleation[edit]
An important stage of the precipitation process is the onset of nucleation. The creation of a solid particle implies the formation of an interface with the solution. This involves energy changes depending on the dissolution reaction free energy (endothermic or exothermic process accompanied by an entropy increase) and the relative surface energy developed between the solid and the solution. If energy changes are not favorable, or without suitable nucleation sites, no precipitation occurs and the solution remain supersaturated.
Inorganic chemistry[edit]
Precipitation in aqueous solution[edit]
A common example of precipitation reaction in aqueous solution is that of silver chloride. When silver nitrate (AgNO3) is added to a solution of potassium chloride (KCl) the precipitation of a white solid (AgCl) is observed.[5][6]
The ionic equation allows to write this reaction by detailing the dissociated ions present in aqueous solution.
Reductive precipitation[edit]
The Walden reductor is an illustration of a reduction reaction directly accompanied by the precipitation of a less soluble compound because of its lower chemical valence:
The Walden reductor made of tiny silver crystals obtained by the immersion of a copper wire into a solution of silver nitrate is used to reduce to their lower valence any metallic ion located above the silver couple (Ag+ + 1 e– → Ag) in the redox potential scale.
Precipitate colors[edit]
Reddish brown stains on a limestone core sample, corresponding to precipitates of oxides/hydroxides of Fe3+
.
Many compounds containing metal ions produce precipitates with distinctive colors. The following are some typical colors for various metals. However, many of these compounds can produce colors very different from those listed.
| Metal | Color |
|---|---|
| Chromium | Blue, deep green, murky green, orange, yellow, brown |
| Cobalt | Pink (when hydrated) |
| Copper | Blue |
| Iron (II) | Dirty Green |
| Iron (III) | Reddish brown |
| Manganese | Pale pink (Mn2+) |
| Nickel | Green |
Many compounds often form white precipitates.
Anion/cation qualitative analysis[edit]
Precipitate formation is useful in the detection of the type of cation in a salt. To do this, an alkali first reacts with the unknown salt to produce a precipitate that is the hydroxide of the unknown salt. To identify the cation, the color of the precipitate and its solubility in excess are noted. Similar processes are often used in sequence – for example, a barium nitrate solution will react with sulfate ions to form a solid barium sulfate precipitate, indicating that it is likely that sulfate ions are present.
Colloidal suspensions[edit]
Without sufficient attraction forces (e.g., Van der Waals force) to aggregate the solid particles together and to remove them from solution by gravity (settling), they remain in suspension and form colloids. Sedimentation can be accelerated by high speed centrifugation. The compact mass obtained so is sometimes referred to as a ‘pellet’.
Digestion and precipitates ageing[edit]
Digestion, or precipitate ageing, happens when a freshly formed precipitate is left, usually at a higher temperature, in the solution from which it precipitates. It results in purer and larger recrystallized particles. The physico-chemical process underlying digestion is called Ostwald ripening.[7][8]
Organic chemistry[edit]
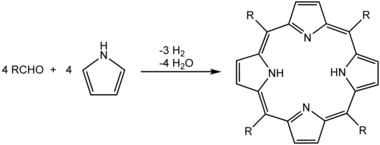
While precipitation reactions can be used for making pigments, removing ions from solution in water treatment, and in classical qualitative inorganic analysis, precipitation is also commonly used to isolate the products of an organic reaction during workup and purification operations. Ideally, the product of the reaction is insoluble in the solvent used for the reaction. Thus, it precipitates as it is formed, preferably forming pure crystals. An example of this would be the synthesis of porphyrins in refluxing propionic acid. By cooling the reaction mixture to room temperature, crystals of the porphyrin precipitate, and are collected by filtration on a Büchner filter as illustrated by the photograph here beside:[9]
Precipitation may also occur when an antisolvent (a solvent in which the product is insoluble) is added, drastically reducing the solubility of the desired product. Thereafter, the precipitate may be easily separated by decanting, filtration, or by centrifugation. An example would be the synthesis of Cr3+tetraphenylporphyrin chloride: water is added to the dimethylformamide (DMF) solution in which the reaction occurred, and the product precipitates.[10] Precipitation is useful in purifying many other products: e.g., crude bmim-Cl is taken up in acetonitrile, and dropped into ethyl acetate, where it precipitates.[11]
Biochemistry[edit]
Proteins purification and separation can be performed by precipitation in changing the nature of the solvent or the value of its dielectric constant (e.g., by replacing water by ethanol), or by increasing the ionic strength of the solution. As proteins have complex tertiary and quaternary structures due to their specific folding and various weak intermolecular interactions (e.g., hydrogen bridges), these superstructures can be modified and proteins denaturated and precipitated. Another important application of an antisolvent is in ethanol precipitation of DNA.
Metallurgy and alloys[edit]
In solid phases, precipitation occurs if the concentration of one solid is above the solubility limit in the host solid, due to e.g. rapid quenching or
ion implantation, and the temperature is high enough that diffusion can lead to segregation into precipitates. Precipitation in solids is routinely used to synthesize nanoclusters.[12]
In metallurgy, precipitation from a solid solution is also a way to strengthen alloys.
Precipitation of ceramic phases in metallic alloys such as zirconium hydrides in zircaloy cladding of nuclear fuel pins can also render metallic alloys brittle and lead to their mechanical failure. Correctly mastering the precise temperature and pressure conditions when cooling down spent nuclear fuels is therefore essential to avoid damaging their cladding and to preserve the integrity of the spent fuel elements on the long term in dry storage casks and in geological disposal conditions.
Industrial processes[edit]
Hydroxide precipitation is probably the most widely used industrial precipitation process in which metal hydroxides are formed by adding calcium hydroxide (slaked lime) or sodium hydroxide (caustic soda) as precipitant.
History[edit]
Powders derived from different precipitation processes have also historically been known as ‘flowers’.
See also[edit]
- Coprecipitation
- Effervescence, the «up-arrow»
- Salting in
- Salting out
References[edit]
- ^ «Precipitation (Chemical) — an overview | ScienceDirect Topics». ScienceDirect. Retrieved 2020-11-28.
- ^ «Chemical precipitation». Encyclopedia Britannica. Retrieved 2020-11-28.
- ^ «Definition of Precipitate». Merriam-Webster. Retrieved 2020-11-28.
- ^ «Definition of Precipitant». Merriam-Webster. Retrieved 2020-11-28.
- ^ Zumdahl, Steven S.; DeCoste, Donald J. (2012). Chemical Principles. Cengage Learning. ISBN 978-1-133-71013-4.
- ^ Zumdahl, Steven S.; DeCoste, Donald J. (2018). Introductory Chemistry: A Foundation. Cengage Learning. ISBN 978-1-337-67132-3.
- ^ Vengrenovitch, R.D. (1982). «On the Ostwald ripening theory». Acta Metallurgica. 30 (6): 1079–1086. doi:10.1016/0001-6160(82)90004-9. ISSN 0001-6160.
- ^ Voorhees, P.W. (1985). «The theory of Ostwald ripening». Journal of Statistical Physics. 38 (1–2): 231–252. Bibcode:1985JSP….38..231V. doi:10.1007/BF01017860. ISSN 0022-4715. S2CID 14865117.
- ^ A. D. Adler; F. R. Longo; J. D. Finarelli; J. Goldmacher; J. Assour; L. Korsakoff (1967). «A simplified synthesis for meso-tetraphenylporphine». J. Org. Chem. 32 (2): 476. doi:10.1021/jo01288a053.
- ^ Alan D. Adler; Frederick R. Longo; Frank Kampas; Jean Kim (1970). «On the preparation of metalloporphyrins». Journal of Inorganic and Nuclear Chemistry. 32 (7): 2443. doi:10.1016/0022-1902(70)80535-8.
- ^ Dupont, J., Consorti, C., Suarez, P., de Souza, R. (2004). «Preparation of 1-Butyl-3-methyl imidazolium-based room temperature ionic liquids». Organic Syntheses.
{{cite journal}}: CS1 maint: multiple names: authors list (link); Collective Volume, vol. 10, p. 184 - ^ Dhara, S. (2007). «Formation, Dynamics, and Characterization of Nanostructures by Ion Beam Irradiation». Critical Reviews in Solid State and Materials Sciences. 32 (1): 1–50. Bibcode:2007CRSSM..32….1D. doi:10.1080/10408430601187624. S2CID 98639891.
Additional reading[edit]
- Zumdahl, Steven S. (2005). Chemical Principles (5th ed.). New York: Houghton Mifflin. ISBN 0-618-37206-7.
External links[edit]
- Precipitation reactions of certain cations
- Digestion Instruments
- A Thesis on pattern formation in precipitation reactions
Principle of chemical precipitation in aqueous solution
In an aqueous solution, precipitation is the process of transforming a dissolved substance into an insoluble solid from a super-saturated solution.[1][2] The solid formed is called the precipitate.[3] In case of an inorganic chemical reaction leading to precipitation, the chemical reagent causing the solid to form is called the precipitant.[4]
The clear liquid remaining above the precipitated or the centrifuged solid phase is also called the ‘supernate’ or ‘supernatant’.
The notion of precipitation can also be extended to other domains of chemistry (organic chemistry and biochemistry) and even be applied to the solid phases (e.g., metallurgy and alloys) when solid impurities segregate from a solid phase.
Supersaturation[edit]
The precipitation of a compound may occur when its concentration exceeds its solubility. This can be due to temperature changes, solvent evaporation, or by mixing solvents. Precipitation occurs more rapidly from a strongly supersaturated solution.
The formation of a precipitate can be caused by a chemical reaction. When a barium chloride solution reacts with sulphuric acid, a white precipitate of barium sulfate is formed. When a potassium iodide solution reacts with a lead(II) nitrate solution, a yellow precipitate of lead(II) iodide is formed.
Nucleation[edit]
An important stage of the precipitation process is the onset of nucleation. The creation of a solid particle implies the formation of an interface with the solution. This involves energy changes depending on the dissolution reaction free energy (endothermic or exothermic process accompanied by an entropy increase) and the relative surface energy developed between the solid and the solution. If energy changes are not favorable, or without suitable nucleation sites, no precipitation occurs and the solution remain supersaturated.
Inorganic chemistry[edit]
Precipitation in aqueous solution[edit]
A common example of precipitation reaction in aqueous solution is that of silver chloride. When silver nitrate (AgNO3) is added to a solution of potassium chloride (KCl) the precipitation of a white solid (AgCl) is observed.[5][6]
The ionic equation allows to write this reaction by detailing the dissociated ions present in aqueous solution.
Reductive precipitation[edit]
The Walden reductor is an illustration of a reduction reaction directly accompanied by the precipitation of a less soluble compound because of its lower chemical valence:
The Walden reductor made of tiny silver crystals obtained by the immersion of a copper wire into a solution of silver nitrate is used to reduce to their lower valence any metallic ion located above the silver couple (Ag+ + 1 e– → Ag) in the redox potential scale.
Precipitate colors[edit]
Reddish brown stains on a limestone core sample, corresponding to precipitates of oxides/hydroxides of Fe3+
.
Many compounds containing metal ions produce precipitates with distinctive colors. The following are some typical colors for various metals. However, many of these compounds can produce colors very different from those listed.
| Metal | Color |
|---|---|
| Chromium | Blue, deep green, murky green, orange, yellow, brown |
| Cobalt | Pink (when hydrated) |
| Copper | Blue |
| Iron (II) | Dirty Green |
| Iron (III) | Reddish brown |
| Manganese | Pale pink (Mn2+) |
| Nickel | Green |
Many compounds often form white precipitates.
Anion/cation qualitative analysis[edit]
Precipitate formation is useful in the detection of the type of cation in a salt. To do this, an alkali first reacts with the unknown salt to produce a precipitate that is the hydroxide of the unknown salt. To identify the cation, the color of the precipitate and its solubility in excess are noted. Similar processes are often used in sequence – for example, a barium nitrate solution will react with sulfate ions to form a solid barium sulfate precipitate, indicating that it is likely that sulfate ions are present.
Colloidal suspensions[edit]
Without sufficient attraction forces (e.g., Van der Waals force) to aggregate the solid particles together and to remove them from solution by gravity (settling), they remain in suspension and form colloids. Sedimentation can be accelerated by high speed centrifugation. The compact mass obtained so is sometimes referred to as a ‘pellet’.
Digestion and precipitates ageing[edit]
Digestion, or precipitate ageing, happens when a freshly formed precipitate is left, usually at a higher temperature, in the solution from which it precipitates. It results in purer and larger recrystallized particles. The physico-chemical process underlying digestion is called Ostwald ripening.[7][8]
Organic chemistry[edit]
While precipitation reactions can be used for making pigments, removing ions from solution in water treatment, and in classical qualitative inorganic analysis, precipitation is also commonly used to isolate the products of an organic reaction during workup and purification operations. Ideally, the product of the reaction is insoluble in the solvent used for the reaction. Thus, it precipitates as it is formed, preferably forming pure crystals. An example of this would be the synthesis of porphyrins in refluxing propionic acid. By cooling the reaction mixture to room temperature, crystals of the porphyrin precipitate, and are collected by filtration on a Büchner filter as illustrated by the photograph here beside:[9]

Precipitation may also occur when an antisolvent (a solvent in which the product is insoluble) is added, drastically reducing the solubility of the desired product. Thereafter, the precipitate may be easily separated by decanting, filtration, or by centrifugation. An example would be the synthesis of Cr3+tetraphenylporphyrin chloride: water is added to the dimethylformamide (DMF) solution in which the reaction occurred, and the product precipitates.[10] Precipitation is useful in purifying many other products: e.g., crude bmim-Cl is taken up in acetonitrile, and dropped into ethyl acetate, where it precipitates.[11]
Biochemistry[edit]
Proteins purification and separation can be performed by precipitation in changing the nature of the solvent or the value of its dielectric constant (e.g., by replacing water by ethanol), or by increasing the ionic strength of the solution. As proteins have complex tertiary and quaternary structures due to their specific folding and various weak intermolecular interactions (e.g., hydrogen bridges), these superstructures can be modified and proteins denaturated and precipitated. Another important application of an antisolvent is in ethanol precipitation of DNA.
Metallurgy and alloys[edit]
In solid phases, precipitation occurs if the concentration of one solid is above the solubility limit in the host solid, due to e.g. rapid quenching or
ion implantation, and the temperature is high enough that diffusion can lead to segregation into precipitates. Precipitation in solids is routinely used to synthesize nanoclusters.[12]
In metallurgy, precipitation from a solid solution is also a way to strengthen alloys.
Precipitation of ceramic phases in metallic alloys such as zirconium hydrides in zircaloy cladding of nuclear fuel pins can also render metallic alloys brittle and lead to their mechanical failure. Correctly mastering the precise temperature and pressure conditions when cooling down spent nuclear fuels is therefore essential to avoid damaging their cladding and to preserve the integrity of the spent fuel elements on the long term in dry storage casks and in geological disposal conditions.
Industrial processes[edit]
Hydroxide precipitation is probably the most widely used industrial precipitation process in which metal hydroxides are formed by adding calcium hydroxide (slaked lime) or sodium hydroxide (caustic soda) as precipitant.
History[edit]
Powders derived from different precipitation processes have also historically been known as ‘flowers’.
See also[edit]
- Coprecipitation
- Effervescence, the «up-arrow»
- Salting in
- Salting out
References[edit]
- ^ «Precipitation (Chemical) — an overview | ScienceDirect Topics». ScienceDirect. Retrieved 2020-11-28.
- ^ «Chemical precipitation». Encyclopedia Britannica. Retrieved 2020-11-28.
- ^ «Definition of Precipitate». Merriam-Webster. Retrieved 2020-11-28.
- ^ «Definition of Precipitant». Merriam-Webster. Retrieved 2020-11-28.
- ^ Zumdahl, Steven S.; DeCoste, Donald J. (2012). Chemical Principles. Cengage Learning. ISBN 978-1-133-71013-4.
- ^ Zumdahl, Steven S.; DeCoste, Donald J. (2018). Introductory Chemistry: A Foundation. Cengage Learning. ISBN 978-1-337-67132-3.
- ^ Vengrenovitch, R.D. (1982). «On the Ostwald ripening theory». Acta Metallurgica. 30 (6): 1079–1086. doi:10.1016/0001-6160(82)90004-9. ISSN 0001-6160.
- ^ Voorhees, P.W. (1985). «The theory of Ostwald ripening». Journal of Statistical Physics. 38 (1–2): 231–252. Bibcode:1985JSP….38..231V. doi:10.1007/BF01017860. ISSN 0022-4715. S2CID 14865117.
- ^ A. D. Adler; F. R. Longo; J. D. Finarelli; J. Goldmacher; J. Assour; L. Korsakoff (1967). «A simplified synthesis for meso-tetraphenylporphine». J. Org. Chem. 32 (2): 476. doi:10.1021/jo01288a053.
- ^ Alan D. Adler; Frederick R. Longo; Frank Kampas; Jean Kim (1970). «On the preparation of metalloporphyrins». Journal of Inorganic and Nuclear Chemistry. 32 (7): 2443. doi:10.1016/0022-1902(70)80535-8.
- ^ Dupont, J., Consorti, C., Suarez, P., de Souza, R. (2004). «Preparation of 1-Butyl-3-methyl imidazolium-based room temperature ionic liquids». Organic Syntheses.
{{cite journal}}: CS1 maint: multiple names: authors list (link); Collective Volume, vol. 10, p. 184 - ^ Dhara, S. (2007). «Formation, Dynamics, and Characterization of Nanostructures by Ion Beam Irradiation». Critical Reviews in Solid State and Materials Sciences. 32 (1): 1–50. Bibcode:2007CRSSM..32….1D. doi:10.1080/10408430601187624. S2CID 98639891.
Additional reading[edit]
- Zumdahl, Steven S. (2005). Chemical Principles (5th ed.). New York: Houghton Mifflin. ISBN 0-618-37206-7.
External links[edit]
- Precipitation reactions of certain cations
- Digestion Instruments
- A Thesis on pattern formation in precipitation reactions
Что такое качественная реакция
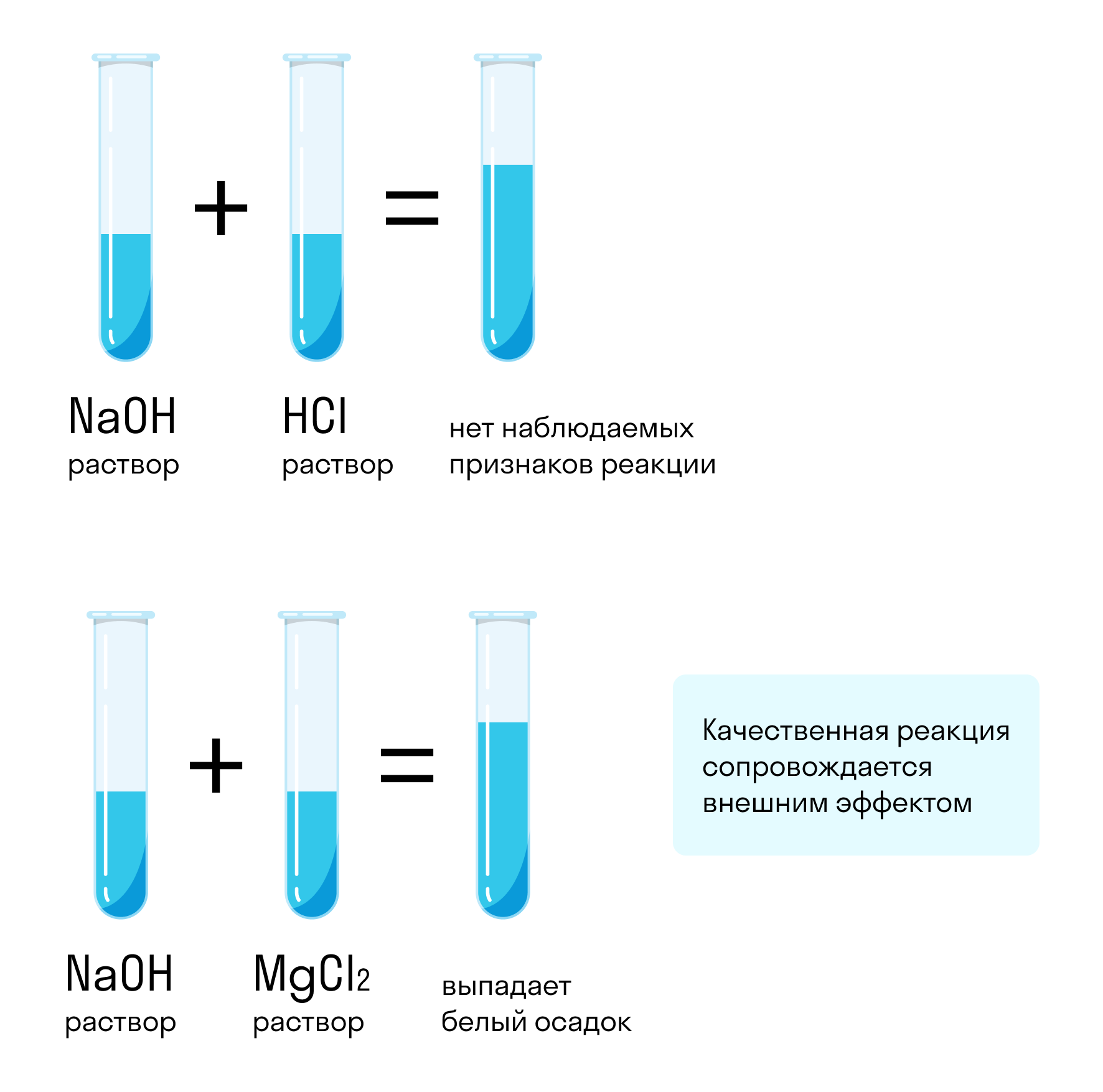
Предположим, у нас есть две пробирки — с водой и с гидроксидом натрия (каустической содой). Можно ли отличить один раствор от другого? Можно, если подобрать правильный реагент, с которым один раствор будет реагировать, а другой нет, или на который эти вещества будут реагировать по-разному.
Для таких целей подойдут не все реагенты. Например, если смешать гидроксид натрия с соляной кислотой, реакция произойдет: NaOH + HCl = NaCl + H2O. Но внешне она никак не проявится — два прозрачных раствора образуют такой же прозрачный третий. Такой реагент не подходит.
Если же смешать гидроксид натрия с хлоридом магния, результат химической реакции будет заметен невооруженным глазом. Характерным признаком станет образование белого осадка: 2NaOH + MgCl2 = Mg(OH)2 + 2NaCl. При смешивании хлорида магния с водой белый осадок не образуется. Значит, этот реагент позволяет отличить один раствор от другого.
Качественными называются реакции, позволяющие идентифицировать в исследуемом объекте определенные атомы, молекулы, функциональные группы и т. д. Идентификация происходит по внешним проявлениям, которые сопровождают реакцию: выделение газа, изменение цвета раствора, образование осадка, появление специфического запаха и др.
Качественные реакции — это простой и быстрый способ узнать качественный состав раствора или другого сложного вещества.
Практикующий детский психолог Екатерина Мурашова
Бесплатный курс для современных мам и пап от Екатерины Мурашовой. Запишитесь и участвуйте в розыгрыше 8 уроков
Качественный анализ
Определение состава того или иного вещества с помощью качественной реакции называют качественным анализом. В химии он часто используется перед количественным анализом, а также для того, чтобы понять, как можно разделить смесь.
Исследуемые объекты могут представлять собой твердые, жидкие или газообразные вещества, и в зависимости от этого качественный анализ проводится разными методами:
-
сухим способом — например, если внести пробу вещества в пламя горелки и отследить, как изменился цвет пламени;
-
мокрым способом — путем преобразования вещества в раствор.
Русский химик Ф. М. Флавицкий также предложил сухой метод растирания твердого исследуемого объекта с реактивом. Если реакция будет качественной, появятся характерные признаки: изменение цвета смеси, выделение газа и т. д.
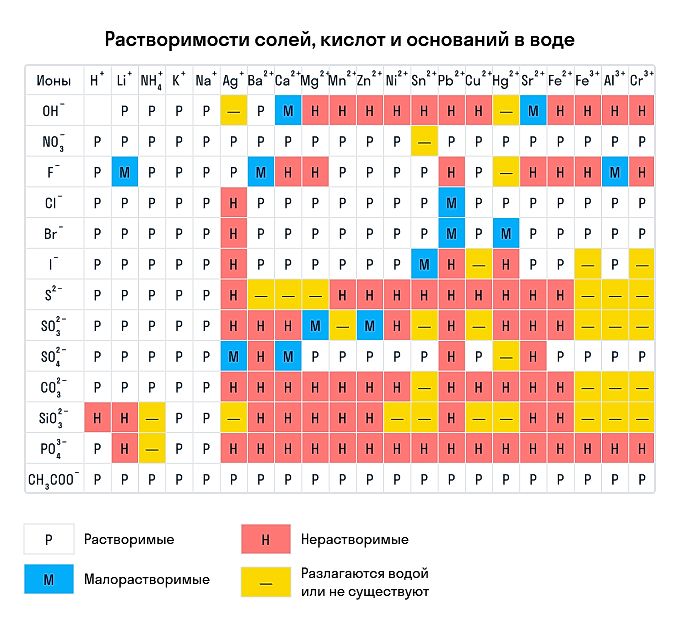
Правила растворимости химических соединений
Сухим способом обычно проводят анализ в полевых условиях, а в лабораториях чаще использую растворы. Поэтому для изучения качественных реакций в химии (неорганической и органической) желательно знать правила растворимости сложных веществ. Наизусть учить, конечно, их не стоит — можно воспользоваться таблицей растворимости, которая приведена ниже.
Растворимы:
-
абсолютно все нитраты;
-
большинство солей аммония, натрия, калия (но есть исключения, например — гексанитритокобальтат (III) калия K3[Co(NO2)6]);
-
соли йодидной, хлороводородной и бромоводородной кислоты (но галогениды свинца (II), ртути (I) и серебра обладают умеренной растворимостью);
-
почти все сульфаты, кроме BaSO4, SrSO4, PbSO4 (при этом CaSO4 и Ag2SO4 умеренно растворимы).
Нерастворимы:
-
любые сульфиды, кроме сульфидов щелочных и щелочноземельных металлов, а также (NH4)2S;
-
любые гидроксиды, кроме гидроксидов щелочных металлов (умеренной растворимостью отличаются Sr(OH)2, Ca(OH)2, Ba(OH)2);
-
любые карбонаты, фосфаты и сульфиты, кроме K2CO3, K2SO3, K3PO4, Na2CO3, Na2SO3, Na3PO4, (NH4)2CO3, (NH4)2SO3, (NH4)3PO4.
Качественные реакции органических веществ
В органической химии качественные реакции позволяют за считанные минуты определить класс соединения — узнать, относится ли исследуемый объект к спиртам, углеводам, альдегидам и т. д. По внешним эффектам судят о присутствии функциональных групп органических соединений в смеси или в растворе.
Белковые соединения при горении издают запах жженой шерсти. При добавлении концентрированной азотной кислоты они окрашивают раствор в ярко-желтый цвет, также характерно образование желтого осадка (ксантопротеиновая реакция). А если соединить в растворе белки со свежеосажденным гидроксидом меди (II), получится сине-фиолетовая смесь.
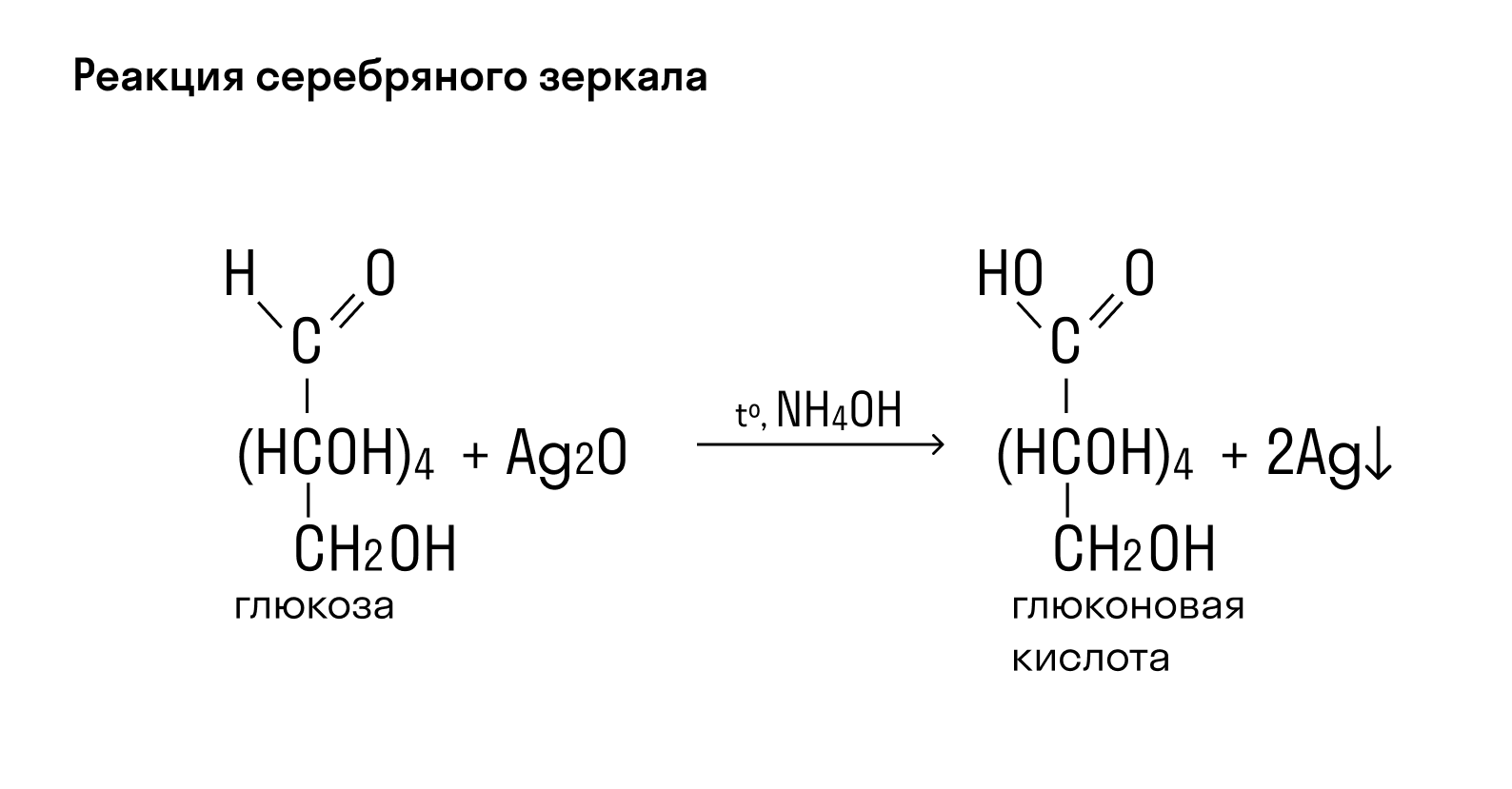
Глюкоза благодаря содержанию альдегидной группы в реакции с аммиачным раствором оксида серебра образует на стенках пробирки «серебряное зеркало». Вместе со свежеосажденным гидроксидом меди (II) она окрашивает раствор в синий цвет, а если данный раствор нагреть — происходит образование красно-оранжевого осадка.
СН2ОН — (СНОН)4 — СОН + Ag2O = СН2ОН — (СНОН)4 — СООН + 2Ag↓ — реакция «серебряного зеркала».
HOСН2 — (СНOH)4 — СН = O + 2Cu(OH)2 ⇒ HOСН2 — (СНOH)4 — СOOH + Cu2O + 2H2O — реакция глюкозы с гидроксидом меди (II).
Фенол с бромной водой образует белый осадок. Также он вступает в качественную реакцию с раствором соли трехвалентного железа — окрашивает его в фиолетовый цвет.
C6H5OH + 2Br2 ⇒ C6H2Br3OH + 3HBr — реакция с бромной водой.
3C6H5OH + FeCl3 ⇒ (C6H5O)3Fe + 3HCl — реакция с хлоридом железа (III).
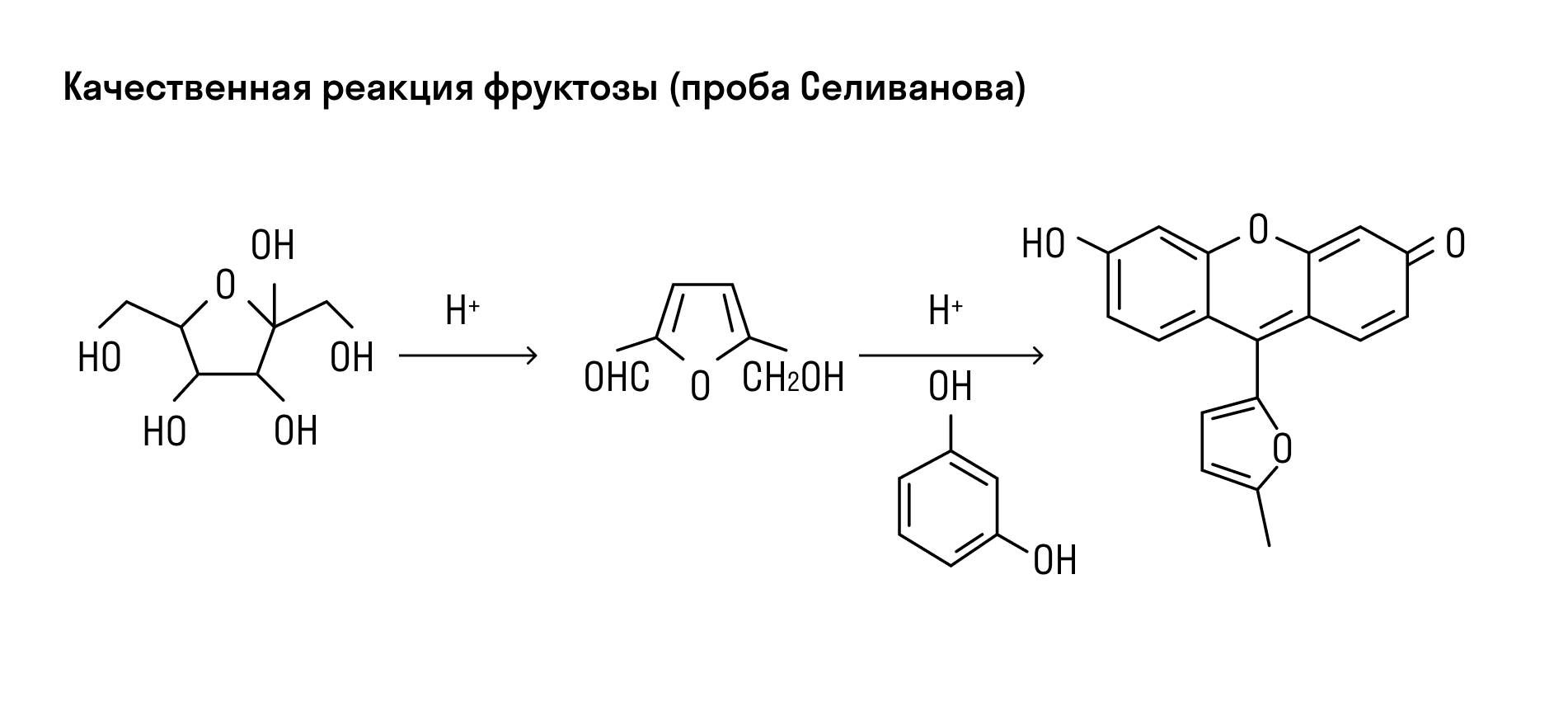
Углеводы с содержанием крахмала можно узнать по синему цвету раствора при добавлении йода. После нагревания такой раствор теряет цвет, но при охлаждении снова становится синим. Фруктозу можно идентифицировать по реакции с резорцином в растворе c соляной кислотой — смесь приобретает вишневый цвет (проба Селиванова).
I2 + (C6H10O5)n ⇒ I2(C6H10O5)n— качественная реакция крахмала с йодом.
Все качественные реакции с органическими соединениями в рамках статьи описать невозможно, но в таблице ниже указаны самые важные из них.
Таблицы качественных реакций
21-Дек-2013 | комментариев 9 | Лолита Окольнова
Вопросы части С объединяют знание всех тем химии. В случае Задания С2 ЕГЭ по химии — знание всех классов неорганических веществ и их качественных реакции.
Дается конкретный химический эксперимент, ход которого нужно описать химическими реакциями.
Для таких реакции обычно предлагаются какие-то внешние проявления — выделения газа, выпадение осадка или изменение окраски раствора.
Таблица качественных реакций для газов
| Описание | Формула |
Реакции |
| Бурый газ |
NO2 |
1) N2 + 2O2 = 2NO2 2) взаимодействие металлов с азотной кислотой (концентрированной) 3) разложение нитратов |
| Запах тухлых яиц |
H2S |
Взаимодействие активных металлов с концентрированной серной кислотой: |
|
Газ с резким запахом. Растворимый в воде |
SO2 |
1) взаимодействие серасодежащих веществ с кислородом
2) взаимодействие некоторых металлов с концентрированной серной кислотой |
| Газ с резким характерным запахом, растворимый в воде |
NH3 |
1) N2 + 3H2 = 2NH3 2) обменные реакции солей аммония |
| Газ, не поддерживающий горение, малорастворимый в воде, не ядовитый |
N2 |
1) горение азотсодержащих веществ; NH4NO2 = N2 + 2H2O |
|
Газы, поддерживающие горение: (для NO2 – бурый цвет) |
O2 O3 NO2 |
3C + 2O3 = 3CO2 С + 2NO2 = CO2 + 2NO |
Таблица качественных реакций для щелочных металлов:
Т.к. все соединения щелочных металлов хорошо растворимы в воде, то их определяют по цвету пламени:
(указан так же цвет пламени некоторых щелочно-земельных металлов)
|
желто-зеленое |
фиолетовое |
кирпично-красное |
ярко-красное |
желтое |
карминово-красное |
|
Ba2+ |
K+ |
Са2+ |
Li+ |
Na+ |
Sr2+ |
Таблица качественных реакций
— цвета осадков
|
Осадки белого цвета |
Качественная реакция |
|
Белый творожистый нерастворимый в воде; нерастворимый в HNO3 |
Ag+ + Cl— → AgCl↓ качественная реакция на соли серебра; качественная реакция на хлорид-ионы; |
|
Белый осадок нерастворимый в кислотах |
Ba2+ + SO4 -2 → BaSO4↓ качественная реакция на соли бария; качественная реакция на сульфат-ионы; |
|
Белый осадок образуется при пропускании газа без цвета с резким запахом через известковую воду; растворяется при пропускании избытка газа; растворяется в кислотах |
Сa(OH)2 + SO2 = CaSO3↓ + H2O
|
|
Белый осадок образуется при добавлении щелочи; растворяется в избытке щелочи |
Al3+ + 3OH— = Al(OH)3↓ Zn2+ + 2OH— = Zn(OH)2↓
|
|
Белый осадок образуется при пропускании газа без цвета и запаха через известковую воду; растворяется при пропускании избытка газа; растворяется в кислотах |
Сa(OH)2 + CO2 = CaCO3↓ + H2O
CaCO3 + 2H+ → CO2↑ + H2O + Ca2+ |
|
Осадок светло-желтого цвета (осадок кремового цвета) образуется при приливании AgNO3; нерастворим в HNO3; |
Ag+ + Br— → AgBr↓ качественная реакция на бромид-ионы; (качественная реакция на соли серебра); |
|
Осадок желтого цвета образуется при приливании AgNO3; нерастворим в HNO3; |
Ag+ + I— → AgJ↓ качественная реакция на иодид-ионы; (качественная реакция на соли серебра); |
|
Осадок желтого цвета образуется при приливании AgNO3; растворим в кислотах; |
3Ag+ + PO43- → Ag3PO4↓ |
|
Осадки коричневых цветов |
Качественная реакция |
|
Осадок бурого цвета образуется при взаимодействии с растворами щелочей; |
Fe3+ +3OH— → Fe(OH)3↓ качественная реакция на соли железа |
|
Осадки синих и зеленых цветов |
Качественная реакция |
|
Осадки зеленого цвета |
Fe2+ +2OH— → Fe(OH)2↓ |
|
Осадок голубого цвета (осадок синего цвета) образуется при взаимодействии с растворами щелочей |
Cu2+ +2OH— → Cu(OH)2↓ качественная реакция на соли меди (II) |
|
Осадок синего цвета образуется при взаимодействии с раствором красной кровяной и желтой кровяной соли |
3Fe2+ + 2[Fe(CN)6]3- → Fe3[Fe(CN)6]2↓ качественная реакция на соли железа (II) — с красной кровяной солью; 4Fe3+ + 3[Fe(CN)6]-4 → Fe4[Fe(CN)6]3↓ качественная реакция на соли железа (III) — с желтой кровяной солью; |
|
Осадки черного цвета |
Качественная реакция |
|
Осадок черного цвета Образуется при взаимодействии с сульфидами или с H2S |
Fe2+ + S2- → FeS↓ Ni2+ + S2- → NiS↓ Cu2+ + S2- → CuS↓ Pb2+ + S2- → PbS↓ Hg2+ + S2- → HgS↓ Ag+ + S2- → Ag2S↓ качественная реакция на сульфид-ионы |
Обсуждение: «Таблицы качественных реакций»
(Правила комментирования)
Качественные реакции
О чем эта статья:
Что такое качественная реакция
Предположим, у нас есть две пробирки — с водой и с гидроксидом натрия (каустической содой). Можно ли отличить один раствор от другого? Можно, если подобрать правильный реагент, с которым один раствор будет реагировать, а другой нет, или на который эти вещества будут реагировать по-разному.
Для таких целей подойдут не все реагенты. Например, если смешать гидроксид натрия с соляной кислотой, реакция произойдет: NaOH + HCl = NaCl + H2O. Но внешне она никак не проявится — два прозрачных раствора образуют такой же прозрачный третий. Такой реагент не подходит.
Если же смешать гидроксид натрия с хлоридом магния, результат химической реакции будет заметен невооруженным глазом. Характерным признаком станет образование белого осадка: 2NaOH + MgCl2 = Mg(OH)2 + 2NaCl. При смешивании хлорида магния с водой белый осадок не образуется. Значит, этот реагент позволяет отличить один раствор от другого.
Качественными называются реакции, позволяющие идентифицировать в исследуемом объекте определенные атомы, молекулы, функциональные группы и т. д. Идентификация происходит по внешним проявлениям, которые сопровождают реакцию: выделение газа, изменение цвета раствора, образование осадка, появление специфического запаха и др.
Качественные реакции — это простой и быстрый способ узнать качественный состав раствора или другого сложного вещества.
Качественный анализ
Определение состава того или иного вещества с помощью качественной реакции называют качественным анализом. В химии он часто используется перед количественным анализом, а также для того, чтобы понять, как можно разделить смесь.
Исследуемые объекты могут представлять собой твердые, жидкие или газообразные вещества, и в зависимости от этого качественный анализ проводится разными методами:
сухим способом — например, если внести пробу вещества в пламя горелки и отследить, как изменился цвет пламени;
мокрым способом — путем преобразования вещества в раствор.
Русский химик Ф. М. Флавицкий также предложил сухой метод растирания твердого исследуемого объекта с реактивом. Если реакция будет качественной, появятся характерные признаки: изменение цвета смеси, выделение газа и т. д.
Правила растворимости химических соединений
Сухим способом обычно проводят анализ в полевых условиях, а в лабораториях чаще использую растворы. Поэтому для изучения качественных реакций в химии (неорганической и органической) желательно знать правила растворимости сложных веществ. Наизусть учить, конечно, их не стоит — можно воспользоваться таблицей растворимости, которая приведена ниже.
Растворимы:
абсолютно все нитраты;
большинство солей аммония, натрия, калия (но есть исключения, например — гексанитритокобальтат (III) калия K3[Co(NO2)6]);
соли йодидной, хлороводородной и бромоводородной кислоты (но галогениды свинца (II), ртути (I) и серебра обладают умеренной растворимостью);
почти все сульфаты, кроме BaSO4, SrSO4, PbSO4 (при этом CaSO4 и Ag2SO4 умеренно растворимы).
Нерастворимы:
любые сульфиды, кроме сульфидов щелочных и щелочноземельных металлов, а также (NH4)2S;
любые гидроксиды, кроме гидроксидов щелочных металлов (умеренной растворимостью отличаются Sr(OH)2, Ca(OH)2, Ba(OH)2);
Качественные реакции органических веществ
В органической химии качественные реакции позволяют за считанные минуты определить класс соединения — узнать, относится ли исследуемый объект к спиртам, углеводам, альдегидам и т. д. По внешним эффектам судят о присутствии функциональных групп органических соединений в смеси или в растворе.
Белковые соединения при горении издают запах жженой шерсти. При добавлении концентрированной азотной кислоты они окрашивают раствор в ярко-желтый цвет, также характерно образование желтого осадка (ксантопротеиновая реакция). А если соединить в растворе белки со свежеосажденным гидроксидом меди (II), получится сине-фиолетовая смесь.
Глюкоза благодаря содержанию альдегидной группы в реакции с аммиачным раствором оксида серебра образует на стенках пробирки «серебряное зеркало». Вместе со свежеосажденным гидроксидом меди (II) она окрашивает раствор в синий цвет, а если данный раствор нагреть — происходит образование красно-оранжевого осадка.
СН2ОН — (СНОН)4 — СОН + Ag2O = СН2ОН — (СНОН)4 — СООН + 2Ag↓ — реакция «серебряного зеркала».
HOСН2 — (СНOH)4 — СН = O + 2Cu(OH)2 ⇒ HOСН2 — (СНOH)4 — СOOH + Cu2O + 2H2O — реакция глюкозы с гидроксидом меди (II).
Фенол с бромной водой образует белый осадок. Также он вступает в качественную реакцию с раствором соли трехвалентного железа — окрашивает его в фиолетовый цвет.
Углеводы с содержанием крахмала можно узнать по синему цвету раствора при добавлении йода. После нагревания такой раствор теряет цвет, но при охлаждении снова становится синим. Фруктозу можно идентифицировать по реакции с резорцином в растворе c соляной кислотой — смесь приобретает вишневый цвет (проба Селиванова).
Все качественные реакции с органическими соединениями в рамках статьи описать невозможно, но в таблице ниже указаны самые важные из них.
Справочные материалы «Признаки химических реакций» для подготовки к ОГЭ по химии
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Признаки химических реакций
Для выполнения заданий № 6, 18, 22 в ОГЭ необходимо точно описывать признаки химических реакций. Как правило, эти реакции являются реакциями ионного обмена. При реакциях ионного обмена чаще всего признаком реакции является выпадение осадка. Определяем это с помощью таблицы растворимости (данные вещества обозначены н)
Осадки бывают разных цветов и разной консистенции. Все это является частью описания признака реакции.
Не менее распространенным признаком реакции является выделение газа.
Газы без цвета с резким запахом, ядовитые — NH 3 (запах нашатырного спирта), H 2 S (запах тухлых яиц), SO 2 (резкий кислый запах). Остальные описываем как газы с неприятным запахом — NO, N 2 О
Газы окрашенные, с неприятным запахом, ядовитые — NO 2 (бурый газ), Cl 2 (желто – зеленый газ с запахом хлорки), О 3 ( газ синего цвета с резким запахом)
Газ без цвета и запаха, ядовитый – CO (угарный газ)
Газ, поддерживающий горение (вспыхивает тлеющая лучинка) — О 2
Газ, вызывающий помутнение известковой или баритовой воды, выделяется с характерным шипением — CO 2
Признаком реакции также является образование воды .
При сливании двух бесцветных растворов появление воды зрительно зафиксировать невозможно, поэтому в заданиях, описывающих признаки реакций, обычно значится: нет видимых признаков реакции.
Капельки воды обычно фиксируют при нагревании нерастворимых гидроксидов металлов.
Необходимо также знать реакции, идущие с изменением цвета. Это превращение гидроксида железа ( II ) в гидроксид железа ( III ) (цвет меняется с зеленого на бурый);
оксида меди ( II ) в растворимые соли меди ( II ) (цвет меняется с черного на голубой, хлорид меди зеленого цвета!);
гидроксида меди ( II ) в оксид меди ( II ) (цвет меняется с голубого на черный).
Если для реакции берут твердые вещества (оксиды, гидроксиды металлов, некоторые нерастворимые соли), а получают в результате реакции растворы, то признаком реакции значится : растворение вещества.
Краткое описание документа:
Данный материал представляет собой полное описание признаков химических реакций, упоминаемых в контрольно — измерительных материалах ОГЭ по химии. Содержание материала может быть использованы учителем для организации повторения раздела «Химические реакции», использоваться для проведения практических работ по химии в курсе основной школы.
Цвета осадков и газов в неорганической химии
Для сдачи ОГЭ необходимо знать и предсказывать по формуле цвет осадка или газа, а также характерные запахи, которыми обладают газы. В данном документе собраны необходимые данные по этому вопросу.
Осадки бывают разных цветов и разной консистенции. Все это является частью описания признака реакции.
Задание 13 ОГЭ по химии.

Автор: Фрундина Дарья Андреевна, учитель химии.
источники:
http://infourok.ru/spravochnie-materiali-priznaki-himicheskih-reakciy-dlya-podgotovki-k-oge-po-himii-3329402.html
http://4ege.ru/gia-po-himii/60744-cveta-osadkov-i-gazov-v-neorganicheskoj-himii.html
осадок
- осадок
-
Осадок – твердый продукт осаждения.
Словарь по аналитической химии [3]
Общая химия : учебник .
.
2012.
Синонимы:
Смотреть что такое «осадок» в других словарях:
-
осадок — Отстой, гуща, подонки. Осадки атмосферные: дождь, град, иней, роса, снег. Ср. остаток… Словарь русских синонимов и сходных по смыслу выражений. под. ред. Н. Абрамова, М.: Русские словари, 1999. осадок отстой, гуща … Словарь синонимов
-
ОСАДОК — ОСАДОК, осадка, муж. 1. Посторонняя примесь к жидкости в виде мельчайших твердых частиц, опускающаяся на дно или на стенки сосуда. Вода дала осадок. || Нерастворимое вещество, выделившееся из раствора в результате химической реакции. Белый осадок … Толковый словарь Ушакова
-
ОСАДОК — • ОСАДОК, в геологии общий термин, используемый для описания какого либо вещества (например, гравия, песка или глины), которое переносится и осаждается водой, льдом, ветром или силой тяжести. Большая часть осадков откладывается в море. К осадкам… … Научно-технический энциклопедический словарь
-
осадок — остался • существование / создание, субъект, продолжение остался неприятный осадок • существование / создание, субъект, продолжение … Глагольной сочетаемости непредметных имён
-
осадок — Ндп. гач кек корж лепешка Совокупность твердых частиц с заполняющей их поры жидкостью, полученная в процессе разделения суспензии. [ГОСТ 16887 71] осадок (в металлургии драгоценных металлов) Продукт, выделенный из содержащего драгоценный металл… … Справочник технического переводчика
-
ОСАДОК — ОСАДОК, дка, муж. 1. Твёрдые частицы, находящиеся в жидкости и осаждающиеся на дне или на стенках сосуда после отстаивания. О. в квасе. 2. перен. Тяжёлое чувство, остающееся после чего н. Неприятный о. от разговора. Толковый словарь Ожегова. С.И … Толковый словарь Ожегова
-
Осадок — 17. Осадок Ндп. Гач Кек Корж Лепешка Совокупность твердых частиц с заполняющей их поры жидкостью, полученная в процессе разделения суспензии Источник: ГОСТ 1688 … Словарь-справочник терминов нормативно-технической документации
-
ОСАДОК — Выпадать/ выпасть в осадок. 1. Разг. Очень удивляться, изумляться неожиданности происходящего. ЧП, 18.02.92; Я молодой, 1995, № 15; Югановы, 53; СМЖ, 88; ФЛ, 101; НРЛ 81; DL, 143; Смирнов 2002, 33; СРГБ 2, 128; Вахитов 2003, 34. 2. Жарг. мол.… … Большой словарь русских поговорок
-
осадок — (иноск.) неприятное душевное чувство, оставшееся после беседы или известия (намек на осадок, устой на дне выпитой жидкости, обыкновенно неприятный) Ср. Степан Захарыч подивился лесной философии Горькухина и ничего не сказал, но почувствовал на… … Большой толково-фразеологический словарь Михельсона
-
осадок — дка; м. см. тж. осадочный 1) Мельчайшие частицы какого л. вещества, выделившиеся из раствора, жидкости и осевшие на дно. Дать оса/док. Жёлтый оса/док. Большой оса/док. Оса/док в вине … Словарь многих выражений
Цвета некоторых неорганических соединений.
Для успешного выполнения заданий ЕГЭ требуется помнить внешний вид и цвета соединений. Проще всего их запомнить, один раз увидев. Ниже приводятся фотографии наиболее «популярных» соединений. В подписях под картинками указаны те цвета, которыми в ЕГЭ чаще всего обозначают эти вещества.
| Соединения меди | |
 |
 |
| Металлическая медь, (красный или золотисто-красный) |
Оксид меди (II), (чёрный порошок) |
 |
 |
| Медный купорос, (синее кристаллическое вещество) |
Малахит, (сине-зелёный осадок) |
 |
|
| Гидроксид меди (II), (синий студенистый осадок) |
|
| Соединения железа | |
 |
|
| Оксид железа (III), (красный порошок) |
|
| Соединения хрома | |
 |
 |
| Оксид хрома (III), (зелёный порошок) |
Оксид хрома (VI), (Красные кристаллы) |
 |
 |
| Дихромат калия, (оранжевый порошок или раствор) |
Хромат калия, (жёлтый порошок или раствор) |
| Соединения серебра | |
 |
 |
| Хлорид серебра, (белый творожистый осадок) |
Бромид серебра, (бледно-желтый творожистый осадок) |
 |
 |
| Йодид серебра, (желтый творожистый осадок) |
Фосфат серебра, (жёлтый осадок) |
| Соединения марганца | |
 |
 |
| Перманганат калия, (фиолетовые кристаллы или раствор) |
Манганат калия, (зелёный раствор или кристаллы) |
 |
 |
| Диоксид марганца, (чёрно-коричневый порошок) |
Сульфат марганца (II), (бледно-розовый порошок или раствор) |
| Прочие вещества | |
 |
 |
| Диоксид азота, (бурый газ) |
Бром, (коричневая жидкость с красными парами) |
 |
 |
| Йод, (серо-коричневые кристаллы с фиолетовыми парами) |
Сера, (жёлтый порошок) |
 |
 |
| Красный фосфор, (красный порошок) |
Белый фосфор, (бледно-жёлтое воскообразное вещество) |
Если вам понравился наш материал — записывайтесь на курсы подготовки к ЕГЭ по химии онлайн
Спасибо за то, что пользуйтесь нашими материалами.
Информация на странице «Цвета некоторых неорганических соединений.» подготовлена нашими авторами специально, чтобы помочь вам в освоении предмета и подготовке к экзаменам.
Чтобы успешно сдать необходимые и поступить в ВУЗ или колледж нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими материалами из данного раздела.
Публикация обновлена:
08.01.2023