| Specific gravity | |
|---|---|
|
Common symbols |
SG |
| SI unit | Unitless |
|
Derivations from |
 |
Relative density, or specific gravity,[1][2] is the ratio of the density (mass of a unit volume) of a substance to the density of a given reference material. Specific gravity for liquids is nearly always measured with respect to water at its densest (at 4 °C or 39.2 °F); for gases, the reference is air at room temperature (20 °C or 68 °F). The term «relative density» (often abbreviated r.d. or RD) is often preferred in scientific usage, whereas the term «specific gravity» is deprecated.
If a substance’s relative density is less than 1 then it is less dense than the reference; if greater than 1 then it is denser than the reference. If the relative density is exactly 1 then the densities are equal; that is, equal volumes of the two substances have the same mass. If the reference material is water, then a substance with a relative density (or specific gravity) less than 1 will float in water. For example, an ice cube, with a relative density of about 0.91, will float. A substance with a relative density greater than 1 will sink.
Temperature and pressure must be specified for both the sample and the reference. Pressure is nearly always 1 atm (101.325 kPa). Where it is not, it is more usual to specify the density directly. Temperatures for both sample and reference vary from industry to industry. In British brewing practice, the specific gravity, as specified above, is multiplied by 1000.[3] Specific gravity is commonly used in industry as a simple means of obtaining information about the concentration of solutions of various materials such as brines, must weight (syrups, juices, honeys, brewers wort, must, etc.) and acids.
Basic calculation[edit]
Relative density (

where 



The reference material can be indicated using subscripts: 
The relative density of gases is often measured with respect to dry air at a temperature of 20 °C and a pressure of 101.325 kPa absolute, which has a density of 1.205 kg/m3. Relative density with respect to air can be obtained by
where 
Those with SG greater than 1 are denser than water and will, disregarding surface tension effects, sink in it. Those with an SG less than 1 are less dense than water and will float on it. In scientific work, the relationship of mass to volume is usually expressed directly in terms of the density (mass per unit volume) of the substance under study. It is in industry where specific gravity finds wide application, often for historical reasons.
True specific gravity of a liquid can be expressed mathematically as:
where 

The apparent specific gravity is simply the ratio of the weights of equal volumes of sample and water in air:
where 

It can be shown that true specific gravity can be computed from different properties:
where g is the local acceleration due to gravity, V is the volume of the sample and of water (the same for both), ρsample is the density of the sample, ρH2O is the density of water, WV represents a weight obtained in vacuum, 

The density of water varies with temperature and pressure as does the density of the sample. So it is necessary to specify the temperatures and pressures at which the densities or weights were determined. It is nearly always the case that measurements are made at 1 nominal atmosphere (101.325 kPa ± variations from changing weather patterns). But as specific gravity usually refers to highly incompressible aqueous solutions or other incompressible substances (such as petroleum products), variations in density caused by pressure are usually neglected at least where apparent specific gravity is being measured. For true (in vacuo) specific gravity calculations, air pressure must be considered (see below). Temperatures are specified by the notation (Ts/Tr), with Ts representing the temperature at which the sample’s density was determined and Tr the temperature at which the reference (water) density is specified. For example, SG (20 °C/4 °C) would be understood to mean that the density of the sample was determined at 20 °C and of the water at 4 °C. Taking into account different sample and reference temperatures, we note that, while SGH2O = 1.000000 (20 °C/20 °C), it is also the case that SGH2O = 0.998203⁄0.999840 = 0.998363 (20 °C/4 °C). Here, temperature is being specified using the current ITS-90 scale and the densities[4] used here and in the rest of this article are based on that scale. On the previous IPTS-68 scale, the densities at 20 °C and 4 °C are 0.9982071 and 0.9999720 respectively, resulting in an SG (20 °C/4 °C) value for water of 0.9982343.
As the principal use of specific gravity measurements in industry is determination of the concentrations of substances in aqueous solutions and as these are found in tables of SG versus concentration, it is extremely important that the analyst enter the table with the correct form of specific gravity. For example, in the brewing industry, the Plato table lists sucrose concentration by weight against true SG, and was originally (20 °C/4 °C)[5] i.e. based on measurements of the density of sucrose solutions made at laboratory temperature (20 °C) but referenced to the density of water at 4 °C which is very close to the temperature at which water has its maximum density, ρH2O equal to 999.972 kg/m3 in SI units (0.999972 g/cm3 in cgs units or 62.43 lb/cu ft in United States customary units). The ASBC table[6] in use today in North America, while it is derived from the original Plato table is for apparent specific gravity measurements at (20 °C/20 °C) on the IPTS-68 scale where the density of water is 0.9982071 g/cm3. In the sugar, soft drink, honey, fruit juice and related industries, sucrose concentration by weight is taken from a table prepared by A. Brix, which uses SG (17.5 °C/17.5 °C). As a final example, the British SG units are based on reference and sample temperatures of 60 °F and are thus (15.56 °C/15.56 °C).
Given the specific gravity of a substance, its actual density can be calculated by rearranging the above formula:
Occasionally a reference substance other than water is specified (for example, air), in which case specific gravity means density relative to that reference.
Temperature dependence[edit]
- See Density for a table of the measured densities of water at various temperatures.
The density of substances varies with temperature and pressure so that it is necessary to specify the temperatures and pressures at which the densities or masses were determined. It is nearly always the case that measurements are made at nominally 1 atmosphere (101.325 kPa ignoring the variations caused by changing weather patterns) but as relative density usually refers to highly incompressible aqueous solutions or other incompressible substances (such as petroleum products) variations in density caused by pressure are usually neglected at least where apparent relative density is being measured. For true (in vacuo) relative density calculations air pressure must be considered (see below). Temperatures are specified by the notation (Ts/Tr) with Ts representing the temperature at which the sample’s density was determined and Tr the temperature at which the reference (water) density is specified. For example, SG (20 °C/4 °C) would be understood to mean that the density of the sample was determined at 20 °C and of the water at 4 °C. Taking into account different sample and reference temperatures we note that while SGH2O = 1.000000 (20 °C/20 °C) it is also the case that RDH2O = 0.998203/0.998840 = 0.998363 (20 °C/4 °C). Here temperature is being specified using the current ITS-90 scale and the densities[7] used here and in the rest of this article are based on that scale. On the previous IPTS-68 scale the densities at 20 °C and 4 °C are, respectively, 0.9982071 and 0.9999720 resulting in an RD (20 °C/4 °C) value for water of 0.9982343.
The temperatures of the two materials may be explicitly stated in the density symbols; for example:
- relative density: 8.1520 °C
4 °C; or specific gravity: 2.43215
0
where the superscript indicates the temperature at which the density of the material is measured, and the subscript indicates the temperature of the reference substance to which it is compared.
Uses[edit]
Relative density can also help to quantify the buoyancy of a substance in a fluid or gas, or determine the density of an unknown substance from the known density of another. Relative density is often used by geologists and mineralogists to help determine the mineral content of a rock or other sample. Gemologists use it as an aid in the identification of gemstones. Water is preferred as the reference because measurements are then easy to carry out in the field (see below for examples of measurement methods).
As the principal use of relative density measurements in industry is determination of the concentrations of substances in aqueous solutions and these are found in tables of RD vs concentration it is extremely important that the analyst enter the table with the correct form of relative density. For example, in the brewing industry, the Plato table, which lists sucrose concentration by mass against true RD, were originally (20 °C/4 °C)[8] that is based on measurements of the density of sucrose solutions made at laboratory temperature (20 °C) but referenced to the density of water at 4 °C which is very close to the temperature at which water has its maximum density of ρ(H
2O) equal to 0.999972 g/cm3 (or 62.43 lb·ft−3). The ASBC table[9] in use today in North America, while it is derived from the original Plato table is for apparent relative density measurements at (20 °C/20 °C) on the IPTS-68 scale where the density of water is 0.9982071 g/cm3. In the sugar, soft drink, honey, fruit juice and related industries sucrose concentration by mass is taken from this work[3] which uses SG (17.5 °C/17.5 °C). As a final example, the British RD units are based on reference and sample temperatures of 60 °F and are thus (15.56 °C/15.56 °C).[3]
Measurement[edit]
Relative density can be calculated directly by measuring the density of a sample and dividing it by the (known) density of the reference substance. The density of the sample is simply its mass divided by its volume. Although mass is easy to measure, the volume of an irregularly shaped sample can be more difficult to ascertain. One method is to put the sample in a water-filled graduated cylinder and read off how much water it displaces. Alternatively the container can be filled to the brim, the sample immersed, and the volume of overflow measured. The surface tension of the water may keep a significant amount of water from overflowing, which is especially problematic for small samples. For this reason it is desirable to use a water container with as small a mouth as possible.
For each substance, the density, ρ, is given by
When these densities are divided, references to the spring constant, gravity and cross-sectional area simply cancel, leaving
Hydrostatic weighing[edit]
Relative density is more easily and perhaps more accurately measured without measuring volume. Using a spring scale, the sample is weighed first in air and then in water. Relative density (with respect to water) can then be calculated using the following formula:
where
- Wair is the weight of the sample in air (measured in newtons, pounds-force or some other unit of force)
- Wwater is the weight of the sample in water (measured in the same units).
This technique cannot easily be used to measure relative densities less than one, because the sample will then float. Wwater becomes a negative quantity, representing the force needed to keep the sample underwater.
Another practical method uses three measurements. The sample is weighed dry. Then a container filled to the brim with water is weighed, and weighed again with the sample immersed, after the displaced water has overflowed and been removed. Subtracting the last reading from the sum of the first two readings gives the weight of the displaced water. The relative density result is the dry sample weight divided by that of the displaced water. This method allows the use of scales which cannot handle a suspended sample. A sample less dense than water can also be handled, but it has to be held down, and the error introduced by the fixing material must be considered.
Hydrometer[edit]
The relative density of a liquid can be measured using a hydrometer. This consists of a bulb attached to a stalk of constant cross-sectional area, as shown in the adjacent diagram.
First the hydrometer is floated in the reference liquid (shown in light blue), and the displacement (the level of the liquid on the stalk) is marked (blue line). The reference could be any liquid, but in practice it is usually water.
The hydrometer is then floated in a liquid of unknown density (shown in green). The change in displacement, Δx, is noted. In the example depicted, the hydrometer has dropped slightly in the green liquid; hence its density is lower than that of the reference liquid. It is necessary that the hydrometer floats in both liquids.
The application of simple physical principles allows the relative density of the unknown liquid to be calculated from the change in displacement. (In practice the stalk of the hydrometer is pre-marked with graduations to facilitate this measurement.)
In the explanation that follows,
- ρref is the known density (mass per unit volume) of the reference liquid (typically water).
- ρnew is the unknown density of the new (green) liquid.
- RDnew/ref is the relative density of the new liquid with respect to the reference.
- V is the volume of reference liquid displaced, i.e. the red volume in the diagram.
- m is the mass of the entire hydrometer.
- g is the local gravitational constant.
- Δx is the change in displacement. In accordance with the way in which hydrometers are usually graduated, Δx is here taken to be negative if the displacement line rises on the stalk of the hydrometer, and positive if it falls. In the example depicted, Δx is negative.
- A is the cross sectional area of the shaft.
Since the floating hydrometer is in static equilibrium, the downward gravitational force acting upon it must exactly balance the upward buoyancy force. The gravitational force acting on the hydrometer is simply its weight, mg. From the Archimedes buoyancy principle, the buoyancy force acting on the hydrometer is equal to the weight of liquid displaced. This weight is equal to the mass of liquid displaced multiplied by g, which in the case of the reference liquid is ρrefVg. Setting these equal, we have
or just
|
|
(1) |
Exactly the same equation applies when the hydrometer is floating in the liquid being measured, except that the new volume is V − AΔx (see note above about the sign of Δx). Thus,
|
|
(2) |
Combining (1) and (2) yields
|
|
(3) |
But from (1) we have V = m/ρref. Substituting into (3) gives
|
|
(4) |
This equation allows the relative density to be calculated from the change in displacement, the known density of the reference liquid, and the known properties of the hydrometer. If Δx is small then, as a first-order approximation of the geometric series equation (4) can be written as:
This shows that, for small Δx, changes in displacement are approximately proportional to changes in relative density.
Pycnometer[edit]
An empty glass pycnometer and stopper
A pycnometer (from Greek: πυκνός (puknos) meaning «dense»), also called pyknometer or specific gravity bottle, is a device used to determine the density of a liquid. A pycnometer is usually made of glass, with a close-fitting ground glass stopper with a capillary tube through it, so that air bubbles may escape from the apparatus. This device enables a liquid’s density to be measured accurately by reference to an appropriate working fluid, such as water or mercury, using an analytical balance.[citation needed]
If the flask is weighed empty, full of water, and full of a liquid whose relative density is desired, the relative density of the liquid can easily be calculated. The particle density of a powder, to which the usual method of weighing cannot be applied, can also be determined with a pycnometer. The powder is added to the pycnometer, which is then weighed, giving the weight of the powder sample. The pycnometer is then filled with a liquid of known density, in which the powder is completely insoluble. The weight of the displaced liquid can then be determined, and hence the relative density of the powder.
A gas pycnometer, the gas-based manifestation of a pycnometer, compares the change in pressure caused by a measured change in a closed volume containing a reference (usually a steel sphere of known volume) with the change in pressure caused by the sample under the same conditions. The difference in change of pressure represents the volume of the sample as compared to the reference sphere, and is usually used for solid particulates that may dissolve in the liquid medium of the pycnometer design described above, or for porous materials into which the liquid would not fully penetrate.
When a pycnometer is filled to a specific, but not necessarily accurately known volume, V and is placed upon a balance, it will exert a force
where mb is the mass of the bottle and g the gravitational acceleration at the location at which the measurements are being made. ρa is the density of the air at the ambient pressure and ρb is the density of the material of which the bottle is made (usually glass) so that the second term is the mass of air displaced by the glass of the bottle whose weight, by Archimedes Principle must be subtracted. The bottle is filled with air but as that air displaces an equal amount of air the weight of that air is canceled by the weight of the air displaced. Now we fill the bottle with the reference fluid e.g. pure water. The force exerted on the pan of the balance becomes:
If we subtract the force measured on the empty bottle from this (or tare the balance before making the water measurement) we obtain.
where the subscript n indicated that this force is net of the force of the empty bottle. The bottle is now emptied, thoroughly dried and refilled with the sample. The force, net of the empty bottle, is now:
where ρs is the density of the sample. The ratio of the sample and water forces is:
This is called the apparent relative density, denoted by subscript A, because it is what we would obtain if we took the ratio of net weighings in air from an analytical balance or used a hydrometer (the stem displaces air). Note that the result does not depend on the calibration of the balance. The only requirement on it is that it read linearly with force. Nor does RDA depend on the actual volume of the pycnometer.
Further manipulation and finally substitution of RDV, the true relative density (the subscript V is used because this is often referred to as the relative density in vacuo), for ρs/ρw gives the relationship between apparent and true relative density:
In the usual case we will have measured weights and want the true relative density. This is found from
Since the density of dry air at 101.325 kPa at 20 °C is[10] 0.001205 g/cm3 and that of water is 0.998203 g/cm3 we see that the difference between true and apparent relative densities for a substance with relative density (20 °C/20 °C) of about 1.100 would be 0.000120. Where the relative density of the sample is close to that of water (for example dilute ethanol solutions) the correction is even smaller.
The pycnometer is used in ISO standard: ISO 1183-1:2004, ISO 1014–1985 and ASTM standard: ASTM D854.
Types
- Gay-Lussac, pear shaped, with perforated stopper, adjusted, capacity 1, 2, 5, 10, 25, 50 and 100 mL
- as above, with ground-in thermometer, adjusted, side tube with cap
- Hubbard, for bitumen and heavy crude oils, cylindrical type, ASTM D 70, 24 mL
- as above, conical type, ASTM D 115 and D 234, 25 mL
- Boot, with vacuum jacket and thermometer, capacity 5, 10, 25 and 50 mL
Digital density meters[edit]
Hydrostatic Pressure-based Instruments: This technology relies upon Pascal’s Principle which states that the pressure difference between two points within a vertical column of fluid is dependent upon the vertical distance between the two points, the density of the fluid and the gravitational force. This technology is often used for tank gaging applications as a convenient means of liquid level and density measure.
Vibrating Element Transducers: This type of instrument requires a vibrating element to be placed in contact with the fluid of interest. The resonant frequency of the element is measured and is related to the density of the fluid by a characterization that is dependent upon the design of the element. In modern laboratories precise measurements of relative density are made using oscillating U-tube meters. These are capable of measurement to 5 to 6 places beyond the decimal point and are used in the brewing, distilling, pharmaceutical, petroleum and other industries. The instruments measure the actual mass of fluid contained in a fixed volume at temperatures between 0 and 80 °C but as they are microprocessor based can calculate apparent or true relative density and contain tables relating these to the strengths of common acids, sugar solutions, etc.
Ultrasonic Transducer: Ultrasonic waves are passed from a source, through the fluid of interest, and into a detector which measures the acoustic spectroscopy of the waves. Fluid properties such as density and viscosity can be inferred from the spectrum.
Radiation-based Gauge: Radiation is passed from a source, through the fluid of interest, and into a scintillation detector, or counter. As the fluid density increases, the detected radiation «counts» will decrease. The source is typically the radioactive isotope caesium-137, with a half-life of about 30 years. A key advantage for this technology is that the instrument is not required to be in contact with the fluid—typically the source and detector are mounted on the outside of tanks or piping.[11]
Buoyant Force Transducer: the buoyancy force produced by a float in a homogeneous liquid is equal to the weight of the liquid that is displaced by the float. Since buoyancy force is linear with respect to the density of the liquid within which the float is submerged, the measure of the buoyancy force yields a measure of the density of the liquid. One commercially available unit claims the instrument is capable of measuring relative density with an accuracy of ± 0.005 RD units. The submersible probe head contains a mathematically characterized spring-float system. When the head is immersed vertically in the liquid, the float moves vertically and the position of the float controls the position of a permanent magnet whose displacement is sensed by a concentric array of Hall-effect linear displacement sensors. The output signals of the sensors are mixed in a dedicated electronics module that provides a single output voltage whose magnitude is a direct linear measure of the quantity to be measured.[12]
The relative density in soil mechanics[edit]
The relative density 
in which 

Examples[edit]
| Material | Specific gravity |
|---|---|
| Balsa wood | 0.2 |
| Oak wood | 0.75 |
| Ethanol | 0.78 |
| Olive oil | 0.91 |
| Water | 1 |
| Ironwood | 1.5 |
| Graphite | 1.9–2.3 |
| Table salt | 2.17 |
| Aluminium | 2.7 |
| Cement | 3.15 |
| Iron | 7.87 |
| Copper | 8.96 |
| Lead | 11.35 |
| Mercury | 13.56 |
| Depleted uranium | 19.1 |
| Gold | 19.3 |
| Osmium | 22.59 |
(Samples may vary, and these figures are approximate.)
Substances with a relative density of 1 are neutrally buoyant, those with RD greater than one are denser than water, and so (ignoring surface tension effects) will sink in it, and those with an RD of less than one are less dense than water, and so will float.
Example:
Helium gas has a density of 0.164 g/L;[13] it is 0.139 times as dense as air, which has a density of 1.18 g/L.[13]
- Urine normally has a specific gravity between 1.003 and 1.030. The Urine Specific Gravity diagnostic test is used to evaluate renal concentration ability for assessment of the urinary system.[14] Low concentration may indicate diabetes insipidus, while high concentration may indicate albuminuria or glycosuria.[14]
- Blood normally has a specific gravity of approximately 1.060.[15]
- Vodka 80° proof (40% v/v) has a specific gravity of 0.9498.[16]
See also[edit]
- API gravity
- Baumé scale
- Buoyancy
- Fluid mechanics
- Gravity (beer)
- Hydrometer
- Jolly balance
- Plato scale
References[edit]
- ^ Dana, Edward Salisbury (1922). A text-book of mineralogy: with an extended treatise on crystallography… New York, London(Chapman Hall): John Wiley and Sons. pp. 195–200, 316.
- ^ Schetz, Joseph A.; Allen E. Fuhs (1999-02-05). Fundamentals of fluid mechanics. Wiley, John & Sons, Incorporated. pp. 111, 142, 144, 147, 109, 155, 157, 160, 175. ISBN 0-471-34856-2.
- ^ a b c Hough, J.S., Briggs, D.E., Stevens, R and Young, T.W. Malting and Brewing Science, Vol. II Hopped Wort and Beer, Chapman and Hall, London, 1991, p. 881
- ^ Bettin, H.; Spieweck, F. (1990). «Die Dichte des Wassers als Funktion der Temperatur nach Einführung des Internationalen Temperaturskala von 1990». PTB-Mitteilungen 100. pp. 195–196.
- ^ ASBC Methods of Analysis Preface to Table 1: Extract in Wort and Beer, American Society of Brewing Chemists, St Paul, 2009
- ^ ASBC Methods of Analysis op. cit. Table 1: Extract in Wort and Beer
- ^ Bettin, H.; Spieweck, F. (1990). Die Dichte des Wassers als Funktion der Temperatur nach Einführung des Internationalen Temperaturskala von 1990 (in German). PTB=Mitt. 100. pp. 195–196.
- ^ ASBC Methods of Analysis Preface to Table 1: Extract in Wort and Beer, American Society of Brewing Chemists, St Paul, 2009
- ^ ASBC Methods of Analysis op. cit. Table 1: Extract in Wort and Beer
- ^ DIN51 757 (04.1994): Testing of mineral oils and related materials; determination of density
- ^ Density – VEGA Americas, Inc. Ohmartvega.com. Retrieved on 2011-09-30.
- ^ Process Control Digital Electronic Hydrometer. Gardco. Retrieved on 2011-09-30.
- ^ a b «Lecture Demonstrations». physics.ucsb.edu.
- ^ a b Lewis, Sharon Mantik; Dirksen, Shannon Ruff; Heitkemper, Margaret M.; Bucher, Linda; Harding, Mariann (5 December 2013). Medical-surgical nursing : assessment and management of clinical problems (9th ed.). St. Louis, Missouri. ISBN 978-0-323-10089-2. OCLC 228373703.
- ^ Shmukler, Michael (2004). Elert, Glenn (ed.). «Density of blood». The Physics Factbook. Retrieved 2022-01-23.
- ^ «Specific Gravity of Liqueurs». Good Cocktails.com.
Further reading[edit]
- Fundamentals of Fluid Mechanics Wiley, B.R. Munson, D.F. Young & T.H. Okishi
- Introduction to Fluid Mechanics Fourth Edition, Wiley, SI Version, R.W. Fox & A.T. McDonald
- Thermodynamics: An Engineering Approach Second Edition, McGraw-Hill, International Edition, Y.A. Cengel & M.A. Boles
- Munson, B. R.; D. F. Young; T. H. Okishi (2001). Fundamentals of Fluid Mechanics (4th ed.). Wiley. ISBN 978-0-471-44250-9.
- Fox, R. W.; McDonald, A. T. (2003). Introduction to Fluid Mechanics (4th ed.). Wiley. ISBN 0-471-20231-2.
External links[edit]
- Specific Gravity Weights Of Materials
| Specific gravity | |
|---|---|
|
Common symbols |
SG |
| SI unit | Unitless |
|
Derivations from |
 |
Relative density, or specific gravity,[1][2] is the ratio of the density (mass of a unit volume) of a substance to the density of a given reference material. Specific gravity for liquids is nearly always measured with respect to water at its densest (at 4 °C or 39.2 °F); for gases, the reference is air at room temperature (20 °C or 68 °F). The term «relative density» (often abbreviated r.d. or RD) is often preferred in scientific usage, whereas the term «specific gravity» is deprecated.
If a substance’s relative density is less than 1 then it is less dense than the reference; if greater than 1 then it is denser than the reference. If the relative density is exactly 1 then the densities are equal; that is, equal volumes of the two substances have the same mass. If the reference material is water, then a substance with a relative density (or specific gravity) less than 1 will float in water. For example, an ice cube, with a relative density of about 0.91, will float. A substance with a relative density greater than 1 will sink.
Temperature and pressure must be specified for both the sample and the reference. Pressure is nearly always 1 atm (101.325 kPa). Where it is not, it is more usual to specify the density directly. Temperatures for both sample and reference vary from industry to industry. In British brewing practice, the specific gravity, as specified above, is multiplied by 1000.[3] Specific gravity is commonly used in industry as a simple means of obtaining information about the concentration of solutions of various materials such as brines, must weight (syrups, juices, honeys, brewers wort, must, etc.) and acids.
Basic calculation[edit]
Relative density (

where 



The reference material can be indicated using subscripts: 
The relative density of gases is often measured with respect to dry air at a temperature of 20 °C and a pressure of 101.325 kPa absolute, which has a density of 1.205 kg/m3. Relative density with respect to air can be obtained by
where 
Those with SG greater than 1 are denser than water and will, disregarding surface tension effects, sink in it. Those with an SG less than 1 are less dense than water and will float on it. In scientific work, the relationship of mass to volume is usually expressed directly in terms of the density (mass per unit volume) of the substance under study. It is in industry where specific gravity finds wide application, often for historical reasons.
True specific gravity of a liquid can be expressed mathematically as:
where 

The apparent specific gravity is simply the ratio of the weights of equal volumes of sample and water in air:
where 

It can be shown that true specific gravity can be computed from different properties:
where g is the local acceleration due to gravity, V is the volume of the sample and of water (the same for both), ρsample is the density of the sample, ρH2O is the density of water, WV represents a weight obtained in vacuum, 

The density of water varies with temperature and pressure as does the density of the sample. So it is necessary to specify the temperatures and pressures at which the densities or weights were determined. It is nearly always the case that measurements are made at 1 nominal atmosphere (101.325 kPa ± variations from changing weather patterns). But as specific gravity usually refers to highly incompressible aqueous solutions or other incompressible substances (such as petroleum products), variations in density caused by pressure are usually neglected at least where apparent specific gravity is being measured. For true (in vacuo) specific gravity calculations, air pressure must be considered (see below). Temperatures are specified by the notation (Ts/Tr), with Ts representing the temperature at which the sample’s density was determined and Tr the temperature at which the reference (water) density is specified. For example, SG (20 °C/4 °C) would be understood to mean that the density of the sample was determined at 20 °C and of the water at 4 °C. Taking into account different sample and reference temperatures, we note that, while SGH2O = 1.000000 (20 °C/20 °C), it is also the case that SGH2O = 0.998203⁄0.999840 = 0.998363 (20 °C/4 °C). Here, temperature is being specified using the current ITS-90 scale and the densities[4] used here and in the rest of this article are based on that scale. On the previous IPTS-68 scale, the densities at 20 °C and 4 °C are 0.9982071 and 0.9999720 respectively, resulting in an SG (20 °C/4 °C) value for water of 0.9982343.
As the principal use of specific gravity measurements in industry is determination of the concentrations of substances in aqueous solutions and as these are found in tables of SG versus concentration, it is extremely important that the analyst enter the table with the correct form of specific gravity. For example, in the brewing industry, the Plato table lists sucrose concentration by weight against true SG, and was originally (20 °C/4 °C)[5] i.e. based on measurements of the density of sucrose solutions made at laboratory temperature (20 °C) but referenced to the density of water at 4 °C which is very close to the temperature at which water has its maximum density, ρH2O equal to 999.972 kg/m3 in SI units (0.999972 g/cm3 in cgs units or 62.43 lb/cu ft in United States customary units). The ASBC table[6] in use today in North America, while it is derived from the original Plato table is for apparent specific gravity measurements at (20 °C/20 °C) on the IPTS-68 scale where the density of water is 0.9982071 g/cm3. In the sugar, soft drink, honey, fruit juice and related industries, sucrose concentration by weight is taken from a table prepared by A. Brix, which uses SG (17.5 °C/17.5 °C). As a final example, the British SG units are based on reference and sample temperatures of 60 °F and are thus (15.56 °C/15.56 °C).
Given the specific gravity of a substance, its actual density can be calculated by rearranging the above formula:
Occasionally a reference substance other than water is specified (for example, air), in which case specific gravity means density relative to that reference.
Temperature dependence[edit]
- See Density for a table of the measured densities of water at various temperatures.
The density of substances varies with temperature and pressure so that it is necessary to specify the temperatures and pressures at which the densities or masses were determined. It is nearly always the case that measurements are made at nominally 1 atmosphere (101.325 kPa ignoring the variations caused by changing weather patterns) but as relative density usually refers to highly incompressible aqueous solutions or other incompressible substances (such as petroleum products) variations in density caused by pressure are usually neglected at least where apparent relative density is being measured. For true (in vacuo) relative density calculations air pressure must be considered (see below). Temperatures are specified by the notation (Ts/Tr) with Ts representing the temperature at which the sample’s density was determined and Tr the temperature at which the reference (water) density is specified. For example, SG (20 °C/4 °C) would be understood to mean that the density of the sample was determined at 20 °C and of the water at 4 °C. Taking into account different sample and reference temperatures we note that while SGH2O = 1.000000 (20 °C/20 °C) it is also the case that RDH2O = 0.998203/0.998840 = 0.998363 (20 °C/4 °C). Here temperature is being specified using the current ITS-90 scale and the densities[7] used here and in the rest of this article are based on that scale. On the previous IPTS-68 scale the densities at 20 °C and 4 °C are, respectively, 0.9982071 and 0.9999720 resulting in an RD (20 °C/4 °C) value for water of 0.9982343.
The temperatures of the two materials may be explicitly stated in the density symbols; for example:
- relative density: 8.1520 °C
4 °C; or specific gravity: 2.43215
0
where the superscript indicates the temperature at which the density of the material is measured, and the subscript indicates the temperature of the reference substance to which it is compared.
Uses[edit]
Relative density can also help to quantify the buoyancy of a substance in a fluid or gas, or determine the density of an unknown substance from the known density of another. Relative density is often used by geologists and mineralogists to help determine the mineral content of a rock or other sample. Gemologists use it as an aid in the identification of gemstones. Water is preferred as the reference because measurements are then easy to carry out in the field (see below for examples of measurement methods).
As the principal use of relative density measurements in industry is determination of the concentrations of substances in aqueous solutions and these are found in tables of RD vs concentration it is extremely important that the analyst enter the table with the correct form of relative density. For example, in the brewing industry, the Plato table, which lists sucrose concentration by mass against true RD, were originally (20 °C/4 °C)[8] that is based on measurements of the density of sucrose solutions made at laboratory temperature (20 °C) but referenced to the density of water at 4 °C which is very close to the temperature at which water has its maximum density of ρ(H
2O) equal to 0.999972 g/cm3 (or 62.43 lb·ft−3). The ASBC table[9] in use today in North America, while it is derived from the original Plato table is for apparent relative density measurements at (20 °C/20 °C) on the IPTS-68 scale where the density of water is 0.9982071 g/cm3. In the sugar, soft drink, honey, fruit juice and related industries sucrose concentration by mass is taken from this work[3] which uses SG (17.5 °C/17.5 °C). As a final example, the British RD units are based on reference and sample temperatures of 60 °F and are thus (15.56 °C/15.56 °C).[3]
Measurement[edit]
Relative density can be calculated directly by measuring the density of a sample and dividing it by the (known) density of the reference substance. The density of the sample is simply its mass divided by its volume. Although mass is easy to measure, the volume of an irregularly shaped sample can be more difficult to ascertain. One method is to put the sample in a water-filled graduated cylinder and read off how much water it displaces. Alternatively the container can be filled to the brim, the sample immersed, and the volume of overflow measured. The surface tension of the water may keep a significant amount of water from overflowing, which is especially problematic for small samples. For this reason it is desirable to use a water container with as small a mouth as possible.
For each substance, the density, ρ, is given by
When these densities are divided, references to the spring constant, gravity and cross-sectional area simply cancel, leaving
Hydrostatic weighing[edit]
Relative density is more easily and perhaps more accurately measured without measuring volume. Using a spring scale, the sample is weighed first in air and then in water. Relative density (with respect to water) can then be calculated using the following formula:
where
- Wair is the weight of the sample in air (measured in newtons, pounds-force or some other unit of force)
- Wwater is the weight of the sample in water (measured in the same units).
This technique cannot easily be used to measure relative densities less than one, because the sample will then float. Wwater becomes a negative quantity, representing the force needed to keep the sample underwater.
Another practical method uses three measurements. The sample is weighed dry. Then a container filled to the brim with water is weighed, and weighed again with the sample immersed, after the displaced water has overflowed and been removed. Subtracting the last reading from the sum of the first two readings gives the weight of the displaced water. The relative density result is the dry sample weight divided by that of the displaced water. This method allows the use of scales which cannot handle a suspended sample. A sample less dense than water can also be handled, but it has to be held down, and the error introduced by the fixing material must be considered.
Hydrometer[edit]
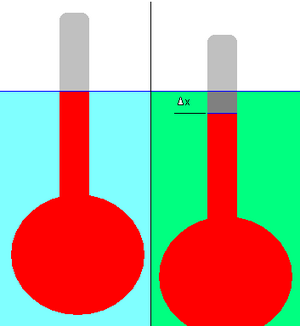
The relative density of a liquid can be measured using a hydrometer. This consists of a bulb attached to a stalk of constant cross-sectional area, as shown in the adjacent diagram.
First the hydrometer is floated in the reference liquid (shown in light blue), and the displacement (the level of the liquid on the stalk) is marked (blue line). The reference could be any liquid, but in practice it is usually water.
The hydrometer is then floated in a liquid of unknown density (shown in green). The change in displacement, Δx, is noted. In the example depicted, the hydrometer has dropped slightly in the green liquid; hence its density is lower than that of the reference liquid. It is necessary that the hydrometer floats in both liquids.
The application of simple physical principles allows the relative density of the unknown liquid to be calculated from the change in displacement. (In practice the stalk of the hydrometer is pre-marked with graduations to facilitate this measurement.)
In the explanation that follows,
- ρref is the known density (mass per unit volume) of the reference liquid (typically water).
- ρnew is the unknown density of the new (green) liquid.
- RDnew/ref is the relative density of the new liquid with respect to the reference.
- V is the volume of reference liquid displaced, i.e. the red volume in the diagram.
- m is the mass of the entire hydrometer.
- g is the local gravitational constant.
- Δx is the change in displacement. In accordance with the way in which hydrometers are usually graduated, Δx is here taken to be negative if the displacement line rises on the stalk of the hydrometer, and positive if it falls. In the example depicted, Δx is negative.
- A is the cross sectional area of the shaft.
Since the floating hydrometer is in static equilibrium, the downward gravitational force acting upon it must exactly balance the upward buoyancy force. The gravitational force acting on the hydrometer is simply its weight, mg. From the Archimedes buoyancy principle, the buoyancy force acting on the hydrometer is equal to the weight of liquid displaced. This weight is equal to the mass of liquid displaced multiplied by g, which in the case of the reference liquid is ρrefVg. Setting these equal, we have
or just
|
|
(1) |
Exactly the same equation applies when the hydrometer is floating in the liquid being measured, except that the new volume is V − AΔx (see note above about the sign of Δx). Thus,
|
|
(2) |
Combining (1) and (2) yields
|
|
(3) |
But from (1) we have V = m/ρref. Substituting into (3) gives
|
|
(4) |
This equation allows the relative density to be calculated from the change in displacement, the known density of the reference liquid, and the known properties of the hydrometer. If Δx is small then, as a first-order approximation of the geometric series equation (4) can be written as:
This shows that, for small Δx, changes in displacement are approximately proportional to changes in relative density.
Pycnometer[edit]
An empty glass pycnometer and stopper
A pycnometer (from Greek: πυκνός (puknos) meaning «dense»), also called pyknometer or specific gravity bottle, is a device used to determine the density of a liquid. A pycnometer is usually made of glass, with a close-fitting ground glass stopper with a capillary tube through it, so that air bubbles may escape from the apparatus. This device enables a liquid’s density to be measured accurately by reference to an appropriate working fluid, such as water or mercury, using an analytical balance.[citation needed]
If the flask is weighed empty, full of water, and full of a liquid whose relative density is desired, the relative density of the liquid can easily be calculated. The particle density of a powder, to which the usual method of weighing cannot be applied, can also be determined with a pycnometer. The powder is added to the pycnometer, which is then weighed, giving the weight of the powder sample. The pycnometer is then filled with a liquid of known density, in which the powder is completely insoluble. The weight of the displaced liquid can then be determined, and hence the relative density of the powder.
A gas pycnometer, the gas-based manifestation of a pycnometer, compares the change in pressure caused by a measured change in a closed volume containing a reference (usually a steel sphere of known volume) with the change in pressure caused by the sample under the same conditions. The difference in change of pressure represents the volume of the sample as compared to the reference sphere, and is usually used for solid particulates that may dissolve in the liquid medium of the pycnometer design described above, or for porous materials into which the liquid would not fully penetrate.
When a pycnometer is filled to a specific, but not necessarily accurately known volume, V and is placed upon a balance, it will exert a force
where mb is the mass of the bottle and g the gravitational acceleration at the location at which the measurements are being made. ρa is the density of the air at the ambient pressure and ρb is the density of the material of which the bottle is made (usually glass) so that the second term is the mass of air displaced by the glass of the bottle whose weight, by Archimedes Principle must be subtracted. The bottle is filled with air but as that air displaces an equal amount of air the weight of that air is canceled by the weight of the air displaced. Now we fill the bottle with the reference fluid e.g. pure water. The force exerted on the pan of the balance becomes:
If we subtract the force measured on the empty bottle from this (or tare the balance before making the water measurement) we obtain.
where the subscript n indicated that this force is net of the force of the empty bottle. The bottle is now emptied, thoroughly dried and refilled with the sample. The force, net of the empty bottle, is now:
where ρs is the density of the sample. The ratio of the sample and water forces is:
This is called the apparent relative density, denoted by subscript A, because it is what we would obtain if we took the ratio of net weighings in air from an analytical balance or used a hydrometer (the stem displaces air). Note that the result does not depend on the calibration of the balance. The only requirement on it is that it read linearly with force. Nor does RDA depend on the actual volume of the pycnometer.
Further manipulation and finally substitution of RDV, the true relative density (the subscript V is used because this is often referred to as the relative density in vacuo), for ρs/ρw gives the relationship between apparent and true relative density:
In the usual case we will have measured weights and want the true relative density. This is found from
Since the density of dry air at 101.325 kPa at 20 °C is[10] 0.001205 g/cm3 and that of water is 0.998203 g/cm3 we see that the difference between true and apparent relative densities for a substance with relative density (20 °C/20 °C) of about 1.100 would be 0.000120. Where the relative density of the sample is close to that of water (for example dilute ethanol solutions) the correction is even smaller.
The pycnometer is used in ISO standard: ISO 1183-1:2004, ISO 1014–1985 and ASTM standard: ASTM D854.
Types
- Gay-Lussac, pear shaped, with perforated stopper, adjusted, capacity 1, 2, 5, 10, 25, 50 and 100 mL
- as above, with ground-in thermometer, adjusted, side tube with cap
- Hubbard, for bitumen and heavy crude oils, cylindrical type, ASTM D 70, 24 mL
- as above, conical type, ASTM D 115 and D 234, 25 mL
- Boot, with vacuum jacket and thermometer, capacity 5, 10, 25 and 50 mL
Digital density meters[edit]
Hydrostatic Pressure-based Instruments: This technology relies upon Pascal’s Principle which states that the pressure difference between two points within a vertical column of fluid is dependent upon the vertical distance between the two points, the density of the fluid and the gravitational force. This technology is often used for tank gaging applications as a convenient means of liquid level and density measure.
Vibrating Element Transducers: This type of instrument requires a vibrating element to be placed in contact with the fluid of interest. The resonant frequency of the element is measured and is related to the density of the fluid by a characterization that is dependent upon the design of the element. In modern laboratories precise measurements of relative density are made using oscillating U-tube meters. These are capable of measurement to 5 to 6 places beyond the decimal point and are used in the brewing, distilling, pharmaceutical, petroleum and other industries. The instruments measure the actual mass of fluid contained in a fixed volume at temperatures between 0 and 80 °C but as they are microprocessor based can calculate apparent or true relative density and contain tables relating these to the strengths of common acids, sugar solutions, etc.
Ultrasonic Transducer: Ultrasonic waves are passed from a source, through the fluid of interest, and into a detector which measures the acoustic spectroscopy of the waves. Fluid properties such as density and viscosity can be inferred from the spectrum.
Radiation-based Gauge: Radiation is passed from a source, through the fluid of interest, and into a scintillation detector, or counter. As the fluid density increases, the detected radiation «counts» will decrease. The source is typically the radioactive isotope caesium-137, with a half-life of about 30 years. A key advantage for this technology is that the instrument is not required to be in contact with the fluid—typically the source and detector are mounted on the outside of tanks or piping.[11]
Buoyant Force Transducer: the buoyancy force produced by a float in a homogeneous liquid is equal to the weight of the liquid that is displaced by the float. Since buoyancy force is linear with respect to the density of the liquid within which the float is submerged, the measure of the buoyancy force yields a measure of the density of the liquid. One commercially available unit claims the instrument is capable of measuring relative density with an accuracy of ± 0.005 RD units. The submersible probe head contains a mathematically characterized spring-float system. When the head is immersed vertically in the liquid, the float moves vertically and the position of the float controls the position of a permanent magnet whose displacement is sensed by a concentric array of Hall-effect linear displacement sensors. The output signals of the sensors are mixed in a dedicated electronics module that provides a single output voltage whose magnitude is a direct linear measure of the quantity to be measured.[12]
The relative density in soil mechanics[edit]
The relative density 
in which 

Examples[edit]
| Material | Specific gravity |
|---|---|
| Balsa wood | 0.2 |
| Oak wood | 0.75 |
| Ethanol | 0.78 |
| Olive oil | 0.91 |
| Water | 1 |
| Ironwood | 1.5 |
| Graphite | 1.9–2.3 |
| Table salt | 2.17 |
| Aluminium | 2.7 |
| Cement | 3.15 |
| Iron | 7.87 |
| Copper | 8.96 |
| Lead | 11.35 |
| Mercury | 13.56 |
| Depleted uranium | 19.1 |
| Gold | 19.3 |
| Osmium | 22.59 |
(Samples may vary, and these figures are approximate.)
Substances with a relative density of 1 are neutrally buoyant, those with RD greater than one are denser than water, and so (ignoring surface tension effects) will sink in it, and those with an RD of less than one are less dense than water, and so will float.
Example:
Helium gas has a density of 0.164 g/L;[13] it is 0.139 times as dense as air, which has a density of 1.18 g/L.[13]
- Urine normally has a specific gravity between 1.003 and 1.030. The Urine Specific Gravity diagnostic test is used to evaluate renal concentration ability for assessment of the urinary system.[14] Low concentration may indicate diabetes insipidus, while high concentration may indicate albuminuria or glycosuria.[14]
- Blood normally has a specific gravity of approximately 1.060.[15]
- Vodka 80° proof (40% v/v) has a specific gravity of 0.9498.[16]
See also[edit]
- API gravity
- Baumé scale
- Buoyancy
- Fluid mechanics
- Gravity (beer)
- Hydrometer
- Jolly balance
- Plato scale
References[edit]
- ^ Dana, Edward Salisbury (1922). A text-book of mineralogy: with an extended treatise on crystallography… New York, London(Chapman Hall): John Wiley and Sons. pp. 195–200, 316.
- ^ Schetz, Joseph A.; Allen E. Fuhs (1999-02-05). Fundamentals of fluid mechanics. Wiley, John & Sons, Incorporated. pp. 111, 142, 144, 147, 109, 155, 157, 160, 175. ISBN 0-471-34856-2.
- ^ a b c Hough, J.S., Briggs, D.E., Stevens, R and Young, T.W. Malting and Brewing Science, Vol. II Hopped Wort and Beer, Chapman and Hall, London, 1991, p. 881
- ^ Bettin, H.; Spieweck, F. (1990). «Die Dichte des Wassers als Funktion der Temperatur nach Einführung des Internationalen Temperaturskala von 1990». PTB-Mitteilungen 100. pp. 195–196.
- ^ ASBC Methods of Analysis Preface to Table 1: Extract in Wort and Beer, American Society of Brewing Chemists, St Paul, 2009
- ^ ASBC Methods of Analysis op. cit. Table 1: Extract in Wort and Beer
- ^ Bettin, H.; Spieweck, F. (1990). Die Dichte des Wassers als Funktion der Temperatur nach Einführung des Internationalen Temperaturskala von 1990 (in German). PTB=Mitt. 100. pp. 195–196.
- ^ ASBC Methods of Analysis Preface to Table 1: Extract in Wort and Beer, American Society of Brewing Chemists, St Paul, 2009
- ^ ASBC Methods of Analysis op. cit. Table 1: Extract in Wort and Beer
- ^ DIN51 757 (04.1994): Testing of mineral oils and related materials; determination of density
- ^ Density – VEGA Americas, Inc. Ohmartvega.com. Retrieved on 2011-09-30.
- ^ Process Control Digital Electronic Hydrometer. Gardco. Retrieved on 2011-09-30.
- ^ a b «Lecture Demonstrations». physics.ucsb.edu.
- ^ a b Lewis, Sharon Mantik; Dirksen, Shannon Ruff; Heitkemper, Margaret M.; Bucher, Linda; Harding, Mariann (5 December 2013). Medical-surgical nursing : assessment and management of clinical problems (9th ed.). St. Louis, Missouri. ISBN 978-0-323-10089-2. OCLC 228373703.
- ^ Shmukler, Michael (2004). Elert, Glenn (ed.). «Density of blood». The Physics Factbook. Retrieved 2022-01-23.
- ^ «Specific Gravity of Liqueurs». Good Cocktails.com.
Further reading[edit]
- Fundamentals of Fluid Mechanics Wiley, B.R. Munson, D.F. Young & T.H. Okishi
- Introduction to Fluid Mechanics Fourth Edition, Wiley, SI Version, R.W. Fox & A.T. McDonald
- Thermodynamics: An Engineering Approach Second Edition, McGraw-Hill, International Edition, Y.A. Cengel & M.A. Boles
- Munson, B. R.; D. F. Young; T. H. Okishi (2001). Fundamentals of Fluid Mechanics (4th ed.). Wiley. ISBN 978-0-471-44250-9.
- Fox, R. W.; McDonald, A. T. (2003). Introduction to Fluid Mechanics (4th ed.). Wiley. ISBN 0-471-20231-2.
External links[edit]
- Specific Gravity Weights Of Materials
Относительной плотностью вещества называют отношение плотности исследуемого вещества к плотности эталонного вещества. В качестве эталонной жидкости чаще всего используют дистиллированную воду, плотность которой при +20 °C равна 998,203 кг/м3, а при температуре максимальной плотности (+4 °C) составляет 999,973 кг/м3.
Определение относительной плотности для жидкости при +20 °C обычно производят путём деления массы определенного объёма жидкости к массе воды этого же объёма при этой же температуре. При этом получают относительную плотность вещества относительно плотности воды при +20 °C и обозначают эту величину как 


Чтобы определить плотность вещества, необходимо относительную плотность умножить на величину абсолютной плотности воды при температуре измерения. Часто можно встретить величину относительной плотности 

См. также
- Объемная плотность
- Удельный вес
Плотность — физическая величина. Определяется отношением массы определенного тела к его обьему.
В физике плотность обозначается маленькой греческой буквой p (читается как «ро»).
Плотность имеет очень широкий диапазон величин. Самой низкой плотностью обладает межгалактическая среда. А самую высокую плотность имеет атомное ядро.
KennyKlapon
Мастер
(1137),
закрыт
13 лет назад
Правильные решения и ответы на любые задания для школьника или студента быстро онлайн. А если не нашли нужное решение или ответ, то задайте свой вопрос нашим специалистам.
Как найти плотность газа в химии?
На этой странице вы найдете ответ на вопрос Как найти плотность газа в химии?. Вопрос
соответствует категории Химия и уровню подготовки учащихся 5 — 9 классов классов. Если ответ полностью не удовлетворяет критериям поиска, ниже можно
ознакомиться с вариантами ответов других посетителей страницы или обсудить с
ними интересующую тему. Здесь также можно воспользоваться «умным поиском»,
который покажет аналогичные вопросы в этой категории. Если ни один из
предложенных ответов не подходит, попробуйте самостоятельно сформулировать
вопрос иначе, нажав кнопку вверху страницы.
В химических
лабораториях очень часто приходится
определять плотность. В литературе
прежних лет и в справочниках старых
изданий приводятся таблицы удельных
весов растворов и твердых тел. Этой
величиной пользовались
вместо плотности, являющейся одной из
важнейших физических величин, которыми
характеризуют свойства вещества.
Плотностью вещества
называют отношение массы тела к его
объему:
т
р-ТГ
где р — плотность;
т —
масса тела, г;
V —
объем тела, см3.
Следовательно,
плотность вещества выражают* в г/см3.
Удельным
весом
у называют
отношение
веса (силы
тяжести) вещества к объему:
G
Плотность и удельный
вес вещества находятся в такой же
зависимости между собой, как масса и
вес, т. е.
где g
— местное
значение ускорения силы тяжести при
свободном падении. Таким образом,
размерность удельного веса
(г/см2-аж2)
и плотности
{г/см6),
а также их
числовыезна-
* В ряде случаев
плотность выражают в г/мл.
Различие
между числовыми значениями плотности,
выраженными в г/см3
и г/мл,
очень
незначительно. Его следует принимать
во внимание лишь при работах особой
точности.
518
чения, выраженные
в одной системе единиц, отличаются друг
от друга**.
Плотность тела не
зависит от его местонахождения на Земле,
в то время как удельный вес изменяется
в зависимости от того, в каком месте
Земли его измерить.
В ряде случаев
предпочитают пользоваться так называемой
относительной
плотностью,
представляющей
собой отношение плотности данного
вещества к
плотности другого вещества при
определенных условиях. Относительная
плотность выражается отвлеченным
числом.
Относительную
плотность d
жидких
и твердых веществ принято
определять по отношению к плотности
дистиллированной воды:
Рв
m
где
р = -у плотность
вещества;
рв
= гг плотность дистиллированной воды
при
4 °С.
Само
собой разумеется, что р и рв
должны выражаться одинаковыми
единицами.
Относительную
плотность d
можно
также выражать отношением массы взятого
вещества к массе дистиллированной
воды, взятой в том же объеме, что и
вещество, при определенных, постоянных
условиях.
Поскольку
числовые значения как относительной
плотности,
так и относительного удельного веса
при указанных постоянных условиях
являются одинаковыми, пользоваться
таблицами относительных удельных весов
в справочниках можно так же, как если
бы это были таблицы плотности.
Относительная
плотность является постоянной величиной
для каждого химически однородного
вещества и для растворов при данной
температуре. Поэтому по ве-
** В технической
системе единиц (МКГСС), в которой за
основную единицу принята не единица
массы, а единица силы — килограмм-сила
(кГ или
кгс), удельный
вес выражается в кГ/м3
или Г/см3.
Следует
отметить, что числовые значения удельного
веса, измеренного в Г/см3,
и плотности,
измеренной в г/см3,
совпадают,
что нередко вызывает путаницу в понятиях
«плотность» и «удельный вес».
619
личине относительной
плотности во многих случаях можно
судить о концентрации вещества в
растворе.
О.бычно
плотность раствора увеличивается с
увеличением
концентрации растворенного вещества
(если оно само
имеет плотность больше, чем растворитель).
Но имеются
вещества, для которых увеличение
плотности с увеличением концентрации
идет только до известного предела,
после которого при увеличении концентрации
происходит уменьшение плотности.
Например, серная
кислота имеет наивысшую плотность,
равную 1,8415 при концентрации 97,35%.
Дальнейшее увеличение концентрации
сопровождается уменьшением плотности
до 1,8315, что соответствует 99,31%.
Уксусная кислота
имеет максимальную плотность при
концентрации 77—79%, а 100%-ная уксусная
кислота имеет ту же плотность, что и 41
%-ная.
Относительная
плотность зависит от температуры, при
которой ее определяют. Поэтому всегда
указывают температуру, при которой
делали определение, и температуру
воды (объем взят за единицу). В справочниках
это показывают при помощи соответствующих
индексов, например d|°;
приведенное
обозначение указывает, что относительная
плотность определена при температуре
20 °С и за единицу для сравнения взята
плотность воды при температуре 4 °С.
Встречаются также и другие индексы,
обозначающие условия, при которых
производилось определение относительной
плотности, например df,
d5
и т. д.
Изменение
относительной плотности 90%-ной серной
кислоты в зависимости от температуры
окружающей среды приводится ниже:
Температура, °С
. . . . 10 15 20
Относительная
плотность 1,8252 1,8198 1,8144
Относительная
плотность с повышением температуры
уменьшается, с понижением ее —
увеличивается.
При определении
относительной плотности необходимо
отмечать температуру, при которой оно
проведено, и полученные
величины сравнивать с табличными
данными, определенными
при той же температуре.
Если измерение
проведено не при той температуре,
которая указана в справочнике, то вводят
поправку, вычисляемую как среднее
изменение относительной плот-
620
мости на один
градус. Например, если в интервале между
15
и 20 °С относительная плотность 90%-ной
серной кислоты
уменьшается на 1,8198—1,8144
= 0,0054, то в
среднем можно принять, что при
изменении температуры на 1 X
(выше 15
°С) относительная плотность уменьшается
на 0,0054 : 5=0,0011.
Таким образом,
если определение вести при 18 °С, то
относительная плотность указанного
раствора должна
быть равна:
0,0054(18—15)
1,8198
— ~ ‘-
= 1,8166
что можно записать:
d’48
= 1,8166.
Однако для введения
температурной поправки к относительной
плотности удобнее пользоваться
приведенной ниже номограммой (рис.
488).
Эта номограмма,
кроме того, дает возможность по известной
относительной плотности, вычисленной
при стандартной
температуре 20 °С, приближенно определять
относительную плотность при других
температурах, в чем иногда может
возникнуть потребность.
Относительную
плотность жидкостей можно определять
при помощи ареометров, пикнометров,
специальных весов и т. п.
Определение
относительной плотности ареометрами.
Для
быстрого определения относительной
плотности жидкости применяют так
называемые ареометры
(рис. 489).
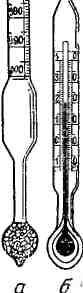
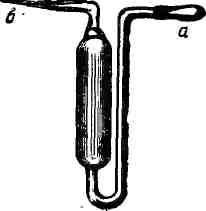
Это — стеклянная трубка (рис. 489, а),
расширяющаяся
внизу и имеющая на конце стеклянный
резервуар, заполненный дробью или
специальной массой (реже—ртутью). В
верхней узкой части ареометра имеется
шкала с делениями. Чем меньше относительная
плотность жидкости, тем глубже
погружается в нее ареометр. Поэтому на
его шкале вверху нанесено наименьшее
значение
относительной плотности, которое можно
определить данным ареометром, внизу —
наибольшее. Например, у ареометров
для жидкостей с относительной плотностью
меньше единицы внизу стоит 1,000, выше
0,990, еще выше
0,980 и т. д.
Промежутки между
цифрами разделены на более мелкие
деления, позволяющие определять
относительную плотность с точностью
до третьего десятичного знака.
У наиболее точных
ареометров шкала охватывает значения
относительной плотности в пределах
0,2—0,4 еди-
621
0,9503
Рис.
488.
Номограмма
температурной
н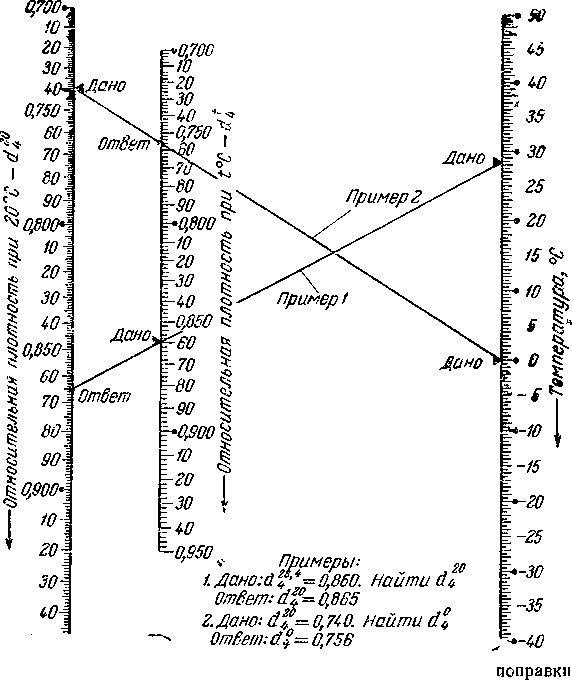
(например, для определения плотности
от 1,б0|) до1,200,
от 1,200 до 1,400 н т. д.). Такие ареометры
обычно продают
в виде наборов, которые дают
возможность
для введения к
плотности.
определять
относительную плотность в широком
интервале.
Иногда
ареометры снабжены термометрами (рис.
489, б), что
позволяет одновременно измерять
температуру, при которой проводится
определение.
Для определения
относительной плотности при помощи
ареометра жидкость наливают в стеклянный
цилиндр
Г
(рис. 490) емкостью
не менее 0,5 л,
сходный по
форме с
мерйым, но без носика и делений.
Размер цилиндра дол
жен’!
соответствовать размеру ареометра.
Наливать жид
кость в цилиндр до
краев не следует, так как при погру
жении
ареометра жидкость может перелиться
через край.
Это
бывает даже опасно при измерении
плотности кон
центрированных
кислот или концентрирован- «;
ных
щелочей и пр. Поэтому уровень жид
кости
в цилиндре должен быть на несколь
ко
сантиметров ниже края цилиндра.
У
Иногда цилиндр
для определения плотности
имеет вверху желоб, расположенный
концентрически,
так что если жидкость при погружении
ареометра перельется через край, то
она не выльется на стол.
Для определения
относительной плотности
имеются специальные приборы,
поддерживающие
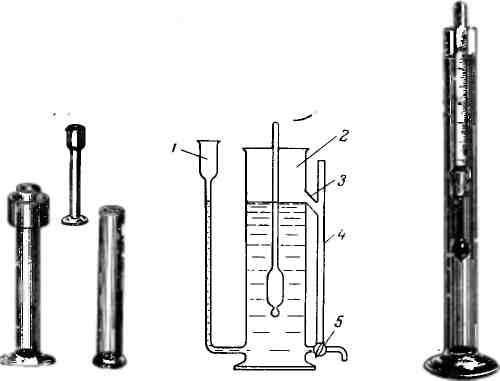
постоянный уровень жидкости в цилиндре.
Схема одного из таких приборов
приведена на рис. 491. Это — цилиндр 2,
имеющий на
определенной высоте отводную трубку
3 для
стекания жидкости, вытесняемой
ареометром при погружении его в жидкость.
Вытесняемая жидкость поступает в
трубку 4,
имеющую
кран 5, через
который жидкость может быть слита.
Цилиндр можно наполнять исследуемой
жидкостью через уравнительную трубку
/, имеющую в верхней части цилиндрическое
расширение.
Рис. 489.
Ареометры.
Ареометр
Погружать ареометр
в жидкость следует осторожно,
не выпуская
его из рук до тех
пор, пока не станет очевидным, что он
плавает.
Тогда руку осторожно отпускают, и
ареометр принимает нужное положение,
должен находиться в центре цилиндра и
ни в коем случае не касаться стенок или
быть к ним очень близко, так как положение
ареометра в цилиндре отражается на
точности показаний. Точно так же
совершенно недопустимо, чтобы
ареометр касался дна цилиндра (рис.
492).
Отсчет проводят
по делениям шкалы ареометра. Деление,
против которого установился верхний
мениск жидкости, характеризует
величину плотности.
623
622

После
определения ареометр обмывают водой
(^сли
определялась
плотность водных растворов), вытирают
и
убирают в специальный футляр или в
ящик. I
Если определяют
относительную плотность жидкости,
нерастворимой в воде, то обмыть ареометр
нужно каким-нибудь органическим
растворителем.
Рис. 490. Цилиндры
для Рис. 491. Прибор для Рис
492.
определения
плотности определения плотности: Правильное
при помощи
ареометров. / _ уравнительная
трубка; положение
2
—
цилиндр; з
—
отводная ареометра
трубка;
4
—
трубка;
5
— кран. «п
Измерении
плотности.
Ареометр требует
осторожного обращения (его можно
легко разбить), что нужно всегда помнить
при работе с ним.
Существуют
специальные ареометры, сразу дающие
нужную характеристику жидкости. Так,
для спирта имеются
специальные спиртометры,
сразу показывающие
процентное содержание спирта; для
молока применяются
так называемые лактометры,
показывающие
содержание жира в молоке, и т. п.
Определение
относительной плотности пикнометрами.
Для
определения относительной плотности
жидкостей
с
точностью до четвертого знака пользуются
пикнометрами
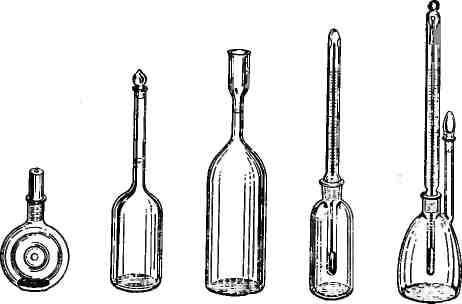
(рис. 493).
При определении
относительной плотности вначале
взвешивают
пустой пикнометр, потом с водой, а затем
с исследуемой жидкостью и находят массу
равных объемов исследуемой
жидкости и воды. Взяв отношение этих
масс, получают
значение относительной плотности (at).
Пусть Р
— масса
пустого пикнометра, Рг
— масса
пикнометра с исследуемой жидкостью,
Р2
— масса
пик-
а б е
‘ г
Рис. 493. Пикнометры
для определения плотности:
а —
Гей-Люссака; б — Рейшауера; в
— Ренье; г
— Менделеева.
нометра с
дистиллированной водой, тогда
относительная плотность исследуемой
жидкости равна:
at
— Р2
— Р
где
(Рг
—
Р)
и
(Р2
— Р)
—
соответственно массы исследуемой
жидкости и воды в объеме пикнометра.
Все взвешивания
проводят на аналитических весах с
точностью до 0,0001
г.
Как и при работе
с ареометром, относительную плотность
определяют при некоторой известной
температуре, обычно
при 20 °С. При этой же температуре
определяют массу воды и пикнометра.
Зная массу воды и найдя в таблицах
ее плотность при 20 °С, можно определить
емкость пикнометра при этой температуре.
ей
40-П7
625
40*
В СССР принята стандартная
температура 20 °С, и все общесоюзные
стандарты основаны на измерениях при]
этой температуре.
При исследовательских
работах наиболее часто применяют
пикнометр Оствальда (рис. 494). На трубки
а и
б пикнометра
надевают отрезки из тонкой резиновом
трубки, закрытые стеклянными палочками.
Вначале пикнометр
хорошо промывают, ополаскивают спиртом
и эфиром и тщательно высушивают,
просасывая
через него
воздух. Для этого,
присоединяют
трубку б к
склян*
ке Дрекселя или Тищенко,
на-1
полненной серной кислотой,
а
трубку а
— к
водоструйному на4
сосу. Когда сушка
закончена, пу«
стой пикнометр вместе
с резин о J
выми
колпачками взвешивают на
аналитических
весах с точностью!
до 0,0001 г
и массу
записывают!
Для удобства взвешивания
в*!
Рис.
494. Пикнометр по верхней части прибора
(у изгибом
Оствальду. трубок
а и б)
прикрепляют
петель-
ку из тонкой
проволоки и за нее пикнометр подвешивают
к крючку, имеющемуся у подЛ вески чашек.
Взвешенный пикнометр
заполняют водой, для чего оЛ тянутую
трубку б
погружают
в наполненный дистиллич рованной водой
стакан и насасывают воду через резино|
вую трубку, надетую на трубку а.
При этом
заполняют} весь пикнометр, не обращая
внимания на метку, имеющу! юся на трубке
а. После
этого прибор помещают на 10-М
15 мин
в водяной
термостат, поддерживая температур^} (20
°С) с точностью до десятых долей градуса.
При
определении относительной плотности
пикнометр? должен
быть так наполнен жидкостью, чтобы она
дохсЛ дила до метки на трубке а
и заполняла
оттянутую трубку б
Если жидкость
переходит за метку, то излишек осторожна
удаляют фильтровальной бумагой. Если
в трубке б остал| ся пузырек воздуха,
его выгоняют, постепенно наклоняв
пикнометр.
Когда уровень
жидкости установили точно, обе труб! ки
закрывают резиновыми колпачками, причем
прежде всего оттянутую трубку, а потом
трубку с меткой-
П*
Вынутый
из воды пикнометр обтирают чистым
полотенцем
(следить, чтобы на стенках не оставалось
волокон) и взвешивают на аналитических
весах с точностью до 0.0001
г.
Затем
выливают воду из пикнометра, снова
тщательно
высушивают его снаружи и внутри и
наполняют исследуемой жидкостью.
Точную установку
уровня жидкости в пикнометре (до
метки) проводят после того, как прибор,
наполненный исследуемой
жидкостью, пробыл 10—15 мин
в
термостате. Взвешивание
проводят, как описано выше. После
окончания работы из пикнометра
выливают жидкость, его моют и убирают
на место.
Пикнометр дает
возможность работать с очень небольшими
количествами жидкости, и получаемые
результаты имеют
достаточную точность.
В лабораторной
практике большим распространением
пользуются также пикнометры Гей-Люссака
(рис. 494, а).
Порядок
работы с ними такой же, как и с пикнометрами
Оствальда. Если на приборе нет метки,
его заполняют весь и закрывают пробкой;
последняя вытесняет излишек жидкости.
Осторожного
обращения требуют пикнометры, в проб-iy
которых
впаян термометр; они малоустойчивы и
их легко опрокинуть и разбить.
Все описанные выше
пикнометры пригодны только для определения
относительной плотности легкоподвижных
жидкостей, не обладающих большой
вязкостью.
Плотность вязких
жидкостей лучше всего определять
ареометром или же при помощи гидростатических
весов.
При очень точном
определении относительной плотности
необходимо вводить поправку на массу
воздуха в объеме, занимаемом пикнометром.
Поправка А
выражается следующей формулой:
(Рх-Р) + А-Ч (P2-P)
+
A-l{
где А
— объем
пикнометра;
/ Pj
и Р, — см.
стр. 473;
X
—
относительная плотность воздуха при
барометрическом
давлении и температуре в весовой
комнате*.
* При температуре
20 СС
и давлении 760 мм
рт. ст. №£> =
= 0,0012.
627
Определение
относительной плотности при помощи
гидростатических
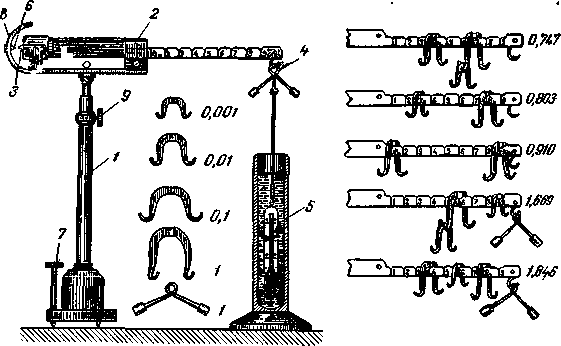
весов. Достаточно точно можно опре-|
делить относительную плотность жидких
и твердых тел! при помощи специальных
весов Мора (рис. 495) и Вест-я фаля (рис.
496).
Весы Мора кроме
одной укороченной чашки имеютД еще
специальный подвесной поплавок, массу
которого* подгоняют таким образом,
чтобы на воздухе весы нахо-i
Дились
в равновесии.
Рис. 496. Гидростатические
весы Вестфаля:
Цилиндре. До
погружения последнего в жидкость весы
должны находиться в равновесии. После
погружения поплавка в жидкость,
находящуюся в цилиндре, весы приводят
в равновесие, помещая на их правое
коромысло рейтеры. Если, например,
первый рейтер встал на деление «8»,
второй на деление «6» и третий на деление
«7» правого плеча коромысла, то
относительная плотность жидкости будет
равна 0,867.
Рис. 495. Гидростатические
весы Мора для определения плотности.
;
Весы снабжаются
разновесом в виде рейтеров.^Коро-мысло
весов разделено на 10 делений.
Для определения
относительной плотности твердого! тела
последнее подвешивают вместо поплавка,
точней уравновешивают
и затем погружают в воду. Подбирая массу
до приведения весов в равновесие,
определяют otJ
носительную
плотность. Принцип определения относи!
тельной плотности здесь основан на
законе Архимеда!
Если тело на
воздухе уравновешивают грузом Р.,
а
при погружении
этого тела в воду — грузом р,
то отно!
Р сительная
плотность тела будет равна р_
, т. е. массе
тела, деленной на
массу вытесняемой им воды.
Если определяют
относительную плотность жидкости, то
погружают поплавок в жидкость,
находящуюся в
1 —
стойка; 2
— коромысло;
3 —
стрелка; 4
— сережка;
5 — поплавок; б
— указатель;
7 — установочный винт; 8
— шкала;
9 — прижимной
винт.
Значительно
большим распространением пользуются
весы Вестфаля.
Весы
Вестфаля отличаются от весов Мора тем,
что плечи коромысла их не равны как
по длине, так и по массе. Длинное
и более легкое плечо разделено на 10
равных частей; на конце его подвешен
на тонкой платиновой проволоке
стеклянный поплавок с термометром.
Масса поплавка такова, что весы на
воздухе находятся в равновесии.
Для определения
относительной плотности в стакан или
цилиндр наливают исследуемую жидкость,
предварительно приведенную к
стандартной температуре. После этого
погружают поплавок в жидкость так,
чтобы он весь находился в ней. При этом
равновесие весов нарушится. Для
достижения равновесия на то плечо, на
котором на-
628
!
629

поплавок, помещают прилагаемые к каждым
Весам рейтеры, их обычно бывает
четыре-пять. Самый большой рейтер по
массе равен массе дистиллированной
воды при 4 °С в объеме, вытесняемом
поплавком. Другие рейтеры
имеют массу в 10, 100, 1000 и 10 000 раз меньше
J
первого.
Первый рейтер дает
первый десятичный знак, второй —J
второй
десятичный знак и т. д. Обычно ограничиваются
тремя десятичными знаками.
Если, например,
первый рейтер стоит на 8-м делении, 1
второй на 9-м и третий на 5-м, то плотность
жидкости бу- j
дет равна
0,895.
Поправки на
температуру, если определение велось
не при стандартной температуре,
рассчитывают, как указа-1 но выше.
Определение
относительной плотности методом
уравновешивания. Этот метод применяют
для определения! плотности твердых
веществ, нерастворимых в спирте или в
смеси органических веществ.
В спирт осторожно
вносят испытуемое вещество, затем
при постоянном перемешивании термометром
добав-J
ляют
понемногу дистиллированной воды до тех
пор, пока ,.j
вещество
не перестанет опускаться на дно и
окажется j
во взвешенном
состоянии. Это произойдет, когда плот-1
ность спирто-водного раствора будет
равна плотности исследуемого вещества.
После этого
определяют весами Мора или Вестфаля
относительную плотность спирто-водного
раствора; полученное значение будет
соответствовать относительном плотности
исследуемого вещества.
Для определения
относительной плотности мелко
раздробленных и порошкообразных тел
можно применят!! смесь нескольких
органических веществ, например хло!
реформа или бромоформа с бензолом,
толуолом или кси§ лолом или водные
растворы двойной йодистой соли калия
и ртути.
После определения
плотности смесь органических растворителей
нужно разогнать, но ни в коем случае не
выбрасывать.
Определение
относительной плотности волюмометрами.
Волюмометрами
(рис. 497) называют пикнометры, примев
няемые для
определения относительной плотности
noj
рошкообразных
твердых веществ. Емкость таких пикнс*
метров
обычно равна 50 мл.
Если
вещество, относительную
630
плотность
которого нужно определить, растворимо
в воде, то
выбирают такую жидкость, в которой
исследуемое вещество не растворяется*.
Для этой цели часто применяют керосин,
а иногда — спирт, хлороформ и другие
органические
жидкости. Перед определением исследуемое
вещество
измельчают до порошкообразного состояния
и высушивают в сушильном шкафу в
течение 1,5—2 ч
при температуре
около 105 °С, если взятое вещество
выдерживает нагревание до этой
температуры.
Рис. 498. Волюмо-
Рис.
497. Волюмо- метр
с градуиро-
метр. ванным
горлом.
Определение
относительной плотности исследуемого
вещества
начинают с определения относительной
плотности выбранной для сравнения
жидкости, например керосина, по описанному
выше пикнометрическому способу. В
тот же волюмометр, предварительно
тщательно промытый,
высушенный и взвешенный на аналитических
весах,
насыпают несколько граммов исследуемого
порошкообразного вещества, взвешивают
и по разности масс пикнометра точно
определяют навеску взятого вещества.
Затем наливают в
волюмометр небольшими порциями
применяемую жидкость (в данном
случае — керосин),
* Жидкость должна
смачивать исследуемое вещество и ее
плотность должна быть меньше плотности
этого вещества.
т
каждый
раз тщательно перемешивая содержимое
встряЛ хиванием.
Когда прибор будет заполнен на V»,
его пса
мещают
на 1—2 ч
на
водяную баню, нагретую до 60—65 в(Л
для удаления
из порошкообразного вещества пузырька!
воздуха. Время от времени содержимое
волюмометр! слегка взбалтывают. После
того как выделение пузырь! ков воздуха
закончится, прибор охлаждают, доливают
д| метки
жидкостью и взвешивают. Таким образом
опредсГ ляют
массу волюмометра с порошкообразным
вещество] и жидкостью.
Относительная
плотность порошкообразного твердог^
тела (dB)
определяется
по формуле:
P + G — F
где dx
—
относительная плотность жидкости;
Р —
масса порошкообразного вещества, г;
G —
масса пикнометра, наполненного жидкостью,
га
F —
масса пикнометра с порошкообразным
вещест-‘
вом и жидкостью,
г.
Правильные
результаты этим методом можно получить
только при условии,
что из порошкообразного веществ!
будет удален весь
воздух.
Если не требуется
большой точности, плотность мож-j
но определять
при помощи волюмометра, показанного
на рис. 498. Он представляет собой колбу
типа мерном с длинным горлом, на котором
нанесены деления с точ! ностью до 0,1 мл,
подобно
тому, как это сделано на бю1 ретках. В
волюмометр наливают керосин, бензин
или другую жидкость, смачивающую твердое
вещество, плот^ ность которого определяют.
Уровень жидкости, после до? ведения ее
до стандартной температуры 20 °С, должен
находиться на уровне нижнего
(нулевого) деления. Затем в
волюмометр насыпают точную навеску
измельченного вещества
и содержимое колбы слегка встряхивают,
стре! мясь
к тому, чтобы жидкость смыла с внутренней
поверх* ности
горла все приставшие к ней частицы
твердого тела/ После
этого волюмометр помещают в термостат,
выдержи? вают
в нем 20 мин
и
затем отмечают уровень жидкости в шейке
волюмометра. По разности уровней
жидкости посла и
до насыпания исследуемого вещества
определяют объем взятой
навески. Плотность твердого вещества
определяют
делением
массы взятой навески на найденный
объем». Точность
определения с помощью этого прибора
до 0,1.
РЕКОМЕНДУЕМАЯ
ЛИТЕРАТУРА
Об изменении
плотности порошкообразных и пористых
тел, как сахар, вата, бумага и др., см.
Krutzsch
J., Chimia, 11,
№ 11, 333 (1957);
РЖХим, 1958, № 14, 140, реф. 46551.
О новом принципе
гидростатического взвешивания жидкостей
см. Ц е й т л и н В. Г., Измерит, техника,
№ 1, 27 (1960); РЖХим, 1960, № 15, 159, реф. 61209, См.
также К и в и л и с С. С, Техника
измерения плотности жидкостей и твердых
тел, Стандартгиз, 1959.
О методе определения
плотности веществ, имеющихся в
микроколичествах, см. J
о n
e s I. M., J. Sci. Instr., 38,
№ 7, 303 (1961); РЖХим, 1962,
реф. 2Е23.
О поплавковом
приборе для измерения плотностей
жидкости под давлением с применением
ультразвукового метода фиксации
положения
поплавка см. Каптель
О. И., Кузнецов
Е. Л., Хожайлов
Н. К., Черненко
Г. В., в сб. «Применение ультразвука к
исследованию веществ», вып. 14, 1961, стр.
323; РЖХим, 1962, реф. 8Е12.
О методе проверки
ареометров в одной жидкости см. И п-п и
ц М. Д., Тютикова
М. И., Измерит, техника, № 12, 17 (1961);
РЖХим, 1962, реф. 15Е8.
Об измерении
плотности твердых тел с применением
градиен-1 эв трубки см. К а ц М. Я., Приборы
и техника эксперимента, № 1, 178 (1962);
РЖХим, 1962,
реф. 16Е21.
Об ареометрах и
определении плотности жидкостей см.
Rands
I. В., Notes
Appl. Sci. Nat. Phys. Lab., №
25, 31 (1963); РЖХим, 1962, реф. 13Е6.
О денсиметре
высокого давления см. Poole
D. R., N v
b e rg D. G., J. Sci. Instr., 39,
№ Ц, 576 (1962); РЖХим,» 1963,
реф. 13Д18.
Установка для
измерения плотности жидкостей при
высокой температуре до 500 СС
и под давлением до 20 кг/см2
описана В е
s-s
о n
a t R., С h
e v а п е 1
Н., Е 1 b
e r g S., J. Phys. Chem., 24,
№ 6, suppl.
A81 (1963);
РЖХим, 1964,
10Д28.
63?
В этой статье мы коснемся нескольких краеугольных понятий в химии, без которых совершенно невозможно
решение задач. Старайтесь понять смысл физических величин, чтобы усвоить эту тему.
Я постараюсь приводить как можно больше примеров по ходу этой статьи, в ходе изучения вы увидите множество примеров
по данной теме.

Относительная атомная масса — Ar
Представляет собой массу атома, выраженную в атомных единицах массы. Относительные атомные массы указаны в периодической
таблице Д.И. Менделеева. Так, один атом водорода имеет атомную массу = 1, кислород = 16, кальций = 40.
Относительная молекулярная масса — Mr
Относительная молекулярная масса складывается из суммы относительных атомных масс всех атомов, входящих в состав вещества.
В качестве примера найдем относительные молекулярные массы кислорода, воды, перманганата калия и медного купороса:
Mr (O2) = (2 × Ar(O)) = 2 × 16 = 32
Mr (H2O) = (2 × Ar(H)) + Ar(O) = (2 × 1) + 16 = 18
Mr (KMnO4) = Ar(K) + Ar(Mn) + (4 × Ar(O)) = 39 + 55 + (4 * 16) = 158
Mr (CuSO4*5H2O) = Ar(Cu) + Ar(S) + (4 × Ar(O)) + (5 × ((Ar(H) × 2) +
Ar(O))) = 64 + 32 + (4 × 16) + (5 × ((1 × 2) + 16)) = 160 + 5 * 18 = 250
Моль и число Авогадро
Моль — единица количества вещества (в системе единиц СИ), определяемая как количество вещества, содержащее столько же структурных единиц
этого вещества (молекул, атомов, ионов) сколько содержится в 12 г изотопа 12C, т.е. 6 × 1023.
Число Авогадро (постоянная Авогадро, NA) — число частиц (молекул, атомов, ионов) содержащихся в одном моле любого вещества.

Больше всего мне хотелось бы, чтобы вы поняли физический смысл изученных понятий. Моль — международная единица количества вещества, которая
показывает, сколько атомов, молекул или ионов содержится в определенной массе или конкретном объеме вещества. Один моль любого вещества
содержит 6.02 × 1023 атомов/молекул/ионов — вот самое важное, что сейчас нужно понять.
Иногда в задачах бывает дано число Авогадро, и от вас требуется найти, какое вам дали количество вещества (моль). Количество вещества в химии
обозначается N, ν (по греч. читается «ню»).
Рассчитаем по формуле: ν = N/NA количество вещества 3.01 × 1023 молекул воды и 12.04 × 1023 атомов углерода.

Мы нашли количества вещества (моль) воды и углерода. Сейчас это может показаться очень абстрактным, но, иногда не зная, как найти
количество вещества, используя число Авогадро, решение задачи по химии становится невозможным.
Молярная масса — M
Молярная масса — масса одного моля вещества, выражается в «г/моль» (грамм/моль). Численно совпадает с изученной нами ранее
относительной молекулярной массой.
Рассчитаем молярные массы CaCO3, HCl и N2
M (CaCO3) = Ar(Ca) + Ar(C) + (3 × Ar(O)) = 40 + 12 + (3 × 16) = 100 г/моль
M (HCl) = Ar(H) + Ar(Cl) = 1 + 35.5 = 36.5 г/моль
M (N2) = Ar(N) × 2 = 14 × 2 = 28 г/моль
Полученные знания не должны быть отрывочны, из них следует создать цельную систему. Обратите внимание: только что мы рассчитали
молярные массы — массы одного моля вещества. Вспомните про число Авогадро.
Получается, что, несмотря на одинаковое число молекул в 1 моле (1 моль любого вещества содержит 6.02 × 1023 молекул),
молекулярные массы отличаются. Так, 6.02 × 1023 молекул N2 весят 28 грамм, а такое же количество молекул
HCl — 36.5 грамм.
Это связано с тем, что, хоть количество молекул одинаково — 6.02 × 1023, в их состав входят разные атомы, поэтому и
массы получаются разные.

Часто в задачах бывает дана масса, а от вас требуется рассчитать количество вещества, чтобы перейти к другому веществу в реакции.
Сейчас мы определим количество вещества (моль) 70 грамм N2, 50 грамм CaCO3, 109.5 грамм HCl. Их молярные
массы были найдены нам уже чуть раньше, что ускорит ход решения.

ν (CaCO3) = m(CaCO3) : M(CaCO3) = 50 г. : 100 г/моль = 0.5 моль
ν (HCl) = m(HCl) : M(HCl) = 109.5 г. : 36.5 г/моль = 3 моль
Иногда в задачах может быть дано число молекул, а вам требуется рассчитать массу, которую они занимают. Здесь нужно использовать
количество вещества (моль) как посредника, который поможет решить поставленную задачу.
Предположим нам дали 15.05 × 1023 молекул азота, 3.01 × 1023 молекул CaCO3 и 18.06 × 1023 молекул
HCl. Требуется найти массу, которую составляет указанное число молекул. Мы несколько изменим известную формулу, которая поможет нам связать
моль и число Авогадро.

Теперь вы всесторонне посвящены в тему. Надеюсь, что вы поняли, как связаны молярная масса, число Авогадро и количество вещества.
Практика — лучший учитель. Найдите самостоятельно подобные значения для оставшихся CaCO3 и HCl.
Молярный объем
Молярный объем — объем, занимаемый одним молем вещества. Примерно одинаков для всех газов при стандартной температуре
и давлении составляет 22.4 л/моль. Он обозначается как — VM.
Подключим к нашей системе еще одно понятие. Предлагаю найти количество вещества, количество молекул и массу газа объемом
33.6 литра. Поскольку показательно молярного объема при н.у. — константа (22.4 л/моль), то совершенно неважно, какой газ мы
возьмем: хлор, азот или сероводород.
Запомните, что 1 моль любого газа занимает объем 22.4 литра. Итак, приступим к решению задачи. Поскольку какой-то газ
все же надо выбрать, выберем хлор — Cl2.


Моль (количество вещества) — самое гибкое из всех понятий в химии. Количество вещества позволяет вам перейти и к
числу Авогадро, и к массе, и к объему. Если вы усвоили это, то главная задача данной статьи — выполнена 

Относительная плотность и газы — D
Относительной плотностью газа называют отношение молярных масс (плотностей) двух газов. Она показывает, во сколько раз одно вещество
легче/тяжелее другого. D = M (1 вещества) / M (2 вещества).
В задачах бывает дано неизвестное вещество, однако известна его плотность по водороду, азоту, кислороду или
воздуху. Для того чтобы найти молярную массу вещества, следует умножить значение плотности на молярную массу
газа, по которому дана плотность.
Запомните, что молярная масса воздуха = 29 г/моль. Лучше объяснить, что такое плотность и с чем ее едят на примере.
Нам нужно найти молярную массу неизвестного вещества, плотность которого по воздуху 2.5

Предлагаю самостоятельно решить следующую задачку (ниже вы найдете решение): «Плотность неизвестного вещества по
кислороду 3.5, найдите молярную массу неизвестного вещества»

Относительная плотность и водный раствор — ρ
Пишу об этом из-за исключительной важности в решении
сложных задач, высокого уровня, где особенно часто упоминается плотность. Обозначается греческой буквой ρ.
Плотность является отражением зависимости массы от вещества, равна отношению массы вещества к единице его объема. Единицы
измерения плотности: г/мл, г/см3, кг/м3 и т.д.
Для примера решим задачку. Объем серной кислоты составляет 200 мл, плотность 1.34 г/мл. Найдите массу раствора. Чтобы не
запутаться в единицах измерения поступайте с ними как с самыми обычными числами: сокращайте при делении и умножении — так
вы точно не запутаетесь.

Иногда перед вами может стоять обратная задача, когда известна масса раствора, плотность и вы должны найти объем. Опять-таки,
если вы будете следовать моему правилу и относится к обозначенным условным единицам «как к числам», то не запутаетесь.
В ходе ваших действий «грамм» и «грамм» должны сократиться, а значит, в таком случае мы будем делить массу на плотность. В противном случае
вы бы получили граммы в квадрате 
К примеру, даны масса раствора HCl — 150 грамм и плотность 1.76 г/мл. Нужно найти объем раствора.

Массовая доля — ω
Массовой долей называют отношение массы растворенного вещества к массе раствора. Важно заметить, что в понятие раствора входит
как растворитель, так и само растворенное вещество.
Массовая доля вычисляется по формуле ω (вещества) = m (вещества) / m (раствора). Полученное число будет показывать массовую долю
в долях от единицы, если хотите получить в процентах — его нужно умножить на 100%. Продемонстрирую это на примере.

Решим несколько иную задачу и найдем массу чистой уксусной кислоты в широко известной уксусной эссенции.

© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Как вычислять относительную плотность вещества
Такая характеристика, как относительная плотность вещества, показывает, во сколько раз оно тяжелее или легче другого соединения. Этот параметр можно определять по отношению к любому газообразному веществу. В большинстве случаев проводятся расчеты относительно воздуха или водорода. Однако могут попадаться задания, в которых необходимо вычислить относительную плотность и по другим газам, таким как кислород, аммиак или сероводород. В любом случае принцип решения задания един.

Вам понадобится
- — периодическая система химических элементов Д.И. Менделеева;
- — калькулятор.
Инструкция
Для того чтобы справиться с задачей, необходимо использовать формулы на определение относительной плотности:
D (воздух) = Mr (газа)/ Mr (воздуха), где:
D (воздух) – относительная плотность;
Mr (газа) – относительная молекулярная масса газообразного вещества;
Mr (воздуха) — относительная молекулярная масса воздуха.
Все три параметра единиц измерения не имеют.
Mr (воздуха) = 29 (величина постоянная), следовательно формула будет иметь вид:
D (воздух) = Mr (газа)/ 29.
По аналогии выглядит формула на определение относительной плотности по водороду, с тем исключением, что вместо воздуха стоит водород. А значит, и в расчет берется относительная молекулярная масса водорода.
D (водород) = Mr (газа)/ Mr (водорода);
D (водород) – относительная плотность;
Mr (газа) – относительная молекулярная масса газообразного вещества;
Mr (водорода) — относительная молекулярная масса водорода.
Mr (водорода) = 2, следовательно и формула будет иметь вид:
D (воздух) = Mr (газа)/ 2.
Пример № 1. Вычислите относительную плотность аммиака по воздуху. Аммиак имеет формулу NH3.
Сначала найдите относительную молекулярную массу аммиака, которую можно рассчитать по таблице Д.И. Менделеева.
Ar (N) = 14, Ar (H) = 3 х 1 = 3, отсюда
Mr (NH3) = 14 + 3 = 17
Подставьте полученные данные в формулу на определение относительной плотности по воздуху:
D (воздух) = Mr (аммиака)/ Mr (воздуха);
D (воздух) = Mr (аммиака)/ 29;
D (воздух) = 17/ 29 = 0, 59.
Пример № 2. Вычислите относительную плотность аммиака по водороду.
Подставьте данные в формулу на определение относительной плотности по водороду:
D (водород) = Mr (аммиака)/ Mr (водорода);
D (водород) = Mr (аммиака)/ 2;
D (водород) = 17/ 2 = 8, 5.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Отношение плотности (массы на объем) вещества к плотности данного стандартного материала
| Удельный вес | |
|---|---|
| Общие символы | SG |
| Единица СИ | Без единиц измерения |
| Производные от. других величин | SG true = ρ выборка ρ H 2 O { displaystyle SG _ { text {true}} = { frac { rho _ { text {sample}}} { rho _ { mathrm {H_ {2} O}}}}} |

Относительная плотность или удельный вес — это отношение плотности (масса единицы объема) вещества к плотности данного справочный материал. Удельный вес жидкостей почти всегда измеряется по отношению к воде в ее самой плотной точке (при 4 ° C или 39,2 ° F); для газов эталоном является воздух при комнатной температуре (20 ° C или 68 ° F). Термин «относительная плотность» часто используется в научных целях.
Если относительная плотность вещества меньше единицы, то оно менее плотное, чем эталон; если больше 1, то он плотнее эталона. Если относительная плотность равна точно 1, то плотности равны; то есть равные объемы двух веществ имеют одинаковую массу. Если эталонным материалом является вода, то вещество с относительной плотностью (или удельным весом) менее 1 будет плавать в воде. Например, кубик льда с относительной плотностью около 0,91 будет плавать. Вещество с относительной плотностью больше 1 утонет.
Температура и давление должны быть указаны как для образца, так и для эталона. Давление почти всегда равно 1 атм (101,325 кПа ). Если это не так, обычно плотность указывается напрямую. Температуры как для образца, так и для эталона варьируются от отрасли к отрасли. В британской пивоваренной практике удельный вес, как указано выше, умножается на 1000. Удельный вес обычно используется в промышленности как простое средство получения информации о концентрации растворов различных материалов, таких как рассолы, сахар растворы (сиропы, соки, мед, пивоваренное сусло, сусло и т. Д.) И кислоты.
Содержание
- 1 Базовый расчет
- 2 Температурная зависимость
- 3 Использование
- 4 Измерение
- 4.1 Гидростатическое взвешивание
- 4.2 Ареометр
- 4.3 Пикнометр
- 4.4 Цифровые плотномеры
- 5 Примеры
- 6 См. Также
- 7 Ссылки
- 8 Дополнительная литература
- 9 Внешние ссылки
Базовый расчет
Относительная плотность (RD) или удельный вес (SG) a безразмерная величина, так как это отношение плотности или веса
- RD = ρ вещества ρ эталон { displaystyle { mathit {RD}} = { frac { rho _ { mathrm {вещество}}} { rho _ { mathrm {reference}}}} ,}
где RD — относительная плотность, ρ субстанция — плотность измеряемого вещества, а ρ ссылка — плотность ссылки. (По соглашению ρ греческая буква rho обозначает плотность.)
Справочный материал может быть обозначен с помощью нижних индексов: RD вещество / ссылка, что означает « относительная плотность вещества относительно эталона «. Если ссылка не указана явно, то обычно предполагается, что это вода при 4 ° C (или, точнее, 3,98 ° C, что является температура, при которой вода достигает максимальной плотности). В единицах SI плотность воды составляет (приблизительно) 1000 kg /m или 1 g /cm, что делает вычисления относительной плотности особенно удобными: плотность объекта нужно всего лишь разделить на 1000 или 1, в зависимости от агрегатов.
Относительная плотность газов часто измеряется по отношению к сухому воздуху при температуре 20 ° C и абсолютном давлении 101,325 кПа, который имеет плотность 1,205 кг / м 2. Относительную плотность по отношению к воздуху можно получить следующим образом:
- RD = ρ gas ρ air ≈ M gas M air { displaystyle { mathit {RD}} = { frac { rho _ { mathrm {gas}}} { rho _ { mathrm {air}}}} приблизительно { frac {M _ { mathrm {gas}}} {M _ { mathrm {air}}}}}
Где M — используется молярная масса и знак приблизительно равенства, потому что равенство имеет место только в том случае, если 1 моль газа и 1 моль воздуха занимают один и тот же объем при данной температуре и давлении, т.е. они оба Идеальные газы. Идеальное поведение обычно наблюдается только при очень низком давлении. Например, один моль идеального газа занимает 22,414 л при 0 ° C и 1 атмосфере, тогда как диоксид углерода имеет молярный объем 22,259 л при тех же условиях.
Те, у кого удельная плотность больше 1, плотнее воды и, не считая эффекта поверхностного натяжения, тонут в ней. Те, у кого удельная плотность меньше 1, менее плотны, чем вода, и будут плавать по ней. В научной работе отношение массы к объему обычно выражается непосредственно через плотность (масса на единицу объема) исследуемого вещества. Именно в промышленности удельный вес находит широкое применение, часто по историческим причинам.
Истинный удельный вес жидкости можно выразить математически следующим образом:
- SG true = ρ sample ρ H 2 O { displaystyle SG _ { text {true}} = { frac { rho _ { text {sample}}} { rho _ { mathrm {H_ {2} O}}}}
где ρ sample — плотность образца, а ρ H2O- плотность воды.
Кажущийся удельный вес — это просто отношение веса равных объемов пробы и воды в воздухе:
- кажущаяся удельная плотность = WA, образец WA, H 2 O { displaystyle SG _ { text {кажущаяся }} = { frac {W _ { mathrm {A}, { text {sample}}}} {W _ { mathrm {A}, mathrm {H_ {2} O}}}}}
где W A, образец представляет вес образца, измеренный в воздухе, а W A, H 2Oвес равного объема воды, измеренный в воздухе.
Можно показать, что истинный удельный вес может быть вычислен из различных свойств:
- SG true = ρ образец ρ H 2 O = m образец V m H 2 OV = m образец m H 2 O gg = WV, образец WV, H 2 O { displaystyle SG _ { text {true}} = { frac { rho _ { text {sample}}} { rho _ { mathrm {H_ {2} O}} }} = { frac { frac {m _ { text {sample}}} {V}} { frac {m _ { mathrm {H_ {2} O}}} {V}}} = { frac { m _ { text {sample}}} {m _ { mathrm {H_ {2} O}}}} { frac {g} {g}} = { frac {W _ { mathrm {V}, { text {sample}}}} {W _ { mathrm {V}, mathrm {H_ {2} O}}}}}
где g — местное ускорение свободного падения, V — объем образца и вода (одинаковая для обоих), ρ образец — плотность образца, ρ H2O- плотность воды, W V — вес, полученный в вакууме, m sample { displaystyle { mathit {m}} _ { text {sample}}}

Плотность воды зависит от температуры и давления, как и плотность образца. Поэтому необходимо указать температуры и давления, при которых были определены плотности или веса. Почти всегда измерения проводятся при 1 номинальной атмосфере (101,325 кПа ± отклонения от меняющихся погодных условий). Но поскольку удельный вес обычно относится к водным растворам с высокой степенью несжимаемости или другим несжимаемым веществам (таким как нефтепродукты), вариациями плотности, вызванными давлением, обычно пренебрегают, по крайней мере, там, где измеряется кажущийся удельный вес. Для расчета истинного (в вакууме) удельного веса необходимо учитывать давление воздуха (см. Ниже). Температуры задаются обозначением (T s/Tr), где T s представляет температуру, при которой была определена плотность образца, а T r — температура, при которой эталон (вода) указана плотность. Например, SG (20 ° C / 4 ° C) следует понимать как означающее, что плотность образца была определена при 20 ° C, а плотность воды — при 4 ° C. Принимая во внимание различную температуру образца и эталонную температуру, отметим, что, хотя SG H2O= 1,000000 (20 ° C / 20 ° C), также верно и то, что SG H2O= ⁄ 0,999840 = 0,998363 (20 ° C / 4 ° C). Здесь температура указывается с использованием текущей шкалы ITS-90, а плотности, используемые здесь и в остальной части этой статьи, основаны на этой шкале. По предыдущей шкале IPTS-68 плотности при 20 ° C и 4 ° C составляют 0,9982071 и 0,9999720 соответственно, в результате чего значение удельной плотности воды (20 ° C / 4 ° C) составляет 0,9982343.
Поскольку измерение удельного веса в основном используется в промышленности, это определение концентраций веществ в водных растворах и поскольку они находятся в таблицах зависимости удельного веса от концентрации, чрезвычайно важно, чтобы аналитик вводил в таблицу правильный вид удельного веса. Например, в пивоваренной промышленности в таблице Плато указана концентрация сахарозы по массе относительно истинной удельной плотности, и она была первоначально (20 ° C / 4 ° C), то есть основана на измерениях плотности растворов сахарозы, полученных при лабораторная температура (20 ° C), но относительно плотности воды при 4 ° C, которая очень близка к температуре, при которой вода имеет максимальную плотность, ρ H2O, равное 999,972 кг / м3 в единицах СИ (0,999972 г / см в кубических единицах или 62,43 фунта / кубических футов в обычных единицах США ). Таблица ASBC, используемая сегодня в Северной Америке, в то время как она получена из исходной таблицы Платона, предназначена для измерений кажущегося удельного веса при (20 ° C / 20 ° C) по шкале IPTS-68, где плотность воды 0,9982071 г / см. В производстве сахара, безалкогольных напитков, меда, фруктовых соков и смежных отраслях концентрация сахарозы по массе берется из таблицы, подготовленной A. Brix, в котором используется SG (17,5 ° C / 17,5 ° C). В качестве последнего примера британские единицы SG основаны на эталонной температуре и температуре образца 60 ° F и, таким образом, составляют (15,56 ° C / 15,56 ° C).
Учитывая удельный вес вещества, его фактическую плотность можно рассчитать, переписав приведенную выше формулу:
- ρ вещества = S G × ρ H 2 O. { displaystyle { rho _ { text {entity}}} = SG times rho _ { mathrm {H_ {2} O}}.}
Иногда указывается эталонное вещество, отличное от воды (например,, воздух), и в этом случае удельный вес означает плотность относительно этого эталона.
Температурная зависимость
- См. Плотность для получения таблицы измеренных плотностей воды при различных температурах.
Плотность веществ зависит от температуры и давления, поэтому необходимо укажите температуры и давления, при которых определялись плотности или массы. Практически всегда измерения проводятся при номинальной температуре в 1 атмосферу (101,325 кПа без учета изменений, вызванных изменением погодных условий), но поскольку относительная плотность обычно относится к водным растворам с высокой степенью несжимаемости или другим несжимаемым веществам (таким как нефтепродукты), изменения плотности вызванные давлением, обычно не учитываются, по крайней мере, там, где измеряется кажущаяся относительная плотность. Для истинных (в вакууме) расчетов относительной плотности необходимо учитывать давление воздуха (см. Ниже). Температуры задаются обозначением (T s/Tr), где T s представляет температуру, при которой была определена плотность образца, а T r — температура, при которой эталонная плотность (воды) указан. Например, SG (20 ° C / 4 ° C) следует понимать как означающее, что плотность образца была определена при 20 ° C, а плотность воды — при 4 ° C. Принимая во внимание различные температуры образца и эталонные температуры, отметим, что хотя SG H2O= 1,000000 (20 ° C / 20 ° C), также имеет место RD H2O= 0,998203 / 0,998840 = 0,998363 (20 ° C / 4 ° C). C). Здесь температура указывается с использованием текущей шкалы ITS-90, а плотности, используемые здесь и в остальной части этой статьи, основаны на этой шкале. По предыдущей шкале IPTS-68 плотности при 20 ° C и 4 ° C составляют соответственно 0,9982071 и 0,9999720, в результате чего значение RD (20 ° C / 4 ° C) для воды составляет 0,9982343.
Температуры двух материалов могут быть явно указаны в символах плотности; например:
- относительная плотность: 8,15. 4 ° C ; или удельный вес: 2,432. 0
, где верхний индекс указывает температуру, при которой измеряется плотность материала, а нижний индекс указывает температуру эталонного вещества, с которым он сравнивается.
Использование
Относительная плотность также может помочь количественно оценить плавучесть вещества в жидкости или газе или определить плотность неизвестного вещество с известной плотностью другого. Относительная плотность часто используется геологами и минералогами для определения содержания минералов в породе или другом образце. Геммологи используют его как вспомогательное средство при идентификации драгоценных камней. Вода предпочтительна в качестве эталона, потому что измерения затем легко проводить в полевых условиях (см. Ниже примеры методов измерения).
Поскольку основным применением измерений относительной плотности в промышленности является определение концентраций веществ в водных растворах, которые можно найти в таблицах зависимости RD от концентрации, чрезвычайно важно, чтобы аналитик вводил таблицу в правильной форме. относительной плотности. Например, в пивоваренной промышленности таблица Plato, в которой указана массовая концентрация сахарозы в сравнении с истинным RD, изначально была (20 ° C / 4 ° C) и основана на измерениях плотности растворов сахарозы. сделано при лабораторной температуре (20 ° C), но относится к плотности воды при 4 ° C, что очень близко к температуре, при которой вода имеет максимальную плотность ρ (H. 2O), равную 0,999972 г / см ( или 62,43 фунт · фут). Таблица ASBC, используемая сегодня в Северной Америке, в то время как она получена из исходной таблицы Плато, предназначена для измерений кажущейся относительной плотности при (20 ° C / 20 ° C) по шкале IPTS-68, где плотность воды 0,9982071 г / см. Массовая концентрация сахарозы в производстве сахара, безалкогольных напитков, меда, фруктовых соков и связанных с ними отраслей взята из этой работы, где используется SG (17,5 ° C / 17,5 ° C). В качестве последнего примера британские единицы RD основаны на эталонной температуре и температуре образца 60 ° F и, таким образом, составляют (15,56 ° C / 15,56 ° C).
Измерение
Относительная плотность может быть рассчитывается непосредственно путем измерения плотности образца и деления ее на (известную) плотность эталонного вещества. Плотность образца — это просто его масса, деленная на его объем. Хотя массу легко измерить, объем образца неправильной формы бывает труднее определить. Один из методов — поместить образец в заполненный водой мерный цилиндр и определить, сколько воды он вытеснил. В качестве альтернативы контейнер может быть заполнен до краев, образец погружен в воду и измерен объем перелива. Поверхностное натяжение воды может удерживать значительное количество воды от перелива, что особенно проблематично для небольших образцов. По этой причине желательно использовать емкость для воды с как можно меньшим отверстием.
Для каждого вещества плотность ρ определяется как
- ρ = Масса Объем = Прогиб × Пружина с постоянной силой тяжести Смещение W ater Line × Площадь C ylinder { displaystyle rho = { frac { text {Mass}} { text {Volume}}} = { frac {{ text {Deflection}} times { frac { text {Spring Constant}} { text {Gravity}}}} {{ text {Displacement}} _ { mathrm {WaterLine}} times { text {Area}} _ { mathrm {Cylinder}}}} ,}
Когда эти плотности разделены, ссылки на постоянную пружины, сила тяжести и площадь поперечного сечения просто сокращаются, оставляя
- RD = ρ объекта ρ ref = Отклонение O bj. Смещение O b j. Прогиб R e f. Смещение R e f. = 3 дюйма 20 мм 5 дюймов 34 мм = 3 дюйма × 34 мм 5 дюймов × 20 мм = 1.02 { displaystyle RD = { frac { rho _ { mathrm {object}}} { rho _ { mathrm { ref}}}} = { frac { frac {{ text {Deflection}} _ { mathrm {Obj.}}} {{ text {Displacement}} _ { mathrm {Obj.}}}} { frac {{ text {Отклонение}} _ { mathrm {Ref.}}} {{ text {Displacement}} _ { mathrm {Ref.}}}}} = { frac { frac {3 mathrm {in}} {20 mathrm {mm}}} { frac {5 mathrm {in}} {34 mathrm {mm}}}} = { frac {3 mathrm {in} } times 34 mathrm {мм}} {5 mathrm {in} times 20 mathrm {mm}}} = 1.02 ,}
Гидростатическое взвешивание
Относительная плотность больше легко и, возможно, более точно измерить без измерения объема. С помощью пружинных весов образец взвешивается сначала на воздухе, а затем в воде. Относительную плотность (по отношению к воде) можно затем рассчитать по следующей формуле:
- RD = W воздух W воздух — W вода { displaystyle RD = { frac {W _ { mathrm {air}}} {W_ { mathrm {air}} -W _ { mathrm {water}}}}}
где
- Wair — вес образца в воздухе (измеряется в ньютонах, фунты-сила или какая-либо другая единица силы)
- Wвода — вес образца в воде (измеряется в тех же единицах).
Этот метод не может быть легко использован для измерения относительной плотности меньше единицы, потому что тогда образец будет плавать. W вода становится отрицательной величиной, представляющей силу, необходимую для удержания образца под водой.
Другой практический метод использует три измерения. Образец взвешивают насухо. Затем контейнер, заполненный водой до краев, взвешивают и снова взвешивают с погруженным образцом после того, как вытесненная вода переливается и удаляется. Вычитание последнего показания из суммы первых двух показаний дает вес вытесненной воды. Результат относительной плотности — это вес сухой пробы, деленный на вес вытесненной воды. Этот метод работает с весами, которые не могут легко вместить взвешенный образец, а также позволяет измерять образцы, которые менее плотны, чем вода.
Ареометр
Относительная плотность жидкости может быть измерена с помощью ареометра. Он состоит из луковицы, прикрепленной к стеблю постоянной площади поперечного сечения, как показано на рисунке рядом.
Сначала ареометр помещается в эталонную жидкость (показана голубым) и отмечается смещение (уровень жидкости на стержне) (синяя линия). Эталоном может быть любая жидкость, но на практике это обычно вода.
Затем ареометр погружается в жидкость неизвестной плотности (показана зеленым). Отмечается изменение смещения Δx. В изображенном примере ареометр немного опустился в зеленой жидкости; следовательно, его плотность ниже, чем у эталонной жидкости. Конечно, необходимо, чтобы ареометр плавал в обеих жидкостях.
Применение простых физических принципов позволяет рассчитать относительную плотность неизвестной жидкости по изменению смещения. (На практике стержень ареометра предварительно размечен градуировкой, чтобы облегчить это измерение.)
В пояснении ниже
- ρref- это известная плотность (масса на единицу объема ) эталонной жидкости (обычно воды).
- ρновая — неизвестная плотность новой (зеленой) жидкости.
- RDновая / ref — относительная плотность новой жидкости по отношению к эталону.
- V- объем вытесненной эталонной жидкости, то есть красный объем на диаграмме.
- m- масса всего ареометра.
- g- местная гравитационная постоянная,.
- Δx- изменение смещения. В соответствии со способом, которым обычно градуируются ареометры, Δx здесь принимается отрицательным, если линия смещения поднимается на ножке ареометра, и положительным, если она падает. В изображенном примере Δx отрицательно.
- A- это площадь поперечного сечения вала.
Поскольку плавающий ареометр находится в статическом равновесии, действующая на него направленная вниз гравитационная сила должна точно уравновешивать восходящая сила плавучести. Гравитационная сила, действующая на ареометр, — это просто его вес в мг. Согласно принципу Архимеда плавучести, сила плавучести, действующая на ареометр, равна весу вытесненной жидкости. Этот вес равен массе вытесненной жидкости, умноженной на г, что в случае эталонной жидкости равно ρ ref Vg. Приравнивая их, мы получаем
- mg = ρ ref V g { displaystyle mg = rho _ { mathrm {ref}} Vg ,}
или просто
-
m = ρ ref V { displaystyle m = rho _ { mathrm {ref}} V ,} (1)
Точно такое же уравнение применяется, когда ареометр плавает в измеряемой жидкости, за исключением того, что новый объем равен V — AΔx (см. примечание выше о знаке Δx). Таким образом,
-
m = ρ new (V — A Δ x) { displaystyle m = rho _ { mathrm {new}} (VA Delta x) ,} (2)
Объединение (1) и (2) дает
-
RD new / ref = ρ new ρ ref = VV — A Δ x { displaystyle RD _ { mathrm {new / ref}} = { frac { rho _ { mathrm {new}}} { rho _ { mathrm {ref}}}} = { frac {V} {VA Delta x}}} (3)
Но из (1) мы имеем V = m / ρ исх.. Подстановка в (3) дает
-
RD new / ref = 1 1 — A Δ xm ρ ref { displaystyle RD _ { mathrm {new / ref}} = { frac {1} {1 — { frac {A Delta x} {m}} rho _ { mathrm {ref}}}}} (4)
Это уравнение позволяет рассчитать относительную плотность по изменению смещения, известной плотности эталонная жидкость и известные свойства ареометра. Если Δx мало, то в качестве аппроксимации первого порядка уравнения (4) геометрического ряда можно записать как:
- RD new / ref ≈ 1 + A Δ xm ρ ref { displaystyle RD _ { mathrm {new / ref}} приблизительно 1 + { frac {A Delta x} {m}} rho _ { mathrm {ref}}}
Это показывает, что, при малых Δx изменения смещения приблизительно пропорциональны изменениям относительной плотности.
Пикнометр


A пикнометр (от греческого : πυκνός (puknos), что означает «плотный»), также пикнометр или баллон для определения плотности — это устройство, используемое для определения плотности жидкости. Пикнометр обычно изготавливается из стекла с плотно прилегающей матовой стеклянной пробкой, через которую проходит капиллярная трубка, чтобы воздух пузыри могут выходить из аппарата. Это устройство позволяет точно измерить плотность жидкости относительно соответствующей рабочей жидкости, такой как вода или ртуть, с помощью аналитических весов .
Если колба взвешенный пустой, полный воды и полный жидкости, относительная плотность которой желательна, относительную плотность жидкости можно легко вычислить. Плотность частиц порошка, к которому нельзя применить обычный метод взвешивания, также можно определить с помощью пикнометра. Порошок добавляют в пикнометр, который затем взвешивают, определяя вес образца порошка. Затем пикнометр заполняется жидкостью известной плотности, в которой порошок полностью нерастворим. Затем можно определить вес вытесненной жидкости и, следовательно, относительную плотность порошка.
A газовый пикнометр, основанное на газе проявление пикнометра, сравнивает изменение давления, вызванное измеренным изменением в замкнутом объеме, содержащем эталон (обычно стальной шар известного объема), с изменением давления, вызванным по образцу при тех же условиях. Разница в изменении давления представляет собой объем образца по сравнению с эталонной сферой и обычно используется для твердых частиц, которые могут растворяться в жидкой среде конструкции пикнометра, описанной выше, или для пористых материалов, в которые жидкость не попадет. полностью проникнуть.
Когда пикнометр заполнен до определенного, но не обязательно точно известного объема V и помещен на весы, он будет оказывать силу
- F b = g (mb — ρ amb ρ b) { displaystyle F_ {b} = g (m_ {b} — rho _ {a} {m_ {b} over rho _ {b}})}
где m b — масса бутылки и g ускорение свободного падения в месте, в котором производятся измерения. ρ a — это плотность воздуха при атмосферном давлении, а ρ b — плотность материала, из которого сделана бутылка (обычно стекла), так что второй член представляет собой масса воздуха, вытесненного стеклом бутылки, вес которой, согласно Принципу Архимеда, должен быть вычтен. Бутылка, конечно, наполнена воздухом, но поскольку этот воздух вытесняет такое же количество воздуха, вес этого воздуха компенсируется весом вытесняемого воздуха. Теперь мы наполняем бутылку эталонной жидкостью, например. чистая вода. Сила, действующая на чашу весов, принимает вид:
- F w = g (m b — ρ a m b ρ b + V ρ w — V ρ a). { displaystyle F_ {w} = g (m_ {b} — rho _ {a} {m_ {b} over rho _ {b}} + V rho _ {w} -V rho _ {a }).}
Если мы вычтем из этого силу, измеренную на пустой бутылке (или тарируем весы перед измерением воды), мы получим.
- F вес, N = г В (ρ вес — ρ a) { Displaystyle F_ {ш, n} = gV ( rho _ {w} — rho _ {a})}
где нижний индекс n указывает, что эта сила не зависит от силы пустой бутылки. Бутылка опорожнена, тщательно высушена и снова наполняется образцом. Сила, за вычетом пустой бутылки, теперь равна:
- F s, n = g V (ρ s — ρ a) { displaystyle F_ {s, n} = gV ( rho _ {s} — rho _ {a})}
, где ρ s — плотность образца. Соотношение сил образца и воды составляет:
- S G A = g V (ρ s — ρ a) g V (ρ w — ρ a) = (ρ s — ρ a) (ρ w — ρ a). { Displaystyle SG_ {A} = {gV ( rho _ {s} — rho _ {a}) over gV ( rho _ {w} — rho _ {a})} = {( rho _ {s} — rho _ {a}) over ( rho _ {w} — rho _ {a})}.}
Это называется кажущейся относительной плотностью и обозначается нижним индексом A, потому что это то, что мы получили бы, если бы взяли соотношение чистых весов в воздухе с аналитических весов или использовали ареометр (шток вытесняет воздух). Учтите, что результат не зависит от калибровки весов. Единственное требование к нему — чтобы он читался линейно с силой. RD A также не зависит от фактического объема пикнометра.
Дальнейшие манипуляции и, наконец, замена RD V, истинной относительной плотности (используется индекс V, потому что его часто называют относительной плотностью в вакууме) для ρ s/ρwдает соотношение между кажущейся и истинной относительной плотностью.
- RDA = ρ s ρ вес — ρ a ρ вес 1 — ρ a ρ вес = RDV — ρ a ρ w 1 — ρ a ρ вес { Displaystyle RD_ {A} = {{ rho _ {s} над rho _ {w}} — { rho _ {a} over rho _ {w}} над 1 — { rho _ {a} over rho _ {w}}} = {RD_ { V} — { rho _ {a} over rho _ {w}} over 1 — { rho _ {a} over rho _ {w}}}}
В обычном случае мы будем измерили вес и хотите получить истинную относительную плотность. Это находится из
- RDV = RDA — ρ a ρ w (RDA — 1) { displaystyle RD_ {V} = RD_ {A} — { rho _ {a} over rho _ {w}} ( RD_ {A} -1)}
Поскольку плотность сухого воздуха при 101,325 кПа при 20 ° C составляет 0,001205 г / см, а плотность воды составляет 0,998203 г / см, мы видим, что разница между истинной и кажущейся относительной плотностью для вещество с относительной плотностью (20 ° C / 20 ° C) около 1,100 будет 0,000120. Если относительная плотность образца близка к плотности воды (например, разбавленные растворы этанола), поправка еще меньше.
Пикнометр используется в стандарте ISO: ISO 1183-1: 2004, ISO 1014–1985 и стандарте ASTM : ASTM D854.
Типы
- Гей-Люссак, грушевидной формы, с перфорированной пробкой, регулируемая, вместимостью 1, 2, 5, 10, 25, 50 и 100 мл
- как указано выше, с заземленным в термометре, отрегулированном, боковая трубка с крышкой
- Хаббарда, для битума и тяжелой сырой нефти, цилиндрического типа, ASTM D 70, 24 мл
- как указано выше, конического типа, ASTM D 115 и D 234, 25 мл
- Загрузочный колпачок, с вакуумной рубашкой и термометром, вместимостью 5, 10, 25 и 50 mL
Цифровые плотномеры
Приборы на основе гидростатического давления: эта технология основана на принципе Паскаля, который гласит, что разница давления между двумя точками в вертикальном столбе жидкости зависит от вертикального расстояния между двумя точками., плотность жидкости и сила тяжести. Эта технология часто используется для измерения уровня жидкости в резервуарах в качестве удобного средства измерения уровня и плотности жидкости.
Преобразователи вибрирующего элемента: для этого типа инструмента требуется, чтобы вибрирующий элемент находился в контакте с исследуемой жидкостью. Резонансная частота элемента измеряется и связана с плотностью жидкости характеристикой, которая зависит от конструкции элемента. В современных лабораториях точные измерения относительной плотности производятся с помощью качающихся U-образных трубок. Они могут производить измерения с точностью до 5-6 знаков после запятой и используются в пивоваренной, дистилляционной, фармацевтической, нефтяной и других отраслях промышленности. Приборы измеряют фактическую массу жидкости, содержащейся в фиксированном объеме при температурах от 0 до 80 ° C, но, поскольку они основаны на микропроцессоре, могут рассчитывать кажущуюся или истинную относительную плотность и содержать таблицы, относящиеся к силе обычных кислот, растворов сахара и т. Д..
Ультразвуковой преобразователь: Ультразвуковые волны проходят от источника через интересующую жидкость и попадают в детектор, который измеряет акустическую спектроскопию волн. Такие свойства жидкости, как плотность и вязкость, можно определить по спектру.
Измеритель на основе излучения: Излучение проходит от источника через исследуемую жидкость в сцинтилляционный детектор или счетчик. По мере увеличения плотности жидкости регистрируемое излучение будет уменьшаться. Источником обычно является радиоактивный изотоп цезий-137 с периодом полураспада около 30 лет. Ключевым преимуществом этой технологии является то, что прибор не должен контактировать с жидкостью — обычно источник и детектор устанавливаются снаружи резервуаров или трубопроводов.
Датчик выталкивающей силы: создаваемая выталкивающая сила поплавком в однородной жидкости равна массе жидкости, вытесняемой поплавком. Поскольку выталкивающая сила линейна по отношению к плотности жидкости, в которую погружен поплавок, мера выталкивающей силы дает меру плотности жидкости. Один коммерчески доступный прибор утверждает, что прибор способен измерять относительную плотность с точностью ± 0,005 единиц RD. Погружная головка зонда содержит пружинно-поплавковую систему математических характеристик. Когда головка погружается в жидкость вертикально, поплавок перемещается вертикально, и положение поплавка контролирует положение постоянного магнита, смещение которого определяется концентрическим набором датчиков линейного перемещения на эффекте Холла. Выходные сигналы датчиков смешиваются в специальном электронном модуле, который обеспечивает одно выходное напряжение, величина которого является прямой линейной мерой измеряемой величины.
Примеры
| Материал | Удельный вес |
|---|---|
| Бальза | 0,2 |
| Дуб древесина | 0,75 |
| Этанол | 0,78 |
| Оливковое масло | 0,91 |
| Вода | 1 |
| Ironwood | 1.5 |
| Graphite | 1.9–2.3 |
| Table salt | 2.17 |
| Aluminium | 2.7 |
| Cement | 3.15 |
| Iron | 7.87 |
| Copper | 8.96 |
| Lead | 11.35 |
| Mercury | 13.56 |
| Depleted uranium | 19.1 |
| Gold | 19.3 |
| Osmium | 22.59 |
(Samples may vary, and these figures are approximate.) Substances with a relative density of 1 are neutrally buoyant, those with RD greater than one are denser than water, and so (ignoring surface tension effects) will sink in it, and those with an RD of less than one are less dense than water, and so will float.
Example:
- R D H 2 O = ρ M a t e r i a l ρ H 2 O = R D, {displaystyle RD_{H_{2}O}={frac {rho _{mathrm {Material} }}{rho _{mathrm {H_{2}O} }}} =RD,}
Helium gas has a density of 0.164 g/L; it is 0.139 times as dense as air, which has a density of 1.18 g/L.
- Urine normally has a specific gravity between 1.003 and 1.030. The Urine Specific Gravity diagnostic test is used to evaluate renal concentration ability for assessment of the urinary system. Low concentration may indicate diabetes insipidus, while high concentration may indicate albuminuria or glycosuria.
- Blood normally has a specific gravity of approximately 1.060.
- Vodka 80° proof (40% v/v) has a specific gravity of 0.9498.
See also
- API gravity
- Baumé scale
- Buoyancy
- Fluid mechanics
- Gravity (beer)
- Hydrometer
- Jolly balance
- Plato scale
References
Further reading
- Fundamentals of Fluid Mechanics Wiley, B.R. Munson, D.F. Young T.H. Okishi
- Introduction to Fluid Mechanics Fourth Edition, Wiley, SI Version, R.W. Fox A.T. McDonald
- Thermodynamics: An Engineering Approach Second Edition, McGraw-Hill, International Edition, Y.A. Cengel M.A. Boles
- Munson, B. R.; D. F. Young; T. H. Okishi (2001). Fundamentals of Fluid Mechanics (4th ed.). Вайли. ISBN 978-0-471-44250-9.
- Fox, R. W.; McDonald, A. T. (2003). Introduction to Fluid Mechanics (4th ed.). Вайли. ISBN 0-471-20231-2.
External links
- Specific Gravity Weights Of Materials