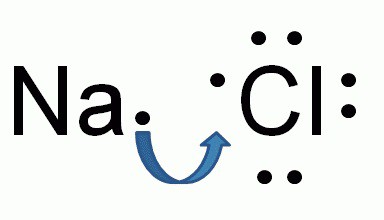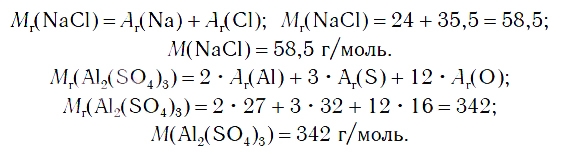This article is about the chemical. For its familiar form, common table salt, see Salt. For the medical solutions, see Saline (medicine). For the mineral, see Halite.

Sodium chloride crystals in a form of halite |
|
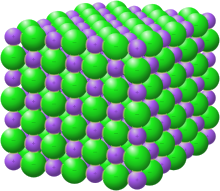
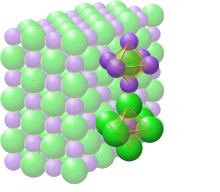
Crystal structure with sodium in purple and chloride in green[1] |
|
| Names | |
|---|---|
| IUPAC name
Sodium chloride |
|
Other names
|
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
|
Beilstein Reference |
3534976 |
| ChEBI |
|
| ChEMBL |
|
| ChemSpider |
|
| ECHA InfoCard | 100.028.726 |
| EC Number |
|
|
Gmelin Reference |
13673 |
| KEGG |
|
| MeSH | Sodium+chloride |
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
NaCl |
| Molar mass | 58.443 g/mol[2] |
| Appearance | Colorless cubic crystals[2] |
| Odor | Odorless |
| Density | 2.17 g/cm3[2] |
| Melting point | 800.7 °C (1,473.3 °F; 1,073.8 K)[2] |
| Boiling point | 1,465 °C (2,669 °F; 1,738 K)[2] |
|
Solubility in water |
360 g/1000 g pure water at T = 25 °C[2] |
| Solubility in ammonia | 21.5 g/L at T = ?[clarification needed] |
| Solubility in methanol | 14.9 g/L at T = ?[clarification needed] |
|
Magnetic susceptibility (χ) |
−30.2·10−6 cm3/mol[3] |
|
Refractive index (nD) |
1.5441 (at 589 nm)[4] |
| Structure[5] | |
|
Crystal structure |
Face-centered cubic (see text), cF8 |
|
Space group |
Fm3m (No. 225) |
|
Lattice constant |
a = 564.02 pm |
|
Formula units (Z) |
4 |
|
Coordination geometry |
octahedral at Na+ octahedral at Cl− |
| Thermochemistry[6] | |
|
Heat capacity (C) |
50.5 J/(K·mol) |
|
Std molar |
72.10 J/(K·mol) |
|
Std enthalpy of |
−411.120 kJ/mol |
| Pharmacology | |
|
ATC code |
A12CA01 (WHO) B05CB01 (WHO), B05XA03 (WHO), S01XA03 (WHO) |
| Hazards | |
| NFPA 704 (fire diamond) |
0 0 0 |
| Lethal dose or concentration (LD, LC): | |
|
LD50 (median dose) |
3 g/kg (oral, rats)[7] |
| Related compounds | |
|
Other anions |
Sodium fluoride Sodium bromide Sodium iodide Sodium astatide |
|
Other cations |
Lithium chloride Potassium chloride Rubidium chloride Caesium chloride Francium chloride |
| Supplementary data page | |
| Sodium chloride (data page) | |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Sodium chloride ,[8] commonly known as salt (although sea salt also contains other chemical salts), is an ionic compound with the chemical formula NaCl, representing a 1:1 ratio of sodium and chloride ions. With molar masses of 22.99 and 35.45 g/mol respectively, 100 g of NaCl contains 39.34 g Na and 60.66 g Cl. Sodium chloride is the salt most responsible for the salinity of seawater and of the extracellular fluid of many multicellular organisms. In its edible form, salt (also known as table salt) is commonly used as a condiment and food preservative. Large quantities of sodium chloride are used in many industrial processes, and it is a major source of sodium and chlorine compounds used as feedstocks for further chemical syntheses. Another major application of sodium chloride is de-icing of roadways in sub-freezing weather.
Uses[edit]
In addition to the familiar domestic uses of salt, more dominant applications of the approximately 250 million tonnes per year production (2008 data) include chemicals and de-icing.[9]
Chemical functions[edit]
Salt is used, directly or indirectly, in the production of many chemicals, which consume most of the world’s production.[10]
Chlor-alkali industry[edit]
It is the starting point for the chloralkali process, the industrial process to produce chlorine and sodium hydroxide, according to the chemical equation
This electrolysis is conducted in either a mercury cell, a diaphragm cell, or a membrane cell. Each of those uses a different method to separate the chlorine from the sodium hydroxide. Other technologies are under development due to the high energy consumption of the electrolysis, whereby small improvements in the efficiency can have large economic paybacks. Some applications of chlorine include PVC thermoplastics production, disinfectants, and solvents.
Sodium hydroxide is extensively used in many different industries enabling production of paper, soap, and aluminium etc.
Soda-ash industry[edit]
Sodium chloride is used in the Solvay process to produce sodium carbonate and calcium chloride. Sodium carbonate, in turn, is used to produce glass, sodium bicarbonate, and dyes, as well as a myriad of other chemicals. In the Mannheim process, sodium chloride is used for the production of sodium sulfate and hydrochloric acid.
Standard[edit]
Sodium chloride has an international standard that is created by ASTM International. The standard is named ASTM E534-13 and is the standard test methods for chemical analysis of sodium chloride. These methods listed provide procedures for analyzing sodium chloride to determine whether it is suitable for its intended use and application.
Miscellaneous industrial uses[edit]
Sodium chloride is heavily used, so even relatively minor applications can consume massive quantities. In oil and gas exploration, salt is an important component of drilling fluids in well drilling. It is used to flocculate and increase the density of the drilling fluid to overcome high downwell gas pressures. Whenever a drill hits a salt formation, salt is added to the drilling fluid to saturate the solution in order to minimize the dissolution within the salt stratum.[9] Salt is also used to increase the curing of concrete in cemented casings.[10]
In textiles and dyeing, salt is used as a brine rinse to separate organic contaminants, to promote «salting out» of dyestuff precipitates, and to blend with concentrated dyes to standardize[clarification needed] them. One of its main roles is to provide the positive ion charge to promote the absorption of negatively charged ions of dyes.[10]
It is also used in processing aluminium, beryllium, copper, steel and vanadium. In the pulp and paper industry, salt is used to bleach wood pulp. It also is used to make sodium chlorate, which is added along with sulfuric acid and water to manufacture chlorine dioxide, an excellent oxygen-based bleaching chemical. The chlorine dioxide process, which originated in Germany after World War I, is becoming more popular because of environmental pressures to reduce or eliminate chlorinated bleaching compounds. In tanning and leather treatment, salt is added to animal hides to inhibit microbial activity on the underside of the hides and to attract moisture back into the hides.[10]
In rubber manufacture, salt is used to make buna, neoprene and white rubber types. Salt brine and sulfuric acid are used to coagulate an emulsified latex made from chlorinated butadiene.[10][9]
Salt also is added to secure the soil and to provide firmness to the foundation on which highways are built. The salt acts to minimize the effects of shifting caused in the subsurface by changes in humidity and traffic load.[10]
Sodium chloride is sometimes used as a cheap and safe desiccant because of its hygroscopic properties, making salting an effective method of food preservation historically; the salt draws water out of bacteria through osmotic pressure, keeping it from reproducing, a major source of food spoilage. Even though more effective desiccants are available, few are safe for humans to ingest.
Water softening[edit]
Hard water contains calcium and magnesium ions that interfere with action of soap and contribute to the buildup of a scale or film of alkaline mineral deposits in household and industrial equipment and pipes. Commercial and residential water-softening units use ion-exchange resins to remove ions that cause the hardness. These resins are generated and regenerated using sodium chloride.[10][9]
Road salt[edit]
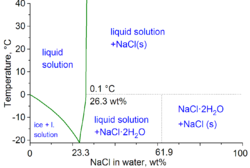
Phase diagram of water–NaCl mixture
The second major application of salt is for de-icing and anti-icing of roads, both in grit bins and spread by winter service vehicles. In anticipation of snowfall, roads are optimally «anti-iced» with brine (concentrated solution of salt in water), which prevents bonding between the snow-ice and the road surface. This procedure obviates the heavy use of salt after the snowfall. For de-icing, mixtures of brine and salt are used, sometimes with additional agents such as calcium chloride and/or magnesium chloride. The use of salt or brine becomes ineffective below −10 °C (14 °F).
Mounds of road salt for use in winter
Salt for de-icing in the United Kingdom predominantly comes from a single mine in Winsford in Cheshire. Prior to distribution it is mixed with <100 ppm of sodium ferrocyanide as an anti-caking agent, which enables rock salt to flow freely out of the gritting vehicles despite being stockpiled prior to use. In recent years this additive has also been used in table salt. Other additives had been used in road salt to reduce the total costs. For example, in the US, a byproduct carbohydrate solution from sugar-beet processing was mixed with rock salt and adhered to road surfaces about 40% better than loose rock salt alone. Because it stayed on the road longer, the treatment did not have to be repeated several times, saving time and money.[10]
In the technical terms of physical chemistry, the minimum freezing point of a water-salt mixture is −21.12 °C (−6.02 °F) for 23.31 wt% of salt. Freezing near this concentration is however so slow that the eutectic point of −22.4 °C (−8.3 °F) can be reached with about 25 wt% of salt.[11]
Environmental effects[edit]
Road salt ends up in fresh-water bodies and could harm aquatic plants and animals by disrupting their osmoregulation ability.[12] The omnipresence of salt poses a problem in any coastal coating application, as trapped salts cause great problems in adhesion. Naval authorities and ship builders monitor the salt concentrations on surfaces during construction. Maximal salt concentrations on surfaces are dependent on the authority and application. The IMO regulation is mostly used and sets salt levels to a maximum of 50 mg/m2 soluble salts measured as sodium chloride. These measurements are done by means of a Bresle test. Salinization (increasing salinity, aka freshwater salinization syndrome) and subsequent increased metal leaching is an ongoing problem throughout North America and European fresh waterways.[13]
In highway de-icing, salt has been associated with corrosion of bridge decks, motor vehicles, reinforcement bar and wire, and unprotected steel structures used in road construction. Surface runoff, vehicle spraying, and windblown actions also affect soil, roadside vegetation, and local surface water and groundwater supplies. Although evidence of environmental loading of salt has been found during peak usage, the spring rains and thaws usually dilute the concentrations of sodium in the area where salt was applied.[10] A 2009 study found that approximately 70% of the road salt being applied in the Minneapolis-St Paul metro area is retained in the local watershed.[14]
Substitution[edit]
Some agencies are substituting beer, molasses, and beet juice instead of road salt.[15] Airlines utilize more glycol and sugar rather than salt based solutions for de-icing.[16]
Food industry and agriculture[edit]
Main article: Salt
Many microorganisms cannot live in a salty environment: water is drawn out of their cells by osmosis. For this reason salt is used to preserve some foods, such as bacon, fish, or cabbage.
Salt is added to food, either by the food producer or by the consumer, as a flavor enhancer, preservative, binder, fermentation-control additive, texture-control agent and color developer. The salt consumption in the food industry is subdivided, in descending order of consumption, into other food processing, meat packers, canning, baking, dairy and grain mill products. Salt is added to promote color development in bacon, ham and other processed meat products. As a preservative, salt inhibits the growth of bacteria. Salt acts as a binder in sausages to form a binding gel made up of meat, fat, and moisture. Salt also acts as a flavor enhancer and as a tenderizer.[10]
In many dairy industries, salt is added to cheese as a color-, fermentation-, and texture-control agent. The dairy subsector includes companies that manufacture creamery butter, condensed and evaporated milk, frozen desserts, ice cream, natural and processed cheese, and specialty dairy products. In canning, salt is primarily added as a flavor enhancer and preservative. It also is used as a carrier for other ingredients, dehydrating agent, enzyme inhibitor and tenderizer. In baking, salt is added to control the rate of fermentation in bread dough. It also is used to strengthen the gluten (the elastic protein-water complex in certain doughs) and as a flavor enhancer, such as a topping on baked goods. The food-processing category also contains grain mill products. These products consist of milling flour and rice and manufacturing cereal breakfast food and blended or prepared flour. Salt is also used a seasoning agent, e.g. in potato chips, pretzels, cat and dog food.[10]
Sodium chloride is used in veterinary medicine as emesis-causing agent. It is given as warm saturated solution. Emesis can also be caused by pharyngeal placement of small amount of plain salt or salt crystals.
Medicine[edit]
Sodium chloride is used together with water as one of the primary solutions for intravenous therapy. Nasal spray often contains a saline solution.
Firefighting[edit]
A class-D fire extinguisher for various metals
Sodium chloride is the principal extinguishing agent in fire extinguishers (Met-L-X, Super D) used on combustible metal fires such as magnesium, potassium, sodium, and NaK alloys (Class D). Thermoplastic powder is added to the mixture, along with waterproofing (metal stearates) and anti-caking materials (tricalcium phosphate) to form the extinguishing agent. When it is applied to the fire, the salt acts like a heat sink, dissipating heat from the fire, and also forms an oxygen-excluding crust to smother the fire. The plastic additive melts and helps the crust maintain its integrity until the burning metal cools below its ignition temperature. This type of extinguisher was invented in the late 1940s as a cartridge-operated unit, although stored pressure versions are now popular. Common sizes are 30 pounds (14 kg) portable and 350 pounds (160 kg) wheeled.[citation needed]
Cleanser[edit]
Since at least medieval times, people have used salt as a cleansing agent rubbed on household surfaces. It is also used in many brands of shampoo, toothpaste and popularly to de-ice driveways and patches of ice.
Optical usage[edit]
Defect-free NaCl crystals have an optical transmittance of about 90% for infrared light, specifically between 200 nm and 20 µm. They were therefore used in optical components (windows and prisms) operating in that spectral range, where few non-absorbing alternatives exist and where requirements for absence of microscopic inhomogeneities are less strict than in the visible range. While inexpensive, NaCl crystals are soft and hygroscopic – when exposed to the ambient air, they gradually cover with «frost». This limits application of NaCl to dry environments, vacuum sealed assembly areas or for short-term uses such as prototyping. Nowadays materials like zinc selenide (ZnSe), which are stronger mechanically and are less sensitive to moisture, are used instead of NaCl for the infrared spectral range.
Chemistry[edit]
Solid sodium chloride[edit]
Sodium chloride crystal under microscope.
NaCl octahedra. The yellow stipples represent the electrostatic force between the ions of opposite charge
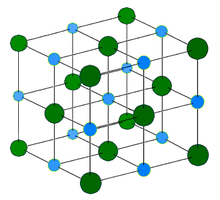
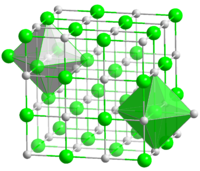
In solid sodium chloride, each ion is surrounded by six ions of the opposite charge as expected on electrostatic grounds. The surrounding ions are located at the vertices of a regular octahedron. In the language of close-packing, the larger chloride ions (167 pm in size[17]) are arranged in a cubic array whereas the smaller sodium ions (116 pm[17]) fill all the cubic gaps (octahedral voids) between them. This same basic structure is found in many other compounds and is commonly known as the halite or rock-salt crystal structure. It can be represented as a face-centered cubic (fcc) lattice with a two-atom basis or as two interpenetrating face centered cubic lattices. The first atom is located at each lattice point, and the second atom is located halfway between lattice points along the fcc unit cell edge.
Solid sodium chloride has a melting point of 801 °C. Thermal conductivity of sodium chloride as a function of temperature has a maximum of 2.03 W/(cm K) at 8 K (−265.15 °C; −445.27 °F) and decreases to 0.069 at 314 K (41 °C; 106 °F). It also decreases with doping.[18]
Atomic-resolution real-time video imaging allows visualization of the initial stage of crystal nucleation of sodium chloride.[19]
Aqueous solutions[edit]
| Solubility of NaCl (g NaCl / 1 kg of solvent at 25 °C (77 °F))[20] |
|
|---|---|
| Water | 360 |
| Formamide | 94 |
| Glycerin | 83 |
| Propylene glycol | 71 |
| Formic acid | 52 |
| Liquid ammonia | 30.2 |
| Methanol | 14 |
| Ethanol | 0.65 |
| Dimethylformamide | 0.4 |
| Propan-1-ol | 0.124 |
| Sulfolane | 0.05 |
| Butan-1-ol | 0.05 |
| Propan-2-ol | 0.03 |
| Pentan-1-ol | 0.018 |
| Acetonitrile | 0.003 |
| Acetone | 0.00042 |
The attraction between the Na+ and Cl− ions in the solid is so strong that only highly polar solvents like water dissolve NaCl well.
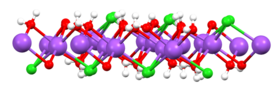
View of one slab of NaCl(H2O)2 (red = O, white = H, green = Cl, purple = Na).[21]
When dissolved in water, the sodium chloride framework disintegrates as the Na+ and Cl− ions become surrounded by polar water molecules. These solutions consist of metal aquo complex with the formula [Na(H2O)8]+, with the Na–O distance of 250 pm. The chloride ions are also strongly solvated, each being surrounded by an average of six molecules of water.[22] Solutions of sodium chloride have very different properties from pure water. The eutectic point is −21.12 °C (−6.02 °F) for 23.31% mass fraction of salt, and the boiling point of saturated salt solution is near 108.7 °C (227.7 °F).[11] From cold solutions, salt crystallises as the dihydrate NaCl·2H2O.[23]
pH of sodium chloride solutions[edit]
The pH of a sodium chloride solution remains ≈7 due to the extremely weak basicity of the Cl− ion, which is the conjugate base of the strong acid HCl. In other words, NaCl has no effect on system pH[24] in diluted solutions where the effects of ionic strength and activity coefficients are negligible.
Stoichiometric and structure variants[edit]
Common salt has a 1:1 molar ratio of sodium and chlorine. In 2013, compounds of sodium and chloride of different stoichiometries have been discovered; five new compounds were predicted (e.g., Na3Cl, Na2Cl, Na3Cl2, NaCl3, and NaCl7). The existence of some of them has been experimentally confirmed at high pressures: cubic and orthorhombic NaCl3 and two-dimensional metallic tetragonal Na3Cl. This indicates that compounds violating chemical intuition are possible, in simple systems under nonambient conditions.[25]
Occurrence[edit]
Most of the world’s salt is dissolved in the ocean[citation needed]. A lesser amount is found in the Earth’s crust as the water-soluble mineral halite (rock salt), and a tiny amount exists as suspended sea salt particles in the atmosphere[citation needed]. These particles are the dominant cloud condensation nuclei far out at sea, which allow the formation of clouds in otherwise non-polluted air.[26]
Production[edit]
Salt is currently mass-produced by evaporation of seawater or brine from brine wells and salt lakes. Mining of rock salt is also a major source. China is the world’s main supplier of salt.[10] In 2017, world production was estimated at 280 million tonnes, the top five producers (in million tonnes) being China (68.0), United States (43.0), India (26.0), Germany (13.0), and Canada (13.0).[27] Salt is also a byproduct of potassium mining.
See also[edit]
- Biosalinity
- Edible salt (table salt)
- Halite, the mineral form of sodium chloride
- Health effects of salt
- Salinity
- Salting the earth
- Salt poisoning
References[edit]
- ^ «Sodium Chloride (NaCl) Crystal». PhysicsOpenLab. Retrieved 23 August 2021.
- ^ a b c d e f Haynes, 4.89
- ^ Haynes, 4.135
- ^ Haynes, 10.241
- ^ Haynes, 4.148
- ^ Haynes, 5.8
- ^ Sodium chloride. nlm.nih.gov.
- ^ Wells, John C. (2008), Longman Pronunciation Dictionary (3rd ed.), Longman, pp. 143 and 755, ISBN 9781405881180
- ^ a b c d Westphal, Gisbert et al. (2002) «Sodium Chloride» in Ullmann’s Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim doi:10.1002/14356007.a24_317.pub4.
- ^ a b c d e f g h i j k l Kostick, Dennis S. (October 2010) «Salt» in U.S. Geological Survey, 2008 Minerals Yearbook
- ^ a b Elvers, B. et al. (ed.) (1991) Ullmann’s Encyclopedia of Industrial Chemistry, 5th ed. Vol. A24, Wiley, p. 319, ISBN 978-3-527-20124-2.
- ^ Rastogi, Nina (16 February 2010) Does road salt harm the environment? slate.com.
- ^ «Saltier waterways are creating dangerous ‘chemical cocktails’«. phys.org.
- ^ «Most Road Salt Is Making It into Lakes And Rivers». www.sciencedaily.com. University of Minnesota. 20 February 2009. Retrieved 27 September 2015.
- ^ Casey, Michael. «Turning to beet juice and beer to address road salt danger». phys.org.
- ^ «EASA Cautions on Organic Salt Deicing Fluid». MRO Network. 9 December 2016.
- ^ a b R. D. Shannon (1976). «Revised effective ionic radii and systematic studies of interatomic distances in halides and chalcogenides». Acta Crystallogr A. 32 (5): 751–767. Bibcode:1976AcCrA..32..751S. doi:10.1107/S0567739476001551.
- ^ Sirdeshmukh, Dinker B.; Sirdeshmukh, Lalitha & Subhadra, K. G. (2001). Alkali halides: a handbook of physical properties. Springer. pp. 65, 68. ISBN 978-3-540-42180-1.
- ^ Nakamuro, Takayuki; Sakakibara, Masaya; Nada, Hiroki; Harano, Koji; Nakamura, Eiichi (2021). «Capturing the Moment of Emergence of Crystal Nucleus from Disorder». Journal of the American Chemical Society. 143 (4): 1763–1767. doi:10.1021/jacs.0c12100. PMID 33475359.
- ^ Burgess, J (1978). Metal Ions in Solution. New York: Ellis Horwood. ISBN 978-0-85312-027-8.
- ^ Klewe, B; Pedersen (1974). «The crystal structure of sodium chloride dihydrate». Acta Crystallogr. B30 (10): 2363–2371. doi:10.1107/S0567740874007138.
- ^ Lincoln, S. F.; Richens, D. T. and Sykes, A. G. (2003) «Metal Aqua Ions» Comprehensive Coordination Chemistry II Volume 1, pp. 515–555. doi:10.1016/B0-08-043748-6/01055-0.
- ^ Water-NaCl phase diagram. Lide, CRC Handbook of Chemistry and Physics, 86 ed (2005-2006), CRC pages 8-71, 8-116
- ^ «Acidic, Basic, and Neutral Salts». Flinn Scientific Chem Fax. 2016. Retrieved 18 September 2018.
Neutralization of a strong acid and a strong base gives a neutral salt.
- ^ Zhang, W.; Oganov, A. R.; Goncharov, A. F.; Zhu, Q.; Boulfelfel, S. E.; Lyakhov, A. O.; Stavrou, E.; Somayazulu, M.; Prakapenka, V. B.; Konôpková, Z. (2013). «Unexpected Stable Stoichiometries of Sodium Chlorides». Science. 342 (6165): 1502–1505. arXiv:1310.7674. Bibcode:2013Sci…342.1502Z. doi:10.1126/science.1244989. PMID 24357316. S2CID 15298372.
- ^ Mason, B. J. (2006). «The role of sea-salt particles as cloud condensation nuclei over the remote oceans». Quarterly Journal of the Royal Meteorological Society. 127 (576): 2023–32. Bibcode:2001QJRMS.127.2023M. doi:10.1002/qj.49712757609. S2CID 121846285.
- ^ Salt, U.S. Geological Survey
This article incorporates public domain material from Salt (PDF). United States Geological Survey.
Cited sources[edit]
- Haynes, William M., ed. (2011). CRC Handbook of Chemistry and Physics (92nd ed.). CRC Press. ISBN 978-1439855119.
External links[edit]
Wikimedia Commons has media related to NaCl.
- Salt United States Geological Survey Statistics and Information
- «Using Salt and Sand for Winter Road Maintenance». Road Management Journal. December 1997. Archived from the original on 21 September 2016. Retrieved 13 February 2007.
- Calculators: surface tensions, and densities, molarities and molalities of aqueous NaCl (and other salts)
- JtBaker MSDS
This article is about the chemical. For its familiar form, common table salt, see Salt. For the medical solutions, see Saline (medicine). For the mineral, see Halite.

Sodium chloride crystals in a form of halite |
|

Crystal structure with sodium in purple and chloride in green[1] |
|
| Names | |
|---|---|
| IUPAC name
Sodium chloride |
|
Other names
|
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
|
Beilstein Reference |
3534976 |
| ChEBI |
|
| ChEMBL |
|
| ChemSpider |
|
| ECHA InfoCard | 100.028.726 |
| EC Number |
|
|
Gmelin Reference |
13673 |
| KEGG |
|
| MeSH | Sodium+chloride |
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
NaCl |
| Molar mass | 58.443 g/mol[2] |
| Appearance | Colorless cubic crystals[2] |
| Odor | Odorless |
| Density | 2.17 g/cm3[2] |
| Melting point | 800.7 °C (1,473.3 °F; 1,073.8 K)[2] |
| Boiling point | 1,465 °C (2,669 °F; 1,738 K)[2] |
|
Solubility in water |
360 g/1000 g pure water at T = 25 °C[2] |
| Solubility in ammonia | 21.5 g/L at T = ?[clarification needed] |
| Solubility in methanol | 14.9 g/L at T = ?[clarification needed] |
|
Magnetic susceptibility (χ) |
−30.2·10−6 cm3/mol[3] |
|
Refractive index (nD) |
1.5441 (at 589 nm)[4] |
| Structure[5] | |
|
Crystal structure |
Face-centered cubic (see text), cF8 |
|
Space group |
Fm3m (No. 225) |
|
Lattice constant |
a = 564.02 pm |
|
Formula units (Z) |
4 |
|
Coordination geometry |
octahedral at Na+ octahedral at Cl− |
| Thermochemistry[6] | |
|
Heat capacity (C) |
50.5 J/(K·mol) |
|
Std molar |
72.10 J/(K·mol) |
|
Std enthalpy of |
−411.120 kJ/mol |
| Pharmacology | |
|
ATC code |
A12CA01 (WHO) B05CB01 (WHO), B05XA03 (WHO), S01XA03 (WHO) |
| Hazards | |
| NFPA 704 (fire diamond) |
0 0 0 |
| Lethal dose or concentration (LD, LC): | |
|
LD50 (median dose) |
3 g/kg (oral, rats)[7] |
| Related compounds | |
|
Other anions |
Sodium fluoride Sodium bromide Sodium iodide Sodium astatide |
|
Other cations |
Lithium chloride Potassium chloride Rubidium chloride Caesium chloride Francium chloride |
| Supplementary data page | |
| Sodium chloride (data page) | |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Sodium chloride ,[8] commonly known as salt (although sea salt also contains other chemical salts), is an ionic compound with the chemical formula NaCl, representing a 1:1 ratio of sodium and chloride ions. With molar masses of 22.99 and 35.45 g/mol respectively, 100 g of NaCl contains 39.34 g Na and 60.66 g Cl. Sodium chloride is the salt most responsible for the salinity of seawater and of the extracellular fluid of many multicellular organisms. In its edible form, salt (also known as table salt) is commonly used as a condiment and food preservative. Large quantities of sodium chloride are used in many industrial processes, and it is a major source of sodium and chlorine compounds used as feedstocks for further chemical syntheses. Another major application of sodium chloride is de-icing of roadways in sub-freezing weather.
Uses[edit]
In addition to the familiar domestic uses of salt, more dominant applications of the approximately 250 million tonnes per year production (2008 data) include chemicals and de-icing.[9]
Chemical functions[edit]
Salt is used, directly or indirectly, in the production of many chemicals, which consume most of the world’s production.[10]
Chlor-alkali industry[edit]
It is the starting point for the chloralkali process, the industrial process to produce chlorine and sodium hydroxide, according to the chemical equation
This electrolysis is conducted in either a mercury cell, a diaphragm cell, or a membrane cell. Each of those uses a different method to separate the chlorine from the sodium hydroxide. Other technologies are under development due to the high energy consumption of the electrolysis, whereby small improvements in the efficiency can have large economic paybacks. Some applications of chlorine include PVC thermoplastics production, disinfectants, and solvents.
Sodium hydroxide is extensively used in many different industries enabling production of paper, soap, and aluminium etc.
Soda-ash industry[edit]
Sodium chloride is used in the Solvay process to produce sodium carbonate and calcium chloride. Sodium carbonate, in turn, is used to produce glass, sodium bicarbonate, and dyes, as well as a myriad of other chemicals. In the Mannheim process, sodium chloride is used for the production of sodium sulfate and hydrochloric acid.
Standard[edit]
Sodium chloride has an international standard that is created by ASTM International. The standard is named ASTM E534-13 and is the standard test methods for chemical analysis of sodium chloride. These methods listed provide procedures for analyzing sodium chloride to determine whether it is suitable for its intended use and application.
Miscellaneous industrial uses[edit]
Sodium chloride is heavily used, so even relatively minor applications can consume massive quantities. In oil and gas exploration, salt is an important component of drilling fluids in well drilling. It is used to flocculate and increase the density of the drilling fluid to overcome high downwell gas pressures. Whenever a drill hits a salt formation, salt is added to the drilling fluid to saturate the solution in order to minimize the dissolution within the salt stratum.[9] Salt is also used to increase the curing of concrete in cemented casings.[10]
In textiles and dyeing, salt is used as a brine rinse to separate organic contaminants, to promote «salting out» of dyestuff precipitates, and to blend with concentrated dyes to standardize[clarification needed] them. One of its main roles is to provide the positive ion charge to promote the absorption of negatively charged ions of dyes.[10]
It is also used in processing aluminium, beryllium, copper, steel and vanadium. In the pulp and paper industry, salt is used to bleach wood pulp. It also is used to make sodium chlorate, which is added along with sulfuric acid and water to manufacture chlorine dioxide, an excellent oxygen-based bleaching chemical. The chlorine dioxide process, which originated in Germany after World War I, is becoming more popular because of environmental pressures to reduce or eliminate chlorinated bleaching compounds. In tanning and leather treatment, salt is added to animal hides to inhibit microbial activity on the underside of the hides and to attract moisture back into the hides.[10]
In rubber manufacture, salt is used to make buna, neoprene and white rubber types. Salt brine and sulfuric acid are used to coagulate an emulsified latex made from chlorinated butadiene.[10][9]
Salt also is added to secure the soil and to provide firmness to the foundation on which highways are built. The salt acts to minimize the effects of shifting caused in the subsurface by changes in humidity and traffic load.[10]
Sodium chloride is sometimes used as a cheap and safe desiccant because of its hygroscopic properties, making salting an effective method of food preservation historically; the salt draws water out of bacteria through osmotic pressure, keeping it from reproducing, a major source of food spoilage. Even though more effective desiccants are available, few are safe for humans to ingest.
Water softening[edit]
Hard water contains calcium and magnesium ions that interfere with action of soap and contribute to the buildup of a scale or film of alkaline mineral deposits in household and industrial equipment and pipes. Commercial and residential water-softening units use ion-exchange resins to remove ions that cause the hardness. These resins are generated and regenerated using sodium chloride.[10][9]
Road salt[edit]
Phase diagram of water–NaCl mixture
The second major application of salt is for de-icing and anti-icing of roads, both in grit bins and spread by winter service vehicles. In anticipation of snowfall, roads are optimally «anti-iced» with brine (concentrated solution of salt in water), which prevents bonding between the snow-ice and the road surface. This procedure obviates the heavy use of salt after the snowfall. For de-icing, mixtures of brine and salt are used, sometimes with additional agents such as calcium chloride and/or magnesium chloride. The use of salt or brine becomes ineffective below −10 °C (14 °F).
Mounds of road salt for use in winter
Salt for de-icing in the United Kingdom predominantly comes from a single mine in Winsford in Cheshire. Prior to distribution it is mixed with <100 ppm of sodium ferrocyanide as an anti-caking agent, which enables rock salt to flow freely out of the gritting vehicles despite being stockpiled prior to use. In recent years this additive has also been used in table salt. Other additives had been used in road salt to reduce the total costs. For example, in the US, a byproduct carbohydrate solution from sugar-beet processing was mixed with rock salt and adhered to road surfaces about 40% better than loose rock salt alone. Because it stayed on the road longer, the treatment did not have to be repeated several times, saving time and money.[10]
In the technical terms of physical chemistry, the minimum freezing point of a water-salt mixture is −21.12 °C (−6.02 °F) for 23.31 wt% of salt. Freezing near this concentration is however so slow that the eutectic point of −22.4 °C (−8.3 °F) can be reached with about 25 wt% of salt.[11]
Environmental effects[edit]
Road salt ends up in fresh-water bodies and could harm aquatic plants and animals by disrupting their osmoregulation ability.[12] The omnipresence of salt poses a problem in any coastal coating application, as trapped salts cause great problems in adhesion. Naval authorities and ship builders monitor the salt concentrations on surfaces during construction. Maximal salt concentrations on surfaces are dependent on the authority and application. The IMO regulation is mostly used and sets salt levels to a maximum of 50 mg/m2 soluble salts measured as sodium chloride. These measurements are done by means of a Bresle test. Salinization (increasing salinity, aka freshwater salinization syndrome) and subsequent increased metal leaching is an ongoing problem throughout North America and European fresh waterways.[13]
In highway de-icing, salt has been associated with corrosion of bridge decks, motor vehicles, reinforcement bar and wire, and unprotected steel structures used in road construction. Surface runoff, vehicle spraying, and windblown actions also affect soil, roadside vegetation, and local surface water and groundwater supplies. Although evidence of environmental loading of salt has been found during peak usage, the spring rains and thaws usually dilute the concentrations of sodium in the area where salt was applied.[10] A 2009 study found that approximately 70% of the road salt being applied in the Minneapolis-St Paul metro area is retained in the local watershed.[14]
Substitution[edit]
Some agencies are substituting beer, molasses, and beet juice instead of road salt.[15] Airlines utilize more glycol and sugar rather than salt based solutions for de-icing.[16]
Food industry and agriculture[edit]
Main article: Salt
Many microorganisms cannot live in a salty environment: water is drawn out of their cells by osmosis. For this reason salt is used to preserve some foods, such as bacon, fish, or cabbage.
Salt is added to food, either by the food producer or by the consumer, as a flavor enhancer, preservative, binder, fermentation-control additive, texture-control agent and color developer. The salt consumption in the food industry is subdivided, in descending order of consumption, into other food processing, meat packers, canning, baking, dairy and grain mill products. Salt is added to promote color development in bacon, ham and other processed meat products. As a preservative, salt inhibits the growth of bacteria. Salt acts as a binder in sausages to form a binding gel made up of meat, fat, and moisture. Salt also acts as a flavor enhancer and as a tenderizer.[10]
In many dairy industries, salt is added to cheese as a color-, fermentation-, and texture-control agent. The dairy subsector includes companies that manufacture creamery butter, condensed and evaporated milk, frozen desserts, ice cream, natural and processed cheese, and specialty dairy products. In canning, salt is primarily added as a flavor enhancer and preservative. It also is used as a carrier for other ingredients, dehydrating agent, enzyme inhibitor and tenderizer. In baking, salt is added to control the rate of fermentation in bread dough. It also is used to strengthen the gluten (the elastic protein-water complex in certain doughs) and as a flavor enhancer, such as a topping on baked goods. The food-processing category also contains grain mill products. These products consist of milling flour and rice and manufacturing cereal breakfast food and blended or prepared flour. Salt is also used a seasoning agent, e.g. in potato chips, pretzels, cat and dog food.[10]
Sodium chloride is used in veterinary medicine as emesis-causing agent. It is given as warm saturated solution. Emesis can also be caused by pharyngeal placement of small amount of plain salt or salt crystals.
Medicine[edit]
Sodium chloride is used together with water as one of the primary solutions for intravenous therapy. Nasal spray often contains a saline solution.
Firefighting[edit]
A class-D fire extinguisher for various metals
Sodium chloride is the principal extinguishing agent in fire extinguishers (Met-L-X, Super D) used on combustible metal fires such as magnesium, potassium, sodium, and NaK alloys (Class D). Thermoplastic powder is added to the mixture, along with waterproofing (metal stearates) and anti-caking materials (tricalcium phosphate) to form the extinguishing agent. When it is applied to the fire, the salt acts like a heat sink, dissipating heat from the fire, and also forms an oxygen-excluding crust to smother the fire. The plastic additive melts and helps the crust maintain its integrity until the burning metal cools below its ignition temperature. This type of extinguisher was invented in the late 1940s as a cartridge-operated unit, although stored pressure versions are now popular. Common sizes are 30 pounds (14 kg) portable and 350 pounds (160 kg) wheeled.[citation needed]
Cleanser[edit]
Since at least medieval times, people have used salt as a cleansing agent rubbed on household surfaces. It is also used in many brands of shampoo, toothpaste and popularly to de-ice driveways and patches of ice.
Optical usage[edit]
Defect-free NaCl crystals have an optical transmittance of about 90% for infrared light, specifically between 200 nm and 20 µm. They were therefore used in optical components (windows and prisms) operating in that spectral range, where few non-absorbing alternatives exist and where requirements for absence of microscopic inhomogeneities are less strict than in the visible range. While inexpensive, NaCl crystals are soft and hygroscopic – when exposed to the ambient air, they gradually cover with «frost». This limits application of NaCl to dry environments, vacuum sealed assembly areas or for short-term uses such as prototyping. Nowadays materials like zinc selenide (ZnSe), which are stronger mechanically and are less sensitive to moisture, are used instead of NaCl for the infrared spectral range.
Chemistry[edit]
Solid sodium chloride[edit]
Sodium chloride crystal under microscope.
NaCl octahedra. The yellow stipples represent the electrostatic force between the ions of opposite charge
In solid sodium chloride, each ion is surrounded by six ions of the opposite charge as expected on electrostatic grounds. The surrounding ions are located at the vertices of a regular octahedron. In the language of close-packing, the larger chloride ions (167 pm in size[17]) are arranged in a cubic array whereas the smaller sodium ions (116 pm[17]) fill all the cubic gaps (octahedral voids) between them. This same basic structure is found in many other compounds and is commonly known as the halite or rock-salt crystal structure. It can be represented as a face-centered cubic (fcc) lattice with a two-atom basis or as two interpenetrating face centered cubic lattices. The first atom is located at each lattice point, and the second atom is located halfway between lattice points along the fcc unit cell edge.
Solid sodium chloride has a melting point of 801 °C. Thermal conductivity of sodium chloride as a function of temperature has a maximum of 2.03 W/(cm K) at 8 K (−265.15 °C; −445.27 °F) and decreases to 0.069 at 314 K (41 °C; 106 °F). It also decreases with doping.[18]
Atomic-resolution real-time video imaging allows visualization of the initial stage of crystal nucleation of sodium chloride.[19]
Aqueous solutions[edit]
| Solubility of NaCl (g NaCl / 1 kg of solvent at 25 °C (77 °F))[20] |
|
|---|---|
| Water | 360 |
| Formamide | 94 |
| Glycerin | 83 |
| Propylene glycol | 71 |
| Formic acid | 52 |
| Liquid ammonia | 30.2 |
| Methanol | 14 |
| Ethanol | 0.65 |
| Dimethylformamide | 0.4 |
| Propan-1-ol | 0.124 |
| Sulfolane | 0.05 |
| Butan-1-ol | 0.05 |
| Propan-2-ol | 0.03 |
| Pentan-1-ol | 0.018 |
| Acetonitrile | 0.003 |
| Acetone | 0.00042 |
The attraction between the Na+ and Cl− ions in the solid is so strong that only highly polar solvents like water dissolve NaCl well.
View of one slab of NaCl(H2O)2 (red = O, white = H, green = Cl, purple = Na).[21]
When dissolved in water, the sodium chloride framework disintegrates as the Na+ and Cl− ions become surrounded by polar water molecules. These solutions consist of metal aquo complex with the formula [Na(H2O)8]+, with the Na–O distance of 250 pm. The chloride ions are also strongly solvated, each being surrounded by an average of six molecules of water.[22] Solutions of sodium chloride have very different properties from pure water. The eutectic point is −21.12 °C (−6.02 °F) for 23.31% mass fraction of salt, and the boiling point of saturated salt solution is near 108.7 °C (227.7 °F).[11] From cold solutions, salt crystallises as the dihydrate NaCl·2H2O.[23]
pH of sodium chloride solutions[edit]
The pH of a sodium chloride solution remains ≈7 due to the extremely weak basicity of the Cl− ion, which is the conjugate base of the strong acid HCl. In other words, NaCl has no effect on system pH[24] in diluted solutions where the effects of ionic strength and activity coefficients are negligible.
Stoichiometric and structure variants[edit]
Common salt has a 1:1 molar ratio of sodium and chlorine. In 2013, compounds of sodium and chloride of different stoichiometries have been discovered; five new compounds were predicted (e.g., Na3Cl, Na2Cl, Na3Cl2, NaCl3, and NaCl7). The existence of some of them has been experimentally confirmed at high pressures: cubic and orthorhombic NaCl3 and two-dimensional metallic tetragonal Na3Cl. This indicates that compounds violating chemical intuition are possible, in simple systems under nonambient conditions.[25]
Occurrence[edit]
Most of the world’s salt is dissolved in the ocean[citation needed]. A lesser amount is found in the Earth’s crust as the water-soluble mineral halite (rock salt), and a tiny amount exists as suspended sea salt particles in the atmosphere[citation needed]. These particles are the dominant cloud condensation nuclei far out at sea, which allow the formation of clouds in otherwise non-polluted air.[26]
Production[edit]
Salt is currently mass-produced by evaporation of seawater or brine from brine wells and salt lakes. Mining of rock salt is also a major source. China is the world’s main supplier of salt.[10] In 2017, world production was estimated at 280 million tonnes, the top five producers (in million tonnes) being China (68.0), United States (43.0), India (26.0), Germany (13.0), and Canada (13.0).[27] Salt is also a byproduct of potassium mining.
See also[edit]
- Biosalinity
- Edible salt (table salt)
- Halite, the mineral form of sodium chloride
- Health effects of salt
- Salinity
- Salting the earth
- Salt poisoning
References[edit]
- ^ «Sodium Chloride (NaCl) Crystal». PhysicsOpenLab. Retrieved 23 August 2021.
- ^ a b c d e f Haynes, 4.89
- ^ Haynes, 4.135
- ^ Haynes, 10.241
- ^ Haynes, 4.148
- ^ Haynes, 5.8
- ^ Sodium chloride. nlm.nih.gov.
- ^ Wells, John C. (2008), Longman Pronunciation Dictionary (3rd ed.), Longman, pp. 143 and 755, ISBN 9781405881180
- ^ a b c d Westphal, Gisbert et al. (2002) «Sodium Chloride» in Ullmann’s Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim doi:10.1002/14356007.a24_317.pub4.
- ^ a b c d e f g h i j k l Kostick, Dennis S. (October 2010) «Salt» in U.S. Geological Survey, 2008 Minerals Yearbook
- ^ a b Elvers, B. et al. (ed.) (1991) Ullmann’s Encyclopedia of Industrial Chemistry, 5th ed. Vol. A24, Wiley, p. 319, ISBN 978-3-527-20124-2.
- ^ Rastogi, Nina (16 February 2010) Does road salt harm the environment? slate.com.
- ^ «Saltier waterways are creating dangerous ‘chemical cocktails’«. phys.org.
- ^ «Most Road Salt Is Making It into Lakes And Rivers». www.sciencedaily.com. University of Minnesota. 20 February 2009. Retrieved 27 September 2015.
- ^ Casey, Michael. «Turning to beet juice and beer to address road salt danger». phys.org.
- ^ «EASA Cautions on Organic Salt Deicing Fluid». MRO Network. 9 December 2016.
- ^ a b R. D. Shannon (1976). «Revised effective ionic radii and systematic studies of interatomic distances in halides and chalcogenides». Acta Crystallogr A. 32 (5): 751–767. Bibcode:1976AcCrA..32..751S. doi:10.1107/S0567739476001551.
- ^ Sirdeshmukh, Dinker B.; Sirdeshmukh, Lalitha & Subhadra, K. G. (2001). Alkali halides: a handbook of physical properties. Springer. pp. 65, 68. ISBN 978-3-540-42180-1.
- ^ Nakamuro, Takayuki; Sakakibara, Masaya; Nada, Hiroki; Harano, Koji; Nakamura, Eiichi (2021). «Capturing the Moment of Emergence of Crystal Nucleus from Disorder». Journal of the American Chemical Society. 143 (4): 1763–1767. doi:10.1021/jacs.0c12100. PMID 33475359.
- ^ Burgess, J (1978). Metal Ions in Solution. New York: Ellis Horwood. ISBN 978-0-85312-027-8.
- ^ Klewe, B; Pedersen (1974). «The crystal structure of sodium chloride dihydrate». Acta Crystallogr. B30 (10): 2363–2371. doi:10.1107/S0567740874007138.
- ^ Lincoln, S. F.; Richens, D. T. and Sykes, A. G. (2003) «Metal Aqua Ions» Comprehensive Coordination Chemistry II Volume 1, pp. 515–555. doi:10.1016/B0-08-043748-6/01055-0.
- ^ Water-NaCl phase diagram. Lide, CRC Handbook of Chemistry and Physics, 86 ed (2005-2006), CRC pages 8-71, 8-116
- ^ «Acidic, Basic, and Neutral Salts». Flinn Scientific Chem Fax. 2016. Retrieved 18 September 2018.
Neutralization of a strong acid and a strong base gives a neutral salt.
- ^ Zhang, W.; Oganov, A. R.; Goncharov, A. F.; Zhu, Q.; Boulfelfel, S. E.; Lyakhov, A. O.; Stavrou, E.; Somayazulu, M.; Prakapenka, V. B.; Konôpková, Z. (2013). «Unexpected Stable Stoichiometries of Sodium Chlorides». Science. 342 (6165): 1502–1505. arXiv:1310.7674. Bibcode:2013Sci…342.1502Z. doi:10.1126/science.1244989. PMID 24357316. S2CID 15298372.
- ^ Mason, B. J. (2006). «The role of sea-salt particles as cloud condensation nuclei over the remote oceans». Quarterly Journal of the Royal Meteorological Society. 127 (576): 2023–32. Bibcode:2001QJRMS.127.2023M. doi:10.1002/qj.49712757609. S2CID 121846285.
- ^ Salt, U.S. Geological Survey
This article incorporates public domain material from Salt (PDF). United States Geological Survey.
Cited sources[edit]
- Haynes, William M., ed. (2011). CRC Handbook of Chemistry and Physics (92nd ed.). CRC Press. ISBN 978-1439855119.
External links[edit]
Wikimedia Commons has media related to NaCl.
- Salt United States Geological Survey Statistics and Information
- «Using Salt and Sand for Winter Road Maintenance». Road Management Journal. December 1997. Archived from the original on 21 September 2016. Retrieved 13 February 2007.
- Calculators: surface tensions, and densities, molarities and molalities of aqueous NaCl (and other salts)
- JtBaker MSDS
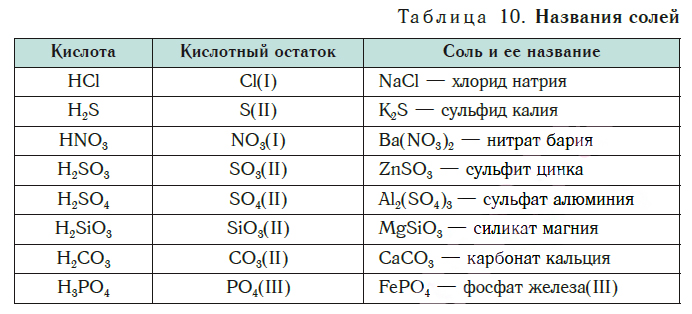
| Хлорид натрия | |
 |
|
 |
|
| Общие | |
|---|---|
| Традиционные названия | обычная соль, поваренная соль, столовая соль, пищевая соль, каменная соль, галит[1] |
| Химическая формула | NaCl |
| Физические свойства | |
| Молярная масса | 58,44277 г/моль |
| Плотность | 2,165 г/см³ |
| Термические свойства | |
| Температура плавления | 800,8 °C |
| Температура кипения | 1465 °C |
| Молярная теплоёмкость (ст. усл.) | 50,8 Дж/(моль·К) |
| Удельная теплота испарения | 170,85 кДж/моль Дж/кг |
| Удельная теплота плавления | 28,68 кДж/моль Дж/кг |
| Химические свойства | |
| pKa | 6,7–7,3 |
| Растворимость в воде | 35,6 (0 °C) 35,9 (25 °C) 39,1 (100 °C) г/100 мл |
| Растворимость в метаноле | 14,9 г/100 мл |
| Растворимость в аммиаке | 21,5 г/100 мл |
| Оптические свойства | |
| Показатель преломления | 1,5442 (589 нм) |
| Структура | |
| Координационная геометрия | Октаэдральная (Na +) Октаэдральная (Cl -) |
| Кристаллическая структура | гранецентрированная кубическая, cF8 |
| Классификация | |
| Рег. номер CAS | [7647-14-5] |
| Рег. номер PubChem | 5234 |
| Рег. номер EINECS | 231-598-3 |
| SMILES | [Na+].[Cl-] |
| RTECS | VZ4725000 |
| Безопасность | |
| ЛД50 | 3000–8000 мг/кг |
| NFPA 704 |
0 0 0 |
Хлори́д на́трия — химическое соединение NaCl, натриевая соль соляной кислоты, хлористый натрий.
Хлорид натрия известен в быту под названием поваренной соли, основным компонентом которой он является. Хлорид натрия в значительном количестве содержится в морской воде, создавая её солёный вкус. Встречается в природе в виде минерала галита (каменная соль).
Чистый хлорид натрия имеет вид бесцветных кристаллов, но с различными примесями его цвет может принимать голубой, фиолетовый, розовый, жёлтый или серый оттенок.
Содержание
- 1 Нахождение в природе и производство
- 1.1 Галит
- 1.2 Каменная соль
- 1.3 Морская соль
- 1.4 Залежи
- 1.5 Производство
- 2 Применение
- 2.1 В пищевой промышленности и кулинарии
- 2.2 В медицине
- 2.3 В коммунальном хозяйстве. Техническая соль
- 2.4 Регенерация Nа-катионитовых фильтров
- 2.5 Химическая промышленность
- 2.5.1 Получение хлора и гидроксида натрия
- 2.5.2 Получение металлического натрия
- 2.5.3 Получение соляной кислоты и сульфата натрия
- 3 Физические и физико-химические свойства
- 4 Лабораторное получение и химические свойства
- 5 Структура
- 6 См. также
- 7 Примечания
- 8 Ссылки
Нахождение в природе и производство
В природе хлорид натрия встречается в виде минерала галита, который образует залежи каменной соли среди осадочных горных пород, прослойки и линзы на берегах солёных озёр и лиманов, соляные корки в солончаках и на стенках кратеров вулканов и в сольфатарах. Огромное количество хлорида натрия растворено в морской воде. Мировой океан содержит 4 × 10 15 тонн NaCl, то есть из каждой тысячи тонн морской воды можно получить в среднем 1,3 тонны хлорида натрия. Следы NaCl постоянно содержатся в атмосфере в результате испарения брызг морской воды. В облаках на высоте полтора километра 30 % капель, больших 10 мкм по размеру, состоят из NaCl. Также он найден в кристаллах снега[2].
Наиболее вероятно, что первое знакомство человека с солью произошло в лагунах теплых морей или на соляных озёрах, где на мелководье соленая вода интенсивно испарялась под действием высокой температуры и ветра, а в осадке накапливалась соль. По образному выражению Пифагора, «соль была рождена благородными родителями: солнцем и морем»[3].
Галит
Основная статья: Галит
В природе хлорид натрия чаще всего встречается в виде минерала галита. Он имеет гранецентрированную кубическую решетку и содержит 39,34 % Na, 60,66 % Cl. Другими химическими элементами, входящими в состав примесей, являются: Br, N, H, Mn, Cu, Ga, As, I, Ag, Ba, Tl, Pb, K, Ca, S, O. Плотность 2,1—2, 2 г / см ³, а твёрдость по шкале Мооса — 2. Бесцветный, прозрачный минерал, со стеклянным блеском. Распространённый минерал соленосных толщ. Образуется при осаждении в замкнутых водоёмах, а также как продукт сгона на стенках кратеров вулканов. Составляет пласты в осадочных породах лагунных и морских фаций, штокоподобные тела в соляных куполах и т. п.[4]
Каменная соль
Каменной солью называют осадочную горную породу из группы эвапоритов, состоящую более чем на 90 % из галита. Галит также часто называют каменной солью. Эта осадочная горная порода может быть бесцветной или снежно-белой, но чаще она окрашена примесями глин, талька (серый цвет), оксидами и гидроксидами железа (желтый, оранжевый, розовый, красный), битумами (бурая). Каменная соль содержит хлориды и сульфаты натрия, калия, магния и кальция, бромиды, йодиды, бораты, гипс, примеси карбонатно-глинистого материала, доломита, анкериту, магнезита, битумов и т. д.[4]
По условиям формирования месторождений каменную соль подразделяют на следующие виды[4]:
- рассолы современных соляных бассейнов
- соляные подземные воды
- залежи минеральных солей современных соляных бассейнов
- ископаемые залежи (важнейшие для промышленности).
Морская соль
Морская соль является смесью солей (хлориды, карбонаты, сульфаты и т. д.), образующейся при полном испарении морской воды. Среднее содержание солей в морской воде составляет:
| Соединение | Масс. доля, % |
|---|---|
| NaCl | 77,8 |
| MgCl2 | 10,9 |
| MgSO4 | 4,7 |
| KCl | 2,5 |
| K2SO4 | 2,5 |
| CaCO3 | 0,3 |
| Ca(HCO3)2 | 0,3 |
| другие соли | 0,2 |
Очищенная кристаллическая морская соль
При испарении морской воды при температуре 20 — 35 ° C в осадке сначала кристаллизуются наименее растворимые соли — карбонаты кальция и магния и сульфат кальция. Затем выпадают более растворимые сульфаты натрия и магния, хлориды натрия, калия и магния, и после них — сульфаты калия и магния. Последовательность кристаллизации солей и состав осадка может несколько варьироваться в зависимости от температуры, скорости испарения и других условий. В промышленности морскую соль получают из морской воды, в основном методом обычного выпаривания. Она отличается от каменной соли значительно большим содержанием других химических солей, минералов и различных микроэлементов, в первую очередь йода, калия, магния и марганца. Соответственно, она отличается от хлорида натрия и по вкусу — горько-солёный привкус ей придают соли магния. Она используется в медицине: при лечении кожных заболеваний, таких как псориаз. Как лечебное вещество в аптечной и обычной торговой сети, распространённым продуктом является соль с Мёртвого моря. В очищенном виде этот вид соли также предлагается в продуктовой торговой сети — как натуральная и богатая йодом пищевая[5].
Залежи
Залежи каменной соли найдены во всех геологических системах. Важнейшие из них сосредоточены в кембрийских, девонских, пермских и третичных отложениях. Каменная соль составляет мощные пластовые залежи и ядра сводчатых структур (соляных куполов и штоков), образует прослойки, линзы, гнезда и вкрапления в других породах[4]. Среди озёрных месторождений России крупнейшие — Эльтонское, Баскунчак в Прикаспии, Кучукское озеро, о. Кулундинское, Эбейты и др. озера в Зап. Сибири.
Производство
В древности технология добычи соли заключалась в том, что соляную рапу вытаскивали лошадиным приводом из шахт, которые назывались «колодцами» или «окнами», и были достаточно глубокими — 60—90 м. Извлечённую соль выливали в особый резервуар — творило, откуда она через отверстия стекала в нижний резервуар, и системой желобов подавалась в деревянные башни. Там её разливали в большие чаны, на которых соль вываривали.
На Руси поморы вываривали соль на побережье Белого моря и называли её морянка. В 1137 новгородский князь Святослав определил налог на соляные варницы[6]:
[7]
Беломорской солью, называемой «морянкой», торговали по всей Российской империи до начала XX века, пока её не вытеснила более дешёвая поволжская соль.
Современная добыча хлорида натрия механизирована и автоматизирована. Соль массово добывается выпариванием морской воды (тогда её называют морской солью) или рассола с других ресурсов, таких как соляные источники и соляные озера, а также разработкой соляных шахт и добычей каменной соли. Для добычи хлорида натрия из морской воды необходимы условия жаркого климата с низкой влажностью воздуха, наличие значительных низменных территорий, лежащих ниже уровня моря, или затопляемых приливом, слабая водопроницаемость почвы испарительных бассейнов, малое количество осадков в течение сезона активного испарения, отсутствие влияния пресных речных вод и наличие развитой транспортной инфраструктуры.
Мировое производство соли в 2009 году оценивается в 260 миллионов тонн. Крупнейшими мировыми производителями являются Китай (60,0 млн тонн), США (46,0 млн тонн), Германия (16,5 млн тонн), Индия (15,8 млн тонн) и Канада (14 млн тонн)[8].
-
Добыча соли в южной части Мертвого моря, Израиль
-
Кристаллы каменной соли
-
Плантация морской соли в Дакаре
-
Соляные кучи на солончаке Уюни, Боливия
Применение
В пищевой промышленности и кулинарии
Соль поваренная
В пищевой промышленности и кулинарии используют хлорид натрия, чистота которого должна быть не менее 97 %. Его применяют как вкусовую добавку и для консервирования пищевых продуктов. Такой хлорид натрия имеет товарное название поваренная соль, порой также употребляются названия пищевая, столовая, а также уточнение названия в зависимости от её происхождения — каменная, морская, и по составу добавок — йодированная, фторированная и т. д. Такая соль является кристаллическим сыпучим продуктом с солёным вкусом без привкуса, без запаха (за исключением йодированной соли), в котором не допускаются посторонние примеси, не связанные с методом добывании соли. Кроме хлорида натрия, поваренная соль содержит небольшое количество солей кальция, магния, калия, которые придают ей гигроскопичности и жёсткости. Чем меньше этих примесей в соли, тем выше её качество.
Выделяют сорта: экстра, высший, первый и второй. Массовая доля хлористого натрия в сортах,%:
- экстра — не менее 99,5;
- высший — 98,2;
- первый — 97,5;
- второй — 97,0.
Массовая доля влаги в выварочной соли сорта «экстра» 0,1 %, в высшем сорте — 0,7 %. Допускают добавки йодида калия (йодистого калия), йодата калия, фторидов калия и натрия. Массовая доля йода должна составлять (40,0 ± 15,0) × 10 −4 %, фтора (25,0 ± 5,0) × 10 −3 %. Цвет экстра и высшего сортов — белый, однако для первого и второго допускается серый, желтоватый, розовый и голубоватый оттенки в зависимости от происхождения соли. Пищевую поваренную соль производят молотой и сеяной. По размеру зёрен молотую соль подразделяют на номера: 0, 1, 2, 3. Чем больше номер, тем больше зерна соли.
В кулинарии хлорид натрия потребляют как важнейшую приправу. Соль имеет характерный вкус, без которого пища кажется человеку пресной. Такая особенность соли обусловлена физиологией человека. Однако зачастую люди потребляют соли больше, чем нужно для физиологических процессов.
Хлорид натрия имеет слабые антисептические свойства — 10-15 % содержание соли предотвращает размножение гнилостных бактерий. Этот факт обусловливает её широкое применение как консерванта.
В медицине
Изотонический раствор хлорида натрия в воде (0,9 %) применяется как дезинтоксикационное средство, для коррекции состояния систем организма в случае обезвоживания, как растворитель других лекарственных препаратов. Гипертонические растворы (10 % р-р) используют как вспомогательный осмотический диуретик при лёгочных, желудочных и кишечных кровотечениях для обеспечения форсированного диуреза, в состояниях, характеризующихся дефицитом ионов натрия и хлора, при отравлении нитратом серебра, для обработки гнойных ран (местно). В офтальмологии как местное средство раствор хлорида натрия обладает противоотёчным действием[9].
В коммунальном хозяйстве. Техническая соль
Зимой хлорид натрия, смешанный с другими солями, песком или глиной — так называемая техническая соль — применяется как антифриз против гололеда. Ею посыпают тротуары, хотя это отрицательно влияет на кожаную обувь и техническое состояние автотранспорта в виду коррозийных процессов.
Регенерация Nа-катионитовых фильтров
Nа-катионитовые фильтры широко применяются в котельных установках всех мощностей для смягчения воды при водоподготовке. Катионитовым материалом на современных водоподготовительных установках служат в основном глауконит, сульфанованные угли и синтетические смолы. Наиболее распространены сульфоугли.
Регенерацию Nа-катионитовых фильтров осуществляют 6—8%-м раствором поваренной соли, в результате действие сульфоуголя восстанавливается. Реакции идут по уравнениям:
- CaR2 + 2NаСl = 2NаR + CaСl2.
- МgR2 + 2NаСl = 2NаR + МgСl2.
Химическая промышленность
Соль, наряду с каменным углем, известняками и серой, образует «большую четвёрку» продуктов минерального сырья, которые являются важнейшими для химической промышленности[10]. Из неё получают соду, хлор, соляную кислоту, гидроксид натрия, сульфат натрия и металлический натрий. Кроме этого соль используется также для промышленного получения легкорастворимого в воде хлората натрия, который является средством для уничтожения сорняков[11]. Суммарное уравнение реакции электролиза горячего раствора хлорида натрия[12]:
- NaCl + 3 H2O → NaClO3 + 3 H2↑
Получение хлора и гидроксида натрия
В промышленности путём электролиза раствора хлорида натрия получают хлор. Процессы, происходящие на электродах[13][14]:
- на катоде как побочный продукт выделяется водород вследствие восстановления ионов H +, образованных в результате электролитической диссоциации воды:
- H2O ⇆ H+ + OH−
- 2 H+ + 2 e− → H2↑
- поскольку (вследствие практически полной электролитической диссоциации NaCl), хлор в растворе находится в виде хлорид-ионов, они окисляются на аноде до свободного хлора в виде газа:
- NaCl → Na+ + Cl−
- 2 Cl− − 2 e− → Cl2↑
- суммарная реакция:
- 2 NaCl + 2 H2O → 2 NaOH + Cl2↑ + H2↑
Как видно из уравнения суммарной реакции, ещё одним продуктом является гидроксид натрия. Расход электроэнергии на 1 т хлора составляет примерно 2700 кВт × час. Полученный хлор сжижается на жёлтую жидкость уже при обычной температуре[15].
Если между анодом и катодом нет диафрагмы, то растворенный в воде хлор начинает реагировать с гидроксидом натрия, образуя хлорид и гипохлорит натрия NaClO[14]:
- 2 NaOH + Cl2 → NaCl + NaClO + H2O
Поэтому для получения гидроксида натрия применяют диафрагму и соответствующий метод получения NaOH называют диафрагменным. В качестве диафрагмы применяют асбестовый картон. В процессе электролиза раствор хлорида натрия постоянно подается в анодное пространство, а из катодного пространства непрерывно вытекает раствор хлорида и гидроксида натрия. Во время выпаривания последнего хлорид кристаллизуется, поскольку его растворимость в 50 % растворе NaOH ничтожно мала (0,9 %). Полученный раствор NaOH выпаривают в железных чанах, затем сухой остаток переплавляют.
Для получения чистого гидроксида натрия (без добавок хлорида натрия) применяют ртутный метод, где используют графитовый анод и ртутный катод. Вследствие того, что перенапряжение выделения водорода на ртути очень большое, на ней вновь появляются ионы натрия и образуется амальгама натрия[14][16]:
- Na+ + e− → Na(Hg)
Амальгаму позже разлагают горячей водой с образованием гидроксида натрия и водорода, а ртуть перекачивают насосом обратно в электролизер:
- 2 Na(Hg) + 2 H2O → 2 NaOH + H2↑
Суммарная реакция процесса такая же, как и в случае диафрагменного метода.
Получение металлического натрия
Металлический натрий получают электролизом расплава хлорида натрия. Происходят следующие процессы:
- на катоде выделяется натрий:
- 2 Na+ + 2 e− → 2 Na
- на аноде выделяется хлор (как побочный продукт):
- 2 Cl− − 2 e− → Cl2
- суммарная реакция:
- 2 Na+ + 2 Cl− → 2 Na + Cl2
Ванна электролизера состоит из стального кожуха с футеровкой, графитового анода и кольцевого железного катода. Между катодом и анодом располагается сетчатая диафрагма. Для снижения температуры плавления NaCl (800 ° C), электролитом является не чистый хлорид натрия, а его смесь с хлоридом кальция CaCl 2 (40:60) с температурой плавления 580 ° C. Металлический натрий, который собирается в верхней части катодного пространства, содержит до 5 % примесь кальция, но последний со временем почти полностью отделяется, поскольку его растворимость в жидком натрии при температуре его плавления (371 ° C) составляет всего 0,01 %. С расходованием NaCl его постоянно добавляют в ванну. Затраты электроэнергии составляют примерно 15 кВт × ч на 1 кг натрия[17].
Получение соляной кислоты и сульфата натрия
Среди многих промышленных методов получения соляной кислоты, то есть водного раствора хлороводорода (HCl), применяется реакция обмена между хлоридом натрия и серной кислотой:
- NaCl + H2SO4 → NaHSO4 + HCl↑
- NaCl + NaHSO4 → Na2SO4 + HCl↑
Первая реакция происходит в значительной степени уже при обычных условиях, а при слабом нагреве идет почти до конца. Вторая происходит лишь при высоких температурах. Процесс осуществляется в специальных механизированных печах большой мощности. Хлороводород, который выделяется, обеспыливают, охлаждают и поглощают водой с образованием соляной кислоты. Как побочный продукт образуется сульфат натрия Na2SO4[18][19].
Этот метод применяется также для получения хлороводорода в лабораторных условиях.
Физические и физико-химические свойства
Температура плавления 800,8 С, кипения 1465 С.
Умеренно растворяется в воде, растворимость мало зависит от температуры: коэффициент растворимости NaCl (в г на 100 г воды) равен 35,9 при 21 °C и 38,1 при 80 °C. Растворимость хлорида натрия существенно снижается в присутствии хлороводорода, гидроксида натрия, солей — хлоридов металлов. Растворяется в жидком аммиаке, вступает в реакции обмена. В чистом виде хлорид натрия не гигроскопичен. Однако соль часто бывает загрязнена примесями (преимущественно ионами Ca 2 +, Mg 2 + и SO2−4), и такая соль на воздухе сыреет[20]. Кристаллогидрат NaCl · 2H 2 O можно выделить при температуре ниже +0,15 ° C[21].
Смесь измельченного льда с мелким порошком хлорида натрия является эффективным охладителем. Так, смесь состава 30 г NaCl на 100 г льда охлаждается до температуры −20 ° C. Это происходит потому, что водный раствор соли замерзает при температуре ниже 0 ° C. Лед, имеющий температуру около 0 ° C, плавится в таком растворе, поглощая тепло окружающей среды.
| Термодинамические характеристики | |
|---|---|
| ΔfH0g | −181,42 кДж/моль |
| ΔfH0l | −385,92 кДж/моль |
| ΔfH0s | −411,12 кДж/моль |
| ΔfH0aq | −407 кДж/моль |
| S0g, 1 bar | 229,79 Дж/(моль·K) |
| S0l, 1 bar | 95,06 Дж/(моль·K) |
| S0s | 72,11 Дж/(моль·K) |
Диэлектрическая проницаемость NaCl — 6,3
Плотность и концентрация водных растворов NaCl
| Концентрация, % | Концентрация, г/л | Плотность, г/мл |
|---|---|---|
| 1 | 10,05 | 1,005 |
| 2 | 20,25 | 1,012 |
| 4 | 41,07 | 1,027 |
| 6 | 62,47 | 1,041 |
| 8 | 84,47 | 1,056 |
| 10 | 107,1 | 1,071 |
| 12 | 130,2 | 1,086 |
| 14 | 154,1 | 1,101 |
| 16 | 178,5 | 1,116 |
| 18 | 203,7 | 1,132 |
| 20 | 229,5 | 1,148 |
| 22 | 256 | 1,164 |
| 24 | 283,2 | 1,18 |
| 26 | 311,2 | 1,197 |
Лабораторное получение и химические свойства
При действии серной кислоты выделяет хлороводород. С раствором нитрата серебра образует белый осадок хлорида серебра.
Учитывая огромные природные запасы хлорида натрия, необходимости в его промышленном или лабораторном синтезе нет. Однако, его можно получить различными химическими методами как основной или побочный продукт.
- получение из простых веществ натрия и хлора является экзотермической реакцией[22]:
- Na(тв) + 1/2Cl2(г) → NaCl(тв) + 410 кДж
- нейтрализация щелочи гидроксида натрия соляной кислотой[23]:
- NaОН + НCl → NaCl + Н2О
Поскольку хлорид натрия в водном растворе почти полностью диссоциирован на ионы: NaCl → Na+ + Cl−, его химические свойства в водном растворе определяются соответствующими химическими свойствами катионов натрия и хлорид-анионов.
Структура
Кристаллическая решётка хлорида натрия.
Голубой цвет = Na+
Зелёный цвет = Cl−
Хлорид натрия образует бесцветные кристаллы кубической сингонии, пространственная группа F m3m, a = 0,563874 нм, d = 2,17 г/см³. Каждый из ионов Cl− окружен шестью ионами Na+ в октаедральний конфигурации, и наоборот. Если мысленно отбросить, например, ионы Na+, то останется плотно упакованная кубическая структура с ионов Cl−, называемая гранецентрированной кубической решеткой. Ионы Na+ тоже образуют плотно упакованную кубическую решетку. Таким образом, кристалл состоит из двух подрешеток, сдвинутых друг относительно друга на полупериод. Такая же решетка характерна для многих других минералов.
В кристаллической решетке между атомами преобладает ионная химическая связь, что является следствием действия электростатического взаимодействия противоположных по заряду ионов
См. также
- Поваренная соль — специя и пищевая добавка
- Галит — минерал
Примечания
- ↑ Натрия хлорид на сайте Национального института стандартов и технологии (англ. National Institute of Standards and Technology) (англ.)
- ↑ Б. В. Некрасов. Основы общей химии. Т. 2. Изд. 3-е, испр. и доп. Москва, издательство «Химия», 1973 г. 688 с.; 270 табл.; 426 рис.; Список литературы, ссылок. С. 218
- ↑ Пифагор. Золотой канон. Фигуры эзотерики. — М.: Изд-во Эксмо, 2003. — 448 с. (Антология мудрости).
- ↑ 1 2 3 4 Малая горная энциклопедия. В 3-х т. / Под ред. В. С. Белецкого . — Донецк: «Донбасс», 2004. — ISBN 966-7804-14-3
- ↑ УНИАН: Морская соль для красоты и здоровья кожи
- ↑ Российское законодательство Х-ХХ веков. Законодательство Древней Руси. т. 1. М, 1984. С. 224—225. (рус.)
- ↑ В переводе с поморской «говори» слово чрен (црен) означает четырёхугольный ящик, кованный из листового железа, а салга — котёл, в котором варили соль. Пузом в беломорских солеварнях называли мешок соли в два четверика, то есть, объёмом около 52 литров.
- ↑ Соль (PDF), Геологический обзор США на сайте Программы минеральных ресурсов (англ.)
- ↑ Энциклопедия здоровья
- ↑ Онлайн Энциклопедия кругосвет. Натрий
- ↑ Б. В. Некрасов. Основы общей химии. Т. 1. Изд. 3-е, испр. и доп. Москва, издательство «Химия», 1973 г. 656 с.; 160 табл.; 391 рис. С. 261
- ↑ Синтез хлората натрия (англ.)
- ↑ Б. В. Некрасов. Основы общей химии. Т. 1. Изд. 3-е, испр. и доп. Москва, издательство «Химия», 1973 г. 656 с.; 160 табл.; 391 рис. С. 249
- ↑ 1 2 3 М. Л. Глинка Общая химия (Учебник), изд. 2-е изд., Перераб. и доп .. — С. 608, Киев: «Высшая школа», 1982.
- ↑ Б. В. Некрасов. Основы общей химии. Т. 1. Изд. 3-е, испр. и доп. Москва, издательство «Химия», 1973 г. 656 с.; 160 табл.; 391 рис. С. 254
- ↑ Б. В. Некрасов. Основы общей химии. Т. 2. Изд. 3-е, испр. и доп. Москва, издательство «Химия», 1973 г. 688 с.; 270 табл.; 426 рис.; Список литературы, ссылок. С. 231
- ↑ Б. В. Некрасов. Основы общей химии. Т. 2. Изд. 3-е, испр. и доп. Москва, издательство «Химия», 1973 г. 688 с.; 270 табл.; 426 рис.; Список литературы, ссылок. С. 219
- ↑ Б. В. Некрасов. Основы общей химии. Т. 1. Изд. 3-е, испр. и доп. Москва, издательство «Химия», 1973 г. 656 с.; 160 табл.; 391 рис. С. 250
- ↑ Б. В. Некрасов. Основы общей химии. Т. 1. Изд. 3-е, испр. и доп. Москва, издательство «Химия», 1973 г. 656 с.; 160 табл.; 391 рис. С. 257—258
- ↑ Б. В. Некрасов. Основы общей химии. Т. 2. Изд. 3-е, испр. и доп. Москва, издательство «Химия», 1973 г. 688 с.; 270 табл.; 426 рис.; Список литературы, ссылок. С. 215—216
- ↑ Б. В. Некрасов. Основы общей химии. Т. 2. Изд. 3-е, испр. и доп. Москва, издательство «Химия», 1973 г. 688 с.; 270 табл.; 426 рис.; Список литературы, ссылок. С. 234
- ↑ Б. В. Некрасов. Основы общей химии. Т. 1. Изд. 3-е, испр. и доп. Москва, издательство «Химия», 1973 г. 656 с.; 160 табл.; 391 рис. С. 255
- ↑ Б. В. Некрасов. Основы общей химии. Т. 1. Изд. 3-е, испр. и доп. Москва, издательство «Химия», 1973 г. 656 с.; 160 табл.; 391 рис. С. 191
Ссылки
| Хлорид натрия на Викискладе? |
- Физико-химические свойства хлорида натрия
- Ассоциация производителей соли
- Институт соли
Шаблон:АТХ код A07
Плазмозамещающие и перфузионные растворы — АТХ код: B05
ПОВАРЕННАЯ СОЛЬ – хлорид натрия NaCl. Умеренно растворяется в воде, растворимость мало зависит от температуры: коэффициент растворимости NaCl (в г на 100 г воды) равен 35,9 при 20° С и 38,1 при 80° С. Растворимость хлорида натрия существенно снижается в присутствии хлороводорода, гидроксида натрия, солей – хлоридов металлов. Растворяется в жидком аммиаке, вступает в реакции обмена. Плотность NaCl – 2,165 г/см3, температура плавления 800,8° С, температура кипения 1465° С.
Раньше говаривали: «Соль всему голова, без соли и жито – трава»; «Один глаз на полицу (где хлеб), другой – в солоницу (солонку)», и еще: «Без хлеба не сытно, без соли не сладко»… Бурятская народная мудрость гласит: «Собираясь пить чай, клади в него щепотку соли; от нее быстрее усваивается пища, исчезнут болезни желудка».
Вряд ли мы узнаем, когда впервые наши далекие предки вкусили соль: нас отделяют от них десять-пятнадцать тысяч лет. Тогда еще не было посуды для приготовления пищи, все растительные продукты люди вымачивали в воде и подпекали на тлеющих углях, а мясо, насаженное на палки, обжаривали в пламени костра. «Поваренной солью» первобытных людей наверняка была зола, которая неизбежно попадала в пищу во время ее приготовления. Зола содержит поташ – карбонат калия K2CO3, который в местах, удаленных от морей и соленых озер, долгое время служил пищевой приправой.
Возможно, однажды, за неимением пресной воды, мясо либо корни и листья растений были замочены в соленой морской или озерной воде, и еда оказалась вкуснее обычной. Может быть, добытое впрок мясо, чтобы защитить его от хищных птиц и насекомых, люди спрятали в морскую воду, а потом обнаружили, что оно приобрело приятный вкус. Наблюдательные охотники первобытных племен могли заметить, что животные любят лизать солонцы – белые кристаллы каменной соли, выступающие кое-где из-под земли, и попробовали добавлять соль в пищу. Могли быть и другие случаи первого знакомства людей с этим удивительным веществом.
Чистая поваренная соль, или хлорид натрия NaCl – бесцветное негигроскопичное (не поглощающее влагу из воздуха) кристаллическое вещество, растворимое в воде и плавящееся при 801° С. В природе хлорид натрия встречается в виде минерала галита – каменной соли. Слово «галит» происходит от греческого «галос», означающего и «соль», и «море». Основная масса галита чаще всего находится на глубине 5 км под поверхностью земли. Однако давление слоя горных пород, расположенных над пластом соли, превращает ее в вязкую, пластичную массу. «Всплывая» в местах пониженного давления кроющих пород, пласт соли образует соляные «купола», выходящие в ряде мест наружу.
Природный галит редко бывает чисто белого цвета. Чаще он буроватый или желтоватый из-за примесей соединений железа. Встречаются, но очень редко, кристаллы галита голубого цвета. Это означает, что они долгое время в глубинах земли находились по соседству с породами, содержащими уран, и подверглись радиоактивному облучению.
В лаборатории тоже можно получить синие кристаллы хлорида натрия. Для этого не потребуется облучения; просто в плотно закрытом сосуде надо нагреть смесь поваренной соли NaCl и небольшого количества металлического натрия Na. Металл способен растворяться в соли. Когда атомы натрия проникают в кристалл, состоящий из катионов Na+ и анионов Cl–, они «достраивают» кристаллическую решетку, занимая подходящие места и превращаясь в катионы Na+. Освободившиеся электроны располагаются в тех местах кристалла, где полагалось бы находиться хлорид-анионам Cl–?. Такие необычные места внутри кристалла, занятые электронами вместо ионов, называют «вакансиями».
При охлаждении кристалла некоторые вакансии объединяются, это и служит причиной появления синей окраски. Кстати, при растворении в воде синего кристалла соли образуется бесцветный раствор – совсем как из обычной соли.
Греческий поэт Гомер (VIII в. до н.э.), написавший Илиаду и Одиссею, называл поваренную соль «божественной». В те времена она ценилась выше золота: ведь, как гласила пословица, «без золота прожить можно, а без соли — нельзя». Из-за месторождений каменной соли происходили военные столкновения, а иногда нехватка соли вызывала «соляные бунты».
На столах императоров, царей, королей и шахов стояли солонки из золота, и заведовал ими особо доверенный человек — солоничий. Воинам часто платили жалованье солью, а чиновники получали солевой паек. Как правило, соляные источники были собственностью властителей и коронованных особ. В Библии есть выражение «пьет соль от дворца царского», означающее человека, получающего содержание от царя.
Соль издавна была символом чистоты и дружбы. «Вы – соль земли» – говорил Христос своим ученикам, имея в виду их высокие нравственные качества. Соль употреблялась при жертвоприношениях, новорожденных детей у древних евреев посыпали солью, а в католических церквах при крещении в ротик младенца клали кристаллик соли.
В обычае арабов было при утверждении торжественных договоров подавать сосуд с солью, из которого в знак доказательства и гарантии постоянной дружбы лица, заключившие договор – «завет соли» – съедали по несколько ее крупинок. «Съесть вместе пуд соли» – у славян значит хорошо узнать друг друга и подружиться. По русскому обычаю, когда подносят гостям хлеб-соль, то тем самым желают им здоровья.
Поваренная соль – не только пищевой продукт, но издавна распространенный консервант, ее применяли при обработке кожевенного и мехового сырья. А в технике она до сих пор является исходным сырьем для получения практически всех соединений натрия, в том числе соды.
Поваренная соль входила и в состав самых древних лекарств, ей приписывали целебные свойства, очищающее и дезинфицирующее действие, причем с давних пор подмечено, что поваренная соль разных месторождений имеет разные биологические свойства: самая в этом отношении полезная – морская. В Лечебнике-травнике, изданном в России в 17 в., написано: «Две сути соли, одну копали из горы, а другую находили в море, а которая из моря, та лутчи, а кроме морской соли та лутчи, которая бела».
Однако в употреблении соли надо соблюдать меру. Известно, что средний европеец ежедневно поглощает с пищей до 15 г соли, в то время как средний японец – около 40 г. Как раз японцы и держат мировое первенство по числу больных гипертонией – болезнью, одна из причин которой состоит в том, что в организме задерживается больше жидкости, чем ему необходимо. Клетки разбухают от ее излишка, сжимают кровеносные сосуды, поэтому повышается кровяное давление, от чего и сердце начинает работать с перегрузкой. Трудно становится и почкам, очищающим организм от избытка катионов натрия.
Ни одно растение не может расти на почве, покрытой солью, солончаки всегда были символом земли бесплодной и необитаемой. Когда властитель Священной Римской империи Фридрих I Барбаросса разрушил в 1155 Милан в Италии, то велел посыпать руины поверженного города солью в знак его полного уничтожения… У разных народов во все времена рассыпать соль значило накликать беду и потерять здоровье.
В древности люди использовали несколько способов добычи поваренной соли: естественное испарение морской воды в «соляных садках», где выпадал хлорид натрия NaCl – «морская» соль, вываривание воды соленых озер с получением «выварочной» соли, и выламывание «каменной» соли в подземных рудниках. Все эти способы дают соль с примесями хлорида магния MgCl2·6 H2O, сульфатов калия K2SO4 и магния MgSO4·7H2O и бромида магния MgBr2·6H2O, содержание которых достигает 8–10 %.
В морской воде в среднем на 1 л приходится до 30 г различных солей, на долю поваренной соли приходится 24 г. Технология получения хлорида натрия NaCl из морской и озерной воды всегда была довольно примитивной.
Например, в конце «бронзового века» – за три, три с половиной тысячи лет до нашей эры – древние солевары обливали бревна морской водой, а потом сжигали их и из золы выбирали соль. Позднее соленые воды стали выпаривать на больших противнях, а для удаления примесей добавляли кровь животных, собирая образующуюся пену. Примерно с конца 16 в. растворы соли очищали и концентрировали, пропуская через башни, заполненные соломой и ветками кустарников. Выпаривание раствора соли на воздухе производили и совсем примитивным способом, сливая рассол по стене, сложенной из связок хвороста и соломы.
Солеварение, старейшее из химических ремесел, возникло на Руси, по-видимому, в начале 7 века. Соляные промыслы принадлежали монахам, которым благоволили русские цари, с них даже не взимался налог на продаваемую соль. Выварка соли приносила монастырям огромные прибыли. Рассолы добывали не только из озер, но и из подземных соляных источников; буровые скважины, которые для этого строили, в 15 в. достигали длины 60–70 м. В скважины опускали трубы, изготовленные из цельного дерева, а упаривали рассолы в железных противнях на дровяной топке. В 1780 в России таким способом было выварено более ста тысяч тонн соли…
В настоящее время поваренную соль добывают из отложений соляных озер и на месторожденияхкаменной соли – галита.
Поваренная соль – не только важная пищевая приправа, но и химическое сырье: из нее получают гидроксид натрия, соду, хлор.
Людмила Аликберова
Формула соли поваренной. Химическая формула: поваренная соль. Свойства поваренной соли
Поваренная соль — это хлорид натрия, используемый в качестве пищевой добавки, пищевого консерванта. Он также используется в химической промышленности и медицине. Он служит важнейшим сырьем для производства каустической соды, соляной кислоты, соды и других веществ. Формула поваренной соли — NaCl.
Содержание
- 1 Образование ионной связи между натрием и хлором
- 2 Химическая формула. Поваренная соль и галит
- 3 Физические свойства поваренной соли
- 4 Получение хлорида натрия в лаборатории
- 5 Производство поваренной соли
- 6 Химические свойства хлорида натрия
- 7 Сферы применения каменной соли
- 8 Значение хлорида натрия для организма человека
Образование ионной связи между натрием и хлором
Химический состав хлорида натрия отражает условную формулу NaCl, которая дает представление о равном количестве атомов натрия и хлора. Но это вещество состоит не из двухатомных молекул, а из кристаллов. Когда щелочной металл взаимодействует с сильным неметаллом, каждый атом натрия отдает валентный электрон более электроотрицательному хлору. Есть катионы натрия Na + и анионы кислотного остатка Cl- соляной кислоты. Частицы с маловероятным зарядом притягиваются, образуя вещество с ионной кристаллической решеткой. Небольшие катионы натрия находятся среди крупных анионов хлора. Количество положительных частиц в составе хлорида натрия равно количеству отрицательных, вещество в целом нейтрально.
Химическая формула. Поваренная соль и галит
Соли — это сложные вещества ионной структуры, названия которых начинаются с названия кислотного остатка. Формула поваренной соли — NaCl. Геологи называют минерал такого состава «галит», а осадочную породу — «каменной солью». Устаревший химический термин, который часто используется на производстве, — хлорид натрия. Это вещество было известно людям с древних времен, когда-то его считали «белым золотом». Современные школьники и студенты при чтении уравнений реакций с участием хлорида натрия называют химическими знаками («хлор натрия»).
Выполняем несложные расчеты по формуле вещества:
1) Mr (NaCl) = Ar (Na) + Ar (Cl) = 22,99 + 35,45 = 58,44.
Относительная молекулярная масса составляет 58,44 (а.е.м.).
2) Численно равняется молекулярной массе молярной массы, но это значение имеет единицы измерения г / моль: M (NaCl) = 58,44 г / моль.
3) 100-граммовая проба соли содержит 60,663 г атомов хлора и 39,337 г натрия.
Физические свойства поваренной соли
Хрупкие кристаллы каменной соли бесцветные или белые. В природе также есть месторождения каменной соли, окрашенной в серый, желтый или синий цвет. Иногда минеральное вещество имеет красный оттенок из-за типа и количества примесей. Твердость галита по шкале Мооса всего 2-2,5, стекло оставляет полосу на своей поверхности.
Другие физические параметры хлорида натрия:
- вкус соленый;
- точка плавления — 801 ° С;
- растворимость в воде — 359 г / л (25 ° C);
- плотность — 2,165 г / см3 (20 ° С);
- температура кипения — 1413 ° С;
- запах — отсутствует;
Получение хлорида натрия в лаборатории
Когда металлический натрий взаимодействует с газообразным хлором в пробирке, образуется белое вещество: хлорид натрия NaCl (формула поваренной соли).
Химия предоставляет информацию о различных способах получения одного и того же соединения. Вот некоторые примеры:
Реакция нейтрализации: NaOH (водный) + HCl = NaCl + H2O.
Окислительно-восстановительная реакция между металлом и кислотой:
2Na + 2HCl = 2NaCl + H2.
Действие кислоты на оксид металла: Na2O + 2HCl (водн.) = 2NaCl + H2O
Вытеснение слабой кислоты из раствора ее соли из более сильной:
Na2CO3 + 2HCl (водн.) = 2NaCl + H2O + CO2 (газ).
Все эти методы слишком дороги и сложны, чтобы их можно было применять в промышленных масштабах.
Производство поваренной соли
Уже на заре цивилизации было известно, что после засолки мясо и рыба хранятся дольше. В некоторых древних странах вместо денег использовались прозрачные кристаллы каменной соли правильной формы, которые на вес золота. Исследования и разработка месторождений каменной соли позволили удовлетворить растущие потребности населения и промышленности. Важнейшие природные источники поваренной соли:
- вода из морей, океанов и соленых озер;
- кристаллы каменной соли на стенках вулканических кратеров;
- физиологический раствор.
- слои и корки каменной соли на берегах соленых водоемов;
- месторождения каменной соли в нескольких странах;
В промышленности используются четыре основных метода получения поваренной соли:
- добыча в соляных шахтах;
- испарение морской воды или рассола из соленых озер (77% сухого остатка — хлорид натрия);
- использование побочного продукта опреснения соленой воды.
- выщелачивание каменной соли из подземного слоя, испарение образовавшегося рассола;
Химические свойства хлорида натрия

Сферы применения каменной соли
Хлорид натрия снижает температуру плавления льда, поэтому зимой на дорогах и тротуарах используют смесь соли и песка. Он поглощает большое количество примесей, а при таянии загрязняет реки и ручьи. Дорожная соль также ускоряет процесс коррозии кузовов автомобилей и повреждает деревья, посаженные рядом с дорогами. В химической промышленности хлорид натрия используется как сырье для большой группы химикатов:
- металлический натрий;
- газообразный хлор;
- каустическая сода и другие соединения.
- соляной кислоты;
Кроме того, поваренная соль используется в производстве мыла и красителей. В качестве пищевого антисептика используется при консервировании, мариновании грибов, рыбы и овощей. Для борьбы с заболеваниями щитовидной железы у населения формула поваренной соли обогащена добавлением безопасных соединений йода, например, KIO3, KI, NaI. Такие добавки поддерживают выработку гормона щитовидной железы и предотвращают эндемический зоб.
Значение хлорида натрия для организма человека

Поваренная соль — это хлорид натрия, применяемый в качестве добавки к пище, консерванта продуктов питания. Используется также в химической промышленности, медицине. Служит важнейшим сырьем для получения едкого натра, соляной кислоты, соды и других веществ. Формула соли поваренной — NaCl.
Образование ионной связи между натрием и хлором
Химический состав хлорида натрия отражает условная формула NaCl, которая дает представление о равном количестве атомов натрия и хлора. Но вещество образовано не двухатомными молекулами, а состоит из кристаллов. При взаимодействии щелочного металла с сильным неметаллом каждый атом натрия отдает валентный электрон более электроотрицательному хлору. Возникают катионы натрия Na+ и анионы кислотного остатка соляной кислоты Cl—. Разноименно заряженные частицы притягиваются, образуя вещество с ионной кристаллической решеткой. Маленькие катионы натрия расположены между крупными анионами хлора. Число положительных частиц в составе хлорида натрия равно количеству отрицательных, вещество в целом является нейтральным.
Химическая формула. Поваренная соль и галит
Соли — это сложные вещества ионного строения, названия которых начинаются с наименования кислотного остатка. Формула соли поваренной — NaCl. Геологи минерал такого состава называют «галит», а осадочную породу — «каменная соль». Устаревшей химический термин, который часто употребляется на производстве, — «хлористый натрий». Это вещество известно людям с глубокой древности, когда-то его считали «белым золотом». Современные ученики школ и студенты при чтении уравнений реакций с участием хлорида натрия называют химические знаки («натрий хлор»).
Проведем несложные расчеты по формуле вещества:
1) Mr (NaCl) = Ar (Na) + Ar (Cl) = 22,99 + 35,45 = 58,44.
Относительная молекулярная масса составляет 58,44 (в а.е.м.).
2) Численно равна молекулярному весу молярная масса, но эта величина имеет единицы измерения г/моль: М (NaCl) = 58,44 г/моль.
3) Образец соли массой 100 г содержит 60,663 г атомов хлора и 39,337 г натрия.
Физические свойства поваренной соли
Хрупкие кристаллы галита — бесцветные или белые. В природе также встречаются месторождения каменной соли, окрашенной в серый, желтый либо голубой цвет. Иногда минеральное вещество обладает красным оттенком, что обусловлено видами и количеством примесей. Твердость галита по шкале Мооса составляет всего 2-2,5, стекло оставляет на его поверхности черту.
Другие физические параметры хлорида натрия:
- запах — отсутствует;
- вкус — соленый;
- плотность — 2,165 г/ см3 (20 °C);
- температура плавления — 801 °C;
- точка кипения — 1413 °C;
- растворимость в воде — 359 г/л (25 °C);
Получение хлорида натрия в лаборатории
При взаимодействии металлического натрия с газообразным хлором в пробирке образуется вещество белого цвета — хлорид натрия NaCl (формула поваренной соли).
Химия дает представление о различных способах получения одного и того же соединения. Вот некоторые примеры:
Реакция нейтрализации: NaOH (водн.) + HCl = NaCl + H2O.
Окислительно-восстановительная реакция между металлом и кислотой:
2Na + 2HCl = 2NaCl + Н2.
Действие кислоты на оксид металла: Na2O + 2HCl (водн.) = 2NaCl + H2O
Вытеснение слабой кислоты из раствора ее соли более сильной:
Na2CO3 + 2HCl (водн.) = 2NaCl + H2O + CO2 (газ).
Для применения в промышленных масштабах все эти методы слишком дорогие и сложные.
Производство поваренной соли
Еще на заре цивилизации люди знали, что после засолки мясо и рыба сохраняются дольше. Прозрачные, правильной формы кристаллы галита использовались в некоторых древних странах вместо денег и были на вес золота. Поиск и разработка месторождений галита позволили удовлетворить растущие потребности населения и промышленности. Важнейшие природные источники поваренной соли:
- залежи минерала галита в разных странах;
- вода морей, океанов и соленых озер;
- прослойки и корки каменной соли на берегах соленых водоемов;
- кристаллы галита на стенках вулканических кратеров;
- солончаки.
В промышленности используются четыре основных способа получения поваренной соли:
- выщелачивание галита из подземного слоя, испарение полученного рассола;
- добыча в соляных шахтах;
- выпаривание морской воды или рассола соленых озер (77% от массы сухого остатка приходится на хлорид натрия);
- использование побочного продукта опреснения соленых вод.
Химические свойства хлорида натрия
По своему составу NaCl — это средняя соль, образованная щелочью и растворимой кислотой. Хлорид натрия — сильный электролит. Притяжение между ионами настолько велико, что его могут разрушить только сильно полярные растворители. В воде ионная кристаллическая решетка вещества распадается, освобождаются катионы и анионы (Na+, Cl—). Их присутствием обусловлена электропроводность, которой обладает раствор поваренной соли. Формула в этом случае записывается так же, как для сухого вещества — NaCl. Одна из качественных реакций на катион натрия — окрашивание в желтый цвет пламени горелки. Для получения результата опыта нужно набрать на чистую проволочную петлю немного твердой соли и внести в среднюю часть пламени. Свойства поваренной соли также связаны с особенностью аниона, которая заключается в качественной реакции на хлорид-ион. При взаимодействии с нитратом серебра в растворе выпадает белый осадок хлорида серебра (фото). Хлороводород вытесняется из соли более сильными кислотами, чем соляная: 2NaCl + H2SO4 = Na2SO4 + 2HCl. При обычных условиях хлорид натрия не подвергается гидролизу.
Сферы применения каменной соли
Хлорид натрия снижает температуру плавления льда, поэтому зимой на дорогах и тротуарах используется смесь соли с песком. Она впитывает в себя большое количество примесей, при таянии загрязняет реки и ручьи. Дорожная соль также ускоряет процесс коррозии автомобильных кузовов, повреждает деревья, посаженные рядом с дорогами. В химической промышленности хлорид натрия используется как сырье для получения большой группы химических веществ:
- соляной кислоты;
- металлического натрия;
- газообразного хлора;
- каустической соды и других соединений.
Кроме того, поваренная соль применяется в производстве мыла, красителей. Как пищевой антисептик используется при консервировании, засолке грибов, рыбы и овощей. Для борьбы с нарушениями работы щитовидной железы у населения формула соли поваренной обогащается за счет добавления безопасных соединений йода, например, KIO3, KI, NaI. Такие добавки поддерживают выработку гормона щитовидной железы, предотвращают заболевание эндемическим зобом.
Значение хлорида натрия для организма человека
Формула соли поваренной, ее состав приобрел жизненно важное значение для здоровья человека. Ионы натрия участвуют в передаче нервных импульсов. Анионы хлора необходимы для выработки соляной кислоты в желудке. Но слишком большое содержание поваренной соли в пище может приводить к высокому кровяному давлению и повышению риска развития заболеваний сердца и сосудов. В медицине при большой кровопотере пациентам вводят физиологический солевой раствор. Для его получения в одном литре дистиллированной воды растворяют 9 г хлорида натрия. Человеческий организм нуждается в непрерывном поступлении этого вещества с пищей. Выводится соль через органы выделения и кожу. Среднее содержание хлорида натрия в теле человека составляет примерно 200 г. Европейцы потребляют в день около 2-6 г поваренной соли, в жарких странах эта цифра выше в связи с более высоким потоотделением.
В уроке 25 «Соли» из курса «Химия для чайников» узнаем, как правильно называть соли, их состав и научимся составлять химические формулы солей.
Как отмечалось в предыдущем уроке, в реакциях кислот с металлами выделяется простое вещество водород Н2. Кроме водорода, образуются и сложные вещества: ZnCl2, MgSO4 и др. Это представители класса широко распространенных в химии соединений — солей (рис. 102).
Здесь же мы рассмотрим состав солей, научимся составлять их формулы, узнаем, как называть соли.
Cостав солей
Сравним формулы кислот HCl и H2SO4 c формулами солей ZnCl2 и FeSO4. Мы видим, что в этих формулах одинаковые кислотные остатки Cl(I) и SO4(II). Но в молекулах кислот они соединены с атомами водорода Н, а в формульных единицах солей — с атомами цинка Zn и железа Fe. Значит, эти и другие соли можно рассматривать как продукты замещения атомов водорода в молекулах кислот на атомы металлов. Вещества, подобные ZnCl2 и FeSO4, относят к классу солей.
Соли — это сложные вещества, состоящие из атомов металлов и кислотных остатков.
В солях кислотные остатки соединяются с атомами металлов в соответствии с их валентностью. Для составления химической формулы соли необходимо знать валентность атома металла и валентность кислотного остатка. При этом пользуются тем же правилом, что и при составлении формул бинарных соединений. Для солей это правило следующее: сумма единиц валентности всех атомов металла должна быть равна сумме единиц валентности всех кислотных остатков.
Для примера составим формулу соли, в которую входят атомы кальция и кислотный остаток фосфорной кислоты PO4(III). Кальций проявляет постоянную валентность II, а валентность кислотного остатка PO4 равна III.
Названия солей
Соли образованы атомами разных металлов и различными кислотными остатками. Поэтому состав солей самый разнообразный. Давайте научимся давать им правильные названия.
Название соли состоит из названия кислотного остатка и названия металла в родительном падеже. Например, соль состава NaCl называют «хлорид натрия».
Если входящий в формульную единицу соли атом металла имеет переменную валентность, то она указывается римской цифрой в круглых скобках после его названия. Так, соль FeCl3 называют «хлорид железа(III)», а cоль FeCl2 — «хлорид железа(II)».
В таблице 10 приведены названия некоторых солей.
Соли — это вещества немолекулярного строения. Поэтому их состав выражают с помощью формульных единиц. В них отражено соотношение атомов металлов и кислотных остатков. Например, в формульной единице NaCl на один атом Na приходится один кислотный остаток Cl.
По химической формуле соли можно вычислить ее относительную формульную массу Mr, а также молярную массу M, например:
К солям относится не только поваренная соль (NaCl), но и мел, мрамор (СаСО3), сода (Na2CO3), марганцовка (KMnO4) и др.
Краткие выводы урока:
- Соли — сложные вещества, которые состоят из атомов металлов и кислотных остатков.
- Соли образуются при замещении атомов водорода в молекулах кислот на атомы металлов.
- Соли — вещества немолекулярного строения.
Надеюсь урок 25 «Соли» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.


![{displaystyle {ce {2 NaCl + 2 H2O ->[electrolysis] Cl2 + H2 + 2 NaOH}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6175336b0ecf3b2032d6a60ac2a534b10e6f61f3)