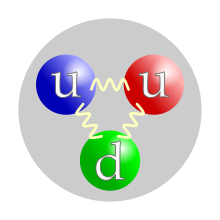
The quark content of a proton. The color assignment of individual quarks is arbitrary, but all three colors must be present. Forces between quarks are mediated by gluons. |
|
| Classification | Baryon |
|---|---|
| Composition | 2 up quarks (u), 1 down quark (d) |
| Statistics | Fermionic |
| Family | Hadron |
| Interactions | Gravity, electromagnetic, weak, strong |
| Symbol | p , p+ , N+ , 1 1H+ |
| Antiparticle | Antiproton |
| Theorized | William Prout (1815) |
| Discovered | Observed as H+ by Eugen Goldstein (1886). Identified in other nuclei (and named) by Ernest Rutherford (1917–1920). |
| Mass | 1.67262192369(51)×10−27 kg[1] 1.007276466621(53) Da[2] 938.27208816(29) MeV/c2[3] |
| Mean lifetime | > 3.6×1029 years[4] (stable) |
| Electric charge | +1 e |
| Charge radius | 0.8414(19) fm[5] |
| Electric dipole moment | < 2.1×10−25 e⋅cm[6] |
| Electric polarizability | 0.00112(4) fm3 |
| Magnetic moment | 1.41060679736(60)×10−26 J⋅T−1[7] 1.52103220230(46)×10−3 μB[5] 2.79284734463(82) μN[8] |
| Magnetic polarizability | 1.9(5)×10−4 fm3 |
| Spin | 1/2 |
| Isospin | 1/2 |
| Parity | +1 |
| Condensed | I(JP) = 1/2(1/2+) |
A proton is a stable subatomic particle, symbol
p
, H+, or 1H+ with a positive electric charge of +1 e elementary charge. Its mass is slightly less than that of a neutron and 1,836 times the mass of an electron (the proton–electron mass ratio). Protons and neutrons, each with masses of approximately one atomic mass unit, are jointly referred to as «nucleons» (particles present in atomic nuclei).
One or more protons are present in the nucleus of every atom. They provide the attractive electrostatic central force which binds the atomic electrons. The number of protons in the nucleus is the defining property of an element, and is referred to as the atomic number (represented by the symbol Z). Since each element has a unique number of protons, each element has its own unique atomic number, which determines the number of atomic electrons and consequently the chemical characteristics of the element.
The word proton is Greek for «first», and this name was given to the hydrogen nucleus by Ernest Rutherford in 1920. In previous years, Rutherford had discovered that the hydrogen nucleus (known to be the lightest nucleus) could be extracted from the nuclei of nitrogen by atomic collisions.[9] Protons were therefore a candidate to be a fundamental or elementary particle, and hence a building block of nitrogen and all other heavier atomic nuclei.
Although protons were originally considered elementary particles, in the modern Standard Model of particle physics, protons are now known to be composite particles, containing three valence quarks, and together with neutrons are now classified as hadrons. Protons are composed of two up quarks of charge +2/3e and one down quark of charge −1/3e. The rest masses of quarks contribute only about 1% of a proton’s mass.[10] The remainder of a proton’s mass is due to quantum chromodynamics binding energy, which includes the kinetic energy of the quarks and the energy of the gluon fields that bind the quarks together. Because protons are not fundamental particles, they possess a measurable size; the root mean square charge radius of a proton is about 0.84–0.87 fm (or 0.84×10−15 to 0.87×10−15 m).[11][12] In 2019, two different studies, using different techniques, found this radius to be 0.833 fm, with an uncertainty of ±0.010 fm.[13][14]
Free protons occur occasionally on Earth: thunderstorms can produce protons with energies of up to several tens of MeV.[15][16] At sufficiently low temperatures and kinetic energies, free protons will bind to electrons. However, the character of such bound protons does not change, and they remain protons. A fast proton moving through matter will slow by interactions with electrons and nuclei, until it is captured by the electron cloud of an atom. The result is a protonated atom, which is a chemical compound of hydrogen. In a vacuum, when free electrons are present, a sufficiently slow proton may pick up a single free electron, becoming a neutral hydrogen atom, which is chemically a free radical. Such «free hydrogen atoms» tend to react chemically with many other types of atoms at sufficiently low energies. When free hydrogen atoms react with each other, they form neutral hydrogen molecules (H2), which are the most common molecular component of molecular clouds in interstellar space.
Free protons are routinely used for accelerators for proton therapy or various particle physics experiments, with the most powerful example being the Large Hadron Collider.
Description[edit]
Unsolved problem in physics:
How do the quarks and gluons carry the spin of protons?
Protons are spin-1/2 fermions and are composed of three valence quarks,[17] making them baryons (a sub-type of hadrons). The two up quarks and one down quark of a proton are held together by the strong force, mediated by gluons.[18]: 21–22 A modern perspective has a proton composed of the valence quarks (up, up, down), the gluons, and transitory pairs of sea quarks. Protons have a positive charge distribution which decays approximately exponentially, with a root mean square charge radius of about 0.8 fm.[19]
Protons and neutrons are both nucleons, which may be bound together by the nuclear force to form atomic nuclei. The nucleus of the most common isotope of the hydrogen atom (with the chemical symbol «H») is a lone proton. The nuclei of the heavy hydrogen isotopes deuterium and tritium contain one proton bound to one and two neutrons, respectively. All other types of atomic nuclei are composed of two or more protons and various numbers of neutrons.
History[edit]
The concept of a hydrogen-like particle as a constituent of other atoms was developed over a long period. As early as 1815, William Prout proposed that all atoms are composed of hydrogen atoms (which he called «protyles»), based on a simplistic interpretation of early values of atomic weights (see Prout’s hypothesis), which was disproved when more accurate values were measured.[20]: 39–42
In 1886, Eugen Goldstein discovered canal rays (also known as anode rays) and showed that they were positively charged particles (ions) produced from gases. However, since particles from different gases had different values of charge-to-mass ratio (e/m), they could not be identified with a single particle, unlike the negative electrons discovered by J. J. Thomson. Wilhelm Wien in 1898 identified the hydrogen ion as the particle with the highest charge-to-mass ratio in ionized gases.[21]
Following the discovery of the atomic nucleus by Ernest Rutherford in 1911, Antonius van den Broek proposed that the place of each element in the periodic table (its atomic number) is equal to its nuclear charge. This was confirmed experimentally by Henry Moseley in 1913 using X-ray spectra.
In 1917 (in experiments reported in 1919 and 1925), Rutherford proved that the hydrogen nucleus is present in other nuclei, a result usually described as the discovery of protons.[22] These experiments began after Rutherford had noticed that, when alpha particles were shot into air (mostly nitrogen), his scintillation detectors showed the signatures of typical hydrogen nuclei as a product. After experimentation Rutherford traced the reaction to the nitrogen in air and found that when alpha particles were introduced into pure nitrogen gas, the effect was larger. In 1919 Rutherford assumed that the alpha particle merely knocked a proton out of nitrogen, turning it into carbon. After observing Blackett’s cloud chamber images in 1925, Rutherford realized that the alpha particle was absorbed. After capture of the alpha particle, a hydrogen nucleus is ejected, so that heavy oxygen, not carbon, is the result – i.e., the atomic number Z of the nucleus is increased rather than reduced. This was the first reported nuclear reaction, 14N + α → 17O + p. Rutherford at first thought of our modern «p» in this equation as a hydrogen ion, H+.
Depending on one’s perspective, either 1919 (when it was seen experimentally as derived from another source than hydrogen) or 1920 (when it was recognized and proposed as an elementary particle) may be regarded as the moment when the proton was ‘discovered’.
Rutherford knew hydrogen to be the simplest and lightest element and was influenced by Prout’s hypothesis that hydrogen was the building block of all elements. Discovery that the hydrogen nucleus is present in other nuclei as an elementary particle led Rutherford to give the hydrogen nucleus H+ a special name as a particle, since he suspected that hydrogen, the lightest element, contained only one of these particles. He named this new fundamental building block of the nucleus the proton, after the neuter singular of the Greek word for «first», πρῶτον. However, Rutherford also had in mind the word protyle as used by Prout. Rutherford spoke at the British Association for the Advancement of Science at its Cardiff meeting beginning 24 August 1920.[23] At the meeting, he was asked by Oliver Lodge for a new name for the positive hydrogen nucleus to avoid confusion with the neutral hydrogen atom. He initially suggested both proton and prouton (after Prout).[24] Rutherford later reported that the meeting had accepted his suggestion that the hydrogen nucleus be named the «proton», following Prout’s word «protyle».[25] The first use of the word «proton» in the scientific literature appeared in 1920.[26][27]
Stability[edit]
Unsolved problem in physics:
Are protons fundamentally stable? Or do they decay with a finite lifetime as predicted by some extensions to the standard model?
The free proton (a proton not bound to nucleons or electrons) is a stable particle that has not been observed to break down spontaneously to other particles. Free protons are found naturally in a number of situations in which energies or temperatures are high enough to separate them from electrons, for which they have some affinity. Free protons exist in plasmas in which temperatures are too high to allow them to combine with electrons. Free protons of high energy and velocity make up 90% of cosmic rays, which propagate in vacuum for interstellar distances. Free protons are emitted directly from atomic nuclei in some rare types of radioactive decay. Protons also result (along with electrons and antineutrinos) from the radioactive decay of free neutrons, which are unstable.
The spontaneous decay of free protons has never been observed, and protons are therefore considered stable particles according to the Standard Model. However, some grand unified theories (GUTs) of particle physics predict that proton decay should take place with lifetimes between 1031 to 1036 years and experimental searches have established lower bounds on the mean lifetime of a proton for various assumed decay products.[28][29][30]
Experiments at the Super-Kamiokande detector in Japan gave lower limits for proton mean lifetime of 6.6×1033 years for decay to an antimuon and a neutral pion, and 8.2×1033 years for decay to a positron and a neutral pion.[31]
Another experiment at the Sudbury Neutrino Observatory in Canada searched for gamma rays resulting from residual nuclei resulting from the decay of a proton from oxygen-16. This experiment was designed to detect decay to any product, and established a lower limit to a proton lifetime of 2.1×1029 years.[32]
However, protons are known to transform into neutrons through the process of electron capture (also called inverse beta decay). For free protons, this process does not occur spontaneously but only when energy is supplied. The equation is:
p+
+
e−
→
n
+
ν
e
The process is reversible; neutrons can convert back to protons through beta decay, a common form of radioactive decay. In fact, a free neutron decays this way, with a mean lifetime of about 15 minutes. A proton can also transform into neutrons through beta plus decay (β+ decay).
According to quantum field theory, the mean proper lifetime of protons 



p+
→
n
+
e+
+
ν
e. This was a matter of concern in the later 1990s because 
p+
+
e−
→
n
+
ν
, (ii)
p+
+
ν
→
n
+
e+
and (iii)
p+
+
e−
+
ν
→
n
. Adding the contributions of each of these processes, one should obtain 
Quarks and the mass of a proton[edit]
In quantum chromodynamics, the modern theory of the nuclear force, most of the mass of protons and neutrons is explained by special relativity. The mass of a proton is about 80–100 times greater than the sum of the rest masses of its three valence quarks, while the gluons have zero rest mass. The extra energy of the quarks and gluons in a proton, as compared to the rest energy of the quarks alone in the QCD vacuum, accounts for almost 99% of the proton’s mass. The rest mass of a proton is, thus, the invariant mass of the system of moving quarks and gluons that make up the particle, and, in such systems, even the energy of massless particles confined to a system is still measured as part of the rest mass of the system.
Two terms are used in referring to the mass of the quarks that make up protons: current quark mass refers to the mass of a quark by itself, while constituent quark mass refers to the current quark mass plus the mass of the gluon particle field surrounding the quark.[37]: 285–286 [38]: 150–151 These masses typically have very different values. The kinetic energy of the quarks that is a consequence of confinement is a contribution (see Mass in special relativity). Using lattice QCD calculations, the contributions to the mass of the proton are the quark condensate (~9%, comprising the up and down quarks and a sea of virtual strange quarks), the quark kinetic energy (~32%), the gluon kinetic energy (~37%), and the anomalous gluonic contribution (~23%, comprising contributions from condensates of all quark flavors).[39]
The constituent quark model wavefunction for the proton is
The internal dynamics of protons are complicated, because they are determined by the quarks’ exchanging gluons, and interacting with various vacuum condensates. Lattice QCD provides a way of calculating the mass of a proton directly from the theory to any accuracy, in principle. The most recent calculations[40][41] claim that the mass is determined to better than 4% accuracy, even to 1% accuracy (see Figure S5 in Dürr et al.[41]). These claims are still controversial, because the calculations cannot yet be done with quarks as light as they are in the real world. This means that the predictions are found by a process of extrapolation, which can introduce systematic errors.[42] It is hard to tell whether these errors are controlled properly, because the quantities that are compared to experiment are the masses of the hadrons, which are known in advance.
These recent calculations are performed by massive supercomputers, and, as noted by Boffi and Pasquini: «a detailed description of the nucleon structure is still missing because … long-distance behavior requires a nonperturbative and/or numerical treatment …»[43]
More conceptual approaches to the structure of protons are: the topological soliton approach originally due to Tony Skyrme and the more accurate AdS/QCD approach that extends it to include a string theory of gluons,[44] various QCD-inspired models like the bag model and the constituent quark model, which were popular in the 1980s, and the SVZ sum rules, which allow for rough approximate mass calculations.[45] These methods do not have the same accuracy as the more brute-force lattice QCD methods, at least not yet.
Charge radius[edit]
The problem of defining a radius for an atomic nucleus (proton) is similar to the problem of atomic radius, in that neither atoms nor their nuclei have definite boundaries. However, the nucleus can be modeled as a sphere of positive charge for the interpretation of electron scattering experiments: because there is no definite boundary to the nucleus, the electrons «see» a range of cross-sections, for which a mean can be taken. The qualification of «rms» (for «root mean square») arises because it is the nuclear cross-section, proportional to the square of the radius, which is determining for electron scattering.[dubious – discuss]
The internationally accepted value of a proton’s charge radius is 0.8768 fm. This value is based on measurements involving a proton and an electron (namely, electron scattering measurements and complex calculation involving scattering cross section based on Rosenbluth equation for momentum-transfer cross section), and studies of the atomic energy levels of hydrogen and deuterium.
However, in 2010 an international research team published a proton charge radius measurement via the Lamb shift in muonic hydrogen (an exotic atom made of a proton and a negatively charged muon). As a muon is 200 times heavier than an electron, its de Broglie wavelength is correspondingly shorter. This smaller atomic orbital is much more sensitive to the proton’s charge radius, so allows more precise measurement. Their measurement of the root-mean-square charge radius of a proton is «0.84184(67) fm, which differs by 5.0 standard deviations from the CODATA value of 0.8768(69) fm«.[46] In January 2013, an updated value for the charge radius of a proton—0.84087(39) fm—was published. The precision was improved by 1.7 times, increasing the significance of the discrepancy to 7σ.[12]
The 2014 CODATA adjustment slightly reduced the recommended value for the proton radius (computed using electron measurements only) to 0.8751(61) fm, but this leaves the discrepancy at 5.6σ.
If no errors were found in the measurements or calculations, it would have been necessary to re-examine the world’s most precise and best-tested fundamental theory: quantum electrodynamics.[47] The proton radius was a puzzle as of 2017.[48][49]
A resolution came in 2019, when two different studies, using different techniques involving the Lamb shift of the electron in hydrogen, and electron–proton scattering, found the radius of the proton to be 0.833 fm, with an uncertainty of ±0.010 fm, and 0.831 fm.[13][14]
The radius of the proton is linked to the form factor and momentum-transfer cross section. The atomic form factor G modifies the cross section corresponding to point-like proton.
The atomic form factor is related to the wave function density of the target:
The form factor can be split in electric and magnetic form factors. These can be further written as linear combinations of Dirac and Pauli form factors.[49]
Pressure inside the proton[edit]
Since the proton is composed of quarks confined by gluons, an equivalent pressure which acts on the quarks can be defined. This allows calculation of their distribution as a function of distance from the centre using Compton scattering of high-energy electrons (DVCS, for deeply virtual Compton scattering). The pressure is maximum at the centre, about 1035 Pa, which is greater than the pressure inside a neutron star.[50] It is positive (repulsive) to a radial distance of about 0.6 fm, negative (attractive) at greater distances, and very weak beyond about 2 fm.
Charge radius in solvated proton, hydronium[edit]
The radius of the hydrated proton appears in the Born equation for calculating the hydration enthalpy of hydronium.
Interaction of free protons with ordinary matter[edit]
Although protons have affinity for oppositely charged electrons, this is a relatively low-energy interaction and so free protons must lose sufficient velocity (and kinetic energy) in order to become closely associated and bound to electrons. High energy protons, in traversing ordinary matter, lose energy by collisions with atomic nuclei, and by ionization of atoms (removing electrons) until they are slowed sufficiently to be captured by the electron cloud in a normal atom.
However, in such an association with an electron, the character of the bound proton is not changed, and it remains a proton. The attraction of low-energy free protons to any electrons present in normal matter (such as the electrons in normal atoms) causes free protons to stop and to form a new chemical bond with an atom. Such a bond happens at any sufficiently «cold» temperature (that is, comparable to temperatures at the surface of the Sun) and with any type of atom. Thus, in interaction with any type of normal (non-plasma) matter, low-velocity free protons do not remain free but are attracted to electrons in any atom or molecule with which they come into contact, causing the proton and molecule to combine. Such molecules are then said to be «protonated», and chemically they are simply compounds of hydrogen, often positively charged. Often, as a result, they become so-called Brønsted acids. For example, a proton captured by a water molecule in water becomes hydronium, the aqueous cation H3O+.
Proton in chemistry[edit]
Atomic number[edit]
In chemistry, the number of protons in the nucleus of an atom is known as the atomic number, which determines the chemical element to which the atom belongs. For example, the atomic number of chlorine is 17; this means that each chlorine atom has 17 protons and that all atoms with 17 protons are chlorine atoms. The chemical properties of each atom are determined by the number of (negatively charged) electrons, which for neutral atoms is equal to the number of (positive) protons so that the total charge is zero. For example, a neutral chlorine atom has 17 protons and 17 electrons, whereas a Cl− anion has 17 protons and 18 electrons for a total charge of −1.
All atoms of a given element are not necessarily identical, however. The number of neutrons may vary to form different isotopes, and energy levels may differ, resulting in different nuclear isomers. For example, there are two stable isotopes of chlorine: 35
17Cl
with 35 − 17 = 18 neutrons and 37
17Cl
with 37 − 17 = 20 neutrons.
Hydrogen ion[edit]
Protium, the most common isotope of hydrogen, consists of one proton and one electron (it has no neutrons). The term «hydrogen ion» (H+
) implies that that H-atom has lost its one electron, causing only a proton to remain. Thus, in chemistry, the terms «proton» and «hydrogen ion» (for the protium isotope) are used synonymously
The proton is a unique chemical species, being a bare nucleus. As a consequence it has no independent existence in the condensed state and is invariably found bound by a pair of electrons to another atom.
Ross Stewart, The Proton: Application to Organic Chemistry (1985, p. 1)
In chemistry, the term proton refers to the hydrogen ion, H+
. Since the atomic number of hydrogen is 1, a hydrogen ion has no electrons and corresponds to a bare nucleus, consisting of a proton (and 0 neutrons for the most abundant isotope protium 1
1H
). The proton is a «bare charge» with only about 1/64,000 of the radius of a hydrogen atom, and so is extremely reactive chemically. The free proton, thus, has an extremely short lifetime in chemical systems such as liquids and it reacts immediately with the electron cloud of any available molecule. In aqueous solution, it forms the hydronium ion, H3O+, which in turn is further solvated by water molecules in clusters such as [H5O2]+ and [H9O4]+.[51]
The transfer of H+
in an acid–base reaction is usually referred to as «proton transfer». The acid is referred to as a proton donor and the base as a proton acceptor. Likewise, biochemical terms such as proton pump and proton channel refer to the movement of hydrated H+
ions.
The ion produced by removing the electron from a deuterium atom is known as a deuteron, not a proton. Likewise, removing an electron from a tritium atom produces a triton.
Proton nuclear magnetic resonance (NMR)[edit]
Also in chemistry, the term «proton NMR» refers to the observation of hydrogen-1 nuclei in (mostly organic) molecules by nuclear magnetic resonance. This method uses the quantized spin magnetic moment of the proton, which is due to its angular momentum (or spin), which in turn has a magnitude of one-half the reduced Planck constant. (
Human exposure[edit]
The Apollo Lunar Surface Experiments Packages (ALSEP) determined that more than 95% of the particles in the solar wind are electrons and protons, in approximately equal numbers.[52][53]
Because the Solar Wind Spectrometer made continuous measurements, it was possible to measure how the Earth’s magnetic field affects arriving solar wind particles. For about two-thirds of each orbit, the Moon is outside of the Earth’s magnetic field. At these times, a typical proton density was 10 to 20 per cubic centimeter, with most protons having velocities between 400 and 650 kilometers per second. For about five days of each month, the Moon is inside the Earth’s geomagnetic tail, and typically no solar wind particles were detectable. For the remainder of each lunar orbit, the Moon is in a transitional region known as the magnetosheath, where the Earth’s magnetic field affects the solar wind, but does not completely exclude it. In this region, the particle flux is reduced, with typical proton velocities of 250 to 450 kilometers per second. During the lunar night, the spectrometer was shielded from the solar wind by the Moon and no solar wind particles were measured.[52]
Protons also have extrasolar origin from galactic cosmic rays, where they make up about 90% of the total particle flux. These protons often have higher energy than solar wind protons, and their intensity is far more uniform and less variable than protons coming from the Sun, the production of which is heavily affected by solar proton events such as coronal mass ejections.
Research has been performed on the dose-rate effects of protons, as typically found in space travel, on human health.[53][54] To be more specific, there are hopes to identify what specific chromosomes are damaged, and to define the damage, during cancer development from proton exposure.[53] Another study looks into determining «the effects of exposure to proton irradiation on neurochemical and behavioral endpoints, including dopaminergic functioning, amphetamine-induced conditioned taste aversion learning, and spatial learning and memory as measured by the Morris water maze.[54] Electrical charging of a spacecraft due to interplanetary proton bombardment has also been proposed for study.[55] There are many more studies that pertain to space travel, including galactic cosmic rays and their possible health effects, and solar proton event exposure.
The American Biostack and Soviet Biorack space travel experiments have demonstrated the severity of molecular damage induced by heavy ions on microorganisms including Artemia cysts.[56]
Antiproton[edit]
CPT-symmetry puts strong constraints on the relative properties of particles and antiparticles and, therefore, is open to stringent tests. For example, the charges of a proton and antiproton must sum to exactly zero. This equality has been tested to one part in 108. The equality of their masses has also been tested to better than one part in 108. By holding antiprotons in a Penning trap, the equality of the charge-to-mass ratio of protons and antiprotons has been tested to one part in 6×109.[57] The magnetic moment of antiprotons has been measured with error of 8×10−3 nuclear Bohr magnetons, and is found to be equal and opposite to that of a proton.[58]
See also[edit]
- Fermion field
- Hydrogen
- Hydron (chemistry)
- List of particles
- Proton–proton chain
- Quark model
- Proton spin crisis
- Proton therapy
References[edit]
- ^ «2018 CODATA Value: proton mass». The NIST Reference on Constants, Units, and Uncertainty. NIST. 20 May 2019. Retrieved 2019-05-20.
- ^ «2018 CODATA Value: proton mass in u». The NIST Reference on Constants, Units, and Uncertainty. NIST. 20 May 2019. Retrieved 2022-09-11.
- ^ «2018 CODATA Value: proton mass energy equivalent in MeV». The NIST Reference on Constants, Units, and Uncertainty. NIST. 20 May 2019. Retrieved 2022-09-11.
- ^ The SNO+ Collaboration; Anderson, M.; Andringa, S.; Arushanova, E.; Asahi, S.; Askins, M.; Auty, D. J.; Back, A. R.; Barnard, Z.; Barros, N.; Bartlett, D. (2019-02-20). «Search for invisible modes of nucleon decay in water with the SNO+ detector». Physical Review D. 99 (3): 032008. arXiv:1812.05552. Bibcode:2019PhRvD..99c2008A. doi:10.1103/PhysRevD.99.032008. S2CID 96457175.
- ^ a b ««2018 CODATA recommended values»«.
- ^ Sahoo, B. K. (2017-01-17). «Improved limits on the hadronic and semihadronic $CP$ violating parameters and role of a dark force carrier in the electric dipole moment of $^{199}mathrm{Hg}$». Physical Review D. 95 (1): 013002. arXiv:1612.09371. doi:10.1103/PhysRevD.95.013002. S2CID 119344894.
- ^ «2018 CODATA Value: proton magnetic moment». The NIST Reference on Constants, Units, and Uncertainty. NIST. 20 May 2019. Retrieved 2022-09-17.
- ^ «2018 CODATA Value: proton magnetic moment to nuclear magneton ratio». The NIST Reference on Constants, Units, and Uncertainty. NIST. 20 May 2019. Retrieved 2022-09-17.
- ^ «proton | Definition, Mass, Charge, & Facts». Encyclopedia Britannica. Retrieved 2018-10-20.
- ^ Cho, Adrian (2 April 2010). «Mass of the Common Quark Finally Nailed Down». Science Magazine. American Association for the Advancement of Science. Retrieved 27 September 2014.
- ^ «Proton size puzzle reinforced!». Paul Shearer Institute. 25 January 2013.
- ^ a b Antognini, Aldo; et al. (25 January 2013). «Proton Structure from the Measurement of 2S-2P Transition Frequencies of Muonic Hydrogen» (PDF). Science. 339 (6118): 417–420. Bibcode:2013Sci…339..417A. doi:10.1126/science.1230016. hdl:10316/79993. PMID 23349284. S2CID 346658.
- ^ a b Bezginov, N.; Valdez, T.; Horbatsch, M.; Marsman, A.; Vutha, A. C.; Hessels, E. A. (2019-09-06). «A measurement of the atomic hydrogen Lamb shift and the proton charge radius». Science. 365 (6457): 1007–1012. Bibcode:2019Sci…365.1007B. doi:10.1126/science.aau7807. ISSN 0036-8075. PMID 31488684. S2CID 201845158.
- ^ a b Xiong, W.; Gasparian, A.; Gao, H.; Dutta, D.; Khandaker, M.; Liyanage, N.; Pasyuk, E.; Peng, C.; Bai, X.; Ye, L.; Gnanvo, K. (November 2019). «A small proton charge radius from an electron–proton scattering experiment». Nature. 575 (7781): 147–150. Bibcode:2019Natur.575..147X. doi:10.1038/s41586-019-1721-2. ISSN 1476-4687. OSTI 1575200. PMID 31695211. S2CID 207831686.
- ^ Köhn, C.; Ebert, U. (2015). «Calculation of beams of positrons, neutrons and protons associated with terrestrial gamma-ray flashes» (PDF). Journal of Geophysical Research: Atmospheres. 23 (4): 1620–1635. Bibcode:2015JGRD..120.1620K. doi:10.1002/2014JD022229.
- ^ Köhn, C.; Diniz, G.; Harakeh, Muhsin (2017). «Production mechanisms of leptons, photons, and hadrons and their possible feedback close to lightning leaders». Journal of Geophysical Research: Atmospheres. 122 (2): 1365–1383. Bibcode:2017JGRD..122.1365K. doi:10.1002/2016JD025445. PMC 5349290. PMID 28357174.
- ^ Adair, R. K. (1989). The Great Design: Particles, Fields, and Creation. Oxford University Press. p. 214. Bibcode:1988gdpf.book…..A.
- ^ Cottingham, W. N.; Greenwood, D. A. (1986). An Introduction to Nuclear Physics. Cambridge University Press. ISBN 978-0-521-65733-4.
- ^ Basdevant, J.-L.; Rich, J.; Spiro, M. (2005). Fundamentals in Nuclear Physics. Springer. p. 155. ISBN 978-0-387-01672-6.
- ^ Department of Chemistry and Biochemistry UCLA Eric R. Scerri Lecturer (2006-10-12). The Periodic Table : Its Story and Its Significance: Its Story and Its Significance. Oxford University Press. ISBN 978-0-19-534567-4.
- ^ Wien, Wilhelm (1904). «Über positive Elektronen und die Existenz hoher Atomgewichte». Annalen der Physik. 318 (4): 669–677. Bibcode:1904AnP…318..669W. doi:10.1002/andp.18943180404.
- ^ Petrucci, R. H.; Harwood, W. S.; Herring, F. G. (2002). General Chemistry (8th ed.). Upper Saddle River, N.J. : Prentice Hall. p. 41. ISBN 978-0-13-033445-9.
- ^ See meeting report and announcement
- ^ Romer A (1997). «Proton or prouton? Rutherford and the depths of the atom». American Journal of Physics. 65 (8): 707. Bibcode:1997AmJPh..65..707R. doi:10.1119/1.18640.
- ^ Rutherford reported acceptance by the British Association in a footnote to Masson, O. (1921). «XXIV. The constitution of atoms». Philosophical Magazine. Series 6. 41 (242): 281–285. doi:10.1080/14786442108636219.
- ^ OED«proton». Oxford English Dictionary (Online ed.). Oxford University Press. Retrieved 24 March 2021. (Subscription or participating institution membership required.)
- ^ Pais, A. (1986). Inward Bound. Oxford University Press. p. 296. ISBN 0-19-851997-4. Pais believed the first science literature use of the word proton occurs in «Physics at the British Association». Nature. 106 (2663): 357–358. 1920. Bibcode:1920Natur.106..357.. doi:10.1038/106357a0.
- ^ Buccella, F.; Miele, G.; Rosa, L.; Santorelli, P.; Tuzi, T. (1989). «An upper limit for the proton lifetime in SO(10)». Physics Letters B. 233 (1–2): 178–182. Bibcode:1989PhLB..233..178B. doi:10.1016/0370-2693(89)90637-0.
- ^ Lee, D.G.; Mohapatra, R.; Parida, M.; Rani, M. (1995). «Predictions for the proton lifetime in minimal nonsupersymmetric SO(10) models: An update». Physical Review D. 51 (1): 229–235. arXiv:hep-ph/9404238. Bibcode:1995PhRvD..51..229L. doi:10.1103/PhysRevD.51.229. PMID 10018289. S2CID 119341478.
- ^ «Proton lifetime is longer than 1034 years». Kamioka Observatory. November 2009.
- ^ Nishino, H.; et al. (2009). «Search for Proton Decay via p→e+π0 and p→μ+π0 in a Large Water Cherenkov Detector». Physical Review Letters. 102 (14): 141801. arXiv:0903.0676. Bibcode:2009PhRvL.102n1801N. doi:10.1103/PhysRevLett.102.141801. PMID 19392425. S2CID 32385768.
- ^ Ahmed, S.; et al. (2004). «Constraints on Nucleon Decay via Invisible Modes from the Sudbury Neutrino Observatory». Physical Review Letters. 92 (10): 102004. arXiv:hep-ex/0310030. Bibcode:2004PhRvL..92j2004A. doi:10.1103/PhysRevLett.92.102004. PMID 15089201. S2CID 119336775.
- ^ Vanzella, Daniel A. T.; Matsas, George E. A. (2001-09-25). «Decay of Accelerated Protons and the Existence of the Fulling–Davies–Unruh Effect». Physical Review Letters. 87 (15): 151301. doi:10.1103/PhysRevLett.87.151301. hdl:11449/66594. PMID 11580689. S2CID 3202478.
- ^ Matsas, George E. A.; Vanzella, Daniel A. T. (1999-03-16). «Decay of protons and neutrons induced by acceleration». Physical Review D. 59 (9): 094004. doi:10.1103/PhysRevD.59.094004. hdl:11449/65768. S2CID 2646123.
- ^ Vanzella, Daniel A. T.; Matsas, George E. A. (2000-12-06). «Weak decay of uniformly accelerated protons and related processes». Physical Review D. 63 (1): 014010. doi:10.1103/PhysRevD.63.014010. hdl:11449/66417. S2CID 12735961.
- ^ Matsas, George E. A.; Vanzella, Daniel a. T. (2002-12-01). «The fulling–davies–unruh effect is mandatory: the proton’s testimony». International Journal of Modern Physics D. 11 (10): 1573–1577. arXiv:gr-qc/0205078. doi:10.1142/S0218271802002918. ISSN 0218-2718. S2CID 16555072.
- ^ Watson, A. (2004). The Quantum Quark. Cambridge University Press. pp. 285–286. ISBN 978-0-521-82907-6.
- ^ Smith, Timothy Paul (2003). Hidden Worlds: Hunting for Quarks in Ordinary Matter. Princeton University Press. Bibcode:2003hwhq.book…..S. ISBN 978-0-691-05773-6.
- ^ André Walker-Loud (19 November 2018). «Dissecting the Mass of the Proton». Physics. Vol. 11. p. 118. Bibcode:2018PhyOJ..11..118W. doi:10.1103/Physics.11.118. Retrieved 2021-06-04.
- ^ See this news report Archived 2009-04-16 at the Wayback Machine and links
- ^ a b Durr, S.; Fodor, Z.; Frison, J.; Hoelbling, C.; Hoffmann, R.; Katz, S.D.; Krieg, S.; Kurth, T.; Lellouch, L.; Lippert, T.; Szabo, K.K.; Vulvert, G. (2008). «Ab Initio Determination of Light Hadron Masses». Science. 322 (5905): 1224–1227. arXiv:0906.3599. Bibcode:2008Sci…322.1224D. CiteSeerX 10.1.1.249.2858. doi:10.1126/science.1163233. PMID 19023076. S2CID 14225402.
- ^ Perdrisat, C. F.; Punjabi, V.; Vanderhaeghen, M. (2007). «Nucleon electromagnetic form factors». Progress in Particle and Nuclear Physics. 59 (2): 694–764. arXiv:hep-ph/0612014. Bibcode:2007PrPNP..59..694P. doi:10.1016/j.ppnp.2007.05.001. S2CID 15894572.
- ^ Boffi, Sigfrido; Pasquini, Barbara (2007). «Generalized parton distributions and the structure of the nucleon». Rivista del Nuovo Cimento. 30 (9): 387. arXiv:0711.2625. Bibcode:2007NCimR..30..387B. doi:10.1393/ncr/i2007-10025-7. S2CID 15688157.
- ^ Joshua, Erlich (December 2008). «Recent Results in AdS/QCD». Proceedings, 8th Conference on Quark Confinement and the Hadron Spectrum, September 1–6, 2008, Mainz, Germany. arXiv:0812.4976. Bibcode:2008arXiv0812.4976E.
- ^ Pietro, Colangelo; Alex, Khodjamirian (October 2000). «QCD Sum Rules, a Modern Perspective». In M., Shifman (ed.). At the Frontier of Particle Physics: Handbook of QCD. World Scientific Publishing. pp. 1495–1576. arXiv:hep-ph/0010175. Bibcode:2001afpp.book.1495C. CiteSeerX 10.1.1.346.9301. doi:10.1142/9789812810458_0033. ISBN 978-981-02-4445-3. S2CID 16053543.
- ^ Pohl, Randolf; et al. (8 July 2010). «The size of the proton». Nature. 466 (7303): 213–216. Bibcode:2010Natur.466..213P. doi:10.1038/nature09250. PMID 20613837. S2CID 4424731.
- ^ Researchers Observes Unexpectedly Small Proton Radius in a Precision Experiment. AZo Nano. July 9, 2010
- ^ Conover, Emily (2017-04-18). «There’s still a lot we don’t know about the proton». Science News. Retrieved 2017-04-29.
- ^ a b Carlson, Carl E. (May 2015). «The proton radius puzzle». Progress in Particle and Nuclear Physics. 82: 59–77. arXiv:1502.05314. Bibcode:2015PrPNP..82…59C. doi:10.1016/j.ppnp.2015.01.002. S2CID 54915587.
- ^ Burkert, V. D.; Elouadrhiri, L.; Girod, F. X. (16 May 2018). «The pressure distribution inside the proton». Nature. 557 (7705): 396–399. Bibcode:2018Natur.557..396B. doi:10.1038/s41586-018-0060-z. OSTI 1438388. PMID 29769668. S2CID 21724781.
- ^ Headrick, J. M.; Diken, E. G.; Walters, R. S.; Hammer, N. I.; Christie, R. A.; Cui, J.; Myshakin, E. M.; Duncan, M. A.; Johnson, M. A.; Jordan, K. D. (2005). «Spectral Signatures of Hydrated Proton Vibrations in Water Clusters». Science. 308 (5729): 1765–1769. Bibcode:2005Sci…308.1765H. doi:10.1126/science.1113094. PMID 15961665. S2CID 40852810.
- ^ a b «Apollo 11 Mission». Lunar and Planetary Institute. 2009. Retrieved 2009-06-12.
- ^ a b c «Space Travel and Cancer Linked? Stony Brook Researcher Secures NASA Grant to Study Effects of Space Radiation». Brookhaven National Laboratory. 12 December 2007. Archived from the original on 26 November 2008. Retrieved 2009-06-12.
- ^ a b Shukitt-Hale, B.; Szprengiel, A.; Pluhar, J.; Rabin, B. M.; Joseph, J. A. (2004). «The effects of proton exposure on neurochemistry and behavior». Advances in Space Research. 33 (8): 1334–9. Bibcode:2004AdSpR..33.1334S. doi:10.1016/j.asr.2003.10.038. PMID 15803624. Archived from the original on 2011-07-25. Retrieved 2009-06-12.
- ^ Green, N. W.; Frederickson, A. R. (2006). «A Study of Spacecraft Charging due to Exposure to Interplanetary Protons» (PDF). AIP Conference Proceedings. 813: 694–700. Bibcode:2006AIPC..813..694G. CiteSeerX 10.1.1.541.4495. doi:10.1063/1.2169250. Archived from the original (PDF) on 2010-05-27. Retrieved 2009-06-12.
- ^ Planel, H. (2004). Space and life: an introduction to space biology and medicine. CRC Press. pp. 135–138. ISBN 978-0-415-31759-7.
- ^ Gabrielse, G. (2006). «Antiproton mass measurements». International Journal of Mass Spectrometry. 251 (2–3): 273–280. Bibcode:2006IJMSp.251..273G. doi:10.1016/j.ijms.2006.02.013.
- ^ «BASE precisely measures antiproton’s magnetic moment». CERN. Retrieved 2022-03-04.
External links[edit]
Media related to Protons at Wikimedia Commons
- Particle Data Group at LBL
- Large Hadron Collider
- Eaves, Laurence; Copeland, Ed; Padilla, Antonio (Tony) (2010). «The shrinking proton». Sixty Symbols. Brady Haran for the University of Nottingham.
- Inside the Proton, the ‘Most Complicated Thing You Could Possibly Imagine’, Quanta Magazine, Oct 19 2022

The quark content of a proton. The color assignment of individual quarks is arbitrary, but all three colors must be present. Forces between quarks are mediated by gluons. |
|
| Classification | Baryon |
|---|---|
| Composition | 2 up quarks (u), 1 down quark (d) |
| Statistics | Fermionic |
| Family | Hadron |
| Interactions | Gravity, electromagnetic, weak, strong |
| Symbol | p , p+ , N+ , 1 1H+ |
| Antiparticle | Antiproton |
| Theorized | William Prout (1815) |
| Discovered | Observed as H+ by Eugen Goldstein (1886). Identified in other nuclei (and named) by Ernest Rutherford (1917–1920). |
| Mass | 1.67262192369(51)×10−27 kg[1] 1.007276466621(53) Da[2] 938.27208816(29) MeV/c2[3] |
| Mean lifetime | > 3.6×1029 years[4] (stable) |
| Electric charge | +1 e |
| Charge radius | 0.8414(19) fm[5] |
| Electric dipole moment | < 2.1×10−25 e⋅cm[6] |
| Electric polarizability | 0.00112(4) fm3 |
| Magnetic moment | 1.41060679736(60)×10−26 J⋅T−1[7] 1.52103220230(46)×10−3 μB[5] 2.79284734463(82) μN[8] |
| Magnetic polarizability | 1.9(5)×10−4 fm3 |
| Spin | 1/2 |
| Isospin | 1/2 |
| Parity | +1 |
| Condensed | I(JP) = 1/2(1/2+) |
A proton is a stable subatomic particle, symbol
p
, H+, or 1H+ with a positive electric charge of +1 e elementary charge. Its mass is slightly less than that of a neutron and 1,836 times the mass of an electron (the proton–electron mass ratio). Protons and neutrons, each with masses of approximately one atomic mass unit, are jointly referred to as «nucleons» (particles present in atomic nuclei).
One or more protons are present in the nucleus of every atom. They provide the attractive electrostatic central force which binds the atomic electrons. The number of protons in the nucleus is the defining property of an element, and is referred to as the atomic number (represented by the symbol Z). Since each element has a unique number of protons, each element has its own unique atomic number, which determines the number of atomic electrons and consequently the chemical characteristics of the element.
The word proton is Greek for «first», and this name was given to the hydrogen nucleus by Ernest Rutherford in 1920. In previous years, Rutherford had discovered that the hydrogen nucleus (known to be the lightest nucleus) could be extracted from the nuclei of nitrogen by atomic collisions.[9] Protons were therefore a candidate to be a fundamental or elementary particle, and hence a building block of nitrogen and all other heavier atomic nuclei.
Although protons were originally considered elementary particles, in the modern Standard Model of particle physics, protons are now known to be composite particles, containing three valence quarks, and together with neutrons are now classified as hadrons. Protons are composed of two up quarks of charge +2/3e and one down quark of charge −1/3e. The rest masses of quarks contribute only about 1% of a proton’s mass.[10] The remainder of a proton’s mass is due to quantum chromodynamics binding energy, which includes the kinetic energy of the quarks and the energy of the gluon fields that bind the quarks together. Because protons are not fundamental particles, they possess a measurable size; the root mean square charge radius of a proton is about 0.84–0.87 fm (or 0.84×10−15 to 0.87×10−15 m).[11][12] In 2019, two different studies, using different techniques, found this radius to be 0.833 fm, with an uncertainty of ±0.010 fm.[13][14]
Free protons occur occasionally on Earth: thunderstorms can produce protons with energies of up to several tens of MeV.[15][16] At sufficiently low temperatures and kinetic energies, free protons will bind to electrons. However, the character of such bound protons does not change, and they remain protons. A fast proton moving through matter will slow by interactions with electrons and nuclei, until it is captured by the electron cloud of an atom. The result is a protonated atom, which is a chemical compound of hydrogen. In a vacuum, when free electrons are present, a sufficiently slow proton may pick up a single free electron, becoming a neutral hydrogen atom, which is chemically a free radical. Such «free hydrogen atoms» tend to react chemically with many other types of atoms at sufficiently low energies. When free hydrogen atoms react with each other, they form neutral hydrogen molecules (H2), which are the most common molecular component of molecular clouds in interstellar space.
Free protons are routinely used for accelerators for proton therapy or various particle physics experiments, with the most powerful example being the Large Hadron Collider.
Description[edit]
Unsolved problem in physics:
How do the quarks and gluons carry the spin of protons?
Protons are spin-1/2 fermions and are composed of three valence quarks,[17] making them baryons (a sub-type of hadrons). The two up quarks and one down quark of a proton are held together by the strong force, mediated by gluons.[18]: 21–22 A modern perspective has a proton composed of the valence quarks (up, up, down), the gluons, and transitory pairs of sea quarks. Protons have a positive charge distribution which decays approximately exponentially, with a root mean square charge radius of about 0.8 fm.[19]
Protons and neutrons are both nucleons, which may be bound together by the nuclear force to form atomic nuclei. The nucleus of the most common isotope of the hydrogen atom (with the chemical symbol «H») is a lone proton. The nuclei of the heavy hydrogen isotopes deuterium and tritium contain one proton bound to one and two neutrons, respectively. All other types of atomic nuclei are composed of two or more protons and various numbers of neutrons.
History[edit]
The concept of a hydrogen-like particle as a constituent of other atoms was developed over a long period. As early as 1815, William Prout proposed that all atoms are composed of hydrogen atoms (which he called «protyles»), based on a simplistic interpretation of early values of atomic weights (see Prout’s hypothesis), which was disproved when more accurate values were measured.[20]: 39–42
In 1886, Eugen Goldstein discovered canal rays (also known as anode rays) and showed that they were positively charged particles (ions) produced from gases. However, since particles from different gases had different values of charge-to-mass ratio (e/m), they could not be identified with a single particle, unlike the negative electrons discovered by J. J. Thomson. Wilhelm Wien in 1898 identified the hydrogen ion as the particle with the highest charge-to-mass ratio in ionized gases.[21]
Following the discovery of the atomic nucleus by Ernest Rutherford in 1911, Antonius van den Broek proposed that the place of each element in the periodic table (its atomic number) is equal to its nuclear charge. This was confirmed experimentally by Henry Moseley in 1913 using X-ray spectra.
In 1917 (in experiments reported in 1919 and 1925), Rutherford proved that the hydrogen nucleus is present in other nuclei, a result usually described as the discovery of protons.[22] These experiments began after Rutherford had noticed that, when alpha particles were shot into air (mostly nitrogen), his scintillation detectors showed the signatures of typical hydrogen nuclei as a product. After experimentation Rutherford traced the reaction to the nitrogen in air and found that when alpha particles were introduced into pure nitrogen gas, the effect was larger. In 1919 Rutherford assumed that the alpha particle merely knocked a proton out of nitrogen, turning it into carbon. After observing Blackett’s cloud chamber images in 1925, Rutherford realized that the alpha particle was absorbed. After capture of the alpha particle, a hydrogen nucleus is ejected, so that heavy oxygen, not carbon, is the result – i.e., the atomic number Z of the nucleus is increased rather than reduced. This was the first reported nuclear reaction, 14N + α → 17O + p. Rutherford at first thought of our modern «p» in this equation as a hydrogen ion, H+.
Depending on one’s perspective, either 1919 (when it was seen experimentally as derived from another source than hydrogen) or 1920 (when it was recognized and proposed as an elementary particle) may be regarded as the moment when the proton was ‘discovered’.
Rutherford knew hydrogen to be the simplest and lightest element and was influenced by Prout’s hypothesis that hydrogen was the building block of all elements. Discovery that the hydrogen nucleus is present in other nuclei as an elementary particle led Rutherford to give the hydrogen nucleus H+ a special name as a particle, since he suspected that hydrogen, the lightest element, contained only one of these particles. He named this new fundamental building block of the nucleus the proton, after the neuter singular of the Greek word for «first», πρῶτον. However, Rutherford also had in mind the word protyle as used by Prout. Rutherford spoke at the British Association for the Advancement of Science at its Cardiff meeting beginning 24 August 1920.[23] At the meeting, he was asked by Oliver Lodge for a new name for the positive hydrogen nucleus to avoid confusion with the neutral hydrogen atom. He initially suggested both proton and prouton (after Prout).[24] Rutherford later reported that the meeting had accepted his suggestion that the hydrogen nucleus be named the «proton», following Prout’s word «protyle».[25] The first use of the word «proton» in the scientific literature appeared in 1920.[26][27]
Stability[edit]
Unsolved problem in physics:
Are protons fundamentally stable? Or do they decay with a finite lifetime as predicted by some extensions to the standard model?
The free proton (a proton not bound to nucleons or electrons) is a stable particle that has not been observed to break down spontaneously to other particles. Free protons are found naturally in a number of situations in which energies or temperatures are high enough to separate them from electrons, for which they have some affinity. Free protons exist in plasmas in which temperatures are too high to allow them to combine with electrons. Free protons of high energy and velocity make up 90% of cosmic rays, which propagate in vacuum for interstellar distances. Free protons are emitted directly from atomic nuclei in some rare types of radioactive decay. Protons also result (along with electrons and antineutrinos) from the radioactive decay of free neutrons, which are unstable.
The spontaneous decay of free protons has never been observed, and protons are therefore considered stable particles according to the Standard Model. However, some grand unified theories (GUTs) of particle physics predict that proton decay should take place with lifetimes between 1031 to 1036 years and experimental searches have established lower bounds on the mean lifetime of a proton for various assumed decay products.[28][29][30]
Experiments at the Super-Kamiokande detector in Japan gave lower limits for proton mean lifetime of 6.6×1033 years for decay to an antimuon and a neutral pion, and 8.2×1033 years for decay to a positron and a neutral pion.[31]
Another experiment at the Sudbury Neutrino Observatory in Canada searched for gamma rays resulting from residual nuclei resulting from the decay of a proton from oxygen-16. This experiment was designed to detect decay to any product, and established a lower limit to a proton lifetime of 2.1×1029 years.[32]
However, protons are known to transform into neutrons through the process of electron capture (also called inverse beta decay). For free protons, this process does not occur spontaneously but only when energy is supplied. The equation is:
p+
+
e−
→
n
+
ν
e
The process is reversible; neutrons can convert back to protons through beta decay, a common form of radioactive decay. In fact, a free neutron decays this way, with a mean lifetime of about 15 minutes. A proton can also transform into neutrons through beta plus decay (β+ decay).
According to quantum field theory, the mean proper lifetime of protons 



p+
→
n
+
e+
+
ν
e. This was a matter of concern in the later 1990s because 
p+
+
e−
→
n
+
ν
, (ii)
p+
+
ν
→
n
+
e+
and (iii)
p+
+
e−
+
ν
→
n
. Adding the contributions of each of these processes, one should obtain 
Quarks and the mass of a proton[edit]
In quantum chromodynamics, the modern theory of the nuclear force, most of the mass of protons and neutrons is explained by special relativity. The mass of a proton is about 80–100 times greater than the sum of the rest masses of its three valence quarks, while the gluons have zero rest mass. The extra energy of the quarks and gluons in a proton, as compared to the rest energy of the quarks alone in the QCD vacuum, accounts for almost 99% of the proton’s mass. The rest mass of a proton is, thus, the invariant mass of the system of moving quarks and gluons that make up the particle, and, in such systems, even the energy of massless particles confined to a system is still measured as part of the rest mass of the system.
Two terms are used in referring to the mass of the quarks that make up protons: current quark mass refers to the mass of a quark by itself, while constituent quark mass refers to the current quark mass plus the mass of the gluon particle field surrounding the quark.[37]: 285–286 [38]: 150–151 These masses typically have very different values. The kinetic energy of the quarks that is a consequence of confinement is a contribution (see Mass in special relativity). Using lattice QCD calculations, the contributions to the mass of the proton are the quark condensate (~9%, comprising the up and down quarks and a sea of virtual strange quarks), the quark kinetic energy (~32%), the gluon kinetic energy (~37%), and the anomalous gluonic contribution (~23%, comprising contributions from condensates of all quark flavors).[39]
The constituent quark model wavefunction for the proton is
The internal dynamics of protons are complicated, because they are determined by the quarks’ exchanging gluons, and interacting with various vacuum condensates. Lattice QCD provides a way of calculating the mass of a proton directly from the theory to any accuracy, in principle. The most recent calculations[40][41] claim that the mass is determined to better than 4% accuracy, even to 1% accuracy (see Figure S5 in Dürr et al.[41]). These claims are still controversial, because the calculations cannot yet be done with quarks as light as they are in the real world. This means that the predictions are found by a process of extrapolation, which can introduce systematic errors.[42] It is hard to tell whether these errors are controlled properly, because the quantities that are compared to experiment are the masses of the hadrons, which are known in advance.
These recent calculations are performed by massive supercomputers, and, as noted by Boffi and Pasquini: «a detailed description of the nucleon structure is still missing because … long-distance behavior requires a nonperturbative and/or numerical treatment …»[43]
More conceptual approaches to the structure of protons are: the topological soliton approach originally due to Tony Skyrme and the more accurate AdS/QCD approach that extends it to include a string theory of gluons,[44] various QCD-inspired models like the bag model and the constituent quark model, which were popular in the 1980s, and the SVZ sum rules, which allow for rough approximate mass calculations.[45] These methods do not have the same accuracy as the more brute-force lattice QCD methods, at least not yet.
Charge radius[edit]
The problem of defining a radius for an atomic nucleus (proton) is similar to the problem of atomic radius, in that neither atoms nor their nuclei have definite boundaries. However, the nucleus can be modeled as a sphere of positive charge for the interpretation of electron scattering experiments: because there is no definite boundary to the nucleus, the electrons «see» a range of cross-sections, for which a mean can be taken. The qualification of «rms» (for «root mean square») arises because it is the nuclear cross-section, proportional to the square of the radius, which is determining for electron scattering.[dubious – discuss]
The internationally accepted value of a proton’s charge radius is 0.8768 fm. This value is based on measurements involving a proton and an electron (namely, electron scattering measurements and complex calculation involving scattering cross section based on Rosenbluth equation for momentum-transfer cross section), and studies of the atomic energy levels of hydrogen and deuterium.
However, in 2010 an international research team published a proton charge radius measurement via the Lamb shift in muonic hydrogen (an exotic atom made of a proton and a negatively charged muon). As a muon is 200 times heavier than an electron, its de Broglie wavelength is correspondingly shorter. This smaller atomic orbital is much more sensitive to the proton’s charge radius, so allows more precise measurement. Their measurement of the root-mean-square charge radius of a proton is «0.84184(67) fm, which differs by 5.0 standard deviations from the CODATA value of 0.8768(69) fm«.[46] In January 2013, an updated value for the charge radius of a proton—0.84087(39) fm—was published. The precision was improved by 1.7 times, increasing the significance of the discrepancy to 7σ.[12]
The 2014 CODATA adjustment slightly reduced the recommended value for the proton radius (computed using electron measurements only) to 0.8751(61) fm, but this leaves the discrepancy at 5.6σ.
If no errors were found in the measurements or calculations, it would have been necessary to re-examine the world’s most precise and best-tested fundamental theory: quantum electrodynamics.[47] The proton radius was a puzzle as of 2017.[48][49]
A resolution came in 2019, when two different studies, using different techniques involving the Lamb shift of the electron in hydrogen, and electron–proton scattering, found the radius of the proton to be 0.833 fm, with an uncertainty of ±0.010 fm, and 0.831 fm.[13][14]
The radius of the proton is linked to the form factor and momentum-transfer cross section. The atomic form factor G modifies the cross section corresponding to point-like proton.
The atomic form factor is related to the wave function density of the target:
The form factor can be split in electric and magnetic form factors. These can be further written as linear combinations of Dirac and Pauli form factors.[49]
Pressure inside the proton[edit]
Since the proton is composed of quarks confined by gluons, an equivalent pressure which acts on the quarks can be defined. This allows calculation of their distribution as a function of distance from the centre using Compton scattering of high-energy electrons (DVCS, for deeply virtual Compton scattering). The pressure is maximum at the centre, about 1035 Pa, which is greater than the pressure inside a neutron star.[50] It is positive (repulsive) to a radial distance of about 0.6 fm, negative (attractive) at greater distances, and very weak beyond about 2 fm.
Charge radius in solvated proton, hydronium[edit]
The radius of the hydrated proton appears in the Born equation for calculating the hydration enthalpy of hydronium.
Interaction of free protons with ordinary matter[edit]
Although protons have affinity for oppositely charged electrons, this is a relatively low-energy interaction and so free protons must lose sufficient velocity (and kinetic energy) in order to become closely associated and bound to electrons. High energy protons, in traversing ordinary matter, lose energy by collisions with atomic nuclei, and by ionization of atoms (removing electrons) until they are slowed sufficiently to be captured by the electron cloud in a normal atom.
However, in such an association with an electron, the character of the bound proton is not changed, and it remains a proton. The attraction of low-energy free protons to any electrons present in normal matter (such as the electrons in normal atoms) causes free protons to stop and to form a new chemical bond with an atom. Such a bond happens at any sufficiently «cold» temperature (that is, comparable to temperatures at the surface of the Sun) and with any type of atom. Thus, in interaction with any type of normal (non-plasma) matter, low-velocity free protons do not remain free but are attracted to electrons in any atom or molecule with which they come into contact, causing the proton and molecule to combine. Such molecules are then said to be «protonated», and chemically they are simply compounds of hydrogen, often positively charged. Often, as a result, they become so-called Brønsted acids. For example, a proton captured by a water molecule in water becomes hydronium, the aqueous cation H3O+.
Proton in chemistry[edit]
Atomic number[edit]
In chemistry, the number of protons in the nucleus of an atom is known as the atomic number, which determines the chemical element to which the atom belongs. For example, the atomic number of chlorine is 17; this means that each chlorine atom has 17 protons and that all atoms with 17 protons are chlorine atoms. The chemical properties of each atom are determined by the number of (negatively charged) electrons, which for neutral atoms is equal to the number of (positive) protons so that the total charge is zero. For example, a neutral chlorine atom has 17 protons and 17 electrons, whereas a Cl− anion has 17 protons and 18 electrons for a total charge of −1.
All atoms of a given element are not necessarily identical, however. The number of neutrons may vary to form different isotopes, and energy levels may differ, resulting in different nuclear isomers. For example, there are two stable isotopes of chlorine: 35
17Cl
with 35 − 17 = 18 neutrons and 37
17Cl
with 37 − 17 = 20 neutrons.
Hydrogen ion[edit]
Protium, the most common isotope of hydrogen, consists of one proton and one electron (it has no neutrons). The term «hydrogen ion» (H+
) implies that that H-atom has lost its one electron, causing only a proton to remain. Thus, in chemistry, the terms «proton» and «hydrogen ion» (for the protium isotope) are used synonymously
The proton is a unique chemical species, being a bare nucleus. As a consequence it has no independent existence in the condensed state and is invariably found bound by a pair of electrons to another atom.
Ross Stewart, The Proton: Application to Organic Chemistry (1985, p. 1)
In chemistry, the term proton refers to the hydrogen ion, H+
. Since the atomic number of hydrogen is 1, a hydrogen ion has no electrons and corresponds to a bare nucleus, consisting of a proton (and 0 neutrons for the most abundant isotope protium 1
1H
). The proton is a «bare charge» with only about 1/64,000 of the radius of a hydrogen atom, and so is extremely reactive chemically. The free proton, thus, has an extremely short lifetime in chemical systems such as liquids and it reacts immediately with the electron cloud of any available molecule. In aqueous solution, it forms the hydronium ion, H3O+, which in turn is further solvated by water molecules in clusters such as [H5O2]+ and [H9O4]+.[51]
The transfer of H+
in an acid–base reaction is usually referred to as «proton transfer». The acid is referred to as a proton donor and the base as a proton acceptor. Likewise, biochemical terms such as proton pump and proton channel refer to the movement of hydrated H+
ions.
The ion produced by removing the electron from a deuterium atom is known as a deuteron, not a proton. Likewise, removing an electron from a tritium atom produces a triton.
Proton nuclear magnetic resonance (NMR)[edit]
Also in chemistry, the term «proton NMR» refers to the observation of hydrogen-1 nuclei in (mostly organic) molecules by nuclear magnetic resonance. This method uses the quantized spin magnetic moment of the proton, which is due to its angular momentum (or spin), which in turn has a magnitude of one-half the reduced Planck constant. (
Human exposure[edit]
The Apollo Lunar Surface Experiments Packages (ALSEP) determined that more than 95% of the particles in the solar wind are electrons and protons, in approximately equal numbers.[52][53]
Because the Solar Wind Spectrometer made continuous measurements, it was possible to measure how the Earth’s magnetic field affects arriving solar wind particles. For about two-thirds of each orbit, the Moon is outside of the Earth’s magnetic field. At these times, a typical proton density was 10 to 20 per cubic centimeter, with most protons having velocities between 400 and 650 kilometers per second. For about five days of each month, the Moon is inside the Earth’s geomagnetic tail, and typically no solar wind particles were detectable. For the remainder of each lunar orbit, the Moon is in a transitional region known as the magnetosheath, where the Earth’s magnetic field affects the solar wind, but does not completely exclude it. In this region, the particle flux is reduced, with typical proton velocities of 250 to 450 kilometers per second. During the lunar night, the spectrometer was shielded from the solar wind by the Moon and no solar wind particles were measured.[52]
Protons also have extrasolar origin from galactic cosmic rays, where they make up about 90% of the total particle flux. These protons often have higher energy than solar wind protons, and their intensity is far more uniform and less variable than protons coming from the Sun, the production of which is heavily affected by solar proton events such as coronal mass ejections.
Research has been performed on the dose-rate effects of protons, as typically found in space travel, on human health.[53][54] To be more specific, there are hopes to identify what specific chromosomes are damaged, and to define the damage, during cancer development from proton exposure.[53] Another study looks into determining «the effects of exposure to proton irradiation on neurochemical and behavioral endpoints, including dopaminergic functioning, amphetamine-induced conditioned taste aversion learning, and spatial learning and memory as measured by the Morris water maze.[54] Electrical charging of a spacecraft due to interplanetary proton bombardment has also been proposed for study.[55] There are many more studies that pertain to space travel, including galactic cosmic rays and their possible health effects, and solar proton event exposure.
The American Biostack and Soviet Biorack space travel experiments have demonstrated the severity of molecular damage induced by heavy ions on microorganisms including Artemia cysts.[56]
Antiproton[edit]
CPT-symmetry puts strong constraints on the relative properties of particles and antiparticles and, therefore, is open to stringent tests. For example, the charges of a proton and antiproton must sum to exactly zero. This equality has been tested to one part in 108. The equality of their masses has also been tested to better than one part in 108. By holding antiprotons in a Penning trap, the equality of the charge-to-mass ratio of protons and antiprotons has been tested to one part in 6×109.[57] The magnetic moment of antiprotons has been measured with error of 8×10−3 nuclear Bohr magnetons, and is found to be equal and opposite to that of a proton.[58]
See also[edit]
- Fermion field
- Hydrogen
- Hydron (chemistry)
- List of particles
- Proton–proton chain
- Quark model
- Proton spin crisis
- Proton therapy
References[edit]
- ^ «2018 CODATA Value: proton mass». The NIST Reference on Constants, Units, and Uncertainty. NIST. 20 May 2019. Retrieved 2019-05-20.
- ^ «2018 CODATA Value: proton mass in u». The NIST Reference on Constants, Units, and Uncertainty. NIST. 20 May 2019. Retrieved 2022-09-11.
- ^ «2018 CODATA Value: proton mass energy equivalent in MeV». The NIST Reference on Constants, Units, and Uncertainty. NIST. 20 May 2019. Retrieved 2022-09-11.
- ^ The SNO+ Collaboration; Anderson, M.; Andringa, S.; Arushanova, E.; Asahi, S.; Askins, M.; Auty, D. J.; Back, A. R.; Barnard, Z.; Barros, N.; Bartlett, D. (2019-02-20). «Search for invisible modes of nucleon decay in water with the SNO+ detector». Physical Review D. 99 (3): 032008. arXiv:1812.05552. Bibcode:2019PhRvD..99c2008A. doi:10.1103/PhysRevD.99.032008. S2CID 96457175.
- ^ a b ««2018 CODATA recommended values»«.
- ^ Sahoo, B. K. (2017-01-17). «Improved limits on the hadronic and semihadronic $CP$ violating parameters and role of a dark force carrier in the electric dipole moment of $^{199}mathrm{Hg}$». Physical Review D. 95 (1): 013002. arXiv:1612.09371. doi:10.1103/PhysRevD.95.013002. S2CID 119344894.
- ^ «2018 CODATA Value: proton magnetic moment». The NIST Reference on Constants, Units, and Uncertainty. NIST. 20 May 2019. Retrieved 2022-09-17.
- ^ «2018 CODATA Value: proton magnetic moment to nuclear magneton ratio». The NIST Reference on Constants, Units, and Uncertainty. NIST. 20 May 2019. Retrieved 2022-09-17.
- ^ «proton | Definition, Mass, Charge, & Facts». Encyclopedia Britannica. Retrieved 2018-10-20.
- ^ Cho, Adrian (2 April 2010). «Mass of the Common Quark Finally Nailed Down». Science Magazine. American Association for the Advancement of Science. Retrieved 27 September 2014.
- ^ «Proton size puzzle reinforced!». Paul Shearer Institute. 25 January 2013.
- ^ a b Antognini, Aldo; et al. (25 January 2013). «Proton Structure from the Measurement of 2S-2P Transition Frequencies of Muonic Hydrogen» (PDF). Science. 339 (6118): 417–420. Bibcode:2013Sci…339..417A. doi:10.1126/science.1230016. hdl:10316/79993. PMID 23349284. S2CID 346658.
- ^ a b Bezginov, N.; Valdez, T.; Horbatsch, M.; Marsman, A.; Vutha, A. C.; Hessels, E. A. (2019-09-06). «A measurement of the atomic hydrogen Lamb shift and the proton charge radius». Science. 365 (6457): 1007–1012. Bibcode:2019Sci…365.1007B. doi:10.1126/science.aau7807. ISSN 0036-8075. PMID 31488684. S2CID 201845158.
- ^ a b Xiong, W.; Gasparian, A.; Gao, H.; Dutta, D.; Khandaker, M.; Liyanage, N.; Pasyuk, E.; Peng, C.; Bai, X.; Ye, L.; Gnanvo, K. (November 2019). «A small proton charge radius from an electron–proton scattering experiment». Nature. 575 (7781): 147–150. Bibcode:2019Natur.575..147X. doi:10.1038/s41586-019-1721-2. ISSN 1476-4687. OSTI 1575200. PMID 31695211. S2CID 207831686.
- ^ Köhn, C.; Ebert, U. (2015). «Calculation of beams of positrons, neutrons and protons associated with terrestrial gamma-ray flashes» (PDF). Journal of Geophysical Research: Atmospheres. 23 (4): 1620–1635. Bibcode:2015JGRD..120.1620K. doi:10.1002/2014JD022229.
- ^ Köhn, C.; Diniz, G.; Harakeh, Muhsin (2017). «Production mechanisms of leptons, photons, and hadrons and their possible feedback close to lightning leaders». Journal of Geophysical Research: Atmospheres. 122 (2): 1365–1383. Bibcode:2017JGRD..122.1365K. doi:10.1002/2016JD025445. PMC 5349290. PMID 28357174.
- ^ Adair, R. K. (1989). The Great Design: Particles, Fields, and Creation. Oxford University Press. p. 214. Bibcode:1988gdpf.book…..A.
- ^ Cottingham, W. N.; Greenwood, D. A. (1986). An Introduction to Nuclear Physics. Cambridge University Press. ISBN 978-0-521-65733-4.
- ^ Basdevant, J.-L.; Rich, J.; Spiro, M. (2005). Fundamentals in Nuclear Physics. Springer. p. 155. ISBN 978-0-387-01672-6.
- ^ Department of Chemistry and Biochemistry UCLA Eric R. Scerri Lecturer (2006-10-12). The Periodic Table : Its Story and Its Significance: Its Story and Its Significance. Oxford University Press. ISBN 978-0-19-534567-4.
- ^ Wien, Wilhelm (1904). «Über positive Elektronen und die Existenz hoher Atomgewichte». Annalen der Physik. 318 (4): 669–677. Bibcode:1904AnP…318..669W. doi:10.1002/andp.18943180404.
- ^ Petrucci, R. H.; Harwood, W. S.; Herring, F. G. (2002). General Chemistry (8th ed.). Upper Saddle River, N.J. : Prentice Hall. p. 41. ISBN 978-0-13-033445-9.
- ^ See meeting report and announcement
- ^ Romer A (1997). «Proton or prouton? Rutherford and the depths of the atom». American Journal of Physics. 65 (8): 707. Bibcode:1997AmJPh..65..707R. doi:10.1119/1.18640.
- ^ Rutherford reported acceptance by the British Association in a footnote to Masson, O. (1921). «XXIV. The constitution of atoms». Philosophical Magazine. Series 6. 41 (242): 281–285. doi:10.1080/14786442108636219.
- ^ OED«proton». Oxford English Dictionary (Online ed.). Oxford University Press. Retrieved 24 March 2021. (Subscription or participating institution membership required.)
- ^ Pais, A. (1986). Inward Bound. Oxford University Press. p. 296. ISBN 0-19-851997-4. Pais believed the first science literature use of the word proton occurs in «Physics at the British Association». Nature. 106 (2663): 357–358. 1920. Bibcode:1920Natur.106..357.. doi:10.1038/106357a0.
- ^ Buccella, F.; Miele, G.; Rosa, L.; Santorelli, P.; Tuzi, T. (1989). «An upper limit for the proton lifetime in SO(10)». Physics Letters B. 233 (1–2): 178–182. Bibcode:1989PhLB..233..178B. doi:10.1016/0370-2693(89)90637-0.
- ^ Lee, D.G.; Mohapatra, R.; Parida, M.; Rani, M. (1995). «Predictions for the proton lifetime in minimal nonsupersymmetric SO(10) models: An update». Physical Review D. 51 (1): 229–235. arXiv:hep-ph/9404238. Bibcode:1995PhRvD..51..229L. doi:10.1103/PhysRevD.51.229. PMID 10018289. S2CID 119341478.
- ^ «Proton lifetime is longer than 1034 years». Kamioka Observatory. November 2009.
- ^ Nishino, H.; et al. (2009). «Search for Proton Decay via p→e+π0 and p→μ+π0 in a Large Water Cherenkov Detector». Physical Review Letters. 102 (14): 141801. arXiv:0903.0676. Bibcode:2009PhRvL.102n1801N. doi:10.1103/PhysRevLett.102.141801. PMID 19392425. S2CID 32385768.
- ^ Ahmed, S.; et al. (2004). «Constraints on Nucleon Decay via Invisible Modes from the Sudbury Neutrino Observatory». Physical Review Letters. 92 (10): 102004. arXiv:hep-ex/0310030. Bibcode:2004PhRvL..92j2004A. doi:10.1103/PhysRevLett.92.102004. PMID 15089201. S2CID 119336775.
- ^ Vanzella, Daniel A. T.; Matsas, George E. A. (2001-09-25). «Decay of Accelerated Protons and the Existence of the Fulling–Davies–Unruh Effect». Physical Review Letters. 87 (15): 151301. doi:10.1103/PhysRevLett.87.151301. hdl:11449/66594. PMID 11580689. S2CID 3202478.
- ^ Matsas, George E. A.; Vanzella, Daniel A. T. (1999-03-16). «Decay of protons and neutrons induced by acceleration». Physical Review D. 59 (9): 094004. doi:10.1103/PhysRevD.59.094004. hdl:11449/65768. S2CID 2646123.
- ^ Vanzella, Daniel A. T.; Matsas, George E. A. (2000-12-06). «Weak decay of uniformly accelerated protons and related processes». Physical Review D. 63 (1): 014010. doi:10.1103/PhysRevD.63.014010. hdl:11449/66417. S2CID 12735961.
- ^ Matsas, George E. A.; Vanzella, Daniel a. T. (2002-12-01). «The fulling–davies–unruh effect is mandatory: the proton’s testimony». International Journal of Modern Physics D. 11 (10): 1573–1577. arXiv:gr-qc/0205078. doi:10.1142/S0218271802002918. ISSN 0218-2718. S2CID 16555072.
- ^ Watson, A. (2004). The Quantum Quark. Cambridge University Press. pp. 285–286. ISBN 978-0-521-82907-6.
- ^ Smith, Timothy Paul (2003). Hidden Worlds: Hunting for Quarks in Ordinary Matter. Princeton University Press. Bibcode:2003hwhq.book…..S. ISBN 978-0-691-05773-6.
- ^ André Walker-Loud (19 November 2018). «Dissecting the Mass of the Proton». Physics. Vol. 11. p. 118. Bibcode:2018PhyOJ..11..118W. doi:10.1103/Physics.11.118. Retrieved 2021-06-04.
- ^ See this news report Archived 2009-04-16 at the Wayback Machine and links
- ^ a b Durr, S.; Fodor, Z.; Frison, J.; Hoelbling, C.; Hoffmann, R.; Katz, S.D.; Krieg, S.; Kurth, T.; Lellouch, L.; Lippert, T.; Szabo, K.K.; Vulvert, G. (2008). «Ab Initio Determination of Light Hadron Masses». Science. 322 (5905): 1224–1227. arXiv:0906.3599. Bibcode:2008Sci…322.1224D. CiteSeerX 10.1.1.249.2858. doi:10.1126/science.1163233. PMID 19023076. S2CID 14225402.
- ^ Perdrisat, C. F.; Punjabi, V.; Vanderhaeghen, M. (2007). «Nucleon electromagnetic form factors». Progress in Particle and Nuclear Physics. 59 (2): 694–764. arXiv:hep-ph/0612014. Bibcode:2007PrPNP..59..694P. doi:10.1016/j.ppnp.2007.05.001. S2CID 15894572.
- ^ Boffi, Sigfrido; Pasquini, Barbara (2007). «Generalized parton distributions and the structure of the nucleon». Rivista del Nuovo Cimento. 30 (9): 387. arXiv:0711.2625. Bibcode:2007NCimR..30..387B. doi:10.1393/ncr/i2007-10025-7. S2CID 15688157.
- ^ Joshua, Erlich (December 2008). «Recent Results in AdS/QCD». Proceedings, 8th Conference on Quark Confinement and the Hadron Spectrum, September 1–6, 2008, Mainz, Germany. arXiv:0812.4976. Bibcode:2008arXiv0812.4976E.
- ^ Pietro, Colangelo; Alex, Khodjamirian (October 2000). «QCD Sum Rules, a Modern Perspective». In M., Shifman (ed.). At the Frontier of Particle Physics: Handbook of QCD. World Scientific Publishing. pp. 1495–1576. arXiv:hep-ph/0010175. Bibcode:2001afpp.book.1495C. CiteSeerX 10.1.1.346.9301. doi:10.1142/9789812810458_0033. ISBN 978-981-02-4445-3. S2CID 16053543.
- ^ Pohl, Randolf; et al. (8 July 2010). «The size of the proton». Nature. 466 (7303): 213–216. Bibcode:2010Natur.466..213P. doi:10.1038/nature09250. PMID 20613837. S2CID 4424731.
- ^ Researchers Observes Unexpectedly Small Proton Radius in a Precision Experiment. AZo Nano. July 9, 2010
- ^ Conover, Emily (2017-04-18). «There’s still a lot we don’t know about the proton». Science News. Retrieved 2017-04-29.
- ^ a b Carlson, Carl E. (May 2015). «The proton radius puzzle». Progress in Particle and Nuclear Physics. 82: 59–77. arXiv:1502.05314. Bibcode:2015PrPNP..82…59C. doi:10.1016/j.ppnp.2015.01.002. S2CID 54915587.
- ^ Burkert, V. D.; Elouadrhiri, L.; Girod, F. X. (16 May 2018). «The pressure distribution inside the proton». Nature. 557 (7705): 396–399. Bibcode:2018Natur.557..396B. doi:10.1038/s41586-018-0060-z. OSTI 1438388. PMID 29769668. S2CID 21724781.
- ^ Headrick, J. M.; Diken, E. G.; Walters, R. S.; Hammer, N. I.; Christie, R. A.; Cui, J.; Myshakin, E. M.; Duncan, M. A.; Johnson, M. A.; Jordan, K. D. (2005). «Spectral Signatures of Hydrated Proton Vibrations in Water Clusters». Science. 308 (5729): 1765–1769. Bibcode:2005Sci…308.1765H. doi:10.1126/science.1113094. PMID 15961665. S2CID 40852810.
- ^ a b «Apollo 11 Mission». Lunar and Planetary Institute. 2009. Retrieved 2009-06-12.
- ^ a b c «Space Travel and Cancer Linked? Stony Brook Researcher Secures NASA Grant to Study Effects of Space Radiation». Brookhaven National Laboratory. 12 December 2007. Archived from the original on 26 November 2008. Retrieved 2009-06-12.
- ^ a b Shukitt-Hale, B.; Szprengiel, A.; Pluhar, J.; Rabin, B. M.; Joseph, J. A. (2004). «The effects of proton exposure on neurochemistry and behavior». Advances in Space Research. 33 (8): 1334–9. Bibcode:2004AdSpR..33.1334S. doi:10.1016/j.asr.2003.10.038. PMID 15803624. Archived from the original on 2011-07-25. Retrieved 2009-06-12.
- ^ Green, N. W.; Frederickson, A. R. (2006). «A Study of Spacecraft Charging due to Exposure to Interplanetary Protons» (PDF). AIP Conference Proceedings. 813: 694–700. Bibcode:2006AIPC..813..694G. CiteSeerX 10.1.1.541.4495. doi:10.1063/1.2169250. Archived from the original (PDF) on 2010-05-27. Retrieved 2009-06-12.
- ^ Planel, H. (2004). Space and life: an introduction to space biology and medicine. CRC Press. pp. 135–138. ISBN 978-0-415-31759-7.
- ^ Gabrielse, G. (2006). «Antiproton mass measurements». International Journal of Mass Spectrometry. 251 (2–3): 273–280. Bibcode:2006IJMSp.251..273G. doi:10.1016/j.ijms.2006.02.013.
- ^ «BASE precisely measures antiproton’s magnetic moment». CERN. Retrieved 2022-03-04.
External links[edit]
Media related to Protons at Wikimedia Commons
- Particle Data Group at LBL
- Large Hadron Collider
- Eaves, Laurence; Copeland, Ed; Padilla, Antonio (Tony) (2010). «The shrinking proton». Sixty Symbols. Brady Haran for the University of Nottingham.
- Inside the Proton, the ‘Most Complicated Thing You Could Possibly Imagine’, Quanta Magazine, Oct 19 2022
Прото́н (от др.-греч. πρῶτος — первый, основной) — элементарная частица. Относится к барионам, имеет спин 1/2, электрический заряд +1 (в единицах элементарного электрического заряда). В физике элементарных частиц рассматривается как нуклон с проекцией изоспина +1/2 (в ядерной физике принят противоположный знак проекции изоспина). Состоит из трёх кварков (один d-кварк и два u-кварка). Стабилен (нижнее ограничение на время жизни — 2,9·1029 лет независимо от канала распада, 1,6·1033 лет для распада в позитрон и нейтральный пион).
Масса протона, выраженная в разных единицах, составляет (рекомендованные значения CODATA 2010 года, в скобках указана погрешность величины в единицах последней значимой цифры, одно стандартное отклонение):
- 938,272 046(21) МэВ[4];
- 1,007 276 466 812(90) а. е. м.[3];
- 1,672 621 777(74)·10−27 кг[2];
- 1836,152 672 1(14) массы электрона[5].
Протоны принимают участие в термоядерных реакциях, которые являются основным источником энергии, генерируемой звёздами. В частности, реакции pp-цикла, который является источником почти всей энергии, излучаемой Солнцем, сводятся к соединению четырёх протонов в ядро гелия-4 с превращением двух протонов в нейтроны.
Кварковая структура протона
Протон в химии
Ядро атома водорода состоит из одного протона. Протон в химическом смысле является ядром атома водорода (точнее, его лёгкого изотопа — протия) без электрона. В физике протон обозначается буквой p (или p+). Химическое обозначение протона (рассматриваемого в качестве положительного иона водорода) — H+, астрофизическое — HII.
Протоны (вместе с нейтронами) являются основными составляющими атомных ядер. Порядковый номер химического элемента в периодической таблице (и, соответственно, все его химические свойства) полностью определяются зарядом ядра его атомов, который, в свою очередь, равен количеству протонов в ядре (протонному числу).
Интересные факты
- Отношение масс протона и электрона, равное 1836,152 672 1(14)[5], с точностью до 0,002 % равно значению 6π5 = 1836,118 108 711 686…
- Ультрарелятивистские протоны (как и любые другие адроны, а также атомные ядра) для неподвижного наблюдателя имеют форму двояковогнутой линзы[6].
- Измерения радиуса протона с помощью атомов обычного водорода, проводимые разными методами с 1960-х годов, привели (CODATA-2006) к результату 0,8768±0,0069 фемтометра (1 фм = 10−15 м)[7]. Первые эксперименты с атомами мюонного водорода[8] дали для этого радиуса на 4 % меньший результат 0,8418±0,0007 фм.[9] Причины такого различия пока неясны.
См. также
- Антипротон
- Нейтрон
- Электрон
- Фемтоскопия
Литература
- Многие известные свойства протона систематически изложены в публикации Particle Data Group. [1] (англ.)
Примечания
- ↑ http://physics.nist.gov/cuu/Constants/Table/allascii.txt Fundamental Physical Constants — Complete Listing
- ↑ 1 2 CODATA Value: proton mass
- ↑ 1 2 CODATA Value: proton mass in u
- ↑ CODATA Value: proton mass energy equivalent in MeV
- ↑ 1 2 CODATA Value: proton-electron mass ratio
- ↑ Иванов И. Какую форму имеет быстро летящий протон? = B. Blok, L. Frankfurt, M. Strikman. On the shape of a rapid hadron in QCD.
- ↑ www.membrana.ru Мюон указал на ошибку в размере протона.
- ↑ где электрон заменён на мюон
- ↑ Dr.Randolf Pohl How small is the proton? = „The size of the proton“ Nature, Doi:10.1038/nature09250, 8 July 2010.
Химический элемент
Химический элемент — совокупность атомов с одним и тем же зарядом ядра, числом протонов в ядре и электронов
в электронной оболочке. Закономерную связь химических элементов отражает периодическая таблица Д.И. Менделеева.

Изучая подобную карточку химического элемента, можно узнать о нем многое:
- Обозначение химического элемента
- Русское наименование
- Порядковый номер = заряд атома = число электронов = число протонов
- Атомная масса
- Распределение электронов по энергетическим уровням
- Электронная конфигурация внешнего уровня
Надо заметить, что на экзамене часто из карточки элемента скрывают распределение электронов и конфигурацию внешнего
уровня. Тем не менее, если вы успешно освоили предыдущую тему, то для вас не составит труда написать электронную
конфигурацию атома зная его порядковый номер в таблице Д.И. Менделеева (номер уж точно не тронут!))
Протоны, нейтроны и электроны
Вы уже знаете, что порядковый номер элемента в периодической таблице Д.И. Менделеева равен числу протонов, а число протонов
равно числу электронов.

Для того чтобы найти число нейтронов в атоме алюминия, необходимо вычесть из атомной массы число протонов:
27 — 13 = 14
Получается, что в атоме алюминия 14 нейтронов. Посчитайте число нейтронов, электронов и протонов самостоятельно для атомов бериллия,
кислорода, меди. Решение вы найдете ниже.

Если вы поняли суть и научились считать протоны, нейтроны и электроны, самое время приступать к следующей теме.
Изотопы
Изотопы (греч. isos — одинаковый + topos — место) — общее название разновидностей одного и того же химического элемента,
имеющих одинаковый заряд ядра (число протонов), но разное число нейтронов.
Вероятно, вы не задумывались, но вся таблица Д.И. Менделеева и представленные в ней химические элементы — это самые распространенные
на земле изотопы.
Лучше всего объяснить, что такое изотопы наглядным примером. Широко известны три изотопа водорода: протий, дейтерий и тритий.

В таблице Д.И. Менделеева представлен самый распространенный из трех — протий. Он содержит 1 протон и 1 электрон, нейтроны отсутствуют. У
дейтерия 1 протон, 1 нейтрон и 1 электрон. У трития 1 протон, 2 нейтрона, 1 электрон.
Теперь очевидно, что изотопы — атомы одного и того же химического элемента, различающиеся числом нейтронов.
Рассмотрим пример с изотопами лития. Самостоятельно посчитайте количество нейтронов у каждого изотопа. Найдите тот, который
включен в таблицу Д.И. Менделеева.

© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
У
этого термина существуют и другие значения, см. Протон
(значения).
|
Протон |
|
|
Символ |
|
|
Масса |
938,272 |
|
Античастица |
Антипротон |
|
Классы |
фермион, |
|
Квантовые числа |
|
|
Электрический |
+1 |
|
Спин |
1/2 |
|
Изотопический |
1/2 |
|
Барионное |
1 |
|
Странность |
0 |
|
Очарование |
0 |
|
Другие свойства |
|
|
Время |
>2,9×1029 |
|
Схема |
нет |
|
Кварковый |
uud |
Прото́н (от др.-гр.
πρῶτος
— первый, основной) — элементарная частица, имеющая положительный электрический
заряд и входящая в состав ядра каждого атома. Общим названием для протонов и нейтронов
является нуклон.
Свободный протон, не связанный с нуклонами, электронами и другими
частицами, является стабильным и не испытывает распада. Протон быстро
связывается с электронами, поэтому свободные протоны наблюдаются лишь при
достаточно больших энергиях или температуре среды, в состоянии плазмы. При
движении быстрых протонов в веществе они тормозятся за счёт столкновений с
ядрами и электронными облаками, производя ионизацию атомов, а затем вступают в
химическую реакцию или захватывают электрон, превращаясь в атомы водорода.
Протоны составляют более 90 % частиц, входящих в состав космических
лучей. В составе водорода протоны составляют основу молекулярных облаков,
распространённых в межзвёздном пространстве. В земных условиях атомы водорода
соединяются в молекулы, образуя газ, который используется в промышленности для
различных целей. Ускоренные протоны являются важным источником частиц в
ускорителях.
Распады нейтронов приводят к образованию протонов, электронов и
антинейтрино. Кроме этого, протоны могут излучаться некоторыми атомными ядрами
при их радиоактивном распаде.
Протоны принимают участие в термоядерных реакциях, которые являются основным
источником энергии, генерируемой звёздами. В частности, реакции pp-цикла,
который является источником почти всей энергии, излучаемой Солнцем, сводятся к
соединению четырёх протонов в ядро гелия-4 с превращением двух протонов в
нейтроны.
Содержание
- 1 Физические
свойства
- 1.1 Структура
- 1.2 Масса
- 1.3 Радиус
- 1.4 Стабильность
- 2 Химические
свойства
- 2.1 Зарядовое
число - 2.2 Ион
водорода - 2.3 Протонный
магнитный резонанс
- 3 История
- 4 Действие
протонного излучения - 5 Антипротон
- 6 Субстанциональная
модель - 7 Интересные
факты - 8 Литература
- 9 Примечания
- 10 См.
также - 11 Внешние
ссылки
Физические
свойства
Протон относится к барионам, имеет спин 1/2, электрический
заряд +1 в единицах элементарного
заряда, что равно 1,602176565(35) × 10−19 К.
Электрический дипольный момент не превышает значения 5,4 × 10−24
К•см. Электрическая поляризуемость
протона равна 1,20(6) × 10−48 м3 ,[1] а магнитная поляризуемость равна
1,9(5) × 10−49 м3.
Магнитный момент протона равен 1,410606743(33) × 10−26
Дж•Т−1, что в 2,792847356(23) раз больше
амплитуды магнитного момента нейтрона. Отношение магнитного момента протона к магнетону
Бора равно 1,521032210(12) × 10−3.
В физике элементарных частиц протон рассматривается как нуклон с проекцией изоспина
+1/2 (в ядерной физике принят противоположный знак проекции изоспина). Протон
участвует в четырёх фундаментальных взаимодействиях, среди которых гравитация, электромагнитное
взаимодействие, сильное взаимодействие,
слабое взаимодействие.
Структура
Согласно квантовой хромодинамике, протон является
фермионом со спином ½ и состоит из трёх кварков
(один d-кварк и два u-кварка). Предполагается, что кварки связаны
друг с другом посредством сильного взаимодействия, переносчиком которого
являются глюоны. В теории также допускается наличие внутри протона виртуальных
(морских) кварков. Сильное взаимодействие кварков за пределами протонов и
нейтронов превращается в ядерные силы, скрепляющие нуклоны в атомных ядрах.
Масса
Масса протона, выраженная в разных единицах, составляет:
- 1,672 621 777(74) × 10−27 кг, [2]
- 938,272 046(21) МэВ/c2, [2]
- 1,007276466812|(90) а. е. м., [2]
- 1836,152 672 45(75) массы электрона. [2]
(рекомендованные значения CODATA 2010 года, в скобках указана погрешность
величины в единицах последней значимой цифры, одно стандартное отклонение).
В стандартной модели масса трёх токовых кварков, образующих протон,
составляет около 1 % массы протона. Считается, что остальная масса протона
возникает за счёт кинетической энергии движения этих кварков и массы-энергии
глюонного поля.[3]
В квантовой хромодинамике масса
протона вычисляется наиболее точно с помощь методики, называемой КХД на решётке
или решёточной КХД. [4]
Радиус
В первом приближении распределение заряда внутри протона может быть описано
экспоненциальной функцией. [5]
Зарядовый радиус протона по данным CODATA составляет
0,8775(51) фм. [2]
К известным способам оценки радиуса протона относятся эксперименты по рассеянию
электронов, фотонов и нуклонов на протонной мишени, [6]
и эксперименты с системой из протона и отрицательного мюона. [7] В зависимости от типа эксперимента и способа
обработки результатов, получаются несколько отличающиеся величины радиуса,
требующие дополнительного объяснения.
Стабильность
Основная статья: Распад протона
Протон считается стабильной частицей, так как распад свободного протона
никогда не наблюдался. Некоторые Теории Великого объединения в физике
элементарных частиц предсказывают распад протона с
временем его жизни порядка 1036 лет. С целью определения времени
жизни протона проводились различные эксперименты в отношении возможных его
распадов на разные частицы.
Нижнее ограничение на время жизни протона — 2,1×1029 лет
независимо от канала распада, было получено в нейтринной лаборатории в Канаде (Sudbury Neutrino Observatory). [8] В эксперименте
изучалось гамма-излучение, которое могло появиться при распаде протона в
составе ядра кислорода-16.
Время жизни 6,6×1033 лет для распада протона на антимюон и нейтральный пион, и 8,2×1033 лет для
распада в позитрон и нейтральный пион дали эксперименты на детекторе в Super-Kamiokande, Япония. [9]
Несмотря на свою стабильность, протон может превратиться в нейтрон в таком
процессе, как электронный захват (или обратный бета-распад). Уравнение реакции
подразумевает излучение электронного нейтрино:
В обратной реакции бета-распада свободный нейтрон самопроизвольно, с
периодом порядка 15 минут, распадается на протон, электрон и электронное
антинейтрино.
Химические
свойства
Зарядовое
число
Протоны (вместе с нейтронами) являются основными составляющими атомных ядер.
Порядковый номер химического элемента в периодической таблице определяется зарядом
ядра его атомов, который, в свою очередь, равен количеству протонов в ядре
(протонному числу). В нейтральном атоме количество отрицательно заряженных
электронов в электронной оболочке атома и количество положительно заряженных
протонов в ядре атома одинаково и суммарный заряд атома равен нулю. Химические
свойства атомов зависят от количества имеющихся у них электронов, поэтому можно
считать, что зарядовое число характеризует и химические свойства.
Кроме зарядового числа, у атомов в ядре имеется некоторое число нейтронов. В
зависимости от числа нейтронов, ядра с одним и тем же зарядовым числом
принадлежат тому или иному изотопу химического элемента.
Ион
водорода
Ядро атома водорода состоит из одного протона. Протон в химическом смысле
является ядром атома водорода (точнее, его лёгкого изотопа — протия) без электрона.
В физике протон обозначается буквой p (или p+). Химическое обозначение протона
(рассматриваемого в качестве положительного иона водорода) — H+, астрофизическое
— HII.
Свободный протон является химически активным реагентом и потому имеет малое
время жизни в химических системах, где быстро захватывает электронное облако у
какой-нибудь молекулы. В водных растворах водород образует гидроксоний,
H3O+, который затем может войти в более сложные катионы с
молекулами воды, например в [H5O2]+ и [H9O4]+.[10]
В протонной теории Брёнстеда — Лоури
кислоты являются донорами протонов, а основания – акцепторами протонов. В
химической реакции, сопровождающейся переносом протона, всегда имеется и кислота
и основание. В биохимии используется термин протонный насос, обычно для
обозначения мембранного белкового аппарата, служащего для переноса гидроксония через мембраны клеток и митохондрий.
Ионы тяжёлого водорода, дейтерия и трития, лишённые электронов, называются дейтрон
и тритон, соответственно.
Протонный
магнитный резонанс
В химии связанные в молекулах протоны могут быть обнаружены и исследованы с
помощью протонного магнитного резонанса. В этом методе используется эффект
переворота спина
протонов под действием радиоизлучения соответствующей частоты.
История
В 1815 году Уильям Праут предположил, что все
атомы состоят из атомов водорода, основываясь на том, что относительная атомная
масса химических элементов приблизительно пропорциональна целым числам. Более
точные измерения показали, что гипотеза Праута
неверна. В 1886 году Eugen Goldstein
открыл анодные (каналовые) лучи и показал, что они
являются потоком положительно заряженных ионов, образующихся в газе. Отношение
массы к заряду ионов у разных газов оказалось различным, достигая минимума у
водородных ионов. В 1896 в катодных лучах был открыт отрицательно заряженный электрон.
После открытия Резерфордом атомных ядер в 1911 году, Антониус
ван ден Брук
предположил, что атомный номер химического элемента, задающий положение
элемента в периодической таблице, равен заряду ядра. Генри Мозли
подтвердил это экспериментально в 1913 году с помощью рентгеноспектрального
анализа.
Открытие протона относится к 1917 году, когда Резерфорд своими
экспериментами доказал, что ядро водорода присутствует также в других атомах. [11] До этого Резерфорд обнаружил ядра водорода с
помощью сцинтилляционных счётчиков в водородном газе, после облучения газа
альфа-частицами. Облучение альфа-частицами воздуха и азота также производило
ядра водорода. При столкновении альфа-частицы с ядром азота возникает
кислород-17 и вылетает протон, ядерная реакция записывается следующим образом: 14N
+ α → 17O + p.
Открытия Резерфорда показали, что не весь атом водорода, как это предполагал
Праут, а только ядро водорода, является наименьшей и
универсальной частицей, входящей в состав каждого ядра. Резерфорд
выбрал для наименования ядра водорода два названия – протон, основываясь
на греческом слове πρῶτον,
то есть первый, и prouton, в честь Праута. [12] В 1920 году
Британская ассоциация развития науки остановила свой выбор на слове протон,
учитывая также название protyle, которое дал Праут водородному атому как универсальному объекту для всех
атомов в своей гипотезе.
Действие
протонного излучения
Комплект научных инструментов для исследования лунной поверхности по
программе «Аполлон» ALSEP определил, что более 95 % частиц в солнечном
ветре представляют собой поровну протоны и электроны. [13] [14]
Поскольку спектрометр солнечного ветра делает непрерывные измерения, стало
возможным измерить, как магнитное поле Земли действует на прилетающие частицы
солнечного ветра. Приблизительно две трети своей орбиты Луна проходит за
пределами основного магнитного поля Земли. При этом концентрация протонов
колеблется от 10 до 20 штук в кубическом сантиметре, а скорости протонов лежат
в интервале 400 – 600 км/с. В
течение 5 дней Луна находится в геомагнитном поясе нашей планеты, где обычно
частицы солнечного ветра отсутствуют. В остальное время Луна находится в
промежуточном поясе, в магнитной оболочке, где магнитное поле Земли заметно
действует на солнечный ветер. Здесь скорости протонов уменьшаются до 250 – 450
км/с, поток протонов снижается. Когда на Луне ночь, спектрометр закрывается от
солнечного ветра Луной и протоны не регистрируются. [13]
Основными источниками солнечных протонов являются корональные
выбросы массы. Протоны возникают также в других звёздах и видны в составе
галактических космических лучей, где их доля достигает 90 %. Эти протоны
могут иметь очень большие энергии по сравнению с солнечными протонами, а их
поток заметно более однородный и изотропный.
В потоках протонов космические корабли приобретают положительный заряд.[15]
Протоны могут оказывать негативное действие на здоровье людей, особенно в
космосе. [14] [16]
Проводимые исследования нацелены на определение того, какие хромосомы могут
повреждаться потоками протонов, приводя к раковым заболеваниям. [14] Изучаются также нейрохимические и
поведенческие нарушения, включая функции гормона дофамина, действие амфетамина, память и пространственную ориентацию. [16] Разрабатываются методы защиты от
солнечных вспышек и галактических космических лучей. В космическом полёте Спейс Шаттла «Колумбия» по
программе STS-65 и в аналогичных советских программах проводились различные
медико-биологические исследования, включая влияние излучения протонов и тяжёлых
ионов на микроорганизмы. [17]
Антипротон
Основная статья: Антипротон
CPT-инвариантность связывает между собой частицы и античастицы, так что
свойства антипротона могут быть определены через свойства протона. Сумма
зарядов протона и антипротона должна равняться нулю, что было проверено с
точностью 1 к 108, и с такой же точностью получено равенство их
масс. Ловушка Пеннинга позволяет улучшить результат
для отношения масс до точности 1 к 6 •109. [18]
Магнитный момент антипротона равен магнитному моменту протона с точностью 8
•10–3 ядерного магнетона, и противоположен по направлению.
Субстанциональная
модель
В теории бесконечной вложенности
материи предполагается, что на уровне атомов и частиц действует сильная гравитация, удерживающая
вещество элементарных частиц от распада, соединяющая нуклоны в ядрах и участвующая
в образовании связей электронов с ядрами атомов. Рассматривается также модель кварковых
квазичастиц, согласно которой кварки являются не настоящими частицами, а
квазичастицами, пригодными лишь для описания свойств симметрии элементарных
частиц. Отсюда следуют гравитационная
модель сильного взаимодействия и субстанциональная
модель протона. При известной величине постоянной сильной гравитации становится
возможным вычислить радиус протона м. [19] и объяснить квантовый спин протона на основе
равенства полного потока энергии гравитационного поля и потока кинетической
энергии вращающегося вещества протона. [20]
Интересные
факты
- Отношение масс протона и электрона, равное 1836,152 672
45(75) [2], с точностью до 0,002%
равно значению - Ультрарелятивистские
протоны (как и любые другие адроны, а также атомные ядра) для неподвижного
наблюдателя имеют форму двояковогнутой линзы [21].
Литература
- Все известные свойства протона систематически изложены
в публикации Particle Data
Group. [2](англ.)
Примечания
- Yao W.-M. et al.,
(Particle Data Group), Physics Letters, Vol. B667, P. 1 (2008) and 2009
partial update for the 2010 edition. [1] - а б в г д е
P.J. Mohr, B.N. Taylor, and
D.B. Newell (2011), «The 2010 CODATA Recommended Values of the
Fundamental Physical Constants» (Web Version 6.0). This database was
developed by J. Baker, M. Douma, and S. Kotochigova. Available: http://physics.nist.gov/constants [Thursday, 02-Jun-2011 21:00:12 EDT]. National
Institute of Standards and Technology, Gaithersburg, MD 20899. - Quarks and Nuclei. — World Scientific, 1984. — С. 65–66. — ISBN 9971-966-61-1>
- S. Dürr, Z. Fodor, J. Frison, C. Hoelbling, R. Hoffmann, S. D. Katz, S. Krieg, T. Kurth, L. Lellouch, T. Lippert, K. K. Szabo, and G.
Vulvert (21 November 2008). «Ab Initio Determination of Light Hadron
Masses - Fundamentals in Nuclear Physics. — Springer, 2005. — ISBN
0-387-01672-4> - Ingo Sick. On the rms-radius
of the proton. Phys.Lett.B576:62-67,2003. - Randolf Pohl at all. The size of the proton. Nature, 2010, Vol. 466, P. 213–216.
- S.N. Ahmed et
al. (SNO
Collaboration) (2004). «Constraints on nucleon decay via invisible modes from
the Sudbury Neutrino Observatory». Physical Review Letters 92 (10). DOI:10.1103/PhysRevLett.92.102004. PMID 15089201. - H. Nishino et al (Kamiokande
collaboration) (2009). Search for Proton Decay via p → e + π0 and p → μ + π0 in a Large Water Cherenkov Detector. Physical Review Letters 102 (14): 141801. doi: 10.1103/PhysRevLett.102.141801. - Headrick, J.M.; Diken, E.G.;
Walters, R. S.; Hammer, N. I.; Christie, R.A. ; Cui, J.; Myshakin, E.M.; Duncan, M.A.; Johnson, M.A.; Jordan,
K.D. (2005). «Spectral Signatures of Hydrated Proton Vibrations in
Water Clusters». Science 308 (5729): 1765–69. DOI:10.1126/science.1113094.
PMID
15961665. - R.H. Petrucci, W.S.
Harwood, and F.G. Herring. General Chemistry. 8th edition. page 41. (2002). - Romer A (1997). «Proton or prouton?
Rutherford and the depths of the atom». Amer. J. Phys. 65 (8). DOI:10.1119/1.18640. - а б
«Apollo 11 Mission». Lunar and Planetary Institute. 2009.
Retrieved 2009-06-12. - а б в
«Space Travel and Cancer
Linked? Stony Brook Researcher Secures NASA Grant to Study Effects of
Space Radiation». Brookhaven National Laboratory. 12 December 2007.
Retrieved 2009-06-12. - N.W. Green and A.R. Frederickson. «A Study of Spacecraft
Charging due to Exposure to Interplanetary Protons». Jet Propulsion Laboratory.
Retrieved 2009-06-12. - а б
B. Shukitt-Hale,
A. Szprengiel, J. Pluhar,
B.M. Rabin, and J.A. Joseph. «The effects of proton
exposure on neurochemistry and behavior«. Elsevier/COSPAR. Retrieved
2009-06-12. - Space and life: an introduction
to space biology and medicine. — CRC Press, 2004. — С. 135–138. — ISBN 0-415-31759-2> - G. Gabrielse (2006).
«Antiproton mass measurements». International Journal of Mass Spectrometry 251 (2–3): 273–280. DOI:10.1016/j.ijms.2006.02.013. - Fedosin S.G. The radius of the proton in the self-consistent model. Hadronic
Journal,
2012, Vol. 35, No. 4, P. 349 – 363; статья на русском
языке: Радиус протона в самосогласованной
модели. - Комментарии к книге: Федосин
С.Г. Физические теории и бесконечная вложенность материи. Пермь, 2009, 844
стр., Табл. 21, Ил.41, Библ. 289 назв. ISBN 978-5-9901951-1-0. - ↑ Иванов И. «Какую
форму имеет быстро летящий протон?» = B. Blok, L. Frankfurt, M. Strikman. On
the shape of a rapid hadron in QCD.
«. Science 322
(5905): 1224–7. DOI:10.1126/science.1163233. PMID 19023076.
См. также
- Антипротон
- Нейтрон
- Субстанциональная
модель нейтрона - Субстанциональная
модель протона - Водород
- Протон-протонный цикл
- Список частиц
- Электрон
- Субстанциональная
модель электрона - Позитрон
- Модель кварковых квазичастиц
- Сильное взаимодействие
- Гравитационная
модель сильного взаимодействия - Константа
взаимодействия - Партон
- Преон
- Водородная система
Внешние
ссылки
- Particle
Data Group - Large
Hadron Collider - Eaves,
Laurence; Copeland, Ed; Padilla, Antonio (Tony) (2010). The shrinking proton. Sixty Symbols. Brady Haran for the University of Nottingham.
В древние времена считалось, что все состоит из земли, воды и воздуха, другого — нет. И сравнительно недавно люди смогли показать всю составляющую нашего мира. Важным вопросом было: что из себя представляет вещество?
Вещество — это материя, которая есть во всех физических телах на нашей планете.
Оно может быть простым и сложным.
Различие этих двух групп состоит в том, что простые вещества состоят из одного вида атомов, а сложные — из нескольких, поэтому впервые в ходе реакций не могут раскладываться на другие атомы, как это делают вторые.
Образцом сложного вещества можно назвать воду (H2O). Если провести химическую реакцию, то оно образует 2 элемента — водород (Н) и кислород (О). То, что получилось, — простые вещества, без последующего разложения.
В 19 веке считалось, что сами элементы не поддаются изменениям и независимы от объединения. Но такие высказывания были опровергнуты русским химиком Дмитрием Ивановичем Менделеевым, который доказал обратное, при этом указав на то, что качественная характеристика каждого элемента влияет на его атомный вес, из-за чего происходит повтор их свойств. Это умозаключение он олицетворил в своей периодической системе, назвав в честь себя.
Атом
Атом — мелкая частица, которая не разлагается в реакции на другие компоненты.
Есть что-то меньше вещества — это атомы.
Атомы можно различать по нескольким параметрам (приведем самые распространенные):
- Масса;
- Размер;
- Физические хар-ки;
- Химические хар-ки;
- Энергия;
- Вес атома.
Любой атом отличается от частицы другого элемента. Если сравнить атом водорода (Н) с атомом кислорода (О), то, очевидно, что у них будет несоответствие по многим характеристикам.
Размер атома
Если сравнить размеры атома и составляющих его частиц, то первый преобладает по своим масштабам. Ядро атома — ничто, по сравнению с ним самим. Взяв один кубический метр платины (Pt) и сплюснув его до такого состояния, где атомные расстояния просто бы исчезли, то он его кубический метр превратился бы в кубический миллиметр.
Из определения атома следует, что это маленькая частица. По форме они напоминают шар, а размер их поперечников составляет стомиллионную долю сантиметра. Чтобы это было нагляднее, рассмотрим поперечник атома водорода (Н), считающийся самым маленьким. Его размер составляет 10-8 доле сантиметра. Большим атомом является уран (U), чья величина составляет 3 х10-8 долей сантиметра.
Масштаб и вес атомов небольшие.
Вес атома
Чтобы посчитать вес какого-либо элемента, принято использовать 0,0625 долю кислорода (О), которая показывает насколько значение этого элемента больше. Если обратиться к таблице Менделеева, то можно увидеть под номерами всех элементов цифру, обозначающую атомный вес. Например, у водорода (Н) он составляет 1,008 (значение округляется, поэтому 1),а у радия — 226,025 (или же 226).Тут можно проследить разницу веса.
На заметку: при работе с периодической таблицей учтите, что если у вещества номер выше, тем вес атома будет больше.
Чаще всего у многих их вес будет дробный. Это объясняется тем, что они вмещают определенное количество частиц со своим весом, но признаки у всех абсолютно идентичны. Но такое не только у атомов. То же самое есть и самих элементов. Их называют изотопами.
Изотопы — химические элементы, занимающие один порядковый номер, но разную массу ядер.
Изотопы есть практически у каждого элемента (у кальция (Са) их целых четыре), при этом, чаще всего, их выводят искусственным путем.
Элементарные частицы
Протоны, нейтроны
Протоны — положительно заряженные части ядра. Заряд равен заряду электрона. Вес составляет 0,0625 грамм.
Нейтроны — нейтральная часть ядра. Чтобы узнать их значение, нужно из атомного веса элемента вычесть значение протонов (= электронов).
Поскольку электроны отделены от своих “напарников”, кружась вокруг них, стоит уделить им отдельное внимание.
Электроны
Электроны — частицы, у которых самый маленький отрицательный электрический заряд.
До настоящего времени считалось, что атомы, разложенные из элементов, являются конечным продуктом. На сегодняшний день эта мысль была развеяна учеными, которые доказали, что даже эти разложенные атомы содержат в себе крохотные молекулы.
Обратимся к одной из гипотез, объясняющую вещественную структуру. Там говорится, что элементный атом — некая совокупность, где есть центр, вокруг которого происходит вращение других крупинок.
Начнем с рассмотрения окраин центра, а именно с электронных уровней и электронов.
Как и говорилось ранее, значение электронов такое же, как и у протонов.
Их можно сравнить с шаром , а диаметр 40-13 сантиметров (что доказывает свою мизерность по сравнению с обычными атомами).
Электроны способны находиться в бездействии. Их масса при этом составляет 91-27 грамм. Это подчеркивает скудность инертных свойств, благодаря которым электроны способны быстро вращаться вокруг свой оси.
Масса электрона зависит от его скорости. Поговорив про массу “покоя”, которая есть у всех тел на Земле, нужно посмотреть и на массу “скорости”. Когда электрон занимается перемещением, то он образовывает электромагнитное поле. Оно играет большую роль, ибо именно из-за проявления ее инертных свойств набирается масса и энергия, передавая это все частицам. Сделаем вывод, что ускоренный динамизм этой частицы, приводит к набору его веса.
Но перемещение электронов не происходит ровно. Научно доказано, что эти частицы двигаются волнообразно из-за интерференции и дифракции.
Интерференция электронов — слияние нескольких волн электронов.
Дифракция электронов — волновое обтекание области места, через которое проходит ток.
Помимо того, что электроны двигаются волнами, так еще они крутят вокруг самих себя. Крутящееся и волновое движение говорит о нем (электроне) как о некоем магните.
Все три вида элементарных частиц фигурируют в постоянном обменивающемся контакте. Между электроном и протоном возникает связь, заставляющая их содействовать, поскольку их заряды противоположны, а вот две одинаковые частицы (например, два электрона) отталкиваются, т.к. заряды одинаковы (так же и у протона).
Нахождение частиц у элемента
Найти у какого-либо элемента эти частицы несложно. Разберем это на примере алюминия (Al).
Его порядковый номер — 13, соответственно, это есть ядро. Атомная масса алюминия составляет 26,98154 (значение округляется, поэтому 27). Протоны равны массе заряда (р=13), так же и электроны (е=13). Чтобы узнать значение нейтронов, нужно из атомной массы вычесть значение заряда ядра (n=27-13=14).
Взаимосвязь частиц
Каждая частица имеет свое электрическое поле, через которое оно “соприкасается” с остальными. Такие поля можно обозначить определенной материей, в которой, помимо этих частиц, есть и другие, наполняющие эту материю — фотоны.
Фотон — частица, не имеющая массы. Является переносчиком электромагнитного “общения”.
Все они имеют конкретный запас энергии. Именно через фотоны происходит коммуникация частиц. В такой связи происходит “бартер” фотонами, что служит для хорошей энергетической силы, то есть взаимосвязи частиц.
И в самом ядре происходит “общение” протона и нейтрона, но здесь уже нет электрического поля, поскольку нейтрон его не образовывает. Здесь все проходит при помощи особого поля, исходящего от ядра.
Ядерное поле — вид материи, который состоит из протонов, нейтронов и мезонов.
Мезон — частица, которая способствует взаимодействию протонов и нейтронов, а также влияет на то, чтобы эти частицы оставались в ядре.
Благодаря мезонам, протоны и нейтроны способны внутри своего ядра передавать определенную информацию путем ядерной силы. Ее работа в ядре происходит на определенной дистанции (приблизительно сантиметров).
Ядерная сила — сила влияния протона и нейтрона друг на друга.
Ядерные силы, происходящие внутри ядра, способны делать из протонов нейтроны и наоборот при помощи мезонов.
Можно сказать, что ядерные силы намного мощнее электрических, но вместе они не дают протонам выйти за границы ядра. Несмотря на то, что частицы сопротивляются, объединение двойной силы подавляет их, при этом создавая крепкое ядро. Из-за них и зависит его прочность.
Все три частицы называются элементарными, потому что их невозможно разложить на другие упрощенные элементы, но они могут становиться и образовываться друг из друга.
Химическое строение атомов
Работа электрона
Структура водорода (Н) заслуживает внимания. Это единственный элемент, который содержит в себе две частицы — один протон, находящийся в ядре, и один электрон, вращающийся вокруг него. Но даже тут есть нюанс: у электрона нет определенного барьера, отгораживающего его от окружающей среды.
Путь электрона вокруг ядра достаточно пластичен и поддается изменениям (причиной может стать увеличение массы электрона). А поскольку в ядре и на оболочке противоположно заряженные частицы, то они имеют свойство присоединяться. Но есть один момент: когда отрицательно заряженная частица облетает ядро, то образовывается центробежная сила, которая пытается максимально отдалить частицу. Все эти моменты создают спорную ситуацию.
Самое важное, чтобы была стабильность, тогда электрон будет спокойно находиться на своем месте. Поскольку вес орбитальной частицы небольшой, то для стабилизации ему придется летать возле ядра намного быстрее (примерно 60 15 облетов).
Получается, что электрон водорода (Н) находится неподалеку от протона, сохраняя минимум своей энергии. Но если какая-либо частица вторгнется в данную схему, и водород (Н) отдалится от ядра, то его энергия станет больше, но не надолго. Дело в том, что электрон все равно будет пытаться вернуться на место, приближенное к ядру. Электрон таким действием (переходом на другую орбиту) предоставил определенную часть своей энергии — лучистой энергии.
Если электрону дадут энергию, то он перейдет на другое место (чем больше энергии, тем дальше от протона). При этом, когда он будет возвращаться к ядру, то будет происходить активная выработка электромагнитной энергии с последующем излучением.
Когда ученые наблюдали за такими переходами этой частицы, они сделали вывод, что как и в любом элементе, так и в водороде (Н) электрон может совершать отойти только на конкретный круг, опираясь на полученное извне питание.Слои, на которых электрон способен перемещаться, называют дозволенными.
Работа протона и нейтрона в ядре
Как говорилось ранее, протон и электрон водорода (Н) — разноименные и аналогичные по значениям, поэтому их совместный заряд составляет — ноль. Из этого выходит, что водород (в обычном его состоянии) — нейтральная частица.
Такой вывод относится ко всем элементам из таблицы Менделеева. Все их атомы в нормальном состоянии нейтральны из-за равновесия разных зарядов.
Вернемся к ядру водорода (Н). Известно, что в нем находится только один протон. Обратимся к массе ядра.
Масса ядра — общее число протонов и нейтронов внутри ядра. Ее можно найти у всех элементов периодической таблицы.
Согласно этому, масса ядра водорода тоже будет составлять один (так как есть 1 протон и полностью отсутствуют нейтроны).
Что говорилось выше, относилось к природному водороду (Н), равному единице. Но существует еще и тяжелый водород (Н) — он же изотоп дейтерий (2H, имеет название тяжелого водорода). Масса равна двум. Если в ядре простого водорода (Н) всего лишь один протон, то у дейтерия — дейтоны.
Дейтон — объединение протона и нейтрона в ядре.
Водород и его изотопы
В природе обычный водород (Н) может вмещать в себя дейтерий, но в очень маленьком количестве (на 6 000 атомов Н один 2H). Но есть еще более тяжелый изотоп водорода (Н) — тритий (³Н, сверхтяжелый водород). В его ядре уже не одна, и не две частицы, а три — два нейтрона и один протон, между которыми есть ядерная сила. Масса трития составляет три. Получается, что он в целых три раза превосходит самый легкий водород.
Несмотря на то, что вес водорода и его изотопов различается, их объединяют некоторые общие свойства. Например, если самый простой водород (Н) вступит в связь с кислородом (О), то получится вода (Н2О). То же самое происходит и в цепи дейтерия ( 2H) и кислорода (О). У этого изотопа тоже на выходе получается вода, но тяжелая, которая пользуется спросом в производстве атомной энергии.
Читайте про свойства магнитного поля.
Из примера можно сделать вывод, главную роль в химических свойствах играет электронная оболочка и ее устройство, а не массу ядра. Водород и его изотопы несут в себе разную массу, но общее у них — это электроны возле ядра, которые и сохраняют идентичные свойства.
Водород (Н) взял первое место в менделеевской таблице. Такое решение было неслучайным. Как мы знаем, порядковый номер напрямую зависит от числа заряда ядра. То же самое и у водорода (Н) (номер в таблице — один = заряд ядра — один). Если правильно сказать, то: всякое вещество, занимающее место в периодической таблице Менделеева, имеет свой порядковый номер, соотносящийся заряду ядра и числу электронов на его оболочках.
Из всего сказанного получается, что водород (Н), занимающий первое место, имеет заряд ядра — +1 и один электрон на орбите.
Гелий и его изотопы
На втором месте в таблице стоит гелий (Не). Как и говорилось ранее про все элементы, его номер и заряд ядра однозначны, поэтому второй будет равен +2 (внутри ядра два протона), а оболочка будет содержать два электрона.
Как и все составляющие таблицы, гелий (Не) имеет изотопы. Их целых девять, но самыми стабильными из них считаются легкий и тяжелый, поэтому ими пользуются чаще. Рассмотрим первый.
Легкий гелий (³Не, еще имеет название гелион). Масса его ядра составляет 3, состоит из двух протонов, одного нейтрона и трех электронов на оболочке. Считается, что содержание гелиона в природном гелии 1/1 000 000 тяжелого гелия. Выводится искусственным путем.
Тяжелый гелий (⁴Не). Считается самым востребованным из всех изотопов гелия (Не). Ядро содержит два протона и два нейтрона, а на орбитах расположены четыре электрона.Образовывает около 99% гелия на нашей планете. Есть забавный факт про это вещество: если охладить его (-271 ºС) и поместить в открытую емкость, то этот изотоп вытечет из нее.
Затруднение состава атома в элементе обусловлено возрастанием объема элементарных частиц: протонов и нейтронов в ядре и электронов на оболочке. При помощи таблицы Менделеева можно узнать все эти необходимые данные об элементе (а именно про частицы).
В науке доказано, что легкие элементы имеют большое преимущество: их ядра, содержащие одинаковое количество протонов и нейтронов, считаются самыми крепкими, поскольку ядерная сила превышена, чем у остальных. Рассмотрим тяжелый гелий (⁴Не). В его составе располагаются два протона и два нейтрона, соответственно, у него неплохая прочность, точно так же, как и возникающая сила ядра.
Такие тяжелые вещества содержат разное количество частиц (протонов, нейтронов и электронов), из-за чего в ядре контакт между ними теряется, чего не происходит в легких. В тяжелых элементах возможно расщепить их ядра при разрыве атомных бомб.
Радиоактивные элементы
У тяжелых элементов есть и подразделение радиоактивных. Они отличаются тем, что их ядра настолько непрочны, что они способны самостоятельно расщепляться на отдельные частицы. Радий (Ra) — самый известный радиоактивный химический элемент. Его порядковый номер — 88. Масса атома равна 226 (если быть точнее, то 226,025).
Состав протонов в ядре — 88, а нейтронов — 138. Все они занимаются распадом, где позже они трансформируются в атомы радона (Rn, радиоактивный газ, номер в периодической таблице — 86). Все происходит точно так же: атомы радона (Rn) занимаются распадом, после чего тоже преобразовываясь в другие элементы.
Электронные оболочки
Электронные оболочки — это тоже важная часть, без которой представление какого-то химического элемента просто не было бы. Как было рассмотрено ранее, электроны единственные, кто размещен за ядром, при этом крутится вокруг него, собираясь определенными группами по разным “отсекам”.
Познание с ядрами и их частицами подошло к концу, поэтому теперь стоит уделить внимание тому, что находится за пределами этой главной точки.
Нахождение электронных оболочек и его содержимого
Чтобы определить количество электронных слоев элемента, нужно обратиться к его номеру периода. Например, алюминий (Al) с порядковым номером 13, находится в третьем периоде, поэтому число его слоев равно 3.
Еще одной удивительной характеристикой оболочек является закрепленное число электронов, которые могут находиться на слое. На первой орбите могут расположиться два электрона, на втором — восемь, на третьем — 16 и т.д. (с каждым разом нужно умножать на четыре).
Завершенным считается тот слой, который достиг окончательного предела. Электроны, которые расположены дальше всего от ядра, более активны, поэтому предпочитают вступать в контакт с другими атомами (научно это можно назвать валентностью). Число электронов на внешней оболочке зависит от номера группы. Например, бор (В) имеет заряд — +5, он находится во втором периоде, поэтому количество электронных слоев равно двум. Первый слой равен двум, а второй — трем, поскольку бор (В) находится в 3 группе.
Когда электронный слой полностью заполнен, то он считается стабилизированным. Это говорит о том, что атому не требуется брать дополнительные силы (электроны) из окружающей среды или других веществ. Если взять гелий (Не), у которого два электрона, находящиеся на одной оболочке, а у неона (Ne) электронов десять, располагающиеся на двух электронных слоях(на первом — 2, на втором — 8). Из этого выходит, что и гелий, и неон полностью заполнены, поэтому они не нуждаются в посторонней помощи, так как их оболочки завершенные. Такие элементы являются инертными в химическом плане (не идут на контакт с другими элементами, чтобы “занять” или “обменяться” этими частицами).
Но таких самодостаточных элементов достаточно мало, больше всего тех, где на внешней оболочке будет не хватать электронов, поэтому такие элементы охотнее прибегают к воздействию с другими. Калий (К) имеет 19 электронов, находящихся на четырех слоях (первый — 2, второй — 8, третий — 8, четвертый — 1). Больше всего интересует последняя оболочка. Поскольку там всего лишь один электрон, который очень далеко от ядра, то последнее не в силах удержать электрон, поэтому он с легкостью может перейти к другому элементу.
Если же взять кислород (О), у которого восемь электронов и две электрические оболочки (на первом — 2, на втором — 6). Как видно, второй слой является незавершенным, до предела ему не хватает еще двух частиц. Кислород пытается сохранить недостающее число, а также найти два электрона, чтобы завершить свой последний круг. Это может произойти в реакции с другими элементами, у которых внешний слой тоже является незавершенным и достаточно отдаленным от ядра, чтобы тот, в свою очередь, не пытался что-либо удержать.
Элементы с проблемой недостатка электронов довольно энергичны в реакциях друг с другом, поскольку у них есть потребность в присоединении или отдаче нужного числа электронов.
Распределение электронов по слоям
Размещение электронов на оболочках происходит в установленном для них порядке. Если же получается, что частица изменяет свое местонахождение или число, то электронный слой просто меняется (а именно его физические и химические свойства).
Одинаковое число протонов и электронов в элементе является доказательством того, что общий заряд (электрический) равняется нулю.
Ионы
Изменение количества двух этих частиц способно привести к тому, что атом преобразуется в электрически заряженный.
Если же у атома возникает проблема с большим объемом электронов, он меняется на отрицательный ион.
Ион — заряженная молекула. Ионы бывают катионами и анионами. Есть во всех веществах.
Катион — положительный ион.
Анион — отрицательный ион.
Хлор (Cl), который вобрал в себя всего лишь один электрон, превращается отрицательным ионом (или же анионом). Такой ион будет считаться однозарядным, так как вместил в себя одну частицу. Писаться он будет уже так: Cl⁻.
Кислороду (О), чтобы стать отрицательным ионом, нужно присоединить два электрона. Он будет считаться двухзарядным. Записываться будет вот так: О⁻.
Когда атом превращается в ион, то для окружающего мира он является системой, которая электрически заряжена, что подразумевает появление определенного электрического поля, объединяющее и сам атом, и все происходящее в его зоне контроля. Это электрическое поле позволяет атому контактировать с другими такими же частицами, имеющими заряженность (ионы, электроны и т.д.).
Как и в остальных случаях, ионы, обладающие разными зарядами, притягиваются химически, что приводит к появлению новых, сложных частиц. Ими считаются молекулы.
Окисление
Степень окисления — заряд элемента, находящегося в соединении, который вычислен путем того, что в соединении ковалентная полярная связь превратилась в ионную.
Окисление — важная часть в образовании новых соединений.
Частицы в реакциях
Когда происходит химическая реакция, электроны либо объединяются, либо переходят к более отрицательному атому, чтобы стать заряженными.
Если бы вещества состояли только из ионов, то их заряды имели целые числа, которые равнялись бы количеству электронов (отданных или не отданных). Рассмотрим хлорид натрия (NaCl). Хлор (Cl) отнимает у натрия (Na) один электрон, при этом два элемента становятся ионами, но с разными зарядами. Натрий (Na) становится положительным, то есть катионом (записывается Na⁺¹), а хлор (Cl) — отрицательным, то есть анионом (записывается Cl⁻¹). Перейдем к соляной кислоте (HCl).
В этой паре хлор (Cl) считается самым отрицательным в электрическом плане, поэтому все два электрона (от водорода (Н) и от него) больше направлены к хлору (Cl), а если электрон водорода (Н) перейдет к хлору, что заряды будут полными, а не частичными как в первом случае. Правильная запись выглядит вот так: H+1CI-1.
Эти надстрочные значки и являются степенью окисления.
Правила записи степени окисления
Чтобы правильно записать степень окисления, нужно знать несколько правил:
- Степень окисления располагается над элементом справа;
- Первым делом записывается знак заряда (плюс или минус), не записывать его нельзя, это считается грубой ошибкой;
- После знака следует само значение;
- Даже если степень окисления равна +1 или -1, то она так и записывается без сокращения ( с сокращением, то есть + или -, пишутся только ионы);
- Заряд ионов записывается над ними справа;
- На первом месте в написании заряда стоит значение, а уже только потом знак.
Пример степени окисления: H+2O-2
Пример заряда иона: AL3+ii.
Вычисление степени окисления
Вычисление степени окисления проводится по некоторым пунктам, которых стоит придерживаться:
1.Есть элементы, у которых степень окисления неизменна, к ним относятся:
- щелочные металлы (степень окисления всегда +1);
- металлы из 2А группы (+2);
- алюминий (FI+3) и бор (B+3);
- фтор (F-1);
- часто кислород (О) имеет степень окисления — 2, но есть исключение у пероксидов, где у кислорода (О) -1;
- водород (Н). С неметаллами его степень равна +1, с металлами — -2.
2. Остальное в периодической таблице с плавающей степенью. Если рассмотреть хлор (Cl), то его значения нечетны: начиная от -1, заканчивая +7 (сюда входит +1, +3, +5). А вот у серы (S) все наоборот — она имеет лишь четные: от -2 до +6 (входит +2, +4).
Главное правило: если сложить все степени из соединения, то должен получиться ноль. Также, если состав какого-либо вещества из одного элемента, то его степень будет нулем.
Бывает такое, что соединение из трех составляющих. Ни в коем случае нельзя делать так, как в соединении двух элементов. Значение первого и последнего элементов известны, а значение третьего нужно считать по специальной формуле.
Пример
Возьмем Н3РО4 (фосфорная кислота).
Из правила водород (Н) будет +1, а кислород (О) — -2, осталось узнать о фосфоре (Р). Мы должны сложить все известные значения.
Здесь будем использовать уравнение.
(+1) × 3 + Х + (-2) × 4 = 0
Х = +5
Мы знаем, что сумма всех элементов должна быть нулем, поэтому приравниваем весь пример ему. Перед водородом (Н) стоит цифра 3, поэтому его степень умножаем на это число, то же самое и с кислородом (О). Фосфор (Р) у нас неизвестен, поэтому обозначаем его иксом. Дальше решаем обычным уравнением и вписываем полученное значение над ним.
Если говорить про степень окисления и валентность, то это абсолютно разные вещи. Первое имеет отрицательное или нулевое значения, а второе только положительное.
Ключевые мометы
Эта тема переплела два ответвления — физику и химию, показывая всю многогранность нашей природы и взаимосвязь этих наук. Как мы поняли, некоторые моменты до сих пор непонятны нам, но ученые не останавливаются на достигнутом, продвигаясь дальше. Данный предмет обсуждения, находящийся в этой работе — базовые понятия, написанные доступным языком.
Этот материал разбирал такие маленькие, но важные для нас моменты — атомы, которых мы не видим, хотя они влияют на все вокруг, даже на нас самих.
Чтобы лучше усвоить материал, здесь собраны ключевые моменты из текста, требующие особого внимания:
- Вещества бывают простыми и сложными;
- Атомы — это неразлагающиеся мелкие частицы;
- Чем выше порядковый номер у элемента, тем больше его атомный вес;
- Изотопы — химические элементы под одним порядковым номером, но с разной массой ядер. Есть у любого элемента;
- У атомов есть частицы (элементарные): протоны, нейтроны, электроны;
- Протоны — положительно заряженные частицы, находящиеся в ядре;
- Нейтроны — беззарядные частицы;
- Электроны — частицы, с самым маленьким отрицательным электрическим зарядом;
- Значение протона равно значению электрона;
- Чем быстрее скорость электрона, тем его масса больше;
- Движение электрона волнообразное, упорядоченное, при этом он вращается;
- Интерференция электронов — слияние нескольких волн электронов;
- Дифракция электронов — волновое обтекание области места, через которое проходит ток;
- Порядковый номер — это заряд ядра;
- У каждой частицы есть электрическое поле, позволяющее взаимодействовать с другими частицами;
- Фотон — переносчик электромагнитного “общения” частиц;
- Ядерное поле — вид материи, который состоит из протонов, нейтронов и мезонов.
- Мезон — частица, позволяющая протонам и нейтронам контактировать, а также удерживает их внутри ядра ядерной силой;
- Ядерная сила — сила влияния протона и нейтрона друг на друга;
- Ядерные силы могут из протонов нейтроны и наоборот при помощи мезонов;
- Ядерные силы мощнее электрических;
- Протон, нейтрон и электрон называются элементарными, потому что их невозможно разложить на более простые частицы, но они могут становиться друг другом и образовываться друг из друга;
- Если электрон отдалится от ядра, то он ненадолго образует энергию, но все равно вернется на свое место, тоже образовывая энергию, переходящую в излучение;
- Дозволенные слои — орбиты, на которые электрон может переходить;
- Дейтон — объединение протона и нейтрона в ядре;
- Легкие элементы считаются лучше, потому что их ядра прочнее из-за одинакового числа частиц;
- Число электронных слоев = номер периода;
- У каждой электронной оболочки есть определенное конечное число электронов, которое оно способно вместить;
- Те элементы, у которых оболочки не полностью заполнены, лучше вступают в контакт с другими элементами;
- Ион — заряженная молекула.
- Катион — положительный ион.
- Анион — отрицательный ион;
- Степень окисления — заряд элемента, который вычислен путем того, что в соединении ковалентная полярная связь превратилась в ионную;
- Есть элементы, чья степень окисления постоянна, а есть те, у кого она изменяется;
- Если сложить все степени окисления в соединении, то всё будет равно нулю.
Короткое, но познавательное видео про элементарные частицы:
Элементарные частицы: нейтроны, протоны, электроны. Действительно элементарные?
Когда речь заходит о том, из чего состоят различные окружающие нас объекты, мы сразу начинаем говорить о молекулах, затем об атомах. А из чего же состоят сами атомы? Так ли просто они устроены, как шарик, который мы видели на уроках химии и физике в школе? На самом деле, все не так уж и просто. Для простоты в самом начале скажем, что абсолютное большинство всех вещей в мире состоит из элементарных частиц. Почему не все? Дело в том, что далеко не вся Вселенная изучена человеком, поэтому мы не можем однозначно сказать, все ли состоит из частиц.
Например, свет — это волна, состоящая из элементарных частиц — фотонов, но раньше наука не могла такое сказать.
Теперь об этих самых частицах. Элементарные частицы — это такие частицы, которые человек сейчас расщепить на более маленькие не может, поэтому пока считается, что из них все и состоит. Таких частиц бывает огромное множество, но сегодня же мы будем больше говорить о наиболее популярных из них, а именно — нейтроны, протоны, электроны.
Где встречаются нейтроны, протоны, электроны?
Почему мы сказали выше, что эти три элементарные частицы считаются наиболее популярными? Все просто — из них состоит абсолютно любой атом. Если говорить об этом чуть более подробно, то атом состоит из двух частей:
- ядро атома
- электроны
В свою же очередь ядро атома включает в себя протоны и нейтроны. Таким образом, атом состоит из трех элементарных частиц, две из которых составляют ядро, а множество третьих вращается вокруг этого ядра.
Классификация элементарных частиц
Чтобы получше разобраться в том, какие бывают элементарные частицы и как они взаимодействуют друг с другом, нам нужно разделить их на группы по принципу схожести определенных свойств. Это и называется классификация. Сейчас все поймете.
Разделим по времени жизни
Делить какие-то там частицы по времени жизни звучит очень странно, ведь это неодушевленные предметы и о жизни здесь речь идти не должна. Вы будете абсолютно правы, имея такую точку зрения. Однако в данном случае имеется в виду не жизнь, как существование живого организма, а скорей пребывание в одном и том же состоянии. Если говорить проще, то не все из элементарных частиц могут сохранять свои свойства в течение большого отрезка времени, поэтому мы и решили их так разделить. Итак, разделить в данном случае можно на две группы:
- стабильные (это те частицы, которые как раз могут очень долго сохранять свойства, некоторые даже говорят бесконечно долго). Сюда относятся электроны, фотоны, протоны и другие частицы)
- нестабильные (а это те, которые через некоторый промежуток времени меняют свои свойства и переходят в другие формы). Сюда относятся все остальные виды частиц.
Разделим по тому, как они взаимодействуют
Интересно, что при довольно схожем строении, разные частицы могут взаимодействовать друг с другом совсем по-разному. Давайте посмотрим, как можно разделить элементарные частицы по такому принципу:
- составные
- бесструктурные
Действительно, частицы тоже бывают составные и фундаментальные (по сути самые простые), и от этого многое зависит. Давайте подробно разберемся с каждым из этих видов.
Составные частицы, которые по-другому еще называются адронами (вы наверняка слышали про Адронный коллайдер в Швейцарии) взаимодействуют со всеми частицами. Такое взаимодействие еще называют фундаментальным. Они в свою очередь тоже подразделяются на мезоны и барионы.
Теперь давайте поговорим о фундаментальных частицах. Здесь все гораздо более интересно, ведь таких частиц в мире открыто великое множество. Давайте для начала узнаем, на какие виды разделяются фундаментальные или же бесструктурные частицы:
- кварки
- лептоны
- калибровочные бозоны
Теперь давайте остановимся на каждом виде отдельно и поговорим о нем более подробно. А начать предлагаем с кварков.
Кварки — это такие частицы, которые находятся в составе адронов. Отдельно их встретить ученым пока не удавалось, только в составе других частиц. Для того, чтобы их изучать, ученым приходится использовать различные хитрые методы. Они подразделяются еще на шесть подтипов, но о них сегодня мы говорить не будем. Интересной особенностью кварков является то, что они, являясь фундаментальными частицами, все же участвуют в сильных взаимодействиях.
Теперь давайте перейдем к лептонам (точечным частицам). Это тоже довольно важный вид бесструктурных частиц. Они в отличие от кварков уже не участвуют в сильных взаимодействиях. Однако именно заряженные лептоны все же могут принимать участие в взаимодействии электромагнитном. Здесь так же, как и в кварках, отмечается целых шесть подтипов.
Ну а теперь последний тип с довольно странным для многих названием — калибровочные бозоны. Это тоже немаловажный тип, ведь именно он служит своего рода посредником в различных взаимодействиях между частицами. Чтобы вам было легче запомнить, приведем несколько примеров таких частиц: фотон, гравитон и глюон.
Ядро протон нейтрон электрон
Отлично, когда мы уже знаем довольно много про то, как устроены остальные элементарные частицы, давайте вернемся обратно к протону, нейтрону и электрону. Теперь самое время поговорить об устройстве ядра атома.
Начнем с того, что в ядре атома собран весь его положительный заряд, который обеспечивается протонами. Несмотря на большой заряд, размеры ядра очень малы по сравнению с электронными орбитами (орбиты, по которым вращается электрон вокруг ядра). В среднем они колеблются от 10 в минус 15 степени до 10 в минус 14 степени. Как мы помним из школьного курса химии количество протонов атома — это номер Z атома и порядковый номер элемента в таблице Менделеева. Примечательно также то, что количество протонов и электронов в атоме всегда одинаково.
Наверняка вам очень интересно, почему ядро атома, которое тоже состоит из элементарных частиц, такое плотное. Дело в том, что связь между протонами и нейтронами не является ни гравитационной, и электромагнитной, но при этом она в несколько раз сильнее, чем связь между ядром и электроном.
Число протонов нейтронов и электронов
Как мы уже поняли выше, в атоме абсолютно всегда количество протонов и электронов равно. Это обусловлено тем, что заряд должен быть нейтрален, а значит и количество положительных должно равняться количеству отрицательных частиц (отметим, что заряд протона +1, а заряд электрона -1). Также напомним, что количество протонов дает нам порядковый номер в таблице Менделеева этого атома. Теперь поговорим о нейтронах. Можно ли каким-то образом определить их количество внутри атома? Конечно можно. Это можно сделать, зная массу атома и количество протонов. Нужно просто вычесть из массы атома количество протонов и мы получим количество нейтронов (иногда нужно округлять). Для примера возьмем Медь (Cu). Ее атомная масса примерно равна 64, а номер в таблице 29, значит количество нейтронов будет равно 64 — 29 = 35. Все очень просто.
3 протона 3 нейтрона 3 электрона
Теперь для того, чтобы получше разобраться в этой теме, давайте попробуем все понять на примере другого атома. Это, как вы могли уже догадаться, атом Лития. У него 3 протона, 3 нейтрона и 3 электрона. По той формуле, которую мы уже узнали выше, тут сразу можно понять, что примерная масса атома Лития будет равна 6 (3 нейтрона + 3 протона). Также мы сходу можем сказать, что номер Лития в таблице Менделеева тоже 3 (количество протонов).
Теперь давайте посмотрим на таблицу Менделеева, представленную выше. Действительно, у Лития именно 3 номер и масса равна 6,941.
Видите, как все легко и просто. Однако особенно внимательный читатель уже давно заметил ошибку. Действительно, округлив массу Лития мы понимаем, что здесь количество нейтронов будет равно 4. Как же так получается, что у нас 3 нейтрона. Это подводит нас к следующей теме, о которой мы сейчас и поговорим.
Протон изотоп нейтрон электрон
Наверное, на одном из школьных уроков вы слышали такой термин, как изотоп. В школе это была та самая тема, после которой я полюбил естественные науки. Сейчас я не могу дать однозначный ответ, почему, просто было очень интересно. Итак, изотопы.
Что такое изотоп
Если говорить просто, то Изотопы представляют собой измененную модель обычного атома какого-то вещества. То есть возьмем любой атом какого-то вещества. У него есть фиксированное количество электронов, протонов и электронов. Однако, как мы уже заметили выше, это количество может быть и другим благодаря существованию изотопов. У изотопов такой же порядковый номер элемента в таблице Менделеева, а значит, как мы уже поняли, у них точно такое же количество протонов. Однако, есть отличия в массе элемента, а значит и в количестве нейтронов. Теперь давайте узнаем, как нам пригодится эта информация и как определить, что перед нами изотоп какого-то элемента.
Как определить, что перед нами изотоп
Наверняка самые догадливые и внимательные из вас уже догадались, что обычная формула с определением количества нейтронов с изотопами не работает от слова совсем, ведь это уже измененная модель обыкновенного элемента. Раз так, то мы можем просто попробовать подставить данные по атому в нашу формулу и понять, работает она или нет. Если нет, то перед нами изотоп. Но естественно, для удобства ученые придумали специальные обозначения для изотопов, чтобы нам, обычным людям, было удобнее с ними работать и изучать их. Как же эти обозначения работаю. А очень просто!
У изотопов после названия еще дописывается количество нуклонов в ядре (то есть количество элементарных частиц внутри ядра, сумма протонов и нейтронов). Давайте разберемся на примере очень популярного изотопа урана-235, радиоактивного урана. Обычный же уран по сути называется уран-238.
Зачем нам это знать?
Как вы уже могли понять, все многообразие элементарных частиц не ограничивается таблицей Менделеева и элементами, которые в ней представлены. У некоторых элементов бывает сразу несколько популярных изотопов, поэтому если вы хотите действительно хорошо разбираться в этой теме, то и запоминание всех популярных изотопов не будет лишним. А эта таблица вам в этом поможет:
Отлично, теперь мы уже неплохо разобрались с массой атома, таблицей Менделеева и разобрали основные типы элементарных частиц. Пришло время поговорить о более серьезных вещах. О чем же?
Радиоактивность
Для многих, кто в школе проходил эту тему лишь вскользь, это понятие выглядит очень страшным и непонятным. Кроме того, у многих на ум приходят различные катастрофы, косвенно связанные с этим понятием. Ну кто из вас сейчас не подумал о Хиросиме или о Чернобыле? Однако мы сейчас будем развеивать все эти мифы и стереотипы и хорошенько разберемся в этой далеко не легкой, но при этом очень интересной теме.
Как это работает?
Для того, чтобы разобраться в чем-либо, нужно сначала понять, с чего все начинается. В данном случае все идет от превращения атомов, а точнее от превращения их ядер. Интересно здесь то, что процесс этот самопроизвольный, то есть для того, чтобы он начался, нужно все-таки воздействовать извне, но как только превращения ядер начались, их уже не остановить! Да, далее произойдет именно то, о чем вы думаете. Ядро, с которого и начнется этот необыкновенно интересный с одной стороны и ужасно опасный с другой процесс называется материнским. Соответственно, если радиоактивный процесс затрагивает какое-то ядро помимо материнского, оно будет считаться дочерним, а 2 ядра, между которыми произошел обмен, называют генетически связанными — все как у людей.
Что такое радиоактивный распад?
Разумеется, радиоактивный распад встречается и в природе, однако происходит он крайне редко и не приносит никакого весомого вреда. А вот искусственный распад — штука очень опасная, если уметь ей управлять. Вся суть в том, что самопроизвольно меняется количество элементарных частиц. Существует несколько типов распадов и зависит этот тип от того, какие частицы будет испускать наш атом. Если это будут 2 протона и 2 нейтрона, то это положительно заряженная частица, называемая альфа-частицей. Соответственно, такой распад будет называться альфа-распадом. А вот с бета-частицами все немного посложнее.
Существует сразу 2 типа таких частиц: электроны и позитроны. Если эта частица электрон, то она обязательно образована нейтроном, распавшимся на протон и электрон. Если же эта бета-частица позитрон, то она всегда образована протоном, который распался на нейтрон и электрон. Распад, при котором из атома вылетает бета-частица — это уже бета-распад. Существует еще и менее популярный тип распада (изомерный переход или гамма-распад), при котором из атома вылетают гамма-кванты. Тут все еще сложнее, ведь такой изомерный переход никогда не бывает один. О чем я говорю? Дело в том, что гамма-распад очень часто сопровождают и другие типы распада. Это происходит в тот момент, когда частица распадается в первый раз. На этом этапе могут произойти другие виды распадов, а уж только потом процесс переходит непосредственно к гамма-распаду.
А в природе где это все можно встретить?
Как мы уже сказали выше, в природе тоже встречается радиоактивность. Если немного подумать, то оказывается, что радиоактивны по сути все вещества, у которых нет стабильных изотопов (кто еще не знает, что это, почитайте о них выше). Так вот, ученые пошли еще дальше и подошли к этому вопросу системно. В итоге они получили, что оказывается по таблице менделеева радиоактивны по своей природе вещества, у которых номер 83 или больше. Однако это если мы говорим о тех веществах, которые однозначно радиоактивны.
А ведь встречаются и немного другие. Например среди элементов с атомной массой поменьше встречаются такие, у изотопов которых очень большой период полураспада. Для примера возьмем теллур-128. У обычного теллура номер в таблице Менделеева 52, а значит он не подходит под первую группу, верно? И это неудивительно, ведь его изотоп теллур-128 так стабилен, что его период полураспада примерно в 2 раза больше, чем( 10 в степени 15 миллиардов лет). Неплохо, верно? Спешим вас успокоить, это элемент с самым большим периодом полураспада, но все-таки это очень много, ведь наша земля в миллиарды раз моложе. А для чего нужны все эти цифры? Это как-то практически применимо? Ну конечно, с помощью этих данных можно определять возраст многих минералов, горных пород и даже возраст планет в космосе! А ведь вы еще не знаете, что же такое период полураспада. Давайте разберемся с этим важнейшим понятием.
А что такое период полураспада?
Говоря о том, где можно встретить радиоактивность в природе, мы затронули такой термин, о котором еще не говорили. Что-ж, это неплохой повод, что это сделать сейчас. Так вот, период полураспада — это такое время, за которое частица распадается.
Но почему же именно ПОЛУраспад? Ну да, здесь все не так просто. Если говорить точнее, то это время, за которое она (частица) распадается с вероятностью 50 процентов. Теперь более понятно, верно?
Как вы уже могли догадаться у одной и той же частицы периоды полураспада могут отличаться в зависимости от изотопов. Однако для изотопа частицы это число постоянно.
Заключение
Как вы уже поняли, об элементарных частицах можно говорить очень много и говорить о них можно бесконечно много. Однако на этом наше небольшое вводное повествование о них предлагаем закончить. Если вам понравилась эта статья и вы хотите, чтобы мы публиковали больше материала на эту тему, то не забудьте проявить немного активности ниже. Напомним также, что на нашем сайте есть множество статей на смежные тематики, поэтому предлагаем вам с ними ознакомиться. До скорых встреч!
Нуклон (составляющая ядра атома) с положительным электрическим зарядом; символ p или p +
 кварк, содержащийся в протоне. Цветовое назначение отдельных кварков произвольно, но все три цвета должны присутствовать. Силы между кварками опосредуются глюонами. кварк, содержащийся в протоне. Цветовое назначение отдельных кварков произвольно, но все три цвета должны присутствовать. Силы между кварками опосредуются глюонами. |
|
| Классификация | Барион |
|---|---|
| Состав | 2 верхние кварки (u), 1 нижние кварки (d) |
| Статистика | Фермионные |
| Взаимодействия | Гравитация, электромагнитное, слабое, сильное |
| Символ | . p.,. p.,. N.,. 1H. |
| Античастица | Антипротон |
| Теоретически | Уильям Праут (1815) |
| Обнаружен | Обозначен как H Юджином Гольдштейном (1886). Определен в других ядрах (и назван) Эрнестом Резерфордом (1917–1920). |
| Масса | 1,67262192369 (51) × 10 кг.
938,27208816 (29) МэВ / c. 1,007276466621 (53) u |
| Средний срок службы | >2,1 × 10 лет (стабильный) |
| Электрический заряд | +1 e. 1,602176634 × 10 C |
| Радиус заряда | 0,8414 (19) fm |
| Электрический дипольный момент | < 5.4×10 e⋅cm |
| Электрическая поляризуемость | 1,20 (6) × 10 фм |
| Магнитный момент | 1,41060679736 (60) × 10 J ⋅T.
1,52103220230 (46) × 10 μB. 2,79284734463 (82) μN |
| Магнитная поляризуемость | 1,9 (5) × 10 фм |
| Спин | 1/2 |
| Изоспин | 1/2 |
| Четность | +1 |
| Конденсированный | I (J ) = 1/2 (1/2) |
A протон представляет собой субатомную частицу, символ. p. или. p., с положительным электрическим зарядом + 1e элементарный заряд и масса немного меньше, чем у нейтрона. Протоны и нейтроны, каждый с массой приблизительно равной одной атомной единице массы, вместе именуются «нуклонами » (частицами, присутствующими в атомных ядрах).
Один или несколько протонов присутствуют в ядре каждого атома ; они являются необходимой частью ядра. Число протонов в ядре является определяющим свойством элемента и называется атомным номером (обозначается символом Z). Поскольку каждый элемент элемент имеет уникальное количество протонов, каждый элемент имеет свой собственный уникальный атомный номер.
Слово протон по-гречески означает «первый», и это название ядру водорода дал Эрнест Резерфорд в 1920 году. В предыдущие годы Резерфорд обнаружил, что водород Ядро (известное как самое легкое ядро) могло быть извлечено из ядер азота путем атомных столкновений. Таким образом, протоны были кандидатом на роль элементарной частицы и, следовательно, строительного блока азота и всех других более тяжелых атомных ядер.
Хотя протоны изначально считались фундаментальными или элементарными частицами, в современной Стандартной модели физики частиц протоны классифицируются как адроны, такие как нейтроны, другой нуклон. Протоны представляют собой составные частицы, состоящие из трех валентных кварков : двух верхних кварков с зарядом + 2 / 3e и одного нижнего кварка с зарядом −1 / 3e. массы покоя кварков составляют лишь около 1% от массы протона. Остальная часть массы протона связана с квантовой хромодинамической энергией связи, которая включает кинетическую энергию кварков и энергию глюонных полей, связывающих кварки вместе. Поскольку протоны не являются элементарными частицами, они обладают измеримым размером; среднеквадратичный зарядовый радиус протона составляет примерно 0,84–0,87 фм (или от 0,84 × 10 до 0,87 × 10 м ). В 2019 году два разных исследования с использованием разных методов показали, что радиус протона составляет 0,833 фм с погрешностью ± 0,010 фм.
При достаточно низких температурах свободные протоны связываются с электроны. Однако характер таких связанных протонов не меняется, и они остаются протонами. Быстрый протон, движущийся через вещество, будет замедляться за счет взаимодействия с электронами и ядрами, пока не будет захвачен электронным облаком атома. Результатом является протонированный атом, который представляет собой химическое соединение водорода. В вакууме, когда присутствуют свободные электроны, достаточно медленный протон может захватить единственный свободный электрон, превратившись в нейтральный атом водорода, который химически является свободным радикалом. Такие «свободные атомы водорода» имеют тенденцию вступать в химическую реакцию со многими другими типами атомов при достаточно низких энергиях. Когда свободные атомы водорода реагируют друг с другом, они образуют нейтральные молекулы водорода (H 2), которые являются наиболее распространенным молекулярным компонентом молекулярных облаков в межзвездном пространстве.
Содержание
- 1 Описание
- 2 История
- 3 Стабильность
- 4 Кварки и масса протона
- 5 Радиус заряда
- 5.1 Давление внутри протона
- 5.2 Радиус заряда в сольватированном протоне, гидроксоний
- 6 Взаимодействие свободных протонов с обычным веществом
- 7 Протон в химии
- 7.1 Атомный номер
- 7.2 Ион водорода
- 7.3 Протонный ядерный магнитный резонанс (ЯМР)
- 8 Воздействие на человека
- 9 Антипротон
- 10 См. Также
- 11 Ссылки
- 12 Внешние ссылки
Описание
Протоны — это spin-1/2 фермионы и состоят из трех валентных кварков, что делает их барионами (суб -тип адронов ). Два верхних кварка и один нижний кварк протона удерживаются вместе сильной силой, опосредованной глюонами. В современной перспективе протон состоит из валентных кварков (вверх, вверх, вниз), глюонов и переходных пар морских кварков. Протоны имеют распределение положительного заряда, которое распадается приблизительно экспоненциально, со среднеквадратичным радиусом около 0,8 фм.
Протоны и нейтроны являются нуклонами, которые могут быть связаны вместе ядерной силой с образованием атомных ядер. Ядро наиболее распространенного изотопа атома водорода (с химическим символом «H») представляет собой неподеленный протон. Ядра тяжелых изотопов водорода дейтерия и трития содержат один протон, связанный с одним и двумя нейтронами, соответственно. Все другие типы атомных ядер состоят из двух или более протонов и различного количества нейтронов.
История
Концепция водородоподобной частицы как составной части других атомов развивалась в течение длительного периода. Еще в 1815 году Уильям Праут предположил, что все атомы состоят из атомов водорода (которые он называл «протилами»), основываясь на упрощенной интерпретации ранних значений атомных масс (см. гипотеза Праута ), которая была опровергнута при более точных измерениях.


В 1886 году Юджин Гольдштейн открыл канальные лучи (также известные как анодные лучи) и показал, что это были положительно заряженные частицы (ионы) производится из газов. Однако, поскольку частицы из разных газов имели разные значения отношения заряда к массе (э / м), их нельзя было идентифицировать с одной частицей, в отличие от обнаруженных отрицательных электронов. Автор J. Дж. Томсон. Вильгельм Вин в 1898 году определил ион водорода как частицу с самым высоким отношением заряда к массе в ионизированных газах.
После открытия ядра атома Эрнестом Резерфордом в 1911 году Антониус ван ден Брук предположил, что место каждого элемента в периодической таблице (его атомный номер) равно его ядерному заряду. Это было экспериментально подтверждено Генри Мозли в 1913 году с использованием рентгеновских спектров.
В 1917 году (в экспериментах, проведенных в 1919 и 1925 годах) Резерфорд доказал, что ядро водорода присутствует в других ядрах, результат обычно описывается как открытие протонов. Эти эксперименты начались после того, как Резерфорд заметил, что когда альфа-частицы были выпущены в воздух (в основном азот), его сцинтилляционные детекторы показали характерные черты типичных ядер водорода как продукта. После экспериментов Резерфорд проследил реакцию на азот в воздухе и обнаружил, что когда альфа-частицы вводились в чистый газообразный азот, эффект был сильнее. В 1919 году Резерфорд предположил, что альфа-частица выбила протон из азота, превратив его в углерод. После наблюдения изображений камеры Вильсона Блэкетта в 1925 году Резерфорд понял, что все было наоборот: после захвата альфа-частицы протон выбрасывается, так что тяжелый кислород, а не углерод, является конечным результатом, то есть Z не уменьшается, а увеличивается. Это была первая описанная ядерная реакция, N + α → O + p. В зависимости от точки зрения, 1919 или 1925 год можно рассматривать как момент «открытия» протона.
Резерфорд знал, что водород является самым простым и легким элементом, и на него повлияла гипотеза Праута о том, что водород является строительным блоком всех элементов. Открытие того, что ядро водорода присутствует во всех других ядрах в качестве элементарной частицы, привело Резерфорда к тому, чтобы дать ядру водорода особое имя как частица, поскольку он подозревал, что водород, самый легкий элемент, содержит только одну из этих частиц. Он назвал этот новый фундаментальный строительный блок ядра протоном в честь среднего единственного числа греческого слова πρῶτον, обозначающего «первый». Однако Резерфорд также имел в виду слово протил, использованное Праутом. Резерфорд выступал в Британской ассоциации содействия развитию науки на заседании в Кардиффе, начавшемся 24 августа 1920 года. Оливер Лодж спросил Резерфорда о новом имени для положительное ядро водорода, чтобы избежать путаницы с нейтральным атомом водорода. Первоначально он предлагал как протон, так и прутон (после Праута). Позже Резерфорд сообщил, что собрание приняло его предложение назвать ядро водорода «протоном», следуя слову Праута «протил». Первое использование слова «протон» в научной литературе появилось в 1920 году.
Недавние исследования показали, что грозы могут производить протоны с энергией до нескольких десятков МэВ.
Протоны — это обычно используется для ускорителей для протонной терапии или различных экспериментов по физике элементарных частиц, наиболее ярким примером которого является Большой адронный коллайдер.
В июльской статье 2017 года исследователи измерили масса протона должна быть 1,007276466583 + 15. −29 атомных единиц массы (значения после числа представляют собой статистическую и систематическую погрешности соответственно), что ниже, чем измерения из CODATA 2014 на три стандартных отклонения.
Стабильность
| Нерешенная проблема в физике :. Стабильны ли протоны в принципе? Или они распадаются с конечным временем жизни, как предсказывают некоторые расширения стандартной модели? (другие нерешенные проблемы в физике) |
Свободный протон (протон, не связанный с нуклонами или электронами) — это стабильная частица, которая имеет не наблюдалось спонтанного разложения на другие частицы. Свободные протоны встречаются естественным образом в ряде ситуаций, в которых энергии или температуры достаточно высоки, чтобы отделить их от электронов, к которым они имеют некоторое сродство. Свободные протоны существуют в плазме, в которой температуры слишком высоки, чтобы позволить им объединяться с электронами. Свободные протоны высокой энергии и скорости составляют 90% космических лучей, которые распространяются в вакууме на межзвездные расстояния. Свободные протоны испускаются непосредственно из атомных ядер в некоторых редких типах радиоактивного распада. Протоны также возникают (вместе с электронами и антинейтрино ) в результате радиоактивного распада свободных нейтронов, которые нестабильны.
Самопроизвольный распад свободных протонов никогда не наблюдался, и поэтому протоны считаются стабильными частицами согласно Стандартной модели. Однако некоторые теории великого объединения (GUT) физики элементарных частиц предсказывают, что распад протона должен происходить со временем жизни от 10 до 10 лет, и экспериментальные поиски установили нижние границы для среднее время жизни протона для различных предполагаемых продуктов распада.
Эксперименты на детекторе Super-Kamiokande в Японии дали более низкие пределы для протона среднего времени жизни, равные 6,6 × 10 лет для распада на антимюон и нейтральный пион и 8,2 × 10 лет для распада на позитрон и нейтральный пион. В другом эксперименте, проведенном в нейтринной обсерватории Садбери в Канаде, проводился поиск гамма-лучей, возникающих из остаточных ядер, возникающих в результате распада протона из кислорода-16. Этот эксперимент был разработан для обнаружения распада любого продукта и установил нижний предел времени жизни протона 2,1 × 10 лет.
Однако известно, что протоны превращаются в нейтроны в процессе электронного захвата (также называемого обратным бета-распадом ). Для свободных протонов этот процесс происходит не спонтанно, а только при подаче энергии. Уравнение следующее:
- . p. + . e. → . n. + . ν. e
Процесс обратим; нейтроны могут превращаться обратно в протоны посредством бета-распада, распространенной формы радиоактивного распада. Фактически, свободный нейтрон распадается таким образом со средним временем жизни около 15 минут.
Кварки и масса протона
В квантовой хромодинамике, современной теории ядерных сил, большая часть массы протонов и нейтронов объясняется специальной теорией относительности. Масса протона примерно в 80–100 раз больше суммы масс покоя составляющих его кварков, в то время как глюоны имеют нулевую массу покоя. Дополнительная энергия кварков и глюонов в области внутри протона по сравнению с энергией покоя одних кварков в вакууме КХД составляет почти 99% масс. Таким образом, масса покоя протона является инвариантной массой системы движущихся кварков и глюонов, составляющих частицу, и в таких системах даже энергия безмассовых частиц все еще измеряется как часть массы покоя системы.
Два термина используются для обозначения массы кварков, из которых состоят протоны: текущая кварковая масса относится к массе самого кварка, а составляющий кварк масса относится к текущей массе кварка плюс масса глюона поля частиц, окружающего кварк. Эти массы обычно имеют очень разные значения. Как уже отмечалось, большая часть массы протона происходит от глюонов, которые связывают текущие кварки вместе, а не от самих кварков. Хотя глюоны по своей природе безмассовые, они обладают энергией, а точнее энергией связи квантовой хромодинамики (QCBE), и именно она вносит большой вклад в общую массу протонов (см. масса в специальная теория относительности ). Протон имеет массу приблизительно 938 МэВ / c, из которых масса покоя его трех валентных кварков дает только около 9,4 МэВ / c; большая часть остатка может быть отнесена к глюонам QCBE.
. Волновая функция модели составляющего кварка для протона
- | p ↑⟩ = 1 18 [2 | u ↑ d ↓ u ↑⟩ + 2 | u ↑ u ↑ d ↓⟩ + 2 | d ↓ u ↑ u ↑⟩ — | u ↑ u ↓ d ↑⟩ — | u ↑ d ↑ u ↓⟩ — | u ↓ d ↑ u ↑⟩ — | d ↑ u ↓ u ↑⟩ — | d ↑ u ↑ u ↓⟩ — | u ↓ u ↑ d ↑⟩]. { displaystyle | p _ { uparrow} rangle = { frac {1} { sqrt {18}}} [2 | u _ { uparrow} d _ { downarrow} u _ { uparrow} rangle +2 | u_ { uparrow} u _ { uparrow} d _ { downarrow} rangle +2 | d _ { downarrow} u _ { uparrow} u _ { uparrow} rangle — | u _ { uparrow} u _ { downarrow} d_ { uparrow} rangle — | u _ { uparrow} d _ { uparrow} u _ { downarrow} rangle — | u _ { downarrow} d _ { uparrow} u _ { uparrow} rangle — | d _ { uparrow} u _ { downarrow} u _ { uparrow} rangle — | d _ { uparrow} u _ { uparrow} u _ { downarrow} rangle — | u _ { downarrow} u _ { uparrow} d _ { uparrow} rangle ].}
Внутренняя динамика протонов сложна, потому что она определяется кварками, обменивающимися глюонами и взаимодействующими с различными вакуумными конденсатами. КХД на решетке позволяет вычислить массу протона прямо из теории с любой принципиальной точностью. Согласно самым последним расчетам, масса определяется с точностью выше 4%, даже с точностью до 1% (см. Рисунок S5 в работе Dürr et al.). Эти утверждения до сих пор спорны, потому что расчеты еще не могут быть выполнены с кварками, такими легкими, как в реальном мире. Это означает, что прогнозы находятся в процессе экстраполяции, который может вносить систематические ошибки. Трудно сказать, правильно ли контролируются эти ошибки, потому что величины, которые сравниваются с экспериментом, представляют собой массы адронов, которые известны заранее.
Эти недавние вычисления выполняются на огромных суперкомпьютерах, и, как отметили Боффи и Паскини: «подробное описание структуры нуклона все еще отсутствует, потому что… поведение на больших расстояниях требует непертурбативного и / или численного лечение… «Более концептуальными подходами к структуре протонов являются: подход топологического солитона, первоначально разработанный Тони Скирмом и более точный подход AdS / QCD который расширяет его и включает теорию струн глюонов, различные модели, вдохновленные КХД, такие как модель мешка и модель составляющих кварков, которые были популярны в 1980-х годах. и правила сумм SVZ, которые позволяют производить грубые приблизительные вычисления массы. Эти методы не обладают такой же точностью, как методы КХД с использованием более грубой силы решетки, по крайней мере, пока.
Зарядный радиус
Задача определения радиуса для атомного ядра (протона) аналогична проблеме атомного радиуса в том, что ни атомы, ни их ядра не имеют определенные границы. Однако ядро можно смоделировать как сферу положительного заряда для интерпретации экспериментов по рассеянию электронов : поскольку нет определенной границы с ядром, электроны «видят» диапазон поперечных сечений для которое можно принять в качестве среднего. Определение «среднеквадратичное значение» (для «среднеквадратичное ») возникает потому, что это ядерное поперечное сечение, пропорциональное квадрату радиуса, которое является определяющим для рассеяния электронов.
Международно принятое значение зарядового радиуса протона составляет 0,8768 фм (см. порядки величины для сравнения с другими размерами). Это значение основано на измерениях, включающих протон и электрон (а именно, измерениях рассеяния электронов и сложных расчетах, включающих сечение рассеяния, основанное на уравнении Розенблюта для сечения передачи импульса. ), и исследования атомных энергетических уровней водорода и дейтерия.
Однако в 2010 году международная исследовательская группа опубликовала результаты измерения зарядового радиуса протона с помощью лэмбовского сдвига в мюонном водороде (экзотический атом, состоящий из протона и отрицательно заряженный мюон ). Поскольку мюон в 200 раз тяжелее электрона, его длина волны де Бройля соответственно короче. Эта меньшая атомная орбиталь намного более чувствительна к радиусу заряда протона, поэтому позволяет более точное измерение. Их измерение среднеквадратичного зарядового радиуса протона составляет 0,84184 (67) фм, что отличается на 5,0 стандартных отклонений от значения CODATA. 0,8768 (69) фм ». В январе 2013 г. было опубликовано обновленное значение зарядового радиуса протона 0,84087 (39) фм. Прецизионность была улучшена в 1,7 раза, значимость расхождения увеличилась до 7σ. Корректировка CODATA 2014 г. немного снизила рекомендуемое значение радиуса протона (рассчитанного только с использованием электронных измерений) до 0,8751 (61) фм, но это оставляет расхождение в 5,6σ.
Международная исследовательская группа, получившая этот результат в Институте Пола Шерера в Виллигене, включает ученых из Института квантовой оптики Макса Планка, Университет Людвига-Максимилиана, Университет Штутгарта и Университет Коимбры, Португалия. Теперь команда пытается объяснить это несоответствие и повторно исследует результаты как предыдущих высокоточных измерений, так и сложных вычислений, включающих рассеяние сечение. Если в измерениях или расчетах не обнаружено ошибок, может потребоваться повторное исследование самой точной и проверенной фундаментальной теории в мире: квантовой электродинамики. Радиус протона остается загадкой по состоянию на 2017 год. Возможно, несоответствие связано с новой физикой, или объяснение может быть обычным физическим эффектом, который был упущен.
Радиус связан с форм-фактором и сечение передачи импульса. Атомный форм-фактор G изменяет сечение, соответствующее точечному протону.
- R e 2 = — 6 d G e d q 2 | q 2 = 0 d σ d Ω = d σ d Ω | точка G 2 (q 2) { displaystyle { begin {align} R_ {e} ^ {2} = — 6 {{ frac {dG_ {e}} {dq ^ {2}}} , { Bigg vert} ,} _ {q ^ {2} = 0} \ { frac {d sigma} {d Omega}} = {{ frac {d sigma} {d Omega} } , { Bigg vert} ,} _ { text {point}} G ^ {2} (q ^ {2}) end {align}}}
Атомарный форм-фактор связана с плотностью волновой функции цели:
- G (q 2) = ∫ eiqr ψ (r) 2 dr 3 { displaystyle G (q ^ {2}) = int e ^ {iqr} psi (r) ^ {2} , dr ^ {3}}
Форм-фактор можно разделить на электрический и магнитный. В дальнейшем они могут быть записаны как линейные комбинации формфакторов Дирака и Паули.
- G m = F D + F P G e = F D — τ F P d σ d Ω = d σ d Ω | NS 1 1 + τ (G е 2 (q 2) + τ ϵ G м 2 (q 2)) { displaystyle { begin {align} G_ {m} = F_ {D} + F_ {P} \ G_ {e} = F_ {D} — tau F_ {P} \ { frac {d sigma} {d Omega}} = {{ frac {d sigma} {d Omega}} , { Bigg vert} ,} _ {NS} { frac {1} {1+ tau}} left (G_ {e} ^ {2} left (q ^ {2} right) + { frac { tau} { epsilon}} G_ {m} ^ {2} left (q ^ {2} right) right) end {align}}}
Давление внутри протона
Поскольку протон состоит из кварков, удерживаемых глюонами, можно определить эквивалентное давление, которое действует на кварки. Это позволяет рассчитать их распределение как функцию расстояния от центра, используя комптоновское рассеяние электронов высоких энергий (DVCS, для глубоко виртуального комптоновского рассеяния). Давление максимально в центре, примерно на 10 Па, что больше, чем давление внутри нейтронной звезды. Он положительный (отталкивающий) на радиальном расстоянии около 0,6 фм, отрицательный (притягивающий) на больших расстояниях и очень слабый на расстоянии более 2 фм.
Зарядный радиус в сольватированном протоне, гидроксоний
Радиус гидратированного протона появляется в уравнении Борна для расчета энтальпии гидратации гидрокония.
Взаимодействие свободные протоны с обычным веществом
Хотя протоны имеют сродство к противоположно заряженным электронам, это взаимодействие с относительно низкой энергией, поэтому свободные протоны должны потерять достаточную скорость (и кинетическую энергию ), чтобы становятся тесно связаны и связаны с электронами. Протоны высоких энергий, пересекая обычное вещество, теряют энергию из-за столкновений с атомными ядрами и из-за ионизации атомов (удаления электронов) до тех пор, пока они не замедлятся достаточно, чтобы быть захваченными электронное облако в нормальном атоме.
Однако в такой ассоциации с электроном характер связанного протона не меняется, и он остается протоном. Притяжение свободных протонов низкой энергии к любым электронам, присутствующим в нормальном веществе (например, электронам в нормальных атомах), заставляет свободные протоны останавливаться и образовывать новую химическую связь с атомом. Такая связь возникает при любой достаточно «холодной» температуре (т.е. сравнимой с температурами на поверхности Солнца) и с любым типом атома. Таким образом, при взаимодействии с любым типом нормального (неплазменного) вещества низкоскоростные свободные протоны притягиваются к электронам в любом атоме или молекуле, с которыми они вступают в контакт, заставляя протон и молекулу объединяться. Такие молекулы называются «протонированными », и в результате химически они часто становятся так называемыми кислотами Бренстеда.
Протонами в химии
Атомный номер
В химии количество протонов в ядре атома известно как атомный номер, который определяет химический элемент, которому принадлежит атом. Например, атомный номер хлора равен 17; это означает, что каждый атом хлора имеет 17 протонов и что все атомы с 17 протонами являются атомами хлора. Химические свойства каждого атома определяются количеством (отрицательно заряженных) электронов, которое для нейтральных атомов равно количеству (положительных) протонов, так что общий заряд равен нулю. Например, нейтральный атом хлора имеет 17 протонов и 17 электронов, тогда как анион Cl имеет 17 протонов и 18 электронов при общем заряде -1.
Однако все атомы данного элемента не обязательно идентичны. количество нейтронов может изменяться для образования разных изотопов, а уровни энергии могут различаться, что приводит к различным ядерным изомерам. Например, есть два стабильных изотопа хлора :. 17Cl. с 35-17 = 18 нейтронами и. 17Cl. с 37-17 = 20 нейтронами.
Ион водорода

Росс Стюарт, Протон: приложение к органической химии (1985, стр. 1)
In в химии термин протон относится к иону водорода H.. Поскольку атомный номер водорода равен 1, ион водорода не имеет электронов и соответствует голому ядру, состоящему из протона (и 0 нейтронов для наиболее распространенного изотопа протия . 1H. ). Протон представляет собой «голый заряд» с радиусом всего лишь около 1/64 000 от радиуса атома водорода, поэтому он чрезвычайно химически активен. Таким образом, свободный протон имеет чрезвычайно короткое время жизни в химических системах, таких как жидкости, и немедленно реагирует с электронным облаком любой доступной молекулы. В водном растворе он образует ион гидроксония, H 3 O, который, в свою очередь, дополнительно сольватируется молекулами воды в кластерах, таких как как [H 5O2] и [H 9O4].
Перенос H. в кислотно-основной реакции обычно называют «переносом протона». кислота называется донором протона, а основание — акцептором протона. Аналогично, биохимические термины, такие как протонный насос и протонный канал, относятся к движению гидратированных ионов H..
Ион, образующийся при удалении электрона из атома дейтерия, известен как дейтрон, а не протон. Аналогичным образом удаление электрона из атома трития дает тритон.
Протонный ядерный магнитный резонанс (ЯМР)
Также в химии термин «протонный ЯМР » относится к наблюдению ядер водорода-1 в (в основном органических ) молекул с помощью ядерного магнитного резонанса. В этом методе используется спин протона, который имеет значение половину (в единицах hbar ). Название относится к исследованию протонов, присутствующих в протии (атомах водорода-1) в соединениях, и не подразумевает, что свободные протоны существуют в исследуемом соединении.
Воздействие на человека
Пакет для экспериментов с лунной поверхностью Apollo (ALSEP) определил, что более 95% частиц в солнечном ветре являются электронами. и протоны в приблизительно равных количествах.
Поскольку спектрометр солнечного ветра проводил непрерывные измерения, стало возможным измерить, как магнитное поле Земли влияет на прибывающие частицы солнечного ветра. Примерно две трети каждой орбиты Луна находится за пределами магнитного поля Земли. В это время типичная плотность протонов составляла от 10 до 20 на кубический сантиметр, при этом большинство протонов имели скорости от 400 до 650 километров в секунду. Примерно пять дней каждого месяца Луна находится внутри геомагнитного хвоста Земли, и обычно частицы солнечного ветра не обнаруживаются. На оставшейся части каждой лунной орбиты Луна находится в переходной области, известной как магнитослой, где магнитное поле Земли влияет на солнечный ветер, но не исключает его полностью. В этой области поток частиц снижается с типичной скоростью протонов от 250 до 450 километров в секунду. В течение лунной ночи спектрометр был защищен от солнечного ветра Луной, и частицы солнечного ветра не измерялись.
Протоны также имеют внесолнечное происхождение из галактических космических лучей, где они составляют около 90% от полного потока частиц. Эти протоны часто имеют более высокую энергию, чем протоны солнечного ветра, и их интенсивность гораздо более однородна и менее изменчива, чем протоны, исходящие от Солнца, на образование которых сильно влияют солнечные протонные события, такие как корональные выбросы массы.
Были проведены исследования влияния мощности дозы протонов, обычно обнаруживаемых в космических путешествиях, на здоровье человека. Чтобы быть более конкретным, есть надежда определить, какие конкретные хромосомы повреждены, и определить повреждение во время развития рака от воздействия протонов. Другое исследование направлено на определение «эффектов воздействия протонного излучения на нейрохимические и поведенческие конечные точки, включая дофаминергическое функционирование, вызванное амфетамином условное обучение отвращению вкуса, а также пространственное обучение и память, как измерено. с помощью водного лабиринта Морриса. Электрическая зарядка космического корабля из-за межпланетной протонной бомбардировки также предлагается для изучения. Есть еще много других исследований, касающихся космических путешествий, включая галактические космические лучи и их возможные последствия для здоровья и воздействие солнечных протонов.
Эксперименты в космических путешествиях American Biostack и Soviet Biorack продемонстрировали серьезность молекулярное повреждение микроорганизмов, включая артемии цисты, вызванные тяжелыми ионами.
антипротон
CPT-симметрия накладывает сильные ограничения на относительные свойства частиц и античастиц и, следовательно, подлежит строгим испытаниям. Например, заряды протона и антипротона должны в сумме равняться нулю. Это равенство было проверено до одной части из 10. Равенство их масс также было проверено лучше, чем одна из десяти. Удерживая антипротоны в ловушке Пеннинга, мы получаем равенство заряда и Массовое соотношение протонов и антипротонов было проверено как одна часть на 6 × 10. магнитный момент антипротонов был измерен с погрешностью 8 × 10 ядер магнетонов Бора и оказался равным магнитному моменту протона и противоположным ему.
См. Также
Физический портал
- Фермионное поле
- Водород
- Гидрон (химия)
- Список частиц
- Протон-протонная цепная реакция
- Модель кварка
- Протонный спиновой кризис
Ссылки
Внешние ссылки
| На Викискладе есть средства массовой информации, относящиеся к Протону. |
- Группа данных по частицам на LBL
- Large Адронный коллайдер
- Ивс, Лоуренс ; Коупленд, Эд; Падилья, Антонио (Тони) (2010). «Сжимающийся протон». Шестьдесят символов. Брэди Харан для Ноттингемского университета.
Эта статья о протоне как субатомной частице. Для использования в других целях см. Протон (значения).

В кварк содержание протона. В присвоение цвета индивидуальных кварков произвольно, но должны присутствовать все три цвета. Силы между кварками опосредуются глюоны. |
|
| Классификация | Барион |
|---|---|
| Сочинение | 2 до кварков (u), 1 вниз кварк (г) |
| Статистика | Фермионный |
| Взаимодействия | Сила тяжести, электромагнитный, слабый, сильный |
| Символ | п , п+ , N+ , 1 1ЧАС+ |
| Античастица | Антипротон |
| Теоретически | Уильям Праут (1815) |
| Обнаруженный | Наблюдается как H+ к Юджин Гольдштейн (1886). Идентифицирован в других ядрах (и назван) Эрнест Резерфорд (1917–1920). |
| Масса | 1.67262192369(51)×10−27 кг[1]
938.27208816(29) МэВ /c2[2] 1.007276466621(53) ты[2] |
| Средняя продолжительность жизни | > 2.1×1029 годы (стабильный) |
| Электрический заряд | +1 е 1.602176634×10−19 C[2] |
| Радиус заряда | 0.8414(19) FM[2] |
| Электрический дипольный момент | < 5.4×10−24 е⋅см |
| Электрическая поляризуемость | 1.20(6)×10−3 FM3 |
| Магнитный момент | 1.41060679736(60)×10−26 J ⋅Т−1[2]
1.52103220230(46)×10−3 μB[2] 2.79284734463(82) μN[2] |
| Магнитная поляризуемость | 1.9(5)×10−4 FM3 |
| Вращение | 1/2 |
| Изоспин | 1/2 |
| Паритет | +1 |
| Сжатый | я (Jп) = 1/2(1/2+) |
А протон это субатомная частица, символ
п
или же
п+
, с положительным электрический заряд из +1е элементарный заряд и массой чуть меньше, чем у нейтрон. Протоны и нейтроны, каждый с массой примерно один атомная единица массы, вместе именуются «нуклоны «(частицы, присутствующие в атомных ядрах).
Один или несколько протонов присутствуют в ядро каждого атом; они являются необходимой частью ядра. Число протонов в ядре является определяющим свойством элемента и называется атомный номер (представлен символом Z). Поскольку каждый элемент имеет уникальное количество протонов, каждый элемент имеет свой уникальный атомный номер.
Слово протон в переводе с греческого означает «первый», и это название ядру водорода дал Эрнест Резерфорд в 1920 году. В предыдущие годы Резерфорд обнаружил, что водород ядро (известное как самое легкое ядро) могло быть извлечено из ядер азот атомными столкновениями.[3] Таким образом, протоны были кандидатом в элементарная частица, и, следовательно, строительный блок азота и всех других более тяжелых атомных ядер.
Хотя протоны изначально считались фундаментальными или элементарные частицы, в современном Стандартная модель из физика элементарных частиц, протоны классифицируются как адроны, подобно нейтроны, другой нуклон. Протоны — составные частицы, состоящие из трех валентные кварки: два до кварков заряда +2/3е и один вниз кварк заряда —1/3е. В массы покоя кварков составляет всего около 1% от массы протона.[4] Остальная часть массы протона связана с энергия связи квантовой хромодинамики, который включает кинетическая энергия кварков и энергии глюон поля, связывающие кварки вместе. Поскольку протоны не являются элементарными частицами, они обладают измеримым размером; среднеквадратическое значение радиус заряда протона составляет около 0,84–0,87 FM (или же 0.84×10−15 к 0.87×10−15 м).[5][6] В 2019 году два разных исследования с использованием разных методов обнаружили, что радиус протона составляет 0,833 фм с погрешностью ± 0,010 фм.[7][8]
При достаточно низких температурах свободные протоны будут связываться с электроны. Однако характер таких связанных протонов не меняется, и они остаются протонами. Быстрый протон, движущийся сквозь вещество, будет замедляться за счет взаимодействия с электронами и ядрами, пока не будет захвачен электронное облако атома. В результате получается протонированный атом, который является химическое соединение водорода. В вакууме, когда присутствуют свободные электроны, достаточно медленный протон может подобрать единственный свободный электрон, став нейтральным. атом водорода, который химически свободный радикал. Такие «свободные атомы водорода» имеют тенденцию вступать в химическую реакцию со многими другими типами атомов при достаточно низких энергиях. Когда свободные атомы водорода реагируют друг с другом, они образуют нейтральные молекулы водорода (H2), которые являются наиболее распространенным молекулярным компонентом молекулярные облака в межзвездное пространство.
Описание
| Ядерная физика |
|---|
 |
| Ядро · Нуклоны (п, п ) · Ядерное дело · Ядерная сила · Ядерная структура · Ядерная реакция |
|
Модели ядра Жидкая капля · Модель ядерной оболочки · Модель взаимодействующих бозонов · Ab initio |
|
Нуклиды классификация Изотопы — равный Z |
|
Ядерная стабильность Связующая энергия · соотношение p – n · Капельная линия · Остров стабильности · Долина стабильности |
|
Радиоактивный распад Альфа α · Бета β (2β, β+ ) · К / л захват · Изомерный (Гамма γ · Внутреннее преобразование ) · Самопроизвольное деление · Распад кластера · Эмиссия нейтронов · Испускание протонов Энергия распада · Цепочка распада · Продукт распада · Радиогенный нуклид |
|
Ядерное деление Спонтанный · Товары (разрыв пары ) · Фотоделение |
|
Процессы захвата электрон (2× ) · нейтрон (s · р ) · протон (п · rp ) |
|
Высокоэнергетические процессы Скалывание (космическим лучом ) · Фотодезинтеграция |
|
Нуклеосинтез и Термоядерная реакция |
|
Ядерная физика высоких энергий Кварк-глюонная плазма · RHIC · LHC |
|
Ученые Альварес · Беккерель · Быть · А. Бор · Н. Бор · Чедвик · Кокрофт · Ir. Кюри · Пт. Кюри · Число Пи. Кюри · Склодовская-Кюри · Дэвиссон · Ферми · Хан · Дженсен · Лоуренс · Майер · Meitner · Олифант · Оппенгеймер · Proca · Перселл · Раби · Резерфорд · Soddy · Strassmann · Witecki · Сцилард · Кассир · Томсон · Уолтон · Вигнер |
Протоны вращение-1/2 фермионы и состоят из трех валентных кварков,[9] делать их барионы (подтип адроны ). Два до кварков и один вниз кварк протона удерживаются вместе сильная сила при посредничестве глюоны.[10]:21–22 В современной перспективе протон состоит из валентных кварков (вверх, вверх, вниз), глюонов и переходных пар морские кварки. Протоны имеют распределение положительного заряда, которое приблизительно экспоненциально затухает со средним квадратом радиус около 0,8 фм.[11]
Протоны и нейтроны оба нуклоны, которые могут быть связаны ядерная сила формировать атомные ядра. Ядро наиболее распространенных изотоп из атом водорода (с химический символ «H») — одиночный протон. Ядра тяжелых изотопов водорода дейтерий и тритий содержат один протон, связанный с одним и двумя нейтронами соответственно. Все другие типы атомных ядер состоят из двух или более протонов и различного количества нейтронов.
История
Концепция водородоподобной частицы как составной части других атомов развивалась в течение длительного периода. Еще в 1815 г. Уильям Праут предположил, что все атомы состоят из атомов водорода (которые он назвал «протилами»), основываясь на упрощенной интерпретации ранних значений атомные веса (видеть Гипотеза Праута ), что было опровергнуто при более точных измерениях.[12]:39–42
В 1886 г. Юджин Гольдштейн обнаруженный лучи канала (также известные как анодные лучи) и показали, что это положительно заряженные частицы (ионы), полученные из газов. Однако, поскольку частицы из разных газов имели разные значения отношение заряда к массе (э / м), их нельзя было отождествить с одной частицей, в отличие от отрицательной электроны обнаружен Дж. Дж. Томсон. Вильгельм Вена в 1898 году идентифицировал ион водорода как частицу с самым высоким отношением заряда к массе в ионизированных газах.[13]
После открытия атомного ядра Эрнест Резерфорд в 1911 г., Антониус ван ден Брук предложил, чтобы место каждого элемента в периодическая таблица (его атомный номер) равен заряду его ядра. Это подтверждено экспериментально Генри Мозли в 1913 г. Рентгеновские спектры.
В 1917 году (в экспериментах, опубликованных в 1919 и 1925 годах) Резерфорд доказал, что ядро водорода присутствует в других ядрах, результат обычно описывается как открытие протонов.[14] Эти эксперименты начались после того, как Резерфорд заметил, что когда альфа-частицы были выпущены в воздух (в основном азотом), его сцинтилляционные детекторы показали характерные черты ядер водорода как продукта. После экспериментов Резерфорд проследил реакцию на азот в воздухе и обнаружил, что когда альфа-частицы вводились в чистый газообразный азот, эффект был сильнее. В 1919 году Резерфорд предположил, что альфа-частица выбила протон из азота, превратив его в углерод. После наблюдения изображений камеры Вильсона Блэкетта в 1925 году Резерфорд понял, что все было наоборот: после захвата альфа-частицы протон выбрасывается, так что тяжелый кислород, а не углерод, является конечным результатом, то есть Z не уменьшается, а увеличивается. Это было первое сообщение ядерная реакция, 14N + α → 17О + п. В зависимости от точки зрения, 1919 или 1925 год можно рассматривать как момент «открытия» протона.
Резерфорд знал, что водород — самый простой и легкий элемент, и на него повлияли Гипотеза Праута что водород был строительным блоком всех элементов. Открытие того, что ядро водорода присутствует во всех других ядрах в качестве элементарной частицы, привело Резерфорда к тому, чтобы дать ядру водорода особое имя как частица, поскольку он подозревал, что водород, самый легкий элемент, содержит только одну из этих частиц. Он назвал этот новый фундаментальный строительный блок ядра протон, после среднего единственного числа греческого слова «первый», πρῶτον. Однако Резерфорд также имел в виду слово протил как используется Prout. Резерфорд выступил на Британская ассоциация развития науки на своем Кардифф Начало встречи 24 августа 1920 г.[15] Резерфорда спросил Оливер Лодж для нового названия положительного ядра водорода, чтобы избежать путаницы с нейтральным атомом водорода. Первоначально он предложил как протон и Prouton (по Пруту).[16] Позже Резерфорд сообщил, что собрание приняло его предложение назвать ядро водорода «протоном», следуя слову Праута «протил».[17] Первое употребление слова «протон» в научной литературе появилось в 1920 году.[18]
Недавние исследования показали, что грозы могут производить протоны с энергией до нескольких десятков МэВ.[19][20]
Протоны обычно используются в ускорителях для протонная терапия или различные физика элементарных частиц эксперименты, самым ярким примером которых является Большой адронный коллайдер.
В статье, опубликованной в июле 2017 года, исследователи измерили массу протона. 1.007276466583+15
−29 атомные единицы массы (значения после числа — статистическая и систематическая погрешности соответственно), что ниже, чем измерения из CODATA 2014 значение на три стандартных отклонения.[21][22]
Стабильность
| Нерешенная проблема в физике:
Принципиально ли протоны стабильны? Или они распадаются с конечным временем жизни, как предсказывают некоторые расширения стандартной модели? (больше нерешенных задач по физике) |
Свободный протон (протон, не связанный с нуклонами или электронами) — это стабильная частица, которая, как не наблюдалось, спонтанно распадается на другие частицы. Свободные протоны встречаются естественным образом в ряде ситуаций, в которых энергия или температура достаточно высоки, чтобы отделить их от электронов, к которым они имеют некоторое сродство. Свободные протоны существуют в плазма при которых температура слишком высока, чтобы позволить им сочетаться с электроны. Свободные протоны высокой энергии и скорости составляют 90% космические лучи, которые распространяются в вакууме на межзвездные расстояния. Свободные протоны испускается напрямую из атомные ядра в некоторых редких типах радиоактивный распад. Также возникают протоны (наряду с электронами и антинейтрино ) от радиоактивный распад свободных нейтронов, которые нестабильны.
Спонтанный распад свободных протонов никогда не наблюдался, и поэтому протоны считаются стабильными частицами согласно Стандартной модели. Однако некоторые теории великого объединения (GUT) физики элементарных частиц предсказывают, что распад протона должен иметь место со сроками жизни от 1031 до 1036 лет и экспериментальные поиски установили нижнюю границу средняя продолжительность жизни протона для различных предполагаемых продуктов распада.[23][24][25]
Эксперименты на Супер-Камиоканде детектор в Японии дал более низкие пределы для протонов средняя продолжительность жизни из 6.6×1033 годы для распада на антимюон и нейтральный пион, и 8.2×1033 годы для распада на позитрон и нейтральный пион.[26]Еще один эксперимент на Нейтринная обсерватория Садбери в Канаде искали гамма излучение в результате остаточных ядер в результате распада протона из кислорода-16. Этот эксперимент был разработан для обнаружения распада любого продукта и установил нижний предел времени жизни протона, равный 2.1×1029 годы.[27]
Однако известно, что протоны превращаются в нейтроны через процесс захват электронов (также называемый обратный бета-распад ). Для свободных протонов этот процесс происходит не спонтанно, а только при подаче энергии. Уравнение:
п+
+
е−
→
п
+
ν
е
Процесс обратимый; нейтроны могут превращаться обратно в протоны через бета-распад, распространенная форма радиоактивный распад. Фактически, свободный нейтрон распадается таким образом, с средняя продолжительность жизни около 15 минут.
Кварки и масса протона
В квантовая хромодинамика, современная теория ядерной силы, большая часть массы протонов и нейтроны объясняется специальная теория относительности. Масса протона примерно в 80–100 раз больше суммы масс покоя протона. кварки которые составляют это, в то время как глюоны иметь нулевую массу покоя. Дополнительная энергия кварки и глюоны в области внутри протона, по сравнению с энергией покоя только кварков в КХД вакуум, составляет почти 99% масс. Таким образом, масса покоя протона равна инвариантная масса системы движущихся кварков и глюонов, составляющих частицу, и в таких системах даже энергия безмассовых частиц равна все еще измеряется как часть остальной массы системы.
Для обозначения массы кварков, составляющих протоны, используются два термина: текущий кварк масса относится к массе самого кварка, а составляющий кварк масса относится к текущей массе кварка плюс массе глюон поле частиц окружающий кварк.[28]:285–286 [29]:150–151 Эти массы обычно имеют очень разные значения. Как уже отмечалось, большая часть массы протона происходит от глюонов, которые связывают текущие кварки вместе, а не от самих кварков. Хотя глюоны по своей природе безмассовые, они обладают энергией, а точнее говоря, энергия связи квантовой хромодинамики (QCBE) — и именно это так сильно влияет на общую массу протонов (см. масса в специальной теории относительности ). Протон имеет массу примерно 938МэВ / c2, из которых масса покоя трех его валентных кварков дает только около 9,4 МэВ / c2; большую часть остатка можно отнести к глюонам. QCBE.[30][31][32]
Волновая функция модели составляющего кварка для протона равна
Внутренняя динамика протонов сложна, потому что она определяется кварками, обменивающимися глюонами и взаимодействующими с различными вакуумными конденсатами. Решетка КХД дает возможность вычислить массу протона прямо из теории с любой принципиальной точностью. Самые последние расчеты[33][34] утверждают, что масса определяется с точностью лучше 4%, даже с точностью до 1% (см. рисунок S5 в Dürr и другие.[34]). Эти утверждения до сих пор спорны, потому что расчеты еще не могут быть выполнены с кварками, такими легкими, как в реальном мире. Это означает, что прогнозы находятся в процессе экстраполяция, которые могут вносить систематические ошибки.[35] Трудно сказать, правильно ли контролируются эти ошибки, потому что величины, которые сравниваются с экспериментом, являются массами адроны, которые известны заранее.
Эти недавние вычисления выполняются на огромных суперкомпьютерах, и, как отметили Боффи и Паскини: «подробное описание структуры нуклона все еще отсутствует, потому что … поведение на больших расстояниях требует непертурбативной и / или численной обработки …»[36]Более концептуальные подходы к структуре протонов: топологический солитон подход первоначально из-за Тони Скирм и точнее AdS / QCD подход который расширяет его, чтобы включить теория струн глюонов,[37] различные модели, вдохновленные КХД, такие как модель сумки и составляющий кварк модели, которые были популярны в 1980-х, и Правила сумм SVZ, позволяющие производить грубые приблизительные расчеты массы.[38] Эти методы не обладают такой же точностью, как методы КХД с использованием более грубой силы решетки, по крайней мере, пока.
Радиус заряда
|
|
Этот раздел должен быть обновлено. Причина: как указано в Наука, то головоломка радиус протона возможно было решено. Новое измерение с использованием лэмбовского сдвига в обычном водороде согласуется с измерениями с использованием мюонного водорода. Обновите эту статью, чтобы отразить недавние события или новую доступную информацию. (Сентябрь 2019) |
Задача определения радиуса для атомного ядра (протона) аналогична проблеме радиус атома, в том, что ни атомы, ни их ядра не имеют определенных границ. Однако ядро можно смоделировать как сферу положительного заряда для интерпретации рассеяние электронов эксперименты: поскольку нет определенной границы с ядром, электроны «видят» диапазон поперечных сечений, для которых можно принять среднее значение. Квалификация «rms» (для «среднеквадратичное значение «) возникает потому, что это ядерное поперечное сечение, пропорциональное квадрату радиуса, которое является определяющим для рассеяния электронов.
Международно признанное значение протона радиус заряда является 0.8768 FM (видеть порядки величины для сравнения с другими размерами). Это значение основано на измерениях с участием протона и электрона (а именно, рассеяние электронов измерения и комплексный расчет сечений рассеяния на основе Розенблют уравнение для сечение передачи импульса ) и исследования атомной уровни энергии водорода и дейтерия.
Однако в 2010 году международная группа исследователей опубликовала результаты измерения зарядового радиуса протона с помощью Баранина сдвиг в мюонном водороде ( экзотический атом состоит из протона и отрицательно заряженного мюон ). Поскольку мюон в 200 раз тяжелее электрона, его длина волны де Бройля соответственно короче. Этот меньший атомная орбиталь намного более чувствителен к радиусу заряда протона, поэтому позволяет более точное измерение. Их измерение среднеквадратичный зарядовый радиус протона составляет «0.84184(67) фм, который отличается на 5.0 Стандартное отклонение от CODATA значение 0,8768 (69) фм«.[39] В январе 2013 года обновленное значение зарядового радиуса протона —0.84087(39) фм-был опубликован. Точность была улучшена в 1,7 раза, достоверность расхождения увеличилась до 7σ.[6]Корректировка CODATA 2014 г. немного снизила рекомендуемое значение радиуса протона (рассчитанного с использованием только электронных измерений) до 0,8751 (61) фм, но это оставляет расхождение на уровне 5,6σ.
Международная исследовательская группа, получившая этот результат в Институт Пауля Шеррера в Виллиген включает ученых из Институт квантовой оптики Макса Планка, Ludwig-Maximilians-Universität, то Institut für Strahlwerkzeuge из Universität Stuttgart, а Коимбрский университет, Португалия.[40][41] Команда теперь пытается объяснить расхождение и повторно исследует результаты как предыдущих высокоточных измерений, так и сложных вычислений, включающих рассеяние поперечное сечение. Если в измерениях или расчетах не обнаружено ошибок, может потребоваться повторное рассмотрение самой точной и проверенной фундаментальной теории в мире: квантовая электродинамика.[40] По состоянию на 2017 год радиус протона остается загадкой.[42] Возможно, расхождение связано с новой физикой, или объяснение может быть обычным физическим эффектом, который был упущен.[43]
Радиус связан с форм-фактором и сечение передачи импульса. Атомный форм-фактор G изменяет сечение, соответствующее точечному протону.
В атомарный форм-фактор связана с плотностью волновой функции цели:
Форм-фактор можно разделить на электрический и магнитный. В дальнейшем они могут быть записаны как линейные комбинации форм-факторов Дирака и Паули.[43]
Давление внутри протона
Поскольку протон состоит из кварков, удерживаемых глюонами, эквивалентный давление который действует на кварки, можно определить. Это позволяет рассчитать их распределение как функцию расстояния от центра, используя Комптоновское рассеяние электронов высоких энергий (DVCS, для глубоко виртуальное комптоновское рассеяние). Давление максимальное в центре, около 1035 Па, превышающее давление внутри нейтронная звезда.[44] Он положительный (отталкивающий) на радиальном расстоянии около 0,6 фм, отрицательный (притягивающий) на больших расстояниях и очень слабый на расстоянии более 2 фм.
Радиус заряда в сольватированном протоне, гидроксоний
Радиус гидратированного протона появляется в Уравнение Борна для расчета энтальпии гидратации гидроксоний.
Взаимодействие свободных протонов с обычным веществом
Хотя протоны имеют сродство к противоположно заряженным электронам, это взаимодействие с относительно низкой энергией, поэтому свободные протоны должны терять достаточную скорость (и кинетическая энергия ), чтобы стать тесно связанным с электронами. Протоны высоких энергий, пересекая обычное вещество, теряют энергию из-за столкновений с атомные ядра, и по ионизация атомов (удаляя электроны), пока они не замедлятся достаточно, чтобы быть захваченными электронное облако в нормальном атоме.
Однако при такой ассоциации с электроном характер связанного протона не меняется, и он остается протоном. Притяжение свободных протонов низкой энергии к любым электронам, присутствующим в нормальном веществе (например, электронам в нормальных атомах), заставляет свободные протоны останавливаться и образовывать новую химическую связь с атомом. Такая связь происходит при любой достаточно «холодной» температуре (т.е. сравнимой с температурами на поверхности Солнца) и с любым типом атома. Таким образом, при взаимодействии с любым типом нормального (неплазменного) вещества низкоскоростные свободные протоны притягиваются к электронам в любом атоме или молекуле, с которыми они вступают в контакт, заставляя протон и молекулу объединяться.Такие молекулы называются «протонированный «, и химически они часто в результате становятся так называемыми Кислоты Бренстеда.
Протон в химии
Атомный номер
В химия, количество протонов в ядро атома известен как атомный номер, что определяет химический элемент которому принадлежит атом. Например, атомный номер хлор 17 лет; это означает, что каждый атом хлора имеет 17 протонов и что все атомы с 17 протонами являются атомами хлора. Химические свойства каждого атома определяются количеством (отрицательно заряженных) электроны, что для нейтральных атомов равно количеству (положительных) протонов, так что полный заряд равен нулю. Например, нейтральный атом хлора имеет 17 протонов и 17 электронов, тогда как Cl− анион имеет 17 протонов и 18 электронов с общим зарядом -1.
Однако все атомы данного элемента не обязательно идентичны. В количество нейтронов может отличаться в форме другого изотопы, и уровни энергии могут различаться, что приводит к разным ядерные изомеры. Например, есть два стабильных изотопы хлора: 35
17Cl
с 35 — 17 = 18 нейтронов и 37
17Cl
с 37 — 17 = 20 нейтронов.
Ион водорода
Протий, наиболее распространенный изотоп водорода, состоит из одного протона и одного электрона (у него нет нейтронов). Термин «ион водорода» (ЧАС+
) означает, что этот атом водорода потерял один электрон, в результате чего остался только протон. Таким образом, в химии термины «протон» и «ион водорода» (для изотопа протия) используются как синонимы.
Протон — это уникальная химическая форма, представляющая собой голое ядро. Как следствие, он не имеет независимого существования в конденсированном состоянии и неизменно оказывается связанным парой электронов с другим атомом.
Росс Стюарт, Протон: приложение к органической химии (1985, стр.1)
В химии термин протон относится к иону водорода, ЧАС+
. Поскольку атомный номер водорода равен 1, ион водорода не имеет электронов и соответствует голому ядру, состоящему из протона (и 0 нейтронов для наиболее распространенного изотопа. протий 1
1ЧАС
). Протон представляет собой «голый заряд» с радиусом всего лишь около 1/64 000 от радиуса атома водорода, поэтому он чрезвычайно химически активен. Таким образом, свободный протон имеет чрезвычайно короткое время жизни в химических системах, таких как жидкости, и немедленно вступает в реакцию с электронное облако любой доступной молекулы. В водном растворе образует ион гидроксония, H3О+, что, в свою очередь, растворенный молекулами воды в кластеры например [H5О2]+ и [H9О4]+.[45]
Передача ЧАС+
в кислотно-основная реакция обычно называют «перенос протона». В кислота называется донором протона, а основание как акцептор протонов. Так же, биохимический такие термины, как протонный насос и протонный канал относятся к движению гидратированных ЧАС+
ионы.
Ион, полученный путем удаления электрона из дейтерий атом известен как дейтрон, а не протон. Точно так же удаление электрона из тритий атом производит тритон.
Протонный ядерный магнитный резонанс (ЯМР)
Также в химии термин «протонный ЯМР «относится к наблюдению ядер водорода-1 в (в основном органический ) молекулы ядерный магнитный резонанс. Этот метод использует вращение протона, имеющего значение половину (в единицах бар ). Название относится к изучению протонов, как они встречаются в протий (атомы водорода-1) в соединениях, и не означает, что в исследуемом соединении существуют свободные протоны.
Воздействие на человека
В Пакеты для экспериментов на Лунной поверхности Аполлона (ALSEP) определили, что более 95% частиц в Солнечный ветер — электроны и протоны, примерно в равных количествах.[46][47]
Потому что солнечный ветер Спектрометр проводились непрерывные измерения, можно было измерить, как Магнитное поле Земли влияет на прибывающие частицы солнечного ветра. Примерно две трети каждой орбиты Луна находится вне магнитного поля Земли. В это время типичная плотность протонов составляла от 10 до 20 на кубический сантиметр, при этом большинство протонов имели скорости от 400 до 650 километров в секунду. Примерно пять дней каждого месяца Луна находится внутри геомагнитного хвоста Земли, и обычно частицы солнечного ветра не обнаруживаются. Оставшуюся часть каждой лунной орбиты Луна находится в переходной области, известной как магнитослой, где магнитное поле Земли влияет на солнечный ветер, но не исключает его полностью. В этой области поток частиц снижается с типичной скоростью протонов от 250 до 450 километров в секунду. В течение лунной ночи спектрометр был защищен от солнечного ветра Луной, и частицы солнечного ветра не измерялись.[46]
Протоны также имеют внесолнечное происхождение из галактических космические лучи, где они составляют около 90% от общего потока частиц. Эти протоны часто имеют более высокую энергию, чем протоны солнечного ветра, и их интенсивность гораздо более однородна и менее изменчива, чем протоны, исходящие от Солнца, на образование которых сильно влияет солнечные протонные события Такие как выбросы корональной массы.
Было проведено исследование эффектов мощности дозы протонов, которые обычно обнаруживаются в космическое путешествие, на здоровье человека.[47][48] Чтобы быть более конкретным, есть надежда определить, какие конкретные хромосомы повреждены, и определить повреждение во время рак развитие от воздействия протонов.[47] Другое исследование направлено на определение «эффектов воздействия протонного излучения на нейрохимические и поведенческие конечные точки, включая дофаминергический функционирование, амфетамин -индуцированное обучение отвращению вкуса, пространственное обучение и память, измеряемые Водный лабиринт Морриса.[48] Электрическая зарядка космического корабля за счет межпланетной протонной бомбардировки также предлагается для изучения.[49] Есть еще много исследований, касающихся космических путешествий, в том числе галактические космические лучи и их возможные последствия для здоровья, и солнечное протонное событие контакт.
В Американский Biostack и советский Biorack эксперименты в космических путешествиях продемонстрировали серьезность молекулярных повреждений, вызванных тяжелыми ионами на микроорганизмы включая Артемия кисты.[50]
Антипротон
CPT-симметрия накладывает строгие ограничения на относительные свойства частиц и античастицы и, следовательно, открыт для строгих испытаний. Например, заряды протона и антипротона должны в сумме равняться нулю. Это равенство было проверено до одной части в 108. Равенство их масс также было проверено лучше, чем одна часть в 108. Удерживая антипротоны в Ловушка Пеннинга, равенство отношения заряда к массе протонов и антипротонов было проверено до одной части в 6×109.[51] В магнитный момент антипротонов измерена с погрешностью 8×10−3 ядерный Магнетоны Бора, и оказывается равным протону и противоположным ему.
Смотрите также
- Фермионное поле
- Водород
- Гидрон (химия)
- Список частиц
- Протон-протонная цепная реакция
- Кварковая модель
- Протонный спиновой кризис
Рекомендации
- ^ «2018 CODATA Значение: масса протона». Справочник NIST по константам, единицам и неопределенности. NIST. 20 мая 2019. Получено 2019-05-20.
- ^ а б c d е ж грамм «Рекомендуемые значения CODATA на 2018 г.» https://physics.nist.gov/cuu/Constants/index.html
- ^ «протон | Определение, масса, заряд и факты». Энциклопедия Британника. Получено 2018-10-20.
- ^ Чо, Адриан (2 апреля 2010 г.). «Наконец прибита масса обычного кварка». Научный журнал. Американская ассоциация развития науки. Получено 27 сентября 2014.
- ^ «Пазл размером с протон усилен!». Институт Пола Ширера. 25 января 2013 г.
- ^ а б Антоньини, Альдо; и другие. (25 января 2013 г.). «Структура протона по измерению частот перехода 2S-2P мюонного водорода» (PDF). Наука. 339 (6118): 417–420. Bibcode:2013Наука … 339..417А. Дои:10.1126 / science.1230016. HDL:10316/79993. PMID 23349284. S2CID 346658.
- ^ Безгинов, Н .; Valdez, T .; Horbatsch, M .; Марсман, А .; Vutha, A.C .; Хессельс, Э. А. (06.09.2019). «Измерение лэмбовского сдвига атомарного водорода и зарядового радиуса протона». Наука. 365 (6457): 1007–1012. Bibcode:2019Научный … 365.1007B. Дои:10.1126 / science.aau7807. ISSN 0036-8075. PMID 31488684. S2CID 201845158.
- ^ Xiong, W .; Гаспарян, А .; Gao, H .; Dutta, D .; Khandaker, M .; Liyanage, N .; Пасюк, Э .; Peng, C .; Bai, X .; Ye, L .; Гнанво, К. (ноябрь 2019 г.). «Малый зарядовый радиус протона из эксперимента по рассеянию электронов на протонах». Природа. 575 (7781): 147–150. Bibcode:2019Натура.575..147X. Дои:10.1038 / s41586-019-1721-2. ISSN 1476-4687. OSTI 1575200. PMID 31695211. S2CID 207831686.
- ^ Адаир, Р. К. (1989). Великий замысел: частицы, поля и творение. Oxford University Press. п. 214. Bibcode:1988gdpf.book ….. A.
- ^ Cottingham, W. N .; Гринвуд, Д. А. (1986). Введение в ядерную физику. Издательство Кембриджского университета. ISBN 9780521657334.
- ^ Basdevant, J.-L .; Rich, J .; Спиро, М. (2005). Основы ядерной физики. Springer. п. 155. ISBN 978-0-387-01672-6.
- ^ Кафедра химии и биохимии Калифорнийского университета в Лос-Анджелесе, лектор Эрик Р. Серри (2006-10-12). Периодическая таблица: ее история и ее значение: ее история и ее значение. Oxford University Press. ISBN 978-0-19-534567-4.
- ^ Вена, Вильгельм (1904). «Uber Positive Elektronen und die Existenz hoher Atomgewichte». Annalen der Physik. 318 (4): 669–677. Bibcode:1904AnP … 318..669Вт. Дои:10.1002 / andp.18943180404.
- ^ Петруччи, Р. Х .; Harwood, W. S .; Херринг, Ф. Г. (2002). Общая химия (8-е изд.). Река Аппер Сэдл, Нью-Джерси: Prentice Hall. п.41.
- ^ Видеть отчет о встрече и объявление
- ^ Ромер А. (1997). «Протон или прутон? Резерфорд и глубины атома». Американский журнал физики. 65 (8): 707. Bibcode:1997AmJPh..65..707R. Дои:10.1119/1.18640.
- ^ Резерфорд сообщил о принятии Британская ассоциация в сноске к Массон, О. (1921). «XXIV. Строение атомов». Философский журнал. 6 серия. 41 (242): 281–285. Дои:10.1080/14786442108636219.
- ^ Пайс, А. (1986). Внутренняя граница. Oxford University Press. п.296. ISBN 0198519974. Паис считал, что впервые в научной литературе это слово использовалось протон происходит в «Физика в Британской ассоциации». Природа. 106 (2663): 357–358. 1920. Bibcode:1920Натура.106..357.. Дои:10.1038 / 106357a0.
- ^ Köhn, C .; Эберт, У. (2015). «Расчет пучков позитронов, нейтронов и протонов, связанных с земными гамма-вспышками» (PDF). Журнал геофизических исследований: атмосферы. 23 (4): 1620–1635. Bibcode:2015JGRD..120.1620K. Дои:10.1002 / 2014JD022229.
- ^ Köhn, C .; Диниз, Г .; Хараке, Мухсин (2017). «Механизмы производства лептонов, фотонов и адронов и их возможная обратная связь, близкая к лидерам молний». Журнал геофизических исследований: атмосферы. 122 (2): 1365–1383. Bibcode:2017JGRD..122.1365K. Дои:10.1002 / 2016JD025445. ЧВК 5349290. PMID 28357174.
- ^ Попкин, Габриэль (20 июля 2017 г.). «Сюрприз! Протон легче, чем мы думали». Наука.
- ^ Heiße, F .; Köhler-Langes, F .; Rau, S .; Hou, J .; Junck, S .; Kracke, A .; Mooser, A .; Квинт, Вт .; Ulmer, S .; Werth, G .; Blaum, K .; Штурм, С. (18 июля 2017 г.). «Высокоточное измерение атомной массы протона». Письма с физическими проверками. 119 (3): 033001. arXiv:1706.06780. Bibcode:2017PhRvL.119c3001H. Дои:10.1103 / PhysRevLett.119.033001. PMID 28777624. S2CID 31683973.
- ^ Buccella, F .; Miele, G .; Rosa, L .; Santorelli, P .; Тузи, Т. (1989). «Верхний предел времени жизни протона в SO (10)». Письма по физике B. 233 (1–2): 178–182. Bibcode:1989ФЛБ..233..178Б. Дои:10.1016/0370-2693(89)90637-0.
- ^ Lee, D.G .; Mohapatra, R .; Parida, M .; Рани, М. (1995). «Прогнозы времени жизни протона в минимальных несуперсимметричных моделях SO (10): обновление». Физический обзор D. 51 (1): 229–235. arXiv:hep-ph / 9404238. Bibcode:1995ПхРвД..51..229Л. Дои:10.1103 / PhysRevD.51.229. PMID 10018289.
- ^ «Время жизни протона больше 1034 годы». Обсерватория Камиока. Ноябрь 2009 г.
- ^ Нишино, H .; и другие. (2009). «Искать распад протона через p → e+π0 и p → μ+π0 в большом водяном черенковском детекторе ». Письма с физическими проверками. 102 (14): 141801. arXiv:0903.0676. Bibcode:2009ПхРвЛ.102н1801Н. Дои:10.1103 / PhysRevLett.102.141801. PMID 19392425. S2CID 32385768.
- ^ Ахмед, S .; и другие. (2004). «Ограничения на распад нуклонов через невидимые режимы из нейтринной обсерватории Садбери». Письма с физическими проверками. 92 (10): 102004. arXiv:hep-ex / 0310030. Bibcode:2004PhRvL..92j2004A. Дои:10.1103 / PhysRevLett.92.102004. PMID 15089201. S2CID 119336775.
- ^ Уотсон, А. (2004). Квантовый кварк. Издательство Кембриджского университета. С. 285–286. ISBN 978-0-521-82907-6.
- ^ Смит, Тимоти Пол (2003). Скрытые миры: охота на кварки в обычной материи. Princeton University Press. Bibcode:2003hwhq.book ….. S. ISBN 978-0-691-05773-6.
- ^ Weise, W .; Грин, А. М. (1984). Кварки и ядра. Всемирный научный. С. 65–66. ISBN 978-9971-966-61-4.
- ^ Болл, Филипп (20 ноября 2008 г.). «Ядерные массы рассчитываются с нуля». Природа. Дои:10.1038 / новости.2008.1246. Получено 27 августа, 2014.
- ^ Рейнольдс, Марк (апрель 2009 г.). «Расчет массы протона». Международный журнал CNRS (13). ISSN 2270-5317. Получено 27 августа, 2014.
- ^ Видеть этот новостной репортаж В архиве 2009-04-16 на Wayback Machine и ссылки
- ^ а б Durr, S .; Fodor, Z .; Frison, J .; Hoelbling, C .; Hoffmann, R .; Katz, S.D .; Krieg, S .; Kurth, T .; Lellouch, L .; Lippert, T .; Сабо, К.К .; Вулверт, Г. (2008). «Ab Initio Определение масс легких адронов». Наука. 322 (5905): 1224–1227. arXiv:0906.3599. Bibcode:2008Sci … 322.1224D. CiteSeerX 10.1.1.249.2858. Дои:10.1126 / science.1163233. PMID 19023076. S2CID 14225402.
- ^ Perdrisat, C.F .; Пенджаби, V .; Вандерхаеген, М. (2007). «Электромагнитные форм-факторы нуклонов». Прогресс в физике элементарных частиц и ядерной физике. 59 (2): 694–764. arXiv:hep-ph / 0612014. Bibcode:2007ПрПНП..59..694П. Дои:10.1016 / j.ppnp.2007.05.001. S2CID 15894572.
- ^ Боффи, Сигфридо; Паскини, Барбара (2007). «Обобщенные партонные распределения и структура нуклона». Ривиста-дель-Нуово-Чименто. 30 (9): 387. arXiv:0711.2625. Bibcode:2007NCimR..30..387B. Дои:10.1393 / NCR / i2007-10025-7. S2CID 15688157.
- ^ Джошуа, Эрлих (декабрь 2008 г.). «Последние результаты в AdS / QCD». Труды 8-й конференции по удержанию кварков и спектру адронов, 1–6 сентября 2008 г., Майнц, Германия. arXiv:0812.4976. Bibcode:2008arXiv0812.4976E.
- ^ Пьетро, Коланджело; Алекс, Ходжамирян (октябрь 2000 г.). «Правила сумм QCD, современная перспектива». В М., Шифман (ред.). На переднем крае физики элементарных частиц: Справочник по КХД. World Scientific Publishing. С. 1495–1576. arXiv:hep-ph / 0010175. Bibcode:2001afpp.book.1495C. CiteSeerX 10.1.1.346.9301. Дои:10.1142/9789812810458_0033. ISBN 978-981-02-4445-3. S2CID 16053543.
- ^ Поль, Рандольф; и другие. (8 июля 2010 г.). «Размер протона». Природа. 466 (7303): 213–216. Bibcode:2010Натура.466..213P. Дои:10.1038 / природа09250. PMID 20613837. S2CID 4424731.
- ^ а б Исследователи наблюдают неожиданно малый радиус протона в прецизионном эксперименте. AZo Nano. 9 июля 2010 г.
- ^ «Протон стал меньше». Photonics.Com. 12 июля 2010 г.. Получено 2010-07-19.
- ^ Коновер, Эмили (2017-04-18). «Мы еще многого не знаем о протоне». Новости науки. Получено 2017-04-29.
- ^ а б Карлсон, Карл Э. (май 2015 г.). «Загадка протонного радиуса». Прогресс в физике элементарных частиц и ядерной физике. 82: 59–77. arXiv:1502.05314. Bibcode:2015ПрПНП..82 … 59С. Дои:10.1016 / j.ppnp.2015.01.002. S2CID 54915587.
- ^ Burkert, V.D .; Elouadrhiri, L .; Жирод, Ф. X. (16 мая 2018 г.). «Распределение давления внутри протона». Природа. 557 (7705): 396–399. Bibcode:2018Натура.557..396Б. Дои:10.1038 / s41586-018-0060-z. OSTI 1438388. PMID 29769668. S2CID 21724781.
- ^ Хедрик, Дж. М .; Diken, E.G .; Уолтерс, Р. С .; Hammer, N.I .; Кристи, Р. А .; Cui, J .; Мышакин, Э. М .; Дункан, М. А .; Johnson, M. A .; Джордан, К. Д. (2005). «Спектральные характеристики колебаний гидратированных протонов в водных кластерах». Наука. 308 (5729): 1765–1769. Bibcode:2005Наука … 308.1765H. Дои:10.1126 / science.1113094. PMID 15961665. S2CID 40852810.
- ^ а б «Миссия Аполлона-11». Лунно-планетарный институт. 2009. Получено 2009-06-12.
- ^ а б c «Космические путешествия и рак связаны? Исследователь из Стоуни-Брук получил грант НАСА на изучение воздействия космической радиации». Брукхейвенская национальная лаборатория. 12 декабря 2007. Архивировано с оригинал 26 ноября 2008 г.. Получено 2009-06-12.
- ^ а б Shukitt-Hale, B .; Szprengiel, A .; Pluhar, J .; Рабин, Б. М .; Джозеф, Дж. А. (2004). «Влияние протонного воздействия на нейрохимию и поведение». Успехи в космических исследованиях. 33 (8): 1334–9. Bibcode:2004AdSpR..33.1334S. Дои:10.1016 / j.asr.2003.10.038. PMID 15803624. Архивировано из оригинал на 2011-07-25. Получено 2009-06-12.
- ^ Грин, Н. З .; Фредериксон, А. Р. (2006). «Исследование заряда космического корабля из-за воздействия межпланетных протонов» (PDF). Материалы конференции AIP. 813: 694–700. Bibcode:2006AIPC..813..694G. CiteSeerX 10.1.1.541.4495. Дои:10.1063/1.2169250. Архивировано из оригинал (PDF) на 2010-05-27. Получено 2009-06-12.
- ^ Планель, Х. (2004). Космос и жизнь: введение в космическую биологию и медицину. CRC Press. С. 135–138. ISBN 978-0-415-31759-7.
- ^ Габриэльс, Г. (2006). «Измерение массы антипротонов». Международный журнал масс-спектрометрии. 251 (2–3): 273–280. Bibcode:2006IJMSp.251..273G. Дои:10.1016 / j.ijms.2006.02.013.
внешняя ссылка
- Группа данных о частицах в LBL
- Большой адронный коллайдер
- Карнизы, Лоуренс; Коупленд, Эд; Падилья, Антонио (Тони) (2010). «Сжимающийся протон». Шестьдесят символов. Брэди Харан для Ноттингемский университет.





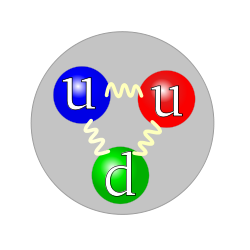











![{ displaystyle | p _ { uparrow} rangle = { frac {1} { sqrt {18}}} [2 | u_ { uparrow} d _ { downarrow} u _ { uparrow} rangle +2 | u _ { uparrow} u _ { uparrow} d _ { downarrow} rangle +2 | d _ { downarrow} u _ { uparrow} u_ { uparrow} rangle - | u _ { uparrow} u _ { downarrow} d _ { uparrow} rangle - | u _ { uparrow} d _ { uparrow} u _ { downarrow} rangle - | u _ { downarrow} d _ { uparrow} u _ { uparrow} rangle - | d _ { uparrow} u _ { downarrow} u _ { uparrow} rangle - | d _ { uparrow} u _ { uparrow} u _ { downarrow} rangle - | u _ { downarrow} u _ { uparrow} d _ { uparrow } rangle].}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9065e6a4a38b5ba8d274c20baad0a25ac6bc1457)

