|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mercury | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Appearance | shiny, silvery liquid | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Standard atomic weight Ar°(Hg) |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mercury in the periodic table | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic number (Z) | 80 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Group | group 12 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Period | period 6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Block | d-block | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electron configuration | [Xe] 4f14 5d10 6s2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrons per shell | 2, 8, 18, 32, 18, 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physical properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase at STP | liquid | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Melting point | 234.3210 K (−38.8290 °C, −37.8922 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Boiling point | 629.88 K (356.73 °C, 674.11 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Density (near r.t.) | 13.534 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Triple point | 234.3156 K, 1.65×10−7 kPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Critical point | 1750 K, 172.00 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of fusion | 2.29 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of vaporization | 59.11 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar heat capacity | 27.983 J/(mol·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Vapor pressure
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidation states | −2 , +1, +2 (a mildly basic oxide) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegativity | Pauling scale: 2.00 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ionization energies |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic radius | empirical: 151 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Covalent radius | 132±5 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waals radius | 155 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Spectral lines of mercury |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Other properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Natural occurrence | primordial | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | rhombohedral
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Speed of sound | liquid: 1451.4 m/s (at 20 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermal expansion | 60.4 µm/(m⋅K) (at 25 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermal conductivity | 8.30 W/(m⋅K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrical resistivity | 961 nΩ⋅m (at 25 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetic ordering | diamagnetic[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar magnetic susceptibility | −33.44×10−6 cm3/mol (293 K)[3] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS Number | 7439-97-6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| History | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Discovery | Ancient Egyptians (before 1500 BCE) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Symbol | «Hg»: from its Latin name hydrargyrum, itself from Greek hydrárgyros, ‘water-silver’ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Main isotopes of mercury
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| references |
Mercury is a chemical element with the symbol Hg and atomic number 80. It is also known as quicksilver and was formerly named hydrargyrum ( hy-DRAR-jər-əm) from the Greek words hydor (water) and argyros (silver).[4] A heavy, silvery d-block element, mercury is the only metallic element that is known to be liquid at standard temperature and pressure; the only other element that is liquid under these conditions is the halogen bromine, though metals such as caesium, gallium, and rubidium melt just above room temperature.
Mercury occurs in deposits throughout the world mostly as cinnabar (mercuric sulfide). The red pigment vermilion is obtained by grinding natural cinnabar or synthetic mercuric sulfide.
Mercury is used in thermometers, barometers, manometers, sphygmomanometers, float valves, mercury switches, mercury relays, fluorescent lamps and other devices, though concerns about the element’s toxicity have led to mercury thermometers and sphygmomanometers being largely phased out in clinical environments in favor of alternatives such as alcohol- or galinstan-filled glass thermometers and thermistor- or infrared-based electronic instruments. Likewise, mechanical pressure gauges and electronic strain gauge sensors have replaced mercury sphygmomanometers.
Mercury remains in use in scientific research applications and in amalgam for dental restoration in some locales. It is also used in fluorescent lighting. Electricity passed through mercury vapor in a fluorescent lamp produces short-wave ultraviolet light, which then causes the phosphor in the tube to fluoresce, making visible light.
Mercury poisoning can result from exposure to water-soluble forms of mercury (such as mercuric chloride or methylmercury), by inhalation of mercury vapor, or by ingesting any form of mercury.
Properties
Physical properties
Mercury is a heavy, silvery-white metal that is liquid at room temperature. Compared to other metals, it is a poor conductor of heat, but a fair conductor of electricity.[6]
It has a freezing point of −38.83 °C and a boiling point of 356.73 °C,[7][8][9] both the lowest of any stable metal, although preliminary experiments on copernicium and flerovium have indicated that they have even lower boiling points.[10] This effect is due to lanthanide contraction and relativistic contraction reducing the radius of the outermost electrons, and thus weakening the metallic bonding in mercury.[8] Upon freezing, the volume of mercury decreases by 3.59% and its density changes from 13.69 g/cm3 when liquid to 14.184 g/cm3 when solid. The coefficient of volume expansion is 181.59 × 10−6 at 0 °C, 181.71 × 10−6 at 20 °C and 182.50 × 10−6 at 100 °C (per °C). Solid mercury is malleable and ductile and can be cut with a knife.[11]
Table of thermal and physical properties of liquid mercury:[12][13]
| Temperature (°C) | Density (kg/m^3) | Specific heat (kJ/kg K) | Kinematic viscosity (m^2/s) | Conductivity (W/m K) | Thermal diffusivity (m^2/s) | Prandtl Number | Bulk modulus (K^-1) |
| 0 | 13628.22 | 0.1403 | 1.24E-07 | 8.2 | 4.30E-06 | 0.0288 | 0.000181 |
| 20 | 13579.04 | 0.1394 | 1.14E-07 | 8.69 | 4.61E-06 | 0.0249 | 0.000181 |
| 50 | 13505.84 | 0.1386 | 1.04E-07 | 9.4 | 5.02E-06 | 0.0207 | 0.000181 |
| 100 | 13384.58 | 0.1373 | 9.28E-08 | 10.51 | 5.72E-06 | 0.0162 | 0.000181 |
| 150 | 13264.28 | 0.1365 | 8.53E-08 | 11.49 | 6.35E-06 | 0.0134 | 0.000181 |
| 200 | 13144.94 | 0.157 | 8.02E-08 | 12.34 | 6.91E-06 | 0.0116 | 0.000181 |
| 250 | 13025.6 | 0.1357 | 7.65E-08 | 13.07 | 7.41E-06 | 0.0103 | 0.000183 |
| 315.5 | 12847 | 0.134 | 6.73E-08 | 14.02 | 8.15E-06 | 0.0083 | 0.000186 |
Chemical properties
Mercury does not react with most acids, such as dilute sulfuric acid, although oxidizing acids such as concentrated sulfuric acid and nitric acid or aqua regia dissolve it to give sulfate, nitrate, and chloride. Like silver, mercury reacts with atmospheric hydrogen sulfide. Mercury reacts with solid sulfur flakes, which are used in mercury spill kits to absorb mercury (spill kits also use activated carbon and powdered zinc).[14]
Amalgams
Mercury-discharge spectral calibration lamp
Mercury dissolves many metals such as gold and silver to form amalgams. Iron is an exception, and iron flasks have traditionally been used to trade mercury. Several other first row transition metals with the exception of manganese, copper and zinc are also resistant in forming amalgams. Other elements that do not readily form amalgams with mercury include platinum.[15][16] Sodium amalgam is a common reducing agent in organic synthesis, and is also used in high-pressure sodium lamps.
Mercury readily combines with aluminium to form a mercury-aluminium amalgam when the two pure metals come into contact. Since the amalgam destroys the aluminium oxide layer which protects metallic aluminium from oxidizing in-depth (as in iron rusting), even small amounts of mercury can seriously corrode aluminium. For this reason, mercury is not allowed aboard an aircraft under most circumstances because of the risk of it forming an amalgam with exposed aluminium parts in the aircraft.[17]
Mercury embrittlement is the most common type of liquid metal embrittlement.
Isotopes
There are seven stable isotopes of mercury, with 202
Hg being the most abundant (29.86%). The longest-lived radioisotopes are 194
Hg with a half-life of 444 years, and 203
Hg with a half-life of 46.612 days. Most of the remaining radioisotopes have half-lives that are less than a day. 199
Hg and 201
Hg are the most often studied NMR-active nuclei, having spins of 1⁄2 and 3⁄2 respectively.[6] For the synthesis of precious metals two stable mercury isotopes are of potential interest — the trace isotope 196
Hg and the more abundant 198
Hg. Both are «one neutron removed» from 197
Hg, a radioisotope which decays to 197
Au, the only known stable isotope of gold. However, the rarity of 196
Hg and the high energy requirements of nuclear reactions «knocking out» a neutron from 198
Hg (either via photodisintegration or via a (n,2n) reaction involving fast neutrons), have thus far ruled out practical application of this «real philosopher’s stone».
Etymology
The symbol for the planet Mercury (☿) has been used since ancient times to represent the element
«Hg» is the modern chemical symbol for mercury. It is an abbreviation of hydrargyrum, a romanized form of the ancient Greek name for mercury, ὑδράργυρος (hydrargyros). Hydrargyros is a Greek compound word meaning «water-silver», from ὑδρ— (hydr-), the root of ὕδωρ (hydor) «water», and ἄργυρος (argyros) «silver». Like the English name quicksilver («living-silver»), this name was due to mercury’s liquid and shiny properties.
The modern English name «mercury» comes from the planet Mercury. In medieval alchemy, the seven known metals—quicksilver, gold, silver, copper, iron, lead, and tin—were associated with the seven planets. Quicksilver was associated with the fastest planet, which had been named after the Roman god Mercury, who was associated with speed and mobility. The astrological symbol for the planet became one of the alchemical symbols for the metal, and «Mercury» became an alternative name for the metal. Mercury is the only metal for which the alchemical planetary name survives, as it was decided it was preferable to «quicksilver» as a chemical name.[18][19]
History
Mercury was found in Egyptian tombs that date from 1500 BC.[20]
In China and Tibet, mercury use was thought to prolong life, heal fractures, and maintain generally good health, although it is now known that exposure to mercury vapor leads to serious adverse health effects.[21] The first emperor of a unified China, Qín Shǐ Huáng Dì—allegedly buried in a tomb that contained rivers of flowing mercury on a model of the land he ruled, representative of the rivers of China—was reportedly killed by drinking a mercury and powdered jade mixture formulated by Qin alchemists intended as an elixir of immortality.[22][23] Khumarawayh ibn Ahmad ibn Tulun, the second Tulunid ruler of Egypt (r. 884–896), known for his extravagance and profligacy, reportedly built a basin filled with mercury, on which he would lie on top of air-filled cushions and be rocked to sleep.[24]
In November 2014 «large quantities» of mercury were discovered in a chamber 60 feet below the 1800-year-old pyramid known as the «Temple of the Feathered Serpent,» «the third largest pyramid of Teotihuacan,» Mexico along with «jade statues, jaguar remains, a box filled with carved shells and rubber balls».[25]
Aristotle recounts that Daedalus made a wooden statue of Venus move by pouring quicksilver in its interior.[26] In Greek mythology Daedalus gave the appearance of voice in his statues using quicksilver. The ancient Greeks used cinnabar (mercury sulfide) in ointments; the ancient Egyptians and the Romans used it in cosmetics. In Lamanai, once a major city of the Maya civilization, a pool of mercury was found under a marker in a Mesoamerican ballcourt.[27][28] By 500 BC mercury was used to make amalgams (Medieval Latin amalgama, «alloy of mercury») with other metals.[29]
Alchemists thought of mercury as the First Matter from which all metals were formed. They believed that different metals could be produced by varying the quality and quantity of sulfur contained within the mercury. The purest of these was gold, and mercury was called for in attempts at the transmutation of base (or impure) metals into gold, which was the goal of many alchemists.[18]
The mines in Almadén (Spain), Monte Amiata (Italy), and Idrija (now Slovenia) dominated mercury production from the opening of the mine in Almadén 2500 years ago, until new deposits were found at the end of the 19th century.[30]
Occurrence
Mercury is an extremely rare element in Earth’s crust, having an average crustal abundance by mass of only 0.08 parts per million (ppm).[31] Because it does not blend geochemically with those elements that constitute the majority of the crustal mass, mercury ores can be extraordinarily concentrated considering the element’s abundance in ordinary rock. The richest mercury ores contain up to 2.5% mercury by mass, and even the leanest concentrated deposits are at least 0.1% mercury (12,000 times average crustal abundance). It is found either as a native metal (rare) or in cinnabar, metacinnabar, sphalerite, corderoite, livingstonite and other minerals, with cinnabar (HgS) being the most common ore.[32][33] Mercury ores often occur in hot springs or other volcanic regions.[34]
Beginning in 1558, with the invention of the patio process to extract silver from ore using mercury, mercury became an essential resource in the economy of Spain and its American colonies. Mercury was used to extract silver from the lucrative mines in New Spain and Peru. Initially, the Spanish Crown’s mines in Almadén in Southern Spain supplied all the mercury for the colonies.[35] Mercury deposits were discovered in the New World, and more than 100,000 tons of mercury were mined from the region of Huancavelica, Peru, over the course of three centuries following the discovery of deposits there in 1563. The patio process and later pan amalgamation process continued to create great demand for mercury to treat silver ores until the late 19th century.[36]
Former mines in Italy, the United States and Mexico, which once produced a large proportion of the world supply, have now been completely mined out or, in the case of Slovenia (Idrija) and Spain (Almadén), shut down due to the fall of the price of mercury. Nevada’s McDermitt Mine, the last mercury mine in the United States, closed in 1992. The price of mercury has been highly volatile over the years and in 2006 was $650 per 76-pound (34.46 kg) flask.[37]
Mercury is extracted by heating cinnabar in a current of air and condensing the vapor. The equation for this extraction is
- HgS + O2 → Hg + SO2
In 2005, China was the top producer of mercury with almost two-thirds global share followed by Kyrgyzstan.[38]: 47 Several other countries are believed to have unrecorded production of mercury from copper electrowinning processes and by recovery from effluents.
Because of the high toxicity of mercury, both the mining of cinnabar and refining for mercury are hazardous and historic causes of mercury poisoning.[39] In China, prison labor was used by a private mining company as recently as the 1950s to develop new cinnabar mines. Thousands of prisoners were used by the Luo Xi mining company to establish new tunnels.[40] Worker health in functioning mines is at high risk.
A newspaper claimed that an unidentified European Union directive calling for energy-efficient lightbulbs to be made mandatory by 2012 encouraged China to re-open cinnabar mines to obtain the mercury required for CFL bulb manufacture. Environmental dangers have been a concern, particularly in the southern cities of Foshan and Guangzhou, and in Guizhou province in the southwest.[40]
Abandoned mercury mine processing sites often contain very hazardous waste piles of roasted cinnabar calcines. Water run-off from such sites is a recognized source of ecological damage. Former mercury mines may be suited for constructive re-use. For example, in 1976 Santa Clara County, California purchased the historic Almaden Quicksilver Mine and created a county park on the site, after conducting extensive safety and environmental analysis of the property.[41]
Chemistry
All known mercury compounds exhibit one of two positive oxidation states: I and II. Experiments have failed to unequivocally demonstrate any higher oxidation states: both the claimed 1976 electrosynthesis of an unstable Hg(III) species and 2007 cryogenic isolation of HgF4 have disputed interpretations and remain difficult (if not impossible) to reproduce.[42]
Compounds of mercury(I)
Unlike its lighter neighbors, cadmium and zinc, mercury usually forms simple stable compounds with metal-metal bonds. Most mercury(I) compounds are diamagnetic and feature the dimeric cation, Hg2+
2. Stable derivatives include the chloride and nitrate. Treatment of Hg(I) compounds complexation with strong ligands such as sulfide, cyanide, etc. induces disproportionation to Hg2+
and elemental mercury.[43] Mercury(I) chloride, a colorless solid also known as calomel, is really the compound with the formula Hg2Cl2, with the connectivity Cl-Hg-Hg-Cl. It is a standard in electrochemistry. It reacts with chlorine to give mercuric chloride, which resists further oxidation. Mercury(I) hydride, a colorless gas, has the formula HgH, containing no Hg-Hg bond.
Indicative of its tendency to bond to itself, mercury forms mercury polycations, which consist of linear chains of mercury centers, capped with a positive charge. One example is Hg2+
3(AsF−
6)
2.[44]
Compounds of mercury(II)
Mercury(II) is the most common oxidation state and is the main one in nature as well. All four mercuric halides are known. They form tetrahedral complexes with other ligands but the halides adopt linear coordination geometry, somewhat like Ag+ does. Best known is mercury(II) chloride, an easily sublimating white solid. HgCl2 forms coordination complexes that are typically tetrahedral, e.g. HgCl2−
4.
Mercury(II) oxide, the main oxide of mercury, arises when the metal is exposed to air for long periods at elevated temperatures. It reverts to the elements upon heating near 400 °C, as was demonstrated by Joseph Priestley in an early synthesis of pure oxygen.[14] Hydroxides of mercury are poorly characterized, as they are for its neighbors gold and silver.
Being a soft metal, mercury forms very stable derivatives with the heavier chalcogens. Preeminent is mercury(II) sulfide, HgS, which occurs in nature as the ore cinnabar and is the brilliant pigment vermillion. Like ZnS, HgS crystallizes in two forms, the reddish cubic form and the black zinc blende form.[6] The latter sometimes occurs naturally as metacinnabar.[33] Mercury(II) selenide (HgSe) and mercury(II) telluride (HgTe) are also known, these as well as various derivatives, e.g. mercury cadmium telluride and mercury zinc telluride being semiconductors useful as infrared detector materials.[45]
Mercury(II) salts form a variety of complex derivatives with ammonia. These include Millon’s base (Hg2N+), the one-dimensional polymer (salts of HgNH+
2)
n), and «fusible white precipitate» or [Hg(NH3)2]Cl2. Known as Nessler’s reagent, potassium tetraiodomercurate(II) (HgI2−
4) is still occasionally used to test for ammonia owing to its tendency to form the deeply colored iodide salt of Millon’s base.
Mercury fulminate is a detonator widely used in explosives.[6]
Organomercury compounds
Organic mercury compounds are historically important but are of little industrial value in the western world. Mercury(II) salts are a rare example of simple metal complexes that react directly with aromatic rings. Organomercury compounds are always divalent and usually two-coordinate and linear geometry. Unlike organocadmium and organozinc compounds, organomercury compounds do not react with water. They usually have the formula HgR2, which are often volatile, or HgRX, which are often solids, where R is aryl or alkyl and X is usually halide or acetate. Methylmercury, a generic term for compounds with the formula CH3HgX, is a dangerous family of compounds that are often found in polluted water.[46] They arise by a process known as biomethylation.
Applications
Mercury is used primarily for the manufacture of industrial chemicals or for electrical and electronic applications. It is used in some liquid-in-glass thermometers, especially those used to measure high temperatures. A still increasing amount is used as gaseous mercury in fluorescent lamps, while most of the other applications are slowly being phased out due to health and safety regulations. In some applications, mercury is replaced with less toxic but considerably more expensive Galinstan alloy.[47]
Medicine
Mercury and its compounds have been used in medicine, although they are much less common today than they once were, now that the toxic effects of mercury and its compounds are more widely understood. An example of the early therapeutic application of mercury of was published in 1787 by James Lind.[48]
The first edition of the Merck’s Manual (1899) featured many mercuric compounds[49] such as:
- Mercauro
- Mercuro-iodo-hemol.
- Mercury-ammonium chloride
- Mercury Benzoate
- Mercuric
- Mercury Bichloride (Corrosive Mercuric Chloride, U.S.P.)
- Mercury Chloride
- Mild Mercury Cyanide
- Mercury Succinimide
- Mercury Iodide
- Red Mercury Biniodide
- Mercury Iodide
- Yellow Mercury Proto-iodide
- Black (Hahnemann), Soluble Mercury Oxide
- Red Mercury Oxide
- Yellow Mercury Oxide
- Mercury Salicylate
- Mercury Succinimide
- Mercury Imido-succinate
- Mercury Sulphate
- Basic Mercury Subsulphate; Turpeth Mineral
- Mercury Tannate
- Mercury-Ammonium Chloride
Mercury is an ingredient in dental amalgams. Thiomersal (called Thimerosal in the United States) is an organic compound used as a preservative in vaccines, though this use is in decline.[50] Thiomersal is metabolized to ethyl mercury. Although it was widely speculated that this mercury-based preservative could cause or trigger autism in children, scientific studies showed no evidence supporting any such link.[51] Nevertheless, thiomersal has been removed from, or reduced to trace amounts in all U.S. vaccines recommended for children 6 years of age and under, with the exception of inactivated influenza vaccine.[52]
Another mercury compound, merbromin (Mercurochrome), is a topical antiseptic used for minor cuts and scrapes that is still in use in some countries.
Mercury in the form of one of its common ores, cinnabar, is used in various traditional medicines, especially in traditional Chinese medicine. Review of its safety has found that cinnabar can lead to significant mercury intoxication when heated, consumed in overdose, or taken long term, and can have adverse effects at therapeutic doses, though effects from therapeutic doses are typically reversible. Although this form of mercury appears to be less toxic than other forms, its use in traditional Chinese medicine has not yet been justified, as the therapeutic basis for the use of cinnabar is not clear.[53]
Today, the use of mercury in medicine has greatly declined in all respects, especially in developed countries. Thermometers and sphygmomanometers containing mercury were invented in the early 18th and late 19th centuries, respectively. In the early 21st century, their use is declining and has been banned in some countries, states and medical institutions. In 2002, the U.S. Senate passed legislation to phase out the sale of non-prescription mercury thermometers. In 2003, Washington and Maine became the first states to ban mercury blood pressure devices.[54] Mercury compounds are found in some over-the-counter drugs, including topical antiseptics, stimulant laxatives, diaper-rash ointment, eye drops, and nasal sprays. The FDA has «inadequate data to establish general recognition of the safety and effectiveness» of the mercury ingredients in these products.[55] Mercury is still used in some diuretics although substitutes now exist for most therapeutic uses.
Production of chlorine and caustic soda
Chlorine is produced from sodium chloride (common salt, NaCl) using electrolysis to separate the metallic sodium from the chlorine gas. Usually the salt is dissolved in water to produce a brine. By-products of any such chloralkali process are hydrogen (H2) and sodium hydroxide (NaOH), which is commonly called caustic soda or lye. By far the largest use of mercury[56][57] in the late 20th century was in the mercury cell process (also called the Castner-Kellner process) where metallic sodium is formed as an amalgam at a cathode made from mercury; this sodium is then reacted with water to produce sodium hydroxide.[58] Many of the industrial mercury releases of the 20th century came from this process, although modern plants claimed to be safe in this regard.[57] After about 1985, all new chloralkali production facilities that were built in the United States used membrane cell or diaphragm cell technologies to produce chlorine.
Laboratory uses
Some medical thermometers, especially those for high temperatures, are filled with mercury; they are gradually disappearing. In the United States, non-prescription sale of mercury fever thermometers has been banned since 2003.[59]
Some transit telescopes use a basin of mercury to form a flat and absolutely horizontal mirror, useful in determining an absolute vertical or perpendicular reference. Concave horizontal parabolic mirrors may be formed by rotating liquid mercury on a disk, the parabolic form of the liquid thus formed reflecting and focusing incident light. Such liquid-mirror telescopes are cheaper than conventional large mirror telescopes by up to a factor of 100, but the mirror cannot be tilted and always points straight up.[60][61][62]
Liquid mercury is a part of popular secondary reference electrode (called the calomel electrode) in electrochemistry as an alternative to the standard hydrogen electrode. The calomel electrode is used to work out the electrode potential of half cells.[63] Last, but not least, the triple point of mercury, −38.8344 °C, is a fixed point used as a temperature standard for the International Temperature Scale (ITS-90).[6]
In polarography both the dropping mercury electrode[64] and the hanging mercury drop electrode[65] use elemental mercury. This use allows a new uncontaminated electrode to be available for each measurement or each new experiment.
Mercury-containing compounds are also of use in the field of structural biology. Mercuric compounds such as mercury(II) chloride or potassium tetraiodomercurate(II) can be added to protein crystals in an effort to create heavy atom derivatives that can be used to solve the phase problem in X-ray crystallography via isomorphous replacement or anomalous scattering methods.
Niche uses
Gaseous mercury is used in mercury-vapor lamps and some «neon sign» type advertising signs and fluorescent lamps. Those low-pressure lamps emit very spectrally narrow lines, which are traditionally used in optical spectroscopy for calibration of spectral position. Commercial calibration lamps are sold for this purpose; reflecting a fluorescent ceiling light into a spectrometer is a common calibration practice.[66] Gaseous mercury is also found in some electron tubes, including ignitrons, thyratrons, and mercury arc rectifiers.[67] It is also used in specialist medical care lamps for skin tanning and disinfection.[68] Gaseous mercury is added to cold cathode argon-filled lamps to increase the ionization and electrical conductivity. An argon-filled lamp without mercury will have dull spots and will fail to light correctly. Lighting containing mercury can be bombarded/oven pumped only once. When added to neon filled tubes the light produced will be inconsistent red/blue spots until the initial burning-in process is completed; eventually it will light a consistent dull off-blue color.[69]
-
The deep violet glow of a mercury vapor discharge in a germicidal lamp, whose spectrum is rich in invisible ultraviolet radiation.
-
Skin tanner containing a low-pressure mercury vapor lamp and two infrared lamps, which act both as light source and electrical ballast
-
Assorted types of fluorescent lamps.
-
The miniaturized Deep Space Atomic Clock is a linear ion-trap-based mercury ion clock, designed for precise and real-time radio navigation in deep space.
The Deep Space Atomic Clock (DSAC) under development by the Jet Propulsion Laboratory utilises mercury in a linear ion-trap-based clock. The novel use of mercury allows very compact atomic clocks, with low energy requirements, and is therefore ideal for space probes and Mars missions.[70]
Cosmetics
Mercury, as thiomersal, is widely used in the manufacture of mascara. In 2008, Minnesota became the first state in the United States to ban intentionally added mercury in cosmetics, giving it a tougher standard than the federal government.[71]
A study in geometric mean urine mercury concentration identified a previously unrecognized source of exposure (skin care products) to inorganic mercury among New York City residents. Population-based biomonitoring also showed that mercury concentration levels are higher in consumers of seafood and fish meals.[72]
Skin whitening
Mercury is effective as an active ingredient in skin whitening compounds used to depigment skin.[73] The Minamata Convention on Mercury limits the concentration of mercury in such whiteners to 1 part per million. However, as of 2022, many commercially sold whitener products continue to exceed that limit, and are considered toxic.[74]
Firearms
Mercury(II) fulminate is a primary explosive which is mainly used as a primer of a cartridge in firearms.
Historic uses
A single-pole, single-throw (SPST) mercury switch
Many historic applications made use of the peculiar physical properties of mercury, especially as a dense liquid and a liquid metal:
- Quantities of liquid mercury ranging from 90 to 600 grams (3.2 to 21.2 oz) have been recovered from elite Maya tombs (100–700 AD)[25] or ritual caches at six sites. This mercury may have been used in bowls as mirrors for divinatory purposes. Five of these date to the Classic Period of Maya civilization (c. 250–900) but one example predated this.[75]
- In Islamic Spain, it was used for filling decorative pools. Later, the American artist Alexander Calder built a mercury fountain for the Spanish Pavilion at the 1937 World Exhibition in Paris. The fountain is now on display at the Fundació Joan Miró in Barcelona.[76]
- Mercury was used inside wobbler lures. Its heavy, liquid form made it useful since the lures made an attractive irregular movement when the mercury moved inside the plug. Such use was stopped due to environmental concerns, but illegal preparation of modern fishing plugs has occurred.
- The Fresnel lenses of old lighthouses used to float and rotate in a bath of mercury which acted like a bearing.[77]
- Mercury sphygmomanometers (blood pressure meter), barometers, diffusion pumps, coulometers, and many other laboratory instruments took advantage of mercury’s properties as a very dense, opaque liquid with a nearly linear thermal expansion.[78]
- As an electrically conductive liquid, it was used in mercury switches (including home mercury light switches installed prior to 1970), tilt switches used in old fire detectors, and tilt switches in some home thermostats.[79]
- Owing to its acoustic properties, mercury was used as the propagation medium in delay-line memory devices used in early digital computers of the mid-20th century.
- Experimental mercury vapor turbines were installed to increase the efficiency of fossil-fuel electrical power plants.[80] The South Meadow power plant in Hartford, CT employed mercury as its working fluid, in a binary configuration with a secondary water circuit, for a number of years starting in the late 1920s in a drive to improve plant efficiency. Several other plants were built, including the Schiller Station in Portsmouth, NH, which went online in 1950. The idea did not catch on industry-wide due to the weight and toxicity of mercury, as well as the advent of supercritical steam plants in later years.[81][82]
- Similarly, liquid mercury was used as a coolant for some nuclear reactors; however, sodium is proposed for reactors cooled with liquid metal, because the high density of mercury requires much more energy to circulate as coolant.[83]
- Mercury was a propellant for early ion engines in electric space propulsion systems. Advantages were mercury’s high molecular weight, low ionization energy, low dual-ionization energy, high liquid density and liquid storability at room temperature. Disadvantages were concerns regarding environmental impact associated with ground testing and concerns about eventual cooling and condensation of some of the propellant on the spacecraft in long-duration operations. The first spaceflight to use electric propulsion was a mercury-fueled ion thruster developed at NASA Glenn Research Center and flown on the Space Electric Rocket Test «SERT-1» spacecraft launched by NASA at its Wallops Flight Facility in 1964. The SERT-1 flight was followed up by the SERT-2 flight in 1970. Mercury and caesium were preferred propellants for ion engines until Hughes Research Laboratory performed studies finding xenon gas to be a suitable replacement. Xenon is now the preferred propellant for ion engines as it has a high molecular weight, little or no reactivity due to its noble gas nature, and has a high liquid density under mild cryogenic storage.[84][85]
Other applications made use of the chemical properties of mercury:
- The mercury battery is a non-rechargeable electrochemical battery, a primary cell, that was common in the middle of the 20th century. It was used in a wide variety of applications and was available in various sizes, particularly button sizes. Its constant voltage output and long shelf life gave it a niche use for camera light meters and hearing aids. The mercury cell was effectively banned in most countries in the 1990s due to concerns about the mercury contaminating landfills.[86]
- Mercury was used for preserving wood, developing daguerreotypes, silvering mirrors, anti-fouling paints (discontinued in 1990), herbicides (discontinued in 1995), interior latex paint, handheld maze games, cleaning, and road leveling devices in cars. Mercury compounds have been used in antiseptics, laxatives, antidepressants, and in antisyphilitics.
- It was allegedly used by allied spies to sabotage Luftwaffe planes: a mercury paste was applied to bare aluminium, causing the metal to rapidly corrode; this would cause structural failures.[87]
- Chloralkali process: The largest industrial use of mercury during the 20th century was in electrolysis for separating chlorine and sodium from brine; mercury being the anode of the Castner-Kellner process. The chlorine was used for bleaching paper (hence the location of many of these plants near paper mills) while the sodium was used to make sodium hydroxide for soaps and other cleaning products. This usage has largely been discontinued, replaced with other technologies that utilize membrane cells.[88]
- As electrodes in some types of electrolysis, batteries (mercury cells), sodium hydroxide and chlorine production, handheld games, catalysts, insecticides.
- Mercury was once used as a gun barrel bore cleaner.[89][90]
- From the mid-18th to the mid-19th centuries, a process called «carroting» was used in the making of felt hats. Animal skins were rinsed in an orange solution (the term «carroting» arose from this color) of the mercury compound mercuric nitrate, Hg(NO3)2·2H2O.[91] This process separated the fur from the pelt and matted it together. This solution and the vapors it produced were highly toxic. The United States Public Health Service banned the use of mercury in the felt industry in December 1941. The psychological symptoms associated with mercury poisoning inspired the phrase «mad as a hatter». Lewis Carroll’s «Mad Hatter» in his book Alice’s Adventures in Wonderland was a play on words based on the older phrase, but the character himself does not exhibit symptoms of mercury poisoning.[92]
- Gold and silver mining. Historically, mercury was used extensively in hydraulic gold mining in order to help the gold to sink through the flowing water-gravel mixture. Thin gold particles may form mercury-gold amalgam and therefore increase the gold recovery rates.[6] Large-scale use of mercury stopped in the 1960s. However, mercury is still used in small scale, often clandestine, gold prospecting. It is estimated that 45,000 metric tons of mercury used in California for placer mining have not been recovered.[93] Mercury was also used in silver mining.[94]
Historic medicinal uses
Mercury(I) chloride (also known as calomel or mercurous chloride) has been used in traditional medicine as a diuretic, topical disinfectant, and laxative. Mercury(II) chloride (also known as mercuric chloride or corrosive sublimate) was once used to treat syphilis (along with other mercury compounds), although it is so toxic that sometimes the symptoms of its toxicity were confused with those of the syphilis it was believed to treat.[95] It is also used as a disinfectant. Blue mass, a pill or syrup in which mercury is the main ingredient, was prescribed throughout the 19th century for numerous conditions including constipation, depression, child-bearing and toothaches.[96] In the early 20th century, mercury was administered to children yearly as a laxative and dewormer, and it was used in teething powders for infants. The mercury-containing organohalide merbromin (sometimes sold as Mercurochrome) is still widely used but has been banned in some countries such as the U.S.[97]
Toxicity and safety
| Hazards | |
|---|---|
| GHS labelling: | |
|
Pictograms |
  
|
|
Signal word |
Danger |
|
Hazard statements |
H330, H360D, H372, H410 |
|
Precautionary statements |
P201, P233, P260, P273, P280, P304, P308, P310, P313, P340, P391, P403[98] |
| NFPA 704 (fire diamond) |
2 0 0 |
Mercury and most of its compounds are extremely toxic and must be handled with care; in cases of spills involving mercury (such as from certain thermometers or fluorescent light bulbs), specific cleaning procedures are used to avoid exposure and contain the spill.[99] Protocols call for physically merging smaller droplets on hard surfaces, combining them into a single larger pool for easier removal with an eyedropper, or for gently pushing the spill into a disposable container. Vacuum cleaners and brooms cause greater dispersal of the mercury and should not be used. Afterwards, fine sulfur, zinc, or some other powder that readily forms an amalgam (alloy) with mercury at ordinary temperatures is sprinkled over the area before itself being collected and properly disposed of. Cleaning porous surfaces and clothing is not effective at removing all traces of mercury and it is therefore advised to discard these kinds of items should they be exposed to a mercury spill.
Mercury can be absorbed through the skin and mucous membranes and mercury vapors can be inhaled, so containers of mercury are securely sealed to avoid spills and evaporation. Heating of mercury, or of compounds of mercury that may decompose when heated, should be carried out with adequate ventilation in order to minimize exposure to mercury vapor. The most toxic forms of mercury are its organic compounds, such as dimethylmercury and methylmercury. Mercury can cause both chronic and acute poisoning.
Releases in the environment
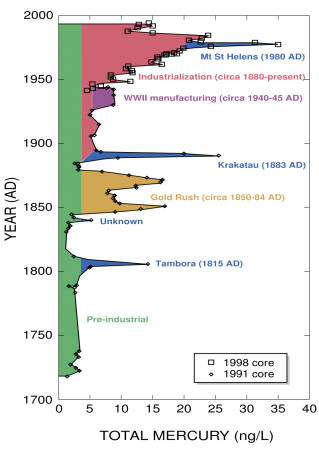
Amount of atmospheric mercury deposited at Wyoming’s Upper Fremont Glacier over the last 270 years
Preindustrial deposition rates of mercury from the atmosphere may be about 4 ng /(1 L of ice deposit). Although that can be considered a natural level of exposure, regional or global sources have significant effects. Volcanic eruptions can increase the atmospheric source by 4–6 times.[100]
Natural sources, such as volcanoes, are responsible for approximately half of atmospheric mercury emissions. The human-generated half can be divided into the following estimated percentages:[101][102][103]
- 65% from stationary combustion, of which coal-fired power plants are the largest aggregate source (40% of U.S. mercury emissions in 1999). This includes power plants fueled with gas where the mercury has not been removed. Emissions from coal combustion are between one and two orders of magnitude higher than emissions from oil combustion, depending on the country.[101]
- 11% from gold production. The three largest point sources for mercury emissions in the U.S. are the three largest gold mines. Hydrogeochemical release of mercury from gold-mine tailings has been accounted as a significant source of atmospheric mercury in eastern Canada.[104]
- 6.8% from non-ferrous metal production, typically smelters.
- 6.4% from cement production.
- 3.0% from waste disposal, including municipal and hazardous waste, crematoria, and sewage sludge incineration.
- 3.0% from caustic soda production.
- 1.4% from pig iron and steel production.
- 1.1% from mercury production, mainly for batteries.
- 2.0% from other sources.
The above percentages are estimates of the global human-caused mercury emissions in 2000, excluding biomass burning, an important source in some regions.[101]
Recent atmospheric mercury contamination in outdoor urban air was measured at 0.01–0.02 μg/m3. A 2001 study measured mercury levels in 12 indoor sites chosen to represent a cross-section of building types, locations and ages in the New York area. This study found mercury concentrations significantly elevated over outdoor concentrations, at a range of 0.0065 – 0.523 μg/m3. The average was 0.069 μg/m3.[105]
Artificial lakes, or reservoirs, may be contaminated with mercury due to the absorption by the water of mercury from submerged trees and soil.
For example, Williston Lake in northern British Columbia, created by the damming of the Peace River in 1968, is still sufficiently contaminated with mercury that it is inadvisable to consume fish from the lake.[106][107] Permafrost soils have accumulated mercury through atmospheric deposition,[108] and permafrost thaw in cryospheric regions is also a mechanism of mercury release into lakes, rivers, and wetlands.[109][110]
Mercury also enters into the environment through the improper disposal (e.g., land filling, incineration) of certain products. Products containing mercury include: auto parts, batteries, fluorescent bulbs, medical products, thermometers, and thermostats.[111] Due to health concerns (see below), toxics use reduction efforts are cutting back or eliminating mercury in such products. For example, the amount of mercury sold in thermostats in the United States decreased from 14.5 tons in 2004 to 3.9 tons in 2007.[112]
Most thermometers now use pigmented alcohol instead of mercury. Mercury thermometers are still occasionally used in the medical field because they are more accurate than alcohol thermometers, though both are commonly being replaced by electronic thermometers and less commonly by galinstan thermometers. Mercury thermometers are still widely used for certain scientific applications because of their greater accuracy and working range.
Historically, one of the largest releases was from the Colex plant, a lithium isotope separation plant at Oak Ridge, Tennessee. The plant operated in the 1950s and 1960s. Records are incomplete and unclear, but government commissions have estimated that some two million pounds of mercury are unaccounted for.[113]
A serious industrial disaster was the dumping of waste mercury compounds into Minamata Bay, Japan, between 1932 and 1968. It is estimated that over 3,000 people suffered various deformities, severe mercury poisoning symptoms or death from what became known as Minamata disease.[114][115]
The tobacco plant readily absorbs and accumulates heavy metals such as mercury from the surrounding soil into its leaves. These are subsequently inhaled during tobacco smoking.[116] While mercury is a constituent of tobacco smoke,[117] studies have largely failed to discover a significant correlation between smoking and Hg uptake by humans compared to sources such as occupational exposure, fish consumption, and amalgam tooth fillings.[118]
Sediment contamination
Sediments within large urban-industrial estuaries act as an important sink for point source and diffuse mercury pollution within catchments.[119] A 2015 study of foreshore sediments from the Thames estuary measured total mercury at 0.01 to 12.07 mg/kg with mean of 2.10 mg/kg and median of 0.85 mg/kg (n=351).[119] The highest mercury concentrations were shown to occur in and around the city of London in association with fine grain muds and high total organic carbon content.[119] The strong affinity of mercury for carbon rich sediments has also been observed in salt marsh sediments of the River Mersey mean of 2 mg/kg up to 5 mg/kg.[120] These concentrations are far higher than those shown in salt marsh river creek sediments of New Jersey and mangroves of Southern China which exhibit low mercury concentrations of about 0.2 mg/kg.[121][122]
Occupational exposure
EPA workers clean up residential mercury spill in 2004
Due to the health effects of mercury exposure, industrial and commercial uses are regulated in many countries. The World Health Organization, OSHA, and NIOSH all treat mercury as an occupational hazard, and have established specific occupational exposure limits. Environmental releases and disposal of mercury are regulated in the U.S. primarily by the United States Environmental Protection Agency.
Fish
Fish and shellfish have a natural tendency to concentrate mercury in their bodies, often in the form of methylmercury, a highly toxic organic compound of mercury. Species of fish that are high on the food chain, such as shark, swordfish, king mackerel, bluefin tuna, albacore tuna, and tilefish contain higher concentrations of mercury than others. Because mercury and methylmercury are fat soluble, they primarily accumulate in the viscera, although they are also found throughout the muscle tissue.[123] Mercury presence in fish muscles can be studied using non-lethal muscle biopsies.[124] Mercury present in prey fish accumulates in the predator that consumes them. Since fish are less efficient at depurating than accumulating methylmercury, methylmercury concentrations in the fish tissue increase over time. Thus species that are high on the food chain amass body burdens of mercury that can be ten times higher than the species they consume. This process is called biomagnification. Mercury poisoning happened this way in Minamata, Japan, now called Minamata disease.
Cosmetics
Some facial creams contain dangerous levels of mercury. Most contain comparatively non-toxic inorganic mercury, but products containing highly toxic organic mercury have been encountered.[125][126]
Effects and symptoms of mercury poisoning
Toxic effects include damage to the brain, kidneys and lungs. Mercury poisoning can result in several diseases, including acrodynia (pink disease), Hunter-Russell syndrome, and Minamata disease.
Symptoms typically include sensory impairment (vision, hearing, speech), disturbed sensation and a lack of coordination. The type and degree of symptoms exhibited depend upon the individual toxin, the dose, and the method and duration of exposure. Case–control studies have shown effects such as tremors, impaired cognitive skills, and sleep disturbance in workers with chronic exposure to mercury vapor even at low concentrations in the range 0.7–42 μg/m3.[127][128] A study has shown that acute exposure (4–8 hours) to calculated elemental mercury levels of 1.1 to 44 mg/m3 resulted in chest pain, dyspnea, cough, hemoptysis, impairment of pulmonary function, and evidence of interstitial pneumonitis.[129] Acute exposure to mercury vapor has been shown to result in profound central nervous system effects, including psychotic reactions characterized by delirium, hallucinations, and suicidal tendency. Occupational exposure has resulted in broad-ranging functional disturbance, including erethism, irritability, excitability, excessive shyness, and insomnia. With continuing exposure, a fine tremor develops and may escalate to violent muscular spasms. Tremor initially involves the hands and later spreads to the eyelids, lips, and tongue. Long-term, low-level exposure has been associated with more subtle symptoms of erethism, including fatigue, irritability, loss of memory, vivid dreams and depression.[130][131]
Treatment
Research on the treatment of mercury poisoning is limited. Currently available drugs for acute mercurial poisoning include chelators N-acetyl-D, L-penicillamine (NAP), British Anti-Lewisite (BAL), 2,3-dimercapto-1-propanesulfonic acid (DMPS), and dimercaptosuccinic acid (DMSA). In one small study including 11 construction workers exposed to elemental mercury, patients were treated with DMSA and NAP.[132] Chelation therapy with both drugs resulted in the mobilization of a small fraction of the total estimated body mercury. DMSA was able to increase the excretion of mercury to a greater extent than NAP.[133]
Regulations
International
140 countries agreed in the Minamata Convention on Mercury by the United Nations Environment Programme (UNEP) to prevent emissions.[134] The convention was signed on 10 October 2013.[135]
United States
In the United States, the Environmental Protection Agency is charged with regulating and managing mercury contamination. Several laws give the EPA this authority, including the Clean Air Act, the Clean Water Act, the Resource Conservation and Recovery Act, and the Safe Drinking Water Act. Additionally, the Mercury-Containing and Rechargeable Battery Management Act, passed in 1996, phases out the use of mercury in batteries, and provides for the efficient and cost-effective disposal of many types of used batteries.[136] North America contributed approximately 11% of the total global anthropogenic mercury emissions in 1995.[137]
The United States Clean Air Act, passed in 1990, put mercury on a list of toxic pollutants that need to be controlled to the greatest possible extent. Thus, industries that release high concentrations of mercury into the environment agreed to install maximum achievable control technologies (MACT). In March 2005, the EPA promulgated a regulation[138] that added power plants to the list of sources that should be controlled and instituted a national cap and trade system. States were given until November 2006 to impose stricter controls, but after a legal challenge from several states, the regulations were struck down by a federal appeals court on 8 February 2008. The rule was deemed not sufficient to protect the health of persons living near coal-fired power plants, given the negative effects documented in the EPA Study Report to Congress of 1998.[139] However newer data published in 2015 showed that after introduction of the stricter controls mercury declined sharply, indicating that the Clean Air Act had its intended impact.[140]
The EPA announced new rules for coal-fired power plants on 22 December 2011.[141] Cement kilns that burn hazardous waste are held to a looser standard than are standard hazardous waste incinerators in the United States, and as a result are a disproportionate source of mercury pollution.[142]
European Union
In the European Union, the directive on the Restriction of the Use of Certain Hazardous Substances in Electrical and Electronic Equipment (see RoHS) bans mercury from certain electrical and electronic products, and limits the amount of mercury in other products to less than 1000 ppm.[143] There are restrictions for mercury concentration in packaging (the limit is 100 ppm for sum of mercury, lead, hexavalent chromium and cadmium) and batteries (the limit is 5 ppm).[144] In July 2007, the European Union also banned mercury in non-electrical measuring devices, such as thermometers and barometers. The ban applies to new devices only, and contains exemptions for the health care sector and a two-year grace period for manufacturers of barometers.[145]
Norway
Norway enacted a total ban on the use of mercury in the manufacturing and import/export of mercury products, effective 1 January 2008.[146] In 2002, several lakes in Norway were found to have a poor state of mercury pollution, with an excess of 1 μg/g of mercury in their sediment.[147]
In 2008, Norway’s Minister of Environment Development Erik Solheim said: «Mercury is among the most dangerous environmental toxins. Satisfactory alternatives to Hg in products are
available, and it is therefore fitting to induce a ban.»[148]
Sweden
Products containing mercury were banned in Sweden in 2009.[149][150]
Denmark
In 2008, Denmark also banned dental mercury amalgam,[148] except for molar masticating surface fillings in permanent (adult) teeth.
See also
- Mercury pollution in the ocean
- Red mercury
- COLEX process (isotopic separation)
References
- ^ «Standard Atomic Weights: Mercury». CIAAW. 2011.
- ^ «Magnetic Susceptibility of the Elements And Inorganic Compounds» (PDF). www-d0.fnal.gov. Fermi National Accelerator Laboratory: DØ Experiment (lagacy document). Archived from the original (PDF) on 24 March 2004. Retrieved 18 February 2015.
- ^ Weast, Robert (1984). CRC, Handbook of Chemistry and Physics. Boca Raton, Florida: Chemical Rubber Company Publishing. pp. E110. ISBN 0-8493-0464-4.
- ^ «Definition of hydrargyrum | Dictionary.com». Archived from the original on 12 August 2014. Retrieved 22 December 2022. Random House Webster’s Unabridged Dictionary.
- ^ «New 12-sided pound coin to enter circulation in March». BBC News. 1 January 2017. Retrieved 2 January 2017.
- ^ a b c d e f Hammond, C. R. «The Elements» (PDF). Archived from the original (PDF) on 26 June 2008. in Lide, D. R., ed. (2005). CRC Handbook of Chemistry and Physics (86th ed.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ^ Senese, F. «Why is mercury a liquid at STP?». General Chemistry Online at Frostburg State University. Archived from the original on 4 April 2007. Retrieved 1 May 2007.
- ^ a b Norrby, L.J. (1991). «Why is mercury liquid? Or, why do relativistic effects not get into chemistry textbooks?». Journal of Chemical Education. 68 (2): 110. Bibcode:1991JChEd..68..110N. doi:10.1021/ed068p110. S2CID 96003717.
- ^ Lide, D. R., ed. (2005). CRC Handbook of Chemistry and Physics (86th ed.). Boca Raton (FL): CRC Press. pp. 4.125–4.126. ISBN 0-8493-0486-5.
- ^ «Dynamic Periodic Table». www.ptable.com. Archived from the original on 20 November 2016. Retrieved 22 November 2016.
- ^ Simons, E. N. (1968). Guide to Uncommon Metals. Frederick Muller. p. 111.
- ^ Holman, Jack P. (2002). Heat Transfer (9th ed.). New York, NY: cGraw-Hill Companies, Inc. pp. 600–606. ISBN 9780072406559.
- ^ Incropera 1 Dewitt 2 Bergman 3 Lavigne 4, Frank P. 1 David P. 2 Theodore L. 3 Adrienne S. 4 (2007). Fundamentals of Heat and Mass Transfer (6th ed.). Hoboken, NJ: John Wiley and Sons, Inc. pp. 941–950. ISBN 9780471457282.
- ^ a b Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ^ Gmelin, Leopold (1852). Hand book of chemistry. Cavendish Society. pp. 103 (Na), 110 (W), 122 (Zn), 128 (Fe), 247 (Au), 338 (Pt). Archived from the original on 9 May 2013. Retrieved 30 December 2012.
- ^ Soratur (2002). Essentials of Dental Materials. Jaypee Brothers Publishers. p. 14. ISBN 978-81-7179-989-3. Archived from the original on 3 June 2016.
- ^ Vargel, C.; Jacques, M.; Schmidt, M. P. (2004). Corrosion of Aluminium. Elsevier. p. 158. ISBN 9780080444956.
- ^ a b Stillman, J. M. (2003). Story of Alchemy and Early Chemistry. Kessinger Publishing. pp. 7–9. ISBN 978-0-7661-3230-6.
- ^ Maurice Crosland (2004) Historical Studies in the Language of Chemistry
- ^ «Mercury and the environment — Basic facts». Environment Canada, Federal Government of Canada. 2004. Archived from the original on 16 September 2011. Retrieved 27 March 2008.
- ^ «Mercury — Element of the ancients». Center for Environmental Health Sciences, Dartmouth College. Archived from the original on 2 December 2012. Retrieved 9 April 2012.
- ^ «Qin Shihuang». Ministry of Culture, People’s Republic of China. 2003. Archived from the original on 4 July 2008. Retrieved 27 March 2008.
- ^ Wright, David Curtis (2001). The History of China. Greenwood Publishing Group. p. 49. ISBN 9780313309403.
- ^ Sobernheim, Moritz (1987). «Khumārawaih». In Houtsma, Martijn Theodoor (ed.). E.J. Brill’s first encyclopaedia of Islam, 1913–1936, Volume IV: ‘Itk–Kwaṭṭa. Leiden: BRILL. p. 973. ISBN 978-90-04-08265-6. Archived from the original on 3 June 2016.
- ^ a b Yuhas, Alan (24 April 2015). «Liquid mercury found under Mexican pyramid could lead to king’s tomb». The Guardian. ISSN 0261-3077. Archived from the original on 1 December 2016. Retrieved 22 November 2016.
- ^ De Anima. Chapter 3. 1907. CS1 maint: location (link)
- ^ Pendergast, David M. (6 August 1982). «Ancient maya mercury». Science. 217 (4559): 533–535. Bibcode:1982Sci…217..533P. doi:10.1126/science.217.4559.533. PMID 17820542. S2CID 39473822.
- ^ «Lamanai». Archived from the original on 11 June 2011. Retrieved 17 June 2011.
- ^ Hesse R W (2007). Jewelrymaking through history. Greenwood Publishing Group. p. 120. ISBN 978-0-313-33507-5.
- ^ Eisler, R. (2006). Mercury hazards to living organisms. CRC Press. ISBN 978-0-8493-9212-2.
- ^ Ehrlich, H. L.; Newman D. K. (2008). Geomicrobiology. CRC Press. p. 265. ISBN 978-0-8493-7906-2.
- ^ Rytuba, James J (2003). «Mercury from mineral deposits and potential environmental impact». Environmental Geology. 43 (3): 326–338. doi:10.1007/s00254-002-0629-5. S2CID 127179672.
- ^ a b «Metacinnabar: Mineral information, data and localities».
- ^ «Mercury Recycling in the United States in 2000» (PDF). USGS. Archived (PDF) from the original on 26 March 2009. Retrieved 7 July 2009.
- ^ Burkholder, M. & Johnson, L. (2008). Colonial Latin America. Oxford University Press. pp. 157–159. ISBN 978-0-19-504542-0.
- ^ Jamieson, R W (2000). Domestic Architecture and Power. Springer. p. 33. ISBN 978-0-306-46176-7.
- ^ Brooks, W. E. (2007). «Mercury» (PDF). U.S. Geological Survey. Archived (PDF) from the original on 27 May 2008. Retrieved 30 May 2008.
- ^
Hetherington, L. E.; Brown, T. J.; Benham, A. J.; Lusty, P. A. J.; Idoine, N. E. (2007). World mineral production: 2001–05 (PDF). Keyworth, Nottingham, UK: British Geological Survey (BGS), Natural Environment Research Council (NERC). ISBN 978-0-85272-592-4. Archived (PDF) from the original on 20 February 2019. Retrieved 20 February 2019. - ^ About the Mercury Rule Archived 1 May 2012 at the Wayback Machine. Act.credoaction.com (21 December 2011). Retrieved on 30 December 2012.
- ^ a b Sheridan, M. (3 May 2009). «‘Green’ Lightbulbs Poison Workers: hundreds of factory staff are being made ill by mercury used in bulbs destined for the West». The Sunday Times (of London, UK). Archived from the original on 17 May 2009.
- ^ Boulland M (2006). New Almaden. Arcadia Publishing. p. 8. ISBN 978-0-7385-3131-1.
- ^ For a general overview, see Riedel, S.; Kaupp, M. (2009). «The Highest Oxidation States of the Transition Metal Elements». Coordination Chemistry Reviews. 253 (5–6): 606–624. doi:10.1016/j.ccr.2008.07.014.
The claimed 1976 synthesis is Deming, Richard L.; Allred, A. L.; Dahl, Alan R.; Herlinger, Albert W.; Kestner, Mark O. (July 1976). «Tripositive mercury. Low temperature electrochemical oxidation of 1,4,8,11-tetraazacyclotetradecanemercury(II) tetrafluoroborate». Journal of the American Chemical Society. 98 (14): 4132–4137. doi:10.1021/ja00430a020; but note that Reidel & Kaupp cite more recent work arguing that the cyclam ligand is instead oxidized.
The claimed 2007 isolation is Xuefang Wang; Andrews, Lester; Riedel, Sebastian; Kaupp, Martin (2007). «Mercury Is a Transition Metal: The First Experimental Evidence for HgF4«. Angew. Chem. Int. Ed. 46 (44): 8371–8375. doi:10.1002/anie.200703710. PMID 17899620, but the spectral identifications are disputed in Rooms, J. F.; Wilson, A. V.; Harvey, I.; Bridgeman, A. J.; Young, N. A. (2008). «Mercury-fluorine interactions: a matrix isolation investigation of Hg⋯F2, HgF2 and HgF4 in argon matrices». Phys Chem Chem Phys. 10 (31): 4594–605. Bibcode:2008PCCP…10.4594R. doi:10.1039/b805608k. PMID 18665309.
- ^ Henderson, W. (2000). Main group chemistry. Great Britain: Royal Society of Chemistry. p. 162. ISBN 978-0-85404-617-1. Archived from the original on 13 May 2016.
- ^ Brown, I. D.; Gillespie, R. J.; Morgan, K. R.; Tun, Z.; Ummat, P. K. (1984). «Preparation and crystal structure of mercury hexafluoroniobate (Hg
3NbF
6) and mercury hexafluorotantalate (Hg
3TaF
6): mercury layer compounds». Inorganic Chemistry. 23 (26): 4506–4508. doi:10.1021/ic00194a020. - ^ Rogalski, A (2000). Infrared detectors. CRC Press. p. 507. ISBN 978-90-5699-203-3.
- ^ National Research Council (U.S.) – Board on Environmental Studies and Toxicology (2000). Toxicological effects of methylmercury. National Academies Press. ISBN 978-0-309-07140-6.
- ^ Surmann, P; Zeyat, H (November 2005). «Voltammetric analysis using a self-renewable non-mercury electrode». Analytical and Bioanalytical Chemistry. 383 (6): 1009–13. doi:10.1007/s00216-005-0069-7. PMID 16228199. S2CID 22732411.
- ^ Lind, J (1787). «An Account of the Efficacy of Mercury in the Cure of Inflammatory Diseases, and the Dysentery». The London Medical Journal. 8 (Pt 1): 43–56. ISSN 0952-4177. PMC 5545546. PMID 29139904.
- ^ Merck’s Manual 1899 (First ed.). Archived from the original on 24 August 2013. Retrieved 16 June 2013.
- ^ FDA. «Thimerosal in Vaccines». Food and Drug Administration. Archived from the original on 26 October 2006. Retrieved 25 October 2006.
- ^ Parker SK; Schwartz B; Todd J; Pickering LK (2004). «Thimerosal-containing vaccines and autistic spectrum disorder: a critical review of published original data». Pediatrics. 114 (3): 793–804. CiteSeerX 10.1.1.327.363. doi:10.1542/peds.2004-0434. PMID 15342856. S2CID 1752023. Erratum: Parker S, Todd J, Schwartz B, Pickering L (January 2005). «Thimerosal-containing vaccines and autistic spectrum disorder: a critical review of published original data». Pediatrics. 115 (1): 200. doi:10.1542/peds.2004-2402. PMID 15630018. S2CID 26700143.
{{cite journal}}: CS1 maint: multiple names: authors list (link). - ^ «Thimerosal in vaccines». Center for Biologics Evaluation and Research, U.S. Food and Drug Administration. 6 September 2007. Archived from the original on 29 September 2007. Retrieved 1 October 2007.
- ^ Liu J; Shi JZ; Yu LM; Goyer RA; Waalkes MP (2008). «Mercury in traditional medicines: is cinnabar toxicologically similar to common mercurials?». Exp. Biol. Med. (Maywood). 233 (7): 810–7. doi:10.3181/0712-MR-336. PMC 2755212. PMID 18445765.
- ^ «Two States Pass First-time Bans on Mercury Blood Pressure Devices». Health Care Without Harm. 2 June 2003. Archived from the original on 4 October 2011. Retrieved 1 May 2007.
- ^ «Title 21—Food and Drugs Chapter I—Food and Drug Administration Department of Health and Human Services Subchapter D—Drugs for Human Use Code of federal regulations». United States Food and Drug Administration. Archived from the original on 13 March 2007. Retrieved 1 May 2007.
- ^ «The CRB Commodity Yearbook (annual)». The CRB Commodity Yearbook: 173. 2000. ISSN 1076-2906.
- ^ a b Leopold, B. R. (2002). «Chapter 3: Manufacturing Processes Involving Mercury. Use and Release of Mercury in the United States» (PDF). National Risk Management Research Laboratory, Office of Research and Development, U.S. Environmental Protection Agency, Cincinnati, Ohio. Archived from the original (PDF) on 21 June 2007. Retrieved 1 May 2007.
- ^ «Chlorine Online Diagram of mercury cell process». Euro Chlor. Archived from the original on 2 September 2006. Retrieved 15 September 2006.
- ^ «Mercury Reduction Act of 2003». United States. Congress. Senate. Committee on Environment and Public Works. Retrieved 6 June 2009.
- ^ «Liquid-mirror telescope set to give stargazing a new spin». Govert Schilling. 14 March 2003. Archived from the original on 18 August 2003. Retrieved 11 October 2008.
- ^ Gibson, B. K. (1991). «Liquid Mirror Telescopes: History». Journal of the Royal Astronomical Society of Canada. 85: 158. Bibcode:1991JRASC..85..158G.
- ^ «Laval University Liquid mirrors and adaptive optics group». Archived from the original on 18 September 2011. Retrieved 24 June 2011.
- ^ Brans, Y W; Hay W W (1995). Physiological monitoring and instrument diagnosis in perinatal and neonatal medicine. CUP Archive. p. 175. ISBN 978-0-521-41951-2.
- ^ Zoski, Cynthia G. (7 February 2007). Handbook of Electrochemistry. Elsevier Science. ISBN 978-0-444-51958-0.
- ^ Kissinger, Peter; Heineman, William R. (23 January 1996). Laboratory Techniques in Electroanalytical Chemistry, Second Edition, Revised and Expanded (2nd ed.). CRC. ISBN 978-0-8247-9445-3.
- ^ Hopkinson, G. R.; Goodman, T. M.; Prince, S. R. (2004). A guide to the use and calibration of detector array equipment. SPIE Press. p. 125. Bibcode:2004gucd.book…..H. ISBN 978-0-8194-5532-1.
- ^ Howatson A H (1965). «Chapter 8». An Introduction to Gas Discharges. Oxford: Pergamon Press. ISBN 978-0-08-020575-5.
- ^ Milo G E; Casto B C (1990). Transformation of human diploid fibroblasts. CRC Press. p. 104. ISBN 978-0-8493-4956-0.
- ^ Shionoya, S. (1999). Phosphor handbook. CRC Press. p. 363. ISBN 978-0-8493-7560-6.
- ^ Robert L. Tjoelker; et al. (2016). «Mercury Ion Clock for a NASA Technology Demonstration Mission». IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 63 (7): 1034–1043. Bibcode:2016ITUFF..63.1034T. doi:10.1109/TUFFC.2016.2543738. PMID 27019481. S2CID 3245467.
- ^ «Mercury in your eye?». CIDPUSA. 16 February 2008. Archived from the original on 5 January 2010. Retrieved 20 December 2009.
- ^ McKelvey W; Jeffery N; Clark N; Kass D; Parsons PJ. 2010 (2011). «Population-Based Inorganic Mercury Biomonitoring and the Identification of Skin Care Products as a Source of Exposure in New York City». Environ Health Perspect. 119 (2): 203–9. doi:10.1289/ehp.1002396. PMC 3040607. PMID 20923743.
- ^ Mohammed, Terry; Mohammed, Elisabeth; Bascombe, Shermel (9 October 2017). «The evaluation of total mercury and arsenic in skin bleaching creams commonly used in Trinidad and Tobago and their potential risk to the people of the Caribbean». Journal of Public Health Research. 6 (3): 1097. doi:10.4081/jphr.2017.1097. PMC 5736993. PMID 29291194.
- ^ Meera Senthilingam, «Skin whitening creams containing high levels of mercury continue to be sold on the world’s biggest e-commerce sites, new report finds», 9 March 2022, CNN https://www.cnn.com/2022/03/09/world/zmwg-skin-whitening-creams-mercury-ecommerce-sites-intl-cmd/index.html
- ^ Healy, Paul F.; Blainey, Marc G. (2011). «Ancient Maya Mosaic Mirrors: Function, Symbolism, And Meaning». Ancient Mesoamerica. 22 (2): 229–244 (241). doi:10.1017/S0956536111000241. S2CID 162282151.
- ^ Lew K. (2008). Mercury. The Rosen Publishing Group. p. 10. ISBN 978-1-4042-1780-5.
- ^ Pearson L. F. (2003). Lighthouses. Osprey Publishing. p. 29. ISBN 978-0-7478-0556-4.
- ^ Ramanathan E. AIEEE Chemistry. Sura Books. p. 251. ISBN 978-81-7254-293-1.
- ^ Shelton, C. (2004). Electrical Installations. Nelson Thornes. p. 260. ISBN 978-0-7487-7979-6.
- ^ «Popular Science». The Popular Science Monthly. Bonnier Corporation. 118 (3): 40. 1931. ISSN 0161-7370.
- ^ Mueller, Grover C. (September 1929). Cheaper Power from Quicksilver. Popular Science.
- ^ Mercury as a Working Fluid. Museum of Retro Technology. 13 November 2008. Archived from the original on 21 February 2011.
- ^ Collier (1987). Introduction to Nuclear Power. Taylor & Francis. p. 64. ISBN 978-1-56032-682-3.
- ^ «Glenn Contributions to Deep Space 1». NASA. Archived from the original on 1 October 2009. Retrieved 7 July 2009.
- ^ «Electric space propulsion». Archived from the original on 30 May 2009. Retrieved 7 July 2009.
- ^ «IMERC Fact Sheet: Mercury Use in Batteries». Northeast Waste Management Officials’ Association. January 2010. Archived from the original on 29 November 2012. Retrieved 20 June 2013.
- ^ Gray, T. (22 September 2004). «The Amazing Rusting Aluminum». Popular Science. Archived from the original on 20 July 2009. Retrieved 7 July 2009.
- ^ Dufault, Renee; Leblanc, Blaise; Schnoll, Roseanne; Cornett, Charles; Schweitzer, Laura; Wallinga, David; Hightower, Jane; Patrick, Lyn; Lukiw, Walter J. (2009). «Mercury from Chlor-alkali plants». Environmental Health. 8: 2. doi:10.1186/1476-069X-8-2. PMC 2637263. PMID 19171026. Archived from the original on 29 July 2012.
- ^ Francis, G. W. (1849). Chemical Experiments. D. Francis. p. 62.
- ^ Castles, W. T.; Kimball, V. F. (2005). Firearms and Their Use. Kessinger Publishing. p. 104. ISBN 978-1-4179-8957-7.
- ^ Lee, J. D. (1999). Concise Inorganic Chemistry. Wiley-Blackwell. ISBN 978-0-632-05293-6.
- ^ Waldron, H. A. (1983). «Did the Mad Hatter have mercury poisoning?». Br. Med. J. (Clin. Res. Ed.). 287 (6409): 1961. doi:10.1136/bmj.287.6409.1961. PMC 1550196. PMID 6418283.
- ^ Alpers, C. N.; Hunerlach, M. P.; May, J. Y.; Hothem, R. L. «Mercury Contamination from Historical Gold Mining in California». U.S. Geological Survey. Archived from the original on 22 February 2008. Retrieved 26 February 2008.
- ^ «Mercury amalgamation». Corrosion Doctors. Archived from the original on 19 May 2009. Retrieved 7 July 2009.
- ^ Pimple, K. D.; Pedroni, J. A.; Berdon, V. (9 July 2002). «Syphilis in history». Poynter Center for the Study of Ethics and American Institutions at Indiana University-Bloomington. Archived from the original on 16 February 2005. Retrieved 17 April 2005.
{{cite news}}: CS1 maint: uses authors parameter (link) - ^ Mayell, H. (17 July 2007). «Did Mercury in «Little Blue Pills» Make Abraham Lincoln Erratic?». National Geographic News. Archived from the original on 22 May 2008. Retrieved 15 June 2008.
- ^ «What happened to Mercurochrome?». 23 July 2004. Archived from the original on 11 April 2009. Retrieved 7 July 2009.
- ^ «Mercury 294594». Sigma-Aldrich.
- ^ «Mercury: Spills, Disposal and Site Cleanup». Environmental Protection Agency. Archived from the original on 13 May 2008. Retrieved 11 August 2007.
- ^ «Glacial Ice Cores Reveal A Record of Natural and Anthropogenic Atmospheric Mercury Deposition for the Last 270 Years». United States Geological Survey (USGS). Archived from the original on 4 July 2007. Retrieved 1 May 2007.
- ^ a b c Pacyna E G; Pacyna J M; Steenhuisen F; Wilson S (2006). «Global anthropogenic mercury emission inventory for 2000». Atmos Environ. 40 (22): 4048. Bibcode:2006AtmEn..40.4048P. doi:10.1016/j.atmosenv.2006.03.041.
- ^ «What is EPA doing about mercury air emissions?». United States Environmental Protection Agency (EPA). Archived from the original on 8 February 2007. Retrieved 1 May 2007.
- ^ Solnit, R. (September–October 2006). «Winged Mercury and the Golden Calf». Orion Magazine. Archived from the original on 5 October 2007. Retrieved 3 December 2007.
- ^ Maprani, Antu C.; Al, Tom A.; MacQuarrie, Kerry T.; Dalziel, John A.; Shaw, Sean A.; Yeats, Phillip A. (2005). «Determination of Mercury Evasion in a Contaminated Headwater Stream». Environmental Science & Technology. 39 (6): 1679–87. Bibcode:2005EnST…39.1679M. doi:10.1021/es048962j. PMID 15819225.
- ^ «Indoor Air Mercury» (PDF). newmoa.org. May 2003. Archived (PDF) from the original on 25 March 2009. Retrieved 7 July 2009.
- ^ Meissner, Dirk (12 May 2015). «West Moberly First Nations concerned about mercury contamination in fish». CBC News. The Canadian Press. Retrieved 20 July 2021.
{{cite web}}: CS1 maint: url-status (link) - ^ «Williston-Dinosaur Watershed Fish Mercury Investigation: 2017 Report» (PDF). Fish and Wildlife Compensation Program, Peace Region. June 2018. Retrieved 20 July 2021.
{{cite web}}: CS1 maint: url-status (link) - ^ Schuster, Paul; Schaefer, Kevin; Aiken, George; Antweiler, Ronald; Dewild, John; et al. (2018). «Permafrost Stores a Globally Significant Amount of Mercury». Geophysical Research Letters. 45 (3): 1463–1471. Bibcode:2018GeoRL..45.1463S. doi:10.1002/2017GL075571.
- ^ St. Pierre, Kyra A.; Zolkos, Scott; Shakil, Sarah; Tank, Suzanne E.; St. Louis, Vincent L.; Kokelj, Steven V. (18 December 2018). «Unprecedented Increases in Total and Methyl Mercury Concentrations Downstream of Retrogressive Thaw Slumps in the Western Canadian Arctic». Environmental Science & Technology. 52 (24): 14099–14109. Bibcode:2018EnST…5214099S. doi:10.1021/acs.est.8b05348. PMID 30474969. S2CID 53745081.
- ^ Ci, Zhijia; Peng, Fei; Xue, Xian; Zhang, Xiaoshan (5 May 2020). «Permafrost Thaw Dominates Mercury Emission in Tibetan Thermokarst Ponds». Environmental Science & Technology. 54 (9): 5456–5466. Bibcode:2020EnST…54.5456C. doi:10.1021/acs.est.9b06712. PMID 32294379. S2CID 215793015.
- ^ «Mercury-containing Products». United States Environmental Protection Agency (EPA). Archived from the original on 12 February 2007. Retrieved 1 May 2007.
- ^ IMERC Fact Sheet – Mercury Use in Thermostats Archived 17 June 2012 at the Wayback Machine January 2010
- ^ «Introduction». United States Department of Energy. Archived from the original on 8 July 2007.
- ^ «Minamata Disease The History and Measures». Ministry of the Environment, Government of Japan. Archived from the original on 24 June 2009. Retrieved 7 July 2009.
- ^ Dennis Normile (27 September 2013). «In Minamata, Mercury Still Divides». Science. 341 (6153): 1446–7. Bibcode:2013Sci…341.1446N. doi:10.1126/science.341.6153.1446. PMID 24072902.
- ^ Pourkhabbaz, A.; Pourkhabbaz, H. (2012). «Investigation of Toxic Metals in the Tobacco of Different Iranian Cigarette Brands and Related Health Issues». Iranian Journal of Basic Medical Sciences. 15 (1): 636–644. PMC 3586865. PMID 23493960.
- ^ Talhout, Reinskje; Schulz, Thomas; Florek, Ewa; Van Benthem, Jan; Wester, Piet; Opperhuizen, Antoon (2011). «Hazardous Compounds in Tobacco Smoke». International Journal of Environmental Research and Public Health. 8 (12): 613–628. doi:10.3390/ijerph8020613. ISSN 1660-4601. PMC 3084482. PMID 21556207.
- ^ Bernhard, David, Rossmann, Andrea, Wick, Georg (2005). «Metals in Cigarette Smoke». IUBMB Life. 57 (12): 805–809. doi:10.1080/15216540500459667. PMID 16393783. S2CID 35694266.
- ^ a b c Vane, Christopher H.; Beriro, Darren J.; Turner, Grenville H. (2015). «Rise and fall of mercury (Hg) pollution in sediment cores of the Thames Estuary, London, UK». Earth and Environmental Science Transactions of the Royal Society of Edinburgh. 105 (4): 285–296. doi:10.1017/S1755691015000158. ISSN 1755-6910.
- ^ Vane, C.H.; Jones, D.G.; Lister, T.R. (2009). «Mercury contamination in surface sediments and sediment cores of the Mersey Estuary, UK» (PDF). Marine Pollution Bulletin. 58 (6): 940–946. doi:10.1016/j.marpolbul.2009.03.006. ISSN 0025-326X. PMID 19356771.
- ^ Vane, C.H.; Harrison, I.; Kim, A.W.; Moss-Hayes, V.; Vickers, B.P.; Horton, B.P. (2008). «Status of organic pollutants in surface sediments of Barnegat Bay-Little Egg Harbor Estuary, New Jersey, USA» (PDF). Marine Pollution Bulletin. 56 (10): 1802–1808. doi:10.1016/j.marpolbul.2008.07.004. ISSN 0025-326X. PMID 18715597.
- ^ Vane, C.H.; Harrison, I.; Kim, A.W.; Moss-Hayes, V.; Vickers, B.P.; Hong, K. (2009). «Organic and metal contamination in surface mangrove sediments of South China» (PDF). Marine Pollution Bulletin. 58 (1): 134–144. doi:10.1016/j.marpolbul.2008.09.024. ISSN 0025-326X. PMID 18990413.
- ^ Cocoros, Glenn; Cahn, Phyllis H.; Siler, William (November 1973). «Mercury concentrations in fish, plankton and water from three Western Atlantic estuaries». Journal of Fish Biology. 5 (6): 641–647. doi:10.1111/j.1095-8649.1973.tb04500.x.
- ^ «How We Do Things at IISD-ELA: Collecting a fish muscle biopsy». IISD. 30 September 2015. Retrieved 7 July 2020.
- ^ Mole, Beth (20 December 2019). «Woman had 524x the normal level of mercury in her blood from skin cream use». ArsTechnica. Retrieved 20 July 2021.
{{cite web}}: CS1 maint: url-status (link) - ^ Mudan, Anita, Copan L, Wang R, et al. (20 December 2019). «Notes from the Field: Methylmercury Toxicity from a Skin Lightening Cream Obtained from Mexico — California, 2019». Morbidity and Mortality Weekly Report. 68 (50): 1166–1167. doi:10.15585/mmwr.mm6850a4. PMC 6936160. PMID 31856147.
- ^ Ngim, CH; Foo, SC; Boey, K.W.; Keyaratnam, J (1992). «Chronic neurobehavioral effects of elemental mercury in dentists». British Journal of Industrial Medicine. 49 (11): 782–90. doi:10.1136/oem.49.11.782. PMC 1039326. PMID 1463679.
- ^ Liang, Y. X.; Sun, R. K.; Sun, Y.; Chen, Z. Q.; Li, L. H. (1993). «Psychological effects of low exposure to mercury vapor: Application of computer-administered neurobehavioral evaluation system». Environmental Research. 60 (2): 320–7. Bibcode:1993ER…..60..320L. doi:10.1006/enrs.1993.1040. PMID 8472661.
- ^ McFarland, RB & Reigel, H (1978). «Chronic Mercury Poisoning from a Single Brief Exposure». J. Occup. Med. 20 (8): 532–4. doi:10.1097/00043764-197808000-00003. PMID 690736.
- ^ Mercury, Environmental Health Criteria monograph No. 001, Geneva: World Health Organization, 1976, ISBN 92-4-154061-3
- ^ Inorganic mercury, Environmental Health Criteria monograph No. 118, Geneva: World Health Organization, 1991, ISBN 92-4-157118-7
- ^ Bluhm, RE; et al. (1992). «Elemental Mercury Vapour Toxicity, Treatment, and Prognosis After Acute, Intensive Exposure in Chloralkali Plant Workers. Part I: History, Neuropsychological Findings and Chelator effects». Hum Exp Toxicol. 11 (3): 201–10. doi:10.1177/096032719201100308. PMID 1352115. S2CID 43524794.
- ^ Bluhm, Re; Bobbitt, Rg; Welch, Lw; Wood, Aj; Bonfiglio, Jf; Sarzen, C; Heath, Aj; Branch, Ra (1992). «Elemental mercury vapour toxicity, treatment, and prognosis after acute, intensive exposure in chloralkali plant workers. Part I: History, neuropsychological findings and chelator effects». Human & Experimental Toxicology. 11 (3): 201–10. doi:10.1177/096032719201100308. PMID 1352115. S2CID 43524794.
- ^ «Minamata Convention Agreed by Nations». United Nations Environment Program. Archived from the original on 30 January 2013. Retrieved 19 January 2013.
- ^ Section, United Nations News Service (19 January 2013). «UN News — Governments at UN forum agree on legally-binding treaty to curb mercury pollution». UN News Service Section. Archived from the original on 16 October 2016. Retrieved 22 November 2016.
- ^ «Mercury: Laws and regulations». United States Environmental Protection Agency. 16 April 2008. Archived from the original on 13 May 2008. Retrieved 30 May 2008.
- ^ «Reductions in Mercury Emissions». International Joint Commission on the Great Lakes. Archived from the original on 28 August 2008. Retrieved 21 July 2008.
- ^ «Clean Air Mercury Rule». United States Environmental Protection Agency (EPA). Archived from the original on 30 June 2007. Retrieved 1 May 2007.
- ^ «State of New Jersey et al., Petitioners vs. Environmental Protection Agency (Case No. 05-1097)» (PDF). United States Court of Appeals for the District of Columbia Circuit. Argued 6 December 2007, Decided 8 February 2008. Archived (PDF) from the original on 3 February 2011. Retrieved 30 May 2008.
- ^ Castro Mark S., Sherwell John (2015). «Effectiveness of Emission Controls to Reduce the Atmospheric Concentrations of Mercury». Environmental Science & Technology. 49 (24): 14000–14007. Bibcode:2015EnST…4914000C. doi:10.1021/acs.est.5b03576. PMID 26606506.
- ^ «Oldest, dirtiest power plants told to clean up». Boston Globe. 22 December 2011. Archived from the original on 14 July 2014. Retrieved 2 January 2012.
- ^ Howard Berkes (10 November 2011). «EPA Regulations Give Kilns Permission To Pollute». NPR. Archived from the original on 17 November 2011. Retrieved 2 January 2012.
- ^ «Directive 2002/95/EC on the Restriction of the Use of Certain Hazardous Substances in Electrical and Electronic Equipment». 27 January 2003. Article 4 Paragraph 1. e.g. «Member States shall ensure that, from July 1, 2006, new electrical and electronic equipment put on the market does not contain lead, mercury, cadmium, hexavalent chromium, polybrominated biphenyls (PBB) or polybrominated diphenyl ethers (PBDE).»
- ^ «Mercury compounds in European Union». EIA Track. 2007. Archived from the original on 28 April 2008. Retrieved 30 May 2008.
- ^ Jones H. (10 July 2007). «EU bans mercury in barometers, thermometers». Reuters. Archived from the original on 3 January 2009. Retrieved 12 September 2017.
- ^ «Norway to ban mercury». EU Business. 21 December 2007. Archived from the original on 21 January 2008. Retrieved 30 May 2008.
- ^ Berg, T; Fjeld, E; Steinnes, E (2006). «Atmospheric mercury in Norway: contributions from different sources». The Science of the Total Environment. 368 (1): 3–9. Bibcode:2006ScTEn.368….3B. doi:10.1016/j.scitotenv.2005.09.059. PMID 16310836.
- ^ a b Edlich, Richard F; Rhoads, Samantha K.; Cantrell, Holly S.; Azavedo, Sabrina M.; Newkirk, Anthony T. «Banning Mercury Amalgam in the United States» (PDF). USA: Food and Drug Administration. Archived from the original (PDF) on 1 November 2013.
- ^ «Sweden to ban mercury — The Local». 14 January 2009. Archived from the original on 28 August 2016. Retrieved 22 November 2016.
{{cite web}}: CS1 maint: bot: original URL status unknown (link) - ^ «Sweden may be forced to lift ban on mercury — The Local». 21 April 2012. Archived from the original on 28 August 2016. Retrieved 22 November 2016.
{{cite web}}: CS1 maint: bot: original URL status unknown (link)
Further reading
- Johnston, Andrew Scott (15 September 2013). Mercury and the Making of California: Mining, Landscape, and Race, 1840–1890. TotalBoox, TBX. University Press of Colorado. ISBN 9781457183997. OCLC 969039240.
External links
Look up mercury in Wiktionary, the free dictionary.
- Chemistry in its element podcast (MP3) from the Royal Society of Chemistry’s Chemistry World: Mercury
- Mercury at The Periodic Table of Videos (University of Nottingham)
- Centers for Disease Control and Prevention – Mercury Topic
- EPA fish consumption guidelines
- Hg 80 Mercury
- Material Safety Data Sheet – Mercury
- Stopping Pollution: Mercury – Oceana
- Natural Resources Defense Council (NRDC): Mercury Contamination in Fish guide – NRDC
- NLM Hazardous Substances Databank – Mercury
- BBC – Earth News – Mercury «turns» wetland birds such as ibises homosexual
- Changing Patterns in the Use, Recycling, and Material Substitution of Mercury in the United States United States Geological Survey
- Thermodynamical data on liquid mercury.
- «Mercury (element)» . Encyclopædia Britannica (11th ed.). 1911.
 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mercury | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Appearance | shiny, silvery liquid | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Standard atomic weight Ar°(Hg) |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mercury in the periodic table | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic number (Z) | 80 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Group | group 12 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Period | period 6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Block | d-block | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electron configuration | [Xe] 4f14 5d10 6s2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrons per shell | 2, 8, 18, 32, 18, 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physical properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase at STP | liquid | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Melting point | 234.3210 K (−38.8290 °C, −37.8922 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Boiling point | 629.88 K (356.73 °C, 674.11 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Density (near r.t.) | 13.534 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Triple point | 234.3156 K, 1.65×10−7 kPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Critical point | 1750 K, 172.00 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of fusion | 2.29 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of vaporization | 59.11 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar heat capacity | 27.983 J/(mol·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Vapor pressure
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidation states | −2 , +1, +2 (a mildly basic oxide) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegativity | Pauling scale: 2.00 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ionization energies |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic radius | empirical: 151 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Covalent radius | 132±5 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waals radius | 155 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Spectral lines of mercury |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Other properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Natural occurrence | primordial | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | rhombohedral
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Speed of sound | liquid: 1451.4 m/s (at 20 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermal expansion | 60.4 µm/(m⋅K) (at 25 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermal conductivity | 8.30 W/(m⋅K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrical resistivity | 961 nΩ⋅m (at 25 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetic ordering | diamagnetic[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar magnetic susceptibility | −33.44×10−6 cm3/mol (293 K)[3] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS Number | 7439-97-6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| History | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Discovery | Ancient Egyptians (before 1500 BCE) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Symbol | «Hg»: from its Latin name hydrargyrum, itself from Greek hydrárgyros, ‘water-silver’ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Main isotopes of mercury
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| references |
Mercury is a chemical element with the symbol Hg and atomic number 80. It is also known as quicksilver and was formerly named hydrargyrum ( hy-DRAR-jər-əm) from the Greek words hydor (water) and argyros (silver).[4] A heavy, silvery d-block element, mercury is the only metallic element that is known to be liquid at standard temperature and pressure; the only other element that is liquid under these conditions is the halogen bromine, though metals such as caesium, gallium, and rubidium melt just above room temperature.
Mercury occurs in deposits throughout the world mostly as cinnabar (mercuric sulfide). The red pigment vermilion is obtained by grinding natural cinnabar or synthetic mercuric sulfide.
Mercury is used in thermometers, barometers, manometers, sphygmomanometers, float valves, mercury switches, mercury relays, fluorescent lamps and other devices, though concerns about the element’s toxicity have led to mercury thermometers and sphygmomanometers being largely phased out in clinical environments in favor of alternatives such as alcohol- or galinstan-filled glass thermometers and thermistor- or infrared-based electronic instruments. Likewise, mechanical pressure gauges and electronic strain gauge sensors have replaced mercury sphygmomanometers.
Mercury remains in use in scientific research applications and in amalgam for dental restoration in some locales. It is also used in fluorescent lighting. Electricity passed through mercury vapor in a fluorescent lamp produces short-wave ultraviolet light, which then causes the phosphor in the tube to fluoresce, making visible light.
Mercury poisoning can result from exposure to water-soluble forms of mercury (such as mercuric chloride or methylmercury), by inhalation of mercury vapor, or by ingesting any form of mercury.
Properties
Physical properties
Mercury is a heavy, silvery-white metal that is liquid at room temperature. Compared to other metals, it is a poor conductor of heat, but a fair conductor of electricity.[6]
It has a freezing point of −38.83 °C and a boiling point of 356.73 °C,[7][8][9] both the lowest of any stable metal, although preliminary experiments on copernicium and flerovium have indicated that they have even lower boiling points.[10] This effect is due to lanthanide contraction and relativistic contraction reducing the radius of the outermost electrons, and thus weakening the metallic bonding in mercury.[8] Upon freezing, the volume of mercury decreases by 3.59% and its density changes from 13.69 g/cm3 when liquid to 14.184 g/cm3 when solid. The coefficient of volume expansion is 181.59 × 10−6 at 0 °C, 181.71 × 10−6 at 20 °C and 182.50 × 10−6 at 100 °C (per °C). Solid mercury is malleable and ductile and can be cut with a knife.[11]
Table of thermal and physical properties of liquid mercury:[12][13]
| Temperature (°C) | Density (kg/m^3) | Specific heat (kJ/kg K) | Kinematic viscosity (m^2/s) | Conductivity (W/m K) | Thermal diffusivity (m^2/s) | Prandtl Number | Bulk modulus (K^-1) |
| 0 | 13628.22 | 0.1403 | 1.24E-07 | 8.2 | 4.30E-06 | 0.0288 | 0.000181 |
| 20 | 13579.04 | 0.1394 | 1.14E-07 | 8.69 | 4.61E-06 | 0.0249 | 0.000181 |
| 50 | 13505.84 | 0.1386 | 1.04E-07 | 9.4 | 5.02E-06 | 0.0207 | 0.000181 |
| 100 | 13384.58 | 0.1373 | 9.28E-08 | 10.51 | 5.72E-06 | 0.0162 | 0.000181 |
| 150 | 13264.28 | 0.1365 | 8.53E-08 | 11.49 | 6.35E-06 | 0.0134 | 0.000181 |
| 200 | 13144.94 | 0.157 | 8.02E-08 | 12.34 | 6.91E-06 | 0.0116 | 0.000181 |
| 250 | 13025.6 | 0.1357 | 7.65E-08 | 13.07 | 7.41E-06 | 0.0103 | 0.000183 |
| 315.5 | 12847 | 0.134 | 6.73E-08 | 14.02 | 8.15E-06 | 0.0083 | 0.000186 |
Chemical properties
Mercury does not react with most acids, such as dilute sulfuric acid, although oxidizing acids such as concentrated sulfuric acid and nitric acid or aqua regia dissolve it to give sulfate, nitrate, and chloride. Like silver, mercury reacts with atmospheric hydrogen sulfide. Mercury reacts with solid sulfur flakes, which are used in mercury spill kits to absorb mercury (spill kits also use activated carbon and powdered zinc).[14]
Amalgams
Mercury-discharge spectral calibration lamp
Mercury dissolves many metals such as gold and silver to form amalgams. Iron is an exception, and iron flasks have traditionally been used to trade mercury. Several other first row transition metals with the exception of manganese, copper and zinc are also resistant in forming amalgams. Other elements that do not readily form amalgams with mercury include platinum.[15][16] Sodium amalgam is a common reducing agent in organic synthesis, and is also used in high-pressure sodium lamps.
Mercury readily combines with aluminium to form a mercury-aluminium amalgam when the two pure metals come into contact. Since the amalgam destroys the aluminium oxide layer which protects metallic aluminium from oxidizing in-depth (as in iron rusting), even small amounts of mercury can seriously corrode aluminium. For this reason, mercury is not allowed aboard an aircraft under most circumstances because of the risk of it forming an amalgam with exposed aluminium parts in the aircraft.[17]
Mercury embrittlement is the most common type of liquid metal embrittlement.
Isotopes
There are seven stable isotopes of mercury, with 202
Hg being the most abundant (29.86%). The longest-lived radioisotopes are 194
Hg with a half-life of 444 years, and 203
Hg with a half-life of 46.612 days. Most of the remaining radioisotopes have half-lives that are less than a day. 199
Hg and 201
Hg are the most often studied NMR-active nuclei, having spins of 1⁄2 and 3⁄2 respectively.[6] For the synthesis of precious metals two stable mercury isotopes are of potential interest — the trace isotope 196
Hg and the more abundant 198
Hg. Both are «one neutron removed» from 197
Hg, a radioisotope which decays to 197
Au, the only known stable isotope of gold. However, the rarity of 196
Hg and the high energy requirements of nuclear reactions «knocking out» a neutron from 198
Hg (either via photodisintegration or via a (n,2n) reaction involving fast neutrons), have thus far ruled out practical application of this «real philosopher’s stone».
Etymology
The symbol for the planet Mercury (☿) has been used since ancient times to represent the element
«Hg» is the modern chemical symbol for mercury. It is an abbreviation of hydrargyrum, a romanized form of the ancient Greek name for mercury, ὑδράργυρος (hydrargyros). Hydrargyros is a Greek compound word meaning «water-silver», from ὑδρ— (hydr-), the root of ὕδωρ (hydor) «water», and ἄργυρος (argyros) «silver». Like the English name quicksilver («living-silver»), this name was due to mercury’s liquid and shiny properties.
The modern English name «mercury» comes from the planet Mercury. In medieval alchemy, the seven known metals—quicksilver, gold, silver, copper, iron, lead, and tin—were associated with the seven planets. Quicksilver was associated with the fastest planet, which had been named after the Roman god Mercury, who was associated with speed and mobility. The astrological symbol for the planet became one of the alchemical symbols for the metal, and «Mercury» became an alternative name for the metal. Mercury is the only metal for which the alchemical planetary name survives, as it was decided it was preferable to «quicksilver» as a chemical name.[18][19]
History
Mercury was found in Egyptian tombs that date from 1500 BC.[20]
In China and Tibet, mercury use was thought to prolong life, heal fractures, and maintain generally good health, although it is now known that exposure to mercury vapor leads to serious adverse health effects.[21] The first emperor of a unified China, Qín Shǐ Huáng Dì—allegedly buried in a tomb that contained rivers of flowing mercury on a model of the land he ruled, representative of the rivers of China—was reportedly killed by drinking a mercury and powdered jade mixture formulated by Qin alchemists intended as an elixir of immortality.[22][23] Khumarawayh ibn Ahmad ibn Tulun, the second Tulunid ruler of Egypt (r. 884–896), known for his extravagance and profligacy, reportedly built a basin filled with mercury, on which he would lie on top of air-filled cushions and be rocked to sleep.[24]
In November 2014 «large quantities» of mercury were discovered in a chamber 60 feet below the 1800-year-old pyramid known as the «Temple of the Feathered Serpent,» «the third largest pyramid of Teotihuacan,» Mexico along with «jade statues, jaguar remains, a box filled with carved shells and rubber balls».[25]
Aristotle recounts that Daedalus made a wooden statue of Venus move by pouring quicksilver in its interior.[26] In Greek mythology Daedalus gave the appearance of voice in his statues using quicksilver. The ancient Greeks used cinnabar (mercury sulfide) in ointments; the ancient Egyptians and the Romans used it in cosmetics. In Lamanai, once a major city of the Maya civilization, a pool of mercury was found under a marker in a Mesoamerican ballcourt.[27][28] By 500 BC mercury was used to make amalgams (Medieval Latin amalgama, «alloy of mercury») with other metals.[29]
Alchemists thought of mercury as the First Matter from which all metals were formed. They believed that different metals could be produced by varying the quality and quantity of sulfur contained within the mercury. The purest of these was gold, and mercury was called for in attempts at the transmutation of base (or impure) metals into gold, which was the goal of many alchemists.[18]
The mines in Almadén (Spain), Monte Amiata (Italy), and Idrija (now Slovenia) dominated mercury production from the opening of the mine in Almadén 2500 years ago, until new deposits were found at the end of the 19th century.[30]
Occurrence
Mercury is an extremely rare element in Earth’s crust, having an average crustal abundance by mass of only 0.08 parts per million (ppm).[31] Because it does not blend geochemically with those elements that constitute the majority of the crustal mass, mercury ores can be extraordinarily concentrated considering the element’s abundance in ordinary rock. The richest mercury ores contain up to 2.5% mercury by mass, and even the leanest concentrated deposits are at least 0.1% mercury (12,000 times average crustal abundance). It is found either as a native metal (rare) or in cinnabar, metacinnabar, sphalerite, corderoite, livingstonite and other minerals, with cinnabar (HgS) being the most common ore.[32][33] Mercury ores often occur in hot springs or other volcanic regions.[34]
Beginning in 1558, with the invention of the patio process to extract silver from ore using mercury, mercury became an essential resource in the economy of Spain and its American colonies. Mercury was used to extract silver from the lucrative mines in New Spain and Peru. Initially, the Spanish Crown’s mines in Almadén in Southern Spain supplied all the mercury for the colonies.[35] Mercury deposits were discovered in the New World, and more than 100,000 tons of mercury were mined from the region of Huancavelica, Peru, over the course of three centuries following the discovery of deposits there in 1563. The patio process and later pan amalgamation process continued to create great demand for mercury to treat silver ores until the late 19th century.[36]
Former mines in Italy, the United States and Mexico, which once produced a large proportion of the world supply, have now been completely mined out or, in the case of Slovenia (Idrija) and Spain (Almadén), shut down due to the fall of the price of mercury. Nevada’s McDermitt Mine, the last mercury mine in the United States, closed in 1992. The price of mercury has been highly volatile over the years and in 2006 was $650 per 76-pound (34.46 kg) flask.[37]
Mercury is extracted by heating cinnabar in a current of air and condensing the vapor. The equation for this extraction is
- HgS + O2 → Hg + SO2
In 2005, China was the top producer of mercury with almost two-thirds global share followed by Kyrgyzstan.[38]: 47 Several other countries are believed to have unrecorded production of mercury from copper electrowinning processes and by recovery from effluents.
Because of the high toxicity of mercury, both the mining of cinnabar and refining for mercury are hazardous and historic causes of mercury poisoning.[39] In China, prison labor was used by a private mining company as recently as the 1950s to develop new cinnabar mines. Thousands of prisoners were used by the Luo Xi mining company to establish new tunnels.[40] Worker health in functioning mines is at high risk.
A newspaper claimed that an unidentified European Union directive calling for energy-efficient lightbulbs to be made mandatory by 2012 encouraged China to re-open cinnabar mines to obtain the mercury required for CFL bulb manufacture. Environmental dangers have been a concern, particularly in the southern cities of Foshan and Guangzhou, and in Guizhou province in the southwest.[40]
Abandoned mercury mine processing sites often contain very hazardous waste piles of roasted cinnabar calcines. Water run-off from such sites is a recognized source of ecological damage. Former mercury mines may be suited for constructive re-use. For example, in 1976 Santa Clara County, California purchased the historic Almaden Quicksilver Mine and created a county park on the site, after conducting extensive safety and environmental analysis of the property.[41]
Chemistry
All known mercury compounds exhibit one of two positive oxidation states: I and II. Experiments have failed to unequivocally demonstrate any higher oxidation states: both the claimed 1976 electrosynthesis of an unstable Hg(III) species and 2007 cryogenic isolation of HgF4 have disputed interpretations and remain difficult (if not impossible) to reproduce.[42]
Compounds of mercury(I)
Unlike its lighter neighbors, cadmium and zinc, mercury usually forms simple stable compounds with metal-metal bonds. Most mercury(I) compounds are diamagnetic and feature the dimeric cation, Hg2+
2. Stable derivatives include the chloride and nitrate. Treatment of Hg(I) compounds complexation with strong ligands such as sulfide, cyanide, etc. induces disproportionation to Hg2+
and elemental mercury.[43] Mercury(I) chloride, a colorless solid also known as calomel, is really the compound with the formula Hg2Cl2, with the connectivity Cl-Hg-Hg-Cl. It is a standard in electrochemistry. It reacts with chlorine to give mercuric chloride, which resists further oxidation. Mercury(I) hydride, a colorless gas, has the formula HgH, containing no Hg-Hg bond.
Indicative of its tendency to bond to itself, mercury forms mercury polycations, which consist of linear chains of mercury centers, capped with a positive charge. One example is Hg2+
3(AsF−
6)
2.[44]
Compounds of mercury(II)
Mercury(II) is the most common oxidation state and is the main one in nature as well. All four mercuric halides are known. They form tetrahedral complexes with other ligands but the halides adopt linear coordination geometry, somewhat like Ag+ does. Best known is mercury(II) chloride, an easily sublimating white solid. HgCl2 forms coordination complexes that are typically tetrahedral, e.g. HgCl2−
4.
Mercury(II) oxide, the main oxide of mercury, arises when the metal is exposed to air for long periods at elevated temperatures. It reverts to the elements upon heating near 400 °C, as was demonstrated by Joseph Priestley in an early synthesis of pure oxygen.[14] Hydroxides of mercury are poorly characterized, as they are for its neighbors gold and silver.
Being a soft metal, mercury forms very stable derivatives with the heavier chalcogens. Preeminent is mercury(II) sulfide, HgS, which occurs in nature as the ore cinnabar and is the brilliant pigment vermillion. Like ZnS, HgS crystallizes in two forms, the reddish cubic form and the black zinc blende form.[6] The latter sometimes occurs naturally as metacinnabar.[33] Mercury(II) selenide (HgSe) and mercury(II) telluride (HgTe) are also known, these as well as various derivatives, e.g. mercury cadmium telluride and mercury zinc telluride being semiconductors useful as infrared detector materials.[45]
Mercury(II) salts form a variety of complex derivatives with ammonia. These include Millon’s base (Hg2N+), the one-dimensional polymer (salts of HgNH+
2)
n), and «fusible white precipitate» or [Hg(NH3)2]Cl2. Known as Nessler’s reagent, potassium tetraiodomercurate(II) (HgI2−
4) is still occasionally used to test for ammonia owing to its tendency to form the deeply colored iodide salt of Millon’s base.
Mercury fulminate is a detonator widely used in explosives.[6]
Organomercury compounds
Organic mercury compounds are historically important but are of little industrial value in the western world. Mercury(II) salts are a rare example of simple metal complexes that react directly with aromatic rings. Organomercury compounds are always divalent and usually two-coordinate and linear geometry. Unlike organocadmium and organozinc compounds, organomercury compounds do not react with water. They usually have the formula HgR2, which are often volatile, or HgRX, which are often solids, where R is aryl or alkyl and X is usually halide or acetate. Methylmercury, a generic term for compounds with the formula CH3HgX, is a dangerous family of compounds that are often found in polluted water.[46] They arise by a process known as biomethylation.
Applications
Mercury is used primarily for the manufacture of industrial chemicals or for electrical and electronic applications. It is used in some liquid-in-glass thermometers, especially those used to measure high temperatures. A still increasing amount is used as gaseous mercury in fluorescent lamps, while most of the other applications are slowly being phased out due to health and safety regulations. In some applications, mercury is replaced with less toxic but considerably more expensive Galinstan alloy.[47]
Medicine
Mercury and its compounds have been used in medicine, although they are much less common today than they once were, now that the toxic effects of mercury and its compounds are more widely understood. An example of the early therapeutic application of mercury of was published in 1787 by James Lind.[48]
The first edition of the Merck’s Manual (1899) featured many mercuric compounds[49] such as:
- Mercauro
- Mercuro-iodo-hemol.
- Mercury-ammonium chloride
- Mercury Benzoate
- Mercuric
- Mercury Bichloride (Corrosive Mercuric Chloride, U.S.P.)
- Mercury Chloride
- Mild Mercury Cyanide
- Mercury Succinimide
- Mercury Iodide
- Red Mercury Biniodide
- Mercury Iodide
- Yellow Mercury Proto-iodide
- Black (Hahnemann), Soluble Mercury Oxide
- Red Mercury Oxide
- Yellow Mercury Oxide
- Mercury Salicylate
- Mercury Succinimide
- Mercury Imido-succinate
- Mercury Sulphate
- Basic Mercury Subsulphate; Turpeth Mineral
- Mercury Tannate
- Mercury-Ammonium Chloride
Mercury is an ingredient in dental amalgams. Thiomersal (called Thimerosal in the United States) is an organic compound used as a preservative in vaccines, though this use is in decline.[50] Thiomersal is metabolized to ethyl mercury. Although it was widely speculated that this mercury-based preservative could cause or trigger autism in children, scientific studies showed no evidence supporting any such link.[51] Nevertheless, thiomersal has been removed from, or reduced to trace amounts in all U.S. vaccines recommended for children 6 years of age and under, with the exception of inactivated influenza vaccine.[52]
Another mercury compound, merbromin (Mercurochrome), is a topical antiseptic used for minor cuts and scrapes that is still in use in some countries.
Mercury in the form of one of its common ores, cinnabar, is used in various traditional medicines, especially in traditional Chinese medicine. Review of its safety has found that cinnabar can lead to significant mercury intoxication when heated, consumed in overdose, or taken long term, and can have adverse effects at therapeutic doses, though effects from therapeutic doses are typically reversible. Although this form of mercury appears to be less toxic than other forms, its use in traditional Chinese medicine has not yet been justified, as the therapeutic basis for the use of cinnabar is not clear.[53]
Today, the use of mercury in medicine has greatly declined in all respects, especially in developed countries. Thermometers and sphygmomanometers containing mercury were invented in the early 18th and late 19th centuries, respectively. In the early 21st century, their use is declining and has been banned in some countries, states and medical institutions. In 2002, the U.S. Senate passed legislation to phase out the sale of non-prescription mercury thermometers. In 2003, Washington and Maine became the first states to ban mercury blood pressure devices.[54] Mercury compounds are found in some over-the-counter drugs, including topical antiseptics, stimulant laxatives, diaper-rash ointment, eye drops, and nasal sprays. The FDA has «inadequate data to establish general recognition of the safety and effectiveness» of the mercury ingredients in these products.[55] Mercury is still used in some diuretics although substitutes now exist for most therapeutic uses.
Production of chlorine and caustic soda
Chlorine is produced from sodium chloride (common salt, NaCl) using electrolysis to separate the metallic sodium from the chlorine gas. Usually the salt is dissolved in water to produce a brine. By-products of any such chloralkali process are hydrogen (H2) and sodium hydroxide (NaOH), which is commonly called caustic soda or lye. By far the largest use of mercury[56][57] in the late 20th century was in the mercury cell process (also called the Castner-Kellner process) where metallic sodium is formed as an amalgam at a cathode made from mercury; this sodium is then reacted with water to produce sodium hydroxide.[58] Many of the industrial mercury releases of the 20th century came from this process, although modern plants claimed to be safe in this regard.[57] After about 1985, all new chloralkali production facilities that were built in the United States used membrane cell or diaphragm cell technologies to produce chlorine.
Laboratory uses
Some medical thermometers, especially those for high temperatures, are filled with mercury; they are gradually disappearing. In the United States, non-prescription sale of mercury fever thermometers has been banned since 2003.[59]
Some transit telescopes use a basin of mercury to form a flat and absolutely horizontal mirror, useful in determining an absolute vertical or perpendicular reference. Concave horizontal parabolic mirrors may be formed by rotating liquid mercury on a disk, the parabolic form of the liquid thus formed reflecting and focusing incident light. Such liquid-mirror telescopes are cheaper than conventional large mirror telescopes by up to a factor of 100, but the mirror cannot be tilted and always points straight up.[60][61][62]
Liquid mercury is a part of popular secondary reference electrode (called the calomel electrode) in electrochemistry as an alternative to the standard hydrogen electrode. The calomel electrode is used to work out the electrode potential of half cells.[63] Last, but not least, the triple point of mercury, −38.8344 °C, is a fixed point used as a temperature standard for the International Temperature Scale (ITS-90).[6]
In polarography both the dropping mercury electrode[64] and the hanging mercury drop electrode[65] use elemental mercury. This use allows a new uncontaminated electrode to be available for each measurement or each new experiment.
Mercury-containing compounds are also of use in the field of structural biology. Mercuric compounds such as mercury(II) chloride or potassium tetraiodomercurate(II) can be added to protein crystals in an effort to create heavy atom derivatives that can be used to solve the phase problem in X-ray crystallography via isomorphous replacement or anomalous scattering methods.
Niche uses
Gaseous mercury is used in mercury-vapor lamps and some «neon sign» type advertising signs and fluorescent lamps. Those low-pressure lamps emit very spectrally narrow lines, which are traditionally used in optical spectroscopy for calibration of spectral position. Commercial calibration lamps are sold for this purpose; reflecting a fluorescent ceiling light into a spectrometer is a common calibration practice.[66] Gaseous mercury is also found in some electron tubes, including ignitrons, thyratrons, and mercury arc rectifiers.[67] It is also used in specialist medical care lamps for skin tanning and disinfection.[68] Gaseous mercury is added to cold cathode argon-filled lamps to increase the ionization and electrical conductivity. An argon-filled lamp without mercury will have dull spots and will fail to light correctly. Lighting containing mercury can be bombarded/oven pumped only once. When added to neon filled tubes the light produced will be inconsistent red/blue spots until the initial burning-in process is completed; eventually it will light a consistent dull off-blue color.[69]
-
The deep violet glow of a mercury vapor discharge in a germicidal lamp, whose spectrum is rich in invisible ultraviolet radiation.
-
Skin tanner containing a low-pressure mercury vapor lamp and two infrared lamps, which act both as light source and electrical ballast
-
Assorted types of fluorescent lamps.
-
The miniaturized Deep Space Atomic Clock is a linear ion-trap-based mercury ion clock, designed for precise and real-time radio navigation in deep space.
The Deep Space Atomic Clock (DSAC) under development by the Jet Propulsion Laboratory utilises mercury in a linear ion-trap-based clock. The novel use of mercury allows very compact atomic clocks, with low energy requirements, and is therefore ideal for space probes and Mars missions.[70]
Cosmetics
Mercury, as thiomersal, is widely used in the manufacture of mascara. In 2008, Minnesota became the first state in the United States to ban intentionally added mercury in cosmetics, giving it a tougher standard than the federal government.[71]
A study in geometric mean urine mercury concentration identified a previously unrecognized source of exposure (skin care products) to inorganic mercury among New York City residents. Population-based biomonitoring also showed that mercury concentration levels are higher in consumers of seafood and fish meals.[72]
Skin whitening
Mercury is effective as an active ingredient in skin whitening compounds used to depigment skin.[73] The Minamata Convention on Mercury limits the concentration of mercury in such whiteners to 1 part per million. However, as of 2022, many commercially sold whitener products continue to exceed that limit, and are considered toxic.[74]
Firearms
Mercury(II) fulminate is a primary explosive which is mainly used as a primer of a cartridge in firearms.
Historic uses
A single-pole, single-throw (SPST) mercury switch
Many historic applications made use of the peculiar physical properties of mercury, especially as a dense liquid and a liquid metal:
- Quantities of liquid mercury ranging from 90 to 600 grams (3.2 to 21.2 oz) have been recovered from elite Maya tombs (100–700 AD)[25] or ritual caches at six sites. This mercury may have been used in bowls as mirrors for divinatory purposes. Five of these date to the Classic Period of Maya civilization (c. 250–900) but one example predated this.[75]
- In Islamic Spain, it was used for filling decorative pools. Later, the American artist Alexander Calder built a mercury fountain for the Spanish Pavilion at the 1937 World Exhibition in Paris. The fountain is now on display at the Fundació Joan Miró in Barcelona.[76]
- Mercury was used inside wobbler lures. Its heavy, liquid form made it useful since the lures made an attractive irregular movement when the mercury moved inside the plug. Such use was stopped due to environmental concerns, but illegal preparation of modern fishing plugs has occurred.
- The Fresnel lenses of old lighthouses used to float and rotate in a bath of mercury which acted like a bearing.[77]
- Mercury sphygmomanometers (blood pressure meter), barometers, diffusion pumps, coulometers, and many other laboratory instruments took advantage of mercury’s properties as a very dense, opaque liquid with a nearly linear thermal expansion.[78]
- As an electrically conductive liquid, it was used in mercury switches (including home mercury light switches installed prior to 1970), tilt switches used in old fire detectors, and tilt switches in some home thermostats.[79]
- Owing to its acoustic properties, mercury was used as the propagation medium in delay-line memory devices used in early digital computers of the mid-20th century.
- Experimental mercury vapor turbines were installed to increase the efficiency of fossil-fuel electrical power plants.[80] The South Meadow power plant in Hartford, CT employed mercury as its working fluid, in a binary configuration with a secondary water circuit, for a number of years starting in the late 1920s in a drive to improve plant efficiency. Several other plants were built, including the Schiller Station in Portsmouth, NH, which went online in 1950. The idea did not catch on industry-wide due to the weight and toxicity of mercury, as well as the advent of supercritical steam plants in later years.[81][82]
- Similarly, liquid mercury was used as a coolant for some nuclear reactors; however, sodium is proposed for reactors cooled with liquid metal, because the high density of mercury requires much more energy to circulate as coolant.[83]
- Mercury was a propellant for early ion engines in electric space propulsion systems. Advantages were mercury’s high molecular weight, low ionization energy, low dual-ionization energy, high liquid density and liquid storability at room temperature. Disadvantages were concerns regarding environmental impact associated with ground testing and concerns about eventual cooling and condensation of some of the propellant on the spacecraft in long-duration operations. The first spaceflight to use electric propulsion was a mercury-fueled ion thruster developed at NASA Glenn Research Center and flown on the Space Electric Rocket Test «SERT-1» spacecraft launched by NASA at its Wallops Flight Facility in 1964. The SERT-1 flight was followed up by the SERT-2 flight in 1970. Mercury and caesium were preferred propellants for ion engines until Hughes Research Laboratory performed studies finding xenon gas to be a suitable replacement. Xenon is now the preferred propellant for ion engines as it has a high molecular weight, little or no reactivity due to its noble gas nature, and has a high liquid density under mild cryogenic storage.[84][85]
Other applications made use of the chemical properties of mercury:
- The mercury battery is a non-rechargeable electrochemical battery, a primary cell, that was common in the middle of the 20th century. It was used in a wide variety of applications and was available in various sizes, particularly button sizes. Its constant voltage output and long shelf life gave it a niche use for camera light meters and hearing aids. The mercury cell was effectively banned in most countries in the 1990s due to concerns about the mercury contaminating landfills.[86]
- Mercury was used for preserving wood, developing daguerreotypes, silvering mirrors, anti-fouling paints (discontinued in 1990), herbicides (discontinued in 1995), interior latex paint, handheld maze games, cleaning, and road leveling devices in cars. Mercury compounds have been used in antiseptics, laxatives, antidepressants, and in antisyphilitics.
- It was allegedly used by allied spies to sabotage Luftwaffe planes: a mercury paste was applied to bare aluminium, causing the metal to rapidly corrode; this would cause structural failures.[87]
- Chloralkali process: The largest industrial use of mercury during the 20th century was in electrolysis for separating chlorine and sodium from brine; mercury being the anode of the Castner-Kellner process. The chlorine was used for bleaching paper (hence the location of many of these plants near paper mills) while the sodium was used to make sodium hydroxide for soaps and other cleaning products. This usage has largely been discontinued, replaced with other technologies that utilize membrane cells.[88]
- As electrodes in some types of electrolysis, batteries (mercury cells), sodium hydroxide and chlorine production, handheld games, catalysts, insecticides.
- Mercury was once used as a gun barrel bore cleaner.[89][90]
- From the mid-18th to the mid-19th centuries, a process called «carroting» was used in the making of felt hats. Animal skins were rinsed in an orange solution (the term «carroting» arose from this color) of the mercury compound mercuric nitrate, Hg(NO3)2·2H2O.[91] This process separated the fur from the pelt and matted it together. This solution and the vapors it produced were highly toxic. The United States Public Health Service banned the use of mercury in the felt industry in December 1941. The psychological symptoms associated with mercury poisoning inspired the phrase «mad as a hatter». Lewis Carroll’s «Mad Hatter» in his book Alice’s Adventures in Wonderland was a play on words based on the older phrase, but the character himself does not exhibit symptoms of mercury poisoning.[92]
- Gold and silver mining. Historically, mercury was used extensively in hydraulic gold mining in order to help the gold to sink through the flowing water-gravel mixture. Thin gold particles may form mercury-gold amalgam and therefore increase the gold recovery rates.[6] Large-scale use of mercury stopped in the 1960s. However, mercury is still used in small scale, often clandestine, gold prospecting. It is estimated that 45,000 metric tons of mercury used in California for placer mining have not been recovered.[93] Mercury was also used in silver mining.[94]
Historic medicinal uses
Mercury(I) chloride (also known as calomel or mercurous chloride) has been used in traditional medicine as a diuretic, topical disinfectant, and laxative. Mercury(II) chloride (also known as mercuric chloride or corrosive sublimate) was once used to treat syphilis (along with other mercury compounds), although it is so toxic that sometimes the symptoms of its toxicity were confused with those of the syphilis it was believed to treat.[95] It is also used as a disinfectant. Blue mass, a pill or syrup in which mercury is the main ingredient, was prescribed throughout the 19th century for numerous conditions including constipation, depression, child-bearing and toothaches.[96] In the early 20th century, mercury was administered to children yearly as a laxative and dewormer, and it was used in teething powders for infants. The mercury-containing organohalide merbromin (sometimes sold as Mercurochrome) is still widely used but has been banned in some countries such as the U.S.[97]
Toxicity and safety
| Hazards | |
|---|---|
| GHS labelling: | |
|
Pictograms |
  
|
|
Signal word |
Danger |
|
Hazard statements |
H330, H360D, H372, H410 |
|
Precautionary statements |
P201, P233, P260, P273, P280, P304, P308, P310, P313, P340, P391, P403[98] |
| NFPA 704 (fire diamond) |
2 0 0 |
Mercury and most of its compounds are extremely toxic and must be handled with care; in cases of spills involving mercury (such as from certain thermometers or fluorescent light bulbs), specific cleaning procedures are used to avoid exposure and contain the spill.[99] Protocols call for physically merging smaller droplets on hard surfaces, combining them into a single larger pool for easier removal with an eyedropper, or for gently pushing the spill into a disposable container. Vacuum cleaners and brooms cause greater dispersal of the mercury and should not be used. Afterwards, fine sulfur, zinc, or some other powder that readily forms an amalgam (alloy) with mercury at ordinary temperatures is sprinkled over the area before itself being collected and properly disposed of. Cleaning porous surfaces and clothing is not effective at removing all traces of mercury and it is therefore advised to discard these kinds of items should they be exposed to a mercury spill.
Mercury can be absorbed through the skin and mucous membranes and mercury vapors can be inhaled, so containers of mercury are securely sealed to avoid spills and evaporation. Heating of mercury, or of compounds of mercury that may decompose when heated, should be carried out with adequate ventilation in order to minimize exposure to mercury vapor. The most toxic forms of mercury are its organic compounds, such as dimethylmercury and methylmercury. Mercury can cause both chronic and acute poisoning.
Releases in the environment
Amount of atmospheric mercury deposited at Wyoming’s Upper Fremont Glacier over the last 270 years
Preindustrial deposition rates of mercury from the atmosphere may be about 4 ng /(1 L of ice deposit). Although that can be considered a natural level of exposure, regional or global sources have significant effects. Volcanic eruptions can increase the atmospheric source by 4–6 times.[100]
Natural sources, such as volcanoes, are responsible for approximately half of atmospheric mercury emissions. The human-generated half can be divided into the following estimated percentages:[101][102][103]
- 65% from stationary combustion, of which coal-fired power plants are the largest aggregate source (40% of U.S. mercury emissions in 1999). This includes power plants fueled with gas where the mercury has not been removed. Emissions from coal combustion are between one and two orders of magnitude higher than emissions from oil combustion, depending on the country.[101]
- 11% from gold production. The three largest point sources for mercury emissions in the U.S. are the three largest gold mines. Hydrogeochemical release of mercury from gold-mine tailings has been accounted as a significant source of atmospheric mercury in eastern Canada.[104]
- 6.8% from non-ferrous metal production, typically smelters.
- 6.4% from cement production.
- 3.0% from waste disposal, including municipal and hazardous waste, crematoria, and sewage sludge incineration.
- 3.0% from caustic soda production.
- 1.4% from pig iron and steel production.
- 1.1% from mercury production, mainly for batteries.
- 2.0% from other sources.
The above percentages are estimates of the global human-caused mercury emissions in 2000, excluding biomass burning, an important source in some regions.[101]
Recent atmospheric mercury contamination in outdoor urban air was measured at 0.01–0.02 μg/m3. A 2001 study measured mercury levels in 12 indoor sites chosen to represent a cross-section of building types, locations and ages in the New York area. This study found mercury concentrations significantly elevated over outdoor concentrations, at a range of 0.0065 – 0.523 μg/m3. The average was 0.069 μg/m3.[105]
Artificial lakes, or reservoirs, may be contaminated with mercury due to the absorption by the water of mercury from submerged trees and soil.
For example, Williston Lake in northern British Columbia, created by the damming of the Peace River in 1968, is still sufficiently contaminated with mercury that it is inadvisable to consume fish from the lake.[106][107] Permafrost soils have accumulated mercury through atmospheric deposition,[108] and permafrost thaw in cryospheric regions is also a mechanism of mercury release into lakes, rivers, and wetlands.[109][110]
Mercury also enters into the environment through the improper disposal (e.g., land filling, incineration) of certain products. Products containing mercury include: auto parts, batteries, fluorescent bulbs, medical products, thermometers, and thermostats.[111] Due to health concerns (see below), toxics use reduction efforts are cutting back or eliminating mercury in such products. For example, the amount of mercury sold in thermostats in the United States decreased from 14.5 tons in 2004 to 3.9 tons in 2007.[112]
Most thermometers now use pigmented alcohol instead of mercury. Mercury thermometers are still occasionally used in the medical field because they are more accurate than alcohol thermometers, though both are commonly being replaced by electronic thermometers and less commonly by galinstan thermometers. Mercury thermometers are still widely used for certain scientific applications because of their greater accuracy and working range.
Historically, one of the largest releases was from the Colex plant, a lithium isotope separation plant at Oak Ridge, Tennessee. The plant operated in the 1950s and 1960s. Records are incomplete and unclear, but government commissions have estimated that some two million pounds of mercury are unaccounted for.[113]
A serious industrial disaster was the dumping of waste mercury compounds into Minamata Bay, Japan, between 1932 and 1968. It is estimated that over 3,000 people suffered various deformities, severe mercury poisoning symptoms or death from what became known as Minamata disease.[114][115]
The tobacco plant readily absorbs and accumulates heavy metals such as mercury from the surrounding soil into its leaves. These are subsequently inhaled during tobacco smoking.[116] While mercury is a constituent of tobacco smoke,[117] studies have largely failed to discover a significant correlation between smoking and Hg uptake by humans compared to sources such as occupational exposure, fish consumption, and amalgam tooth fillings.[118]
Sediment contamination
Sediments within large urban-industrial estuaries act as an important sink for point source and diffuse mercury pollution within catchments.[119] A 2015 study of foreshore sediments from the Thames estuary measured total mercury at 0.01 to 12.07 mg/kg with mean of 2.10 mg/kg and median of 0.85 mg/kg (n=351).[119] The highest mercury concentrations were shown to occur in and around the city of London in association with fine grain muds and high total organic carbon content.[119] The strong affinity of mercury for carbon rich sediments has also been observed in salt marsh sediments of the River Mersey mean of 2 mg/kg up to 5 mg/kg.[120] These concentrations are far higher than those shown in salt marsh river creek sediments of New Jersey and mangroves of Southern China which exhibit low mercury concentrations of about 0.2 mg/kg.[121][122]
Occupational exposure
EPA workers clean up residential mercury spill in 2004
Due to the health effects of mercury exposure, industrial and commercial uses are regulated in many countries. The World Health Organization, OSHA, and NIOSH all treat mercury as an occupational hazard, and have established specific occupational exposure limits. Environmental releases and disposal of mercury are regulated in the U.S. primarily by the United States Environmental Protection Agency.
Fish
Fish and shellfish have a natural tendency to concentrate mercury in their bodies, often in the form of methylmercury, a highly toxic organic compound of mercury. Species of fish that are high on the food chain, such as shark, swordfish, king mackerel, bluefin tuna, albacore tuna, and tilefish contain higher concentrations of mercury than others. Because mercury and methylmercury are fat soluble, they primarily accumulate in the viscera, although they are also found throughout the muscle tissue.[123] Mercury presence in fish muscles can be studied using non-lethal muscle biopsies.[124] Mercury present in prey fish accumulates in the predator that consumes them. Since fish are less efficient at depurating than accumulating methylmercury, methylmercury concentrations in the fish tissue increase over time. Thus species that are high on the food chain amass body burdens of mercury that can be ten times higher than the species they consume. This process is called biomagnification. Mercury poisoning happened this way in Minamata, Japan, now called Minamata disease.
Cosmetics
Some facial creams contain dangerous levels of mercury. Most contain comparatively non-toxic inorganic mercury, but products containing highly toxic organic mercury have been encountered.[125][126]
Effects and symptoms of mercury poisoning
Toxic effects include damage to the brain, kidneys and lungs. Mercury poisoning can result in several diseases, including acrodynia (pink disease), Hunter-Russell syndrome, and Minamata disease.
Symptoms typically include sensory impairment (vision, hearing, speech), disturbed sensation and a lack of coordination. The type and degree of symptoms exhibited depend upon the individual toxin, the dose, and the method and duration of exposure. Case–control studies have shown effects such as tremors, impaired cognitive skills, and sleep disturbance in workers with chronic exposure to mercury vapor even at low concentrations in the range 0.7–42 μg/m3.[127][128] A study has shown that acute exposure (4–8 hours) to calculated elemental mercury levels of 1.1 to 44 mg/m3 resulted in chest pain, dyspnea, cough, hemoptysis, impairment of pulmonary function, and evidence of interstitial pneumonitis.[129] Acute exposure to mercury vapor has been shown to result in profound central nervous system effects, including psychotic reactions characterized by delirium, hallucinations, and suicidal tendency. Occupational exposure has resulted in broad-ranging functional disturbance, including erethism, irritability, excitability, excessive shyness, and insomnia. With continuing exposure, a fine tremor develops and may escalate to violent muscular spasms. Tremor initially involves the hands and later spreads to the eyelids, lips, and tongue. Long-term, low-level exposure has been associated with more subtle symptoms of erethism, including fatigue, irritability, loss of memory, vivid dreams and depression.[130][131]
Treatment
Research on the treatment of mercury poisoning is limited. Currently available drugs for acute mercurial poisoning include chelators N-acetyl-D, L-penicillamine (NAP), British Anti-Lewisite (BAL), 2,3-dimercapto-1-propanesulfonic acid (DMPS), and dimercaptosuccinic acid (DMSA). In one small study including 11 construction workers exposed to elemental mercury, patients were treated with DMSA and NAP.[132] Chelation therapy with both drugs resulted in the mobilization of a small fraction of the total estimated body mercury. DMSA was able to increase the excretion of mercury to a greater extent than NAP.[133]
Regulations
International
140 countries agreed in the Minamata Convention on Mercury by the United Nations Environment Programme (UNEP) to prevent emissions.[134] The convention was signed on 10 October 2013.[135]
United States
In the United States, the Environmental Protection Agency is charged with regulating and managing mercury contamination. Several laws give the EPA this authority, including the Clean Air Act, the Clean Water Act, the Resource Conservation and Recovery Act, and the Safe Drinking Water Act. Additionally, the Mercury-Containing and Rechargeable Battery Management Act, passed in 1996, phases out the use of mercury in batteries, and provides for the efficient and cost-effective disposal of many types of used batteries.[136] North America contributed approximately 11% of the total global anthropogenic mercury emissions in 1995.[137]
The United States Clean Air Act, passed in 1990, put mercury on a list of toxic pollutants that need to be controlled to the greatest possible extent. Thus, industries that release high concentrations of mercury into the environment agreed to install maximum achievable control technologies (MACT). In March 2005, the EPA promulgated a regulation[138] that added power plants to the list of sources that should be controlled and instituted a national cap and trade system. States were given until November 2006 to impose stricter controls, but after a legal challenge from several states, the regulations were struck down by a federal appeals court on 8 February 2008. The rule was deemed not sufficient to protect the health of persons living near coal-fired power plants, given the negative effects documented in the EPA Study Report to Congress of 1998.[139] However newer data published in 2015 showed that after introduction of the stricter controls mercury declined sharply, indicating that the Clean Air Act had its intended impact.[140]
The EPA announced new rules for coal-fired power plants on 22 December 2011.[141] Cement kilns that burn hazardous waste are held to a looser standard than are standard hazardous waste incinerators in the United States, and as a result are a disproportionate source of mercury pollution.[142]
European Union
In the European Union, the directive on the Restriction of the Use of Certain Hazardous Substances in Electrical and Electronic Equipment (see RoHS) bans mercury from certain electrical and electronic products, and limits the amount of mercury in other products to less than 1000 ppm.[143] There are restrictions for mercury concentration in packaging (the limit is 100 ppm for sum of mercury, lead, hexavalent chromium and cadmium) and batteries (the limit is 5 ppm).[144] In July 2007, the European Union also banned mercury in non-electrical measuring devices, such as thermometers and barometers. The ban applies to new devices only, and contains exemptions for the health care sector and a two-year grace period for manufacturers of barometers.[145]
Norway
Norway enacted a total ban on the use of mercury in the manufacturing and import/export of mercury products, effective 1 January 2008.[146] In 2002, several lakes in Norway were found to have a poor state of mercury pollution, with an excess of 1 μg/g of mercury in their sediment.[147]
In 2008, Norway’s Minister of Environment Development Erik Solheim said: «Mercury is among the most dangerous environmental toxins. Satisfactory alternatives to Hg in products are
available, and it is therefore fitting to induce a ban.»[148]
Sweden
Products containing mercury were banned in Sweden in 2009.[149][150]
Denmark
In 2008, Denmark also banned dental mercury amalgam,[148] except for molar masticating surface fillings in permanent (adult) teeth.
See also
- Mercury pollution in the ocean
- Red mercury
- COLEX process (isotopic separation)
References
- ^ «Standard Atomic Weights: Mercury». CIAAW. 2011.
- ^ «Magnetic Susceptibility of the Elements And Inorganic Compounds» (PDF). www-d0.fnal.gov. Fermi National Accelerator Laboratory: DØ Experiment (lagacy document). Archived from the original (PDF) on 24 March 2004. Retrieved 18 February 2015.
- ^ Weast, Robert (1984). CRC, Handbook of Chemistry and Physics. Boca Raton, Florida: Chemical Rubber Company Publishing. pp. E110. ISBN 0-8493-0464-4.
- ^ «Definition of hydrargyrum | Dictionary.com». Archived from the original on 12 August 2014. Retrieved 22 December 2022. Random House Webster’s Unabridged Dictionary.
- ^ «New 12-sided pound coin to enter circulation in March». BBC News. 1 January 2017. Retrieved 2 January 2017.
- ^ a b c d e f Hammond, C. R. «The Elements» (PDF). Archived from the original (PDF) on 26 June 2008. in Lide, D. R., ed. (2005). CRC Handbook of Chemistry and Physics (86th ed.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ^ Senese, F. «Why is mercury a liquid at STP?». General Chemistry Online at Frostburg State University. Archived from the original on 4 April 2007. Retrieved 1 May 2007.
- ^ a b Norrby, L.J. (1991). «Why is mercury liquid? Or, why do relativistic effects not get into chemistry textbooks?». Journal of Chemical Education. 68 (2): 110. Bibcode:1991JChEd..68..110N. doi:10.1021/ed068p110. S2CID 96003717.
- ^ Lide, D. R., ed. (2005). CRC Handbook of Chemistry and Physics (86th ed.). Boca Raton (FL): CRC Press. pp. 4.125–4.126. ISBN 0-8493-0486-5.
- ^ «Dynamic Periodic Table». www.ptable.com. Archived from the original on 20 November 2016. Retrieved 22 November 2016.
- ^ Simons, E. N. (1968). Guide to Uncommon Metals. Frederick Muller. p. 111.
- ^ Holman, Jack P. (2002). Heat Transfer (9th ed.). New York, NY: cGraw-Hill Companies, Inc. pp. 600–606. ISBN 9780072406559.
- ^ Incropera 1 Dewitt 2 Bergman 3 Lavigne 4, Frank P. 1 David P. 2 Theodore L. 3 Adrienne S. 4 (2007). Fundamentals of Heat and Mass Transfer (6th ed.). Hoboken, NJ: John Wiley and Sons, Inc. pp. 941–950. ISBN 9780471457282.
- ^ a b Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ^ Gmelin, Leopold (1852). Hand book of chemistry. Cavendish Society. pp. 103 (Na), 110 (W), 122 (Zn), 128 (Fe), 247 (Au), 338 (Pt). Archived from the original on 9 May 2013. Retrieved 30 December 2012.
- ^ Soratur (2002). Essentials of Dental Materials. Jaypee Brothers Publishers. p. 14. ISBN 978-81-7179-989-3. Archived from the original on 3 June 2016.
- ^ Vargel, C.; Jacques, M.; Schmidt, M. P. (2004). Corrosion of Aluminium. Elsevier. p. 158. ISBN 9780080444956.
- ^ a b Stillman, J. M. (2003). Story of Alchemy and Early Chemistry. Kessinger Publishing. pp. 7–9. ISBN 978-0-7661-3230-6.
- ^ Maurice Crosland (2004) Historical Studies in the Language of Chemistry
- ^ «Mercury and the environment — Basic facts». Environment Canada, Federal Government of Canada. 2004. Archived from the original on 16 September 2011. Retrieved 27 March 2008.
- ^ «Mercury — Element of the ancients». Center for Environmental Health Sciences, Dartmouth College. Archived from the original on 2 December 2012. Retrieved 9 April 2012.
- ^ «Qin Shihuang». Ministry of Culture, People’s Republic of China. 2003. Archived from the original on 4 July 2008. Retrieved 27 March 2008.
- ^ Wright, David Curtis (2001). The History of China. Greenwood Publishing Group. p. 49. ISBN 9780313309403.
- ^ Sobernheim, Moritz (1987). «Khumārawaih». In Houtsma, Martijn Theodoor (ed.). E.J. Brill’s first encyclopaedia of Islam, 1913–1936, Volume IV: ‘Itk–Kwaṭṭa. Leiden: BRILL. p. 973. ISBN 978-90-04-08265-6. Archived from the original on 3 June 2016.
- ^ a b Yuhas, Alan (24 April 2015). «Liquid mercury found under Mexican pyramid could lead to king’s tomb». The Guardian. ISSN 0261-3077. Archived from the original on 1 December 2016. Retrieved 22 November 2016.
- ^ De Anima. Chapter 3. 1907. CS1 maint: location (link)
- ^ Pendergast, David M. (6 August 1982). «Ancient maya mercury». Science. 217 (4559): 533–535. Bibcode:1982Sci…217..533P. doi:10.1126/science.217.4559.533. PMID 17820542. S2CID 39473822.
- ^ «Lamanai». Archived from the original on 11 June 2011. Retrieved 17 June 2011.
- ^ Hesse R W (2007). Jewelrymaking through history. Greenwood Publishing Group. p. 120. ISBN 978-0-313-33507-5.
- ^ Eisler, R. (2006). Mercury hazards to living organisms. CRC Press. ISBN 978-0-8493-9212-2.
- ^ Ehrlich, H. L.; Newman D. K. (2008). Geomicrobiology. CRC Press. p. 265. ISBN 978-0-8493-7906-2.
- ^ Rytuba, James J (2003). «Mercury from mineral deposits and potential environmental impact». Environmental Geology. 43 (3): 326–338. doi:10.1007/s00254-002-0629-5. S2CID 127179672.
- ^ a b «Metacinnabar: Mineral information, data and localities».
- ^ «Mercury Recycling in the United States in 2000» (PDF). USGS. Archived (PDF) from the original on 26 March 2009. Retrieved 7 July 2009.
- ^ Burkholder, M. & Johnson, L. (2008). Colonial Latin America. Oxford University Press. pp. 157–159. ISBN 978-0-19-504542-0.
- ^ Jamieson, R W (2000). Domestic Architecture and Power. Springer. p. 33. ISBN 978-0-306-46176-7.
- ^ Brooks, W. E. (2007). «Mercury» (PDF). U.S. Geological Survey. Archived (PDF) from the original on 27 May 2008. Retrieved 30 May 2008.
- ^
Hetherington, L. E.; Brown, T. J.; Benham, A. J.; Lusty, P. A. J.; Idoine, N. E. (2007). World mineral production: 2001–05 (PDF). Keyworth, Nottingham, UK: British Geological Survey (BGS), Natural Environment Research Council (NERC). ISBN 978-0-85272-592-4. Archived (PDF) from the original on 20 February 2019. Retrieved 20 February 2019. - ^ About the Mercury Rule Archived 1 May 2012 at the Wayback Machine. Act.credoaction.com (21 December 2011). Retrieved on 30 December 2012.
- ^ a b Sheridan, M. (3 May 2009). «‘Green’ Lightbulbs Poison Workers: hundreds of factory staff are being made ill by mercury used in bulbs destined for the West». The Sunday Times (of London, UK). Archived from the original on 17 May 2009.
- ^ Boulland M (2006). New Almaden. Arcadia Publishing. p. 8. ISBN 978-0-7385-3131-1.
- ^ For a general overview, see Riedel, S.; Kaupp, M. (2009). «The Highest Oxidation States of the Transition Metal Elements». Coordination Chemistry Reviews. 253 (5–6): 606–624. doi:10.1016/j.ccr.2008.07.014.
The claimed 1976 synthesis is Deming, Richard L.; Allred, A. L.; Dahl, Alan R.; Herlinger, Albert W.; Kestner, Mark O. (July 1976). «Tripositive mercury. Low temperature electrochemical oxidation of 1,4,8,11-tetraazacyclotetradecanemercury(II) tetrafluoroborate». Journal of the American Chemical Society. 98 (14): 4132–4137. doi:10.1021/ja00430a020; but note that Reidel & Kaupp cite more recent work arguing that the cyclam ligand is instead oxidized.
The claimed 2007 isolation is Xuefang Wang; Andrews, Lester; Riedel, Sebastian; Kaupp, Martin (2007). «Mercury Is a Transition Metal: The First Experimental Evidence for HgF4«. Angew. Chem. Int. Ed. 46 (44): 8371–8375. doi:10.1002/anie.200703710. PMID 17899620, but the spectral identifications are disputed in Rooms, J. F.; Wilson, A. V.; Harvey, I.; Bridgeman, A. J.; Young, N. A. (2008). «Mercury-fluorine interactions: a matrix isolation investigation of Hg⋯F2, HgF2 and HgF4 in argon matrices». Phys Chem Chem Phys. 10 (31): 4594–605. Bibcode:2008PCCP…10.4594R. doi:10.1039/b805608k. PMID 18665309.
- ^ Henderson, W. (2000). Main group chemistry. Great Britain: Royal Society of Chemistry. p. 162. ISBN 978-0-85404-617-1. Archived from the original on 13 May 2016.
- ^ Brown, I. D.; Gillespie, R. J.; Morgan, K. R.; Tun, Z.; Ummat, P. K. (1984). «Preparation and crystal structure of mercury hexafluoroniobate (Hg
3NbF
6) and mercury hexafluorotantalate (Hg
3TaF
6): mercury layer compounds». Inorganic Chemistry. 23 (26): 4506–4508. doi:10.1021/ic00194a020. - ^ Rogalski, A (2000). Infrared detectors. CRC Press. p. 507. ISBN 978-90-5699-203-3.
- ^ National Research Council (U.S.) – Board on Environmental Studies and Toxicology (2000). Toxicological effects of methylmercury. National Academies Press. ISBN 978-0-309-07140-6.
- ^ Surmann, P; Zeyat, H (November 2005). «Voltammetric analysis using a self-renewable non-mercury electrode». Analytical and Bioanalytical Chemistry. 383 (6): 1009–13. doi:10.1007/s00216-005-0069-7. PMID 16228199. S2CID 22732411.
- ^ Lind, J (1787). «An Account of the Efficacy of Mercury in the Cure of Inflammatory Diseases, and the Dysentery». The London Medical Journal. 8 (Pt 1): 43–56. ISSN 0952-4177. PMC 5545546. PMID 29139904.
- ^ Merck’s Manual 1899 (First ed.). Archived from the original on 24 August 2013. Retrieved 16 June 2013.
- ^ FDA. «Thimerosal in Vaccines». Food and Drug Administration. Archived from the original on 26 October 2006. Retrieved 25 October 2006.
- ^ Parker SK; Schwartz B; Todd J; Pickering LK (2004). «Thimerosal-containing vaccines and autistic spectrum disorder: a critical review of published original data». Pediatrics. 114 (3): 793–804. CiteSeerX 10.1.1.327.363. doi:10.1542/peds.2004-0434. PMID 15342856. S2CID 1752023. Erratum: Parker S, Todd J, Schwartz B, Pickering L (January 2005). «Thimerosal-containing vaccines and autistic spectrum disorder: a critical review of published original data». Pediatrics. 115 (1): 200. doi:10.1542/peds.2004-2402. PMID 15630018. S2CID 26700143.
{{cite journal}}: CS1 maint: multiple names: authors list (link). - ^ «Thimerosal in vaccines». Center for Biologics Evaluation and Research, U.S. Food and Drug Administration. 6 September 2007. Archived from the original on 29 September 2007. Retrieved 1 October 2007.
- ^ Liu J; Shi JZ; Yu LM; Goyer RA; Waalkes MP (2008). «Mercury in traditional medicines: is cinnabar toxicologically similar to common mercurials?». Exp. Biol. Med. (Maywood). 233 (7): 810–7. doi:10.3181/0712-MR-336. PMC 2755212. PMID 18445765.
- ^ «Two States Pass First-time Bans on Mercury Blood Pressure Devices». Health Care Without Harm. 2 June 2003. Archived from the original on 4 October 2011. Retrieved 1 May 2007.
- ^ «Title 21—Food and Drugs Chapter I—Food and Drug Administration Department of Health and Human Services Subchapter D—Drugs for Human Use Code of federal regulations». United States Food and Drug Administration. Archived from the original on 13 March 2007. Retrieved 1 May 2007.
- ^ «The CRB Commodity Yearbook (annual)». The CRB Commodity Yearbook: 173. 2000. ISSN 1076-2906.
- ^ a b Leopold, B. R. (2002). «Chapter 3: Manufacturing Processes Involving Mercury. Use and Release of Mercury in the United States» (PDF). National Risk Management Research Laboratory, Office of Research and Development, U.S. Environmental Protection Agency, Cincinnati, Ohio. Archived from the original (PDF) on 21 June 2007. Retrieved 1 May 2007.
- ^ «Chlorine Online Diagram of mercury cell process». Euro Chlor. Archived from the original on 2 September 2006. Retrieved 15 September 2006.
- ^ «Mercury Reduction Act of 2003». United States. Congress. Senate. Committee on Environment and Public Works. Retrieved 6 June 2009.
- ^ «Liquid-mirror telescope set to give stargazing a new spin». Govert Schilling. 14 March 2003. Archived from the original on 18 August 2003. Retrieved 11 October 2008.
- ^ Gibson, B. K. (1991). «Liquid Mirror Telescopes: History». Journal of the Royal Astronomical Society of Canada. 85: 158. Bibcode:1991JRASC..85..158G.
- ^ «Laval University Liquid mirrors and adaptive optics group». Archived from the original on 18 September 2011. Retrieved 24 June 2011.
- ^ Brans, Y W; Hay W W (1995). Physiological monitoring and instrument diagnosis in perinatal and neonatal medicine. CUP Archive. p. 175. ISBN 978-0-521-41951-2.
- ^ Zoski, Cynthia G. (7 February 2007). Handbook of Electrochemistry. Elsevier Science. ISBN 978-0-444-51958-0.
- ^ Kissinger, Peter; Heineman, William R. (23 January 1996). Laboratory Techniques in Electroanalytical Chemistry, Second Edition, Revised and Expanded (2nd ed.). CRC. ISBN 978-0-8247-9445-3.
- ^ Hopkinson, G. R.; Goodman, T. M.; Prince, S. R. (2004). A guide to the use and calibration of detector array equipment. SPIE Press. p. 125. Bibcode:2004gucd.book…..H. ISBN 978-0-8194-5532-1.
- ^ Howatson A H (1965). «Chapter 8». An Introduction to Gas Discharges. Oxford: Pergamon Press. ISBN 978-0-08-020575-5.
- ^ Milo G E; Casto B C (1990). Transformation of human diploid fibroblasts. CRC Press. p. 104. ISBN 978-0-8493-4956-0.
- ^ Shionoya, S. (1999). Phosphor handbook. CRC Press. p. 363. ISBN 978-0-8493-7560-6.
- ^ Robert L. Tjoelker; et al. (2016). «Mercury Ion Clock for a NASA Technology Demonstration Mission». IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 63 (7): 1034–1043. Bibcode:2016ITUFF..63.1034T. doi:10.1109/TUFFC.2016.2543738. PMID 27019481. S2CID 3245467.
- ^ «Mercury in your eye?». CIDPUSA. 16 February 2008. Archived from the original on 5 January 2010. Retrieved 20 December 2009.
- ^ McKelvey W; Jeffery N; Clark N; Kass D; Parsons PJ. 2010 (2011). «Population-Based Inorganic Mercury Biomonitoring and the Identification of Skin Care Products as a Source of Exposure in New York City». Environ Health Perspect. 119 (2): 203–9. doi:10.1289/ehp.1002396. PMC 3040607. PMID 20923743.
- ^ Mohammed, Terry; Mohammed, Elisabeth; Bascombe, Shermel (9 October 2017). «The evaluation of total mercury and arsenic in skin bleaching creams commonly used in Trinidad and Tobago and their potential risk to the people of the Caribbean». Journal of Public Health Research. 6 (3): 1097. doi:10.4081/jphr.2017.1097. PMC 5736993. PMID 29291194.
- ^ Meera Senthilingam, «Skin whitening creams containing high levels of mercury continue to be sold on the world’s biggest e-commerce sites, new report finds», 9 March 2022, CNN https://www.cnn.com/2022/03/09/world/zmwg-skin-whitening-creams-mercury-ecommerce-sites-intl-cmd/index.html
- ^ Healy, Paul F.; Blainey, Marc G. (2011). «Ancient Maya Mosaic Mirrors: Function, Symbolism, And Meaning». Ancient Mesoamerica. 22 (2): 229–244 (241). doi:10.1017/S0956536111000241. S2CID 162282151.
- ^ Lew K. (2008). Mercury. The Rosen Publishing Group. p. 10. ISBN 978-1-4042-1780-5.
- ^ Pearson L. F. (2003). Lighthouses. Osprey Publishing. p. 29. ISBN 978-0-7478-0556-4.
- ^ Ramanathan E. AIEEE Chemistry. Sura Books. p. 251. ISBN 978-81-7254-293-1.
- ^ Shelton, C. (2004). Electrical Installations. Nelson Thornes. p. 260. ISBN 978-0-7487-7979-6.
- ^ «Popular Science». The Popular Science Monthly. Bonnier Corporation. 118 (3): 40. 1931. ISSN 0161-7370.
- ^ Mueller, Grover C. (September 1929). Cheaper Power from Quicksilver. Popular Science.
- ^ Mercury as a Working Fluid. Museum of Retro Technology. 13 November 2008. Archived from the original on 21 February 2011.
- ^ Collier (1987). Introduction to Nuclear Power. Taylor & Francis. p. 64. ISBN 978-1-56032-682-3.
- ^ «Glenn Contributions to Deep Space 1». NASA. Archived from the original on 1 October 2009. Retrieved 7 July 2009.
- ^ «Electric space propulsion». Archived from the original on 30 May 2009. Retrieved 7 July 2009.
- ^ «IMERC Fact Sheet: Mercury Use in Batteries». Northeast Waste Management Officials’ Association. January 2010. Archived from the original on 29 November 2012. Retrieved 20 June 2013.
- ^ Gray, T. (22 September 2004). «The Amazing Rusting Aluminum». Popular Science. Archived from the original on 20 July 2009. Retrieved 7 July 2009.
- ^ Dufault, Renee; Leblanc, Blaise; Schnoll, Roseanne; Cornett, Charles; Schweitzer, Laura; Wallinga, David; Hightower, Jane; Patrick, Lyn; Lukiw, Walter J. (2009). «Mercury from Chlor-alkali plants». Environmental Health. 8: 2. doi:10.1186/1476-069X-8-2. PMC 2637263. PMID 19171026. Archived from the original on 29 July 2012.
- ^ Francis, G. W. (1849). Chemical Experiments. D. Francis. p. 62.
- ^ Castles, W. T.; Kimball, V. F. (2005). Firearms and Their Use. Kessinger Publishing. p. 104. ISBN 978-1-4179-8957-7.
- ^ Lee, J. D. (1999). Concise Inorganic Chemistry. Wiley-Blackwell. ISBN 978-0-632-05293-6.
- ^ Waldron, H. A. (1983). «Did the Mad Hatter have mercury poisoning?». Br. Med. J. (Clin. Res. Ed.). 287 (6409): 1961. doi:10.1136/bmj.287.6409.1961. PMC 1550196. PMID 6418283.
- ^ Alpers, C. N.; Hunerlach, M. P.; May, J. Y.; Hothem, R. L. «Mercury Contamination from Historical Gold Mining in California». U.S. Geological Survey. Archived from the original on 22 February 2008. Retrieved 26 February 2008.
- ^ «Mercury amalgamation». Corrosion Doctors. Archived from the original on 19 May 2009. Retrieved 7 July 2009.
- ^ Pimple, K. D.; Pedroni, J. A.; Berdon, V. (9 July 2002). «Syphilis in history». Poynter Center for the Study of Ethics and American Institutions at Indiana University-Bloomington. Archived from the original on 16 February 2005. Retrieved 17 April 2005.
{{cite news}}: CS1 maint: uses authors parameter (link) - ^ Mayell, H. (17 July 2007). «Did Mercury in «Little Blue Pills» Make Abraham Lincoln Erratic?». National Geographic News. Archived from the original on 22 May 2008. Retrieved 15 June 2008.
- ^ «What happened to Mercurochrome?». 23 July 2004. Archived from the original on 11 April 2009. Retrieved 7 July 2009.
- ^ «Mercury 294594». Sigma-Aldrich.
- ^ «Mercury: Spills, Disposal and Site Cleanup». Environmental Protection Agency. Archived from the original on 13 May 2008. Retrieved 11 August 2007.
- ^ «Glacial Ice Cores Reveal A Record of Natural and Anthropogenic Atmospheric Mercury Deposition for the Last 270 Years». United States Geological Survey (USGS). Archived from the original on 4 July 2007. Retrieved 1 May 2007.
- ^ a b c Pacyna E G; Pacyna J M; Steenhuisen F; Wilson S (2006). «Global anthropogenic mercury emission inventory for 2000». Atmos Environ. 40 (22): 4048. Bibcode:2006AtmEn..40.4048P. doi:10.1016/j.atmosenv.2006.03.041.
- ^ «What is EPA doing about mercury air emissions?». United States Environmental Protection Agency (EPA). Archived from the original on 8 February 2007. Retrieved 1 May 2007.
- ^ Solnit, R. (September–October 2006). «Winged Mercury and the Golden Calf». Orion Magazine. Archived from the original on 5 October 2007. Retrieved 3 December 2007.
- ^ Maprani, Antu C.; Al, Tom A.; MacQuarrie, Kerry T.; Dalziel, John A.; Shaw, Sean A.; Yeats, Phillip A. (2005). «Determination of Mercury Evasion in a Contaminated Headwater Stream». Environmental Science & Technology. 39 (6): 1679–87. Bibcode:2005EnST…39.1679M. doi:10.1021/es048962j. PMID 15819225.
- ^ «Indoor Air Mercury» (PDF). newmoa.org. May 2003. Archived (PDF) from the original on 25 March 2009. Retrieved 7 July 2009.
- ^ Meissner, Dirk (12 May 2015). «West Moberly First Nations concerned about mercury contamination in fish». CBC News. The Canadian Press. Retrieved 20 July 2021.
{{cite web}}: CS1 maint: url-status (link) - ^ «Williston-Dinosaur Watershed Fish Mercury Investigation: 2017 Report» (PDF). Fish and Wildlife Compensation Program, Peace Region. June 2018. Retrieved 20 July 2021.
{{cite web}}: CS1 maint: url-status (link) - ^ Schuster, Paul; Schaefer, Kevin; Aiken, George; Antweiler, Ronald; Dewild, John; et al. (2018). «Permafrost Stores a Globally Significant Amount of Mercury». Geophysical Research Letters. 45 (3): 1463–1471. Bibcode:2018GeoRL..45.1463S. doi:10.1002/2017GL075571.
- ^ St. Pierre, Kyra A.; Zolkos, Scott; Shakil, Sarah; Tank, Suzanne E.; St. Louis, Vincent L.; Kokelj, Steven V. (18 December 2018). «Unprecedented Increases in Total and Methyl Mercury Concentrations Downstream of Retrogressive Thaw Slumps in the Western Canadian Arctic». Environmental Science & Technology. 52 (24): 14099–14109. Bibcode:2018EnST…5214099S. doi:10.1021/acs.est.8b05348. PMID 30474969. S2CID 53745081.
- ^ Ci, Zhijia; Peng, Fei; Xue, Xian; Zhang, Xiaoshan (5 May 2020). «Permafrost Thaw Dominates Mercury Emission in Tibetan Thermokarst Ponds». Environmental Science & Technology. 54 (9): 5456–5466. Bibcode:2020EnST…54.5456C. doi:10.1021/acs.est.9b06712. PMID 32294379. S2CID 215793015.
- ^ «Mercury-containing Products». United States Environmental Protection Agency (EPA). Archived from the original on 12 February 2007. Retrieved 1 May 2007.
- ^ IMERC Fact Sheet – Mercury Use in Thermostats Archived 17 June 2012 at the Wayback Machine January 2010
- ^ «Introduction». United States Department of Energy. Archived from the original on 8 July 2007.
- ^ «Minamata Disease The History and Measures». Ministry of the Environment, Government of Japan. Archived from the original on 24 June 2009. Retrieved 7 July 2009.
- ^ Dennis Normile (27 September 2013). «In Minamata, Mercury Still Divides». Science. 341 (6153): 1446–7. Bibcode:2013Sci…341.1446N. doi:10.1126/science.341.6153.1446. PMID 24072902.
- ^ Pourkhabbaz, A.; Pourkhabbaz, H. (2012). «Investigation of Toxic Metals in the Tobacco of Different Iranian Cigarette Brands and Related Health Issues». Iranian Journal of Basic Medical Sciences. 15 (1): 636–644. PMC 3586865. PMID 23493960.
- ^ Talhout, Reinskje; Schulz, Thomas; Florek, Ewa; Van Benthem, Jan; Wester, Piet; Opperhuizen, Antoon (2011). «Hazardous Compounds in Tobacco Smoke». International Journal of Environmental Research and Public Health. 8 (12): 613–628. doi:10.3390/ijerph8020613. ISSN 1660-4601. PMC 3084482. PMID 21556207.
- ^ Bernhard, David, Rossmann, Andrea, Wick, Georg (2005). «Metals in Cigarette Smoke». IUBMB Life. 57 (12): 805–809. doi:10.1080/15216540500459667. PMID 16393783. S2CID 35694266.
- ^ a b c Vane, Christopher H.; Beriro, Darren J.; Turner, Grenville H. (2015). «Rise and fall of mercury (Hg) pollution in sediment cores of the Thames Estuary, London, UK». Earth and Environmental Science Transactions of the Royal Society of Edinburgh. 105 (4): 285–296. doi:10.1017/S1755691015000158. ISSN 1755-6910.
- ^ Vane, C.H.; Jones, D.G.; Lister, T.R. (2009). «Mercury contamination in surface sediments and sediment cores of the Mersey Estuary, UK» (PDF). Marine Pollution Bulletin. 58 (6): 940–946. doi:10.1016/j.marpolbul.2009.03.006. ISSN 0025-326X. PMID 19356771.
- ^ Vane, C.H.; Harrison, I.; Kim, A.W.; Moss-Hayes, V.; Vickers, B.P.; Horton, B.P. (2008). «Status of organic pollutants in surface sediments of Barnegat Bay-Little Egg Harbor Estuary, New Jersey, USA» (PDF). Marine Pollution Bulletin. 56 (10): 1802–1808. doi:10.1016/j.marpolbul.2008.07.004. ISSN 0025-326X. PMID 18715597.
- ^ Vane, C.H.; Harrison, I.; Kim, A.W.; Moss-Hayes, V.; Vickers, B.P.; Hong, K. (2009). «Organic and metal contamination in surface mangrove sediments of South China» (PDF). Marine Pollution Bulletin. 58 (1): 134–144. doi:10.1016/j.marpolbul.2008.09.024. ISSN 0025-326X. PMID 18990413.
- ^ Cocoros, Glenn; Cahn, Phyllis H.; Siler, William (November 1973). «Mercury concentrations in fish, plankton and water from three Western Atlantic estuaries». Journal of Fish Biology. 5 (6): 641–647. doi:10.1111/j.1095-8649.1973.tb04500.x.
- ^ «How We Do Things at IISD-ELA: Collecting a fish muscle biopsy». IISD. 30 September 2015. Retrieved 7 July 2020.
- ^ Mole, Beth (20 December 2019). «Woman had 524x the normal level of mercury in her blood from skin cream use». ArsTechnica. Retrieved 20 July 2021.
{{cite web}}: CS1 maint: url-status (link) - ^ Mudan, Anita, Copan L, Wang R, et al. (20 December 2019). «Notes from the Field: Methylmercury Toxicity from a Skin Lightening Cream Obtained from Mexico — California, 2019». Morbidity and Mortality Weekly Report. 68 (50): 1166–1167. doi:10.15585/mmwr.mm6850a4. PMC 6936160. PMID 31856147.
- ^ Ngim, CH; Foo, SC; Boey, K.W.; Keyaratnam, J (1992). «Chronic neurobehavioral effects of elemental mercury in dentists». British Journal of Industrial Medicine. 49 (11): 782–90. doi:10.1136/oem.49.11.782. PMC 1039326. PMID 1463679.
- ^ Liang, Y. X.; Sun, R. K.; Sun, Y.; Chen, Z. Q.; Li, L. H. (1993). «Psychological effects of low exposure to mercury vapor: Application of computer-administered neurobehavioral evaluation system». Environmental Research. 60 (2): 320–7. Bibcode:1993ER…..60..320L. doi:10.1006/enrs.1993.1040. PMID 8472661.
- ^ McFarland, RB & Reigel, H (1978). «Chronic Mercury Poisoning from a Single Brief Exposure». J. Occup. Med. 20 (8): 532–4. doi:10.1097/00043764-197808000-00003. PMID 690736.
- ^ Mercury, Environmental Health Criteria monograph No. 001, Geneva: World Health Organization, 1976, ISBN 92-4-154061-3
- ^ Inorganic mercury, Environmental Health Criteria monograph No. 118, Geneva: World Health Organization, 1991, ISBN 92-4-157118-7
- ^ Bluhm, RE; et al. (1992). «Elemental Mercury Vapour Toxicity, Treatment, and Prognosis After Acute, Intensive Exposure in Chloralkali Plant Workers. Part I: History, Neuropsychological Findings and Chelator effects». Hum Exp Toxicol. 11 (3): 201–10. doi:10.1177/096032719201100308. PMID 1352115. S2CID 43524794.
- ^ Bluhm, Re; Bobbitt, Rg; Welch, Lw; Wood, Aj; Bonfiglio, Jf; Sarzen, C; Heath, Aj; Branch, Ra (1992). «Elemental mercury vapour toxicity, treatment, and prognosis after acute, intensive exposure in chloralkali plant workers. Part I: History, neuropsychological findings and chelator effects». Human & Experimental Toxicology. 11 (3): 201–10. doi:10.1177/096032719201100308. PMID 1352115. S2CID 43524794.
- ^ «Minamata Convention Agreed by Nations». United Nations Environment Program. Archived from the original on 30 January 2013. Retrieved 19 January 2013.
- ^ Section, United Nations News Service (19 January 2013). «UN News — Governments at UN forum agree on legally-binding treaty to curb mercury pollution». UN News Service Section. Archived from the original on 16 October 2016. Retrieved 22 November 2016.
- ^ «Mercury: Laws and regulations». United States Environmental Protection Agency. 16 April 2008. Archived from the original on 13 May 2008. Retrieved 30 May 2008.
- ^ «Reductions in Mercury Emissions». International Joint Commission on the Great Lakes. Archived from the original on 28 August 2008. Retrieved 21 July 2008.
- ^ «Clean Air Mercury Rule». United States Environmental Protection Agency (EPA). Archived from the original on 30 June 2007. Retrieved 1 May 2007.
- ^ «State of New Jersey et al., Petitioners vs. Environmental Protection Agency (Case No. 05-1097)» (PDF). United States Court of Appeals for the District of Columbia Circuit. Argued 6 December 2007, Decided 8 February 2008. Archived (PDF) from the original on 3 February 2011. Retrieved 30 May 2008.
- ^ Castro Mark S., Sherwell John (2015). «Effectiveness of Emission Controls to Reduce the Atmospheric Concentrations of Mercury». Environmental Science & Technology. 49 (24): 14000–14007. Bibcode:2015EnST…4914000C. doi:10.1021/acs.est.5b03576. PMID 26606506.
- ^ «Oldest, dirtiest power plants told to clean up». Boston Globe. 22 December 2011. Archived from the original on 14 July 2014. Retrieved 2 January 2012.
- ^ Howard Berkes (10 November 2011). «EPA Regulations Give Kilns Permission To Pollute». NPR. Archived from the original on 17 November 2011. Retrieved 2 January 2012.
- ^ «Directive 2002/95/EC on the Restriction of the Use of Certain Hazardous Substances in Electrical and Electronic Equipment». 27 January 2003. Article 4 Paragraph 1. e.g. «Member States shall ensure that, from July 1, 2006, new electrical and electronic equipment put on the market does not contain lead, mercury, cadmium, hexavalent chromium, polybrominated biphenyls (PBB) or polybrominated diphenyl ethers (PBDE).»
- ^ «Mercury compounds in European Union». EIA Track. 2007. Archived from the original on 28 April 2008. Retrieved 30 May 2008.
- ^ Jones H. (10 July 2007). «EU bans mercury in barometers, thermometers». Reuters. Archived from the original on 3 January 2009. Retrieved 12 September 2017.
- ^ «Norway to ban mercury». EU Business. 21 December 2007. Archived from the original on 21 January 2008. Retrieved 30 May 2008.
- ^ Berg, T; Fjeld, E; Steinnes, E (2006). «Atmospheric mercury in Norway: contributions from different sources». The Science of the Total Environment. 368 (1): 3–9. Bibcode:2006ScTEn.368….3B. doi:10.1016/j.scitotenv.2005.09.059. PMID 16310836.
- ^ a b Edlich, Richard F; Rhoads, Samantha K.; Cantrell, Holly S.; Azavedo, Sabrina M.; Newkirk, Anthony T. «Banning Mercury Amalgam in the United States» (PDF). USA: Food and Drug Administration. Archived from the original (PDF) on 1 November 2013.
- ^ «Sweden to ban mercury — The Local». 14 January 2009. Archived from the original on 28 August 2016. Retrieved 22 November 2016.
{{cite web}}: CS1 maint: bot: original URL status unknown (link) - ^ «Sweden may be forced to lift ban on mercury — The Local». 21 April 2012. Archived from the original on 28 August 2016. Retrieved 22 November 2016.
{{cite web}}: CS1 maint: bot: original URL status unknown (link)
Further reading
- Johnston, Andrew Scott (15 September 2013). Mercury and the Making of California: Mining, Landscape, and Race, 1840–1890. TotalBoox, TBX. University Press of Colorado. ISBN 9781457183997. OCLC 969039240.
External links
Look up mercury in Wiktionary, the free dictionary.
- Chemistry in its element podcast (MP3) from the Royal Society of Chemistry’s Chemistry World: Mercury
- Mercury at The Periodic Table of Videos (University of Nottingham)
- Centers for Disease Control and Prevention – Mercury Topic
- EPA fish consumption guidelines
- Hg 80 Mercury
- Material Safety Data Sheet – Mercury
- Stopping Pollution: Mercury – Oceana
- Natural Resources Defense Council (NRDC): Mercury Contamination in Fish guide – NRDC
- NLM Hazardous Substances Databank – Mercury
- BBC – Earth News – Mercury «turns» wetland birds such as ibises homosexual
- Changing Patterns in the Use, Recycling, and Material Substitution of Mercury in the United States United States Geological Survey
- Thermodynamical data on liquid mercury.
- «Mercury (element)» . Encyclopædia Britannica (11th ed.). 1911.
Оглавление
- 1 Введение
- 2 История
- 3 Химические свойства
- 4 Физические свойства
- 5 Получение
- 6 Нахождение в природе
- 7 Применение ртути и её соединений
- 7.1 Медицина
- 7.2 Техника
- 7.3 Металлургия
- 7.4 Химическая промышленность
- 7.5 Сельское хозяйство
- 8 Заключение
- 8.1 Запрет использования ртутьсодержащей продукции
- 8.2 Демеркуризация
- 8.3 Гигиеническое нормирование концентраций ртути
- 9 Список источников
Оглавление
- 1 Введение
- 2 История
- 3 Химические свойства
- 4 Физические свойства
- 5 Получение
- 6 Нахождение в природе
- 7 Применение ртути и её соединений
- 7.1 Медицина
- 7.2 Техника
- 7.3 Металлургия
- 7.4 Химическая промышленность
- 7.5 Сельское хозяйство
- 8 Заключение
- 8.1 Запрет использования ртутьсодержащей продукции
- 8.2 Демеркуризация
- 8.3 Гигиеническое нормирование концентраций ртути
- 9 Список источников
Введение
Ртуть (Hg, от лат. Hydrargyrum) – элемент шестого периода
периодической системы химических элементов Д. И. Менделеева с атомным номером
80, относящийся к подгруппе цинка (побочной подгруппе II группы). Простое вещество ртуть –
переходный металл, при комнатной температуре представляющий собой тяжёлую
серебристо-белую жидкость, пары которой чрезвычайно ядовиты. Ртуть – один из
двух химических элементов (и единственный металл), простые вещества которых при
нормальных условиях находятся в жидком агрегатном состоянии (второй такой
элемент – бром).
История
Ртуть известна с древних времен. Нередко её находили в самородном
виде (жидкие капли на горных породах), но чаще получали обжигом природной
киновари. Древние греки и римляне использовали ртуть для очистки золота
(амальгамирование), знали о токсичности самой ртути и её соединений, в частности
сулемы. Много веков алхимики считали ртуть главной составной частью всех
металлов и полагали, что если жидкой ртути возвратить твердость при помощи серы
или мышьяка, то получится золото. Выделение ртути в чистом виде было описано
шведским химиком Георгом Брандтом в 1735 г. Для представления элемента как у
алхимиков, так и в нынешнее время используется символ планеты Меркурий. Но
принадлежность ртути к металлам была доказана только трудами Ломоносова и
Брауна, которые в декабре 1759 года смогли заморозить ртуть и установить её
металлические свойства: ковкость, электропроводность и др.
Ртуть – вещество первого класса опасности. Является переходным металлом,
представляющим собой серебристо-белую жидкость с тяжелой массой, пары которой
очень ядовиты (в условиях привычной температуры жилых помещений).
Ртуть Hg,
химический элемент II
группы периодичной системы, атомное число 80, атомная масса 200,59. Природная
ртуть состоит из семи стабильных изотопов: 196Hg (0,146%), 198Hg (10,02%), 199Hg (16,84%), 200Hg (23,13%), 201Hg (13,22%), 202Hg (29,80%), 204Hg (6,85%). Поперечное сечение захвата
тепловых нейтронов для природной смеси изотопов 38·10-27м2. Конфигурация
внешних электронных оболочек атома 5s25p65d106s2; степень окисления + 1 и + 2; энергии
ионизации Hg0:Hg+:Hg2+:Hg3+ соответственно 10,4376, 18,756 и 34,2 эВ;
сродство к электрону – 0,19 эВ; работа выхода электрона 4,52 эВ; электроотрицательность
по Полингу 1,9; атомный радиус 0,155 нм, ковалентный радиус 0,149 нм, ионный
радиус (в скобках указано координационное число) Hg+ 0,111 нм (3), 0,133 нм (6), Hg2+ 0,083 нм (2), 0,110 нм (4), 0,116 нм (6),
0,128нм (8).
Химические свойства
Для ртути характерны две степени
окисления: +1 и +2. В степени окисления +1 ртуть представляет собой
двухъядерный катион Hg22+ со
связью металл-металл. Ртуть – один из немногих металлов, способных формировать
такие катионы, и у ртути они – самые устойчивые.
В степени окисления +1 ртуть склонна к диспропорционированию.
Оно протекает при нагревании и подщелачивании.
добавлении лигандов, стабилизирующих степень окисления ртути +2.
Из-за диспропорционирования и гидролиза гидроксид ртути (I) получить не удаётся.
На холоде ртуть +2
и металлическая ртуть, наоборот, сопропорционируют. Поэтому, в частности, при
реакции нитрата ртути (II) со ртутью получается нитрат ртути (I).
В степени окисления +2 ртуть образует катионы Hg2+, которые очень легко
гидролизуются. При этом гидроксид ртути Hg(OH)2
существует только в очень разбавленных (<10−4моль/л) растворах. В
более концентрированных растворах он дегидратируется
В очень концентрированной щелочи оксид ртути частично растворяется с
образованием гидроксокомплекса
Ртуть в степени окисления +2 образует уникально прочные комплексы со
многими лигандами, причём как жёсткими, так и мягкими по теории ЖМКО. С йодом
(-1), серой (-2) и углеродом она образует очень прочные ковалентные связи. По
устойчивости связей металл-углерод ртути нет равных среди других металлов,
поэтому получено огромное количество ртутьорганических соединений.
Из элементов IIБ
группы именно у ртути появляется возможность разрушения очень устойчивой 6d10 – электронной
оболочки, что приводит к возможности существования соединений ртути(IV), но они крайне
малоустойчивы, поэтому эту степень окисления скорее можно отнести к курьёзной,
чем к характерной. В частности, при взаимодействии атомов ртути и смеси неона и
фтора при температуре 4К получен HgF4.
Физические свойства
Ртуть – единственный металл, который находится в жидком состоянии при комнатной температуре. Температура плавления составляет 234,32 K (-38,83 °C),кипит при 629,88 K (356,73 °C), критическая точка –1750 K (1477 °C), 152 МПа (1500 атм). Обладает свойствами диамагнетика. Образует со многими металлами жидкие и твёрдые сплавы – амальгамы. Стойкие к амальгамированию металлы: V, Fe, Mo, Cs, Nb, Ta, W, Co .
Плотность ртути при
нормальных условиях – 13 500 кг/м3.
Таблица
1 – Зависимость плотности от температуры
|
Температура в °С |
ρ, 103 кг/м3 |
Температура в °С |
ρ, 103 кг/м3 |
|
0 |
13,5951 |
50 |
13,4723 |
|
5 |
13,5827 |
55 |
13,4601 |
|
10 |
13,5704 |
60 |
13,4480 |
|
15 |
13,5580 |
65 |
13,4358 |
|
20 |
13,5457 |
70 |
13,4237 |
|
25 |
13,5335 |
75 |
13,4116 |
|
30 |
13,5212 |
80 |
13,3995 |
|
35 |
13,5090 |
90 |
13,3753 |
|
40 |
13,4967 |
100 |
13,3514 |
|
45 |
13,4845 |
300 |
12,875 |
Простое вещество ртуть (CAS-номер: 7439-97-6) – переходный металл, при комнатной
температуре представляет собой тяжёлую серебристо-белую жидкость, пары которой
чрезвычайно ядовиты. Ртуть – один из двух химических элементов (и единственный
металл), простые вещества которых при нормальных условиях находятся в жидком
агрегатном состоянии (второй элемент – бром).
Получение
Ртуть
получают путём восстановления из её наиболее распространённого минерала –
киновари.
Пары ртути конденсируют и собирают. Этот способ применяли ещё алхимики
древности.
На протяжении многих столетий в Европе основным и единственным
месторождением ртути был Альмаден в Испании. В Новое время с ним стала
конкурировать Идрия вовладениях Габсбургов (современная Словения). Там же
появилась первая лечебница для поражённых отравлением парами ртути рудокопов. В
2012 г. ЮНЕСКО объявило промышленную инфраструктуру Альмдена и Идрии памятником
Всемирного наследия человечества.
В надписях во дворце древнеперсидских царей Ахеменидов (VI–IV века до н. э.) в Сузах упоминается,
что ртутную киноварь доставляли сюда с Зеравшанских гор и использовали в
качестве краски.
Нахождение в природе
Ртуть – относительно редкий элемент в земной коре со средней концентрацией
83 мг/т. Однако ввиду того, что ртуть слабо связывается химически с наиболее
распространёнными в земной коре элементами, ртутные руды могут быть очень
концентрированными по сравнению с обычными породами. Наиболее богатые ртутью
руды содержат до 2,5 % ртути. Основная форма нахождения ртути в природе – рассеянная,
и только 0,02 % её заключено в месторождениях. Содержание ртути в различных
типах изверженных пород близки между собой (около 100 мг/т). Из осадочных пород
максимальные концентрации ртути установлены в глинистых сланцах (до 200 мг/т).
В водах Мирового океана содержание ртути – 0,1 мкг/л. Важнейшей геохимической
особенностью ртути является то, что среди других халькофильных элементов она
обладает самым высоким потенциалом ионизации. Это определяет такие свойства
ртути, как способность восстанавливаться до атомарной формы (самородной ртути),
значительную химическую стойкость к кислороду и кислотам.
Ртуть присутствует в большинстве сульфидных минералов. Особенно
высокие её содержания (до тысячных и сотых долей процента) устанавливаются в
блёклых рудах, антимонитах, сфалеритах и реальгарах. Близость ионных радиусов
двухвалентной ртути и кальция, одновалентной ртути и бария определяет их
изоморфизм во флюоритах и баритах. В киновари и метациннабарите сера иногда
замещается селеном или теллуром; содержание селена часто составляет сотые и
десятые доли процента. Известны крайне редкие селениды ртути – тиманит (HgSe) и онофрит (смесь
тиманита и сфалерита).
Ртуть является одним из наиболее чувствительных индикаторов скрытого
оруденения не только ртутных, но и различных сульфидных месторождений, поэтому
ореолы ртути обычно выявляются над всеми скрытыми сульфидными залежами и вдоль
дорудных разрывных нарушений. Эта особенность, а также незначительное
содержание ртути в породах, объясняются высокой упругостью паров ртути,
возрастающей с увеличением температуры и определяющей высокую миграцию этого
элемента в газовой фазе.
В поверхностных условиях киноварь и металлическая ртуть не растворимы
в воде, но при их наличии (Fe2(SO4)3,
озон, пероксид водорода) растворимость этих минералов достигает десятков мг/л.
Особенно хорошо растворяется ртуть в сульфидах едких щелочей с образованием,
например, комплекса HgS•nNa2S. Ртуть легко сорбируется
глинами, гидроокислами железа и марганца, глинистыми сланцами и углями.
В природе известно около 20 минералов ртути, но главное промышленное
значение имеет киноварь HgS
(86,2 % Hg). В редких
случаях предметом добычи является самородная ртуть, метациннабарит HgS и блёклая руда – шватцит
(до 17 % Hg). На
единственном месторождении Гуитцуко (Мексика) главным рудным минералом является
ливингстонит HgSb4S7. В зоне
окисления ртутных месторождений образуются вторичные минералы ртути. К ним относятся,
прежде всего, самородная ртуть, реже метациннабарит, отличающиеся от таких же
первичных минералов большей чистотой состава. Относительно распространена
каломель Hg2Cl2. На
месторождении Терлингуа (Техас) распространены и другие гипергенные галоидные
соединения – терлингуаит Hg2ClO, эглестонит Hg4Cl.
Применение ртути и её соединений
Медицина
В связи с высокой токсичностью ртуть почти полностью вытеснена из
медицинских препаратов. Её соединения (в частности, мертиолят) иногда используются
в малых количествах как консервант для вакцин. Сама ртуть сохраняется в ртутных
медицинских термометрах (один медицинский термометр содержит до 2 г ртути).
Однако вплоть до
1970-х годов соединения ртути использовались в медицине очень активно:
●
хлорид ртути (I) (каломель) – слабительное;
●
меркузал и промеран – сильные
мочегонные;
●
хлорид ртути (II), цианид ртути (II), амидохлорид ртути и жёлтый оксид
ртути(II) –
антисептики (в том числе в составе мазей).
Известны случаи, когда при завороте кишок больному вливали в желудок
стакан ртути. По мнению древних врачевателей, предлагавших такой метод лечения,
ртуть благодаря своей тяжести и подвижности должна была пройти по кишечнику и
под своим весом расправить его перекрутившиеся части.
Амальгаму серебра применяли в стоматологии в качестве материала
зубных пломб до появления светоотверждаемых материалов.
Ртуть-203 (T1/2 = 53
сек) используется в радиофармакологии.
Техника
●
Ртуть используется как рабочее тело
в ртутных термометрах (особенно высокоточных), так как (а) обладает довольно
широким диапазоном, в котором находится в жидком состоянии, (б) её коэффициент
термического расширения почти не зависит от температуры и (в) обладает
сравнительно малой теплоёмкостью. Сплав ртути с таллием используется для
низкотемпературных термометров.
●
Парами ртути заполняют
люминесцентные лампы, поскольку пары светятся в тлеющем разряде. В спектре
испускания паров ртути много ультрафиолетового света и, чтобы преобразовать его
в видимый, стекло люминесцентных ламп изнутри покрывают люминофором. Без люминофора
ртутные лампы являются источником жесткого ультрафиолета (254 нм), в каковом
качестве и используются. Такие лампы делают из кварцевого стекла, пропускающего
ультрафиолет, поэтому они называются кварцевыми.
●
Ртутные электрические вентили
(игнитроны) в мощных выпрямительных устройствах, электроприводах,
электросварочных устройствах, тяговых и выпрямительных подстанциях и т. п.[18] со
средней силой тока в сотни ампер и выпрямленным напряжением до 5 кВ.
●
Ртуть и сплавы на её основе
используются в герметичных выключателях, включающихся при определённом
положении.
●
Ртуть используется в датчиках положения.
●
В некоторых химических источниках
тока (например, ртутно-цинковых), в эталонных источниках напряжения (Нормальный
элемент Вестона).
●
Ртуть также иногда применяется в
качестве рабочего тела в тяжелонагруженных гидродинамических подшипниках.
●
Ртуть ранее входила в состав
некоторых биоцидных красок для предотвращения обрастания корпуса судов в
морской воде. Сейчас запрещается использовать такого типа покрытия.
●
Иодид ртути(I) используется как полупроводниковый
детектор радиоактивного излучения.
●
Фульминат ртути(II) («гремучая ртуть») издавна
применяется в качестве инициирующего ВВ (Детонаторы).
●
Бромид ртути(I) применяется при термохимическом
разложении воды на водород и кислород (атомно-водородная энергетика).
●
Перспективно использование ртути в
сплавах с цезием в качестве высокоэффективного рабочего тела в ионных
двигателях.
●
До середины 20 века ртуть широко
применялась в барометрах и манометрах.
●
Ртутные вакуумные насосы были
основными источниками вакуума в 19 и начале 20 веков.
●
Ранее ртуть использовали для
золочения поверхностей методом амальгамирования, однако в настоящее время от
этого метода отказались из-за токсичности ртути.
●
Соединения ртути использовались в
шляпном производстве для выделки фетра.
Металлургия
●
Металлическая ртуть применяется для
получения целого ряда важнейших сплавов.
●
Ранее различные амальгамы металлов,
особенно золота и серебра, широко использовались в ювелирном деле, в
производстве зеркал.
●
Металлическая ртуть служит катодом
для электролитического получения ряда активных металлов, хлора и щелочей. Сейчас
вместо ртутных катодов используют электролиз с диафрагмой.
●
Ртуть используется для переработки
вторичного алюминия (см. амальгамация)
●
Ртуть хорошо смачивает золото,
поэтому ей обрабатывают золотоносные глины для выделения из них этого металла. Эта
технология распространена, в частности, в Амазонии.
Химическая
промышленность
●
Соли ртути использовали в качестве
катализатора промышленного получения ацетальдегида из ацетилена (реакция
Кучерова), однако в настоящее время ацетальдегид получают прямым каталитическим
окислением этана или этена.
●
Реактив Несслера используется для
количественного определения аммиака.
Сельское хозяйство
Высокотоксичные соединения ртути – каломель, сулему, мертиолят и
другие – используют для протравливания семенного зерна и в качестве пестицидов.
Заключение
Запрет использования ртутьсодержащей продукции
С 2020 года международная
конвенция, названная в честь массового отравления ртутью и подписанная многими
странами, запретит производство, экспорт и импорт нескольких различных видов
ртутьсодержащих продукции применяемой в быту, в том числе электрических
батарей, электрических выключателей и реле, некоторых видов компактных
люминесцентных ламп (КЛЛ), люминесцентных ламп с холодным катодом или с внешним
электродом, ртутных термометров и приборов измерения давлении. Конвенция вводит
регулирование использования ртути и ограничивает ряд промышленных процессов и
отраслей, в том числе горнодобывающую (особенно непромышленную добычу золота),
производство цемента.
Демеркуризация
Очистка помещений и предметов от загрязнений металлической
ртутью и источников ртутных паров называется демеркуризацией. В быту широко
применяется демеркуризация с помощью серы и хлорного железа FeCl3.
Гигиеническое нормирование концентраций ртути
Предельно допустимые уровни загрязнённости металлической ртутью
и её парами:
●
ПДК в населённых пунктах
(среднесуточная) – 0,0003 мг/м³
●
ПДК в жилых помещениях
(среднесуточная) – 0,0003 мг/м³
●
ПДК воздуха в рабочей зоне (макс.
разовая) – 0,01 мг/м³
●
ПДК воздуха в рабочей зоне
(среднесменная) – 0,005 мг/м³
●
ПДК сточных вод (для неорганических
соединений в пересчёте на двухвалентную ртуть) – 0,005 мг/л
●
ПДК водных объектов
хозяйственно-питьевого и культурного водопользования, в воде водоёмов – 0,0005
мг/л
●
ПДК морских водоёмов – 0,0001 мг/л
Список источников
1.
Ртуть //Материал из Википедии – свободной энциклопедии.
2.
Ртуть // химик.
3.
Ртуть //Глоссарий. Химия.
|
|
|
| Название, символ, номер | Ртуть / Hydrargyrum (Hg), 80 |
|---|---|
| Атомная масса (молярная масса) |
200,592(3) а. е. м. (г/моль) |
| Электронная конфигурация | [Xe] 4f14 5d10 6s2 |
| Радиус атома | 157 пм |
| Ковалентный радиус | 149 пм |
| Радиус иона | (+2e) 110 (+1e) 127 пм |
| Электроотрицательность | 2,00 (шкала Полинга) |
| Электродный потенциал | Hg←Hg2+ 0,854 В |
| Степени окисления | +2, +1 |
| Энергия ионизации (первый электрон) |
1 006,0 (10,43) кДж/моль (эВ) |
| Плотность (при н. у.) | 13,546 (20 °C) г/см³ |
| Температура плавления | 234,32 K (-38,83 °C) |
| Температура кипения | 629,88 K (356,73 °C) |
| Уд. теплота плавления | 2,295 кДж/моль |
| Уд. теплота испарения | 58,5 кДж/моль |
| Молярная теплоёмкость | 27,98 Дж/(K·моль) |
| Молярный объём | 14,81 см³/моль |
| Структура решётки | ромбоэдрическая |
| Параметры решётки | ahex=3,464 сhex=6,708 Å |
| Отношение c/a | 1,94 |
| Температура Дебая | 100,00 K |
| Теплопроводность | (300 K) 8,3 Вт/(м·К) |
| Номер CAS | 7439-97-6 |
Содержание
- 1 История
- 1.1 Происхождение названия
- 2 Нахождение в природе
- 2.1 Месторождения
- 3 В окружающей среде
- 4 Изотопы
- 5 Получение
- 6 Физические свойства
- 7 Химические свойства
- 7.1 Характерные степени окисления
- 7.2 Свойства металлической ртути
- 8 Применение ртути и её соединений
- 8.1 Медицина
- 8.2 Техника
- 8.3 Металлургия
- 8.4 Химическая промышленность
- 8.5 Сельское хозяйство
- 9 Токсикология ртути
- 9.1 Гигиеническое нормирование концентраций ртути
- 9.2 Демеркуризация
- 9.3 Запрет использования содержащей ртуть продукции
История
Астрономический символ планеты Меркурий
Ртуть известна с древних времён. Нередко её находили в самородном виде (жидкие капли на горных породах), но чаще получали обжигом природной киновари. Древние греки и римляне использовали ртуть для очистки золота (амальгамирование), знали о токсичности самой ртути и её соединений, в частности сулемы. Много веков алхимики считали ртуть главной составной частью всех металлов и полагали, что если жидкой ртути возвратить твёрдость при помощи серы или мышьяка, то получится золото. Выделение ртути в чистом виде было описано шведским химиком Георгом Брандтом в 1735 году. Для представления элемента как у алхимиков, так и в настоящее время используется символ планеты Меркурий. Но принадлежность ртути к металлам была доказана только трудами Ломоносова и Брауна, которые в декабре 1759 года смогли заморозить ртуть и установить её металлические свойства в твёрдом состоянии: ковкость, электропроводность и др.
Происхождение названия
Русское название ртути происходит от праслав. *rьtǫtь, связанного с лит. rìsti «катиться». Символ Hg заимствован от латинского алхимического названия этого элемента hydrargyrum (от др.-греч. ὕδωρ «вода» и ἄργυρος «серебро»).
Нахождение в природе
Ртуть — относительно редкий элемент в земной коре со средней концентрацией 83 мг/т. Однако ввиду того, что ртуть слабо связывается химически с наиболее распространёнными в земной коре элементами, ртутные руды могут быть очень концентрированными по сравнению с обычными породами. Наиболее богатые ртутью руды содержат до 2,5 % ртути. Основная форма нахождения ртути в природе — рассеянная, и только 0,02 % её заключено в месторождениях. Содержание ртути в различных типах изверженных пород близки между собой (около 100 мг/т). Из осадочных пород максимальные концентрации ртути установлены в глинистых сланцах (до 200 мг/т). В водах Мирового океана содержание ртути — 0,1 мкг/л. Важнейшей геохимической особенностью ртути является то, что среди других халькофильных элементов она обладает самым высоким потенциалом ионизации. Это определяет такие свойства ртути, как способность восстанавливаться до атомарной формы (самородной ртути), значительную химическую стойкость к кислороду и кислотам.
Ртуть присутствует в большинстве сульфидных минералов. Особенно высокие её содержания (до тысячных и сотых долей процента) устанавливаются в блёклых рудах, антимонитах, сфалеритах и реальгарах. Близость ионных радиусов двухвалентной ртути и кальция, одновалентной ртути и бария определяет их изоморфизм во флюоритах и баритах. В киновари и метациннабарите сера иногда замещается селеном или теллуром; содержание селена часто составляет сотые и десятые доли процента. Известны крайне редкие селениды ртути — тиманит (HgSe) и онофрит (смесь тиманита и сфалерита).
Ртуть является одним из наиболее чувствительных индикаторов скрытого оруденения не только ртутных, но и различных сульфидных месторождений, поэтому ореолы ртути обычно выявляются над всеми скрытыми сульфидными залежами и вдоль дорудных разрывных нарушений. Эта особенность, а также незначительное содержание ртути в породах, объясняются высокой упругостью паров ртути, возрастающей с увеличением температуры и определяющей высокую миграцию этого элемента в газовой фазе.
В обычных условиях киноварь и металлическая ртуть не растворимы в воде, но в присутствии некоторых веществ (Fe2(SO4)3, озон, пероксид водорода) растворимость в воде этих минералов достигает десятков мг/л. Особенно хорошо растворяется ртуть в сульфидах щелочных металлов с образованием, например, комплекса HgS•nNa2S. Ртуть легко сорбируется глинами, гидроксидами железа и марганца, глинистыми сланцами и углями.
В природе известно около 20 минералов ртути, но главное промышленное значение имеет киноварь HgS (86,2 % Hg). В редких случаях предметом добычи является самородная ртуть, метациннабарит HgS и блёклая руда — шватцит (до 17 % Hg). На единственном месторождении Гуитцуко (Мексика) главным рудным минералом является ливингстонит HgSb4S7. В зоне окисления ртутных месторождений образуются вторичные минералы ртути. К ним относятся, прежде всего, самородная ртуть, реже метациннабарит, отличающиеся от таких же первичных минералов большей чистотой состава. Относительно распространена каломель Hg2Cl2. На месторождении Терлингуа (Техас) распространены и другие гипергенные галоидные соединения — терлингуаит Hg2ClO, эглестонит Hg4Cl.
Месторождения
Ртуть считается редким металлом.
Одно из крупнейших в мире ртутных месторождений находится в Испании (Альмаден). Известны месторождения ртути на Кавказе (Дагестан, Армения), в Таджикистане, Словении, Киргизии (Хайдаркан — Айдаркен), Донбассе (Горловка, Никитовский ртутный комбинат).
В России находятся 23 месторождения ртути, промышленные запасы составляют 15,6 тыс. тонн (на 2002 год), из них крупнейшие разведаны на Чукотке — Западно-Палянское и Тамватнейское.
В окружающей среде
Содержание ртути в ледниках за 270 лет
До индустриальной революции осаждение ртути из атмосферы составляло около 4 нанограммов на 1 кубический дециметр льда. Природные источники, такие, как вулканы, составляют примерно половину всех выбросов атмосферной ртути. Причиной появления остальной половины является деятельность человека. В ней основную долю составляют выбросы в результате сгорания угля (главным образом в тепловых электростанциях) — 65 %, добыча золота — 11 %, выплавка цветных металлов — 6,8 %, производство цемента — 6,4 %, утилизация мусора — 3 %, производство соды — 3 %, чугуна и стали — 1,4 %, ртути (в основном для батареек) — 1,1 %, остальное — 2 %.
Одно из тяжелейших загрязнений ртутью в истории случилось в японском городе Минамата в 1956 году, что привело к более чем трём тысячам жертв, которые либо умерли, либо сильно пострадали от болезни Минамата.
Изотопы
Основная статья: Изотопы ртути
Природная ртуть состоит из смеси 7 стабильных изотопов: 196Hg (распространённость 0,155 %), 198Hg (10,04 %), 199Hg (16,94 %), 200Hg (23,14 %), 201Hg (13,17 %), 202Hg (29,74 %), 204Hg (6,82 %). Искусственным путём получены радиоактивные изотопы ртути с массовыми числами 171—210.
Получение
Ртуть получают обжигом киновари (сульфида ртути II) или металлотермическим методом:
- HgS + O2 ⟶ Hg + SO2↑
- HgS + Fe ⟶ FeS↓ + Hg
Пары ртути конденсируют и собирают. Этот способ применяли ещё алхимики древности.
На протяжении многих столетий в Европе основным и единственным месторождением ртути был Альмаден в Испании. В Новое время с ним стала конкурировать Идрия во владениях Габсбургов (современная Словения). Там же появилась первая лечебница для поражённых отравлением парами ртути рудокопов. В 2012 г. ЮНЕСКО объявило промышленную инфраструктуру Альмадена и Идрии памятником Всемирного наследия человечества.
В надписях во дворце древнеперсидских царей Ахеменидов (VI—IV века до н. э.) в Сузах упоминается, что ртутную киноварь доставляли сюда с Зеравшанских гор и использовали в качестве краски.
Физические свойства
100 граммовая гирька, не тонет в металлическая ртути, из-за разницы по плотности
Переливание ртути из сосуда в сосуд
Ртуть — единственный металл, который находится в жидком состоянии при комнатной температуре. Температура плавления составляет 234,32 K (-38,83 °C), кипит при 629,88 K (356,73 °C), критическая точка — 1750 K (1477 °C), 152 МПа (1500 атм). Обладает свойствами диамагнетика. Образует со многими металлами жидкие и твёрдые сплавы — амальгамы. Стойкие к амальгамированию металлы: V, Fe, Mo, Cs, Nb, Ta, W, Co.
Плотность ртути при нормальных условиях — 13 546 кг/м3, при других температурах — в таблице:
| Температура в °С | Плотность (ρ), 103 кг/м3 | Температура в °С | Плотность (ρ), 103 кг/м3 |
| 0 | 13,5950 | 50 | 13,4725 |
| 5 | 13,5827 | 55 | 13,4601 |
| 10 | 13,5704 | 60 | 13,4480 |
| 15 | 13,5580 | 65 | 13,4358 |
| 20 | 13,5457 | 70 | 13,4237 |
| 25 | 13,5335 | 75 | 13,4116 |
| 30 | 13,5212 | 80 | 13,3995 |
| 35 | 13,5090 | 90 | 13,3753 |
| 40 | 13,4967 | 100 | 13,3514 |
| 45 | 13,4845 | 300 | 12,875 |
Химические свойства
Характерные степени окисления
| Степень окисления | Оксид | Гидроксид | Характер | Примечания |
|---|---|---|---|---|
| +1 | Hg2O | <Hg2(OH)2или
Hg2O•H2O>* |
Слабоосновный | Склонность к диспропорционированию |
| +2 | HgO | <Hg(OH)2>** | Очень слабое основание, иногда — амфотерный |
- *Гидроксид не получен, существуют только соответствующие соли.
- **Гидроксид существует только в очень разбавленных (<10−4моль/л) растворах.
Диаграмма Пурбе системы Hg-HgO
Для ртути характерны две степени окисления: +1 и +2. В степени окисления +1 ртуть представляет собой двухъядерный катион Hg22+ со связью металл-металл. Ртуть — один из немногих металлов, способных формировать такие катионы, и у ртути они — самые устойчивые.
В степени окисления +1 ртуть склонна к диспропорционированию. Оно протекает при нагревании:
-
- Hg22+ → Hg + Hg2+
подщелачивании:
-
- Hg22+ + 2OH− → Hg + HgO + H2O
добавлении лигандов, стабилизирующих степень окисления ртути +2.
Из-за диспропорционирования и гидролиза гидроксид ртути (I) получить не удаётся.
На холоде ртуть +2 и металлическая ртуть, наоборот, сопропорционируют. Поэтому, в частности, при реакции нитрата ртути (II) со ртутью получается нитрат ртути (I):
-
- Hg + Hg(NO3)2 → Hg2(NO3)2
В степени окисления +2 ртуть образует катионы Hg2+, которые очень легко гидролизуются. При этом гидроксид ртути Hg(OH)2 существует только в очень разбавленных (<10−4моль/л) растворах. В более концентрированных растворах он дегидратируется:
-
- Hg2+ + 2OH− → HgO + H2O
В очень концентрированной щёлочи оксид ртути частично растворяется с образованием гидроксокомплекса:
-
- HgO + OH− + H2O → [Hg(OH)3]−
Ртуть в степени окисления +2 образует уникально прочные комплексы со многими лигандами, причём как жёсткими, так и мягкими по теории ЖМКО. С йодом (-1), серой (-2) и углеродом она образует очень прочные ковалентные связи. По устойчивости связей металл-углерод ртути нет равных среди других металлов, поэтому получено огромное количество ртутьорганических соединений.
Из элементов IIБ группы именно у ртути появляется возможность разрушения очень устойчивой 6d10 — электронной оболочки, что приводит к возможности существования соединений ртути IV, но они крайне малоустойчивы, поэтому эту степень окисления скорее можно отнести к курьёзной, чем к характерной. В частности, при взаимодействии атомов ртути и смеси неона и фтора при температуре 4 К получен HgF4. Однако более новые исследования не подтвердили его существование.
Свойства металлической ртути
Ртуть — малоактивный металл. Она не растворяется в растворах кислот, не обладающих окислительными свойствами, но растворяется в царской водке с образованием тетрахлорортутной кислоты:
-
- 3Hg + 2HNO3 + 12HCl → 3H2[HgCl4] + 2NO↑ + 4H2O
и азотной кислоте:
-
- Hg + 4HNO3 → Hg(NO3)2 + 2NO2↑ + 2H2O
Также с трудом растворяется в серной кислоте при нагревании, с образованием сульфата ртути:
-
- Hg + 2H2SO4 → HgSO4 + SO2↑ + 2H2O
При растворении избытка ртути в азотной кислоте на холоде образуется нитрат диртути Hg2(NO3)2.
При нагревании до 300 °C ртуть вступает в реакцию с кислородом:
-
- 2Hg + O2 →300∘C 2HgO
При этом образуется оксид ртути II красного цвета. Эта реакция обратима: при нагревании выше 340 °C оксид разлагается до простых веществ.
-
- 2HgO →>340∘C 2Hg + O2↑
Реакция разложения оксида ртути исторически является одним из первых способов получения кислорода.
При нагревании ртути с серой образуется сульфид ртути II:
-
- Hg + S →t∘C HgS
Ртуть также реагирует с галогенами (причём на холоде — медленно).
Ртуть можно окислить также щелочным раствором перманганата калия:
-
- Hg + 2KMnO4 + 3KOH → K[Hg(OH)3] + 2K2MnO4
и различными хлорсодержащими отбеливателями. Эти реакции используют для удаления металлической ртути.
Словенский город Идрия — крупнейший в Европе центр добычи ртути с XV века
Применение ртути и её соединений
Медицина
В связи с высокой токсичностью ртуть почти полностью вытеснена из медицинских препаратов. Её соединения (в частности, мертиолят) иногда используются в малых количествах как консервант для вакцин. Сама ртуть сохраняется в ртутных медицинских термометрах (один медицинский термометр содержит до 2 г ртути).
Однако вплоть до 1970-х годов соединения ртути использовались в медицине очень активно:
- хлорид ртути I (каломель) — слабительное;
- меркузал и промеран — сильные мочегонные;
- хлорид ртути II, цианид ртути II , амидохлорид ртути и жёлтый оксид ртути II — антисептики (в том числе в составе мазей).
Известны случаи, когда при завороте кишок больному вливали в желудок стакан ртути. По мнению древних врачевателей, предлагавших такой метод лечения, ртуть благодаря своей тяжести и подвижности должна была пройти по кишечнику и под своим весом расправить его перекрутившиеся части.
Планета Меркурий (проявление ртути) в виде врача с лекарством. Миниатюра XV в.
Препараты ртути применяли с XVI в. (в СССР вплоть до 1963 года) для лечения сифилиса. Это было обусловлено тем, что бледная трепонема, вызывающая сифилис, обладает высокой чувствительностью к органическим и неорганическим соединениям, блокирующим сульфгидрильные группы тиоловых ферментов микроба — соединениям ртути, мышьяка, висмута и йода. Однако такое лечение было недостаточно эффективно и весьма токсично для организма больного, приводя к полному выпадению волос и высокому риску развития серьезных осложнений; причем возможности повышения дозы препаратов ртути или мышьяка при недостаточной противосифилитической активности стандартных доз ограничивались именно токсичностью для организма больного. Также применялись методики общей меркуризации организма, при которой больной помещался в нагревающуюся емкость, куда подавались пары ртути. Данная методика, хотя и была относительно эффективна, но побочные эффекты и риск смертельного отравления ртутью привел к постепенному вытеснению её из клинической практики.
Амальгаму серебра применяли в стоматологии в качестве материала зубных пломб до появления светоотверждаемых материалов.
Ртуть-203 (T1/2 = 53 сек) используется в радиофармакологии.
Техника
- Ртуть используется как рабочее тело в ртутных термометрах (особенно высокоточных), так как (а) обладает довольно широким диапазоном, в котором находится в жидком состоянии, (б) её коэффициент термического расширения почти не зависит от температуры и (в) обладает сравнительно малой теплоёмкостью. Сплав ртути с таллием используется для низкотемпературных термометров.
- Парами ртути заполняют люминесцентные лампы, поскольку пары светятся в тлеющем разряде. В спектре испускания паров ртути много ультрафиолетового света и, чтобы преобразовать его в видимый, стекло люминесцентных ламп изнутри покрывают люминофором. Без люминофора ртутные лампы являются источником жёсткого ультрафиолета (254 нм), в каковом качестве и используются для обеззараживания помещений. Такие лампы делают из кварцевого стекла, пропускающего ультрафиолет, поэтому они называются кварцевыми.
- Ртутные электрические вентили (игнитроны) в мощных выпрямительных устройствах, электроприводах, электросварочных устройствах, тяговых и выпрямительных подстанциях и т. п. со средней силой тока в сотни ампер и выпрямленным напряжением до 5 кВ.
- Ртуть и сплавы на её основе используются в герметичных выключателях, включающихся при определённом положении.
- Ртуть используется в датчиках положения.
- В некоторых химических источниках тока (например, ртутно-цинковых), в эталонных источниках напряжения (Нормальный элемент Вестона).
- Ртуть также иногда применяется в качестве рабочего тела в тяжелонагруженных гидродинамических подшипниках.
- Ртуть ранее входила в состав некоторых биоцидных красок для предотвращения обрастания корпуса судов в морской воде. Сейчас запрещается использовать такого типа покрытия.
- Йодид ртути I используется как полупроводниковый детектор радиоактивного излучения.
- Фульминат ртути II («гремучая ртуть») издавна применяется в качестве инициирующего ВВ (Детонаторы).
- Бромид ртути I применяется при термохимическом разложении воды на водород и кислород (атомно-водородная энергетика).
- Перспективно использование ртути в сплавах с цезием в качестве высокоэффективного рабочего тела в ионных двигателях.
- До середины XX века ртуть широко применялась в барометрах, манометрах и сфигмоманометрах (отсюда традиция измерять давление в миллиметрах ртутного столба).
- Низкое давление насыщенного пара определяет использование ртути в качестве вакуумного материала. Так, ртутные вакуумные насосы были основными источниками вакуума в XIX и начале XX веков.
- Ранее ртуть использовали для золочения поверхностей методом амальгамирования, однако в настоящее время от этого метода отказались из-за токсичности ртути.
- Соединения ртути использовались в шляпном производстве для выделки фетра.
Металлургия
- Металлическая ртуть применяется для получения целого ряда важнейших сплавов.
- Ранее различные амальгамы металлов, особенно золота и серебра, широко использовались в ювелирном деле, в производстве зеркал.
- Металлическая ртуть служит катодом для электролитического получения ряда активных металлов, хлора и щелочей. Сейчас вместо ртутных катодов используют электролиз с диафрагмой.
- Ртуть используется для переработки вторичного алюминия (см. амальгамация)
- Ртуть хорошо смачивает золото, поэтому ей обрабатывают золотоносные глины для выделения из них этого металла. Эта технология распространена, в частности, в Амазонии.
Химическая промышленность
- Соли ртути использовали в качестве катализатора промышленного получения ацетальдегида из ацетилена (реакция Кучерова), однако в настоящее время ацетальдегид получают прямым каталитическим окислением этана или этена.
- Реактив Несслера используется для количественного определения аммиака.
- При производстве хлора и едких щелочей путем электролиза иногда применяется жидкий ртутный катод.
Сельское хозяйство
Высокотоксичные соединения ртути — каломель, сулему, мертиолят и другие — используют для протравливания семенного зерна и в качестве пестицидов.
Токсикология ртути
Основная статья: Отравление ртутью
NFPA 704 для данного вещества (синее — опасность для здоровья, красное — огнеопасность, жёлтое — реакционноспособность)
Ртуть и все её соединения ядовиты. Воздействие ртути — даже в небольших количествах — может вызывать серьёзные проблемы со здоровьем и представляет угрозу для внутриутробного развития плода и развития ребёнка на ранних стадиях жизни. Ртуть может оказывать токсическое воздействие на нервную, пищеварительную и иммунную системы, а также на легкие, почки, кожу и глаза. ВОЗ рассматривает ртуть в качестве одного из десяти основных химических веществ или групп химических веществ, представляющих значительную проблему для общественного здравоохранения.
Наиболее ядовиты пары́ и растворимые соединения ртути. Сама металлическая ртуть менее опасна, однако она постепенно испаряется даже при комнатной температуре. Пары могут вызвать тяжёлое отравление. Ртуть и её соединения (сулема, каломель, киноварь, цианид ртути) поражают нервную систему, печень, почки, желудочно-кишечный тракт, при вдыхании — дыхательные пути (а проникновение ртути в организм чаще происходит именно при вдыхании её паров, не имеющих запаха). По классу опасности ртуть относится к первому классу (чрезвычайно опасное химическое вещество). Опасный загрязнитель окружающей среды, особенно опасны выбросы в воду, поскольку в результате деятельности населяющих дно микроорганизмов происходит образование растворимой в воде и токсичной метилртути, накапливающейся в рыбе. Ртуть — типичный представитель кумулятивных ядов.
Органические соединения ртути (диметилртуть и др.) в целом намного токсичнее, чем неорганические, прежде всего из-за их липофильности и способности более эффективно взаимодействовать с элементами ферментативных систем организма.
Гигиеническое нормирование концентраций ртути
Предельно допустимые уровни загрязнённости металлической ртутью и её парами:
- ПДК в населённых пунктах (среднесуточная) — 0,0003 мг/м³
- ПДК в жилых помещениях (среднесуточная) — 0,0003 мг/м³
- ПДК воздуха в рабочей зоне (макс. разовая) — 0,01 мг/м³
- ПДК воздуха в рабочей зоне (среднесменная) — 0,005 мг/м³
- ПДК сточных вод (для неорганических соединений в пересчёте на двухвалентную ртуть) — 0,005 мг/л
- ПДК водных объектов хозяйственно-питьевого и культурного водопользования, в воде водоёмов — 0,0005 мг/л
- ПДК рыбохозяйственных водоёмов — 0,00001 мг/л
- ПДК морских водоёмов — 0,0001 мг/л
Демеркуризация
Основная статья: Демеркуризация
Очистка помещений и предметов от загрязнений металлической ртутью и источников ртутных паров называется демеркуризацией. В быту широко применяется демеркуризация с помощью серы и хлорного железа FeCl3.
Запрет использования содержащей ртуть продукции
Основная статья: Минаматская конвенция о ртути
С 2020 года международная конвенция, названная в честь массового отравления ртутью и подписанная многими странами, запретит производство, экспорт и импорт нескольких различных видов ртутьсодержащих продуктов, применяемых в быту, в том числе электрических батарей, электрических выключателей и реле, некоторых видов компактных люминесцентных ламп (КЛЛ), люминесцентных ламп с холодным катодом или с внешним электродом, ртутных термометров и приборов измерения давления. Конвенция вводит регулирование использования ртути и ограничивает ряд промышленных процессов и отраслей, в том числе горнодобывающую (особенно непромышленную добычу золота), производство цемента.
В природе существует множество полезных ископаемых, которые обладают определёнными характеристиками и используются для различных нужд человека.
Одним из древних металлов является ртуть. Химический элемент имеет особенности, которые делают его незаменимым в современной промышленности.
История открытия
О ртути люди узнали ещё в древние времена. Вещество часто находили в виде самородка, который представлял жидкие капли на горных породах. Но чаще металл получали из его соединения с серой — сульфида ртути (HgS), или киновари. Люди из Древнего Рима и Греции применяли вещество для очистки золота от разных примесей. В то время народы уже раскрыли, что металл и его соединения вредны для здоровья.
О веществе стало известно так рано, потому что добываемая киноварь быстро разлагалась под воздействием высоких температур воздуха и образовывала металлическую ртуть. В период древних цивилизаций люди обжигали киноварь в глиняных сосудах, на крышках которых конденсировался необходимый металл. Сегодня для этого применяют трубчатые печи.
Когда алхимики открыли новый элемент, они назвали его «живым серебром» (argentum vivum). Учёные считали его женским началом веществ и матерью всех металлов. Они полагали, что при помощи мышьяка и серы жидкой ртути можно вернуть твёрдость и получить таким образом золото.
В течение многих столетий алхимики утверждали, что это вещество содержится в любом металле. Кроме того, они верили, что оно могло стать основой для философского камня. Позже веществу дали другое название — hydrargyrum, что с латинского переводится как «жидкое серебро».
В Средневековье известные химические элементы ассоциировали с открытыми в то время семью планетами. Ртуть совпадала с обозначением Меркурия. Так люди подчёркивали близость металла к золоту (Солнцу), поскольку небесное тело расположено близко к светилу. Также название «Mercury» соответствовало уникальному свойству элемента. Капли вещества стремительно перекатывались по гладким поверхностям, что напоминало быстрое передвижение античного бога-посланника Меркурия.
В 1735 году шведский учёный Георг Брандт подробно описал образование вещества в чистом виде. Для обозначения уже использовался символ планеты Меркурий.
В 1759 году Браун и Ломоносов доказали, что вещество относится к металлам. Они смогли определить его металлические свойства в твёрдом агрегатном состоянии после замерзания.
Нахождение в природе
В России есть 23 места, где добывают ртуть. Самое крупное из них находится на Чукотке.
Металл также добывают и в других странах:
- Италия;
- Испания;
- Словения;
- Таджикистан;
- Украина;
- Киргизия.
Концентрация вещества в земной коре составляет всего 83 мг/т. Редкий металл слабо соединяется химически с иными элементами. Но ртутные руды часто бывают очень концентрированными, если их сравнивать с обычными горными породами, и могут содержать до 2,5% серебристого металла.
В основном ртуть рассеяна в природе. Лишь 0,02% от всего её объёма заключено в месторождениях. Наибольшие концентрации наблюдаются в глинистых сланцах. В Мировом океане объём вещества достигает 0,1 мкг/л.
Металл можно обнаружить во многих сульфидных минералах.
Основными природными материалами для добычи вещества выступают антимониты, блёклые руды, сфалериты и реальгары. Ртуть добывают из киновари, метациннабарита, а также из селенидов металла (тиманита и онофрита).
Описание элемента
Элемент расположен между золотом и таллием в таблице Менделеева. Ртуть имеет порядковый номер 80 и обозначается Hg. Она относится к элементам шестого периода и входит в подгруппу цинка. Это единственный металл, простые вещества которого находятся в жидком состоянии при нормальных условиях.
Электронная формула ртути — 1s22s22p63s23p63d104s24p64d104f145s25p65d106s2. Атомы вещества в соединениях с другими элементами проявляют валентность I и II.
Непрозрачный металл представлен тяжёлой серебристой жидкостью.
Основные физические свойства ртути:
- температура плавления: -38,8°C;
- температура кипения: +356,7°C;
- молярный объём — 14,80 см3/моль;
- атомная масса — 200,6;
- плотность — 13,5 г/см3.
В жидком виде ртуть обладает металлическим блеском. Когда вещество затвердевает, оно приобретает кристаллическое состояние. Ртуть может взаимодействовать со многими металлами, образуя при реакции с ними соединения, которые называются амальгамы. Химический элемент относится к группе диамагнетиков: он не магнитится, а отталкивается в присутствии магнитов. При горении вещество образует ядовитые испарения.
Ртуть характеризуется высоким потенциалом ионизации. Она способна восстанавливаться до атомарной формы (самородка). Кроме того, элемент обладает высокой химической стойкостью к кислороду и кислотам.
Химические особенности
Металл характеризуется степенью окисления +1 и +2. В первом случае он представлен двухъядерным катионом Hg22+ с металлической связью и склонен к диспропорционированию, которое проходит при нагревании и разбавлении водой.
На холоде вещество со степенью окисления +2 и металлическая ртуть сопропорционируют. Реагируя с нитратом металла, элемент образует нитрат ртути. При степени окисления +2 получаются катионы Hg2+, которые легко гидролизуются. Гидроксид металла существует лишь в разбавленных растворах, а в жидкостях с высокой концентрацией он дегидратируется.
Элемент со степенью окисления +2 образует с различными лигандами устойчивые комплексы. Прочные ковалентные связи наблюдаются с йодом, серой и углеродом. С последним веществом ртуть образует самые устойчивые соединения.
Сферы использования
Применение ртути в современной промышленности соблюдается с большой осторожностью. Перед работой с этим элементом нужно познакомиться с мерами безопасности.
Сферы использования металла:
- Материал применяется в виде рабочего тела в ртутных термометрах.
- Пары ртути, которые светятся в тлеющем разряде, используются для заполнения люминесцентных ламп.
- Металл и его сплавы применяют в герметичных выключателях, которые включаются в определённом положении.
- Некоторые химические источники тока и гидродинамические подшипники не обходятся без ртути.
- Вещество может применяться в датчиках положения.
- Иодид металла служит полупроводниковым детектором радиоактивного излучения.
- Бромид ртути используется в атомно-водородной энергетике.
- Соединение элемента с цезием выступает высокоэффективным рабочим телом в ионных двигателях.
- Металлическую ртуть используют как катод для электролитического получения активных металлов и щелочей.
- С помощью вещества перерабатывают вторичный алюминий.
- Соли химического элемента широко используют в лабораториях. Они помогают получить ацетальдегид из ацетилена.
- Каломель, сулему и некоторые другие токсичные соединения с Hg применяются в сельском хозяйстве для протравливания зерна и в качестве пестицидов.
В области медицины вещество практически не используют, поскольку оно считается опасным для жизни человека. В виде консерванта он содержится в малых количествах в вакцинах. В прошлом ртуть использовали в качестве слабительного, мочегонного и антисептического средства.
С 2020 года будет запрещено производство некоторых предметов для бытовых нужд, содержащих токсичный металл, поскольку испарения часто вызывают отравления у людей. Также введут регулирование применения вещества и ограничат многие промышленные процессы и отрасли, связанные с этим химическим элементом.
Ртуть — довольно интересный металл, который проявляет необычные свойства. О нём имеется немало занимательных фактов, однако учёные продолжают изучать особенности «жидкого серебра». Возможно, в будущем этому элементу найдут дополнительное применение и смогут снизить степень его токсичности.
Hg, химический элемент II группы периодической системы Менделеева, атомный номер 80, атомная масса 200,59; серебристо-белый тяжёлый металл, жидкий при комнатной температуре. В природе Р. представлена семью стабильными изотопами с массовыми числами: 196 (0,2%), 198 (10,0%), 199 (16,8%), 200 (23,1%), 201 (13,2%), 202 (29,8%), 204 (6,9%).
Историческая справка. Самородная Р. была известна за 2000 лет до н. э. народам Древней Индии и Древнего Китая. Ими же, а также греками и римлянами применялась Киноварь (природная HgS) как краска, лекарственное и косметическое средство. Греческий врач Диоскорид (1 в. н. э.), нагревая киноварь в железном сосуде с крышкой, получил Р. в виде паров, которые конденсировались на холодной внутренней поверхности крышки. Продукт реакции был назван hydrárgyros (от греч. hýdor — вода и árgyros — серебро), т. е. жидким серебром, откуда произошли латинские названия hydrargyrum, а также argentum vivum — живое серебро. Последнее сохранилось в названиях P. quicksilver (англ.) и Quecksilber (нем.). Происхождение русского названия Р. не установлено. Алхимики считали Р. главной составной частью всех металлов. «Фиксация» Р. (переход в твёрдое состояние) признавалась первым условием её превращения в золото. Твёрдую Р. впервые получили в декабре 1759 петербургские академик И. А. Браун и М. В. Ломоносов. Учёным удалось заморозить Р. в смеси из снега и концентрированной азотной кислоты. В опытах Ломоносова отвердевшая Р. оказалась ковкой, как свинец. Известие о «фиксации» Р. произвело сенсацию в учёном мире того времени; оно явилось одним из наиболее убедительных доказательств того, что Р. — такой же металл, как и все прочие.
Распространение Р. в природе. Р. принадлежит к числу весьма редких элементов, её среднее содержание в земной коре (кларк) близко к 4,5․10-6% по массе. Приблизительно в таких количествах она содержится в изверженных горных породах. Важную роль в геохимии Р. играет её миграция в газообразном состоянии и в водных растворах. В земной коре Р. преимущественно рассеяна; осаждается из горячих подземных вод, образуя Ртутные руды (содержание Р. в них составляет несколько процентов). Известно 35 ртутных минералов; главнейший из них — киноварь HgS.
В биосфере Р. в основном рассеивается и лишь в незначительных количествах сорбируется глинами и илами (в глинах и сланцах в среднем 4․10-5%). В морской воде содержится 3․10-9% Р.
Самородная Р., встречающаяся в природе, образуется при окислении киновари в сульфат и разложении последнего, при вулканических извержениях (редко), гидротермальным путём (выделяется из водных растворов).
Физические и химические свойства Р. — единственный металл, жидкий при комнатной температуре. Твёрдая Р. кристаллизуется в ромбические сингонии, а = 3,463 Å, с = 6,706 Å; плотность твёрдой Р. 14,193 г/см3 (—38,9 °С), жидкой 13,52 г/см3 (20 °С), атомный радиус 1,57 Å, ионный радиус Hg2+ 1,10 Å; tпл — 38,89 °С; tkип 357,25 °С; удельная теплоемкость при 0 °С 0,139 кдж/(кг ․К) [0,03336 кал/(г․°С)]; при 200 °С 0,133 кдж/(кг․К)[0,0319 кал/(г ․°С)]; температурный коэффициент линейного расширения 1,826․10-4 (0—100 °С); теплопроводность 8,247вт/(м․К) [0,0197 кал/(см․сек․°C) (при 20°C); удельное электросопротивление при 0°С 94,07․10-8 ом․м (94,07․10-6 ом․см). При 4,155 К Р. становится сверхпроводником (см. Сверхпроводимость). Р. диамагнитна, её атомная магнитная восприимчивость равна —0,19․10-6 (при 18 °С).
Конфигурация внешних электронов атома Hg 5d 106s2, в соответствии с чем при химических реакциях образуются катионы Hg2+ и Hg22+. Химическая активность Р. невелика. В сухом воздухе (или кислороде) она при комнатной температуре сохраняет свой блеск неограниченно долго. С кислородом даёт 2 соединения: чёрную закись Hg2O и красную окись HgO. Hg2O появляется в виде чёрной плёнки на поверхности Р. при действии озона. HgO образуется при нагревании Hg на воздухе (300—350 °С), а также при осторожном нагревании нитратов Hg (NO3)2 или Hg2(NO3)2. Гидроокись Р. практически не образуется. При взаимодействии с металлами, которые Р. смачивает, образуются амальгамы (См. Амальгама). Из сернистых соединений важнейшим является HgS, которую получают растиранием Hg с серным цветом при комнатной температуре, а также осаждением растворов солей Hg2+ сероводородом или сульфидом щелочного металла. С галогенами (хлором, иодом) Р. соединяется при нагревании, образуя почти недиссоциирующие, в большинстве ядовитые соединения типа HgX2. В соляной и разбавленной серной кислотах Р. не растворяется но растворима в царской водке, азотной и горячей концентрированной серной кислотах.
Почти все соли Hg2+ плохо растворимы в воде. К хорошо растворимым относится нитрат Hg (NO3)2.
Большое значение имеют хлориды Р.: Hg2Cl2 (Каломель) и HgCl2 (Сулема) Известны соли окисной Р. цианистой и роданистой кислот, а также ртутная соль гремучей кислоты Hg (ONC)2, т. н. Гремучая ртуть. При действии аммиака на соли образуются многочисленные Комплексные соединения, например HgCI․2NH3 (плавкий белый преципитат) и HgNH2CI (неплавкий белый преципитат). Применение находят Ртутьорганические соединения.
Получение Р. Ртутные руды (или рудные концентраты), содержащие Р. в виде киновари, подвергают окислительному обжигу
HgS + O2 = Hg + SO2.
Обжиговые газы, пройдя пылеуловительную камеру, поступают в трубчатый холодильник из нержавеющей стали или монель-металла. Жидкая Р. стекает в железные приёмники. Для очистки сырую Р. пропускают тонкой струйкой через высокий (1—1,5м) сосуд с 10%-ной HNO3, промывают водой, высушивают и перегоняют в вакууме.
Возможно также гидрометаллургическое извлечение Р. из руд и концентратов растворением HgS в сернистом натрии с последующим вытеснением Р. алюминием. Разработаны способы извлечения Р. электролизом сульфидных растворов.
Применение. Р. широко применяется при изготовлении научных приборов (барометры, термометры, манометры, вакуумные насосы, нормальные элементы (См. Нормальный элемент), полярографы, капиллярные электрометры и др.), в ртутных лампах (См. Ртутная лампа), переключателях, выпрямителях; как жидкий катод в производстве едких щелочей и хлора электролизом, в качестве катализатора при синтезе уксусной кислоты, в металлургии для амальгамации (См. Амальгамация) золота и серебра, при изготовлении взрывчатых веществ (см. Гремучая ртуть); в медицине (каломель, сулема, ртутьорганические и другие соединения), в качестве пигмента (киноварь), в сельском хозяйстве (органические соединения Р.) в качестве протравителя семян и гербицида, а также как компонент краски морских судов (для борьбы с обрастанием их организмами). Р. и ее соединения токсичны, поэтому работа с ними требует принятия необходимых мер предосторожности.
С. А. Погодин.
Р. в организме. Содержание Р. в организмах составляет около 10-6% В среднем в организм человека с пищей ежесуточно поступает 0,02—0,05 мг Р. Концентрация Р. в крови человека составляет в среднем 0,023 мкг/мл, в моче — 0,1—0,2 мкг/мл. В связи с загрязнением воды промышленными отходами в теле многих ракообразных и рыб концентрация Р. (главным образом в виде её органических соединений) может значительно превышать допустимый санитарно-гигиенический уровень. Ионы Р. и её соединения, связываясь с сульфгидрильными группами (См. Сульфгидрильные группы) ферментов, могут инактивировать их. Попадая в организм, Р. влияет на поглощение и обмен микроэлементов — Cu, Zn, Cd, Se. В целом биологическая роль Р. в организме изучена недостаточно.
Ю. И. Раецкая.
Отравления Р. и её соединениями возможны на ртутных рудниках и заводах, при производстве некоторых измерительных приборов, ламп, фармацевтических препаратов, инсектофунгицидов и др.
Основную опасность представляют пары металлической Р., выделение которых с открытых поверхностей возрастает при повышении температуры воздуха. При вдыхании Р. попадает в кровь. В организме Р. циркулирует в крови, соединяясь с белками; частично откладывается в печени, в почках, селезёнке, ткани мозга и др. Токсическое действие связано с блокированием сульфгидрильных групп тканевых белков, нарушением деятельности головного мозга (в первую очередь, гипоталамуса). Из организма Р. выводится через почки, кишечник, потовые железы и др.
Острые отравления Р. и её парами встречаются редко. При хронических отравлениях наблюдаются эмоциональная неустойчивость, раздражительность, снижение работоспособности, нарушение сна, дрожание пальцев рук, снижение обоняния, головные боли. Характерный признак отравления — появление по краю дёсен каймы сине-чёрного цвета; поражение дёсен (разрыхлённость, кровоточивость) может привести к гингивиту и стоматиту. При отравлениях органическими соединениями Р. (диэтилмеркурфосфатом, диэтил-ртутью, этилмеркурхлоридом) преобладают признаки одновременного поражения центральной нервной (энцефало-полиневрит) и сердечно-сосудистой систем, желудка, печени, почек.
Лечение: внутривенное введение 20%-ного раствора гипосульфита (12—15 вливаний на курс), унитиол, фармакологические и физиотерапевтические средства, нормализующие высшую нервную деятельность, курортолечение (Пятигорск, Мацеста и т. п.) и др. Профилактика: замена Р. менее вредными веществами, правильные способы хранения, соблюдение мер безопасности при использовании (герметичность оборудования, рациональная отделка помещений, рабочих поверхностей, эффективная вентиляция), индивидуальная защита; предварительные и периодические медицинские осмотры.
Препараты Р. находят применение в медицинской практике, главным образом благодаря их антисептическим и мочегонным свойствам. Как мочегонные применяют меркузал, промеран и др. В качестве антисептиков используют сулему (дезинфекция кожи, одежды, предметов ухода за больными и т. п.), диоцид (стерилизация хирургических инструментов и т. п.), цианид и оксицианид Р. (для промываний и спринцеваний при некоторых воспалительных процессах), амидохлорид Р. (в виде мази при заболеваниях кожи), окись Р. жёлтую (в виде мази при заболеваниях глаз и кожи). Применявшиеся ранее для лечения сифилиса препараты Р. в современной практике не используются.
А. А. Каспаров.
Лит.: Мельников С. М., Ртуть, в кн.: Краткая химическая энциклопедия, т. 4, М., 1965; Реми Г., Курс неорганической химии, пер. с нем., т. 2, М., 1966; Рипан Р., Четяну И., Неорганическая химия, пер. с рум., М., 1972; Некрасов Б. В., Основы общей химии, 2 изд., т. 2, М., 1969; Вредные вещества в промышленности, под общ. ред. Н. В. Лазарева, 6 изд., [ч. 2], Л., 1971; Трахтенберг И. М., Хроническое воздействие ртути на организм, К., 1969; Профессиональные болезни, 3 изд., М., 1973.
Большая советская энциклопедия. — М.: Советская энциклопедия.
1969—1978.
РТУТЬ (лат. Hydrargyrum), Hg, химич. элемент II группы короткой формы (12-й группы длинной формы) периодич. системы; ат. н. 80, ат. м. 200,59. Природная Р. состоит из семи стабильных изотопов: 196Hg (0,15%), 198Hg (9,97%), 199Hg (16,87%), 200Hg (23,10%), 201Hg (13,18%), 202Hg (29,86%), 204Hg (6,87%). Искусственно получены радиоизотопы с массовыми числами 174–208.
Историческая справка
Р. – один из семи металлов, известных с древнейших времён в Индии, Китае, Египте (за 2000 лет до н. э.). Нередко её находили в самородном виде, чаще получали обжигом природной киновари. Р. и её соединения использовались в медицине, из киновари делали красные краски (вермильон). Древние греки и римляне использовали Р. для извлечения золота и серебра (амальгамирование), знали о токсичности самой Р. и её соединений, напр. хлорида ртути(II) – сулемы. Алхимики считали Р. гл. составной частью всех металлов и предполагали, что из неё можно получить золото. Лат. назв. образовано от греч. ὑδράργυρος (ὕδωρ – вода и ἄργυρος – серебро; «жидкое текучее серебро»), данного в 1 в. н. э. Диоскоридом. Совр. англ. (mercury) и франц. (mercure) названия Р. произошли от имени др.-рим. бога торговли и посланника богов Меркурия (Mercurius; в алхимии Р. обозначалась астрономич. символом планеты Меркурий). Выделение Р. в чистом виде описано Г. Брандтом в 1735.
Распространённость в природе
Содержание Р. в земной коре 7,0·10–6% по массе, в мор. воде 0,03 мг/м3, в атмосфере 2·10–3 мг/м3. Р. относят к рассеянным элементам (в концентрир. виде в месторождениях находится только 0,02% всей Р.); в природе встречается в свободном состоянии (ртуть самородная). Образует более 30 минералов. Осн. рудный минерал – киноварь HgS. Минералы Р. в виде изоморфных примесей встречаются в кварце, халцедоне, карбонатах, слюдах, свинцово-цинковых рудах. В обменных процессах гидросферы, литосферы, атмосферы участвует большое количество Р. См. также Ртутные руды.
Свойства
Конфигурация внешних электронных оболочек атома Р. 4f145s25p65d106s2; в соединениях обычно проявляет степень окисления +1 и +2; энергии ионизации Hg0→Hg+→Hg2+→Hg3+ соответственно равны 1007, 1809 и 3300 кДж/моль; электроотрицательность по Полингу 1,9; атомный радиус 155 пм, ковалентный радиус 149 пм, ионные радиусы (в скобках указано координац. число) Hg+ 111 пм (3), 133 пм (6), Hg2+ 83 пм (2), 110 пм (4), 116 пм (6), 128 пм (8).
Р. – серебристо-белый металл, летучий уже при комнатной темп-ре, в парах бесцветный; единственный из металлов – жидкий при комнатной темп-ре; tпл –38,87 °C, tкип 356,58 °C; плотность (кг/м3): 13 595,1 (0 °C), 13 545,7 (20 °C), 13533,6 (25 °C), 13411,8 (75 °C), 13351,5 (100 °C). Твёрдая Р. – бесцветные кристаллы; до 79 К существует ромбоэдрическая кристаллич. α -модификация, ниже – β-Hg с тетрагональной объёмноцентрир. решёткой; плотность твёрдой Р. 14193 кг/м3 (–38,9 °C). Теплоёмкость 27,98 Дж/(моль·К), температурный коэф. линейного расширения 41·10–6 К–1 (195–234 К). Диамагнетик. Темп-ра перехода в сверхпроводящее состояние α-Hg 4,153 К, β-Hg 3,949 К. Растворимость Р. (г в 100 г): в воде 6·10–6 (25 °C), бензоле 2·10–7 (20 °C), диоксане 7,0·10–7 (25 °C). Р. не смачивает стекло.
Р. окисляется до HgO кислородом (при темп-ре выше 300 °C), озоном – при комнатной темп-ре, во влажном воздухе покрывается плёнкой оксида (ртути оксид). Не реагирует с Н2, N2, P, As, С, Si, В, Ge, с сухими НСl, HF, H2S, NH3, PH3 и AsH3 при темп-ре ниже 200 °C; с НВr, HI, H2Se, тонкоизмельчённой S взаимодействует уже при комнатной темп-ре. Р. не взаимодействует с разбавленными H2SO4 и HCl; реагирует с царской водкой, HNO3 и концентрир. H2SO4. С галогенами Р. активно взаимодействует, образуя галогениды (см., напр., Ртути хлориды), с халькогенами – халькогениды (HgS, HgSe, HgTe). Р. образует сплавы – амальгамы со многими металлами (кроме V, Fe, Mo, Cs, Nb, Та, W), даёт интерметаллич. соединения (меркуриды). Соли Hg(I) существуют в виде димеров, катион Hg22+ сохраняется как в кристаллич. решётке, так и в растворе; существуют галогениды Hg2X2 (X – F, Cl, Br, I), в частности хлорид Hg2Cl2 (каломель), нитрат Hg2(NO3)2 и его кристаллогидрат Hg2(NO3)2·2H2O, сульфат Hg2SO4 и др. Соли Hg(II) – нитрат Hg(NO3)2, сульфат HgSO4; дигалогениды Р. имеют преим. ковалентный характер, существуют в водном растворе почти исключительно в молекулярной форме, склонны образовывать галогенидные комплексы. Мн. соединения Р. летучи, разлагаются на свету, при нагревании, легко восстанавливаются. См. также Ртутьорганические соединения.
Биологическая роль
Р. высокотоксична для любых форм жизни. Пары́ и соединения Р. чрезвычайно ядовиты, накапливаются в организме, легко сорбируются лёгочной тканью, попадают в кровь, подвергаются ферментативному окислению до ионов Р., которые образуют соединения с молекулами белка, ферментами, нарушают обмен веществ, поражают нервную систему. ПДК Р. в воздухе рабочей зоны 0,01 мг/м3, в атмосферном воздухе 0,0003 мг/м3, в воде водоёмов 0,0005 мг/дм3, в почве 2,1 мг/кг. При работе с Р. необходима полная герметизация аппаратуры. Для хранения Р. используют стальные баллоны. Случайно пролитую Р. необходимо собрать медной пластинкой, затем обработать поверхность раствором FeCl3 (демеркуризация).
Естественные источники загрязнения среды – испарение со всей поверхности суши, возгонка из соединений, находящихся глубоко в толще земной коры, вулканич. деятельность; антропогенные источники – металлургия, сжигание органич. топлив, произ-во хлора и соды, бытовые (сжигание мусора, сточные воды и т. д.) и др. Экологич. последствия проявляются прежде всего в водной среде – подавляется жизнедеятельность одноклеточных морских организмов и рыб, нарушается фотосинтез, ассимилируются нитраты, фосфаты, соединения аммония и т. д.
Получение
Р. получают гл. обр. обжигом киновари HgS при 700–800 °C. Восстановленная Р. удаляется из зоны реакции с отходящими газами, очищается в электрофильтрах от взвешенных частиц и собирается в конденсаторах. Выход Р. более 80%. Для получения технич. продукта Р. фильтруют через пористые перегородки, керамич. фильтры, сукно, замшу, последовательно промывают растворами щелочей, азотной кислотой, растворами Hg(NO3)2 и перегоняют. Гидрометаллургич. извлечение Р. ведут обработкой киновари водными щелочными растворами сульфида или полисульфида натрия. Образовавшиеся растворы тиосолей Р. подвергают электролизу. Для получения особо чистой Р. используют четырёхстадийное электрохимич. рафинирование в электролизёрах с ртутными электродами.
Объём использования Р. – ок. 4000 т/год.
Применение
Р. – материал катодов при электрохимич. получении едких щелочей и хлора, применяется в полярографии, в произ-ве ртутных вентилей, газоразрядных источников света (люминесцентных и ртутных ламп), диффузионных вакуумных насосов, контрольно-измерит. приборов (термометров, барометров, манометров и др.); для определения чистоты фтора, а также его концентрации в газах. Соединения Р. используют в меркуриметрическом и меркурометрическом методах объёмного анализа, для чернения латуни, как компонент глазурей, в составе электролита в химич. источниках тока, взрывчатых веществ (гремучая ртуть) и др.