|
|

|
|
| Names | |
|---|---|
| IUPAC name
Sulfurous acid |
|
| Other names
Sulfuric(IV) acid |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChEBI |
|
| ChEMBL |
|
| ChemSpider |
|
| ECHA InfoCard | 100.029.066 |
| EC Number |
|
|
Gmelin Reference |
1458 |
| KEGG |
|
|
PubChem CID |
|
| UNII |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
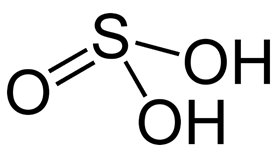
Chemical formula |
H2SO3 |
| Molar mass | 82.07 g/mol |
| Acidity (pKa) | 1.857, 7.172 |
| Conjugate base | Bisulfite |
| Hazards | |
| GHS labelling: | |
|
Pictograms |
 
|
|
Signal word |
Danger |
|
Hazard statements |
H314, H332 |
|
Precautionary statements |
P260, P261, P264, P271, P280, P301+P330+P331, P303+P361+P353, P304+P312, P304+P340, P305+P351+P338, P310, P312, P321, P363, P405, P501 |
| Flash point | Non-flammable |
| Safety data sheet (SDS) | ICSC 0074 |
| Related compounds | |
|
Related compounds |
Sulfur dioxide Sulfuric acid Selenous acid |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Sulfurous acid (also sulfuric(IV) acid, sulphurous acid (UK), sulphuric(IV) acid (UK)) is the chemical compound with the formula H2SO3. There is no evidence that sulfurous acid exists in solution,[1] but the molecule has been detected in the gas phase.[2] The conjugate bases of this elusive acid are, however, common anions, bisulfite (or hydrogen sulfite) and sulfite. Sulfurous acid is an intermediate species in the formation of acid rain from sulfur dioxide.[3]
Raman spectra of solutions of sulfur dioxide in water show only signals due to the SO2 molecule and the bisulfite ion, HSO−3.[4] The intensities of the signals are consistent with the following equilibrium:
SO2 + H2O ⇌ HSO−3 + H+ Ka = 1.54×10−2; pKa = 1.81.
17O NMR spectroscopy provided evidence that solutions of sulfurous acid and protonated sulfites contain a mixture of isomers, which is in equilibrium:[5]
Attempts to concentrate the solutions of sulfurous acid simply reverses the equilibrium, producing sulfur dioxide and water vapor. A clathrate with the formula 4SO2·23H2O has been crystallised. It decomposes above 7 °C. Anhydrous sulfurous acid H2SO3 has not been isolated.
Uses[edit]
Aqueous solutions of sulfur dioxide, which sometimes are referred to as sulfurous acid, are used as reducing agents and as disinfectants, as are solutions of bisulfite and sulfite salts. They are oxidised to sulfuric acid or sulfate by accepting another oxygen atom.[6]
See also[edit]
- Bisulfite
- Carbonic acid
- Pulp (paper)
- Sulfite paper pulp process
- Sulfite
- Sulfuric acid
References[edit]
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. p. 719. ISBN 978-0-08-037941-8.
- ^ D. Sülzle; M. Verhoeven; J. K. Terlouw; H. Schwarz (1988). «Generation and Characterization of Sulfurous Acid (H2SO3) and of Its Radical Cation as Stable Species in the Gas Phase». Angew. Chem. Int. Ed. Engl. 27 (11): 1533–4. doi:10.1002/anie.198815331.
- ^ McQuarrie; Rock (1987). General Chemistry (2nd ed.). New York: W.H. Freeman and Company. p. 243. ISBN 0-7167-1806-5.
- ^ Jolly, William L. (1991), Modern Inorganic Chemistry (2nd ed.), New York: McGraw-Hill, ISBN 0-07-032768-8
- ^ Catherine E. Housecroft; Alan G. Sharpe (2008). «Chapter 16: The group 16 elements». Inorganic Chemistry, 3rd Edition. Pearson. p. 520. ISBN 978-0-13-175553-6.
- ^ L. Kolditz, Anorganische Chemie, VEB Deutscher Verlag der Wissenschaften, Berlin 1983, S. 476.

|
|

|
|
| Names | |
|---|---|
| IUPAC name
Sulfurous acid |
|
| Other names
Sulfuric(IV) acid |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChEBI |
|
| ChEMBL |
|
| ChemSpider |
|
| ECHA InfoCard | 100.029.066 |
| EC Number |
|
|
Gmelin Reference |
1458 |
| KEGG |
|
|
PubChem CID |
|
| UNII |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
H2SO3 |
| Molar mass | 82.07 g/mol |
| Acidity (pKa) | 1.857, 7.172 |
| Conjugate base | Bisulfite |
| Hazards | |
| GHS labelling: | |
|
Pictograms |
 
|
|
Signal word |
Danger |
|
Hazard statements |
H314, H332 |
|
Precautionary statements |
P260, P261, P264, P271, P280, P301+P330+P331, P303+P361+P353, P304+P312, P304+P340, P305+P351+P338, P310, P312, P321, P363, P405, P501 |
| Flash point | Non-flammable |
| Safety data sheet (SDS) | ICSC 0074 |
| Related compounds | |
|
Related compounds |
Sulfur dioxide Sulfuric acid Selenous acid |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Sulfurous acid (also sulfuric(IV) acid, sulphurous acid (UK), sulphuric(IV) acid (UK)) is the chemical compound with the formula H2SO3. There is no evidence that sulfurous acid exists in solution,[1] but the molecule has been detected in the gas phase.[2] The conjugate bases of this elusive acid are, however, common anions, bisulfite (or hydrogen sulfite) and sulfite. Sulfurous acid is an intermediate species in the formation of acid rain from sulfur dioxide.[3]
Raman spectra of solutions of sulfur dioxide in water show only signals due to the SO2 molecule and the bisulfite ion, HSO−3.[4] The intensities of the signals are consistent with the following equilibrium:
SO2 + H2O ⇌ HSO−3 + H+ Ka = 1.54×10−2; pKa = 1.81.
17O NMR spectroscopy provided evidence that solutions of sulfurous acid and protonated sulfites contain a mixture of isomers, which is in equilibrium:[5]
Attempts to concentrate the solutions of sulfurous acid simply reverses the equilibrium, producing sulfur dioxide and water vapor. A clathrate with the formula 4SO2·23H2O has been crystallised. It decomposes above 7 °C. Anhydrous sulfurous acid H2SO3 has not been isolated.
Uses[edit]
Aqueous solutions of sulfur dioxide, which sometimes are referred to as sulfurous acid, are used as reducing agents and as disinfectants, as are solutions of bisulfite and sulfite salts. They are oxidised to sulfuric acid or sulfate by accepting another oxygen atom.[6]
See also[edit]
- Bisulfite
- Carbonic acid
- Pulp (paper)
- Sulfite paper pulp process
- Sulfite
- Sulfuric acid
References[edit]
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. p. 719. ISBN 978-0-08-037941-8.
- ^ D. Sülzle; M. Verhoeven; J. K. Terlouw; H. Schwarz (1988). «Generation and Characterization of Sulfurous Acid (H2SO3) and of Its Radical Cation as Stable Species in the Gas Phase». Angew. Chem. Int. Ed. Engl. 27 (11): 1533–4. doi:10.1002/anie.198815331.
- ^ McQuarrie; Rock (1987). General Chemistry (2nd ed.). New York: W.H. Freeman and Company. p. 243. ISBN 0-7167-1806-5.
- ^ Jolly, William L. (1991), Modern Inorganic Chemistry (2nd ed.), New York: McGraw-Hill, ISBN 0-07-032768-8
- ^ Catherine E. Housecroft; Alan G. Sharpe (2008). «Chapter 16: The group 16 elements». Inorganic Chemistry, 3rd Edition. Pearson. p. 520. ISBN 978-0-13-175553-6.
- ^ L. Kolditz, Anorganische Chemie, VEB Deutscher Verlag der Wissenschaften, Berlin 1983, S. 476.
| Сернистая кислота | |
|---|---|
   |
|
| Общие | |
| Систематическое наименование |
Сернистая кислота |
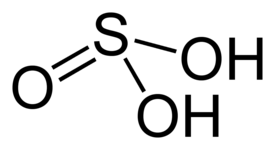
| Хим. формула | H2SO3 |
| Физические свойства | |
| Состояние | Жидкость |
| Молярная масса | 82.07 г/моль |
| Химические свойства | |
| Константа диссоциации кислоты [math]displaystyle{ pK_a }[/math] | 1,81 |
| Растворимость | |
| • в воде | 14.73 г/100 мл |
| Классификация | |
| Рег. номер CAS | 7782-99-2 |
| Безопасность | |
| Пиктограммы ECB |
|
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Серни́стая кислота́ (химическая формула — H2SO3) — химическая неорганическая кислота средней силы, существующая только в водном растворе. Образуется при растворении диоксида серы в воде.
Её соли и эфиры называются сульфи́тами и ги́дросульфи́тами.
Физические свойства
Сернистая кислота — это двухосновная кислота средней силы. Образуется при растворении диоксида серы в воде. Ввиду неустойчивости не может быть выделена в чистом виде из водных растворов.
Химические свойства
Кислота средней силы:
- [math]displaystyle{ mathsf{H_2SO_3 rightleftarrows H^+ + HSO_3^-} }[/math]
- [math]displaystyle{ mathsf{HSO_3^- rightleftarrows H^+ + SO_3^{2-}} }[/math]
Существует лишь в разбавленных водных растворах (в свободном состоянии не выделена):
- [math]displaystyle{ mathsf{SO_2+H_2O rightleftarrows H_2SO_3} }[/math]
- Баланс реакции лежит далеко слева.
Растворы H2SO3 всегда имеют резкий специфический запах химически не связанного водой SO2.
Двухосновная кислота, образует два ряда солей: кислые — гидросульфиты (в недостатке щёлочи):
- [math]displaystyle{ mathsf{H_2SO_3 + NaOH longrightarrow NaHSO_3 + H_2O} }[/math]
и средние — сульфиты (в избытке щёлочи):
- [math]displaystyle{ mathsf{H_2SO_3 + 2NaOH longrightarrow Na_2SO_3 + 2H_2O} }[/math]
Как и сернистый газ, сернистая кислота и её соли являются сильными восстановителями:
- [math]displaystyle{ mathsf{H_2SO_3 + Br_2 + H_2O longrightarrow H_2SO_4 + 2HBr} }[/math]
[math]displaystyle{ mathsf{H_2SO_3 + Cl_2 + H_2O longrightarrow H_2SO_4 + 2HCl} }[/math]
При взаимодействии с ещё более сильными восстановителями может играть роль окислителя:
- [math]displaystyle{ mathsf{H_2SO_3 + 2H_2S longrightarrow 3S downarrow + 3H_2O} }[/math]
Качественная реакция на сульфит-ионы — обесцвечивание раствора перманганата калия:
- [math]displaystyle{ mathsf{5SO_3^{2-} + 6H^{+} + 2MnO_4^{-} longrightarrow 5SO_4^{2-} + 2Mn^{2+} + 3H_2O} }[/math]
Необратимо окисляется кислородом до серной кислоты при +70 °C под давлением и в присутствии сульфата меди (II). Образующийся сульфит меди (II) окисляется кислородом до сульфата меди (II):
[math]displaystyle{ mathsf{2H_2SO_3 + O_2 xrightarrow {+70^oC, p, CuSO_4} 2H_2SO_4} }[/math]
Физиологические свойства
Пары сернистой кислоты имеют примерно те же свойства воздействия на организм человека, что и её ангидрид, сернистый газ, — с той только разницей, что концентрация таких паров в случае кислоты будет всегда ниже. Тем не менее, сернистая кислота всегда приводит к стойкому раздражению дыхательных путей, не позволяющему человеку продолжительного пребывания в атмосфере, сколько-нибудь богатой такими парами. При постоянном действии на человека даже разрежённых испарений сернистой кислоты, сразу не производящей заметного раздражения дыхательных органов, всё равно проявляются катаральные воспаления соединительной оболочки глаз, возникают трудности дыхания, расстройство пищеварения, что, в конце концов, приводит к общему упадку сил организма.[1]
Применение
- Восстановитель, для беления шерсти, шелка и других материалов, которые не выдерживают отбеливания с помощью сильных окислителей;
- Консервирование плодов, овощей, винных изделий;
- Осветление фруктовых соков, долгое время производимое при посредстве сернистого газа, на самом деле в своём механизме использует химическое воздействие сернистой кислоты;[2]
Примечания
- ↑ Ф. Ф. Эрисман. «Профессиональная гигиена». Избранные произведения: в 2 т. — М.: Медгиз, 1959 г.
- ↑ И. Н. Вольпер. Сахар: сладкий, горький, соленый — М.: «Химия и жизнь», № 10, 1965 г.
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1995. — Т. 4 (Пол-Три). — 639 с. — ISBN 5-82270-092-4.
Справочник содержит названия веществ и описания химических формул (в т.ч. структурные формулы и скелетные формулы).
Сернистая кислота
Брутто-формула:
H2O3S
CAS# 7782-99-2
Категории:
Неорганические кислоты
PubChem CID: 1100
Названия
Русский:
- Сернистая кислота
Варианты формулы:
H2SO3
H(+1)2S(+4)O(-2)3
HO-S`|O|-OH
O//S<_(A75)OH>_(A15)OH
H/OS|O`|/OH
Вещества, имеющие отношение…
Ангидрид:
Оксид серы(IV)
Анион:
Сульфиты; Гидросульфиты
Химический состав
Реакции, в которых участвует Сернистая кислота
-
Na2SO3 + H2SO4 -> Na2SO4 + H2SO3
-
H2SO3 -> H2O + SO2″|^»
-
SO2 + H2O <=> H2SO3
-
{M}(OH)2 + H2{X} = {M}{X} + 2H2O
, где M =
Mg Ca Ba Sr Cu Zn; X =
SO4 SO3 CO3 -
H2{X} + 2{M}OH = {M}2{X} + 2H2O
, где X =
SO4 SO3; M =
Li Na K Rb
И ещё 3 реакции…
Определение и формула сернистой кислоты
Существует в водном растворе только при концентрации не более 6%, в остальных случаях сразу же разлагается на диоксид серы и воду. Плотность – 1,03 г/см3.
Химическая формула сернистой кислоты
Химическая формула сернистой кислоты H2SO3. Она показывает, что в состав данной молекулы входят два атома водорода (Ar = 1 а.е.м.), один атом серы (Ar = 32 а.е.м.) и три атома кислорода (Ar = 16 а.е.м.). По химической формуле можно вычислить молекулярную массу сернистой кислоты:
Mr(H2SO3) = 2×Ar(H) + Ar(S) + 3×Ar(O);
Mr(H2SO3) = 2×1 + 32 + 3×16= 2 + 32 + 48 = 82
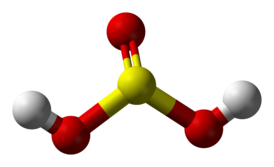
Графическая (структурная) формула сернистой кислоты
Структурная (графическая) формула сернистой кислоты является более наглядной (рис. 1). Она показывает то, как связаны атомы между собой внутри молекулы:
Рис. 1. Структурная формула сернистой кислоты.
Ионная формула
Сернистая кислота представляет собой двухосновную кислоту, которая подвергается ступенчатой диссоциации в водном растворе согласно следующим уравнениям реакции:
H2SO3 ↔ H+ + HSO3—;
HSO3— ↔ H+ + SO32-
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |
Химия
Онисим
16 сентября, 17:45
+2
Сомневаетесь в ответе?
Найдите правильный ответ на вопрос ✅ «Как пишется формула серной кислоты …» по предмету 📘 Химия, а если вы сомневаетесь в правильности ответов или ответ отсутствует, то попробуйте воспользоваться умным поиском на сайте и найти ответы на похожие вопросы.
Смотреть другие ответы
Химия: Какие частицы входят в состав ядра атома? а). электроны б). протоны в). нейтроны г). ионы
Ответы (3)
По положению элемента #40 в табл Менделеева запишите электрон конфигур. Выделите ваоентные электронв и распредилите их по квантовым состоянием в стабильном и возбуж состояниях. Для валент электрон запишите квант числа.
Ответы (1)
Кількість речовини атомів Оксигену у 49 г сульфатної кислоти?
Ответы (1)
CH3-CH2-CH2-Cl+KOH⇒?
Ответы (2)
Сожгли вещество, масса которого 13,8 грамм, при этом выделился оксид углерода (четырех валентный) объемом 23,52 литра, и вода массой 10,8 грамм. Плотность этого вещества по водороду 46. Установить молекулярную формулу
Ответы (2)
Не уверен в ответе?
Найди верный ответ на вопрос ✅ «Как пишется формула серной кислоты …» по предмету 📙 Химия, а если ответа нет или никто не дал верного ответа, то воспользуйся поиском и попробуй найти ответ среди похожих вопросов.
Искать другие ответы
- Вход
- Регистрация
- Без ответов
- Теги
- Пользователи
- Задать вопрос
- Отвечаем правильно
- Химия
- Как пишется формула серной кислоты
0 голосов
Как пишется формула серной кислоты
- пишется
- формула
- кислоты
- 5 — 9 классы
- химия
спросил
20 Март, 18
от
Pavelveselov6_zn
(17 баллов)
в категории Химия
2 Ответы
0 голосов
Она пишется вот так: H2SO4
ответил
20 Март, 18
от
AlexRadchenko_zn
(27 баллов)
0 голосов
Формула серной кислоты: Н2SO4
ответил
20 Март, 18
от
Dеspair_zn
(56 баллов)
- Обратная связь
Учиться и решать задачи с пояснениями просто.
…
Помощь с домашними заданиями. Решение задач, ответы на вопросы учеников и студентов.
OTVETYTUT.COM — 2018
Главная
Контакты
Серни́стая кислота́ (химическая формула — H2SO3) — химическая неорганическая кислота средней силы, существующая только в водном растворе. Образуется при растворении диоксида серы в воде.
Её соли и эфиры называются сульфи́тами и ги́дросульфи́тами.
Физические свойства
Сернистая кислота — это двухосновная кислота средней силы. Образуется при растворении диоксида серы в воде. Ввиду неустойчивости не может быть выделена в чистом виде из водных растворов.
Химические свойства
Кислота средней силы:
Существует лишь в разбавленных водных растворах (в свободном состоянии не выделена):
- Баланс реакции лежит далеко слева.
Растворы H2SO3 всегда имеют резкий специфический запах химически не связанного водой SO2.
Двухосновная кислота, образует два ряда солей: кислые — гидросульфиты (в недостатке щёлочи):
и средние — сульфиты (в избытке щёлочи):
Как и сернистый газ, сернистая кислота и её соли являются сильными восстановителями:

При взаимодействии с ещё более сильными восстановителями может играть роль окислителя:
Качественная реакция на сульфит-ионы — обесцвечивание раствора перманганата калия:
Необратимо окисляется кислородом до серной кислоты при +70 °C под давлением и в присутствии сульфата меди (II). Образующийся сульфит меди (II) окисляется кислородом до сульфата меди (II):

Физиологические свойства
Пары сернистой кислоты имеют примерно те же свойства воздействия на организм человека, что и её ангидрид, сернистый газ, — с той только разницей, что концентрация таких паров в случае кислоты будет всегда ниже. Тем не менее, сернистая кислота всегда приводит к стойкому раздражению дыхательных путей, не позволяющему человеку продолжительного пребывания в атмосфере, сколько-нибудь богатой такими парами. При постоянном действии на человека даже разрежённых испарений сернистой кислоты, сразу не производящей заметного раздражения дыхательных органов, всё равно проявляются катаральные воспаления соединительной оболочки глаз, возникают трудности дыхания, расстройство пищеварения, что, в конце концов, приводит к общему упадку сил организма.[1]
Применение
- Восстановитель, для беления шерсти, шелка и других материалов, которые не выдерживают отбеливания с помощью сильных окислителей;
- Консервирование плодов, овощей, винных изделий;
- Осветление фруктовых соков, долгое время производимое при посредстве сернистого газа, на самом деле в своём механизме использует химическое воздействие сернистой кислоты;[2]
Примечания
- ↑ Ф. Ф. Эрисман. «Профессиональная гигиена». Избранные произведения: в 2 т. — М.: Медгиз, 1959 г.
- ↑ И. Н. Вольпер. Сахар: сладкий, горький, соленый — М.: «Химия и жизнь», № 10, 1965 г.
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1995. — Т. 4 (Пол-Три). — 639 с. — ISBN 5-82270-092-4.
Эта страница в последний раз была отредактирована 3 декабря 2022 в 22:07.
Как только страница обновилась в Википедии она обновляется в Вики 2.
Обычно почти сразу, изредка в течении часа.