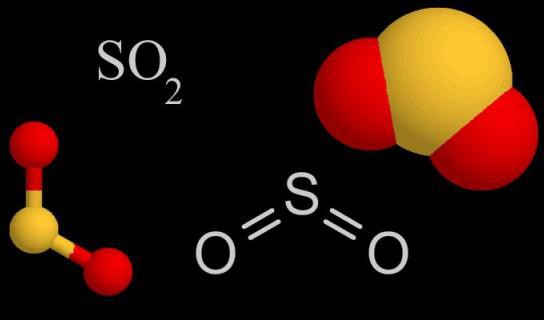
Сернистый газ имеет молекулярное строение, аналогичное озону. Атом серы, находящийся в центре молекулы, связан с двумя атомами кислорода. Этот газообразный продукт окисления серы не имеет цвета, издает резкий запах, при изменении условий легко конденсируется в прозрачную жидкость. Вещество хорошо растворимо в воде, обладает антисептическими свойствами. В больших количествах получают SO2 в химической промышленности, а именно в цикле сернокислотного производства. Газ широко используется для обработки сельскохозяйственных и пищевых продуктов, отбеливания тканей в текстильной промышленности.
Систематические и тривиальные названия вещества
Необходимо разобраться в многообразии терминов, относящихся к одному и тому же соединению. Официальное название соединения, химический состав которого отражает формула SO2, — диоксид серы. ИЮПАК рекомендует использовать этот термин и его английский аналог — Sulfur dioxide. Учебники для школ и ВУЗов чаще упоминают еще такое название — оксид серы (IV). Римской цифрой в скобках обозначена валентность атома S. Кислород в этом оксиде двухвалентен, а окислительное число серы +4. В технической литературе используются такие устаревшие термины, как сернистый газ, ангидрид сернистой кислоты (продукт ее дегидратации).
Состав и особенности молекулярного строения SO2
Молекула SO2 образована одним атомом серы и двумя атомами кислорода. Между ковалентными связями имеется угол, составляющий 120°. В атоме серы происходит sp2-гибридизация — выравниваются по форме и энергии облака одного s и двух p-электронов. Именно они участвуют в образовании ковалентной связи между серой и кислородом. В паре О—S расстояние между атомами составляет 0,143 нм. Кислород более электроотрицательный элемент, чем сера, значит, связывающие пары электронов смещаются от центра к внешним углам. Вся молекула тоже поляризована, отрицательный полюс — атомы О, положительный — атом S.
Некоторые физические параметры диоксида серы
Оксид четырехвалентной серы при обычных показателях окружающей среды сохраняет газообразное агрегатное состояние. Формула сернистого газа позволяет определить его относительную молекулярную и молярную массы: Mr(SO2) = 64,066, М = 64,066 г/моль (можно округлять до 64 г/моль). Этот газ почти в 2,3 раза тяжелее воздуха (М(возд.) = 29 г/моль). Диоксид обладает резким специфическим запахом горящей серы, который трудно перепутать с каким-либо другим. Он неприятный, раздражает слизистые покровы глаз, вызывает кашель. Но оксид серы (IV) не такой ядовитый, как сероводород.
Под давлением при комнатной температуре газообразный сернистый ангидрид сжижается. При низких температурах вещество находится в твердом состоянии, плавится при –72…–75,5 °C. При дальнейшем повышении температуры появляется жидкость, а при –10,1 °C вновь образуется газ. Молекулы SO2 являются термически устойчивыми, разложение на атомарную серу и молекулярный кислород происходит при очень высоких температурах (около 2800 ºС).
Растворимость и взаимодействие с водой
Диоксид серы при растворении в воде частично взаимодействует с ней с образованием очень слабой сернистой кислоты. В момент получения она тут же разлагается на ангидрид и воду: SO2 + Н2О ↔ Н2SO3. На самом деле в растворе присутствует не сернистая кислота, а гидратированные молекулы SO2. Газообразный диоксид лучше взаимодействует с прохладной водой, его растворимость понижается с повышением температуры. При обычных условиях может раствориться в 1 объеме воды до 40 объемов газа.
Сернистый газ в природе
Значительные объемы диоксида серы выделяются с вулканическими газами и лавой во время извержений. Многие виды антропогенной деятельности тоже приводят к повышению концентрации SO2 в атмосфере.
Сернистый ангидрид поставляют в воздух металлургические комбинаты, где не улавливаются отходящие газы при обжиге руды. Многие виды топливных ископаемых содержат серу, в результате значительные объемы диоксида серы выделяется в атмосферный воздух при сжигании угля, нефти, газа, полученного из них горючего. Сернистый ангидрид становится токсичным для человека при концентрации в воздухе свыше 0,03 %. У человека начинается одышка, могут наступить явления, напоминающие бронхит и воспаление легких. Очень высокая концентрация в атмосфере диоксида серы может привести к сильному отравлению или летальному исходу.
Сернистый газ — получение в лаборатории и в промышленности
Лабораторные способы:
- При сжигании серы в колбе с кислородом или воздухом получается диоксид по формуле: S + O2 = SO2.
- Можно подействовать на соли сернистой кислоты более сильными неорганическими кислотами, лучше взять соляную, но можно разбавленную серную:
- Na2SO3 + 2HCl = 2NaCl + H2SO3;
- Na2SO3 + H2SO4 (разб.) = Na2SO4 + H2SO3;
- H2SO3 = Н2О + SO2↑.
3. При взаимодействии меди с концентрированной серной кислотой выделяется не водород, а диоксид серы:
2H2SO4 (конц.) + Cu = CuSO4 + 2H2O + SO2↑.
Современные способы промышленного производства сернистого ангидрида:
- Окисления природной серы при ее сжигании в специальных топках: S + О2 = SO2.
- Обжиг железного колчедана (пирита).
Основные химические свойства диоксида серы
Сернистый газ является активным соединением в химическом плане. В окислительно-восстановительных процессах это вещество чаще выступает в качестве восстановителя. Например, при взаимодействии молекулярного брома с диоксидом серы продуктами реакции являются серная кислота и бромоводород. Окислительные свойства SO2 проявляются, если пропускать этот газ через сероводородную воду. В результате выделяется сера, происходит самоокисление-самовосстановление: SO2 + 2H2S = 3S + 2H2O.
Диоксид серы проявляет кислотные свойства. Ему соответствует одна из самых слабых и неустойчивых кислот — сернистая. Это соединение в чистом виде не существует, обнаружить кислотные свойства раствора диоксида серы можно с помощью индикаторов (лакмус розовеет). Сернистая кислота дает средние соли — сульфиты и кислые — гидросульфиты. Среди них встречаются стабильные соединения.
Процесс окисления серы в диоксиде до шестивалентного состояния в ангидриде серной кислоты — каталитический. Получившееся вещество энергично растворяется в воде, реагирует с молекулами Н2О. Реакция является экзотермической, образуется серная кислота, вернее, ее гидратированная форма.
Практическое использование сернистого газа
Основной способ промышленного производства серной кислоты, для которого нужен диоксид элемента, насчитывает четыре стадии:
- Получение сернистого ангидрида при сжигании серы в особых печах.
- Очищение полученного диоксида серы от всевозможных примесей.
- Дальнейшее окисление до шестивалентной серы в присутствии катализатора.
- Абсорбция триоксида серы водой.
Ранее почти всю двуокись серы, необходимую для производства серной кислоты в промышленных масштабах, получали при обжиге пирита как побочный продукт сталеплавильного производства. Новые виды переработки металлургического сырья меньше используют сжигание руды. Поэтому основным исходным веществом для сернокислотного производства в последние годы стала природная сера. Значительные мировые запасы этого сырья, его доступность позволяют организовать широкомасштабную переработку.
Диоксид серы находит широкое применение не только в химической промышленности, но и в других отраслях экономики. Текстильные комбинаты используют это вещество и продукты его химического взаимодействия для отбеливания шелковых и шерстяных тканей. Это один из видов бесхлорного отбеливания, при котором волокна не разрушаются.
Диоксид серы обладает отличными дезинфицирующими свойствами, что находит применение в борьбе с грибками и бактериями. Сернистым ангидридом окуривают хранилища сельскохозяйственной продукции, винные бочки и подвалы. Используется SO2 в пищевой промышленности как консервирующее и антибактериальное вещество. Добавляют его в сиропы, вымачивают в нем свежие плоды. Сульфитизация
сока сахарной свеклы обесцвечивает и обеззараживает сырье. Консервированные овощные пюре и соки тоже содержат диоксид серы в качестве антиокислительного и консервирующего агента.
Оксид серы (сернистый газ, серы диоксид, ангидрид сернистый) — это бесцветный газ, имеющий в в нормальных условиях резкий характерный запах (похож на запах загорающейся спички). Сжижается под давлением при комнатной температуре. Сернистый газ растворим в воде, при этом образуется нестойкая серная кислота. Также это вещество растворяется в серной кислоте и этаноле. Это один из основных компонентов, входящих в состав вулканических газов.
Как получают сернистый газ
Получение SO2 — диоксида серы — промышленным способом заключается в сжигании серы или обжиге сульфидов (используется в основном пирит).
4FeS2 (пирит) + 11O2 = 2Fe2O3 (оксид железа) + 8SO2 (сернистый газ).
В условиях лаборатории сернистый газ можно получить путем воздействия сильных кислот на гидросульфиты и сульфиты. При этом получившаяся сернистая кислота сразу распадается на воду и сернистый газ. Например:
Na2SO3 (сульфит натрия) + H2SO4 (серная кислота) = Na2SO4 (сульфат натрия) + H2SO3 (сернистая кислота). H2SO3 (сернистая кислота) = H2O (вода) + SO2 (сернистый газ).
Третий способ получения сернистого ангидрида заключается в воздействии концентрированной серной кислоты при нагревании на малоактивные металлы. Например: Cu (медь) + 2H2SO4 (серная кислота) = CuSO4 (сульфат меди) + SO2 (диоксид серы) + 2H2O (вода).
Химические свойства диоксида серы
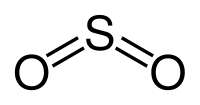
Формула сернистого газа — SO2. Это вещество относится к кислотный оксидам.
1. Диоксид серы растворяется в воде, при этом образуется сернистая кислота. В обычных условиях данная реакция обратима.
SO2 (диоксид серы) + H2O (вода) = H2SO3 (сернистая кислота).
2. С щелочами диоксид серы образует сульфиты. Например: 2NaOH (гидроксид натрия) + SO2 (сернистый газ) = Na2SO3 (сульфит натрия) + H2O (вода).
3. Химическая активность сернистого газа достаточно велика. Наиболее выражены восстановительные свойства сернистого ангидрида. В таких реакциях степень окисления серы повышается. Например: 1) SO2 (диоксид серы) + Br2 (бром) + 2H2O (вода) = H2SO4 (серная кислота) + 2HBr (бромоводород); 2) 2SO2 (диоксид серы) + O2 (кислород) = 2SO3 (сульфит); 3) 5SO2 (диоксид серы) + 2KMnO4 (перманганат калия) + 2H2O (вода) = 2H2SO4 (серная кислота) + 2MnSO4 (сульфат марганца) + K2SO4 (сульфат калия).
Последняя реакция — это пример качественной реакции на SO2 и SO3. Происходит обесцвечивание раствора фиолетового цвета).
4. В условиях присутствия сильных восстановителей сернистый ангидрид может проявлять свойства окислительные. Например, для того чтобы в металлургической промышленности извлечь серу из отходящих газов, используют восстановление диоксида серы оксидом углерода (CO): SO2 (диоксид серы) + 2CO (оксид углерода) = 2CO2 (диоксид углерода) + S (сера).
Также окислительные свойства этого вещества используют в целях получения фосфорноваристой ксилоты: PH3 (фосфин) + SO2 (сернистый газ) = H3PO2 (фосфорноваристая кислота) + S (сера).
Где применяют сернистый газ
В основном диоксид серы используют для получения кислоты серной. Также его применяют как консервант (Е-220) в производстве слабоалкогольных напитков (вино и другие напитки средней ценовой категории). Благодаря свойству этого газа убивать различные микроорганизмы, им окуривают складские помещения и овощехранилища. Помимо этого, оксид серы используют для отбеливания шерсти, шелка, соломы (тех материалов, которые нельзя отбелить хлором). В лабораториях сернистый газ применяют в качестве растворителя и в целях получения различных солей кислоты сернистой.
Физиологическое воздействие
Сернистый газ обладает сильными токсическими свойствами. Симптомы отравления — это кашель, насморк, охриплость голоса, своеобразный привкус во рту, сильное першение в горле. При вдыхании диоксида серы в высоких концентрациях возникает затруднение глотания и удушье, расстройство речи, тошнота и рвота, возможно развитие острого отека легких.
ПДК сернистого газа: — в помещении — 10 мг/м³; — среднесуточная максимально-разовая в атмосферном воздухе — 0,05 мг/м³.
Чувствительность к диоксиду серы у отдельных людей, растений и животных различна. Например, среди деревьев наиболее устойчивы дуб и береза, а наименее — ель и сосна.
- СЕРНИСТЫЙ ГАЗ
-
СЕРНИСТЫЙ ГАЗ (сернистый ангидрид, двуокись серы) (SO2), бесцветный токсичный газ с резким запахом. Применяется в производстве СЕРНОЙ КИСЛОТЫ, а также в качестве хладагента, отбеливателя и консерванта. Свойства: температура плавления -75,5 °С, температура кипения -10,0 °С; плотность 2,2 (плотность воздуха равна 1).
Научно-технический энциклопедический словарь.
Смотреть что такое «СЕРНИСТЫЙ ГАЗ» в других словарях:
-
СЕРНИСТЫЙ ГАЗ — СЕРНИСТЫЙ ГАЗ, сернистый ангидрид, S02, бесцветный газ с резким раздражающим запахом, уд. в. 2,23. Находит применение в промышленности для беления различных продуктов: сукна, шелка, бумажной массы, перьев, соломы, воска, щетины, конского волоса,… … Большая медицинская энциклопедия
-
СЕРНИСТЫЙ ГАЗ — СЕРНИСТЫЙ ГАЗ … Большая политехническая энциклопедия
-
сернистый газ — Газ, содержащий органические сернистые соединения, которые имеют склонность вызывать коррозию металлического оборудования, с которым он контактирует при нормальных условиях переработки. [СТ РК ИСО 1998 1 2004 (ИСО 1998 1:1998, IDT)] Тематики… … Справочник технического переводчика
-
сернистый газ — sieringosios dujos statusas T sritis chemija apibrėžtis Dujos, turinčios metalų koroziją sukeliančių sieros junginių. atitikmenys: angl. sour gas rus. высокосернистый газ; кислый газ; сернистый газ … Chemijos terminų aiškinamasis žodynas
-
сернистый газ — sieros(IV) oksidas statusas T sritis chemija formulė SO₂ atitikmenys: angl. sulfur dioxide; sulfur(IV) oxide rus. сернистый ангидрид; сернистый газ; серы двуокись; серы диоксид; серы(IV) оксид ryšiai: sinonimas – sieros dioksidas … Chemijos terminų aiškinamasis žodynas
-
Сернистый газ — сернистый ангидрид (см.) … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
-
СЕРНИСТЫЙ ГАЗ — сернистый ангидрид, получается при горении серы; удушлив, растворяется в воде. Применяется для обеззараживания незагруженных (во избежание порчи зерна и муки) зернохранилищ и др. помещений от вредных насекомых и грызунов. Расходуется в количестве … Сельскохозяйственный словарь-справочник
-
сернистый газ — сернистый ангидрид, двуокись серы … Cловарь химических синонимов I
-
Сернистый газ — SO2, то же, что Сернистый ангидрид … Большая советская энциклопедия
-
СЕРНИСТЫЙ ГАЗ — см. Серы диоксид … Большой энциклопедический политехнический словарь

- СЕРНИСТЫЙ ГАЗ
-
= сернистый ангидрид (см.).
Брокгауз и Ефрон.
Энциклопедия Брокгауза и Ефрона.
2012
СЕРНИСТЫЙ ГАЗ
- СЕРНИСТЫЙ ГАЗ
- СЕРНИСТЫЙ ГАЗ, сернистый ангидрид, S02,~ бесцветный газ с резким раздражающим запахом, уд. в. 2,23. Находит применение в промышленности для беления различных продуктов: сукна, шелка, бумажной массы, перьев, соломы, воска, щетины, конского волоса, пищевых продуктов, для дезинфекции фруктов и консервов и т. д. В качестве побочного продукта С. г. образуется и выделяется в воздух рабочих помещений в ряде производств: серной к-ты, целлюлезы, при обжиге руд, содержащих, сернистые металлы, в травилках на металлозаводах, при производстве стекла, ультрамарина и др., весьма часто С. г. содержится в воздухе котельных и зольных помещений, где он образуется при сжигании содержащих серу углей. Данных относительно содержания S02 в воздухе рабочих помещений собрано довольно» много; количества его колеблются в широких пределах—от 0,01 до 0,3 мг на 1 л воздуха. В котельных Московской области обнаружены количества от 0,001 до 0,04 мг, в кузницах— от 0,014 до 0,05—0,1 мг; при холодной вулканизации найдены гораздо большие количества— 0,4—0,5 мг. Отравления С. г. в производственных условиях обычно носят характер легких, тяжелые отравления встречаются редко._ В СССР за годы 1924—29 зарегистрировано* 82© 472 случая как с потерей,, так и без потери трудоспособности, при этом следует учесть то обстоятельство, что в 1924/25 г. произошло совершенно случайное, не связанное с производством отравление 296 человек; в остальные годы число случаев составляло 35, 50, 75, 9. Основные причины отравлений—несчастные •случаи или плохое состояние аппаратуры. Сущность действия С. г. сводится к действию серной к-ты, т. к. SO2 при соприкосновении с влажными тканями превращается в сернистую, а, затем в серную к-ту. Благодаря своей сильной растворимости в воде S02 улавливается и следовательно оказывает основное действие на верхние дыхательные пути. Экспериментальные исследования, проведенные в Украинском ин-те патологии и гигиены труда, показали, что при остром отравлении у животных получаются резкие изменения по всему дыхательному тракту, причем особенно резко они выражены в трахее и бронхах. При хрон. отравлении (0,5 мг[л) развивается небольшой катаральный бронхит и бронхиолит. У людей непривычных концентрации С. г. 0,06 мгл воздуха настолько раздражают дыхательные пути», что пребывание в течение больше х/г—1 часа становится невозможным. У работающих постоянно в атмосфере С. г. наступает привыкание и они переносят в течение многих часов концентрации 0,1—0,2 мг на 1 л воздуха. В качестве предельно допустимой концентрации S02 в воздухе рабочих помещений НКТ СССР установил 0,02 мг/л, в исключительных случаях при кратковременном пребывании в атмосфере С. г.—0,04 мг/л. Симптомы воздействия С. г. выражаются в чихании, кашле, спазме голосовой щели, что вынуждает рабочих оставлять помещение, и этим предупреждается общее действие газов, ограничивающееся гл. обр. верхними дыхательными путями. В редких тяжелых случаях может развиться воспаление бронхов и даже -отек легких. Аналогично S02 действуют пары дымящей серной кислоты, к-рые наряду с S02 •содержат серный ангидрид S03. При вдыхании этих паров в значительной концентрации могут развиться явления более резкие, чем вышеописанные, а именно—глубокие бронхиты, отеки гортани, бронхопневмонии, в очень тяжелых •случаях отек легких. Легочные осложнения обычно развиваются не сразу, а спустя 1—2 дня после вдыхания паров. Длительное вдыхание паров дымящейся серной к-ты может вести к развитию хрон. бронхитов и конъюнктивитов.—В деле профилактики отравлений С. г. основное значение имеют полная герметизация аппаратуры и наблюдение за исправным ее состоянием; при невозможности предупредить выделение С. г. в воздух необходимы вытяжные установки непосредственно над местом выделения газов (напр. травилки) или устройство общей вентиляции, дающей возможность довести концентрацию газа в воздухе до установленных величин. Большое значение имеет рационализация производственного процесса: в травилках напр. прибавление к раствору серной к-ты и т. н. присадков (различных веществ, ускоряющих производственный процесс и одновременно уменьшающих выделение в воздух капелек и паров травильных жидкостей) резко уменьшает выделение в воздух S02. Процессы беления, часто проводимые до сих пор примитивным путем «(окуриванием), должны быть рационализиро- ваны.—Л е ч е н и е при острых отравлениях, как при отравлении другими раздражающими газами,—немедленное удаление из отравленной атмосферы, вдыхание кислорода, возбуждающие Средства И Т. Д. н. Розенбаум. Открытие в судебных случаях и определение при проф. отравления х. При исследовании внутренностей, копченого мяса, консервов и т. д. их помещают в колбу, заткнутую пробкой с двумя трубками. Одна из них соединена с аппаратом Киппа для выделения угольного ангидрида, другая с приемниками для поглощения сернистого ангидрида. Последние содержат раствор иода в присутствии йодистого калия. По вытеснении сернистого ангидрида угольным ангидридом жидкость из приемников кипятят до удаления иода, и в растворе открывают и количественно определяют серную к-ту. При другой вариации способа сернистый ангидрид вытесняют в раствор хлорноватокалиевой соли (бертолетовой соли) и определяют количество иона, получающегося восстановлением ионахлорноватой к-ты. Для открытия и количественного определения сернистого ангидрида в воздухе определенный объем последнего протягивается через поглотители (см. Яды, изолирование) раствором бертолетовой соли и определяется количество иона хлора титрованием азотнокислым серебром или нефелометрически, переведением в хлористое серебро. Лит.: Труды Украинского ин-та патологии и гигиены труда, вып. 6, Харьков, 19 28 (статьи И. Милынтейна, Кленевского и Пейсаховича). СЕРНОВОДСК—Самарский (в отличие от С. Кавказского), иначе Сергиевские Минеральные воды, серно-грязевой курорт в Бугурусланском районе Средневолжского края, в V/% %м от ст. Серные Воды Самаро-Златоуст. ж. д., на ветке Самара—Кротовка—Сургут. Курорт расположен на склоне большого горного плато (из отрогов Уральского хребта), у линии перехода его в долину живописной речки Сургут. Климат курорта умеренно-континентальный. Средняя t° воздуха в мае +15,1°, в июне + 21, 2°, в июле + + 19,5°, в августе + 17,5°, в сентябре + 14°. В эти месяцы преобладают теплые юго-восточные ветры. Хорошая инсоляция, сухость воздуха, незначительная относительная влажность создают весьма благоприятные условия для бальнеотерапии. Основные богатства курорта заключаются в 4 серных источниках, вытекающих из массива плато (известняк, гипс, доломиты) и образующих искусственное серное («фисташковое») озеро.. Лечебногрязевое хозяйство невелико. Общий дебит серных источников составляет ок. 56 тыс. гл в сутки. Источники холодные. По своему хим. составу они принадлежат к сероводородно-сульфидно-землистым водам. По содержанию свободного сероводорода Сергиевские Минводы (0,080 г свободного H2S на 1 л) относятся к типу Мацестинских. Грязь серного озера и отводящих рукавов представляет собой пластичную илистую массу черного цвета с довольно резким запахом H2S. Есть ванное здание (60 ванн) для горных ванн и грязелечебница. Следует отметить слабое пока еще техническое оборудование курорта. С 1932 года открыто новое здание поликлиники и рентген, кабинет. Больные размещаются в санаториях, пансионатах и общежитиях. Сан. состояние курорта и сан .-горная охрана оставляют желать лучшего. Показания: б-ни органов движения, страдания периферической нерв- ной системы, гинекологические и андрологи- i ческие воспалительные заболевания с характером выпотов и инфильтратов, флебиты и тромбофлебиты, хрон. интоксикации свинцом и ртутью, гуммозный сифилис и невролюес, различные формы экземы, чешуйчатый лишай, себорея и пр. Налаживается лечение б-ней обмена—подагры и ожирения, а с 1932 г. курорт ставит себе задачей использование серных ванн для лечения сердечно-сосудистых заболеваний по типу Мацесты. С 1930 г. курорт открыт круглый год, но в полностью развернутом виде он функционирует обычно с 1/VІ по 15/IХ. Лит.: Лившиц Т.,К вопросу об изменении морфологии крови под влиянием серно-грязевых процедур, Учен, записки Казанск. гос. ун-та, т. LХХХVІI, кн. 1, 19.27; о н ж е, О реакции сердечно-сосудистой системы на серно-грязевые процедуры, ibid., т. LХХХVІ, кн. 1, 1926; Николаев П., Как меняется решим сердечнососудистой системы под влиянием серно-грязевых баль-нео-процедур, Врач, дело, 1925, № 10—И; Шулпй-нов С, К вопросу о содержании свободного H2S в воде курорта Серноводска Самарской губ., Кур. дело, 1928, №6. П. Николаев.
Большая медицинская энциклопедия.
1970.
Полезное
Смотреть что такое «СЕРНИСТЫЙ ГАЗ» в других словарях:
-
СЕРНИСТЫЙ ГАЗ — (сернистый ангидрид, двуокись серы) (SO2), бесцветный токсичный газ с резким запахом. Применяется в производстве СЕРНОЙ КИСЛОТЫ, а также в качестве хладагента, отбеливателя и консерванта. Свойства: температура плавления 75,5 °С, температура… … Научно-технический энциклопедический словарь
-
СЕРНИСТЫЙ ГАЗ — СЕРНИСТЫЙ ГАЗ … Большая политехническая энциклопедия
-
сернистый газ — Газ, содержащий органические сернистые соединения, которые имеют склонность вызывать коррозию металлического оборудования, с которым он контактирует при нормальных условиях переработки. [СТ РК ИСО 1998 1 2004 (ИСО 1998 1:1998, IDT)] Тематики… … Справочник технического переводчика
-
сернистый газ — sieringosios dujos statusas T sritis chemija apibrėžtis Dujos, turinčios metalų koroziją sukeliančių sieros junginių. atitikmenys: angl. sour gas rus. высокосернистый газ; кислый газ; сернистый газ … Chemijos terminų aiškinamasis žodynas
-
сернистый газ — sieros(IV) oksidas statusas T sritis chemija formulė SO₂ atitikmenys: angl. sulfur dioxide; sulfur(IV) oxide rus. сернистый ангидрид; сернистый газ; серы двуокись; серы диоксид; серы(IV) оксид ryšiai: sinonimas – sieros dioksidas … Chemijos terminų aiškinamasis žodynas
-
Сернистый газ — сернистый ангидрид (см.) … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
-
СЕРНИСТЫЙ ГАЗ — сернистый ангидрид, получается при горении серы; удушлив, растворяется в воде. Применяется для обеззараживания незагруженных (во избежание порчи зерна и муки) зернохранилищ и др. помещений от вредных насекомых и грызунов. Расходуется в количестве … Сельскохозяйственный словарь-справочник
-
сернистый газ — сернистый ангидрид, двуокись серы … Cловарь химических синонимов I
-
Сернистый газ — SO2, то же, что Сернистый ангидрид … Большая советская энциклопедия
-
СЕРНИСТЫЙ ГАЗ — см. Серы диоксид … Большой энциклопедический политехнический словарь
Сернистый газ. Сернистая кислота и её соли
I. Cернистый ангидрид; сернистый газ, оксид серы (IV) SO2
1. Физические свойства
Бесцветный газ с резким запахом; хорошо растворим в воде (в 1V H2O растворяется 40VSO2 при н.у.); более чем в два раза тяжелее воздуха, ядовит; t°пл. = -75,5°C; t°кип. = -10°С.
Обесцвечивает многие красители, убивает микроорганизмы.
2. Получение
1) При сжигании серы в кислороде: S + O2 → SO2
2) Окислением сульфидов: 4FeS2 + 11O2 → 2Fe2O3 + 8SO2
3) Обработкой солей сернистой кислоты минеральными кислотами: Na2SO3 + 2HCl → 2NaCl + SO2 + H2O
4) При окислении металлов концентрированной серной кислотой: Cu + 2H2SO4(конц) → CuSO4 + SO2 + 2H2O
3. Химические свойства
1) Реакции окисления, SO2 — восстановитель (S+4 – 2ē → S+6)
2 SO2 + O2 → 2 SO3 (катализатор – V2O5)
SO2 + Br2 + 2H2O → H2SO4 + 2HBr
5SO2 + 2KMnO4 + 2H2O → K2SO4 + 2MnSO4 + 2H2SO4
2) Реакции восстановления, SO2 — окислитель (S+4 + 4ē → S0)
SO2 + С → S + СO2 (при нагревании)
SO2 + 2H2S → 3S + 2H2O
3) Сернистый ангидрид — кислотный оксид: взаимодействие с водой
При растворении в воде образуется слабая и неустойчивая сернистая кислота H2SO3 (существует только в водном растворе)
Видео — эксперимент «Получение сернистой кислоты»
SO2 + H2O ↔ H2SO3
Видео: «Получение оксида серы (IV) и сернистой кислоты»
II. Сернистая кислота и ее соли
1. Сернистая кислота — неустойчивая двухосновная неорганическая кислота средней силы. Отвечает степени окисления серы +4. Химическая формула 
2. Химические свойства
1) Сернистая кислота диссоциирует ступенчато:
H2SO3 ↔ H+ + HSO3— (первая ступень, образуется гидросульфит – анион)
HSO3— ↔ H+ + SO32- (вторая ступень, образуется анион сульфит)
H2SO3 образует два ряда солей — средние (сульфиты) и кислые (гидросульфиты).
Качественной реакцией на соли сернистой кислоты является взаимодействие соли с сильной кислотой, при этом выделяется газ SO2 с резким запахом:
Na2SO3 + 2HCl → 2NaCl + SO2 ↑+ H2O
2H+ + SO32- → SO2 ↑+ H2O
2) Раствор сернистой кислоты H2SO3 обладает восстановительными свойствами. Сернистая кислота взаимодействует с раствором йода, обесцвечивая его. При этом образуются йодоводородная и серная кислоты.
Опыт: “Свойства сернистой кислоты”
H2SO3 + I2 + H2O = H2SO4 + 2НI
3) Как и все кислоты, сернистая кислота меняет цвет растворов индикаторов. Метиловый оранжевый в растворе кислоты становится красным. В старину дамские соломенные шляпки отбеливали сернистой кислотой. Раствор сернистой кислоты отбеливает ткани из растительного материала, шерсти, шелка. Видео: «Свойства сернистой кислоты»
4) Взаимодействие со щелочами
Ba(OH)2 + SO2 → BaSO3↓(сульфит бария) + H2O
Ba(OH)2 + 2SO2 (избыток)→ Ba(HSO3)2(гидросульфит бария)
5) Взаимодействие с основными оксидами: SO2 + CaO = CaSO3
6) Водные растворы сульфитов щелочных металлов окисляются на воздухе:
2Na2SO3 + O2 → 2Na2SO4
2SO32- + O2 → 2SO42-
III. Задания для закрепления
Задание №1 Закончите уравнения химических реакций, составьте электронный баланс, укажите процессы окисления и восстановления, окислитель и восстановитель:
SO2 + Br2 + H2O→
PbS + O2 →
Задание №2 Осуществите превращения по схемам. Уравнения реакций ионного обмена напишите в полном и кратком ионном виде.
S → H2S → SO2 → Na2SO3 → BaSO3 → SO2
SO2 + Br2,H2O →А→Na2SO4→BaSO4
FeS2 → SO2→Na2SO3 +HCl→A+ O2→B→H2SO4
SO2 +KMnO4,H2O →A+ BaCl2→B
SO2→S→K2S→H2S→PbS→SO2
H2SO3 +I2→A+Cu→B+NaOH→C
K2SO3→SO2→MgSO3→SO2→KHSO3→SO2
ЦОРы
Видео — эксперимент «Получение сернистой кислоты»
Опыт: “Свойства сернистой кислоты”
-
У этого термина существуют и другие значения, см. Оксид серы.
Серни́стый газ (окси́д се́ры (IV), диокси́д се́ры, двуокись серы, серни́стый ангидри́д) — соединение серы с кислородом состава SO2. В нормальных условиях представляет собой бесцветный газ с характерным резким запахом (загорающейся спички). Растворяется в воде с образованием нестойкой сернистой кислоты. Растворяется также в этаноле и се́рной кислоте. Под давлением сжижается уже при комнатной температуре.
Сернистый газ — один из главных компонентов вулканических газов. В высоких концентрациях имеет раздражающее действие, токсичен, вызывает насморк, кашель, охриплость, сильное першение в горле и характерный привкус. При вдыхании сернистого газа более высокой концентрации — удушье, расстройство речи, затруднение глотания, рвота, возможен острый отёк лёгких.
Тем не менее, сернистый газ широко используется в пищевой промышленности в качестве консерванта Е220. Он убивает микроорганизмы, поэтому им окуривают овощехранилища и склады, а также используют для отбеливания соломы, шёлка и шерсти, то есть материалов, которые нельзя отбеливать хлором.
Сернистый газ в афоризмах и кратких цитатах[править]
|
|
Ни удушливые газы, ни сернистый дым, ни зола, взвеваемая ветром, не могли остановить меня.[1] |
|
|
…ныне давно небывавшая гостья в Сибири ― холера ― унесла много жертв из населения, не побоявшись и сернистых ядовитых газов.[2] |
| — Александр Черкасов, «На Алтае: Записки городского головы», 1884 |
|
|
― Вот что я придумал, ― заявил Каштанов: ― нужно отравить или оглушить муравьёв <…> сернистым газом.[3] |
| — Владимир Обручев, «Плутония», 1924 |
|
|
Известно, что серная кислота получается окислением сернистого ангидрида SO2 в серный ангидрид SO3 с последующим присоединением воды.[5] |
| — Б. Казаков, Е. Грузинов, «Четырежды открытый». Элемент № 23: ванадий, 1969 |
|
|
Большой интерес вызвал вопрос, что же «выплевывают» вулканы Ио? Приборы «Вояджера-1» уверенно назвали только двуокись серы.[7] |
| — Борис Силкин, «Странный мир Ио», 1982 |
|
|
Попробуем представить себе артезианский колодец, в котором вместо воды — сера и её двуокись.[7] |
| — Борис Силкин, «Странный мир Ио», 1982 |
|
|
на «вояджеровских» снимках отчетливо различимы и эскарпы, и сопутствующие им яркие и темные потоки всех описанных выше форм и очертаний, и области, засыпанные слоями «сернистокислого» снега.[7] |
| — Борис Силкин, «Странный мир Ио», 1982 |
|
|
Общий объем поступлений сернистого газа, или диоксида серы (S02), в атмосферу Земли в разных источниках обычно оценивается от 100 млн. до 150 млн. т. в год.[8] |
| — Владимир Максаковский. «Географическая картина мира» (Книга I. Общая характеристика мира), 2003 |
|
|
Диоксид серы и оксиды азота в воздухе соединяются с парами воды, концентрируясь в первую очередь у основания облаков. Затем вместе с дождями (туманами) они выпадают на землю…[8] |
| — Владимир Максаковский. «Географическая картина мира» (Книга I. Общая характеристика мира), 2003 |
|
|
Одна из главных загадок ― наличие в атмосфере планеты <Венеры> значительных количеств двуокиси серы SO2. Из малых составляющих атмосферы этот газ наиболее обилен, что противоречит результатам химических моделей…[9] |
| — Дмитрий Титов, ««Венера-Экспресс» — первая европейская миссия к планете Венера», 2006 |
Сернистый газ в научной и научно-популярной прозе[править]
|
|
В пестролистных растениях цвет зависит от присутствия в соке клеточек ярких растворов, которые маскируют, скрывают зеленые зерна хлорофилла, но под микроскопом эти зерна нетрудно обнаружить. Еще легче обнаружить их следующим образом: стоит обмакнуть красный или почти чёрный лист какого-нибудь Coleus или другого пестролистного растения в слабый раствор сернистой кислоты, и он тотчас позеленеет. Это зависит от того, что сернистая кислота, обесцвечивая красный раствор, не действует на хлорофилл.[10] |
| — Климент Тимирязев, «Растение как источник силы», 1875 |
|
|
Изучая автоускоряющуюся медленную реакцию окисления сероводорода H2S, Эмануэль, Павлов и я в этом году показали, что продуктами этой давно известной реакции является не только SO2 (сернистый газ) и Н2O, но в весьма значительных количествах появляется и такой «экзотический» продукт, как SO. В первых стадиях реакции SO появляется в очень большом количестве, достигая 7% от исходного вещества и до 40% от превращенного к этому моменту H2S, и лишь в конечных стадиях SO исчезает, переходя в SO2. |
| — Николай Семёнов, «Теория цепных реакций», 1940 |
|
|
Диоксид серы хорошо растворяется в воде (около 40 объемов в 1 объеме воды при 20°С); при этом частично происходит реакция с водой и образуется сернистая кислота: |
| — Николай Глинка, «Общая химия», 1950-е |
|
|
Молекула SO2 построена аналогично молекуле озона. Ядра составляющих ее атомов образуют равнобедренный треугольник. <…> |
| — Николай Глинка, «Общая химия», 1950-е |
|
|
Контактный способ производства серной кислоты применяется в промышленности с 1875 года. В печи сжигается пирит ― самое дешевое пока сырье ― или сера. Образующийся сернистый газ последовательно проходит через несколько очистительных башен 2 и электрофильтров, в которых из него удаляются твердые частицы. Для еще лучшей очистки от пыли газ промывается в башне водой и сушится серной кислотой в следующей башне. От мышьяковистых соединений сернистый газ очищается в камере и затем поступает в подогреватель, где смешивается с воздухом. Температура смеси ― 400-500°C. После подогрева смесь направляется в контактный аппарат. Здесь она проходит через слой так называемой контактной массы, в состав которой входят 4-6% катализатора. SO2 взаимодействует с кислородом и превращается в SO3. Серный ангидрид улавливается концентрированной серной кислотой в поглотительной башне, и насыщенная серным ангидридом «дымящаяся» серная кислота (олеум) стекает в сборники, а оттуда идёт на склад.[13] |
| — Михайлов Г., Казбек-Казиев В., «Серная кислота», 1967 |
|
|
Таким образом, в основе процесса лежат отщепление одного атома кислорода от молекулы NO2, окисление этим кислородом сернистого ангидрида, окисление NO снова до NO2 и его повторное использование. Какой из описанных способов лучше? Безусловно, контактный. Нитрозным способом получают 75-78%-ную кислоту, а контактным ― купоросное масло (92-94% H2SO4) и олеум (100%-ная кислота, насыщенная серным ангидридом). Доля контактной серной кислоты в общем объеме сернокислотного производства непрерывно возрастает.[13] |
| — Михайлов Г., Казбек-Казиев В., «Серная кислота», 1967 |
|
|
…в начале первой мировой войны химикам вновь пришлось обратиться к элементу №23. В эти годы сражающимся странам потребовались громадные количества серной кислоты. Ведь без неё невозможно получить нитроклетчатку ― основу боевых порохов. Известно, что серная кислота получается окислением сернистого ангидрида SO2 в серный ангидрид SO3 с последующим присоединением воды. Однако SO2 непосредственно с кислородом реагирует крайние медленно. Окисление сернистого ангидрида может происходить при восстановлении двуокиси азота (на этой реакции основан нитрозный способ производства серной кислоты), но более чистая и концентрированная кислота получается, если реакцию окисления SO2 в SO3 проводить в присутствии некоторых твёрдых катализаторов (контактный метод производства). Первым катализатором сернокислотного контактного производства была дорогостоящая платина. Её, естественно, не хватало, требовались заменители. Ими оказались пятиокись ванадия V2O5 и некоторые соли ванадиевых кислот, например Ag3VO4. Они почти с таким же успехом, как и платина, ускоряют окисление SO2 в SO3, но обходятся значительно дешевле, да и требуется их меньше. И главное, они не боятся контактных ядов, выводящих из строя платиновые катализаторы.[5] |
| — Б. Казаков, Е. Грузинов, «Четырежды открытый». Элемент № 23: ванадий, 1969 |
|
|
Большой интерес вызвал вопрос, что же «выплевывают» вулканы Ио? Приборы «Вояджера-1» уверенно назвали только двуокись серы. Подозрительно, например, полное отсутствие воды, ведь у нас на Земле вулканы извергают ее столько, что, по некоторым гипотезам, чуть ли не все моря и океаны обязаны им своим существованием. Может быть, Ио так долго и усердно извергала влагу из своих недр, что её запасы просто исчерпались?[7] |
| — Борис Силкин, «Странный мир Ио», 1982 |
|
|
Попробуем представить себе артезианский колодец, в котором вместо воды — сера и её двуокись. Найдя подходящую трещину или расселину, они, конечно, не преминут выбраться на белый свет, так что потоки серы и ее производных из недр здесь вполне в состоянии порождать уступы и ступени, простирающиеся на многие сотни километров.[7] |
| — Борис Силкин, «Странный мир Ио», 1982 |
|
|
А давление атмосферы на Ио, как мы знаем, очень низкое (около 10~2 Па), так что есть чему выбить пробку из этой космической бутылки — скорость выделения газов должна достигать 350 м/с. |
| — Борис Силкин, «Странный мир Ио», 1982 |
|
|
Монооксид серы является вторым по распространенности газом, наблюдаемым в атмосфере Ио, спутника Юпитера. Наземные наблюдения миллиметровых волн в среднем по полушарию дают соотношение SO/SO2 3-10% по объёму. Наблюдаемая численность согласуется с образованием SO в результате фотолиза <разложения воздействием света> SO2. С другой стороны, низкое давление Ио (~10-9 бар), неравномерная атмосфера SO2, по крайней мере частично, обусловлены вулканическим выделением газа <…>. Газообразный SO2 наблюдался в дымовых шлейфах извержений и над вулканически активными регионами <…>. В этой работе мы показываем, что высокотемпературные вулканические газы, выделяющиеся из магм, могут создавать наблюдаемое содержание SO в атмосфере Ио.[14] |
| — Михаил Золотов, Брюс Фигли, «Вулканическое образование монооксида серы (SO) на Ио», 1998 |
|
|
Общий объем поступлений сернистого газа, или диоксида серы (S02), в атмосферу Земли в разных источниках обычно оценивается от 100 млн. до 150 млн. т. в год, оксида азота ― около 100 млн т. С попаданием в атмосферу соединений серы, а также азота непосредственно связана становящаяся все более актуальной проблема так называемых кислотных (кислых) дождей. Механизм их образования очень прост. Диоксид серы и оксиды азота в воздухе соединяются с парами воды, концентрируясь в первую очередь у основания облаков. Затем вместе с дождями (туманами) они выпадают на землю фактически в виде разбавленных серной и азотной кислот. Такие осадки резко нарушают нормы кислотности почвы, ухудшают водообмен растений, способствуя высыханию лесов, особенно хвойных. Попадая в реки и озера, они угнетающе действуют на их фауну и флору, нередко приводя к полному уничтожению биологической жизни ― от рыб до микроорганизмов. Большой вред они наносят и различным конструкционным материалам, ускоряя коррозию металлов, разрушение исторических и архитектурных памятников.[8] |
| — Владимир Максаковский. «Географическая картина мира» (Книга I. Общая характеристика мира), 2003 |
|
|
Одна из главных загадок ― наличие в атмосфере планеты <Венеры> значительных количеств двуокиси серы SO2. Из малых составляющих атмосферы этот газ наиболее обилен, что противоречит результатам химических моделей, которые предсказывают быстрое связывание SO2 минералами поверхности. Его большое содержание может косвенно свидетельствовать о работе активных вулканов, которые постоянно пополняют запасы двуокиси серы в атмосфере, однако пока нет убедительного доказательства их наличия на планете.[9] |
| — Дмитрий Титов, ««Венера-Экспресс» — первая европейская миссия к планете Венера», 2006 |
Сернистый газ в публицистике и документальной прозе[править]
|
|
Но есть другие газы и пары, которые можно назвать ядовитыми, так как они непосредственно оказывают гибельное, токсическое действие на центральные органы нервной системы (мозг) или на кровь. В числе их следует упомянуть угольную кислоту, окись углерода, сероводород, сернистый углерод, сернистую кислоту, анилин, мышьяковистый водород, ртутные пары и т. д.[15] |
| — Фёдор Эрисман, «Профессиональная гигиена», 1908 |
|
|
Капиталистическая печать скупо и скромно сообщает о несчастных случаях с пешеходами и жильцами квартир, окна которых выходят на уличные магистрали. А ведь случаи отравления угарным газом улицы далеко не редки в таких городах, как Нью-Йорк или Чикаго. Воздух этих городов разрушает даже металл и камень! Из вытяжных труб химических заводов наружу вылетают сернистые и фтористые соединения, мышьяковистый водород и т. д.[16] |
| — Михаил Калинушкин, «Чистый воздух», 1951 |
|
|
Однако даже после обработки сока известью и углекислым газом в нем остается еще немало красящих веществ. Обесцветить сок полностью помогает сернистый ангидрид (SO2). Операция эта называется сульфитацией от латинского названия серы ― Sulfur. Сернистый ангидрид, растворяясь в воде, образует сернистую кислоту. Та окисляется в серную кислоту и выделяет свободный водород. В нем-то всё и дело! Водород связывает хромофоры ― цветообразующие группы окрашенных веществ, и сами вещества становятся бесцветными.[17] |
| — Израиль Вольпер, «Сахар: сладкий, горький, соленый», 1965 |
|
|
У кадмиевых покрытий есть еще одна любопытная особенность: в чистой атмосфере сельских местностей они обладают значительно большей коррозийной устойчивостью, чем в атмосфере промышленных районов. Особенно быстро такое покрытие выходит из строя, если в воздухе повышенное содержание сернистого или серного ангидридов.[18] |
| — Борис Горзев, «Ещё о кадмии», 1970 |
|
|
Чтобы воспрепятствовать проведению занятий, левые студенты прибегли к испытанному средству — химической обструкции. Для этого использовались разнообразные вещества во всех трёх состояних — жидком, твёрдом и газообразном. |
| — Яна Седова, «Октябрический режим», 2017 |
Сернистый газ в мемуарах, письмах и дневниковой прозе[править]
|
|
Сильный серный запах захватывает дыхание: кругом меня опять темно; резкий ветер, дующий здесь непрерывно, убедил меня, что вершина вулкана ― самое прохладное место в Неаполе. <…> Несколько секунд вулкан дрожал под моими ногами и снова все погрузилось во мрак; но глухое клокотание в жерле не умолкало и тяжело движущаяся лава разливала кругом себя красноватое зарево. Я чувствовал неодолимое влечение к этому грозному деятелю природы; мне хотелось заглянуть в лабораторию, где работают ее таинственные силы, я был от этой мастерской так недалеко… Ни удушливые газы, ни сернистый дым, ни зола, взвеваемая ветром, не могли остановить меня.[1] |
| — Константин Ушинский, «Детский мир», 1864 |
|
|
Надо заметить, что в Сузунском заводе много десятков тысяч сернистых руд обрабатывают в пожогах, так что в это время отделяется большое количество сернистой кислоты и нередко по всему селению пахнет тухлыми яйцами, а возгонная сера тонким желтоватым налетом садится поблизости пожогов, что в особенности заметно на дождевых лужах. От таких сернистых отделений поблизости завода не живут куры и пропадают вместе с некоторыми злаками, растущими в огородах. Вся медная посуда и серебряные вещи чернеют до того, что их трудно отчистить; по этому случаю пожоги по возможности делаются осенью и зимою.[2] |
| — Александр Черкасов, «На Алтае: Записки городского головы», 1884 |
|
|
Вследствие этого всегда говорили и думали, что жители Сузунского завода застрахованы от разных эпидемий, но это неверно по многим наблюдениям; а ныне давно небывавшая гостья в Сибири ― холера ― унесла много жертв из населения, не побоявшись и сернистых ядовитых газов.[2] |
| — Александр Черкасов, «На Алтае: Записки городского головы», 1884 |
|
|
Взобраться на вулкан <Алагёз> можно со стороны так называемого восточного прорыва. Он имеет четыре вершинки, с каждой из которых открывается вид вниз, на кратер. Что же в конце концов происходит с лавой при её извержении? Мы встречаемся прежде всего в кратере с огромным количеством квасцов. Квасцы ― это химическое перерождение лавы, т. е. полевого шпата, под влиянием сернистого газа и воды.[20] |
| — Мариэтта Шагинян, Дневник, сентябрь 1927 |
|
|
Обилие вкраплений серного колчедана в коренных породах района и характер пласта глубоких россыпей позволили мне предложить следующее объяснение золотоносности. Анализы кубиков колчедана как из серного шлиха, собранного на золотопромывальных машинах, так и выбитых прямо из горных пород, показали, что они содержат большее или меньшее количество золота. Очевидно сернистые газы, выделявшиеся из остывавших массивов гранита и отложившие эти кубики в осадочных породах, содержали также золото.[21] |
| — Владимир Обручев, «Мои путешествия по Сибири», 1948 |
|
|
Дыхание затруднено как высотою, так и недостатком кислорода и избытком фтора, хлора и серных окислов. Как было бы жутко здесь, не будь перед нами сверкающей огненной горы, осыпающейся огнём во тьме ночи и влекущей вперед. Усталость исчезает, как бы сгорает в праздничном огне…[22] |
| — Александр Святловский, «Тектоника Камчатки», 1967 |
|
|
…в те дни, когда вдруг просыпалась Этна, извергая из своих семи кратеров огонь и дым и швыряя в небо раскалённые каменные бомбы, заставляя трескаться землю, обжигая лавой виноградники и обволакивая остров клубами сернистых газов, озарёнными снизу отсветами преисподней… Кто знает, какая нечеловеческая сила разрушила циклопические постройки древней Сицилии? И почему иные из них остались почти нетронутыми, не поверженными во прах?[6] |
| — Валентин Катаев, «Алмазный мой венец», 1977 |
Сернистый газ в беллетристике и художественной прозе[править]
|
|
Из этих поясов в изобилии вытекала вода, уже довольно горячая, так как температура на достигнутой глубине дошла до 45°. Работа становилась более трудной и без вентиляции была бы совершенно невозможной. Атмосфера в нижнем отделении шахты уже напоминала хорошую баню и была наполнена парами воды с сернистым запахом. Насосы опять работали непрерывно, компрессор вдувал холодный воздух, и тем не менее температура держалась около 27°.[23] |
| — Владимир Обручев, «Тепловая шахта», 1920 |
|
|
― Вот что я придумал, ― заявил Каштанов: ― нужно отравить или оглушить муравьев ядовитыми газами, чтобы они оставались в оцепенении в течение времени, необходимого нам для поисков наших вещей в муравейнике. Такими газами являются хлор, бром и сернистый газ. Следовательно, нужно прежде всего найти материал для приготовления достаточного количества газов. Хлор можно добыть из поваренной соли, которая имеется в море. Бром, вероятно, имеется в золе водорослей, растущих в этом мире, но добыть его будет еще труднее, чем хлор. Всего легче было бы приготовить сернистый газ, если мы только найдем серу, серный колчедан или другую сернистую руду. Свинцовый блеск мы уже видели в ущелье птеродактилей; может быть, он найдется и здесь, в утёсах возвышенности.[3] |
| — Владимир Обручев, «Плутония», 1924 |
|
|
Я никогда по-настоящему не любил младенцев; от их криков всегда становится неуютно. А Дая всегда мне говорила, что младенцы только для этого и существуют. Я любил её… |
| — Джордж Эффинджер, «Среда, 15 ноября 1967 года» 1971 |
Сернистый газ в стихах[править]
|
|
Вновь собиралась страсть в прыжок, |
| — Сергей Петров, «В дыму морозном тёплый дом…», 12 августа 1942 |
Источники[править]
- ↑ 1 2 Ушинский К.Д. Собрание сочинений в одиннадцати томах. Том 4. Детский мир и Хрестоматия. — Москва-Ленинград, «Издательство Академии педагогических наук РСФСР», 1948 г.
- ↑ 1 2 3 А. А. Черкасов На Алтае: Записки городского головы. — Барнаул, 2004 г.
- ↑ 1 2 Обручев В.А. «Плутония. Земля Санникова». — М.: Машиностроение, 1982 г.
- ↑ 1 2 Катаев В.П. Избранные стихотворения. Москва, «Астрель», 2009 г.
- ↑ 1 2 Б. Казаков, Е. Грузинов, Элемент № 23: ванадий (Четырежды открытый). ― М.: «Химия и жизнь», № 4, 1966 г.
- ↑ 1 2 Катаев В.П. Трава забвенья. — Москва, «Вагриус», 1997 г.
- ↑ 1 2 3 4 5 6 Борис Силкин. «Странный мир Ио». — М.: «Химия и жизнь», № 4, 1982 г.
- ↑ 1 2 3 В. П. Максаковский. Географическая картина мира. — М.: Дрофа, 2008
- ↑ 1 2 Д. Титов. «Венера-Экспресс» — первая европейская миссия к планете Венера. — М.: «Наука и жизнь», № 1, 2006 г.
- ↑ К.А.Тимирязев. «Жизнь растения» (по изданию 1919 года). — М.: Сельхозгиз, 1936 г.
- ↑ Семёнов Н. Н. Теория цепных реакций (из статьи «Теория горения»). — М.: «Наука и жизнь» № 8-9, 1940 г.
- ↑ 1 2 Н. Л. Глинка. Общая химия: Учебное пособие для вузов (под. ред. В.А.Рабиновича, издание 16-е, исправленное и дополненное). ― Л.: Химия, 1973 г. ― 720 стр.
- ↑ 1 2 Михайлов Г., Казбек-Казиев В., Серная кислота. ― М.: «Химия и жизнь», № 5, 1967 г.
- ↑ Mikhail Yu. Zolotov and Bruce Fegley, Jr. Volcanic Production of Sulfur Monoxide (SO) on Io. — Vernadsky Institute of Geochemistry and Analytical Chemistry, Russian Academy of Sciences, Kosygin Str. 19, Moscow 117975, Russia, 1998.
- ↑ Ф.Ф.Эрисман. Избранные произведения: в 2 т. — М.: Медгиз, 1959 г.
- ↑ Михаил Калинушкин. Чистый воздух — М.: «Техника — молодежи», № 1, 1951 г.
- ↑ И. Н. Вольпер. Сахар: сладкий, горький, соленый — М.: «Химия и жизнь», № 10, 1965 г.
- ↑ Борис Горзев. Ещё о кадмии (редакционная колонка). — М.: «Химия и жизнь», № 9, 1970 год
- ↑ Я. А. Седова. Октябрический режим. Том второй. — М.: издательство Алгоритм, 2017 г.
- ↑ Мариэтта Шагинян. Дневники. 1917—1931. — Л.: Издательство писателей в Ленинграде, 1932 г.
- ↑ Обручев В.А., «Мои путешествия по Сибири». — М., Л.: Изд-во АН СССР, 1948 г.
- ↑ Святловский А. Е.. «Очерк истории четвертичного вулканизма и тектоники Камчатки». — М.: «Наука», 1968 г. 218с.
- ↑ Обручев В.А. «Путешествие в прошлое и будущее»: повести и рассказы. ― М.: Наука, 1965 г.
- ↑ С. В. Петров, Собрание стихотворений. В 2 книгах, — М.: Водолей Publishers, 2008 г.
См. также[править]
- Сера
- Закись серы
- Моноокись серы
- Олеум
- Серная кислота
- Сероводород
- Серный дождь
- Медный купорос
- Купоросное масло
- Колчедан
- Кислотный дождь
- Ад
- Вулканы
Экологический кризис Донбасса как промышленного района Украины. Загрязнения атмосферного воздуха и водных ресурсов. Экологические последствия массового закрытия шахт. Состояние рекреационной зоны и изменение геологической среды региона закрытия шахт.
- Экологическая обстановка Донбасса
Экологический кризис Донбасса как промышленного района Украины. Загрязнения атмосферного воздуха, водных ресурсов, почвы. Экологические последствия массового закрытия шахт. Экологическая обстановка в промышленных регионах Луганской области.
реферат [46,9 K], добавлена 19.07.2005
- Причины загрязнения атмосферного воздуха в Донбассе
Экологический кризис Донбасса как промышленного района Украины. Экологическая ситуация в Донецкой области. Загрязнения атмосферного воздуха. Характеристика вредных веществ. Данные по производственным выбросам. Региональные проблемы Донецкой области.
реферат [381,2 K], добавлена 03.02.2009
- Экологические вопросы при проектировании жилого дома
Экологическая характеристика района и состояние воздушного бассейна, основные загрязнители атмосферного воздуха. Использование территорий санитарно-защитных зон, экологический мониторинг водных экосистем региона. Расчет твердых и жидких бытовых отходов.
практическая работа [34,6 K], добавлена 15.05.2010
- Экологический кризис
Введение в понятие «экологический кризис». Качество окружающей среды. Состояние атмосферного воздуха. Состояние гидросферы, земельных ресурсов. Система экологической безопасности. Развитие экологического нормирования, основные экологические стандарты.
контрольная работа [27,1 K], добавлена 18.03.2010
- Актуальные проблемы, возникающие в результате деятельности экологически опасных производств
Воздействие на окружающую среду Донбасса экологически опасных объектов. Проблема закрывающихся шахт. Загрязнение воздушного бассейна Донбасса экологически опасными промышленными предприятиями. Мероприятия по обеспечению экологической безопасности.
реферат [26,8 K], добавлена 05.12.2009
- Современная экологическая ситуация в Донецком регионе
История заселения, освоения и развития Донбасса. Экологическое состояние территории региона: радиационная безопасность, шахтные отвалы, бытовые и промышленные отходы. Участие Украины в международных и национальных программах по охране окружающей среды.
курсовая работа [64,3 K], добавлена 03.12.2014
- Современное геоэкологическое состояние Бакалинского района
Характеристика экологической ситуации района, развитие растениеводческих и животноводческих отраслей. Состояние атмосферного воздуха, водных и земельных ресурсов, растительного и животного мира. Задачи по улучшению состояния природной среды района.
курсовая работа [412,8 K], добавлена 04.10.2013
- Экологическая обстановка в моём городе
Влияние выбросов заводов на экологическую ситуацию в городе Челябинске. Распространенность болезней населения. Наличие водных ресурсов и их использование. Состояние атмосферного воздуха. Экологическое образование и воспитание подрастающего поколения.
реферат [33,6 K], добавлена 06.04.2014
- Экологические проблемы города Луганска
Изучение экологических проблем Луганска, обусловленных свалками мусора. Негативное влияние закрытия шахт, при котором породные и шахтные отвалы при их засыпке обеспечивают проникновение газов на поверхность. Роль химической промышленности на экологию.
реферат [19,6 K], добавлена 01.12.2010
- Современный экологический кризис
Экологический кризис, кризис взаимоотношений общества и природы, сохранения окружающей среды. Научно-техническая революция и глобальный экологический кризис. Современные экологические катастрофы. Реальные экологически негативные последствия загрязнения.
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.