Рис.1.Сигма-связь
Рис.2.Пи-связь
σ-связь(сигма-связь) — ковалентная связь, образующаяся перекрыванием электронных облаков «по осевой линии». Характеризуется осевой симметрией. Связь, образующаяся при перекрывании гибридных орбиталей вдоль линии, соединяющей ядра атома.
Концепцию сигма- и Пи- связей сформулировал дважды лауреат Нобелевской премии Лайнус Полинг в 30-х годах прошлого века [1]. Идея включала гибридизацию атомных орбиталей, рассчитанную с помощью простых алгебраических действий.
Считалось, что сигма-связь образуется за счёт перекрывания вытянутых гибридных орбиталей (рис.1), а Пи-связь образуется за счёт перекрывания p-орбиталей (рис.2).
В настоящее время разработаны Анимированные изображения гибридизации атомных орбиталей.
Однако сам Л.Полинг не был удовлетворён описанием сигма- и Пи- связей. На симпозиуме по теоретической органической химии, посвящённом памяти А.Кекуле (Лондон, сентябрь 1958г.), он раскритиковал и отказался от σ, π — описаний и предложил теорию изогнутой химической связи[2]. Последняя теория чётко учитывала физический смысл ковалентной химической связи, а именно кулоновскую электронную корреляцию.
Основная характеристика сигма-связи (длина и прочность) зависит от электронной конфигурации атомов, образующих сигма-связь. Характеристика сигма-связи [3]
| Молекула | Электронная конфигурация атома | Орбитальный радиус атома, Å | Длина связи, Å | Энергия разрыва связи, кДж/моль |
|---|---|---|---|---|
| H2 | —— 1S1 | 0,53 | 0,74 | 436 |
| Li2 | [He] 2S1 | 1,57 | 2,67 | 102 |
| Na2 | [Ne] 3S1 | 1,715 | 3,08 | 73 |
| K2 | [Ar] 4S1 | 2,09 | 3,92 | 57 |
| Rb2 | [Kr] 5S1 | 2,22 | 4,10 | 49 |
| Cs2 | [Xe] 6S1 | 2,35 | 4,30 | 42 |
Чем больше электронное экранирование ядра атома, тем удалённее от ядра единственный валентный электрон электронной оболочки атома, тем больше длина сигма-связи и меньше её прочность.
Примечания
- ↑ Паулинг Л. Природа химической связи / под. ред. Я.К.Сыркина. — М.-Л.: Издательство химической литературы, 1947. — 440 с.
- ↑ Полинг Л. Кекуле и химическая связь (книга «Теоретическая органическая химия») / под. ред. Р.Х.Фрейдлиной. — М.-Л.: Издательство иностранной литературы, 1963. — С. 7-16. — 366 с.
- ↑ Лидин Р.А, Андреева Л.Л, Молочко В.А. Справочник по неорганической химии. Константы неорганических веществ. — М: Химия, 1987. — С. 132-136. — 320 с.
| |
|||||||
|---|---|---|---|---|---|---|---|
| Внутримолекулярное взаимодействие |
|
||||||
| Межмолекулярное взаимодействие |
|
In chemistry, sigma bonds (σ bonds) are the strongest type of covalent chemical bond.[1] They are formed by head-on overlapping between atomic orbitals. Sigma bonding is most simply defined for diatomic molecules using the language and tools of symmetry groups. In this formal approach, a σ-bond is symmetrical with respect to rotation about the bond axis. By this definition, common forms of sigma bonds are s+s, pz+pz, s+pz and dz2+dz2 (where z is defined as the axis of the bond or the internuclear axis).[2]
Quantum theory also indicates that molecular orbitals (MO) of identical symmetry actually mix or hybridize. As a practical consequence of this mixing of diatomic molecules, the wavefunctions s+s and pz+pz molecular orbitals become blended. The extent of this mixing (or hybridization or blending) depends on the relative energies of the MOs of like symmetry.
1sσ* antibonding molecular orbital in H2 with nodal plane
For homodiatomics (homonuclear diatomic molecules), bonding σ orbitals have no nodal planes at which the wavefunction is zero, either between the bonded atoms or passing through the bonded atoms. The corresponding antibonding, or σ* orbital, is defined by the presence of one nodal plane between the two bonded atoms.
Sigma bonds are the strongest type of covalent bonds due to the direct overlap of orbitals, and the electrons in these bonds are sometimes referred to as sigma electrons.[3]
The symbol σ is the Greek letter sigma. When viewed down the bond axis, a σ MO has a circular symmetry, hence resembling a similarly sounding «s» atomic orbital.
Typically, a single bond is a sigma bond while a multiple bond is composed of one sigma bond together with pi or other bonds. A double bond has one sigma plus one pi bond, and a triple bond has one sigma plus two pi bonds.
| —— | ———————————————— | ————— |
| Atomic
orbitals |

|
|
| Symmetric (s–s and p–p) sigma bonds between atomic orbitals |
A pi bond, for comparison |
|
| —— | ———————————————— | ————— |
 σs–hybrid |
 σs–p |
Polyatomic molecules[edit]
Sigma bonds are obtained by head-on overlapping of atomic orbitals. The concept of sigma bonding is extended to describe bonding interactions involving overlap of a single lobe of one orbital with a single lobe of another. For example, propane is described as consisting of ten sigma bonds, one each for the two C−C bonds and one each for the eight C−H bonds.
Multiple-bonded complexes[edit]
Transition metal complexes that feature multiple bonds, such as the dihydrogen complex, have sigma bonds between the multiple bonded atoms. These sigma bonds can be supplemented with other bonding interactions, such as π-back donation, as in the case of W(CO)3(PCy3)2(H2), and even δ-bonds, as in the case of chromium(II) acetate.[4]
Organic molecules[edit]
Organic molecules are often cyclic compounds containing one or more rings, such as benzene, and are often made up of many sigma bonds along with pi bonds. According to the sigma bond rule, the number of sigma bonds in a molecule is equivalent to the number of atoms plus the number of rings minus one.
- Nσ = Natoms + Nrings − 1
This rule is a special-case application of the Euler characteristic of the graph which represents the molecule.
A molecule with no rings can be represented as a tree with a number of bonds equal to the number of atoms minus one (as in dihydrogen, H2, with only one sigma bond, or ammonia, NH3, with 3 sigma bonds). There is no more than 1 sigma bond between any two atoms.
Molecules with rings have additional sigma bonds, such as benzene rings, which have 6 C−C sigma bonds within the ring for 6 carbon atoms. The anthracene molecule, C14H10, has three rings so that the rule gives the number of sigma bonds as 24 + 3 − 1 = 26. In this case there are 16 C−C sigma bonds and 10 C−H bonds.
This rule fails in the case of molecules which, when drawn flat on paper, have a different number of rings than the molecule actually has — for example, Buckminsterfullerene, C60, which has 32 rings, 60 atoms, and 90 sigma bonds, one for each pair of bonded atoms; however, 60 + 32 — 1 = 91, not 90. This is because the sigma rule is a special case of the Euler characteristic, where each ring is considered a face, each sigma bond is an edge, and each atom is a vertex. Ordinarily, one extra face is assigned to the space not inside any ring, but when Buckminsterfullerene is drawn flat without any crossings, one of the rings makes up the outer pentagon; the inside of that ring is the outside of the graph. This rule fails further when considering other shapes — toroidal fullerenes will obey the rule that the number of sigma bonds in a molecule is exactly the number of atoms plus the number of rings, as will nanotubes — which, when drawn flat as if looking through one from the end, will have a face in the middle, corresponding to the far end of the nanotube, which is not a ring, and a face corresponding to the outside.
See also[edit]
- Bond strength
- Molecular geometry
References[edit]
- ^ Moore, John; Stanitski, Conrad L.; Jurs, Peter C. (2009-01-21). Principles of Chemistry: The Molecular Science. ISBN 9780495390794.
- ^ Clayden, Jonathan; Greeves, Nick; Warren, Stuart (March 2012) [2002]. Organic Chemistry (2nd ed.). Oxford: OUP Oxford. pp. 101–136. ISBN 978-0199270293.
- ^ Keeler, James; Wothers, Peter (May 2008). Chemical Structure and Reactivity (1st ed.). Oxford: OUP Oxford. pp. 27–46. ISBN 978-0199289301.
- ^ Kubas, Gregory (2002). «Metal Dihydrogen and σ-Bond Complexes: Structure, Theory, and Reactivity». J. Am. Chem. Soc. 124 (14): 3799–3800. doi:10.1021/ja0153417.
External links[edit]
- IUPAC-definition
In chemistry, sigma bonds (σ bonds) are the strongest type of covalent chemical bond.[1] They are formed by head-on overlapping between atomic orbitals. Sigma bonding is most simply defined for diatomic molecules using the language and tools of symmetry groups. In this formal approach, a σ-bond is symmetrical with respect to rotation about the bond axis. By this definition, common forms of sigma bonds are s+s, pz+pz, s+pz and dz2+dz2 (where z is defined as the axis of the bond or the internuclear axis).[2]
Quantum theory also indicates that molecular orbitals (MO) of identical symmetry actually mix or hybridize. As a practical consequence of this mixing of diatomic molecules, the wavefunctions s+s and pz+pz molecular orbitals become blended. The extent of this mixing (or hybridization or blending) depends on the relative energies of the MOs of like symmetry.
1sσ* antibonding molecular orbital in H2 with nodal plane
For homodiatomics (homonuclear diatomic molecules), bonding σ orbitals have no nodal planes at which the wavefunction is zero, either between the bonded atoms or passing through the bonded atoms. The corresponding antibonding, or σ* orbital, is defined by the presence of one nodal plane between the two bonded atoms.
Sigma bonds are the strongest type of covalent bonds due to the direct overlap of orbitals, and the electrons in these bonds are sometimes referred to as sigma electrons.[3]
The symbol σ is the Greek letter sigma. When viewed down the bond axis, a σ MO has a circular symmetry, hence resembling a similarly sounding «s» atomic orbital.
Typically, a single bond is a sigma bond while a multiple bond is composed of one sigma bond together with pi or other bonds. A double bond has one sigma plus one pi bond, and a triple bond has one sigma plus two pi bonds.
| —— | ———————————————— | ————— |
| Atomic
orbitals |

|
|
| Symmetric (s–s and p–p) sigma bonds between atomic orbitals |
A pi bond, for comparison |
|
| —— | ———————————————— | ————— |
 σs–hybrid |
 σs–p |
Polyatomic molecules[edit]
Sigma bonds are obtained by head-on overlapping of atomic orbitals. The concept of sigma bonding is extended to describe bonding interactions involving overlap of a single lobe of one orbital with a single lobe of another. For example, propane is described as consisting of ten sigma bonds, one each for the two C−C bonds and one each for the eight C−H bonds.
Multiple-bonded complexes[edit]
Transition metal complexes that feature multiple bonds, such as the dihydrogen complex, have sigma bonds between the multiple bonded atoms. These sigma bonds can be supplemented with other bonding interactions, such as π-back donation, as in the case of W(CO)3(PCy3)2(H2), and even δ-bonds, as in the case of chromium(II) acetate.[4]
Organic molecules[edit]
Organic molecules are often cyclic compounds containing one or more rings, such as benzene, and are often made up of many sigma bonds along with pi bonds. According to the sigma bond rule, the number of sigma bonds in a molecule is equivalent to the number of atoms plus the number of rings minus one.
- Nσ = Natoms + Nrings − 1
This rule is a special-case application of the Euler characteristic of the graph which represents the molecule.
A molecule with no rings can be represented as a tree with a number of bonds equal to the number of atoms minus one (as in dihydrogen, H2, with only one sigma bond, or ammonia, NH3, with 3 sigma bonds). There is no more than 1 sigma bond between any two atoms.
Molecules with rings have additional sigma bonds, such as benzene rings, which have 6 C−C sigma bonds within the ring for 6 carbon atoms. The anthracene molecule, C14H10, has three rings so that the rule gives the number of sigma bonds as 24 + 3 − 1 = 26. In this case there are 16 C−C sigma bonds and 10 C−H bonds.
This rule fails in the case of molecules which, when drawn flat on paper, have a different number of rings than the molecule actually has — for example, Buckminsterfullerene, C60, which has 32 rings, 60 atoms, and 90 sigma bonds, one for each pair of bonded atoms; however, 60 + 32 — 1 = 91, not 90. This is because the sigma rule is a special case of the Euler characteristic, where each ring is considered a face, each sigma bond is an edge, and each atom is a vertex. Ordinarily, one extra face is assigned to the space not inside any ring, but when Buckminsterfullerene is drawn flat without any crossings, one of the rings makes up the outer pentagon; the inside of that ring is the outside of the graph. This rule fails further when considering other shapes — toroidal fullerenes will obey the rule that the number of sigma bonds in a molecule is exactly the number of atoms plus the number of rings, as will nanotubes — which, when drawn flat as if looking through one from the end, will have a face in the middle, corresponding to the far end of the nanotube, which is not a ring, and a face corresponding to the outside.
See also[edit]
- Bond strength
- Molecular geometry
References[edit]
- ^ Moore, John; Stanitski, Conrad L.; Jurs, Peter C. (2009-01-21). Principles of Chemistry: The Molecular Science. ISBN 9780495390794.
- ^ Clayden, Jonathan; Greeves, Nick; Warren, Stuart (March 2012) [2002]. Organic Chemistry (2nd ed.). Oxford: OUP Oxford. pp. 101–136. ISBN 978-0199270293.
- ^ Keeler, James; Wothers, Peter (May 2008). Chemical Structure and Reactivity (1st ed.). Oxford: OUP Oxford. pp. 27–46. ISBN 978-0199289301.
- ^ Kubas, Gregory (2002). «Metal Dihydrogen and σ-Bond Complexes: Structure, Theory, and Reactivity». J. Am. Chem. Soc. 124 (14): 3799–3800. doi:10.1021/ja0153417.
External links[edit]
- IUPAC-definition

В химии, сигма-связи (σ-связи ) являются наиболее прочным типом ковалентной химической связи. Они образованы лобовым перекрытием атомных орбиталей. Сигма-связь проще всего определить для двухатомных молекул, используя язык и инструменты групп симметрии. В этом формальном подходе σ-связь симметрична относительно вращения вокруг оси связи. Согласно этому определению, распространенными формами сигма-связей являются s + s, p z+pz, s + p z и d z+dz(где z определяется как ось связи или межъядерная ось). Квантовая теория также указывает, что молекулярные орбитали (МО) одинаковой симметрии действительно смешиваются или гибридизуются. Как практическое следствие этого смешения двухатомных молекул, волновые функции s + s и p z+pzмолекулярные орбитали становятся смешанными. Степень этого смешения (или гибридизации, или смешения) зависит от относительных энергий МО одинаковой симметрии.

Для гомодиатомики связывающие σ-орбитали не имеют узловых плоскостей, в которых волновая функция равна нулю, либо между связанными атомами, либо проходящими через связанные атомы. Соответствующее разрыхляющее соединение или σ * орбиталь определяется наличием одной узловой плоскости между двумя связанными атомами.
Сигма-связи являются самым прочным типом ковалентных связей из-за прямого перекрытия орбиталей, и электроны в этих связях иногда называют сигма-электронами.
символ σ — греческая буква сигма. Если смотреть вниз по оси связей, σ-МО имеет круговую симметрию, следовательно, напоминающую аналогично звучащую «s» атомную орбиталь.
Как правило, одинарная связь является сигма-связь, в то время как множественная связь состоит из одной сигма-связи вместе с пи или другими связями. двойная связь имеет одну сигму плюс одну пи-связь, а тройная связь имеет одну сигму плюс две пи-связи.
| —— | ———————————————— | ————— |
| . Атомные
орбитали |
 |
|
| Симметричные (s – s и p – p). сигма-связи между атомными орбиталями | A пи-связь,. для сравнения | |
| —— | ———————————————— | —— ——— |
 . σs–гибрид . σs–гибрид |
 . σs – p . σs – p |
Содержание
- 1 Многоатомные молекулы
- 2 Многосвязные комплексы
- 3 Органические молекулы
- 4 См. Также
- 5 Ссылки
- 6 Внешние ссылки
Многоатомные молекулы
Сигма-связи получаются лобовым перекрытием атомных орбиталей. Концепция сигма-связывания расширена для описания связывающих взаимодействий, включающих перекрытие одной доли одной орбитали с одной долей другой. Например, пропан описывается как состоящий из десяти сигма-связей, по одной для двух связей C-C и по одной для восьми связей C-H.
Комплексы с множественными связями
Комплексы переходных металлов, которые имеют множественные связи, такие как дигидрогенный комплекс, имеют сигма-связи между множественными связанными атомами. Эти сигма-связи могут быть дополнены другими связывающими взаимодействиями, такими как π-донорство, как в случае W (CO) 3(PCy 3 )2(H2), и даже δ-связями, как в в случае ацетата хрома (II).
Органические молекулы
Органические молекулы часто представляют собой циклические соединения, содержащие одно или несколько колец, такие как бензол, и часто состоят из множества сигма-связей вместе с пи-связями. Согласно правилу сигма-связей, количество сигма-связей в молекуле эквивалентно количеству атомов плюс количество колец минус один.
- Nσ= N атомов + N колец — 1
Это правило является частным применением характеристики Эйлера графа, представляющего молекула.
Молекула без колец может быть представлена как дерево с числом связей, равным числу атомов минус один (как в дигидроген, H 2, только с одной сигма-связью, или аммиак, NH 3, с тремя сигма-связями). Между любыми двумя атомами существует не более 1 сигма-связи.
Молекулы с кольцами имеют дополнительные сигма-связи, такие как бензольные кольца, которые имеют 6 сигма-связей C-C внутри кольца для 6 атомов углерода. Молекула антрацена, C 14H10, имеет три кольца, так что правило дает количество сигма-связей как 24 + 3 — 1 = 26. В этом случае имеется 16 сигма-связей C-C и 10 Связи C − H.
Это правило не работает в случае молекул, которые, когда они нарисованы на бумаге, имеют другое количество колец, чем у молекулы на самом деле — например, Бакминстерфуллерен, C 60, который имеет 32 кольца, 60 атомов и 90 сигма-связей, по одной для каждой пары связанных атомов; однако 60 + 32 — 1 = 91, а не 90. Это связано с тем, что правило сигмы является частным случаем характеристики Эйлера, где каждое кольцо считается гранью, каждая сигма-связь является ребром и каждый атом — вершина. Обычно одна дополнительная грань назначается пространству не внутри какого-либо кольца, но , когда бакминстерфуллерен нарисован плоско без каких-либо пересечений, одно из колец образует внешний пятиугольник; внутренняя часть этого кольца является внешней стороной графа. Это правило больше не работает при рассмотрении других форм — тороидальные фуллерены подчиняются правилу, согласно которому количество сигма-связей в молекуле равно количеству атомов плюс количество колец, как и нанотрубки, которые, если их нарисовать плоскими, как если бы они смотрели сквозь них от конца будет иметь грань посередине, соответствующую дальнему концу нанотрубки, которая не является кольцом, и грань, соответствующую внешней стороне.
См. Также
- Прочность связи
- Молекулярная геометрия
Ссылки
Внешние ссылки
- Определение IUPAC
Как поставить знак сигма в ворде? Какой код сигмы в ворде?
Греческая буква сигма часто используется для написания формул, поэтому её может потребоваться поставить в программе ворд. Давайте разберемся, какие существуют способы, как поставить знак сигма в программе ворд.
Первый способ. Использовать функционал формул. Для этого в верхней панели настроек программы ворд входите в закладку «Вставка», где в самой правой части есть раздел «Символы» и нажимаем на иконку «Формула», после на экране появиться спецформа.
Войдя в данную спецформу, вы должны на верхней панели найти закладку «Конструктор», в ней настраиваются формулы, но вы смотрите на раздел «Символы», полистайте доступные символы, среди которых найдете сигму.
Второй способ. Вы снова заходите в закладку «Вставка», но в разделе «Символы», нажимаете уже на вторую иконку «Символ», в ней представлено большое количество доступных в программе ворд символов. Для быстроты поиска сигмы, поставить в разделе «набор», греческие символы, сред них и найдете эту букву.
Поставить символ сигма можно и с помощью специального кода, чтобы это сделать, сначала набираете на экране код 03C3, сразу после него нажмите сочетание клавиш ALT+X и на экране отразится символ сигма.
Видео
Источник статьи: http://portalonline.ru/kompyutery-i-programmy/2257-kak-postavit-znak-sigma-v-vorde-kakoj-kod-sigmy-v-vorde.html
Типы связей в молекулах органических веществ
Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа.
Типы связей в молекулах органических веществ
Одна из характеристик химических связей — тип перекрывания орбиталей атомов в молекуле.
По характеру перекрывания различают σ-(сигма) и π‑(пи) связи.
σ-Связь — это связь, в которой перекрывание орбиталей происходит вдоль оси, соединяющей ядра атомов.
σ-Связь может быть образована любыми типами орбиталей (s, p, d, гибридизованными).
σ-Связь — это основная связь в молекуле, которая преимущественно образуется между атомами.
Между двумя атомами возможна только одна σ-связь.
π-Связь — это связь, в которой перекрывание орбиталей происходит в плоскости, перпендикулярной оси, соединяющей ядра атомов, сверху и снизу от оси связи.
π-Связь образуется при перекрывании только р- (или d) орбиталей, перпендикулярных линии связи и параллельных друг другу.
π-Связь является дополнительной к σ-связи, она менее прочная и легче разрывается при химических реакциях.
С–С, С–Н, С–О Двойная связь
С=С, С=О Тройная связь
С≡С, С≡N σ-связь σ-связь + π-связь σ-связь + две π-связи
Таким образом, число сигма-связей ( σ-связей) в молекуле метана равно четырем:
В молекуле этилена число сигма-связей равно пяти, а также есть одна пи-связь (между атомами углерода):
В молекуле ацетилена всего три сигма-связи и две пи-связи:
H–C≡C–H
Добавить комментарий Отменить ответ
Этот сайт использует Akismet для борьбы со спамом. Узнайте как обрабатываются ваши данные комментариев.
Источник статьи: http://chemege.ru/svyazi-organika/
Сигма (буква)
- Σ, σ, ς (название: си́гма, греч. σίγμα) — 18-я буква греческого алфавита. В системе греческой алфавитной записи чисел имеет значение 200. Происходит от финикийской буквы (син). От буквы «сигма» произошли латинская буква S, кириллическая С и некоторые другие, в том числе косвенным образом и кириллическая буква зело (Ѕ, в книгах печаталась следующим образом: ).
Строчное начертание сигмы двояко: в начале и середине слов пишется σ, в конце же ς. В некоторых книгах, особенно при издании папирусных фрагментов (где неясно, конец ли слова перед нами) вместо знаков Σ, σ, ς используется единое с-образное начертание буквы, так называемая «sigma lunatum», то есть «лунообразная сигма» (Ϲ, ϲ).
Финальную строчную сигму (ς) часто путают со строчной дзетой (ζ) (которая в конце слов практически не встречается) и со стигмой (Ϛ, ϛ), ныне употребляемой исключительно для обозначения цифры 6.
Связанные понятия
Ѹ, ѹ или Ꙋ, ꙋ (ук или оук, глаголица: Ⱆ) — буква старославянской азбуки. Первоначально диграф букв О и У (точнее, буквы «ик», варианта ижицы) писался горизонтально, но впоследствии, для экономии места, стали использовать вертикальную лигатуру, а впоследствии и вовсе заменили буквой У.
Ϙ, ϙ или Ϟ, ϟ (название: ко́ппа, др.-греч. ϙόππα или κόππα) — вышедшая из употребления буква греческого алфавита. В системе греческой алфавитной записи чисел имеет числовое значение 90. Происходит от финикийской буквы — куф, означавшей глухой увулярный взрывной согласный . От буквы «коппа» произошли латинская буква Q и кириллический знак Ҁ.
Ꙗ, ꙗ (условное название: я, а йотированное или аз йотированный) — 34-я буква старославянской кириллицы. Построена как лигатура букв І и А. В глаголице отсутствует — соответствующие звуки там обозначаются буквой ять (Ⱑ). Числового значения не имеет. В начале слов и после гласных обозначает звуки , после согласных — их смягчение и звук . В церковнославянской письменности обычно объединяется с малым юсом (Ѧ) и помещается на 34-е место в азбуке (подробнее о взаимоотношении этих двух форм см. в статье.
Ѕ, ѕ (македонское название — дзе, старинное название — зело́) — буква расширенной кириллицы, 10-я буква македонского алфавита, 8-я буква старо- и церковнославянских азбук; использовалась и в других языках.
Сюда перенаправляются запросы «ẘ» и «W̊». Про W̊ нужна отдельная статья, перенаправление ẘ должно вести на неё.Кружок — диакритический знак, который может быть как надстрочным, так и подстрочным. Употребляется с различными буквами латинского алфавита.
Источник статьи: http://kartaslov.ru/%D0%BA%D0%B0%D1%80%D1%82%D0%B0-%D0%B7%D0%BD%D0%B0%D0%BD%D0%B8%D0%B9/%D0%A1%D0%B8%D0%B3%D0%BC%D0%B0+(%D0%B1%D1%83%D0%BA%D0%B2%D0%B0)
Сигма связь как пишется
сигма-связь — сущ., кол во синонимов: 1 • связь (97) Словарь синонимов ASIS. В.Н. Тришин. 2013 … Словарь синонимов
сигма-связь — sigma ryšys statusas T sritis fizika atitikmenys: angl. sigma bond vok. Sigma Bindung, f rus. сигма связь, f pranc. liaison sigma, f … Fizikos terminų žodynas
сигма-связь — (3 ж), Р. си/гма свя/зи … Орфографический словарь русского языка
сигма-связь — си/гма свя/зь, си/гма свя/зи (σ свя/зь) … Слитно. Раздельно. Через дефис.
связь — Сцепление, соединительное звено. Сцепление мыслей, понятий ассоциация идей. См. союз.. влиятельная связь. Словарь русских синонимов и сходных по смыслу выражений. под. ред. Н. Абрамова, М.: Русские словари, 1999. связь логичность, связность,… … Словарь синонимов
Сигма- и пи-связи — (σ и π связи) ковалентные химические связи, характеризующиеся определенней, но различной пространственной симметрией распределения электронной плотности. Как известно, ковалентная связь образуется в результате обобществления электронов… … Большая советская энциклопедия
Пи-связь — Рис.1.Пи связь в молекуле этилена … Википедия
Двойная связь (химия) — У этого термина существуют и другие значения, см. Двойная связь. Рис.1.Сигма связь … Википедия
Ковалентная связь — Рис.1. Модель одинарной ковалентной связи (электронная плотность выделена красным цветом) Ковалентная связь (атомная связь, гомеополярная связь) химическая связь, образованная перекрытием (обобществлением) пары … Википедия
Тройная связь — Рис.1.Тройная связь в рамках теории валентных связей Тройная связь ковалентная связь двух атомов в молекуле посредством трёх общих связывающих электронных пар. Первая картина наглядного строения тройной связи была дана в … Википедия
Источник статьи: http://dic.academic.ru/dic.nsf/ruwiki/1626895
Морфемный разбор слова:
Однокоренные слова к слову:
Типы связей в молекулах органических веществ
Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа.
Типы связей в молекулах органических веществ
Одна из характеристик химических связей — тип перекрывания орбиталей атомов в молекуле.
По характеру перекрывания различают σ-(сигма) и π‑(пи) связи.
σ-Связь — это связь, в которой перекрывание орбиталей происходит вдоль оси, соединяющей ядра атомов.
σ-Связь может быть образована любыми типами орбиталей (s, p, d, гибридизованными).
σ-Связь — это основная связь в молекуле, которая преимущественно образуется между атомами.
Между двумя атомами возможна только одна σ-связь.
π-Связь — это связь, в которой перекрывание орбиталей происходит в плоскости, перпендикулярной оси, соединяющей ядра атомов, сверху и снизу от оси связи.
π-Связь образуется при перекрывании только р- (или d) орбиталей, перпендикулярных линии связи и параллельных друг другу.
π-Связь является дополнительной к σ-связи, она менее прочная и легче разрывается при химических реакциях.
С–С, С–Н, С–О Двойная связь
С=С, С=О Тройная связь
С≡С, С≡N σ-связь σ-связь + π-связь σ-связь + две π-связи
Таким образом, число сигма-связей ( σ-связей) в молекуле метана равно четырем:
В молекуле этилена число сигма-связей равно пяти, а также есть одна пи-связь (между атомами углерода):
В молекуле ацетилена всего три сигма-связи и две пи-связи:
H–C≡C–H
Добавить комментарий Отменить ответ
Этот сайт использует Akismet для борьбы со спамом. Узнайте, как обрабатываются ваши данные комментариев.
Источник
Сигма-связь
σ-связь(сигма-связь) — ковалентная связь, образующаяся перекрыванием электронных облаков «по осевой линии». Характеризуется осевой симметрией. Связь, образующаяся при перекрывании гибридных орбиталей вдоль линии, соединяющей ядра атома.
Считалось, что сигма-связь образуется за счёт перекрывания вытянутых гибридных орбиталей (рис.1), а Пи-связь образуется за счёт перекрывания p-орбиталей (рис.2).
В настоящее время разработаны Анимированные изображения гибридизации атомных орбиталей.
Основная характеристика сигма-связи (длина и прочность) зависит от электронной конфигурации атомов, образующих сигма-связь. Характеристика сигма-связи [3]
| Молекула | Электронная конфигурация атома | Орбитальный радиус атома, Å | Длина связи, Å | Энергия разрыва связи, кДж/моль |
|---|---|---|---|---|
| H2 | —— 1S 1 | 0,53 | 0,74 | 436 |
| Li2 | [He] 2S 1 | 1,57 | 2,67 | 102 |
| Na2 | [Ne] 3S 1 | 1,715 | 3,08 | 73 |
| K2 | [Ar] 4S 1 | 2,09 | 3,92 | 57 |
| Rb2 | [Kr] 5S 1 | 2,22 | 4,10 | 49 |
| Cs2 | [Xe] 6S 1 | 2,35 | 4,30 | 42 |
Чем больше электронное экранирование ядра атома, тем удалённее от ядра единственный валентный электрон электронной оболочки атома, тем больше длина сигма-связи и меньше её прочность.
Источник
Чему равна сигма в физике
Что ты хочешь узнать?
Ответ
Прописная буква Σ обозначает:
в математике — сумму;F-сигма-множество в физике — сигма-гипероны, один из видов элементарных частиц.
Строчная σ обозначает:
в теории вероятностей и математической статистике — среднеквадратичное отклонение (квадратный корень из дисперсии); в теории чисел — функцию суммы делителей числа ( ); сигма-алгебру — алгебру множеств, замкнутую относительно счётных объединений, использующуюся для ключевых определений теории меры и теории вероятностей; в физике — удельную проводимость, тензор напряжений, коэффициент поверхностного натяжения, механическое напряжение, постоянную Стефана — Больцмана, поверхностную плотность электрического заряда; в химии — сигма-связь — один из видов ковалентной связи и реакционную константу в уравнении Гаммета; в электронике существует Сигма-дельта модуляция.
С названием этой греческой буквы лишь опосредованно связаны названия сигмовидной кишки, а также графиков некоторых математических функций (сигмоиды): по форме они напоминают латинскую букву S.
| Буква греческого алфавита сигма |
|---|
| Σσς |
| ◄ | Ξ | Ο | Π | Ρ | Σ | Τ | Υ | Φ | Χ | ► |
| ◄ | ο | π | ρ | ς | σ | τ | υ | φ | χ | ► |
| ◄ | ξ | ο | π | ρ | ς | σ | τ | υ | φ | ► |
Характеристики Название Σ: greek capital letter sigma
σ: greek small letter sigma
ς: greek small letter final sigma Юникод Σ: U+03A3
σ: U+03C3
ς: U+03C2 HTML-код Σ:
Строчное начертание сигмы двояко: в начале и середине слов пишется σ, в конце же ς. В некоторых книгах, особенно при издании папирусных фрагментов (где неясно, конец ли слова перед нами) вместо знаков Σ, σ, ς используется единое с-образное начертание буквы, так называемая «sigma lunatum», то есть «лунообразная сигма» (Ϲ, ϲ).
Финальную строчную сигму (ς) часто путают со строчной дзетой (ζ) (которая в конце слов практически не встречается) и со стигмой (Ϛ, ϛ), ныне употребляемой исключительно для обозначения цифры 6.
Обозначения [ править | править код ]
Прописная буква Σ обозначает:
Строчная σ обозначает:
С названием этой греческой буквы лишь опосредованно связаны названия сигмовидной кишки, а также графиков некоторых математических функций (сигмоиды): по форме они напоминают латинскую букву S.
Σ, σ, ς (название: си́гма, греч. σίγμα ) — 18-я буква греческого алфавита. В системе греческой алфавитной записи чисел имеет значение 200. Происходит от финикийской буквы 

Строчное начертание сигмы двояко: в начале и середине слов пишется σ, в конце же ς. В греческих книгах для начального обучения чтению вместо непростых знаков Σ, σ, ς используется с-образное начертание «sigma lunata» ( Ϲ, ϲ ).
Обозначения
Прописная буква Σ обозначает:
Строчная σ обозначает:
С названием этой греческой буквы лишь опосредованно связаны названия сигмовидной кишки, а также графиков некоторых математических функций (сигмоиды): по форме они напоминают латинскую букву S.
Смотреть что такое «Сигма (буква)» в других словарях:
СИГМА — 1) 18 я буква греческого алфавита, соответствует звуку с; 2) у древних римлян ложе для пиров, имевшее форму греческой буквы сигмы; 3) в мат. греч. сигма употр. для обозначения суммы и как знак интеграла. Словарь иностранных слов, вошедших в… … Словарь иностранных слов русского языка
Сигма — У этого слова несколько значений: Сигма буква греческого алфавита. Сигма (язык) Стандартное отклонение в теории вероятностей. Сигма алгебра в теории множеств. «Сигма» чешский футбольный клуб. Sigma Corporation японский производитель… … Википедия
сигма — сумма, буква Словарь русских синонимов. сигма сущ., кол во синонимов: 2 • буква (103) • сумма … Словарь синонимов
СИГМА — (sigma) Буква греческого алфавита; заглавная изображается как Σ, строчная – как σ. В экономической литературе она используется различным образом. Заглавная буква Σ обычно обозначает сумму членов ряда: Σ1N x1=(x1+x2+. +xN) Здесь подстрочный… … Экономический словарь
сигма — греческая буква Σ, Σ. В математике символ Σ часто употребляют для обозначения суммы. * * * СИГМА СИГМА, греческая буква S, s. В математике символ S часто употребляют для обозначения суммы … Энциклопедический словарь
СИГМА — греч. буква Г, о. В математике символ часто употребляют для обозначения суммы … Естествознание. Энциклопедический словарь
сигма — (др. греч. Σ, σ, ς σιγμα) 1) 18 я буква греческого алфавита; σ΄ – 200 ; ¸σ – 200000 ; 2) в математике: Σ – сумма … Словарь лингвистических терминов Т.В. Жеребило
сигма — (грч. sigma) назив за грчката буква … Macedonian dictionary
Источник
Сигма и пи связи
Ковалентные связи. Пи- и сигма- связи
Основные объекты биохимии.
Объектами изучения биоорганической химии являются белки и пептиды, нуклеиновые кислоты, углеводы, липиды, биополимеры, алкалоиды, терпеноиды, витамины, антибиотики, гормоны, токсины, а также синтетические регуляторы биологических процессов: лекарственные препараты, пестициды и др.
Изомерия органических соединений, ее виды. Характеристика видов изомерии, примеры.
Различают два вида изомерии: структурную и пространственную (т.е. стереоизомерию). Структурные изомеры отличаются друг от друга порядком связи атомов в молекуле, стереоизомеры — расположением атомов в пространстве при одинаковом порядке связей между ними.
Выделяют следующие разновидности структурной изомерии: изомерию углеродного скелета, изомерию положения, изомерию различных классов органических соединений (межклассовую изомерию).
Изомерия углеродного скелета обусловлена различным порядком связи между атомами углерода, образующими скелет молекулы. Например: молекулярной формуле С4Н10 соответствуют два углеводорода: н-бутан и изобутан. Для углеводорода С5Н12 возможны три изомера: пентан, изо-пентан и неопентан. С4Н10 соответствуют два углеводорода: н-бутан и изобутан. Для углеводорода С5Н12 возможны три изомера: пентан, изо-пентан и неопентан.
Изомерия положения обусловлена различным положением кратной связи, заместителя, функциональной группы при одинаковом углеродном скелете молекулы
Межклассовая изомерия- изомерия веществ, принадлежащих к разным классам органических соединений.
Современная классификация и номенклатура органических соединений.
В настоящее время широко используется систематическая номенклатура- IUPAC- международная единая химическая номенклатура. Правила ИЮПАК основываются на несколько систем:
1) радикально-функциональная ( в основе названия лежит название функц-й группы),
2) соединительная (названия составляют из нескольких равноправных частей),
3) заместительная (основой названия служит углеводородный фрагмент).
Ковалентные связи. Пи- и сигма- связи.
Ковалентная связь являетсся основным типом связи в органических соединениях.
Это связь, образованная перекрытием пары валентных электронных облаков.
Пи-связь- это ковалентная связь, образующаяся путем перекрывания р-атомных орбиталей.
Сигма-связь- это ковалентная связь, образующаяся при перекрывании s-атомных орбиталей.
Если между атомами в молекуле образуются как s-, так и р-связи, то образуется кратная (двойная или тройная) связь.
6. Современные представления о структуре органических соединений. Понятие «химическое строение», «конфигурация», «конформация», их определение. Роль структуры в проявлении биологической активности.
В 1861 году А.М. Бутлеровым была предложена теория химического строения органических соединений, лежащая в основе современных представлений о структуре орг. соединений,которая состоит из следующих основных положений:
1.В молекулах веществ существует строгая последовательность химического связывания атомов, которая называется химическим строением.
2.Химические свойства вещества определяются природой элементарных составных частей, их количеством и химическим строением.
3.Если у веществ с одинаковым составом и молекулярной массой различное строение, то возникает явление изомерии.
4.Так как в конкретных реакциях изменяются только некоторые части молекулы, то исследование строения продукта помогает определить строение исходной молекулы.
5.Химическая природа (реакционная способность) отдельных атомов в молекуле меняется в зависимости от окружения, т.е. от того, с какими атомами других элементов они соединены.
Понятие «химическое строение» включает представление об определенном порядке соединения атомов в молекуле и об их химическом взаимодействии, изменяющем свойства атомов.
Конфигурация — относительное пространственное расположение атомов или групп атомов в молекуле химического соединения.
Конформация — пространственное расположение атомов в молекуле определенной конфигурации, обусловленное поворотом вокруг одной или нескольких одинарных сигма-связей
Сигма связь-ковалентная связь образованная при перекрывании атомных s-электронных облаков, происходит вблизи прямой, соединяющей ядра взаимодействующих атомов (т.е. вблизи оси связи)
В образовании сигма-связи могут принимать участие p-электронные облака, ориентированные вдоль оси связи. в молекуле HF ковалентная сигма-связь возникает вследствие перекрывание 1s-электронного облака атома водорода и 2p-электронного облака атома фтора.
Химическая связь в молекуле F2 тоже сигма связь, она образована 2p-элект. облаками двух атомов фтора.
Пи-связь — ковалентная связь, при взаимодействии p-электронных облаков, ориентированных перпендикулярно оси связи, образуются не одна, а две области перекрывания, расположенные по обе стороны от этой связи.
Примеры:
в молекуле N2 атомы азота связаны в молекуле тремя ковалентными связями, но связи неравноценны одна из них сигма, две другие пи-связи.
вывод о неравноценности связей в молекуле подтверждается тем, что энергия их разрыва различна; пи-связь является непрочной
Общая химия
3. Химическая связь
3.5. Сигма — и пи-связь
Пространственно различают два типа связи — сигма — и пи-связь.
1. Сигма-связь (σ-связь) — простой (одинарный) ковалентная связь, образующаяся перекрыванием электронных облаков по линии, соединяющей атомы.
Связь характеризуется осевой симметрией:
В образовании σ-связи могут принимать участие как обычные, так и гібридизовані орбитали.
Пи-связь (π-связь). Если у атома после образования σ-связи остались неспаренные электроны, он может использовать их на образование второго типа связи, который называют π-связью. Рассмотрим его механизм на примере образования молекулы кислородаO2.
Два неспаренные р-электроны в атоме Кислорода могут образовать две совместные ковалентные пары с электронами второго атома Кислорода:
Одна пара идет на образование σ-связи:
Другая, перпендикулярная к ней, — на образование π-связи:
Еще однаp-орбиталь (рв), как иs-орбиталь, на которой находятся по две спаренные электроны, участия в связи не берут и не обобществляются.
Аналогичным образом при образовании органических соединений (алкенов и алкадієнів) послеsp2-гибридизации у каждого из двух атомов Углерода (между которыми образуется связь) остается по одной негібридизованій р-орбитали.
которые размещаются в плоскости, которая является перпендикулярной к оси соединения атомов Карбона:
В сумме σ — и π-связи дают двойную связь.
Тройная связь образуется аналогично и состоит из одной σ-связи (рх) и двух я-связей, которые образованы двумя взаимноперпендикулярными парамиp-орбиталей (ру,pz):
Пример: образование молекулы азотаN2.
Электронная формула атома Азота-7N 1s22s22p3или
В результате образования трех общих электронных парN≡Nкаждый атом Азота приобретает устойчивую электронную конфигурацию инертного элемента 2s22p6(октет электронов).
Тройная связь возникает и при образовании алкінів (в органической химии).
В результатеsг-гибридизации внешней электронной оболочки атома Углерода образуется двеsр-орбитали, расположенные по оси 0Х. Одна из них идет на формирование в-связи с другим атомом Углерода (вторая — на формирование σ-связи с атомом Водорода). А две не гібридизовані р-орбитали (ру,pz) размещаются перпендикулярно друг к другу и к оси соединения атомов (0Х).
С помощью π-связи формируется молекула бензену и других аренов.
Длина связи (ароматического, «полуторного», сказывается
Все шесть атомов Углерода имеют общую π-электронное облако, плотность которой локализована над и под плоскостью ароматического ядра и равномерно распределена (делокалізована) между всеми атомами Углерода. По современным представлениям она имеет форму тороида:
Под длиной связи понимают расстояние между центрами ядер атомов Углерода, участвующих в связи.
π-Связи возникают между атомами, уже соединенными σ-связью (при этом образуются двойные и тройные ковалентные связи).
π-Связь слабее σ-связи из-за менее полного перекрывания р-АО.
Поэтому поляризуемость π-связи значительно выше, чем σ-связи.
Источник
Сигма-связь
Из Википедии — свободной энциклопедии
σ-связь (сигма-связь) — ковалентная связь, образующаяся перекрыванием электронных облаков «по осевой линии», соединяющей ядра атомов. Характеризуется осевой симметрией.
Считалось, что сигма-связь образуется за счёт перекрывания вытянутых гибридных орбиталей (рис.1), а Пи-связь образуется за счёт перекрывания p-орбиталей (рис.2).
Основная характеристика сигма-связи (длина и прочность) зависит от электронной конфигурации атомов, образующих сигма-связь. Характеристика сигма-связи [3]
| Молекула | Электронная конфигурация атома | Орбитальный радиус атома, Å | Длина связи, Å | Энергия разрыва связи, кДж/моль |
|---|---|---|---|---|
| H2 | —— 1S 1 | 0,53 | 0,74 | 436 |
| Li2 | [He] 2S 1 | 1,57 | 2,67 | 102 |
| Na2 | [Ne] 3S 1 | 1,715 | 3,08 | 73 |
| K2 | [Ar] 4S 1 | 2,09 | 3,92 | 57 |
| Rb2 | [Kr] 5S 1 | 2,22 | 4,10 | 49 |
| Cs2 | [Xe] 6S 1 | 2,35 | 4,30 | 42 |
Чем больше электронное экранирование ядра атома, тем удалённее от ядра единственный валентный электрон электронной оболочки атома, тем больше длина сигма-связи и меньше её прочность.
Источник
Теперь вы знаете какие однокоренные слова подходят к слову Как пишется сигма связь в химии, а так же какой у него корень, приставка, суффикс и окончание. Вы можете дополнить список однокоренных слов к слову «Как пишется сигма связь в химии», предложив свой вариант в комментариях ниже, а также выразить свое несогласие проведенным с морфемным разбором.
Лекция
3
Химическая
связь и строение молекул
Учение
о химической связи – центральный вопрос
современной химии. Без него нельзя
понять причины многообразия химических
соединений, механизм их образования,
строение и реакционную способность.
Образование
молекул из атомов приводит к выигрышу
энергии, так как в обычных условиях
молекулярное состояние устойчивее, чем
атомное. Учение о строении атомов
объясняет механизм образования молекул,
а также природу химической связи.
У
атома на внешнем энергетическом уровне
может содержаться от одного до восьми
электронов. Если число электронов на
внешнем уровне атома максимальное,
которое он может вместить, то такой
уровень называется завершенным.
Завершенные уровни характеризуются
большой прочностью. Таковы внешние
уровни атомов благородных газов: у гелия
на внешнем уровне два электрона (s2),
у остальных – по восемь электронов
(ns2np6).
Внешние уровни атомов других элементов
незавершенные
и в процессе химического взаимодействия
они завершаются. Чтобы добиться этого
состояния соответствующим атомам
приходится разменивать свои электроны.
И, как часто случается в жизни, «те,
которые имеют меньше, отдают тем, кто
имеет больше».
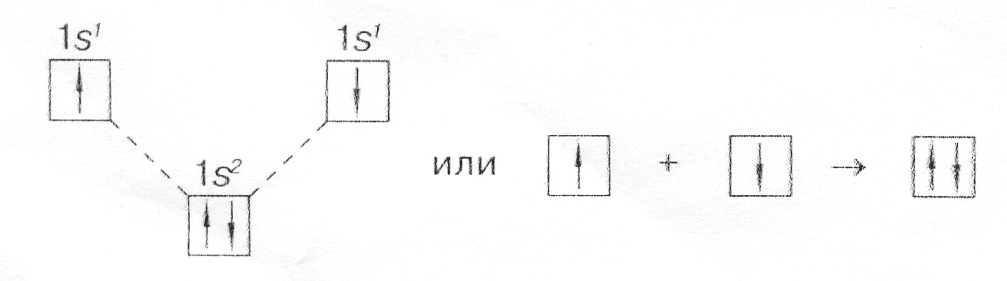
Ковалентная связь
В
1907 г. Н.А. Морозов и позднее в 1916-1918 г.г.
американцы Дж. Льюис и И. Ленгмюр ввели
представление об образовании химической
связи общей электронной парой
и предложили обозначать валентные
электроны точками
Связь,
образованная электронами, принадлежащими
двум взаимодействующим атомам, называется
ковалентной.
По представлениям Морозова-Льюиса-Ленгмюра:
-
при
взаимодействии атомов между ними
формируются поделенные – общие –
электронные пары, принадлежащие обоим
атомам; -
за
счет общих электронных пар каждый атом
в молекуле приобретает на внешнем
энергетическом уровне восемь электронов,
s2p6;
3)
конфигурация
s2
p6
–
это устойчивая конфигурация инертного
газа и в процессе химического взаимодействия
каждый атом стремится ее достигнуть;
4)
количество общих электронных пар
определяет ковалентность элемента в
молекуле и равно оно числу электронов
у атома, недостающих до восьми;
5)
валентность свободного атома определяется
числом неспаренных электронов.
Изображать
химические связи принято по разному:
-
с
помощью электронов в виде точек,
поставленных у химического символа
элемента. Тогда образование молекулы
водорода можно показать схемой
Н×
+ Н×
®
Н : Н;
-
с
помощью квантовых ячеек (орбиталей)
как размещение двух электронов с
противоположными спинами в одной
молекулярной квантовой ячейке
Схема
расположения, показывает, что молекулярный
энергетический уровень ниже исходных
атомных уровней, а значит, молекулярное
состояние вещества более устойчиво,
чем атомное;
-
часто,
особенно в органической химии, ковалентную
связь изображают черточкой (например,
Н-Н), которая символизирует пару
электронов.
Ковалентная
связь в молекуле хлора также осуществляется
с помощью двух общих электронов, или
электронной пары.
Как
видно, каждый атом хлора имеет три
неподеленные пары и один неспаренный
электрон. Образование химической связи
происходит за счет неспаренных электронов
каждого атома. Неспаренные электроны
связываются в общую пару электронов,
называемую также поделенной
парой.
Метод валентных связей
Представления
о механизме образования химической
связи на примере молекулы водорода
распространяются и на другие молекулы.
Теория химической связи, созданная на
этой основе, получила название метода
валентных связей (МВС).
Основные положения:
1)
ковалентная связь образуется в результате
перекрывания двух электронных облаков
с противоположно направленными спинами,
причем образованное общее электронное
облако принадлежит двум атомам;
2)
ковалентная связь тем прочнее, чем в
большей степени перекрываются
взаимодействующие электронные облака.
Степень перекрывания электронных
облаков зависит от их размеров и
плотности;
3)
образование молекулы сопровождается
сжатием электронных облаков и уменьшением
размеров молекулы по сравнению с
размерами атомов;
4)
в образовании связи принимают участие
s-
и p-электроны
внешнего энергетического уровня и
d-электроны
предвнешнего энергетического уровня.
Сигма (s) и пи (p)-связи
В
молекуле хлора каждый его атом имеет
завершенный внешний уровень из восьми
электронов s2
p6
, причем два из них (электронная пара) в
одинаковой степени принадлежит обоим
атомам. Перекрывание электронных облаков
при образовании молекулы показано на
рисунке
а
б
Схема
образования химической связи в молекулах
хлора Cl2
(а) и хлороводорода HCl
(б)
Химическая
связь, для которой линия, соединяющая
атомные ядра, является осью симметрии
связывающего электронного облака,
называется сигма
(σ)-связью.
Она возникает при «лобовом» перекрывании
атомных орбиталей. Связи при перекрывании
s-s-орбиталей
в молекуле Н2;
р-р-орбиталей в молекуле Cl2
и s-p-орбиталей
в молекуле НСl
являются сигма связями. Возможно
«боковое» перекрывание атомных орбиталей.
При перекрывании р-электронных облаков,
ориентированных перпендикулярно оси
связи, т.е. по оси у- и z-осям,
образуются две области перекрывания,
расположенные по обе стороны от этой
оси. Такая ковалентная связь называется
пи (p)-связью.
Перекрывание электронных облаков при
образовании π-связи меньше. Кроме того,
области перекрывания лежат дальше от
ядер, чем при образовании σ-связи.
Вследствие этих причин π-связь обладает
меньшей прочностью по сравнению с
σ-связью. Поэтому энергия двойной связи
меньше удвоенной энергии одинарной
связи, которая всегда является σ-связью.
Кроме того, σ-связь имеет осевую,
цилиндрическую симметрию и представляет
собой тело вращения вокруг линии,
соединяющей атомные ядра. π-Связь,
наоборот, не обладает цилиндрической
симметрией.
Одинарная
связь всегда является чистой или
гибридной σ-связью. Двойная же связь
состоит из одной σ- и одной π-связей,
расположенных перпендикулярно друг
относительно друга. σ-Связь прочнее
π-связи. В соединениях с кратными связями
обязательно присутствует одна σ-связь
и одна или две π-связи.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- Курс
Меня зовут Быстрицкая Вера Васильевна.
Я репетитор по Химии
Вам нужны консультации по Химии по Skype?
Если да, подайте заявку. Стоимость договорная.
Чтобы закрыть это окно, нажмите «Нет».
ТИПЫ СВЯЗЕЙ
Связи между атомами углерода в органических цепях бывают одинарные, двойные и тройные.
СИГМА И ПИ-СВЯЗИ.
Сигма-связь – это связь, в которой перекрывание орбиталей происходит ВДОЛЬ ОСИ, соединяющей ядра атомов.
Может быть образована всеми типами орбиталей (s,p,d).
Основная связь в молекуле, они более прочные и образуют скелет молекулы.
Между двумя атомами в химической частице возможна только одна σ-связь.
Пи-связь – это связь, в которой перекрывание орбиталей происходит в плоскости, перпендикулярной оси, соединяющей ядра атомов, сверху и снизу от оси связи.
Пи-связь- дополнительная к сигма-связи, она менее прочная и легче разрывается при химических реакциях.
ГИБРИДИЗАЦИЯ
изменение формы электронных облаков
sp3 — гибридизация
sp3 — гибридизация
sp2 — гибридизация
sp-гибридизация
ЭЛЕКТРОННЫЕ ЭФФЕКТЫ ЗАМЕСТИТЕЛЕЙ
Нуклеофилы — анионы или молекулы, имеющие неподеленную пару с участками молекул, на которые сосредоточен эффективный положительный заряд.
Электрофилы — анионы или молекулы, имеющие неподеленую пару электронов, взаимодействующие с участками молекул, на которые сосредоточен эффективный отрицательный заряд.
Индуктивный эффект — смещение электронной плотности σ – связи, происходящие вследствии различия электроотрицательностей.
Заместители вызывают поляризацию не только «своей», но и соседних σ-связей. Этот вид передачи влияния атомов называют индуктивным эффектом (/-эффект).
Из-за слабой поляризуемости σ-связи индуктивный эффект затухает через три-четыре связи в цепи.
Его действие наиболее сильно проявляется по отношению к атому углерода, соседнему с тем, у которого находится заместитель.
Направление индуктивного эффекта заместителя оценивается сравнением с атомом водорода, индуктивный эффект которого принят за нуль.
Графически результат /-эффекта изображают стрелкой, совпадающей с положением валентной черточки и направленной острием в сторону более электроотрицательного атома.
Отрицательный индуктивный эффект (-/-эффект).Такие заместители в целом понижают электронную плотность системы, их называют электроноакцепторными. К ним относится большинство функциональных групп: OH, NH₂, COOH, NO₂ и катионных групп, например -NH₃⁺.
Положительный индуктивный эффект (+/-эффект). Заместитель, смещающий по сравнению с атомом водорода электронную плотность σ-связи в сторону атома углерода цепи, проявляет положительный индуктивный эффект (+/-эффект).Такие заместители повышают электронную плотность в цепи (или кольце) и называются электронодонорными. К их числу относятся алкильные группы, находящиеся у sр2-гибридизированного атома углерода, и анионные центры в заряженных частицах, например -О-.
Мезомерный эффект — смещение электронной плотности в сопряженных системах с участием π-связей или неподеленных электронных пар
Заместитель, повышающий электронную плотность в сопряженной системе, проявляет положительный мезомерный эффект (+М- эффект). +М-Эффектом обладают заместители, включающие атомы с неподеленной парой электронов (например, аминогруппа в молекуле анилина) или целым отрицательным зарядом.
Заместитель, понижающий электронную плотность в сопряженной системе, проявляет отрицательный мезомерный эффект (-М- эффект). -М-Эффектом в сопряженной системе обладают атомы кислорода или азота, связанные двойной связью с атомом углерода.
Смещение электронной плотности обозначается изогнутой стрелкой, начало которой показывает, какие электроны смещаются, а конец — связь или атом, к которым они смещаются.
Мезомерный эффект, в отличие от индуктивного, передается по системе сопряженных связей на значительно большее расстояние.
Тесты ЕГЭ ФИПИ 2015 по теме «Гибридизация электронных облаков»
На чтение 6 мин Просмотров 1.8к.

| Буква греческого алфавита сигма |
|---|
| Σσς |
| ◄ | Ξ | Ο | Π | Ρ | Σ | Τ | Υ | Φ | Χ | ► |
| ◄ | ο | π | ρ | ς | σ | τ | υ | φ | χ | ► |
| ◄ | ξ | ο | π | ρ | ς | σ | τ | υ | φ | ► |
Характеристики
Название
Σ: greek capital letter sigma
σ: greek small letter sigma
ς: greek small letter final sigma
Юникод
Σ: U+03A3
σ: U+03C3
ς: U+03C2
HTML-код
Σ:
σ:
ς:
UTF-16
Σ: 0x3A3
σ: 0x3C3
ς: 0x3C2
Σ: %CE%A3
σ: %CF%83
ς: %CF%82
Мнемоника
Σ: Σ
σ: σ
ς: ς
Σ, σ, ς (название: си́гма, греч. σίγμα , др.-греч. σῖγμα ) — 18-я буква греческого алфавита. В системе греческой алфавитной записи чисел имеет значение 200. Происходит от финикийской буквы 

Строчное начертание сигмы двояко: в начале и середине слов пишется σ, в конце же ς. В некоторых книгах, особенно при издании папирусных фрагментов (где неясно, конец ли слова перед нами) вместо знаков Σ, σ, ς используется единое с-образное начертание буквы, так называемая «sigma lunatum», то есть «лунообразная сигма» (Ϲ, ϲ).
Финальную строчную сигму (ς) часто путают со строчной дзетой (ζ) (которая в конце слов практически не встречается) и со стигмой (Ϛ, ϛ), ныне употребляемой исключительно для обозначения цифры 6.
Обозначения [ править | править код ]
Прописная буква Σ обозначает:
Строчная σ обозначает:
- в теории вероятностей и математической статистике — среднеквадратичное отклонение (квадратный корень из дисперсии);
- в теории чисел — функцию суммы делителей числа ( σ ( n ) <displaystyle sigma (n)>
);
- сигма-алгебру — алгебру множеств, замкнутую относительно счётных объединений, использующуюся для ключевых определений теории меры и теории вероятностей;
- в физике — удельную проводимость, тензор напряжений, коэффициент поверхностного натяжения, механическое напряжение, постоянную Стефана — Больцмана, поверхностную плотность электрического заряда;
- в химии — сигма-связь — один из видов ковалентной связи и реакционную константу в уравнении Гаммета;
- в электронике существует Сигма-дельта модуляция.
- в квантовой механике — матрицы Паули.
С названием этой греческой буквы лишь опосредованно связаны названия сигмовидной кишки, а также графиков некоторых математических функций (сигмоиды): по форме они напоминают латинскую букву S.
Как набрать «скрытые» символы на клавиатуре с помощью Alt кодов и HTML мнемоник
Существующих символов — а это не только буквы, цифры, знаки математические и пунктуационные, и многие другие, — гораздо больше, чем клавиш на клавиатуре компьютера. Сотрудники компании Microsoft, разработавшие систему Windows, решили эту проблему, присвоив каждому символу уникальный код, ввод которого осуществляется при помощи клавиши Alt.
Для ознакомления со списком всех существующих символов нужно зайти в меню «Пуск» и далее:
Все программы -> Стандартные -> Служебные -> Таблица символов
В результате откроется таблица символов в Unicode.
Для справки: Unicode — стандарт кодирования символов, позволяющий представить знаки практически всех письменных языков. Изначально Unicode был создан для устранения ошибок с кодировкой.
Чтобы перевести таблицу в удобную для вас кодировку, нужно поставить галочку напротив «Дополнительных параметров просмотра» и при помощи выпадающего меню выбрать необходимый набор символов («кириллица» для русского языка).
Alt коды
Для набора Alt кода нужно зажать клавишу Alt и поочерёдно нажать указанные цифры кода, после клавиша Alt отпускается. Символ появится после отпускания клавиши.
HTML мнемоники
Помимо Alt кодов приведены в таблице приведены HTML мнемоники.
Мнемоника — это кодовое представление символа в HTML, начинающегося со знака амперсанда «&» и завершающееся точкой с запятой «;».
Соответственно в HTML, например, символ «больше» можно записать двумя способами:
> — как обычный символ
> — как код-мнемоника;
Символ может быть отображен только в том случае, если представлен в используемом шрифте. В противном случае, вы увидите прямоугольник, знак вопроса и нечто иное, обозначающее отсутствие изображения для указанного символа.
Сейчас данная проблема успешно решается благодаря подключаемым шрифтам.
Сегодня поговорим об одной замечательной особенности, о которой знают довольно малое количество пользователей ПК. Это может вызвать удивление, но уже немало насмотрелся, как для простого копирования, которое выполняется с помощью комбинации клавиш Ctrl-C, люди изгаляются через выделение нужного фрагмента (чаще слова) мышкой, затем жмут правую клавишу и выбирают пункт «копировать». Альтернативный вариант — копирование через кнопку, расположенную на панели инструментов.

Как обычно происходит вставка в текст символов, отсутствующих на клавиатуре в явном виде? Вызывается программа «Таблица символов» ( Win+R → charmap → Enter ), там долго и упорно ищется нужный символ, который и добавляется. Минус у такого решения, пожалуй, один — слишком долго искать нужно. Не спорю, порой попадаются действительно «непечатаемые знаки», но в обычно этого не требуется.
Для набора Alt кода следует зажать клавишу Alt (удивлены?) и на цифровой клавиатуре (той, что справа, за стрелками) нажать поочерёдно указанные цифры, после клавиша Alt отпускается. Проблемы могут возникнуть с укороченными клавиатурами, что свойственно для ноутбуков. В таком случае, как правило, нужно дополнительно зажать синюю клавишу Fn.
В таблице ниже попытался собрать самые необходимые символы, дополненные потенциально полезными. Помимо Alt кодов приведены и HTML мнемоники.
Мненимоника — конструкция, кодирующая спецсимволы определённым образом. Имеет вид: &обозначение; — амперсанд+обозначение+точка-с-запятой .
Для произвольного использования спецзнаков из таблицы имеются противопоказания. Неважно, печатается символ «как есть» или с помощью мнемоники, отображён он может быть только в том случае, если представлен в используемом шрифте. В противном случае, вы увидите прямоугольник, знак вопроса и нечто иное, обозначающее отсутствие изображения для указанного символа. Сейчас данная проблема успешно решается благодаря подключаемым шрифтам. Но авторам текстов необходимо иметь ввиду, что «вордовский» документ, набранный шрифтом Calibri, не всегда полностью отобразится у заказчика, который использует иную операционную систему со своим набором предустановленных шрифтов. Безопасными можно считать «наиболее полезные символы», а с дробями возможны проблемы.
Пояснения по поводу подписей «для ru» и «для en». Это текущий, активный, язык ввода. Как правило, дефолтное переключение назначено на сочетание клавиш Alt+Shift.



























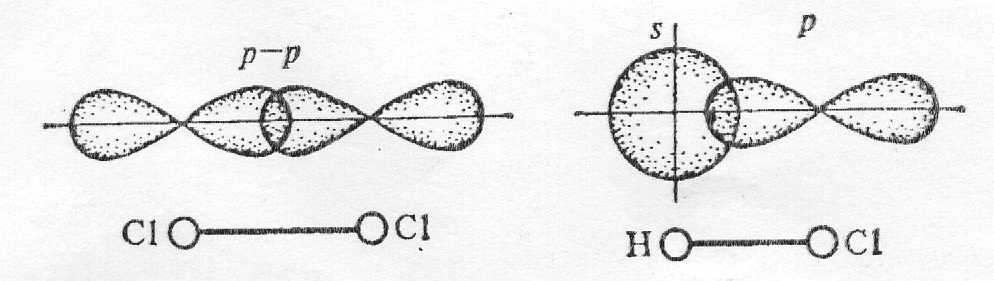
![[[pictureof]]](https://dist-tutor.info/s3/dist-tutor/user/20094/ava/thumbnails/mQ6siSVtAT1Szar.jpg)








 );
);