|
|

|
|
| Names | |
|---|---|
| Preferred IUPAC name
Potassium metasilicate |
|
| Other names
Liquid glass |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChemSpider |
|
| ECHA InfoCard | 100.029.989 |
| EC Number |
|
| E number | E560 (acidity regulators, …) |
|
PubChem CID |
|
| UNII |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
K2O3Si |
| Molar mass | 154.279 g·mol−1 |
| Appearance | White crystals |
| Hazards | |
| GHS labelling: | |
|
Pictograms |
 
|
|
Signal word |
Danger |
|
Hazard statements |
H314, H335 |
|
Precautionary statements |
P260, P261, P264, P271, P280, P301+P330+P331, P303+P361+P353, P304+P340, P305+P351+P338, P310, P312, P321, P363, P403+P233, P405, P501 |
| NFPA 704 (fire diamond) |
1 0 0 |
| Related compounds | |
|
Other anions |
Potassium carbonate Potassium germanate Potassium stannate Potassium plumbate |
|
Other cations |
Sodium silicate |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Potassium silicate is the name for a family of inorganic compounds. The most common potassium silicate has the formula K2SiO3, samples of which contain varying amounts of water. These are white solids or colorless solutions.[1]
Synthesis, structure, reactions[edit]
Potassium silicate can be synthesized in the laboratory by treating silica with potassium hydroxide, according to this idealized equation:
These solutions are highly alkaline. Addition of acids causes the reformation of silica.
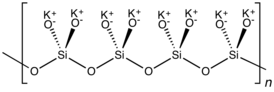
K2SiO3 adopts a chain or cyclic structures with interlinked SiO32− monomers. Each Si is tetrahedral.
Uses[edit]
Woodwork protection against fire[edit]
Impregnation of wood with a potassium silicate solution is an easy and low cost way for rendering the woodwork of houses secure against catching fire. The woodwork is first saturated with a diluted and nearly neutral solution of potash silicate. After drying, one or two coats of a more concentrated solution are usually applied.[2]
Horticulture[edit]
In horticulture, potassium silicate is used as a soluble source of potassium and silica. It makes the growing medium more alkaline.
It is also used as a supplement (in conjunction with normal fertilizer) for the numerous benefits that increasing the availability of silicon compounds has. Silicon-containing compounds are valuable to a plant, and serve to support the plant. Stems thicken, the plant becomes more tolerant to drought and resists wilting, and the plant gets larger leaves and fruit (because the stem can support more weight).[3] The thicker cell walls of the plant also provides an added mechanical resistance to sap sucking insects (e.g. spider mite) and various pathogenic fungi (e.g. powdery mildew).
Industrial uses[edit]
Some metal cleaning formulations use potassium silicate, which also serves as a corrosion inhibitor.[4] It also finds various uses in the fabrication of welding rods or even of cosmetics.
Safety[edit]
Potassium silicate is strongly alkaline.
See also[edit]
- Sodium silicate
- Silica gel
References[edit]
- ^ Gerard Lagaly, Werner Tufar, A. Minihan, A. Lovell «Silicates» in Ullmann’s Encyclopedia of Industrial Chemistry, Wiley-VCH, 2005. doi:10.1002/14356007.a23_661
- ^ Cobleigh, Rolfe (1909). Handy farm devices and how to make them. Part II: Worth knowing to render wood fireproof. New York: Orange Judd.
- ^ S. Y. Wang & G. J. Galletta (1998) Foliar application of potassium silicate induces metabolic changes in strawberry plants, Journal of Plant Nutrition, 21:1, 157-167, doi:10.1080/01904169809365390
- ^ Elmore AR (2005). «Final report on the safety assessment of potassium silicate, sodium metasilicate, and sodium silicate». Int. J. Toxicol. 24 (Suppl 1): 103–17. doi:10.1080/10915810590918643. PMID 15981734. S2CID 208153862.
External links[edit]

|
|

|
|
| Names | |
|---|---|
| Preferred IUPAC name
Potassium metasilicate |
|
| Other names
Liquid glass |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChemSpider |
|
| ECHA InfoCard | 100.029.989 |
| EC Number |
|
| E number | E560 (acidity regulators, …) |
|
PubChem CID |
|
| UNII |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
K2O3Si |
| Molar mass | 154.279 g·mol−1 |
| Appearance | White crystals |
| Hazards | |
| GHS labelling: | |
|
Pictograms |
 
|
|
Signal word |
Danger |
|
Hazard statements |
H314, H335 |
|
Precautionary statements |
P260, P261, P264, P271, P280, P301+P330+P331, P303+P361+P353, P304+P340, P305+P351+P338, P310, P312, P321, P363, P403+P233, P405, P501 |
| NFPA 704 (fire diamond) |
1 0 0 |
| Related compounds | |
|
Other anions |
Potassium carbonate Potassium germanate Potassium stannate Potassium plumbate |
|
Other cations |
Sodium silicate |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Potassium silicate is the name for a family of inorganic compounds. The most common potassium silicate has the formula K2SiO3, samples of which contain varying amounts of water. These are white solids or colorless solutions.[1]
Synthesis, structure, reactions[edit]
Potassium silicate can be synthesized in the laboratory by treating silica with potassium hydroxide, according to this idealized equation:
These solutions are highly alkaline. Addition of acids causes the reformation of silica.
K2SiO3 adopts a chain or cyclic structures with interlinked SiO32− monomers. Each Si is tetrahedral.
Uses[edit]
Woodwork protection against fire[edit]
Impregnation of wood with a potassium silicate solution is an easy and low cost way for rendering the woodwork of houses secure against catching fire. The woodwork is first saturated with a diluted and nearly neutral solution of potash silicate. After drying, one or two coats of a more concentrated solution are usually applied.[2]
Horticulture[edit]
In horticulture, potassium silicate is used as a soluble source of potassium and silica. It makes the growing medium more alkaline.
It is also used as a supplement (in conjunction with normal fertilizer) for the numerous benefits that increasing the availability of silicon compounds has. Silicon-containing compounds are valuable to a plant, and serve to support the plant. Stems thicken, the plant becomes more tolerant to drought and resists wilting, and the plant gets larger leaves and fruit (because the stem can support more weight).[3] The thicker cell walls of the plant also provides an added mechanical resistance to sap sucking insects (e.g. spider mite) and various pathogenic fungi (e.g. powdery mildew).
Industrial uses[edit]
Some metal cleaning formulations use potassium silicate, which also serves as a corrosion inhibitor.[4] It also finds various uses in the fabrication of welding rods or even of cosmetics.
Safety[edit]
Potassium silicate is strongly alkaline.
See also[edit]
- Sodium silicate
- Silica gel
References[edit]
- ^ Gerard Lagaly, Werner Tufar, A. Minihan, A. Lovell «Silicates» in Ullmann’s Encyclopedia of Industrial Chemistry, Wiley-VCH, 2005. doi:10.1002/14356007.a23_661
- ^ Cobleigh, Rolfe (1909). Handy farm devices and how to make them. Part II: Worth knowing to render wood fireproof. New York: Orange Judd.
- ^ S. Y. Wang & G. J. Galletta (1998) Foliar application of potassium silicate induces metabolic changes in strawberry plants, Journal of Plant Nutrition, 21:1, 157-167, doi:10.1080/01904169809365390
- ^ Elmore AR (2005). «Final report on the safety assessment of potassium silicate, sodium metasilicate, and sodium silicate». Int. J. Toxicol. 24 (Suppl 1): 103–17. doi:10.1080/10915810590918643. PMID 15981734. S2CID 208153862.
External links[edit]
Неорганическая соль, соль щелочного металла калия и метакремниевой кислоты.
Альтернативное название
Калий кремнекислый; калиевая силикат-глыба; К метасиликат калия
Формула
K2SiO3
Физические свойства
| Свойство | Описание |
|---|---|
| Внешний вид | Бесцветные прозрачные кристаллы или белые хлопья |
| Молярная масса | 976 г/моль |
| Температура плавления | -97oС |
| Плотность | 2,6 г/см3 |
Химические свойства
При взаимодействии с сильными кислотами оседает гелеобразный осадок кремниевых кислот общей формулы nH20·mSiO2:
m K2SiO3 + 2m HCl + (n-m) H2O = 2m KCl + nH20·mSiO2↓.
При взаимодействии с плавиковой кислотой образуется гексафторосиликат калия:
K2SiO3 + 6HF = K2[SiF6]↓ + 3H20.
В водном растворе подвергается гидролизу. В холодной воде гидролиз частичный:
K2SiO3 + 6HF = KHSiO3 + KOH,
а в горячей он протекает до конца с образованием осадка кремниевых кислот:
K2SiO3 + (n+1) H2O = 2KOH + SiO2· nH20 ↓.
Силикат калия реагирует с диоксидом углерода:
K2SiO3 + СО2 = SiO2 ↓+ K2CO3.
Получение в промышленности
В промышленности силикат калия получают сплавлением оксида кремния (кварцевого песка) с гидроксидом калия (едким кали) или с карбонатом калия (поташем):
SiO2 + 2KOH = K2SiO3+ Н2О,
SiO2 + K2CO3 = K2SiO3+ СО2.
В первом случае процесс заканчивается при температуре 950-1000°С, во втором – при 1050°С. В результате получается калиевая силикат-глыба. Растворяя ее в горячей воде получают калиевое жидкое стекло. Водный раствор силиката калия имеет консистенцию очень вязкой тягучей жидкости.
Применение
Силикат калия в виде жидкого стекла применяется как клей для склеивания бумаги, стекла, дерева и металла, его добавляют в строительные материалы. Им обрабатывают почву вокруг свай при сооружении фундаментов. В литейном производстве из него и смесей с другими веществами делают литейные формы. Входит он и в состав некоторых строительных смесей для предотвращения их слеживаемости.
В сельском хозяйстве силикат калия применяют в качестве кремниевого удобрения, повышающего урожайность и иммунитет растений к болезням и неблагоприятным условиям среды.
Силикат кальция используется в производстве красок. Получающиеся краски применяют для внутренних работ в помещениях и обладают высокой огнестойкостью. Оценили их и художники как одни из лучших для фресок.
В пищевой промышленности он применялся в России до 2010 г как пищевая добавка Е560 применяемая как средство для предотвращения слеживаемости. Его добавляли в сухое молоко, соль, сахар и другие продукты. Сейчас он запрещен в большинстве стран, кроме Китая и Украины до выяснения его влияния на окружающую среду. Также его подозревают в том, что при передозировке он вреден для желудка и кишечника. Проводятся исследования с целью вынесения окончательного решения об обоснованности его применения в пищевой промышленности.
В медицине его применяют для снижения слеживаемости порошков, а также в качестве вспомогательного вещества в составе таблеток. При умеренном употреблении (не более 30 мг в сутки) силикат калия безвреден.
Пример решения задачи
Какое осмотическое давление 20% раствора силиката калия при температуре 60°С? Плотность раствора равна 1,2 г/мл.
Решение
Вес 1000 мл раствора равен 1,2·1000 = 1200 г.
Молярная масса силиката калия М = 154,28 г/моль.
Составляем пропорцию:
в 100 г раствора – 20 г K2SiO3,
в 1200 г раствора – х г K2SiO3.
х = 1200 · 20 / 100 = 240 г.
Уравнение диссоциации K2SiO3:
K2SiO3 = 2K+ + SiO32-.
Число ионов, образующихся при диссоциации K2SiO3/, i=3.
Молярная концентрация раствора
СМ = 240 / 154,28 = 1,556 моль/л = 1556 моль/м3.
Осмотическое давление:
росм = i· СМ ·R· T = 3·1556 ·8.314 · (60+273) = 1,29·107 Па = 1,29·107 / 1,013·105 = 127,5 атм.
Ответ: 127,5 атм.
Силикат калия — это неорганическое соединение калия и метакремниевой кислоты. Вещество применяется во многих областях: как кремнийсодержащее удобрение в садоводстве, в качестве пропитки, препятствующей возгоранию древесных изделий, для получения сварочных смесей, как антикоррозийный элемент. Калиевый силикат в составе косметических и лекарственных средств выполняет функцию антислёживающего агента, он проявляет бактерицидное и эмульгирующее действие. Ранее применялся в пищевой отрасли под кодом Е560, сегодня эта добавка запрещена в связи с доказанным вредом желудочно-кишечному тракту.
Содержание
- Что такое силикат калия, формула
- Физические свойства, внешний вид
- Химические свойства, реакции
- Производство и получение, уравнение калия силиката
- Применение
- Применение в пищевой промышленности, косметологии и фармацевтике
- Применение в сельском хозяйстве и других областях
- Польза и вред пищевой добавки
- Упаковка, транспортировка, класс опасности
- Где купить и сколько стоит
- Заключение
Что такое силикат калия, формула
Силикат калия представляет собой калиевую соль кремниевой кислоты – слабое нестабильное вещество с химической формулой H2SiO3. Кремнекислый калий описывается формулой K2SiO3. Он не встречается в природе, синтезирован искусственным путём. Является результатом замещения двух атомов водорода калием – высокореактивным металлом щелочной группы. Молекула представляет собой полимерные единицы, состоящие из кремния, соединённого с двумя кислородами (валентность +4) посредством ковалентных полярных связей, с положительно заряженным калием.
Физические свойства, внешний вид
Силикат калия — это порошок, хлопья либо мелкодисперсные кристаллы беловатого либо желтоватого цвета, могут быть бесцветные. Не имеет вкуса и запаха, высоко гигроскопичный. Растворяется в воде, при нагревании растворимость улучшается. В холодном растворе образует коллоиды, взвесь мелких частичек в жидкой фазе, в горячем – разлагается.
Концентрированный раствор силиката называют жидким стеклом, широко применяется для выпуска стройматериалов, огнеупорных красок, машинного масла. При этом формируется гидрозоль – равномерно распределённая взвесь твёрдого тонко распыленного твёрдого вещества в воде. Атомарный состав гидрозоля: SiO2∙nH2O. Не смешивается со спиртами, в частности с этанолом.
Плавится в пределах 976-978 °С, плотность низкая. Раствор силиката характеризуется сильнощелочной реакцией из-за гидролиза по аниону, который сопровождается отделением большого количества гидроксильных группировок (-OH). Проявляет высокую адсорбирующую способность.
Химические свойства, реакции
Силикат калия реагирует с кислотами, вступая в реакцию ионного обмена. Так, при взаимодействии с хлороводородом выделяется хлорид калия:
K2SiO3 + 2HCl → 2KCl + H2SiO3↓
Это качественная реакция, осаждается слаборастворимая кислота калия – желейного белёсого студенистого осадка. Силикат калия реагирует с газами, с диоксидом углерода даёт кремнезём и карбонат:
K2SiO3 + CO2 → SiO2↓ + K2CO3
Гидролиз протекает в растворе, реакция сопровождается выделением гидрометасиликата калия, калиевых и гидроксид-ионов:
K2SiO3 + H2O → KHSiO3 + HO– + K+
Силикат калия реагирует с горячей жидкостью, при этом начинается необратимое разложение до едкого кали:
K2SiO3 + 2H2O → 2KOH + H2SiO3↓
Реакция с плавиковой кислотой калия силиката даёт гексафторосиликат калия:
K2SiO3 + HF → K2[SiF6]↓ + 3H2O.
Производство и получение, уравнение калия силиката
Кристаллы силиката калия
Метасиликат калия в лабораторных и промышленных условиях синтезируют путём сплавления. Карбонат калия реагирует с оксидом:
SiO2 + K2CO3 → K2SiO3 + CO2↑
Из уравнения калия силиката следует, что это обратимая реакция, которая может идти в обе стороны. Она протекает при нагреве порядка 1150 °С. Менее жёсткий температурный режим возможен при смешивании кремнезёма с каустическим поташем:
SiO2 + KOH → K2SiO3 + H2O
Процесс производства идёт в несколько этапов:
- Подготавливают сырьё, им служит в основном кварцевый песок. Необходимо, чтобы он был чист от негашёной извести, оксидов железа, алюминия. При необходимости его дополнительно обогащают для снижения концентрации вредных примесей. В качестве источника щёлочи выбирают сульфат натрия, соду.
- Для получения шихты – однородной смеси материалов, их смешивают, проводят увлажнение до 6%, это улучшает однородность и облегчает перемешивание. При этом на поверхности кварцевых зерен образуется щелочная плёнка, что интенсифицирует силикатообразование.
- Дальнейшие этапы протекают при постепенном снижении и повышении режима температуры. При 100-120 °С удаляют излишнюю влагу.
- При 500 °С происходят полиморфные превращения кварца: изменение модификации (тригональная, гексональная).
- При 855 °С расплавляются различные составляющие шихты, например, натриевая соль угольной кислоты.
- При 900 °С образуется силикат калия. При дальнейшем нагреве (1400 °С) формирует стекольная масса, которая затем охлаждается. Для выработки чистого соединения на этом этапе его фильтруют.
- Кристаллы отправляются в вакуумную сушку, где освобождаются от избыточного увлажнения, затем просеиваются.
Применение
Силикат калия используется в лёгкой и тяжёлой промышленности. Это сырьё для изготовления стекла, устойчивых к возгоранию стройматериалов. Другая сфера применения силикатного порошка – удобрение для почв, бедных кремнием. Гидрированный силикат натрия хорошо склеивает металл, дерево и бумагу, укрепляет фундамент построек, подходит для создания литейных форм. Реагент нашел применение в медицине и косметике, он предотвращает образование комочков, уничтожает патогенную микрофлору.
Применение в пищевой промышленности, косметологии и фармацевтике
Добавка Е560 до 2010 года в большинстве стран использовалась как эмульгатор и стабилизатор. Она не давала сыпучим продуктам слёживаться, поглощать влажность из воздуха, образуя комочки, способствовала сохранению привлекательного товарного вида. После тщательных исследований выяснилось, что силикат калия небезопасен, после чего его исключили из оборота многие государства, кроме Украины и Китая. Ранее встречался на упаковке такой продукции, как:
- быстрорастворимые напитки;
- мука;
- соль;
- сахар, сахарная пудра;
- супы и картофельное пюре быстрого приготовления;
- кофе, какао.
Несмотря на запрет в пищевой индустрии, силикат калия добавляется в косметику. Часто производители вносят его в сыпучие средства, такие как тени для век, румяна, пудру, сухие духи, антиперспиранты, присыпки. Играет роль связующего компонента, продлевает срок годности, негативно влияет на бактерии и грибки, подавляя их жизнедеятельность.
Схожую функцию силикат калия выполняет в лекарствах. Его добавляют в таблетированные формы для увеличения стойкости таблетки к действию повреждающих механических факторов, для эмульгации активного компонента со вспомогательными. Важен для медицинской сферы, поскольку препятствует образованию комков в порошковых смесях.
Применение в сельском хозяйстве и других областях
Силикат калия — это хорошая подкормка, восстанавливающая содержание микроэлементов в клеточном соке. При недостатке этого элемента растения чувствуют себя плохо, это сопровождается такими симптомами, как:
- побеги истончаются и становятся более ломкими;
- листья теряют хлорофилл, начинают желтеть и увядать;
- снижается урожайность за счёт потери некоторых цветков способности к опылению;
- цветение отсутствует или менее обильное;
- плохо растут корни;
- нарушается солевой обмен, хуже усваивают азот и фосфор, понижается продуктивность зелёной массы.
Удобрение понижает кислотность субстрата. В кислых почвах растения развиваются хуже, поэтому при избытке органических кислот (фульвокислоты, винная, уксусная и др.) необходимо повышать значение водородного показателя.
Из-за специфических свойства возможно применение как внекорневой и как прикорневой подкормки. Он способствует упрочнению листьев, стеблей и побегов, укрепляет клеточную стенку при сохранении её упругости, запускает рост и цветение декоративных культур. Стимулируется устойчивость к стрессовым факторам, улучшается морозостойкость, засухоустойчивость. Благодаря силикату у растений формируется стойкий иммунитет против патогенов и вредителей.
В строительстве силикат калия – кислото- и гидроупорная добавка в строительные спецпродукты. Это пластификатор бетона и цемента, улучшает его прочность и устойчивость при застывании, снижает нагрузку повреждающих факторов среды. Он необходим для производства электродов, а также сварок, литья. Его добавляют в краски, которые можно использовать для внутренних и внешних отделочных работ, они устойчивы к действию пламени, отличаются низкой пожароопасностью.
Польза и вред пищевой добавки
Е560 не приносит организму пользы, поскольку минералы в таком виде не усваиваются организмом и находятся в продукции в слишком низкой концентрации. Попадая в ЖКТ, соединение проходит через него и выделяется неизменным.
Существуют данные о негативном влиянии силиката на слизистую желудка и кишечника. Он токсичен и очень щелочной, способен вызывать повреждения тканей и провоцировать обострение хронических заболеваний. Учёные предполагают, что он может вредить и окружающей среде, однако однозначного ответа пока нет, проводятся испытания.
Упаковка, транспортировка, класс опасности
Силикат калия относится к 4 классу (малоопасные). При перевозке он упаковывается в вакуумированные полиэтиленовые мешки, мягкие контейнеры, картонные коробки. Раствор силиката транспортируют в плотно закрытых канистрах или бочках.
Где купить и сколько стоит
Силикат калия продаётся заводами-производителями оптом. Цена порошкообразного товара от 70 рублей за 1 кг, раствора – 100-120 руб/л. В качестве удобрения его можно приобрести в садовых магазинах от 80 рублей за 200 грамм.
Заключение
Силикат калия – это огнезащитный реактив, который эффективно повышает температуру возгорание пигментов. Он стабилизирует строительные смеси, повышает их прочность, входит в состав сжижженного стекла, ориентированного на склейку поверхностей разной природы. Использовался в сухих продуктах питания, стабилизируя их структуру, позже исключён из списка безопасных добавок. До сих пор применяется в сыпучей косметике, присыпках, медицинских препаратах. Восполняет дефицит калия в растениях, способствует повышению значения pH почвы.
Читайте также:
- Силикат натрия: свойства, описание, применение
- Нитрат серебра: свойства, реакции, инструкция, применение
- Сульфат алюминия: свойства, применение
- Дихлорметан: свойства, реакции, применение
Сайт предоставляет информацию в справочных целях, только для ознакомления. Поставить диагноз и назначить адекватное лечение может только врач! Медикаменты и народные средства должны назначаться специалистом, так как имеют противопоказания и побочные действия! Посещение и консультации квалифицированного специалиста строго обязательны!
Загрузка…

|
|

|
|
| Имена |
|
|---|---|
| Предпочтительное имя IUPAC
Метасиликат калия |
|
| Другие имена Жидкое стекло Жидкое |
|
| Идентификаторы |
|
|
Количество CAS |
|
|
3D модель ( JSmol ) |
|
| ХимПаук |
|
| Информационная карта ECHA | 100.029.989 |
| Номер ЕС |
|
| номер Е | E560 (регуляторы кислотности, …) |
|
PubChem CID |
|
| УНИИ |
|
|
Панель управления CompTox ( EPA ) |
|
|
ИнЧИ
|
|
|
УЛЫБКИ
|
|
| Характеристики |
|
|
Химическая формула |
К 2 О 3 Si |
| Молярная масса | 154,279 г·моль -1 |
| вид |
Белые кристаллы |
| Опасности |
|
| Маркировка СГС : |
|
|
Пиктограммы |
 
|
|
Сигнальное слово |
Опасность |
|
Заявления об опасности |
Х314 , Х335 |
|
Заявления о мерах предосторожности |
P260 , P261 , P264 , P271 , P280 , P301+P330+ P331 , P303+ P361+P353 , P304+P340 , P305+P351+P338 , P310 , P312 , P321 , P363 , P403 + P233 , P401 |
| NFPA 704 (огненный алмаз) |
1 0 0 |
| Родственные соединения |
|
|
Другие анионы |
Карбонат калия Германат калия Станнат калия Плюбат калия |
|
Другие катионы |
Силикат натрия |
|
Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 °C [77 °F], 100 кПа).
Ссылки на информационные ящики |
Силикат калия — это название семейства неорганических соединений . Наиболее распространенный силикат калия имеет формулу K 2 SiO 3 , образцы которого содержат различное количество воды . Это белые твердые вещества или бесцветные растворы. [1]
Синтез, строение, реакции [ править ]
Силикат калия можно синтезировать в лаборатории путем обработки кремнезема гидроксидом калия в соответствии с этим идеализированным уравнением:
Эти растворы сильно щелочные. Добавление кислот вызывает преобразование кремнезема.
K 2 SiO 3 принимает цепочечную или циклическую структуру со связанными мономерами SiO 3 2- . Каждый Si является тетраэдрическим.
Использует [ править ]
Защита деревянных изделий от огня [ править ]
Пропитка древесины раствором силиката калия является простым и малозатратным способом защиты деревянных конструкций домов от возгорания. Деревянные изделия сначала пропитывают разбавленным и почти нейтральным раствором силиката калия. После высыхания обычно наносят один-два слоя более концентрированного раствора. [2]
Садоводство [ править ]
В садоводстве силикат калия используется как растворимый источник калия и кремнезема . Это делает среду выращивания более щелочной.
Он также используется в качестве добавки (в сочетании с обычным удобрением ) из-за многочисленных преимуществ, которые дает увеличение доступности соединений кремния. Кремнийсодержащие соединения ценны для растения и служат для его поддержки. Стебли утолщаются, растение становится более устойчивым к засухе и сопротивляется увяданию, у него появляются более крупные листья и плоды (поскольку стебель может выдерживать больший вес). [3] Более толстые клеточные стенки растения также обеспечивают дополнительную механическую устойчивость к сосущим сок насекомым (например, паутинному клещу ) и различным патогенным грибкам (например , мучнистой росе ).
Промышленное использование [ править ]
В некоторых составах для очистки металлов используется силикат калия, который также служит ингибитором коррозии. [4] Он также находит различное применение в производстве сварочных прутков и даже косметических средств.
Безопасность [ править ]
Силикат калия сильно щелочной.
Смотрите также [ править ]
- Силикат натрия
- Силикагель
Ссылки [ править ]
- ^ Джерард Лагали, Вернер Туфар, А. Минихан, А. Ловелл «Силикаты» в Энциклопедии промышленной химии Ульмана, Wiley-VCH, 2005. doi : 10.1002/14356007.a23_661
- ^ Кобли, Рольф (1909). Удобные сельскохозяйственные приспособления и как их сделать. Часть II: Стоит знать, как сделать древесину огнеупорной . Нью-Йорк: Оранжевый Джадд.
- ^ SY Wang & GJ Galletta (1998) Внекорневое внесение силиката калия вызывает метаболические изменения в растениях клубники, Journal of Plant Nutrition, 21: 1, 157-167, doi : 10.1080/01904169809365390
- ^ Элмор А.Р. (2005). «Заключительный отчет об оценке безопасности силиката калия, метасиликата натрия и силиката натрия». Междунар. Дж. Токсикол . 24 (Приложение 1): 103–17. дои : 10.1080/10915810590918643 . PMID 15981734 . S2CID 208153862 .
Внешние ссылки [ править ]
 |
|
 |
|
| Имена | |
|---|---|
| Предпочитающий ed Название IUPAC Метасиликат калия | |
| Другие названия Жидкое стекло. Waterglass | |
| Идентификаторы | |
| Номер CAS |
|
| 3D-модель (JSmol ) |
|
| ChemSpider |
|
| ECHA InfoCard | 100.029.989 |
| Номер EC |
|
| Номер E | E560 (кислотность регуляторы,…) |
| PubChem CID |
|
| UNII |
|
| CompTox Dashboard (EPA ) |
|
InChI
|
|
УЛЫБКА
|
|
| Свойства | |
| Химическая формула | K2O3Si |
| Молярная масса | 154,279 г · моль |
| Внешний вид | Белые кристаллы |
| Опасности | |
| Классификация ЕС (DSD) (устаревшая) | Коррозионная (C ), раздражающая (Xi) |
| R-фразы (устаревшие)) | R34, R37 |
| S-фразы (устаревшие) | (S1 / 2), S13, S24 / 25, S36 / 37/39, S45 |
| NFPA 70 4 (огненный алмаз) |  0 1 0 0 1 0 |
| Родственные соединения | |
| Другие анионы | Карбонат калия… |
| Другие катионы | Силикат натрия |
| Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобокс | |
Силикат калия — это название семейства неорганических соединений. Наиболее распространенный силикат калия имеет формулу K 2 SiO 3, образцы которого содержат различные количества воды. Это белые твердые вещества или бесцветные растворы.
Содержание
- 1 Синтез, структура, реакции
- 2 Использование
- 2.1 Защита деревянных конструкций от огня
- 2.2 Садоводство
- 2.3 Промышленное использование
- 3 Безопасность
- 4 См. Также
- 5 Ссылки
- 6 Внешние ссылки
Синтез, структура, реакции
Силикат калия может быть синтезирован в лаборатории путем обработки кремнезема гидроксидом калия, согласно этому идеализированному уравнению:
- n SiO 2 + 2 KOH ⟶ K 2 O ⋅ n SiO 2 + H 2 O { displaystyle { ce {{ mathit {n}} {SiO2} + 2KOH->K2O. { Mathit {n}} {SiO2} + H2O}}}
Эти растворы очень щелочные. Добавление кислот вызывает <преобразование кремнезема. 223>SiO 3 имеет цепную или циклическую структуру со связанными мономерами SiO 3. Каждый Si является тетраэдрическим.
Используется
Woodw Защита орков от огня
Пропитка древесины раствором силиката калия — простой и недорогой способ обезопасить деревянные конструкции домов от возгорания. Деревянные изделия сначала пропитываются разбавленным и почти нейтральным раствором силиката калия. После высыхания обычно наносят один или два слоя более концентрированного раствора.
Садоводство
В садоводстве силикат калия используется в качестве растворимого источника калий и кремний. Это делает среду выращивания более щелочной.
Он также используется в качестве добавки (в сочетании с обычным удобрением ) из-за многочисленных преимуществ, связанных с увеличением доступности соединений кремния. Кремнийсодержащие соединения ценны для растений и служат для поддержания растений. Стебли утолщаются, растение становится более устойчивым к засухе и сопротивляется увяданию, а у растения появляются более крупные листья и плоды (поскольку стебель может выдерживать больший вес). Более толстые клеточные стенки растения также обеспечивают дополнительную механическую стойкость к насекомым, сосущим сок (например, паутинный клещ ) и различным патогенным грибам (например, мучнистая роса ).
Промышленное использование
В некоторых составах для очистки металлов используется силикат калия, который также служит ингибитором коррозии. Он также находит различное применение при изготовлении сварочных стержней или даже в косметике.
Безопасность
Силикат калия является сильнощелочным.
См. Также
- Силикат натрия
Ссылки
Внешние ссылки
Силикат калия
Potassium silicate
Силикат калия (пищевая добавка Е560) — калиевая соль кремниевой кислоты с формулой K2SiO3. Внешне выглядит как кристаллоподобный порошок белого цвета с жёлтым отливом без вкуса и запаха с низкой насыпной плотностью и высокой способностью к физической адсорбции воды. Растворим в воде, нерастворим в спиртах. В основе строения всех силикатов лежат тетраэдры [SiO4]4-, способные связываться (полимеризоваться) своими вершинами с образованием островных, кольцевых, цепочечных, слоистых и каркасных структур.
Силикаты широко распространены в природе (около 75 % массы земной коры), составляют примерно треть всех известных минералов (полевые шпаты, глинистые минералы, слюды и т.п.).
Получают нагреванием смесей, содержащих оксиды кремния и калия; гидротермальным синтезом; осаждением из растворов и газовой фазы; кристаллизацией расплавов и стёкол.
Пищевая добавка Е560 относится к добавкам препятствующим слёживанию и комкованию синтетического происхождения, используется в технологических целях в процессе производства пищевых продуктов.
Получение
Силикат калия образуется при сплавлении оксида кремния (IV) с карбонатом калия (1) или гидроксидом калия (2):
SiO2 + K2CO3 = K2SiO3 + CO2↑ (t = 1150 °C) (1);
SiO2 + 2KOH = K2SiO3 + H2O (t = 900–1000 °C) (2).
Применение
Как пищевая добавка Е560 практически не используется. Существует жёсткие ограничения по её применению в производстве пищевых продуктов. Её дозировка не должна превышать от 10 до 30 грамм на 1 килограмм готового продукта. Диетологи и гастроэнтерологи рекомендуют ограничивать употребление продуктов, содержащих силикат калия из-за потенциальных осложнений в области пищеварительной системы.
Силикат калия может использоваться в качестве удобрения, ингредиента чистящих средств и строительных материалов.
Польза и вред
Научные данные о пользе применения пищевой добавки Е559 для здоровья человека в настоящий момент отсутствуют. Биологической ценности не представляет.
Силикат калия токсичен. Может вызывать патологии органов брюшной полости и пищеварительного тракта. Силикат калия сильно щелочной.
Беременность и грудное вскармливание
Применение при беременности
Категория действия на плод по FDA — N.
Адекватных и хорошо контролируемых исследований о возможности применения силиката калия у беременных женщин не проведено.
Применение в период грудного вскармливания
Специальных исследований о возможности применения силиката калия в период грудного вскармливания не проведено.
Особые указания
Пищевая добавка Е560 не входит в перечень разрешённых в Российской Федерации, Евросоюзе, на Украине и большинстве стран мира.
Классификация
-
Категория при беременности по FDA
N
(не классифицировано FDA)
Поиск химических веществ по названиям или формулам.
Справочник содержит названия веществ и описания химических формул (в т.ч. структурные формулы и скелетные формулы).
Введите часть названия или формулу для поиска:
Общее число найденных записей: 223.
Показано записей: 20.
1. Метасиликат калия
Брутто-формула:
K2O3Si
CAS# 10006-28-7
Названия
Русский:
- Кремнекислый калий
- Метасиликат калия [Wiki]
- силикат калия
;
;
;
English:
- AC1L24UH
- Dipotassium silicate
- E560
- EINECS:233-001-1
- Liquid glass
- Potassium metasilicate(IUPAC)
- Potassium silicate [Wiki]
- Silicic acid (H2SiO3), dipotassium salt
- Silicic acid (H2SiO3), potassium salt (1:2)
- Silicic acid (H2SiO3),potassium salt (1:2)(CAS)
- Waterglass
- dipotassium dioxido(oxo)silane
- dipotassium oxosilanediolate
- dipotassium;dioxido(oxo)silane(IUPAC)
;
;
;
;
;
;
;
;
;
;
;
;
;
;
2. гидросиликат калия
Брутто-формула:
HKO3Si
CAS# 1312-76-1
Названия
Русский:
- гидросиликат калия
;
English:
- EINECS:215-199-1
- Potassium Hydrogen Metasilicate
- Potassium hydroxy(oxo)silanolate(IUPAC)
- Silanolate, 1-hydroxy-1-oxo-, potassium salt (1:1)(CAS)
- silanolate, hydroxyoxo-, potassium salt
;
;
;
;
;
3. Гексафторосиликат(IV) калия
Брутто-формула:
F6K2Si
CAS# 16871-90-2
Названия
Русский:
- Гексафторосиликат(IV) калия [Wiki]
;
English:
- Dipotassium hexafluorosilicate(IUPAC)
- Dipotassium hexafluorosilicate(2-)
- EINECS:240-896-2
- Potassium Fluosilicate
- Potassium hexafluorosilicate
- Potassium silicofluoride
- Silicate(2-), hexafluoro-, dipotassium
- Silicate(2-), hexafluoro-, potassium (1:2)(CAS)
- UN2655
- dipotassium hexafluorosilicon(2-)
;
;
;
;
;
;
;
;
;
;
F|Si^—<`F`K^+><`/F><|F><F>/F/0K^+
$L(1.2)K^+# -0F-Si^2-<`F></F><`/F><F>-F-0K^+
4. силикат натрия
Брутто-формула:
Na2O3Si
CAS# 6834-92-0
Названия
Русский:
- Жидкое стекло
- Метасиликат натрия
- силикат натрия
;
;
;
English:
- Britesil
- E550
- Liquid glass
- Silicic acid, (H2SiO3), disodium salt(CAS)
- Sodium metasilicate(IUPAC)
- Sodium polysilicate
- Sodium sesquisilicate
- Sodium silicate
- Sodium silicate glass
- Sodium siliconate
- Sodium water glass
- Waterglass
- disodium oxosilanediolate
- disodium;dioxido(oxo)silane(IUPAC)
;
;
;
;
;
;
;
;
;
;
;
;
;
;
Na^+/0O^-Si|O`|/O^-Na^+
5. Ортосиликат натрия
Брутто-формула:
Na4O4Si
CAS# 13472-30-5
Названия
Русский:
- Кремнекислый натрий
- Ортосиликат натрия
;
;
English:
- EINECS:236-741-3
- Silicic acid (H4SiO4), sodium salt (1:4)
- Silicic acid (H4SiO4), tetrasodium salt
- Tetrasodium orthosilicate
- tetrasodium silicate
- tetrasodium;silicate(IUPAC)
;
;
;
;
;
;
Na^+O`^-/Si/O^-Na^+; Na^+`/0O`^-#SiO^-`/0Na^+
6. Кремнефтористоводородная кислота
Брутто-формула:
H2F6Si
CAS# 16961-83-4
Названия
Русский:
- Гексафторсиликат (IV) водорода
- Кремнефтористоводородная кислота [Wiki]
- гексафторокремниевая кислота
;
;
;
English:
- Dihydrogen hexafluorosilicate
- Dihydrogen hexafluorosilicate(2-)
- Dihydrogenhexafluorosilicate
- EINECS:241-034-8
- Fluorosilicic acid
- Fluosilicicacid (6CI)
- Hexafluorosilicic acid [Wiki]
- Hydrogen hexafluorosilicate (H2SiF6)
- Silicate(2-), hexafluoro-, dihydrogen
- Silicate(2-),hexafluoro-, hydrogen (1:2)
- Silicon hexafluoride dihydride
- dihydrogen hexafluorosilanediuide
- fluosilic acid
- hexafluorosilicon(2-);hydron(IUPAC)
- hydrofluorosilic acid
- hydrofluorosilicic acid
- oxonium hexafluoridosilicate(2−)
- oxonium hexafluorosilanediuide
- silicofluoric acid
- silicofluoridd
- silicofluoride
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
F|Si^—<`F`H^+><`/F><|F><F>/F/0H^+
$L(1.2)H^+# -0F-Si^2-<`F></F><`/F><F>-F-0H^+
7. Метасиликат железа(II)
Брутто-формула:
FeO3Si
CAS# 13478-48-3
Названия
Русский:
- Кремнекислое железо
- Метасиликат железа(II)
- Силикат железа(II) [Wiki]
;
;
;
English:
- EINECS:235-766-7
- Iron metasilicate (FeSiO3)
- Iron silicon oxide (FeSiO3)
- Iron(2+) oxosilanediolate
- Ironsilicate (FeSiO3) (6CI,7CI)
- Silicic acid (H2SiO3),iron(2+) salt (1:1) (8CI,9CI)(CAS)
- Silicic acid (H4SiO4), iron(2++) salt (1:2)
- dioxido(oxo)silane;iron(2+)(IUPAC)
;
;
;
;
;
;
;
;
Fe^2+_(x.5,y-1,N0)O`^-_(x1)Si<//O>|O^-
8. Метасиликат железа (III)
Брутто-формула:
Fe2O9Si3
Названия
Русский:
- Метасиликат железа (III)
;
English:
- Ferric Silicate
- Iron(III) Silicate
;
;
O`^-/Si`|O|O^-/0Fe^3+O`^-/Si`|O|O^-/0Fe^3+O`^-/Si`|O|O^-
9. гидросиликат железа (III)
Брутто-формула:
HFeO6Si2
Названия
Русский:
- гидросиликат железа (III)
;
English:
- iron hydrogen silicate
;
Fe(+3)H(+1)(Si(+4)O(-2)3)2
O`^-/Si`|O|O^-/0Fe^3+O`^-/Si`|O|OH
10. Метасиликат
Брутто-формула:
O3Si^2-
CAS# 15593-90-5
Названия
Русский:
- Метасиликат [Wiki]
;
English:
- Metasilicate
- Silicate (SiO3)(2-)
- Silicate ion (SiO32-)
- dioxido(oxo)silane(IUPAC)
- silicate [Wiki]
;
;
;
;
;
11. Силикат лития
Брутто-формула:
Li2O3Si
CAS# 12627-14-4
Названия
Русский:
- Силикат лития
- метасиликат лития
;
;
English:
- Dilithium oxosilanediolate(IUPAC)
- EINECS:235-730-0
- Lithium silicate
- Silicic acid, lithiumsalt
- dilithium metasilicate
- dilithium;dioxido(oxo)silane
- lithium metasilicate
- silanediolate, 1-oxo-, lithium salt (1:2)(CAS)
;
;
;
;
;
;
;
;
Li^+/0O`^-Si|O`|/O^-Li^+
12. Силикат рубидия
Брутто-формула:
O3Rb2Si
Названия
Русский:
- Метасиликат рубидия
- Силикат рубидия
;
;
English:
- Rubidium silicate
- dirubidium;dioxido(oxo)silane(IUPAC)
;
;
Rb^+/0O`^-Si|O`|/O^-Rb^+
13. Силикат цезия
Брутто-формула:
Cs2O3Si
Названия
Русский:
- Силикат цезия
- метасиликат цезия
;
;
English:
- Caesium metasilicate
- Caesium silicate
- Cesium metasilicate
;
;
;
Cs^+/0O`^-Si|O`|/O^-Cs^+
14. Силикат кальция
Брутто-формула:
CaO3Si
CAS# 10101-39-0
Названия
Русский:
- Силикат кальция [Wiki]
- метасиликат кальция
;
;
English:
- Aedelforsite
- Calcium metasilicate
- Calcium monosilicate
- Calcium oxosilanediolate(IUPAC)
- Calcium salt of silicic acid
- Calcium silicate [Wiki]
- Calcium silicon oxide
- Casiflux
- E 552
- Florite
- Fuwalip
- Gillebachite
- Okenite
- Schalstein
- Silicic acid (H2SiO3), calcium salt (1:1)
- Wollastokup
- calcium;dioxido(oxo)silane(IUPAC)
- silanediolate, 1-oxo-, calcium salt (1:1)
- silanediolate, oxo-, calcium salt
- silicic acid calcium salt
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
$slope(45)$L(1.2)Ca^2+`/hO^-`Si<`=O>/O^-h
Ca^2+/0O`^-# -Si<//O>|O^-
15. Метасиликат магния
Брутто-формула:
MgO3Si
CAS# 1343-88-0
Названия
Русский:
- Метасиликат магния
- силикат магния
;
;
English:
- Avibest
- Britesorb 90
- Chooz
- EINECS:215-681-1
- Gastomag
- HS-T (silicate)
- Haiburaito325
- Kyowaad 600S
- Laponite 508
- MP 30-36
- Macrosorb M15
- Magmasil
- Magnesium metasilicate
- Magnesium oxosilanediolate(IUPAC)
- Magnesium silicate
- Magnesol R 60
- Magsil 399
- Mizuka Life P 1G
- Mizupearl M 302
- Naisuton
- Novasorb
- Salisil
- Shimugon M
- Silicic acid, magnesium salt (1:1)
- Silton SS 1
- Tomita AD 600CY
- Trimax
- Trisomin
- magnesium;dioxido(oxo)silane(IUPAC)
- silanediolate, 1-oxo-, magnesium salt (1:1)(CAS)
- steatite
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
$L(1.2)$slope(45)Mg^++`/hO^-`Si<`=O>/O^-h
17. Тетраэтоксисилан
Брутто-формула:
C8H20O4Si
CAS# 78-10-4
Названия
Русский:
- Тетраэтоксисилан [Wiki]
- тетраэтилортосиликат
- тетраэтилсиликат
- этилсиликат
;
;
;
;
English:
- EINECS:201-083-8
- Silicic acid (H4SiO4), tetraethyl ester(CAS)
- Silicon tetraethoxide
- TEOS
- Tetraethyl orthosilicate(IUPAC) [Wiki]
- Tetraethyl-O-silicate
- UN1292
- ethyl silicate
- silicic acid tetraethyl ester
- silicon ethoxide
- tetraethoxysilane
- tetraethyl silicate(IUPAC)
- tetraethylorthosilicate
- tetraethyloxysilane
;
;
;
;
;
;
;
;
;
;
;
;
;
;
Si@:r(a)<_(A&a)O_q6_q6>@(0)@r(-90)@r(90)@r(180)
18. Гексафторосиликат натрия
Брутто-формула:
F6Na2Si
CAS# 16893-85-9
Названия
Русский:
- Гексафторосиликат натрия [Wiki]
- соль натрия и кремнефтористоводородной кислоты
;
;
English:
- Disodium hexafluorosilicate(IUPAC)
- Silicate(2-), hexafluoro-, sodium (1:2)(CAS)
- Sodium fluorosilicate [Wiki]
- Sodium hexafluorosilicate
- disodium;hexafluorosilicon(2-)(IUPAC)
- sodium silicofluoride
;
;
;
;
;
;
$L(1.2)Na^+_(x%d:2.3,N0)Si^2-<`|F></dF><`dF><`/wF><wF><|F>_(x%d,N0)Na^+
$L(1.2)Na^+_(x%d:2.3,N0)Si^4+<`|hF^-></hF^-><`hF`^-><`/hF`^-><hF^-><|hF^->_(x%d,N0)Na^+
19. Алюмосиликат
Брутто-формула:
H4Al2O9Si2
CAS# 1332-58-7
Названия
Русский:
- «белая глина»
- Алюмосиликат
- Силикат алюминия
- каолин
;
;
;
;
English:
- Aluminium silicate
- Aluminum, dioxo-μ-[silicic acid (H2SiO3)ato(2-)-κO, (hydroxy-κO)oxosilyl ester]-, hydrate (1:2)(CAS)
- Bolus alba
- China clay
- E559
- kaolin
- oxo-oxoalumanyloxy-[oxo(oxoalumanyloxy)silyl]oxysilane;dihydrate(IUPAC)
- μ-{Hydrogenato(2-)-κO [(hydroxy-κO)(oxo)silyl]silicate}(dioxo)dialuminium dihydrate(IUPAC)
;
;
;
;
;
;
;
;
O//Al/OSi|O`|/O<`|0H2O`|0H2O>Si|O`|/OAl\O
20. Ортосиликат циркония(IV)
Брутто-формула:
O4SiZr
CAS# 10101-52-7
Названия
Русский:
- Кремнекислый цирконий
- Ортосиликат циркония(IV) [Wiki]
- соль циркония и кремневой кислоты
;
;
;
English:
- EINECS:233-252-7
- Silicic acid (H4SiO4), zirconium(4+) salt (1:1)
- Zircon
- Zircon (Zr(SiO4))
- Zirconium(4+) orthosilicate
- Zirconium(4+) silicate
- Zirconium(IV) orthosilicate
- Zirconium(IV) silicate [Wiki]
;
;
;
;
;
;
;
;
Si<_(y%a:1.2,x.5)O^-><_(y%a,x-.5)O`^-><_(y%a,x-1.5)O`^->_(y%a,x1.5)O^-_(y%a,x-1.5,H)Zr^4+<_(H)#2><_(H)#3>_(H)#4
Zr^4+_(x2,N0)$slope(45)Si<`O`^-><`/O`^-><O^->/O^-



