«E550» redirects here. For the Italian locomotive, see FS Class E550.
Sodium silicate is a generic name for chemical compounds with the formula Na
2xSi
yO
2y+x or (Na
2O)
x·(SiO
2)
y, such as sodium metasilicate Na
2SiO
3, sodium orthosilicate Na
4SiO
4, and sodium pyrosilicate Na
6Si
2O
7. The anions are often polymeric. These compounds are generally colorless transparent solids or white powders, and soluble in water in various amounts.
Sodium silicate is also the technical and common name for a mixture of such compounds, chiefly the metasilicate, also called waterglass, water glass, or liquid glass. The product has a wide variety of uses, including the formulation of cements, passive fire protection, textile and lumber processing, manufacture of refractory ceramics, as adhesives, and in the production of silica gel. The commercial product, available in water solution or in solid form, is often greenish or blue owing to the presence of iron-containing impurities.
In industry, the various grades of sodium silicate are characterized by their SiO2:Na2O weight ratio (which can be converted to molar ratio by multiplication with 1.032). The ratio can vary between 1:2 and 3.75:1.[1] Grades with ratio below 2.85:1 are termed alkaline. Those with a higher SiO2:Na2O ratio are described as neutral.
History[edit]
Soluble silicates of alkali metals (sodium or potassium) were observed by European alchemists already in the 1500s. Giambattista della Porta observed in 1567 that tartari salis (cream of tartar, potassium hydrogen tartrate) caused powdered crystallum (quartz) to melt at a lower temperature.[2] Other possible early references to alkali silicates were made by Basil Valentine in 1520,[3] and by Agricola in 1550. Around 1640, Jean Baptist van Helmont reported the formation of alkali silicates as a soluble substance made by melting sand with excess alkali, and observed that the silica could be precipitated quantitatively by adding acid to the solution.[4]
In 1646, Glauber made potassium silicate, that he termed liquor silicum by melting potassium carbonate (obtained by calcinating cream of tartar) and sand in a crucible, and keeping it molten until it ceased to bubble (due to the release of carbon dioxide). The mixture was allowed to cool and then was ground to a fine powder. When the powder was exposed to moist air, it gradually formed a viscous liquid, which Glauber called «Oleum oder Liquor Silicum, Arenæ, vel Crystallorum» (i.e., oil or solution of silica, sand or quartz crystal).[5][6]
However, it was later claimed that the substances prepared by those alchemists were not waterglass as it is understood today.[7][8][9] That would have been prepared in 1818 by Johann Nepomuk von Fuchs, by treating silicic acid with an alkali; the result being soluble in water, «but not affected by atmospheric changes».[10][11]
The terms «water glass» and «soluble glass» were used by Leopold Wolff in 1846,[12] by Émile Kopp in 1857,[13] and by Hermann Krätzer in 1887.[14]
In 1892, Rudolf Von Wagner distinguished soda, potash, double (soda and potash), and fixing (i.e., stabilizing) as types of water glass. The fixing type was «a mixture of silica well saturated with potash water glass and a sodium silicate» used to stabilize inorganic water color pigments on cement work for outdoor signs and murals.[15][16][17][18]
Properties[edit]
Sodium silicates are colorless glassy or crystalline solids, or white powders. Except for the most silicon-rich ones, they are readily soluble in water, producing alkaline solutions.
Sodium silicates are stable in neutral and alkaline solutions. In acidic solutions, the silicate ions react with hydrogen ions to form silicic acids, which tend to decompose into hydrated silicon dioxide gel.[19][failed verification] Heated to drive off the water, the result is a hard translucent substance called silica gel, widely used as a desiccant. It can withstand temperatures up to 1100 °C.
Production[edit]
Solutions of sodium silicates can be produced by treating a mixture of silica (usually as quartz sand), caustic soda, and water, with hot steam in a reactor. The overall reaction is
- 2x NaOH + SiO
2 → (Na
2O)
x·SiO
2 + x H
2O
Sodium silicates can also be obtained by dissolving silica SiO
2 (whose melting point is 1713 °C) in molten sodium carbonate (that melts with decomposition at 851 °C):[20]
- x Na
2CO
3 + SiO
2 → (Na
2O)
x·SiO
2 + CO
2
The material can be obtained also from sodium sulfate (melting point 884 °C) with carbon as a reducing agent:
- 2x Na
2SO
4 + C + 2 SiO
2 → 2 (Na
2O)
x·SiO
2 + 2 SO
2 + CO
2
In 1990, 4 million tons of alkali metal silicates were produced.[1]
Ferrosilicon[edit]
Sodium silicate may be produced as a part of hydrogen production by dissolving ferrosilicon in an aqueous sodium hydroxide (NaOH • H2O) solution:[21]
- 2NaOH + Si + H2O → 2Na2SiO3 + 2H2
Bayer process[edit]
Though unprofitable, Na2SiO3 is a byproduct of Bayer process which is often converted to calcium silicate (Ca2SiO4).
Uses[edit]
The main applications of sodium silicates are in detergents, paper, water treatment, and construction materials.[1]
Engineering[edit]
Adhesive[edit]
The largest application of sodium silicate solutions is a cement for producing cardboard.[1] When used as a paper cement, the tendency is for the sodium silicate joint eventually to crack within a few years, at which point it no longer holds the paper surfaces cemented together.
Sodium silicate solutions can also be used as a spin-on adhesive layer to bond glass to glass [22] or silicon oxide covered silicon wafers to one another.[23] Sodium silicate glass-to-glass bonding has the advantage that it is a low temperature bonding technique, as opposed to fusion bonding.[22] It is also less processing intensive than glass-to-glass anodic bonding,[24] which requires an intermediate layer such as SiN to act as a diffusion barrier for sodium ions.[24] Deposition of such a layer requires a low pressure chemical vapor deposition step.[24] A disadvantage of sodium silicate bonding, however, is that it is very difficult to eliminate air bubbles.[23] This is due in part because this bonding technique doesn’t require bonding in vacuum and it also doesn’t use field assistance like in anodic bonding.[25] Though this lack of field assistance can sometimes be beneficial, because field assistance can provide such high attraction between wafers as to bend a thinner wafer and collapse[25] onto the nanofluidic cavity or MEMS elements.
Drilling fluids[edit]
Sodium silicate is frequently used in drilling fluids to stabilize borehole walls and to avoid the collapse of bore walls. It is particularly useful when drill holes pass through argillaceous formations containing swelling clay minerals such as smectite or montmorillonite.
Concrete and general masonry treatment[edit]
Concrete treated with a sodium silicate solution helps to reduce porosity in most masonry products such as concrete, stucco, and plasters. This effect aids in reducing water penetration, but has no known effect on reducing water vapor transmission and emission.[26] A chemical reaction occurs with the excess Ca(OH)2 (portlandite) present in the concrete that permanently binds the silicates with the surface, making them far more durable and water repellent. This treatment generally is applied only after the initial cure has taken place (7 days or so depending on conditions). These coatings are known as silicate mineral paint. An example of the reaction of sodium silicate with the calcium hydroxide found in concrete to form calcium silicate hydrate (or C-S-H) gel, the main product in hydrated Portland cement, follows. [27]
- Na
2SiO
3 + y H
2O + x Ca(OH)
2 → x CaO.SiO
2.y H
2O + 2NaOH
Detergent auxiliaries[edit]
It is used in detergent auxiliaries such as complex sodium disilicate and modified sodium disilicate. The detergent granules gain their ruggedness from a coating of silicates.[1]
Water treatment[edit]
Sodium silicate is used as an alum coagulant and an iron flocculant in wastewater treatment plants. Sodium silicate binds to colloidal molecules, creating larger aggregates that sink to the bottom of the water column. The microscopic negatively charged particles suspended in water interact with sodium silicate. Their electrical double layer collapses due to the increase of ionic strength caused by the addition of sodium silicate (doubly negatively charged anion accompanied by two sodium cations) and they subsequently aggregate. This process is called coagulation.[1]
Refractory use[edit]
Water glass is a useful binder of solids, such as vermiculite and perlite. When blended with the aforementioned lightweight aggregates, water glass can be used to make hard, high-temperature insulation boards used for refractories, passive fire protection and high temperature insulations, such as moulded pipe insulation applications. When mixed with finely divided mineral powders, such as vermiculite dust (which is common scrap from the exfoliation process), one can produce high temperature adhesives. The intumescence disappears in the presence of finely divided mineral dust, whereby the waterglass becomes a mere matrix. Waterglass is inexpensive and abundantly available, which makes its use popular in many refractory applications.
Sand casting[edit]
It is used as a binder of the sand when doing sand casting of iron or steel. It allows the rapid production of a strong mold, by passing CO2 through the mixture of sand and sodium silicate in the mold box, which hardens it almost instantly.
Dye auxiliary[edit]
Sodium silicate solution is used as a fixative for hand dyeing with reactive dyes that require a high pH to react with the textile fiber. After the dye is applied to a cellulose-based fabric, such as cotton or rayon, or onto silk, it is allowed to dry, after which the sodium silicate is painted on to the dyed fabric, covered with plastic to retain moisture, and left to react for an hour at room temperature.[28]
Metal repair[edit]
Sodium silicate is used, along with magnesium silicate, in muffler repair and fitting paste. When dissolved in water, both sodium silicate and magnesium silicate form a thick paste that is easy to apply. When the exhaust system of an internal combustion engine heats up to its operating temperature, the heat drives out all of the excess water from the paste. The silicate compounds that are left over have glass-like properties, making a temporary, brittle repair.
Automotive repair[edit]
Sodium silicate is also used currently as an exhaust system joint and crack sealer for repairing mufflers, resonators, tailpipes, and other exhaust components, with and without fiberglass reinforcing tapes. In this application, the sodium silicate (60–70%) is typically mixed with kaolin (40-30%), an aluminium silicate mineral, to make the sodium silicate «glued» joint opaque. The sodium silicate, however, is the high-temperature adhesive; the kaolin serves simply as a compatible high-temperature coloring agent. Some of these repair compounds also contain glass fibres to enhance their gap-filling abilities and reduce brittleness.
Sodium silicate can be used to fill gaps within the head gasket. Commonly used on aluminum alloy cylinder heads, which are sensitive to thermally induced surface deflection. This can be caused by many things including head-bolt stretching, deficient coolant delivery, high cylinder head pressure, overheating, etc.
«Liquid glass» (sodium silicate) is added to the system through the radiator, and allowed to circulate. Sodium silicate is suspended in the coolant until it reaches the cylinder head. At 100–105 °C (212-221 °F), sodium silicate loses water molecules to form a glass seal with a remelt temperature above 810 °C (1,490 °F).
A sodium silicate repair can last two years or longer. The repair occurs rapidly, and symptoms disappear instantly. This repair works only when the sodium silicate reaches its «conversion» temperature at 100–105 °C. Contamination of engine oil is a serious possibility in situations in which a coolant-to-oil leak is present. Sodium silicate (glass particulate) contamination of lubricants is detrimental to their function.
Sodium silicate solution is used to inexpensively, quickly, and permanently disable automobile engines. Running an engine with about 2 liters of a sodium silicate solution instead of motor oil causes the solution to precipitate, catastrophically damaging the engine’s bearings and pistons within a few minutes.[29] In the United States, this procedure was used to comply with requirements of the Car Allowance Rebate System (CARS) program.[29][30]
Safe construction[edit]
A mixture of sodium silicate and sawdust has been used in between the double skin of certain safes. This not only makes them more fire resistant, but also makes cutting them open with an oxyacetylene torch extremely difficult due to the smoke emitted.
Crystal gardens[edit]
When crystals of a number of metallic salts are dropped into a solution of water glass, simple or branching stalagmites of coloured metal silicates are formed. This phenomenon has been used by manufacturers of toys and chemistry sets to provide instructive enjoyment to many generations of children from the early 20th century until the present. An early mention of crystals of metallic salts forming a «chemical garden» in sodium silicate is found in the 1946 Modern Mechanix magazine.[31] Metal salts used included the sulfates and/or chlorides of copper, cobalt, iron, nickel, and manganese.
Pottery[edit]
Sodium silicate is used as a deflocculant in casting slips helping reduce viscosity and the need for large amounts of water to liquidize the clay body. It is also used to create a crackle effect in pottery, usually wheel-thrown. A vase or bottle is thrown on the wheel, fairly narrow and with thick walls. Sodium silicate is brushed on a section of the piece. After 5 minutes, the wall of the piece is stretched outward with a rib or hand. The result is a wrinkled or cracked look.
It is also the main agent in «magic water», which is used when joining clay pieces, especially if the moisture level of the two differs.[32]
Sealing of leaking water-containing structures[edit]
Sodium silicate with additives was injected into the ground to harden it and thereby to prevent further leakage of highly radioactive water from the Fukushima Daiichi nuclear power plant in Japan in April, 2011.[33] The residual heat carried by the water used for cooling the damaged reactors accelerated the setting of the injected mixture.
On June 3, 1958, the USS Nautilus, the world’s first nuclear submarine, visited Everett and Seattle. In Seattle, crewmen dressed in civilian clothing were sent in to secretly buy 140 quarts (160 liter) of an automotive product containing sodium silicate (originally identified as Stop Leak) to repair a leaking condenser system. The Nautilus was en route to the North Pole on a top secret mission to cross the North Pole submerged.[34]
Firearm cartridges[edit]
A historical use of the adhesive properties of sodium silicates is the production of paper cartridges for black powder revolvers produced by Colt’s Manufacturing Company during the period from 1851 until 1873, especially during the American Civil War. Sodium silicate was used to seal combustible nitrated paper together to form a conical paper cartridge to hold the black powder, as well as to cement the lead ball or conical bullet into the open end of the paper cartridge. Such sodium silicate cemented paper cartridges were inserted into the cylinders of revolvers, thereby speeding the reloading of cap-and-ball black powder revolvers. This use largely ended with the introduction of Colt revolvers employing brass-cased cartridges starting in 1873.[35][36] Similarly, sodium silicate was also used to cement the top wad into brass shotgun shells, thereby eliminating any need for a crimp at the top of the brass shotgun shell to hold a shotgun shell together. Reloading brass shotgun shells was widely practiced by self-reliant American farmers during the 1870s, using the same waterglass material that was also used to preserve eggs. The cementing of the top wad on a shotgun shell consisted of applying from three to five drops of waterglass on the top wad to secure it to the brass hull. Brass hulls for shotgun shells were superseded by paper hulls starting around 1877. The newer paper-hulled shotgun shells used a roll crimp in place of a waterglass-cemented joint to hold the top wad in the shell. However, whereas brass shotshells with top wads cemented with waterglass could be reloaded nearly indefinitely (given powder, wad, and shot, of course), the paper hulls that replaced the brass hulls could be reloaded only a few times.
Food and medicine[edit]
Cosmetics[edit]
Sodium silicate and other silicates are the primary components in «instant» wrinkle remover creams, which temporarily tighten the skin to minimize the appearance of wrinkles & under-eye bags. These creams, when applied as a thin film and allowed to dry for a few minutes, can present dramatic results. This effect is not permanent, lasting from a few minutes up to a couple of hours. It works like water cement, once the muscle starts to move, it cracks and leaves white residues on the skin.
Food preservation[edit]
World War I poster suggesting the use of waterglass to preserve eggs (lower right).
Waterglass has been used as an egg preservative with large success, primarily when refrigeration is not available.
Fresh-laid eggs are immersed in a solution of sodium silicate (waterglass). After being immersed in the solution they were removed and allowed to dry. A permanent air tight coating remains on the eggs. If they are then stored in appropriate environment, the majority of bacteria which would otherwise cause them to spoil are kept out and their moisture is kept in.
According to the cited source, treated eggs can be kept fresh using this method for up to five months.
When boiling eggs so preserved, the shell is no longer permeable to air, and the egg will tend to crack unless a hole in the shell is made (e.g. with a pin) in order to allow steam to escape.[37]
Homebrewing[edit]
Sodium silicate flocculant properties are also used to clarify wine and beer by precipitating colloidal particles. As a clearing agent, though, sodium silicate is sometimes confused with isinglass which is prepared from collagen extracted from the dried swim bladders of sturgeon and other fishes. Eggs preserved in a bucket of waterglass gel, and their shells are sometimes also used (baked and crushed) to clear wine.[38]
Aquaculture[edit]
Sodium silicate gel is also used as a substrate for algal growth in aquaculture hatcheries.[39]
See also[edit]
- Potassium silicate
- Silica gel
- Precipitated silica
References[edit]
- ^ a b c d e f Gerard Lagaly, Werner Tufar, A. Minihan, A. Lovell «Silicates» in Ullmann’s Encyclopedia of Industrial Chemistry, Wiley-VCH, 2005. doi:10.1002/14356007.a23_661
- ^ Giambattista della Porta (1569): Magia naturalis sive de miraculis rerum naturalium, libri iiii (Natural magic or on the miracles of nature, in four books); pages 290–291, «Crystallus, ut fusilis fiat» (quartz, so made molten). Published by Guillaume Rouillé (Gulielmum Rovillium) in Lyon (Lugdunum) France
- ^ Kohn, C. (1862): «Die Erfindung des Wasserglas im Jahre 1520» (The invention of waterglass in the year 1520), Zeitschrift des Oesterreichischen Ingenieur-Vereins (Journal of the Austrian Engineer Association), volume 14, pages 229–230.
- ^ Johannes van Helmont (1644): Opuscula medica inaudita, published by Jost Kalckhoven (Jodocum Kalcoven) Cologne, Germany. In Part I: De Lithiasi, page 53, van Helmont mentions that alkalis dissolve silicates: «Porro lapides, gemmae, arenae, marmora, silices, &c. adjuncto alcali, vitrificantur: sin autem plure alcali coquantur, resolvuntur in humido quidem: ac resoluta, facili negotio acidorum spirituum, separantur ab alcali, pondere pristini pulveris lapidum.» (Furthermore, stone, gems, sand, marble, silica, etc., become glassy by the addition of alkali: but if roasted with more alkali, they are dissolved in moisture: and the former weight of the stone powder is separated from the alkali and released by simply adding acid.)
- ^ Johann Rudolf Glauber (1646), Furni Novi Philosophici (New Philosophical Furnace). Published by Johan Jansson, Amsterdam.
- ^ Johann Rudolf Glauber (1661): Furni Novi Philosophici Oder Beschreibung einer New-erfundenen Distillir-Kunst (New Philosophical Furnace, or Treatise on Newly Discovered Distillation Art) chapter LXXIX, pages 164–166: «Wie durch Hülff eines reinen Sandes oder Kißlings auß Sale Tartari ein kräfftiger Spiritus kan erlanget werden.» (How with the help of a pure sand or silica a powerful solution can be gotten from cream of tartar).
- ^ Anon. (1863): «Die Erfindung des Wasserglases im Jahre 1520.» Kunst- und Gewerbe-Blatt, volume 49, pages 228–230.
- ^ Anon. (1863): «Die Erfindung des Wasserglases im Jahre 1520.» Reprint, Polytechnisches Journal, volume 168, pages 394–395
- ^ Anon. (1863) «Die angebliche Erfindung des Wasserglases im Jahre 1520» (On the alleged invention of waterglass in the year 1520). Reprint, Neues Repertorium für Pharmacie, volume 12, pages 271–273.
- ^ Johann Nepomuk von Fuchs (1825) «Ueber ein neues Produkt aus Kieselerde und Kali» (On a new product from silica and potash), Archiv für die gesammte Naturlehre, volume 5, issue 4, pages 385–412. On page 386: «Ich erhielt es zuerst, vor ungefähr 7 Jahren» (I first obtained it about 7 years ago).
- ^ Joh. Nepomuk Fuchs (1825) «Ueber ein neues Produkt aus Kieselerde und Kali; und dessen nüzliche Anwendung als Schuzmittel gegen schnelle Verbreitung des Feuers in Theatern, als Bindemittel, firnißartigen Anstrichen u.s.w.» (On a new product from silica and potash; and its useful application as a protection against the rapid spread of fire in theaters, as a glue, varnish, etc.). Polytechnisches Journal, volume 17, pages 465–481.
- ^ Leopold Wolff (1846): Das Wasserglas: Seine Darstellung, Eigenschaften und seine mannichfache Anwendung in den technischen Gewerben (Water-glass: its preparation, properties, and its manifold uses in technical commerce) published by Quedlinburg, Leipzig, Germany.
- ^ Emile Kopp (1857): «Sur la préparation et les propriétés du verre soluble ou des silicates de potasse et de soude; analyse de tous les travaux publiés jusqu’a ce jour sur ce sujet» (On the preparation and properties of soluble glass or the silicates of potash and soda; analysis of all works published until today on this subject). Le Moniteur scientifique, volume 1, 337–349, pages 366–391.
- ^ Hermann Krätzer (1887): Wasserglas und Infusorienerde, deren Natur und Bedeutung für Industrie, Technik und die Gewerbe (Water-glass and soluble earths, their nature and significance for industry, technology, and commerce). Published by Hartleben, Vienna, Austria.
- ^ Von Wagner, Rudolf (1892; translation of 13th edition by Willian Crookes) Manual of Chemical Technology [1]
- ^ Von Wagner, Manual of Chemical Technology (1892 translation)
- ^ Hermann Mayer (1925): Das Wasserglas; Sein Eigenschaften, Fabrikation und Verwendung auf Grund von Erfahrungen und Mitteilungen der Firma Henkel & Cie. (The Water-glass: Its properties, production, and application on the basis of experiences and communications of the firm of Henkel & Co.) Published by Vieweg, Braunschweig, Germany.
- ^ Morris Schrero (1922): Water-glass: A Bibliography. Published by Carnegie Library, Pittsburgh, Pennsylvania.
- ^ Christopher Gelpi; Peter Feaver; Jason Reifler (2005). Replication data for: Success Matters: Casualty Sensitivity and the War in Iraq. OCLC 795918959.
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ^ Brack, Paul; Dann, Sandie E.; Wijayantha, K. G. Upul; Adcock, Paul; Foster, Simon (November 2015). «An old solution to a new problem? Hydrogen generation by the reaction of ferrosilicon with aqueous sodium hydroxide solutions». Energy Science & Engineering. 3 (6): 535–540. doi:10.1002/ese3.94. S2CID 54929253.
- ^ a b Wang, H.Y; Foote, R.S; Jacobson, S.C; Schneibel, J.H; Ramsey, J.M (1997-12-15). «Low temperature bonding for microfabrication of chemical analysis devices». Sensors and Actuators B: Chemical. 45 (3): 199–207. doi:10.1016/S0925-4005(97)00294-3. ISSN 0925-4005.
- ^ a b Puers, R; Cozma, A (1997-09-01). «Bonding wafers with sodium silicate solution». Journal of Micromechanics and Microengineering. 7 (3): 114–117. Bibcode:1997JMiMi…7..114P. doi:10.1088/0960-1317/7/3/008. ISSN 0960-1317. S2CID 250822654.
- ^ a b c Berthold, A.; Nicola, L.; Sarro, P.M; Vellekoop, M.J (2000-05-15). «Glass-to-glass anodic bonding with standard IC technology thin films as intermediate layers». Sensors and Actuators A: Physical. 82 (1–3): 224–228. doi:10.1016/S0924-4247(99)00376-3. ISSN 0924-4247.
- ^ a b Li, Dongqing, ed. (2008). Encyclopedia of Microfluidics and Nanofluidics. Boston, MA: Springer US. doi:10.1007/978-0-387-48998-8. ISBN 978-0-387-32468-5.
- ^ «Home» (PDF).
- ^ JLR Thompson et al Characterization of Silicate Sealers on Concrete Cement and Concrete Research Vol. 27 No. 10 1997
- ^ Burch, Paula (March 22, 2010). «Sodium silicate as a fixative for dyeing». Retrieved March 22, 2010.
- ^ a b Helliker, Kevin. «The Killer App for Clunkers Breathes Fresh Life Into ‘Liquid Glass'» The Wall Street Journal, 4 August 2009.
- ^ Engine Disablement Procedures for the CARS program Archived 2010-10-19 at the Wayback Machine, cars.gov
- ^ «Magic garden». Mechanix Illustrated: 88. April 1946. Archived from the original on 2012-02-10. Retrieved 2007-04-30.
- ^ «Ceramic, Pottery, Sculpture and Kintsugi Repair | China repair and restoration».
- ^ Press Release (TEPCO:2011.4.6)
- ^ Commander William R. Anderson with Clay Blair Jr., Nautilus 90 North (Cleveland and New York: The World Publishing Co., 1959), pp. 133–137; Commander William R. Anderson with Clay Blair Jr., Nautilus 90 North (New York: The New American Library, 1959), 89–90
- ^ Tom Kelley (August 1995). «Making and using combustible paper pistol cartridges».
- ^ Kirst, W.J. (1983). Self consuming paper cartridges for the percussion revolver. Minneapolis, Minnesota: Northwest Development Co.
- ^ How To Store Fresh Eggs. motherearthnews.com
- ^ SM Tritton (1956) Amateur wine making.
- ^ Bechtold, M. F. (1955). «Polymerization and Properties of Dilute Aqueous Silicic Acid from Cation Exchange». The Journal of Physical Chemistry. 59 (6): 532–541. doi:10.1021/j150528a013.
Further reading[edit]
- Ashford’s Dictionary of Industrial Chemicals, third edition, 2011, page 8369.
External links[edit]
- Centre Européen d’Etudes des Silicates
- International Chemical Safety Card 1137
- ChemSub Online : Silicic acid, sodium salt
- ChemSub Online : Sodium metasilicate
«E550» redirects here. For the Italian locomotive, see FS Class E550.
Sodium silicate is a generic name for chemical compounds with the formula Na
2xSi
yO
2y+x or (Na
2O)
x·(SiO
2)
y, such as sodium metasilicate Na
2SiO
3, sodium orthosilicate Na
4SiO
4, and sodium pyrosilicate Na
6Si
2O
7. The anions are often polymeric. These compounds are generally colorless transparent solids or white powders, and soluble in water in various amounts.
Sodium silicate is also the technical and common name for a mixture of such compounds, chiefly the metasilicate, also called waterglass, water glass, or liquid glass. The product has a wide variety of uses, including the formulation of cements, passive fire protection, textile and lumber processing, manufacture of refractory ceramics, as adhesives, and in the production of silica gel. The commercial product, available in water solution or in solid form, is often greenish or blue owing to the presence of iron-containing impurities.
In industry, the various grades of sodium silicate are characterized by their SiO2:Na2O weight ratio (which can be converted to molar ratio by multiplication with 1.032). The ratio can vary between 1:2 and 3.75:1.[1] Grades with ratio below 2.85:1 are termed alkaline. Those with a higher SiO2:Na2O ratio are described as neutral.
History[edit]
Soluble silicates of alkali metals (sodium or potassium) were observed by European alchemists already in the 1500s. Giambattista della Porta observed in 1567 that tartari salis (cream of tartar, potassium hydrogen tartrate) caused powdered crystallum (quartz) to melt at a lower temperature.[2] Other possible early references to alkali silicates were made by Basil Valentine in 1520,[3] and by Agricola in 1550. Around 1640, Jean Baptist van Helmont reported the formation of alkali silicates as a soluble substance made by melting sand with excess alkali, and observed that the silica could be precipitated quantitatively by adding acid to the solution.[4]
In 1646, Glauber made potassium silicate, that he termed liquor silicum by melting potassium carbonate (obtained by calcinating cream of tartar) and sand in a crucible, and keeping it molten until it ceased to bubble (due to the release of carbon dioxide). The mixture was allowed to cool and then was ground to a fine powder. When the powder was exposed to moist air, it gradually formed a viscous liquid, which Glauber called «Oleum oder Liquor Silicum, Arenæ, vel Crystallorum» (i.e., oil or solution of silica, sand or quartz crystal).[5][6]
However, it was later claimed that the substances prepared by those alchemists were not waterglass as it is understood today.[7][8][9] That would have been prepared in 1818 by Johann Nepomuk von Fuchs, by treating silicic acid with an alkali; the result being soluble in water, «but not affected by atmospheric changes».[10][11]
The terms «water glass» and «soluble glass» were used by Leopold Wolff in 1846,[12] by Émile Kopp in 1857,[13] and by Hermann Krätzer in 1887.[14]
In 1892, Rudolf Von Wagner distinguished soda, potash, double (soda and potash), and fixing (i.e., stabilizing) as types of water glass. The fixing type was «a mixture of silica well saturated with potash water glass and a sodium silicate» used to stabilize inorganic water color pigments on cement work for outdoor signs and murals.[15][16][17][18]
Properties[edit]
Sodium silicates are colorless glassy or crystalline solids, or white powders. Except for the most silicon-rich ones, they are readily soluble in water, producing alkaline solutions.
Sodium silicates are stable in neutral and alkaline solutions. In acidic solutions, the silicate ions react with hydrogen ions to form silicic acids, which tend to decompose into hydrated silicon dioxide gel.[19][failed verification] Heated to drive off the water, the result is a hard translucent substance called silica gel, widely used as a desiccant. It can withstand temperatures up to 1100 °C.
Production[edit]
Solutions of sodium silicates can be produced by treating a mixture of silica (usually as quartz sand), caustic soda, and water, with hot steam in a reactor. The overall reaction is
- 2x NaOH + SiO
2 → (Na
2O)
x·SiO
2 + x H
2O
Sodium silicates can also be obtained by dissolving silica SiO
2 (whose melting point is 1713 °C) in molten sodium carbonate (that melts with decomposition at 851 °C):[20]
- x Na
2CO
3 + SiO
2 → (Na
2O)
x·SiO
2 + CO
2
The material can be obtained also from sodium sulfate (melting point 884 °C) with carbon as a reducing agent:
- 2x Na
2SO
4 + C + 2 SiO
2 → 2 (Na
2O)
x·SiO
2 + 2 SO
2 + CO
2
In 1990, 4 million tons of alkali metal silicates were produced.[1]
Ferrosilicon[edit]
Sodium silicate may be produced as a part of hydrogen production by dissolving ferrosilicon in an aqueous sodium hydroxide (NaOH • H2O) solution:[21]
- 2NaOH + Si + H2O → 2Na2SiO3 + 2H2
Bayer process[edit]
Though unprofitable, Na2SiO3 is a byproduct of Bayer process which is often converted to calcium silicate (Ca2SiO4).
Uses[edit]
The main applications of sodium silicates are in detergents, paper, water treatment, and construction materials.[1]
Engineering[edit]
Adhesive[edit]
The largest application of sodium silicate solutions is a cement for producing cardboard.[1] When used as a paper cement, the tendency is for the sodium silicate joint eventually to crack within a few years, at which point it no longer holds the paper surfaces cemented together.
Sodium silicate solutions can also be used as a spin-on adhesive layer to bond glass to glass [22] or silicon oxide covered silicon wafers to one another.[23] Sodium silicate glass-to-glass bonding has the advantage that it is a low temperature bonding technique, as opposed to fusion bonding.[22] It is also less processing intensive than glass-to-glass anodic bonding,[24] which requires an intermediate layer such as SiN to act as a diffusion barrier for sodium ions.[24] Deposition of such a layer requires a low pressure chemical vapor deposition step.[24] A disadvantage of sodium silicate bonding, however, is that it is very difficult to eliminate air bubbles.[23] This is due in part because this bonding technique doesn’t require bonding in vacuum and it also doesn’t use field assistance like in anodic bonding.[25] Though this lack of field assistance can sometimes be beneficial, because field assistance can provide such high attraction between wafers as to bend a thinner wafer and collapse[25] onto the nanofluidic cavity or MEMS elements.
Drilling fluids[edit]
Sodium silicate is frequently used in drilling fluids to stabilize borehole walls and to avoid the collapse of bore walls. It is particularly useful when drill holes pass through argillaceous formations containing swelling clay minerals such as smectite or montmorillonite.
Concrete and general masonry treatment[edit]
Concrete treated with a sodium silicate solution helps to reduce porosity in most masonry products such as concrete, stucco, and plasters. This effect aids in reducing water penetration, but has no known effect on reducing water vapor transmission and emission.[26] A chemical reaction occurs with the excess Ca(OH)2 (portlandite) present in the concrete that permanently binds the silicates with the surface, making them far more durable and water repellent. This treatment generally is applied only after the initial cure has taken place (7 days or so depending on conditions). These coatings are known as silicate mineral paint. An example of the reaction of sodium silicate with the calcium hydroxide found in concrete to form calcium silicate hydrate (or C-S-H) gel, the main product in hydrated Portland cement, follows. [27]
- Na
2SiO
3 + y H
2O + x Ca(OH)
2 → x CaO.SiO
2.y H
2O + 2NaOH
Detergent auxiliaries[edit]
It is used in detergent auxiliaries such as complex sodium disilicate and modified sodium disilicate. The detergent granules gain their ruggedness from a coating of silicates.[1]
Water treatment[edit]
Sodium silicate is used as an alum coagulant and an iron flocculant in wastewater treatment plants. Sodium silicate binds to colloidal molecules, creating larger aggregates that sink to the bottom of the water column. The microscopic negatively charged particles suspended in water interact with sodium silicate. Their electrical double layer collapses due to the increase of ionic strength caused by the addition of sodium silicate (doubly negatively charged anion accompanied by two sodium cations) and they subsequently aggregate. This process is called coagulation.[1]
Refractory use[edit]
Water glass is a useful binder of solids, such as vermiculite and perlite. When blended with the aforementioned lightweight aggregates, water glass can be used to make hard, high-temperature insulation boards used for refractories, passive fire protection and high temperature insulations, such as moulded pipe insulation applications. When mixed with finely divided mineral powders, such as vermiculite dust (which is common scrap from the exfoliation process), one can produce high temperature adhesives. The intumescence disappears in the presence of finely divided mineral dust, whereby the waterglass becomes a mere matrix. Waterglass is inexpensive and abundantly available, which makes its use popular in many refractory applications.
Sand casting[edit]
It is used as a binder of the sand when doing sand casting of iron or steel. It allows the rapid production of a strong mold, by passing CO2 through the mixture of sand and sodium silicate in the mold box, which hardens it almost instantly.
Dye auxiliary[edit]
Sodium silicate solution is used as a fixative for hand dyeing with reactive dyes that require a high pH to react with the textile fiber. After the dye is applied to a cellulose-based fabric, such as cotton or rayon, or onto silk, it is allowed to dry, after which the sodium silicate is painted on to the dyed fabric, covered with plastic to retain moisture, and left to react for an hour at room temperature.[28]
Metal repair[edit]
Sodium silicate is used, along with magnesium silicate, in muffler repair and fitting paste. When dissolved in water, both sodium silicate and magnesium silicate form a thick paste that is easy to apply. When the exhaust system of an internal combustion engine heats up to its operating temperature, the heat drives out all of the excess water from the paste. The silicate compounds that are left over have glass-like properties, making a temporary, brittle repair.
Automotive repair[edit]
Sodium silicate is also used currently as an exhaust system joint and crack sealer for repairing mufflers, resonators, tailpipes, and other exhaust components, with and without fiberglass reinforcing tapes. In this application, the sodium silicate (60–70%) is typically mixed with kaolin (40-30%), an aluminium silicate mineral, to make the sodium silicate «glued» joint opaque. The sodium silicate, however, is the high-temperature adhesive; the kaolin serves simply as a compatible high-temperature coloring agent. Some of these repair compounds also contain glass fibres to enhance their gap-filling abilities and reduce brittleness.
Sodium silicate can be used to fill gaps within the head gasket. Commonly used on aluminum alloy cylinder heads, which are sensitive to thermally induced surface deflection. This can be caused by many things including head-bolt stretching, deficient coolant delivery, high cylinder head pressure, overheating, etc.
«Liquid glass» (sodium silicate) is added to the system through the radiator, and allowed to circulate. Sodium silicate is suspended in the coolant until it reaches the cylinder head. At 100–105 °C (212-221 °F), sodium silicate loses water molecules to form a glass seal with a remelt temperature above 810 °C (1,490 °F).
A sodium silicate repair can last two years or longer. The repair occurs rapidly, and symptoms disappear instantly. This repair works only when the sodium silicate reaches its «conversion» temperature at 100–105 °C. Contamination of engine oil is a serious possibility in situations in which a coolant-to-oil leak is present. Sodium silicate (glass particulate) contamination of lubricants is detrimental to their function.
Sodium silicate solution is used to inexpensively, quickly, and permanently disable automobile engines. Running an engine with about 2 liters of a sodium silicate solution instead of motor oil causes the solution to precipitate, catastrophically damaging the engine’s bearings and pistons within a few minutes.[29] In the United States, this procedure was used to comply with requirements of the Car Allowance Rebate System (CARS) program.[29][30]
Safe construction[edit]
A mixture of sodium silicate and sawdust has been used in between the double skin of certain safes. This not only makes them more fire resistant, but also makes cutting them open with an oxyacetylene torch extremely difficult due to the smoke emitted.
Crystal gardens[edit]
When crystals of a number of metallic salts are dropped into a solution of water glass, simple or branching stalagmites of coloured metal silicates are formed. This phenomenon has been used by manufacturers of toys and chemistry sets to provide instructive enjoyment to many generations of children from the early 20th century until the present. An early mention of crystals of metallic salts forming a «chemical garden» in sodium silicate is found in the 1946 Modern Mechanix magazine.[31] Metal salts used included the sulfates and/or chlorides of copper, cobalt, iron, nickel, and manganese.
Pottery[edit]
Sodium silicate is used as a deflocculant in casting slips helping reduce viscosity and the need for large amounts of water to liquidize the clay body. It is also used to create a crackle effect in pottery, usually wheel-thrown. A vase or bottle is thrown on the wheel, fairly narrow and with thick walls. Sodium silicate is brushed on a section of the piece. After 5 minutes, the wall of the piece is stretched outward with a rib or hand. The result is a wrinkled or cracked look.
It is also the main agent in «magic water», which is used when joining clay pieces, especially if the moisture level of the two differs.[32]
Sealing of leaking water-containing structures[edit]
Sodium silicate with additives was injected into the ground to harden it and thereby to prevent further leakage of highly radioactive water from the Fukushima Daiichi nuclear power plant in Japan in April, 2011.[33] The residual heat carried by the water used for cooling the damaged reactors accelerated the setting of the injected mixture.
On June 3, 1958, the USS Nautilus, the world’s first nuclear submarine, visited Everett and Seattle. In Seattle, crewmen dressed in civilian clothing were sent in to secretly buy 140 quarts (160 liter) of an automotive product containing sodium silicate (originally identified as Stop Leak) to repair a leaking condenser system. The Nautilus was en route to the North Pole on a top secret mission to cross the North Pole submerged.[34]
Firearm cartridges[edit]
A historical use of the adhesive properties of sodium silicates is the production of paper cartridges for black powder revolvers produced by Colt’s Manufacturing Company during the period from 1851 until 1873, especially during the American Civil War. Sodium silicate was used to seal combustible nitrated paper together to form a conical paper cartridge to hold the black powder, as well as to cement the lead ball or conical bullet into the open end of the paper cartridge. Such sodium silicate cemented paper cartridges were inserted into the cylinders of revolvers, thereby speeding the reloading of cap-and-ball black powder revolvers. This use largely ended with the introduction of Colt revolvers employing brass-cased cartridges starting in 1873.[35][36] Similarly, sodium silicate was also used to cement the top wad into brass shotgun shells, thereby eliminating any need for a crimp at the top of the brass shotgun shell to hold a shotgun shell together. Reloading brass shotgun shells was widely practiced by self-reliant American farmers during the 1870s, using the same waterglass material that was also used to preserve eggs. The cementing of the top wad on a shotgun shell consisted of applying from three to five drops of waterglass on the top wad to secure it to the brass hull. Brass hulls for shotgun shells were superseded by paper hulls starting around 1877. The newer paper-hulled shotgun shells used a roll crimp in place of a waterglass-cemented joint to hold the top wad in the shell. However, whereas brass shotshells with top wads cemented with waterglass could be reloaded nearly indefinitely (given powder, wad, and shot, of course), the paper hulls that replaced the brass hulls could be reloaded only a few times.
Food and medicine[edit]
Cosmetics[edit]
Sodium silicate and other silicates are the primary components in «instant» wrinkle remover creams, which temporarily tighten the skin to minimize the appearance of wrinkles & under-eye bags. These creams, when applied as a thin film and allowed to dry for a few minutes, can present dramatic results. This effect is not permanent, lasting from a few minutes up to a couple of hours. It works like water cement, once the muscle starts to move, it cracks and leaves white residues on the skin.
Food preservation[edit]
World War I poster suggesting the use of waterglass to preserve eggs (lower right).
Waterglass has been used as an egg preservative with large success, primarily when refrigeration is not available.
Fresh-laid eggs are immersed in a solution of sodium silicate (waterglass). After being immersed in the solution they were removed and allowed to dry. A permanent air tight coating remains on the eggs. If they are then stored in appropriate environment, the majority of bacteria which would otherwise cause them to spoil are kept out and their moisture is kept in.
According to the cited source, treated eggs can be kept fresh using this method for up to five months.
When boiling eggs so preserved, the shell is no longer permeable to air, and the egg will tend to crack unless a hole in the shell is made (e.g. with a pin) in order to allow steam to escape.[37]
Homebrewing[edit]
Sodium silicate flocculant properties are also used to clarify wine and beer by precipitating colloidal particles. As a clearing agent, though, sodium silicate is sometimes confused with isinglass which is prepared from collagen extracted from the dried swim bladders of sturgeon and other fishes. Eggs preserved in a bucket of waterglass gel, and their shells are sometimes also used (baked and crushed) to clear wine.[38]
Aquaculture[edit]
Sodium silicate gel is also used as a substrate for algal growth in aquaculture hatcheries.[39]
See also[edit]
- Potassium silicate
- Silica gel
- Precipitated silica
References[edit]
- ^ a b c d e f Gerard Lagaly, Werner Tufar, A. Minihan, A. Lovell «Silicates» in Ullmann’s Encyclopedia of Industrial Chemistry, Wiley-VCH, 2005. doi:10.1002/14356007.a23_661
- ^ Giambattista della Porta (1569): Magia naturalis sive de miraculis rerum naturalium, libri iiii (Natural magic or on the miracles of nature, in four books); pages 290–291, «Crystallus, ut fusilis fiat» (quartz, so made molten). Published by Guillaume Rouillé (Gulielmum Rovillium) in Lyon (Lugdunum) France
- ^ Kohn, C. (1862): «Die Erfindung des Wasserglas im Jahre 1520» (The invention of waterglass in the year 1520), Zeitschrift des Oesterreichischen Ingenieur-Vereins (Journal of the Austrian Engineer Association), volume 14, pages 229–230.
- ^ Johannes van Helmont (1644): Opuscula medica inaudita, published by Jost Kalckhoven (Jodocum Kalcoven) Cologne, Germany. In Part I: De Lithiasi, page 53, van Helmont mentions that alkalis dissolve silicates: «Porro lapides, gemmae, arenae, marmora, silices, &c. adjuncto alcali, vitrificantur: sin autem plure alcali coquantur, resolvuntur in humido quidem: ac resoluta, facili negotio acidorum spirituum, separantur ab alcali, pondere pristini pulveris lapidum.» (Furthermore, stone, gems, sand, marble, silica, etc., become glassy by the addition of alkali: but if roasted with more alkali, they are dissolved in moisture: and the former weight of the stone powder is separated from the alkali and released by simply adding acid.)
- ^ Johann Rudolf Glauber (1646), Furni Novi Philosophici (New Philosophical Furnace). Published by Johan Jansson, Amsterdam.
- ^ Johann Rudolf Glauber (1661): Furni Novi Philosophici Oder Beschreibung einer New-erfundenen Distillir-Kunst (New Philosophical Furnace, or Treatise on Newly Discovered Distillation Art) chapter LXXIX, pages 164–166: «Wie durch Hülff eines reinen Sandes oder Kißlings auß Sale Tartari ein kräfftiger Spiritus kan erlanget werden.» (How with the help of a pure sand or silica a powerful solution can be gotten from cream of tartar).
- ^ Anon. (1863): «Die Erfindung des Wasserglases im Jahre 1520.» Kunst- und Gewerbe-Blatt, volume 49, pages 228–230.
- ^ Anon. (1863): «Die Erfindung des Wasserglases im Jahre 1520.» Reprint, Polytechnisches Journal, volume 168, pages 394–395
- ^ Anon. (1863) «Die angebliche Erfindung des Wasserglases im Jahre 1520» (On the alleged invention of waterglass in the year 1520). Reprint, Neues Repertorium für Pharmacie, volume 12, pages 271–273.
- ^ Johann Nepomuk von Fuchs (1825) «Ueber ein neues Produkt aus Kieselerde und Kali» (On a new product from silica and potash), Archiv für die gesammte Naturlehre, volume 5, issue 4, pages 385–412. On page 386: «Ich erhielt es zuerst, vor ungefähr 7 Jahren» (I first obtained it about 7 years ago).
- ^ Joh. Nepomuk Fuchs (1825) «Ueber ein neues Produkt aus Kieselerde und Kali; und dessen nüzliche Anwendung als Schuzmittel gegen schnelle Verbreitung des Feuers in Theatern, als Bindemittel, firnißartigen Anstrichen u.s.w.» (On a new product from silica and potash; and its useful application as a protection against the rapid spread of fire in theaters, as a glue, varnish, etc.). Polytechnisches Journal, volume 17, pages 465–481.
- ^ Leopold Wolff (1846): Das Wasserglas: Seine Darstellung, Eigenschaften und seine mannichfache Anwendung in den technischen Gewerben (Water-glass: its preparation, properties, and its manifold uses in technical commerce) published by Quedlinburg, Leipzig, Germany.
- ^ Emile Kopp (1857): «Sur la préparation et les propriétés du verre soluble ou des silicates de potasse et de soude; analyse de tous les travaux publiés jusqu’a ce jour sur ce sujet» (On the preparation and properties of soluble glass or the silicates of potash and soda; analysis of all works published until today on this subject). Le Moniteur scientifique, volume 1, 337–349, pages 366–391.
- ^ Hermann Krätzer (1887): Wasserglas und Infusorienerde, deren Natur und Bedeutung für Industrie, Technik und die Gewerbe (Water-glass and soluble earths, their nature and significance for industry, technology, and commerce). Published by Hartleben, Vienna, Austria.
- ^ Von Wagner, Rudolf (1892; translation of 13th edition by Willian Crookes) Manual of Chemical Technology [1]
- ^ Von Wagner, Manual of Chemical Technology (1892 translation)
- ^ Hermann Mayer (1925): Das Wasserglas; Sein Eigenschaften, Fabrikation und Verwendung auf Grund von Erfahrungen und Mitteilungen der Firma Henkel & Cie. (The Water-glass: Its properties, production, and application on the basis of experiences and communications of the firm of Henkel & Co.) Published by Vieweg, Braunschweig, Germany.
- ^ Morris Schrero (1922): Water-glass: A Bibliography. Published by Carnegie Library, Pittsburgh, Pennsylvania.
- ^ Christopher Gelpi; Peter Feaver; Jason Reifler (2005). Replication data for: Success Matters: Casualty Sensitivity and the War in Iraq. OCLC 795918959.
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ^ Brack, Paul; Dann, Sandie E.; Wijayantha, K. G. Upul; Adcock, Paul; Foster, Simon (November 2015). «An old solution to a new problem? Hydrogen generation by the reaction of ferrosilicon with aqueous sodium hydroxide solutions». Energy Science & Engineering. 3 (6): 535–540. doi:10.1002/ese3.94. S2CID 54929253.
- ^ a b Wang, H.Y; Foote, R.S; Jacobson, S.C; Schneibel, J.H; Ramsey, J.M (1997-12-15). «Low temperature bonding for microfabrication of chemical analysis devices». Sensors and Actuators B: Chemical. 45 (3): 199–207. doi:10.1016/S0925-4005(97)00294-3. ISSN 0925-4005.
- ^ a b Puers, R; Cozma, A (1997-09-01). «Bonding wafers with sodium silicate solution». Journal of Micromechanics and Microengineering. 7 (3): 114–117. Bibcode:1997JMiMi…7..114P. doi:10.1088/0960-1317/7/3/008. ISSN 0960-1317. S2CID 250822654.
- ^ a b c Berthold, A.; Nicola, L.; Sarro, P.M; Vellekoop, M.J (2000-05-15). «Glass-to-glass anodic bonding with standard IC technology thin films as intermediate layers». Sensors and Actuators A: Physical. 82 (1–3): 224–228. doi:10.1016/S0924-4247(99)00376-3. ISSN 0924-4247.
- ^ a b Li, Dongqing, ed. (2008). Encyclopedia of Microfluidics and Nanofluidics. Boston, MA: Springer US. doi:10.1007/978-0-387-48998-8. ISBN 978-0-387-32468-5.
- ^ «Home» (PDF).
- ^ JLR Thompson et al Characterization of Silicate Sealers on Concrete Cement and Concrete Research Vol. 27 No. 10 1997
- ^ Burch, Paula (March 22, 2010). «Sodium silicate as a fixative for dyeing». Retrieved March 22, 2010.
- ^ a b Helliker, Kevin. «The Killer App for Clunkers Breathes Fresh Life Into ‘Liquid Glass'» The Wall Street Journal, 4 August 2009.
- ^ Engine Disablement Procedures for the CARS program Archived 2010-10-19 at the Wayback Machine, cars.gov
- ^ «Magic garden». Mechanix Illustrated: 88. April 1946. Archived from the original on 2012-02-10. Retrieved 2007-04-30.
- ^ «Ceramic, Pottery, Sculpture and Kintsugi Repair | China repair and restoration».
- ^ Press Release (TEPCO:2011.4.6)
- ^ Commander William R. Anderson with Clay Blair Jr., Nautilus 90 North (Cleveland and New York: The World Publishing Co., 1959), pp. 133–137; Commander William R. Anderson with Clay Blair Jr., Nautilus 90 North (New York: The New American Library, 1959), 89–90
- ^ Tom Kelley (August 1995). «Making and using combustible paper pistol cartridges».
- ^ Kirst, W.J. (1983). Self consuming paper cartridges for the percussion revolver. Minneapolis, Minnesota: Northwest Development Co.
- ^ How To Store Fresh Eggs. motherearthnews.com
- ^ SM Tritton (1956) Amateur wine making.
- ^ Bechtold, M. F. (1955). «Polymerization and Properties of Dilute Aqueous Silicic Acid from Cation Exchange». The Journal of Physical Chemistry. 59 (6): 532–541. doi:10.1021/j150528a013.
Further reading[edit]
- Ashford’s Dictionary of Industrial Chemicals, third edition, 2011, page 8369.
External links[edit]
- Centre Européen d’Etudes des Silicates
- International Chemical Safety Card 1137
- ChemSub Online : Silicic acid, sodium salt
- ChemSub Online : Sodium metasilicate
Неорганическое соединение, соль натрия (щелочной металл) и метакремниевой кислоты (Na2SiO3)
Внешний вид – бесцветные или белые кристаллы, растворимые в холодной воде с образованием кристаллогидрата (полисиликаты натрия Na2O ∙ 6SiO2 ∙ 8H2O, Na2O ∙ 5SiO2 ∙ 9H2O, Na2O ∙ 4SiO2 ∙ 10H2O)
Формула
Na2SiO3
Свойства силиката натрия
Физические свойства
Порошок белого цвета, состоящий из бесцветных кристаллов орторомбической сингонии, без запаха. Активно поглощает из воздуха влагу и углекислоту. При комнатной температуре растворяется в воде, образую кристаллогидраты с пятью, девятью или десятью молекулами воды (в зависимости от окружающих условий), концентрированные растворы образуют коллоид гидрозоля (SiO2 ∙ nH2O). В горячей воде и при сильном нагревании разлагается. Водный раствор имеет щелочную среду, т.к. гидролиз идет по аниону.
Химические свойства
Соединение взаимодействует с кислотами и щелочами, углекислым газом. Водный раствор взаимодействует с кислотами с образованием кремниевой кислоты, в горячей воде идет щелочной гидролиз. Деполимеризация силикатов протекает с активным выделением SiO2.
Разложение кислотами:
Na2SiO3+2HCl→2NaCl + SiO2↓+H2O
Разложение щелочами:
Na2SiO3 + 2NaOH→Na4SiO4+H2O
Реакция с углекислым газом:
Na2SiO3 + CO2 → Na2CO3 + SiO2↓
Получение метасиликата натрия
Естественные источники получения
В природе силикаты натрия можно получить из пород с высоким содержанием глины, шпатов с полевым происхождением, природной слюды и т.д.
Искусственные источники получения
Сплавление диоксида кремния с едким натром:
SiO2 + 2NaOH→Na2SiO3+H2O
Сплавлением диоксида кремния с карбонатом натрия:
SiO2 + Na2CO3 → Na2SiO3 + CO2
Разложение ортосиликата натрия:
Na4SiO4 → Na2SiO3 + Na2O
Нагревают кристаллогидрат:
Na2SiO3 ∙ 9H2O → Na2SiO3 + 9H2O
Применение силиката натрия
Силикат натрия нашел широкое применение во многих отраслях промышленности. Его используют в качестве компонента шихты для производства стекла, наполнителя в составе облегченных цементных растворов для цементирования скважин, при производстве жароустойчивых и кислотоупорных бетонов. Что касается химической промышленности, то метасиликат натрия используют при производстве моющих и очищающих средств, средств бытовой химии (стиральный порошок Henkel). Также у него широкое применение в нефтедобыче (как коагулянт при выпуске регенерирующего масла) и текстильной промышленности, металлургии, машиностроении. Силикат натрия используют как ингибитор с коррозионным действием, для дезинфекции помещений, белья, посуды, сантехники. Что интересно, силикаты являются одним из компонентов драгоценных камней (изумруда, топаза, аквамарина). Их используют как противопожарную пропитку для дерева (обработка декораций), смесью опилок и силиката заполняют промежуток между стенками сейфов также для защиты от возгорания. Широко известны склеивающие свойства силиката.
Тест по теме «Силикат натрия»
Find chemicals by name or formulas.
This reference contains the names of substances and descriptions of the chemical formulas (including the structural formula and the skeletal formula).
Type the part of name or the formula of substance for search:
Languages:
Default |
All possible |
From list
[▼]
|
Apply to found
силикат натрия
Molecular formula:
Na2O3Si
CAS# 6834-92-0
Categories:
Неорганические соли
PubChem CID: 23266
Names
Русский:
- Жидкое стекло
- Метасиликат натрия
- силикат натрия
Variants of the formula:
Na2SiO3
Na(+1)2Si(+4)O(-2)3
Na^+/0O^-Si|O`|/O^-Na^+
Related Compounds
Anion:
silicate
Elemental composition
Reactions in which силикат натрия is involved
-
{M}2O + {X}O2 -> {M}2{X}O3
, where M =
Na K Li Rb Cs; X =
C S Si -
CaCl2 + Na2SiO3 -> CaSiO3″|v» + 2NaCl
-
{M}2SiO3 + 2H{X} -> H2SiO3 + 2{M}{X}
, where M =
Na K; X =
F Cl Br I NO3 -
Na2SiO3 + 2CH3COOH -> 2CH3COONa + H2SiO3″|v»
Гигроскопическое химическое соединение с переменным соотношением Na2O / SiO2, предшественник жидкого стекла
Силикат натрия — общее название для химические соединения с формулой Na. 2xSi. yO. 2y + x или (Na. 2O). x· (SiO. 2). y, такие как метасиликат натрия Na. 2SiO. 3, ортосиликат натрия Na. 4SiO. 4и пиросиликат натрия Na. 6Si. 2O. 7. Анионы часто бывают полимерными. Эти соединения, как правило, представляют собой бесцветные прозрачные твердые вещества или белые порошки, растворимые в воде в различных количествах.
Силикат натрия также является техническим и общеупотребительным названием смеси таких соединений, в основном метасиликата, также называемого жидкое стекло, жидкое стекло или жидкое стекло . продукт имеет широкий спектр применений, в том числе при разработке цементы, пассивной противопожарной защиты, текстильная и лесоматериалы обработка, производство тугоплавких керамики, так как клеи, а при производстве силикагель. Коммерческий продукт, доступный в водном растворе или в твердой форме, часто бывает зеленоватым или синим из-за присутствия железосодержащих примесей.
В промышленности различные марки силиката натрия характеризуются их массовым соотношением SiO 2 : Na 2 O (которое может быть преобразовано в молярное соотношение путем умножения на 1.032). Соотношение может варьироваться от 1: 2 до 3,75: 1. Марки с соотношением ниже 2,85: 1 называются щелочными. Те, у кого соотношение SiO 2 : Na 2 O описаны как нейтральные.
Содержание
- 1 История
- 2 Свойства
- 3 Производство
- 4 Использование
- 4.1 Разработка
- 4.1.1 Клей
- 4.1.2 Буровые растворы
- 4.1.3 Обработка бетона и общей кирпичной кладки
- 4.1.4 Вспомогательные моющие средства
- 4.1.5 Обработка воды
- 4.1.6 Использование огнеупоров
- 4.1.7 Литье в песчаные формы
- 4.1.8 Вспомогательные красители
- 4.1. 9 Пассивная противопожарная защита
- 4.1.10 Ремонт металла
- 4.1.11 Ремонт автомобилей
- 4.1.12 Безопасное строительство
- 4.1.13 Хрустальные сады
- 4.1.14 Керамика
- 4.1.15 Герметизация протекающих водосодержащих конструкций
- 4.1.16 Патроны для огнестрельного оружия
- 4.2 Продукты питания и лекарства
- 4.2.1 Консервация продуктов
- 4.2.2 Домашнее пивоварение
- 4.2.3 Аквакультура
- 4.1 Разработка
- 5 См. также
- 6 Ссылки
- 7 Дополнительная литература
- 8 Внешние ссылки
История
Наблюдались растворимые силикаты щелочных металлов (натрия или калия ) европейскими алхимиками уже в 1500-х гг. Джамбаттиста делла Порта наблюдал в 1567 году, что tartari salis (винный камень, гидротартрат калия ) заставляет порошкообразный кристалл (кварц) плавиться при более низкой температуре. Другие возможные ранние ссылки на силикаты щелочных металлов были сделаны Василием Валентином в 1520 году и Агриколой в 1550 году. Около 1640 года Жан Баптист ван Гельмонт сообщил об образовании силикаты щелочных металлов в качестве растворимого вещества, получаемого плавлением песка с избытком щелочи, и было обнаружено, что диоксид кремния может быть количественно осажден путем добавления кислоты в раствор.
В 1646 году Глаубер сделал силикат калия, который он назвал щелочным кремнием путем плавления карбоната калия (полученного кальцинированием винного камня) и песка в тигле и выдерживания его в расплавленном состоянии до тех пор, пока он не перестанет пузыриться. (из-за выделения двуокиси углерода ). Смеси давали остыть, а затем измельчали до мелкого порошка. Когда порошок подвергался воздействию влажного воздуха, он постепенно образовывал вязкую жидкость, которую Глаубер назвал «Oleum oder Liquor Silicum, Arenæ, vel Crystallorum» (т.е. масло или раствор кремнезема, песка или кристалла кварца).
Однако позже было заявлено, что вещества, приготовленные этими алхимиками, не были жидким стеклом, как это понимается сегодня. Его приготовил в 1818 году Иоганн Непомук фон Фукс путем обработки кремниевой кислоты щелочью; в результате он растворим в воде, «но не подвержен влиянию атмосферных изменений».
Термины «жидкое стекло» и «растворимое стекло» использовались в 1846 г., в 1857 г. и в 1887 г.
В 1892 году Рудольф фон Вагнер выделил соду, поташ, двойной (сода и поташ) и фиксирующий (т. Е. Стабилизирующий) тип жидкого стекла. Тип фиксации представлял собой «смесь диоксида кремния, хорошо пропитанного калийным жидким стеклом и силикатом натрия», используемую для стабилизации неорганических акварельных пигментов на цементных покрытиях для наружных вывесок и фресок.
Свойства
Натрий силикаты представляют собой бесцветные стеклообразные или кристаллические твердые вещества или белые порошки. За исключением наиболее богатых кремнием, они легко растворяются в воде, образуя щелочные растворы.
Силикаты натрия стабильны в нейтральных и щелочных растворах. В кислых растворах ионы силиката реагируют с ионами водорода с образованием кремниевых кислот, которые имеют тенденцию разлагаться на гидратированный диоксид кремния гель. При нагревании для удаления воды в результате получается твердое полупрозрачное вещество, называемое силикагелем, широко используемое в качестве осушителя. Он выдерживает температуру до 1100 ° C.
Производство
Растворы силикатов натрия могут быть получены путем обработки смеси кремнезема (обычно как кварцевого песка ), каустической соды. и вода горячим паром в реакторе . Общая реакция:
- 2x NaOH + SiO. 2→ (Na. 2O). x· SiO. 2+ x H. 2O
Силикаты натрия также могут быть получены растворением кремнезема SiO. 2(точка плавления составляет 1713 ° C) в расплавленном карбонате натрия (который плавится с разложением при 851 ° C):
- x Na. 2CO. 3+ SiO. 2→ (Na. 2O). x· SiO. 2+ CO. 2
Материал также может быть получен из сульфата натрия (точка плавления 884 ° C) с углеродом в качестве восстановителя:
- 2x Na. 2SO. 4+ C + 2 SiO. 2→ 2 (Na. 2O). x· SiO. 2+ 2 SO. 2+ CO. 2
В 1990 г. 4 миллиона тонн силикатов щелочных металлов.
Использование
Основное применение силикатов натрия — это моющие средства, бумага, обработка воды и строительные материалы.
Машиностроение
Клей
Наиболее широко применяемые растворы силиката натрия — это цемент для производства картона. При использовании в качестве цемента для бумаги соединение из силиката натрия имеет тенденцию к растрескиванию в течение нескольких лет, после чего это не долго r скрепляет бумажные поверхности друг с другом.
Буровые растворы
Силикат натрия часто используется в буровых растворах для стабилизации стенок ствола скважины и предотвращения обрушения стенок ствола. Это особенно полезно, когда буровые скважины проходят через глинистые пласты, содержащие набухающие глинистые минералы, такие как смектит или монтмориллонит.
Обработка бетона и общей каменной кладки
Бетон, обработанный раствором силиката натрия, помогает снизить пористость в большинстве каменных изделий, таких как бетон, штукатурка и штукатурка. Этот эффект помогает уменьшить проникновение воды, но не имеет известного влияния на снижение передачи и выброса водяного пара. Происходит химическая реакция с избытком Ca (OH) 2(портландита ), присутствующим в бетоне, который надолго связывает силикаты с поверхностью, делая их более прочными и водоотталкивающими. Это лечение обычно применяется только после первоначального лечения (около 7 дней в зависимости от условий). Эти покрытия известны как силикатная минеральная краска.
Вспомогательные моющие средства
Они используются во вспомогательных детергентах, таких как сложный дисиликат натрия и модифицированный дисиликат натрия. Гранулы детергента приобретают прочность благодаря покрытию из силикатов.
Обработка воды
Силикат натрия используется в качестве коагулянта квасцов, а железный флокулянт в сточной воде обработка растений. Силикат натрия связывается с коллоидными молекулами, создавая более крупные агрегаты, которые опускаются на дно водной толщи. Микроскопические отрицательно заряженные частицы, взвешенные в воде, взаимодействуют с силикатом натрия. Их двойной электрический слой разрушается из-за увеличения ионной силы, вызванного добавлением силиката натрия (дважды отрицательно заряженный анион, сопровождаемый двумя катионами натрия), и впоследствии они объединяются. Этот процесс называется коагуляцией.
Использование огнеупоров
Жидкое стекло является полезным связующим для твердых веществ, таких как вермикулит и перлит. При смешивании с вышеупомянутыми легкими заполнителями жидкое стекло можно использовать для изготовления жестких высокотемпературных изоляционных плит, используемых для огнеупоров, пассивной противопожарной защиты и высокотемпературной изоляции, такой как изоляция формованных труб. При смешивании с мелкодисперсными минеральными порошками, такими как вермикулитная пыль (который является обычным отходом процесса расслоения), можно получить высокотемпературные клеи. Вспучивание исчезает в присутствии мелкодисперсной минеральной пыли, в результате чего жидкое стекло становится простой матрицей. Жидкое стекло недорогое и широко доступно, что делает его популярным во многих областях применения огнеупоров.
Литье в песчаные формы
Используется в качестве связующего для песка при литье в песчаные формы железа или стали. Он обеспечивает быстрое изготовление прочной формы путем пропускания CO2 смеси песка и силиката натрия в формовочной коробке, которая почти мгновенно затвердевает.
Вспомогательный краситель
Раствор силиката натрия используется в качестве фиксатора для ручного окрашивания реактивными красителями, которые требуют высокого pH для взаимодействия с текстильным волокном. После того, как краситель нанесен на ткань на основе целлюлозы, такую как хлопок или вискоза, или на шелк, ей дают высохнуть, после чего силикат натрия наносится на окрашенную ткань, покрывается пластиком для удержания влаги и оставляется. реагировать в течение часа при комнатной температуре.
Пассивная защита от огня


Силикаты натрия по своей природе вспучиваются. Они бывают в форме гранул (твердых шариков), а также в виде жидкого жидкого стекла. Сплошная листовая форма (Palusol) должна быть гидроизолирована для обеспечения долгосрочной пассивной противопожарной защиты (PFP).
Стандартные твердые силикаты натрия в форме шариков использовались в качестве заполнителя в силиконовой резине для производства пластика трубы противопожарного материала устройств. Силиконовый каучук не обладал достаточной гидроизоляцией для сохранения проницаемости, и продукты пришлось отозвать, что проблематично для противопожарных заглушек, скрытых за гипсокартоном в зданиях.
Пасты для уплотнения цели также нестабильны. Это тоже привело к отзыву и даже судебным разбирательствам. Только версия 3M «Expantrol», которая имеет внешнюю термообработку, которая помогает герметизировать внешнюю поверхность, как часть технологического стандарта, достигла достаточной долговечности, чтобы соответствовать требованиям DIBt одобрения в США для использования в противопожарной защите.
В отличие от других вспучивающихся веществ силикат натрия, как в форме шариков, так и в жидкой форме, по своей природе эндотермичен из-за жидкой воды в жидком стекле и гидратов в форму прилла. Отсутствие в США обязательных испытаний на старение, в соответствии с которыми системы PFP должны проходить испытания производительности системы после воздействия старения и влажности, лежит в основе постоянной доступности в Северной Америке продуктов PFP, которые могут выйти из строя в течение нескольких недель после установки. Неизбирательное использование силикатов натрия без надлежащих гидроизоляционных мер является источником проблем и риска. Когда силикаты натрия должным образом защищены, они работают очень хорошо и надежно в течение длительного времени. Доказательство этого можно увидеть во многих разрешениях DIBt для противопожарных устройств для пластиковых труб с использованием Palusol (продукт BASF ), в которых используются водонепроницаемые листы из силиката натрия.
Ремонт металла
Силикат натрия используется вместе с силикатом магния в пасте для ремонта и монтажа глушителя. При растворении в воде силикат натрия и силикат магния образуют густую пасту, которую легко наносить. Когда выхлопная система двигателя внутреннего сгорания нагревается до своей рабочей температуры, тепло вытесняет всю лишнюю воду из пасты. Оставшиеся силикатные составы обладают стеклоподобными свойствами, что делает ремонт временным хрупким.
Ремонт автомобилей
Силикат натрия в настоящее время также используется в качестве герметика стыков выхлопной системы и герметика трещин при ремонте глушителей, резонаторов, выхлопных труб и других компонентов выхлопной системы с армирующими стекловолоконными лентами и без них. В этом применении силикат натрия (60–70%) обычно смешивают с каолином (40-30%), минеральным силикатом алюминия, чтобы сделать «склеенное» соединение силикатом натрия непрозрачным. Однако силикат натрия представляет собой высокотемпературный клей; каолин служит просто совместимым высокотемпературным красителем. Некоторые из этих ремонтных составов также содержат стекловолокно для улучшения их способности заполнять зазоры и уменьшения хрупкости.
Силикат натрия можно использовать для заполнения зазоров внутри прокладки головки. Обычно используется в головках цилиндров из алюминиевого сплава , которые чувствительны к термическому деформации поверхности. Это может быть вызвано многими причинами, включая растяжение головки болта, недостаточную подачу охлаждающей жидкости, высокое давление в ГБЦ, перегрев и т. Д.
«Жидкое стекло» (силикат натрия) добавлено к система через радиатор и позволила циркулировать. Силикат натрия находится во взвешенном состоянии в охлаждающей жидкости, пока не достигнет головки блока цилиндров. При температуре 100–105 ° C (212–221 ° F) силикат натрия теряет молекулы воды, образуя стеклянное уплотнение с температурой плавления выше 810 ° C (1490 ° F).
Ремонт силикатом натрия может длиться два года или дольше. Восстановление происходит быстро, и симптомы исчезают мгновенно. Этот ремонт работает только тогда, когда силикат натрия достигает своей «конверсионной» температуры 100–105 ° C. Загрязнение моторного масла — серьезная возможность в ситуациях, когда присутствует утечка охлаждающей жидкости в масло. Загрязнение смазочных материалов силикатом натрия (частицами стекла) нарушает их функцию.
Раствор силиката натрия используется для недорогого, быстрого и постоянного вывода из строя автомобильных двигателей. Запуск двигателя с примерно 2 литрами раствора силиката натрия вместо моторного масла вызывает выпадение раствора в осадок, катастрофически повреждая подшипники и поршни двигателя в течение нескольких минут. В США эта процедура использовалась для соответствия требованиям программы Car Allowance Rebate System (CARS).
Безопасная конструкция
Смесь силиката натрия и опилки использовались между двойной обшивкой некоторых сейфов. Это не только делает их более огнестойкими, но и делает их вскрытие кислородно-ацетиленовым резаком чрезвычайно трудным из-за выделяемого дыма.
Сады кристаллов
Когда кристаллы ряда солей металлов бросают в раствор жидкого стекла, образуются простые или разветвленные сталагмиты цветных силикатов металлов. Это явление использовалось производителями игрушек и химических наборов, чтобы доставлять поучительное удовольствие многим поколениям детей с начала 20 века до наших дней. Раннее упоминание о кристаллах солей металлов, образующих «химический сад » в силикате натрия, можно найти в журнале Modern Mechanix за 1946 год. Используемые соли металлов включают сульфаты и / или хлориды меди, кобальта, железа, никеля и марганца.
Керамика
Силикат натрия используется в качестве дефлокулянта в литейных шликерах, помогая снизить вязкость и потребность в большом количестве воды для разжижения глины. тело. Он также используется для создания эффекта потрескивания в керамике, обычно выкованной кругом. На колесо набрасывается ваза или бутылка, довольно узкая и с толстыми стенками. Силикат натрия наносится кистью на участок детали. Через 5 минут стенка изделия вытягивается наружу ребром или рукой. Результат — морщинистый или потрескавшийся вид.
Он также является основным агентом в «волшебной воде», которая используется при соединении кусков глины, особенно если их уровень влажности отличается.
Герметизация протекающих водосодержащих структур
Силикат натрия с добавками был закачан в землю, чтобы укрепить ее и тем самым предотвратить дальнейшую утечку высокорадиоактивной воды с АЭС Фукусима-дайити в Японии в апреле 2011 года. Остаточное тепло уносимая водой, использованной для охлаждения поврежденных реакторов, ускоряла схватывание закачиваемой смеси.
3 июня 1958 года USS Nautilus, первая в мире атомная подводная лодка, посетила Эверетт и Сиэтл. В Сиэтле членов экипажа, одетых в гражданскую одежду, отправили тайно купить 140 литров автомобильного продукта, содержащего силикат натрия (первоначально обозначенного как Stop Leak), для ремонта протекающей системы конденсатора. «Наутилус» направлялся к Северному полюсу для выполнения сверхсекретной миссии по пересечению Северного полюса под водой.
Патроны для огнестрельного оружия
Историческое использование адгезионных свойств силикатов натрия — производство бумажные патроны для револьверов с черным порохом, произведенные Мануфактурной компанией Кольта в период с 1851 по 1873 год, особенно во время Гражданской войны в США. Силикат натрия использовался для скрепления горючей нитрированной бумаги вместе с образованием конического бумажного картриджа для удерживания черного пороха, а также для приклеивания свинцового шара или конической пули к открытому концу бумажного картриджа. Такие патроны из цементированной силикатом натрия бумаги вставлялись в цилиндры револьверов, тем самым ускоряя перезарядку револьверов с черным порохом. Это использование в значительной степени закончилось выпуском револьверов Colt с патронами в латунной гильзе, начиная с 1873 года. Аналогичным образом, силикат натрия также использовался для цементирования верхнего пыжа в латунных гильзах для дробовика, тем самым устраняя необходимость в обжиме на верхняя часть латунного гильзы для дробовика, чтобы держать гильзу вместе. Перезарядка латунных гильз для дробовиков широко практиковалась самодостаточными американскими фермерами в 1870-х годах с использованием того же материала жидкого стекла, который также использовался для сохранения яиц. Цементирование верхнего комка на патрон дробовика заключалось в нанесении от трех до пяти капель водяного стекла на верхний комок, чтобы прикрепить его к латунному корпусу. Латунные корпуса для патронов для дробовика были заменены бумажными, начиная примерно с 1877 года. В более новых патронах для дробовиков с бумажным корпусом использовался обжимной валик вместо цементированного жидким стеклом соединения, чтобы удерживать верхний комок в гильзе. Однако, в то время как латунные дробовые патроны с верхними пыжами, зацементированными жидким стеклом, можно было перезаряжать почти бесконечно (учитывая порох, пыж и дробь, конечно), бумажные корпуса, которые заменили латунные корпуса, можно было перезаряжать только несколько раз.
Продукты питания и лекарства
Хотя силикат натрия и другие силикаты не используются в медицине, они являются основными компонентами «мгновенных» кремов для разглаживания морщин, которые временно подтягивают кожу, чтобы минимизировать внешний вид от морщин и мешков под глазами. Эти кремы, если их нанести тонким слоем и дать высохнуть в течение нескольких минут, могут дать впечатляющие результаты. К сожалению, это не постоянно, длится несколько минут или пару часов. Он работает как водный цемент: как только мышца начинает двигаться, она трескается и оставляет белые остатки на коже.
Консервирование продуктов

Жидкое стекло с большим успехом использовалось в качестве консерванта для яиц, в основном, когда охлаждение недоступно. Свежеотнесенные яйца погружают в раствор силиката натрия (жидкое стекло). После погружения в раствор их удалили и дали высохнуть. На яйцах остается стойкий воздухонепроницаемый налет. Если они затем хранятся в подходящей среде, большинство бактерий, которые в противном случае могли бы вызвать их порчу, удерживаются, а их влага сохраняется. Согласно цитируемому источнику, обработанные яйца можно хранить свежими с использованием этого метода до пяти месяцев.. При варке яиц таким образом скорлупа становится непроницаемой для воздуха, и яйцо будет иметь тенденцию треснуть, если в скорлупе не будет проделано отверстие (например, булавкой) для выхода пара.
Домашнее пивоварение
Силикат натрия свойства флокулянта также используются для осветления вина и пива путем осаждения коллоидных частиц. Однако в качестве очищающего агента силикат натрия иногда путают с isinglass, который получают из коллагена, экстрагированного из высушенных плавательных пузырей осетровых рыб <11.>и прочие рыбки. Яйца, консервированные в ведре с жидким стекловолокном, и их скорлупа иногда также используются (запекаются и измельчаются) для очистки вина.
Аквакультура
Гель силиката натрия также используется в качестве субстрата для роста водорослей в аквакультуре питомниках.
См. также
- Силикат калия
Ссылки
Дополнительная литература
- Словарь промышленных химикатов Эшфорда, третье издание, 2011 г., стр. 8369.
Внешние ссылки
- Европейским центром исследований силикатов
- Международная карта химической безопасности 1137
- ChemSub Online: Кремниевая кислота, натриевая соль
- ChemSub Online: метасиликат натрия
НАТРИЯ СИЛИКАТЫ
- НАТРИЯ СИЛИКАТЫ
-
соли к-т кремния. Бесцв. кристаллы или стеклообразные в-ва. Известны: метасиликат Na2SiO3, ортосиликат Na4SiO4, пиросиликат Na6Si2O7, a также пентаоксодисиликат Na2Si2O5, октаоксотрисиликат Na4Si3O8, гептаоксотрисиликат Na2SiO3, октасиликат Na6Si8O19, гидраты метасиликата Na2Si3O7 ХnН 2 О, где n=1,5-9, гидраты пиросиликата Na6Si2O7.nН 2 О, где п= 3, 5, 11; выделены гидроксо- и гидросиликаты NaHSi2O4(OH)2.2H2O, NaSi2O3 (ОН)3 ХН 3 О, NaSi7O13(OH)3 x х 3Н 2 О, Na2H2SiO4 Х7Н 2 О, NaHSi2O5 и др. Св-ва нек-рых из них см. в таблице.
Н. с. раств. в воде, не обнаруживая точки насыщения, причем м. б. получены очень концентрир. густые коллоидные р-ры. Для получения р-ров Н. с. используют стеклообразные продукты с разл. соотношениями Na2O/SiO2. Водные р-ры Н. с. подвергаются гидролизу и имеют сильную щелочную р-цию: при рН < 10,9 неустойчивы и выделяют кремнекислоту в виде геля.
Все кристаллич. безводные Н. с. получают кристаллизацией стекол соответствующего состава (см. Стекло растворимое). Н. с. используют как компоненты шихты в произ-ве стекла, для получения алюмосиликатных катализаторов, цеолитов, в производстве теплоизоляц. материалов, жаростойких и кислотоупорных бетонов, жидкого стекла.
СВОЙСТВА СИЛИКАТОВ НАТРИЯ
aNg, Nm и p -показатели преломления, соотв. больший, средний и меньший. b Т. разл. (Na2Si3O7
3Na2OХSiO2 + SiO2). вT-pa полиморфного перехода, DH перехода 6,3 кДж/моль. г Плотн. стеклообразного 2,51 г/см 3. д Известна др. моноклинная форма с т. пл. 808°С (инконгруэнтно). е Т. разл. (Na6Si8O19
b-Na2 Si2 О 5 + Na2Si3O7). ж При 620 °C начинает разлагаться (Na6Si2O7
Na4SiO4 + Na2SiO3). з‘>T-pa перехода в моноклинную модификацию (т. пл. 1120°С, плотн. 2,60 г/см 3).
Я. С. Никонова.
Химическая энциклопедия. — М.: Советская энциклопедия.
.
1988.
Полезное
Смотреть что такое «НАТРИЯ СИЛИКАТЫ» в других словарях:
-
Натрия силикаты — натриевые соли кремниевых кислот, например Na2SiO3; см. Силикаты натрия … Большая советская энциклопедия
-
Силикаты — – соединения химических элементов с кремнеземом, в которых кремний максимально окислен (цемент, бетон, стекло, керамика и др.). [Терминологический словарь по бетону и железобетону. ФГУП «НИЦ «Строительство» НИИЖБ и м. А. А. Гвоздева, Москва … Энциклопедия терминов, определений и пояснений строительных материалов
-
СИЛИКАТЫ — (природные), важнейший класс породообразующих минералов, состоящих из соединений кремния и кислорода (SiO4), с различным металлам. Основные структурные единицы силикатов, кремнекислородные тетраэдры SiO4, могут образовывать одинарные или двойные… … Научно-технический энциклопедический словарь
-
Силикаты (минералы) — У этого термина существуют и другие значения, см. Силикаты. Силикаты и алюмосиликаты представляют собой обширную группу минералов. Для них характерен сложный химический состав и изоморфные замещения одних элементов и комплексов элементов другими … Википедия
-
Силикаты натрия — натриевые соли кремниевых кислот. Известны следующие безводные С. н.: Na2O․SiO2 (или Na2SiO3) метасиликат натрия, 2Na2O․SiO2 (Na4SiO4) ортосиликат натрия, 3Na2O․2SiO2 (Na6Si2O7) пиросиликат натрия, Na2O․2SiO2 (Na2Si2O5) бисиликат натрия,… … Большая советская энциклопедия
-
Силикаты (соли) — У этого термина существуют и другие значения, см. Силикаты. Силикаты (от лат. silex камень) соли метакремниевой кислоты H2SiO3, например, стеклом. В природе встречается в виде минералов, а также являются основой горных пород, из которых состоит… … Википедия
-
Глюконат натрия — (Sodium Gluconate) (формула ) E 576 применяется в пяти промышленных целях: Содержание 1 Применение в промышленных моющих средствах 1.1 … Википедия
-
Перкарбонат натрия — Общие Систематическое наименование Гидропероксосольват карбоната натрия Традиционные названия Перкарбонат натрия, пероксигидрат карбоната натрия Химическая формула Na2CO3·1,5H2O2 … Википедия
-
Метасиликат натрия — Метасиликат натрия … Википедия
-
Ортосиликат натрия — Общие Систематическое наименование Ортосиликат калия; силикат калия Традиционные названия Кремнекислый калий Химическая формула Na4SiO4 Физические свойства … Википедия


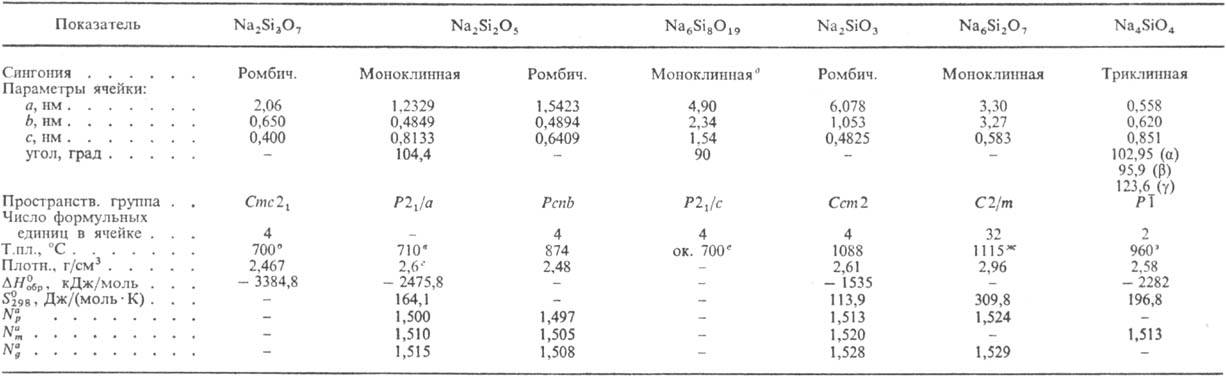
 3Na2OХSiO2 + SiO2). вT-pa полиморфного перехода, DH перехода 6,3 кДж/моль. г Плотн. стеклообразного 2,51 г/см 3. д Известна др. моноклинная форма с т. пл. 808°С (инконгруэнтно). е Т. разл. (Na6Si8O19
3Na2OХSiO2 + SiO2). вT-pa полиморфного перехода, DH перехода 6,3 кДж/моль. г Плотн. стеклообразного 2,51 г/см 3. д Известна др. моноклинная форма с т. пл. 808°С (инконгруэнтно). е Т. разл. (Na6Si8O19 b-Na2 Si2 О 5 + Na2Si3O7). ж При 620 °C начинает разлагаться (Na6Si2O7
b-Na2 Si2 О 5 + Na2Si3O7). ж При 620 °C начинает разлагаться (Na6Si2O7 Na4SiO4 + Na2SiO3). з‘>T-pa перехода в моноклинную модификацию (т. пл. 1120°С, плотн. 2,60 г/см 3).
Na4SiO4 + Na2SiO3). з‘>T-pa перехода в моноклинную модификацию (т. пл. 1120°С, плотн. 2,60 г/см 3).