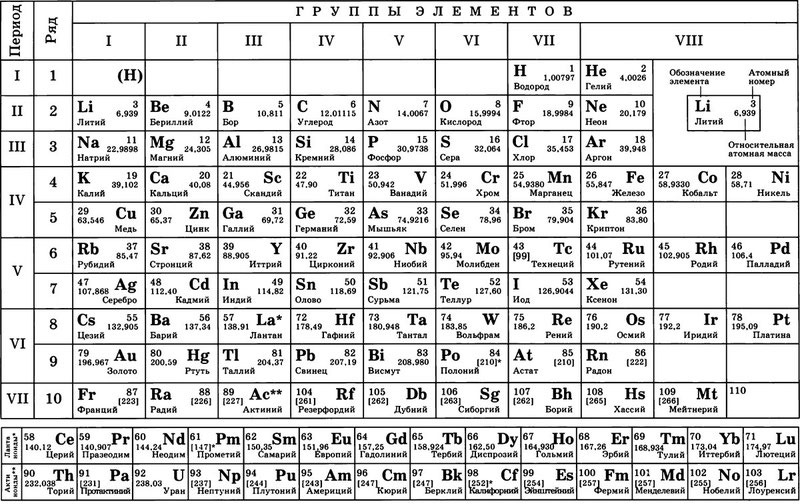
Химические элементы: названия, символы и произношение символов
В таблице содержатся русские и латинские названия химических элементов, символы химических элементов и произношение символов. Для правильного произношения названий и символов в русских названиях и произношениях проставлены ударения.
| Русское название элемента | Латинское название элемента | Символ элемента | Произношение символа |
|---|---|---|---|
| Азо́т | Nitrogenium | N | эн |
| Акти́ний | Actinium | Ac | акти́ний |
| Алюми́ний | Aluminium | Al | алюми́ний |
| Амери́ций | Americium | Am | амери́ций |
| Арго́н | Argon | Ar | арго́н |
| Аста́т | Astatum | At | аста́т |
| Ба́рий | Barium | Ba | ба́рий |
| Бери́ллий | Beryllium | Be | бери́ллий |
| Бе́рклий | Berkelium | Bk | бе́рклий |
| Бор | Borum | B | бор |
| Бо́рий | Bohrium | Bh | бо́рий |
| Бром | Bromium | Br | бром |
| Вана́дий | Vanadium | V | вана́дий |
| Ви́смут | Bismuthum | Bi | ви́смут |
| Водоро́д | Hydrogenium | H | аш |
| Вольфра́м | Wolframium | W | вольфра́м |
| Гадоли́ний | Gadolinium | Gd | гадоли́ний |
| Га́ллий | Gallium | Ga | га́ллий |
| Га́фний | Hafnium | Hf | га́фний |
| Ге́лий | Helium | He | ге́лий |
| Герма́ний | Germanium | Ge | герма́ний |
| Го́льмий | Holmium | Ho | го́льмий |
| Дармшта́дтий | Darmstadtium | Ds | дармшта́дтий |
| Диспро́зий | Dysprosium | Dy | диспро́зий |
| Ду́бний | Dubnium | Db | ду́бний |
| Евро́пий | Europium | Eu | евро́пий |
| Желе́зо | Ferrum | Fe | фе́ррум |
| Зо́лото | Aurum | Au | а́урум |
| И́ндий | Indium | In | и́ндий |
| Йод | Iodium | I | йод |
| Ири́дий | Iridium | Ir | ири́дий |
| Итте́рбий | Ytterbium | Yb | итте́рбий |
| И́ттрий | Yttrium | Y | и́ттрий |
| Ка́дмий | Cadmium | Cd | ка́дмий |
| Ка́лий | Kalium | K | ка́лий |
| Калифо́рний | Californium | Cf | калифо́рний |
| Ка́льций | Calcium | Ca | ка́льций |
| Кислоро́д | Oxygenium | O | о |
| Ко́бальт | Cobaltum | Co | ко́бальт |
| Коперни́ций | Copernicium | Cn | коперни́ций |
| Кре́мний | Silicium | Si | сили́циум |
| Крипто́н | Krypton | Kr | крипто́н |
| Ксено́н | Xenon | Xe | ксено́н |
| Кю́рий | Curium | Cm | кю́рий |
| Ланта́н | Lanthanum | La | ланта́н |
| Ливермо́рий | Livermorium | Lv | ливермо́рий |
| Ли́тий | Lithium | Li | ли́тий |
| Лоуре́нсий | Lawrencium | Lr | лоуре́нсий |
| Люте́ций | Lutetium | Lu | люте́ций |
| Ма́гний | Magnesium | Mg | ма́гний |
| Ма́рганец | Manganum | Mn | ма́рганец |
| Медь | Cuprum | Cu | ку́прум |
| Мейтне́рий | Meitnerium | Mt | мейтне́рий |
| Менделе́вий | Mendelevium | Md | менделе́вий |
| Молибде́н | Molybdaenum | Mo | молибде́н |
| Моско́вий | Moscovium | Mc | моско́вий |
| Мышья́к | Arsenicum | As | арсе́никум |
| На́трий | Natrium | Na | на́трий |
| Неоди́м | Neodymium | Nd | неоди́м |
| Нео́н | Neon | Ne | нео́н |
| Непту́ний | Neptunium | Np | непту́ний |
| Ни́кель | Niccolum | Ni | ни́кель |
| Нио́бий | Niobium | Nb | нио́бий |
| Нихо́ний | Nihonium | Nh | нихо́ний |
| Нобе́лий | Nobelium | No | нобе́лий |
| Оганесо́н | Oganesson | Og | оганесо́н |
| О́лово | Stannum | Sn | ста́ннум |
| О́смий | Osmium | Os | о́смий |
| Палла́дий | Palladium | Pd | палла́дий |
| Пла́тина | Platinum | Pt | пла́тина |
| Плуто́ний | Plutonium | Pu | плуто́ний |
| Поло́ний | Polonium | Po | поло́ний |
| Празеоди́м | Praseodymium | Pr | празеоди́м |
| Проме́тий | Promethium | Pm | проме́тий |
| Протакти́ний | Protactinium | Pa | протакти́ний |
| Ра́дий | Radium | Ra | ра́дий |
| Радо́н | Radon | Rn | радо́н |
| Резерфо́рдий | Rutherfordium | Rf | резерфо́рдий |
| Ре́ний | Rhenium | Re | ре́ний |
| Рентге́ний | Roentgenium | Rg | рентге́ний |
| Ро́дий | Rhodium | Rh | ро́дий |
| Ртуть | Hydrargyrum | Hg | гидра́ргирум |
| Руби́дий | Rubidium | Rb | руби́дий |
| Руте́ний | Ruthenium | Ru | руте́ний |
| Сама́рий | Samarium | Sm | сама́рий |
| Свине́ц | Plumbum | Pb | плю́мбум |
| Селе́н | Selenium | Se | селе́н |
| Се́ра | Sulfur | S | эс |
| Серебро́ | Argentum | Ag | арге́нтум |
| Сибо́ргий | Seaborgium | Sg | сибо́ргий |
| Ска́ндий | Scandium | Sc | ска́ндий |
| Стро́нций | Strontium | Sr | стро́нций |
| Сурьма́ | Stibium | Sb | сти́биум |
| Та́ллий | Thallium | Tl | та́ллий |
| Танта́л | Tantalum | Ta | танта́л |
| Теллу́р | Tellurium | Te | теллу́р |
| Теннесси́н | Tennessium | Ts | теннесси́н |
| Те́рбий | Terbium | Tb | те́рбий |
| Техне́ций | Technetium | Tc | техне́ций |
| Тита́н | Titanium | Ti | тита́н |
| То́рий | Thorium | Th | то́рий |
| Ту́лий | Thulium | Tm | ту́лий |
| Углеро́д | Carboneum | C | цэ |
| Ура́н | Uranium | U | ура́н |
| Фе́рмий | Fermium | Fm | фе́рмий |
| Флеро́вий | Flerovium | Fl | флеро́вий |
| Фо́сфор | Phosphorus | P | пэ |
| Фра́нций | Francium | Fr | фра́нций |
| Фтор | Fluorum | F | фтор |
| Ха́ссий | Hassium | Hs | га́ссий |
| Хлор | Chlorum | Cl | хлор |
| Хром | Chromium | Cr | хром |
| Це́зий | Caesium | Cs | це́зий |
| Це́рий | Cerium | Ce | це́рий |
| Цинк | Zincum | Zn | цинк |
| Цирко́ний | Zirconium | Zr | цирко́ний |
| Эйнште́йний | Einsteinium | Es | эйнште́йний |
| Э́рбий | Erbium | Er | э́рбий |
Загрузить PDF
Загрузить PDF
Если таблица Менделеева кажется вам сложной для понимания, вы не одиноки! Хотя бывает непросто понять ее принципы, умение работать с ней поможет при изучении естественных наук. Для начала изучите структуру таблицы и то, какую информацию можно узнать из нее о каждом химическом элементе. Затем можно приступить к изучению свойств каждого элемента. Наконец, с помощью таблицы Менделеева можно определить число нейтронов в атоме того или иного химического элемента.
-
1
Таблица Менделеева, или периодическая система химических элементов, начинается в левом верхнем углу и заканчивается в конце последней строки таблицы (в нижнем правом углу). Элементы в таблице расположены слева направо в порядке возрастания их атомного номера. Атомный номер показывает, сколько протонов содержится в одном атоме. Кроме того, с увеличением атомного номера возрастает и атомная масса. Таким образом, по расположению того или иного элемента в таблице Менделеева можно определить его атомную массу.
- Атомная масса увеличивается слева направо и сверху вниз, поскольку в атомах элементов с бо́льшим номером содержится больше протонов и нейтронов. Каждый последующий элемент содержит больше протонов, чем предыдущий, поэтому возрастает и его атомная масса.
- В атомной массе не учитываются электроны, поскольку они весят намного меньше, чем протоны и нейтроны.[1]
-
2
Как видно, каждый следующий элемент содержит на один протон больше, чем предшествующий ему элемент. Это очевидно, если посмотреть на атомные номера. Атомные номера возрастают на один при движении слева направо. Поскольку элементы расположены по группам, некоторые ячейки таблицы остаются пустыми.[2]
- Например, первая строка таблицы содержит водород, который имеет атомный номер 1, и гелий с атомным номером 2. Однако они расположены на противоположных краях, так как принадлежат к разным группам.
-
3
Узнайте о группах, которые включают в себя элементы со схожими физическими и химическими свойствами. Элементы каждой группы располагаются в соответствующей вертикальной колонке. Как правило, они обозначаются одним цветом, что помогает определить элементы со схожими физическими и химическими свойствами и предсказать их поведение.[3]
Все элементы той или иной группы имеют одинаковое число электронов на внешней оболочке.[4]
- Водород можно отнести как к группе щелочных металлов, так и к группе галогенов. В некоторых таблицах его указывают в обеих группах.
- В большинстве случаев группы пронумерованы от 1 до 18, и номера ставятся вверху или внизу таблицы. Номера могут быть указаны римскими (например, IA) или арабскими (например,1A или 1) цифрами.
- При движении вдоль колонки сверху вниз говорят, что вы «просматриваете группу».
-
4
Узнайте, почему в таблице присутствуют пустые ячейки. Элементы упорядочены не только в соответствии с их атомным номером, но и по группам (элементы одной группы обладают схожими физическими и химическими свойствами). Благодаря этому можно легче понять, как ведет себя тот или иной элемент. Однако с ростом атомного номера не всегда находятся элементы, которые попадают в соответствующую группу, поэтому в таблице встречаются пустые ячейки.[5]
- Например, первые 3 строки имеют пустые ячейки, поскольку переходные металлы встречаются лишь с атомного номера 21.
- Элементы с атомными номерами с 57 по 71 относятся к редкоземельным элементам, и обычно их выносят в отдельную подгруппу в нижнем правом углу таблицы.
-
5
Каждая строка таблицы представляет собой период. Все элементы одного периода имеют одинаковое число атомных орбиталей, на которых расположены электроны в атомах. Количество орбиталей соответствует номеру периода. Таблица содержит 7 строк, то есть 7 периодов.[6]
- Например, атомы элементов первого периода имеют одну орбиталь, а атомы элементов седьмого периода — 7 орбиталей.
- Как правило, периоды обозначаются цифрами от 1 до 7 слева таблицы.
- При движении вдоль строки слева направо говорят, что вы «просматриваете период».
-
6
Научитесь различать металлы, металлоиды и неметаллы. Вы лучше будете понимать свойства того или иного элемента, если сможете определить, к какому типу он относится. Для удобства в большинстве таблиц металлы, металлоиды и неметаллы обозначаются разными цветами. Металлы находятся в левой, а неметаллы — в правой части таблицы. Металлоиды расположены между ними.[7]
- Помните, что по свойствам водород можно отнести как к щелочным металлам, так и к галогенам, поэтому он может иметь разный цвет и располагаться в двух ячейках.
- Металлические элементы блестят, являются твердыми при комнатной температуре (за исключением ртути), хорошо проводят тепло и электрический заряд и достаточно пластичны.
- Неметаллы не имеют выраженного блеска, плохо проводят тепло и электрический заряд, обладают низкой пластичностью. Как правило, при комнатной температуре неметаллические элементы представляют собой газ, но при определенных температурах и давлениях они могут принимать жидкое или твердое состояние.
- Металлоиды совмещают в себе свойства металлов и неметаллов.[8]
Реклама
-
1
Каждый элемент обозначается одной или двумя латинскими буквами. Как правило, символ элемента приведен крупными буквами в центре соответствующей ячейки. Символ представляет собой сокращенное название элемента, которое совпадает в большинстве языков. При проведении экспериментов и работе с химическими уравнениями обычно используются символы элементов, поэтому полезно помнить их.[9]
- Обычно символы элементов являются сокращением их латинского названия, хотя для некоторых, особенно недавно открытых элементов, они получены из общепринятого названия. К примеру, гелий обозначается символом He, что близко к общепринятому названию в большинстве языков. В то же время железо обозначается как Fe, что является сокращением его латинского названия.
-
2
Обратите внимание на полное название элемента, если оно приведено в таблице. Это «имя» элемента используется в обычных текстах. Например, «гелий» и «углерод» являются названиями элементов. Обычно, хотя и не всегда, полные названия элементов указываются под их химическим символом.[10]
- Иногда в таблице не указываются названия элементов и приводятся лишь их химические символы.
-
3
Найдите атомный номер. Обычно атомный номер элемента расположен вверху соответствующей ячейки, посередине или в углу. Он может также находиться под символом или названием элемента. Элементы имеют атомные номера от 1 до 118.[11]
- Атомный номер всегда является целым числом.
-
4
Помните о том, что атомный номер соответствует числу протонов в атоме. Все атомы того или иного элемента содержат одинаковое количество протонов. В отличие от электронов, количество протонов в атомах элемента остается постоянным. В противном случае получился бы другой химический элемент![12]
- По атомному номеру элемента можно также определить количество электронов и нейтронов в атоме.
-
5
Обычно количество электронов равно числу протонов. Исключением является тот случай, когда атом ионизирован. Протоны имеют положительный, а электроны — отрицательный заряд. Поскольку атомы обычно нейтральны, они содержат одинаковое количество электронов и протонов. Тем не менее, атом может захватывать электроны или терять их, и в этом случае он ионизируется.[13]
- Ионы имеют электрический заряд. Если в ионе больше протонов, то он обладает положительным зарядом, и в этом случае после символа элемента ставится знак «плюс». Если ион содержит больше электронов, он имеет отрицательный заряд, что обозначается знаком «минус».
- Знаки «плюс» и «минус» не ставятся, если атом не является ионом.
Реклама
-
1
Найдите атомную массу. Обычно атомную массу указывают внизу ячейки, под символом элемента. Атомная масса представляет собой сумму масс частиц, составляющих ядро атома, то есть протонов и нейтронов. Однако элементы имеют изотопы, поэтому атомная масса является средней величиной с учетом их распространенности в природе.[14]
- Поскольку атомная масса представляет собой среднюю величину, для большинства элементов она записывается в виде десятичной дроби.
- Хотя может показаться, что атомная масса всегда возрастает при движении слева направо и сверху вниз, это справедливо не во всех случаях.
-
2
Найдите массовое число конкретного элемента. Поскольку в атомной массе учитываются все изотопы элемента, для определения массового числа достаточно округлить приведенную в таблице атомную массу до ближайшего целого числа.[15]
- Например, атомная масса углерода составляет 12,011, после округления получаем 12. Для железа, атомная масса которого равна 55,847, получаем 56.
-
3
Вычтите из массового числа атома его атомный номер, чтобы найти количество нейтронов. Масса атома представляет сумму масс протонов и нейтронов. Ввиду этого можно легко определить число нейтронов — достаточно вычесть из массового числа атомный номер, то есть количество протонов![16]
- Используйте следующую формулу: Число нейтронов = Массовое число – Число протонов.
- Например, массовое число углерода равно 12, и атом углерода имеет 6 протонов. Поскольку 12 – 6 = 6, атом углерода содержит 6 нейтронов.
- Массовое число железа составляет 56, и его атом содержит 26 протонов. Так как 56 – 26 = 30, в атоме железа содержится 30 нейтронов.
- Изотопы элементов имеют разное количество нейтронов, благодаря чему меняется их атомная масса.
Реклама
Советы
- Многим сложно освоить таблицу Менделеева. Не расстраивайтесь, если столкнетесь с определенными трудностями!
- Хотя цвета могут меняться, они передают одну и ту же информацию.
- Встречаются упрощенные таблицы. Например, в таблице могут содержаться лишь символы элементов и их атомные номера. Выберите такую таблицу, которая подходит для ваших целей.
Реклама
Об этой статье
Эту страницу просматривали 240 167 раз.
Была ли эта статья полезной?
Из таблицы Менделеева можно почерпнуть огромное количество информации о каждом химическом элементе, что значительно облегчит решение задач. Более того, периодическую систему можно использовать на ЕГЭ, и это может стать серьезным подспорьем. Главное — уметь грамотно ей пользоваться. Как это делать — читайте в нашей статье.
Таблица Менделеева — краткое описание
Таблица Менделеева — это графическое выражение периодического закона, который открыл русский ученый Д.И. Менделеев в 1869 году. Периодическая система представляет собой классификацию химических элементов, которая основана на зависимости свойств химических элементов от заряда их атомного числа. Первоначальный вариант предполагал зависимость свойств веществ от их атомной массы.
Существуют три формата таблицы Менделеева:
- короткий (короткопериодный);
- длинный (длиннопериодный);
- сверхдлинный.
Международным союзом теоретической и прикладной химии (ИЮПАК) в качестве основного утвержден длинный вариант таблицы Менделеева, а короткий вариант официально отменен в 1989 году.
Пустые ячейки в таблице
Создав периодическую таблицу в 1869 году на базе уже известных миру 63-х химических элементов, Менделеев предсказал открытие новых и оставил для них пустые ячейки в таблице. Русский ученый оказался прав. Гипотеза Менделеева в скором времени была подтверждена открытиями других ученых: в 1875 году был открыт галлий, в 1879 — скандий, в 1886 — германий. На 2023 год в таблицу собраны 118 известных элементов. Последние из них открыты в 2016 году: ученые обнаружили нихоний, московий, теннессин и оганесон.
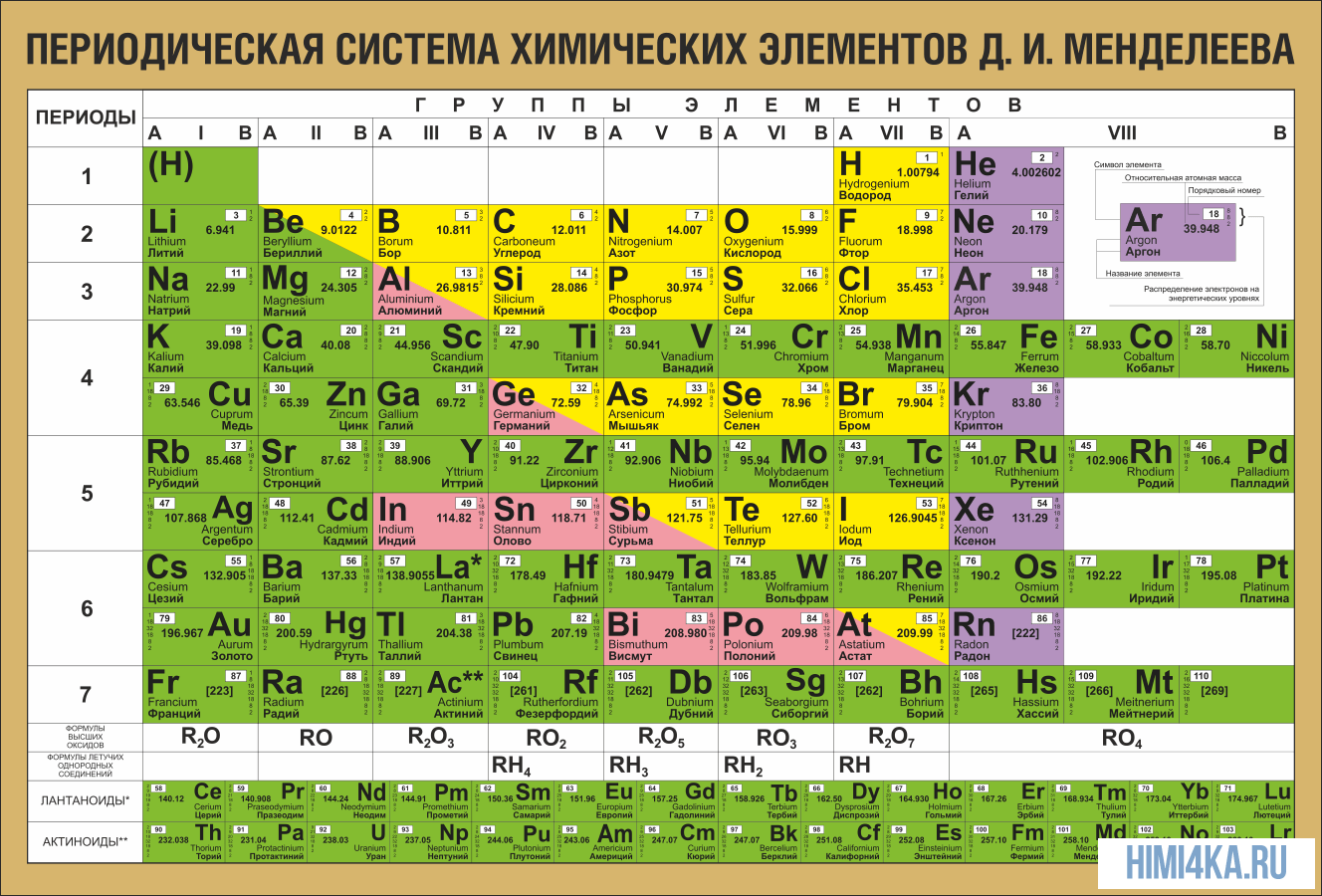
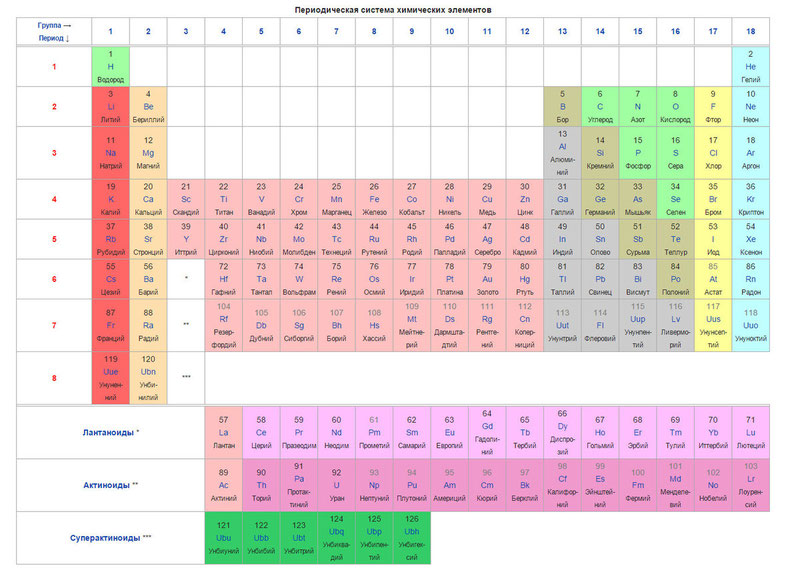
Структура таблицы
В таблице Менделеева химические вещества расположены в специальном порядке: слева направо по мере роста их атомных масс. Все они в периодической системе объединены в периоды и группы. Таблица состоит из семи периодов и восьми групп.
Периоды — это горизонтальные ряды в таблице.
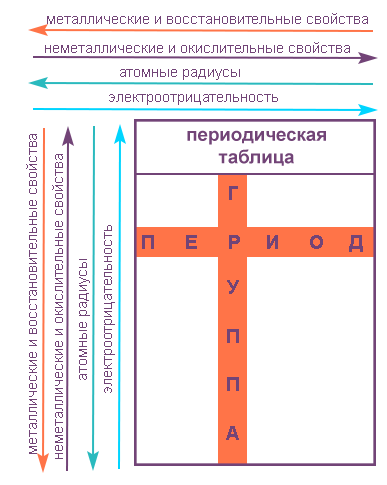
Элементы, которые относятся к одному периоду, показывают следующие закономерности с увеличением их порядкового номера:
- Возрастает электроотрицательность.
- Металлические свойства убывают, неметаллические возрастают.
- Атомный радиус падает.
Периоды в таблице делятся на:
- малые;
- большие.
Малыми называются периоды, которые содержат небольшое количество элементов. Это первый, второй и третий периоды, первый состоит из 2-х, второй и третий из 8 элементов.
Все остальные периоды — это большие периоды. Четвертый и пятый состоят из 18 элементов, шестой — из 32-х, седьмой — из 24-х.
В нижней части таблицы Менделеева расположены химические вещества, которые называются лантаноидами и актиноидами.
Таблица периодической системы содержит десять рядов. Малые периоды состоят из одного ряда, большие периоды содержат по два ряда. В седьмом периоде находится один ряд.
Каждый большой период состоит из четного и нечетного рядов. В четных рядах содержатся металлы, в нечетных рядах — неметаллы.
Периодическая система начинается водородом — первым химическим элементом, а заканчивается на сегодняшний день 118-м — оганесоном. Ученые утверждают, что таблица не закончена, идет активный поиск 119-го элемента.
Группы элементов с похожими свойствами
Группа — это вертикальная колонка в периодической таблице, определяющая основные физико-химические свойства элементов. Вещества, принадлежащие к одной и той же группе, обладают похожими химическими особенностями и демонстрируют одинаковую закономерность в изменении своих свойств по мере увеличения атомного числа.
Всем группам (колонкам таблицы) присваиваются номера от 1 до 18 — слева направо (от щелочных металлов к благородным газам). Такая система вступила в силу в 1988 году по инициативе ИЮПАК. Все прежние названия групп, которые использовали в разных странах, больше не употребляются.
Элементы, которые относятся к одной группе, показывают следующие закономерности по направлению сверху вниз:
- Возрастает радиус атома элементов в рамках одной группы.
- Усиливаются металлические свойства элементов и ослабевают неметаллические.
- Падает электроотрицательность.
Цветовое определение групп
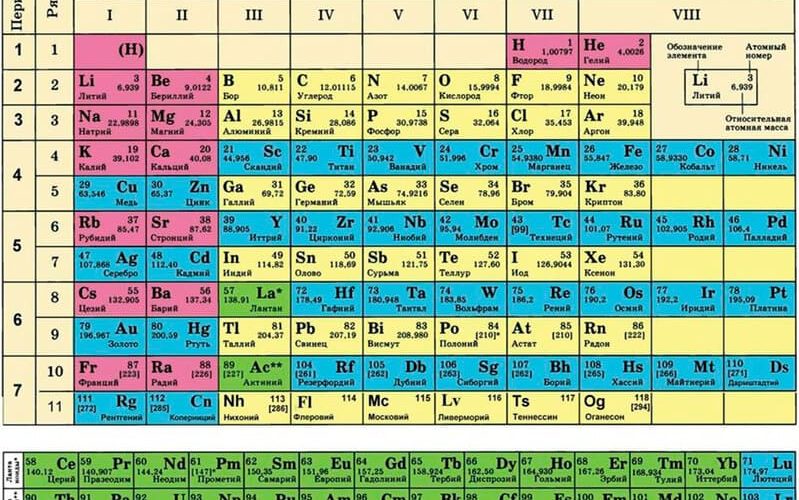
Вещества в каждой группе делятся на те, которые находятся в главной подгруппе и те, которые входят в побочную подгруппу. В таблице составляющие побочной группы выделяются синим цветом, к ней относятся элементы только больших периодов (начинаются с четвертого периода). В главную подгруппу могут входить элементы и малых, и больших периодов (начинаются с первого или второго периодов).
Различение металлов, металлоидов и неметаллов
Все химические элементы в зависимости от их химических и физических свойств можно разделить на 3 типа:
- металлы;
- металлоиды;
- неметаллы.
Характеристика металлов (например, медь, алюминий, золото):
- Хорошая электро- и теплопроводность.
- Способность отражать свет (яркий внешний вид).
- Высокая температура плавления (остаются твердыми при нормальных значениях окружающей среды, исключение — ртуть).
- Пластичность и податливость.
Неметаллы встречаются в природе в трех состояниях: газ (например, водород), жидкость (например, бром) и твердые вещества (например, фосфор). Их характеризуют:
- Неспособность проводить тепло и электричество.
- Разнообразный внешний вид (элементы с низкой плотностью и яркостью).
- Значительно более низкая температура плавления в сравнении с металлами.
- Хрупкость и ломкость.
Металлоиды имеют смешанные свойства металлов и неметаллов (например, кремний). Их основные черты:
- Средняя тепло- и электропроводность.
- Внешний вид может быть схож с металлами или неметаллами.
- Различаются между собой по температуре плавления, плотности, цвету и форме.
Обозначение элементов
Каждый элемент в периодической системе Менделеева имеет несколько обозначений:
- название;
- буквенное выражение;
- атомный номер;
- массовое число.
Буквенное, название
В таблице может быть указано полное название вещества (например, Carbon), в таких случаях его располагают под химическим символом.
Символ — это сокращенное название элемента (например, гелий — He).
Иногда в таблице не указываются названия вещества и приводится лишь его химический символ. Обозначения, как правило, состоят из одной или двух латинских букв. Символ элемента расположен в центре соответствующей ячейки в таблице.
Атомный номер
Атомный номер элемента обычно располагается вверху соответствующей ячейки, посередине или в углу. Все элементы имеют атомные номера от 1 до 118. Атомный номер — это всегда целое число.
Массовое число
Массовое число — это общее количество протонов и нейтронов в ядре. Его легко определить по атомной массе элемента, округляя ее до ближайшего целого числа.
Атомная масса указывается внизу ячейки, под символом элемента. Атомная масса — это сумма масс частиц, которые составляют ядро атома (протоны и нейтроны), представляет собой среднюю величину, для большинства элементов записывается в виде десятичной дроби.
Например, фосфор (P) имеет атомную массу равную 30,97376, следовательно, массовое число (количество протонов и нейтронов в ядре) составит 31.
Валентность
Валентность — это свойство элементов образовывать химические связи.
Валентность бывает:
- постоянная;
- переменная (зависит от состава вещества, в которое входит элемент).
Определить валентность по таблице Менделеева несложно:
- Постоянная валентность идентична номеру группы главной подгруппы. Номера групп в таблице изображаются римскими цифрами.
- Переменная валентность (часто бывает у неметаллов) определяется по формуле: 8 (всего 8 групп в таблице) вычесть № группы, в которой находится вещество.
Например, вещества, находящиеся в первой группе главной подгруппы (Li, К) имеют валентность, равную I; элементы, которые располагаются во второй группе главной подгруппы (Mg, Ca) обладают II валентностью. Мышьяк (As) находится в V группе главной подгруппы, следовательно, значение его валентности также будет равняться V. Помимо этого, у вещества есть еще одно значение валентности. Определяется оно по приведенной выше формуле и равняется III.
Если у вас возникнут сложности в усвоении знаний не только по химии, но и по любому другому предмету, обращайтесь за помощью к образовательному ресурсу Феникс.Хелп. Для нас не существует нелюбимых дисциплин и сложных тем!
ПЕРИОДИЧЕСКАЯ ТАБЛИЦА МЕНДЕЛЕЕВА
Еще в школе, сидя на уроках химии, все мы помним таблицу на стене класса или химической лаборатории. Эта таблица содержала классификацию всех известных человечеству химических элементов, тех фундаментальных компонентов, из которых состоит Земля и вся Вселенная. Тогда мы и подумать не могли, что таблица Менделеева бесспорно является одним из величайших научных открытий, который является фундаментом нашего современного знания о химии.
На первый взгляд, ее идея выглядит обманчиво просто: организовать химические элементы в порядке возрастания веса их атомов. Причем в большинстве случаев оказывается, что химические и физические свойства каждого элемента сходны с предыдущим ему в таблице элементом. Эта закономерность проявляется для всех элементов, кроме нескольких самых первых, просто потому что они не имеют перед собой элементов, сходных с ними по атомному весу. Именно благодаря открытию такого свойства мы можем поместить линейную последовательность элементов в таблицу, очень напоминающую настенный календарь, и таким образом объединить огромное количество видов химических элементов в четкой и связной форме. Разумеется, сегодня мы пользуемся понятием атомного числа (количества протонов) для того, чтобы упорядочить систему элементов. Это помогло решить так называемую техническую проблему «пары перестановок», однако не привело к кардинальному изменению вида периодической таблицы.
В периодической таблице Менделеева все элементы упорядочены с учетом их атомного числа, электронной конфигурации и повторяющихся химических свойств. Ряды в таблице называются периодами, а столбцы группами. В первой таблице, датируемой 1869 годом, содержалось всего 60 элементов, теперь же таблицу пришлось увеличить, чтобы поместить 118 элементов, известных нам сегодня.
Периодическая система Менделеева систематизирует не только элементы, но и самые разнообразные их свойства. Химику часто бывает достаточно иметь перед глазами Периодическую таблицу для того, чтобы правильно ответить на множество вопросов (не только экзаменационных, но и научных).
The YouTube ID of 1M7iKKVnPJE is invalid.
Периодический закон
Существуют две формулировки периодического закона химических элементов: классическая и современная.
Классическая, в изложении его первооткрывателя Д.И. Менделеева: свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величин атомных весов элементов.
Современная: свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от заряда ядра атомов элементов (порядкового номера).
Графическим изображением периодического закона является периодическая система элементов, которая представляет собой естественную классификацию химических элементов, основанную на закономерных изменениях свойств элементов от зарядов их атомов. Наиболее распространёнными изображениями периодической системы элементов Д.И. Менделеева являются короткая и длинная формы.
Группы и периоды Периодической системы
Группами называют вертикальные ряды в периодической системе. В группах элементы объединены по признаку высшей степени окисления в оксидах. Каждая группа состоит из главной и побочной подгрупп. Главные подгруппы включают в себя элементы малых периодов и одинаковые с ним по свойствам элементы больших периодов. Побочные подгруппы состоят только из элементов больших периодов. Химические свойства элементов главных и побочных подгрупп значительно различаются.
Периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров. В периодической системе имеются семь периодов: первый, второй и третий периоды называют малыми, в них содержится соответственно 2, 8 и 8 элементов; остальные периоды называют большими: в четвёртом и пятом периодах расположены по 18 элементов, в шестом — 32, а в седьмом (пока незавершенном) — 31 элемент. Каждый период, кроме первого, начинается щелочным металлом, а заканчивается благородным газом.
Физический смысл порядкового номера химического элемента: число протонов в атомном ядре и число электронов, вращающихся вокруг атомного ядра, равны порядковому номеру элемента.
Свойства таблицы Менделеева
Напомним, что группами называют вертикальные ряды в периодической системе и химические свойства элементов главных и побочных подгрупп значительно различаются.
Свойства элементов в подгруппах закономерно изменяются сверху вниз:
- усиливаются металлические свойства и ослабевают неметаллические;
- возрастает атомный радиус;
- возрастает сила образованных элементом оснований и бескислородных кислот;
- электроотрицательность падает.
Все элементы, кроме гелия, неона и аргона, образуют кислородные соединения, существует всего восемь форм кислородных соединений. В периодической системе их часто изображают общими формулами, расположенными под каждой группой в порядке возрастания степени окисления элементов: R2O, RO, R2O3, RO2, R2O5, RO3, R2O7, RO4, где символом R обозначают элемент данной группы. Формулы высших оксидов относятся ко всем элементам группы, кроме исключительных случаев, когда элементы не проявляют степени окисления, равной номеру группы (например, фтор).
Оксиды состава R2O проявляют сильные основные свойства, причём их основность возрастает с увеличением порядкового номера, оксиды состава RO (за исключением BeO) проявляют основные свойства. Оксиды состава RO2, R2O5, RO3, R2O7 проявляют кислотные свойства, причём их кислотность возрастает с увеличением порядкового номера.
Элементы главных подгрупп, начиная с IV группы, образуют газообразные водородные соединения. Существуют четыре формы таких соединений. Их располагают под элементами главных подгрупп и изображают общими формулами в последовательности RH4, RH3, RH2, RH.
Соединения RH4 имеют нейтральный характер; RH3 — слабоосновный; RH2 — слабокислый; RH — сильнокислый характер.
Напомним, что периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров.
В пределах периода с увеличением порядкового номера элемента:
- электроотрицательность возрастает;
- металлические свойства убывают, неметаллические возрастают;
- атомный радиус падает.
Элементы таблицы Менделеева
Щелочные и щелочноземельные элементы
К ним относятся элементы из первой и второй группы периодической таблицы. Щелочные металлы из первой группы — мягкие металлы, серебристого цвета, хорошо режутся ножом. Все они обладают одним-единственным электроном на внешней оболочке и прекрасно вступают в реакцию. Щелочноземельные металлы из второй группы также имеют серебристый оттенок. На внешнем уровне помещено по два электрона, и, соответственно, эти металлы менее охотно взаимодействуют с другими элементами. По сравнению со щелочными металлами, щелочноземельные металлы плавятся и кипят при более высоких температурах.
Показать / Скрыть текст
| Щелочные металлы | Щелочноземельные металлы |
| Литий Li 3 | Бериллий Be 4 |
| Натрий Na 11 | Магний Mg 12 |
| Калий K 19 | Кальций Ca 20 |
| Рубидий Rb 37 | Стронций Sr 38 |
| Цезий Cs 55 | Барий Ba 56 |
| Франций Fr 87 | Радий Ra 88 |
Лантаниды (редкоземельные элементы) и актиниды
Лантаниды — это группа элементов, изначально обнаруженных в редко встречающихся минералах; отсюда их название «редкоземельные» элементы. Впоследствии выяснилось, что данные элементы не столь редки, как думали вначале, и поэтому редкоземельным элементам было присвоено название лантаниды. Лантаниды и актиниды занимают два блока, которые расположены под основной таблицей элементов. Обе группы включают в себя металлы; все лантаниды (за исключением прометия) нерадиоактивны; актиниды, напротив, радиоактивны.
Показать / Скрыть текст
| Лантаниды | Актиниды |
| Лантан La 57 | Актиний Ac 89 |
| Церий Ce 58 | Торий Th 90 |
| Празеодимий Pr 59 | Протактиний Pa 91 |
| Неодимий Nd 60 | Уран U 92 |
| Прометий Pm 61 | Нептуний Np 93 |
| Самарий Sm 62 | Плутоний Pu 94 |
| Европий Eu 63 | Америций Am 95 |
| Гадолиний Gd 64 | Кюрий Cm 96 |
| Тербий Tb 65 | Берклий Bk 97 |
| Диспрозий Dy 66 | Калифорний Cf 98 |
| Гольмий Ho 67 | Эйнштейний Es 99 |
| Эрбий Er 68 | Фермий Fm 100 |
| Тулий Tm 69 | Менделевий Md 101 |
| Иттербий Yb 70 | Нобелий No 102 |
Галогены и благородные газы
Галогены и благородные газы объединены в группы 17 и 18 периодической таблицы. Галогены представляют собой неметаллические элементы, все они имеют семь электронов во внешней оболочке. В благородных газахвсе электроны находятся во внешней оболочке, таким образом с трудом участвуют в образовании соединений. Эти газы называют «благородными, потому что они редко вступают в реакцию с прочими элементами; т. е. ссылаются на представителей благородной касты, которые традиционно сторонились других людей в обществе.
Показать / Скрыть текст
| Галогены | Благородные газы |
| Фтор F 9 | Гелий He 2 |
| Хлор Cl 17 | Неон Ne 10 |
| Бром Br 35 | Аргон Ar 18 |
| Йод I 53 | Криптон Kr 36 |
| Астат At 85 | Ксенон Xe 54 |
| — | Радон Rn 86 |
Переходные металлы
Переходные металлы занимают группы 3—12 в периодической таблице. Большинство из них плотные, твердые, с хорошей электро- и теплопроводностью. Их валентные электроны (при помощи которых они соединяются с другими элементами) находятся в нескольких электронных оболочках.
Показать / Скрыть текст
| Переходные металлы |
| Скандий Sc 21 |
| Титан Ti 22 |
| Ванадий V 23 |
| Хром Cr 24 |
| Марганец Mn 25 |
| Железо Fe 26 |
| Кобальт Co 27 |
| Никель Ni 28 |
| Медь Cu 29 |
| Цинк Zn 30 |
| Иттрий Y 39 |
| Цирконий Zr 40 |
| Ниобий Nb 41 |
| Молибден Mo 42 |
| Технеций Tc 43 |
| Рутений Ru 44 |
| Родий Rh 45 |
| Палладий Pd 46 |
| Серебро Ag 47 |
| Кадмий Cd 48 |
| Лютеций Lu 71 |
| Гафний Hf 72 |
| Тантал Ta 73 |
| Вольфрам W 74 |
| Рений Re 75 |
| Осмий Os 76 |
| Иридий Ir 77 |
| Платина Pt 78 |
| Золото Au 79 |
| Ртуть Hg 80 |
| Лоуренсий Lr 103 |
| Резерфордий Rf 104 |
| Дубний Db 105 |
| Сиборгий Sg 106 |
| Борий Bh 107 |
| Хассий Hs 108 |
| Мейтнерий Mt 109 |
| Дармштадтий Ds 110 |
| Рентгений Rg 111 |
| Коперниций Cn 112 |
Металлоиды
Металлоиды занимают группы 13—16 периодической таблицы. Такие металлоиды, как бор, германий и кремний, являются полупроводниками и используются для изготовления компьютерных чипов и плат.
Показать / Скрыть текст
| Металлоиды |
| Бор B 5 |
| Кремний Si 14 |
| Германий Ge 32 |
| Мышьяк As 33 |
| Сурьма Sb 51 |
| Теллур Te 52 |
| Полоний Po 84 |
Постпереходными металлами
Элементы, называемые постпереходными металлами, относятся к группам 13—15 периодической таблицы. В отличие от металлов, они не имеют блеска, а имеют матовую окраску. В сравнении с переходными металлами постпереходные металлы более мягкие, имеют более низкую температуру плавления и кипения, более высокую электроотрицательность. Их валентные электроны, с помощью которых они присоединяют другие элементы, располагаются только на внешней электронной оболочке. Элементы группы постпереходных металлов имеют гораздо более высокую температуру кипения, чем металлоиды.
Показать / Скрыть текст
| Постпереходные металлы |
| Алюминий Al 13 |
| Галлий Ga 31 |
| Индий In 49 |
| Олово Sn 50 |
| Таллий Tl 81 |
| Свинец Pb 82 |
| Висмут Bi 83 |
Неметаллы
Из всех элементов, классифицируемых как неметаллы, водород относится к 1-й группе периодической таблицы, а остальные — к группам 13—18. Неметаллы не являются хорошими проводниками тепла и электричества. Обычно при комнатной температуре они пребывают в газообразном (водород или кислород) или твердом состоянии (углерод).
Показать / Скрыть текст
| Неметаллы |
| Водород H 1 |
| Углерод C 6 |
| Азот N 7 |
| Кислород O 8 |
| Фосфор P 15 |
| Сера S 16 |
| Селен Se 34 |
| Флеровий Fl 114 |
| Унунсептий Uus 117 |
А теперь закрепите полученные знания, посмотрев видео про таблицу Менделеева и не только.
Отлично, первый шаг на пути к знаниям сделан. Теперь вы более-менее ориентируетесь в таблице Менделеева и это вам очень даже пригодится, ведь Периодическая система Менделеева является фундаментом, на котором стоит эта удивительная наука.
Название и произношение химических элементов таблицы Менделеева
В этом уроке вы научитесь читать периодическую таблицу. Мы внимательно рассмотрим группы периодической таблицы. Кроме того, вы узнаете о различных свойствах групп периодической таблицы, периодов и семейств.
Различные элементы организованы и отображаются в периодической таблице. В этой таблице, разработанной русским химиком Дмитрием Менделеевым (1834–1907) в 1869 году, сгруппированы элементы, которые, хотя и уникальны, обладают некоторыми общими химическими свойствами с другими элементами. Свойства элементов определяют их физическое состояние при комнатной температуре: они могут быть газами, твердыми телами или жидкостями. Элементы также обладают специфической химической активностью, способностью соединяться и химически связываться друг с другом.
В периодических таблицах есть много типов физических и химических элементов, которые устанавливаются в соответствии с их свойствами и позиционируются из-за их атомной структуры. Периодические таблицы содержат строки и столбцы. В периодической таблице строки расположены слева направо, а столбцы — сверху вниз.
Периодические таблицы — один из важнейших инструментов в истории химии. Он сообщает нам атомные свойства каждого типа химического вещества, также сообщает об атомном номере, атомной массе, а также показывает сравнение между элементами. Итак, здесь мы показываем некоторые моменты о том, как читать периодическую таблицу.
Таблица исключений с правильным произношением химических элементов на русском языке
| АТОМНЫЙ НОМЕР | РУССКОЕ НАЗВАНИЕ ХИМИЧЕСКОГО ЭЛЕМЕНТА | ХИМИЧЕСКИЙ ЗНАК | ПРОИЗНОШЕНИЕ НА РУССКОМ ЯЗЫКЕ |
| 1 | Водород | H | Аш |
| 6 | Углерод | C | Це |
| 7 | Азот | N | Эн |
| 8 | Кислород | O | О |
| 14 | Кремний | Si | Силициум |
| 15 | Фосфор | P | Пэ |
| 16 | Сера | S | Эс |
| 26 | Железо | Fe | Феррум |
| 29 | Медь | Cu | Купрум |
| 33 | Мышьяк | As | Арсеникум |
| 47 | Серебро | Ag | Аргентум |
| 50 | Олово | Sn | Станум |
| 51 | Сурьма | Sb | Стибиум |
| 79 | Золото | Au | Аурум |
| 80 | Ртуть | Hg | Гидраргирум |
| 82 | Свинец | Pb | Плюмбум |
| Примечание: произношение остальных химических элементов соответствует названию элементов на русском языке (пример: аргон произносится как аргон, хром произносится как хром и т.д.) |
В таблице ниже описаны произношения всех известных на данный момент химических элементов.
Полная таблица латинских названий химических элементов с произношением на русском языке
(расположение слоев в порядке заполнения подуровней)
| Атомный номер | Русское название химического элемента | Латинское название химического элемента | Химический знак | Произношение на русском языке |
| 1 | водород | hydrogenium | H | аш |
| 2 | гелий | helium | He | гелий |
| 2 период химических элементов | ||||
| 3 | литий | lithium | Li | литий |
| 4 | бериллий | beryllium | Be | бериллий |
| 5 | бор | borium | B | бор |
| 6 | углерод | carboneum | C | це |
| 7 | азот | nitrogenium | N | эн |
| 8 | кислород | oxygenium | O | о |
| 9 | фтор | fluorum | F | фтор |
| 10 | неон | neon | Ne | неон |
| 3 период химических элементов | ||||
| 11 | натрий | natrium | Na | натрий |
| 12 | магний | magnesium | Mg | магний |
| 13 | алюминий | aluminium | Al | алюминий |
| 14 | кремний | silicium | Si | силициум |
| 15 | фосфор | phosphorus | P | пэ |
| 16 | сера | sulfur | S | эс |
| 17 | хлор | clorum | Cl | хлор |
| 18 | аргон | argon | Ar | аргон |
| 4 период химических элементов | ||||
| 19 | калий | kalium | K | калий |
| 20 | кальций | calcium | Ca | кальций |
| 21 | скандий | scandium | Sc | скандий |
| 22 | титан | titanium | Ti | титан |
| 23 | ванадий | vanadium | V | ванадий |
| 24 | хром | chromium | Cr | хром |
| 25 | марганец | manganum | Mn | марганец |
| 26 | железо | ferrum | Fe | феррум |
| 27 | кобальт | cobaltum | Co | кобальт |
| 28 | никель | niccolum | Ni | никель |
| 29 | медь | cuprum | Cu | купрум |
| 30 | цинк | zincum | Zn | цинк |
| 31 | галий | gallium | Ga | галий |
| 32 | германий | germanium | Ge | германий |
| 33 | мышьяк | arsenicum | As | арсеникум |
| 34 | селен | selenium | Se | селен |
| 35 | бром | bromum | Br | бром |
| 36 | криптон | krypton | Kr | криптон |
| 5 период химических элементов | ||||
| 37 | рубидий | rubidium | Rb | рубидий |
| 38 | стронций | strontium | Sr | стронций |
| 39 | иттрий | yttrium | Y | иттрий |
| 40 | цирконий | zirconium | Zr | цирконий |
| 41 | ниобий | niobium | Nb | ниобий |
| 42 | молибден | molybdaenum | Mo | молибден |
| 43 | технеций | technetium | Tc | технеций |
| 44 | рутений | ruthenium | Ru | рутений |
| 45 | родий | rhodium | Rh | родий |
| 46 | палладий | palladium | Pd | палладий |
| 47 | серебро | argentum | Ag | аргентум |
| 48 | кадмий | cadmium | Cd | кадмий |
| 49 | индий | indium | In | индий |
| 50 | олово | stannum | Sn | станум |
| 51 | сурьма | stibium | Sb | стибиум |
| 52 | теллур | tellurium | Te | теллур |
| 53 | йод | iodum | I | йод |
| 54 | ксенон | xenon | Xe | ксенон |
| 6 период химических элементов | ||||
| 55 | цезий | ceslum | Cs | цезий |
| 56 | барий | barlum | Ba | барий |
| 57 | лантан | lanthanum | La | лантан |
| 58 | церий | cerium | Ce | церий |
| 59 | празеодим | praseodymium | Pr | празеодим |
| 60 | неодим | neodymium | Nd | неодим |
| 61 | прометий | promethium | Pm | прометий |
| 62 | самарий | samarium | Sm | самарий |
| 63 | европий | europium | Eu | эвропий |
| 64 | гадолиний | gadolinium | Gd | гадолиний |
| 65 | тербий | terbium | Tb | тербий |
| 66 | диспрозий | dysprosium | Dy | диспрозий |
| 67 | гольмий | holmium | Ho | гольмий |
| 68 | эрбий | erbium | Er | эрбий |
| 69 | тулий | thulium | Tm | тулий |
| 70 | иттербий | ytterbium | Yb | иттербий |
| 71 | лютеций | lutetium | Lu | лютеций |
| 72 | гафний | hafnium | Hf | гафний |
| 73 | тантал | tantalum | Ta | тантал |
| 74 | вольфрам | wolframium | W | вольфрам |
| 75 | рений | rhenium | Re | рений |
| 76 | осмий | osmium | Os | осмий |
| 77 | иридий | iridium | Ir | иридий |
| 78 | платина | platinum | Pt | платины |
| 79 | золото | aurum | Au | аурум |
| 80 | ртуть | hydrargyrum | Hg | гидраргирум |
| 81 | таллий | thallium | Tl | таллий |
| 82 | свинец | plumbum | Pb | плюмбум |
| 83 | висмут | bismuthum | Bi | висмут |
| 84 | полоний | polonium | Po | полоний |
| 85 | астат | astatium | At | астата |
| 86 | радон | radon | Rn | радон |
| 7 период химических элементов | ||||
| 87 | франций | francium | Fr | франций |
| 88 | радий | radium | Ra | радий |
| 89 | актиний | actinium | Ac | актиний |
| 90 | торий | thorium | Th | торий |
| 91 | протактиний | protactinium | Pa | протактиний |
| 92 | урана | uranium | U | уран |
| 93 | нептуний | neptunium | Np | нептуний |
| 94 | плутоний | plutonium | Pu | плутоний |
| 95 | америций | americium | Am | америций |
| 96 | кюрий | curium | Cm | кюрий |
| 97 | берклий | berkelium | Bk | берклий |
| 98 | калифорний | californium | Cf | калифорний |
| 99 | эйнштейний | einsteinium | Es | эйнштейний |
| 100 | фермий | fermium | Fm | фермий |
| 101 | менделеевий | mendelevium | Md | менделеевий |
| 102 | нобелий | nobelium | No | нобелий |
| 103 | лоуренсий | lawrencium | Lr | лоуренсий |
| 104 | резерфордий | rutherfordium | Rf | резерфордий |
| 105 | дубний | dubnium | Db | дубний |
| 106 | сиборгий | seaborgium | Sg | сиборгий |
| 107 | борий | bohrium | Bh | борий |
| 108 | хассий | hassium | Hs | хассий |
| 109 | мейтнерий | meitnerium | Mt | мейтнерий |
| 110 | Дармштадтий (Унуннилий) | Darmstadtium (Ununnilium) | Ds (Uun) | дармштадий |
| 111 | Рентгений (Унунуний) | Roentgenium (Unununium) | Rg (Uuu) | рентгений |
| 112 | Коперниций (Унунбий) | Copernicium (Ununbium) | Cn (Uub) | коперниций |
| 113 | Нихоний (Унунтрий) | Nihonium (Ununtrium) | Nt (Unt) | нихоний |
| 114 | Флеровий (Унунквадий) | Flerovium (Ununquadium) | Fl (Uuq) | флеровий |
| 115 | Московий (Унунпентий) | Moscovium (Ununpentium) | Mc (Uup) | московий |
| 116 | Ливерморий (Унунгексий) | Livermorium (Ununhexium) | Lv (Uuh) | ливерморий |
| 117 | Теннессин (Унунсептий) | Tennessine (Ununseptium) | Тc (Uus) | теннессин |
| 118 | Оганесон (Унуноктий) | Oganesson (Ununoctium) | Og (Uuo) | оганесон |
| 8 период химических элементов | ||||
| 119 | унуненний | ununnenium | Uue | |
| 120 | унбинилий | unbinilium | Ubn | |
| 121 | унбиуний | unbiunium | Ubu | |
| 122 | унбибий | unbibium | Ubb | |
| 123 | унбитрий | unbitrium | Ubt | |
| 124 | унбиквадий | unbiquadium | Ubq | |
| 125 | унбипентий | unbipentium | Ubp | |
| 126 | унбигексий | unbihexium | Ubh |
Как пользоваться таблицей Менделеева? Для непосвященного человека читать таблицу Менделеева – всё равно, что для гнома смотреть на древние руны эльфов. А таблица Менделеева может рассказать о мире очень многое.
Помимо того, что сослужит вам службу на экзамене, она еще и просто незаменима при решении огромного количества химических и физических задач. Но как ее читать? К счастью, сегодня этому искусству может научиться каждый. В этой статье расскажем, как понять таблицу Менделеева.
Периодическая система химических элементов (таблица Менделеева) – это классификация химических элементов, которая устанавливает зависимость различных свойств элементов от заряда атомного ядра.
История создания Таблицы
Дмитрий Иванович Менделеев был не простым химиком, если кто-то так думает. Это был химик, физик, геолог, метролог, эколог, экономист, нефтяник, воздухоплаватель, приборостроитель и педагог. За свою жизнь ученый успел провести фундаментально много исследований в самых разных областях знаний. Например, широко распространено мнение, что именно Менделеев вычислил идеальную крепость водки – 40 градусов.
Не знаем, как Менделеев относился к водке, но точно известно, что его диссертация на тему «Рассуждение о соединении спирта с водой» не имела к водке никакого отношения и рассматривала концентрации спирта от 70 градусов. При всех заслугах ученого, открытие периодического закона химических элементов – одного их фундаментальных законов природы, принесло ему самую широкую известность.
Существует легенда, согласно которой периодическая система приснилась ученому, после чего ему осталось лишь доработать явившуюся идею. Но, если бы все было так просто.. Данная версия о создании таблицы Менделеева, по-видимому, не более чем легенда. На вопрос о том, как была открыта таблица, сам Дмитрий Иванович отвечал: «Я над ней, может быть, двадцать лет думал, а вы думаете: сидел и вдруг… готово»
В середине девятнадцатого века попытки упорядочить известные химические элементы (известно было 63 элемента) параллельно предпринимались несколькими учеными. Например, в 1862 году Александр Эмиль Шанкуртуа разместил элементы вдоль винтовой линии и отметил циклическое повторение химических свойств.
Химик и музыкант Джон Александр Ньюлендс предложил свой вариант периодической таблицы в 1866 году. Интересен тот факт, что в расположении элементов ученый пытался обнаружить некую мистическую музыкальную гармонию. В числе прочих попыток была и попытка Менделеева, которая увенчалась успехом.
В 1869 году была опубликована первая схема таблицы, а день 1 марта 1869 года считается днем открытия периодического закона. Суть открытия Менделеева состояла в том, что свойства элементов с ростом атомной массы изменяются не монотонно, а периодически.
Первый вариант таблицы содержал всего 63 элемента, но Менделеев предпринял ряд очень нестандартных решений. Так, он догадался оставлять в таблице место для еще неоткрытых элементов, а также изменил атомные массы некоторых элементов. Принципиальная правильность закона, выведенного Менделеевым, подтвердилась очень скоро, после открытия галлия, скандия и германия, существование которых было предсказано ученым.
Современный вид таблицы Менделеева
Ниже приведем саму таблицу
Сегодня для упорядочения элементов вместо атомного веса (атомной массы) используется понятие атомного числа (числа протонов в ядре). В таблице содержится 120 элементов, которые расположены слева направо в порядке возрастания атомного числа (числа протонов)
Столбцы таблицы представляют собой так называемые группы, а строки – периоды. В таблице 18 групп и 8 периодов.
- Металлические свойства элементов при движении вдоль периода слева направо уменьшаются, а в обратном направлении – увеличиваются.
- Размеры атомов при перемещении слева направо вдоль периодов уменьшаются.
- При движении сверху вниз по группе увеличиваются восстановительные металлические свойства.
- Окислительные и неметаллические свойства при движении вдоль периода слева направо увеличиваются.
Что мы узнаем об элементе по таблице? Для примера, возьмем третий элемент в таблице – литий, и рассмотрим его подробно.
Первым делом мы видим сам символ элемента и его название под ним. В верхнем левом углу находится атомный номер элемента, в порядке которого элемент расположен в таблице. Атомный номер, как уже было сказано, равен числу протонов в ядре. Число положительных протонов, как правило, равно числу отрицательных электронов в атоме (за исключением изотопов).
Атомная масса указана под атомным числом (в данном варианте таблицы). Если округлить атомную массу до ближайшего целого, мы получим так называемое массовое число. Разность массового числа и атомного числа дает количество нейтронов в ядре. Так, число нейтронов в ядре гелия равно двум, а у лития – четырем.
Вот и закончился наш курс «Таблица Менделеева для чайников». В завершение, предлагаем вам посмотреть тематическое видео, и надеемся, что вопрос о том, как пользоваться периодической таблицей Менделеева, стал вам более понятен. Напоминаем, что изучать новый предмет всегда эффективнее не одному, а при помощи опытного наставника. Именно поэтому, никогда не стоит забывать о студенческом сервисе, который с радостью поделится с вами своими знаниями и опытом.
ТАБЛИЦА МЕНДЕЛЕЕВА — периодическая система химических элементов
Таблица Менделеева (периодическая система химических элементов) — это такая таблица, в которой классифицируются химические элементы по различным свойствам в зависимости от заряда их атомного ядра. Таблица является графическим изображением периодического закона, который открыл Дмитрий Иванович Менделеев в 1869 году. Изначальный вариант этой таблицы 1869 — 1871 гг. и устанавливал зависимость свойств элементов от их атомной массы. На данный момент элементы сводятся в двумерную таблицу, в которой каждый столбец — это группа, определяющая основные физико-химические свойства, а строки — это периоды, схожие друг с другом. Наиболее распространены 2 формы таблицы: короткая и длинная.
ТАБЛИЦА МЕНДЕЛЕЕВА

Порядковый номер элемента — это число равное числу протонов в ядре атома и числу электронов, которые вращаются вокруг него.
Чтобы посмотреть все свойства конкретного химического элемента нужно перейти по ссылке нажав на символ элемента в таблице.
| П. |
Группы химических элементов |
|||||||||
|
VIII |
||||||||||
| 1 |
1,00794 Водород |
4,0026 Гелий |
||||||||
| 2 |
6,941 Литий |
9,0122 Берилий |
10,811 Бор |
12,01115 Углерод |
14,0067 Азот |
15,9994 Кислород |
18,9984 Фтор |
20,179 Неон |
||
| 3 |
22,9898 Натрий |
24,305 Магний |
26,9815 Алюминий |
28,086 Кремний |
30,9738 Фосфор |
32,064 Сера |
35,454 Хлор |
39,948 Аргон |
||
| 4 |
39,0983 Калий |
40,08 Кальций |
44,956 Скандий |
47,88 Титан |
50,942 Ванадий |
51,996 Хром |
54,938 Марганец |
55,847 Железо |
58,9332 Кобальт |
58,69 Никель |
|
63,546 Медь |
65,39 Цинк |
69,72 Галлий |
72,61 Германий |
74,9216 Мышьяк |
78,96 Селен |
79,904 Бром |
83,80 Криптон |
|||
| 5 |
85,47 Рубидий |
87,62 Стронций |
88,906 Иттрий |
91,224 Цирконий |
92,906 Ниобий |
95,94 Молибден |
98,906 Технеций |
101,07 Рутений |
102,905 Родий |
106,42 Палладий |
|
107,868 Серебро |
112,41 Кадмий |
114,82 Индий |
118,71 Олово |
121,75 Сурьма |
127,60 Теллур |
126,9045 Йод |
131,30 Ксенон |
|||
| 6 |
132,905 Цезий |
137,327 Барий |
138,91 Лантан |
178,49 Гафний |
180,948 Тантал |
183,85 Вольфрам |
186,207 Рений |
190,2 Осмий |
192,22 Иридий |
195,09 Платина |
|
196,967 Золото |
200,59 Ртуть |
204,383 Таллий |
207,19 Свинец |
208,98 Висмут |
[209] Полоний |
[210] Астат |
[222] Радон |
|||
| 7 |
[223] Франций |
226,025 Радий |
[227] Актиний |
[261] Резерфордий |
[262] Дубний |
[263] Сиборгий |
[264] Борий |
[265] Хассий |
[266] Мейтнерий |
[281] Дармштадтий |
|
[281] Рентгений |
[285] Коперниций |
[284] Нихоний |
[289] Флеровий |
[288] Московий |
[293] Ливерморий |
[294] Теннесин |
[294] Оганесон |
|||
| 8 |
[316] Унуненний |
[320] Унбинилий |
||||||||
|
Высшие оксиды |
||||||||||
|
R2O |
RO |
R2O3 |
RO2 |
R2O5 |
RO3 |
R2O7 |
RO4 |
|||
|
Летучие водородные соединения |
||||||||||
|
RH4 |
RH3 |
H2R |
RH |
|
* ЛАНТАНОИДЫ |
|||||||||
|
114,16 Церий |
140,907 Празеодим |
144,24 Неодим |
[145] Прометий |
150,36 Самарий |
151,96 Европий |
157,25 Гадолиний |
158,924 Тербий |
162,5 Диспрозий |
164,93 Гольмий |
|
167,26 Эрбий |
168,94 Тулий |
173,04 Иттербий |
174,97 Лютеций |
||||||
|
** АКТИНОИДЫ |
|||||||||
|
232,038 Торий |
231,04 Протактиний |
238,03 Уран |
237,05 Нептуний |
[244] Плутоний |
[243] Америций |
[247] Кюрий |
[247] Берклий |
[251] Калифорний |
[254] Эйнштейний |
|
[257] Фермий |
[258] Менделевий |
[259] Нобелий |
260 Лоуренсий |
||||||
|
*** СУПЕРАКТИНОИДЫ |
|||||||||
|
320 Унбиуний |
* Унбибий |
* Унбитрий |
332 Унбиквадий |
* Унбипентий |
* Унбигексий |
||||
|
s – элементы |
p – элементы |
d – элементы |
f – элементы |
Периодическая система химических элементов Д.И. Менделеева
Расшифровка периодической системы химических элементов Д.И. Менделеева:
Периоды – горизонтальные строки химических элементов.
Группы – вертикальные столбцы химических элементов.
Подгруппы – А — главные (s- и р-элементы) и В — побочные (d- и f-элементы).
Номер периода – номер внешнего энергетического уровня в электронной формуле атома элемента.
Номер группы (для большинства элементов) – общее число валентных электронов (электронов внешнего энергетического уровня, а также предпоследнего d-подуровня, если он застроен не полностью).
Число элементов в периоде – максимальная емкость соответствующего энергетического уровня:
|
1 период |
2 элемента (1s2) |
5 период |
18 элементов (5s24d105p6) |
|
2 период |
8 элементов (2s22p6) |
6 период |
32 элемента (6s24f145d106p6) |
|
3 период |
8 элементов (3s23p6) |
7 период |
32 элемента (6s24f145d106p6) |
|
4 период |
18 элементов (4s23d104p6) |
8 период |
не завершен |
Построение периодов – в начале: два s-элемента, в конце: шесть р- элементов. В четвертом и пятом периодах между ними помещается по десять d-элементов, а в шестом и седьмом к ним добавляются четырнадцать f-элементов (формы электронных орбиталей).
В периоде – свойства химических элементов различаются между собой, т.к. электронные конфигурации валентных электронов их атомов различны.
В подгруппе – свойства элементов сходны между собой, т.к. электронные конфигурации валентных электронов их атомов сходны.
Причина периодичности свойств химических элементов заключается в периодической повторяемости сходных электронных конфигураций внешних энергетических уровней.
Формы электронных орбиталей (электронные семейства)
Классификация химических элементов по электронным конфигурациям их атомов (электронные орбитали)
|
Название семейства |
Тип конфигурации |
Застраиваемые подуровни |
|
s — элементы |
ns1–2 |
внешний (n) s-подуровень |
|
p -элементы |
ns2 np1–6 |
внешний (n) р-подуровень |
|
d — элементы |
(n-1)d1–10 ns1–2 |
предвнешний (n–1 ) d-подуровень |
|
f — элементы |
(n-2)f1–14 (n-1)d1–10 ns1–2 |
третий снаружи (n–2) f-подуровень |
Графическое изображение орбиталей
Свойства элементов таблицы Менделеева
Металлы – элементы главных подгрупп с числом валентных электронов от 1 до 3 (подгруппы IA, IIA, IIIА, кроме элемента бора), а также германий, олово, свинец, сурьма, висмут и полоний.
Неметаллы – бор и элементы главных подгрупп с числом валентных электронов от 4 до 7 (подгруппы IVA, VA, VIA, VIIA) кроме германия, олова, свинца, сурьмы, висмута и полония.
Переходные элементы – элементы побочных подгрупп (IB-VIIB); в виде простых веществ ведут себя как металлы.
Благородные газы – элементы подгруппы VIIIA, полностью застроенные энергетические подуровни s2p6, для гелия s2.
Галогены – элементы подгруппы VII(a) таблицы Менделеева, реагируют со всеми простыми веществами, кроме некот. неметаллов, являются энергичными окислителями, к ним относят F, Cl, Br, I, At, Ts.
Лантанойды – 15 элементов III группы 6-го периода, металлы с атомными номерами 57–71. Все они имеют стабильные изотопы, кроме прометия.
Актинойды – 15 радиоактивных элементов III группы 7-го периода с атомными номерами 89–103.
Свойства элементов в подгруппах закономерно изменяются сверху вниз:
— металлические свойства усиливаются и неметаллические свойства ослабевают;
— атомный радиус увеличивается;
— возрастает сила образованных элементом оснований и бескислородных кислот;
— уменьшается электроотрицательность.
В периодах с увеличением порядкового номера элемента прослеживается следующая закономерность:
— увеличивается электроотрицательность;
— металлические свойства ослабевают, неметаллические усиливаются;
— уменьшается атомный радиус.
Все элементы таблицы Менделеева, исключая гелий, неон и аргон, образуют кислородные соединения, которые изображены общими формулами под каждой группой в порядке возрастания степени окисления элементов: R2O, RO, R2O3, RO2, R2O5, RO3, R2O7, RO4, где R — обозначает элемент группы.
Элементы главных подгрупп, начиная с IV группы, образуют газообразные водородные соединения: RH4, RH3, RH2, RH. Соединения RH4 имеют нейтральный характер; RH3 – слабоосновной; RH2 – слабокислый; RH – сильнокислый характер.
История открытия периодического закона Менделеевым Д.И.
Самый важный вклад в систематизацию химических элементов внёс русский выдающийся химик Дмитрий Иванович Менделеев, автор труда «Основы химии», который в марте 1869 года представил Русскому химическому обществу (РХО) периодический закон химических элементов, изложенный в нескольких основных положениях.
В 1871 году Менделеев в итоговой статье «Периодическая законность химических элементов» дал формулировку Периодического закона: «Свойства элементов, а потому и свойства образуемых ими простых и сложных тел стоят в периодической зависимости от атомного веса». Тогда же Менделеев придал своей периодической таблице классический вид (короткая таблица, смотрите ниже).
В современном изложении периодический закон химических элементов звучит так: «Свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от заряда ядра атомов элементов (порядкового номера).»
Периодическая таблица элементов Менделеева длинная форма
Длинная форма таблицы Менделеева (или длиннопериодная форма) состоит из 18 групп с лева на право от щелочных металов до благородных газов. считается официальной версией с 1989 года.
Таблица Менделеева для печати в хорошем качестве скачать
Вы можете скачать таблицу Менделеева на выбор короткую или длинную форму в цветном и черно-белом цвете, для этого откройте по ссылке ниже изображение и сохраните его себе на компьютер.
1) Таблица Менделеева для печати в хорошем качестве цветная (короткая форма)
2) Таблица Менделеева для печати в хорошем качестве черно-белая (короткая форма)
3) Таблица Менделеева для печати в хорошем качестве цветная (длинная форма)
4) Таблица Менделеева для печати в хорошем качестве черно-белая (длинная форма)
____________
Источник информации:
1. Большой химический справочник / А.И.Волков, — М.: 2005.
2. Большая энциклопедия химических элементов. Периодическая таблица Менделеева / И.А.Леенсон. — Москва : 2014.
3. По материалам сайта ru.wikipedia.org
Строение веществ и их переходы из одного состояния в другое изучает химия. В первую очередь для успешного понимания науки нужно выучить названия и произношение химических элементов. Существует общепринятая система классификации. Её первоначальный вариант разработал русский учёный Дмитрий Иванович Менделеев, назвав свой свод периодической таблицей. Всего же на начало 2019-го года известно 118 элементов.
Оглавление:
- Классификация химических веществ
- Правильное произношение
- Названия популярных элементов
- Чтение формул и символов
Классификация химических веществ
Вещество состоит из различных частиц. В его состав входят электроны, нейтроны и протоны. Взаимосвязи элементарных зарядов образуют атомы. В свою очередь, из них формируются молекулы и кристаллы. Из-за особенностей строения кристаллической решётки — основы вещества — тела могут находиться в твёрдом, жидком или газообразном состоянии. При этом они могут переходить из одной фазы в другую.
Каждому состоянию тела присущ набор свойств. Это характеристики, определяющие индивидуальность вещества, позволяя их отличать друг от друга.
Из наиболее интересных можно отметить: температуру плавления и кипения, строение кристаллической решётки, плотность, термодинамические и фазовые характеристики.
Вещества могут не только изменять свои агрегатные состояния, но и взаимодействовать между собой, образовывая новые соединения. Впервые классифицировать тела попробовал Д. И. Менделеев.
Его периодическая таблица, составленная им с 1869 года по 1871 год, строилась на отличии атомного веса (массы). В современном варианте его система видоизменилась. Так было выполнено сведение веществ в двумерную таблицу, в которой столбцы определяют главные физико-химические свойства, а строки являются периодами, в определённой мере подобными друг другу.
Каждый элемент, внесённый в таблицу, имеет свою историю открытия. Учёные, исследуя то или иное вещество, выделяли в нём индивидуальные особенности, что позволяло им давать названия, ассоциирующиеся с какими-то либо личными убеждениями и сравнениями.
Но перед этим в учёном мире были приняты важные термины:
- Элемент — слово произошло от латинского elementum, обозначающего какую-либо часть. Ученые античного времени говорили: «Как слова состоят из букв, так и тела — из элементов». Слово образовано из отрицательной приставки «а» и «томе» — рассечение.
- Атом — в переводе с греческого языка слово обозначает целое (неделимое).
- Молекула — термин происходит от латинского moles. На русский язык это слово можно перевести как «массив», «глыба».
Как видно из названия, химические совокупности ассоциируются с их свойствами. По этому же принципу давались названия и открытым веществам. Так как исследованиями занимались в основном Европейские учёные, то их названия записывались на латыни.
При этом у подавляющего числа элементов, звучащих на русском, они фонетически близки к латинским.
Правильное произношение
В таблице Менделеева все вещества написаны на латыни. Часто вместе с сокращённым названием указывается полное. Например, Ar — argon, Ba — barium, Au — aurum. Но для русскоязычного населения полное наименование пишут на русском. Так, Ar — аргон, Ba — барий, Au — аурум.
Произношение их что на латыни, что на русском языке одинаково. Единственное — присутствует акцент. Но существуют элементы, которые имеют двойное название. То есть, их можно произносить так же, как они и пишутся, или совсем по-другому. К таким веществам относятся:
- Золото — обозначается знаком Au и читается аурум. Слово в переводе с иностранного обозначает «жёлтое».
- Серебро — символизируется символом Ar, может произноситься как «аргентум». Слово имеет индоевропейское происхождение. Arg — обозначает светлый.
- Железо — подписывают знаком Fe, а читают как феррум. С латинского ferrum происходит от fars, что обозначает «крепкий».
- Сера — правильное название sulfur (сульфур). Обозначают её символом S. Интересно, что в древнерусском и старославянском под серой понимали любое горючее вещество, например, жир.
- Свинец — произносится как плюмбум (plumbum). Причина названия элемента доподлинно неизвестна. Сокращённое обозначение элемента — Pb.
- Олово — химический символ Sn. Элемент четырнадцатой группы пишется на латыни как stannum. Произносится также — «станниум». Происхождение записи связывают с санскритским словом, обозначающим прочность.
- Углерод — элемент, обозначающийся знаком C. Латинское название carboneum произносится как «карбон». Слово имеет в названии корень carbō обозначающий «уголь».
- Ртуть — с латинского звучит как «гидраргиум». Hydrargirum произошло от слияния слов «хюдор» — вода и «аргирос» — серебро.
- Медь — международное обозначение Сu. Пишется как cuprum, а произносится «купрум». Считается, что элемент получил название в честь острова Кипр, где находилось много рудников.
- Азот — пишется в зарубежной литературе как nitrogenium. За обозначение принят символ N. На русском языке произносится как «нитрогениум». Слово происходит от древнегреческого ἄζωτоς — «безжизненный».
Названия популярных элементов
В классической периодической таблице указано 118 элементов.
Расположены они по атомным номерам. Но вместе с этим существует и расширенный свод. Он является логическим продолжением труда русского химика и включает возможные, ещё не выявленные вещества. С учётом расширенной таблицы всего предполагается существование 218 веществ. Вот самые распространённые химические элементы таблицы Менделеева с произношением:
| Азо́т | эн | N | Nitrogenium |
| Алюми́ний | алюми́ний | Al | Aluminium |
| Ба́рий | Barium | Ba | ба́рий |
| Бери́ллий | Beryllium | Be | бери́ллий |
| Бор | Borum | B | бор |
| Бром | Bromium | Br | бром |
| Вана́дий | Vanadium | V | вана́дий |
| Ви́смут | Bismuthum | Bi | ви́смут |
| Водород | Hydrogenium | H | аш |
| Вольфра́м | Wolframium | W | вольфра́м |
| Ге́лий | Helium | He | ге́лий |
| Герма́ний | Germanium | Ge | герма́ний |
| Желе́зо | Ferrum | Fe | фе́ррум |
| Зо́лото | Aurum | Au | а́урум |
| Индий | Indium | In | и́ндий |
| Йод | Iodium | I | йод |
| Ири́дий | Iridium | Ir | ири́дий |
| Ка́дмий | Cadmium | Cd | ка́дмий |
| Ка́лий | Kalium | K | ка́лий |
| Ка́льций | Calcium | Ca | ка́льций |
| Кислоро́д | Oxygenium | O | о |
| Ко́бальт | Cobaltum | Co | ко́бальт |
| Кре́мний | Silicium | Si | сили́циум |
| Крипто́н | Krypton | Kr | крипто́н |
| Ксено́н | Xenon | Xe | ксено́н |
| Литий | Lithium | Li | ли́тий |
| Ма́гний | Magnesium | Mg | ма́гний |
| Ма́рганец | Manganum | Mn | ма́рганец |
| Медь | Cuprum | Cu | ку́прум |
| Молибде́н | Molybdaenum | Mo | молибде́н |
| Мышьяк | Arsenicum | As | арсе́никум |
| На́трий | Natrium | Na | на́трий |
| Неоди́м | Neodymium | Nd | неоди́м |
| Нео́н | Neon | Ne | нео́н |
| Ни́кель | Niccolum | Ni | ни́кель |
| Олово | Stannum | Sn | ста́ннум |
| Осмий | Osmium | Os | о́смий |
| Палла́дий | Palladium | Pd | палла́дий |
| Платина | Platinum | Pt | пла́тина |
| Плуто́ний | Plutonium | Pu | плуто́ний |
| Ра́дий | Radium | Ra | ра́дий |
| Радо́н | Radon | Rn | радо́н |
| Резерфо́рдий | Rutherfordium | Rf | резерфо́рдий |
| Ре́ний | Rhenium | Re | ре́ний |
| Ртуть | Hydrargyrum | Hg | гидра́ргирум |
| Руби́дий | Rubidium | Rb | руби́дий |
| Свине́ц | Plumbum | Pb | плю́мбум |
| Селе́н | Selenium | Se | селе́н |
| Се́ра | Sulfur | S | эс |
| Серебро́ | Argentum | Ag | арге́нтум |
| Стро́нций | Strontium | Sr | стро́нций |
| Сурьма́ | Stibium | Sb | сти́биум |
| Танта́л | Tantalum | Ta | танта́л |
| Тита́н | Titanium | Ti | тита́н |
| То́рий | Thorium | Th | то́рий |
| Углеро́д | Carboneum | C | цэ |
| Ура́н | Uranium | U | ура́н |
| Фо́сфор | Phosphorus | P | пэ |
| Фтор | Fluorum | F | фтор |
| Хлор | Chlorum | Cl | хлор |
| Хром | Chromium | Cr | хром |
| Це́зий | Caesium | Cs | це́зий |
| Цинк | Zincum | Zn | цинк |
| Цирко́ний | Zirconium | Zr | цирко́ний |
Следует отметить, что знаковое обозначение элементов принято Международным союзом теоретической и прикладной химии. Его членами являются академии наук, химические общества, и научные организации 57 стран мира.
В качестве аббревиатуры комитета используется ИЮПАК. Именно его члены занимаются стандартизацией в области химии.
Чтение формул и символов
Цифра, стоящая перед веществом, обозначает количество молекул. Элемент же записывают буквенными символами. В устной речи придерживаются правила, при котором называют последовательно, начиная справа, все знаки.
Например, H2O — формула воды, её читают как «аш два о», NaCl (хлорид натрия) — «натрий хлор». Чтобы правильно произносить химические соединения, необходимо знать, как звучат символы элементов. Не стоит забывать и то, что индекс, относящийся к скобкам (группе атомов), произносят с суффиксом -жды. Например: дважды, трижды, четырежды.
Таким образом, несмотря на то, что существуют русские и латинские обозначения каждого химического элемента, в химических формулах используется только стандартное правило. При произношении соединения употребляют латинские названия. При этом часто они соответствуют русским, особенно если в имени элемента используется более одной буквы. Если же в названии стоит один символ, то латинскому имении соответствует название этой буквы.
То есть, например, гелий, так и произносится в формулах. Но если встречаются сокращённые буквы латиницы, то нужно произносить элемент полностью, как он и называется, например, Si — сицилициум и так далее. Вот некоторые названия редких элементов:
- Сm — кюрий.
- Сf — калифорний.
- Fm — фермий.
- No — нобелий.
- Lr — лоуренций.
- Hs — хассий.
- Po — полоний.
- Pa — проктаний.
- Gd — гадолиний.
- Er — эрбий.
Интересно и то, что последние элементы, которые добавляют в таблицу Менделеева являются синтезированными. Так, 115 был получен в Дубне. Назвали его moscovium (Mc), произносится на русском — «московий». Элемент 117 назвали tennessine (TS). Имя ему было дано в честь штата Теннесси.
В честь Юрия Цолаковича Оганесяна было решено назвать 118 элемент. Пишется он как oganesson (Og), читается — «оганесон». Это пока последний элемент, добавленный в таблицу.