For the leavening agent of which baking soda is a common ingredient, see Baking powder.

|
||
|
||
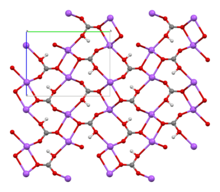
Crystal structure |
||
|
||
| Names | ||
|---|---|---|
| IUPAC name
sodium hydrogencarbonate |
||
| Other names
Baking soda, bicarb (laboratory slang), bicarbonate of soda, nahcolite, natrium hydrogen carbonate, natron |
||
| Identifiers | ||
|
CAS Number |
|
|
|
3D model (JSmol) |
|
|
|
Beilstein Reference |
4153970 | |
| ChEBI |
|
|
| ChEMBL |
|
|
| ChemSpider |
|
|
| DrugBank |
|
|
| ECHA InfoCard | 100.005.122 |
|
| EC Number |
|
|
| E number | E500(ii) (acidity regulators, …) | |
|
IUPHAR/BPS |
|
|
| KEGG |
|
|
| MeSH | Sodium+bicarbonate | |
|
PubChem CID |
|
|
| RTECS number |
|
|
| UNII |
|
|
|
CompTox Dashboard (EPA) |
|
|
|
InChI
|
||
|
SMILES
|
||
| Properties | ||
|
Chemical formula |
NaHCO 3 |
|
| Molar mass | 84.0066 g mol−1 | |
| Appearance | White crystals | |
| Odor | Odorless | |
| Density |
|
|
| Melting point | (Decomposes to sodium carbonate starting at 50 °C[1][6]) | |
|
Solubility in water |
|
|
| Solubility | 0.02 wt% acetone, 2.13 wt% methanol @22 °C.[4] insoluble in ethanol | |
| log P | −0.82 | |
| Acidity (pKa) |
|
|
|
Refractive index (nD) |
nα = 1.377 nβ = 1.501 nγ = 1.583 | |
| Structure | ||
|
Crystal structure |
Monoclinic | |
| Thermochemistry | ||
|
Heat capacity (C) |
87.6 J/mol K[7] | |
|
Std molar |
101.7 J/mol K[7] | |
|
Std enthalpy of |
−950.8 kJ/mol[7] | |
|
Gibbs free energy (ΔfG⦵) |
−851.0 kJ/mol[7] | |
| Pharmacology | ||
|
ATC code |
B05CB04 (WHO) B05XA02 (WHO), QG04BQ01 (WHO) | |
|
Routes of |
Intravenous, oral | |
| Hazards | ||
| Occupational safety and health (OHS/OSH): | ||
|
Main hazards |
Causes serious eye irritation | |
| NFPA 704 (fire diamond) |
2 0 1 |
|
| Flash point | Incombustible | |
| Lethal dose or concentration (LD, LC): | ||
|
LD50 (median dose) |
4220 mg/kg (rat, oral)[8] | |
| Safety data sheet (SDS) | External MSDS | |
| Related compounds | ||
|
Other anions |
Sodium carbonate | |
|
Other cations |
|
|
|
Related compounds |
|
|
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Cupcakes baked with baking soda as a raising agent
Sodium bicarbonate (IUPAC name: sodium hydrogencarbonate[9]), commonly known as baking soda or bicarbonate of soda, is a chemical compound with the formula NaHCO3. It is a salt composed of a sodium cation (Na+) and a bicarbonate anion (HCO3−). Sodium bicarbonate is a white solid that is crystalline, but often appears as a fine powder. It has a slightly salty, alkaline taste resembling that of washing soda (sodium carbonate). The natural mineral form is nahcolite. It is a component of the mineral natron and is found dissolved in many mineral springs.[10]
Nomenclature[edit]
Because it has long been known and widely used, the salt has many different names such as baking soda, bread soda, cooking soda, and bicarbonate of soda and can often be found near baking powder in stores. The term baking soda is more common in the United States, while bicarbonate of soda is more common in Australia, United Kingdom and Ireland.[11] and in many northern/central European countries it is called Natron. Abbreviated colloquial forms such as sodium bicarb, bicarb soda, bicarbonate, and bicarb are common.[12]
The word saleratus, from Latin sal æratus (meaning «aerated salt»), was widely used in the 19th century for both sodium bicarbonate and potassium bicarbonate.[13]
Its E number food additive code is E500.[14]
The prefix bi in bicarbonate comes from an outdated naming system predating molecular knowledge in reference to the two molar equivalents of carbon dioxide (known as carbonic acid in the ancient chemistry language) that potassium hydrocarbonate/bicarbonate releases upon decomposition to (di)potassium carbonate and to potassium oxide (potash).[15] The modern chemical formulas of these compounds now express their precise chemical compositions which were unknown when the name bi-carbonate of potash was coined (see also: bicarbonate).
Uses[edit]
Cooking[edit]
Leavening[edit]
In cooking, baking soda is primarily used in baking as a leavening agent. When it reacts with acid, carbon dioxide is released, which causes expansion of the batter and forms the characteristic texture and grain in cakes, quick breads, soda bread, and other baked and fried foods. The acid–base reaction can be generically represented as follows:[16]
- NaHCO3 + H+ → Na+ + CO2 + H2O
Acidic materials that induce this reaction include hydrogen phosphates, cream of tartar, lemon juice, yogurt, buttermilk, cocoa, and vinegar. Baking soda may be used together with sourdough, which is acidic, making a lighter product with a less acidic taste.[17]
Heat can also by itself cause sodium bicarbonate to act as a raising agent in baking because of thermal decomposition, releasing carbon dioxide at temperatures above 80 °C (180 °F), as follows:[18]
- 2 NaHCO3 → Na2CO3 + H2O + CO2
When used this way on its own, without the presence of an acidic component (whether in the batter or by the use of a baking powder containing acid), only half the available CO2 is released (one CO2 molecule is formed for every two equivalents of NaHCO3). Additionally, in the absence of acid, thermal decomposition of sodium bicarbonate also produces sodium carbonate, which is strongly alkaline and gives the baked product a bitter, «soapy» taste and a yellow color. Since the reaction occurs slowly at room temperature, mixtures (cake batter, etc.) can be allowed to stand without rising until they are heated in the oven.[citation needed]
Baking powder[edit]
Baking powder, also sold for cooking, contains around 30% of bicarbonate, and various acidic ingredients which are activated by the addition of water, without the need for additional acids in the cooking medium.[19][20][21] Many forms of baking powder contain sodium bicarbonate combined with calcium acid phosphate, sodium aluminium phosphate, or cream of tartar.[22] Baking soda is alkaline; the acid used in baking powder avoids a metallic taste when the chemical change during baking creates sodium carbonate.[23]
Pyrotechnics[edit]
Sodium bicarbonate is one of the main components of the common «black snake» firework. The effect is caused by the thermal decomposition, which produces carbon dioxide gas to produce a long snake-like ash as a combustion product of the other main component, sucrose.[24] Sodium bicarbonate is also used to delay combustion reactions by releasing CO2 and H2O when heated, both of which are flame retardants.
Mild disinfectant[edit]
It has weak disinfectant properties,[25][26] and it may be an effective fungicide against some organisms.[27] Because baking soda will absorb musty smells, it has become a reliable method for used book sellers when making books less malodorous.[28]
Fire extinguisher[edit]
Sodium bicarbonate can be used to extinguish small grease or electrical fires by being thrown over the fire, as heating of sodium bicarbonate releases carbon dioxide.[29] However, it should not be applied to fires in deep fryers; the sudden release of gas may cause the grease to splatter.[29] Sodium bicarbonate is used in BC dry chemical fire extinguishers as an alternative to the more corrosive monoammonium phosphate in ABC extinguishers. The alkaline nature of sodium bicarbonate makes it the only dry chemical agent, besides Purple-K, that was used in large-scale fire suppression systems installed in commercial kitchens. Because it can act as an alkali, the agent has a mild saponification effect on hot grease, which forms a smothering, soapy foam.[citation needed]
Neutralization of acids[edit]
Sodium bicarbonate reacts spontaneously with acids, releasing CO2 gas as a reaction product. It is commonly used to neutralize unwanted acid solutions or acid spills in chemical laboratories.[30] It is not appropriate to use sodium bicarbonate to neutralize base[31] even though it is amphoteric, reacting with both acids and bases.[citation needed]
Agriculture[edit]
Sodium bicarbonate when applied on leaves, can prevent the growth of fungi; however, it does not kill the fungus. Excessive amount of sodium bicarbonate can cause discolouration of fruits (two percent solution) and chlorosis (one percent solution).[32]
Medical uses and health[edit]
Sodium bicarbonate mixed with water can be used as an antacid to treat acid indigestion and heartburn.[33] Its reaction with stomach acid produces salt, water, and carbon dioxide:
- NaHCO3 + HCl → NaCl + H2O + CO2(g)
A mixture of sodium bicarbonate and polyethylene glycol such as PegLyte,[34] dissolved in water and taken orally, is an effective gastrointestinal lavage preparation and laxative prior to gastrointestinal surgery, gastroscopy, etc.[citation needed]
Intravenous sodium bicarbonate in an aqueous solution is sometimes used for cases of acidosis, or when insufficient sodium or bicarbonate ions are in the blood.[35] In cases of respiratory acidosis, the infused bicarbonate ion drives the carbonic acid/bicarbonate buffer of plasma to the left, and thus raises the pH. For this reason, sodium bicarbonate is used in medically supervised cardiopulmonary resuscitation. Infusion of bicarbonate is indicated only when the blood pH is markedly low (< 7.1–7.0).[36]
HCO3− is used for treatment of hyperkalemia, as it will drive K+ back into cells during periods of acidosis.[37] Since sodium bicarbonate can cause alkalosis, it is sometimes used to treat aspirin overdoses. Aspirin requires an acidic environment for proper absorption, and a basic environment will diminish aspirin absorption in cases of overdose.[38] Sodium bicarbonate has also been used in the treatment of tricyclic antidepressant overdose.[39] It can also be applied topically as a paste, with three parts baking soda to one part water, to relieve some kinds of insect bites and stings (as well as accompanying swelling).[40]
Some alternative practitioners, such as Tullio Simoncini, have promoted baking soda as a cancer cure, which the American Cancer Society has warned against due to both its unproven effectiveness and potential danger in use.[41] Edzard Ernst has called the promotion of sodium bicarbonate as a cancer cure «one of the more sickening alternative cancer scams I have seen for a long time».[42]
Sodium bicarbonate can be added to local anesthetics, to speed up the onset of their effects and make their injection less painful.[43] It is also a component of Moffett’s solution, used in nasal surgery.[citation needed]
It has been proposed that acidic diets weaken bones.[44] One systematic meta-analysis of the research shows no such effect.[45] Another also finds that there is no evidence that alkaline diets improve bone health, but suggests that there «may be some value» to alkaline diets for other reasons.[46]
Antacid (such as baking soda) solutions have been prepared and used by protesters to alleviate the effects of exposure to tear gas during protests.[failed verification][47]
Similarly to its use in baking, sodium bicarbonate is used together with a mild acid such as tartaric acid as the excipient in effervescent tablets: when such a tablet is dropped in a glass of water, the carbonate leaves the reaction medium as carbon dioxide gas (HCO3− + H+ → H2O + CO2↑ or, more precisely, HCO3− + H3O+ → 2 H2O + CO2↑). This makes the tablet disintegrate, leaving the medication suspended and/or dissolved in the water together with the resulting salt (in this example, sodium tartrate).[48]
Personal hygiene[edit]
Sodium bicarbonate is also used as an ingredient in some mouthwashes. It has anticaries and abrasive properties.[49] It works as a mechanical cleanser on the teeth and gums, neutralizes the production of acid in the mouth, and also acts as an antiseptic to help prevent infections.[50][51] Sodium bicarbonate in combination with other ingredients can be used to make a dry or wet deodorant.[52][53] Sodium bicarbonate may be used as a buffering agent, combined with table salt, when creating a solution for nasal irrigation.[54]
It is used in eye hygiene to treat blepharitis. This is done by addition of a teaspoon of sodium bicarbonate to cool water that was recently boiled, followed by gentle scrubbing of the eyelash base with a cotton swab dipped in the solution.[55][56]
Veterinary uses[edit]
Sodium bicarbonate is used as a cattle feed supplement, in particular as a buffering agent for the rumen.[57]
Cleaning agent[edit]
Sodium bicarbonate is used in a process for removing paint and corrosion called sodablasting. As a blasting medium, sodium bicarbonate is used to remove surface contamination from softer and less resilient substrates such as aluminium, copper or timber which could be damaged by silica sand abrasive media.[58]
A manufacturer recommends a paste made from baking soda with minimal water as a gentle scouring powder,[29] and is useful in removing surface rust, as the rust forms a water-soluble compound when in a concentrated alkaline solution;[59] cold water should be used, as hot-water solutions can corrode steel.[60] Sodium bicarbonate attacks the thin protective oxide layer that forms on aluminium, making it unsuitable for cleaning this metal.[61] A solution in warm water will remove the tarnish from silver when the silver is in contact with a piece of aluminium foil.[61][62] Baking soda is commonly added to washing machines as a replacement for water softener and to remove odors from clothes. It is also almost as effective in removing heavy tea and coffee stains from cups as Sodium hydroxide, when diluted with warm water.
During the Manhattan Project to develop the nuclear bomb in the early 1940s, the chemical toxicity of uranium was an issue. Uranium oxides were found to stick very well to cotton cloth, and did not wash out with soap or laundry detergent. However, the uranium would wash out with a 2% solution of sodium bicarbonate. Clothing can become contaminated with toxic dust of depleted uranium (DU), which is very dense, hence used for counterweights in a civilian context, and in armour-piercing projectiles. DU is not removed by normal laundering; washing with about 6 ounces (170 g) of baking soda in 2 gallons (7.5 L) of water will help to wash it out.[63]
Odor control[edit]
It is often claimed that baking soda is an effective odor remover,[64][better source needed] and it is often recommended that an open box be kept in the refrigerator to absorb odor.[65] This idea was promoted by the leading U.S. brand of baking soda, Arm & Hammer, in an advertising campaign starting in 1972.[66] Though this campaign is considered a classic of marketing, leading within a year to more than half of American refrigerators containing a box of baking soda,[67][68] there is little evidence that it is in fact effective in this application.[69][70]
Hydrogen gas production[edit]
Sodium bicarbonate can be used as a catalyst in gas production. Its performance for this application is «good», however not usually used.[citation needed] Hydrogen gas is produced via electrolysis of water, process in which electric current is applied through a volume of water, which causes the hydrogen atoms to separate from the oxygen atoms. This demonstration is usually done in high school chemistry classes to show electrolysis.
Chemistry[edit]
Sodium bicarbonate is an amphoteric compound. Aqueous solutions are mildly alkaline due to the formation of carbonic acid and hydroxide ion:
- HCO−
3 + H2O → H
2CO
3 + OH−
Sodium bicarbonate can often be used as a safer alternative to sodium hydroxide, and as such can be used as a wash to remove any acidic impurities from a «crude» liquid, producing a purer sample. Reaction of sodium bicarbonate and an acid produces a salt and carbonic acid, which readily decomposes to carbon dioxide and water:
- NaHCO3 + HCl → NaCl + H2O+CO2
- H2CO3 → H2O + CO2(g)
Sodium bicarbonate reacts with acetic acid (found in vinegar), producing sodium acetate, water, and carbon dioxide:
- NaHCO3 + CH3COOH → CH3COONa + H2O + CO2(g)
Sodium bicarbonate reacts with bases such as sodium hydroxide to form carbonates:
- NaHCO3 + NaOH → Na2CO3 + H2O
Thermal decomposition[edit]
At temperatures from 80–100 °C (176–212 °F), sodium bicarbonate gradually decomposes into sodium carbonate, water, and carbon dioxide. The conversion is faster at 200 °C (392 °F):[71]
- 2 NaHCO3 → Na2CO3 + H2O + CO2
Most bicarbonates undergo this dehydration reaction. Further heating converts the carbonate into the oxide (above 850 °C/1,560 °F):[71]
- Na2CO3 → Na2O + CO2
These conversions are relevant to the use of NaHCO3 as a fire-suppression agent («BC powder») in some dry-powder fire extinguishers.[citation needed]
Stability and shelf life[edit]
If kept cool (room temperature) and dry (an airtight container is recommended to keep out moist air), sodium bicarbonate can be kept without a significant amount of decomposition for at least two or three years.[72][73][74][75]
History[edit]
The word natron has been in use in many languages throughout modern times (in the forms of anatron, natrum and natron) and originated (like Spanish, French and English natron as well as ‘sodium’) via Arabic naṭrūn (or anatrūn; cf. the Lower Egyptian “Natrontal” Wadi El Natrun, where a mixture of sodium carbonate and sodium hydrogen carbonate for the dehydration of mummies was used [76]) from Greek nítron (νίτρον) (Herodotus; Attic lítron (λίτρον)), which can be traced back to ancient Egyptian ntr. The Greek nítron (soda, saltpeter) was also used in Latin (sal) nitrum and in German Salniter (the source of Nitrogen, Nitrat etc.).[77][78]
In 1791, French chemist Nicolas Leblanc produced sodium carbonate, also known as soda ash. The pharmacist Valentin Rose the Younger is credited with the discovery of sodium bicarbonate in 1801 in Berlin. In 1846, two American bakers, John Dwight and Austin Church, established the first factory in the United States to produce baking soda from sodium carbonate and carbon dioxide.[79]
Saleratus, potassium or sodium bicarbonate, is mentioned in the novel Captains Courageous by Rudyard Kipling as being used extensively in the 1800s in commercial fishing to prevent freshly caught fish from spoiling.[80]
In 1919, US Senator Lee Overman declared that bicarbonate of soda could cure the Spanish flu. In the midst of the debate on 26 January 1919, he interrupted the discussion to announce the discovery of a cure. «I want to say, for the benefit of those who are making this investigation,» he reported, «that I was told by a judge of a superior court in the mountain country of North Carolina they have discovered a remedy for this disease.» The purported cure implied a critique of modern science and an appreciation for the simple wisdom of simple people. «They say that common baking soda will cure the disease,» he continued, «that they have cured it with it, that they have no deaths up there at all; they use common baking soda, which cures the disease.»[81]
Production[edit]
Sodium bicarbonate is produced industrially from sodium carbonate:[82]
- Na2CO3 + CO2 + H2O → 2 NaHCO3
It is produced on the scale of about 100,000 tonnes/year (as of 2001)[dubious – discuss][83] with a worldwide production capacity of 2.4 million tonnes per year (as of 2002).[84] Commercial quantities of baking soda are also produced by a similar method: soda ash, mined in the form of the ore trona, is dissolved in water and treated with carbon dioxide. Sodium bicarbonate precipitates as a solid from this solution.[citation needed]
Regarding the Solvay process, sodium bicarbonate is an intermediate in the reaction of sodium chloride, ammonia, and carbon dioxide. The product however shows low purity (75pc).[citation needed]
- NaCl + CO2 + NH3 + H2O → NaHCO3 + NH4Cl
Although of no practical value, NaHCO3 may be obtained by the reaction of carbon dioxide with an aqueous solution of sodium hydroxide:[citation needed]
- CO2 + NaOH → NaHCO3
Mining[edit]
Naturally occurring deposits of nahcolite (NaHCO3) are found in the Eocene-age (55.8–33.9 Mya) Green River Formation, Piceance Basin in Colorado. Nahcolite was deposited as beds during periods of high evaporation in the basin. It is commercially mined using common underground mining techniques such as bore, drum, and longwall mining in a fashion very similar to coal mining.[citation needed]
It is also produced by solution mining, pumping heated water through nahcolite beds and crystalizing the dissolved nahcolite through a cooling crystallization process.
In popular culture[edit]
Sodium bicarbonate, as «bicarbonate of soda», was a frequent source of punch lines for Groucho Marx in Marx Brothers movies. In Duck Soup, Marx plays the leader of a nation at war. In one scene, he receives a message from the battlefield that his general is reporting a gas attack, and Groucho tells his aide: «Tell him to take a teaspoonful of bicarbonate of soda and a half a glass of water.»[85] In A Night at the Opera, Groucho’s character addresses the opening night crowd at an opera by saying of the lead tenor: «Signor Lassparri comes from a very famous family. His mother was a well-known bass singer. His father was the first man to stuff spaghetti with bicarbonate of soda, thus causing and curing indigestion at the same time.»[86]
In the Joseph L. Mankewicz classic All About Eve, the Max Fabian character (Gregory Ratoff) has an extended scene with Margo Channing (Bette Davis) in which, suffering from heartburn, he requests and then drinks bicarbonate of soda, eliciting a prominent burp. Channing promises to always keep a box of bicarb with Max’s name on it.
See also[edit]
- Carbonic acid
- List of ineffective cancer treatments
- List of minerals
- Natron
- Natrona (disambiguation)
- Trona
References[edit]
- ^ a b Haynes, p. 4.90
- ^ a b c Haynes, p. 5.194
- ^ a b c «Sodium Bicarbonate» (PDF). United Nations Environment Programme. Archived from the original (PDF) on 16 May 2011.
- ^ Ellingboe JL, Runnels JH (1966). «Solubilities of Sodium Carbonate and Sodium Bicarbonate in Acetone-Water and Methanol-Water Mixtures». J. Chem. Eng. Data. 11 (3): 323–324. doi:10.1021/je60030a009.
- ^ a b Haynes, p. 7.23
- ^ Pasquali I, Bettini R, Giordano F (2007). «Thermal behaviour of diclofenac, diclofenac sodium and sodium bicarbonate compositions». Journal of Thermal Analysis and Calorimetry. 90 (3): 903–907. doi:10.1007/s10973-006-8182-1. S2CID 95695262.
- ^ a b c d Haynes, p. 5.19
- ^ Chambers M. «Sodium bicarbonate [USP:JAN]». ChemIDplus. U.S. National Library of Medicine.
- ^ Nomenclature of Inorganic Chemistry IUPAC Recommendations 2005 (PDF), IUPAC, p. 137, archived (PDF) from the original on 18 May 2017
- ^ «Mineral Springs – an overview | ScienceDirect Topics».
- ^ «What’s the difference between bicarbonate of soda, baking soda and baking powder?». ThatsLife! Pacific Network.
- ^ PubChem. «Sodium bicarbonate». pubchem.ncbi.nlm.nih.gov. Retrieved 25 January 2021.
- ^ «Definition of SALERATUS». www.merriam-webster.com. Retrieved 6 December 2020.
- ^ «Approved additives and E numbers». Food Standards Agency. Retrieved 7 December 2020.
- ^ Wollaston, WH (January 1814). «I. A Synoptic scale of chemical equivalents». Philosophical Transactions of the Royal Society of London. 104: 1–22. doi:10.1098/rstl.1814.0001. S2CID 96774986.
- ^ Bent AJ, ed. (1997). The Technology of Cake Making (6 ed.). Springer. p. 102. ISBN 9780751403497. Retrieved 12 August 2009.
- ^ Cascio J. «Sourdough» (PDF). University of Alaska Fairbanks Cooperative Extension Service. FNH-00061. Archived from the original (PDF) on 27 March 2016. Retrieved 2 May 2017.
- ^ «The Many Practical Uses of Baking Soda in the Kitchen». About.com Food. Retrieved 22 January 2017.
- ^ Czernohorsky JH, Hooker R. «The Chemistry of Baking» (PDF). New Zealand Institute of Chemistry. Archived from the original (PDF) on 27 November 2016. Retrieved 22 January 2017.
- ^ «Baking Soda and Baking Powder». FineCooking.com. Archived from the original on 2 February 2017. Retrieved 22 January 2017.
- ^ «Baking Soda FAQs». Arm & Hammer Multi-Brand. Church & Dwight Company. What is the difference baking soda and baking powder?. Archived from the original on 27 June 2017. Retrieved 20 July 2017.
- ^ «Glossary Ingredients». Cooking.com. Archived from the original on 15 September 2008.
- ^ «Sodium Bicarbonate». BRP Adhikary. 11 July 2016. Retrieved 25 January 2021.
- ^ «Sugar snake». MEL Science. MEL Science 2015–2019. Archived from the original on 6 October 2019. Retrieved 28 October 2019.
- ^ Malik YS, Goyal SM (May 2006). «Virucidal efficacy of sodium bicarbonate on a food contact surface against feline calicivirus, a norovirus surrogate». International Journal of Food Microbiology. 109 (1–2): 160–3. doi:10.1016/j.ijfoodmicro.2005.08.033. PMID 16540196.
- ^ Rutala WA, Barbee SL, Aguiar NC, Sobsey MD, Weber DJ (January 2000). «Antimicrobial activity of home disinfectants and natural products against potential human pathogens». Infection Control and Hospital Epidemiology. 21 (1): 33–8. doi:10.1086/501694. PMID 10656352. S2CID 34461187.
- ^ Zamani M, Sharifi Tehrani A, Ali Abadi AA (2007). «Evaluation of antifungal activity of carbonate and bicarbonate salts alone or in combination with biocontrol agents in control of citrus green mold». Communications in Agricultural and Applied Biological Sciences. 72 (4): 773–7. PMID 18396809.
- ^ Altman G (22 May 2006). «Book Repair for BookThinkers: How To Remove Odors From Books». The BookThinker (69).
- ^ a b c «Arm & Hammer Baking Soda – Basics – The Magic of Arm & Hammer Baking Soda». armandhammer.com. Archived from the original on 31 August 2009. Retrieved 30 July 2009.
- ^ «Prepare for Emergencies from Uncontrolled Hazards». American Chemical Society.
- ^ Hurum D. «Laboratory Safety» (PDF). Civil Engineering. Northwestern University.
- ^ «Horticulture myths». University of Vermont Extension Department of Plant and Soil Science. Archived from the original on 7 August 2019. Retrieved 18 October 2021.
- ^ «Sodium Bicarbonate». Jackson Siegelbaum Gastroenterology. 1998. Archived from the original on 5 October 2016. Retrieved 4 October 2016.
- ^ «PegLyte». Pendo Phama.
- ^ «Sodium Bicarbonate Intravenous Infusion» (PDF). Consumer Medicine Information. Better Health Channel. 13 July 2004. Archived from the original (PDF) on 22 August 2008.
- ^ «Respiratory Acidosis: Treatment & Medication». emedicine. 26 March 2020.
- ^ Dart RC (2004). Medical Toxicology. Lippincott Williams & Wilkins. pp. 910–. ISBN 978-0-7817-2845-4.
- ^ Cloth Diapers. Donald C. Cooper PhD. pp. 46–.
- ^ [old info]Knudsen K, Abrahamsson J (April 1997). «Epinephrine and sodium bicarbonate independently and additively increase survival in experimental amitriptyline poisoning». Critical Care Medicine. 25 (4): 669–74. doi:10.1097/00003246-199704000-00019. PMID 9142034.
- ^ «Insect bites and stings: First aid». Mayo Clinic. 15 January 2008.
- ^ «Sodium Bicarbonate». American Cancer Society. 28 November 2008. Archived from the original on 19 February 2013. Retrieved 19 February 2013.
{{cite web}}: CS1 maint: unfit URL (link) - ^ Ernst E (3 February 2017). «This must be the most sickening cancer scam I have seen for a while».
- ^ Edgcombe H, Hocking G, Radcliffe J (2005). «Anaesthesia UK : Local Anaesthetic Pharmacology». John Radcliffe Hospital, Oxford, UK.
- ^ Fox D (15 December 2001). «Hard cheese». New Scientist. Retrieved 20 July 2017.
- ^ Fenton, T. R.; Tough, S. C.; Lyon, A. W.; Eliasziw, M.; Hanley, D. A. (2011). «Causal assessment of dietary acid load and bone disease: A systematic review & meta-analysis applying Hill’s epidemiologic criteria for causality». Nutrition Journal. 10: 41. doi:10.1186/1475-2891-10-41. PMC 3114717. PMID 21529374.
- ^ Schwalfenberg, Gerry K. (2012). «The Alkaline Diet: Is There Evidence That an Alkaline pH Diet Benefits Health?». Journal of Environmental and Public Health. 2012: 1–7. doi:10.1155/2012/727630. PMC 3195546. PMID 22013455.
- ^ «Medical information from Prague 2000». Archived from the original on 18 October 2014.
- ^ Shirsand, S. B.; Suresh, Sarasija; Jodhana, L. S.; Swamy, P. V. (2010). «Formulation Design and Optimization of Fast Disintegrating Lorazepam Tablets by Effervescent Method». Indian Journal of Pharmaceutical Sciences. 72 (4): 431–436. doi:10.4103/0250-474X.73911. ISSN 0250-474X. PMC 3013557. PMID 21218052.
- ^ Storehagen S, Ose N, Midha S. «Dentifrices and mouthwashes ingredients and their use» (PDF). Institutt for klinisk odontologi. Universitetet i Oslo.
- ^ US 4132770A, Barth J, «Oral Product», issued 1979
- ^ Iqbal K, Asmat M, Jawed S, Mushtaque A, Mohsin F, Hanif S, et al. (July 2011). «Role of different ingredients of tooth pastes and mouthwashes in oral health» (PDF). Journal of Pakistan Dental Association. 20 (3): 163–70.
- ^ Lamb JH (1946). «Sodium Bicarbonate: An Excellent Deodorant». The Journal of Investigative Dermatology. 7 (3): 131–133. doi:10.1038/jid.1946.13.
- ^ «Bicarb soda: natural body deodorant». sustainableecho.com. 10 March 2009.
- ^ Metson RB (2005). The Harvard Medical School Guide to Healing Your Sinues. McGraw Hill. p. 68. ISBN 9780071444699.
- ^ «Blepharitis : Information for patients leaflet» (PDF). Ouh.nhs.uk. Retrieved 28 February 2022.
- ^ «Blepharitis. Treatment and Causes. Eyelid inflammation | Patient». Patient. Archived from the original on 5 December 2015. Retrieved 31 May 2016.
- ^ Paton LJ, Beauchemin KA, Veira DM, von Keyserlingk MA (2006). «Use of sodium bicarbonate, offered free choice or blended into the ration, to reduce the risk of ruminal acidosis in cattle». Canadian Journal of Animal Science. 86 (3): 429–437. doi:10.4141/A06-014.
- ^ «Blast Away Grime With Baking Soda». Popular Mechanics. 5 August 2013. Retrieved 2 August 2020.
- ^ Housecroft CE, Sharpe AG (2008). «Chapter 22: d-block metal chemistry: the first row elements». Inorganic Chemistry, 3rd Edition. Pearson. p. 716. ISBN 978-0-13-175553-6.
- ^ «Science Lab.com». MSDS- Sodium carbonate. sciencelab.com. Archived from the original on 5 September 2012.
- ^ a b «Finishing Techniques in Metalwork». Philadelphia Museum of Art.
- ^ «Put a Shine on It». scifun.chem.wisc.edu. Archived from the original on 31 July 2012. Retrieved 6 March 2011.
- ^ Orcutt JA. «Depleted Uranium and Health: Facts and Helpful Suggestions». Pharmacology and Toxicology of Uranium Compounds. McGraw-Hill. Archived from the original on 17 January 2013. Retrieved 21 March 2012.
- ^ Raymond J (10 June 2016). «Kitchen Odor Eliminating Candles, Products, and Tricks». cravedujour.com. Archived from the original on 7 August 2020. Retrieved 29 June 2016.
- ^
Vicki Lansky, Martha Campbell, Baking Soda: Over 500 Fabulous, Fun, and Frugal Uses You’ve Probably Never Thought Of, 2009, ISBN 1931863733, p. 28 - ^ «A trusted solution for more than 170 years. Pure and simple.», Arm & Hammer «About Us» page
- ^ Keith Sawyer, Group Genius: The Creative Power of Collaboration, 2017, ISBN 0465093582, «keep food tasting fresh»
- ^ Clayton M. Christensen, Scott Cook, Taddy Hall, Marketing Malpractice: The Cause and the Cure, Harvard Business Review, December 2005, [1]
- ^ «Myth #100: An Open Box of Baking Soda in the Fridge absorbs Odors», Bruce Weinstein, Mark Scarbrough, Lobsters Scream When You Boil Them; And 100 Other Myths About Food and Cooking, 2011, ISBN 1439195382, p. 312
- ^ «Baking Soda as Odor Absorber | Cook’s Illustrated». Cooksillustrated.com. Retrieved 28 February 2022.
- ^ a b «Decomposition of Carbonates». General Chemistry Online. Archived from the original on 2 October 1999. Retrieved 16 March 2010.
- ^ PubChem. «Sodium bicarbonate». pubchem.ncbi.nlm.nih.gov. Retrieved 16 May 2021.
- ^ «Sodium bicarbonate (S300) batch numbering and shelf life statement – Solvay Chemicals, Inc» (PDF). 31 January 2019.
- ^ «Re: Shelf Life – Sodium Bicarbonate (all grades) – Tronox Alkali Corporation» (PDF). 1 April 2015.
- ^ «Does Baking Soda Go Bad? How to Know If It’s Still Good». The Spruce Eats. Retrieved 16 May 2021.
- ^ Renate Gerner: Instruments and substances used in mummification. In: Renate Gerner, Rosemarie Drenkhahn (ed.): Mumie und Computer. A multidisciplinary research project in Hanover. Special exhibition of the Kestner Museum Hanover from September 26, 1991 to January 19, 1992. Kestner Museum, Hanover 1991, ISBN 3-924029-17-2, p. 28 f.
- ^ Franz Dornseiff: «The Greek words in German.» Walter de Gruyter & Co, Berlin 1950, p. 44.
- ^ Friedrich Kluge, Alfred Götze (Philologist): Etymological Dictionary of the German Language. 20th edition, ed. by Walther Mitzka, De Gruyter, Berlin / New York 1967; Reprint (“21st unchanged edition”) ibid 1975, ISBN 3-11-005709-3, p. 504.
- ^ «Company History». Church & Dwight Co. Archived from the original on 16 October 2011.
- ^ Kipling R (1897). Captains Courageous. p. 25.
- ^ Bristow, Nancy K. (2012), American Pandemic: The Lost Worlds of the 1918 Influenza Epidemic, Oxford University Press, p. 178, ISBN 978-0199811342
- ^ Thieme C (2000). «Sodium Carbonates». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a24_299. ISBN 3527306730.
- ^ Holleman AF, Wiberg E (2001). Inorganic Chemistry. San Diego: Academic Press. ISBN 0-12-352651-5.
- ^ Page 45, section 3.6.2.1 of «Process Best Practices Reference Document (BREF) for Soda Ash,» report produced by the European Soda Ash Producer’s Association Archived 3 October 2006 at the Wayback Machine, March 2004.
- ^ «Duck Soup (1933)». IMDb. Retrieved 4 August 2015.
- ^ «A Night at the Opera (1935)». IMDb. Retrieved 4 August 2015.
Bibliography[edit]
- Haynes WM, ed. (2011). CRC Handbook of Chemistry and Physics (92nd ed.). CRC Press. ISBN 978-1439855119.
External links[edit]
- International Chemical Safety Card 1044
For the leavening agent of which baking soda is a common ingredient, see Baking powder.

|
||
|
||

Crystal structure |
||
|
||
| Names | ||
|---|---|---|
| IUPAC name
sodium hydrogencarbonate |
||
| Other names
Baking soda, bicarb (laboratory slang), bicarbonate of soda, nahcolite, natrium hydrogen carbonate, natron |
||
| Identifiers | ||
|
CAS Number |
|
|
|
3D model (JSmol) |
|
|
|
Beilstein Reference |
4153970 | |
| ChEBI |
|
|
| ChEMBL |
|
|
| ChemSpider |
|
|
| DrugBank |
|
|
| ECHA InfoCard | 100.005.122 |
|
| EC Number |
|
|
| E number | E500(ii) (acidity regulators, …) | |
|
IUPHAR/BPS |
|
|
| KEGG |
|
|
| MeSH | Sodium+bicarbonate | |
|
PubChem CID |
|
|
| RTECS number |
|
|
| UNII |
|
|
|
CompTox Dashboard (EPA) |
|
|
|
InChI
|
||
|
SMILES
|
||
| Properties | ||
|
Chemical formula |
NaHCO 3 |
|
| Molar mass | 84.0066 g mol−1 | |
| Appearance | White crystals | |
| Odor | Odorless | |
| Density |
|
|
| Melting point | (Decomposes to sodium carbonate starting at 50 °C[1][6]) | |
|
Solubility in water |
|
|
| Solubility | 0.02 wt% acetone, 2.13 wt% methanol @22 °C.[4] insoluble in ethanol | |
| log P | −0.82 | |
| Acidity (pKa) |
|
|
|
Refractive index (nD) |
nα = 1.377 nβ = 1.501 nγ = 1.583 | |
| Structure | ||
|
Crystal structure |
Monoclinic | |
| Thermochemistry | ||
|
Heat capacity (C) |
87.6 J/mol K[7] | |
|
Std molar |
101.7 J/mol K[7] | |
|
Std enthalpy of |
−950.8 kJ/mol[7] | |
|
Gibbs free energy (ΔfG⦵) |
−851.0 kJ/mol[7] | |
| Pharmacology | ||
|
ATC code |
B05CB04 (WHO) B05XA02 (WHO), QG04BQ01 (WHO) | |
|
Routes of |
Intravenous, oral | |
| Hazards | ||
| Occupational safety and health (OHS/OSH): | ||
|
Main hazards |
Causes serious eye irritation | |
| NFPA 704 (fire diamond) |
2 0 1 |
|
| Flash point | Incombustible | |
| Lethal dose or concentration (LD, LC): | ||
|
LD50 (median dose) |
4220 mg/kg (rat, oral)[8] | |
| Safety data sheet (SDS) | External MSDS | |
| Related compounds | ||
|
Other anions |
Sodium carbonate | |
|
Other cations |
|
|
|
Related compounds |
|
|
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Cupcakes baked with baking soda as a raising agent
Sodium bicarbonate (IUPAC name: sodium hydrogencarbonate[9]), commonly known as baking soda or bicarbonate of soda, is a chemical compound with the formula NaHCO3. It is a salt composed of a sodium cation (Na+) and a bicarbonate anion (HCO3−). Sodium bicarbonate is a white solid that is crystalline, but often appears as a fine powder. It has a slightly salty, alkaline taste resembling that of washing soda (sodium carbonate). The natural mineral form is nahcolite. It is a component of the mineral natron and is found dissolved in many mineral springs.[10]
Nomenclature[edit]
Because it has long been known and widely used, the salt has many different names such as baking soda, bread soda, cooking soda, and bicarbonate of soda and can often be found near baking powder in stores. The term baking soda is more common in the United States, while bicarbonate of soda is more common in Australia, United Kingdom and Ireland.[11] and in many northern/central European countries it is called Natron. Abbreviated colloquial forms such as sodium bicarb, bicarb soda, bicarbonate, and bicarb are common.[12]
The word saleratus, from Latin sal æratus (meaning «aerated salt»), was widely used in the 19th century for both sodium bicarbonate and potassium bicarbonate.[13]
Its E number food additive code is E500.[14]
The prefix bi in bicarbonate comes from an outdated naming system predating molecular knowledge in reference to the two molar equivalents of carbon dioxide (known as carbonic acid in the ancient chemistry language) that potassium hydrocarbonate/bicarbonate releases upon decomposition to (di)potassium carbonate and to potassium oxide (potash).[15] The modern chemical formulas of these compounds now express their precise chemical compositions which were unknown when the name bi-carbonate of potash was coined (see also: bicarbonate).
Uses[edit]
Cooking[edit]
Leavening[edit]
In cooking, baking soda is primarily used in baking as a leavening agent. When it reacts with acid, carbon dioxide is released, which causes expansion of the batter and forms the characteristic texture and grain in cakes, quick breads, soda bread, and other baked and fried foods. The acid–base reaction can be generically represented as follows:[16]
- NaHCO3 + H+ → Na+ + CO2 + H2O
Acidic materials that induce this reaction include hydrogen phosphates, cream of tartar, lemon juice, yogurt, buttermilk, cocoa, and vinegar. Baking soda may be used together with sourdough, which is acidic, making a lighter product with a less acidic taste.[17]
Heat can also by itself cause sodium bicarbonate to act as a raising agent in baking because of thermal decomposition, releasing carbon dioxide at temperatures above 80 °C (180 °F), as follows:[18]
- 2 NaHCO3 → Na2CO3 + H2O + CO2
When used this way on its own, without the presence of an acidic component (whether in the batter or by the use of a baking powder containing acid), only half the available CO2 is released (one CO2 molecule is formed for every two equivalents of NaHCO3). Additionally, in the absence of acid, thermal decomposition of sodium bicarbonate also produces sodium carbonate, which is strongly alkaline and gives the baked product a bitter, «soapy» taste and a yellow color. Since the reaction occurs slowly at room temperature, mixtures (cake batter, etc.) can be allowed to stand without rising until they are heated in the oven.[citation needed]
Baking powder[edit]
Baking powder, also sold for cooking, contains around 30% of bicarbonate, and various acidic ingredients which are activated by the addition of water, without the need for additional acids in the cooking medium.[19][20][21] Many forms of baking powder contain sodium bicarbonate combined with calcium acid phosphate, sodium aluminium phosphate, or cream of tartar.[22] Baking soda is alkaline; the acid used in baking powder avoids a metallic taste when the chemical change during baking creates sodium carbonate.[23]
Pyrotechnics[edit]
Sodium bicarbonate is one of the main components of the common «black snake» firework. The effect is caused by the thermal decomposition, which produces carbon dioxide gas to produce a long snake-like ash as a combustion product of the other main component, sucrose.[24] Sodium bicarbonate is also used to delay combustion reactions by releasing CO2 and H2O when heated, both of which are flame retardants.
Mild disinfectant[edit]
It has weak disinfectant properties,[25][26] and it may be an effective fungicide against some organisms.[27] Because baking soda will absorb musty smells, it has become a reliable method for used book sellers when making books less malodorous.[28]
Fire extinguisher[edit]
Sodium bicarbonate can be used to extinguish small grease or electrical fires by being thrown over the fire, as heating of sodium bicarbonate releases carbon dioxide.[29] However, it should not be applied to fires in deep fryers; the sudden release of gas may cause the grease to splatter.[29] Sodium bicarbonate is used in BC dry chemical fire extinguishers as an alternative to the more corrosive monoammonium phosphate in ABC extinguishers. The alkaline nature of sodium bicarbonate makes it the only dry chemical agent, besides Purple-K, that was used in large-scale fire suppression systems installed in commercial kitchens. Because it can act as an alkali, the agent has a mild saponification effect on hot grease, which forms a smothering, soapy foam.[citation needed]
Neutralization of acids[edit]
Sodium bicarbonate reacts spontaneously with acids, releasing CO2 gas as a reaction product. It is commonly used to neutralize unwanted acid solutions or acid spills in chemical laboratories.[30] It is not appropriate to use sodium bicarbonate to neutralize base[31] even though it is amphoteric, reacting with both acids and bases.[citation needed]
Agriculture[edit]
Sodium bicarbonate when applied on leaves, can prevent the growth of fungi; however, it does not kill the fungus. Excessive amount of sodium bicarbonate can cause discolouration of fruits (two percent solution) and chlorosis (one percent solution).[32]
Medical uses and health[edit]
Sodium bicarbonate mixed with water can be used as an antacid to treat acid indigestion and heartburn.[33] Its reaction with stomach acid produces salt, water, and carbon dioxide:
- NaHCO3 + HCl → NaCl + H2O + CO2(g)
A mixture of sodium bicarbonate and polyethylene glycol such as PegLyte,[34] dissolved in water and taken orally, is an effective gastrointestinal lavage preparation and laxative prior to gastrointestinal surgery, gastroscopy, etc.[citation needed]
Intravenous sodium bicarbonate in an aqueous solution is sometimes used for cases of acidosis, or when insufficient sodium or bicarbonate ions are in the blood.[35] In cases of respiratory acidosis, the infused bicarbonate ion drives the carbonic acid/bicarbonate buffer of plasma to the left, and thus raises the pH. For this reason, sodium bicarbonate is used in medically supervised cardiopulmonary resuscitation. Infusion of bicarbonate is indicated only when the blood pH is markedly low (< 7.1–7.0).[36]
HCO3− is used for treatment of hyperkalemia, as it will drive K+ back into cells during periods of acidosis.[37] Since sodium bicarbonate can cause alkalosis, it is sometimes used to treat aspirin overdoses. Aspirin requires an acidic environment for proper absorption, and a basic environment will diminish aspirin absorption in cases of overdose.[38] Sodium bicarbonate has also been used in the treatment of tricyclic antidepressant overdose.[39] It can also be applied topically as a paste, with three parts baking soda to one part water, to relieve some kinds of insect bites and stings (as well as accompanying swelling).[40]
Some alternative practitioners, such as Tullio Simoncini, have promoted baking soda as a cancer cure, which the American Cancer Society has warned against due to both its unproven effectiveness and potential danger in use.[41] Edzard Ernst has called the promotion of sodium bicarbonate as a cancer cure «one of the more sickening alternative cancer scams I have seen for a long time».[42]
Sodium bicarbonate can be added to local anesthetics, to speed up the onset of their effects and make their injection less painful.[43] It is also a component of Moffett’s solution, used in nasal surgery.[citation needed]
It has been proposed that acidic diets weaken bones.[44] One systematic meta-analysis of the research shows no such effect.[45] Another also finds that there is no evidence that alkaline diets improve bone health, but suggests that there «may be some value» to alkaline diets for other reasons.[46]
Antacid (such as baking soda) solutions have been prepared and used by protesters to alleviate the effects of exposure to tear gas during protests.[failed verification][47]
Similarly to its use in baking, sodium bicarbonate is used together with a mild acid such as tartaric acid as the excipient in effervescent tablets: when such a tablet is dropped in a glass of water, the carbonate leaves the reaction medium as carbon dioxide gas (HCO3− + H+ → H2O + CO2↑ or, more precisely, HCO3− + H3O+ → 2 H2O + CO2↑). This makes the tablet disintegrate, leaving the medication suspended and/or dissolved in the water together with the resulting salt (in this example, sodium tartrate).[48]
Personal hygiene[edit]
Sodium bicarbonate is also used as an ingredient in some mouthwashes. It has anticaries and abrasive properties.[49] It works as a mechanical cleanser on the teeth and gums, neutralizes the production of acid in the mouth, and also acts as an antiseptic to help prevent infections.[50][51] Sodium bicarbonate in combination with other ingredients can be used to make a dry or wet deodorant.[52][53] Sodium bicarbonate may be used as a buffering agent, combined with table salt, when creating a solution for nasal irrigation.[54]
It is used in eye hygiene to treat blepharitis. This is done by addition of a teaspoon of sodium bicarbonate to cool water that was recently boiled, followed by gentle scrubbing of the eyelash base with a cotton swab dipped in the solution.[55][56]
Veterinary uses[edit]
Sodium bicarbonate is used as a cattle feed supplement, in particular as a buffering agent for the rumen.[57]
Cleaning agent[edit]
Sodium bicarbonate is used in a process for removing paint and corrosion called sodablasting. As a blasting medium, sodium bicarbonate is used to remove surface contamination from softer and less resilient substrates such as aluminium, copper or timber which could be damaged by silica sand abrasive media.[58]
A manufacturer recommends a paste made from baking soda with minimal water as a gentle scouring powder,[29] and is useful in removing surface rust, as the rust forms a water-soluble compound when in a concentrated alkaline solution;[59] cold water should be used, as hot-water solutions can corrode steel.[60] Sodium bicarbonate attacks the thin protective oxide layer that forms on aluminium, making it unsuitable for cleaning this metal.[61] A solution in warm water will remove the tarnish from silver when the silver is in contact with a piece of aluminium foil.[61][62] Baking soda is commonly added to washing machines as a replacement for water softener and to remove odors from clothes. It is also almost as effective in removing heavy tea and coffee stains from cups as Sodium hydroxide, when diluted with warm water.
During the Manhattan Project to develop the nuclear bomb in the early 1940s, the chemical toxicity of uranium was an issue. Uranium oxides were found to stick very well to cotton cloth, and did not wash out with soap or laundry detergent. However, the uranium would wash out with a 2% solution of sodium bicarbonate. Clothing can become contaminated with toxic dust of depleted uranium (DU), which is very dense, hence used for counterweights in a civilian context, and in armour-piercing projectiles. DU is not removed by normal laundering; washing with about 6 ounces (170 g) of baking soda in 2 gallons (7.5 L) of water will help to wash it out.[63]
Odor control[edit]
It is often claimed that baking soda is an effective odor remover,[64][better source needed] and it is often recommended that an open box be kept in the refrigerator to absorb odor.[65] This idea was promoted by the leading U.S. brand of baking soda, Arm & Hammer, in an advertising campaign starting in 1972.[66] Though this campaign is considered a classic of marketing, leading within a year to more than half of American refrigerators containing a box of baking soda,[67][68] there is little evidence that it is in fact effective in this application.[69][70]
Hydrogen gas production[edit]
Sodium bicarbonate can be used as a catalyst in gas production. Its performance for this application is «good», however not usually used.[citation needed] Hydrogen gas is produced via electrolysis of water, process in which electric current is applied through a volume of water, which causes the hydrogen atoms to separate from the oxygen atoms. This demonstration is usually done in high school chemistry classes to show electrolysis.
Chemistry[edit]
Sodium bicarbonate is an amphoteric compound. Aqueous solutions are mildly alkaline due to the formation of carbonic acid and hydroxide ion:
- HCO−
3 + H2O → H
2CO
3 + OH−
Sodium bicarbonate can often be used as a safer alternative to sodium hydroxide, and as such can be used as a wash to remove any acidic impurities from a «crude» liquid, producing a purer sample. Reaction of sodium bicarbonate and an acid produces a salt and carbonic acid, which readily decomposes to carbon dioxide and water:
- NaHCO3 + HCl → NaCl + H2O+CO2
- H2CO3 → H2O + CO2(g)
Sodium bicarbonate reacts with acetic acid (found in vinegar), producing sodium acetate, water, and carbon dioxide:
- NaHCO3 + CH3COOH → CH3COONa + H2O + CO2(g)
Sodium bicarbonate reacts with bases such as sodium hydroxide to form carbonates:
- NaHCO3 + NaOH → Na2CO3 + H2O
Thermal decomposition[edit]
At temperatures from 80–100 °C (176–212 °F), sodium bicarbonate gradually decomposes into sodium carbonate, water, and carbon dioxide. The conversion is faster at 200 °C (392 °F):[71]
- 2 NaHCO3 → Na2CO3 + H2O + CO2
Most bicarbonates undergo this dehydration reaction. Further heating converts the carbonate into the oxide (above 850 °C/1,560 °F):[71]
- Na2CO3 → Na2O + CO2
These conversions are relevant to the use of NaHCO3 as a fire-suppression agent («BC powder») in some dry-powder fire extinguishers.[citation needed]
Stability and shelf life[edit]
If kept cool (room temperature) and dry (an airtight container is recommended to keep out moist air), sodium bicarbonate can be kept without a significant amount of decomposition for at least two or three years.[72][73][74][75]
History[edit]
The word natron has been in use in many languages throughout modern times (in the forms of anatron, natrum and natron) and originated (like Spanish, French and English natron as well as ‘sodium’) via Arabic naṭrūn (or anatrūn; cf. the Lower Egyptian “Natrontal” Wadi El Natrun, where a mixture of sodium carbonate and sodium hydrogen carbonate for the dehydration of mummies was used [76]) from Greek nítron (νίτρον) (Herodotus; Attic lítron (λίτρον)), which can be traced back to ancient Egyptian ntr. The Greek nítron (soda, saltpeter) was also used in Latin (sal) nitrum and in German Salniter (the source of Nitrogen, Nitrat etc.).[77][78]
In 1791, French chemist Nicolas Leblanc produced sodium carbonate, also known as soda ash. The pharmacist Valentin Rose the Younger is credited with the discovery of sodium bicarbonate in 1801 in Berlin. In 1846, two American bakers, John Dwight and Austin Church, established the first factory in the United States to produce baking soda from sodium carbonate and carbon dioxide.[79]
Saleratus, potassium or sodium bicarbonate, is mentioned in the novel Captains Courageous by Rudyard Kipling as being used extensively in the 1800s in commercial fishing to prevent freshly caught fish from spoiling.[80]
In 1919, US Senator Lee Overman declared that bicarbonate of soda could cure the Spanish flu. In the midst of the debate on 26 January 1919, he interrupted the discussion to announce the discovery of a cure. «I want to say, for the benefit of those who are making this investigation,» he reported, «that I was told by a judge of a superior court in the mountain country of North Carolina they have discovered a remedy for this disease.» The purported cure implied a critique of modern science and an appreciation for the simple wisdom of simple people. «They say that common baking soda will cure the disease,» he continued, «that they have cured it with it, that they have no deaths up there at all; they use common baking soda, which cures the disease.»[81]
Production[edit]
Sodium bicarbonate is produced industrially from sodium carbonate:[82]
- Na2CO3 + CO2 + H2O → 2 NaHCO3
It is produced on the scale of about 100,000 tonnes/year (as of 2001)[dubious – discuss][83] with a worldwide production capacity of 2.4 million tonnes per year (as of 2002).[84] Commercial quantities of baking soda are also produced by a similar method: soda ash, mined in the form of the ore trona, is dissolved in water and treated with carbon dioxide. Sodium bicarbonate precipitates as a solid from this solution.[citation needed]
Regarding the Solvay process, sodium bicarbonate is an intermediate in the reaction of sodium chloride, ammonia, and carbon dioxide. The product however shows low purity (75pc).[citation needed]
- NaCl + CO2 + NH3 + H2O → NaHCO3 + NH4Cl
Although of no practical value, NaHCO3 may be obtained by the reaction of carbon dioxide with an aqueous solution of sodium hydroxide:[citation needed]
- CO2 + NaOH → NaHCO3
Mining[edit]
Naturally occurring deposits of nahcolite (NaHCO3) are found in the Eocene-age (55.8–33.9 Mya) Green River Formation, Piceance Basin in Colorado. Nahcolite was deposited as beds during periods of high evaporation in the basin. It is commercially mined using common underground mining techniques such as bore, drum, and longwall mining in a fashion very similar to coal mining.[citation needed]
It is also produced by solution mining, pumping heated water through nahcolite beds and crystalizing the dissolved nahcolite through a cooling crystallization process.
In popular culture[edit]
Sodium bicarbonate, as «bicarbonate of soda», was a frequent source of punch lines for Groucho Marx in Marx Brothers movies. In Duck Soup, Marx plays the leader of a nation at war. In one scene, he receives a message from the battlefield that his general is reporting a gas attack, and Groucho tells his aide: «Tell him to take a teaspoonful of bicarbonate of soda and a half a glass of water.»[85] In A Night at the Opera, Groucho’s character addresses the opening night crowd at an opera by saying of the lead tenor: «Signor Lassparri comes from a very famous family. His mother was a well-known bass singer. His father was the first man to stuff spaghetti with bicarbonate of soda, thus causing and curing indigestion at the same time.»[86]
In the Joseph L. Mankewicz classic All About Eve, the Max Fabian character (Gregory Ratoff) has an extended scene with Margo Channing (Bette Davis) in which, suffering from heartburn, he requests and then drinks bicarbonate of soda, eliciting a prominent burp. Channing promises to always keep a box of bicarb with Max’s name on it.
See also[edit]
- Carbonic acid
- List of ineffective cancer treatments
- List of minerals
- Natron
- Natrona (disambiguation)
- Trona
References[edit]
- ^ a b Haynes, p. 4.90
- ^ a b c Haynes, p. 5.194
- ^ a b c «Sodium Bicarbonate» (PDF). United Nations Environment Programme. Archived from the original (PDF) on 16 May 2011.
- ^ Ellingboe JL, Runnels JH (1966). «Solubilities of Sodium Carbonate and Sodium Bicarbonate in Acetone-Water and Methanol-Water Mixtures». J. Chem. Eng. Data. 11 (3): 323–324. doi:10.1021/je60030a009.
- ^ a b Haynes, p. 7.23
- ^ Pasquali I, Bettini R, Giordano F (2007). «Thermal behaviour of diclofenac, diclofenac sodium and sodium bicarbonate compositions». Journal of Thermal Analysis and Calorimetry. 90 (3): 903–907. doi:10.1007/s10973-006-8182-1. S2CID 95695262.
- ^ a b c d Haynes, p. 5.19
- ^ Chambers M. «Sodium bicarbonate [USP:JAN]». ChemIDplus. U.S. National Library of Medicine.
- ^ Nomenclature of Inorganic Chemistry IUPAC Recommendations 2005 (PDF), IUPAC, p. 137, archived (PDF) from the original on 18 May 2017
- ^ «Mineral Springs – an overview | ScienceDirect Topics».
- ^ «What’s the difference between bicarbonate of soda, baking soda and baking powder?». ThatsLife! Pacific Network.
- ^ PubChem. «Sodium bicarbonate». pubchem.ncbi.nlm.nih.gov. Retrieved 25 January 2021.
- ^ «Definition of SALERATUS». www.merriam-webster.com. Retrieved 6 December 2020.
- ^ «Approved additives and E numbers». Food Standards Agency. Retrieved 7 December 2020.
- ^ Wollaston, WH (January 1814). «I. A Synoptic scale of chemical equivalents». Philosophical Transactions of the Royal Society of London. 104: 1–22. doi:10.1098/rstl.1814.0001. S2CID 96774986.
- ^ Bent AJ, ed. (1997). The Technology of Cake Making (6 ed.). Springer. p. 102. ISBN 9780751403497. Retrieved 12 August 2009.
- ^ Cascio J. «Sourdough» (PDF). University of Alaska Fairbanks Cooperative Extension Service. FNH-00061. Archived from the original (PDF) on 27 March 2016. Retrieved 2 May 2017.
- ^ «The Many Practical Uses of Baking Soda in the Kitchen». About.com Food. Retrieved 22 January 2017.
- ^ Czernohorsky JH, Hooker R. «The Chemistry of Baking» (PDF). New Zealand Institute of Chemistry. Archived from the original (PDF) on 27 November 2016. Retrieved 22 January 2017.
- ^ «Baking Soda and Baking Powder». FineCooking.com. Archived from the original on 2 February 2017. Retrieved 22 January 2017.
- ^ «Baking Soda FAQs». Arm & Hammer Multi-Brand. Church & Dwight Company. What is the difference baking soda and baking powder?. Archived from the original on 27 June 2017. Retrieved 20 July 2017.
- ^ «Glossary Ingredients». Cooking.com. Archived from the original on 15 September 2008.
- ^ «Sodium Bicarbonate». BRP Adhikary. 11 July 2016. Retrieved 25 January 2021.
- ^ «Sugar snake». MEL Science. MEL Science 2015–2019. Archived from the original on 6 October 2019. Retrieved 28 October 2019.
- ^ Malik YS, Goyal SM (May 2006). «Virucidal efficacy of sodium bicarbonate on a food contact surface against feline calicivirus, a norovirus surrogate». International Journal of Food Microbiology. 109 (1–2): 160–3. doi:10.1016/j.ijfoodmicro.2005.08.033. PMID 16540196.
- ^ Rutala WA, Barbee SL, Aguiar NC, Sobsey MD, Weber DJ (January 2000). «Antimicrobial activity of home disinfectants and natural products against potential human pathogens». Infection Control and Hospital Epidemiology. 21 (1): 33–8. doi:10.1086/501694. PMID 10656352. S2CID 34461187.
- ^ Zamani M, Sharifi Tehrani A, Ali Abadi AA (2007). «Evaluation of antifungal activity of carbonate and bicarbonate salts alone or in combination with biocontrol agents in control of citrus green mold». Communications in Agricultural and Applied Biological Sciences. 72 (4): 773–7. PMID 18396809.
- ^ Altman G (22 May 2006). «Book Repair for BookThinkers: How To Remove Odors From Books». The BookThinker (69).
- ^ a b c «Arm & Hammer Baking Soda – Basics – The Magic of Arm & Hammer Baking Soda». armandhammer.com. Archived from the original on 31 August 2009. Retrieved 30 July 2009.
- ^ «Prepare for Emergencies from Uncontrolled Hazards». American Chemical Society.
- ^ Hurum D. «Laboratory Safety» (PDF). Civil Engineering. Northwestern University.
- ^ «Horticulture myths». University of Vermont Extension Department of Plant and Soil Science. Archived from the original on 7 August 2019. Retrieved 18 October 2021.
- ^ «Sodium Bicarbonate». Jackson Siegelbaum Gastroenterology. 1998. Archived from the original on 5 October 2016. Retrieved 4 October 2016.
- ^ «PegLyte». Pendo Phama.
- ^ «Sodium Bicarbonate Intravenous Infusion» (PDF). Consumer Medicine Information. Better Health Channel. 13 July 2004. Archived from the original (PDF) on 22 August 2008.
- ^ «Respiratory Acidosis: Treatment & Medication». emedicine. 26 March 2020.
- ^ Dart RC (2004). Medical Toxicology. Lippincott Williams & Wilkins. pp. 910–. ISBN 978-0-7817-2845-4.
- ^ Cloth Diapers. Donald C. Cooper PhD. pp. 46–.
- ^ [old info]Knudsen K, Abrahamsson J (April 1997). «Epinephrine and sodium bicarbonate independently and additively increase survival in experimental amitriptyline poisoning». Critical Care Medicine. 25 (4): 669–74. doi:10.1097/00003246-199704000-00019. PMID 9142034.
- ^ «Insect bites and stings: First aid». Mayo Clinic. 15 January 2008.
- ^ «Sodium Bicarbonate». American Cancer Society. 28 November 2008. Archived from the original on 19 February 2013. Retrieved 19 February 2013.
{{cite web}}: CS1 maint: unfit URL (link) - ^ Ernst E (3 February 2017). «This must be the most sickening cancer scam I have seen for a while».
- ^ Edgcombe H, Hocking G, Radcliffe J (2005). «Anaesthesia UK : Local Anaesthetic Pharmacology». John Radcliffe Hospital, Oxford, UK.
- ^ Fox D (15 December 2001). «Hard cheese». New Scientist. Retrieved 20 July 2017.
- ^ Fenton, T. R.; Tough, S. C.; Lyon, A. W.; Eliasziw, M.; Hanley, D. A. (2011). «Causal assessment of dietary acid load and bone disease: A systematic review & meta-analysis applying Hill’s epidemiologic criteria for causality». Nutrition Journal. 10: 41. doi:10.1186/1475-2891-10-41. PMC 3114717. PMID 21529374.
- ^ Schwalfenberg, Gerry K. (2012). «The Alkaline Diet: Is There Evidence That an Alkaline pH Diet Benefits Health?». Journal of Environmental and Public Health. 2012: 1–7. doi:10.1155/2012/727630. PMC 3195546. PMID 22013455.
- ^ «Medical information from Prague 2000». Archived from the original on 18 October 2014.
- ^ Shirsand, S. B.; Suresh, Sarasija; Jodhana, L. S.; Swamy, P. V. (2010). «Formulation Design and Optimization of Fast Disintegrating Lorazepam Tablets by Effervescent Method». Indian Journal of Pharmaceutical Sciences. 72 (4): 431–436. doi:10.4103/0250-474X.73911. ISSN 0250-474X. PMC 3013557. PMID 21218052.
- ^ Storehagen S, Ose N, Midha S. «Dentifrices and mouthwashes ingredients and their use» (PDF). Institutt for klinisk odontologi. Universitetet i Oslo.
- ^ US 4132770A, Barth J, «Oral Product», issued 1979
- ^ Iqbal K, Asmat M, Jawed S, Mushtaque A, Mohsin F, Hanif S, et al. (July 2011). «Role of different ingredients of tooth pastes and mouthwashes in oral health» (PDF). Journal of Pakistan Dental Association. 20 (3): 163–70.
- ^ Lamb JH (1946). «Sodium Bicarbonate: An Excellent Deodorant». The Journal of Investigative Dermatology. 7 (3): 131–133. doi:10.1038/jid.1946.13.
- ^ «Bicarb soda: natural body deodorant». sustainableecho.com. 10 March 2009.
- ^ Metson RB (2005). The Harvard Medical School Guide to Healing Your Sinues. McGraw Hill. p. 68. ISBN 9780071444699.
- ^ «Blepharitis : Information for patients leaflet» (PDF). Ouh.nhs.uk. Retrieved 28 February 2022.
- ^ «Blepharitis. Treatment and Causes. Eyelid inflammation | Patient». Patient. Archived from the original on 5 December 2015. Retrieved 31 May 2016.
- ^ Paton LJ, Beauchemin KA, Veira DM, von Keyserlingk MA (2006). «Use of sodium bicarbonate, offered free choice or blended into the ration, to reduce the risk of ruminal acidosis in cattle». Canadian Journal of Animal Science. 86 (3): 429–437. doi:10.4141/A06-014.
- ^ «Blast Away Grime With Baking Soda». Popular Mechanics. 5 August 2013. Retrieved 2 August 2020.
- ^ Housecroft CE, Sharpe AG (2008). «Chapter 22: d-block metal chemistry: the first row elements». Inorganic Chemistry, 3rd Edition. Pearson. p. 716. ISBN 978-0-13-175553-6.
- ^ «Science Lab.com». MSDS- Sodium carbonate. sciencelab.com. Archived from the original on 5 September 2012.
- ^ a b «Finishing Techniques in Metalwork». Philadelphia Museum of Art.
- ^ «Put a Shine on It». scifun.chem.wisc.edu. Archived from the original on 31 July 2012. Retrieved 6 March 2011.
- ^ Orcutt JA. «Depleted Uranium and Health: Facts and Helpful Suggestions». Pharmacology and Toxicology of Uranium Compounds. McGraw-Hill. Archived from the original on 17 January 2013. Retrieved 21 March 2012.
- ^ Raymond J (10 June 2016). «Kitchen Odor Eliminating Candles, Products, and Tricks». cravedujour.com. Archived from the original on 7 August 2020. Retrieved 29 June 2016.
- ^
Vicki Lansky, Martha Campbell, Baking Soda: Over 500 Fabulous, Fun, and Frugal Uses You’ve Probably Never Thought Of, 2009, ISBN 1931863733, p. 28 - ^ «A trusted solution for more than 170 years. Pure and simple.», Arm & Hammer «About Us» page
- ^ Keith Sawyer, Group Genius: The Creative Power of Collaboration, 2017, ISBN 0465093582, «keep food tasting fresh»
- ^ Clayton M. Christensen, Scott Cook, Taddy Hall, Marketing Malpractice: The Cause and the Cure, Harvard Business Review, December 2005, [1]
- ^ «Myth #100: An Open Box of Baking Soda in the Fridge absorbs Odors», Bruce Weinstein, Mark Scarbrough, Lobsters Scream When You Boil Them; And 100 Other Myths About Food and Cooking, 2011, ISBN 1439195382, p. 312
- ^ «Baking Soda as Odor Absorber | Cook’s Illustrated». Cooksillustrated.com. Retrieved 28 February 2022.
- ^ a b «Decomposition of Carbonates». General Chemistry Online. Archived from the original on 2 October 1999. Retrieved 16 March 2010.
- ^ PubChem. «Sodium bicarbonate». pubchem.ncbi.nlm.nih.gov. Retrieved 16 May 2021.
- ^ «Sodium bicarbonate (S300) batch numbering and shelf life statement – Solvay Chemicals, Inc» (PDF). 31 January 2019.
- ^ «Re: Shelf Life – Sodium Bicarbonate (all grades) – Tronox Alkali Corporation» (PDF). 1 April 2015.
- ^ «Does Baking Soda Go Bad? How to Know If It’s Still Good». The Spruce Eats. Retrieved 16 May 2021.
- ^ Renate Gerner: Instruments and substances used in mummification. In: Renate Gerner, Rosemarie Drenkhahn (ed.): Mumie und Computer. A multidisciplinary research project in Hanover. Special exhibition of the Kestner Museum Hanover from September 26, 1991 to January 19, 1992. Kestner Museum, Hanover 1991, ISBN 3-924029-17-2, p. 28 f.
- ^ Franz Dornseiff: «The Greek words in German.» Walter de Gruyter & Co, Berlin 1950, p. 44.
- ^ Friedrich Kluge, Alfred Götze (Philologist): Etymological Dictionary of the German Language. 20th edition, ed. by Walther Mitzka, De Gruyter, Berlin / New York 1967; Reprint (“21st unchanged edition”) ibid 1975, ISBN 3-11-005709-3, p. 504.
- ^ «Company History». Church & Dwight Co. Archived from the original on 16 October 2011.
- ^ Kipling R (1897). Captains Courageous. p. 25.
- ^ Bristow, Nancy K. (2012), American Pandemic: The Lost Worlds of the 1918 Influenza Epidemic, Oxford University Press, p. 178, ISBN 978-0199811342
- ^ Thieme C (2000). «Sodium Carbonates». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a24_299. ISBN 3527306730.
- ^ Holleman AF, Wiberg E (2001). Inorganic Chemistry. San Diego: Academic Press. ISBN 0-12-352651-5.
- ^ Page 45, section 3.6.2.1 of «Process Best Practices Reference Document (BREF) for Soda Ash,» report produced by the European Soda Ash Producer’s Association Archived 3 October 2006 at the Wayback Machine, March 2004.
- ^ «Duck Soup (1933)». IMDb. Retrieved 4 August 2015.
- ^ «A Night at the Opera (1935)». IMDb. Retrieved 4 August 2015.
Bibliography[edit]
- Haynes WM, ed. (2011). CRC Handbook of Chemistry and Physics (92nd ed.). CRC Press. ISBN 978-1439855119.
External links[edit]
- International Chemical Safety Card 1044
Пищевая добавка E500 (Карбонаты натрия) Карбонат натрия используется во многих отраслях промышленности: в мыловарении, в производстве бытовой химии. Пищевая добавка E500 незаменима при выпекании мучных изделий: пирожков, печенья и других блюд, а так же для поддержания кислотно-щелочного баланса организма человека в норме.
Дорогие читатели! Наши статьи рассказывают о типовых способах решения юридических вопросов, но каждый случай носит уникальный характер.
Если вы хотите узнать, как решить именно Вашу проблему — обращайтесь в форму онлайн-консультанта справа или звоните по телефону 8 (800) 302-76-94. Это быстро и бесплатно!
Показать содержание
- Что это такое?
Виды Описание и свойства К какому классу относится? Из чего и как получают карбонат и гидрокарбонат натрия (Е500ii)?
- Запрещено ли вещество в России и других странах?
- Как узнать, что оно есть в составе товара?
- Влияние на организм человека: опасен компонент или нет?
Есть ли польза? Возможный вред и меры предосторожности Допустимое суточное потребление (ДСП)
- Применение
В пищевой промышленности Для производства косметики В медицинской промышленности В других отраслях
- Варианты замены
Что это такое?
Справка. Карбонат натрия – это химическое соединение натриевой соли, получаемое из угольной кислоты по методу, выработанному химиком-инженером Эрнестом Соловье в 19 веке.
Производство карбоната натрия регулируется ГОСТом № 32802-2014, введенным 1 января 2016 года шестью странами:
- Киргизией;
- Россией;
- Белоруссией;
- Арменией;
- Таджикистаном;
- и Казахстаном.
Другое название добавки E500 – пищевая сода.
Виды
Пищевая сода подразделяется на три основных вида натриевой соли:
- E 500(i) – декагидрат (Na2Co310H2O) и моногидрат (Na2Co3 H2O) без содержания воды (натрий углекислый, Na2Co3). Это кальцинированная сода.
- E500 (ii) – гидрокарбонат натрия (NaHCO3).
- E 500(iii) – смесь двух химических соединений: гидрокарбоната и карбоната натрия (Na2CO3 NaHCO3 2H2O).
Порошок кальцинированной соды имеет гигроскопичную структуру, без включения атомов водорода.
Описание и свойства
Карбонаты натрия обладают следующими характеристиками:
| Название признака | Свойства |
| Оттенок | Белый |
| Плотность | (г/см) 2,16 |
| Запах | Не пахучий |
| Консистенция | Сыпучий порошок |
| Вкус | Солоноватый, с привкусом щелочи |
Химическо-физические показатели добавки E500 должны соответствовать требованиям ГОСТа № 32802-2014, приведенным в пункте 4. 1. 4 (таблица № 3), в которые входят следующие показатели:
- тест на натрий, карбонат, нерастворимые вещества, соли аммония;
- pH раствора E500 (ii) на H2O;
- массовая доля сухого вещества;
- доля потери массы вещества при высушивании, выраженная в %.
Справка! Для E500 (iii) измеряется норма железа, воды и хлористого натрия. Пищевая сода не растворяется в спирте, но хорошо взаимодействует с водой.
К какому классу относится?
Карбонаты натрия, согласно классификации пищевых добавок РФ, относятся к искусственным добавкам (эмульгаторам). Это вещество сохраняет консистенцию продуктов, не нарушая их структуры, нормализует влажность и препятствует «слеживанию и комкованию». Код E500 расшифровывается так:
- «E» обозначает статус вещества и принадлежность к определенной стране (Евросоюз).
- «500» обозначает под классовый номер химического вещества.
- (i), (ii), (iii) – римские цифры уточняют различия в добавках одной подгруппы.
Индификационный номер указывает на рамки применения химического соединения, в соответствии с безопасностью и правилами использования для улучшения качества продуктов питания.
Из чего и как получают карбонат и гидрокарбонат натрия (Е500ii)?
Справка. Солянка содоносная (Salsola soda) – это первое растение, из которого было получено соединение Na2CO3. В 18 веке кальцинированную соду добывали из золы растений, растущих в прибрежных водах, а так же из морских водорослей.
Добавку перерабатывали по способу Николы Леблана – французского химика:
- В определенных пропорциях смешивали мел, известняк, древесный уголь и глауберовою соль.
- Состав нагревали до 1000 C.
- Полученный уголь промывали водой для получения осадка карбоната натрия.
- Далее лишнюю жидкость выпаривали и перекристаллизовали.
- Полученный NaCl обрабатывали серной кислотой, а HCI отводили водой.
На выходе получалась соляная кислота.
В 19 веке был открыт промышленный способ добычи соды с помощью газообразных соединений CO2 и NH3.
- При вводе гидрокарбоната аммония в раствор хлорида натрия, выпадает осадок NaHCO3, который подвергается фильтрации и кальцинированию.
- При нагревании гидрокарбонат натрия переходит в карбонат натрия.
- Полученный оксид углерода возвращают в производство, а NH4Cl соединяют с Ca(OH)2 и получается аммиак.
- NH3 фильтруют, остается CaCl2.
Метод Соловье используется в современной промышленности.
В конце 30-ых годов 20 века Хоу Дебангом – китайским химиком был разработан новый способ получения кальцинированной соды. Метод схож с Соловье, но отличается.
- В подогретый раствор NaCl вводят аммиак и диоксид углерода.
- В полученном растворе появляется осадок гидрокарбоната натрия.
- Его охлаждают на 10 градусов, вследствие чего образуется хлорид аммония, который пускается на повторное производство.
Этот метод широко используется в Китае для выращивания риса.
Справка. E500 добывают как минерал в озерах Западной Сибири, Америке, Забайкалье.
В мире лидирует несколько крупных производителей соды:
- Англия: «Brunner Mond».
- Россия: «АО «Башкирская содовая компания».
- Турция: «Soda Sanayii AS».
- Китай: « Eastern United Nanjing Chemical Industries Group Co. Ltd».
- Бельгия: «Solvay».
Китай занимает первые позиции по добыче соды в мировом масштабе: более 60% от общего объема ежегодно.
Запрещено ли вещество в России и других странах?
Пищевая добавка E500 разрешена к использованию во всех странах:
- Австралии;
- США;
- Израиле;
- Малайзии;
- Великобритании и других странах.
Важно. Пищевые добавки, разрешенные к использованию, утверждает Минздрав РФ, а контролирует Роспотребнадзор.
Как узнать, что оно есть в составе товара?
Понять, присутствует ли в составе продукта сода, можно по маркировке E500 . Производители должны указывать полное обозначение, в соответствии с 4. 4. 1. ГОСТа No 32802-2014 РФ.
- На продуктах американского производства наносят маркировку Sodium carbonates.
- Во Франции: Carbonat de sodium.
- В Германии: Natriumcarbonat.
Влияние на организм человека: опасен компонент или нет?
В соответствии с ГОСТом 12. 1. 007-76, пищевая добавка E500 принадлежат к третьему классу опасности по степени воздействия на организм человека.
Важно. Пищевая сода не вызывает токсичных отравлений, не горит и взрывобезопасная.
Есть ли польза?
Добавка широко используется для лечения различных заболеваний и осложнений:
- при отравлениях кислотами;
- при гастрите;
- при язве;
- при ангине;
- при кашле;
- при химических ожогах.
Уровень pH E500 варьируется от 8 до 9 единиц.
Возможный вред и меры предосторожности
При употреблении большого количества соды могут появиться побочные эффекты:
- повышенное артериальное давление;
- судороги;
- аритмия;
- отеки конечностей;
- боль в животе.
Внимание. Соду не рекомендуется употреблять людям, страдающим аллергией, так как добавка может вызвать непереносимость.
Допустимое суточное потребление (ДСП)
Официальная норма потребления соды в сутки не установлена. Однако стоит не злоупотреблять добавкой в чрезмерных количествах.
Применение
Карбонат натрия в основном используют в пищевой промышленности для изготовления кондитерских и мучных изделий. Сода активно выводит углекислый газ из теста, вследствие чего изделие становится пышным, мягким и хорошо пропекается.
В пищевой промышленности
Добавка E500 увеличивает срок годности продуктов, так как бактерии и другие организмы не размножаются в щелочной среде. Карбонаты натрия используют не только для выпекания хлебобулочных изделий, но и для изготовления пищевых продуктов, согласно СанПину 2. 3. 2. 1293-03:
- Для шоколада и какао максимальная дозировка E500 в сухом и обезжиренном виде составляет 70 грамм на 1 кг.
- Для сухого, сгущенного и концентрированного молока берут норму гидрокарбоната натрия согласно ТИ.
Внимание. Карбонат натрия и чайная сода (NaHCO3)– это два различных соединения.
Чайную соду получают аммиачно-хлоридным методом.
Для производства косметики
Карбонат натрия обладает противовоспалительным отбеливающим эффектом, хорошо устраняет жирный блеск на коже, поэтому используется в косметических средствах:
- в лосьонах для лица;
- в зубных пастах («Dabur Промис»);
- в масках для лица (для жирной кожи).
Пищевую соду применяют для снижения лишнего веса при различных обертываниях и ваннах.
В медицинской промышленности
В основу некоторых лекарств входят натриевые соли угольной кислоты, так как большинство компонентов не усваиваются организмом в кислотной среде:
- препараты для лечения кашля;
- лекарства для внутривенных инфузий;
- растворы для обработки ран.
Важно! Соду используют для лечения грибковых заболеваний.
В других отраслях
Гидрокарбонат натрия применяется в производстве:
- стеклянных изделий;
- алюминия;
- целлюлозы;
- табачных изделий;
- при переработке нефтяных продуктов;
- с помощью Na2CO3 добывают ультрамарин;
- снижают уровень жесткости воды.
Варианты замены
Группа карбонатов имеет подгруппы, каждая из которых используется в продуктовой промышленности:
- Карбонаты калия (E501) Стабилизирует кислотность продукта.
- Карбонаты аммония (E503). В качестве разрыхлителя и регулятора кислотности.
- Карбонаты магния (E504). Стабилизируют цвет и консистенцию продукта.
Справка. Пищевую соду для выпечки заменяют алкогольными продуктами (спирт, ром), разрыхлителем теста.
Карбонаты натрия – это вещества, необходимые для производства товаров различных отраслей: от продуктов питания до строительства домов. E500 является неотъемлемым элементом при добыче золота и изготовления алюминия.
Это быстро и бесплатно!
Гидрокарбонат натрия (бытовое название – «питьевая сода») – неорганическое вещество, представляет собой кислую натриевую соль угольной кислоты. Прочие названия — двууглекислый натрий и бикарбонат натрия. Химическая формула соединения — NaHCO3. Внешне гидрокарбонат натрия выглядит как белый порошок с привкусом соли. При попадании на слизистые и в дыхательные пути может вызывать раздражение.
Свойства
Вещество при взаимодействии с водой образует слабый раствор щелочи. Вступая в реакцию с кислотами, питьевая сода образует соли, соответствующие данным кислотам, и выделяет углекислоту. В процессе реакции она распадается на воду и углекислый газ. Такую реакцию можно провести даже в бытовых условиях, если «погасить» соду уксусной эссенцией или раствором лимонной кислоты.
Применение
Пищевая сода востребована в быту, медицине и многих отраслях промышленности:
- химия;
- пищевое производство;
- металлургия;
- производство текстиля;
- фармацевтика.
Вещество входит в состав продуктов как пищевая добавка E500. Применяется в производстве газированных напитков, кулинарных и хлебобулочных изделий. При изготовлении теста в промышленных и бытовых условиях пищевая сода выполняет роль разрыхлителя, благодаря которому выпечка поднимается и получается пышной.
В текстильной промышленности NaHCO3 используют в производстве тканей из шелка и хлопка, при изготовлении резины, искусственной кожи. Благодаря щелочной реакции пищевая сода задействована в процессе дубления натуральной кожи, чтобы нейтрализовать кислоту.
В медицине раствор соды применяют для промывания и полоскания при заболеваниях зубов и десен, верхних дыхательных путей. При приеме внутрь сода действует как антацид, снижая кислотность желудочного сока. Внутривенно раствор соды применяют при метаболическом ацидозе. Средство быстро снижает уровень кальция и калия в плазме крови, повышает содержание натрия. Внутривенное введение также используется при лечении пациентов с передозировкой антидепрессантов, нейролептиков, при отравлениях кокаином.
Гидрокарбонат натрия включают в состав ингаляционных растворов, используют в косметологии и для домашнего ухода за внешностью.
Сода используется в химической индустрии для изготовления средств бытовой химии, красителей, пенопластов, реагентов для пожаротушения.
Пищевая сода, чайная (sodium bicarbonate), бикарбонат натрия или натрий двууглекислый — всем доступное вещество, нетоксичное, обладает рядом удивительно полезных и даже целебных свойств. Она всегда широко применяется в быту, а в последнее время стали много говорить об исцеляющих свойствах соды чайной.
Химическая формула пищевой соды
Сода пищевая, чайная — гидрокарбонат, бикарбонат натрия или двууглекислый натрий. Химическая формула NaHCO3 – кислая соль угольной кислоты, широко применяется в лёгкой, пищевой промышленности и быту.
Уникальные бактерицидные, противовоспалительные свойства природной соды были известны ещё с древних времён и применялись в лечении различных болезней и недугов не только у людей, но и у животных.
Есть мнение, что даже слегка солоноватый вкус нашей крови объясняется присутствием в ней не поваренной соли, а именно гидрокарбоната натрия. Сода наравне с водой и солью всегда присутствовала в жизни живых организмов и даже в их составе!
Содой давно лечились на Востоке. Ю.Н. Рерих в своей работе «По тропам Срединной Азии» описывает, как лечили верблюдов содовым раствором, после их сильнейшего отравления неизвестной травой. Сода спасла животных от неминуемой смерти.
Уникальные свойства пищевой соды
Среди простых людей бытует мнение, что длительный приём соды внутрь вредит слизистой оболочке желудка. И данное мнение поддерживается многими медиками. Особенно нешуточные страсти в последнее время разгорелись вокруг пищевой соды. Попробуем разобраться в фактах, говорящих о пользе соды и заодно об научных экспериментах над ней.
В лаборатории одного из медицинских ВУЗов Белоруссии ещё в советское время были проведены опыты и научно доказано, что сода не влияет на кислотно-выделительную функцию желудка, и её применение возможно, как при пониженной, так и при повышенной кислотности желудочного сока.
Целебные свойства соды, её доступность, неограниченный срок хранения и сегодня позволяют использовать пищевую соду в лечении практических всех болезней! Сода справляется даже там, где другие лекарства бессильны. Столь мощное воздействие на организм объясняется способность пищевой соды ощелачивать организм. Кислая среда в организме — отличная среда микроорганизмам, вызывающим болезни и воспалительные процессы.
Остановимся чуть подробней на вопросе кислотно-щёлочного баланса в организме.
Кислотно-щелочная среда организма. Какой должен быть показатель
Человеческий организм состоит из щелочей и кислот, при этом в здоровом организме щелочей должно быть в 3-4 раза больше. Данное соотношение определяется уровнем рН. По этому показателю можно судить о состоянии нашего с вами здоровье.
При рождении рH крови человека 7,5-7,3. С возрастом этот показатель из-за несоблюдения правильного образа жизни, избыточного питания, вредного влияния внешней среды, уменьшается. В здоровом организме взрослого человека показатель кислотности рH крови должен находиться в пределах 7,35 — 7,45, что встречается крайне редко, в большинстве случаем не превышает 7,15 — 7,20, а при показателе ниже, чем в 6,8 (очень кислая кровь) наступает смерть человека, так называемый ацидоз (БСЭ, т.12, с. 200).
Причины закисления организма человека
Причины возникновения дисбаланса кислотно-щелочного уровня в организме, приводящие к болезням:
- неправильное питание, в котором много белковой пищи и мало растительной;
- фаст фуд, продукты с высоким содержанием консервантов, пищевых добавок, усилителей вкуса, крахмала, сахара;
- загрязнённый воздух, плохая вода, бесконтрольное применение лекарств;
- негативные эмоции, стресс, злоба, беспокойство, негодование, ненависть;
- потеря психической энергии приводит к болезням. Поэтому в древнем учении Агни-йоги для восстановления энергетических центров и психики, для профилактики многих болезней рекомендовано принимать пищевую соду ежедневно.
Делаем вывод: в кислом организме легко уживаются все болезни, в щелочном наоборот — организм выздоравливает! Так что мы должны стремиться к ощелачиванию своего организма, в чём нам успешно и помогает обычная чайная сода.
Важно! Однако, чтобы начать лечение содой, стоит проконсультироваться с врачом и помнить, что каждый организм индивидуален. Поэтому начинаем приём осторожно, наблюдая за реакцией организма!
 Сода пищевая лечение и приём внутрь
Сода пищевая лечение и приём внутрь
Температура содовых растворов для внутреннего применения должна быть слегка горячей, и ни в коем случае не холодной! Гасим соду горячей водой при температуре +60º С.
При такой температуре гидрокарбонат натрия (та самая пищевая сода из пачки) распадается на карбонат натрия (кальцинированная сода), углекислый газ и воду:
2NaHCO3→ Na2CO3+H2O+Co2↑
Не путать здесь кальцинированную соду, полученную в реакции (молекулярный вид) от технической кальцинированной соды, продающейся в магазинах!
Ещё лучше применять соду в горячем t+ 60º молоке , что способствует лучшему всасыванию её в кровь.
Как холодное молоко не соединяется с тканями, так горячее — с содой, проникает в центры клеток. Елена Рерих
Концентрация соды в растворе строго индивидуальна для каждого организма своя. Начинать можно с 15 ч.л., или даже с 1-2 грамм, растворяя их в горячей жидкости, при температуре 60 градусов и постепенно доводить дозу до 1 ч.л. Хотя в некоторых источниках указана доза до 2 ч.л.
Переизбыток соды в холодной воде не осваивается и вызывает понос. Это свойство используется как слабительное. Ещё важная особенность соды в том, что избыток её всегда выводится из организма с мочёй.
!Единственное ограничение: следует воздержаться от применения соды в период обострения желудочно-кишечных заболеваний.!
- Смягчает кашель и облегчает отхождение мокроты. Даже детям полезно принимать при кашле горячее молоко чуть выше парного (около 400) с добавлением ½ ч. ложки соды на стакан молока. Можно к этому добавить пол ложечки мёда и кусочек сливочного масла;
- Лечит морскую болезнью благодаря своему воздействию на вестибулярный аппарат;
- Пищевая сода положительно влияет на работу сердца, улучшает сердцебиение и устраняет аритмию;
- Выщелачивает, растворяет все виды вредных отложений в суставах, вылечивая остеохондроз, артрит, артроз, полиартрит, радикулит, ревматизм, подагру;
- Гидрокарбонат натрия избавляет от мочекаменной болезни, от камней в печени, почках, желчном пузыре, кишечнике.
- Применяется сода при лечении алкоголизма, наркомании, токсикомании;
- Лечит рак при соблюдении режима питания (нужно исключить из питания молочные продукты, которые засоряют лимфоток и сахар, питающий раковые клетки). Ещё в 60-х годах прошлого века на закрытой конференции были указаны причины всё больше набиравшего обороты заболевания — рак: закисление организма. И были указаны пути борьбы с онкологией — ощелачивание организма, которое легко осуществляется с помощью пищевой соды. Но врачи не спешат делится этим открытием со своими пациентами, назначая дорогие препараты и рекомендуя нестерпимые процедуры, вплоть до облучения. И понятно, что даже поборов рак, после подобного лечения человек обречён на другие недуги.
- Сода снимает изжогу (хотя врачи настоятельно рекомендуют не злоупотреблять содой, так как в ответ на действие соды в желудке образуется ещё больше кислоты). Это так, если применять соду во время пищеварения, а если пить соду на пустой желудок, то механизм действия совершенно иной: сода, являясь антацидом (антикислотным препаратом), попадая в нейтральную среду желудка (именно такая кислотность желудочного сока при пустом желудке) нейтрализует избыточную кислоту и приводит кислотность в нормальное состояние.
- Медицина широко использует инъекции содового раствора при лечении различных лёгочных заболеваний и дыхательной системы, осложнённых инфарктом миокарда.
- Сода при ослаблении организма, при упадке сил, усталости дает заряд эритроцитам, тем самым поднимает жизненный тонус.
Чем отличается сода пищевая (чайная) от кальцинированной промышленно произведённой
Давайте внесём ясность в этом вопросе. По вышеприведённой формуле реакции, видно, что гидрокарбонат натрия (бикарбонат натрия) пищевая сода под воздействием температуры распадается на карбонат натрия (кальцинированная сода молекулярный вид!) Na2CO3 воду Н2О и углекислый газ СО2.
Сода же кальцинированная, та, что продаётся в магазинах — сухое вещество, изготовленное промышленным способом, с более высокой концентрацией натрия (нет воды и углекислого газа). Помимо того
- У промышленной кальцинированной более высокий показатель ph-11 — это сильная щёлочь, тогда как у соды пищевой — он равен 8.
- Имеет иные добавки в своём составе для усиления эффекта очищения и воздействия на предметы, которые недопустимы в питании (например Е-550).
- Непищевое соединение рекомендовано к применению для иных бытовых нужд, для использования в пищу есть отличное средство — пищевая чайная сода.
- Конечно, кальцинированная сода не несёт таких вредных последствий для организма как каустическая сода, ещё более концентрированная, но всё же важно быть острожным и защищать свою слизистую при работе с ней.
Лечение содой по Неумывакину. Как принимать соду
Профессор Иван Неумывакин даёт целый рад консультаций о благотворном влиянии соды на организм, о процессе ощелачивания и борьбы с ацидозом. На Yoy Tube доступны видеоролики с его участием.
Если изложить кратко, то раствор соды готовится следующим образом:
Начинаем приём постепенно привыкая к соде, с 14 чайной ложки и постепенно доводим в течение недели до полной ложки. Добавлю здесь, концентрация соды зависит от того, что вы лечите или принимаете для профилактики болезней. И ещё, все мы индивидуальны, потому полную ложку соды может всё же многовато. Смотрим на свои ощущения.
Соду растворяем в горячей воде или ещё лучше в горячем молоке 60 º небольшим объемом. Затем разводим холодной жидкость до нужного объема. Достаточно полстакана или стакан, принимаем тёплый раствор за 20 минут до еды.
Наружное применение пищевой соды 
- Отбеливает зубы при ежедневном полоскании полости рта горячим раствором соды. Эффект усиливается, если в раствор добавить несколько капель перекиси водорода;
- При укусах насекомых смазывают места укуса содовой кашицей.
- Лечит грибковые заболевания кожи. Простой доступный рецепт: 1/2 чайной ложки соды, капля столового уксуса и капля йода, всё перемешать и при помощи ватной палочки нанести на пораженный ноготь. Делать процедуру 2 раза в день: утром и вечером. Проверьте, будет ли ваш ноготь действительно здоров?
- При лёгких ожогах нужно тут же посыпать соду на больное место;
- Спринцевания содой при молочнице поможет устранить зуд и творожистые выделения. Дважды в день нужно проводить процедуру подмывания и спринцевания раствором из расчёта 1ч.л. соды на 1 литр кипячёной тёплой воды. Процедуру проделываем ежедневно, 14 дней подряд. Молочницу лечат оба партнёра, лучше воздержаться от близости в период лечения. от близости.
- Сода поможет в зачатии! В благоприятные для зачатия дни приготовьте раствор: 1 ч. л. порошка на пол литра теплой воды, полностью растворите соду и аккуратно проспринцуйтесь. Сода благотворно воздействует на вашу слизистую, способствует оплодотворению. Главное: проводите процедуру за пол часа до полового акта.
- Не хотите беременности — проспринцуйтесь сразу после полового акта. Содовый раствор будет способствовать вымыванию сперматозоидов и нейтрализации среды.
- Заметен эффект воздействия соды при избавлении от курения. Если прополоскать рот крепким содовым раствором (4 ч.л. на стакан) и закурить, то возникает отвращению к сигарете.
- Внутривенные содовые инъекции позволяют вывести человека даже из диабетической комы!
- Более того, сода благотворно действует на общую нейтрализацию организма, повышает его щелочные резервы и оздоравливая.
Содовые ванны
Очень полезным является приём содовых ванн. Они способствуют таким улучшениям, как:
- улучшению психического состояния человека,
- помогают избавлению от стресса,
- повышают мужскую потенцию,
- снимают кожные высыпания,
- выводят из организма радионуклиды.
- Доказано воздействие соды на снижение веса организма. Для этого нужно принимать содовые ванны с концентрацией до 1 пачки. И лишний жир пусть не сразу, медленно, но уйдёт с ваших боков! Но не стоит ждать чуда от 2-3 ванн. Процесс похудения должен сопровождаться ограничениями себя в питании, физической нагрузкой и постепенно вы заметите результат.
Концентрация подобных ванн следующая. Начинаем с дозы от 7 столовых ложек, доведя до пачки (500 гр.) на ванну воды. Время воздействия 20-40 минут для профилактики этих нарушений.
Использование пищевой соды в инъекциях
Уже с прошлого века врачи начали использовать соду в инъекциях при определённых заболеваниях.
Натрий гидрокарбонат можно приобрести в аптеке в следующих лекарственных формах:
— 4% — 5% раствор в ампулах по 20 мл для инъекций;
— суппозитории по 0,3, 0,5, 0,7 г;
— таблетки по 0,3 и 0,5 г.
Внутривенные инъекции натрия гидрокарбоната осуществляется 3% или 5% раствором по 50-100 мл.
Как видим, спектр применения пищевой соды очень велик. Возникает вопрос, а чем же можно объяснить столь благотворное воздействие соды на организм? Химическим составом этого вещества? Но он предельно прост. А может, в чем-то ином скрыты эти её истинно необыкновенные свойства? Читаем далее В чём тайна соды?
Всё больше людей пробуют на себе лечение и профилактику пищевой содой. И всё больше среди них положительных результатов.
В заключении, предлагаю вашему вниманию видеоролик о том, как побороть рак с помощью пищевой соды. Смотрите всю правду о раке и делайте выводы! Рак излечим с помощью обычной соды. Много видео на Ютюбе о собственном выздоровлении.
Начиная то или иное лечение, изучите тщательно вопрос, чтобы избежать ошибок. Прислушивайтесь к себе, меняя дозировку, корректируя рекомендованные советы. Помните, мы все уникальны!
Оставляйте ваши комментарии и будьте взаимно вежливы. Если ваше мнение расходится с изложенным, приводите свои доводы обосновано, сдерживайте, пожалуйста, свои эмоции.
Будьте здоровы, берегите себя.




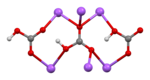



 Сода пищевая лечение и приём внутрь
Сода пищевая лечение и приём внутрь

