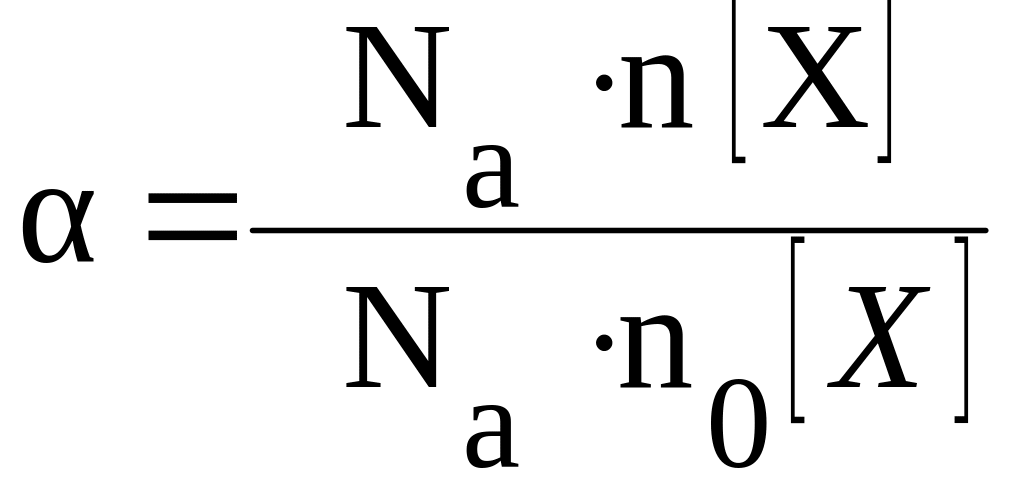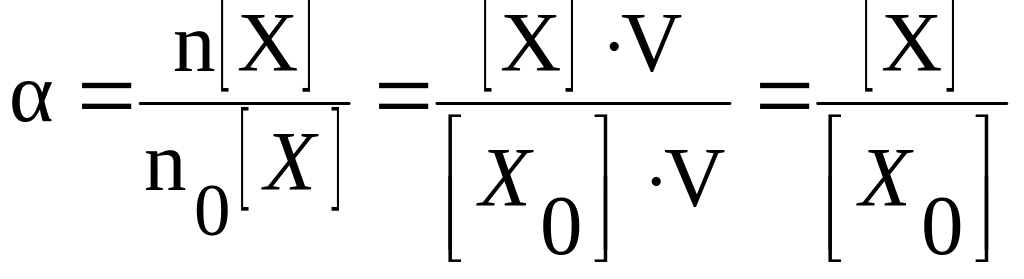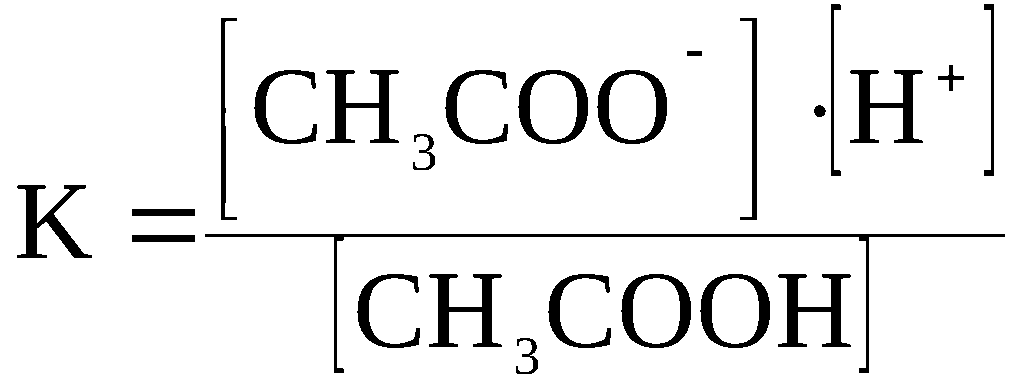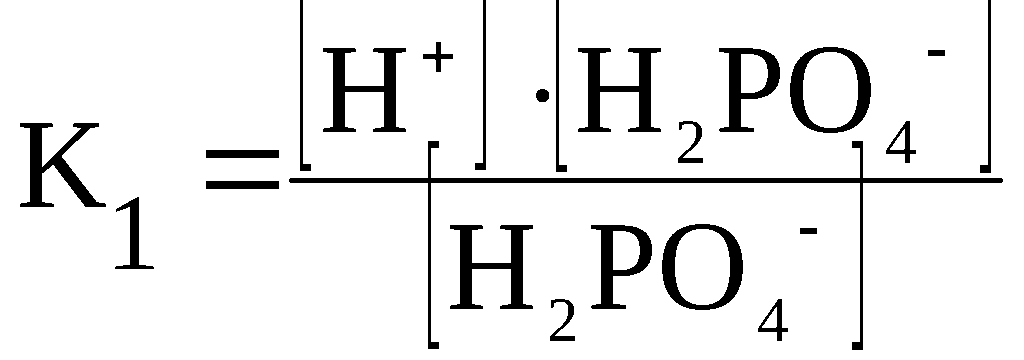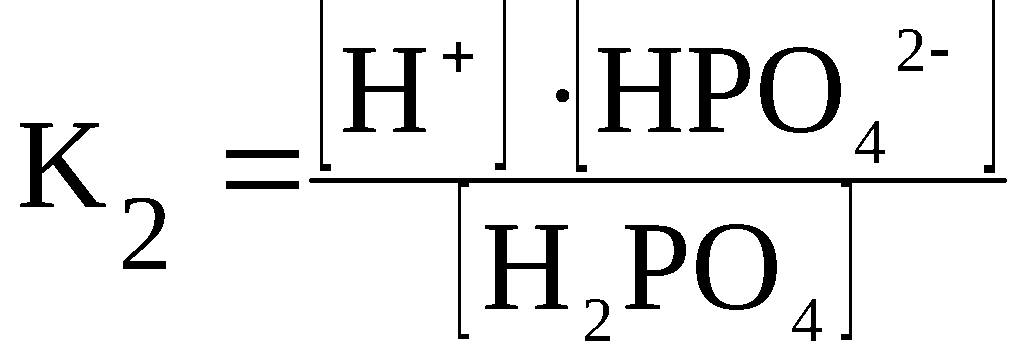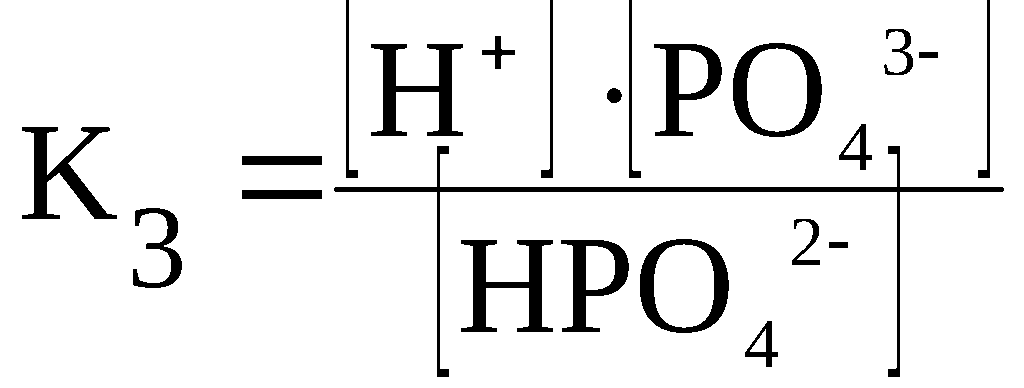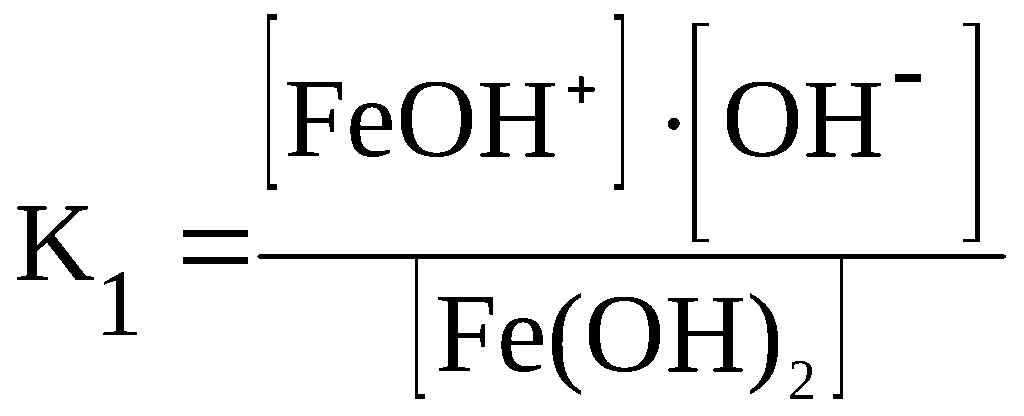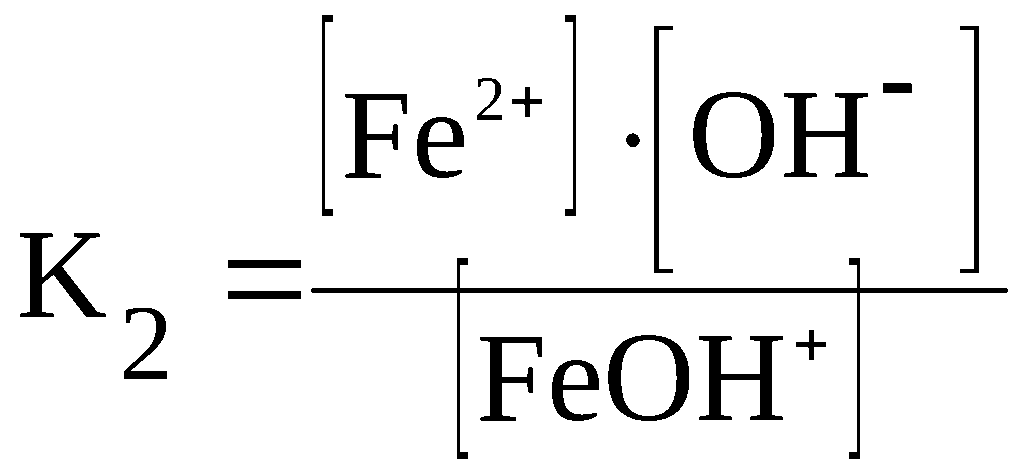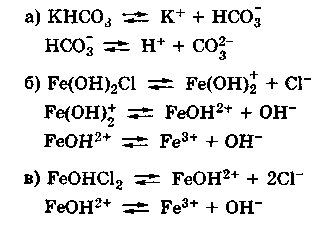Материалы из методички: Сборник задач по теоретическим основам химии для студентов заочно-дистанционного отделения / Барботина Н.Н., К.К. Власенко, Щербаков В.В. – М.: РХТУ им. Д.И. Менделеева, 2007. -155 с.
Степень диссоциации
Классификация электролитов
Диссоциация электролитов
Константа диссоциации
Примеры решения задач
Задачи для самостоятельного решения
Степень диссоциации
Вещества, которые в растворах или расплавах полностью или частично распадаются на ионы, называются электролитами.
Степень диссоциации α — это отношение числа молекул, распавшихся на ионы N′ к общему числу растворенных молекул N:
α = N′/N
Степень диссоциации выражают в процентах или в долях единицы. Если α =0, то диссоциация отсутствует и вещество не является электролитом. В случае если α =1, то электролит полностью распадается на ионы.
Классификация электролитов
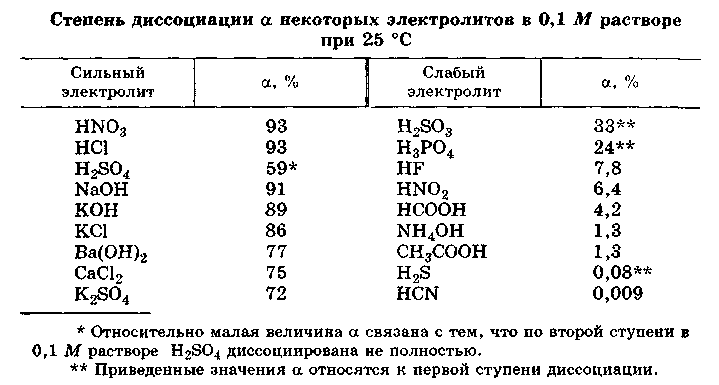
Согласно современным представлениям теории растворов все электролиты делятся на два класса: ассоциированные (слабые) и неассоциированные (сильные). Неассоциированные электролиты в разбавленных растворах практически полностью диссоциированы на ионы. Для этого класса электролитов a близко к единице (к 100 %). Неассоциированными электролитами являются, например, HCl, NaOH, K2SO4 в разбавленных водных растворах.
Ассоциированные электролиты подразделяются на три типа:
-
-
- Слабые электролиты существуют в растворах как в виде ионов, так и в виде недиссоциированных молекул. Примерами ассоциированных электролитов этой группы являются, в частности, Н2S, Н2SO3, СН3СOОН в водных растворах.
- Ионные ассоциатыобразуются в растворах путем ассоциации простых ионов за счет электростатического взаимодействия. Ионные ассоциаты возникают в концентрированных растворах хорошо растворимых электролитов. В результате в растворе находятся как простые ионы, так и ионные ассоциаты. Например, в концентрированном водном растворе КCl образуются простые ионы К+, Cl— , а также возможно образование ионных пар (К+Cl— ), ионных тройников (K2Cl+, KCl2— ) и ионных квадруполей (K2Cl2, KCl32- , K3Cl2+).
- Комплексные соединения(как ионные, так и молекулярные), внутренняя сфера которых ступенчато диссоциирует на ионные и (или) молекулярные частицы.
Примеры комплексных ионов: [Cu(NH3)4]2+, [Fe(CN)6]3+, [Cr(H2O)3Cl2]+.
-
При таком подходе один и тот же электролит может относиться к различным типам в зависимости от концентрации раствора, вида растворителя и температуры. Подтверждением этому являются данные, приведенные в таблице.
Таблица. Характеристика растворов KI в различных растворителях
| Концентрация электролита, С, моль/л | Температура
t,оС |
Растворитель | Тип электролита |
| 0,01 | 25 | Н2О | Неассоциированный (сильный) |
| 5 | 25 | Н2О | Ионный ассоциат |
| 0,001 | 25 | С6Н6 | Ассоциированный (слабый) |
Приближенно, для качественных рассуждений можно пользоваться устаревшим делением электролитов на сильные и слабые. Выделение группы электролитов “средней силы” не имеет смысла. Эти электролиты являются ассоциированными. К слабым электролитам обычно относят электролиты, степень диссоцииации которых мала α<<1.
Таким образом, к сильным электролитам относятся разбавленные водные растворы почти всех хорошо растворимых в воде солей, многие разбавленные водные растворы минеральных кислот (НСl, HBr, НNО3, НСlO4 и др.), разбавленные водные растворы гидроксидов щелочных металлов. К слабым электролитам принадлежат все органические кислоты в водных растворах, некоторые водные растворы неорганических кислот, например, H2S, HCN, H2CO3, HNO2, HСlO и др. К слабым электролитам относится и вода.
Диссоциация электролитов
Уравнение реакции диссоциации сильного электролита можно представить следующим образом. Между правой и левой частями уравнения реакции диссоциации сильного электролита ставится стрелка или знак равенства:
HCl → H+ + Cl—
Na2SO3 = 2Na+ + SO32-
Допускается также ставить знак обратимости, однако в этом случае указывается направление, в котором смещается равновесие диссоциации, или указывается, что α≈1. Например:
NaOH → Na+ + OH—
Диссоциация кислых и основных солей в разбавленных водных растворах протекает следующим образом:
NaHSO3 → Na+ + HSO3—
Анион кислой соли будет диссоциировать в незначительной степени, поскольку является ассоциированным электролитом:
HSO3— → H+ + SO32-
Аналогичным образом происходит диссоциация основных солей:
Mg(OH)Cl → MgOH+ + Cl—
Катион основной соли подвергается дальнейшей диссоциации как слабый электролит:
MgOH+ → Mg2+ + OH—
Двойные соли в разбавленных водных растворах рассматриваются как неассоциированные электролиты:
KAl(SO4)2 → K+ + Al3+ + 2SO42-
Комплексные соединения в разбавленных водных растворах практически полностью диссоциируют на внешнюю и внутреннюю сферы:
K3[Fe(CN)6] → 3K+ + [Fe(CN)6]3-
В свою очередь, комплексный ион в незначительной степени подвергается дальнейшей диссоциации:
[Fe(CN)6]3- → Fe3+ + 6CN—
Константа диссоциации
При растворении слабого электролита КА в растворе установится равновесие:
КА ↔ К+ + А—
которое количественно описывается величиной константы равновесия Кд, называемой константой диссоциации:
Kд = [К+] · [А—] /[КА] (2)
Константа диссоциации характеризует способность электролита диссоциировать на ионы. Чем больше константа диссоциации, тем больше ионов в растворе слабого электролита. Например, в растворе азотистой кислоты HNO2 ионов Н+ больше, чем в растворе синильной кислоты HCN, поскольку К(HNO2) = 4,6·10— 4, а К(HCN) = 4,9·10— 10.
Для слабых I-I электролитов (HCN, HNO2, CH3COOH) величина константы диссоциации Кд связана со степенью диссоциации α и концентрацией электролита c уравнением Оствальда:
Кд = (α2·с)/(1-α) (3)
Для практических расчетов при условии, что α<<1 используется приближенное уравнение:
Кд = α2·с (4)
Поскольку процесс диссоциации слабого электролита обратим, то к нему применим принцип Ле Шателье. В частности, добавление CH3COONa к водному раствору CH3COOH вызовет подавление собственной диссоциации уксусной кислоты и уменьшение концентрации протонов. Таким образом, добавление в раствор ассоциированного электролита веществ, содержащих одноименные ионы, уменьшает его степень диссоциации.
Следует отметить, что константа диссоциации слабого электролита связана с изменением энергии Гиббса в процессе диссоциации этого электролита соотношением:
ΔGT0 = — RTlnKд (5)
Уравнение (5) используется для расчета констант диссоциации слабых электролитов по термодинамическим данным.
Примеры решения задач
Задача 1. Определите концентрацию ионов калия и фосфат-ионов в 0,025 М растворе K3PO4.
Решение. K3PO4 – сильный электролит и в водном растворе диссоциирует полностью:
K3PO4 → 3К+ + РО43-
Следовательно, концентрации ионов К+ и РО43- равны соответственно 0,075М и 0,025М.
Задача 2. Определите степень диссоциации αд и концентрацию ионов ОН— (моль/л) в 0,03 М растворе NH3·H2О при 298 К, если при указанной температуре Кд(NH3·H2О) = 1,76× 10— 5.
Решение. Уравнение диссоциации электролита:
NH3·H2О → NH4+ + OH—
Концентрации ионов: [NH4+] = αС ; [OH—] = αС , где С – исходная концентрация NH3·H2О моль/л. Следовательно:
Kд = αС · αС /(1 — αС)
Поскольку α << 1, то:
Кд ≈ α 2С
Константа диссоциации зависит от температуры и от природы растворителя, но не зависит от концентрации растворов NH3·H2О. Закон разбавления Оствальда выражает зависимость α слабого электролита от концентрации.
α = √(Кд / С) = √(1,76× 10— 5 / 0,03) = 0,024 или 2,4 %
[OH—] = αС, откуда [OH— ] = 2,4·10— 2·0,03 = 7,2·10-4 моль/л.
Задача 3. Определите константу диссоциации уксусной кислоты, если степень диссоциации CH3CОOH в 0,002 М растворе равна 9,4 %.
Решение. Уравнение диссоциации кислоты:
CH3CОOH → СН3СОО— + Н+.
α = [Н+] / Сисх(CH3CОOH)
откуда [Н+] = 9,4·10—2·0,002 = 1,88·10-4 М.
Так как [CH3CОO—] = [Н+] и [CH3CОOH] ≈ Сисх(CH3CОOH), то:
Kд = [Н+]2 / Сисх(CH3CОOH)
Константу диссоциации можно также найти по формуле: Кд ≈ α 2С.
Задача 4. Константа диссоциации HNO2 при 298К равна 4,6× 10— 4. Найдите концентрацию азотистой кислоты, при которой степень диссоциации HNO2 равна 5 %.
Решение.
Кд =α 2С , откуда получаем Сисх(HNO2) = 4,6·10— 4/(5·10— 2)2 = 0,184 М.
Задача 5. На основе справочных данных рассчитайте константу диссоциации муравьиной кислоты при 298 К.
Решение. Уравнение диссоциации муравьиной кислоты
НСООН →Н+ + СООН—
В “Кратком справочнике физико–химических величин” под редакцией А.А. Равделя и А.М. Пономаревой приведены значения энергий Гиббса образований ионов в растворе, а также гипотетически недиссоциированных молекул. Значения энергий Гиббса для муравьиной кислоты и ионов Н+ и СООН— в водном растворе приведены ниже:
| Вещество, ион | НСООН | Н+ | СООН— |
| ΔGT0, кДж/моль | — 373,0 | 0 | — 351,5 |
Изменение энергии Гиббса процесса диссоциации равно:
ΔGT0 = — 351,5- (- 373,0) = 21,5 кДж/моль.
Для расчета константы диссоциации используем уравнение (5). Из этого уравнения получаем:
lnKд = — Δ GT0/RT= — 21500/(8,31 298) = — 8,68
Откуда находим: Kд = 1,7× 10— 4.
Задачи для самостоятельного решения
1. К сильным электролитам в разбавленных водных растворах относятся:
- СН3СOOH
- Na3PO4
- NaCN
- NH3
- C2H5OH
- HNO2
- HNO3
13.2. К слабым электролитам в водных растворах относятся:
- KAl(SO4)2
- NaNO3
- HCN
- NH4Cl
- C2H5OH
- H2SO3
- H2SO4
3. Определите концентрацию ионов NH4+ в 0,03 М растворе (NH4)2Fe(SO4)2;
4. Определите концентрацию ионов водорода в 6 мас.% растворе H2SO4, плотность которого составляет 1,038 г/мл. Принять степень диссоциации кислоты по первой и второй ступеням равной 100 %.
5. Определите концентрацию гидроксид-ионов в 0,15 М растворе Ba(OH)2.
6. Степень диссоциации муравьиной кислоты в 0,1 М растворе равна 4 %. Рассчитайте Концентрацию ионов водорода в этом растворе и константу диссоциации НСООН.
7. Степень диссоциации муравьиной кислоты в водном растворе увеличится при:
а) уменьшении концентрации HCOOH;
б) увеличении концентрации HCOOH;
в) добавлении в раствор муравьиной кислоты HCOONa;
г) добавлении в раствор муравьиной кислоты НCl.
8. Константа диссоциации хлорноватистой кислоты равна 5× 10— 8. Определите концентрацию HClO, при которой степень диссоциации HClO равна 0,5 %, и концентрацию ионов Н+ в этом растворе.
9. Вычислите объем воды, который необходимо добавить к 50 мл 0,02 М раствора NH3·H2О, чтобы степень диссоциации NH3·H2О увеличилась в 10 раз, если Кд(NH4OH) = 1,76·10— 5.
10. Определите степень диссоциации азотистой кислоты в 0,25 М растворе при 298 К, если при указанной температуре Кд(HNO2) = 4,6× 10— 4.
Изучая
свойства растворов электролитов, С.
Аррениус ввёл понятие «степень
диссоциации», предположив, что некоторые
электролиты не могут полностью
диссоциировать на ионы.
Степенью
диссоциации называется отношение
числа молекул, распавшихся в растворе
на ионы, к общему числу молекул электролита
в растворе.
|
|
(1) |
где:
N(X)
– число продиссоциировавших молекул
электролита X;
N0(X)
– общее число молекул электролита X
в растворе.
Степень
диссоциации ()
зависит от следующих факторов:
– от
природы электролита и растворителя;
– концентрации
электролита;
– температуры.
Степень
диссоциации можно также выразить через
количество вещества по формуле:
|
|
(2) |
где
n(X)
– количество молей продиссоциировавшего
вещества X;
n0б(X)
– общее количество молей вещества X
в растворе;
Na
–
число Авогадро.
Количество вещества
можно выразить через молярную концентрацию
раствора и объём раствора, поэтому
степень диссоциации можно также
определить как отношение молярной
концентрации продиссоциировавшего
вещества к молярной концентрации всего
вещества, находящегося в растворе.
|
|
( |
где
[Х] – молярная концентрация
продиссоциировавшего вещества X;
[Х0]
– общая молярная концентрация вещества
X
в растворе.
Электролиты
можно разделить на 2 большие группы:
электролиты сильные и слабые.
Сильные
электролиты
диссоциируют в растворах полностью и
процесс диссоциации необратим:
HNO3
H+
+ NO3–
. Из этого следует, что степень
диссоциации сильного электролита равна
1.
Сильными
электролитами являются:
–все
растворимые соли;
– гидроксиды
щелочных и щелочно-земельных металлов
(NaOH,
KOH,
Ba(OH)2;
– некоторые
кислоты (H2SO4,
HNO3,
HCl,
HBr,
HI.
Для
слабых электролитов степень диссоциации
α < 1,
поскольку слабые электролиты диссоциируют
лишь частично, и
процесс диссоциации обратим, т.е.
в растворе устанавливается динамическое
равновесие между ионами и
непродиссоциировавшими молекулами.
Основные
слабые электролиты:
– вода
H2O;
– гидроксиды
Al(OH)3;
Обратимый
характер диссоциации слабых электролитов
отражается при записи уравнений.
CH3COOH
⇆
CH3COO–
+ H+
H3PO4
⇆
H+
+ H2PO4–
H2PO4–
⇆
H+
+ HPO42–
HPO42–
⇆
H+
+ PO43–
4 Константа диссоциации
К
равновесию, которое устанавливается в
растворе слабого электролита между
молекулами и ионами, можно применить
законы химического равновесия и записать
выражение константы равновесия.
Ниже
приводится выражение константы равновесия
для процесса диссоциации уксусной
кислоты CH3COOH
⇆
CH3COO–
+ H+.
К
онстанта
равновесия, соответствующая процессу
диссоциации слабого электролита,
называется
константой
диссоциации.
Величина
константы диссоциации зависит от природы
электролита и растворителя, температуры,
но не зависит от концентрации электролита
в растворе.
Она
характеризует способность данной
кислоты или данного основания распадаться
на ионы: чем легче электролит диссоциирует
на ионы, тем больше константа диссоциации.
Константа
диссоциации является справочной
величиной.
Ступенчатая
диссоциация электролитов. Многоосновные
кислоты и многокислотные основания
диссоциируют ступенчато.
Каждая
стадия ступенчатой диссоциации
многоосновной кислоты характеризуется
своей константой диссоциации.
H3PO4
⇆
H+
+ H2PO4–
H2PO4–
⇆
H+
+ HPO42–
HPO42–
⇆
H+
+ PO43–
Аналогичные
соотношения характеризуют и ступенчатую
диссоциацию оснований многовалентных
металлов.
Fe(OH)2
⇆
FeOH+
+ OH–
F
eOH+
⇆
Fe2+
+ OH–
При
ступенчатой диссоциации веществ распад
по первой ступени всегда происходит в
гораздо большей степени, чем по второй;
по второй стадии – больше, чем по третьей
и т.д. Иначе говоря, соблюдается
неравенство:
K1
>> K2
> K3
> … .
Это
объясняется тем, что энергия, необходимая
для отрыва иона от нейтральной молекулы,
меньше, чем от заряженной частицы.
Например, отрыв иона H+
будет происходить более легко от
нейтральной частицы – молекулы H3PO4,
чем от отрицательно заряженного иона
H2PO4–.
В свою очередь, отрыв иона H+
от однозарядного иона H2PO4–
требует меньшей энергии, чем от
двухзарядного иона HPO4–.
Кислые
и основные соли также диссоциируют
ступенчато, например:
Нетрудно заметить,
что диссоциация гидроаниона или
гидроксокатиона идентична второй или
третьей ступени диссоциации соответствующих
кислоты или основания и потому подчиняется
тем же закономерностям, которые были
сформулированы для ступенчатой
диссоциации кислот и оснований. В
частности, если основная соль
соответствует слабому основанию, а
кислая соль — слабой кислоте, то диссоциация
гидроаниона или гидроксокатиона (т. е.
вторая или третья ступень диссоциации
соли) протекает в незначительной степени.
Во всякой
кислородсодержащей кислоте и во всяком
основании (имеются в виду кислоты и
основания в традиционном понимании)
имеются гидроксогруппы. Разница между
кислотой и основанием заключается в
том, что в первом случае диссоциация
происходит по связи ЭО—Н, а во втором
— по связи Э—ОН.
Амфотерные
гидроксиды диссоциируют и как основания,
и как кислоты (и те и другие очень слабые).
Так, ионизацию гидроксида цинка можно
представить следующей схемой (без учета
гидратации образующихся ионов):
Прибавление кислоты
смещает эти равновесия влево, а
прибавление щелочи — вправо. Поэтому
в кислой среде преобладает диссоциация
по типу основания, а в щелочной — по
типу кислоты. В обоих случаях связывание
в молекулы воды ионов, образующихся
при диссоциации малорастворимого
амфотерного электролита, вызывает
переход в раствор новых порций таких
ионов, их связывание, переход в раствор
новых ионов и т. д. Следовательно,
растворение такого электролита происходит
как в растворе кислоты, так и в растворе
щелочи.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Электролитической диссоциацией называют процесс, в ходе которого молекулы растворенного вещества
распадаются на ионы в результате взаимодействия с растворителем (воды). Диссоциация является обратимым процессом.
Диссоциация обуславливает ионную проводимость растворов электролитов. Чем больше молекул вещества распадается на ионы, тем
лучше оно проводит электрический ток и является более сильным электролитом.
В общем виде процесс электролитической диссоциации можно представить так:
KA ⇄ K+ (катион) + A— (анион)
NaCl ⇄ Na+ + Cl—

Замечу, что сила кислоты определяется способностью отщеплять протон. Чем легче кислота его отщепляет, тем она сильнее.
У HF крайне затруднен процесс диссоциации из-за образования водородных связей между F (самым электроотрицательным элементом) одной молекулы
и H другой молекулы.
Ступени диссоциации
Некоторые вещества диссоциируют на ионы не в одну стадию (как NaCl), а ступенчато. Это характерно для многоосновных кислот: H2SO4,
H3PO4.
Посмотрите на ступенчатую диссоциацию ортофосфорной кислоты:

Важно заметить, что концентрация ионов на разных ступенях разная. На первых ступенях ионов всегда много, а до последних доходят не все молекулы.
Поэтому в растворе ортофосфорной кислоты концентрация дигидрофосфат-анионов будет больше, чем фосфат-анионов.
Для серной кислоты диссоциация будет выглядеть так:

Для средних солей диссоциация чаще всего происходит в одну ступень:
Na3PO4 ⇄ 3Na+ + PO43-
Из одной молекулы ортофосфата натрия образовалось 4 иона.
K2SO4 ⇄ 2K+ + SO42-
Из одной молекулы сульфата калия образовалось 3 иона.
Электролиты и неэлектролиты
Химические вещества отличаются друг от друга по способности проводить электрический ток. Исходя из этой способности,
вещества делятся на электролиты и неэлектролиты.

Электролиты — жидкие или твердые вещества, в которых присутствуют ионы, способные перемещаться и проводить электрический
ток. Связи в их молекулах обычно ионные или ковалентные сильнополярные.
К ним относятся соли, сильные кислоты и щелочи (растворимые основания).
Степень диссоциации сильных электролитов составляет от 0,3 до 1, что означает 30-100% распад молекул, попавших в раствор, на ионы.

Неэлектролиты — вещества недиссоциирующие в растворах на ионы. В молекулах эти веществ связи ковалентные неполярные или слабополярные.
К неэлектролитам относятся многие органические вещества, слабые кислоты, нерастворимые в воде основания и гидроксид аммония.
Степень их диссоциации до 0 до 0.3, то есть в растворе неэлектролита на ионы распадается до 30% молекул. Они плохо или вообще не проводят
электрический ток.

Молекулярное, полное и сокращенное ионные уравнения
Молекулярное уравнение представляет собой запись реакции с использованием молекул. Это те уравнения, к которым мы привыкли и которыми
наиболее часто пользуемся. Примеры молекулярных уравнений:

Полные ионные уравнения записываются путем разложения молекул на ионы. Запомните, что нельзя раскладывать на ионы:
- Слабые электролиты (в их числе вода)
- Осадки
- Газы

Сокращенное ионное уравнение записывается путем сокращения одинаковых ионов из левой и правой части. Просто, как в математике — остается только то,
что сократить нельзя.

© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Слабые и сильные электролиты. Степень диссоциации
Электролитическая диссоциация в той или иной степени – процесс обратимый. Но при растворении некоторых соединений равновесие диссоциации в значительной степени смещено в сторону диссоциируемой формы. В растворах таких электролитов диссоциация протекает практически необратимо. Поэтому при написании уравнений диссоциации таких веществ пишется или знак равенства или прямая стрелка, обозначающая, что реакция происходит практически необратимо.
I. Степень электролитической диссоциации
Посмотрите видео-презентацию: “Степень электролитической диссоциации”
Поскольку электролитическая диссоциация — процесс обратимый, то в растворах электролитов наряду с их ионами присутствуют и молекулы. Другими словами, различные электролиты, согласно теории С. Аррениуса, диссоциируют на ионы в различной степени. Полнота распада (сила электролита) характеризуется количественной величиной – степенью диссоциации.
Степень диссоциации (α – греческая буква альфа) — это отношение числа молекул, распавшихся на ионы (n), к общему числу растворенных молекул (N):
Степень диссоциации электролита определяется опытным путем и выражается в долях единицы или в процентах. Если α = 0, то диссоциация отсутствует, а если α = 1 или 100%, то электролит полностью распадается на ионы. Если же α = 20%, то это означает, что из 100 молекул данного электролита 20 распалось на ионы.
Степень диссоциации зависит от природы электролита и растворителя, от концентрации электролита, температуры.
1. Зависимость степени диссоциации от природы: чем полярнее химическая связь в молекуле электролита и растворителя, тем сильнее выражен процесс диссоциации электролита на ионы и тем выше значение степени диссоциации.
2. Зависимость степени диссоциации от концентрации электролита: с уменьшением концентрации электролита, т.е. при разбавлении его водой, степень диссоциации всегда увеличивается.
3. Зависимость степени диссоциации от температуры: степень диссоциации возрастает при повышении температуры (повышение температуры приводит к увеличению кинетической энергии растворённых частиц, что способствует распаду молекул на ионы).
II. Сильные и слабые электролиты
В зависимости от степени диссоциации различают электролиты сильные и слабые. Электролиты со степенью диссоциации больше 30% обычно называют сильными, со степенью диссоциации от 3 до 30% — средними, менее 3% — слабыми электролитами.
Классификация электролитов в зависимости от степени электролитической диссоциации (памятка)
|
Классификация электролитов |
Сильные электролиты |
Средние электролиты |
Слабые электролиты |
|
Значение степени диссоциации (α) |
α>30% |
3%≤α≤30% |
α<3% |
|
Примеры |
1. Растворимые соли 2. Сильные кислоты: НСl, HBr, HI, НNО3, НClO4, Н2SO4(разб.) 3. Сильные основания – щёлочи |
H3PO4 H2SO3 |
1. Почти все органические кислоты CH3COOH, C2H5COOH и др. 2. Некоторые неорганические кислоты H2CO3, H2S и др. 3. Почти все малорастворимые в воде соли, основания и гидроксид аммония (Ca3(PO4)2; Cu(OH)2; Al(OH)3; NH4OH) 4. Вода |
Определение сильных и слабых электролитов
III. Тренажёр
«Сильные и слабые электролиты»
ЦОРы
Видео-презентация: “Степень электролитической диссоциации”
Видео:Зависимость степени диссоциации от концентрации электролита
Видео: Зависимость степени диссоциации от температуры
Определение сильных и слабых электролитов