|
||
|
||
| Identifiers | ||
|---|---|---|
|
CAS Number |
|
|
|
3D model (JSmol) |
|
|
| ChEBI |
|
|
| ChEMBL |
|
|
| ChemSpider |
|
|
| DrugBank |
|
|
| ECHA InfoCard | 100.028.896 |
|
| EC Number |
|
|
| KEGG |
|
|
|
PubChem CID |
|
|
| RTECS number |
|
|
| UNII |
|
|
| UN number | 1564 | |
|
CompTox Dashboard (EPA) |
|
|
|
InChI
|
||
|
SMILES
|
||
| Properties | ||
|
Chemical formula |
BaSO4 | |
| Molar mass | 233.39 g/mol | |
| Appearance | white crystalline | |
| Odor | odorless | |
| Density | 4.49 g/cm3 | |
| Melting point | 1,580 °C (2,880 °F; 1,850 K) | |
| Boiling point | 1,600 °C (2,910 °F; 1,870 K) (decomposes) | |
|
Solubility in water |
0.2448 mg/100 mL (20 °C) 0.285 mg/100 mL (30 °C) |
|
|
Solubility product (Ksp) |
1.0842 × 10−10 (25 °C) | |
| Solubility | insoluble in alcohol,[1] soluble in concentrated, hot sulfuric acid | |
|
Magnetic susceptibility (χ) |
−71.3·10−6 cm3/mol | |
|
Refractive index (nD) |
1.636 (alpha) | |
| Structure | ||
|
Crystal structure |
orthorhombic | |
| Thermochemistry | ||
|
Heat capacity (C) |
101.7 J/(mol K) | |
|
Std molar |
132 J/(mol·K)[2] | |
|
Std enthalpy of |
−1465 kJ/mol[2] | |
| Pharmacology | ||
|
ATC code |
V08BA01 (WHO) | |
|
Routes of |
by mouth, rectal | |
| Pharmacokinetics: | ||
|
Bioavailability |
negligible by mouth | |
|
Excretion |
rectal | |
| Legal status |
|
|
| Hazards | ||
| GHS labelling: | ||
|
Precautionary statements |
P260, P264, P270, P273, P314, P501 | |
| NFPA 704 (fire diamond) |
0 0 0 |
|
| Flash point | noncombustible[3] | |
| NIOSH (US health exposure limits): | ||
|
PEL (Permissible) |
TWA 15 mg/m3 (total) TWA 5 mg/m3 (resp)[3] | |
|
REL (Recommended) |
TWA 10 mg/m3 (total) TWA 5 mg/m3 (resp)[3] | |
|
IDLH (Immediate danger) |
N.D.[3] | |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Barium sulfate (or sulphate) is the inorganic compound with the chemical formula BaSO4. It is a white crystalline solid that is odorless and insoluble in water. It occurs as the mineral barite, which is the main commercial source of barium and materials prepared from it. The white opaque appearance and its high density are exploited in its main applications.[4]
Uses[edit]
Drilling fluids[edit]
About 80% of the world’s barium sulfate production, mostly purified mineral, is consumed as a component of oil well drilling fluid. It increases the density of the fluid,[5] increasing the hydrostatic pressure in the well and reducing the chance of a blowout.
Radiocontrast agent[edit]
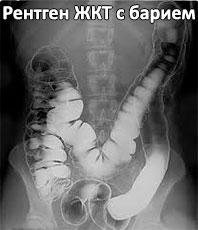
Barium sulfate in suspension is often used medically as a radiocontrast agent for X-ray imaging and other diagnostic procedures. It is most often used in imaging of the GI tract during what is colloquially known as a «barium meal». It is administered orally, or by enema, as a suspension of fine particles in a thick milk-like solution (often with sweetening and flavoring agents added). Although barium is a heavy metal, and its water-soluble compounds are often highly toxic, the low solubility of barium sulfate protects the patient from absorbing harmful amounts of the metal. Barium sulfate is also readily removed from the body, unlike Thorotrast, which it replaced. Due to the relatively high atomic number (Z = 56) of barium, its compounds absorb X-rays more strongly than compounds derived from lighter nuclei.
Pigment[edit]
The majority of synthetic barium sulfate is used as a component of white pigment for paints. In oil paint, barium sulfate is almost transparent[citation needed], and is used as a filler or to modify consistency. One major manufacturer of artists’ oil paint sells «permanent white» that contains a mixture of titanium white pigment (TiO2) and barium sulfate. The combination of barium sulfate and zinc sulfide (ZnS) is the inorganic pigment called lithopone. In photography it is used as a coating for certain photographic papers.[5]
It is also used as a coating to diffuse light evenly.
Heat-reflecting paint[edit]
Barium sulfate is highly reflective, of both visible and ultraviolet light.[6] Researchers used it as an ingredient in paint that reflects 98.1% of all solar radiation, thus cooling surfaces to which it has been applied. This contrasts with commercially available white paints which can only reflect 80 — 90% of the sunlight.[7] By using hexagonal nanoplatelet boron nitride, the thickness of a coating was reduced to 1.5 mm.[6]
Paper brightener[edit]
A thin layer of barium sulfate called baryta is first coated on the base surface of most photographic paper to increase the reflectiveness of the image, with the first such paper introduced in 1884 in Germany.[8] The light-sensitive silver halide emulsion is then coated over the baryta layer. The baryta coating limits the penetration of the emulsion into the fibers of the paper and makes the emulsion more even, resulting in more uniform blacks.[9] Further coatings may then be present for fixing and protection of the image. Baryta has also been used to brighten papers intended for ink-jet printing.[10]
Plastics filler[edit]
Barium sulfate is commonly used as a filler for plastics to increase the density of the polymer in vibrational mass damping applications. In polypropylene and polystyrene plastics, it is used as a filler in proportions up to 70%. It has an effect of increasing acid and alkali resistance and opacity. Such composites are also used as X-ray shielding materials due to their enhanced radio-opacity.[11] For some particular applications, composites with high mass fraction (70–80%) of barium sulfate may be preferred to the more commonly used steel shields.[clarification needed][citation needed]
Niche uses[edit]
Barium sulfate is used in soil testing. Tests for soil pH and other qualities of soil use colored indicators, and small particles (usually clay) from the soil can cloud the test mixture and make it hard to see the color of the indicator. Barium sulfate added to the mixture binds with these particles, making them heavier so they fall to the bottom, leaving a clearer solution.
In colorimetry, barium sulfate is used as a near-perfect diffuser when measuring light sources.
In metal casting, the moulds used are often coated with barium sulfate in order to prevent the molten metal from bonding with the mould.
It is also used in brake linings, anacoustic foams, powder coatings, and root canal filling.
Barium sulfate is an ingredient in the «rubber» pellets used by Chilean police.[12] This together with silica helps the pellet attain a 96.5 shore A hardness.[12]
Catalyst support[edit]
Barium sulfate is used as a catalyst support when selectively hydrogenating functional groups that are sensitive to overreduction. With a low surface area, the contact time of the substrate with the catalyst is shorter and thus selectivity is achieved. Palladium on barium sulfate is also used as a catalyst in the Rosenmund reduction.
Pyrotechnics[edit]
As barium compounds emit a characteristic green light when heated at high temperature, barium salts are often used in green pyrotechnic formulas, although nitrate and chlorate salts are more common. Barium sulfate is commonly used as a component of «strobe» pyrotechnic compositions.
Copper industry[edit]
As barium sulfate has a high melting point and is insoluble in water, it is used as a release material in casting of copper anode plates. The anode plates are cast in copper molds, so to avoid the direct contact of the liquid copper with the solid copper mold, a suspension of fine barium sulfate powder in water is used as a coating on the mold surface. Thus, when the molten copper solidifies in form of an anode plate it can be easily released from its mold.
Radiometric measurements[edit]
Barium sulfate is sometimes used (or else PTFE) to coat the interior of integrating spheres due to the high reflectance of the material and near Lambertian characteristics.
Production[edit]
Almost all of the barium consumed commercially is obtained from barite, which is often highly impure. Barite is processed by thermo-chemical sulfate reduction (TSR), also known as carbothermal reduction (heating with coke) to give barium sulfide:
- BaSO4 + 4 C → BaS + 4 CO
In contrast to barium sulfate, barium sulfide is soluble in water and readily converted to the oxide, carbonate, and halides. To produce highly pure barium sulfate, the sulfide or chloride is treated with sulfuric acid or sulfate salts:
- BaS + H2SO4 → BaSO4 + H2S
Barium sulfate produced in this way is often called blanc fixe, which is French for «permanent white». Blanc fixe is the form of barium encountered in consumer products, such as paints.[5]
In the laboratory barium sulfate is generated by combining solutions of barium ions and sulfate salts. Because barium sulfate is the least toxic salt of barium due to its insolubility, wastes containing barium salts are sometimes treated with sodium sulfate to immobilize (detoxify) the barium. Barium sulfate is one of the most insoluble salts of sulfate. Its low solubility is exploited in qualitative inorganic analysis as a test for Ba2+ ions, as well as for sulfate.
Untreated raw materials such as natural baryte formed under hydrothermal conditions may contain many impurities, a.o., quartz, or even amorphous silica.[13]
History[edit]
Barium sulfate is reduced to barium sulfide by carbon. The accidental discovery of this conversion many centuries ago led to the discovery of the first synthetic phosphor.[4] The sulfide, unlike the sulfate, is water-soluble.
During the early part of the 20th century, during the Japanese colonization period, hokutolite was found to exist naturally in the Beitou hot-springs area near Taipei City, Taiwan. Hokutolite is a radioactive mineral composed mostly of PbSO4 and BaSO4, but also containing traces of uranium, thorium and radium. The Japanese harvested these elements for industrial uses, and also developed dozens of “therapeutic hot-spring baths” in the area.[14]
Safety aspects[edit]
Although soluble salts of barium are moderately toxic to humans, barium sulfate is nontoxic due to its insolubility. The most common means of inadvertent barium poisoning arises from the consumption of soluble barium salts mislabeled as BaSO4. In the Celobar incident (Brazil, 2003), nine patients died from improperly prepared radiocontrast agent. In regards to occupational exposures, the Occupational Safety and Health Administration set a permissible exposure limit at 15 mg/m3, while the National Institute for Occupational Safety and Health has a recommended exposure limit at 10 mg/m3. For respiratory exposures, both agencies have set an occupational exposure limit at 5 mg/m3.[15]
See also[edit]
- List of inorganic pigments
- Baryte
References[edit]
- ^ CRC Handbook of Chemistry and Physics (85th ed.). CRC Press. 2004. pp. 4–45. ISBN 0-8493-0485-7.
- ^ a b Zumdahl, Steven S. (2009). Chemical Principles (6th ed.). Houghton Mifflin Company. ISBN 978-0-618-94690-7.
- ^ a b c d NIOSH Pocket Guide to Chemical Hazards. «#0047». National Institute for Occupational Safety and Health (NIOSH).
- ^ a b Holleman, A. F. and Wiberg, E. (2001) Inorganic Chemistry, San Diego, CA : Academic Press, ISBN 0-12-352651-5.
- ^ a b c Kresse, Robert; Baudis, Ulrich; Jäger, Paul; Riechers, H. Hermann; Wagner, Heinz; Winkler, Jochen; Wolf, Hans Uwe (2007). «Barium and Barium Compounds». Ullmann’s Encyclopedia of Industrial Chemistry. doi:10.1002/14356007.a03_325.pub2. ISBN 978-3-527-30673-2.
- ^ a b Puiu, Tibi (2022-10-04). «World’s whitest paint is now thin enough to coat and cool down cars, trains and planes». ZME Science. Retrieved 2022-10-12.
- ^ Wiles, Kayla (September 16, 2021). «Purdue record for the whitest paint appears in latest edition of ‘Guinness World Records’«. www.purdue.edu. Retrieved 2022-10-12.
- ^ The Getty Conservation Institute, Silver Gelatin. The Atlas of Analytical Signatures of Photographic Processes. J. Paul Getty Trust, 2013.
- ^ Salvaggio, Nanette L. Basic Photographic Materials and Processes. Taylor & Francis US, Oct 27, 2008. p. 362.
- ^ Nikitas, Theano. «Inkjet papers that will give your photos pizzazz: are you and your clients bored with your photo prints? check out our favorite fine-art and specialty inkjet papers that are sure to make your images stand out.» Photo District News July 2012: 36+. General Reference Center GOLD. Web. 3 Nov. 2012.
- ^ Lopresti, Mattia; Alberto, Gabriele; Cantamessa, Simone; Cantino, Giorgio; Conterosito, Eleonora; Palin, Luca; Milanesio, Marco (28 January 2020). «Light Weight, Easy Formable and Non-Toxic Polymer-Based Composites for Hard X-ray Shielding: A Theoretical and Experimental Study». International Journal of Molecular Sciences. 21 (3): 833. doi:10.3390/ijms21030833. PMC 7037949. PMID 32012889.
- ^ a b «Investigación U. de Chile comprueba que perdigones usados por Carabineros contienen solo 20 por ciento de goma». Universidad de Chile. November 18, 2019. Retrieved June 29, 2020.
- ^ Fedele, L.; Todesca, R.; Boni, M. (1 February 2003). «Barite-silica mineralization at the inter-Ordovician unconformity in southwestern Sardinia (Italy): a fluid inclusion study». Mineralogy and Petrology. 77 (3–4): 197–213. Bibcode:2003MinPe..77..197F. doi:10.1007/s00710-002-0200-9. S2CID 129874363.
- ^ Chu, Tieh-Chi; Wang, Jeng-long (2000). «Radioactive Disequilihrium of Uranium and Thorium Nuclide Series in Hot Spring and River Water from Peitou Hot Spring Basin in Taipei». Journal of Nuclear and Radiochemical Sciences. 1 (1): 5–10. doi:10.14494/jnrs2000.1.5.
- ^ «Barium Sulfate». NIOSH Pocket Guide to Chemical Hazards. Centers for Disease Control and Prevention. April 4, 2011. Retrieved November 18, 2013.

|
||
|
||
| Identifiers | ||
|---|---|---|
|
CAS Number |
|
|
|
3D model (JSmol) |
|
|
| ChEBI |
|
|
| ChEMBL |
|
|
| ChemSpider |
|
|
| DrugBank |
|
|
| ECHA InfoCard | 100.028.896 |
|
| EC Number |
|
|
| KEGG |
|
|
|
PubChem CID |
|
|
| RTECS number |
|
|
| UNII |
|
|
| UN number | 1564 | |
|
CompTox Dashboard (EPA) |
|
|
|
InChI
|
||
|
SMILES
|
||
| Properties | ||
|
Chemical formula |
BaSO4 | |
| Molar mass | 233.39 g/mol | |
| Appearance | white crystalline | |
| Odor | odorless | |
| Density | 4.49 g/cm3 | |
| Melting point | 1,580 °C (2,880 °F; 1,850 K) | |
| Boiling point | 1,600 °C (2,910 °F; 1,870 K) (decomposes) | |
|
Solubility in water |
0.2448 mg/100 mL (20 °C) 0.285 mg/100 mL (30 °C) |
|
|
Solubility product (Ksp) |
1.0842 × 10−10 (25 °C) | |
| Solubility | insoluble in alcohol,[1] soluble in concentrated, hot sulfuric acid | |
|
Magnetic susceptibility (χ) |
−71.3·10−6 cm3/mol | |
|
Refractive index (nD) |
1.636 (alpha) | |
| Structure | ||
|
Crystal structure |
orthorhombic | |
| Thermochemistry | ||
|
Heat capacity (C) |
101.7 J/(mol K) | |
|
Std molar |
132 J/(mol·K)[2] | |
|
Std enthalpy of |
−1465 kJ/mol[2] | |
| Pharmacology | ||
|
ATC code |
V08BA01 (WHO) | |
|
Routes of |
by mouth, rectal | |
| Pharmacokinetics: | ||
|
Bioavailability |
negligible by mouth | |
|
Excretion |
rectal | |
| Legal status |
|
|
| Hazards | ||
| GHS labelling: | ||
|
Precautionary statements |
P260, P264, P270, P273, P314, P501 | |
| NFPA 704 (fire diamond) |
0 0 0 |
|
| Flash point | noncombustible[3] | |
| NIOSH (US health exposure limits): | ||
|
PEL (Permissible) |
TWA 15 mg/m3 (total) TWA 5 mg/m3 (resp)[3] | |
|
REL (Recommended) |
TWA 10 mg/m3 (total) TWA 5 mg/m3 (resp)[3] | |
|
IDLH (Immediate danger) |
N.D.[3] | |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Barium sulfate (or sulphate) is the inorganic compound with the chemical formula BaSO4. It is a white crystalline solid that is odorless and insoluble in water. It occurs as the mineral barite, which is the main commercial source of barium and materials prepared from it. The white opaque appearance and its high density are exploited in its main applications.[4]
Uses[edit]
Drilling fluids[edit]
About 80% of the world’s barium sulfate production, mostly purified mineral, is consumed as a component of oil well drilling fluid. It increases the density of the fluid,[5] increasing the hydrostatic pressure in the well and reducing the chance of a blowout.
Radiocontrast agent[edit]
Barium sulfate in suspension is often used medically as a radiocontrast agent for X-ray imaging and other diagnostic procedures. It is most often used in imaging of the GI tract during what is colloquially known as a «barium meal». It is administered orally, or by enema, as a suspension of fine particles in a thick milk-like solution (often with sweetening and flavoring agents added). Although barium is a heavy metal, and its water-soluble compounds are often highly toxic, the low solubility of barium sulfate protects the patient from absorbing harmful amounts of the metal. Barium sulfate is also readily removed from the body, unlike Thorotrast, which it replaced. Due to the relatively high atomic number (Z = 56) of barium, its compounds absorb X-rays more strongly than compounds derived from lighter nuclei.
Pigment[edit]
The majority of synthetic barium sulfate is used as a component of white pigment for paints. In oil paint, barium sulfate is almost transparent[citation needed], and is used as a filler or to modify consistency. One major manufacturer of artists’ oil paint sells «permanent white» that contains a mixture of titanium white pigment (TiO2) and barium sulfate. The combination of barium sulfate and zinc sulfide (ZnS) is the inorganic pigment called lithopone. In photography it is used as a coating for certain photographic papers.[5]
It is also used as a coating to diffuse light evenly.
Heat-reflecting paint[edit]
Barium sulfate is highly reflective, of both visible and ultraviolet light.[6] Researchers used it as an ingredient in paint that reflects 98.1% of all solar radiation, thus cooling surfaces to which it has been applied. This contrasts with commercially available white paints which can only reflect 80 — 90% of the sunlight.[7] By using hexagonal nanoplatelet boron nitride, the thickness of a coating was reduced to 1.5 mm.[6]
Paper brightener[edit]
A thin layer of barium sulfate called baryta is first coated on the base surface of most photographic paper to increase the reflectiveness of the image, with the first such paper introduced in 1884 in Germany.[8] The light-sensitive silver halide emulsion is then coated over the baryta layer. The baryta coating limits the penetration of the emulsion into the fibers of the paper and makes the emulsion more even, resulting in more uniform blacks.[9] Further coatings may then be present for fixing and protection of the image. Baryta has also been used to brighten papers intended for ink-jet printing.[10]
Plastics filler[edit]
Barium sulfate is commonly used as a filler for plastics to increase the density of the polymer in vibrational mass damping applications. In polypropylene and polystyrene plastics, it is used as a filler in proportions up to 70%. It has an effect of increasing acid and alkali resistance and opacity. Such composites are also used as X-ray shielding materials due to their enhanced radio-opacity.[11] For some particular applications, composites with high mass fraction (70–80%) of barium sulfate may be preferred to the more commonly used steel shields.[clarification needed][citation needed]
Niche uses[edit]
Barium sulfate is used in soil testing. Tests for soil pH and other qualities of soil use colored indicators, and small particles (usually clay) from the soil can cloud the test mixture and make it hard to see the color of the indicator. Barium sulfate added to the mixture binds with these particles, making them heavier so they fall to the bottom, leaving a clearer solution.
In colorimetry, barium sulfate is used as a near-perfect diffuser when measuring light sources.
In metal casting, the moulds used are often coated with barium sulfate in order to prevent the molten metal from bonding with the mould.
It is also used in brake linings, anacoustic foams, powder coatings, and root canal filling.
Barium sulfate is an ingredient in the «rubber» pellets used by Chilean police.[12] This together with silica helps the pellet attain a 96.5 shore A hardness.[12]
Catalyst support[edit]
Barium sulfate is used as a catalyst support when selectively hydrogenating functional groups that are sensitive to overreduction. With a low surface area, the contact time of the substrate with the catalyst is shorter and thus selectivity is achieved. Palladium on barium sulfate is also used as a catalyst in the Rosenmund reduction.
Pyrotechnics[edit]
As barium compounds emit a characteristic green light when heated at high temperature, barium salts are often used in green pyrotechnic formulas, although nitrate and chlorate salts are more common. Barium sulfate is commonly used as a component of «strobe» pyrotechnic compositions.
Copper industry[edit]
As barium sulfate has a high melting point and is insoluble in water, it is used as a release material in casting of copper anode plates. The anode plates are cast in copper molds, so to avoid the direct contact of the liquid copper with the solid copper mold, a suspension of fine barium sulfate powder in water is used as a coating on the mold surface. Thus, when the molten copper solidifies in form of an anode plate it can be easily released from its mold.
Radiometric measurements[edit]
Barium sulfate is sometimes used (or else PTFE) to coat the interior of integrating spheres due to the high reflectance of the material and near Lambertian characteristics.
Production[edit]
Almost all of the barium consumed commercially is obtained from barite, which is often highly impure. Barite is processed by thermo-chemical sulfate reduction (TSR), also known as carbothermal reduction (heating with coke) to give barium sulfide:
- BaSO4 + 4 C → BaS + 4 CO
In contrast to barium sulfate, barium sulfide is soluble in water and readily converted to the oxide, carbonate, and halides. To produce highly pure barium sulfate, the sulfide or chloride is treated with sulfuric acid or sulfate salts:
- BaS + H2SO4 → BaSO4 + H2S
Barium sulfate produced in this way is often called blanc fixe, which is French for «permanent white». Blanc fixe is the form of barium encountered in consumer products, such as paints.[5]
In the laboratory barium sulfate is generated by combining solutions of barium ions and sulfate salts. Because barium sulfate is the least toxic salt of barium due to its insolubility, wastes containing barium salts are sometimes treated with sodium sulfate to immobilize (detoxify) the barium. Barium sulfate is one of the most insoluble salts of sulfate. Its low solubility is exploited in qualitative inorganic analysis as a test for Ba2+ ions, as well as for sulfate.
Untreated raw materials such as natural baryte formed under hydrothermal conditions may contain many impurities, a.o., quartz, or even amorphous silica.[13]
History[edit]
Barium sulfate is reduced to barium sulfide by carbon. The accidental discovery of this conversion many centuries ago led to the discovery of the first synthetic phosphor.[4] The sulfide, unlike the sulfate, is water-soluble.
During the early part of the 20th century, during the Japanese colonization period, hokutolite was found to exist naturally in the Beitou hot-springs area near Taipei City, Taiwan. Hokutolite is a radioactive mineral composed mostly of PbSO4 and BaSO4, but also containing traces of uranium, thorium and radium. The Japanese harvested these elements for industrial uses, and also developed dozens of “therapeutic hot-spring baths” in the area.[14]
Safety aspects[edit]
Although soluble salts of barium are moderately toxic to humans, barium sulfate is nontoxic due to its insolubility. The most common means of inadvertent barium poisoning arises from the consumption of soluble barium salts mislabeled as BaSO4. In the Celobar incident (Brazil, 2003), nine patients died from improperly prepared radiocontrast agent. In regards to occupational exposures, the Occupational Safety and Health Administration set a permissible exposure limit at 15 mg/m3, while the National Institute for Occupational Safety and Health has a recommended exposure limit at 10 mg/m3. For respiratory exposures, both agencies have set an occupational exposure limit at 5 mg/m3.[15]
See also[edit]
- List of inorganic pigments
- Baryte
References[edit]
- ^ CRC Handbook of Chemistry and Physics (85th ed.). CRC Press. 2004. pp. 4–45. ISBN 0-8493-0485-7.
- ^ a b Zumdahl, Steven S. (2009). Chemical Principles (6th ed.). Houghton Mifflin Company. ISBN 978-0-618-94690-7.
- ^ a b c d NIOSH Pocket Guide to Chemical Hazards. «#0047». National Institute for Occupational Safety and Health (NIOSH).
- ^ a b Holleman, A. F. and Wiberg, E. (2001) Inorganic Chemistry, San Diego, CA : Academic Press, ISBN 0-12-352651-5.
- ^ a b c Kresse, Robert; Baudis, Ulrich; Jäger, Paul; Riechers, H. Hermann; Wagner, Heinz; Winkler, Jochen; Wolf, Hans Uwe (2007). «Barium and Barium Compounds». Ullmann’s Encyclopedia of Industrial Chemistry. doi:10.1002/14356007.a03_325.pub2. ISBN 978-3-527-30673-2.
- ^ a b Puiu, Tibi (2022-10-04). «World’s whitest paint is now thin enough to coat and cool down cars, trains and planes». ZME Science. Retrieved 2022-10-12.
- ^ Wiles, Kayla (September 16, 2021). «Purdue record for the whitest paint appears in latest edition of ‘Guinness World Records’«. www.purdue.edu. Retrieved 2022-10-12.
- ^ The Getty Conservation Institute, Silver Gelatin. The Atlas of Analytical Signatures of Photographic Processes. J. Paul Getty Trust, 2013.
- ^ Salvaggio, Nanette L. Basic Photographic Materials and Processes. Taylor & Francis US, Oct 27, 2008. p. 362.
- ^ Nikitas, Theano. «Inkjet papers that will give your photos pizzazz: are you and your clients bored with your photo prints? check out our favorite fine-art and specialty inkjet papers that are sure to make your images stand out.» Photo District News July 2012: 36+. General Reference Center GOLD. Web. 3 Nov. 2012.
- ^ Lopresti, Mattia; Alberto, Gabriele; Cantamessa, Simone; Cantino, Giorgio; Conterosito, Eleonora; Palin, Luca; Milanesio, Marco (28 January 2020). «Light Weight, Easy Formable and Non-Toxic Polymer-Based Composites for Hard X-ray Shielding: A Theoretical and Experimental Study». International Journal of Molecular Sciences. 21 (3): 833. doi:10.3390/ijms21030833. PMC 7037949. PMID 32012889.
- ^ a b «Investigación U. de Chile comprueba que perdigones usados por Carabineros contienen solo 20 por ciento de goma». Universidad de Chile. November 18, 2019. Retrieved June 29, 2020.
- ^ Fedele, L.; Todesca, R.; Boni, M. (1 February 2003). «Barite-silica mineralization at the inter-Ordovician unconformity in southwestern Sardinia (Italy): a fluid inclusion study». Mineralogy and Petrology. 77 (3–4): 197–213. Bibcode:2003MinPe..77..197F. doi:10.1007/s00710-002-0200-9. S2CID 129874363.
- ^ Chu, Tieh-Chi; Wang, Jeng-long (2000). «Radioactive Disequilihrium of Uranium and Thorium Nuclide Series in Hot Spring and River Water from Peitou Hot Spring Basin in Taipei». Journal of Nuclear and Radiochemical Sciences. 1 (1): 5–10. doi:10.14494/jnrs2000.1.5.
- ^ «Barium Sulfate». NIOSH Pocket Guide to Chemical Hazards. Centers for Disease Control and Prevention. April 4, 2011. Retrieved November 18, 2013.
| Сульфат бария | |
 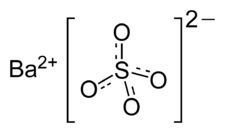 |
|
 |
|
| Общие | |
|---|---|
| Систематическое наименование | Сульфат бария |
| Химическая формула | BaSO4 |
| Физические свойства | |
| Состояние (ст. усл.) | твердый |
| Отн. молек. масса | 233.43 а. е. м. |
| Плотность | 4.5 г/см³ |
| Термические свойства | |
| Температура плавления | 1580 °C |
| Химические свойства | |
| Растворимость в воде | 0.000115 г/100 мл |
| Классификация | |
| Рег. номер CAS | 7727-43-7 |
Сульфа́т ба́рия (сернокислый барий) — сернокислая соль бария. Химическая формула — BaSO4.
Содержание
- 1 Получение
- 2 Свойства
- 3 Химические свойства
- 4 Токсичность
- 5 Применение
- 5.1 Аналитическая химия
- 5.2 Рентгеноконтрастное вещество
- 5.3 Пигмент-наполнитель
- 5.4 Пиротехника
- 5.5 Другие применения
- 6 Ссылки
- 7 Литература
- 8 Примечания
Получение
- Взаимодействием солей, оксида, пероксида или гидроксида бария с серной кислотой или растворимыми сульфатами:
- BaCl2 + H2SO4 → BaSO4↓ + 2HCl
- Ba(NO3)2 + Na2SO4 → BaSO4↓ + 2NaNO3
- BaO + H2SO4 → BaSO4↓ + H2O
- В промышленности большие объёмы сульфата бария получают из природного минерала тяжелого шпата, при этом исходное сырьё измельчается и отмучивается.
Свойства
Кристаллическое вещество — белый порошок или прозрачный кристалл, практически нерастворим в воде (растворимость 0,0015 г/л при 18 °C) и других растворителях. В природе встречается в виде минерала барита, который является основной бариевой рудой.
Химические свойства
- Плотность: 4,5 г/см³
- Молекулярный вес: 233,43 г/моль
- Температура плавления: 1580 °C
- Коэффициент преломления: 1,63
Сульфат бария не растворим в щелочах и большинстве кислот, однако растворим в хлорной воде, бромистоводородной и йодистоводородной кислотах, растворах гидрокарбонатов щелочных металлов[1]. Вступает во взаимодействие с концентрированной серной кислотой, которая переводит нерастворимый сульфат в хорошо растворимый гидросульфат бария:
- BaSO4 + H2SO4 → Ba(HSO4)2
При прокаливании с углём или коксом сульфат восстанавливается до сульфида:
- BaSO4 + 2C → BaS + 2CO2
При температуре свыше 1600 °C разлагается:
- 2BaSO4 → 2BaO + 2SO2 + O2
Токсичность
Сульфат бария не является токсичным для организма веществом, в отличие от всех растворимых солей бария, и именно поэтому возможно его применение в качестве рентгеноконтрастного вещества.
Применение
Аналитическая химия
В аналитической химии сульфат бария применяют как хорошую гравиметрическую форму для определения сульфат-ионов и ионов бария в гравиметрическом анализе.
Рентгеноконтрастное вещество
Часто используется при рентгеновских исследованиях желудочно-кишечного тракта как радиоконтрастное вещество, так как тяжёлые атомы бария хорошо поглощают рентгеновское излучение. Хотя все растворимые соли бария ядовиты, сульфат бария практически нерастворим в воде (и в растворе соляной кислоты, которая содержится в желудочном соке), поэтому он нетоксичен. Для рентгенографического исследования органов пищеварения пациент принимает внутрь суспензию сульфата бария («бариевую кашу») с содержанием бария 58,7 %.
Пигмент-наполнитель
Сульфат бария является одной из составляющих часть смесей, используемых в качестве белых пигментов:
- Смесь сульфата бария с сульфидом цинка, получаемая взаимодействием растворов сульфида бария и сульфата цинка — литопон.
- Мелкокристаллический сульфат бария, получаемый взаимодействием осаждением сульфата натрия из раствора сульфида бария — бланфикс (фр. Blanc fixe).
Употребляется как клеевая краска, так как не растворим в органических растворителях. Эти белила дешевле свинцовых, в отличие от них не токсичны и не темнеют от сернистого водорода.
Пиротехника
Сульфат бария используется как цветовой компонент для пиротехнических средств, так как ионы бария способствуют окрашиванию пламени в зеленый цвет. В настоящее время для этих целей в основном используют нитрат бария, за счет того, что он является сильным окислителем и способствует энергичному горению пиротехнической смеси.
Другие применения
Сульфат бария используется для различных промышленных целей:
- В качестве наполнителя для фото- и писчей бумаги, для линолеума и для некоторых лако-красочных материалов. См., например, баритаж.
- Как белый наполнитель для пластмасс, а также как компонент буровых растворов для увеличения их плотности.
- В фотометрии: для окраски фотометрических шаров
- В электрохимической промышленности при изготовлении свинцовых аккумуляторов как расширитель активной массы отрицательного электрода.
- При производстве пасты для травления стекла.
- При производстве некоторых огнеупорных материалов.
- Протектор для рентгеновского излучения (бариевая штукатурка рентгеновских кабинетов).
- Добавление в продукцию Lego на случай, если ребенок проглотит деталь.
- Как основной компонент циммерита — обмазки брони немецких танков и САУ периода Второй мировой войны.
Ссылки
- Характеристики сульфата бария (аккумуляторного)
- Сульфат бария на медицинской энциклопедии
Литература
- Учебник общей химии Некрасов Б. В. 1981 год, в 2 томах.
Примечания
- ↑ Н.С. Фрумина, Н.Н. Горюнова, С.Н. Еременко. Аналитическая химия бария. — Москва: Наука, 1977.
| Сульфат бария | |
|---|---|
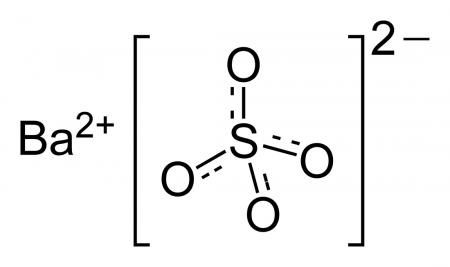 |
|
 |
|
| Систематическое наименование |
Сульфат бария |
| Хим. формула | BaSO4 |
| Рац. формула | BaSO4 |
| Состояние | твёрдый |
| Молярная масса | 233.43 г/моль |
| Плотность | 4.5 г/см³ |
| Температура | |
| • плавления | 1580 °C |
| • разложения | 2912 ± 1 °F |
| Давление пара | 0 ± 1 мм рт.ст. |
| Растворимость | |
| • в воде | 0,0002448 г/100 мл (20 °C) 0,000285 г/100 мл (30 °C) |
| Рег. номер CAS | 7727-43-7 |
| PubChem | 24414 |
| Рег. номер EINECS | 231-784-4 |
| SMILES |
[O-]S(=O)(=O)[O-].[Ba+2] |
| InChI |
1S/Ba.H2O4S/c;1-5(2,3)4/h;(H2,1,2,3,4)/q+2;/p-2 TZCXTZWJZNENPQ-UHFFFAOYSA-L |
| RTECS | CR0600000 |
| ChEBI | 133326 |
| ChemSpider | 22823 |
| Токсичность | не токсичен |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Сульфат бария (сернокислый барий) — сернокислая соль бария. Химическая формула — BaSO4.
Содержание
- 1 Получение
- 2 Свойства
- 3 Химические свойства
- 4 Токсичность
- 5 Применение
- 5.1 Аналитическая химия
- 5.2 Рентгеноконтрастное вещество
- 5.3 Пигмент-наполнитель
- 5.4 Другие применения
Получение
Сульфат бария получают взаимодействием растворимых солей, оксида, пероксида или гидроксида бария с серной кислотой или растворимыми сульфатами:
-
- BaCl2 + Na2SO4 → BaSO4↓ + 2NaCl
-
- BaO2 + H2SO4 → BaSO4↓ + H2O2
Последняя реакция используется также для получения пероксида водорода.
В промышленности большие объёмы сульфата бария получают из природного минерала тяжелого шпата, при этом исходное сырьё измельчается и декантируется.
Свойства
Кристаллическое вещество — белый порошок или прозрачный кристалл, практически нерастворим в воде (растворимость 0,0015 г/л при 18 °C) и других растворителях. В природе встречается в виде минерала барита, который является основной бариевой рудой.
Химические свойства
Сульфат бария нерастворим в щелочах и большинстве кислот, однако растворим в хлорной воде, бромистоводородной и йодистоводородной кислотах, растворах гидрокарбонатов щелочных металлов.
Вступает во взаимодействие с концентрированной серной кислотой, которая переводит нерастворимый сульфат в хорошо растворимый гидросульфат бария:
-
- BaSO4 + H2SO4 → Ba(HSO4)2
При прокаливании с углём или коксом сульфат восстанавливается до сульфида:
-
- BaSO4 + 4C → BaS + 4CO
При температурах выше 1600 °C разлагается:
-
- 2BaSO4 → 2BaO + 2SO2 + O2
Токсичность
Сульфат бария в силу низкой растворимости в воде не является токсичным для организма веществом, в отличие от всех растворимых солей бария, и поэтому возможно его применение в качестве рентгеноконтрастного вещества.
Применение
Аналитическая химия
В аналитической химии сульфат бария применяют как хорошую гравиметрическую форму для определения сульфат-ионов и ионов бария в гравиметрическом анализе.
Рентгеноконтрастное вещество
Часто используется при рентгеновских исследованиях желудочно-кишечного тракта как радиоконтрастное вещество, так как тяжёлые атомы бария хорошо поглощают рентгеновское излучение. Хотя все растворимые соли бария ядовиты, сульфат бария практически нерастворим в воде (и в соляной кислоте, которая содержится в желудочном соке), поэтому он нетоксичен. Для рентгенографического исследования органов пищеварения пациент принимает внутрь суспензию сульфата бария («баритовую кашу») с содержанием бария 58,7 %.
Пигмент-наполнитель
Сульфат бария является одной из составляющих смесей, используемых в качестве белых пигментов:
- Смесь сульфата бария с сульфидом цинка, получаемая взаимодействием растворов сульфида бария и сульфата цинка, — литопон.
- Мелкокристаллический сульфат бария, получаемый осаждением сульфатом натрия из раствора сульфида бария, — бланфикс (фр. Blanc fixe).
Употребляется как клеевая краска, так как нерастворим в органических растворителях. Эти белила дешевле свинцовых, в отличие от них не токсичны и не темнеют от сероводорода.
Другие применения
Сульфат бария используется для различных промышленных целей:
- В качестве наполнителя для фото- и писчей бумаги, для линолеума и для некоторых лако-красочных материалов.
- Как белый наполнитель для пластмасс.
- В фотометрии: для окраски фотометрических шаров
- В электрохимической промышленности при изготовлении свинцовых аккумуляторов как расширитель активной массы отрицательного электрода.
- При производстве пасты для травления стекла.
- При производстве некоторых огнеупорных материалов.
- Протектор для рентгеновского излучения (бариевая штукатурка рентгеновских кабинетов).
- Добавление в продукцию Lego для обеспечения рентгеноконтрастности на случай, если ребёнок проглотит деталь (это был эксперимент, который закончился неудачно в 1996 году, из-за снижения прочности деталей и токсичности сульфата бария промышленного качества).
- Как основной компонент циммерита — обмазки брони немецких танков и САУ периода Второй мировой войны.
- В виде баритового концентрата при бурении скважин для утяжеления глинистых буровых растворов.
Сульфат бария — вещество, встречающееся в природе 
Сульфат бария очень инертен, не растворяется ни в воде, ни в растворителях. Нейтрален к щелочам и большинству кислот, пожаробезопасен, не ядовит. Чтобы вызвать термическое разложение, его нужно нагреть до t +1600 °С. Взаимодействует с концентрированной серной кислотой H2SO4, бромоводородной HBr и йодноводородной HI кислотами, хлорной водой, углеродом, водородом, едким натром NaOH.
Получение
Сульфат бария производят переработкой и очисткой природного сырья — барита (тяжелого шпата). Кроме этого существуют лабораторные способы:
• реакцией обмена растворимых солей бария и серной кислоты;
• реакцией обмена между сульфатом ZnSO4 и сульфидом BaS;
• взаимодействием бариевого оксида BaO или пероксида BaO2 с серной кислотой;
• воздействием гидроокиси Ba(OH)2 на серную кислоту, ее соль или оксид серы SO3.
Применение
Сульфат бария применяется во многих областях, благодаря невысокой стоимости и нетоксичности. Востребован в лабораторной аналитике, промышленности, быту.
• В медицине — контрастное вещество при рентгеноскопии ЖКТ.
• Добавляется в штукатурку рентгенкабинетов для поглощения рентгеновских лучей.
• В гравиметрическом анализе для идентификации бариевых ионов и сульфат-ионов.
• Белый пигмент и наполнитель в лакокрасочной индустрии, при производстве пластиков, клеев, бумаги, линолеума и т.п.
• Входит в состав буровых растворов при нефтедобыче, паст для травления стекла, огнеупоров, пиротехнических смесей.
• Используется для покрытия пресс-форм на металлургических предприятиях.
• В электротехнике для изготовления свинцовых аккумуляторов.
• В химпроме — сырье для получения бариесодержащих соединений.
Меры безопасности
Как химическое вещество сульфат бария неядовит и пожаробезопасен. В воде и соляной кислоте не растворим, поэтому организмом человека не усваивается, не оказывает на него токсического воздействия. Тем не менее, его мелкодисперсионная пыль раздражает дыхательные пути и слизистые, и их следует защищать при работе. ГОСТ требует, чтобы работы с реактивом проводились в помещениях с оборудованной принудительной системой вентиляции, а работники использовали средства защиты: маски и пылезащитные очки.
Условия хранения
Хранят сульфат бария на сухих складах в пластиковых мешках, бочках, флягах, стеклянных сосудах. Если реактив упакован герметично, то допускается хранение на открытых площадках.
Как приобрести вещество у ПраймКемикалсГрупп
В магазине ПраймКемикалсГрупп можно купить сульфат бария высокой чистоты. Для этого достаточно сделать заказ на сайте pcgroup.ru, на странице товара, или звоните по одному из телефонов, указанных в верхней части страницы. Мы также отвечаем на вопросы и оформляем заказы через электронную почту info@pcgroup.ru или мессенджеры WhatsApp и Telegram: +7(929) 635 82 73. Организована доставка во все регионы России.
| Сульфат бария | |
|---|---|
  |
|
 |
|
| Общие | |
| Систематическое наименование |
Сульфат бария |
| Хим. формула | BaSO4 |
| Физические свойства | |
| Состояние | твёрдый |
| Молярная масса | 233.43 г/моль |
| Плотность | 4.5 г/см³ |
| Термические свойства | |
| Т. плав. | 1580 °C |
|
Т. разл. |
2912 ± 1 °F |
| Давление пара | 0 ± 1 мм рт.ст. |
| Химические свойства | |
| Растворимость в воде |
0,0002448 г/100 мл (20 °C) 0,000285 г/100 мл (30 °C) |
| Классификация | |
| Рег. номер CAS | 7727-43-7 |
| PubChem | 24414 |
| Рег. номер EINECS | 231-784-4 |
| SMILES |
[O-]S(=O)(=O)[O-].[Ba+2] |
| InChI |
1S/Ba.H2O4S/c;1-5(2,3)4/h;(H2,1,2,3,4)/q+2;/p-2 TZCXTZWJZNENPQ-UHFFFAOYSA-L |
| RTECS | CR0600000 |
| ChEBI | 133326 |
| ChemSpider | 22823 |
| Безопасность | |
| Токсичность | не токсичен |
| NFPA 704 |
0 0 0 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. |
Сульфа́т ба́рия (сернокислый барий) — сернокислая соль бария. Химическая формула — BaSO4.
Содержание
- 1 Получение
- 2 Свойства
- 3 Химические свойства
- 4 Токсичность
-
5 Применение
- 5.1 Аналитическая химия
- 5.2 Рентгеноконтрастное вещество
- 5.3 Пигмент-наполнитель
- 5.4 Другие применения
- 6 Примечания
- 7 Ссылки
- 8 Литература
Получение
Сульфат бария получают взаимодействием растворимых солей, оксида, пероксида или гидроксида бария с серной кислотой или растворимыми сульфатами:
Последняя реакция используется также для получения пероксида водорода.
В промышленности большие объёмы сульфата бария получают из природного минерала тяжелого шпата, при этом исходное сырьё измельчается и декантируется.
Свойства
Кристаллическое вещество — белый порошок или прозрачный кристалл, практически нерастворим в воде (растворимость 0,0015 г/л при 18 °C) и других растворителях. В природе встречается в виде минерала барита, который является основной бариевой рудой.
Химические свойства
Сульфат бария нерастворим в щелочах и большинстве кислот, однако растворим в хлорной воде, бромистоводородной и йодистоводородной кислотах, растворах гидрокарбонатов щелочных металлов.
Вступает во взаимодействие с концентрированной серной кислотой, которая переводит нерастворимый сульфат в хорошо растворимый гидросульфат бария:
При прокаливании с углём или коксом сульфат восстанавливается до сульфида:
При температурах выше 1600 °C разлагается:
Токсичность
Сульфат бария в силу низкой растворимости в воде не является токсичным для организма веществом, в отличие от всех растворимых солей бария, и поэтому возможно его применение в качестве рентгеноконтрастного вещества.
Применение
Аналитическая химия
В аналитической химии сульфат бария применяют как хорошую гравиметрическую форму для определения сульфат-ионов и ионов бария в гравиметрическом анализе.
Рентгеноконтрастное вещество
Часто используется при рентгеновских исследованиях желудочно-кишечного тракта как радиоконтрастное вещество, так как тяжёлые атомы бария хорошо поглощают рентгеновское излучение. Хотя все растворимые соли бария ядовиты, сульфат бария практически нерастворим в воде (и в соляной кислоте, которая содержится в желудочном соке), поэтому он нетоксичен. Для рентгенографического исследования органов пищеварения пациент принимает внутрь суспензию сульфата бария («баритовую кашу») с содержанием бария 58,7 %.
Пигмент-наполнитель
Сульфат бария является одной из составляющих смесей, используемых в качестве белых пигментов:
- Смесь сульфата бария с сульфидом цинка, получаемая взаимодействием растворов сульфида бария и сульфата цинка, — литопон.
- Мелкокристаллический сульфат бария, получаемый осаждением сульфатом натрия из раствора сульфида бария, — бланфикс (фр. Blanc fixe).
Употребляется как клеевая краска, так как нерастворим в органических растворителях. Эти белила дешевле свинцовых, в отличие от них не токсичны и не темнеют от сероводорода.
Другие применения
Сульфат бария используется для различных промышленных целей:
- В качестве наполнителя для фото- и писчей бумаги, для линолеума и для некоторых лако-красочных материалов. См., например, баритаж.
- Как белый наполнитель для пластмасс.
- В фотометрии: для окраски фотометрических шаров
- В электрохимической промышленности при изготовлении свинцовых аккумуляторов как расширитель активной массы отрицательного электрода.
- При производстве пасты для травления стекла.
- При производстве некоторых огнеупорных материалов.
- Протектор для рентгеновского излучения (бариевая штукатурка рентгеновских кабинетов).
- Добавление в продукцию Lego для обеспечения рентгеноконтрастности на случай, если ребёнок проглотит деталь (это был эксперимент, который закончился неудачно в 1996 году, из-за снижения прочности деталей и токсичности сульфата бария промышленного качества).
- Как основной компонент циммерита — обмазки брони немецких танков и САУ периода Второй мировой войны.
- В виде баритового концентрата при бурении скважин для утяжеления глинистых буровых растворов.
Содержание
- Структурная формула
- Русское название
- Английское название
- Латинское название вещества Бария сульфат
- Химическое название
- Брутто формула
- Фармакологическая группа вещества Бария сульфат
- Нозологическая классификация
- Код CAS
- Фармакологическое действие
- Характеристика
- Фармакология
- Применение вещества Бария сульфат
- Противопоказания
- Побочные действия вещества Бария сульфат
- Способ применения и дозы
- Меры предосторожности
- Особые указания
- Торговые названия с действующим веществом Бария сульфат
Структурная формула
Русское название
Бария сульфат
Английское название
Barium sulfate
Латинское название вещества Бария сульфат
Barii sulfas (род. Barii sulfatis)
Химическое название
Бария сульфат
Фармакологическая группа вещества Бария сульфат
Фармакологическое действие
—
рентгеноконтрастное.
Характеристика
Белый рыхлый порошок без запаха и вкуса. Нерастворим в воде, практически нерастворим в разведенных кислотах и щелочах, органических растворителях.
Фармакология
Повышает контрастность изображения при рентгенологических исследованиях. Максимальная рентгеноконтрастность пищевода, желудка и двенадцатиперстной кишки достигается немедленно после введения внутрь, тонкой кишки — через 15–90 мин (в зависимости от скорости опорожнения желудка и вязкости препарата); наибольшая визуализация дистального отдела тонкой и толстой кишки зависит от положения тела и гидростатического давления. Не всасывается из ЖКТ и не попадает в системный кровоток (при отсутствии перфораций). Выводится с фекалиями.
Применение вещества Бария сульфат
Рентгенография ЖКТ, особенно верхних отделов тонкого кишечника.
Противопоказания
Гиперчувствительность, непроходимость толстой кишки, перфорация ЖКТ, обезвоживание организма, аллергические реакции или бронхиальная астма в анамнезе, муковисцидоз, острый дивертикулит, острый язвенный колит.
Побочные действия вещества Бария сульфат
Тяжелый и длительный запор, спазмы кишечника, диарея. Анафилактоидные реакции — свистящее и/или затрудненное дыхание, стесненность в грудной клетке, боль в области желудка и нижней части живота, вздутие живота.
Способ применения и дозы
Исследование верхних отделов ЖКТ: суспензию из 80 г порошка и 100 мл воды принимают внутрь или вводят желудочным зондом, для двойного контрастирования в суспензию добавляют цитрат натрия и сорбит.
Рентгенологическое исследование толстой кишки: суспензию из 750 г порошка и 1 л 0,5% водного раствора танина вводят в клизме в прямую кишку.
Меры предосторожности
После 20 ч накануне процедуры не рекомендуется употреблять твердую пищу. Перед ректальным введением допускается прием мягкой пищи, утром (перед исследованием) вводят суппозиторий бисакодила. После исследования необходимо употреблять больше жидкости для ускорения эвакуации сульфата бария.
Особые указания
При изготовлении суспензии всегда добавлять порошок к воде. Хранят суспензию при 15–30 °C, перед применением взбалтывают.
Торговые названия с действующим веществом Бария сульфат
| Торговое название | Цена за упаковку, руб. |
|---|---|
| Бар-ВИПС |
5948.20 |
Сульфат бария, характеристика, свойства и получение, химические реакции.
Сульфат бария – неорганическое вещество, имеет химическую формулу BaSO4.
Краткая характеристика сульфата бария
Физические свойства сульфата бария
Получение сульфата бария
Химические свойства сульфата бария
Химические реакции сульфата бария
Применение и использование сульфата бария
Краткая характеристика сульфата бария:
Сульфат бария – неорганическое вещество белого цвета.
Химическая формула сульфата бария BaSO4.
Сульфат бария – неорганическое химическое соединение, соль серной кислоты и бария.
Сульфат бария существует в двух модификациях (α, β и γ). α-модификация сульфата бария имеет ромбическую сингонию. β-модификация сульфата бария имеет кубическую сингонию. α-модификация переходит в β-модификацию при температуре 1150 Со.
Практически не растворяется в воде.
Устойчив при высокой температуре.
Сульфат бария не ядовит, пожаро- и взрывобезопасен.
Сульфат бария распространён в природе в виде минерала барита (тяжелого шпата).
Физические свойства сульфата бария:
| Наименование параметра: | Значение: |
| Химическая формула | BaSO4 |
| Синонимы и названия иностранном языке | barium sulfate (англ.)
barium sulphate (барит (рус.) баритовые белила (рус.) |
| Тип вещества | неорганическое |
| Внешний вид | бесцветные ромбические кристаллы |
| Цвет | белый, бесцветный |
| Вкус | —* |
| Запах | без запаха |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | твердое вещество |
| Плотность (состояние вещества – твердое вещество, при 20 °C), кг/м3 | 2710 |
| Плотность (состояние вещества – твердое вещество, при 20 °C), г/см3 | 2,710 |
| Температура разложения, °C | > 1600 |
| Температура плавления, °C | 1580 |
| Молярная масса, г/моль | 342,15 |
| Растворимость в воде (18 oС), г/100 г | 0,00022 |
* Примечание:
— нет данных.
Получение сульфата бария:
В промышленности сульфат бария получают из природного минерала барита (тяжелого шпата).
В лаборатории сульфат бария получают в результате следующих химических реакций:
- 1. взаимодействия хлорида бария и сульфата натрия:
BaCl2 + Na2SO4 → BaSO4 + 2NaCl.
- 2. взаимодействия хлорида бария и сульфата магния:
BaCl2 + MgSO4 → BaSO4 + MgCl2.
- 3. взаимодействия хлорида бария и сульфата меди:
CuSO4 + BaCl2 → BaSO4 + CuCl2.
- 4. взаимодействия хлорида бария и сульфата калия:
BaCl2 + K2SO4 → BaSO4 + 2KCl.
- 5. взаимодействия сульфата цинка и сульфида бария:
ZnSO4 + BaS → BaSO4 + ZnS.
- 6. взаимодействия сульфата натрия и гидроксида бария:
Na2SO4 + Ba(OH)2 → BaSO4 + 2NaOH.
- 7. взаимодействия сульфата натрия и хлорида бария:
Na2SO4 + BaCl2 = BaSO4 + 2NaCl.
- 8. взаимодействия сульфата натрия и нитрата бария:
Na2SO4 + Ba(NO3)2 → 2NaNO3 + BaSO4.
- 9. взаимодействия гидроксида бария и оксида серы:
Ba(OH)2 + SO3 → BaSO4 + H2O.
Химические свойства сульфата бария. Химические реакции сульфата бария:
Химические свойства сульфата бария аналогичны свойствам сульфатов других металлов. Однако, сульфат бария не реагирует с кислотами и с щелочами. Поэтому для него характерны следующие химические реакции:
1. реакция взаимодействия сульфата бария и углерода:
BaSO4 + 4C → BaS + 4CO (t = 1100-1200 °C),
BaSO4 + 3C → BaS + CO2 + 2CO (t°).
В результате реакции образуются в первом случае – сульфид бария и оксид углерода (II), во втором – сульфид бария, оксид углерода (IV) и оксид углерода (II).
2. реакция взаимодействия сульфата бария и водорода:
BaSO4 + 4H2 → BaS + 4H2O (t = 900-1000 °C).
В результате реакции образуются сульфид бария и вода.
3. реакция взаимодействия сульфата бария и гидроксида натрия:
2BaSO4 + 2NaOH ⇄ (BaOH)2SO4 + Na2SO4 (t = 20-40 °C).
В результате реакции образуются гидроксосульфат бария и сульфат натрия. В ходе реакции используется концентрированный холодный раствор гидроксида натрия. Реакция носит обратимый характер.
4. реакция термического разложения сульфата бария:
2BaSO4 → 2BaO + 2SO2 + O2 (t > 1600 °C).
В результате реакции образуются оксид бария, оксид серы (IV) и кислород.
Применение и использование сульфата бария:
Сульфат бария используется во множестве отраслей промышленности и для бытовых нужд:
– при рентгеновских исследованиях в качестве рентгеноконтрастного вещества;
– в аналитической химии;
– как белый пигмент и наполнитель в составе некоторых веществ (лакокрасочных материалов, пластмасс, фото- и писчей бумаги, линолеумов и пр.);
– в качестве компонента бурового раствора нефтяных скважин;
– в качестве покрытия материалов пресс-форм в металлургии.
Примечание: © Фото https://www.pexels.com, https://pixabay.com
сульфат бария реагирует кислота 1 2 3 4 5 вода
уравнение реакций соединения масса взаимодействие сульфата бария
реакции
Коэффициент востребованности
7 815