|
|

|
|
| Names | |
|---|---|
| Other names
Plaster of Paris |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChEBI |
|
| ChEMBL |
|
| ChemSpider |
|
| DrugBank |
|
| ECHA InfoCard | 100.029.000 |
| EC Number |
|
| E number | E516 (acidity regulators, …) |
|
Gmelin Reference |
7487 |
| KEGG |
|
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
CaSO4 |
| Molar mass | 136.14 g/mol (anhydrous) 145.15 g/mol (hemihydrate) 172.172 g/mol (dihydrate) |
| Appearance | white solid |
| Odor | odorless |
| Density | 2.96 g/cm3 (anhydrous) 2.32 g/cm3 (dihydrate) |
| Melting point | 1,460 °C (2,660 °F; 1,730 K) (anhydrous) |
|
Solubility in water |
0.26 g/100ml at 25 °C (dihydrate)[1] |
|
Solubility product (Ksp) |
4.93 × 10−5 mol2L−2 (anhydrous) 3.14 × 10−5 (dihydrate) [2] |
| Solubility in glycerol | slightly soluble (dihydrate) |
| Acidity (pKa) | 10.4 (anhydrous) 7.3 (dihydrate) |
|
Magnetic susceptibility (χ) |
-49.7·10−6 cm3/mol |
| Structure | |
|
Crystal structure |
orthorhombic |
| Thermochemistry | |
|
Std molar |
107 J·mol−1·K−1 [3] |
|
Std enthalpy of |
-1433 kJ/mol[3] |
| Hazards | |
| NFPA 704 (fire diamond) |
1 0 0 |
| Flash point | Non-flammable |
| NIOSH (US health exposure limits): | |
|
PEL (Permissible) |
TWA 15 mg/m3 (total) TWA 5 mg/m3 (resp) [for anhydrous form only][4] |
|
REL (Recommended) |
TWA 10 mg/m3 (total) TWA 5 mg/m3 (resp) [anhydrous only][4] |
|
IDLH (Immediate danger) |
N.D.[4] |
| Safety data sheet (SDS) | ICSC 1589 |
| Related compounds | |
|
Other cations |
Magnesium sulfate Strontium sulfate Barium sulfate |
|
Related desiccants |
Calcium chloride Magnesium sulfate |
|
Related compounds |
Plaster of Paris Gypsum |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Calcium sulfate (or calcium sulphate) is the inorganic compound with the formula CaSO4 and related hydrates. In the form of γ-anhydrite (the anhydrous form), it is used as a desiccant. One particular hydrate is better known as plaster of Paris, and another occurs naturally as the mineral gypsum. It has many uses in industry. All forms are white solids that are poorly soluble in water.[5] Calcium sulfate causes permanent hardness in water.
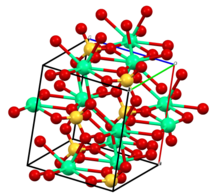
Hydration states and crystallographic structures[edit]
The compound exists in three levels of hydration corresponding to different crystallographic structures and to minerals:
- CaSO
4 (anhydrite): anhydrous state.[6] The structure is related to that of zirconium orthosilicate (zircon): Ca2+
is 8-coordinate, SO2−
4 is tetrahedral, O is 3-coordinate. - CaSO
4·2H
2O (gypsum and selenite (mineral)): dihydrate.[7] - CaSO
4·1/2H
2O (bassanite): hemihydrate, also known as plaster of Paris. Specific hemihydrates are sometimes distinguished: α-hemihydrate and β-hemihydrate.[8]
Uses[edit]
The main use of calcium sulfate is to produce plaster of Paris and stucco. These applications exploit the fact that calcium sulfate which has been powdered and calcined forms a moldable paste upon hydration and hardens as crystalline calcium sulfate dihydrate. It is also convenient that calcium sulfate is poorly soluble in water and does not readily dissolve in contact with water after its solidification.
Hydration and dehydration reactions[edit]
With judicious heating, gypsum converts to the partially dehydrated mineral called bassanite or plaster of Paris. This material has the formula CaSO4·(nH2O), where 0.5 ≤ n ≤ 0.8.[8] Temperatures between 100 and 150 °C (212–302 °F) are required to drive off the water within its structure. The details of the temperature and time depend on ambient humidity. Temperatures as high as 170 °C (338 °F) are used in industrial calcination, but at these temperatures γ-anhydrite begins to form. The heat energy delivered to the gypsum at this time (the heat of hydration) tends to go into driving off water (as water vapor) rather than increasing the temperature of the mineral, which rises slowly until the water is gone, then increases more rapidly. The equation for the partial dehydration is:
- CaSO4 · 2 H2O → CaSO4 · 1/2 H2O + 1+1/2 H2O↑
The endothermic property of this reaction is relevant to the performance of drywall, conferring fire resistance to residential and other structures. In a fire, the structure behind a sheet of drywall will remain relatively cool as water is lost from the gypsum, thus preventing (or substantially retarding) damage to the framing (through combustion of wood members or loss of strength of steel at high temperatures) and consequent structural collapse. But at higher temperatures, calcium sulfate will release oxygen and act as an oxidizing agent. This property is used in aluminothermy. In contrast to most minerals, which when rehydrated simply form liquid or semi-liquid pastes, or remain powdery, calcined gypsum has an unusual property: when mixed with water at normal (ambient) temperatures, it quickly reverts chemically to the preferred dihydrate form, while physically «setting» to form a rigid and relatively strong gypsum crystal lattice:
- CaSO4 · 1/2 H2O + 1+1/2 H2O → CaSO4 · 2 H2O
This reaction is exothermic and is responsible for the ease with which gypsum can be cast into various shapes including sheets (for drywall), sticks (for blackboard chalk), and molds (to immobilize broken bones, or for metal casting). Mixed with polymers, it has been used as a bone repair cement. Small amounts of calcined gypsum are added to earth to create strong structures directly from cast earth, an alternative to adobe (which loses its strength when wet). The conditions of dehydration can be changed to adjust the porosity of the hemihydrate, resulting in the so-called α- and β-hemihydrates (which are more or less chemically identical).
On heating to 180 °C (356 °F), the nearly water-free form, called γ-anhydrite (CaSO4·nH2O where n = 0 to 0.05) is produced. γ-Anhydrite reacts slowly with water to return to the dihydrate state, a property exploited in some commercial desiccants. On heating above 250 °C, the completely anhydrous form called β-anhydrite or «natural» anhydrite is formed. Natural anhydrite does not react with water, even over geological timescales, unless very finely ground.
The variable composition of the hemihydrate and γ-anhydrite, and their easy inter-conversion, is due to their nearly identical crystal structures containing «channels» that can accommodate variable amounts of water, or other small molecules such as methanol.
Food industry[edit]
The calcium sulfate hydrates are used as a coagulant in products such as tofu.[9]
For the FDA, it is permitted in Cheese and Related Cheese Products; Cereal Flours; Bakery Products; Frozen Desserts; Artificial Sweeteners for Jelly & Preserves; Condiment Vegetables; and Condiment Tomatoes and some candies.[10]
It is known in the E number series as E516, and the UN’s FAO knows it as a firming agent, a flour treatment agent, a sequestrant, and a leavening agent.[10]
Dentistry[edit]
Calcium sulfate has a long history of use in dentistry.[11] It has been used in bone regeneration as a graft material and graft binder (or extender) and as a barrier in guided bone tissue regeneration. It is a biocompatible material and is completely resorbed following implantation.[12] It does not evoke a significant host response and creates a calcium-rich milieu in the area of implantation.[13]
Other uses[edit]
When sold at the anhydrous state as a desiccant with a color-indicating agent under the name Drierite, it appears blue (anhydrous) or pink (hydrated) due to impregnation with cobalt(II) chloride, which functions as a moisture indicator.
Up to the 1970s, commercial quantities of sulfuric acid were produced in Whitehaven (Cumbria, UK) from anhydrous calcium sulfate. Upon being mixed with shale or marl, and roasted, the sulfate liberates sulfur dioxide gas, a precursor in sulfuric acid production, the reaction also produces calcium silicate, a mineral phase essential in cement clinker production.[14]
- 2 CaSO4 + 2 SiO2 → 2 CaSiO3 + 2 SO2 + O2 [15]
The plant made sulfuric acid by the “Anhydrite Process” , in which cement clinker itself was a by-product. In this process, anhydrite (calcium sulfate) replaces limestone in a cement rawmix, and under reducing conditions, sulfur dioxide is evolved instead of carbon dioxide. The sulfur dioxide is converted to sulfuric acid by the Contact Process using a vanadium pentoxide catalyst. [16]
CaSO4 + 2 C → CaS + 2CO2
3 CaSO4 + CaS + 2 SiO2 → 2 Ca2SiO4 (belite) + 4 SO2
3 CaSO4 + CaS → 4 CaO + 4 SO2
Ca2SiO4 + CaO → Ca3OSiO4 (alite)
2 SO2 + O2 → 2 SO3
(in the presence of the catalyst vanadium pentoxide)
SO3 + H2O → H2SO4 [17]
Because of its use in an expanding niche market, the Whitehaven plant continued to expand in a manner not shared by the other Anhydrite Process plants. The anhydrite mine opened on 11/1/1955, and the acid plant started on 14/11/1955. For a while in the early 1970s, it became the largest sulfuric acid plant in the UK, making about 13% of national production, and it was by far the largest Anhydrite Process plant ever built. [18]
Production and occurrence[edit]
The main sources of calcium sulfate are naturally occurring gypsum and anhydrite, which occur at many locations worldwide as evaporites. These may be extracted by open-cast quarrying or by deep mining. World production of natural gypsum is around 127 million tonnes per annum.[19]
In addition to natural sources, calcium sulfate is produced as a by-product in a number of processes:
- In flue-gas desulfurization, exhaust gases from fossil-fuel power stations and other processes (e.g. cement manufacture) are scrubbed to reduce their sulfur oxide content, by injecting finely ground limestone:[20]
- SO2 + 0.5 O2 + CaCO3 → CaSO4 + CO2
Related sulfur-trapping methods use lime and some produces an impure calcium sulfite, which oxidizes on storage to calcium sulfate.
- In the production of phosphoric acid from phosphate rock, calcium phosphate is treated with sulfuric acid and calcium sulfate precipitates. The product, called phosphogypsum is often contaminated with impurities making its use uneconomic.
- In the production of hydrogen fluoride, calcium fluoride is treated with sulfuric acid, precipitating calcium sulfate.
- In the refining of zinc, solutions of zinc sulfate are treated with hydrated lime to co-precipitate heavy metals such as barium.
- Calcium sulfate can also be recovered and re-used from scrap drywall at construction sites.
These precipitation processes tend to concentrate radioactive elements in the calcium sulfate product. This issue is particular with the phosphate by-product, since phosphate ores naturally contain uranium and its decay products such as radium-226, lead-210 and polonium-210. Extraction of uranium from phosphorus ores can be economical on its own depending on prices on the uranium market or the separation of uranium can be mandated by environmental legislation and its sale is used to recover part of the cost of the process.[21][22][23]
Calcium sulfate is also a common component of fouling deposits in industrial heat exchangers, because its solubility decreases with increasing temperature (see the specific section on the retrograde solubility).
Retrograde solubility[edit]
The dissolution of the different crystalline phases of calcium sulfate in water is exothermic and releases heat (decrease in Enthalpy: ΔH < 0). As an immediate consequence, to proceed, the dissolution reaction needs to evacuate this heat that can be considered as a product of reaction. If the system is cooled, the dissolution equilibrium will evolve towards the right according to the Le Chatelier principle and calcium sulfate will dissolve more easily. Thus the solubility of calcium sulfate increases as the temperature decreases and vice versa. If the temperature of the system is raised, the reaction heat cannot dissipate and the equilibrium will regress towards the left according to Le Chatelier principle. The solubility of calcium sulfate decreases as temperature increases. This counter-intuitive solubility behaviour is called retrograde solubility. It is less common than for most of the salts whose dissolution reaction is endothermic (i.e., the reaction consumes heat: increase in Enthalpy: ΔH > 0) and whose solubility increases with temperature. Another calcium compound, calcium hydroxide (Ca(OH)2, portlandite) also exhibits a retrograde solubility for the same thermodynamic reason: because its dissolution reaction is also exothermic and releases heat. So, to dissolve the maximum amount of calcium sulfate or calcium hydroxide in water, it is necessary to cool the solution down close to its freezing point instead of increasing its temperature.
Temperature dependence of the solubility of calcium sulfate (3 phases) in pure water.
The retrograde solubility of calcium sulfate is also responsible for its precipitation in the hottest zone of heating systems and for its contribution to the formation of scale in boilers along with the precipitation of calcium carbonate whose solubility also decreases when CO2 degasses from hot water or can escape out of the system.
On planet Mars[edit]
2011 findings by the Opportunity rover on the planet Mars show a form of calcium sulfate in a vein on the surface. Images suggest the mineral is gypsum.[24]
See also[edit]
- Calcium sulfate (data page)
- Alabaster
- Anhydrite
- Bathybius haeckelii
- Chalk (calcium carbonate)
- Gypsum
- Gypsum plaster
- Phosphogypsum
- Selenite (mineral)
- Flue-gas desulfurization
References[edit]
- ^ Lebedev, A. L.; Kosorukov, V. L. (2017). «Gypsum Solubility in Water at 25°C» (PDF). Geochemistry International. 55 (2): 171–177. doi:10.1134/S0016702917010062. S2CID 132916752.
- ^ D.R. Linde (ed.) «CRC Handbook of Chemistry and Physics», 83rd Edition, CRC Press, 2002
- ^ a b Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. p. A21. ISBN 978-0-618-94690-7.
- ^ a b c NIOSH Pocket Guide to Chemical Hazards. «#0095». National Institute for Occupational Safety and Health (NIOSH).
- ^ Franz Wirsching «Calcium Sulfate» in Ullmann’s Encyclopedia of Industrial Chemistry, 2012 Wiley-VCH, Weinheim. doi:10.1002/14356007.a04_555
- ^ Morikawa, H.; Minato, I.; Tomita, T.; Iwai, S. (1975). «Anhydrite: A refinement». Acta Crystallographica Section B. 31 (8): 2164. doi:10.1107/S0567740875007145.
- ^ Cole, W.F.; Lancucki, C.J. (1974). «A refinement of the crystal structure of gypsum CaSO
4·2H
2O«. Acta Crystallographica Section B. 30 (4): 921. doi:10.1107/S0567740874004055. - ^ a b Taylor H.F.W. (1990) Cement Chemistry. Academic Press, ISBN 0-12-683900-X, pp. 186-187.
- ^ «About tofu coagulant». www.soymilkmaker.com. Sanlinx Inc. 31 August 2015.
- ^ a b «Compound Summary for CID 24497 — Calcium Sulfate». PubChem.
- ^ Titus, Harry W.; McNally, Edmund; Hilberg, Frank C. (1933-01-01). «Effect of Calcium Carbonate and Calcium Sulphate on Bone Development». Poultry Science. 12 (1): 5–8. doi:10.3382/ps.0120005. ISSN 0032-5791.
- ^ Thomas, Mark V.; Puleo, David A.; Al-Sabbagh, Mohanad (2005). «Calcium sulfate: a review». Journal of Long-Term Effects of Medical Implants. 15 (6): 599–607. doi:10.1615/jlongtermeffmedimplants.v15.i6.30. ISSN 1050-6934. PMID 16393128.
- ^ «Biphasic Calcium Sulfate — Overview». Augma Biomaterials. 2020-03-25. Retrieved 2020-07-16.
- ^ Whitehaven Coast Archeological Survey
- ^ COMMONWEALTH OF AUSTRALIA. DEPARTMENT OF SUPPLY AND SHIPPING. BUREAU OF MINERAL RESOURCES GEOLOGY AND GEOPHYSICS. REPORT NO.1949/44 (Geol. Ser. No. 27) by E.K. Sturmfels THE PRODUCTION OF SULPHURIC ACID AND PORTLAND CEMENT FROM CALCIUM SULPHATE AND ALUMINIUM SILICATES
- ^ Whitehaven anhydrate process
- ^ Whitehaven anhydrate process
- ^ website cement kilns whitehaven
- ^ Gypsum, USGS, 2008
- ^ Speight, James G. (2000). «Fuels, Synthetic, Gaseous Fuels». Kirk‐Othmer Encyclopedia of Chemical Technology. doi:10.1002/0471238961.0701190519160509.a01. ISBN 9780471484943.
- ^ Wang, R. D.; Field, L. A.; Gillet d’Auriac, F. S. «Recovery of uranium from phosphate rocks». OSTI 6654998.
- ^ «Uranium from Phosphates | Phosphorite Uranium — World Nuclear Association».
- ^ «Brazil plans uranium-phosphate extraction plant in Santa Quitéria : Uranium & Fuel — World Nuclear News».
- ^ «NASA Mars Opportunity rover finds mineral vein deposited by water». NASA Jet Propulsion Laboratory. December 7, 2011. Retrieved April 23, 2013.
External links[edit]
- International Chemical Safety Card 1215
- NIOSH Pocket Guide to Chemical Hazards

|
|

|
|
| Names | |
|---|---|
| Other names
Plaster of Paris |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChEBI |
|
| ChEMBL |
|
| ChemSpider |
|
| DrugBank |
|
| ECHA InfoCard | 100.029.000 |
| EC Number |
|
| E number | E516 (acidity regulators, …) |
|
Gmelin Reference |
7487 |
| KEGG |
|
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
CaSO4 |
| Molar mass | 136.14 g/mol (anhydrous) 145.15 g/mol (hemihydrate) 172.172 g/mol (dihydrate) |
| Appearance | white solid |
| Odor | odorless |
| Density | 2.96 g/cm3 (anhydrous) 2.32 g/cm3 (dihydrate) |
| Melting point | 1,460 °C (2,660 °F; 1,730 K) (anhydrous) |
|
Solubility in water |
0.26 g/100ml at 25 °C (dihydrate)[1] |
|
Solubility product (Ksp) |
4.93 × 10−5 mol2L−2 (anhydrous) 3.14 × 10−5 (dihydrate) [2] |
| Solubility in glycerol | slightly soluble (dihydrate) |
| Acidity (pKa) | 10.4 (anhydrous) 7.3 (dihydrate) |
|
Magnetic susceptibility (χ) |
-49.7·10−6 cm3/mol |
| Structure | |
|
Crystal structure |
orthorhombic |
| Thermochemistry | |
|
Std molar |
107 J·mol−1·K−1 [3] |
|
Std enthalpy of |
-1433 kJ/mol[3] |
| Hazards | |
| NFPA 704 (fire diamond) |
1 0 0 |
| Flash point | Non-flammable |
| NIOSH (US health exposure limits): | |
|
PEL (Permissible) |
TWA 15 mg/m3 (total) TWA 5 mg/m3 (resp) [for anhydrous form only][4] |
|
REL (Recommended) |
TWA 10 mg/m3 (total) TWA 5 mg/m3 (resp) [anhydrous only][4] |
|
IDLH (Immediate danger) |
N.D.[4] |
| Safety data sheet (SDS) | ICSC 1589 |
| Related compounds | |
|
Other cations |
Magnesium sulfate Strontium sulfate Barium sulfate |
|
Related desiccants |
Calcium chloride Magnesium sulfate |
|
Related compounds |
Plaster of Paris Gypsum |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Calcium sulfate (or calcium sulphate) is the inorganic compound with the formula CaSO4 and related hydrates. In the form of γ-anhydrite (the anhydrous form), it is used as a desiccant. One particular hydrate is better known as plaster of Paris, and another occurs naturally as the mineral gypsum. It has many uses in industry. All forms are white solids that are poorly soluble in water.[5] Calcium sulfate causes permanent hardness in water.
Hydration states and crystallographic structures[edit]
The compound exists in three levels of hydration corresponding to different crystallographic structures and to minerals:
- CaSO
4 (anhydrite): anhydrous state.[6] The structure is related to that of zirconium orthosilicate (zircon): Ca2+
is 8-coordinate, SO2−
4 is tetrahedral, O is 3-coordinate. - CaSO
4·2H
2O (gypsum and selenite (mineral)): dihydrate.[7] - CaSO
4·1/2H
2O (bassanite): hemihydrate, also known as plaster of Paris. Specific hemihydrates are sometimes distinguished: α-hemihydrate and β-hemihydrate.[8]
Uses[edit]
The main use of calcium sulfate is to produce plaster of Paris and stucco. These applications exploit the fact that calcium sulfate which has been powdered and calcined forms a moldable paste upon hydration and hardens as crystalline calcium sulfate dihydrate. It is also convenient that calcium sulfate is poorly soluble in water and does not readily dissolve in contact with water after its solidification.
Hydration and dehydration reactions[edit]
With judicious heating, gypsum converts to the partially dehydrated mineral called bassanite or plaster of Paris. This material has the formula CaSO4·(nH2O), where 0.5 ≤ n ≤ 0.8.[8] Temperatures between 100 and 150 °C (212–302 °F) are required to drive off the water within its structure. The details of the temperature and time depend on ambient humidity. Temperatures as high as 170 °C (338 °F) are used in industrial calcination, but at these temperatures γ-anhydrite begins to form. The heat energy delivered to the gypsum at this time (the heat of hydration) tends to go into driving off water (as water vapor) rather than increasing the temperature of the mineral, which rises slowly until the water is gone, then increases more rapidly. The equation for the partial dehydration is:
- CaSO4 · 2 H2O → CaSO4 · 1/2 H2O + 1+1/2 H2O↑
The endothermic property of this reaction is relevant to the performance of drywall, conferring fire resistance to residential and other structures. In a fire, the structure behind a sheet of drywall will remain relatively cool as water is lost from the gypsum, thus preventing (or substantially retarding) damage to the framing (through combustion of wood members or loss of strength of steel at high temperatures) and consequent structural collapse. But at higher temperatures, calcium sulfate will release oxygen and act as an oxidizing agent. This property is used in aluminothermy. In contrast to most minerals, which when rehydrated simply form liquid or semi-liquid pastes, or remain powdery, calcined gypsum has an unusual property: when mixed with water at normal (ambient) temperatures, it quickly reverts chemically to the preferred dihydrate form, while physically «setting» to form a rigid and relatively strong gypsum crystal lattice:
- CaSO4 · 1/2 H2O + 1+1/2 H2O → CaSO4 · 2 H2O
This reaction is exothermic and is responsible for the ease with which gypsum can be cast into various shapes including sheets (for drywall), sticks (for blackboard chalk), and molds (to immobilize broken bones, or for metal casting). Mixed with polymers, it has been used as a bone repair cement. Small amounts of calcined gypsum are added to earth to create strong structures directly from cast earth, an alternative to adobe (which loses its strength when wet). The conditions of dehydration can be changed to adjust the porosity of the hemihydrate, resulting in the so-called α- and β-hemihydrates (which are more or less chemically identical).
On heating to 180 °C (356 °F), the nearly water-free form, called γ-anhydrite (CaSO4·nH2O where n = 0 to 0.05) is produced. γ-Anhydrite reacts slowly with water to return to the dihydrate state, a property exploited in some commercial desiccants. On heating above 250 °C, the completely anhydrous form called β-anhydrite or «natural» anhydrite is formed. Natural anhydrite does not react with water, even over geological timescales, unless very finely ground.
The variable composition of the hemihydrate and γ-anhydrite, and their easy inter-conversion, is due to their nearly identical crystal structures containing «channels» that can accommodate variable amounts of water, or other small molecules such as methanol.
Food industry[edit]
The calcium sulfate hydrates are used as a coagulant in products such as tofu.[9]
For the FDA, it is permitted in Cheese and Related Cheese Products; Cereal Flours; Bakery Products; Frozen Desserts; Artificial Sweeteners for Jelly & Preserves; Condiment Vegetables; and Condiment Tomatoes and some candies.[10]
It is known in the E number series as E516, and the UN’s FAO knows it as a firming agent, a flour treatment agent, a sequestrant, and a leavening agent.[10]
Dentistry[edit]
Calcium sulfate has a long history of use in dentistry.[11] It has been used in bone regeneration as a graft material and graft binder (or extender) and as a barrier in guided bone tissue regeneration. It is a biocompatible material and is completely resorbed following implantation.[12] It does not evoke a significant host response and creates a calcium-rich milieu in the area of implantation.[13]
Other uses[edit]
When sold at the anhydrous state as a desiccant with a color-indicating agent under the name Drierite, it appears blue (anhydrous) or pink (hydrated) due to impregnation with cobalt(II) chloride, which functions as a moisture indicator.
Up to the 1970s, commercial quantities of sulfuric acid were produced in Whitehaven (Cumbria, UK) from anhydrous calcium sulfate. Upon being mixed with shale or marl, and roasted, the sulfate liberates sulfur dioxide gas, a precursor in sulfuric acid production, the reaction also produces calcium silicate, a mineral phase essential in cement clinker production.[14]
- 2 CaSO4 + 2 SiO2 → 2 CaSiO3 + 2 SO2 + O2 [15]
The plant made sulfuric acid by the “Anhydrite Process” , in which cement clinker itself was a by-product. In this process, anhydrite (calcium sulfate) replaces limestone in a cement rawmix, and under reducing conditions, sulfur dioxide is evolved instead of carbon dioxide. The sulfur dioxide is converted to sulfuric acid by the Contact Process using a vanadium pentoxide catalyst. [16]
CaSO4 + 2 C → CaS + 2CO2
3 CaSO4 + CaS + 2 SiO2 → 2 Ca2SiO4 (belite) + 4 SO2
3 CaSO4 + CaS → 4 CaO + 4 SO2
Ca2SiO4 + CaO → Ca3OSiO4 (alite)
2 SO2 + O2 → 2 SO3
(in the presence of the catalyst vanadium pentoxide)
SO3 + H2O → H2SO4 [17]
Because of its use in an expanding niche market, the Whitehaven plant continued to expand in a manner not shared by the other Anhydrite Process plants. The anhydrite mine opened on 11/1/1955, and the acid plant started on 14/11/1955. For a while in the early 1970s, it became the largest sulfuric acid plant in the UK, making about 13% of national production, and it was by far the largest Anhydrite Process plant ever built. [18]
Production and occurrence[edit]
The main sources of calcium sulfate are naturally occurring gypsum and anhydrite, which occur at many locations worldwide as evaporites. These may be extracted by open-cast quarrying or by deep mining. World production of natural gypsum is around 127 million tonnes per annum.[19]
In addition to natural sources, calcium sulfate is produced as a by-product in a number of processes:
- In flue-gas desulfurization, exhaust gases from fossil-fuel power stations and other processes (e.g. cement manufacture) are scrubbed to reduce their sulfur oxide content, by injecting finely ground limestone:[20]
- SO2 + 0.5 O2 + CaCO3 → CaSO4 + CO2
Related sulfur-trapping methods use lime and some produces an impure calcium sulfite, which oxidizes on storage to calcium sulfate.
- In the production of phosphoric acid from phosphate rock, calcium phosphate is treated with sulfuric acid and calcium sulfate precipitates. The product, called phosphogypsum is often contaminated with impurities making its use uneconomic.
- In the production of hydrogen fluoride, calcium fluoride is treated with sulfuric acid, precipitating calcium sulfate.
- In the refining of zinc, solutions of zinc sulfate are treated with hydrated lime to co-precipitate heavy metals such as barium.
- Calcium sulfate can also be recovered and re-used from scrap drywall at construction sites.
These precipitation processes tend to concentrate radioactive elements in the calcium sulfate product. This issue is particular with the phosphate by-product, since phosphate ores naturally contain uranium and its decay products such as radium-226, lead-210 and polonium-210. Extraction of uranium from phosphorus ores can be economical on its own depending on prices on the uranium market or the separation of uranium can be mandated by environmental legislation and its sale is used to recover part of the cost of the process.[21][22][23]
Calcium sulfate is also a common component of fouling deposits in industrial heat exchangers, because its solubility decreases with increasing temperature (see the specific section on the retrograde solubility).
Retrograde solubility[edit]
The dissolution of the different crystalline phases of calcium sulfate in water is exothermic and releases heat (decrease in Enthalpy: ΔH < 0). As an immediate consequence, to proceed, the dissolution reaction needs to evacuate this heat that can be considered as a product of reaction. If the system is cooled, the dissolution equilibrium will evolve towards the right according to the Le Chatelier principle and calcium sulfate will dissolve more easily. Thus the solubility of calcium sulfate increases as the temperature decreases and vice versa. If the temperature of the system is raised, the reaction heat cannot dissipate and the equilibrium will regress towards the left according to Le Chatelier principle. The solubility of calcium sulfate decreases as temperature increases. This counter-intuitive solubility behaviour is called retrograde solubility. It is less common than for most of the salts whose dissolution reaction is endothermic (i.e., the reaction consumes heat: increase in Enthalpy: ΔH > 0) and whose solubility increases with temperature. Another calcium compound, calcium hydroxide (Ca(OH)2, portlandite) also exhibits a retrograde solubility for the same thermodynamic reason: because its dissolution reaction is also exothermic and releases heat. So, to dissolve the maximum amount of calcium sulfate or calcium hydroxide in water, it is necessary to cool the solution down close to its freezing point instead of increasing its temperature.
Temperature dependence of the solubility of calcium sulfate (3 phases) in pure water.
The retrograde solubility of calcium sulfate is also responsible for its precipitation in the hottest zone of heating systems and for its contribution to the formation of scale in boilers along with the precipitation of calcium carbonate whose solubility also decreases when CO2 degasses from hot water or can escape out of the system.
On planet Mars[edit]
2011 findings by the Opportunity rover on the planet Mars show a form of calcium sulfate in a vein on the surface. Images suggest the mineral is gypsum.[24]
See also[edit]
- Calcium sulfate (data page)
- Alabaster
- Anhydrite
- Bathybius haeckelii
- Chalk (calcium carbonate)
- Gypsum
- Gypsum plaster
- Phosphogypsum
- Selenite (mineral)
- Flue-gas desulfurization
References[edit]
- ^ Lebedev, A. L.; Kosorukov, V. L. (2017). «Gypsum Solubility in Water at 25°C» (PDF). Geochemistry International. 55 (2): 171–177. doi:10.1134/S0016702917010062. S2CID 132916752.
- ^ D.R. Linde (ed.) «CRC Handbook of Chemistry and Physics», 83rd Edition, CRC Press, 2002
- ^ a b Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. p. A21. ISBN 978-0-618-94690-7.
- ^ a b c NIOSH Pocket Guide to Chemical Hazards. «#0095». National Institute for Occupational Safety and Health (NIOSH).
- ^ Franz Wirsching «Calcium Sulfate» in Ullmann’s Encyclopedia of Industrial Chemistry, 2012 Wiley-VCH, Weinheim. doi:10.1002/14356007.a04_555
- ^ Morikawa, H.; Minato, I.; Tomita, T.; Iwai, S. (1975). «Anhydrite: A refinement». Acta Crystallographica Section B. 31 (8): 2164. doi:10.1107/S0567740875007145.
- ^ Cole, W.F.; Lancucki, C.J. (1974). «A refinement of the crystal structure of gypsum CaSO
4·2H
2O«. Acta Crystallographica Section B. 30 (4): 921. doi:10.1107/S0567740874004055. - ^ a b Taylor H.F.W. (1990) Cement Chemistry. Academic Press, ISBN 0-12-683900-X, pp. 186-187.
- ^ «About tofu coagulant». www.soymilkmaker.com. Sanlinx Inc. 31 August 2015.
- ^ a b «Compound Summary for CID 24497 — Calcium Sulfate». PubChem.
- ^ Titus, Harry W.; McNally, Edmund; Hilberg, Frank C. (1933-01-01). «Effect of Calcium Carbonate and Calcium Sulphate on Bone Development». Poultry Science. 12 (1): 5–8. doi:10.3382/ps.0120005. ISSN 0032-5791.
- ^ Thomas, Mark V.; Puleo, David A.; Al-Sabbagh, Mohanad (2005). «Calcium sulfate: a review». Journal of Long-Term Effects of Medical Implants. 15 (6): 599–607. doi:10.1615/jlongtermeffmedimplants.v15.i6.30. ISSN 1050-6934. PMID 16393128.
- ^ «Biphasic Calcium Sulfate — Overview». Augma Biomaterials. 2020-03-25. Retrieved 2020-07-16.
- ^ Whitehaven Coast Archeological Survey
- ^ COMMONWEALTH OF AUSTRALIA. DEPARTMENT OF SUPPLY AND SHIPPING. BUREAU OF MINERAL RESOURCES GEOLOGY AND GEOPHYSICS. REPORT NO.1949/44 (Geol. Ser. No. 27) by E.K. Sturmfels THE PRODUCTION OF SULPHURIC ACID AND PORTLAND CEMENT FROM CALCIUM SULPHATE AND ALUMINIUM SILICATES
- ^ Whitehaven anhydrate process
- ^ Whitehaven anhydrate process
- ^ website cement kilns whitehaven
- ^ Gypsum, USGS, 2008
- ^ Speight, James G. (2000). «Fuels, Synthetic, Gaseous Fuels». Kirk‐Othmer Encyclopedia of Chemical Technology. doi:10.1002/0471238961.0701190519160509.a01. ISBN 9780471484943.
- ^ Wang, R. D.; Field, L. A.; Gillet d’Auriac, F. S. «Recovery of uranium from phosphate rocks». OSTI 6654998.
- ^ «Uranium from Phosphates | Phosphorite Uranium — World Nuclear Association».
- ^ «Brazil plans uranium-phosphate extraction plant in Santa Quitéria : Uranium & Fuel — World Nuclear News».
- ^ «NASA Mars Opportunity rover finds mineral vein deposited by water». NASA Jet Propulsion Laboratory. December 7, 2011. Retrieved April 23, 2013.
External links[edit]
- International Chemical Safety Card 1215
- NIOSH Pocket Guide to Chemical Hazards
| Сульфат кальция | |
 |
|
| Общие | |
|---|---|
| Систематическое наименование | Сульфат кальция |
| Традиционные названия | кальций сернокислый, гипс, алебастр, селенит |
| Химическая формула | CaSO4 |
| Физические свойства | |
| Состояние (ст. усл.) | кристаллическое |
| Молярная масса | 136,1406 г/моль |
| Плотность | 2,96 г/см³ |
| Термические свойства | |
| Температура плавления | 1450 °C |
| Молярная теплоёмкость (ст. усл.) | 99.660 Дж/(моль·К) |
| Энтальпия образования (ст. усл.) | −1434,5 кДж/моль |
| Удельная теплота плавления | < Дж/кг |
| Химические свойства | |
| Растворимость в воде | 0,2036 г/100 мл |
| Классификация | |
| Рег. номер CAS | 7778-18-9 |
| SMILES | [O-]S(=O)(=O)[O-].[Ca+2] |
Сульфа́т ка́льция (CaSO4) — неорганическое соединение, кальциевая соль серной кислоты.
Находится в природе в виде дигидрата CaSO4 ∙ 2H2O (гипс, селенит) и в безводном состоянии — ангидрит.
Безводный сульфат кальция — бесцветные кристаллы при нормальных условиях — с ромбической кристаллической решёткой, плотность 2,96 г/см³, температура плавления 1450 °C. При повышенных температурах (свыше 1200 °C) может существовать в виде стабильной кубической модификации или двух метастабильных α- и β-гексагональных модификаций. Очень медленно присоединяет воду, гидратируясь до кристаллогидрата с 1/2 или 2 молекулами воды на 1 молекулу сульфата, соответственно CaSO4 · 0,5H2О и CaSO4 · 2H2О. В воде растворим незначительно. Растворимость падает с повышением температуры: если при 20 °C она составляет 0,2036 г/100 г воды, то вблизи точки кипения воды (100 °C) снижается до 0,067 г сульфата на 100 г воды. Растворённый в природной воде сульфат кальция является одним из факторов, определяющих жёсткость воды.
В индустриальных масштабах добывают в составе природных минералов, например гипса, селенита или алебастра или получают синтетическим путём — сплавлением CaCl2 с K2SO4.
В аналитической химии может быть получен воздействием серной кислоты на оксид, карбонат, оксалат или ацетат кальция.
Образуется в результате окисления сульфида кальция при нагреве до 700—800 °C по реакции CaS + 2O2 = CaSO4.
При повышении температуры, но не более чем до 180 °C двуводный сульфат кальция теряет часть воды, переходя в полуводный — так называемый «жжёный гипс», пригодный для дальнейшего применения как вяжущее вещество. При дальнейшем нагреве до 220 °C гипс полностью теряет воду, образуя безводный CaSO4, который лишь при длительном хранении поглощает влагу и переходит в полугидрат. Если обжиг вести при температуре выше 220 °C, то получается безводный CaSO4, который влагу уже не поглощает и не «схватывается» при смешивании с водой (это вещество нередко называют «мёртвый гипс»). При дальнейшем нагревании до 900—1200 °C можно получить «гидравлический гипс», который после охлаждения вновь обретает свойства связываться с водой. Первый способ частичной дегидратиции применяют в промышленных условиях для получения полугидрата сульфата кальция (жжёного гипса, алебастра) CaSO4 ∙ 0,5H2O, нагревая дигидрат примерно до 140 °C, уравнение реакции: CaSO4 · 2H2О = CaSO4 · 0,5H2О + 1,5H2О. Значительные объёмы полученного таким путём алебастра используются в строительстве (из него изготавливают сухую штукатурку, плиты и панели для перегородок, гипсовые камни, архитектурные детали и др.). Изделия из гипса характеризуются сравнительно небольшой плотностью, несгораемостью и относительно невысокой теплопроводностью. Свойство алебастра затвердевать при смешении с водой нашло применение и в медицине, и в искусстве. «Это свойство гипса широко используют в ортопедии, травматологии и хирургии для изготовления гипсовых повязок, обеспечивающих фиксацию отдельных частей тела. Отвердевание замешанного с водой гипса сопровождается небольшим увеличением объёма. Это позволяет проводить тонкое воспроизведение всех деталей лепной формы, что широко используют скульпторы и архитекторы.» [1].
Регистрационный номер CAS:
- ангидрат 7778-18-9 [2];
- полугидрат 10034-76-1 [3];
- двугидрат 10101-41-4 [4].
Применение
В пищевой промышленности зарегистрирован в качестве пищевой добавки эмульгатора E516.
Искусственные кристаллы сульфата кальция, легированные марганцем или самарием, применяются как термолюминесцентный материал.
Безводный сульфат кальция в силу своих гигроскопичных свойств применяется как влагопоглотитель. Нередко с помощью специальных добавок ему в этом качестве придают дополнительные свойства. Так, осушитель Drierite, состоящий из ангидрата с добавкой хлорида кобальта, меняет свою изначально голубую окраску на розовую, что позволяет своевременно отследить момент исчерпания ресурса препарата.
Сульфат кальция может применяться в качестве коагулянта, например, при изготовлении тофу.
Примечания
- ↑ Химия вокруг нас. Строительные материалы. Книги. Наука и техника
- ↑ Common Chemistry — Substance Details — 7778-18-9 : Sulfuric acid, calcium salt (1:1)
- ↑ Common Chemistry — Substance Details — 10034-76-1 : Sulfuric acid, calcium salt, hydrate (2:2:1)
- ↑ Common Chemistry — Substance Details — 10101-41-4 : Sulfuric acid, calcium salt (1:1), dihydrate
См. также
- Сульфаты
- Пищевые добавки
- Штукатурка
- Гипсокартон
|
Соединения кальция |
|---|
|
Алюминаты кальция (mCaO·nAl2O3) • Алюмогидрид кальция (Ca[AlH4]2) • Амид кальция (Ca(NH2)2) • Арсенат кальция (Ca3(AsO4)2) • Ацетат кальция ((CH3COO)2Ca) • Бисульфид кальция (Ca(HS)2) • Борат кальция (Ca3(BO3)2) • Бромид кальция (CaBr2) • Вольфрамат кальция (CaWO4) • Гексаборид кальция (CaB6) • Гексафторсиликат кальция (CaSiF6) • Гидрид кальция (CaH2) • Гидроксид кальция (Ca(OH)2) • Гидроортофосфат кальция (CaHPO4) • Гипофосфит кальция (Ca(PH2O2)) • Гипохлорит кальция (Ca(ClO)2) • Глицерофосфат кальция (C3H7CaO6P) • Глюконат кальция (C12H22CaO14) • Дигидрокарбонат кальция (Ca(HCO3)2) • 2,5-дигидроксибензолсульфонат кальция (C12H10CaO10S2) • Дигидроортофосфат кальция (Ca(H2PO4)2) • Иодат кальция (Ca(IO3)2) • Иодид кальция (CaI2) • Карбид кальция (CaC2) • Карбонат кальция (CaCO3) • Моносилицид кальция (CaSi) • Нитрат кальция (Са(NО3)2) • Нитрид кальция (Ca3N2) • Оксалат кальция (СаС2О4) • Оксид кальция (CaO) • Ортофосфат кальция (Ca3(PO4)2) • Перманганат кальция (Ca(MnO4)2) • Пероксид кальция (CaO2) • Пирофосфат кальция (Ca2P2O7) • Силикат кальция (CaSiO3) • Силицид дикальция (Ca2Si) • Силицид кальция (CaSi2) • Сульфат кальция (CaSO4) • Сульфид кальция (CaS) • Сульфит кальция (CaSO3) • Тетрагидроалюминат кальция (Ca(AlH4)2) • Титанат кальция (CaTiO3) • Триметафосфат кальция (Ca3(P3O9)2) • Флюорит (CaF2) • Формиат кальция (Ca(HCOO)2) • Фосфид кальция (Ca3P2) • Фторид кальция (CaF2) • Хлорат кальция (Ca(ClO3)2) • Хлорид кальция (CaCl2) • Хлорная известь (Ca(Cl)OCl) • Хромат кальция (CaCrO4) • Цианамид кальция (CaCN2) • Цианид кальция (Ca(CN)2) • Цитрат кальция (Ca3(C6H5O7)2) • |
|
Растворимость кислот, оснований и солей в воде |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
Сульфаты |
|---|
|
Алюм (KAl(SO4)2•12H2O) • Аммоний сульфата алюминия ((NH4)Al(SO4)2) • Аммоний-железо сульфат (NH4Fe(SO4)2) • Аммоний-железо(II) сульфат ([NH4]2[Fe][SO4]2) • Аммоний-железо(III) сульфат (NH4Fe(SO4)2) • Аммоний-церий(IV) сульфат ((NH4)4Ce(SO4)4) • Гептагидрат сульфата магния (MgSO4) • Гидросульфат аммония ((NH4)HSO4) • Гидросульфат калия (KHSO4) • Гидросульфат натрия (NaHSO4) • Дисульфат калия (K2S2O7) • Дисульфат натрия (Na2S2O7) • Железа(III) основный сульфат ([Fe3(SO4)5](OH)2) • Квасцы • Купорос • Оксид-сульфат титана (TiOSO4) • Олеум (H2SO4•xSO3) • Пиросерная кислота (H2S2O7) • Серная кислота (H2SO4) • Соли Туттона • Сульфат актиния(III) (Ac2(SO4)3) • Сульфат алюминия (Al2(SO4)3) • Сульфат алюмонатрия (NaAl(SO4)2) • Сульфат аммония ((NH4)2SO4) • Сульфат бария (BaSO4) • Сульфат бериллия (BeSO4) • Сульфат ванадила (VOSO4) • Сульфат ванадия(III) (V2(SO4)3) • Сульфат висмута (Bi2(SO4)3) • Сульфат гидроксиаммония ((NH3OH)2SO4) • Сульфат железа(II) (FeSO4) • Сульфат железа(III) (Fe2(SO4)3) • Сульфат индия(III) (In2(SO4)3) • Сульфат иридия(III) (Ir2(SO4)3) • Сульфат кадмия (CdSO4) • Сульфат калия (K2SO4) • Сульфат кальция (CaSO4) • Сульфат кобальта(II) (CoSO4) • Сульфат кобальта(III) (Co2(SO4)3) • Сульфат лития (Li2SO4) • Сульфат магния (MgSO4) • Сульфат марганца(II) (MnSO4) • Сульфат марганца(III) (Mn2(SO4)3) • Сульфат меди(I) (Cu2SO4) • Сульфат меди(II) (CuSO4) • Сульфат натрия (Na2SO4) • Сульфат никеля(II) (NiSO4) • Сульфат олова(II) (SnSO4) • Сульфат празеодима (Pr2(SO4)3) • Сульфат ртути(I) (Hg2SO4) • Сульфат ртути(II) (HgSO4) • Сульфат свинца(II) (PbSO4) • Сульфат серебра (Ag2SO4) • Сульфат стронция (SrSO4) • Сульфат сурьмы (Sb2(SO4)3) • Сульфат таллия(I) (Tl2SO4) • Сульфат таллия(III) (Tl2(SO4)3) • Сульфат тетраамина меди (Cu(NH3)4SO4) • Сульфат титана(III) (Ti2(SO4)3) • Сульфат титана(IV) (Ti(SO4)2) • Сульфат урана (U(SO4)2) • Сульфат уранила (UO2SO4) • Сульфат хрома(III) (Cr2(SO4)3) • Сульфат хрома(III)-калия (KCr(SO4)2) Сульфат цезия (Cs2SO4) • Сульфат церия(IV) (Ce(SO4)2) • Сульфат цинка (ZnSO4) • Сульфат циркония (Zr(SO4)2) |
Поиск химических веществ по названиям или формулам.
Справочник содержит названия веществ и описания химических формул (в т.ч. структурные формулы и скелетные формулы).
Введите часть названия или формулу для поиска:
Языки:
По умолчанию |
Все возможные |
Из списка
|
Применить к найденному
Сульфат кальция
Брутто-формула:
CaO4S
CAS# 7778-18-9
Категории:
Неорганические соли
PubChem CID: 24497
| ChemSpider ID: 22905
| CHEMBL2106140
| CHEBI:31346
Названия
Русский:
- Сульфат кальция(IUPAC) [Wiki]
- алебастр
- гипс
- кальций сернокислый
- кальция сульфат
- селенит
English:
- Anhydrite
- Anhydrous gypsum
- Calcium sulfate(IUPAC) [Wiki]
- Crysalba
- Drierite
- EINECS:231-900-3
- Gypsum
- Karstenite
- Muriacite
- Osteoset
- Sulfuric acid, calciumsalt (1:1)(CAS)
- Thiolite
Варианты формулы:
CaSO4
Ca(+2)S(+6)O(-2)4
Ca^2+O//S`|O|<_(A80,w+)O^->dO^-
Ca^++/0O`^-# -S`|O|<=O>|O^-
Вещества, имеющие отношение…
Анион:
Сульфаты
Химический состав
Реакции, в которых участвует Сульфат кальция
-
{M}O + H2{A} -> {M}{A} + H2O
, где M =
Cu Ca Mg Ba Sr Hg Mn Cr Ni Fe Zn Pb Co; A =
SO4 -
{M}(OH)2 + SO3 -> {M}SO4 + H2O
, где M =
Ca Ba Sr Mn -
{M}O + SO3 -> {M}SO4
, где M =
Ca Ba Sr -
{M}(OH)2 + H2{X} = {M}{X} + 2H2O
, где M =
Mg Ca Ba Sr Cu Zn; X =
SO4 SO3 CO3 -
{M} + H2{X} -> {M}{X} + H2″|^»
, где M =
Mg Ca Ba Sr Zn Cd Fe; X =
SO4
И ещё 19 реакций…
Физические свойства
Сульфат кальция CaSO4 — соль металла кальция и серной кислоты. Белый. Весьма гигроскопичный. При плавлении разлагается. Мало растворяется в воде.
Относительная молекулярная масса Mr = 136,14; относительная плотность для тв. и ж. состояния d = 2,96; tпл = 1450º C (разлагается).
Способ получения
1. В результате взаимодействия хлорида кальция и сульфата калия при 800º С образуется сульфат кальция и хлорид калия:
CaCl2 + K2SO4 = CaSO4 + 2KCl
2. Сульфат магния взаимодействует с перхлоратом кальция с образованием сульфата кальция и перхлората магния:
MgSO4 + Ca(ClO4)2 = СаSO4 + Mg(ClO4)2
3. Гидроксид кальция вступает в реакцию с серной кислотой и образует сульфат кальция и воду:
Ca(OH)2 + H2SO4 = CaSO4↓ + 2H2O
Качественная реакция
Качественная реакция на сульфат кальция — взаимодействие его с хлоридом бария, в результате реакции происходит образование белого осадка , который не растворим в азотной кислоте:
1. При взаимодействии с хлоридом бария, сульфат кальция образует сульфат бария и хлорид кальция:
CaSO4 + BaCl2 = BaSO4↓ + CaCl2
Химические свойства
1. Сульфат кальция реагирует с простыми веществами:
1.1. Сульфат кальция взаимодействует с углеродом (коксом) при 900º С и образует сульфид кальция, угарный газ или углекислый газ:
CaSO4 + 4C = CaS + 4CO
2. Сульфат кальция вступает в реакцию со многими сложными веществами:
2.1. Сульфат кальция взаимодействует с оксидами:
2.1.1. Сульфат в результате реакции с угарным газом при 600 — 800º С образует сульфид кальция и углекислый газ:
CaSO4 + 4CO = CaS + 4CO2
2.2. Сульфат кальция может реагировать с кислотами:
2.2.1. При взаимодействии с концентрированной серной кислотой сульфат кальция образует гидросульфат кальция:
CaSO4 + H2SO4 = Ca(HSO4)2
2.3. Сульфат кальция реагирует с солями:
2.3.1. Сульфат кальция взаимодействует с концентрированным раствором карбоната натрия. При этом образуются карбонат кальция и сульфат натрия:
CaSO4 + Na2CO3 = CaCO3 + Na2SO4
3. Сульфат кальция разлагается при температуре выше 1450º С, образуя оксид кальция, оксид серы и кислород:
2CaSO4 = 2CaO + 2SO2 + O2
 |
|
 |
|
| Имена | |
|---|---|
| Другие названия Парижский гипс. Дриерит. Гипс | |
| Идентификаторы | |
| Номер CAS |
|
| 3D-модель (JSmol ) |
|
| ChEBI |
|
| ChEMBL |
|
| ChemSpider |
|
| DrugBank |
|
| ECHA InfoCard | 100.029.000 |
| Номер ЕС |
|
| Номер E | E516 (регуляторы кислотности,…) |
| Справочник Gmelin | 7487 |
| KEGG |
|
| PubChem CID |
|
| номер RTECS |
|
| UNII |
|
| CompTox Dashboard (EPA ) |
|
InChI
|
|
УЛЫБАЕТСЯ
|
|
| Свойства | |
| Химическая формула | CaSO 4 |
| Молярная масса | 136,14 г / моль (безводный). 145,15 г / моль (полугидрат). 172,172 г / моль (дигидрат) |
| Внешний вид | белое твердое вещество |
| Запах | без запаха |
| Плотность | 2,96 г / см (безводный). 2,32 г / см (дигидрат) |
| Точка плавления | 1460 ° C (2660 ° F; 1730 K) (безводный) |
| Растворимость в воде | 0,21 г / 100 мл при 20 ° C (безводный). 0,24 г / 100 мл при 20 ° C (дигидрат) |
| Произведение растворимости (Ksp) | 4,93 × 10 моль (безводный). 3,14 × 10 (дигидрат). |
| Растворимость в глицерине | малорастворимый (дигидрат) |
| Кислотность (pK a) | 10,4 (безводный). 7,3 (дигидрат) |
| Магнитная восприимчивость (χ) | -49,7 · 10 см / моль |
| Структура | |
| Кристаллическая структура | орторомбическая |
| Термохимия | |
| Стандартные молярные. энтропия (S 298) | 107 Дж · моль · K |
| Стандартная энтальпия образования. (ΔfH298) | -1433 кДж / моль |
| Опасности | |
| Паспорт безопасности | См.: страница данных. ICSC 1589 |
| NFPA 704 (огненный алмаз) |  0 1 0 0 1 0 |
| Температура вспышки | Невоспламеняющийся |
| NIOSH (пределы воздействия на здоровье в США): | |
| PEL (допустимое) | TWA 15 мг / м (всего) TWA 5 мг / м (соответственно) [только для безводной формы] |
| REL (рекомендуется) | TWA 10 мг / м (всего) TWA 5 мг / м (соответственно) [только безводный] |
| IDLH (непосредственная опасность) | ND |
| Связанная со фунты | |
| Другие катионы | Сульфат магния. Сульфат стронция. Сульфат бария |
| Связанные осушители | Хлорид кальция. Сульфат магния |
| Связанные соединения | Парижский гипс. Гипс |
| Страница дополнительных данных | |
| Структура и. свойства | Показатель преломления (n),. Диэлектрическая проницаемость (εr) и т. Д. |
| Термодинамические. данные | Фазовое поведение. твердое тело – жидкость – газ |
| Спектральные данные | UV, IR, ЯМР, MS |
| Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки в ink | |
Сульфат кальция (или сульфат кальция ) представляет собой неорганическое соединение с формулой CaSO 4 и родственные гидраты. В форме γ- ангидрита (безводная форма) он используется как осушитель. Один конкретный гидрат более известен как гипс, а другой встречается в природе как минерал гипс. Он имеет множество применений в промышленности. Все формы представляют собой белые твердые вещества, которые плохо растворяются в воде. Сульфат кальция вызывает постоянную жесткость воды.
Содержание
- 1 Состояния гидратации и кристаллографические структуры
- 2 Использование
- 2.1 Реакции гидратации и дегидратации
- 2.2 Пищевая промышленность
- 2.3 Стоматология
- 2.4 Другое применение
- 3 Производство и распространение
- 4 Ретроградная растворимость
- 5 На планете Марс
- 6 См. Также
- 7 Ссылки
- 8 Внешние ссылки
Состояния гидратации и кристаллографические структуры
Соединение существует на трех уровнях гидратации, соответствующей различным кристаллографическим структурам и разным минералам в природе:
- CaSO 4(ангидрит ): безводное состояние.
- CaSO 4 · 2 H 2 O (гипс и селенит (минерал) ): дигидрат.
- CaSO 4 · ⁄ 2H2O ( бассанит ): полугидрат, также известный как гипс Парижа. Иногда выделяют конкретные полугидраты: α-полугидрат и β-полугидрат.
Использование
Основное применение сульфата кальция — производство гипса и штукатурки. В этих применениях используется тот факт, что сульфат кальция, который был измельчен и кальцинирован, образует формуемую пасту при гидратации и затвердевает в виде кристаллического дигидрата сульфата кальция. Также удобно, что сульфат кальция плохо растворим в воде и не растворяется легко при контакте с водой после его затвердевания.
Реакции гидратации и дегидратации
При разумном нагревании гипс превращается в частично обезвоженный минерал, называемый бассанитом или гипсом. Этот материал имеет формулу CaSO 4 · (nH 2 O), где 0,5 ≤ n ≤ 0,8. Температура от 100 до 150 ° C (212–302 ° F) требуется, чтобы отогнать воду внутри его конструкции. Детали температуры и времени зависят от влажности окружающей среды. При промышленном обжиге используются температуры до 170 ° C (338 ° F), но при этих температурах начинает образовываться γ-ангидрит. Тепловая энергия, передаваемая гипсу в это время (теплота гидратации), имеет тенденцию уходить в отгонку воды (в виде водяного пара), а не на повышение температуры минерала, которая медленно повышается, пока вода не уйдет, а затем увеличивается быстрее.. Уравнение частичной дегидратации:
- CaSO 4 · 2 H 2 O → CaSO 4 · 1/2 H 2 O + 1 + 1/2 H 2O↑
Свойство эндотермии этой реакции имеет отношение к характеристикам гипсокартона, придающим огнестойкость жилым и другим конструкциям. При пожаре конструкция за листом гипсокартона будет оставаться относительно холодной, поскольку вода теряется из гипса, таким образом предотвращая (или существенно замедляя) повреждение каркаса (из-за возгорания деревянные элементы или потеря прочности стали при высоких температурах) и последующее разрушение конструкции. Но при более высоких температурах сульфат кальция выделяет кислород и действует как окислитель. Это свойство используется в алюминотермии. В отличие от большинства минералов, которые при регидратации просто образуют жидкие или полужидкие пасты или остаются порошкообразными, кальцинированный гипс имеет необычное свойство: при смешивании с водой при нормальной (окружающей) температуре он быстро химически превращается в предпочтительную форму дигидрата, при физическом «схватывании» с образованием жесткой и относительно прочной кристаллической решетки гипса:
- CaSO 4 · 1/2 H 2 O + 1 + 1/2 H 2 O → CaSO 4 · 2 H 2O
Эта реакция является экзотермической и отвечает за легкость, с которой гипс можно отливать в различные формы, включая листы (для гипсокартон ), палки (для школьной доски) и формы (для иммобилизации сломанных костей или для металлического литья). Смешанный с полимерами, он использовался в качестве цемента для восстановления костей. Небольшие количества кальцинированного гипса добавляются в землю для создания прочных конструкций непосредственно из литой земли, альтернативы саману (который теряет свою прочность при намокании). Условия дегидратации можно изменить, чтобы отрегулировать пористость полугидрата, что приведет к так называемым α- и β-полугидратам (которые более или менее химически идентичны).
При нагревании до 180 ° C (356 ° F) почти безводная форма, называемая γ-ангидритом (CaSO 4 · nH 2 O, где n = От 0 до 0,05). -ангидрит медленно реагирует с водой, возвращаясь в состояние дигидрата, свойство, используемое в некоторых коммерческих осушителях. При нагревании выше 250 ° C образуется полностью безводная форма, называемая β-ангидритом или «природным» ангидритом. Природный ангидрит не вступает в реакцию с водой даже в геологических масштабах, если только его не измельчить очень мелко.
Переменный состав полугидрата и γ-ангидрита и их легкое взаимное превращение обусловлено их почти идентичными кристаллическими структурами, содержащими «каналы», которые могут принимать переменные количества воды или других небольших молекул, таких как метанол.
Пищевая промышленность
Гидраты сульфата кальция используются в качестве коагулянта в таких продуктах, как тофу.
Для FDA, это разрешено в сыре и родственных сырных продуктах; Зерновая мука; Хлебобулочные изделия; Замороженные десерты; Искусственные подсластители для желе и консервов; Приправы для овощей; и приправы для томатов и некоторых конфет.
Он известен в серии E number как E516, и ФАО знает его как укрепляющий агент, средство для обработки муки., секвестрант и разрыхлитель.
Стоматология
Сульфат кальция давно используется в стоматологии. Он использовался при регенерации кости в качестве материала трансплантата и связующего / расширителя трансплантата, а также в качестве барьера при направленной регенерации тканей. Это необычайно биосовместимый материал, который полностью рассасывается после имплантации. Он не вызывает значительного ответа хозяина и создает среду, богатую кальцием в области имплантации.
Другое применение

При продаже в безводном состоянии в качестве осушителя с указанием цвета агента под названием дриерит, он выглядит синим (безводный) или розовым (гидратированный) из-за пропитки хлоридом кобальта (II), который функционирует как индикатор влажности.
До 1970-х годов серная кислота производилась в промышленных количествах в Whitehaven (Cumbria, UK) из безводного сульфата кальция. После смешивания с сланцем или мергелем и обжига сульфат выделяет газ триоксид серы, прекурсор в производстве серной кислоты, В результате реакции также образуется силикат кальция, минеральная фаза, необходимая для производства цемента клинкера.
- CaSO 4 + SiO 2 → CaSiO 3 + SO 3
Производство и наличие
Основными источниками сульфата кальция являются природные гипс и ангидрит, которые встречаются во многих местах по всему миру как эвапориты. Их можно добывать открытым способом или глубокой добычей. Мировое производство природного гипса составляет около 127 миллионов тонн в год.
Помимо природных источников, сульфат кальция производится как побочный продукт в ряде процессов:
- В дымовых газах десульфурация, выхлопные газы электростанций, работающих на ископаемом топливе и других процессов (например, производства цемента), очищаются для снижения содержания в них оксида серы путем впрыскивания тонко измельченного известняка или лайм. При этом образуется нечистый сульфит кальция, который при хранении окисляется до сульфата кальция.
- При производстве фосфорной кислоты из фосфатной руды кальций фосфат обрабатывают серной кислотой и осаждают сульфат кальция.
- При производстве фтороводорода фторид кальция обрабатывают серной кислотой, в результате чего осаждается сульфат кальция.
- При рафинировании цинка растворы сульфата цинка обрабатывают известью для совместного осаждения тяжелых металлов, таких как барий.
- Сульфат кальция также можно извлекать и повторно использовать из лома гипсокартона на строительных площадках.
Эти процессы осаждения имеют тенденцию концентрировать радиоактивные элементы в сульфате кальция. Эта проблема особенно характерна для фосфатных побочных продуктов, поскольку фосфатные руды естественным образом содержат уран и его продукты распада, такие как радий-226, свинец- 210 и полоний-210.
Сульфат кальция также является обычным компонентом засоряющих отложений в промышленных теплообменниках, поскольку его растворимость уменьшается с повышением температуры (см. Специальный раздел о ретроградном растворимость).
Ретроградная растворимость
Растворение различных кристаллических фаз сульфата кальция в воде экзотермическое с выделением тепла (уменьшение энтальпии : ΔH < 0). As an immediate consequence, to proceed, the dissolution reaction needs to evacuate this heat that can be considered as a product of reaction. If the system is cooled, the dissolution equilibrium will evolve towards the right according to the Принцип Ле-Шателье и сульфат кальция растворяются легче. Растворимость сульфата кальция увеличивается, таким образом, при понижении температуры. Если температура системы повышается, тепло реакции не может рассеиваться и равновесие будет регрессировать влево в соответствии с принципом Ле Шателье. Растворимость сульфата кальция уменьшается, таким образом, при повышении температуры. Такое противоречивое поведение растворимости называется ретроградной растворимостью. Оно встречается реже, чем для большинства солей, реакция растворения которых <85.>эндотермический (т.е. реакция потребляет тепло: увеличение энтальпии : ΔH>0), растворимость которого увеличивается с температурой. Другое соединение кальция, гидроксид кальция (Ca (OH) 2, портландит ) также имеет ретрографию нерастворимость по той же термодинамической причине: потому что реакция его растворения также экзотермична и выделяет тепло. Таким образом, чтобы растворить в воде большее количество сульфата или гидроксида кальция, необходимо охладить раствор до точки его замерзания, а не повышать его температуру.

Ретроградная растворимость сульфата кальция также ответственна за его осаждение в самой горячей зоне систем отопления и за его вклад в образование накипь в котлах вместе с осаждением карбоната кальция, растворимость которого также уменьшается, когда CO2 дегазирует из горячей воды или может улетучиваться из система.
На планете Марс
Результаты 2011 года, полученные марсоходом Opportunity на планете Марс, показывают форму сульфата кальция в вене на поверхности. Изображения показывают, что минерал — это гипс.
См. Также
- Сульфат кальция (страница данных)
- Алебастр
- Ангидрит
- Bathybius haeckelii
- Мел (карбонат кальция)
- Гипс
- Гипс
- Фосфогипс
- Селенит (минерал)
- Обессеривание дымовых газов
Ссылки
Внешние ссылки
- Международная карта химической безопасности 1215
- Карманное руководство NIOSH на химические опасности
КАЛЬЦИЯ СУЛЬФАТ
сернокислый кальций, CaSO4, соль. Находится в природе в виде дигидрата CaSO4․2H2O (гипс, селенит) и в безводном состоянии — ангидрит. Безводный К. с. — бесцветные кристаллы, плотность 2,96 г/см3, tпл 1450°C; очень медленно присоединяет воду. В воде растворим незначительно (г на 100 г H2O): 0,2036 (20 °С), 0,067 (100 °С). Известен так называемый полуобожжённый гипс CaSO4․1/2H2O; будучи замешан в кашицу с водой, он быстро твердеет, превращаясь в CaSO4․2H2O. Применяют К. с. для изготовления фигур, слепков, как строительный материал (см. Гипс, Гипсовые вяжущие материалы) и в медицине (см. Кальций).
КАЛЬЦИЯ СУЛЬФИД →← КАЛЬЦИЯ ОКИСЬ
Смотреть что такое КАЛЬЦИЯ СУЛЬФАТ в других словарях:
КАЛЬЦИЯ СУЛЬФАТ
CaSO4, бесцв. кристаллы; до 1200°С устойчива ромбич. модификация — ангидрит ( а =0,699 нм, b= 0,700 нм, с =0,624 нм, z =4, пространств. группа Атта);… смотреть
КАЛЬЦИЯ СУЛЬФАТ
CaSO4, бесцв. кристаллы. Плохо растворим в воде. Осн. минералы: ангидрит CaSO4 и гипс CaSO4 х 2H2O. «Полуобожжёпный» гипс CaSO41/2Н2O, будучи замешан с… смотреть
КАЛЬЦИЯ СУЛЬФАТ
КАЛЬЦИЯ СУЛЬФАТ — CaSO4, бесцветные кристаллы. Плохо растворим в воде. Основные минералы: ангидрит CaSO4 и гипс CaSO4 . 2H2O. «Полуобожженный» гипс CaSO4 . 1/2H2O, будучи замешан с водой, быстро твердеет, превращаясь в CaSO4 . 2H2O. Это свойство используют в строительстве, для изготовления слепков, наложения гипсовых повязок в медицине.<br>… смотреть
КАЛЬЦИЯ СУЛЬФАТ
КАЛЬЦИЯ СУЛЬФАТ , CaSO4, бесцветные кристаллы. Плохо растворим в воде. Основные минералы: ангидрит CaSO4 и гипс CaSO4 · 2H2O. «Полуобожженный» гипс CaSO4 · 1/2H2O, будучи замешан с водой, быстро твердеет, превращаясь в CaSO4 · 2H2O. Это свойство используют в строительстве, для изготовления слепков, наложения гипсовых повязок в медицине…. смотреть
КАЛЬЦИЯ СУЛЬФАТ
КАЛЬЦИЯ СУЛЬФАТ, CaSO4, бесцветные кристаллы. Плохо растворим в воде. Основные минералы: ангидрит CaSO4 и гипс CaSO4 · 2H2O. «Полуобожженный» гипс CaSO4 · 1/2H2O, будучи замешан с водой, быстро твердеет, превращаясь в CaSO4 · 2H2O. Это свойство используют в строительстве, для изготовления слепков, наложения гипсовых повязок в медицине…. смотреть
КАЛЬЦИЯ СУЛЬФАТ
— CaSO4, бесцветные кристаллы. Плохо растворим в воде.Основные минералы: ангидрит CaSO4 и гипс CaSO4 . 2H2O. «»Полуобожженный»»гипс CaSO4 . 1/2H2O, будучи замешан с водой, быстро твердеет, превращаясьв CaSO4 . 2H2O. Это свойство используют в строительстве, для изготовленияслепков, наложения гипсовых повязок в медицине…. смотреть
КАЛЬЦИЯ СУЛЬФАТ ЖЖЕНЫЙ
КАЛЬЦИЯ СУЛЬФАТ ЖЖЕНЫЙ. Calcii sulfas ustum.Синоним: жженый гипс.Свойства.Сухой мелкий аморфный порошок белого или слегка сероватого цвета.Мало раствор… смотреть
