Magnesium sulfate hexahydrate |
|

Anhydrous magnesium sulfate |
|

Epsomite (Magnesium sulfate heptahydrate) |
|
| Names | |
|---|---|
| IUPAC name
Magnesium sulfate |
|
Other names
|
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChEBI |
|
| ChEMBL |
|
| ChemSpider |
|
| DrugBank |
|
| ECHA InfoCard | 100.028.453 |
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
MgSO4 |
| Molar mass |
|
| Appearance | white crystalline solid |
| Odor | odorless |
| Density |
|
| Melting point |
|
|
Solubility in water |
|
|
Solubility product (Ksp) |
738 (502 g/L) |
| Solubility |
|
|
Magnetic susceptibility (χ) |
−50·10−6 cm3/mol |
|
Refractive index (nD) |
1.523 (monohydrate) 1.433 (heptahydrate) |
| Structure | |
|
Crystal structure |
monoclinic (hydrate) |
| Pharmacology | |
|
ATC code |
A06AD04 (WHO) A12CC02 (WHO) B05XA05 (WHO) D11AX05 (WHO) V04CC02 (WHO) |
| Hazards | |
| NFPA 704 (fire diamond) |
1 0 0 |
| Safety data sheet (SDS) | External MSDS |
| Related compounds | |
|
Other cations |
|
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
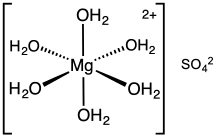
Magnesium sulfate or magnesium sulphate (in English-speaking countries other than the US) is a chemical compound, a salt with the formula MgSO4, consisting of magnesium cations Mg2+ (20.19% by mass) and sulfate anions SO2−4. It is a white crystalline solid, soluble in water but not in ethanol.
Magnesium sulfate is usually encountered in the form of a hydrate MgSO4·nH2O, for various values of n between 1 and 11. The most common is the heptahydrate MgSO4·7H2O, known as Epsom salt, which is a household chemical with many traditional uses, including bath salts.[1]
The main use of magnesium sulfate is in agriculture, to correct soils deficient in magnesium (an essential plant nutrient because of the role of magnesium in chlorophyll and photosynthesis). The monohydrate is favored for this use; by the mid 1970s, its production was 2.3 million tons per year.[2] The anhydrous form and several hydrates occur in nature as minerals, and the salt is a significant component of the water from some springs.
Hydrates[edit]
Magnesium sulfate can crystallize as several hydrates, including:
- Anhydrous, MgSO4; unstable in nature, hydrates to form epsomite.[3]
- Monohydrate, MgSO4·H2O; kieserite, monoclinic.[4]
- Monohydrate, MgSO4·H2O; triclinic.[5]
- MgSO4·1.25H2O or 4MgSO4·5H2O.[6]
- Dihydrate, MgSO4·2H2O; orthorhombic.
- MgSO4·2.5H2O or 2MgSO4·5H2O.[6]
- Trihydrate, MgSO4·3H2O.[6]
- Tetrahydrate, MgSO4·4H2O; starkeyite, monoclinic.[7]
- Pentahydrate, MgSO4·5H2O; pentahydrite, triclinic.[4]
- Hexahydrate, MgSO4·6H2O; hexahydrite, monoclinic.
- Heptahydrate, MgSO4·7H2O («Epsom salt»); epsomite, orthorhombic.[4]
- Enneahydrate, MgSO4·9H2O, monoclinic.[8]
- Decahydrate, MgSO4·10H2O.[7]
- Undecahydrate, MgSO4·11H2O; meridianiite, triclinic.[7]
As of 2017, the existence of the decahydrate apparently has not been confirmed.[8]
All the hydrates lose water upon heating. Above 320 °C, only the anhydrous form is stable. It decomposes without melting at 1124 °C into magnesium oxide (MgO) and sulfur trioxide (SO3).
Heptahydrate[edit]
The heptahydrate takes its common name «Epsom salt» from a bitter saline spring in Epsom in Surrey, England, where the salt was produced from the springs that arise where the porous chalk of the North Downs meets the impervious London clay.
The heptahydrate readily loses one equivalent of water to form the hexahydrate.
It is a natural source of both magnesium and sulphur. Epsom salts are commonly used in bath salts, exfoliants, muscle relaxers and pain relievers. However, these are different from Epsom salts that are used for gardening, as they contain aromas and perfumes not suitable for plants.[9]
Monohydrate[edit]
Magnesium sulfate monohydrate, or kieserite, can be prepared by heating the heptahydrate to 120 °C.[10] Further heating to 250 °C gives anhydrous magnesium sulfate.[10] Kieserite exhibits monoclinic symmetry at pressures lower than 2.7 GPa after which it transforms to phase of triclinic symmetry.[5]
Undecahydrate[edit]
The undecahydrate MgSO4·11H2O, meridianiite, is stable at atmospheric pressure only below 2 °C. Above that temperature, it liquefies into a mix of solid heptahydrate and a saturated solution. It has a eutectic point with water at −3.9 °C and 17.3% (mass) of MgSO4.[6] Large crystals can be obtained from solutions of the proper concentration kept at 0 °C for a few days.[6]
At pressures of about 0.9 GPa and at 240 K, meridianiite decomposes into a mixture of ice VI and the enneahydrate MgSO4·9H2O.[8]
Enneahydrate[edit]
The enneahydrate MgSO4·9H2O was identified and characterized only recently, even though it seems easy to produce (by cooling a solution of MgSO4 and sodium sulfate Na2SO4 in suitable proportions).
The structure is monoclinic, with unit-cell parameters at 250 K: a = 0.675 nm, b = 1.195 nm, c = 1.465 nm, β = 95.1°, V = 1.177 nm3 with Z = 4. The most probable space group is P21/c. Magnesium selenate also forms an enneahydrate MgSeO4·9H2O, but with a different crystal structure.[8]
Natural occurrence[edit]
As Mg2+ and SO2−4 ions are respectively the second cation and the second anion present in seawater after Na+ and Cl−, magnesium sulfates are common minerals in geological environments. Their occurrence is mostly connected with supergene processes. Some of them are also important constituents of evaporitic potassium-magnesium (K-Mg) salts deposits.
Bright spots observed by the Dawn Spacecraft in Occator Crater on the dwarf planet Ceres are most consistent with reflected light from magnesium sulfate hexahydrate.[11]
Almost all known mineralogical forms of MgSO4 are hydrates. Epsomite is the natural analogue of «Epsom salt». Meridianiite, MgSO4·11H2O, has been observed on the surface of frozen lakes and is thought to also occur on Mars. Hexahydrite is the next lower hydrate. Three next lower hydrates – pentahydrite, starkeyite, and especially sanderite – are rare. Kieserite is a monohydrate and is common among evaporitic deposits. Anhydrous magnesium sulfate was reported from some burning coal dumps.
Preparation[edit]
Magnesium sulfate is usually obtained directly from dry lake beds and other natural sources. It can also be prepared by reacting magnesite (magnesium carbonate, MgCO3) or magnesia (oxide, MgO) with sulfuric acid (H2SO4).
Another possible method is to treat seawater or magnesium-containing industrial wastes so as to precipitate magnesium hydroxide and react the precipitate with sulfuric acid.
Also, magnesium sulfate heptahydrate (epsomite, MgSO4·7H2O) is manufactured by dissolution of magnesium sulfate monohydrate (kieserite, MgSO4·H2O) in water and subsequent crystallization of the heptahydrate.
Physical properties[edit]
Magnesium sulfate relaxation is the primary mechanism that causes the absorption of sound in seawater at frequencies above 10 kHz[12] (acoustic energy is converted to thermal energy). Lower frequencies are less absorbed by the salt, so that low frequency sound travels farther in the ocean. Boric acid and magnesium carbonate also contribute to absorption.[13]
Uses[edit]
Medical[edit]
Magnesium sulfate is used both externally (as Epsom salt) and internally.
The main external use is the formulation as bath salts, especially for foot baths to soothe sore feet. Such baths have been claimed to also soothe and hasten recovery from muscle pain, soreness, or injury.[14] Potential health effects of magnesium sulfate are reflected in medical studies on the impact of magnesium on resistant depression[15] and as an analgesic for migraine and chronic pain.[16] Magnesium sulfate has been studied in the treatment of asthma,[17] preeclampsia and eclampsia.[18]
Magnesium sulfate is the usual component of the concentrated salt solution used in isolation tanks to increase its specific gravity to approximately 1.25–1.26. This high density allows an individual to float effortlessly on the surface of water in the closed tank, eliminating as many of the external senses as possible.
In the UK, a medication containing magnesium sulfate and phenol, called «drawing paste», is useful for small boils or localized infections[19] and removing splinters.[20]
Internally, magnesium sulfate may be administered by oral, respiratory, or intravenous routes. Internal uses include replacement therapy for magnesium deficiency,[21] treatment of acute and severe arrhythmias,[22] as a bronchodilator in the treatment of asthma,[23] preventing eclampsia,[24] a tocolytic agent,[25] and as an anticonvulsant.[25]
It also may be used as laxative.[26]
Agriculture[edit]
In agriculture, magnesium sulfate is used to increase magnesium or sulfur content in soil. It is most commonly applied to potted plants, or to magnesium-hungry crops such as potatoes, tomatoes, carrots, peppers, lemons, and roses. The advantage of magnesium sulfate over other magnesium soil amendments (such as dolomitic lime) is its high solubility, which also allows the option of foliar feeding. Solutions of magnesium sulfate are also nearly pH neutral, compared with the slightly alkaline salts of magnesium as found in limestone; therefore, the use of magnesium sulfate as a magnesium source for soil does not significantly change the soil pH.[25] Contrary to the popular belief that magnesium sulfate is able to control pests and slugs, helps seeds germination, produce more flowers, improve nutrient uptake, and is environmentally friendly, it does none of the purported claims except for correcting magnesium deficiency in soils. Magnesium sulfate can even pollute water if used in excessive amounts.[27]
Magnesium sulfate was historically used as a treatment for lead poisoning prior to the development of chelation therapy, as it was hoped that any lead ingested would be precipitated out by the magnesium sulfate and subsequently purged from the digestive system.[28] This application saw particularly widespread use among veterinarians during the early-to-mid 20th century; Epsom salt was already available on many farms for agricultural use, and it was often prescribed in the treatment of farm animals that inadvertently ingested lead.[29][30]
Food preparation[edit]
Magnesium sulfate is used as
- Brewing salt in making beer.[31]
- coagulant for making tofu.[32]
- Salt substitute.
Chemistry[edit]
Anhydrous magnesium sulfate is commonly used as a desiccant in organic synthesis owing to its affinity for water and compatibility with most organic compounds. During work-up, an organic phase is treated with anhydrous magnesium sulfate. The hydrated solid is then removed by filtration, decantation, or by distillation (if the boiling point is low enough). Other inorganic sulfate salts such as sodium sulfate and calcium sulfate may be used in the same way.
Construction[edit]
Magnesium sulfate is used to prepare specific cements by the reaction between magnesium oxide and magnesium sulfate solution, which are of good binding ability and more resistance than Portland cement. This cement is mainly adopted in the production of lightweight insulation panels. Weakness in water resistance limits its usage.
Magnesium (or sodium) sulfate is also used for testing aggregates for soundness in accordance with ASTM C88 standard, when there are no service records of the material exposed to actual weathering conditions. The test is accomplished by repeated immersion in saturated solutions followed by oven drying to dehydrate the salt precipitated in permeable pore spaces. The internal expansive force, derived from the rehydration of the salt upon re-immersion, simulates the expansion of water on freezing.
Magnesium sulfate is also used to test the resistance of concrete to external sulfate attack (ESA).
Aquaria[edit]
Magnesium sulfate heptahydrate is also used to maintain the magnesium concentration in marine aquaria which contain large amounts of stony corals, as it is slowly depleted in their calcification process. In a magnesium-deficient marine aquarium, calcium and alkalinity concentrations are very difficult to control because not enough magnesium is present to stabilize these ions in the saltwater and prevent their spontaneous precipitation into calcium carbonate.[33]
Double salts[edit]
Double salts containing magnesium sulfate exist. There are several known as sodium magnesium sulfates and potassium magnesium sulfates. A mixed copper-magnesium sulfate heptahydrate (Mg,Cu)SO4·7H2O was recently found to occur in mine tailings and has been given the mineral name alpersite.[34]
Research[edit]
Research on topical magnesium (for example epsom salt baths) is very limited.[35][36][37] The Epsom Salt Council recommends bathing 2 or 3 times/ week, using 500-600g Epsom salts each time.[38]
See also[edit]
- Calcium sulfate
- Magnesium chloride
References[edit]
- ^ «Quick Cures/Quack Cures: Is Epsom Worth Its Salt?». The Wall Street Journal. 9 April 2012. Archived from the original on 12 April 2012. Retrieved 15 June 2019.
- ^ Industrial Inorganic Chemistry, Karl Heinz Büchel, Hans-Heinrich Moretto, Dietmar Werner, John Wiley & Sons, 2d edition, 2000, ISBN 978-3-527-61333-5
- ^ «Unnamed (Mg Sulphate)».
- ^ a b c Odochian, Lucia (1995). «Study of the nature of the crystallization water in some magnesium hydrates by thermal methods». Journal of Thermal Analysis and Calorimetry. 45 (6): 1437–1448. doi:10.1007/BF02547437. S2CID 97855885. Archived from the original on 26 August 2011. Retrieved 7 August 2010.
- ^ a b Meusburger, Johannes (15 January 2020). «Polymorphism of Mg-sulfate monohydrate kieserite under pressure and its occurrence on giant icy jovian satellites».
- ^ a b c d e A. Dominic Fortes, Frank Browning, and Ian G. Wood (2012): «Cation substitution in synthetic meridianiite (MgSO4·11H2O) I: X-ray powder diffraction analysis of quenched polycrystalline aggregates». Physics and Chemistry of Minerals, volume 39, issue, pages 419–441. doi:10.1007/s00269-012-0497-9
- ^ a b c R. C. Peterson, W. Nelson, B. Madu, and H. F. Shurvell (2007): «Meridianiite: A new mineral species observed on Earth and predicted to exist on Mars». American Mineralogist, volume 92, issue 10, pages 1756–1759. doi:10.2138/am.2007.2668
- ^ a b c d A. Dominic Fortes, Kevin S. Knight, and Ian G. Wood (2017): «Structure, thermal expansion and incompressibility of MgSO4·9H2O, its relationship to meridianiite (MgSO4·11H2O) and possible natural occurrences». Acta Crystallographica Section B: Structureal Science, Crystal Engineering and Materials, volume 73, part 1, pages 47-64. doi:10.1107/S2052520616018266
- ^ «What Is Epsom Salt And Why Is It So Important For My Cannabis Garden?». Herbies. Retrieved 28 October 2020.
- ^ a b PubChem. «Hazardous Substances Data Bank (HSDB) : 664». pubchem.ncbi.nlm.nih.gov. Retrieved 15 March 2022.
- ^ M. C. De Sanctis; E. Ammannito; A. Raponi; S. Marchi; T. B. McCord; H. Y. McSween; F. Capaccioni; M. T. Capria; F. G. Carrozzo; M. Ciarniello; A. Longobardo; F. Tosi; S. Fonte; M. Formisano; A. Frigeri; M. Giardino; G. Magni; E. Palomba; D. Turrini; F. Zambon; J.-P. Combe; W. Feldman; R. Jaumann; L. A. McFadden; C. M. Pieters (2015). «Ammoniated phyllosilicates with a likely outer Solar System origin on (1) Ceres» (PDF). Nature. 528 (7581): 241–244. Bibcode:2015Natur.528..241D. doi:10.1038/nature16172. PMID 26659184. S2CID 1687271.
- ^ «Underlying physics and mechanisms for the absorption of sound in seawater». Resource.npl.co.uk. Archived from the original on 18 June 2009. Retrieved 6 July 2009.
- ^ Michael A. Ainslie, Principles of Sonar Performance Modeling, p.18
- ^ Ingraham, Paul. «Does Epsom Salt Work? The science of Epsom salt bathing for recovery from muscle pain, soreness, or injury». Pain Science. Archived from the original on 10 September 2016. Retrieved 29 August 2016.
- ^ Eby, George A.; Eby, Karen L. (April 2010). «Magnesium for treatment-resistant depression: a review and hypothesis». Medical Hypotheses. 74 (4): 649–660. doi:10.1016/j.mehy.2009.10.051. ISSN 1532-2777. PMID 19944540.
- ^ [citation needed]
- ^ «Magnesium sulfate asthma – Search Results». PubMed. Retrieved 29 June 2021.
- ^ «Magnesium sulfate eclampsia – Search Results». PubMed. Retrieved 29 June 2021.
- ^ «Boots Magnesium Sulfate Paste B.P. — Patient Information Leaflet (PIL) — (eMC)». www.medicines.org.uk. Retrieved 14 April 2018.
- ^ «Removing a splinter with Magnesium Sulphate».
- ^ «Pharmaceutical Information – Magnesium Sulfate». RxMed. Archived from the original on 3 April 2009. Retrieved 6 July 2009.
- ^ «CPR and First Aid: Antiarrhythmic Drugs During and Immediately After Cardiac Arrest (section)». American Heart Association. Retrieved 29 August 2016.
Previous ACLS guidelines addressed the use of magnesium in cardiac arrest with polymorphic ventricular tachycardia (ie, torsades de pointes) or suspected hypomagnesemia, and this has not been reevaluated in the 2015 Guidelines Update. These previous guidelines recommended defibrillation for termination of polymorphic VT (ie, torsades de pointes), followed by consideration of intravenous magnesium sulfate when secondary to a long QT interval.
- ^ Blitz M, Blitz S, Hughes R, Diner B, Beasley R, Knopp J, Rowe BH (2005). «Aerosolized magnesium sulfate for acute asthma: a systematic review». Chest. 128 (1): 337–344. doi:10.1378/chest.128.1.337. PMID 16002955..
- ^ Duley, L; Gülmezoglu, AM; Henderson-Smart, DJ; Chou, D (10 November 2010). «Magnesium sulphate and other anticonvulsants for women with pre-eclampsia». The Cochrane Database of Systematic Reviews (11): CD000025. doi:10.1002/14651858.CD000025.pub2. PMC 7061250. PMID 21069663.
- ^ a b c «Pubchem: Magnesium Sulfate». PubChem. Archived from the original on 29 April 2021. Retrieved 13 September 2021.
- ^ Izzo, A. A.; Gaginella, T. S.; Capasso, F. (June 1996). «The osmotic and intrinsic mechanisms of the pharmacological laxative action of oral high doses of magnesium sulphate. Importance of the release of digestive polypeptides and nitric oxide». Magnesium Research. 9 (2): 133–138. ISSN 0953-1424. PMID 8878010.
- ^ «Horticulture myths». University of Vermont Extension Department of Plant and Soil Science. Archived from the original on 7 September 2019. Retrieved 18 October 2021.
- ^ Wood, H. C. (1877). A Treatise on Therapeutics, Comprising Materia Medica and Toxicology, with Especial Reference to the Application of the Physiological Action of Drugs to Clinical Medicine. Philadelphia: J. B. Lippincott & Co. p. 34.
The treatment of acute lead-poisoning consists in the evacuation of the stomach, if necessary, the exhibition of the sulphate of sodium or of magnesium, and the meeting of the indications as they arrive. The Epsom and Glauber’s salts act as chemical antidotes, by precipitating the insoluble sulphate of lead, and also, if in excess, empty the bowel of the compound formed.
- ^ Barker, C. A. V. (January 1945). «Experience with Lead Poisoning». Canadian Journal of Comparative Medicine and Veterinary Science. 9 (1): 6–8. PMC 1660962. PMID 17648099.
Udall (1) suggests sodium citrate as of some value together with Epsom salts which will bring about a precipitation of the lead in the form of an insoluble compound. Nelson (3) reported a case that survived following the use of a 20% magnesium sulphate solution intravenously, subcutaneously and orally. McIntosh (5) has suggested that purgative doses of Epsom salts may be effective in combining with the lead and overcoming the toxicity.
- ^ Herriot, James (1972). All Creatures Great and Small. New York: St. Martin’s Press. p. 157. ISBN 0-312-08498-6.
The specific antidotes to metal poisoning had not been discovered and the only thing which sometimes did a bit of good was magnesium sulphate which caused the precipitation of insoluble lead sulphate. The homely term for magnesium sulphate is, of course, epsom salts.
- ^ «Magnesium Sulphate». National Home Brew. Archived from the original on 1 August 2016. Retrieved 4 January 2019.
- ^ US 6042851, Matsuura, Masaru; Sasaki, Masaoki & Sasakib, Jun et al., «Process for producing packed tofu», published 2000-03-28
- ^ «Do-It-Yourself Magnesium Supplements for the Reef Aquarium». Reefkeeping. 2006. Archived from the original on 22 March 2008. Retrieved 14 March 2008.
- ^ Peterson, Ronald C.; Hammarstrom, Jane M.; Seal, II, Robert R (February 2006). «Alpersite (Mg,Cu)SO4·7H2O, a new mineral of the melanterite group, and cuprian pentahydrite: Their occurrence within mine waste». American Mineralogist. 91 (2–3): 261–269. doi:10.2138/am.2006.1911. S2CID 56431885.
- ^ «Epsom Salt: Benefits, Uses, and Side Effects». Healthline. 13 December 2018.
- ^ «Magnesium Oil Benefits: Forms, Benefits, Uses, and Risks». Healthline. 25 January 2021.
- ^ Rath, Linda. «Why Take an Epsom Salts Bath?». WebMD.
- ^ (PDF) http://www.epsomsaltcouncil.org/wp-content/uploads/2015/10/report_on_absorption_of_magnesium_sulfate.pdf.
External links[edit]
- International Chemical Safety Cards—Magnesium Sulfate

Magnesium sulfate hexahydrate |
|

Anhydrous magnesium sulfate |
|

Epsomite (Magnesium sulfate heptahydrate) |
|
| Names | |
|---|---|
| IUPAC name
Magnesium sulfate |
|
Other names
|
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChEBI |
|
| ChEMBL |
|
| ChemSpider |
|
| DrugBank |
|
| ECHA InfoCard | 100.028.453 |
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
MgSO4 |
| Molar mass |
|
| Appearance | white crystalline solid |
| Odor | odorless |
| Density |
|
| Melting point |
|
|
Solubility in water |
|
|
Solubility product (Ksp) |
738 (502 g/L) |
| Solubility |
|
|
Magnetic susceptibility (χ) |
−50·10−6 cm3/mol |
|
Refractive index (nD) |
1.523 (monohydrate) 1.433 (heptahydrate) |
| Structure | |
|
Crystal structure |
monoclinic (hydrate) |
| Pharmacology | |
|
ATC code |
A06AD04 (WHO) A12CC02 (WHO) B05XA05 (WHO) D11AX05 (WHO) V04CC02 (WHO) |
| Hazards | |
| NFPA 704 (fire diamond) |
1 0 0 |
| Safety data sheet (SDS) | External MSDS |
| Related compounds | |
|
Other cations |
|
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Magnesium sulfate or magnesium sulphate (in English-speaking countries other than the US) is a chemical compound, a salt with the formula MgSO4, consisting of magnesium cations Mg2+ (20.19% by mass) and sulfate anions SO2−4. It is a white crystalline solid, soluble in water but not in ethanol.
Magnesium sulfate is usually encountered in the form of a hydrate MgSO4·nH2O, for various values of n between 1 and 11. The most common is the heptahydrate MgSO4·7H2O, known as Epsom salt, which is a household chemical with many traditional uses, including bath salts.[1]
The main use of magnesium sulfate is in agriculture, to correct soils deficient in magnesium (an essential plant nutrient because of the role of magnesium in chlorophyll and photosynthesis). The monohydrate is favored for this use; by the mid 1970s, its production was 2.3 million tons per year.[2] The anhydrous form and several hydrates occur in nature as minerals, and the salt is a significant component of the water from some springs.
Hydrates[edit]
Magnesium sulfate can crystallize as several hydrates, including:
- Anhydrous, MgSO4; unstable in nature, hydrates to form epsomite.[3]
- Monohydrate, MgSO4·H2O; kieserite, monoclinic.[4]
- Monohydrate, MgSO4·H2O; triclinic.[5]
- MgSO4·1.25H2O or 4MgSO4·5H2O.[6]
- Dihydrate, MgSO4·2H2O; orthorhombic.
- MgSO4·2.5H2O or 2MgSO4·5H2O.[6]
- Trihydrate, MgSO4·3H2O.[6]
- Tetrahydrate, MgSO4·4H2O; starkeyite, monoclinic.[7]
- Pentahydrate, MgSO4·5H2O; pentahydrite, triclinic.[4]
- Hexahydrate, MgSO4·6H2O; hexahydrite, monoclinic.
- Heptahydrate, MgSO4·7H2O («Epsom salt»); epsomite, orthorhombic.[4]
- Enneahydrate, MgSO4·9H2O, monoclinic.[8]
- Decahydrate, MgSO4·10H2O.[7]
- Undecahydrate, MgSO4·11H2O; meridianiite, triclinic.[7]
As of 2017, the existence of the decahydrate apparently has not been confirmed.[8]
All the hydrates lose water upon heating. Above 320 °C, only the anhydrous form is stable. It decomposes without melting at 1124 °C into magnesium oxide (MgO) and sulfur trioxide (SO3).
Heptahydrate[edit]
The heptahydrate takes its common name «Epsom salt» from a bitter saline spring in Epsom in Surrey, England, where the salt was produced from the springs that arise where the porous chalk of the North Downs meets the impervious London clay.
The heptahydrate readily loses one equivalent of water to form the hexahydrate.
It is a natural source of both magnesium and sulphur. Epsom salts are commonly used in bath salts, exfoliants, muscle relaxers and pain relievers. However, these are different from Epsom salts that are used for gardening, as they contain aromas and perfumes not suitable for plants.[9]
Monohydrate[edit]
Magnesium sulfate monohydrate, or kieserite, can be prepared by heating the heptahydrate to 120 °C.[10] Further heating to 250 °C gives anhydrous magnesium sulfate.[10] Kieserite exhibits monoclinic symmetry at pressures lower than 2.7 GPa after which it transforms to phase of triclinic symmetry.[5]
Undecahydrate[edit]
The undecahydrate MgSO4·11H2O, meridianiite, is stable at atmospheric pressure only below 2 °C. Above that temperature, it liquefies into a mix of solid heptahydrate and a saturated solution. It has a eutectic point with water at −3.9 °C and 17.3% (mass) of MgSO4.[6] Large crystals can be obtained from solutions of the proper concentration kept at 0 °C for a few days.[6]
At pressures of about 0.9 GPa and at 240 K, meridianiite decomposes into a mixture of ice VI and the enneahydrate MgSO4·9H2O.[8]
Enneahydrate[edit]
The enneahydrate MgSO4·9H2O was identified and characterized only recently, even though it seems easy to produce (by cooling a solution of MgSO4 and sodium sulfate Na2SO4 in suitable proportions).
The structure is monoclinic, with unit-cell parameters at 250 K: a = 0.675 nm, b = 1.195 nm, c = 1.465 nm, β = 95.1°, V = 1.177 nm3 with Z = 4. The most probable space group is P21/c. Magnesium selenate also forms an enneahydrate MgSeO4·9H2O, but with a different crystal structure.[8]
Natural occurrence[edit]
As Mg2+ and SO2−4 ions are respectively the second cation and the second anion present in seawater after Na+ and Cl−, magnesium sulfates are common minerals in geological environments. Their occurrence is mostly connected with supergene processes. Some of them are also important constituents of evaporitic potassium-magnesium (K-Mg) salts deposits.
Bright spots observed by the Dawn Spacecraft in Occator Crater on the dwarf planet Ceres are most consistent with reflected light from magnesium sulfate hexahydrate.[11]
Almost all known mineralogical forms of MgSO4 are hydrates. Epsomite is the natural analogue of «Epsom salt». Meridianiite, MgSO4·11H2O, has been observed on the surface of frozen lakes and is thought to also occur on Mars. Hexahydrite is the next lower hydrate. Three next lower hydrates – pentahydrite, starkeyite, and especially sanderite – are rare. Kieserite is a monohydrate and is common among evaporitic deposits. Anhydrous magnesium sulfate was reported from some burning coal dumps.
Preparation[edit]
Magnesium sulfate is usually obtained directly from dry lake beds and other natural sources. It can also be prepared by reacting magnesite (magnesium carbonate, MgCO3) or magnesia (oxide, MgO) with sulfuric acid (H2SO4).
Another possible method is to treat seawater or magnesium-containing industrial wastes so as to precipitate magnesium hydroxide and react the precipitate with sulfuric acid.
Also, magnesium sulfate heptahydrate (epsomite, MgSO4·7H2O) is manufactured by dissolution of magnesium sulfate monohydrate (kieserite, MgSO4·H2O) in water and subsequent crystallization of the heptahydrate.
Physical properties[edit]
Magnesium sulfate relaxation is the primary mechanism that causes the absorption of sound in seawater at frequencies above 10 kHz[12] (acoustic energy is converted to thermal energy). Lower frequencies are less absorbed by the salt, so that low frequency sound travels farther in the ocean. Boric acid and magnesium carbonate also contribute to absorption.[13]
Uses[edit]
Medical[edit]
Magnesium sulfate is used both externally (as Epsom salt) and internally.
The main external use is the formulation as bath salts, especially for foot baths to soothe sore feet. Such baths have been claimed to also soothe and hasten recovery from muscle pain, soreness, or injury.[14] Potential health effects of magnesium sulfate are reflected in medical studies on the impact of magnesium on resistant depression[15] and as an analgesic for migraine and chronic pain.[16] Magnesium sulfate has been studied in the treatment of asthma,[17] preeclampsia and eclampsia.[18]
Magnesium sulfate is the usual component of the concentrated salt solution used in isolation tanks to increase its specific gravity to approximately 1.25–1.26. This high density allows an individual to float effortlessly on the surface of water in the closed tank, eliminating as many of the external senses as possible.
In the UK, a medication containing magnesium sulfate and phenol, called «drawing paste», is useful for small boils or localized infections[19] and removing splinters.[20]
Internally, magnesium sulfate may be administered by oral, respiratory, or intravenous routes. Internal uses include replacement therapy for magnesium deficiency,[21] treatment of acute and severe arrhythmias,[22] as a bronchodilator in the treatment of asthma,[23] preventing eclampsia,[24] a tocolytic agent,[25] and as an anticonvulsant.[25]
It also may be used as laxative.[26]
Agriculture[edit]
In agriculture, magnesium sulfate is used to increase magnesium or sulfur content in soil. It is most commonly applied to potted plants, or to magnesium-hungry crops such as potatoes, tomatoes, carrots, peppers, lemons, and roses. The advantage of magnesium sulfate over other magnesium soil amendments (such as dolomitic lime) is its high solubility, which also allows the option of foliar feeding. Solutions of magnesium sulfate are also nearly pH neutral, compared with the slightly alkaline salts of magnesium as found in limestone; therefore, the use of magnesium sulfate as a magnesium source for soil does not significantly change the soil pH.[25] Contrary to the popular belief that magnesium sulfate is able to control pests and slugs, helps seeds germination, produce more flowers, improve nutrient uptake, and is environmentally friendly, it does none of the purported claims except for correcting magnesium deficiency in soils. Magnesium sulfate can even pollute water if used in excessive amounts.[27]
Magnesium sulfate was historically used as a treatment for lead poisoning prior to the development of chelation therapy, as it was hoped that any lead ingested would be precipitated out by the magnesium sulfate and subsequently purged from the digestive system.[28] This application saw particularly widespread use among veterinarians during the early-to-mid 20th century; Epsom salt was already available on many farms for agricultural use, and it was often prescribed in the treatment of farm animals that inadvertently ingested lead.[29][30]
Food preparation[edit]
Magnesium sulfate is used as
- Brewing salt in making beer.[31]
- coagulant for making tofu.[32]
- Salt substitute.
Chemistry[edit]
Anhydrous magnesium sulfate is commonly used as a desiccant in organic synthesis owing to its affinity for water and compatibility with most organic compounds. During work-up, an organic phase is treated with anhydrous magnesium sulfate. The hydrated solid is then removed by filtration, decantation, or by distillation (if the boiling point is low enough). Other inorganic sulfate salts such as sodium sulfate and calcium sulfate may be used in the same way.
Construction[edit]
Magnesium sulfate is used to prepare specific cements by the reaction between magnesium oxide and magnesium sulfate solution, which are of good binding ability and more resistance than Portland cement. This cement is mainly adopted in the production of lightweight insulation panels. Weakness in water resistance limits its usage.
Magnesium (or sodium) sulfate is also used for testing aggregates for soundness in accordance with ASTM C88 standard, when there are no service records of the material exposed to actual weathering conditions. The test is accomplished by repeated immersion in saturated solutions followed by oven drying to dehydrate the salt precipitated in permeable pore spaces. The internal expansive force, derived from the rehydration of the salt upon re-immersion, simulates the expansion of water on freezing.
Magnesium sulfate is also used to test the resistance of concrete to external sulfate attack (ESA).
Aquaria[edit]
Magnesium sulfate heptahydrate is also used to maintain the magnesium concentration in marine aquaria which contain large amounts of stony corals, as it is slowly depleted in their calcification process. In a magnesium-deficient marine aquarium, calcium and alkalinity concentrations are very difficult to control because not enough magnesium is present to stabilize these ions in the saltwater and prevent their spontaneous precipitation into calcium carbonate.[33]
Double salts[edit]
Double salts containing magnesium sulfate exist. There are several known as sodium magnesium sulfates and potassium magnesium sulfates. A mixed copper-magnesium sulfate heptahydrate (Mg,Cu)SO4·7H2O was recently found to occur in mine tailings and has been given the mineral name alpersite.[34]
Research[edit]
Research on topical magnesium (for example epsom salt baths) is very limited.[35][36][37] The Epsom Salt Council recommends bathing 2 or 3 times/ week, using 500-600g Epsom salts each time.[38]
See also[edit]
- Calcium sulfate
- Magnesium chloride
References[edit]
- ^ «Quick Cures/Quack Cures: Is Epsom Worth Its Salt?». The Wall Street Journal. 9 April 2012. Archived from the original on 12 April 2012. Retrieved 15 June 2019.
- ^ Industrial Inorganic Chemistry, Karl Heinz Büchel, Hans-Heinrich Moretto, Dietmar Werner, John Wiley & Sons, 2d edition, 2000, ISBN 978-3-527-61333-5
- ^ «Unnamed (Mg Sulphate)».
- ^ a b c Odochian, Lucia (1995). «Study of the nature of the crystallization water in some magnesium hydrates by thermal methods». Journal of Thermal Analysis and Calorimetry. 45 (6): 1437–1448. doi:10.1007/BF02547437. S2CID 97855885. Archived from the original on 26 August 2011. Retrieved 7 August 2010.
- ^ a b Meusburger, Johannes (15 January 2020). «Polymorphism of Mg-sulfate monohydrate kieserite under pressure and its occurrence on giant icy jovian satellites».
- ^ a b c d e A. Dominic Fortes, Frank Browning, and Ian G. Wood (2012): «Cation substitution in synthetic meridianiite (MgSO4·11H2O) I: X-ray powder diffraction analysis of quenched polycrystalline aggregates». Physics and Chemistry of Minerals, volume 39, issue, pages 419–441. doi:10.1007/s00269-012-0497-9
- ^ a b c R. C. Peterson, W. Nelson, B. Madu, and H. F. Shurvell (2007): «Meridianiite: A new mineral species observed on Earth and predicted to exist on Mars». American Mineralogist, volume 92, issue 10, pages 1756–1759. doi:10.2138/am.2007.2668
- ^ a b c d A. Dominic Fortes, Kevin S. Knight, and Ian G. Wood (2017): «Structure, thermal expansion and incompressibility of MgSO4·9H2O, its relationship to meridianiite (MgSO4·11H2O) and possible natural occurrences». Acta Crystallographica Section B: Structureal Science, Crystal Engineering and Materials, volume 73, part 1, pages 47-64. doi:10.1107/S2052520616018266
- ^ «What Is Epsom Salt And Why Is It So Important For My Cannabis Garden?». Herbies. Retrieved 28 October 2020.
- ^ a b PubChem. «Hazardous Substances Data Bank (HSDB) : 664». pubchem.ncbi.nlm.nih.gov. Retrieved 15 March 2022.
- ^ M. C. De Sanctis; E. Ammannito; A. Raponi; S. Marchi; T. B. McCord; H. Y. McSween; F. Capaccioni; M. T. Capria; F. G. Carrozzo; M. Ciarniello; A. Longobardo; F. Tosi; S. Fonte; M. Formisano; A. Frigeri; M. Giardino; G. Magni; E. Palomba; D. Turrini; F. Zambon; J.-P. Combe; W. Feldman; R. Jaumann; L. A. McFadden; C. M. Pieters (2015). «Ammoniated phyllosilicates with a likely outer Solar System origin on (1) Ceres» (PDF). Nature. 528 (7581): 241–244. Bibcode:2015Natur.528..241D. doi:10.1038/nature16172. PMID 26659184. S2CID 1687271.
- ^ «Underlying physics and mechanisms for the absorption of sound in seawater». Resource.npl.co.uk. Archived from the original on 18 June 2009. Retrieved 6 July 2009.
- ^ Michael A. Ainslie, Principles of Sonar Performance Modeling, p.18
- ^ Ingraham, Paul. «Does Epsom Salt Work? The science of Epsom salt bathing for recovery from muscle pain, soreness, or injury». Pain Science. Archived from the original on 10 September 2016. Retrieved 29 August 2016.
- ^ Eby, George A.; Eby, Karen L. (April 2010). «Magnesium for treatment-resistant depression: a review and hypothesis». Medical Hypotheses. 74 (4): 649–660. doi:10.1016/j.mehy.2009.10.051. ISSN 1532-2777. PMID 19944540.
- ^ [citation needed]
- ^ «Magnesium sulfate asthma – Search Results». PubMed. Retrieved 29 June 2021.
- ^ «Magnesium sulfate eclampsia – Search Results». PubMed. Retrieved 29 June 2021.
- ^ «Boots Magnesium Sulfate Paste B.P. — Patient Information Leaflet (PIL) — (eMC)». www.medicines.org.uk. Retrieved 14 April 2018.
- ^ «Removing a splinter with Magnesium Sulphate».
- ^ «Pharmaceutical Information – Magnesium Sulfate». RxMed. Archived from the original on 3 April 2009. Retrieved 6 July 2009.
- ^ «CPR and First Aid: Antiarrhythmic Drugs During and Immediately After Cardiac Arrest (section)». American Heart Association. Retrieved 29 August 2016.
Previous ACLS guidelines addressed the use of magnesium in cardiac arrest with polymorphic ventricular tachycardia (ie, torsades de pointes) or suspected hypomagnesemia, and this has not been reevaluated in the 2015 Guidelines Update. These previous guidelines recommended defibrillation for termination of polymorphic VT (ie, torsades de pointes), followed by consideration of intravenous magnesium sulfate when secondary to a long QT interval.
- ^ Blitz M, Blitz S, Hughes R, Diner B, Beasley R, Knopp J, Rowe BH (2005). «Aerosolized magnesium sulfate for acute asthma: a systematic review». Chest. 128 (1): 337–344. doi:10.1378/chest.128.1.337. PMID 16002955..
- ^ Duley, L; Gülmezoglu, AM; Henderson-Smart, DJ; Chou, D (10 November 2010). «Magnesium sulphate and other anticonvulsants for women with pre-eclampsia». The Cochrane Database of Systematic Reviews (11): CD000025. doi:10.1002/14651858.CD000025.pub2. PMC 7061250. PMID 21069663.
- ^ a b c «Pubchem: Magnesium Sulfate». PubChem. Archived from the original on 29 April 2021. Retrieved 13 September 2021.
- ^ Izzo, A. A.; Gaginella, T. S.; Capasso, F. (June 1996). «The osmotic and intrinsic mechanisms of the pharmacological laxative action of oral high doses of magnesium sulphate. Importance of the release of digestive polypeptides and nitric oxide». Magnesium Research. 9 (2): 133–138. ISSN 0953-1424. PMID 8878010.
- ^ «Horticulture myths». University of Vermont Extension Department of Plant and Soil Science. Archived from the original on 7 September 2019. Retrieved 18 October 2021.
- ^ Wood, H. C. (1877). A Treatise on Therapeutics, Comprising Materia Medica and Toxicology, with Especial Reference to the Application of the Physiological Action of Drugs to Clinical Medicine. Philadelphia: J. B. Lippincott & Co. p. 34.
The treatment of acute lead-poisoning consists in the evacuation of the stomach, if necessary, the exhibition of the sulphate of sodium or of magnesium, and the meeting of the indications as they arrive. The Epsom and Glauber’s salts act as chemical antidotes, by precipitating the insoluble sulphate of lead, and also, if in excess, empty the bowel of the compound formed.
- ^ Barker, C. A. V. (January 1945). «Experience with Lead Poisoning». Canadian Journal of Comparative Medicine and Veterinary Science. 9 (1): 6–8. PMC 1660962. PMID 17648099.
Udall (1) suggests sodium citrate as of some value together with Epsom salts which will bring about a precipitation of the lead in the form of an insoluble compound. Nelson (3) reported a case that survived following the use of a 20% magnesium sulphate solution intravenously, subcutaneously and orally. McIntosh (5) has suggested that purgative doses of Epsom salts may be effective in combining with the lead and overcoming the toxicity.
- ^ Herriot, James (1972). All Creatures Great and Small. New York: St. Martin’s Press. p. 157. ISBN 0-312-08498-6.
The specific antidotes to metal poisoning had not been discovered and the only thing which sometimes did a bit of good was magnesium sulphate which caused the precipitation of insoluble lead sulphate. The homely term for magnesium sulphate is, of course, epsom salts.
- ^ «Magnesium Sulphate». National Home Brew. Archived from the original on 1 August 2016. Retrieved 4 January 2019.
- ^ US 6042851, Matsuura, Masaru; Sasaki, Masaoki & Sasakib, Jun et al., «Process for producing packed tofu», published 2000-03-28
- ^ «Do-It-Yourself Magnesium Supplements for the Reef Aquarium». Reefkeeping. 2006. Archived from the original on 22 March 2008. Retrieved 14 March 2008.
- ^ Peterson, Ronald C.; Hammarstrom, Jane M.; Seal, II, Robert R (February 2006). «Alpersite (Mg,Cu)SO4·7H2O, a new mineral of the melanterite group, and cuprian pentahydrite: Their occurrence within mine waste». American Mineralogist. 91 (2–3): 261–269. doi:10.2138/am.2006.1911. S2CID 56431885.
- ^ «Epsom Salt: Benefits, Uses, and Side Effects». Healthline. 13 December 2018.
- ^ «Magnesium Oil Benefits: Forms, Benefits, Uses, and Risks». Healthline. 25 January 2021.
- ^ Rath, Linda. «Why Take an Epsom Salts Bath?». WebMD.
- ^ (PDF) http://www.epsomsaltcouncil.org/wp-content/uploads/2015/10/report_on_absorption_of_magnesium_sulfate.pdf.
External links[edit]
- International Chemical Safety Cards—Magnesium Sulfate
Справочник содержит названия веществ и описания химических формул (в т.ч. структурные формулы и скелетные формулы).
Введите часть названия или формулу для поиска:
Сульфат магния
Брутто-формула:
MgO4S
CAS# 7487-88-9
Названия
Русский:
- Сернокислый магний
- Сульфат магния(IUPAC) [Wiki]
- магний сернокислый
- магния сульфат
- эпсомская соль
English:
- Magnesium sulfate(IUPAC) [Wiki]
- magnesium sulphate
Варианты формулы:
Mg^2+O//S`|O|<_(A80,w+)O^->dO^-
Mg^2+/0O`^-# -S`|O|<||O>-O^-
Реакции, в которых участвует Сульфат магния
-
{M}O + H2{A} -> {M}{A} + H2O
, где M =
Cu Ca Mg Ba Sr Hg Mn Cr Ni Fe Zn Pb Co; A =
SO4 -
{M}(OH)2 + H2{X} = {M}{X} + 2H2O
, где M =
Mg Ca Ba Sr Cu Zn; X =
SO4 SO3 CO3 -
{M} + H2{X} -> {M}{X} + H2″|^»
, где M =
Mg Ca Ba Sr Zn Cd Fe; X =
SO4 -
MgSO4 + H2S «700^oC»—> MgO + SO2 + S + H2O
-
MgSO4 + SiO2 «680^oC»—> MgSiO3 + SO3″|^»
Физические свойства
Сульфат магния MgSO4 — соль щелочного металла магния и серной кислоты. Белый, разлагается выше температуры плавления. Хорошо растворяется в воде (слабый гидролиз по катиону).
Относительная молекулярная масса Mr = 120,37; относительная плотность для тв. и ж. состояния d = 2,66; tпл = 1137º C;
Способ получения
1. В результате взаимодействия карбоната магния и концентрированного раствора сульфата аммония при кипении образуется сульфат магния, аммиак, углекислый газ и воды:
MgCO3 + (NH4)2SO4 = MgSO4 + 2NH3↑ + CO2↑ + H2O
Качественная реакция
Качественная реакция на сульфат магния — взаимодействие его с хлоридом бария, в результате реакции происходит образование белого осадка , который не растворим в азотной кислоте:
1. При взаимодействии с хлоридом бария, сульфат магния образует сульфат бария и хлорид магния:
MgSO4 + BaCl2 = BaSO4↓ + MgCl2
Химические свойства
1. Сульфат магния вступает в реакцию со многими сложными веществами:
1.1. Сульфат магния взаимодействует с основаниями:
1.1.1. Сульфат магния реагирует с разбавленным раствором гидроксидом натрия с образованием гидроксида магния и сульфата натрия:
MgSO4 + 2NaOH = Mg(OH)2↓ + Na2SO4
1.2. Сульфат магния может реагировать с кислотами:
1.2.1. При взаимодействии с концентрированной и холодной серной кислотой твердый сульфат магния образует гидросульфат магния:
MgSO4 + H2SO4 = Mg(HSO4)2
1.3. Сульфат магния реагирует с солями:
1.3.1. Сульфат магния взаимодействует с концентрированным гидратом аммиака. При этом образуются гидроксид магния и сульфат аммония:
MgSO4 + 2(NH3 · H2O) = Mg(OH)2↓ + (NH4)2SO4
1.3.2. Сульфат магния вступает в реакцию с перхлоратами кальция, стронция и бария образуя сульфат этого металла и перхлорат магния:
MgSO4 + Ca(ClO4)2 = CaSO4 + Mg(ClO4)2
MgSO4 + Sr(ClO4)2 = SrSO4 + Mg(ClO4)2
MgSO4 + Ba(ClO4)2 = BaSO4 + Mg(ClO4)2
1.3.3. Сульфат магния вступает во взаимодействие с гидрокарбонатом калия и образует карбонат магния, сульфат калия, воду и углекислый газ:
MgSO4 + 2KHCO3 = MgCO3↓ + K2SO4 + H2O + CO2↑
1.3.4. В результате реакции между насыщенным сульфатом магния и насыщенным хроматом кальция образуется хромат магния и сульфат кальция:
MgSO4 + CaCrO4 = MgCrO4 + CaSO4↓
2. Сульфат магния разлагается при температуре выше 1200º С, образуя оксид магния, оксид серы и кислород:
2MgSO4 = 2MgO + 2SO2 + O2
| Сульфат магния | |
|---|---|
| Систематическое наименование |
Сульфат магния |
| Традиционные названия | Сернокислый магний, эпсомская соль |
| Хим. формула | MgSO4 |
| Молярная масса | 120,37 г/моль |
| Плотность | 2,66 г/см³ |
| Т. плав. | 1137 °C |
| Мол. теплоёмк. | 96,40 Дж/(моль·К) |
| Энтальпия образования | -1288,8 кДж/моль |
| Растворимость в воде | 35,120; 54,880; 68,3100 г/100 мл |
| Растворимость в эфире | 1,1618 г/100 мл |
| ГОСТ | ГОСТ 4523-77 |
| Рег. номер CAS | 7487-88-9 |
| PubChem | 24083 |
| Рег. номер EINECS | 231-298-2 |
| SMILES |
[Mg+2].[O-]S([O-])(=O)=O |
| InChI |
1S/Mg.H2O4S/c;1-5(2,3)4/h;(H2,1,2,3,4)/q+2;/p-2 CSNNHWWHGAXBCP-UHFFFAOYSA-L |
| Кодекс Алиментариус | E518 |
| RTECS | OM4500000 |
| ChEBI | 32599 |
| ChemSpider | 22515 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. |
Сульфат магния — неорганическое вещество, соль металла магния и серной кислоты с формулой MgSO4, белый порошок, образует несколько кристаллогидратов. В медицине используется при лечении ожирения как солевое слабительное, для достижения так называемого магниевого стресса.
Впервые была найдена в воде эпсомского источника в Англии ботаником Неемией Грю в 1695 году.
Получение
- Взаимодействие серной кислоты и магния
Mg + H2SO4 → MgSO4 + H2
- Взаимодействием серной кислоты с оксидом, гидроксидом и карбонатом магния:
-
- MgO + H2SO4 → MgSO4 + H2O
- Mg(OH)2 + H2SO4 → MgSO4 + 2H2O
- MgCO3 + H2SO4 → MgSO4 + CO2↑ + H2O
- Обменными реакциями:
-
- MgCO3 + (NH4)2SO4 →100oC MgSO4 + 2NH3↑ + CO2↑ + H2O
- Безводный сульфат магния получают сушкой кристаллогидрата:
-
- MgSO4 ⋅ 7H2O →200oC MgSO4 + 7H2O
- В промышленности сульфат магния получают из морской воды, минералов кизерита и карналлита.
Физические свойства
Сульфат магния — белый гигроскопичный порошок, кристаллы ромбической сингонии, параметры ячейки a = 0,482 нм, b = 0,672 нм, c = 0,833 нм. При температуре 1010 °С происходит переход в другую ромбическую фазу.
Образует несколько кристаллогидратов: MgSO4·nH2O, где n = 1, 2, 3, 4, 5, 6, 7, 12.
Наиболее изучены кристаллогидраты — MgSO4·7H2O (эпсомит), MgSO4·6H2O и MgSO 4·H2O (кизерит).
Растворим в этаноле, глицерине и диэтиловом эфире. Не растворим в ацетоне.
Входит в число основных соединений в морской воде, отвечающих за поглощение звука, при этом звуковая энергия преобразуется в тепловую. Поглощение зависит от частоты звуковых колебаний: низкочастотный звук поглощается хуже, а высокочастотный — лучше (зависимость практически линейная при логарифмическом масштабе частоты и поглощения), что объясняет большую дальность распространения низкочастотных звуковых волн.
Химические свойства
- При нагревании выше температуры плавления разлагается:
-
- 2MgSO4 →1200∘C 2MgO + 2SO2 + O2
- С концентрированной серной кислотой образует гидросульфат:
-
- MgSO4 + H2SO4 → Mg(HSO4)2
- при нагревании выпадают сольваты состава MgSO4·H2SO4 и MgSO4·3H2SO4.
- При нагревании взаимодействует с сероводородом, диоксидом кремния, углеродом:
-
- MgSO4 + H2S →700∘C MgO + SO2 + S + H2O
- MgSO4 + SiO2 →680∘C MgSiO3 + SO3
- 2MgSO4 + C →800∘C 2MgO + 2SO2 + CO2
- MgSO4 + 2C →>800∘C MgS + 2CO2
Применение
- Сульфат магния относится к многотоннажному производству, цена ≈130 USD/т.
- Магния сульфат широко применяется в медицине, обычно в виде 25 % раствора, оказывает многогранное влияние на организм. При внутривенном введении быстро снижает давление, усиливая диурез. При приёме внутрь плохо всасывается, действует как слабительное средство, также оказывает желчегонное действие, что связано с рефлексами, возникающими при раздражении нервных окончаний слизистой оболочки двенадцатиперстной кишки. При парентеральном введении сульфат магния оказывает успокаивающее действие на ЦНС. В зависимости от дозы может наблюдаться седативный, снотворный или наркотический эффект. Более подробно см. статью Сульфат магния (лекарственное средство).
- Сульфат магния применяется как добавка для устройства дорожных и аэродромных оснований и покрытий.
- Входит в состав магнезиального цемента.
- В целлюлозно-бумажной промышленности используется как наполнитель, а также как компонент, позволяющий сохранить и улучшить физико-механические показатели бумаги при использовании отбеливателей (особенно хлорсодержащих) и для получения огнестойких изделий из бумаги.
- Используется для приготовления огнестойких составов для пропитки различных материалов.
- Для производства синтетических моющих средств (например, как стабилизатор перекисных соединений).
- Широко применяется в текстильной промышленности как наполнитель материалов, утяжелитель шёлка и хлопка, протрава для покраски тканей и как отбеливающий компонент.
- В лабораторных условиях безводный сульфат магния используется для сушки растворителей.
| Сульфат магния | |
| Общие | |
|---|---|
| Систематическое наименование | Сульфат магния |
| Традиционные названия | Сернокислый магния, эпсомская соль |
| Химическая формула | MgSO4 |
| Физические свойства | |
| Молярная масса | 120,37 г/моль |
| Плотность | 2,66 г/см³ |
| Термические свойства | |
| Температура плавления | 1137 °C |
| Молярная теплоёмкость (ст. усл.) | 96,40 Дж/(моль·К) |
| Энтальпия образования (ст. усл.) | -1288,8 кДж/моль |
| Химические свойства | |
| Растворимость в воде | 35,120; 54,880; 68,3100 г/100 мл |
| Растворимость в эфире | 1,1618 г/100 мл |
| Классификация | |
| Рег. номер CAS | 7487-88-9 |
| SMILES | [Mg+2].[O-]S([O-])(=O)=O |
| RTECS | OM4500000 |
Сульфат магния — неорганическое вещество, соль металла магния и серной кислоты с формулой MgSO4, белый порошок, образует несколько кристаллогидратов. В медицине используется при лечении ожирения как солевое слабительное, для достижения так называемого магниевого стресса.
Впервые была найдена в эпсомском источнике в Англии.
Получение
- Взаимодействием серной кислоты с оксидом, гидроксидом и карбонатом магния:
- Обменными реакциями:
- Безводный сульфат магния получают сушкой кристаллогидрата:
- В промышленности сульфат магния получают из морской воды, минералов кизерита и карналлита.
Физические свойства
Сульфат магния — белый гигроскопичный порошок, кристаллы ромбической сингонии, параметры ячейки a = 0,482 нм, b =0,672 нм, c = 0,833 нм. При температуре 1010°С происходит переход в другую ромбическую фазу.
Образует несколько кристаллогидратов: MgSO4•nH2O, где n=1, 2, 3, 4, 5, 6, 7, 12.
Наиболее изучена кристаллогидраты MgSO4•7H2O, MgSO4•6H2O и MgSO4•H2O.
Растворим в этаноле, глицерине и диэтиловом эфире.
Химические свойства
- При нагревании выше температуры плавления разлагается:
- С концентрированной серной кислотой образует гидросульфаты:
-
- при нагревании выпадают сольваты состава MgSO4•H2SO4 и MgSO4•3H2SO4.
- При нагревании взаимодействует с сероводородом, двуокисью кремния, углеродом:
Применение
- Сульфат магния относится к многотоннажному производству, цена ≈130$/т.
- Сульфат магния применяется как добавка для устройства дорожных и аэродромных оснований и покрытий.
- Входит в состав магнезиального цемента.
- В целлюлозно-бумажной промышленности используется как наполнитель, а также как компонент позволяющий сохранить и улучшить физико-механические показатели бумаги при использовании отбеливателей (особенно хлорсодержащих) и для получения огнестойких изделий из бумаги.
- Используется для приготовления огнестойких составов для пропитки различных материалов
- Для производства синтетических моющих средств (например как стабилизатор перекисных соединений).
- Широкая область применения в текстильной промышленности как наполнитель материалов, утяжелитель шелка и хлопка, протрава для покраски тканей и как отбеливающий компонент.
См. также
- Гептагидрат сульфата магния
Литература
- Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1971. — Т. 1. — 561 с.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 2-е изд., испр. — М.-Л.: Химия, 1966. — Т. 1. — 1072 с.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1990. — Т. 2. — 671 с. — ISBN 5-82270-035-5
-
Общие
сведения.
Формула:
MgSO4
Бесцветные
ромбоэдрические диамагнитные кристаллы
с плотностью 2,66 г/см3, tпл=1185оС.
Растворяется в воде, спирте и эфире.
Молярная
электропроводность при бесконечном
разведении при 25оС
равна
266
Cм.см2/моль.
-
Получение.
Гранулированный
безводный сернокислый магний получают
осторожным нагреванием MgSO4
x
7H2O,
сначала прогревают на 150 — 175°С в муфельной
печи до тех пор, пока не будет удалена
большая часть гидратной воды.
-
Качественный
анализ.-
Аналитические
реакции на катион магния.
-
1.
С гидрофосфатом натрия Na2HPO4
в присутствии аммонийного буферного
раствора c образованием белого
кристаллического осадка, растворимого
в уксусной и минеральных кислотах (ГФ).
NH4Cl
MgCl2
+ Na2HPO4
+ NH4OH
NH4MgPO4
+ H2O
+ 2 NaCl
2NH4MgPO4
+ 4CH3COOH
2Mg(CH3COO)2
+ (NH4)2HPO4
+ H3PO4
Реакцию
обнаружения следует проводить при рН
= 9 (в присутствии аммонийного буфера).
Мешающие
ионы: катионы s-, p- и d-элементов. Для
использования ее в качестве дробной,
мешающие ионы удаляют: катионы р-элементов
– восстановлением цинком в среде
аммиака; Ba2+,
Sr2+
– осаждением (NH4)2SO4;
Fe3+,
AI3+,
Cr3+
–
раствором аммиака; Mn2+,
Fe2+,
Co2+
–
окислением Н2О2.
Реакцию
можно провести пробирочным и
микрокристаллоскопическим способом.
Методика:
в пробирке смешивают 4 капли раствора
соли магния, 1 каплю NH4CI
и 3 капли NH4OH.
Далее операции выполняют по общей
методике микрокристаллоскопии: наносят
каплю раствора из пробирки и каплю
раствора реагента на предметное стекло
и наблюдают под микроскопом бесцветные
кристаллы в виде дендритов или звездочек.
2.
С
магнезоном
(п-нитробензолазорезорцином)
с образованием осадка или раствора
тёмно-синего цвета. Реакцию ведут в
основной среде (рН >10).
Error: Reference source not found
Реакция
дробная. Мешающие ионы: катионы р- и
d-элементов, NH4+.
Особенно существенно мешают ионы Co2+,
Ni2+,
Cd2+,
дающие с магнезоном осадки синего цвета.
-
Аналитические
реакции на сульфат-ион.
1.
С групповым реактивом BaCl2
+ CaCl2
или BaCl2
(ГФ).
Дробное
открытие сульфат-иона проводят в кислой
среде, что позволяет устранить мешающее
влияние CO32-
,
PO43-
,
и др., и при кипячении исследуемого
раствора с 6 моль/дм3
HCl
для удаления S2-
,
SO32-
,
S2O32-
-ионов,
которые могут образовать элементную
серу, осадок которой можно принять за
осадок BaSO4.
Осадок BaSO4
способен образовывать изоморфные
кристаллы с KMnO4
и окрашиваться в розовый цвет (повышается
специфичность реакции).
Методика
выполнения
реакции в присутствии 0,002 моль/дм3
KMnO4.
К
3-5 каплям испытуемого раствора добавляют
равные объёмы растворов перманганата
калия, хлорида бария и хлороводородной
кислоты и энергично перемешивают 2-3
мин. Дают отстояться и, не отделяя осадка
от раствора, добавляют 1-2 капли 3% раствора
Н2О2,
перемешивают и центрифугируют. Осадок
должен остаться окрашенным в розовый
цвет, а раствор над осадком обесцветиться.
2.
С ацетатом свинца.
SO42-
+ Pb2+
PbSO4
Методика:
к 2 см3
раствора сульфата добавляют 0,5 см3
разбавленной хлороводородной кислоты
и 0,5 см3
раствора ацетата свинца; образуется
белый осадок, растворимый в насыщенном
растворе ацетата аммония или гидроксида
натрия.
PbSO4
+ 4 NaOH
Na2[Pb(OH)4]
+ Na2SO4
-
С
cолями
стронция – образование белого осадка,
нерастворимого в кислотах (отличие от
сульфитов).
SO42—
+ Sr2+
SrSO4
Методика:
К 4-5 каплям анализируемого раствора
добавляют 4-5 капель концентрированного
раствора хлорида стронция, выпадает
белый осадок.
-
С
солями кальция – образование игольчатых
кристаллов гипса CaSO4
2H2O.
SO42-
+ Са2+
+ 2Н2О
СаSO4
2Н2О
Методика:
на предметное стекло наносят по капле
анализируемого раствора и соли кальция,
слегка подсушивают. Образовавшиеся
кристаллы рассматривают под микроскопом.
-
Количественный
анализ.-
Стандартизация
0,05 М раствора трилона Б по сульфату
магния или цинка (способ пипетирования)
-
1.
HJnd2-
+ Me2+
MeJnd—
+ H+
2.
H+
+ NH3
H2O
NH4+
+ H2O
3.
Me2+
+ H2Y2-
MeY2-
+ 2H+
4.
MeJnd—
+ H2Y2-
+ OH—
MeY2-
+ HJnd2-
+ H2O
М
(MgSO47H2O)
=246,48
г/моль
М
(ZnSO47H2O)
=287,54 г/моль
А.
Приготовление стандартного 0,05 М раствора
сульфата магния (цинка) (см. табл. 1, стр.
21).
Б.
Установление КП
раствора трилона Б
Методика:
Аликвотную
часть полученного раствора (индивидуальное
задание)
помещают
в колбу для титрования, прибавляют 5 см3
аммиачного буферного раствора, 0,1 г
сухогой индикаторной смеси кислотного
хромчерного специального (в смеси с
хлоридом натрия) и титруют 0,05 М раствором
трилона Б до перехода красно-фиолетовой
окраски раствора в синюю.
-
Применение.
Сульфат
магния вводится
внутримышечно, внутривенно, через рот
и в виде клизм. Для достижения желчегонного
эффекта сульфат магния назначают внутрь
в виде 20 — 25%-ного раствора по 1 столовой
ложке 3 раза в день перед едой. Для слепого
зондирования утром натощак принимают
50 мл 25%-ного раствора сульфата магния
или 100 мл 10%-ного раствора, ложатся на
правый бок с теплой грелкой на 1 — 1,5
часа. Для прекращения гипертонических
кризов раствор сульфата магния вводят
внутривенно медленно.
-
Список
литературы.
-
Лурье
Ю.Ю. Справочник по аналитической химии.
Москва, 1972; -
Методическое
указание «Инструментальные методы
анализа», Пермь, 2004; -
Методическое
указание «Качественный химический
анализ», Пермь, 2003; -
Методическое
указание «Количественный химический
анализ», Пермь, 2004; -
Рабинович
В.А., Хавин З.Я. Краткий химический
справочник, Ленинград, 1991.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
<amp/>
|
Сульфат магния |
|
|---|---|
| Названия: | магния сульфат магния(II) сульфат магний сернокислый магниевый купорос английская соль горькая соль горькозем соль Эпсома эпсомская соль PubChem: 24083 |
| Формула: | MgSO4 (безводный) MgSO4 · 7H2O (гептагидрат) |
| SMILES: | [O-]S(=O)(=O)[O-].[Mg+2] |
| Молярная масса: | 120,366 г/моль (безводный) 246,470 г/моль (гептагидрат) |
| Плотность: | 2,66 г/см3 (безводный) 2,445 г/см3 (моногидрат) 1,68 г/см3 (гептагидрат) |
| Сингония: | ромбическая (гептагидрат, эпсомит) a=11,887 Å, b=12,013 Å, c=6,861 Åα=90°, β=90°, γ=90° ромбическая (α-безводный) a=5,174713 Å, b=7,87563 Å, c=6,49517 Åα=90°, β=90°, γ=90° ромбическая (β-безводный) a=4,74599 Å, b=8,5831 Å, c=6,70934 Åα=90°, β=90°, γ=90° моноклинная (моногидрат, кизерит) a=6,891 Å, b=7,624 Å, c=7,645 Åα=90°, β=117,683°, γ=90° ромбическая (дигидрат, сандерит) a=8,8932 Å, b=8,4881 Å, c=12,4401 Åα=90°, β=90°, γ=90° моноклинная (тетрагидрат, старкеит) a=5,922 Å, b=13,604 Å, c=7,905 Åα=90°, β=90,85°, γ=90° моноклинная (тетрагидрат, крансвикит) a=11,9236 Å, b=5,1736 Å, c=12,1958 Åα=90°, β=117,548°, γ=90° триклинная (пентагидрат, пентагидрит) a=6,314 Å, b=10,505 Å, c=6,03 Åα=81,12°, β=109,82°, γ=105,08° моноклинная (гексагидрат, гексагидрит) a=9,975 Å, b=7,186 Å, c=24,267 Åα=90°, β=98,78°, γ=90° моноклинная (монодекагидрат, меридианит) a=6,72548 Å, b=6,77937 Å, c=17,2898 Åα=90°, β=89,478°, γ=90° |
| Формы: |
https://media.crystalls.info/w/uploads/media/Prolongated_tetragonal_pyramidal_prism.json
Вытянутая четырехугольная пирамидальная призма
https://media.crystalls.info/w/uploads/media/Beveled_tetragonal_prism.json
Скошенная четырехугольная призма
https://media.crystalls.info/w/uploads/media/Tetragonal_prism.json
Четырехугольная призма
https://media.crystalls.info/w/uploads/media/Prolongated_octahedron.json
Вытянутый октаэдр
https://media.crystalls.info/w/uploads/media/Truncated_tetragonal_prism.json
Усеченная четырехугольная призма
https://media.crystalls.info/w/uploads/media/Needle.json
Игла |
| Цвет: | бесцветный белый |
| Температура разложения: | 1127 °C1400,15 K <br />2060,6 °F <br />2520,27 °R <br /> (безводный) 194 °C467,15 K <br />381,2 °F <br />840,87 °R <br /> (моногидрат) 73 °C346,15 K <br />163,4 °F <br />623,07 °R <br /> (гексагидрат) 48,4 °C321,55 K <br />119,12 °F <br />578,79 °R <br /> (гептагидрат) -2 °C271,15 K <br />28,4 °F <br />488,07 °R <br /> (монодекагидрат) |
| Показатель преломления: | 1,523 (моногидрат) 1,433 (гептагидрат) |
| Магнитные свойства: | диамагнетик χ=-5,00 · 10-5см³/моль |
| Устойчивость: | сильно выветривается (гептагидрат) гигроскопичен (безводный) |
| Прочность: | относительно прочен (2 по Моосу) |
| Токсичность: | слабо токсичен ЛД50=1200мг/кг |
Описание
Неорганическое соединение, соль двухвалентного переходного металла магния и неорганической серной кислоты. Из водных растворов кристаллизуется в виде гептагидрата.
Нахождение в природе
Встречается в природе как минералы эпсомит, кизерит, сандерит, старкеит, крансвикит, пентагидрит, гексагидрит и меридианит.
Где приобрести
Можно приобрести в аптеке (как «Магния сульфат» или «Английская соль»).
Методы получения
Взаимодействие гидроксида, карбоната или оксида магния и серной кислоты
Уравнение реакции:
Для получения 100,00 грамм гептагидрата сульфата магния требуется 23,66 грамм гидроксида или 34,21 грамм карбоната или 34,21 грамм оксида магния и 107,55 грамм 37% серной кислоты.
В емкость с кислотой небольшими порциями добавляют соответствующее соединение магния и перемешивают до его полного растворения, а в случае с карбонатом — до прекращения выделения углекислого газа. После завершения реакции раствор фильтруют и используют для выращивания кристаллов.
Взаимодействие металлического магния и серной кислоты
Уравнение реакции:
Для получения 100,00 грамм гептагидрата сульфата магния требуется 9,86 грамм магнийа и 107,55 грамм 37% серной кислоты.
В емкость с разбавленной кислотой добавляют магний в виде мелких кусочков, стружки или порошка, после чего перемешивают до прекращения выделения газа.
Взаимодействие металлического магния и медного, цинкового или железного купороса
Уравнение реакции:
Для получения 100,00 грамм гептагидрата сульфата магния требуется 9,86 грамм магнийа и 101,30 грамм пентагидрата сульфата меди(II) или 112,80 грамм гептагидрата сульфата железа(II) или 116,67 грамм гептагидрата сульфата цинка.
В емкость с раствором сульфата меди, железа или цинка добавляют магний в виде мелких кусочков, стружки или порошка, после чего оставляют на несколько дней. После завершения реакции, сопровождающейся изменением цвета раствора, в осадок выпадает менее активный металл. Раствор фильтруют от осадка.
Влияние температуры
Условия хранения
Для хранения используют герметичную емкость, на дно которой наливают небольшое количество насыщенного раствора или помещают смоченную этим же раствором вату. В качестве альтернативного варианта помещают кристалл в ёмкость с маслом (аптечное вазелиновое, растительное) или гидрофобным растворителем (керосин, бензин, парафин). Также можно залить кристаллы акрилом или другим отвердевающим пластиком.
Растворимость
ТаблицаГрафик
| Температура | гр/100,00 гр воды |
гр/100,00 гр этанола |
гр/100,00 гр метанола |
гр/100,00 гр диэтилового эфира |
гр/100,00 гр глицерина |
гр/100,00 гр муравьиной кислоты 95% |
гр/100,00 гр серной кислоты |
|||
|---|---|---|---|---|---|---|---|---|---|---|
| (безводный) | (гептагидрат) | (безводный) | (гептагидрат) | (безводный) | (гептагидрат) | (безводный) | (безводный) | (безводный) | (безводный) | |
| 0°C273,15 K <br />32 °F <br />491,67 °R <br /> | 25,5 |
1,3 |
29 |
|||||||
| 10°C283,15 K <br />50 °F <br />509,67 °R <br /> | 30,4 |
|||||||||
| 15°C288,15 K <br />59 °F <br />518,67 °R <br /> | ~32,8 |
0,025 |
0,276 |
|||||||
| 20°C293,15 K <br />68 °F <br />527,67 °R <br /> | 35,1 |
71 |
~0,25 |
1,16 |
0,34 |
|||||
| 25°C298,15 K <br />77 °F <br />536,67 °R <br /> | 37,4 |
0,224 |
26,3 |
0,22 |
||||||
| 30°C303,15 K <br />86 °F <br />545,67 °R <br /> | 39,7 |
~0,19 |
||||||||
| 40°C313,15 K <br />104 °F <br />563,67 °R <br /> | 44,7 |
~0,13 |
41 |
|||||||
| 50°C323,15 K <br />122 °F <br />581,67 °R <br /> | 50,4 |
~0,07 |
||||||||
| 60°C333,15 K <br />140 °F <br />599,67 °R <br /> | 54,8 |
0,016 |
0,0123 |
|||||||
| 70°C343,15 K <br />158 °F <br />617,67 °R <br /> | 59,2 |
|||||||||
| 80°C353,15 K <br />176 °F <br />635,67 °R <br /> | 54,8 |
|||||||||
| 90°C363,15 K <br />194 °F <br />653,67 °R <br /> | ~52,5 |
1,71 |
||||||||
| 100°C373,15 K <br />212 °F <br />671,67 °R <br /> | 50,2 |
Нерастворим в ацетоне, сероуглероде, этилацетате, метилацетате и аммиаке.
Галерея
Видео
Источники
- Р.А.Кипер, Свойства веществ. Справочник
- Р.А.Кипер, Свойства веществ. Справочник
- Р.А.Кипер, Свойства веществ. Справочник
- А.Фортес, Кристаллические структуры и термическое расширение α- и β-модификация решетки сульфата магния, полученные методом дифракции нейтронов
- М.Гелльери, Структура синтетического эпсомита
- Дж.Брегалт, Изучение структуры кизерита
- Г.Ма, Определение кристаллической структуры сандерита методом рентгенодифракции
- Р.Петерсон, Кристаллическая структура крансвикита
- У.Баур, Дифракция нейтронов на кристаллах тетрагидрата сульфата магния
- У.Баур, Сравнение кристаллов пентагидрата сульфата магния с кристаллами пентагидратов сульфата меди(II) и хромата магния
- А.Батсанов, Гексагидрат сульфата магния при 120K
- Ф.Генцели, Кристаллизация и определение структуры нового гидрата сульфата магния (монодекагидрата)
- Сайт Phasediagram.dk














