Состав
В состав средства входит действующее вещество натрия тетраборат и вспомогательный компонент глицерол.
Форма выпуска
Натрия тетраборат — это раствор, который применяется местно и наружно. Жидкость вмещается во флаконах из темного стекла, по 30 г или 50 г. Флакон вкладывается в пачку из картона.
Фармакологическое действие
Формула натрия тетрабората — Na2B4O7, это соединение бора, соль слабой борной кислоты и сильного основания.
Раствор Натрия тетрабората в глицерине оказывает бактериостатическое и антисептическое воздействие на организм. Средство демонстрирует бактериостатическую активность. Препарат высокоэффективен при терапии вагинального кандидоза. Средство способствует удалению мицелия гриба из влагалища, препятствует прикреплению патогенного грибка к стенкам влагалища и приостанавливает процесс его размножения.
Фунгистатическим или фунгицидным действием не обладает, поэтому противогрибковым средством данный препарат не является.
Описывая что такое Тетраборат натрия, следует отметить, что это вещество входит также в состав комбинированных средств, которые применяются для лечения воспалений верхних дыхательных путей.
Тетраборат натрия оказывает инсектицидный эффект.
Фармакокинетика и фармакодинамика
Применение Натрия тетрабората должно быть исключительно местным: средство приносит пользу для организма исключительно при нанесении на слизистые оболочки и на кожу. Через поверхность слизистых и кожи препарат всасывается в пищеварительную систему. Выводится через почки и кишечник в течение одной недели после того, как препарат был применен.
Показания к применению
Целесообразно местное применение средства в следующих случаях:
- при пролежнях и опрелостях (для обеззараживания);
- при молочнице (вагинальном кандидозе);
- при стоматите, тонзиллите, фарингите.
Противопоказания
Нельзя использовать средство для применения внутрь. Противопоказано при высокой чувствительности, а также при наличии повреждения кожи в местах, которые нужно обработать. Не практикуется применение Натрия тетрабората для грудничков и детей ввиду повышенной токсичности. Однако по показаниям и под контролем врача может применяться у детей при стоматите.
Побочные действия
В качестве побочных эффектов возможно проявление небольшого раздражения, зуда, отеков в местах нанесения. Как правило, такие побочные эффекты появляются у пациентов, которые склонны к аллергии. При возникновении любых негативных реакций применение раствора нужно прекратить и обратиться к специалисту.
Натрия тетраборат, инструкция по применению (Способ и дозировка)
Препарат следует использовать для смазывания кожи, спринцевания, полоскания, в зависимости от диагноза, 2-3 раза в день. Инструкция на Натрия тетраборат для новорожденных и детей основывается, в первую очередь, на рекомендациях лечащего педиатра. Как правило, новорожденным младенцам, страдающим стоматитом, слизистую оболочку обрабатывают ватным тампоном, смоченным в растворе. Процедуру проводят трижды в сутки, лечение длится 6 дней.
Если кандидоз поражает слизистую оболочку рта, раствором нужно обрабатывать пораженные грибком участки 2-3 раза в день. Лечение должно продолжаться от 3 до 7 дней, в зависимости от состояния пациента.
Перед применением Тетрабората натрия больными молочницей половых органов нужно провести спринцевание отварами трав или кипяченой водой. Далее средством смачивают марлевый тампон и вводят его во влагалище примерно на 30 минут. Количество таких процедур зависит от состояния пациентки. Если симптомы кандидоза слабо выражены, достаточно проводить процедуру один раз в день. При хронической стадии болезни и выраженных симптомах применять средство нужно дважды в день. Продолжительность лечения – 1 неделя, даже если симптомы исчезли, не следует прекращать терапию раньше. В процессе лечения после извлечения тампона некоторое время следует избегать подмывания. В период лечения рекомендуется применять нейтральное мыло.
Больные тонзиллитом обрабатывают раствором миндалины, проводить такую процедуру нужно 4-6 раз в день. Продолжительность лечения — 7 дней. Чтобы терапевтический эффект был более выраженным, нужно практиковать полоскание горла солевым раствором Тетрабората натрия. Его можно приготовить своими руками. Для этого несколько капель средства нужно развести в солевом растворе (1 чайная ложка соли на 1 стакан воды). Как сделать раствор для полоскания в других пропорциях, подскажет специалист.
Передозировка
Следует учитывать, что при приеме средства внутрь смертельная доза для взрослого человека составляет 10–20 г.
При передозировке могут отмечаться такие симптомы:
- боль в животе, диарея, рвота;
- головные боли, ощущение общей слабости;
- потеря сознания, дегидратация;
- судороги, подергивания мышц лица или конечностей;
- поражение печени и почек;
- сердечно-сосудистая недостаточность.
В таком случае необходимо сразу промыть желудок, провести форсированный диурез. При тяжелых отравлениях практикуется гемодиализ. Назначается Рибофлавин внутривенно, мононуклеотид. Проводится коррекция ацидоза и водно-электролитного баланса. Также внутривенно вводится раствор Гидрокарбоната натрия, растворов Натрия хлорида и глюкозы, плазмозамещающих растворов.
Если пациент жалуется на боли в желудке, ему назначается раствор Платифиллина и Атропина, 1% раствор Промедола, внутривенно вводится глюкозо-новокаиновая смесь.
Также назначаются средства для поддержки нормальной работы сосудов и сердца.
Взаимодействие
Не следует практиковать одновременное применение антибиотиков местно, а также тех препаратов, в составе которых есть борная кислота, фенол.
Не следует применять Тетраборат натрия с гормональными средствами.
При одновременном приеме с другими средствами для наружного применения могут отмечаться аллергические проявления.
Условия продажи
Продается в аптеках без рецепта.
Условия хранения
Температура хранения должна составлять не более 25 °С. Следует беречь от детей.
Срок годности
Тетраборат натрия можно хранить 2 года.
Особые указания
Чтобы достичь максимальной эффективности при монолечении при молочнице средством, необходимо, чтобы процедуры проводил специалист. Очень важно провести многократную обработку, иначе вследствие наличия во влагалище остатков грибов может развиться рецидив заболевания.
Аналоги
Совпадения по коду АТХ 4-го уровня:
Раствор Натрия тетраборат не имеет аналогов по действующему веществу. Однако существует много препаратов, оказывающих схожее действие. О том, чем можно заменить это средство при стоматите, кандидозе и при лечении других заболеваний, следует обязательно узнавать у специалиста.
Детям
Не рекомендуется ввиду высокой токсичности. Практикуется применение при стоматите под контролем врача и строго по инструкции, для чего нужен осмотр и назначение схемы лечения.
Натрия тетраборат при беременности и лактации
Допускается применение этого средства при беременности под контролем лечащего гинеколога. Именно врач должен назначать схему лечения индивидуально. В период кормления грудью применять нежелательно.
Отзывы о Натрия тетраборате
Отзывы о растворе часто являются положительными. Женщины пишут о том, что натрия тетраборат позволяет избавиться от молочницы, особенно если у пациентки наблюдаются частые рецидивы болезни. Важно правильно проводить процедуру и делать это по той схеме, которую назначил врач.
О применении средства детям отзывы не столь однозначные. Многие родители опасаются его применять, вполне обосновано считая лекарство токсичным.
Цена Натрия тетрабората, где купить
Стоимость Натрия тетрабората составляет в среднем 20 рублей.
Где можно купить средство? Средство продается в аптеках и интернет-аптеках.
- Интернет-аптеки РоссииРоссия
ЗдравСити
-
Натрия тетрабората р-р в глицерине 20% фл. 30гЗАО Московская фарм.ф-ка
Аптека Диалог
-
Натрия тетраборат (раствор буры в глицерине) 20% 30гМФФ
-
Натрия тетраборат (раствор буры в глицерине) 20% 30гСамарамедпром
показать еще

|
|

|
|
| Names | |
|---|---|
| IUPAC name
disodium;3,7-dioxido-2,4,6,8,9-pentaoxa-1,3,5,7-tetraborabicyclo[3.3.1]nonane;decahydrate[1] |
|
| Other names
borax decahydrate |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChEBI |
|
| ChEMBL |
|
| ChemSpider |
|
| EC Number |
|
| E number | E285 (preservatives) |
| KEGG |
|
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
B4O7Na2·10H2O Na2B4O7·10H2O B4H20Na2O17 |
| Molar mass | 381.37 (decahydrate) |
| Appearance | white, crystalline solid |
| Density | 1.73 g/cm3 (decahydrate, solid)[2] |
| Melting point | 743 °C (1,369 °F; 1,016 K) (anhydrous)[2] 75 °C (decahydrate, decomposes)[2] |
| Boiling point | 1,575 °C (2,867 °F; 1,848 K) (anhydrous)[2] |
|
Solubility in water |
31.7 g/L [2] |
|
Magnetic susceptibility (χ) |
−85.0·10−6 cm3/mol (anhydrous)[2]: p.4.135 |
|
Refractive index (nD) |
n1=1.447, n2=1.469, n3=1.472 (decahydrate)[2]: p.4.139 |
| Structure[3] | |
|
Crystal structure |
Monoclinic, mS92, No. 15 |
|
Space group |
C2/c |
|
Point group |
2/m |
|
Lattice constant |
a = 1.1885 nm, b = 1.0654 nm, c = 1.2206 nm α = 90°, β = 106.623°°, γ = 90° |
|
Lattice volume (V) |
1.4810 nm3 |
|
Formula units (Z) |
4 |
| Pharmacology | |
|
ATC code |
S01AX07 (WHO) |
| Hazards | |
| GHS labelling: | |
|
Pictograms |

|
|
Hazard statements |
H360 |
|
Precautionary statements |
P201, P308+P313 |
| NFPA 704 (fire diamond) |
[7] 1 0 0 |
| NIOSH (US health exposure limits): | |
|
PEL (Permissible) |
none[4] |
|
REL (Recommended) |
TWA 1 mg/m3 (anhydrous and pentahydrate)[4][5] TWA 5 mg/m3 (decahydrate)[6] |
|
IDLH (Immediate danger) |
N.D.[4] |
| Related compounds | |
|
Other anions |
Sodium aluminate |
|
Other cations |
Lithium tetraborate |
|
Related compounds |
Boric acid, sodium perborate |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa). Infobox references |
Borax is a salt (ionic compound), a hydrated borate of sodium, with chemical formula Na2H20B4O17 often written Na2B4O7·10H2O.[1] It is a colorless crystalline solid, that dissolves in water to make a basic solution. It is commonly available in powder or granular form, and has many industrial and household uses, including as a pesticide, as a metal soldering flux, as a component of glass, enamel, and pottery glazes, for tanning of skins and hides, for artificial aging of wood, as a preservative against wood fungus, and as a pharmaceutic alkalizer. In chemical laboratories, it is used as a buffering agent.[1][8]
The compound is often called sodium tetraborate decahydrate, but that name is not consistent with its structure. The anion is not tetraborate [B4O7]2− but tetrahydroxy tetraborate [B4O5(OH)4]2−,[9] so the more correct formula should be Na2B4O5(OH)4·8H2O. Informally, the product is often called sodium borate decahydrate or just sodium borate.
The terms tincal «tinkle» and tincar «tinker» refer to native borax, historically mined from dry lake beds in various parts of Asia.[10]
History[edit]
Borax was first discovered in dry lake beds in Tibet. Native tincal from Tibet, Persia, and other parts of Asia was traded via the Silk Road to the Arabian Peninsula in the 8th century AD.[10]
Borax first came into common use in the late 19th century when Francis Marion Smith’s Pacific Coast Borax Company began to market and popularize a large variety of applications under the 20 Mule Team Borax trademark, named for the method by which borax was originally hauled out of the California and Nevada deserts.[11][12]
Etymology[edit]
The English word borax is Latinized: the Middle English form was boras, from Old French boras, bourras. That may have been from Medieval Latin baurach (another English spelling), borac(-/um/em), borax, along with Spanish borrax (> borraj) and Italian borrace, in the 9th century.
The words tincal and tincar were adopted into English in the 17th century from Malay tingkal and from Urdu/Persian Arabic تنکار tinkār/tankār; thus the two forms in English. These all appear to be related to the Sanskrit टांकण ṭānkaṇa.[13][14]
Chemistry[edit]
Structure[edit]
From the chemical perspective, borax contains the [B4O5(OH)4]2− ion. In this structure, there are two four-coordinate boron centers and two three-coordinate boron centers.
Physical properties[edit]
The crystalline decahydrate is a proton conductor at temperatures above 21 °C. Conductivity is maximum along the b axis.[9]
Reactions[edit]
Borax is also easily converted to boric acid and other borates, which have many applications. Its reaction with hydrochloric acid to form boric acid is:
Na2B4O7·10H2O + 2 HCl → 4 H3BO3 + 2 NaCl + 5H2O
The «decahydrate» is sufficiently stable to find use as a primary standard for acid base titrimetry.[15]: p.316
Molten borax dissolves many metal oxides to form glasses. This property is important for its uses in metallurgy and for the borax bead test of qualitative chemical analysis.
Solubility[edit]
Borax is soluble in a variety of solvents; however, it is notably insoluble in ethanol.[1]
| Organic solvent | Temperature °C (°F) |
Borax decahydrate % by weight in saturated solution |
|---|---|---|
| Glycerol 98.5% | 20 (68) | 52.60 |
| Glycerol 86.5% | 20 (68) | 47.19 |
| Ethylene glycol | 25 (77) | 41.60 |
| Diethylene glycol | 25 (77) | 18.60 |
| Methanol | 25 (77) | 19.90 |
| Aqueous ethanol 46.5% | 15.5 (60) | 2.48 |
| Acetone | 25 (77) | 0.60 |
| Ethyl acetate | 25 (77) | 0.14 |
| Temperature °C (°F) |
Borax decahydrate % by weight in saturated solution |
|---|---|
| 0 (32) | 1.99 |
| 5 (41) | 2.46 |
| 10 (50) | 3.09 |
| 15 (59) | 3.79 |
| 20 (68) | 4.70 |
| 25 (77) | 5.80 |
| 30 (86) | 7.20 |
| 35 (95) | 9.02 |
| 40 (104) | 11.22 |
| 45 (113) | 14.21 |
| 50 (122) | 17.91 |
| 55 (131) | 23.22 |
| 60 (140) | 30.32 |
| 65 (149) | 33.89 |
| 70 (158) | 36.94 |
| 75 (167) | 40.18 |
| 80 (176) | 44.31 |
| 85 (185) | 48.52 |
| 90 (194) | 53.18 |
| 95 (203) | 58.94 |
| 100 (212) | 65.63 |
Hydrates[edit]
The term borax properly refers to the so called decahydrate Na2B4O7·10H2O, more correctly written Na2B4O5(OH)4·8H2O. However, the term may be applied also to the related compounds
Borax pentahydrate[edit]
Borax pentahydrate has the formula Na2B4O7·5H2O, more properly Na2B4O5(OH)4·3H2O It is a colorless solid with density is 1.880 kg/m3 that crystallizes from water solutions above 60.8 °C in the rhombohedral crystal system. It occurs naturally as the mineral tinkhanite.[17] It can be obtained by heating the decahydrate above 61 °C.[18]
Borax dihydrate[edit]
Borax dihydrate has the formula Na2B4O7·2H2O, more properly Na2B4O5(OH)4. It can be obtained by heating the decahydrate or pentahydrate to above 116-120 °C. [18]
Anhydrous borax[edit]
Anhydrous borax is sodium tetraborate proper, with formula Na2B4O7. It can be obtained by heating any hydrate to 300 °C.[18] It has one amorphous (glassy) form and three crystalline forms — α, β, and γ, with melting points of 1015, 993 and 936 K respectively. α-Na2B4O7 is the stable form.[18]
Natural sources[edit]
Borax occurs naturally in evaporite deposits produced by the repeated evaporation of seasonal lakes. The most commercially important deposits are found in: Turkey; Boron, California; and Searles Lake, California. Also, borax has been found at many other locations in the Southwestern United States, the Atacama desert in Chile, newly discovered deposits in Bolivia, and in Tibet and Romania. Borax can also be produced synthetically from other boron compounds.[citation needed]
Naturally occurring borax (known by the trade name Rasorite–46 in the United States and many other countries) is refined by a process of recrystallization.[19]
Uses[edit]
Ant control[edit]
Borax is used in control solutions because it is toxic to ants. Because it is slow-acting, worker ants will carry the borax to their nests and poison the rest of the colony.[20]
Household products[edit]
Borax is used in various household laundry and cleaning products,[21][22] including the 20 Mule Team Borax laundry booster, Boraxo powdered hand soap, and some tooth bleaching formulas.[23][24]
pH buffer[edit]
Borate ions (commonly supplied as boric acid) are used in biochemical and chemical laboratories to make buffers, e.g. for polyacrylamide gel electrophoresis of DNA and RNA, such as TBE buffer (borate buffered tris-hydroxymethylaminomethonium)[25][26] or the newer SB buffer or BBS buffer (borate buffered saline) in coating procedures. Borate buffers (usually at pH 
Co-complexing agent[edit]
Borax as a source of borate has been used to take advantage of the co-complexing ability of borate with other agents in water to form complex ions with various substances. Borate and a suitable polymer bed are used to chromatograph non-glycated hemoglobin differentially from glycated hemoglobin (chiefly HbA1c), which is an indicator of long-term hyperglycemia in diabetes mellitus.[citation needed]
Water-softening agent[edit]
Borax alone does not have a high affinity for the hardness cations, although it has been used for water-softening. Its chemical equation for water-softening is given below:
Ca2+ (aq) + Na2B4O7 (aq) → Ca B4O7 (s)↓ + 2 Na+ (aq)
Mg2+ (aq) + Na2B4O7 (aq) → Mg B4O7 (s)↓ + 2 Na+ (aq)
The sodium ions introduced do not make water ‘hard’. This method is suitable for removing both temporary and permanent types of hardness.
Flux[edit]
A mixture of borax and ammonium chloride is used as a flux when welding iron and steel. It lowers the melting point of the unwanted iron oxide (scale), allowing it to run off. Borax is also used mixed with water as a flux when soldering jewelry metals such as gold or silver, where it allows the molten solder to wet the metal and flow evenly into the joint.[citation needed] Borax is also a good flux for «pre-tinning» tungsten with zinc, making the tungsten soft-solderable.[27] Borax is often used as a flux for forge welding.[28]
Small-scale gold mining[edit]
In artisanal gold mining, borax is sometimes used as part of a process known as the borax method (as a flux) meant to eliminate the need for toxic mercury in the gold extraction process, although it cannot directly replace mercury. Borax was reportedly used by gold miners in parts of the Philippines in the 1900s.[29][30] There is evidence that, in addition to reducing the environmental impact, this method achieves better gold recovery for suitable ores and is less expensive. This borax method is used in northern Luzon in the Philippines, but miners have been reluctant to adopt it elsewhere for reasons that are not well understood.[31] The method has also been promoted in Bolivia[32] and Tanzania.[33]
Flubber[edit]
A rubbery polymer sometimes called Slime, Flubber, ‘gluep’ or ‘glurch’ (or erroneously called Silly Putty, which is based on silicone polymers), can be made by cross-linking polyvinyl alcohol with borax. Making flubber from polyvinyl acetate-based glues, such as Elmer’s Glue, and borax is a common elementary-science demonstration.[34][35]
Food additive[edit]
Borax, given the E number E285, is used as a food additive, but is banned in some countries, such as Australia, China, Thailand and the United States.[36] As a consequence, certain foods, such as caviar, produced for sale in the United States contain higher levels of salt to assist preservation.[37]
In addition to its use as a preservative, borax imparts a firm, rubbery texture to food. In China, borax (Chinese: 硼砂; pinyin: péng shā or Chinese: 月石; pinyin: yuè shí) has been found in foods including wheat and rice noodles named lamian (Chinese: 拉面; pinyin: lāmiàn), shahe fen (Chinese: 沙河粉; pinyin: shāhéfěn), char kway teow (Chinese: 粿條; pinyin: guǒ tiáo), and chee cheong fun (Chinese: 肠粉; pinyin: chángfěn)[clarify][38] In Indonesia, it is a common, but forbidden,[39] additive to such foods as noodles, bakso (meatballs), and steamed rice.
When consumed with boric acid, numerous studies have demonstrated an inverse correlation between borax and various types of cancers.[40] Boric acid and borax are low in toxicity for acute oral exposures, at approximately the same acute toxicity as salt. The average dose for asymptomatic ingestion cases, which accounts for 88% of all ingestions, is around 0.9 grams. However, the range of reported asymptomatic doses is wide, from 0.01 to 88.8 g.[41]
Other uses[edit]
- Ingredient in enamel glazes[42]
- Component of glass, pottery, and ceramics[43]
- Used as an additive in ceramic slips and glazes to improve fit on wet, greenware, and bisque[citation needed]
- Fire retardant[44]
- Anti-fungal compound for cellulose insulation[43]
- Moth proofing 10% solution for wool[45]
- Pulverized for the prevention of stubborn pests (e.g. German cockroaches) in closets, pipe and cable inlets, wall panelling gaps, and inaccessible locations where ordinary pesticides are undesirable[46]
- Precursor for sodium perborate monohydrate that is used in detergents, as well as for boric acid and other borates[citation needed]
- Tackifier ingredient in casein, starch and dextrin based adhesives[47]
- Precursor for boric acid, a tackifier ingredient in polyvinyl acetate, polyvinyl alcohol based adhesives
- To make indelible ink for dip pens by dissolving shellac into heated borax[citation needed]
- Curing agent for snake skins[citation needed]
- Curing agent for salmon eggs, for use in sport fishing for salmon[48]
- Swimming pool buffering agent to control pH[49]
- Neutron absorber, used in nuclear reactors and spent fuel pools to control reactivity and to shut down a nuclear chain reaction[50]
- As a micronutrient fertilizer to correct boron-deficient soils[51][52]
- Preservative in taxidermy[53]
- To color fires with a green tint[54]
- Traditionally used to coat dry-cured meats such as hams to improve the appearance and discourage flies[55][56][57]
- Used by blacksmiths in forge welding[28]
- Used as a flux for melting metals and alloys in casting to draw out impurities and prevent oxidation[citation needed]
- Used as a woodworm treatment (diluted in water)[citation needed]
- In particle physics as an additive to nuclear emulsion, to extend the latent image lifetime of charged particle tracks. The first observation of the pion, which was awarded the 1950 Nobel Prize, used this type of emulsion.[58][59]
Toxicity[edit]
Borax, sodium tetraborate decahydrate, according to one study, is not acutely toxic. Its LD50 (median lethal dose) score is tested at 2.66 g/kg in rats, meaning that a significant dose of the chemical is needed to cause severe symptoms or death. The lethal dose is not necessarily the same for humans. On pesticide information websites it is listed as a non-lethal compound and of no hazardous concerns.
Borax has been in use as an insecticide in the United States with various restrictions since 1946. All restrictions were removed in February 1986 due to the low toxicity of borax, as reported in two EPA documents relating to boric acid and borax.[60][61]
EPA has determined that, because they are of low toxicity and occur naturally, boric acid and its sodium salts should be exempted from the requirement of a tolerance (maximum residue limit) for all raw agricultural commodities.[60]
Although it cited inconclusive data, a re-evaluation in 2006 by the EPA still found that «There were no signs of toxicity observed during the study and no evidence of cytotoxicity to the target organ.»[62] In the reevaluation, a study of toxicity due to overexposure was checked and the findings were that «The residential handler inhalation risks due to boric acid and its sodium salts as active ingredients are not a risk concern and do not exceed the level of concern…» but that there could be some risk of irritation to children inhaling it if used as a powder for cleaning rugs.
Sodium tetraborate decahydrate has no known hazard issues.[63][clarification needed]
Overexposure to borax dust can cause respiratory irritation, while no skin irritation is known to exist due to external borax exposure. Ingestion may cause gastrointestinal distress including nausea, persistent vomiting, abdominal pain, and diarrhea. Effects on the vascular system and human brain include headaches and lethargy, but are less frequent. In severe cases, a «beefy» red rash affecting the palms, soles, buttocks and scrotum has occurred. [64]
Possible carcinogen[edit]
The Indonesian Directorate of Consumer Protection warns of the risk of liver cancer with high consumption of borax over a period of 5–10 years.[57]
Risk to fertility and pregnancy[edit]
Borax was added to the Substance of Very High Concern (SVHC) candidate list on December 16, 2010. The SVHC candidate list is part of the EU Regulations on the Registration, Evaluation, Authorisation and Restriction of Chemicals 2006 (REACH), and the addition was based on the revised classification of borax as toxic for reproduction category 1B under the CLP Regulations. Substances and mixtures imported into the EU which contain borax are now required to be labelled with the warnings «May damage fertility» and «May damage the unborn child».[65] It was proposed for addition to REACH Annex XIV by the ECHA on July 1, 2015.[66] If this recommendation is approved, all imports and uses of borax in the EU will have to be authorized by the ECHA.[needs update]
Review of the boron toxicity (as boric acid and borates) published 2012 in Journal of Toxicology and Environmental Health concluded: «It clearly appears that human B [boron] exposures, even in the highest exposed cohorts, are too low to reach the blood (and target tissue) concentrations that would be required to exert adverse effects on reproductive functions.»[67]
A draft risk assessment released by Health Canada in July 2016 has found that overexposure to boric acid has the potential to cause developmental and reproductive health effects. Since people are already exposed to boric acid naturally through their diets and water, Health Canada advised that exposure from other sources should be reduced as much as possible, especially for children and pregnant women. The concern is not with any one product, but rather multiple exposures from a variety of sources. With this in mind, the department also announced that registrations for certain pesticides that contain boric acid, which are commonly used in homes, will have their registrations cancelled and be phased out of the marketplace. As well, new, more protective label directions are being introduced for other boric acid pesticides that continue to be registered in Canada (for example, enclosed bait stations and spot treatments using gel formulations).[68]
See also[edit]
- Borax bead test
- John Veatch
- List of cleaning agents
- Sodium borohydride
- Ulexite
References[edit]
- ^ a b c d e PubChem. «Borax». pubchem.ncbi.nlm.nih.gov. Retrieved December 27, 2021.
- ^ a b c d e f g Haynes, William M., ed. (2011). CRC Handbook of Chemistry and Physics (92nd ed.). CRC Press. ISBN 978-1439855119.
- ^ Levy, H. A.; Lisensky, G. C. (1978). «Crystal structures of sodium sulfate decahydrate (Glauber’s salt) and sodium tetraborate decahydrate (borax). Redetermination by neutron diffraction». Acta Crystallographica Section B. 34 (12): 3502–3510. doi:10.1107/S0567740878011504.
- ^ a b c NIOSH Pocket Guide to Chemical Hazards. «#0057». National Institute for Occupational Safety and Health (NIOSH).
- ^ NIOSH Pocket Guide to Chemical Hazards. «#0059». National Institute for Occupational Safety and Health (NIOSH).
- ^ NIOSH Pocket Guide to Chemical Hazards. «#0058». National Institute for Occupational Safety and Health (NIOSH).
- ^ «Potential Commodities NFPA 704» (PDF). Archived from the original (PDF) on May 17, 2016. Retrieved December 9, 2018.
- ^ «CompTox Chemicals Dashboard». comptox.epa.gov. Retrieved January 1, 2022.
- ^ a b S.Maričić, V.Pravdić, and Z.Veksli (1962): «Proton conductivity in borax, Na2[B4O5(OH)4]-8H2O».Journal of Physics and Chemistry of Solids, volume 23, issue 11, pages 1651-1659. doi:10.1016/0022-3697(62)90248-2
- ^ a b «Borax (Na2B4O7·10H2O ) – Sodium Borate – Occurrence, Discovery and Applications». Amoz.com. August 16, 2004.
- ^ «American Borax Production» Scientific American September 22, 1877
- ^ Hildebrand, G. H. (1982) «Borax Pioneer: Francis Marion Smith.» San Diego: Howell-North Books. p. 267 ISBN 0-8310-7148-6
- ^ «Tincal». Oxford English Dictionary (Online ed.). Oxford University Press. (Subscription or participating institution membership required.)
- ^ Chemical Age of India, Vol. 37, No.10 & 11 (1976)
- ^ Mendham, J.; Denney, R. C.; Barnes, J. D.; Thomas, M. J. K. (2000), Vogel’s Quantitative Chemical Analysis (6th ed.), New York: Prentice Hall, ISBN 0-582-22628-7
- ^ a b Borax decahydrate. borax.com
- ^ Mehmet Akgül and Osman Çamlıbe (2021) «The use of borax pentahydrate of inorganic filler in medium density fiberboard production». Maderas, Ciencia y tecnología, volume 23, Epub 28-Ene-2021. doi:10.4067/s0718-221×2021000100422
- ^ a b c d Ömer Şahin and A. Nusret Bulutcu (2002): «Dehydration Behaviour of Borax Pentahydrate to Anhydrous Borax by Multi-Stage Heating in a Fluidized». Turkish Journal of Chemistry, volume 26, article 10, pages 89–96.
- ^ Wizniak, Jaime (July 2005). «Borax, Boric Acid, and Boron – From exotic to commodity» (PDF). Indian Journal of Chemical Technology. 12 (4). ISSN 0975-0991.
- ^ Klotz, John H.; Greenberg, Les; Amrhein, Christopher; Rust, Michael K. (August 1, 2000). «Toxicity and Repellency of Borate-Sucrose Water Baits to Argentine Ants (Hymenoptera: Formicidae)». Journal of Economic Entomology. 93 (4): 1256–1258. doi:10.1603/0022-0493-93.4.1256. PMID 10985039. S2CID 17829851.
- ^ Record in the Household Products Database of NLM
- ^ «The Many, Many Uses of Borax for Laundry». U.S. Borax. Retrieved June 13, 2022.
- ^ Hammond, C. R. (2004). The Elements, in Handbook of Chemistry and Physics 81st edition. CRC press. ISBN 978-0-8493-0485-9.
- ^ O’Neil, M.J. (ed.). The Merck Index — An Encyclopedia of Chemicals, Drugs, and Biologicals. Cambridge, UK: Royal Society of Chemistry, 2013., p. 1595
- ^ Peacock, Andrew C.; Dingman, C. Wesley (1967). «Resolution of Multiple Ribonucleic Acid Species by Polyacrylamide Gel Electrophoresis». Biochemistry. 6 (6): 1818–1827. doi:10.1021/bi00858a033. PMID 6035921.
- ^ Anderson, S. (1981). «Shotgun DNA sequencing using cloned DNase I-generated fragments». Nucleic Acids Research. 9 (13): 3015–27. doi:10.1093/nar/9.13.3015. PMC 327328. PMID 6269069.
- ^ Dodd, J.G. (1966). «Soft soldering to tungsten wire». Am. J. Phys. 34 (10): xvi. Bibcode:1966AmJPh..34D..16D. doi:10.1119/1.1972398.
- ^ a b Moehring, Jack; Willman, Michael; Pulscher, Isaac; Rowe, Devin (December 2016). «Bladesmithing at South Dakota School of Mines and Technology». JOM. 68 (12): 3186–3192. Bibcode:2016JOM….68l3186M. doi:10.1007/s11837-016-2139-z. ISSN 1047-4838. S2CID 137747858.
- ^ «March 2012 ipad ewaste Filipino Borax, Pakistans Pollution, Artisanal Gold Mining». Blacksmithinstitute.org. Archived from the original on October 13, 2016. Retrieved August 7, 2016.
- ^ «The borax method» (PDF). Borax replacing mercury in small-scale mining. The Geological Survey of Denmark and Greenland (GEUS). Archived from the original (PDF) on December 6, 2008. Retrieved August 2, 2008.
- ^ Appel, Peter W.U.; Na-Oy, Leoncio (June 1, 2012). «The Borax Method of Gold Extraction for Small-Scale Miners». Journal of Health and Pollution. 2 (3): 5–10. doi:10.5696/2156-9614-2.3.5.
- ^ Appel, Peter W. U.; Andersen, Astrid; Na-Oy, Leoncio D.; Onos, Rudy (December 1, 2015). «Introduction of Mercury-free Gold Extraction Methods to Medium-Scale Miners and Education of Health Care Providers to Reduce the use of Mercury in Sorata, Bolivia». Journal of Health and Pollution. 5 (9): 12–17. doi:10.5696/2156-9614-5-9.12. PMC 6221499. PMID 30524772.
- ^ Appel, Peter W.U.; Jønsson, Jesper Bosse (December 31, 1969). «Borax – an alternative to mercury for gold extraction by small-scale miners: introducing the method in Tanzania». Geological Survey of Denmark and Greenland (GEUS) Bulletin. 20: 87–90. doi:10.34194/geusb.v20.4988.
- ^ Parratore, Phil (1998). Wacky Science: A Cookbook for Elementary Teachers. Dubuque, IA: Kendall Hunt. p. 26. ISBN 978-0-7872-2741-8.
- ^ «Slime Recipe — How to Make Borax and White Glue Slime». Chemistry.about.com. Retrieved August 7, 2016.
- ^ Reiley, Laura (April 22, 2019). «After China turned it into a cheap snack, caviar is at risk of losing its status as a luxury good». The Washington Post. Retrieved April 22, 2019.
- ^ «Caviar glossary». The Caviar Guide a gourmet review of caviars & fish roe. Hanson Ltd, Geneva, Switzerland. Archived from the original on December 8, 2008. Retrieved July 7, 2008.
- ^ «Chinese Ingredients: Borax Powder, Mushroom Extract – Chowhound». Chowhound.chow.com. September 11, 2005. Retrieved August 7, 2016.
- ^ «BAHAN BERBAHAYA YANG DILARANG UNTUK PANGAN». www.pom.go.id. Retrieved June 26, 2021.
- ^ Wu, Lun; Wei, Ying; Zhou, Wen-Bo; Zhang, You-Shun; Chen, Qin-Hua; Liu, Ming-Xing; Zhu, Zheng-Peng; Zhou, Jiao; Yang, Li-Hua; Wang, Hong-Mei; Wei, Guang-Min; Wang, Sheng; Tang, Zhi-Gang (July 1, 2019). «Gene expression alterations of human liver cancer cells following borax exposure». Oncology Reports. 42 (1): 115–130. doi:10.3892/or.2019.7169. ISSN 1021-335X.
- ^ «Boric Acid Technical Fact Sheet». npic.orst.edu. Retrieved December 13, 2022.
- ^ «Alphabetical information on pottery glaze making materials and clay body ingredients». Sheffield Pottery. Retrieved December 4, 2019.
- ^ a b Schubert, David M. (2003). «Borates in Industrial Use». In Roesky, Herbert W.; Atwood, David A. (eds.). Group 13 Chemistry III. Group 13 Chemistry III: Industrial Applications. Structure and Bonding. Vol. 105. Springer Berlin Heidelberg. pp. 1–40. doi:10.1007/3-540-46110-8_1. ISBN 978-3-540-46110-4.
- ^ Shen, Kelvin K.; O’Connor, Roderick (1998), Pritchard, Geoffrey (ed.), «Flame retardants: borates», Plastics Additives: An A-Z reference, Polymer Science and Technology Series, Springer Netherlands, pp. 268–276, doi:10.1007/978-94-011-5862-6_30, ISBN 978-94-011-5862-6
- ^ «Centre for Alternative Technology». Cat.org.uk. Archived from the original on August 1, 2012. Retrieved August 7, 2016.
- ^ Murray, Lynda M. (1989). «Least toxic pest control: how infestations of termites, ants, fleas, ticks, and beetles can be controlled without causing short- or long-term indoor air quality changes and health risks» (PDF). nepis.epa.gov. United States Environmental Protection Agency. [/web/20220626035430/https://nepis.epa.gov/Exe/ZyPDF.cgi/9100YHGT.PDF?Dockey=9100YHGT.PDF Archived] (PDF) from the original on June 25, 2022. Retrieved June 25, 2022.
- ^ Suárez, Juan C. (2011), «Bioadhesives», in da Silva, Lucas F. M.; Öchsner, Andreas; Adams, Robert D. (eds.), Handbook of Adhesion Technology, Springer Berlin Heidelberg, pp. 1385–1408, doi:10.1007/978-3-642-01169-6_53, ISBN 978-3-642-01168-9
- ^ «Curing eggs for steelhead, steelhead egg cures, Buzz Ramsey, Bill Swann, Andy Martin». wildriversfishing.com. Retrieved April 16, 2021.
- ^ [1], «Buffer System for Swimming Pools and Related Structures», issued 2008-11-17
- ^ «Development of Boron-based materials for nuclear applications» (PDF). Archived (PDF) from the original on September 22, 2010.
- ^ «Borax». Nature.berkeley.edu. Retrieved August 7, 2016.
- ^ «Boron Basics». www.spectrumanalytic.com.
- ^ «Learning Taxidermy Fish». Taxidermy Hobbyist | The Art Of Taxidermy. March 17, 2011. Retrieved April 16, 2021.
- ^ Marie, Anne. «How To Color Fire – Fun Fireplace Instructions». Chemistry.about.com. Retrieved August 7, 2016.
- ^ Nicholls, Walter (November 10, 1991). «THE CUSTOM OF THE COUNTRY HAM». The Washington Post.
- ^ «Report of the State Board of Health of the State of New Hampshire …, Volume 19». 1906. pp. 169–171.
{{cite web}}: CS1 maint: url-status (link) - ^ a b «Watch Out For The Food We Consume». Directorate of Consumer Protection, Jakarta, Indonesia. 2006. Archived from the original on December 28, 2008. Retrieved February 10, 2009.
- ^ C.M.G. Lattes, R.H.Fowler, and R.Cuer (1947): «Range-Energy Relation for Protons and a-Particles in the New Ilford ‘Nuclear Research’ Emulsions». Nature, volume 159, pages 301-302
- ^ C.M.G.Lattes and G.P.S.Occhialini (1947): «Determination of the Energy and Momentum of Fast Neutrons in Cosmic Rays». Nature, volume 159 (1947), , pages 331-332
- ^ a b «Pesticide Reregistration Status — Pesticides — US EPA» (PDF). Epa.gov. Retrieved August 7, 2016.
- ^ «Pesticides — US EPA» (PDF). Epa.gov. August 20, 2015. Retrieved August 7, 2016.
- ^ «Regulations.gov». Archived from the original on May 3, 2015. Retrieved April 27, 2015.
- ^ «Safety Data Sheet : acc. to OSHA HCS» (PDF). Aquasolutions.org. Retrieved August 7, 2016.
- ^ Reigart, J. Routt (2009). Recognition and Management of Pesticide Poisonings (5th Ed. ). DIANE Publishing. p. 76. ISBN 978-1-4379-1452-8. Retrieved June 4, 2020.
- ^ Member state committee draft support document for identification of disodium tetraborate, anhydrous as a substance of very high concern because of its CMR properties. Adopted on June 9, 2010. Echa.europa.eu. Retrieved on February 17, 2012.
- ^ Recommendation of the European Chemicals Agency of 1 July 2015 for the inclusion of substances in Annex XIV to REACH (List of Substances subject to Authorisation) Echa.europa.eu. Retrieved on July 6, 2015.
- ^ Bolt, Hermann M.; Başaran, Nurşen; Duydu, Yalçın (2012). «Human Environmental and Occupational Exposures to Boric Acid: Reconciliation with Experimental Reproductive Toxicity Data». Journal of Toxicology and Environmental Health, Part A. 75 (8–10): 508–514. doi:10.1080/15287394.2012.675301. PMID 22686310. S2CID 31972554.
- ^ «Information Update – Health Canada advises Canadians to avoid homemade craft and pesticide recipes using boric acid – Recalls & alerts – Healthy Canadians Website». Healthycanadians.gc.ca. July 22, 2016. Retrieved August 7, 2016.
External links[edit]
Wikimedia Commons has media related to Borax.
Look up borax in Wiktionary, the free dictionary.
- International Chemical Safety Card 0567
- International Chemical Safety Card 1229 (fused borax)
- National Pollutant Inventory – Boron and compounds
- NIOSH Pocket Guide to Chemical Hazards
- Sodium Borate in sefsc.noaa.gov

|
|

|
|
| Names | |
|---|---|
| IUPAC name
disodium;3,7-dioxido-2,4,6,8,9-pentaoxa-1,3,5,7-tetraborabicyclo[3.3.1]nonane;decahydrate[1] |
|
| Other names
borax decahydrate |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChEBI |
|
| ChEMBL |
|
| ChemSpider |
|
| EC Number |
|
| E number | E285 (preservatives) |
| KEGG |
|
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
B4O7Na2·10H2O Na2B4O7·10H2O B4H20Na2O17 |
| Molar mass | 381.37 (decahydrate) |
| Appearance | white, crystalline solid |
| Density | 1.73 g/cm3 (decahydrate, solid)[2] |
| Melting point | 743 °C (1,369 °F; 1,016 K) (anhydrous)[2] 75 °C (decahydrate, decomposes)[2] |
| Boiling point | 1,575 °C (2,867 °F; 1,848 K) (anhydrous)[2] |
|
Solubility in water |
31.7 g/L [2] |
|
Magnetic susceptibility (χ) |
−85.0·10−6 cm3/mol (anhydrous)[2]: p.4.135 |
|
Refractive index (nD) |
n1=1.447, n2=1.469, n3=1.472 (decahydrate)[2]: p.4.139 |
| Structure[3] | |
|
Crystal structure |
Monoclinic, mS92, No. 15 |
|
Space group |
C2/c |
|
Point group |
2/m |
|
Lattice constant |
a = 1.1885 nm, b = 1.0654 nm, c = 1.2206 nm α = 90°, β = 106.623°°, γ = 90° |
|
Lattice volume (V) |
1.4810 nm3 |
|
Formula units (Z) |
4 |
| Pharmacology | |
|
ATC code |
S01AX07 (WHO) |
| Hazards | |
| GHS labelling: | |
|
Pictograms |

|
|
Hazard statements |
H360 |
|
Precautionary statements |
P201, P308+P313 |
| NFPA 704 (fire diamond) |
[7] 1 0 0 |
| NIOSH (US health exposure limits): | |
|
PEL (Permissible) |
none[4] |
|
REL (Recommended) |
TWA 1 mg/m3 (anhydrous and pentahydrate)[4][5] TWA 5 mg/m3 (decahydrate)[6] |
|
IDLH (Immediate danger) |
N.D.[4] |
| Related compounds | |
|
Other anions |
Sodium aluminate |
|
Other cations |
Lithium tetraborate |
|
Related compounds |
Boric acid, sodium perborate |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa). Infobox references |
Borax is a salt (ionic compound), a hydrated borate of sodium, with chemical formula Na2H20B4O17 often written Na2B4O7·10H2O.[1] It is a colorless crystalline solid, that dissolves in water to make a basic solution. It is commonly available in powder or granular form, and has many industrial and household uses, including as a pesticide, as a metal soldering flux, as a component of glass, enamel, and pottery glazes, for tanning of skins and hides, for artificial aging of wood, as a preservative against wood fungus, and as a pharmaceutic alkalizer. In chemical laboratories, it is used as a buffering agent.[1][8]
The compound is often called sodium tetraborate decahydrate, but that name is not consistent with its structure. The anion is not tetraborate [B4O7]2− but tetrahydroxy tetraborate [B4O5(OH)4]2−,[9] so the more correct formula should be Na2B4O5(OH)4·8H2O. Informally, the product is often called sodium borate decahydrate or just sodium borate.
The terms tincal «tinkle» and tincar «tinker» refer to native borax, historically mined from dry lake beds in various parts of Asia.[10]
History[edit]
Borax was first discovered in dry lake beds in Tibet. Native tincal from Tibet, Persia, and other parts of Asia was traded via the Silk Road to the Arabian Peninsula in the 8th century AD.[10]
Borax first came into common use in the late 19th century when Francis Marion Smith’s Pacific Coast Borax Company began to market and popularize a large variety of applications under the 20 Mule Team Borax trademark, named for the method by which borax was originally hauled out of the California and Nevada deserts.[11][12]
Etymology[edit]
The English word borax is Latinized: the Middle English form was boras, from Old French boras, bourras. That may have been from Medieval Latin baurach (another English spelling), borac(-/um/em), borax, along with Spanish borrax (> borraj) and Italian borrace, in the 9th century.
The words tincal and tincar were adopted into English in the 17th century from Malay tingkal and from Urdu/Persian Arabic تنکار tinkār/tankār; thus the two forms in English. These all appear to be related to the Sanskrit टांकण ṭānkaṇa.[13][14]
Chemistry[edit]
Structure[edit]
From the chemical perspective, borax contains the [B4O5(OH)4]2− ion. In this structure, there are two four-coordinate boron centers and two three-coordinate boron centers.
Physical properties[edit]
The crystalline decahydrate is a proton conductor at temperatures above 21 °C. Conductivity is maximum along the b axis.[9]
Reactions[edit]
Borax is also easily converted to boric acid and other borates, which have many applications. Its reaction with hydrochloric acid to form boric acid is:
Na2B4O7·10H2O + 2 HCl → 4 H3BO3 + 2 NaCl + 5H2O
The «decahydrate» is sufficiently stable to find use as a primary standard for acid base titrimetry.[15]: p.316
Molten borax dissolves many metal oxides to form glasses. This property is important for its uses in metallurgy and for the borax bead test of qualitative chemical analysis.
Solubility[edit]
Borax is soluble in a variety of solvents; however, it is notably insoluble in ethanol.[1]
| Organic solvent | Temperature °C (°F) |
Borax decahydrate % by weight in saturated solution |
|---|---|---|
| Glycerol 98.5% | 20 (68) | 52.60 |
| Glycerol 86.5% | 20 (68) | 47.19 |
| Ethylene glycol | 25 (77) | 41.60 |
| Diethylene glycol | 25 (77) | 18.60 |
| Methanol | 25 (77) | 19.90 |
| Aqueous ethanol 46.5% | 15.5 (60) | 2.48 |
| Acetone | 25 (77) | 0.60 |
| Ethyl acetate | 25 (77) | 0.14 |
| Temperature °C (°F) |
Borax decahydrate % by weight in saturated solution |
|---|---|
| 0 (32) | 1.99 |
| 5 (41) | 2.46 |
| 10 (50) | 3.09 |
| 15 (59) | 3.79 |
| 20 (68) | 4.70 |
| 25 (77) | 5.80 |
| 30 (86) | 7.20 |
| 35 (95) | 9.02 |
| 40 (104) | 11.22 |
| 45 (113) | 14.21 |
| 50 (122) | 17.91 |
| 55 (131) | 23.22 |
| 60 (140) | 30.32 |
| 65 (149) | 33.89 |
| 70 (158) | 36.94 |
| 75 (167) | 40.18 |
| 80 (176) | 44.31 |
| 85 (185) | 48.52 |
| 90 (194) | 53.18 |
| 95 (203) | 58.94 |
| 100 (212) | 65.63 |
Hydrates[edit]
The term borax properly refers to the so called decahydrate Na2B4O7·10H2O, more correctly written Na2B4O5(OH)4·8H2O. However, the term may be applied also to the related compounds
Borax pentahydrate[edit]
Borax pentahydrate has the formula Na2B4O7·5H2O, more properly Na2B4O5(OH)4·3H2O It is a colorless solid with density is 1.880 kg/m3 that crystallizes from water solutions above 60.8 °C in the rhombohedral crystal system. It occurs naturally as the mineral tinkhanite.[17] It can be obtained by heating the decahydrate above 61 °C.[18]
Borax dihydrate[edit]
Borax dihydrate has the formula Na2B4O7·2H2O, more properly Na2B4O5(OH)4. It can be obtained by heating the decahydrate or pentahydrate to above 116-120 °C. [18]
Anhydrous borax[edit]
Anhydrous borax is sodium tetraborate proper, with formula Na2B4O7. It can be obtained by heating any hydrate to 300 °C.[18] It has one amorphous (glassy) form and three crystalline forms — α, β, and γ, with melting points of 1015, 993 and 936 K respectively. α-Na2B4O7 is the stable form.[18]
Natural sources[edit]
Borax occurs naturally in evaporite deposits produced by the repeated evaporation of seasonal lakes. The most commercially important deposits are found in: Turkey; Boron, California; and Searles Lake, California. Also, borax has been found at many other locations in the Southwestern United States, the Atacama desert in Chile, newly discovered deposits in Bolivia, and in Tibet and Romania. Borax can also be produced synthetically from other boron compounds.[citation needed]
Naturally occurring borax (known by the trade name Rasorite–46 in the United States and many other countries) is refined by a process of recrystallization.[19]
Uses[edit]
Ant control[edit]
Borax is used in control solutions because it is toxic to ants. Because it is slow-acting, worker ants will carry the borax to their nests and poison the rest of the colony.[20]
Household products[edit]
Borax is used in various household laundry and cleaning products,[21][22] including the 20 Mule Team Borax laundry booster, Boraxo powdered hand soap, and some tooth bleaching formulas.[23][24]
pH buffer[edit]
Borate ions (commonly supplied as boric acid) are used in biochemical and chemical laboratories to make buffers, e.g. for polyacrylamide gel electrophoresis of DNA and RNA, such as TBE buffer (borate buffered tris-hydroxymethylaminomethonium)[25][26] or the newer SB buffer or BBS buffer (borate buffered saline) in coating procedures. Borate buffers (usually at pH 
Co-complexing agent[edit]
Borax as a source of borate has been used to take advantage of the co-complexing ability of borate with other agents in water to form complex ions with various substances. Borate and a suitable polymer bed are used to chromatograph non-glycated hemoglobin differentially from glycated hemoglobin (chiefly HbA1c), which is an indicator of long-term hyperglycemia in diabetes mellitus.[citation needed]
Water-softening agent[edit]
Borax alone does not have a high affinity for the hardness cations, although it has been used for water-softening. Its chemical equation for water-softening is given below:
Ca2+ (aq) + Na2B4O7 (aq) → Ca B4O7 (s)↓ + 2 Na+ (aq)
Mg2+ (aq) + Na2B4O7 (aq) → Mg B4O7 (s)↓ + 2 Na+ (aq)
The sodium ions introduced do not make water ‘hard’. This method is suitable for removing both temporary and permanent types of hardness.
Flux[edit]
A mixture of borax and ammonium chloride is used as a flux when welding iron and steel. It lowers the melting point of the unwanted iron oxide (scale), allowing it to run off. Borax is also used mixed with water as a flux when soldering jewelry metals such as gold or silver, where it allows the molten solder to wet the metal and flow evenly into the joint.[citation needed] Borax is also a good flux for «pre-tinning» tungsten with zinc, making the tungsten soft-solderable.[27] Borax is often used as a flux for forge welding.[28]
Small-scale gold mining[edit]
In artisanal gold mining, borax is sometimes used as part of a process known as the borax method (as a flux) meant to eliminate the need for toxic mercury in the gold extraction process, although it cannot directly replace mercury. Borax was reportedly used by gold miners in parts of the Philippines in the 1900s.[29][30] There is evidence that, in addition to reducing the environmental impact, this method achieves better gold recovery for suitable ores and is less expensive. This borax method is used in northern Luzon in the Philippines, but miners have been reluctant to adopt it elsewhere for reasons that are not well understood.[31] The method has also been promoted in Bolivia[32] and Tanzania.[33]
Flubber[edit]
A rubbery polymer sometimes called Slime, Flubber, ‘gluep’ or ‘glurch’ (or erroneously called Silly Putty, which is based on silicone polymers), can be made by cross-linking polyvinyl alcohol with borax. Making flubber from polyvinyl acetate-based glues, such as Elmer’s Glue, and borax is a common elementary-science demonstration.[34][35]
Food additive[edit]
Borax, given the E number E285, is used as a food additive, but is banned in some countries, such as Australia, China, Thailand and the United States.[36] As a consequence, certain foods, such as caviar, produced for sale in the United States contain higher levels of salt to assist preservation.[37]
In addition to its use as a preservative, borax imparts a firm, rubbery texture to food. In China, borax (Chinese: 硼砂; pinyin: péng shā or Chinese: 月石; pinyin: yuè shí) has been found in foods including wheat and rice noodles named lamian (Chinese: 拉面; pinyin: lāmiàn), shahe fen (Chinese: 沙河粉; pinyin: shāhéfěn), char kway teow (Chinese: 粿條; pinyin: guǒ tiáo), and chee cheong fun (Chinese: 肠粉; pinyin: chángfěn)[clarify][38] In Indonesia, it is a common, but forbidden,[39] additive to such foods as noodles, bakso (meatballs), and steamed rice.
When consumed with boric acid, numerous studies have demonstrated an inverse correlation between borax and various types of cancers.[40] Boric acid and borax are low in toxicity for acute oral exposures, at approximately the same acute toxicity as salt. The average dose for asymptomatic ingestion cases, which accounts for 88% of all ingestions, is around 0.9 grams. However, the range of reported asymptomatic doses is wide, from 0.01 to 88.8 g.[41]
Other uses[edit]
- Ingredient in enamel glazes[42]
- Component of glass, pottery, and ceramics[43]
- Used as an additive in ceramic slips and glazes to improve fit on wet, greenware, and bisque[citation needed]
- Fire retardant[44]
- Anti-fungal compound for cellulose insulation[43]
- Moth proofing 10% solution for wool[45]
- Pulverized for the prevention of stubborn pests (e.g. German cockroaches) in closets, pipe and cable inlets, wall panelling gaps, and inaccessible locations where ordinary pesticides are undesirable[46]
- Precursor for sodium perborate monohydrate that is used in detergents, as well as for boric acid and other borates[citation needed]
- Tackifier ingredient in casein, starch and dextrin based adhesives[47]
- Precursor for boric acid, a tackifier ingredient in polyvinyl acetate, polyvinyl alcohol based adhesives
- To make indelible ink for dip pens by dissolving shellac into heated borax[citation needed]
- Curing agent for snake skins[citation needed]
- Curing agent for salmon eggs, for use in sport fishing for salmon[48]
- Swimming pool buffering agent to control pH[49]
- Neutron absorber, used in nuclear reactors and spent fuel pools to control reactivity and to shut down a nuclear chain reaction[50]
- As a micronutrient fertilizer to correct boron-deficient soils[51][52]
- Preservative in taxidermy[53]
- To color fires with a green tint[54]
- Traditionally used to coat dry-cured meats such as hams to improve the appearance and discourage flies[55][56][57]
- Used by blacksmiths in forge welding[28]
- Used as a flux for melting metals and alloys in casting to draw out impurities and prevent oxidation[citation needed]
- Used as a woodworm treatment (diluted in water)[citation needed]
- In particle physics as an additive to nuclear emulsion, to extend the latent image lifetime of charged particle tracks. The first observation of the pion, which was awarded the 1950 Nobel Prize, used this type of emulsion.[58][59]
Toxicity[edit]
Borax, sodium tetraborate decahydrate, according to one study, is not acutely toxic. Its LD50 (median lethal dose) score is tested at 2.66 g/kg in rats, meaning that a significant dose of the chemical is needed to cause severe symptoms or death. The lethal dose is not necessarily the same for humans. On pesticide information websites it is listed as a non-lethal compound and of no hazardous concerns.
Borax has been in use as an insecticide in the United States with various restrictions since 1946. All restrictions were removed in February 1986 due to the low toxicity of borax, as reported in two EPA documents relating to boric acid and borax.[60][61]
EPA has determined that, because they are of low toxicity and occur naturally, boric acid and its sodium salts should be exempted from the requirement of a tolerance (maximum residue limit) for all raw agricultural commodities.[60]
Although it cited inconclusive data, a re-evaluation in 2006 by the EPA still found that «There were no signs of toxicity observed during the study and no evidence of cytotoxicity to the target organ.»[62] In the reevaluation, a study of toxicity due to overexposure was checked and the findings were that «The residential handler inhalation risks due to boric acid and its sodium salts as active ingredients are not a risk concern and do not exceed the level of concern…» but that there could be some risk of irritation to children inhaling it if used as a powder for cleaning rugs.
Sodium tetraborate decahydrate has no known hazard issues.[63][clarification needed]
Overexposure to borax dust can cause respiratory irritation, while no skin irritation is known to exist due to external borax exposure. Ingestion may cause gastrointestinal distress including nausea, persistent vomiting, abdominal pain, and diarrhea. Effects on the vascular system and human brain include headaches and lethargy, but are less frequent. In severe cases, a «beefy» red rash affecting the palms, soles, buttocks and scrotum has occurred. [64]
Possible carcinogen[edit]
The Indonesian Directorate of Consumer Protection warns of the risk of liver cancer with high consumption of borax over a period of 5–10 years.[57]
Risk to fertility and pregnancy[edit]
Borax was added to the Substance of Very High Concern (SVHC) candidate list on December 16, 2010. The SVHC candidate list is part of the EU Regulations on the Registration, Evaluation, Authorisation and Restriction of Chemicals 2006 (REACH), and the addition was based on the revised classification of borax as toxic for reproduction category 1B under the CLP Regulations. Substances and mixtures imported into the EU which contain borax are now required to be labelled with the warnings «May damage fertility» and «May damage the unborn child».[65] It was proposed for addition to REACH Annex XIV by the ECHA on July 1, 2015.[66] If this recommendation is approved, all imports and uses of borax in the EU will have to be authorized by the ECHA.[needs update]
Review of the boron toxicity (as boric acid and borates) published 2012 in Journal of Toxicology and Environmental Health concluded: «It clearly appears that human B [boron] exposures, even in the highest exposed cohorts, are too low to reach the blood (and target tissue) concentrations that would be required to exert adverse effects on reproductive functions.»[67]
A draft risk assessment released by Health Canada in July 2016 has found that overexposure to boric acid has the potential to cause developmental and reproductive health effects. Since people are already exposed to boric acid naturally through their diets and water, Health Canada advised that exposure from other sources should be reduced as much as possible, especially for children and pregnant women. The concern is not with any one product, but rather multiple exposures from a variety of sources. With this in mind, the department also announced that registrations for certain pesticides that contain boric acid, which are commonly used in homes, will have their registrations cancelled and be phased out of the marketplace. As well, new, more protective label directions are being introduced for other boric acid pesticides that continue to be registered in Canada (for example, enclosed bait stations and spot treatments using gel formulations).[68]
See also[edit]
- Borax bead test
- John Veatch
- List of cleaning agents
- Sodium borohydride
- Ulexite
References[edit]
- ^ a b c d e PubChem. «Borax». pubchem.ncbi.nlm.nih.gov. Retrieved December 27, 2021.
- ^ a b c d e f g Haynes, William M., ed. (2011). CRC Handbook of Chemistry and Physics (92nd ed.). CRC Press. ISBN 978-1439855119.
- ^ Levy, H. A.; Lisensky, G. C. (1978). «Crystal structures of sodium sulfate decahydrate (Glauber’s salt) and sodium tetraborate decahydrate (borax). Redetermination by neutron diffraction». Acta Crystallographica Section B. 34 (12): 3502–3510. doi:10.1107/S0567740878011504.
- ^ a b c NIOSH Pocket Guide to Chemical Hazards. «#0057». National Institute for Occupational Safety and Health (NIOSH).
- ^ NIOSH Pocket Guide to Chemical Hazards. «#0059». National Institute for Occupational Safety and Health (NIOSH).
- ^ NIOSH Pocket Guide to Chemical Hazards. «#0058». National Institute for Occupational Safety and Health (NIOSH).
- ^ «Potential Commodities NFPA 704» (PDF). Archived from the original (PDF) on May 17, 2016. Retrieved December 9, 2018.
- ^ «CompTox Chemicals Dashboard». comptox.epa.gov. Retrieved January 1, 2022.
- ^ a b S.Maričić, V.Pravdić, and Z.Veksli (1962): «Proton conductivity in borax, Na2[B4O5(OH)4]-8H2O».Journal of Physics and Chemistry of Solids, volume 23, issue 11, pages 1651-1659. doi:10.1016/0022-3697(62)90248-2
- ^ a b «Borax (Na2B4O7·10H2O ) – Sodium Borate – Occurrence, Discovery and Applications». Amoz.com. August 16, 2004.
- ^ «American Borax Production» Scientific American September 22, 1877
- ^ Hildebrand, G. H. (1982) «Borax Pioneer: Francis Marion Smith.» San Diego: Howell-North Books. p. 267 ISBN 0-8310-7148-6
- ^ «Tincal». Oxford English Dictionary (Online ed.). Oxford University Press. (Subscription or participating institution membership required.)
- ^ Chemical Age of India, Vol. 37, No.10 & 11 (1976)
- ^ Mendham, J.; Denney, R. C.; Barnes, J. D.; Thomas, M. J. K. (2000), Vogel’s Quantitative Chemical Analysis (6th ed.), New York: Prentice Hall, ISBN 0-582-22628-7
- ^ a b Borax decahydrate. borax.com
- ^ Mehmet Akgül and Osman Çamlıbe (2021) «The use of borax pentahydrate of inorganic filler in medium density fiberboard production». Maderas, Ciencia y tecnología, volume 23, Epub 28-Ene-2021. doi:10.4067/s0718-221×2021000100422
- ^ a b c d Ömer Şahin and A. Nusret Bulutcu (2002): «Dehydration Behaviour of Borax Pentahydrate to Anhydrous Borax by Multi-Stage Heating in a Fluidized». Turkish Journal of Chemistry, volume 26, article 10, pages 89–96.
- ^ Wizniak, Jaime (July 2005). «Borax, Boric Acid, and Boron – From exotic to commodity» (PDF). Indian Journal of Chemical Technology. 12 (4). ISSN 0975-0991.
- ^ Klotz, John H.; Greenberg, Les; Amrhein, Christopher; Rust, Michael K. (August 1, 2000). «Toxicity and Repellency of Borate-Sucrose Water Baits to Argentine Ants (Hymenoptera: Formicidae)». Journal of Economic Entomology. 93 (4): 1256–1258. doi:10.1603/0022-0493-93.4.1256. PMID 10985039. S2CID 17829851.
- ^ Record in the Household Products Database of NLM
- ^ «The Many, Many Uses of Borax for Laundry». U.S. Borax. Retrieved June 13, 2022.
- ^ Hammond, C. R. (2004). The Elements, in Handbook of Chemistry and Physics 81st edition. CRC press. ISBN 978-0-8493-0485-9.
- ^ O’Neil, M.J. (ed.). The Merck Index — An Encyclopedia of Chemicals, Drugs, and Biologicals. Cambridge, UK: Royal Society of Chemistry, 2013., p. 1595
- ^ Peacock, Andrew C.; Dingman, C. Wesley (1967). «Resolution of Multiple Ribonucleic Acid Species by Polyacrylamide Gel Electrophoresis». Biochemistry. 6 (6): 1818–1827. doi:10.1021/bi00858a033. PMID 6035921.
- ^ Anderson, S. (1981). «Shotgun DNA sequencing using cloned DNase I-generated fragments». Nucleic Acids Research. 9 (13): 3015–27. doi:10.1093/nar/9.13.3015. PMC 327328. PMID 6269069.
- ^ Dodd, J.G. (1966). «Soft soldering to tungsten wire». Am. J. Phys. 34 (10): xvi. Bibcode:1966AmJPh..34D..16D. doi:10.1119/1.1972398.
- ^ a b Moehring, Jack; Willman, Michael; Pulscher, Isaac; Rowe, Devin (December 2016). «Bladesmithing at South Dakota School of Mines and Technology». JOM. 68 (12): 3186–3192. Bibcode:2016JOM….68l3186M. doi:10.1007/s11837-016-2139-z. ISSN 1047-4838. S2CID 137747858.
- ^ «March 2012 ipad ewaste Filipino Borax, Pakistans Pollution, Artisanal Gold Mining». Blacksmithinstitute.org. Archived from the original on October 13, 2016. Retrieved August 7, 2016.
- ^ «The borax method» (PDF). Borax replacing mercury in small-scale mining. The Geological Survey of Denmark and Greenland (GEUS). Archived from the original (PDF) on December 6, 2008. Retrieved August 2, 2008.
- ^ Appel, Peter W.U.; Na-Oy, Leoncio (June 1, 2012). «The Borax Method of Gold Extraction for Small-Scale Miners». Journal of Health and Pollution. 2 (3): 5–10. doi:10.5696/2156-9614-2.3.5.
- ^ Appel, Peter W. U.; Andersen, Astrid; Na-Oy, Leoncio D.; Onos, Rudy (December 1, 2015). «Introduction of Mercury-free Gold Extraction Methods to Medium-Scale Miners and Education of Health Care Providers to Reduce the use of Mercury in Sorata, Bolivia». Journal of Health and Pollution. 5 (9): 12–17. doi:10.5696/2156-9614-5-9.12. PMC 6221499. PMID 30524772.
- ^ Appel, Peter W.U.; Jønsson, Jesper Bosse (December 31, 1969). «Borax – an alternative to mercury for gold extraction by small-scale miners: introducing the method in Tanzania». Geological Survey of Denmark and Greenland (GEUS) Bulletin. 20: 87–90. doi:10.34194/geusb.v20.4988.
- ^ Parratore, Phil (1998). Wacky Science: A Cookbook for Elementary Teachers. Dubuque, IA: Kendall Hunt. p. 26. ISBN 978-0-7872-2741-8.
- ^ «Slime Recipe — How to Make Borax and White Glue Slime». Chemistry.about.com. Retrieved August 7, 2016.
- ^ Reiley, Laura (April 22, 2019). «After China turned it into a cheap snack, caviar is at risk of losing its status as a luxury good». The Washington Post. Retrieved April 22, 2019.
- ^ «Caviar glossary». The Caviar Guide a gourmet review of caviars & fish roe. Hanson Ltd, Geneva, Switzerland. Archived from the original on December 8, 2008. Retrieved July 7, 2008.
- ^ «Chinese Ingredients: Borax Powder, Mushroom Extract – Chowhound». Chowhound.chow.com. September 11, 2005. Retrieved August 7, 2016.
- ^ «BAHAN BERBAHAYA YANG DILARANG UNTUK PANGAN». www.pom.go.id. Retrieved June 26, 2021.
- ^ Wu, Lun; Wei, Ying; Zhou, Wen-Bo; Zhang, You-Shun; Chen, Qin-Hua; Liu, Ming-Xing; Zhu, Zheng-Peng; Zhou, Jiao; Yang, Li-Hua; Wang, Hong-Mei; Wei, Guang-Min; Wang, Sheng; Tang, Zhi-Gang (July 1, 2019). «Gene expression alterations of human liver cancer cells following borax exposure». Oncology Reports. 42 (1): 115–130. doi:10.3892/or.2019.7169. ISSN 1021-335X.
- ^ «Boric Acid Technical Fact Sheet». npic.orst.edu. Retrieved December 13, 2022.
- ^ «Alphabetical information on pottery glaze making materials and clay body ingredients». Sheffield Pottery. Retrieved December 4, 2019.
- ^ a b Schubert, David M. (2003). «Borates in Industrial Use». In Roesky, Herbert W.; Atwood, David A. (eds.). Group 13 Chemistry III. Group 13 Chemistry III: Industrial Applications. Structure and Bonding. Vol. 105. Springer Berlin Heidelberg. pp. 1–40. doi:10.1007/3-540-46110-8_1. ISBN 978-3-540-46110-4.
- ^ Shen, Kelvin K.; O’Connor, Roderick (1998), Pritchard, Geoffrey (ed.), «Flame retardants: borates», Plastics Additives: An A-Z reference, Polymer Science and Technology Series, Springer Netherlands, pp. 268–276, doi:10.1007/978-94-011-5862-6_30, ISBN 978-94-011-5862-6
- ^ «Centre for Alternative Technology». Cat.org.uk. Archived from the original on August 1, 2012. Retrieved August 7, 2016.
- ^ Murray, Lynda M. (1989). «Least toxic pest control: how infestations of termites, ants, fleas, ticks, and beetles can be controlled without causing short- or long-term indoor air quality changes and health risks» (PDF). nepis.epa.gov. United States Environmental Protection Agency. [/web/20220626035430/https://nepis.epa.gov/Exe/ZyPDF.cgi/9100YHGT.PDF?Dockey=9100YHGT.PDF Archived] (PDF) from the original on June 25, 2022. Retrieved June 25, 2022.
- ^ Suárez, Juan C. (2011), «Bioadhesives», in da Silva, Lucas F. M.; Öchsner, Andreas; Adams, Robert D. (eds.), Handbook of Adhesion Technology, Springer Berlin Heidelberg, pp. 1385–1408, doi:10.1007/978-3-642-01169-6_53, ISBN 978-3-642-01168-9
- ^ «Curing eggs for steelhead, steelhead egg cures, Buzz Ramsey, Bill Swann, Andy Martin». wildriversfishing.com. Retrieved April 16, 2021.
- ^ [1], «Buffer System for Swimming Pools and Related Structures», issued 2008-11-17
- ^ «Development of Boron-based materials for nuclear applications» (PDF). Archived (PDF) from the original on September 22, 2010.
- ^ «Borax». Nature.berkeley.edu. Retrieved August 7, 2016.
- ^ «Boron Basics». www.spectrumanalytic.com.
- ^ «Learning Taxidermy Fish». Taxidermy Hobbyist | The Art Of Taxidermy. March 17, 2011. Retrieved April 16, 2021.
- ^ Marie, Anne. «How To Color Fire – Fun Fireplace Instructions». Chemistry.about.com. Retrieved August 7, 2016.
- ^ Nicholls, Walter (November 10, 1991). «THE CUSTOM OF THE COUNTRY HAM». The Washington Post.
- ^ «Report of the State Board of Health of the State of New Hampshire …, Volume 19». 1906. pp. 169–171.
{{cite web}}: CS1 maint: url-status (link) - ^ a b «Watch Out For The Food We Consume». Directorate of Consumer Protection, Jakarta, Indonesia. 2006. Archived from the original on December 28, 2008. Retrieved February 10, 2009.
- ^ C.M.G. Lattes, R.H.Fowler, and R.Cuer (1947): «Range-Energy Relation for Protons and a-Particles in the New Ilford ‘Nuclear Research’ Emulsions». Nature, volume 159, pages 301-302
- ^ C.M.G.Lattes and G.P.S.Occhialini (1947): «Determination of the Energy and Momentum of Fast Neutrons in Cosmic Rays». Nature, volume 159 (1947), , pages 331-332
- ^ a b «Pesticide Reregistration Status — Pesticides — US EPA» (PDF). Epa.gov. Retrieved August 7, 2016.
- ^ «Pesticides — US EPA» (PDF). Epa.gov. August 20, 2015. Retrieved August 7, 2016.
- ^ «Regulations.gov». Archived from the original on May 3, 2015. Retrieved April 27, 2015.
- ^ «Safety Data Sheet : acc. to OSHA HCS» (PDF). Aquasolutions.org. Retrieved August 7, 2016.
- ^ Reigart, J. Routt (2009). Recognition and Management of Pesticide Poisonings (5th Ed. ). DIANE Publishing. p. 76. ISBN 978-1-4379-1452-8. Retrieved June 4, 2020.
- ^ Member state committee draft support document for identification of disodium tetraborate, anhydrous as a substance of very high concern because of its CMR properties. Adopted on June 9, 2010. Echa.europa.eu. Retrieved on February 17, 2012.
- ^ Recommendation of the European Chemicals Agency of 1 July 2015 for the inclusion of substances in Annex XIV to REACH (List of Substances subject to Authorisation) Echa.europa.eu. Retrieved on July 6, 2015.
- ^ Bolt, Hermann M.; Başaran, Nurşen; Duydu, Yalçın (2012). «Human Environmental and Occupational Exposures to Boric Acid: Reconciliation with Experimental Reproductive Toxicity Data». Journal of Toxicology and Environmental Health, Part A. 75 (8–10): 508–514. doi:10.1080/15287394.2012.675301. PMID 22686310. S2CID 31972554.
- ^ «Information Update – Health Canada advises Canadians to avoid homemade craft and pesticide recipes using boric acid – Recalls & alerts – Healthy Canadians Website». Healthycanadians.gc.ca. July 22, 2016. Retrieved August 7, 2016.
External links[edit]
Wikimedia Commons has media related to Borax.
Look up borax in Wiktionary, the free dictionary.
- International Chemical Safety Card 0567
- International Chemical Safety Card 1229 (fused borax)
- National Pollutant Inventory – Boron and compounds
- NIOSH Pocket Guide to Chemical Hazards
- Sodium Borate in sefsc.noaa.gov
| Тетраборат натрия | |
|---|---|
 |
|
 |
|
| Традиционные названия | бура, боракс |
| Хим. формула | Na2B4O7 |
| Состояние | кристаллы |
| Молярная масса | 201,22 г/моль |
| Плотность | 2,37 ± 0,01 г/см³ |
| Т. плав. | 664 °C (β-модификация) 710 °C (γ-модификация) |
| Т. кип. | 1575 °C |
| Т. разл. | 2867 ± 1 °F |
| Давление пара | 0 ± 1 мм рт.ст. |
| Растворимость в воде | 3,2 г/100 мл (25 °C) 10,5 г/100 мл (50 °C) |
| Растворимость в этаноле | 0,05 г/100 мл |
| Растворимость в ацетоне | 0,006 г/100 мл |
| ГОСТ | ГОСТ 8429-77 |
| PubChem | 10219853 |
| SMILES |
[Na+].[Na+].[O-]B1OB2OB([O-])OB(O1)O2.O.O.O.O.O.O.O.O.O.O |
| InChI |
1S/B4O7.2Na/c5-1-7-3-9-2(6)10-4(8-1)11-3;;/q-2;2*+1 UQGFMSUEHSUPRD-UHFFFAOYSA-N |
| Кодекс Алиментариус | E285 |
| RTECS | VZ2275000 и ED4588000 |
| ChemSpider | 8395345 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. |
Тетраборат натрия («бура», «боракс» (от лат. borax)) — неорганическое соединение, натриевая соль борной кислоты с химической формулой Na2B4O7, наиболее распространённое и используемое соединение бора, образует несколько кристаллогидратов, широко применяется в промышленности.
Физические свойства
Имеет две метастабильные модификации: β и γ. β-модификация является ромбической с температурой плавления 664 °C, γ-модификация — моноклинная с температурой плавления 710 °C. Температура кипения — 1575 °C. Расплав застывает в стекловидную массу с плотностью 2,36 г/см3.
Химические свойства
Растворимость в воде составляет 3,2 г / 100 мл (25 °C), 10,5 г / 100 мл (50 °C), в этаноле — 0,05 г / 100 г (25 °C), ацетоне — 0,006 г / 100 г (25 °C), не растворим в диэтиловом эфире и глицерине. Реагирует с метанолом при растворении с образованием бороорганических соединений.
Образует несколько кристаллогидратов с разным содержанием воды. Эти кристаллогидраты и безводный тетраборат натрия Na2B4O7 обычно называют «бура». Примеры кристаллогидратов:
- пентагидрат (Na2B4O7·5H2O), так называемая «ювелирная бура», используется при пайке ювелирных изделий;
- декагидрат (Na2B4O7·10H2O).
Однако наиболее часто «бурой» называют декагидрат Na2B4O7·10H2O. Эта соль представляет собой прозрачные кристаллы с молярной массой 381,43 г/моль, имеющие хорошую растворимость в тёплой воде. При нагревании свыше 400 °C полностью теряет кристаллизационную воду.
Так как тетраборат натрия является солью слабой кислоты и сильного основания, в воде гидролизуется. Водный раствор тетрабората натрия имеет щелочную реакцию.
Взаимодействует с сильными кислотами, образуя соответствующую соль и борную кислоту:
- Na2B4O7⋅10H2O + 2HCl ⟶ 4H3BO3 + 2NaCl + 5H2O⋅
Многие соли металлов борной кислоты нерастворимы в воде и при взаимодействии в растворе их растворимых солей с тетраборатом натрия образующиеся бораты выпадают в осадок. На этом основано применение буры для «умягчения» воды:
- Ca(aq)2+ + Na2B4O7(aq) ⟶ CaB4O7(s) + 2Na(aq)+
- Mg(aq)2+ + Na2B4O7(aq) ⟶ MgB4O7(s) + 2Na(aq)+
С оксидами многих переходных металлов бура при сплавлении образует разнообразно окрашенные соединения — бораты «перлы буры». По окраске перлов можно судить о качественном химическом составе пробы.
Окрашивает пламя горелки в зелёный цвет (характерная реакция на соединения бора).
Получение
Десятиводную соль Na2B4O7·10H2O получают из природных минералов, например, буры или кернита, осуществляя их перекристаллизацию. Также для этой цели применяют химическое взаимодействие некоторых природных боратов (ашарита и улексита) с карбонатом или гидрокарбонатом натрия.
Может быть получен реакцией карбоната натрия и борной кислоты при нагреве, пропусканием углекислого газа через растворметабората натрия.
Применение
Тетраборат натрия применяется:
- как сырьё для получения борной кислоты и различных соединений бора;
- в производстве эмалей, глазурей, оптических и цветных стёкол, различных керамик;
- при пайке и плавке металлов в составе флюса;
- в бумажной и фармацевтической промышленности;
- в производстве строительных материалов как компонент антисептика для изготовления целлюлозного утеплителя «Эковата»
- как дезинфицирующее и консервирующее средство;
- для приготовления буферных растворов;
- в аналитической химии:
- как стандартное вещество для определения концентрации растворов кислот;
- для качественного определения оксидов металлов (по цвету перлов);
- в фотографии — в составе медленно действующих проявителей в качестве слабого ускоряющего вещества;
- как компонент моющих средств;
- как компонент косметики;
- как инсектицид в отравленных приманках для уничтожения тараканов.
В 1977 году мировое производство тетрабората натрия составило 1,5 млн тонн.
Нахождение в природе
Существуют многочисленные минералы, содержащие тетраборат натрия. К ним относятся:
- бура (боракс, тинкал) — минерал состава Na2B4O7·10H2O — декагидрат тетрабората натрия;
- кернит — тетрагидрат тетрабората натрия — Na2B4O7·4H2O;
- многочисленные минералы класса боратов, в которых помимо оксидов натрия и бора содержатся другие металлы, — кальций, магний, железо и др.;
- кристаллогидраты тетрабората натрия выпадают в осадок при пересыхании некоторых бессточных, сезонно пересыхающих солёных озёр, например, в озере Серлс, расположенном в пустыне Мохаве в США, и некоторых озёр в Турции.
Содержание
- Структурная формула
- Русское название
- Английское название
- Латинское название вещества Натрия тетраборат
- Брутто формула
- Фармакологическая группа вещества Натрия тетраборат
- Нозологическая классификация
- Код CAS
- Фармакологическое действие
- Характеристика
- Фармакология
- Применение вещества Натрия тетраборат
- Противопоказания
- Побочные действия вещества Натрия тетраборат
- Передозировка
- Способ применения и дозы
- Меры предосторожности
- Торговые названия с действующим веществом Натрия тетраборат
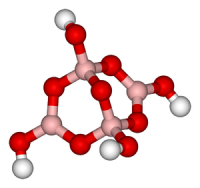
Структурная формула
Русское название
Натрия тетраборат
Английское название
Sodium tetraborate
Латинское название вещества Натрия тетраборат
Natrii tetraboras (род. Natrii tetraboratis)
Фармакологическая группа вещества Натрия тетраборат
Фармакологическое действие
—
антисептическое, инсектицидное.
Характеристика
Бесцветные прозрачные, легко выветривающиеся кристаллы или белый кристаллический порошок. Растворим в воде (1:25 в холодной и 2:1 в кипящей воде), глицерине, нерастворим в спирте. Водные растворы имеют солоновато-щелочной вкус и щелочную реакцию.
Фармакология
Эффективен при вагинальном кандидозе. Удаляет мицелий гриба из крипт влагалища, нарушает процесс прикрепления гриба к стенке влагалища и тормозит его размножение. Не является этиотропным агентом, т.к. не обладает фунгицидным или фунгистатическим действием. В качестве противомикробного средства входит в состав комбинированных препаратов (бикарминт) для лечения воспалительных заболеваний верхних дыхательных путей.
Всасывается в ЖКТ, через поврежденные кожные покровы. Выводится почками в неизмененном виде и через кишечник в течение недели. Депонируется в костной ткани и печени.
В пищевой промышленности разрешен для использования в качестве пищевой добавки, зарегистрированной как Е285. Обладает инсектицидными свойствами (по уровню токсичности относится к 4 классу). Основной областью применения является уничтожение тараканов. Разрешен для продажи населению и использования в практике медицинской дезинсекции.
Применение вещества Натрия тетраборат
Местно — опрелости, пролежни, вагинальный кандидоз, фарингит, тонзиллит.
Дезинсекция — уничтожение тараканов.
Противопоказания
Гиперчувствительность, значительные повреждения целостности кожных покровов (при обработке кожи), детский возраст.
Побочные действия вещества Натрия тетраборат
Слабое цитотоксическое, судорожное (у детей), местнораздражающее.
Передозировка
Симптомы: боли в животе, рвота, диарея, общая слабость, головная боль, дегидратация, потеря сознания, генерализованные подергивания мышц лица, конечностей, судороги, сердечно-сосудистая недостаточность; возможно поражение печени и почек. Смертельная доза для взрослых 10–20 г, токсическая концентрация в крови 40 мг/л, смертельная — 50 мг/л.
Лечение: промывание желудка, форсированный диурез, гемодиализ при тяжелых отравлениях; в/м — рибофлавин мононуклеотид 10 мг/сут; коррекция водно-электролитного баланса и ацидоза — в/в инфузии раствора гидрокарбоната натрия, плазмозамещающих растворов, растворов глюкозы и натрия хлорида; при болях в животе — п/к 1 мл 0,1% раствора атропина, 1 мл 0,2% раствора платифиллина, 1 мл 1% раствора промедола, в/в инфузия глюкозо-новокаиновой смеси (50 мл 2% раствора новокаина и 500 мл 5% раствора глюкозы); сердечно-сосудистые средства.
Способ применения и дозы
Наружно для полосканий, смазывания кожи, спринцеваний.
Меры предосторожности
Условием эффективности при монотерапии вагинального кандидоза является необходимость проведения лечебных процедур медицинским персоналом, многократность обработок; в противном случае клетки гриба могут задерживаться в криптах влагалища и приводить к рецидиву.
Торговые названия с действующим веществом Натрия тетраборат
| Торговое название | Цена за упаковку, руб. |
|---|---|
| Натрия тетраборат |
от 12.00 до 14.00 |
| Натрия тетрабората раствор в глицерине 20% |
15.00 |
Минерал Tincalconite
Кристаллы буры
Тетраборат натрия («бура») — Na2B4O7, соль слабой борной кислоты и сильного основания, распространённое соединение бора, имеет несколько кристаллогидратов, широко применяется в технике.
Содержание
- 1 Химия
- 2 Природные источники
- 3 Бура
- 4 Тинкал
- 5 Ювелирная бура
- 6 Применение
- 7 См. также
- 8 Примечания
- 9 Литература
Химия
Структура аниона [B4O5(OH)4]2− в буре
Термин «Бура» применяют по отношению к нескольким близким веществам: она может существовать в безводной форме, в природе чаще встречается в виде пятиводного или десятиводного кристаллогидрата:
- Безводная бура (Na2B4O7)
- Пентагидрат (Na2B4O7·5H2O)
- Декагидрат (Na2B4O7·10H2O)
Однако наиболее часто слово бура относят к соединению Na2B4O7·10H2O.
Природные источники
Бура, «cottonball»
Тетраборат натрия (Бура) встречается в солевых отложениях, образованных при испарении сезонных озёр (см. en:playa).
Бура
Бура́ (декагидрат тетрабората натрия, NaB4O7 · 10H2O) — прозрачные кристаллы, при нагревании до 400 °C полностью теряют воду. В воде бура гидролизуется, её водный раствор имеет щелочную реакцию. С оксидами многих металлов бура при нагревании образует окрашенные соединения — бораты («перлы буры»). В природе встречается в виде минерала тинкаля.
Тинкал
Тинкал, или «Бура» (декагидрат тетрабората натрия, Na2B4O7·10H2O) — минерал моноклинной сингонии, призматический. «Тинкал» (Tinkal) — слово санскритского происхождения, являющееся синонимом более частоупотребляемого названия минерала — «Бура» (от арабского «бюрак» — белый). Цвет белый, блеск стеклянный, твёрдость 2—2,5. Плотность 1,71. Спайность средняя по (100) и (110). Образует короткопризматические кристаллы, по форме напоминающие кристаллы пироксенов, а также сплошные зернистые массы и прожилки в глинистых породах. Типичный минерал эвапоритов. На воздухе разрушается, теряя воду и покрывается коркой тинкалконита или кернита, либо целиком в них превращается.
Ювелирная бура
Так называемая Ювелирная бура — пятиводный тетраборат натрия Na2B4O7·5H2O.
Применение
Бура применяется:
- в производстве эмалей, глазурей, оптических и цветных стекол;
- при пайке в качестве флюса;
- в бумажной и фармацевтической промышленности;
- в производстве строительных материалов как компонент антисептика для изготовления целлюлозного утеплителя «Эковата»
- как дезинфицирующее и консервирующее средство;
- в аналитической химии:
- как стандартное вещество для определения концентрации растворов кислот;
- для качественного определения оксидов металлов (по цвету перлов);
- в фотографии — в составе медленно действующих проявителей в качестве слабого ускоряющего вещества[1];
- как компонент моющих средств;
- как компонент косметики;
- как сырьё для получения бора.
См. также
- Буферные растворы
- Бура (минерал)
Примечания
- ↑ Натрия тетраборат // Фотокинотехника: Энциклопедия / Главный редактор Е. А. Иофис. — М.: Советская энциклопедия, 1981.
Литература
- International Chemical Safety Card 0567
- International Chemical Safety Card 1229 (fused borax)
- National Pollutant Inventory — Boron and compounds
- NIOSH Pocket Guide to Chemical Hazards
- Sodium Borate in sefsc.noaa.gov
|
Соединения натрия |
|---|
|
Азид натрия (NaN3) • Альгинат натрия • Алюминат натрия (NaAlO2) • Амид натрия (NaNH2) • Арсенат натрия (Na3AsO4) • Бензилнатрий (NaCH2C6H5) • Бензоат натрия (NaC6H5CO2) • Борогидрид натрия (NaBH4) • Бромат натрия (NaBrO3) • Бромид натрия (NaBr) • Висмутат натрия (NaBiO3) • Вольфрамат натрия (Na2WO4) • Гексагидроксостаннат(IV) натрия (Na2[Sn(OH)6]) • Гексагидроксохромат (III) натрия (Na3[Сr(OH)6]) • Гексанитрокобальтат(III) натрия (Na3[Co(NO2)6]) • Гексафтороалюминат натрия (Na3[AlF6]) • Гексафторосиликат натрия (Na2[SiF6]) • Гексафторостибат натрия (Na[SbF6]) • Гексафторофосфат(V) натрия (Na[PF6]) • Гексахлороиридат(III) натрия (Na3[IrCl6]) • Гексахлорородат(III) натрия (Na3[RhCl6]) • Германат натрия (Na2GeO3) • Гидрид натрия (NaH) • Гидрокарбонат натрия (NaHCO3) • Гидроксид натрия (NaOH) • Гидросульфат натрия (NaHSO4) • Гидросульфид натрия (NaHS) • Гидросульфит натрия (NaHSO3) • Гидрофосфат натрия (Na2HPO4) • Гипонитрит натрия (Na2N2O2) • Гипофосфит натрия (Na(PH2O2)) • Гипохлорит натрия (NaOCl) • Глутамат натрия (C5H8NNaO4) • Дигидропирофосфат натрия (Na2H2P2O7) • Дигидроортопериодат натрия (Na3H2IO6) • Дигидрофосфат натрия (NaH2PO4) • Диоксоферрат(III) натрия (NaFeO2) • Дитионат натрия (Na2S2O6) • Дитионит натрия (Na2S2O4) • Дихромат натрия (Na2Cr2O7) • Диэтилдитиокарбамат натрия (C5H10NS2Na) • Инозинат натрия (C10H11N2Na2O8P) • Иодат натрия (NaIO3) • Иодид натрия (NaI) • Карбонат натрия (Na2CO3) • Лаурилсульфат натрия (C12H25SO4Na) • Метаарсенит натрия (NaAsO2) • Метаборат натрия (NaBO2) • Метаванадат натрия (NaVO3) • Метадисульфит натрия (Na2S2O5) • Метасиликат натрия (Na2SiO3) • Метафосфат натрия (NaPO3) • Надпероксид натрия (NaO2) • Нитрат натрия (NaNO3) • Нитрид натрия (Na3N) • Нитрит натрия (NaNO2) • Нонагидридоренат(VII) натрия (Na2[ReH9]) • Оксид натрия (Na2O) • Ортованадат натрия (Na3VO4) • Ортосиликат натрия (Na4SiO4) • Ортотеллурат натрия (Na6TeO6) • Ортофосфат натрия (Na3PO4) • Пентаборат натрия (NaB5O8) • Периодат натрия (NaIO4) • Перманганат натрия (NaMnO4) • Пероксид натрия (Na2O2) • Перосмат натрия (Na2[OsO2(OH)4]) • Пиросульфат натрия (Na2S2O7) • Пирофосфат натрия (Na4P2O7) • Полисульфид натрия (Na2Sn) • Сегнетова соль (KNaC4H4O6•4H2O) • Селенат натрия (Na2SeO4) • Селенид натрия (Na2Se) • Селенит натрия (Na2SeO3) • Тиоантимонат натрия (Na3[SbS4]•9H2O) • Сульфат натрия (Na2SO4) • Сульфид натрия (Na2S) • Сульфит натрия (Na2SO3) • Тартрат натрия (Na2C4H4O6) • Теллурит натрия (Na2TeO3) • Теллурид натрия (Na2Te) • Тетраборат натрия (Na2B4O7) • Тетрагидроксоцинкат(II) натрия (Na2[Zn(OH)4]) • Тетраоксоманганат(V) натрия (Na3MnO4) • Тетратиоарсенат натрия (Na3[AsS4]) • Тиосульфат натрия (Na2S2O3) • Тиоцианат натрия (NaSCN) • Тритиостибат натрия (Na3[SbS3]) • Трифосфат натрия (Na5P3O10) • Фенилнатрий (NaC6H5) • Формиат натрия (HCOONa) • Фосфид натрия (Na3P) • Фосфит натрия (Na2(PHO2)) • Фторид натрия (NaF) • Хлорид натрия (NaCl) • Хлорат натрия (NaClO3) • Хлорит натрия (NaClO2) • Цианат натрия (NaNCO) • Этилнатрий (NaC2H5) |
Натрия тетраборат (Sodium tetraborate)
💊 Состав препарата Натрия тетраборат
✅ Применение препарата Натрия тетраборат
Описание активных компонентов препарата
Натрия тетраборат
(Sodium tetraborate)
Приведенная научная информация является обобщающей и не может быть использована для принятия
решения о возможности применения конкретного лекарственного препарата.
Дата обновления: 2020.05.05
Владелец регистрационного удостоверения:
Код ATX:
D04AX
(Противозудные препараты другие)
Лекарственная форма
|
|
Натрия тетраборат |
Р-р д/местн. прим. 20%: фл. 30 г или 50 г рег. №: ЛСР-000027/08 |
Форма выпуска, упаковка и состав
препарата Натрия тетраборат
| Раствор для местного применения 20% | 100 г |
| боракс (натрия тетраборат) | 20 г |
30 г — флаконы темного стекла.
50 г — флаконы темного стекла.
Фармакологическое действие
Антисептическое средство. Обладает бактериостатической активностью. Эффективен при кандидозе. Удаляет мицелий гриба со слизистых оболочек, нарушает процесс прикрепления гриба к слизистым оболочкам и тормозит его размножение.
Фармакокинетика
Системная абсорбция при местном и наружном применении низкая; всасывается в ЖКТ при частичном проглатывании (при смазывании слизистой оболочки полости рта, глотки), может всасываться через поврежденные кожные покровы. Депонируется в костной ткани, печени. Выводится почками в неизмененном виде и через кишечник в течение одной недели.
Показания активных веществ препарата
Натрия тетраборат
Кандидозные поражения слизистой оболочки полости рта, глотки, половых органов, глаз; опрелости, пролежни.
Режим дозирования
Способ применения и режим дозирования конкретного препарата зависят от его формы выпуска и других факторов. Оптимальный режим дозирования определяет врач. Следует строго соблюдать соответствие используемой лекарственной формы конкретного препарата показаниям к применению и режиму дозирования.
Индивидуальный. Применяют наружно и местно. Способ применения и дозы зависят от показаний и применяемой лекарственной формы.
Побочное действие
Гиперемия, ощущение жжения в месте нанесения средства, аллергические реакции.
Противопоказания к применению
Повышенная чувствительность к натрия тетраборату; беременность, период грудного вскармливания; детский возраст; нарушение целостности слизистой оболочки и кожи.
Применение при беременности и кормлении грудью
Противопоказано применение при беременности и в период грудного вскармливания.
Применение у детей
Противопоказано применение у детей.
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код
тетраборат натрия
Бура пятиводная
Химическая формула: Na2[B4O5(OH)4]·8H2O
Торговые обозначения.
• sodium borate
• borate
• boric acid
• sodium tetraborate
• Боракс
• Бура пятиводная
• Borax
• Disodium bicyclo[3.3.1]tetraboroxane-3
• 2, 4, 6, 8, 9-pentaoxa-1, 3, 5, 7-tetraborabicyclo[3.3.1]nonane-3
• тетраборат натрия
Описание продукта.
Бура, также известная как натрий, тетраборат натрия или тетраборат динатрия, является важным соединением бора, минералом и солью борной кислоты. Обычно это белый порошок, состоящий из мягких бесцветных кристаллов, которые легко растворяются в воде. Термин «буракс» используется для ряда близкородственных минералов или химических соединений, которые различаются по содержанию их кристаллической воды, но обычно «бура» относится к декагидрату. Коммерчески продаваемая бура обычно частично обезвоживается. Тетраборат натрия используется в качестве пищевой добавки в некоторых странах, но запрещен в Соединенных Штатах. Как следствие, некоторые продукты, такие как икра, произведенная для продажи в США, содержат более высокие уровни соли, чтобы помочь в сохранении. В Индонезии тетраборат натрия является распространенной, но запрещенной добавкой к таким продуктам, как лапша, баксо (фрикадельки) и рис, приготовленный на пару. Дирекция по защите прав потребителей в стране предупреждает о риске развития рака печени с высоким уровнем потребления в течение 5-10 лет. тетраборат натрия — сложный боратный минерал, который встречается в плайа-озерах и других месторождениях эвапорита. Основная структура буры содержит цепи взаимосвязанных треугольников BO2 (OH) и тетраэдров BO3 (OH), связанных с цепями натриевых и водных октаэдров. Большинство старых минеральных образцов тетраборат натрия являются мелкими белыми из-за химической реакции от обезвоживания. Они фактически изменили (по крайней мере, на их поверхности) минеральный тинккалонит с потерей воды. Такое изменение от одного минерала к другому оставляет первоначальную форму кристалла. Минералоги называют это псевдоморфоном или «фальшивой формой», потому что цинкалконит имеет кристаллическую форму требуемой буры. тетраборат натрия непосредственно осаждается в засушливых регионах от испарения воды в прерывистых озерах, называемых playas. Плайас формируется только во время дождливых сезонов из-за стока из соседних гор. Этот сток богат элементным бором и высоко концентрирован путем испарения в засушливом климате. В конечном итоге концентрация настолько велика, что образуются кристаллы тетраборат натрия и других минералов бора. Наиболее коммерчески важные месторождения находятся вблизи Борона, Калифорнии и других мест на юго-западе США, пустыне Атакама в Чили и в Тибете. Бурак также может быть получен синтетически из других соединений бора. Тетраборат натрия происходит естественным образом в испаренных отложениях, образующихся при повторном испарении сезонных озер. Наиболее коммерчески важные месторождения находятся в Турции; Борон, Калифорния; И озеро Сирлес, штат Калифорния. Кроме того, пустыня Атакама в Чили, недавно открытые месторождения в Боливии, а также в Тибете и Румынии. Тетраборат натрия можно также синтезировать из других соединений бора. Естественно встречающаяся бура очищается процессом рекристаллизации. Тетраборат натрия, декагидрат тетрабората натрия, не является токсичным. Оценка LD50 (средняя летальная доза) оценивается в 2,66 г / кг у крыс. Значительная доза химического вещества необходима, чтобы вызвать серьезные симптомы или смерть. Смертельная доза не обязательно одинакова для людей. Достаточное воздействие пыли Тетраборат натрия может вызвать раздражение дыхательных путей и кожи. Проглатывание может вызвать желудочно-кишечные расстройства, включая тошноту, постоянную рвоту, боль в животе и диарею. Воздействие на сосудистую систему и мозг включает головные боли и летаргию, но они менее часты. Термин «буракс» часто используется для ряда близкородственных минералов или химических соединений, которые различаются по содержанию их кристаллической воды. Как долго бура использовалась человеком, вопрос вряд ли разрешится. Согласно легенде, вавилоняне принесли буры с Дальнего Востока более 4000 лет назад, чтобы их использовали ювелиры, и писания часто цитировали древних египтян как их использование в металлургии, медицине и мумификации, но ничто из этого не может быть обосновано. Нитрон-баурак из греков, борит евреев, баранка арабов, борек персов и буханка турок могут, как представляется, выражать одно и то же вещество, борат соды (то есть буру). Однако нет никаких доказательств того, когда или когда эти названия описывают вещество, которое мы теперь знаем как буру (Na2B4O7 · 10H2O). Фактически, это все транслитерации арабского слова, означающего «блеск». Кажется вероятным, что настоящая бура была известна и использовалась мастерами, учеными и алхимиками исламской цивилизации до 800 года н.э., и, возможно, торговцы Харун-аль-Рашида переправляли борат в Китай примерно в это время; Однако, если это так, его происхождение неизвестно. Только в средние века буря из Тибета регулярно импортировалась в Европу. Это было очень дорого, и это ограничивало его главным образом торговлей драгоценными металлами. Голдсмит использовал его в качестве паяльника и в рафинировании металлов и анализе руд. Количество торгуемых товаров было небольшим, его метод производства был секретным, и его источник оставался загадкой до второй половины 18 века. К началу 1500-х годов производство стекла широко практикуется в Европе, однако нет ссылок на использование буры. Пытаясь исправить первое использование буры в стекле, нужно помнить, что до 19-го века многие счета стекла были написаны наблюдателями, которые сами не были вовлечены в искусство. Техническая тайна была передана из уст в уста и практическим обучением, а тем, кто знал больше всего, не было дано писать на благо других. Самая ранняя ссылка на боросиликатное стекло поступает из Китая, где Чжао Рукуо описал стекольное производство арабами и другими в 1225 году: «Тетраборат натрия добавляется так, что стекло выдерживает самые сильные термические экстремумы и не трескается». Самое раннее европейское упоминание о буре в стекле происходит в немецкой работе Иоганна Кункеля в 1679 году, давая рецепты искусственных драгоценных камней. В 1739 году другой немецкий, Иоганн Крамер, рекомендовал для хрусталя три части готовых кремнеземов (кремнезем), одну часть чистейшей щелочной соли (поташ) и одну часть сожженной боровы (буры). В 1758 году Роберт Досси сообщил, что лучшие стеклянные пластины состоят из 56 процентов белого песка, 23,5 процента жемчужной золы (поташ), 14 процентов селитры и 6,5 процентов буры. Он также отмечает, что бура помогает стеклу получать определенные цвета.Borax имеет множество применений. Он наиболее известен тем, что он использует в стиральных и чистящих средствах, таких как «20 Мул Team Borax» и «Boraxo» порошок и мыло. Тетраборат натрия также используется в биохимических и химических лабораториях для изготовления буферов, например. Для электрофореза в железе ДНК, такого как TBE или новый SB-буфер или BBS (забуференный боратом физиологический раствор) в процедурах покрытия. Бутановые буферы также используются в качестве предпочтительного уравновешивающего раствора в реакциях сшивки на основе DMP. Тетраборат натрия является источником бората, который использовался для использования совместной комплексообразующей способности бората с другими агентами в воде с образованием сложных ионов с различными веществами. Бораты в качестве подходящего полимерного слоя используются в медицине для диагностики гипергликемии при сахарном диабете. Борат и запатентованная синтетическая аминокислота Deselex (от Henkel) использовались для усложнения катионов «твердости» воды, чтобы сделать «программное обеспечение» для не осаждающейся воды. Смесь бура хлорида аммония используется в качестве флюса при сварке железа и стали. Тетраборат натрия заменяет ртуть как предпочтительный метод извлечения золота в мелкомасштабных горнодобывающих предприятиях. Метод называется методом буры и используется на Филиппинах. Тетраборат натрия также используется для изготовления шпаклевки. Каучукоподобный полимер, иногда называемый флюкбером, клеем или глянцем, может быть получен путем сшивания поливинилацетата с бурой. Создание флюкбера из клея на основе поливинилацетата, такого как Elmer’s Glue, и буры, является общим экспериментом начального образования. Тетраборат натрия широко используется в детергентах, умягчителях для воды, мылах, дезинфицирующих средствах и пестицидах. Он используется для изготовления эмалированных глазурей, стекла и укрепления керамики и керамики. Он также легко превращается в борную кислоту или борат, которые имеют много применений. Смесь буры и хлорида аммония используется в качестве флюса при сварке железа и стали. Он снижает температуру плавления нежелательного оксида железа (шкала), позволяя ему убежать. Тетраборат натрия также используется в сочетании с водой в качестве флюса при пайке золота, серебра и т. Д. В ювелирных изделиях. Это позволяет расплавленному припою равномерно течь над рассматриваемым соединением. Borax — это ингредиент в слизе. Тетраборат натрия также используется при гидролизе казеина для приготовления молочной краски. Казеин действует как связующее вещество для пигментов и является естественным компонентом молока. Он производится путем осаждения из молока ферментом или кислотой и затем превращается в клейкий казеиновый клей с помощью щелочи, такой как бура. Казеин является одним из первых связующих, когда-либо используемых человечеством. Казеин можно нанести на различные поверхности, включая древесину и штукатурку. Используемая поверхность всегда должна быть жесткой, поскольку казеин слишком хрупкий, чтобы нарисовать на гибких поверхностях, таких как холст. Казеин также является эмульгатором, что позволяет комбинировать масло и воду. Из методов изготовления казеиновой краски Тетраборат натрия -казеин легче использовать и лучше подходит в качестве пигментного связующего. Он используется для изготовления краски, которая обычно называется казеиновой температурой, но также может использоваться для изготовления большего количества краски для внутренних стен.
Физико-химические свойства.
|
№ |
Показатель |
Значение |
|
1 |
Внешний вид Тетраборат натрия |
Белый, без запаха, кристаллический твердый |
|
2 |
Удельный вес Тетраборат натрия |
1,81 |
|
3 |
Растворимость в воде Тетраборат натрия |
3,82% при 20 ° C; 51,2% при 100 ° С |
|
4 |
Точка плавления Тетраборат натрия |
200 ° C (392 ° F) |
|
5 |
PH: Тетраборат натрия |
9,3 (3,0% раствор) при 20 ° C |
Транспортировка и хранение.
Обращение:
Обращайтесь с сухим защитным газом. Держите контейнер плотно закрытым. Хранить в сухом прохладном месте в плотно закрытых контейнерах. Обеспечьте хорошую вентиляцию на рабочем месте. Открывайте и обрабатывайте контейнер с осторожностью. Информация о защите от взрывов и пожаров: Продукт не воспламеняется.
Хранение:
Требования, предъявляемые к складским помещениям и таре: Никаких особых требований. Информация о хранении в одном общем хранилище: Хранить вдали от воды / влаги. Хранить вдали от восстанавливающих агентов. Дополнительная информация о условиях хранения: Хранить в сухом инертном газе. Этот продукт гигроскопичен. Держите контейнер плотно закрытым. Хранить в прохладном, сухом состоянии в хорошо закрытых контейнерах. Защищайте от влаги и воды.
Области применения.
У Тетраборат натрия много применений, а также ингредиент в других продуктах. Вот некоторые виды применения порошка буры и чистой буры в воде:
• Тетраборат натрия Ингредиент в эмалированных глазури.
• Тетраборат натрия Компонент из стекла, керамики.
• Тетраборат натрия можно использовать в качестве добавки в керамических слипах и глазури для улучшения пригонки.
• Тетраборат натрия В производстве огнестойких материалов.
• Тетраборат натрия Противогрибковое соединение для стекловолокна и целлюлозной изоляции
• Тетраборат натрия 10% раствор для шерсти
• Тетраборат натрия Предшественник моногидрата пербората натрия, который используется в детергентах, а также для борной кислоты и других буровых растворов
• Тетраборат натрия Предшественник для борной кислоты, ингредиент клейкости в поливинилацетате, клей на основе поливинилового спирта
• Тетраборат натрия Детоксикация фторида
• Тетраборат натрия Лечение молочницы в копытах лошадей
• Тетраборат натрия Используется для изготовления несмываемых чернил для погружных ручек путем растворения шеллака в нагретой буре
• Тетраборат натрия Отвердитель для змеиных шкур
• Тетраборат натрия Отвердитель для яиц лосося, для использования в спортивной рыбалке для лосося
• Тетраборат натрия Буферный агент бассейна для контроля рН
• Тетраборат натрия Нейтронный поглотитель, используемый в ядерных реакторах и бассейнах отработавшего топлива для контроля реактивности и прекращения ядерной цепной реакции
• Тетраборат натрия В качестве микроэлементного удобрения для коррекции не содержащих бора почв
• Тетраборат натрия Для очистки полости головного мозга черепа для монтажа
• Тетраборат натрия Для окраски огней с зеленым оттенком
• Тетраборат натрия традиционно применяли для покрытия сухих замороженных мясных продуктов, таких как ветчины, чтобы защитить их от взрыва в процессе дальнейшего хранения
• Тетраборат натрия Обнаружен в некоторых коммерческих витаминах
• Тетраборат натрия Для остановки радиатора автомобиля и утечек блока двигателя
• Тетраборат натрия Как важный компонент в слизе
• Тетраборат натрия Используется современным кузнецом в процессе сварки фортом
Натрия тетраборат (Бура)

|
IUPAC по русски |
динатриевый; 3,7-диоксидо-2,4,6,8,9-пентаокса-1,3,5,7-тетраборабицикло[3.3.1]нонан; пентагидрат |
|
IUPAC по англ. |
disodium;3,7-dioxido-2,4,6,8,9-pentaoxa-1,3,5,7-tetraborabicyclo[3.3.1]nonane;pentahydrate |
|
Номер CAS |
12045-88-4 |
|
|
|
|
Синонимы |
Натрия тетраборат (Бура), Натрия тетраборат декагидрат, пентагидрат тетрабората динатрия, 5-гидрат буры, disodium tetraborate pentahydrate, borax 5-hydrate |
|
По английски |
Sodium tetraborate |
|
Эмпирическая формула |
Na2B4O7•10H2O |
|
Группа на сайте |
Инсектициды и акарициды медицинские, Действующие вещества медицинских инсектицидов и акарицидов |
|
Химический класс |
Неорганические вещества |
| Препаративная форма |
10% Порошок (дуст) |
|
|
|
|
Способ проникновения |
Инсектицид, контактно-кишечный пестицид |
|
Действие на организмы |
Контактно-кишечный пестицид, инсектицид |
|
Цель и область применения |
Инсектицид |
|
Способы применения |
Размещение в ходах вредителей |
|
|
Нажмите на фотографию для увеличения
Физико-химические свойства
Вещество ступенчато обезвоживается при нагреве до 380°С с получением стекла. Растворяется в спиртах, глицерине, воде, метаноле. В природе минерал – бура[5].
Тетраборат натрия – бесцветные кристаллы. Водный раствор имеет щелочную реакцию[3].
Физические характеристики
- молекулярная масса – 381,38;
- температура плавления Na2B4O7•10H2O – 64°С (с разложением);
- температура плавления безводного кристаллического продукта – 742°С;
- температура кипения – 1675°С;
- растворимость в воде при 20°С – 2,5%;
- плотность 1,69–1,72[3][5].
Действие на вредные организмы
Тетраборат натрия является инсектицидом кишечного и контактного действия. В отношении рабочих особей рыжих домовых муравьев энтомологическая эффективность достигает 100% в течение семи суток от начала экспозиции, а в отношении самок и рабочих особей в колонии – 100% в течение 35 суток[2].
Пестициды, содержащие
Натрия тетраборат (Бура)
для медицинского, санитарного
и бытового применения:
закончился срок регистрации:
Применение
Натрия тетраборат декагидрат применяется для получения борной кислоты и других соединений бора, как антисептик, микрокомпонент удобрений[5]. Помимо этого, вещество применяется в стекольном производстве, при спайке и сварке металлов, в текстильной, керамической, кожевенной, мыловаренной, пищевой и резиновой промышленности, для пропитки древесины и в медицине[3]. В медицине тетраборат используется преимущественно в виде средства под названием «бура в глицерине». Его, как правило, используют в борьбе с грибковыми инфекциями кожи и слизистых. При нанесении на поврежденные покровы препарат может вызвать раздражение[4].
Инсектицид. В качестве инсектицида зарегистрированные препараты на основе тетрабората натрия применяется для борьбы с муравьями в пищевых, жилых, детских и лечебных учреждениях[2].
Токсикологические свойства и характеристики
Теплокровные и человек. Тетраборат натрия проникает через кожу, имеет нерезко выраженное кумулятивное действие. Не обладает местным раздражающим действием при контакте с конъюктивой глаза и кожей, эффекта сенсибилизации и эмбриотоксического эффекта не вызывает[2].
Люди, работающие с веществом, часто страдают хронической экземой. При работе необходимо защищать органы дыхания, глаза и кожу от воздействия пыли[3].
Тетраборат натрия, так же, как борная кислота и растворимые бораты, быстро и почти полностью всасываются из желудочно-кишечного тракта. В крови бор равномерно распределяется между эритроцитами и плазмой, но быстро переходит в ткани. В мягких тканях обнаруживается ~ 10% от дозы (преимущественно в мозге, печени и жировой ткани). Выделение соединений бора происходит главным образом через желудочно-кишечный тракт[3].
Классы опасности. Инсектициды на основе тетрабората натрия относится к IV классу малоопасных средств дезинсекции по ГОСТ 12.1.007.[2]
История
Уже давно препараты на основе буры являются эффективным средством против тараканов. Применяли следующие рецепты:
- взять сахарную пудру, муку и буру в равных пропорциях и в сухом виде, смешать, рассыпать в местах, где часто появляются тараканы;
- смешать буру, муку и стручковый перец и также насыпать в местах наблюдения тараканов;
- мелко молотую канифоль, сахарную пудру и буру смешать, посыпать в течение трех дней там, где появляются тараканы;
- в горячей воде растворить буру и смочить этим раствором кусочки хлеба, несколько дней подряд подкладывать приманки в местах появления тараканов и на следующий день уничтожить отравленных тараканов и приманки[1].
Приманки на основе буры также использовали против грызунов – смешивали пластмассовой лопаточкой буру, сахарную пудру и мелкомолотую канифоль. Посыпали смесью места возле дыр, образованных грызунами[1].
Получение
Вещество получают:
- перекристаллизацией природной буры или кернита (тетрагидрат);
- взаимодействием борной кислоты с карбонатом натрия;
- взаимодействием природных боратов с карбонатом и гидрокарбонатом натрия при нагревании[5].
Составитель:
Страница внесена: 17.12.13 11:18
Последнее обновление: 26.10.22 23:23
Статья составлена с использованием следующих материалов:
Литературные источники:
1.
Дворак В. Вредные насекомые, грызуны и микроорганизмы в домашнем быту / Составители В.Дворак, С.Дворак. – Рига, Коммерческая фирма «Рейтерн» Союза журналистов Латвии, 1992. – 24 с
2.
Инструкция по применению средства инсектицидного «АНТИМУРАВЕЙ» (ЗАО «Научно-коммерческая фирма «РЭТ», г.Москва , Россия) Скачать >>>
3.
Лазарев Н.В. Вредные вещества в промышленности. Справочник для химиков, инженеров и врачей. Том III. Неорганические и элементоорганические соединения. Под ред. проф. Н.В.Лазарева и И.Д.Гадаскиной. Л.: «Химия», 1977.– 608 с.
4.
Натрия тетраборат в глицерине, официальная инструкция к препарату
5.
Химический энциклопедический словарь. Гл.ред. И.Л.Кнунянц. Москва: Советская энциклопедия», 1983. – 792 с.
Свернуть
Список всех источников
-
29.06.2017
Бура́ — неорганическое вещество, натриевая соль борной кислоты.
Химическое название — тетраборат натрия. Бурой называют как безводную соль, так и ее кристаллогидраты. Формула безводной соли — Na2B4O7. Чаще всего используется 10-ти водный кристаллогидрат Na2B4O7·10H2O.
Получают буру из природного сырья, хотя некоторые предприятия синтезируют 10-ти водный кристаллогидрат из борной кислоты и соды. Минералы тинкал (десятиводный кристаллогидрат) и кернит (четырехводный кристаллогидрат) — это тетраборат натрия естественного происхождения. Бура содержится в минералах на основе боратов. Ее добывают из отложений соленых озер.
Выпускается тетраборат натрия разной степени очистки. Есть марки технической буры и пищевой буры.
Свойства
Кристаллическое вещество; кристаллы бесцветные, прозрачные, белые или сероватые, с жирным блеском. Без запаха, со сладковато-щелочным вкусом. Хорошо растворяется в воде, глицерине; не растворяется в спиртах. При плавлении превращается в бесцветный стеклообразный материал.
Водный раствор имеет выраженную щелочную реакцию. Вступает в реакции с сильными кислотами. Взаимодействие раствора буры с металлами приводит к образованию нерастворимых боратов. Это свойство используется для удаления из воды солей магния и кальция: их бораты выпадают в осадок и их легко удалить фильтрованием. Очень интересна способность буры образовывать цветные бораты (их называют «перлы буры») при сплавлении с оксидами металлов. Эту особенность используют в аналитике для оценки качественного состава неизвестного вещества.
Меры предосторожности
Тетраборат натрия относят к малоопасным для человека веществам. Он не горит и не взрывается, его раствор не вызывает раздражений кожи или глаз. Не является аллергеном, не влияет на развитие плода у беременных. Тем не менее, при регулярном воздействии на кожу пыль буры может привести к дерматиту. Поэтому сотрудники, постоянно имеющие дело с хим. реактивом по роду своей деятельности, должны использовать средства защиты для кожи, глаз и органов дыхания.
В быту буру следует хранить в недоступном для детей и животных месте, в герметично закрытых сосудах, так как проглатывание концентрированного вещества может привести к отравлению.
Применение
- В химической промышленности для получения бора,
борной кислоты, боратов; бытовых и промышленных СМС, чистящих средств, полиролей и натирок, клеев; тосола; смазочных материалов и тормозных жидкостей.
- В аналитической химии — как индикатор металлов; для получения буферных растворов; эталон при измерении концентрации кислотного раствора.
- В стекольной, керамической, фарфоровой, лакокрасочной индустрии для производства цветных стекол, глазурей и эмалей, фарфоровых и фаянсовых изделий, а также оптического стекла.
- На электротехнических, радиоэлектронных, металлургических предприятиях для пайки и сварки металлов. Пятиводный кристаллогидрат востребован в ювелирном деле как часть флюса для работ с золотом и серебром.
- Входит в состав электролитов для создания антикоррозионных покрытий электролитическим способом.
- При изготовлении строительного утеплителя «Эковата» (в качестве дезинфицирующего ингредиента); для протравы древесины и деревянных строений.
- В медицине — водные и глицериновые растворы буры применяются как антисептическое наружное средство при грибковых заболеваниях для обработки кожи, полоскания рта, спринцевания.
- В сельском хозяйстве и быту — инсектицид против всех видов насекомых; входит в состав микроудобрений.
- На кожевенных предприятиях — при дублении кож и выделке мехов.
- В целлюлозно-бумажной, текстильной, резиновой, фармацевтической, пищевой, косметической, мыловаренной индустрии, в водоподготовке.
- В фотопроявителе.
- В быту — для удаления трудновыводимых загрязнений, например, при чистке сантехники; для уничтожения плесени на поверхностях; для стирки вещей из шерсти.
Как действовать в аварийных ситуациях, связанных с кислотами и щелочами
Карбамид — ценное удобрение и сырье для химической промышленности - В химической промышленности для получения бора,











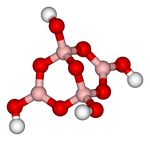


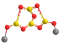
 Химическое название — тетраборат натрия. Бурой называют как безводную соль, так и ее кристаллогидраты. Формула безводной соли — Na2B4O7. Чаще всего используется 10-ти водный кристаллогидрат Na2B4O7·10H2O.
Химическое название — тетраборат натрия. Бурой называют как безводную соль, так и ее кристаллогидраты. Формула безводной соли — Na2B4O7. Чаще всего используется 10-ти водный кристаллогидрат Na2B4O7·10H2O. Кристаллическое вещество; кристаллы бесцветные, прозрачные, белые или сероватые, с жирным блеском. Без запаха, со сладковато-щелочным вкусом. Хорошо растворяется в воде, глицерине; не растворяется в спиртах. При плавлении превращается в бесцветный стеклообразный материал.
Кристаллическое вещество; кристаллы бесцветные, прозрачные, белые или сероватые, с жирным блеском. Без запаха, со сладковато-щелочным вкусом. Хорошо растворяется в воде, глицерине; не растворяется в спиртах. При плавлении превращается в бесцветный стеклообразный материал. борной кислоты, боратов; бытовых и промышленных СМС, чистящих средств, полиролей и натирок, клеев; тосола; смазочных материалов и тормозных жидкостей.
борной кислоты, боратов; бытовых и промышленных СМС, чистящих средств, полиролей и натирок, клеев; тосола; смазочных материалов и тормозных жидкостей.