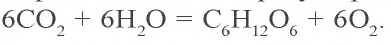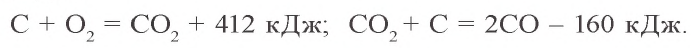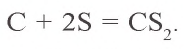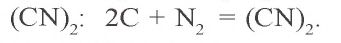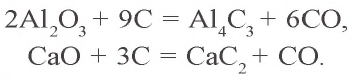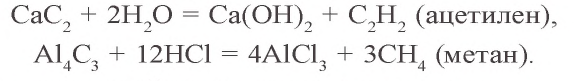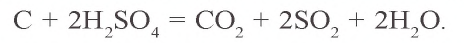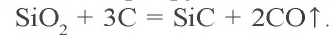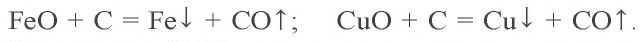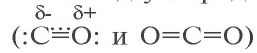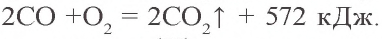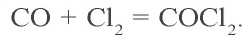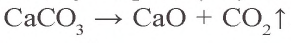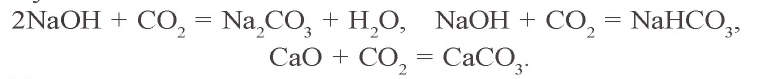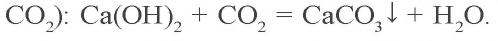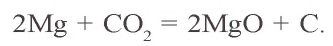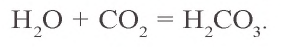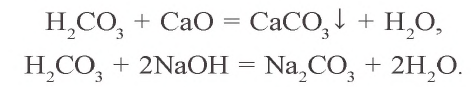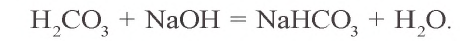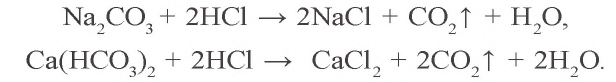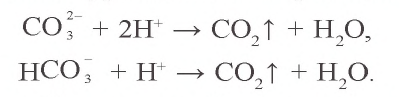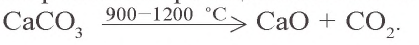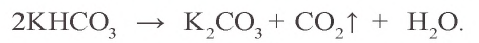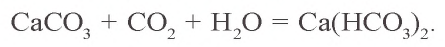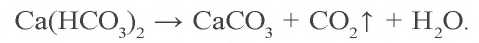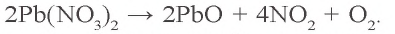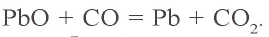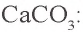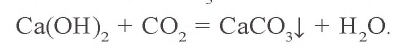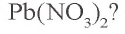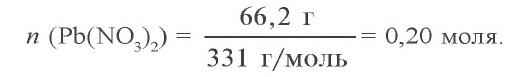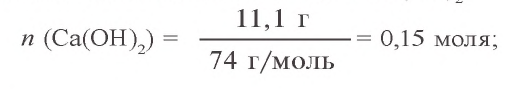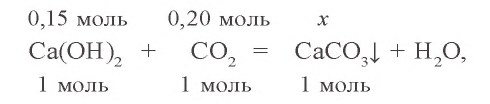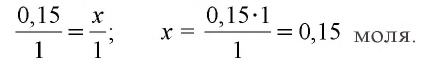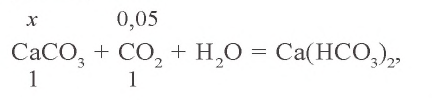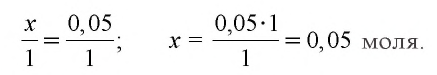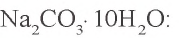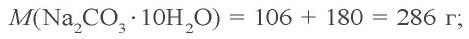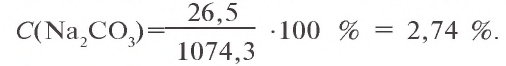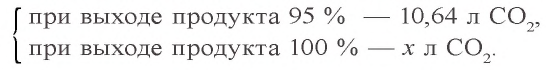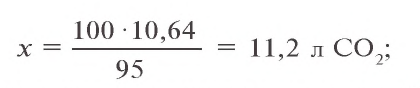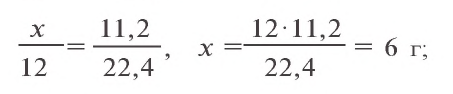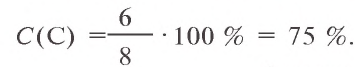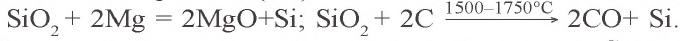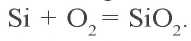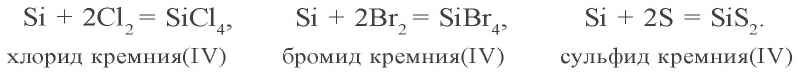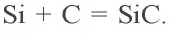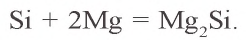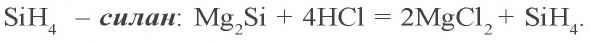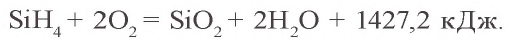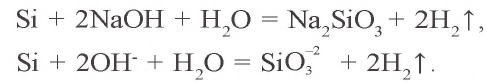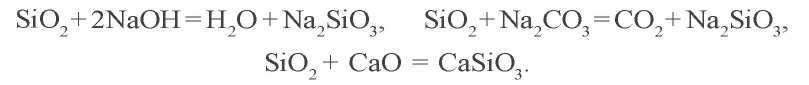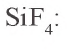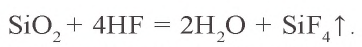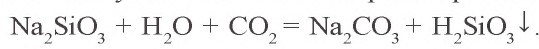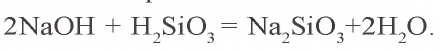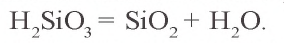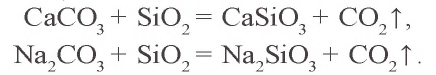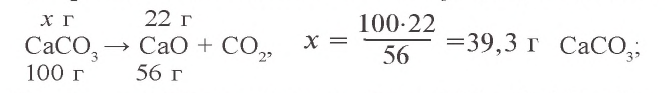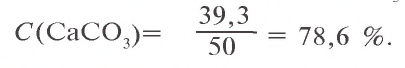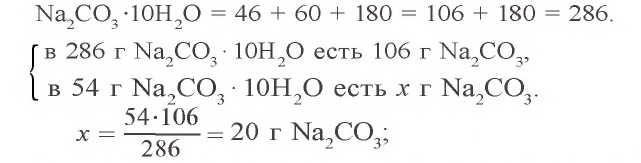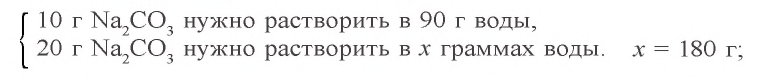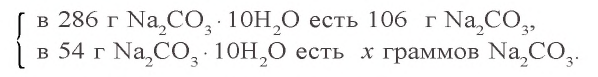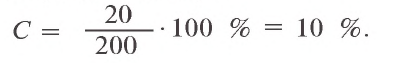Углерод
Углерод — неметаллический элемент IV группы периодической таблицы Д.И. Менделеева, является важнейшей частью всех органических
веществ в природе.

Общая характеристика элементов IVa группы
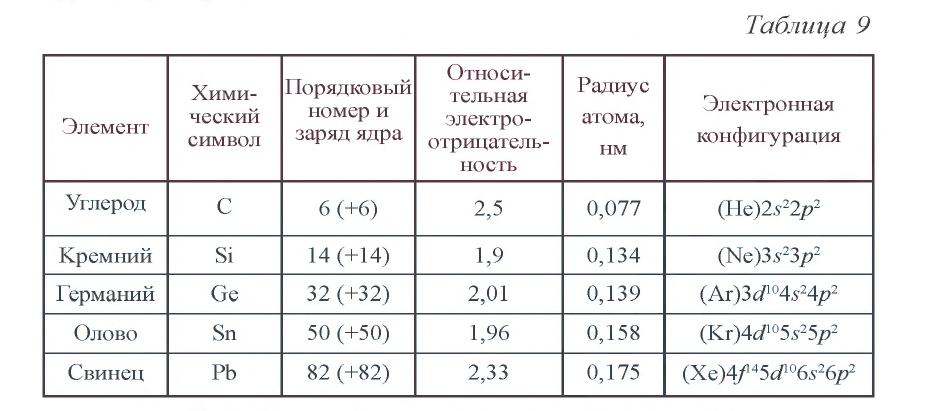
От C к Pb (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств.
Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Из элементов IVа группы углерод и кремний относятся к неметаллам, германий, олово и свинец — металлы.

Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns2np2:
- C — 2s22p2
- Si — 3s23p2
- Ge — 4s24p2
- Sn — 5s25p2
- Pb — 6s26p2

Природные соединения
В природе углерод встречается в виде следующих соединений:
- Аллотропных модификаций — графит, алмаз, фуллерен
- MgCO3 — магнезит
- CaCO3 — кальцит (мел, мрамор)
- CaCO3*MgCO3 — доломит

Получение
Углерод получают в ходе пиролиза углеводородов (пиролиз — нагревание без доступа кислорода). Также применяется получение углеродистых соединений:
древесины и каменного угля.
C2H6 → (t) C + H2 (пиролиз этана)

Химические свойства
- Реакции с неметаллами
- Реакции с металлами
- Восстановительные свойства
- Реакция с водой
- Реакции с кислотами
При нагревании углерод реагирует со многими неметаллами: водородом, кислородом, фтором.
C + H2 → (t) CH4 (метан)
2С + O2 → (t) 2CO (угарный газ — продукт неполного окисления углерода, образуется при недостатке кислорода)
С + O2 → (t) CO2 (углекислый газ — продукт полного окисления углерода, образуется при достаточном количестве кислорода)
С + F2 → (t) CF4
При нагревании углерод реагирует с металлами, проявляя свои окислительные свойства. Напомню, что металлы могут принимать только положительные
степени окисления.
Ca + C → CaC2 (карбид кальция, СО углерода = -1)
Al + C → Al4C3 (карбид алюминий, СО углерода -4)
Очевидно, что степень окисления углерода в соединении с различными металлами может отличаться.

Углерод — хороший восстановитель. С помощью него металлургическая промышленность справляется с задачей получения чистых металлов из их
оксидов:
Fe2O3 + C → Fe + CO2
ZnO + C → Zn + CO
FeO + C → Fe + CO
Углерод восстанавливает не только металлы из их оксидов, но и неметаллы подобным образом:
SiO2 + C → (t) Si + CO
Может восстановить и собственный оксид:
CO2 + C → CO

Известная реакция взаимодействия угля с водяным паром, называемая также газификацией угля, торфа, сланца — крайне важна в промышленности:
C + H2O → CO↑ + H2↑
В реакциях с кислотами углерод проявляет себя как восстановитель:
C + HNO3(конц.) → (t) CO2 + NO2 + H2O
C + HNO3 → CO2 + NO + H2O
C + H2SO4(конц.) → CO2 + SO2 + H2O

Оксид углерода II — СO
Оксид углерода II — продукт неполного окисления углерода. Несолеобразующий оксид. Это чрезвычайно опасное вещество часто образуется
при пожарах в замкнутых помещениях, при прогревании машины в гараже.
Растворяясь в крови угарный газ (имеющий в 300 раз большее сродство к гемоглобину, чем кислород) легко выигрывает конкуренцию у кислорода
и занимает его место в эритроцитах. Отравление угарным газом нередко заканчивается летальным исходом.
Получение
В промышленности угарный газ получают восстановлением оксида углерода IV или газификацией угля (t = 1000 °С).
CO2 + C → (t) CO
C + H2O → (t) CO + H2
В лаборатории угарный газ получают при разложении муравьиной кислоты в присутствии серной:
HCOOH → (H2SO4) CO + H2O
Химические свойства
Полностью окисляется до углекислого газа в реакции с кислородом, восстанавливает оксиды металлов.
CO + O2 → CO2
Fe2O3 + CO → Fe + CO2
FeO + CO → Fe + CO2
Образование карбонилов — чрезвычайно токсичных веществ.
Fe + CO → (t) Fe(CO)5

Оксид углерода IV — CO2
Продукт полного окисления углерода. Относится к кислотным оксидам, соответствует угольной кислоте H2CO3. Бесцветный газ,
без запаха.
Получение
В промышленности углекислый газ получают при разложении известняка, в ходе производства алкоголя, при спиртовом брожении глюкозы.
CaCO3 → (t) CaO + CO2↑
C6H12O6 → C2H5OH + CO2↑
В лабораторных условиях используют реакцию мела (мрамора) с соляной кислотой.
CaCO3 + HCl → CaCl2 + H2O + CO2↑
Углекислый газ образуется при горении органических веществ:
C3H8 + O2 → CO2 + H2O

Химические свойства
- Реакция с водой
- Реакции с основными оксидами и основаниями
- Окислительные свойства
В результате реакции с водой образуется нестойкая угольная кислота, которая сразу же распадается на воду и углекислый газ.
CO2 + H2O ⇄ H2CO3
В ходе реакций с основаниями и основными оксидами углекислый газ образует соли угольной кислоты: средние — карбонаты (при избытке основания),
кислые — гидрокарбонаты (при избытке кислотного оксида).
2KOH + CO2 → K2CO3 + H2O (соотношение основание — кислотный оксид 2:1)
KOH + CO2 → KHCO3 (соотношение основание — кислотный оксид 1:1)
Na2O + CO2 → Na2CO3
При нагревании способен окислять металлы до их оксидов.
Zn + CO2 → (t) ZnO + CO

Угольная кислота
Слабая двухосновная кислота, существующая только в растворах, разлагается на воду и углекислый газ.

Химические свойства
- Качественная реакция
- Средние и кислые соли
- Нагревание солей угольной кислоты
Определить наличие карбонат-иона можно с помощью кислоты: такая реакция сопровождается «закипанием» — появлением пузырьков бесцветного
газа без запаха.
MgCO3 + HCl → MgCl2 + CO2↑ + H2O
Я не раз встречал описание реакций, связанных с этой кислотой, которое заслуживает нашего внимания. В задании было сказано, что
при добавлении к раствору гидроксида кальция углекислого газа осадок появлялся, при дальнейшем пропускании углекислого газа —
помутнение исчезало.
Это можно легко объяснить, вспомнив про способность угольной кислоты образовывать кислые соли, которые растворимы.
Ca(OH)2 + CO2 → CaCO3 (осадок выпадает)
CaCO3 + H2O + CO2 → Ca(HCO3)2 (осадок растворяется)

Чтобы сделать из средней соли (карбоната) — кислую соль (гидрокарбонат) нужно добавить угольную кислоту. Однако написать ее формулу
H2CO3 — ошибка. Ее следует записать в виде воды и углекислого газа.
Li2CO3 + CO2 + H2O → LiHCO3 (средняя соль + кислота = кислая соль)
Чтобы вернуть среднюю соль, следует добавить к кислой соли щелочь.
LiHCO3 + LiOH → Li2CO3 + H2O
При нагревании карбонаты распадаются на соответствующий оксид металла и углекислый газ, гидрокарбонаты — на карбонат металла, углекислый газ и воду.
MgCO3 → (t) MgO + CO2
KHCO3 → (t) K2CO3 + CO2↑ + H2O
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Уголь — это один из самых древних видов топлива, известных человеку. И даже сегодня он занимает лидирующие позиции по объему использования. Причиной тому служит его распространенность, легкость добычи, переработки и использования. Но что он собой представляет? Какова химическая формула угля?
На самом деле данный вопрос не совсем корректен. Уголь — это не вещество, это смесь различных веществ. Их целое множество, поэтому полностью определить состав угля невозможно. Поэтому под химической формулой угля в этой статье мы будем подразумевать скорее его элементный состав и некоторые другие особенности.

Но что мы можем узнать о состоянии этого вещества? Уголь образуется из останков растений в течение многих лет вследствие воздействия большой температуры и давления. А так как растения имеют органическую природу, то и в составе угля будут преобладать органические вещества.
В зависимости от возраста и иных условий происхождения угля его делят на несколько видов. Каждый вид отличается элементарным составом, наличием примесей и другими немаловажными характеристиками.
Бурый уголь

Является самым молодым видом угля. В нем даже наблюдается растительная древесная структура. Образуется напрямую из торфа на глубине порядка 1 километра.
Этот вид угля содержит достаточно большое количество влаги: от 20 до 40%. При попадании на воздух она испаряется, а уголь рассыпается в порошок. Далее речь пойдет о химическом составе именно этого сухого остатка. Количество неорганических примесей в буром угле также велико и составляет 20-45%. В качестве этих примесей выступают диоксид кремния, оксиды алюминия, кальция и железа. Также в нем могут содержаться оксиды щелочных металлов.
Много в этом угле и летучих органических и неорганических веществ. Они могут составлять до половины массы этого вида угля. Элементарный состав за вычетом неорганических и летучих веществ следующий:
- Углерод 50-75%.
- Кислород 26-37%.
- Водород 3-5%.
- Азот 0-2%.
- Сера 0,5-3%.
Каменный уголь

По времени образования этот вид угля идет следующим после бурого. Он имеет черный или серо-черный цвет, а также смоляной, иногда металлический блеск.
Влажность каменного угля значительно меньше бурого: всего 1-12%. Содержание летучих веществ в каменном угле очень колеблется в зависимости от места добычи. Оно может быть минимальным (от 2%), но может и достигать значений, аналогичных бурому углю (до 48%). Элементарный состав следующий:
- Углерод 75-92%.
- Водород 2,5-5,7%.
- Кислород 1,5-15%.
- Азот до 2,7%.
- Сера 0-4%.
Отсюда можно сделать вывод, что химическая формула угля каменного состоит из большего числа углерода, чем у бурого. Это делает данный вид угля более качественным топливом.
Антрацит

Антрацит — это самая древняя форма ископаемого угля. Ему присущ темно-черный цвет, и он имеет характерный металлический блеск. Это самый лучший уголь по количеству тепла, которое он выделяет при горении.
Количество влаги и летучих веществ в нем очень мало. Около 5-7% на каждый показатель. А элементарный состав характеризуется крайне высоким содержанием углерода:
- Углерод более 90%.
- Водород 1-3%.
- Кислород 1-1,5%.
- Азот 1-1,5%.
- Сера до 0,8%.
Больше угля содержится лишь в графите, который является дальнейшей стадией углефикации антрацита.
Древесный уголь

Этот тип угля не является ископаемым, поэтому он имеет некоторые особенности своего состава. Производят его путем нагрева сухой древесины до температуры 450-500 oC без доступа воздуха. Этот процесс называют пиролизом. В ходе него из древесины выделяется ряд веществ: метанол, ацетон, уксусная кислота и другие, после чего она превращается в уголь. Кстати, горение древесины — это тоже пиролиз, но из-за наличия кислорода воздуха загораются выделяющиеся газы. Именно этим и обуславливается наличие языков пламени при горении.
Древесина не является однородной, в ней очень много пор и капилляров. Подобная структура отчасти сохраняется и полученном из нее угле. По этой причине он обладает хорошей адсорбционной способностью и применяется наряду с активированным углем.
Влажность этого типа угля совсем небольшая (около 3%), но при длительном хранении он поглощает влагу из воздуха и процентное содержание воды повышается до 7-15%. Содержание неорганических примесей и летучих веществ регламентируется ГОСТами и должно составлять не более 3% и 20% соответственно. Элементный состав зависит от технологии получения, и примерно выглядит так:
- Углерод 80-92%.
- Кислород 5-15%.
- Водород 4-5%.
- Азот ~0%.
- Сера ~0%.
Химическая формула угля древесного показывает, что по содержанию углерода он близок к каменному, но вдобавок имеет лишь незначительное количество ненужных для горения элементов (серы и азота).
Активированный уголь
Активированный уголь — это тип угля с высокой удельной поверхностью пор, из-за чего он обладает даже большей адсорбционной способностью, чем древесный. В качестве сырья для его получения используются древесный и каменный угли, а также скорлупа кокосовых орехов. Исходный материал подвергают процессу активации. Суть его состоит в том, чтобы вскрыть закупоренные поры действием высокой температуры, растворами электролитов или водяным паром.
В ходе процесса активации меняется лишь структура вещества, поэтому химическая формула активированного угля идентична составу сырья, из которого тот был изготовлен. Влажность активированного угля зависит от удельной поверхности пор и обычно составляет менее 12%.
Автор:
01-10-2018 17:53
Жду ваши вопросы и мнения в комментариях
Содержание:
Группа углерода:
Элементы группы углерода расположены в основной подгруппе четвертой группы периодической таблицы элементов ( p-элементы) и на внешнем энергетическом уровне атомов имеют четыре электрона. В периодической таблице они находятся в промежутке между элементами, которые легко присоединяют и легко отдают электроны. В водородных соединениях они проявляют степень окисления –4 (метан
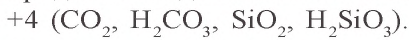
В табл. 9 приводятся некоторые характеристики элементов группы углерода
Расположение углерода в периодической таблице, строение его атома:
- Углерод – основа живой природы.
- Углерод встречается в природе в чистом виде и в виде карбонатсодержащих минералов.
- Алмаз и графит — аллотропические модификации углерода.
- Карбин — искусственная аллотропическая модификация углерода.
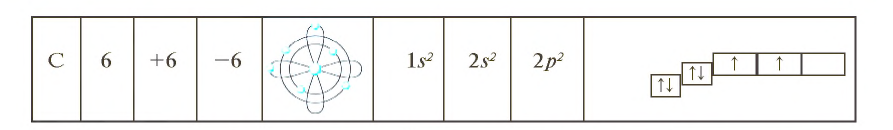
В периодической таблице углерод расположен расположен в основной подгруппе четвертой группы второго периода под порядковым номером 6 и относится к семейству p-элементов. Его относительная атомная масса равна 12,011. На внешнем энергетическом уровне атома имеется четыре электрона.
В периодической таблице углерод находится среди элементов, атомы которых легко отдают и легко присоединяют электроны. В водородных соединениях 
В природе углерод встречается в свободном состоянии и в составе соединений. В составе минералов в основном содержится в виде солей угольной кислоты; например, кальцит (известняк) 
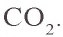
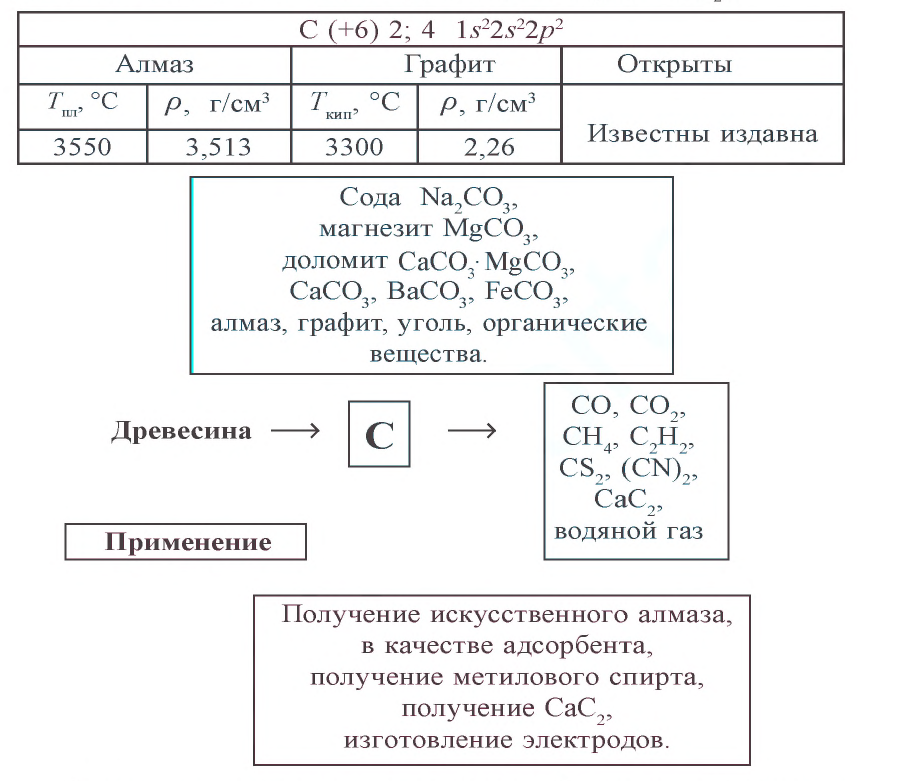
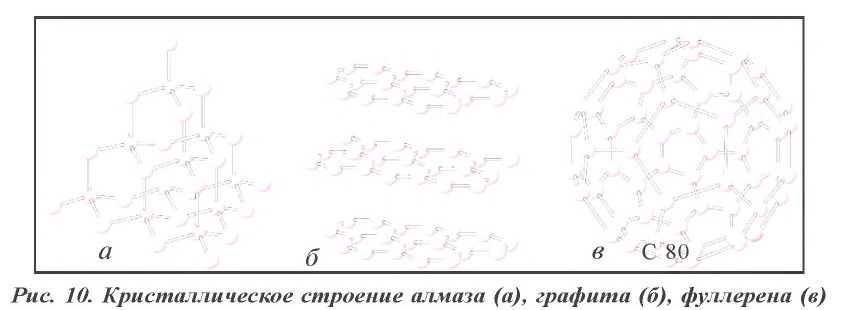
В свободном состоянии углерод встречается в виде алмаза и графита. Это — твердые вещества с атомной кристаллической решеткой. Они различаются строением кристаллической решетки и физическими свойствами.
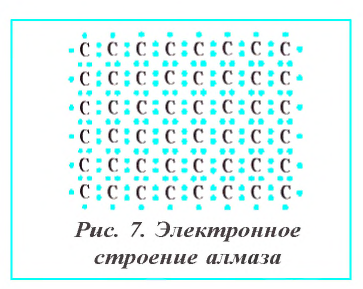
Алмаз — самое твердое вещество в природе. Чистый алмаз — бесцветное прозрачное вещество с сильным лучепреломляющим свойством и кристаллическим строением. В кристаллах алмаза все атомы углерода находятся на одинаковом расстоянии друг от друга, и каждый атом образует с четырьмя соседними атомами ковалентную связь, направленную к вершинам тетраэдра (рис. 7). Алмаз хорошо проводит тепло, но почти не проводит электрический ток. Ограненные прозрачные кристаллы алмаза называются бриллиантами. Они применяются при изготовлении ювелирных изделий. Технический алмаз пол у чают искусственным путем. В технике алмаз используют для изготовления абразивных материалов, приборов для резки стекла, обработки металлов и других материалов (рис. 8).
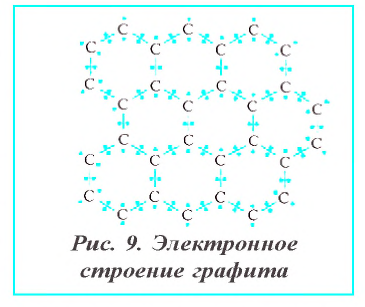
Графит — темно-серое мягкое кристаллическое вещество с металлическим блеском. Атомы углерода в графите расположены в параллельных плоскостях (рис. 9). Вследствие того, что связь между атомами, расположенными в параллельных плоскостях, слабее, чем между атомами, находящимися на горизонтальной плоскости, графит при поверхностном трении разъедается.
Он применяется для изготовления сухих смазочных материалов, электродов, карандашей. Древесный уголь, кокс, костный уголь, сажа состоят из мелких кристаллов сухого графита.
Карбин — искусственная аллотропическая модификация углерода, в которой атомы образуют линейные цепочки. Карбин бывает двух типов: полиин, где атомы углерода связаны друг с другом чередующейся одинарной и тройной связью: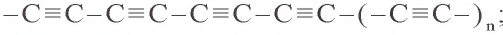
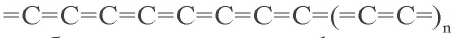
Фуллерен – аллотропическая модификация углерода, открытая в конце 80-х годов XX века. Существует в виде икосаэдра, состоящего из 20 шестиугольников и 12 пятиугольников более чем 80 углеродных атомов. Он образуется в небольшом количестве при переходе газообразного углерода в твердое состояние (рис. 10).
Содержащийся в воздухе углекислый газ усваивается растениями в процессе фотосинтеза. При этом образуются органические вещества и выделяется кислород. Углерод, имеющийся в составе растений, переходит в организм животных. Такие полезные ископаемые, как каменный уголь, нефть, природный газ, образовались из остатков растений и животных. В результате жизнедеятельности растительного и животного мира, горения угля, нефти, газа, извержения вулканов и выветривания минеральных ископаемых углерод возвращается в атмосферу в виде углекислого газа.
При разложении горных пород иногда образуются основные оксиды, с которыми соединяется углекислый газ воздуха. Это приводит к образованию новых минералов. Так происходит круговорот углерода в природе.
Физические и химические свойства углерода
Распространение в природе: Углерод составляет основу всех живых организмов. Такие полезные ископаемые, как нефть, природный газ, торф, уголь, горючие сланцы, являются различными соединениями углерода. Особенно богат углеродом каменный уголь. Самые распространенные на земном шаре известняк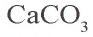
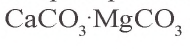
Содержание углерода в земной коре составляет 0,023%.
В атмосфере углерод встречается в виде углекислого газа, который участвует в процессе фотосинтеза и образует различные углеводные соединения:
Из образующегося в процессе фотосинтеза 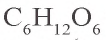
Физические свойства: Любая аллотропическая разновидность углерода представляет собой трудно плавящееся и не растворимое в обычных растворителях вещество без запаха и вкуса. Температура плавления 3550 °C (алмаз), температура кипения (сублимации) 4830 °C; плотность алмаза 3513 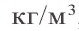
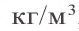
Адсорбция: Углерод в виде древесного угля обладает высшими адсорбционными свойствами
- Aдсорбция – поглощение одного вещества поверхностью другого.
- Aдсорбент – вещество, на поверхности которого происходит поглощение.
- Поглощение жидкостью или поверхностью твердых веществ молекул, атомов, ионов другого вещества называется адсорбцией.
- Поглощение веществом других веществ из внешней среды называется сорбцией.
Aдсорбционная способность зависит от площади поверхности. Для усиления адсорбционной способности угля его активируют сильно нагретым водяным паром. При этом вещества, заполняющие пустоты угля, вытесняются, и тем самым увеличивается его поглощающая поверхность. Активированный уголь используется для поглощения летучих ядовитых веществ из воздуха и смеси газов (противогазы); для очищения организма от отравляющих веществ (крови, органов пищеварения); для очистки продуктов в пищевой промышленности (масложировые продукты), а также в химической промышленности в качестве катализатора.
В годы первой мировой войны Н.Д.Зелинский, используя активированный уголь в качестве сорбента против отравляющих химических веществ, изобрел противогаз. Изобретение Зелинского сохранило жизнь сотен тысяч солдат.
Химические свойства: При обычной температуре углерод неактивен. При нагревании углерод вступает во взаимодействие со многими веществами – кислородом, серой, азотом, металлами и их оксидами, непосредственно взаимодействует с фтором (и не взаимодействует с другими галогенами): 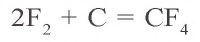
Вступая в реакцию с кислородом, углерод образует два вида оксидов:
При 900–1000 °C соединяется с серой:
В атмосфере азота при пропускании между двумя графитовыми электродами разряда электрической дуги образуется дициан
Металлы образуют с углеродом карбиды: 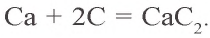
Kaрбиды образуются также при взаимодействии углерода с оксидами металлов:
Некоторые карбиды металлов, взаимодействуя с водой или кислотами, образуют водородные соединения различного состава (ацетилен, метан):
Углерод взаимодействует также с кислотами:
Карбиды промежуточных металлов (титана, вольфрама, железа, никеля и др.) обладают хорошей электропроводимостью, твердостью, тугоплавкостью, химической устойчивостью.
При восстановлении 
Углерод – сильный восстановитель. При взаимодействии с оксидами металлов восстанавливает металлы до свободного состояния:
Важнейшие соединения углерода
Какие продукты можно получить при химической переработке известняка?
Неорганические соединения углерода широко распространены в природе и встречаются в виде множества минералов, горных пород, углекислого газа в составе воздуха. Некоторые из неорганических соединений углерода являются важнейшим сырьем для различных отраслей народного хозяйства. Жизнь человека трудно представить без органических соединений углерода. Важнейшие из них – соединения, образованные углеродом и водородом, называемые углеводородами, которые обладают различным составом. Мы изучаем их в курсе органической химии.
Углерод образует с кислородом два оксида: оксид углерода(II) CO и оксид углерода(IV) 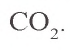
Оксид углерода(II) CO (угарный газ) – бесцветный газ без запаха, чрезвычайно ядовит, легче воздуха и мало растворим в воде. Относится к семейству индифферентных оксидов.
Оксид углерода(II) образуется в результате взаимодействия оксида углерода(IV) с раскаленным при 450 °C углем при недостатке кислорода: 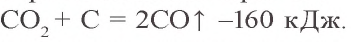
На воздухе и в присутствии кислорода оксид углерода(II) горит синим пламенем:
Как и углерод, оксид углерода(II) является восстановителем. При 300–1500 °C он восстанавливает металлы из их оксидов: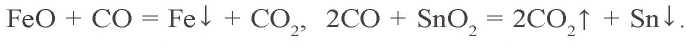
Угарный газ, по сравнению с кислородом, легче соединяется с гемоглобином в составе крови, что ухудшает снабжение организма кислородом. Длительное вдыхание угарного газа при недостатке кислорода приводит к летальному исходу. Оксид углерода(II) используется в промышленности при восстановлении металлов из их оксидов, в качестве составной части искусственных горючих, при органическом синтезе.
Оксид углерода(IV) 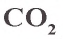
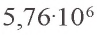
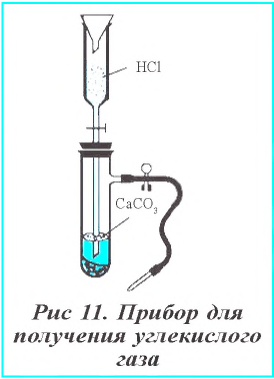
Получение. В лаборатории оксид углерода(IV) получают воздействием на карбонат кальция (мел, кусочки известняка, мрамор) соляной кислотой (рис. 11):
В промышленности оксид углерода(IV) получают путем прокаливания известняка:
В природе углекислый газ образуется в процессе дыхания животных и растений, гниения остатков органического происхождения и горения. Углекислый газ проявляет свойства кислотных оксидов. Растворяясь в воде, он образует угольную кислоту: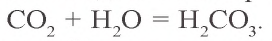
При пропускании углекислого газа через известковую воду наблюдается сильное помутнение (качественная реакция для
Углекислый газ не поддерживает горения, в его присутствии горят лишь некоторые вещества, например, магний:
Применение: В промышленности углекислый газ применяется при производстве соды (пищевой, бытовой, технической), синтезе органических кислот, в качестве огнетушителя, при изготовлении газированных напитков. Сухой лед используется в пищевой промышленности для охлаждения продуктов.
Угольная кислота и свойства карбонатов
Kaковы специфические химические свойства угольной кислоты и карбонатов?
Угольная кислота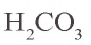
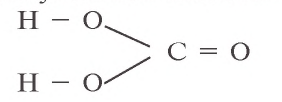
Структурная формула угольной кислоты имеет вид:
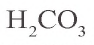
Угольная кислота вступает во взаимодействие только с оксидами и гидроксидами щелочных и щелочноземельных металлов. Ее средние соли называются карбонатами 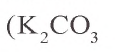
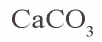
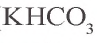

При взаимодействии обильного количества угольной кислоты с щелочью образуется кислая соль:
Карбонаты щелочных металлов, аммония, а также все гидрокарбонаты, растворяясь в воде, подвергаются гидролизу; остальные карбонаты не растворимы в воде. При воздействии сильных кислот на карбонаты и гидрокарбонаты выделяется углекислый газ:
Сокращенное ионное уравнение этих реакций имеет вид:
Реакции взаимодействия солей угольной кислоты с сильными кислотами используются для распознавания карбонатов и гидрокарбонатов среди других солей. Так как при взаимодействии карбонатов с кислотами связываются ионы водорода, карбонаты можно использовать для нейтрализации кислот. В сельском хозяйстве для уменьшения кислотности почвы и улучшения ее структуры применяется измельченный известняк (напишите уравнение реакции самостоятельно).
Все карбонаты, за исключением карбонатов щелочных металлов, при нагревании расщепляются с выделением углекислого газа:
Эта реакция протекает до конца только при условии вывода углекислого газа из зоны реакции.
При нагревании гидрокарбонаты переходят в карбонаты:
При пропускании через водный раствор карбоната натрия углекислого газа образуется гидрокарбонат натрия (питьевая сода):
Kaрбонат кальция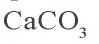
Известняк — природное соединение, являющееся основным сырьем в производстве строительных материалов, цемента, гашеной извести, стекла. В горах имеются в основном залежи известняка 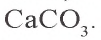
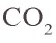

Образовавшаяся соль 
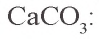
Карбонат натрия 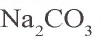
Гидрокарбонат натрия 
Задачи с решением и примеры №1
Пример 1. Твердый остаток, полученный в результате накаливания 66,2 г нитрата свинца(II), восстановили оксидом углерода(II). Какой объем (при н.у.) угарного газа израсходован в этом химическом процессе и какой объем углекислого газа образовался? Сколько осадка образуется при пропускании образовавшегося углекислого газа через раствор, содержащий 11,1 г гидроксида кальция?
Решение. 1. Запишем уравнение происшедших химических реакций
накаливание
Твердый остаток, образовавшийся в первом процессе — оксид свинца (II) (PbO). Восстановление PbO угарным газом:
При пропускании образовавшегося 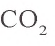
2. Сколько твердого остатка (PbO) образовалось (a) и какой объем угарного газа израсходован для его восстановления (б)? Какой объем углекислого газа образовался в результате окисления угарного газа (в)? a) сколько молей в 66,2 г
Согласно уравнению первой реакции, из 2 молей 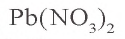
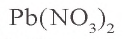
б) определение израсходованного угарного газа. Как видно из уравнения второй реакции, для восстановления 1 моля PbO расходуется 1 моль CO. Значит, для восстановления 0,20 моля PbO также расходуется 0,20 моля CO. Определим объем 0,20 моля CO при н.у.: V(CO) = 22,4 л/моль . 0,20 моля = 4,48 л. Израсходовано 4,48 л или 0,20 моля CO;
в) определение образовавшегося углекислого газа. Из второй реакции известно, что при расходовании 1 моля CO образуется 1 моль 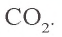
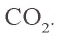
3. Определим количество осадка, выпавшего при пропускании 0,20 моля 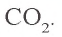
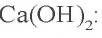
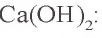
б) запишем уравнение третьей реакции:
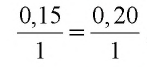
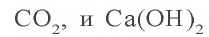
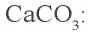
Образовалось 0,15 моля 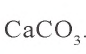
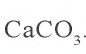
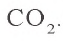
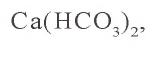
0,05 моля 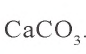
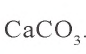
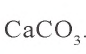
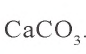
0,15 – 0,05 = 0,10 моля 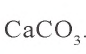
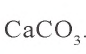
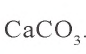
Ответ: выпало в осадок 10 г 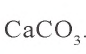
Пример 2. К 1060 г 2 %-ного раствора карбоната натрия добавили 14,3 г соли 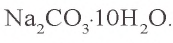
Решение: 1) найдем массу растворимого в 1060 г 2 %-ного раствора 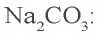
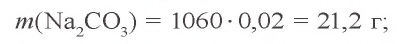
2) найдем массу 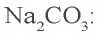
3) всего образовалось: 1060 + 14,3 = 1074,3 г. Масса соли в образовавшемся растворе: 21,2 + 5,3 = 26,5 г.
Значит, в 1074,3 г раствора содержится 26,5 г соли
Найдем процентную концентрацию раствора:
Ответ: 2,47 %.
Пример 3. Для анализа привезенного угля сожгли 8 г этого топлива. В результате образовалось 10,64 л (н.у.) углекислого газа. Вычислите, сколько процентов чистого углерода содержится в привезенном угле, если образовавшийся углекислый газ составляет 95 % от того количества, которое может теоретически образоваться?
Решение:
1) какой объем (при н.у.) углекислого газа мог образоваться, если бы выход продукта равнялся 100 % ?
2) при сгорании какого количества углерода образуется 11,2 л
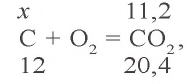
3) в 8 г сожженного угла содержится 6 г чистого углерода. Сколько процентов составляет это количество?
Ответ: в угле содержится 75 % углерода
Кремний
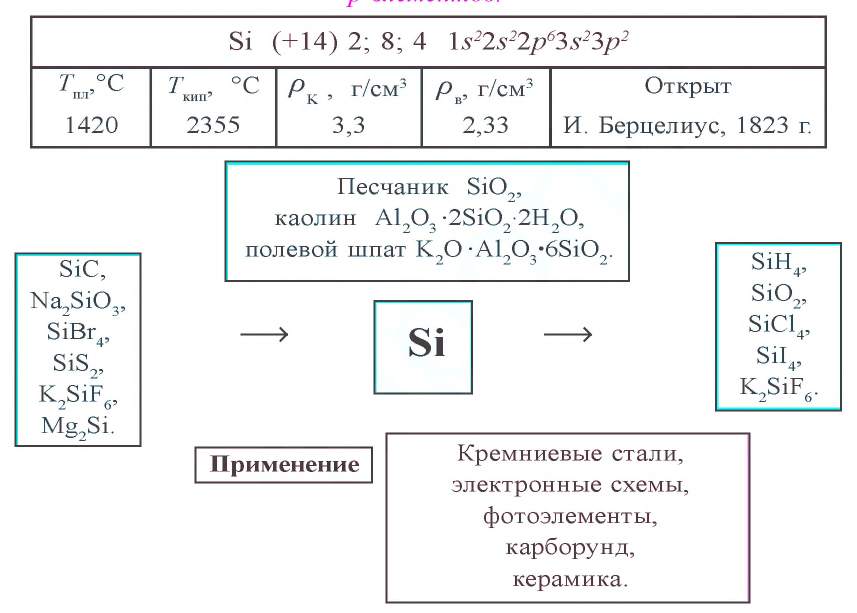
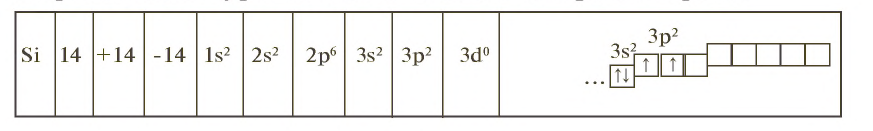
Kремний расположен в основной подгруппе четвертой группы третьего периода периодической таблицы под порядковым номером 14 и относится к семейству р-элементов. Его относительная атомная масса равна 28,086. На внешнем энергетическом уровне атома имеется четыре электрона
В периодической таблице кремний находится среди элементов, атомы которых легко отдают и легко присоединяют электроны. В соединениях с водородом 
Распространение в природе и биологическое значение
Массовая доля кремния, который по распространенности в земной коре занимает второе место после кислорода, составляет 27,6 %. В природе кремний встречается только в виде соединений. Кремний – основной элемент природы. Большинство горных пород (гнейсы, граниты, базальты) и минералов (кварц, полевой шпат, песок, глины) состоит из соединений кремния. Кремний входит в состав стеблей и листьев растений, перьев птиц и шерсти животных.
Получение и применение
Kремний получают путем восстановления оксида кремния(IV) магнием, алюминием или углеродом:
Кремний используется для получения многих сплавов. Сталь, содержащая в своем составе 4 % кремния, приобретает магнитные свойства. Из такой стали (электротехническая сталь) изготовляют трансформаторы, двигатели, генераторы. Сталь, содержащая 16 % кремния (кислотоупорная сталь), применяется в химической промышленности для изготовления аппаратов и приборов. Кристаллы чистого кремния используются для изготовления полупроводников в радио- и электротехнике, которые превращают солнечную энергию в электрическую. Кремниевые солнечные батареи применяются в космических устройствах в качестве источника энергии.
Свойства кремния
Физические и химические свойства. По внешнему виду кремний похож на металл. Кристаллический кремний – вещество стального цвета с металлическим блеском. Температура плавления равна 1420 °C, температура кипения – 2355 °C; плотность – 2329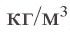
В отличие от углерода, у кремния слабо выражены неметаллические свойства, так как радиус его атома больше и электроны на внешнем энергетическом уровне находятся дальше от ядра. При сильном нагревании кремний сгорает в воздухе и превращается в оксид кремния(IV):
При нагревании кремний взаимодействует также с хлором, бромом и серой:
Соединения кремния с галогенами и серой при взаимодействии с водой гидролизуются:
При высокой температуре кремний соединяется с углеродом и образует очень твердое соединение – карборунд (карбид кремния):
Из карборунда изготовляют шлифовальные и точильные камни. При нагревании кремний реагирует со многими металлами (Mg, Ca, Cr, Mn, Fe и др.) с образованием силицидов:
При воздействии на силициды кислот образуется кремневодород
Силан – бесцветный газ, сильный восстановитель, самовоспламеняется на воздухе:
Помимо силана, существует еще ряд кремневодородов с общей формулой 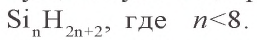
Важнейшие соединения
Оксид кремния(IV) 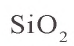
Оксид кремния(IV) не взаимодействует с кислотами, за исключением плавиковой. Под воздействием этой кислоты образуется газообразный фторид кремния
Из расплавленного кварца получают кварцевые стекла, пропускающие ультрафиолетовые лучи и обладающие малым коэффициентом расширения. Температура плавления кварца составляет около 1500°C, поэтому кварцевые стекла можно использовать в высокотемпературных условиях. Из кварца изготовляют ртутные лампы и химическую лабораторную посуду.
Meтакремниевая кислота и ее соли
Meтакремниевая кислота 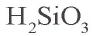
Метакремниевая кислота не растворима в воде и образует гелеобразный осадок, который растворяется только в щелочах с образованием солей метакремниевой кислоты:
При нагревании метакремниевая кислота легко распадается на воду и оксид кремния(IV):
Метакремниевую кислоту получают путем воздействия на ее соли другими кислотами. Ее соли называются силикатами. Только силикаты щелочных металлов растворимы в воде. Растворы силикатов калия и натрия 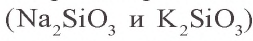
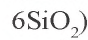
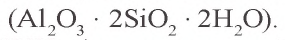
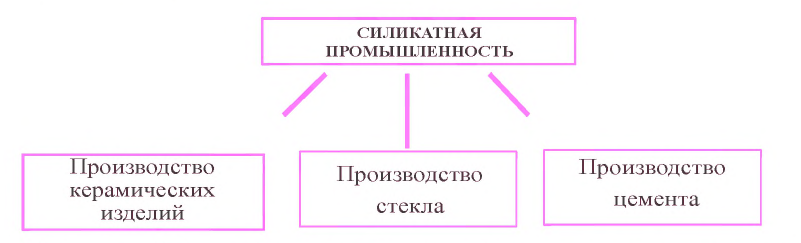
Силикатная промышленность
Что вы знаете о предприятиях по производству стекла, цемента, керамики и железобетона?
Природные силикаты и кремнезем используются при изготовлении стекла, фарфора и фаянса, керамических изделий и вяжущих материалов
Наряду с углем в Ангрене добывается и каолин, являющийся важнейшим сырьем для силикатной промышленности
Стекло. Обычное, или бутылочное стекло получают путем сплавления оксида кремния(IV) (в виде кварца, песка) с карбонатом кальция (в виде известняка, мрамора) и карбонатом натрия (в виде соды):
Образовавшееся стекло представляет собой сплав силикатов кальция и натрия с оксидом кремния(IV). Химический состав такого стекла можно выразить примерно следующей формулой: 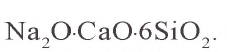
Цветные стекла получают путем добавления различных веществ. Оксид кобальта(II) придает стеклу синюю окраску, оксид хрома(III) – зеленую, оксид железа(II) – темно-зеленую, оксид меди(I) – красную. При добавлении в шихту золота можно получить рубиновое стекло, пропускающее только инфракрасные лучи.
Из стеклянных волокон производят ткани с тепло- и электроизоляционными свойствами и кислотостойкие материалы.
Цемент: Для производства цемента сырье (известняк, мел и глину) измельчают и подают во вращающуюся печь, температуру в которой повышают до 450 °C. При такой температуре из состава сырья испаряется вода и выделяется углекислый газ. В результате образуются куски твердеющей массы – клинкер. Цемент получают размалывая клинкер в порошок. При разведении цемента водой образуется твердеющее тесто. Отвердевание происходит даже под водой. Цемент используется в качестве связующего материала при строительстве подводных и наземных сооружений.
Бетон и железобетон: При смешивании цементного раствора с песком, мелким гравием и щебнем получается масса, называемая бетоном. Сооружение из бетона с основой из железных стержней, арматуры и балок называется железобетоном. Бетон и железобетон широко используются в различных областях народного хозяйства.
Keрамика: Изделия, изготовленные из глины, называются керамическими. Сырьем для глиняных (керамических) изделий служат каолиновая глина, песок, мел, доломиты. В настоящее время керамические изделия используются также в приборостроении, электротехнике, радиотехнике. Для этого применяется тонкая керамика. Основным сырьем для тонкой керамики являются специальные смеси, состоящие из талька, глинозема, оксида магния, титановых соединений.
Местные гончарные предприятия и крупные заводы по производству керамических изделий работают по следующей схеме: подготовка целевого сырья → приготовление глины (керамической массы) → формование (придание определенной формы) → сушка → обжиг.
С целью предотвращения проникания воды в поры керамических изделий и загрязнения их покрывают глазурью, для чего в печь бросают поваренную соль. Испаряясь, поваренная соль взаимодействует с оксидом кремния, в результате чего изделия покрываются гладким, стеклообразным слоем, не пропускающим влагу.
Задачи с решением и примеры №2
Задача 1. При нагревании 50 г известняка получено 22 г CaO. Сколько процентов 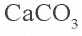
Решение: 1) при нагревании известняка содержащийся в нем 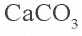
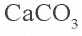
2) в составе 50 г известняка было 39,3 г 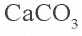
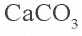
Ответ: 78,5 % 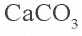
Задача 2. Сколько граммов воды потребуется для приготовления 10 %-ного раствора карбоната натрия из 54 г кристаллической соды
Решение: 1) сколько граммов 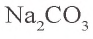
2) сколько граммов воды необходимо для приготовления 10 %-ного раствора карбоната натрия, если в 54 г кристаллической соды содержится 20 г 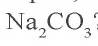
3) если растворить 54 г кристаллической соды в 146 г воды, образуется (54 + 146) 200 г раствора.
Ответ: нужно 146 г воды.
Проверка правильности решения:
1) масса раствора: 54 г + 146 г = 200 г;
2) в 200 г раствора растворено 54 г кристаллической соды. Сколько 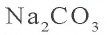
3) нахождение массы растворимого 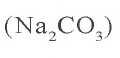
x = 20 г 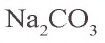
4) в 200 г раствора имеется 20 г растворимого.
Процентная концентрация раствора:
- Углеводороды в химии
- Окислительно-восстановительные реакции
- Оксигенсодержащие органические соединения
- Нитрогенсодержащие органические соединения
- Жиры в химии
- Углеводы в химии
- Амины в химии
- Белки в химии