«Acetic» redirects here. Not to be confused with Ascetic.
|
||
|
||

|
||
| Names | ||
|---|---|---|
| Preferred IUPAC name
Acetic acid[3] |
||
| Systematic IUPAC name
Ethanoic acid |
||
| Other names
Vinegar (when dilute); Hydrogen acetate; Methanecarboxylic acid[1][2] |
||
| Identifiers | ||
|
CAS Number |
|
|
|
3D model (JSmol) |
|
|
| 3DMet |
|
|
| Abbreviations | AcOH | |
|
Beilstein Reference |
506007 | |
| ChEBI |
|
|
| ChEMBL |
|
|
| ChemSpider |
|
|
| DrugBank |
|
|
| ECHA InfoCard | 100.000.528 |
|
| EC Number |
|
|
| E number | E260 (preservatives) | |
|
Gmelin Reference |
1380 | |
|
IUPHAR/BPS |
|
|
| KEGG |
|
|
| MeSH | Acetic+acid | |
|
PubChem CID |
|
|
| RTECS number |
|
|
| UNII |
|
|
| UN number | 2789 | |
|
CompTox Dashboard (EPA) |
|
|
|
InChI
|
||
|
SMILES
|
||
| Properties | ||
|
Chemical formula |
CH3COOH | |
| Molar mass | 60.052 g·mol−1 | |
| Appearance | Colourless liquid | |
| Odor | Heavily vinegar-like | |
| Density | 1.049 g/cm3 (liquid); 1.27 g/cm3 (solid) | |
| Melting point | 16 to 17 °C; 61 to 62 °F; 289 to 290 K | |
| Boiling point | 118 to 119 °C; 244 to 246 °F; 391 to 392 K | |
|
Solubility in water |
Miscible | |
| log P | -0.28[4] | |
| Vapor pressure | 11.6 mmHg (20 °C)[5] | |
| Acidity (pKa) | 4.756 | |
| Conjugate base | Acetate | |
|
Magnetic susceptibility (χ) |
-31.54·10−6 cm3/mol | |
|
Refractive index (nD) |
1.371 (VD = 18.19) | |
| Viscosity | 1.22 mPa s | |
|
Dipole moment |
1.74 D | |
| Thermochemistry | ||
|
Heat capacity (C) |
123.1 J K−1 mol−1 | |
|
Std molar |
158.0 J K−1 mol−1 | |
|
Std enthalpy of |
-483.88–483.16 kJ/mol | |
|
Std enthalpy of |
-875.50–874.82 kJ/mol | |
| Pharmacology | ||
|
ATC code |
G01AD02 (WHO) S02AA10 (WHO) | |
| Hazards | ||
| GHS labelling: | ||
|
Pictograms |
 
|
|
|
Signal word |
Danger | |
|
Hazard statements |
H226, H314 | |
|
Precautionary statements |
P280, P305+P351+P338, P310 | |
| NFPA 704 (fire diamond) |
3 2 0 |
|
| Flash point | 40 °C (104 °F; 313 K) | |
|
Autoignition |
427 °C (801 °F; 700 K) | |
| Explosive limits | 4–16% | |
| Lethal dose or concentration (LD, LC): | ||
|
LD50 (median dose) |
3.31 g kg−1, oral (rat) | |
|
LC50 (median concentration) |
5620 ppm (mouse, 1 hr) 16000 ppm (rat, 4 hr)[7] |
|
| NIOSH (US health exposure limits): | ||
|
PEL (Permissible) |
TWA 10 ppm (25 mg/m3)[6] | |
|
REL (Recommended) |
TWA 10 ppm (25 mg/m3) ST 15 ppm (37 mg/m3)[6] | |
|
IDLH (Immediate danger) |
50 ppm[6] | |
| Related compounds | ||
|
Related carboxylic acids |
Formic acid Propionic acid |
|
|
Related compounds |
Acetaldehyde Acetamide Acetic anhydride Chloroacetic acid Acetyl chloride Glycolic acid Ethyl acetate Potassium acetate Sodium acetate Thioacetic acid |
|
| Supplementary data page | ||
| Acetic acid (data page) | ||
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Acetic acid , systematically named ethanoic acid , is an acidic, colourless liquid and organic compound with the chemical formula CH3COOH (also written as CH3CO2H, C2H4O2, or HC2H3O2). Vinegar is at least 4% acetic acid by volume, making acetic acid the main component of vinegar apart from water and other trace elements.
Acetic acid is the second simplest carboxylic acid (after formic acid). It is an important chemical reagent and industrial chemical, used primarily in the production of cellulose acetate for photographic film, polyvinyl acetate for wood glue, and synthetic fibres and fabrics. In households, diluted acetic acid is often used in descaling agents. In the food industry, acetic acid is controlled by the food additive code E260 as an acidity regulator and as a condiment. In biochemistry, the acetyl group, derived from acetic acid, is fundamental to all forms of life. When bound to coenzyme A, it is central to the metabolism of carbohydrates and fats.
The global demand for acetic acid is about 6.5 million metric tons per year (t/a), of which approximately 1.5 t/a is met by recycling; the remainder is manufactured from methanol.[8] Vinegar is mostly dilute acetic acid, often produced by fermentation and subsequent oxidation of ethanol.
Nomenclature[edit]
The trivial name «acetic acid» is the most commonly used and preferred IUPAC name. The systematic name «ethanoic acid», a valid IUPAC name, is constructed according to the substitutive nomenclature.[9] The name «acetic acid» derives from «acetum», the Latin word for vinegar, and is related to the word «acid» itself.
«Glacial acetic acid» is a name for water-free (anhydrous) acetic acid. Similar to the German name «Eisessig» («ice vinegar»), the name comes from the ice-like crystals that form slightly below room temperature at 16.6 °C (61.9 °F) (the presence of 0.1% water lowers its melting point by 0.2 °C).[10]
A common symbol for acetic acid is AcOH, where Ac is the pseudoelement symbol representing the acetyl group CH3−C(=O)−; the conjugate base, acetate (CH3COO−), is thus represented as AcO−.[11] (The symbol Ac for the acetyl functional group is not to be confused with the symbol Ac for the element actinium; the context prevents confusion among organic chemists). To better reflect its structure, acetic acid is often written as CH3−C(O)OH, CH3−C(=O)OH, CH3COOH, and CH3CO2H. In the context of acid–base reactions, the abbreviation HAc is sometimes used,[12] where Ac in this case is a symbol for acetate (rather than acetyl). Acetate is the ion resulting from loss of H+ from acetic acid. The name «acetate» can also refer to a salt containing this anion, or an ester of acetic acid.[13]
Properties[edit]
Acidity[edit]
The hydrogen centre in the carboxyl group (−COOH) in carboxylic acids such as acetic acid can separate from the molecule by ionization:
- CH3COOH ⇌ CH3CO−2 + H+
Because of this release of the proton (H+), acetic acid has acidic character. Acetic acid is a weak monoprotic acid. In aqueous solution, it has a pKa value of 4.76.[14] Its conjugate base is acetate (CH3COO−). A 1.0 M solution (about the concentration of domestic vinegar) has a pH of 2.4, indicating that merely 0.4% of the acetic acid molecules are dissociated.[a] However, in very dilute (< 10−6 M) solution acetic acid is >90% dissociated.

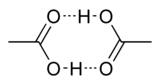
Cyclic dimer of acetic acid; dashed green lines represent hydrogen bonds
Structure[edit]
In solid acetic acid, the molecules form chains, individual molecules being interconnected by hydrogen bonds.[15] In the vapour at 120 °C (248 °F), dimers can be detected. Dimers also occur in the liquid phase in dilute solutions in non-hydrogen-bonding solvents, and a certain extent in pure acetic acid,[16] but are disrupted by hydrogen-bonding solvents. The dissociation enthalpy of the dimer is estimated at 65.0–66.0 kJ/mol, and the dissociation entropy at 154–157 J mol−1 K−1.[17] Other carboxylic acids engage in similar intermolecular hydrogen bonding interactions.[18]
Solvent properties[edit]
Liquid acetic acid is a hydrophilic (polar) protic solvent, similar to ethanol and water. With a relative static permittivity (dielectric constant) of 6.2, it dissolves not only polar compounds such as inorganic salts and sugars, but also non-polar compounds such as oils as well as polar solutes. It is miscible with polar and non-polar solvents such as water, chloroform, and hexane. With higher alkanes (starting with octane), acetic acid is not miscible at all compositions, and solubility of acetic acid in alkanes declines with longer n-alkanes.[19] The solvent and miscibility properties of acetic acid make it a useful industrial chemical, for example, as a solvent in the production of dimethyl terephthalate.[8]
Biochemistry[edit]
At physiological pHs, acetic acid is usually fully ionised to acetate.
The acetyl group, formally derived from acetic acid, is fundamental to all forms of life. When bound to coenzyme A, it is central to the metabolism of carbohydrates and fats. Unlike longer-chain carboxylic acids (the fatty acids), acetic acid does not occur in natural triglycerides. However, the artificial triglyceride triacetin (glycerine triacetate) is a common food additive and is found in cosmetics and topical medicines.[20]
Acetic acid is produced and excreted by acetic acid bacteria, notably the genus Acetobacter and Clostridium acetobutylicum. These bacteria are found universally in foodstuffs, water, and soil, and acetic acid is produced naturally as fruits and other foods spoil. Acetic acid is also a component of the vaginal lubrication of humans and other primates, where it appears to serve as a mild antibacterial agent.[21]
Production[edit]
Purification and concentration plant for acetic acid in 1884
Acetic acid is produced industrially both synthetically and by bacterial fermentation. About 75% of acetic acid made for use in the chemical industry is made by the carbonylation of methanol, explained below.[8] The biological route accounts for only about 10% of world production, but it remains important for the production of vinegar because many food purity laws require vinegar used in foods to be of biological origin. Other processes are methyl formate isomerization, conversion of syngas to acetic acid, and gas phase oxidation of ethylene and ethanol.[22]
Acetic acid can be purified via fractional freezing using an ice bath. The water and other impurities will remain liquid while the acetic acid will precipitate out. As of 2003–2005, total worldwide production of virgin acetic acid[b] was estimated at 5 Mt/a (million tonnes per year), approximately half of which was produced in the United States. European production was approximately 1 Mt/a and declining, while Japanese production was 0.7 Mt/a. Another 1.5 Mt were recycled each year, bringing the total world market to 6.5 Mt/a.[23][24] Since then the global production has increased to 10.7 Mt/a (in 2010), and further; however, a slowing in this increase in production is predicted.[25] The two biggest producers of virgin acetic acid are Celanese and BP Chemicals. Other major producers include Millennium Chemicals, Sterling Chemicals, Samsung, Eastman, and Svensk Etanolkemi [sv].[26]
Methanol carbonylation[edit]
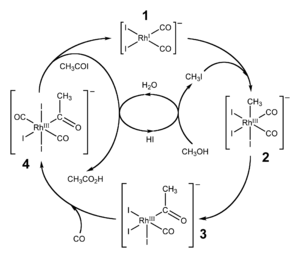
Most acetic acid is produced by methanol carbonylation. In this process, methanol and carbon monoxide react to produce acetic acid according to the equation:
The process involves iodomethane as an intermediate, and occurs in three steps. A catalyst, metal carbonyl, is needed for the carbonylation (step 2).[27]
- CH3OH + HI → CH3I + H2O
- CH3I + CO → CH3COI
- CH3COI + H2O → CH3COOH + HI
Two related processes exist for the carbonylation of methanol: the rhodium-catalyzed Monsanto process, and the iridium-catalyzed Cativa process. The latter process is greener and more efficient[28] and has largely supplanted the former process, often in the same production plants. Catalytic amounts of water are used in both processes, but the Cativa process requires less, so the water-gas shift reaction is suppressed, and fewer by-products are formed.
By altering the process conditions, acetic anhydride may also be produced on the same plant using the rhodium catalysts.[29]
Acetaldehyde oxidation[edit]
Prior to the commercialization of the Monsanto process, most acetic acid was produced by oxidation of acetaldehyde. This remains the second-most-important manufacturing method, although it is usually not competitive with the carbonylation of methanol. The acetaldehyde can be produced by hydration of acetylene. This was the dominant technology in the early 1900s.[30]
Light naphtha components are readily oxidized by oxygen or even air to give peroxides, which decompose to produce acetic acid according to the chemical equation, illustrated with butane:
- 2 C4H10 + 5 O2 → 4 CH3CO2H + 2 H2O
Such oxidations require metal catalyst, such as the naphthenate salts of manganese, cobalt, and chromium.
The typical reaction is conducted at temperatures and pressures designed to be as hot as possible while still keeping the butane a liquid. Typical reaction conditions are 150 °C (302 °F) and 55 atm.[31] Side-products may also form, including butanone, ethyl acetate, formic acid, and propionic acid. These side-products are also commercially valuable, and the reaction conditions may be altered to produce more of them where needed. However, the separation of acetic acid from these by-products adds to the cost of the process.[32]
Under similar conditions and using similar catalysts as are used for butane oxidation, the oxygen in air to produce acetic acid can oxidize acetaldehyde.[32]
- 2 CH3CHO + O2 → 2 CH3CO2H
Using modern catalysts, this reaction can have an acetic acid yield greater than 95%. The major side-products are ethyl acetate, formic acid, and formaldehyde, all of which have lower boiling points than acetic acid and are readily separated by distillation.[32]
Ethylene oxidation[edit]
Acetaldehyde may be prepared from ethylene via the Wacker process, and then oxidised as above.
In more recent times, chemical company Showa Denko, which opened an ethylene oxidation plant in Ōita, Japan, in 1997, commercialised a cheaper single-stage conversion of ethylene to acetic acid.[33] The process is catalyzed by a palladium metal catalyst supported on a heteropoly acid such as silicotungstic acid. A similar process uses the same metal catalyst on silicotungstic acid and silica:[34]
- C2H4 + O2 → CH3CO2H
It is thought to be competitive with methanol carbonylation for smaller plants (100–250 kt/a), depending on the local price of ethylene.
The approach will be based on utilizing a novel selective photocatalytic oxidation technology for the selective oxidation of ethylene and ethane to acetic acid. Unlike traditional oxidation catalysts, the selective oxidation process will use UV light to produce acetic acid at ambient temperatures and pressure.
Oxidative fermentation[edit]
For most of human history, acetic acid bacteria of the genus Acetobacter have made acetic acid, in the form of vinegar. Given sufficient oxygen, these bacteria can produce vinegar from a variety of alcoholic foodstuffs. Commonly used feeds include apple cider, wine, and fermented grain, malt, rice, or potato mashes. The overall chemical reaction facilitated by these bacteria is:
- C2H5OH + O2 → CH3COOH + H2O
A dilute alcohol solution inoculated with Acetobacter and kept in a warm, airy place will become vinegar over the course of a few months. Industrial vinegar-making methods accelerate this process by improving the supply of oxygen to the bacteria.[35]
The first batches of vinegar produced by fermentation probably followed errors in the winemaking process. If must is fermented at too high a temperature, acetobacter will overwhelm the yeast naturally occurring on the grapes. As the demand for vinegar for culinary, medical, and sanitary purposes increased, vintners quickly learned to use other organic materials to produce vinegar in the hot summer months before the grapes were ripe and ready for processing into wine. This method was slow, however, and not always successful, as the vintners did not understand the process.[36]
One of the first modern commercial processes was the «fast method» or «German method», first practised in Germany in 1823. In this process, fermentation takes place in a tower packed with wood shavings or charcoal. The alcohol-containing feed is trickled into the top of the tower, and fresh air supplied from the bottom by either natural or forced convection. The improved air supply in this process cut the time to prepare vinegar from months to weeks.[37]
Nowadays, most vinegar is made in submerged tank culture, first described in 1949 by Otto Hromatka and Heinrich Ebner.[38] In this method, alcohol is fermented to vinegar in a continuously stirred tank, and oxygen is supplied by bubbling air through the solution. Using modern applications of this method, vinegar of 15% acetic acid can be prepared in only 24 hours in batch process, even 20% in 60-hour fed-batch process.[36]
Anaerobic fermentation[edit]
Species of anaerobic bacteria, including members of the genus Clostridium or Acetobacterium can convert sugars to acetic acid directly without creating ethanol as an intermediate. The overall chemical reaction conducted by these bacteria may be represented as:
- C6H12O6 → 3 CH3COOH
These acetogenic bacteria produce acetic acid from one-carbon compounds, including methanol, carbon monoxide, or a mixture of carbon dioxide and hydrogen:
- 2 CO2 + 4 H2 → CH3COOH + 2 H2O
This ability of Clostridium to metabolize sugars directly, or to produce acetic acid from less costly inputs, suggests that these bacteria could produce acetic acid more efficiently than ethanol-oxidizers like Acetobacter. However, Clostridium bacteria are less acid-tolerant than Acetobacter. Even the most acid-tolerant Clostridium strains can produce vinegar in concentrations of only a few per cent, compared to Acetobacter strains that can produce vinegar in concentrations up to 20%. At present, it remains more cost-effective to produce vinegar using Acetobacter, rather than using Clostridium and concentrating it. As a result, although acetogenic bacteria have been known since 1940, their industrial use is confined to a few niche applications.[39]
Uses[edit]
Acetic acid is a chemical reagent for the production of chemical compounds. The largest single use of acetic acid is in the production of vinyl acetate monomer, closely followed by acetic anhydride and ester production. The volume of acetic acid used in vinegar is comparatively small.[8][24]
Vinyl acetate monomer[edit]
The primary use of acetic acid is the production of vinyl acetate monomer (VAM). In 2008, this application was estimated to consume a third of the world’s production of acetic acid.[8] The reaction consists of ethylene and acetic acid with oxygen over a palladium catalyst, conducted in the gas phase.[40]
- 2 H3C−COOH + 2 C2H4 + O2 → 2 H3C−CO−O−CH=CH2 + 2 H2O
Vinyl acetate can be polymerised to polyvinyl acetate or other polymers, which are components in paints and adhesives.[40]
Ester production[edit]
The major esters of acetic acid are commonly used as solvents for inks, paints and coatings. The esters include ethyl acetate, n-butyl acetate, isobutyl acetate, and propyl acetate. They are typically produced by catalyzed reaction from acetic acid and the corresponding alcohol:
- CH3COO−H + HO−R → CH3COO−R + H2O, R = general alkyl group
For example, acetic acid and ethanol gives ethyl acetate and water.
- CH3COO−H + HO−CH2CH3 → CH3COO−CH2CH3 + H2O
Most acetate esters, however, are produced from acetaldehyde using the Tishchenko reaction. In addition, ether acetates are used as solvents for nitrocellulose, acrylic lacquers, varnish removers, and wood stains. First, glycol monoethers are produced from ethylene oxide or propylene oxide with alcohol, which are then esterified with acetic acid. The three major products are ethylene glycol monoethyl ether acetate (EEA), ethylene glycol monobutyl ether acetate (EBA), and propylene glycol monomethyl ether acetate (PMA, more commonly known as PGMEA in semiconductor manufacturing processes, where it is used as a resist solvent). This application consumes about 15% to 20% of worldwide acetic acid. Ether acetates, for example EEA, have been shown to be harmful to human reproduction.[24]
Acetic anhydride[edit]
The product of the condensation of two molecules of acetic acid is acetic anhydride. The worldwide production of acetic anhydride is a major application, and uses approximately 25% to 30% of the global production of acetic acid. The main process involves dehydration of acetic acid to give ketene at 700–750 °C. Ketene is thereafter reacted with acetic acid to obtain the anhydride:[41]
- CH3CO2H → CH2=C=O + H2O
- CH3CO2H + CH2=C=O → (CH3CO)2O
Acetic anhydride is an acetylation agent. As such, its major application is for cellulose acetate, a synthetic textile also used for photographic film. Acetic anhydride is also a reagent for the production of heroin and other compounds.[41]
Use as solvent[edit]
As a polar protic solvent, acetic acid is frequently used for recrystallization to purify organic compounds. Acetic acid is used as a solvent in the production of terephthalic acid (TPA), the raw material for polyethylene terephthalate (PET). In 2006, about 20% of acetic acid was used for TPA production.[24]
Acetic acid is often used as a solvent for reactions involving carbocations, such as Friedel-Crafts alkylation. For example, one stage in the commercial manufacture of synthetic camphor involves a Wagner-Meerwein rearrangement of camphene to isobornyl acetate; here acetic acid acts both as a solvent and as a nucleophile to trap the rearranged carbocation.[42]
Glacial acetic acid is used in analytical chemistry for the estimation of weakly alkaline substances such as organic amides. Glacial acetic acid is a much weaker base than water, so the amide behaves as a strong base in this medium. It then can be titrated using a solution in glacial acetic acid of a very strong acid, such as perchloric acid.[43]
Medical use[edit]
Acetic acid injection into a tumor has been used to treat cancer since the 1800s.[44][45]
Acetic acid is used as part of cervical cancer screening in many areas in the developing world.[46] The acid is applied to the cervix and if an area of white appears after about a minute the test is positive.[46]
Acetic acid is an effective antiseptic when used as a 1% solution, with broad spectrum of activity against streptococci, staphylococci, pseudomonas, enterococci and others.[47][48][49] It may be used to treat skin infections caused by pseudomonas strains resistant to typical antibiotics.[50]
While diluted acetic acid is used in iontophoresis, no high quality evidence supports this treatment for rotator cuff disease.[51][52]
As a treatment for otitis externa, it is on the World Health Organization’s List of Essential Medicines.[53][54]
Foods[edit]
Acetic acid has 349 kcal (1,460 kJ) per 100 g.[55] Vinegar is typically no less than 4% acetic acid by mass.[56][57][58] Legal limits on acetic acid content vary by jurisdiction. Vinegar is used directly as a condiment, and in the pickling of vegetables and other foods. Table vinegar tends to be more diluted (4% to 8% acetic acid), while commercial food pickling employs solutions that are more concentrated. The proportion of acetic acid used worldwide as vinegar is not as large as commercial uses, but is by far the oldest and best-known application.[59]
Reactions[edit]
Organic chemistry[edit]
Two typical organic reactions of acetic acid
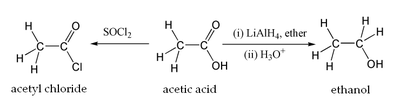
Acetic acid undergoes the typical chemical reactions of a carboxylic acid. Upon treatment with a standard base, it converts to metal acetate and water. With strong bases (e.g., organolithium reagents), it can be doubly deprotonated to give LiCH2COOLi. Reduction of acetic acid gives ethanol. The OH group is the main site of reaction, as illustrated by the conversion of acetic acid to acetyl chloride. Other substitution derivatives include acetic anhydride; this anhydride is produced by loss of water from two molecules of acetic acid. Esters of acetic acid can likewise be formed via Fischer esterification, and amides can be formed. When heated above 440 °C (824 °F), acetic acid decomposes to produce carbon dioxide and methane, or to produce ketene and water:[60][61][62]
- CH3COOH → CH4 + CO2
- CH3COOH → CH2=C=O + H2O
Reactions with inorganic compounds[edit]
Acetic acid is mildly corrosive to metals including iron, magnesium, and zinc, forming hydrogen gas and salts called acetates:
- Mg + 2 CH3COOH → (CH3COO)2Mg + H2
Because aluminium forms a passivating acid-resistant film of aluminium oxide, aluminium tanks are used to transport acetic acid. Metal acetates can also be prepared from acetic acid and an appropriate base, as in the popular «baking soda + vinegar» reaction giving off sodium acetate:
- NaHCO3 + CH3COOH → CH3COONa + CO2 + H2O
A colour reaction for salts of acetic acid is iron(III) chloride solution, which results in a deeply red colour that disappears after acidification.[63] A more sensitive test uses lanthanum nitrate with iodine and ammonia to give a blue solution.[64] Acetates when heated with arsenic trioxide form cacodyl oxide, which can be detected by its malodorous vapours.[65]
Other derivatives[edit]
Organic or inorganic salts are produced from acetic acid. Some commercially significant derivatives:
- Sodium acetate, used in the textile industry and as a food preservative (E262).
- Copper(II) acetate, used as a pigment and a fungicide.
- Aluminium acetate and iron(II) acetate—used as mordants for dyes.
- Palladium(II) acetate, used as a catalyst for organic coupling reactions such as the Heck reaction.
Halogenated acetic acids are produced from acetic acid. Some commercially significant derivatives:
- Chloroacetic acid (monochloroacetic acid, MCA), dichloroacetic acid (considered a by-product), and trichloroacetic acid. MCA is used in the manufacture of indigo dye.
- Bromoacetic acid, which is esterified to produce the reagent ethyl bromoacetate.
- Trifluoroacetic acid, which is a common reagent in organic synthesis.
Amounts of acetic acid used in these other applications together account for another 5–10% of acetic acid use worldwide.[24]
History[edit]
Vinegar was known early in civilization as the natural result of exposure of beer and wine to air, because acetic acid-producing bacteria are present globally. The use of acetic acid in alchemy extends into the third century BC, when the Greek philosopher Theophrastus described how vinegar acted on metals to produce pigments useful in art, including white lead (lead carbonate) and verdigris, a green mixture of copper salts including copper(II) acetate. Ancient Romans boiled soured wine to produce a highly sweet syrup called sapa. Sapa that was produced in lead pots was rich in lead acetate, a sweet substance also called sugar of lead or sugar of Saturn, which contributed to lead poisoning among the Roman aristocracy.[66]
In the 16th-century German alchemist Andreas Libavius described the production of acetone from the dry distillation of lead acetate, ketonic decarboxylation. The presence of water in vinegar has such a profound effect on acetic acid’s properties that for centuries chemists believed that glacial acetic acid and the acid found in vinegar were two different substances. French chemist Pierre Adet proved them identical.[66][67]
Crystallised acetic acid.
In 1845 German chemist Hermann Kolbe synthesised acetic acid from inorganic compounds for the first time. This reaction sequence consisted of chlorination of carbon disulfide to carbon tetrachloride, followed by pyrolysis to tetrachloroethylene and aqueous chlorination to trichloroacetic acid, and concluded with electrolytic reduction to acetic acid.[68]
By 1910, most glacial acetic acid was obtained from the pyroligneous liquor, a product of the distillation of wood. The acetic acid was isolated by treatment with milk of lime, and the resulting calcium acetate was then acidified with sulfuric acid to recover acetic acid. At that time, Germany was producing 10,000 tons of glacial acetic acid, around 30% of which was used for the manufacture of indigo dye.[66][69]
Because both methanol and carbon monoxide are commodity raw materials, methanol carbonylation long appeared to be attractive precursors to acetic acid. Henri Dreyfus at British Celanese developed a methanol carbonylation pilot plant as early as 1925.[70] However, a lack of practical materials that could contain the corrosive reaction mixture at the high pressures needed (200 atm or more) discouraged commercialization of these routes. The first commercial methanol carbonylation process, which used a cobalt catalyst, was developed by German chemical company BASF in 1963. In 1968, a rhodium-based catalyst (cis−[Rh(CO)2I2]−) was discovered that could operate efficiently at lower pressure with almost no by-products. US chemical company Monsanto Company built the first plant using this catalyst in 1970, and rhodium-catalyzed methanol carbonylation became the dominant method of acetic acid production (see Monsanto process). In the late 1990s, the chemicals company BP Chemicals commercialised the Cativa catalyst ([Ir(CO)2I2]−), which is promoted by iridium[71] for greater efficiency. This iridium-catalyzed Cativa process is greener and more efficient[28] and has largely supplanted the Monsanto process, often in the same production plants.
Interstellar medium[edit]
Interstellar acetic acid was discovered in 1996 by a team led by David Mehringer[72] using the former Berkeley-Illinois-Maryland Association array at the Hat Creek Radio Observatory and the former Millimeter Array located at the Owens Valley Radio Observatory. It was first detected in the Sagittarius B2 North molecular cloud (also known as the Sgr B2 Large Molecule Heimat source). Acetic acid has the distinction of being the first molecule discovered in the interstellar medium using solely radio interferometers; in all previous ISM molecular discoveries made in the millimetre and centimetre wavelength regimes, single dish radio telescopes were at least partly responsible for the detections.[72]
Health effects and safety[edit]
Concentrated acetic acid is corrosive to skin.[73][74] These burns or blisters may not appear until hours after exposure.
Prolonged inhalation exposure (eight hours) to acetic acid vapours at 10 ppm can produce some irritation of eyes, nose, and throat; at 100 ppm marked lung irritation and possible damage to lungs, eyes, and skin may result. Vapour concentrations of 1,000 ppm cause marked irritation of eyes, nose and upper respiratory tract and cannot be tolerated. These predictions were based on animal experiments and industrial exposure.
In 12 workers exposed for two or more years to acetic acid airborne average concentration of 51 ppm (estimated), produced symptoms of conjunctive irritation, upper respiratory tract irritation, and hyperkeratotic dermatitis. Exposure to 50 ppm or more is intolerable to most persons and results in intensive lacrimation and irritation of the eyes, nose, and throat, with pharyngeal oedema and chronic bronchitis. Unacclimatised humans experience extreme eye and nasal irritation at concentrations in excess of 25 ppm, and conjunctivitis from concentrations below 10 ppm has been reported. In a study of five workers exposed for seven to 12 years to concentrations of 80 to 200 ppm at peaks, the principal findings were blackening and hyperkeratosis of the skin of the hands, conjunctivitis (but no corneal damage), bronchitis and pharyngitis, and erosion of the exposed teeth (incisors and canines).[75]
The hazards of solutions of acetic acid depend on the concentration. The following table lists the EU classification of acetic acid solutions:[76][citation needed]
| Concentration by weight |
Molarity | GHS pictograms | H-Phrases |
|---|---|---|---|
| 10–25% | 1.67–4.16 mol/L | 
|
H315 |
| 25–90% | 4.16–14.99 mol/L | 
|
H314 |
| >90% | >14.99 mol/L |  
|
H226, H314 |
Concentrated acetic acid can be ignited only with difficulty at standard temperature and pressure, but becomes a flammable risk in temperatures greater than 39 °C (102 °F), and can form explosive mixtures with air at higher temperatures (explosive limits: 5.4–16%).
See also[edit]
- Acetic acid (data page)
- Acids in wine
Notes[edit]
- ^ [H3O+] = 10−2.4 = 0.4%
- ^ Acetic acid that is manufactured by intent, rather than recovered from processing (such as the production of cellulose acetates, polyvinyl alcohol operations, and numerous acetic anhydride acylations).
References[edit]
- ^ Scientific literature reviews on generally recognised as safe (GRAS) food ingredients. National Technical Information Service. 1974. p. 1.
- ^ «Chemistry», volume 5, Encyclopædia Britannica, 1961, page 374
- ^ Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. p. 745. doi:10.1039/9781849733069-00648. ISBN 978-0-85404-182-4.
- ^ «acetic acid_msds».
- ^ Lange’s Handbook of Chemistry, 10th ed.
- ^ a b c NIOSH Pocket Guide to Chemical Hazards. «#0002». National Institute for Occupational Safety and Health (NIOSH).
- ^ «Acetic acid». Immediately Dangerous to Life or Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ^ a b c d e Cheung, Hosea; Tanke, Robin S.; Torrence, G. Paul. «Acetic Acid». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a01_045.pub2.
- ^ IUPAC Provisional Recommendations 2004 Chapter P-12.1; page 4
- ^ Armarego, W.L.F.; Chai, Christina (2009). Purification of Laboratory Chemicals, 6th edition. Butterworth-Heinemann. ISBN 978-1-85617-567-8.
- ^ Cooper, Caroline (9 August 2010). Organic Chemist’s Desk Reference (2 ed.). CRC Press. pp. 102–104. ISBN 978-1-4398-1166-5.
- ^ DeSousa, Luís R. (1995). Common Medical Abbreviations. Cengage Learning. p. 97. ISBN 978-0-8273-6643-5.
- ^ Hendrickson, James B.; Cram, Donald J.; Hammond, George S. (1970). Organic Chemistry (3 ed.). Tokyo: McGraw Hill Kogakusha. p. 135.
- ^ Goldberg, R.; Kishore, N.; Lennen, R. (2002). «Thermodynamic Quantities for the Ionization Reactions of Buffers» (PDF). Journal of Physical and Chemical Reference Data. 31 (2): 231–370. Bibcode:2002JPCRD..31..231G. doi:10.1063/1.1416902. Archived from the original (PDF) on 6 October 2008.
- ^ Jones, R. E.; Templeton, D.H. (1958). «The crystal structure of acetic acid» (PDF). Acta Crystallographica. 11 (7): 484–487. doi:10.1107/S0365110X58001341. hdl:2027/mdp.39015077597907.
- ^ Briggs, James M.; Toan B. Nguyen; William L. Jorgensen (1991). «Monte Carlo simulations of liquid acetic acid and methyl acetate with the OPLS potential functions». Journal of Physical Chemistry. 95 (8): 3315–3322. doi:10.1021/j100161a065.
- ^ Togeas, James B. (2005). «Acetic Acid Vapor: 2. A Statistical Mechanical Critique of Vapor Density Experiments». Journal of Physical Chemistry A. 109 (24): 5438–5444. Bibcode:2005JPCA..109.5438T. doi:10.1021/jp058004j. PMID 16839071.
- ^ McMurry, John (2000). Organic Chemistry (5 ed.). Brooks/Cole. p. 818. ISBN 978-0-534-37366-5.
- ^ Zieborak, K.; Olszewski, K. (1958). Bulletin de l’Académie Polonaise des Sciences, Série des Sciences Chimiques, Géologiques et Géographiques. 6 (2): 3315–3322.
{{cite journal}}: CS1 maint: untitled periodical (link) - ^ Fiume, M. Z.; Cosmetic Ingredients Review Expert Panel (June 2003). «Final report on the safety assessment of triacetin». International Journal of Toxicology. 22 (Suppl 2): 1–10. doi:10.1080/747398359. PMID 14555416.
- ^ Buckingham, J., ed. (1996). Dictionary of Organic Compounds. Vol. 1 (6th ed.). London: Chapman & Hall. ISBN 978-0-412-54090-5.
- ^ Yoneda, Noriyuki; Kusano, Satoru; Yasui, Makoto; Pujado, Peter; Wilcher, Steve (2001). «Recent advances in processes and catalysts for the production of acetic acid». Applied Catalysis A: General. 221 (1–2): 253–265. doi:10.1016/S0926-860X(01)00800-6.
- ^ «Production report». Chemical & Engineering News: 67–76. 11 July 2005.
- ^ a b c d e Malveda, Michael; Funada, Chiyo (2003). «Acetic Acid». Chemicals Economic Handbook. SRI International. p. 602.5000. Archived from the original on 14 October 2011.
- ^ Acetic Acid. SRI Consulting.
- ^ «Reportlinker Adds Global Acetic Acid Market Analysis and Forecasts». Market Research Database. June 2014. p. contents.
- ^ Yoneda, N.; Kusano, S.; Yasui, M.; Pujado, P.; Wilcher, S. (2001). «Recent advances in processes and catalysts for the production of acetic acid». Applied Catalysis A: General. 221 (1–2): 253–265. doi:10.1016/S0926-860X(01)00800-6.
- ^ a b Lancaster, Mike (2002). Green Chemistry, an Introductory Text. Cambridge: Royal Society of Chemistry. pp. 262–266. ISBN 978-0-85404-620-1.
- ^ Zoeller, J. R.; Agreda, V. H.; Cook, S. L.; Lafferty, N. L.; Polichnowski, S. W.; Pond, D. M. (1992). «Eastman Chemical Company Acetic Anhydride Process». Catalysis Today. 13 (1): 73–91. doi:10.1016/0920-5861(92)80188-S.
- ^ Hintermann, Lukas; Labonne, Aurélie (2007). «Catalytic Hydration of Alkynes and Its Application in Synthesis». Synthesis. 2007 (8): 1121. doi:10.1055/s-2007-966002.
- ^ Chenier, Philip J. (2002). Survey of Industrial Chemistry (3 ed.). Springer. p. 151. ISBN 978-0-306-47246-6.
- ^ a b c Sano, Ken‐ichi; Uchida, Hiroshi; Wakabayashi, Syoichirou (1999). «A new process for acetic acid production by direct oxidation of ethylene». Catalysis Surveys from Japan. 3 (1): 55–60. doi:10.1023/A:1019003230537. ISSN 1384-6574. S2CID 93855717.
- ^ Sano, Ken-ichi; Uchida, Hiroshi; Wakabayashi, Syoichirou (1999). «A new process for acetic acid production by direct oxidation of ethylene». Catalyst Surveys from Japan. 3: 66–60. doi:10.1023/A:1019003230537. S2CID 93855717.
- ^ Misono, Makoto (2009). «Recent progress in the practical applications of heteropolyacid and perovskite catalysts: Catalytic technology for the sustainable society». Catalysis Today. 144 (3–4): 285–291. doi:10.1016/j.cattod.2008.10.054.
- ^ Chotani, Gopal K.; Gaertner, Alfred L.; Arbige, Michael V.; Dodge, Timothy C. (2007). «Industrial Biotechnology: Discovery to Delivery». Kent and Riegel’s Handbook of Industrial Chemistry and Biotechnology. Kent and Riegel’s Handbook of Industrial Chemistry and Biotechnology. Springer. pp. 32–34. Bibcode:2007karh.book……. ISBN 978-0-387-27842-1.
- ^ a b Hromatka, Otto; Ebner, Heinrich (1959). «Vinegar by Submerged Oxidative Fermentation». Industrial & Engineering Chemistry. 51 (10): 1279–1280. doi:10.1021/ie50598a033.
- ^ Partridge, Everett P. (1931). «Acetic Acid and Cellulose Acetate in the United States A General Survey of Economic and Technical Developments». Industrial & Engineering Chemistry. 23 (5): 482–498. doi:10.1021/ie50257a005.
- ^ Hromatka, O.; Ebner, H. (1949). «Investigations on vinegar fermentation: Generator for vinegar fermentation and aeration procedures». Enzymologia. 13: 369.
- ^ Sim, Jia Huey; Kamaruddin, Azlina Harun; Long, Wei Sing; Najafpour, Ghasem (2007). «Clostridium aceticum—A potential organism in catalyzing carbon monoxide to acetic acid: Application of response surface methodology». Enzyme and Microbial Technology. 40 (5): 1234–1243. doi:10.1016/j.enzmictec.2006.09.017.
- ^ a b Roscher, Günter. «Vinyl Esters». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a27_419.
- ^ a b Held, Heimo; Rengstl, Alfred; Mayer, Dieter. «Acetic Anhydride and Mixed Fatty Acid Anhydrides». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a01_065.
- ^ Sell, Charles S. (2006). «4.2.15 Bicyclic Monoterpenoids». The Chemistry of Fragrances: From Perfumer to Consumer. RSC Paperbacks Series. Vol. 38 (2 ed.). Great Britain: Royal Society of Chemistry. p. 80. ISBN 978-0-85404-824-3.
- ^ Felgner, Andrea. «Determination of Water Content in Perchloric acid 0,1 mol/L in acetic acid Using Karl Fischer Titration». Sigma-Aldrich. Retrieved 27 July 2017.
- ^ Barclay, John (1866). «Injection of Acetic Acid in Cancer». Br Med J. 2 (305): 512. doi:10.1136/bmj.2.305.512-a. PMC 2310334.
- ^ Shibata N. (1998). «Percutaneous ethanol and acetic acid injection for liver metastasis from colon cancer». Gan to Kagaku Ryoho. 25 (5): 751–5. PMID 9571976.
- ^ a b Fokom-Domgue, J.; Combescure, C.; Fokom-Defo, V.; Tebeu, P. M.; Vassilakos, P.; Kengne, A. P.; Petignat, P. (3 July 2015). «Performance of alternative strategies for primary cervical cancer screening in sub-Saharan Africa: systematic review and meta-analysis of diagnostic test accuracy studies». BMJ (Clinical Research Ed.). 351: h3084. doi:10.1136/bmj.h3084. PMC 4490835. PMID 26142020.
- ^ Madhusudhan, V. L. (8 April 2015). «Efficacy of 1% acetic acid in the treatment of chronic wounds infected with Pseudomonas aeruginosa: prospective randomised controlled clinical trial». International Wound Journal. 13 (6): 1129–1136. doi:10.1111/iwj.12428. ISSN 1742-481X. PMC 7949569. PMID 25851059. S2CID 4767974.
- ^ Ryssel, H.; Kloeters, O.; Germann, G.; Schäfer, Th; Wiedemann, G.; Oehlbauer, M. (1 August 2009). «The antimicrobial effect of acetic acid—an alternative to common local antiseptics?». Burns. 35 (5): 695–700. doi:10.1016/j.burns.2008.11.009. ISSN 1879-1409. PMID 19286325.
- ^ «Antiseptics on Wounds: An Area of Controversy». www.medscape.com. Retrieved 15 August 2016.
- ^ Nagoba, B. S.; Selkar, S. P.; Wadher, B. J.; Gandhi, R. C. (December 2013). «Acetic acid treatment of pseudomonal wound infections—a review». Journal of Infection and Public Health. 6 (6): 410–5. doi:10.1016/j.jiph.2013.05.005. PMID 23999348.
- ^ Page, M. J.; Green, S.; Mrocki, M. A.; Surace, S. J.; Deitch, J.; McBain, B.; Lyttle, N.; Buchbinder, R. (10 June 2016). «Electrotherapy modalities for rotator cuff disease». The Cochrane Database of Systematic Reviews. 2016 (6): CD012225. doi:10.1002/14651858.CD012225. PMC 8570637. PMID 27283591.
- ^ Habif, Thomas P. (2009). Clinical Dermatology (5 ed.). Elsevier Health Sciences. p. 367. ISBN 978-0-323-08037-8.
- ^ World Health Organization (2019). World Health Organization model list of essential medicines: 21st list 2019. Geneva: World Health Organization. hdl:10665/325771. WHO/MVP/EMP/IAU/2019.06. License: CC BY-NC-SA 3.0 IGO.
- ^ World Health Organization (2021). World Health Organization model list of essential medicines: 22nd list (2021). Geneva: World Health Organization. hdl:10665/345533. WHO/MHP/HPS/EML/2021.02.
- ^ Greenfield, Heather; Southgate, D.A.T. (2003). Food Composition Data: Production, Management and Use. Rome: FAO. p. 146. ISBN 9789251049495.
- ^ «CPG Sec. 525.825 Vinegar, Definitions» (PDF). United States Food and Drug Administration. March 1995.
- ^ «Departmental Consolidation of the Food and Drugs Act and the Food and Drug Regulations – Part B – Division 19» (PDF). Health Canada. August 2018. p. 591.
- ^ «Commission Regulation (EU) 2016/263». Official Journal of the European Union. European Commission. February 2016.
- ^ Bernthsen, A.; Sudborough, J. J. (1922). Organic Chemistry. London: Blackie and Son. p. 155.
- ^ Blake, P. G.; Jackson, G. E. (1968). «The thermal decomposition of acetic acid». Journal of the Chemical Society B: Physical Organic: 1153–1155. doi:10.1039/J29680001153.
- ^ Bamford, C. H.; Dewar, M. J. S. (1949). «608. The thermal decomposition of acetic acid». Journal of the Chemical Society: 2877. doi:10.1039/JR9490002877.
- ^ Duan, Xiaofeng; Page, Michael (1995). «Theoretical Investigation of Competing Mechanisms in the Thermal Unimolecular Decomposition of Acetic Acid and the Hydration Reaction of Ketene». Journal of the American Chemical Society. 117 (18): 5114–5119. doi:10.1021/ja00123a013. ISSN 0002-7863.
- ^ Charlot, G.; Murray, R. G. (1954). Qualitative Inorganic Analysis (4 ed.). CUP Archive. p. 110.
- ^ Neelakantam, K.; Row, L Ramachangra (1940). «The Lanthanum Nitrate Test for Acetatein Inorganic Qualitative Analysis» (PDF). Retrieved 5 June 2013.
- ^ Brantley, L. R.; Cromwell, T. M.; Mead, J. F. (1947). «Detection of acetate ion by the reaction with arsenious oxide to form cacodyl oxide». Journal of Chemical Education. 24 (7): 353. Bibcode:1947JChEd..24..353B. doi:10.1021/ed024p353. ISSN 0021-9584.
- ^ a b c Martin, Geoffrey (1917). Industrial and Manufacturing Chemistry (Part 1, Organic ed.). London: Crosby Lockwood. pp. 330–331.
- ^ Adet, P. A. (1798). «Mémoire sur l’acide acétique (Memoir on acetic acid)». Annales de Chimie. 27: 299–319.
- ^ Goldwhite, Harold (September 2003). «This month in chemical history» (PDF). New Haven Section Bulletin American Chemical Society. 20 (3): 4. Archived from the original (PDF) on 4 March 2009.
- ^ Schweppe, Helmut (1979). «Identification of dyes on old textiles». Journal of the American Institute for Conservation. 19 (1/3): 14–23. doi:10.2307/3179569. JSTOR 3179569. Archived from the original on 29 May 2009. Retrieved 12 October 2005.
- ^ Wagner, Frank S. (1978). «Acetic acid». In Grayson, Martin (ed.). Kirk-Othmer Encyclopedia of Chemical Technology (3rd ed.). New York: John Wiley & Sons.
- ^ Industrial Organic Chemicals, Harold A. Wittcoff, Bryan G. Reuben, Jeffery S. Plotkin
- ^ a b Mehringer, David M.; et al. (1997). «Detection and Confirmation of Interstellar Acetic Acid». Astrophysical Journal Letters. 480 (1): L71. Bibcode:1997ApJ…480L..71M. doi:10.1086/310612.
- ^ «ICSC 0363 – ACETIC ACID». International Programme on Chemical Safety. 5 June 2010.
- ^ «Occupational Safety and Health Guideline for Acetic Acid» (PDF). Centers for Disease Control and Prevention. Retrieved 8 May 2013.
- ^ Sherertz, Peter C. (1 June 1994). Acetic Acid (PDF). Virginia Department of Health Division of Health Hazards Control. Archived from the original (PDF) on 4 March 2016.
- ^ «Details». hcis.safeworkaustralia.gov.au.
External links[edit]
Look up acetic in Wiktionary, the free dictionary.
- International Chemical Safety Card 0363
- National Pollutant Inventory – Acetic acid fact sheet
- NIOSH Pocket Guide to Chemical Hazards
- Method for sampling and analysis
- 29 CFR 1910.1000, Table Z-1 (US Permissible exposure limits)
- ChemSub Online: Acetic acid
- Calculation of vapor pressure, liquid density, dynamic liquid viscosity, surface tension of acetic acid
- Acetic acid bound to proteins in the PDB
- Swedish Chemicals Agency. Information sheet – Acetic Acid
- Process Flow sheet of Acetic acid Production by the Carbonylation of Methanol
«Acetic» redirects here. Not to be confused with Ascetic.
|
||
|
||

|
||
| Names | ||
|---|---|---|
| Preferred IUPAC name
Acetic acid[3] |
||
| Systematic IUPAC name
Ethanoic acid |
||
| Other names
Vinegar (when dilute); Hydrogen acetate; Methanecarboxylic acid[1][2] |
||
| Identifiers | ||
|
CAS Number |
|
|
|
3D model (JSmol) |
|
|
| 3DMet |
|
|
| Abbreviations | AcOH | |
|
Beilstein Reference |
506007 | |
| ChEBI |
|
|
| ChEMBL |
|
|
| ChemSpider |
|
|
| DrugBank |
|
|
| ECHA InfoCard | 100.000.528 |
|
| EC Number |
|
|
| E number | E260 (preservatives) | |
|
Gmelin Reference |
1380 | |
|
IUPHAR/BPS |
|
|
| KEGG |
|
|
| MeSH | Acetic+acid | |
|
PubChem CID |
|
|
| RTECS number |
|
|
| UNII |
|
|
| UN number | 2789 | |
|
CompTox Dashboard (EPA) |
|
|
|
InChI
|
||
|
SMILES
|
||
| Properties | ||
|
Chemical formula |
CH3COOH | |
| Molar mass | 60.052 g·mol−1 | |
| Appearance | Colourless liquid | |
| Odor | Heavily vinegar-like | |
| Density | 1.049 g/cm3 (liquid); 1.27 g/cm3 (solid) | |
| Melting point | 16 to 17 °C; 61 to 62 °F; 289 to 290 K | |
| Boiling point | 118 to 119 °C; 244 to 246 °F; 391 to 392 K | |
|
Solubility in water |
Miscible | |
| log P | -0.28[4] | |
| Vapor pressure | 11.6 mmHg (20 °C)[5] | |
| Acidity (pKa) | 4.756 | |
| Conjugate base | Acetate | |
|
Magnetic susceptibility (χ) |
-31.54·10−6 cm3/mol | |
|
Refractive index (nD) |
1.371 (VD = 18.19) | |
| Viscosity | 1.22 mPa s | |
|
Dipole moment |
1.74 D | |
| Thermochemistry | ||
|
Heat capacity (C) |
123.1 J K−1 mol−1 | |
|
Std molar |
158.0 J K−1 mol−1 | |
|
Std enthalpy of |
-483.88–483.16 kJ/mol | |
|
Std enthalpy of |
-875.50–874.82 kJ/mol | |
| Pharmacology | ||
|
ATC code |
G01AD02 (WHO) S02AA10 (WHO) | |
| Hazards | ||
| GHS labelling: | ||
|
Pictograms |
 
|
|
|
Signal word |
Danger | |
|
Hazard statements |
H226, H314 | |
|
Precautionary statements |
P280, P305+P351+P338, P310 | |
| NFPA 704 (fire diamond) |
3 2 0 |
|
| Flash point | 40 °C (104 °F; 313 K) | |
|
Autoignition |
427 °C (801 °F; 700 K) | |
| Explosive limits | 4–16% | |
| Lethal dose or concentration (LD, LC): | ||
|
LD50 (median dose) |
3.31 g kg−1, oral (rat) | |
|
LC50 (median concentration) |
5620 ppm (mouse, 1 hr) 16000 ppm (rat, 4 hr)[7] |
|
| NIOSH (US health exposure limits): | ||
|
PEL (Permissible) |
TWA 10 ppm (25 mg/m3)[6] | |
|
REL (Recommended) |
TWA 10 ppm (25 mg/m3) ST 15 ppm (37 mg/m3)[6] | |
|
IDLH (Immediate danger) |
50 ppm[6] | |
| Related compounds | ||
|
Related carboxylic acids |
Formic acid Propionic acid |
|
|
Related compounds |
Acetaldehyde Acetamide Acetic anhydride Chloroacetic acid Acetyl chloride Glycolic acid Ethyl acetate Potassium acetate Sodium acetate Thioacetic acid |
|
| Supplementary data page | ||
| Acetic acid (data page) | ||
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Acetic acid , systematically named ethanoic acid , is an acidic, colourless liquid and organic compound with the chemical formula CH3COOH (also written as CH3CO2H, C2H4O2, or HC2H3O2). Vinegar is at least 4% acetic acid by volume, making acetic acid the main component of vinegar apart from water and other trace elements.
Acetic acid is the second simplest carboxylic acid (after formic acid). It is an important chemical reagent and industrial chemical, used primarily in the production of cellulose acetate for photographic film, polyvinyl acetate for wood glue, and synthetic fibres and fabrics. In households, diluted acetic acid is often used in descaling agents. In the food industry, acetic acid is controlled by the food additive code E260 as an acidity regulator and as a condiment. In biochemistry, the acetyl group, derived from acetic acid, is fundamental to all forms of life. When bound to coenzyme A, it is central to the metabolism of carbohydrates and fats.
The global demand for acetic acid is about 6.5 million metric tons per year (t/a), of which approximately 1.5 t/a is met by recycling; the remainder is manufactured from methanol.[8] Vinegar is mostly dilute acetic acid, often produced by fermentation and subsequent oxidation of ethanol.
Nomenclature[edit]
The trivial name «acetic acid» is the most commonly used and preferred IUPAC name. The systematic name «ethanoic acid», a valid IUPAC name, is constructed according to the substitutive nomenclature.[9] The name «acetic acid» derives from «acetum», the Latin word for vinegar, and is related to the word «acid» itself.
«Glacial acetic acid» is a name for water-free (anhydrous) acetic acid. Similar to the German name «Eisessig» («ice vinegar»), the name comes from the ice-like crystals that form slightly below room temperature at 16.6 °C (61.9 °F) (the presence of 0.1% water lowers its melting point by 0.2 °C).[10]
A common symbol for acetic acid is AcOH, where Ac is the pseudoelement symbol representing the acetyl group CH3−C(=O)−; the conjugate base, acetate (CH3COO−), is thus represented as AcO−.[11] (The symbol Ac for the acetyl functional group is not to be confused with the symbol Ac for the element actinium; the context prevents confusion among organic chemists). To better reflect its structure, acetic acid is often written as CH3−C(O)OH, CH3−C(=O)OH, CH3COOH, and CH3CO2H. In the context of acid–base reactions, the abbreviation HAc is sometimes used,[12] where Ac in this case is a symbol for acetate (rather than acetyl). Acetate is the ion resulting from loss of H+ from acetic acid. The name «acetate» can also refer to a salt containing this anion, or an ester of acetic acid.[13]
Properties[edit]
Acidity[edit]
The hydrogen centre in the carboxyl group (−COOH) in carboxylic acids such as acetic acid can separate from the molecule by ionization:
- CH3COOH ⇌ CH3CO−2 + H+
Because of this release of the proton (H+), acetic acid has acidic character. Acetic acid is a weak monoprotic acid. In aqueous solution, it has a pKa value of 4.76.[14] Its conjugate base is acetate (CH3COO−). A 1.0 M solution (about the concentration of domestic vinegar) has a pH of 2.4, indicating that merely 0.4% of the acetic acid molecules are dissociated.[a] However, in very dilute (< 10−6 M) solution acetic acid is >90% dissociated.

Cyclic dimer of acetic acid; dashed green lines represent hydrogen bonds
Structure[edit]
In solid acetic acid, the molecules form chains, individual molecules being interconnected by hydrogen bonds.[15] In the vapour at 120 °C (248 °F), dimers can be detected. Dimers also occur in the liquid phase in dilute solutions in non-hydrogen-bonding solvents, and a certain extent in pure acetic acid,[16] but are disrupted by hydrogen-bonding solvents. The dissociation enthalpy of the dimer is estimated at 65.0–66.0 kJ/mol, and the dissociation entropy at 154–157 J mol−1 K−1.[17] Other carboxylic acids engage in similar intermolecular hydrogen bonding interactions.[18]
Solvent properties[edit]
Liquid acetic acid is a hydrophilic (polar) protic solvent, similar to ethanol and water. With a relative static permittivity (dielectric constant) of 6.2, it dissolves not only polar compounds such as inorganic salts and sugars, but also non-polar compounds such as oils as well as polar solutes. It is miscible with polar and non-polar solvents such as water, chloroform, and hexane. With higher alkanes (starting with octane), acetic acid is not miscible at all compositions, and solubility of acetic acid in alkanes declines with longer n-alkanes.[19] The solvent and miscibility properties of acetic acid make it a useful industrial chemical, for example, as a solvent in the production of dimethyl terephthalate.[8]
Biochemistry[edit]
At physiological pHs, acetic acid is usually fully ionised to acetate.
The acetyl group, formally derived from acetic acid, is fundamental to all forms of life. When bound to coenzyme A, it is central to the metabolism of carbohydrates and fats. Unlike longer-chain carboxylic acids (the fatty acids), acetic acid does not occur in natural triglycerides. However, the artificial triglyceride triacetin (glycerine triacetate) is a common food additive and is found in cosmetics and topical medicines.[20]
Acetic acid is produced and excreted by acetic acid bacteria, notably the genus Acetobacter and Clostridium acetobutylicum. These bacteria are found universally in foodstuffs, water, and soil, and acetic acid is produced naturally as fruits and other foods spoil. Acetic acid is also a component of the vaginal lubrication of humans and other primates, where it appears to serve as a mild antibacterial agent.[21]
Production[edit]
Purification and concentration plant for acetic acid in 1884
Acetic acid is produced industrially both synthetically and by bacterial fermentation. About 75% of acetic acid made for use in the chemical industry is made by the carbonylation of methanol, explained below.[8] The biological route accounts for only about 10% of world production, but it remains important for the production of vinegar because many food purity laws require vinegar used in foods to be of biological origin. Other processes are methyl formate isomerization, conversion of syngas to acetic acid, and gas phase oxidation of ethylene and ethanol.[22]
Acetic acid can be purified via fractional freezing using an ice bath. The water and other impurities will remain liquid while the acetic acid will precipitate out. As of 2003–2005, total worldwide production of virgin acetic acid[b] was estimated at 5 Mt/a (million tonnes per year), approximately half of which was produced in the United States. European production was approximately 1 Mt/a and declining, while Japanese production was 0.7 Mt/a. Another 1.5 Mt were recycled each year, bringing the total world market to 6.5 Mt/a.[23][24] Since then the global production has increased to 10.7 Mt/a (in 2010), and further; however, a slowing in this increase in production is predicted.[25] The two biggest producers of virgin acetic acid are Celanese and BP Chemicals. Other major producers include Millennium Chemicals, Sterling Chemicals, Samsung, Eastman, and Svensk Etanolkemi [sv].[26]
Methanol carbonylation[edit]
Most acetic acid is produced by methanol carbonylation. In this process, methanol and carbon monoxide react to produce acetic acid according to the equation:
The process involves iodomethane as an intermediate, and occurs in three steps. A catalyst, metal carbonyl, is needed for the carbonylation (step 2).[27]
- CH3OH + HI → CH3I + H2O
- CH3I + CO → CH3COI
- CH3COI + H2O → CH3COOH + HI
Two related processes exist for the carbonylation of methanol: the rhodium-catalyzed Monsanto process, and the iridium-catalyzed Cativa process. The latter process is greener and more efficient[28] and has largely supplanted the former process, often in the same production plants. Catalytic amounts of water are used in both processes, but the Cativa process requires less, so the water-gas shift reaction is suppressed, and fewer by-products are formed.
By altering the process conditions, acetic anhydride may also be produced on the same plant using the rhodium catalysts.[29]
Acetaldehyde oxidation[edit]
Prior to the commercialization of the Monsanto process, most acetic acid was produced by oxidation of acetaldehyde. This remains the second-most-important manufacturing method, although it is usually not competitive with the carbonylation of methanol. The acetaldehyde can be produced by hydration of acetylene. This was the dominant technology in the early 1900s.[30]
Light naphtha components are readily oxidized by oxygen or even air to give peroxides, which decompose to produce acetic acid according to the chemical equation, illustrated with butane:
- 2 C4H10 + 5 O2 → 4 CH3CO2H + 2 H2O
Such oxidations require metal catalyst, such as the naphthenate salts of manganese, cobalt, and chromium.
The typical reaction is conducted at temperatures and pressures designed to be as hot as possible while still keeping the butane a liquid. Typical reaction conditions are 150 °C (302 °F) and 55 atm.[31] Side-products may also form, including butanone, ethyl acetate, formic acid, and propionic acid. These side-products are also commercially valuable, and the reaction conditions may be altered to produce more of them where needed. However, the separation of acetic acid from these by-products adds to the cost of the process.[32]
Under similar conditions and using similar catalysts as are used for butane oxidation, the oxygen in air to produce acetic acid can oxidize acetaldehyde.[32]
- 2 CH3CHO + O2 → 2 CH3CO2H
Using modern catalysts, this reaction can have an acetic acid yield greater than 95%. The major side-products are ethyl acetate, formic acid, and formaldehyde, all of which have lower boiling points than acetic acid and are readily separated by distillation.[32]
Ethylene oxidation[edit]
Acetaldehyde may be prepared from ethylene via the Wacker process, and then oxidised as above.
In more recent times, chemical company Showa Denko, which opened an ethylene oxidation plant in Ōita, Japan, in 1997, commercialised a cheaper single-stage conversion of ethylene to acetic acid.[33] The process is catalyzed by a palladium metal catalyst supported on a heteropoly acid such as silicotungstic acid. A similar process uses the same metal catalyst on silicotungstic acid and silica:[34]
- C2H4 + O2 → CH3CO2H
It is thought to be competitive with methanol carbonylation for smaller plants (100–250 kt/a), depending on the local price of ethylene.
The approach will be based on utilizing a novel selective photocatalytic oxidation technology for the selective oxidation of ethylene and ethane to acetic acid. Unlike traditional oxidation catalysts, the selective oxidation process will use UV light to produce acetic acid at ambient temperatures and pressure.
Oxidative fermentation[edit]
For most of human history, acetic acid bacteria of the genus Acetobacter have made acetic acid, in the form of vinegar. Given sufficient oxygen, these bacteria can produce vinegar from a variety of alcoholic foodstuffs. Commonly used feeds include apple cider, wine, and fermented grain, malt, rice, or potato mashes. The overall chemical reaction facilitated by these bacteria is:
- C2H5OH + O2 → CH3COOH + H2O
A dilute alcohol solution inoculated with Acetobacter and kept in a warm, airy place will become vinegar over the course of a few months. Industrial vinegar-making methods accelerate this process by improving the supply of oxygen to the bacteria.[35]
The first batches of vinegar produced by fermentation probably followed errors in the winemaking process. If must is fermented at too high a temperature, acetobacter will overwhelm the yeast naturally occurring on the grapes. As the demand for vinegar for culinary, medical, and sanitary purposes increased, vintners quickly learned to use other organic materials to produce vinegar in the hot summer months before the grapes were ripe and ready for processing into wine. This method was slow, however, and not always successful, as the vintners did not understand the process.[36]
One of the first modern commercial processes was the «fast method» or «German method», first practised in Germany in 1823. In this process, fermentation takes place in a tower packed with wood shavings or charcoal. The alcohol-containing feed is trickled into the top of the tower, and fresh air supplied from the bottom by either natural or forced convection. The improved air supply in this process cut the time to prepare vinegar from months to weeks.[37]
Nowadays, most vinegar is made in submerged tank culture, first described in 1949 by Otto Hromatka and Heinrich Ebner.[38] In this method, alcohol is fermented to vinegar in a continuously stirred tank, and oxygen is supplied by bubbling air through the solution. Using modern applications of this method, vinegar of 15% acetic acid can be prepared in only 24 hours in batch process, even 20% in 60-hour fed-batch process.[36]
Anaerobic fermentation[edit]
Species of anaerobic bacteria, including members of the genus Clostridium or Acetobacterium can convert sugars to acetic acid directly without creating ethanol as an intermediate. The overall chemical reaction conducted by these bacteria may be represented as:
- C6H12O6 → 3 CH3COOH
These acetogenic bacteria produce acetic acid from one-carbon compounds, including methanol, carbon monoxide, or a mixture of carbon dioxide and hydrogen:
- 2 CO2 + 4 H2 → CH3COOH + 2 H2O
This ability of Clostridium to metabolize sugars directly, or to produce acetic acid from less costly inputs, suggests that these bacteria could produce acetic acid more efficiently than ethanol-oxidizers like Acetobacter. However, Clostridium bacteria are less acid-tolerant than Acetobacter. Even the most acid-tolerant Clostridium strains can produce vinegar in concentrations of only a few per cent, compared to Acetobacter strains that can produce vinegar in concentrations up to 20%. At present, it remains more cost-effective to produce vinegar using Acetobacter, rather than using Clostridium and concentrating it. As a result, although acetogenic bacteria have been known since 1940, their industrial use is confined to a few niche applications.[39]
Uses[edit]
Acetic acid is a chemical reagent for the production of chemical compounds. The largest single use of acetic acid is in the production of vinyl acetate monomer, closely followed by acetic anhydride and ester production. The volume of acetic acid used in vinegar is comparatively small.[8][24]
Vinyl acetate monomer[edit]
The primary use of acetic acid is the production of vinyl acetate monomer (VAM). In 2008, this application was estimated to consume a third of the world’s production of acetic acid.[8] The reaction consists of ethylene and acetic acid with oxygen over a palladium catalyst, conducted in the gas phase.[40]
- 2 H3C−COOH + 2 C2H4 + O2 → 2 H3C−CO−O−CH=CH2 + 2 H2O
Vinyl acetate can be polymerised to polyvinyl acetate or other polymers, which are components in paints and adhesives.[40]
Ester production[edit]
The major esters of acetic acid are commonly used as solvents for inks, paints and coatings. The esters include ethyl acetate, n-butyl acetate, isobutyl acetate, and propyl acetate. They are typically produced by catalyzed reaction from acetic acid and the corresponding alcohol:
- CH3COO−H + HO−R → CH3COO−R + H2O, R = general alkyl group
For example, acetic acid and ethanol gives ethyl acetate and water.
- CH3COO−H + HO−CH2CH3 → CH3COO−CH2CH3 + H2O
Most acetate esters, however, are produced from acetaldehyde using the Tishchenko reaction. In addition, ether acetates are used as solvents for nitrocellulose, acrylic lacquers, varnish removers, and wood stains. First, glycol monoethers are produced from ethylene oxide or propylene oxide with alcohol, which are then esterified with acetic acid. The three major products are ethylene glycol monoethyl ether acetate (EEA), ethylene glycol monobutyl ether acetate (EBA), and propylene glycol monomethyl ether acetate (PMA, more commonly known as PGMEA in semiconductor manufacturing processes, where it is used as a resist solvent). This application consumes about 15% to 20% of worldwide acetic acid. Ether acetates, for example EEA, have been shown to be harmful to human reproduction.[24]
Acetic anhydride[edit]
The product of the condensation of two molecules of acetic acid is acetic anhydride. The worldwide production of acetic anhydride is a major application, and uses approximately 25% to 30% of the global production of acetic acid. The main process involves dehydration of acetic acid to give ketene at 700–750 °C. Ketene is thereafter reacted with acetic acid to obtain the anhydride:[41]
- CH3CO2H → CH2=C=O + H2O
- CH3CO2H + CH2=C=O → (CH3CO)2O
Acetic anhydride is an acetylation agent. As such, its major application is for cellulose acetate, a synthetic textile also used for photographic film. Acetic anhydride is also a reagent for the production of heroin and other compounds.[41]
Use as solvent[edit]
As a polar protic solvent, acetic acid is frequently used for recrystallization to purify organic compounds. Acetic acid is used as a solvent in the production of terephthalic acid (TPA), the raw material for polyethylene terephthalate (PET). In 2006, about 20% of acetic acid was used for TPA production.[24]
Acetic acid is often used as a solvent for reactions involving carbocations, such as Friedel-Crafts alkylation. For example, one stage in the commercial manufacture of synthetic camphor involves a Wagner-Meerwein rearrangement of camphene to isobornyl acetate; here acetic acid acts both as a solvent and as a nucleophile to trap the rearranged carbocation.[42]
Glacial acetic acid is used in analytical chemistry for the estimation of weakly alkaline substances such as organic amides. Glacial acetic acid is a much weaker base than water, so the amide behaves as a strong base in this medium. It then can be titrated using a solution in glacial acetic acid of a very strong acid, such as perchloric acid.[43]
Medical use[edit]
Acetic acid injection into a tumor has been used to treat cancer since the 1800s.[44][45]
Acetic acid is used as part of cervical cancer screening in many areas in the developing world.[46] The acid is applied to the cervix and if an area of white appears after about a minute the test is positive.[46]
Acetic acid is an effective antiseptic when used as a 1% solution, with broad spectrum of activity against streptococci, staphylococci, pseudomonas, enterococci and others.[47][48][49] It may be used to treat skin infections caused by pseudomonas strains resistant to typical antibiotics.[50]
While diluted acetic acid is used in iontophoresis, no high quality evidence supports this treatment for rotator cuff disease.[51][52]
As a treatment for otitis externa, it is on the World Health Organization’s List of Essential Medicines.[53][54]
Foods[edit]
Acetic acid has 349 kcal (1,460 kJ) per 100 g.[55] Vinegar is typically no less than 4% acetic acid by mass.[56][57][58] Legal limits on acetic acid content vary by jurisdiction. Vinegar is used directly as a condiment, and in the pickling of vegetables and other foods. Table vinegar tends to be more diluted (4% to 8% acetic acid), while commercial food pickling employs solutions that are more concentrated. The proportion of acetic acid used worldwide as vinegar is not as large as commercial uses, but is by far the oldest and best-known application.[59]
Reactions[edit]
Organic chemistry[edit]
Two typical organic reactions of acetic acid
Acetic acid undergoes the typical chemical reactions of a carboxylic acid. Upon treatment with a standard base, it converts to metal acetate and water. With strong bases (e.g., organolithium reagents), it can be doubly deprotonated to give LiCH2COOLi. Reduction of acetic acid gives ethanol. The OH group is the main site of reaction, as illustrated by the conversion of acetic acid to acetyl chloride. Other substitution derivatives include acetic anhydride; this anhydride is produced by loss of water from two molecules of acetic acid. Esters of acetic acid can likewise be formed via Fischer esterification, and amides can be formed. When heated above 440 °C (824 °F), acetic acid decomposes to produce carbon dioxide and methane, or to produce ketene and water:[60][61][62]
- CH3COOH → CH4 + CO2
- CH3COOH → CH2=C=O + H2O
Reactions with inorganic compounds[edit]
Acetic acid is mildly corrosive to metals including iron, magnesium, and zinc, forming hydrogen gas and salts called acetates:
- Mg + 2 CH3COOH → (CH3COO)2Mg + H2
Because aluminium forms a passivating acid-resistant film of aluminium oxide, aluminium tanks are used to transport acetic acid. Metal acetates can also be prepared from acetic acid and an appropriate base, as in the popular «baking soda + vinegar» reaction giving off sodium acetate:
- NaHCO3 + CH3COOH → CH3COONa + CO2 + H2O
A colour reaction for salts of acetic acid is iron(III) chloride solution, which results in a deeply red colour that disappears after acidification.[63] A more sensitive test uses lanthanum nitrate with iodine and ammonia to give a blue solution.[64] Acetates when heated with arsenic trioxide form cacodyl oxide, which can be detected by its malodorous vapours.[65]
Other derivatives[edit]
Organic or inorganic salts are produced from acetic acid. Some commercially significant derivatives:
- Sodium acetate, used in the textile industry and as a food preservative (E262).
- Copper(II) acetate, used as a pigment and a fungicide.
- Aluminium acetate and iron(II) acetate—used as mordants for dyes.
- Palladium(II) acetate, used as a catalyst for organic coupling reactions such as the Heck reaction.
Halogenated acetic acids are produced from acetic acid. Some commercially significant derivatives:
- Chloroacetic acid (monochloroacetic acid, MCA), dichloroacetic acid (considered a by-product), and trichloroacetic acid. MCA is used in the manufacture of indigo dye.
- Bromoacetic acid, which is esterified to produce the reagent ethyl bromoacetate.
- Trifluoroacetic acid, which is a common reagent in organic synthesis.
Amounts of acetic acid used in these other applications together account for another 5–10% of acetic acid use worldwide.[24]
History[edit]
Vinegar was known early in civilization as the natural result of exposure of beer and wine to air, because acetic acid-producing bacteria are present globally. The use of acetic acid in alchemy extends into the third century BC, when the Greek philosopher Theophrastus described how vinegar acted on metals to produce pigments useful in art, including white lead (lead carbonate) and verdigris, a green mixture of copper salts including copper(II) acetate. Ancient Romans boiled soured wine to produce a highly sweet syrup called sapa. Sapa that was produced in lead pots was rich in lead acetate, a sweet substance also called sugar of lead or sugar of Saturn, which contributed to lead poisoning among the Roman aristocracy.[66]
In the 16th-century German alchemist Andreas Libavius described the production of acetone from the dry distillation of lead acetate, ketonic decarboxylation. The presence of water in vinegar has such a profound effect on acetic acid’s properties that for centuries chemists believed that glacial acetic acid and the acid found in vinegar were two different substances. French chemist Pierre Adet proved them identical.[66][67]
Crystallised acetic acid.
In 1845 German chemist Hermann Kolbe synthesised acetic acid from inorganic compounds for the first time. This reaction sequence consisted of chlorination of carbon disulfide to carbon tetrachloride, followed by pyrolysis to tetrachloroethylene and aqueous chlorination to trichloroacetic acid, and concluded with electrolytic reduction to acetic acid.[68]
By 1910, most glacial acetic acid was obtained from the pyroligneous liquor, a product of the distillation of wood. The acetic acid was isolated by treatment with milk of lime, and the resulting calcium acetate was then acidified with sulfuric acid to recover acetic acid. At that time, Germany was producing 10,000 tons of glacial acetic acid, around 30% of which was used for the manufacture of indigo dye.[66][69]
Because both methanol and carbon monoxide are commodity raw materials, methanol carbonylation long appeared to be attractive precursors to acetic acid. Henri Dreyfus at British Celanese developed a methanol carbonylation pilot plant as early as 1925.[70] However, a lack of practical materials that could contain the corrosive reaction mixture at the high pressures needed (200 atm or more) discouraged commercialization of these routes. The first commercial methanol carbonylation process, which used a cobalt catalyst, was developed by German chemical company BASF in 1963. In 1968, a rhodium-based catalyst (cis−[Rh(CO)2I2]−) was discovered that could operate efficiently at lower pressure with almost no by-products. US chemical company Monsanto Company built the first plant using this catalyst in 1970, and rhodium-catalyzed methanol carbonylation became the dominant method of acetic acid production (see Monsanto process). In the late 1990s, the chemicals company BP Chemicals commercialised the Cativa catalyst ([Ir(CO)2I2]−), which is promoted by iridium[71] for greater efficiency. This iridium-catalyzed Cativa process is greener and more efficient[28] and has largely supplanted the Monsanto process, often in the same production plants.
Interstellar medium[edit]
Interstellar acetic acid was discovered in 1996 by a team led by David Mehringer[72] using the former Berkeley-Illinois-Maryland Association array at the Hat Creek Radio Observatory and the former Millimeter Array located at the Owens Valley Radio Observatory. It was first detected in the Sagittarius B2 North molecular cloud (also known as the Sgr B2 Large Molecule Heimat source). Acetic acid has the distinction of being the first molecule discovered in the interstellar medium using solely radio interferometers; in all previous ISM molecular discoveries made in the millimetre and centimetre wavelength regimes, single dish radio telescopes were at least partly responsible for the detections.[72]
Health effects and safety[edit]
Concentrated acetic acid is corrosive to skin.[73][74] These burns or blisters may not appear until hours after exposure.
Prolonged inhalation exposure (eight hours) to acetic acid vapours at 10 ppm can produce some irritation of eyes, nose, and throat; at 100 ppm marked lung irritation and possible damage to lungs, eyes, and skin may result. Vapour concentrations of 1,000 ppm cause marked irritation of eyes, nose and upper respiratory tract and cannot be tolerated. These predictions were based on animal experiments and industrial exposure.
In 12 workers exposed for two or more years to acetic acid airborne average concentration of 51 ppm (estimated), produced symptoms of conjunctive irritation, upper respiratory tract irritation, and hyperkeratotic dermatitis. Exposure to 50 ppm or more is intolerable to most persons and results in intensive lacrimation and irritation of the eyes, nose, and throat, with pharyngeal oedema and chronic bronchitis. Unacclimatised humans experience extreme eye and nasal irritation at concentrations in excess of 25 ppm, and conjunctivitis from concentrations below 10 ppm has been reported. In a study of five workers exposed for seven to 12 years to concentrations of 80 to 200 ppm at peaks, the principal findings were blackening and hyperkeratosis of the skin of the hands, conjunctivitis (but no corneal damage), bronchitis and pharyngitis, and erosion of the exposed teeth (incisors and canines).[75]
The hazards of solutions of acetic acid depend on the concentration. The following table lists the EU classification of acetic acid solutions:[76][citation needed]
| Concentration by weight |
Molarity | GHS pictograms | H-Phrases |
|---|---|---|---|
| 10–25% | 1.67–4.16 mol/L | 
|
H315 |
| 25–90% | 4.16–14.99 mol/L | 
|
H314 |
| >90% | >14.99 mol/L |  
|
H226, H314 |
Concentrated acetic acid can be ignited only with difficulty at standard temperature and pressure, but becomes a flammable risk in temperatures greater than 39 °C (102 °F), and can form explosive mixtures with air at higher temperatures (explosive limits: 5.4–16%).
See also[edit]
- Acetic acid (data page)
- Acids in wine
Notes[edit]
- ^ [H3O+] = 10−2.4 = 0.4%
- ^ Acetic acid that is manufactured by intent, rather than recovered from processing (such as the production of cellulose acetates, polyvinyl alcohol operations, and numerous acetic anhydride acylations).
References[edit]
- ^ Scientific literature reviews on generally recognised as safe (GRAS) food ingredients. National Technical Information Service. 1974. p. 1.
- ^ «Chemistry», volume 5, Encyclopædia Britannica, 1961, page 374
- ^ Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. p. 745. doi:10.1039/9781849733069-00648. ISBN 978-0-85404-182-4.
- ^ «acetic acid_msds».
- ^ Lange’s Handbook of Chemistry, 10th ed.
- ^ a b c NIOSH Pocket Guide to Chemical Hazards. «#0002». National Institute for Occupational Safety and Health (NIOSH).
- ^ «Acetic acid». Immediately Dangerous to Life or Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ^ a b c d e Cheung, Hosea; Tanke, Robin S.; Torrence, G. Paul. «Acetic Acid». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a01_045.pub2.
- ^ IUPAC Provisional Recommendations 2004 Chapter P-12.1; page 4
- ^ Armarego, W.L.F.; Chai, Christina (2009). Purification of Laboratory Chemicals, 6th edition. Butterworth-Heinemann. ISBN 978-1-85617-567-8.
- ^ Cooper, Caroline (9 August 2010). Organic Chemist’s Desk Reference (2 ed.). CRC Press. pp. 102–104. ISBN 978-1-4398-1166-5.
- ^ DeSousa, Luís R. (1995). Common Medical Abbreviations. Cengage Learning. p. 97. ISBN 978-0-8273-6643-5.
- ^ Hendrickson, James B.; Cram, Donald J.; Hammond, George S. (1970). Organic Chemistry (3 ed.). Tokyo: McGraw Hill Kogakusha. p. 135.
- ^ Goldberg, R.; Kishore, N.; Lennen, R. (2002). «Thermodynamic Quantities for the Ionization Reactions of Buffers» (PDF). Journal of Physical and Chemical Reference Data. 31 (2): 231–370. Bibcode:2002JPCRD..31..231G. doi:10.1063/1.1416902. Archived from the original (PDF) on 6 October 2008.
- ^ Jones, R. E.; Templeton, D.H. (1958). «The crystal structure of acetic acid» (PDF). Acta Crystallographica. 11 (7): 484–487. doi:10.1107/S0365110X58001341. hdl:2027/mdp.39015077597907.
- ^ Briggs, James M.; Toan B. Nguyen; William L. Jorgensen (1991). «Monte Carlo simulations of liquid acetic acid and methyl acetate with the OPLS potential functions». Journal of Physical Chemistry. 95 (8): 3315–3322. doi:10.1021/j100161a065.
- ^ Togeas, James B. (2005). «Acetic Acid Vapor: 2. A Statistical Mechanical Critique of Vapor Density Experiments». Journal of Physical Chemistry A. 109 (24): 5438–5444. Bibcode:2005JPCA..109.5438T. doi:10.1021/jp058004j. PMID 16839071.
- ^ McMurry, John (2000). Organic Chemistry (5 ed.). Brooks/Cole. p. 818. ISBN 978-0-534-37366-5.
- ^ Zieborak, K.; Olszewski, K. (1958). Bulletin de l’Académie Polonaise des Sciences, Série des Sciences Chimiques, Géologiques et Géographiques. 6 (2): 3315–3322.
{{cite journal}}: CS1 maint: untitled periodical (link) - ^ Fiume, M. Z.; Cosmetic Ingredients Review Expert Panel (June 2003). «Final report on the safety assessment of triacetin». International Journal of Toxicology. 22 (Suppl 2): 1–10. doi:10.1080/747398359. PMID 14555416.
- ^ Buckingham, J., ed. (1996). Dictionary of Organic Compounds. Vol. 1 (6th ed.). London: Chapman & Hall. ISBN 978-0-412-54090-5.
- ^ Yoneda, Noriyuki; Kusano, Satoru; Yasui, Makoto; Pujado, Peter; Wilcher, Steve (2001). «Recent advances in processes and catalysts for the production of acetic acid». Applied Catalysis A: General. 221 (1–2): 253–265. doi:10.1016/S0926-860X(01)00800-6.
- ^ «Production report». Chemical & Engineering News: 67–76. 11 July 2005.
- ^ a b c d e Malveda, Michael; Funada, Chiyo (2003). «Acetic Acid». Chemicals Economic Handbook. SRI International. p. 602.5000. Archived from the original on 14 October 2011.
- ^ Acetic Acid. SRI Consulting.
- ^ «Reportlinker Adds Global Acetic Acid Market Analysis and Forecasts». Market Research Database. June 2014. p. contents.
- ^ Yoneda, N.; Kusano, S.; Yasui, M.; Pujado, P.; Wilcher, S. (2001). «Recent advances in processes and catalysts for the production of acetic acid». Applied Catalysis A: General. 221 (1–2): 253–265. doi:10.1016/S0926-860X(01)00800-6.
- ^ a b Lancaster, Mike (2002). Green Chemistry, an Introductory Text. Cambridge: Royal Society of Chemistry. pp. 262–266. ISBN 978-0-85404-620-1.
- ^ Zoeller, J. R.; Agreda, V. H.; Cook, S. L.; Lafferty, N. L.; Polichnowski, S. W.; Pond, D. M. (1992). «Eastman Chemical Company Acetic Anhydride Process». Catalysis Today. 13 (1): 73–91. doi:10.1016/0920-5861(92)80188-S.
- ^ Hintermann, Lukas; Labonne, Aurélie (2007). «Catalytic Hydration of Alkynes and Its Application in Synthesis». Synthesis. 2007 (8): 1121. doi:10.1055/s-2007-966002.
- ^ Chenier, Philip J. (2002). Survey of Industrial Chemistry (3 ed.). Springer. p. 151. ISBN 978-0-306-47246-6.
- ^ a b c Sano, Ken‐ichi; Uchida, Hiroshi; Wakabayashi, Syoichirou (1999). «A new process for acetic acid production by direct oxidation of ethylene». Catalysis Surveys from Japan. 3 (1): 55–60. doi:10.1023/A:1019003230537. ISSN 1384-6574. S2CID 93855717.
- ^ Sano, Ken-ichi; Uchida, Hiroshi; Wakabayashi, Syoichirou (1999). «A new process for acetic acid production by direct oxidation of ethylene». Catalyst Surveys from Japan. 3: 66–60. doi:10.1023/A:1019003230537. S2CID 93855717.
- ^ Misono, Makoto (2009). «Recent progress in the practical applications of heteropolyacid and perovskite catalysts: Catalytic technology for the sustainable society». Catalysis Today. 144 (3–4): 285–291. doi:10.1016/j.cattod.2008.10.054.
- ^ Chotani, Gopal K.; Gaertner, Alfred L.; Arbige, Michael V.; Dodge, Timothy C. (2007). «Industrial Biotechnology: Discovery to Delivery». Kent and Riegel’s Handbook of Industrial Chemistry and Biotechnology. Kent and Riegel’s Handbook of Industrial Chemistry and Biotechnology. Springer. pp. 32–34. Bibcode:2007karh.book……. ISBN 978-0-387-27842-1.
- ^ a b Hromatka, Otto; Ebner, Heinrich (1959). «Vinegar by Submerged Oxidative Fermentation». Industrial & Engineering Chemistry. 51 (10): 1279–1280. doi:10.1021/ie50598a033.
- ^ Partridge, Everett P. (1931). «Acetic Acid and Cellulose Acetate in the United States A General Survey of Economic and Technical Developments». Industrial & Engineering Chemistry. 23 (5): 482–498. doi:10.1021/ie50257a005.
- ^ Hromatka, O.; Ebner, H. (1949). «Investigations on vinegar fermentation: Generator for vinegar fermentation and aeration procedures». Enzymologia. 13: 369.
- ^ Sim, Jia Huey; Kamaruddin, Azlina Harun; Long, Wei Sing; Najafpour, Ghasem (2007). «Clostridium aceticum—A potential organism in catalyzing carbon monoxide to acetic acid: Application of response surface methodology». Enzyme and Microbial Technology. 40 (5): 1234–1243. doi:10.1016/j.enzmictec.2006.09.017.
- ^ a b Roscher, Günter. «Vinyl Esters». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a27_419.
- ^ a b Held, Heimo; Rengstl, Alfred; Mayer, Dieter. «Acetic Anhydride and Mixed Fatty Acid Anhydrides». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a01_065.
- ^ Sell, Charles S. (2006). «4.2.15 Bicyclic Monoterpenoids». The Chemistry of Fragrances: From Perfumer to Consumer. RSC Paperbacks Series. Vol. 38 (2 ed.). Great Britain: Royal Society of Chemistry. p. 80. ISBN 978-0-85404-824-3.
- ^ Felgner, Andrea. «Determination of Water Content in Perchloric acid 0,1 mol/L in acetic acid Using Karl Fischer Titration». Sigma-Aldrich. Retrieved 27 July 2017.
- ^ Barclay, John (1866). «Injection of Acetic Acid in Cancer». Br Med J. 2 (305): 512. doi:10.1136/bmj.2.305.512-a. PMC 2310334.
- ^ Shibata N. (1998). «Percutaneous ethanol and acetic acid injection for liver metastasis from colon cancer». Gan to Kagaku Ryoho. 25 (5): 751–5. PMID 9571976.
- ^ a b Fokom-Domgue, J.; Combescure, C.; Fokom-Defo, V.; Tebeu, P. M.; Vassilakos, P.; Kengne, A. P.; Petignat, P. (3 July 2015). «Performance of alternative strategies for primary cervical cancer screening in sub-Saharan Africa: systematic review and meta-analysis of diagnostic test accuracy studies». BMJ (Clinical Research Ed.). 351: h3084. doi:10.1136/bmj.h3084. PMC 4490835. PMID 26142020.
- ^ Madhusudhan, V. L. (8 April 2015). «Efficacy of 1% acetic acid in the treatment of chronic wounds infected with Pseudomonas aeruginosa: prospective randomised controlled clinical trial». International Wound Journal. 13 (6): 1129–1136. doi:10.1111/iwj.12428. ISSN 1742-481X. PMC 7949569. PMID 25851059. S2CID 4767974.
- ^ Ryssel, H.; Kloeters, O.; Germann, G.; Schäfer, Th; Wiedemann, G.; Oehlbauer, M. (1 August 2009). «The antimicrobial effect of acetic acid—an alternative to common local antiseptics?». Burns. 35 (5): 695–700. doi:10.1016/j.burns.2008.11.009. ISSN 1879-1409. PMID 19286325.
- ^ «Antiseptics on Wounds: An Area of Controversy». www.medscape.com. Retrieved 15 August 2016.
- ^ Nagoba, B. S.; Selkar, S. P.; Wadher, B. J.; Gandhi, R. C. (December 2013). «Acetic acid treatment of pseudomonal wound infections—a review». Journal of Infection and Public Health. 6 (6): 410–5. doi:10.1016/j.jiph.2013.05.005. PMID 23999348.
- ^ Page, M. J.; Green, S.; Mrocki, M. A.; Surace, S. J.; Deitch, J.; McBain, B.; Lyttle, N.; Buchbinder, R. (10 June 2016). «Electrotherapy modalities for rotator cuff disease». The Cochrane Database of Systematic Reviews. 2016 (6): CD012225. doi:10.1002/14651858.CD012225. PMC 8570637. PMID 27283591.
- ^ Habif, Thomas P. (2009). Clinical Dermatology (5 ed.). Elsevier Health Sciences. p. 367. ISBN 978-0-323-08037-8.
- ^ World Health Organization (2019). World Health Organization model list of essential medicines: 21st list 2019. Geneva: World Health Organization. hdl:10665/325771. WHO/MVP/EMP/IAU/2019.06. License: CC BY-NC-SA 3.0 IGO.
- ^ World Health Organization (2021). World Health Organization model list of essential medicines: 22nd list (2021). Geneva: World Health Organization. hdl:10665/345533. WHO/MHP/HPS/EML/2021.02.
- ^ Greenfield, Heather; Southgate, D.A.T. (2003). Food Composition Data: Production, Management and Use. Rome: FAO. p. 146. ISBN 9789251049495.
- ^ «CPG Sec. 525.825 Vinegar, Definitions» (PDF). United States Food and Drug Administration. March 1995.
- ^ «Departmental Consolidation of the Food and Drugs Act and the Food and Drug Regulations – Part B – Division 19» (PDF). Health Canada. August 2018. p. 591.
- ^ «Commission Regulation (EU) 2016/263». Official Journal of the European Union. European Commission. February 2016.
- ^ Bernthsen, A.; Sudborough, J. J. (1922). Organic Chemistry. London: Blackie and Son. p. 155.
- ^ Blake, P. G.; Jackson, G. E. (1968). «The thermal decomposition of acetic acid». Journal of the Chemical Society B: Physical Organic: 1153–1155. doi:10.1039/J29680001153.
- ^ Bamford, C. H.; Dewar, M. J. S. (1949). «608. The thermal decomposition of acetic acid». Journal of the Chemical Society: 2877. doi:10.1039/JR9490002877.
- ^ Duan, Xiaofeng; Page, Michael (1995). «Theoretical Investigation of Competing Mechanisms in the Thermal Unimolecular Decomposition of Acetic Acid and the Hydration Reaction of Ketene». Journal of the American Chemical Society. 117 (18): 5114–5119. doi:10.1021/ja00123a013. ISSN 0002-7863.
- ^ Charlot, G.; Murray, R. G. (1954). Qualitative Inorganic Analysis (4 ed.). CUP Archive. p. 110.
- ^ Neelakantam, K.; Row, L Ramachangra (1940). «The Lanthanum Nitrate Test for Acetatein Inorganic Qualitative Analysis» (PDF). Retrieved 5 June 2013.
- ^ Brantley, L. R.; Cromwell, T. M.; Mead, J. F. (1947). «Detection of acetate ion by the reaction with arsenious oxide to form cacodyl oxide». Journal of Chemical Education. 24 (7): 353. Bibcode:1947JChEd..24..353B. doi:10.1021/ed024p353. ISSN 0021-9584.
- ^ a b c Martin, Geoffrey (1917). Industrial and Manufacturing Chemistry (Part 1, Organic ed.). London: Crosby Lockwood. pp. 330–331.
- ^ Adet, P. A. (1798). «Mémoire sur l’acide acétique (Memoir on acetic acid)». Annales de Chimie. 27: 299–319.
- ^ Goldwhite, Harold (September 2003). «This month in chemical history» (PDF). New Haven Section Bulletin American Chemical Society. 20 (3): 4. Archived from the original (PDF) on 4 March 2009.
- ^ Schweppe, Helmut (1979). «Identification of dyes on old textiles». Journal of the American Institute for Conservation. 19 (1/3): 14–23. doi:10.2307/3179569. JSTOR 3179569. Archived from the original on 29 May 2009. Retrieved 12 October 2005.
- ^ Wagner, Frank S. (1978). «Acetic acid». In Grayson, Martin (ed.). Kirk-Othmer Encyclopedia of Chemical Technology (3rd ed.). New York: John Wiley & Sons.
- ^ Industrial Organic Chemicals, Harold A. Wittcoff, Bryan G. Reuben, Jeffery S. Plotkin
- ^ a b Mehringer, David M.; et al. (1997). «Detection and Confirmation of Interstellar Acetic Acid». Astrophysical Journal Letters. 480 (1): L71. Bibcode:1997ApJ…480L..71M. doi:10.1086/310612.
- ^ «ICSC 0363 – ACETIC ACID». International Programme on Chemical Safety. 5 June 2010.
- ^ «Occupational Safety and Health Guideline for Acetic Acid» (PDF). Centers for Disease Control and Prevention. Retrieved 8 May 2013.
- ^ Sherertz, Peter C. (1 June 1994). Acetic Acid (PDF). Virginia Department of Health Division of Health Hazards Control. Archived from the original (PDF) on 4 March 2016.
- ^ «Details». hcis.safeworkaustralia.gov.au.
External links[edit]
Look up acetic in Wiktionary, the free dictionary.
- International Chemical Safety Card 0363
- National Pollutant Inventory – Acetic acid fact sheet
- NIOSH Pocket Guide to Chemical Hazards
- Method for sampling and analysis
- 29 CFR 1910.1000, Table Z-1 (US Permissible exposure limits)
- ChemSub Online: Acetic acid
- Calculation of vapor pressure, liquid density, dynamic liquid viscosity, surface tension of acetic acid
- Acetic acid bound to proteins in the PDB
- Swedish Chemicals Agency. Information sheet – Acetic Acid
- Process Flow sheet of Acetic acid Production by the Carbonylation of Methanol
Формула уксусной кислоты
Химическая и структурная формулы уксусной кислоты
Химическая формула: CH3COOH
Брутто-формула: C2H4O2
Структурная формула:
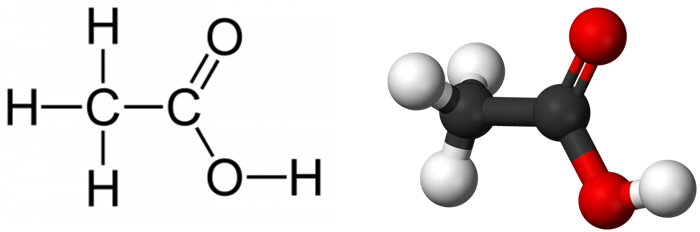
Молярная масса: 60,05 г/моль.
Уксусная кислота – предельная одноосновная карбоновая кислота. Образует соли – ацетаты.
Слабая кислота, константа диссоциации Ka=1,75 •10–5, рКа = 4,76.
Физические свойства уксусной кислоты
Уксусная кислота — бесцветная жидкость с резким характерным запахом, кислым вкусом. Гигроскопична, неограниченно растворяется в воде. Существует в виде димеров. Безводная уксусная кислота называется ледяной, поскольку при замерзании образует льдовидную массу.
Химические свойства уксусной кислоты
Уксусная кислота проявляет все основные свойствами карбоновых кислот.
- Взаимодействует с активными металлами с образованием водорода и соответствующих солей (ацетатов):
- Взаимодействует с оксидами металлов:
- Взаимодействует с гидроксидами металлов:
- В присутствии серной кислоты вступает в реакцию этерификации с образованием сложных эфиров:
- Вступает в реакции галогенирования с образованием галогенуксусных кислот:
- Реакция горения:
Качественной реакцией на соли уксусной кислоты является взаимодействие с сильными кислотами. Уксусная кислота слабая и вытесняется сильными кислотами из растворов солей, при этом появляется ее характерный запах:
Получение. Наиболее экономически выгодный промышленный способ получения уксусной кислоты – карбонилирование метанола моноксидом углерода, катализатор – соли родия, промотор – иодид-ионы:
Биохимический способ – окисление этанола:
Водные растворы уксусной кислоты используются в пищевой промышленности (пищевая добавка E260), бытовой кулинарии, и консервировании. Уксусную кислоту применяют для получения лекарственных и душистых веществ, в качестве растворителя.
|
|
Концентрированная уксусная кислота (с концентрацией более 30%) способна вызывать химические ожоги. Пары уксусной кислоты раздражают слизистые оболочки верхних дыхательных путей |
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |
| Уксусная кислота | |
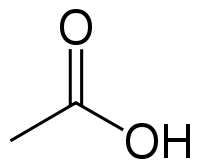 |
|
 |
|
| Общие | |
|---|---|
| Химическая формула | CH3COOH |
| Физические свойства | |
| Состояние (ст. усл.) | бесцветная жидкость |
| Молярная масса | 60,05 г/моль |
| Плотность | 1,0492 г/см³ |
| Термические свойства | |
| Температура плавления | 16,75 °C |
| Температура кипения | 118,1 °C |
| Критическая точка | 321,6 °C, 5,79 МПа |
| Молярная теплоёмкость (ст. усл.) | 123,4 Дж/(моль·К) |
| Энтальпия образования (ст. усл.) | −487 кДж/моль |
| Химические свойства | |
| pKa | 4,76 (Ka=1,75*10-5) |
| Оптические свойства | |
| Показатель преломления | 1,372 |
| Структура | |
| Дипольный момент | 1,74 Д |
| Классификация | |
| Рег. номер CAS | 64-19-7 |
У́ксусная кислота (эта́новая кислота) — органическое вещество с формулой CH3COOH. Слабая, предельная одноосно́вная карбоновая кислота. Производные уксусной кислоты носят название «ацетаты».
Содержание
- 1 История
- 2 Физические свойства
- 3 Получение
- 3.1 В промышленности
- 3.1.1 Окислительные методы
- 3.1.2 Каталитическое карбонилирование метанола
- 3.1.3 Биохимический способ производства
- 3.1 В промышленности
- 4 Химические свойства
- 5 Применение
- 6 Безопасность
- 7 Примечания
- 8 Ссылки
История
Уксус является продуктом брожения вина и известен человеку с давних времен.
Первое упоминание о практическом применении уксусной кислоты относится к третьему веку до н. э. Греческий ученый Теофраст впервые описал действие уксуса на металлы, приводящее к образованию некоторых используемых в искусстве пигментов. Уксус применялся для получения «свинцовых белил», а также ярь-медянки (зелёной смеси солей меди, содержащей помимо всего ацетат меди).
В Древнем Риме готовили специально прокисшее вино в свинцовых горшках. В результате получался очень сладкий напиток, который называли «сапа». «Сапа» содержала большое количество ацетата свинца — очень сладкого вещества, которое также называют «свинцовым сахаром» или «сахаром Сатурна». Высокая популярность «сапы» была причиной хронического отравления свинцом, распространенного среди римской аристократии.[1]
В VIII веке арабский алхимик Джабир ибн Хайян впервые получил концентрированную уксусную кислоту путем перегонки.
Во времена Эпохи Возрождения уксусную кислоту получали путём возгонки ацетатов некоторых металлов (чаще всего использовался ацетат меди (II)) (при сухой перегонке ацетатов металлов получается ацетон, вполне промышленный способ до середины 20 века).
Свойства уксусной кислоты меняются в зависимости от содержания в ней воды. В связи с этим многие века химики ошибочно считали, что кислота из вина и кислота из ацетатов на самом деле являются двумя разными веществами. Идентичность веществ, полученных различными способами, была показана немецким алхимиком XVI века Андреа Либавиусом (нем. Andreas Libavius) и французским химиком Пьером Августом Адэ (фр. Pierre Auguste Adet)[1].
Завод, производящий уксусную кислоту. 1884 год.
В 1847 году немецкий химик Адольф Кольбе впервые синтезировал уксусную кислоту из неорганических материалов. Последовательность превращений включала в себя хлорирование сероуглерода до тетрахлорметана с последующим пиролизом до тетрахлорэтилена. Дальнейшее хлорирование в воде привело к трихлоруксусной кислоте, которая после электролитического восстановления превратилась в уксусную кислоту.[2]
В конце XIX — начале XX века большую часть уксусной кислоты получали перегонкой древесины. Основным производителем уксусной кислоты являлась Германия. В 1910 году ею было произведено более 10 тыс. тонн кислоты, причем около 30 % этого количества было израсходовано на производство красителя индиго.[1][3]
Физические свойства
Ледяная уксусная кислота
Уксусная кислота представляет собой бесцветную жидкость с характерным резким запахом и кислым вкусом. Гигроскопична. Неограниченно растворима в воде. Смешивается со многими растворителями; в уксусной кислоте хорошо растворимы неорганические соединения и газы, такие как HF, HCl, HBr, HI и другие. Существует в виде циклических и линейных димеров[4].
Абсолютная уксусная кислота называется ледяной, ибо при замерзании образует льдовидную массу (см. изображение справа).
- Давление паров (в мм. рт. ст.):
- 10 (17,1 °C)
- 40 (42,4 °C)
- 100 (62,2 °C)
- 400 (98,1 °C)
- 560 (109 °C)
- 1520 (143,5 °C)
- 3800 (180,3 °C)
- Диэлектрическая проницаемость: 6,15 (20 °C)
- Динамическая вязкость жидкостей и газов (в мПа·с): 1,155 (25,2 °C); 0,79 (50 °C)
- Поверхностное натяжение: 27,8 мН/м (20 °C)
- Удельная теплоемкость при постоянном давлении: 2,01 Дж/г·K (17 °C)
- Стандартная энергия Гиббса образования ΔfG0 (298 К, кДж/моль): −392,5 (ж)
- Стандартная энтропия образования ΔfS0 (298 К, Дж/моль·K): 159,8 (ж)
- Энтальпия плавления ΔHпл: 11,53 кДж/моль
- Температура вспышки в воздухе: 38 °C
- Температура самовоспламенения на воздухе: 454 °C
- Теплота сгорания: 876,1 кДж/моль
Уксусная кислота образует двойные азеотропные смеси со следующими веществами.
| Вещество | tкип, °C | массовая доля уксусной кислоты |
|---|---|---|
| четыреххлористый углерод | 76,5 | 3 % |
| циклогексан | 81,8 | 6,3 % |
| бензол | 88,05 | 2 % |
| толуол | 104,9 | 34 % |
| гептан | 91,9 | 33 % |
| трихлорэтилен | 86,5 | 4 % |
| этилбензол | 114,65 | 66 % |
| о-ксилол | 116 | 76 % |
| п-ксилол | 115,25 | 72 % |
| бромоформ | 118 | 83 % |
-
- Уксусная кислота образует тройные азеотропные смеси
- с водой и бензолом (tкип 88 °C);
- с водой и бутилацетатом (tкип 89 °C).
- Уксусная кислота образует тройные азеотропные смеси
Получение
- Уксусную кислоту можно получить окислением ацетальдегида кислородом воздуха. Процесс проводят в присутствии катализатора — ацетата марганца (II) Mn(CH3COO)2 при температуре 50-60 °С:
2 CH3CHO + O2 → 2 CH3COOH
В промышленности
Окислительные методы
Ранними промышленными методами получения уксусной кислоты были окисление ацетальдегида и бутана[5].
Ацетальдегид окислялся в присутствии ацетата марганца (II) при повышенной температуре и давлении. Выход уксусной кислоты составлял около 95 %.
Окисление н-бутана проводилось при температуре 150—200 °C и давлении 150 атм. Катализатором этого процесса являлся ацетат кобальта.
Оба метода базировались на окислении продуктов крекинга нефти. В результате повышения цен на нефть оба метода стали экономически невыгодными, и были вытеснены более совершенными каталитическими процессами карбонилирования метанола[5].
Каталитическое карбонилирование метанола
Каталитическая схема процесса фирмы Monsanto
Важным способом промышленного синтеза уксусной кислоты является каталитическое карбонилирование метанола моноксидом углерода[6], которое происходит по формальному уравнению:
Реакция карбонилирования метанола была открыта учеными фирмы BASF в 1913 году. В 1960 году эта компания запустила первый завод, производящий уксусную кислоту этим методом.[7] Катализатором превращения служил йодид кобальта.
Усовершенствованная реакция синтеза уксусной кислоты карбонилированием метанола была внедрена исследователями фирмы Monsanto в 1970 году.[8][9] Это гомогенный процесс, в котором используются соли родия в качестве катализаторов, а также йодид-ионы в качестве промоторов. Важной особенностью метода является большая скорость, а также высокая селективность (99 % по метанолу и 90 % по CO).[5]
Этим способом получают чуть более 50 % всей промышленной уксусной кислоты.[10]
В процессе фирмы BP в качестве катализаторов используются соединения иридия.
Биохимический способ производства
При биохимическом производство уксусной кислоты используется способность некоторых микроорганизмов окислять этанол. Этот процесс называют уксуснокислым брожением. В качестве сырья используются этанолсодержащие жидкости (вино, забродившие соки), либо же просто водный раствор этилового спирта[11].
Реакция окисления этанола до уксусной кислоты протекает при участии фермента алкогольоксидазы. Это сложный многоступенчатый процесс, который описывается формальным уравнением[12]:
- СН3СН2ОН + О2 → СН3СООН + Н2О
Химические свойства
Уксусная кислота обладает всеми свойствами карбоновых кислот. Связь между водородом и кислородом карбоксильной группы (−COOH) карбоновой кислоты является сильно полярной, вследствие чего эти соединения способны легко диссоциировать и проявляют кислотные свойства.
В результате диссоциации уксусной кислоты образуется ацетат-ион CH3COO− и протон H+. Уксусная кислота является слабой одноосновной кислотой со значением pKa в водном растворе равным 4,75. Раствор с концентрацией 1.0 M (приблизительная концентрация пищевого уксуса) имеет pH 2,4, что соответствует степени диссоциации 0,4 %.
Исследования показывают, что в кристаллическом состоянии молекулы образуют димеры, связанные водородными связями.[13]
Уксусная кислота способна взаимодействовать с активными металлами. При этом выделяется водород и образуются соли — ацетаты.
Mg(тв) + 2CH3COOH → (CH3COO)2Mg + H2
Уксусная кислота может хлорироваться действием газообразного хлора. При этом образуется хлоруксусная кислота.
CH3COOH + Cl2 → CH2ClCOOH + HCl
Этим путем могут быть получены также дихлоруксусная (CHCl2COOH) и трихлоруксусная (CCl3COOH) кислоты.
Уксусная кислота вступает во все реакции, характерные для карбоновых кислот. Она может быть восстановлена до этанола действием алюмогидрида лития. Уксусная кислота также может быть превращена в хлорангидрид действием тионилхлорида. Натриевая соль уксусный кислоты декарбоксилируется при нагревании со щелочью, что приводит к образованию метана.
Применение
Уксусную кислоту, концентрация которой близка к 100 %, называют ледяной. 70-80 % водный раствор уксусной кислоты называют уксусной эссенцией, а 3-15 % — уксусом[14]. Водные растворы уксусной кислоты широко используются в пищевой промышленности (пищевая добавка E260) и бытовой кулинарии, а также в консервировании.
Уксусную кислоту применяют для получения лекарственных и душистых веществ, как растворитель (например, в производстве ацетилцеллюлозы, ацетона). Она используется в книгопечатании и крашении.
Уксусная кислота используется как реакционная среда для проведения окисления различных органических веществ. В лабораторных условиях это, например, окисление органических сульфидов пероксидом водорода, в промышленности — окисление пара-ксилола кислородом воздуха в терефталевую кислоту.
Поскольку пары уксусной кислоты обладают резким раздражающим запахом, возможно её применение в медицинских целях в качестве замены нашатырного спирта для выведения больного из обморочного состояния.
Безопасность
Пары уксусной кислоты раздражают слизистые оболочки верхних дыхательных путей. Порог восприятия запаха уксусной кислоты в воздухе находится в районе 0,4 мг/л. ПДК в атмосферном воздухе составляет 0,06 мг/м³, в воздухе рабочих помещений — 5 мг/м³.[4]
Действие уксусной кислоты на биологические ткани зависит от степени её разбавления водой. Опасными считаются растворы, в которых концентрация кислоты превышает 30 %.[4] Концентрированная уксусная кислота способна вызывать химические ожоги, инициирующие развитие коагуляционных некрозов прилегающих тканей различной протяженности и глубины[15].
Токсикологические свойства уксусной кислоты не зависят от способа, которым она была получена[16]. Смертельная доза составляет примерно 20 мл.
Последствиями приёма концентрированной уксусной кислоты являются тяжёлый ожог слизистой оболочки полости рта, глотки, пищевода и желудка; последствия всасывания уксусной эссенции — ацидоз, гемолиз, гемоглобинурия, нарушение свёртываемости крови, сопровождающееся тяжёлыми желудочно-кишечными кровотечениями. Характерно значительное сгущение крови из-за потери плазмы через обожжённую слизистую оболочку, что может вызвать шок. К опасным осложнениям отравления уксусной эссенцией относятся острая почечная недостаточность и токсическая дистрофия печени.
При приёме уксусной кислоты внутрь следует выпить большое количество жидкости. Вызов рвоты является крайне опасным, так как вторичное прохождение кислоты по пищеводу усугубит ожог. Показано промывание желудка через зонд. Необходима немедленная госпитализация.
Примечания
- ↑ 1 2 3 Martin Geoffrey Industrial and Manufacturing Chemistry. — Part 1, Organic. — London: Crosby Lockwood, 1917. — P. pp. 330–31.
- ↑ Goldwhite, Harold (September 2003). «Short summary of the career of the German organic chemist, Hermann Kolbe» (PDF). New Haven Section Bull. Am. Chem. Soc. 20 (3).
- ↑ Schweppe, Helmut (1979). «Identification of dyes on old textiles». J. Am. Inst. Conservation 19 (1/3): pp. 14–23. DOI:10.2307/3179569.
- ↑ 1 2 3 Уксусная кислота
- ↑ 1 2 3 Реутов О.А. Органическая химия. — М.: Изд-во МГУ, 1999. — Т. 4.
- ↑ Advances in Organometallic Chemistry
- ↑ Acetic Acid Production and Manufacturing Process
- ↑ U.S. Patent 3 769 329
- ↑ Патент США
- ↑ Экологический фактор, или Окружающая среда как стимул эволюции промышленной химии
- ↑ Кандидат биологических наук Н. Кустова Уксус. Что это такое и как его делают (рус.). Интернет-ресурс «Всякая всячина». Архивировано из первоисточника 26 августа 2011. Проверено 2 сентября 2010.
- ↑ Биотехнология органических кислот и белковых препаратов: Учебное пособие
- ↑ Jones, R.E.; Templeton, D.H. (1958). «The crystal structure of acetic acid». Acta Crystallogr. 11 (7): pp. 484–87. DOI:10.1107/S0365110X58001341.
- ↑ Уксус — статья из Большой советской энциклопедии
- ↑ Уксусная кислота : Медицинский портал Eurolab
- ↑ www.textra-vita.com/technology Глава 17. Уксусная кислота 7. Токсиколого-гигиеническая оценка
Ссылки
| Портал «Наука» | |
| Уксусная кислота на Викискладе? | |
| Проект «Химия» |
- Уксусная кислота
- Свойства
- Плотность водных растворов уксусной кислоты в зависимости от концентрации
|
Растворимость кислот, оснований и солей в воде |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
| |
|
|---|---|
| С0 | Муравьиная |
| С1 — С5 | Уксусная (С1) · Пропионовая (С2) · Масляная (С3) · Валериановая (С4) · Капроновая (С5) |
| С6 — С10 | Энантовая (С6) · Каприловая (С7) · Пеларгоновая (С8) · Каприновая (С9) · Ундециловая (С10) |
| С11 — С15 | Лауриновая (С11) · Тридекановая (С12) · Миристиновая (С13) · Пентадекановая (С14) · Пальмитиновая (С15) |
| С16 — С20 | Маргариновая (С16) · Стеариновая (С17) · Нонадекановая (С18) · Арахиновая (С19) · Генэйкозановая (С20) |
| С21 и более | Бегеновая (С21) · Трикозановая (С22) · Лигноцериновая (С23) · Пентакозановая (С24) · Церотиновая (С25) |
|
|
| Уксусная кислота | ||
|---|---|---|
|
||
 |
||
| Общие | ||
| Систематическое наименование (b) |
Этановая кислота | |
| Сокращения | Уксус | |
| Традиционные названия | Уксусная кислота | |
| Хим. формула (b) | CH3COOH | |
| Физические свойства | ||
| Состояние (b) | Жидкость | |
| Молярная масса (b) | 60,05 г/моль (b) | |
| Плотность (b) | 1,0492 г/см³ | |
| Поверхностное натяжение (b) | 27,1 ± 0,01 мН/м[1], 24,61 ± 0,01 мН/м[1] и 22,13 ± 0,01 мН/м[1] | |
| Динамическая вязкость (b) | 1,056 мПа·с[2], 0,786 мПа·с[2], 0,599 мПа·с[2] и 0,464 мПа·с[2] | |
| Энергия ионизации (b) | 10,66 ± 0,01 эВ[3] | |
| Термические свойства | ||
| Температура | ||
| • плавления (b) | 16,75 °C | |
| • кипения (b) | 118,1 °C | |
| • вспышки (b) | 103 ± 1 ℉[3] и 39 ± 6 °C[4] | |
| • самовоспламенения (b) | 427 ± 1 °C[5] | |
| Пределы взрываемости (b) | 4 ± 0,1 об.%[3] | |
| Критическая точка (b) | 321,6 °C, 5,79 МПа | |
| Мол. теплоёмк. (b) | 123,4 Дж/(моль·К) | |
| Энтальпия | ||
| • образования | −487 кДж/моль | |
| Давление пара | 11 ± 1 мм рт.ст.[3], 10 ± 1 кПа[6] и 100 ± 1 кПа[6] | |
| Химические свойства | ||
| Константа диссоциации кислоты (b) | 4,76 (Ka=1,75*10-5) | |
| Оптические свойства | ||
| Показатель преломления (b) | 1,372 | |
| Структура | ||
| Дипольный момент (b) | 1,74 Д (b) | |
| Классификация | ||
| Рег. номер CAS (b) | 64-19-7 | |
| PubChem (b) | 176 | |
| Рег. номер EINECS (b) | 200-580-7 | |
| SMILES (b) |
CC(=O)O |
|
| InChI (b) |
InChI=1S/C2H4O2/c1-2(3)4/h1H3,(H,3,4) QTBSBXVTEAMEQO-UHFFFAOYSA-N |
|
| Кодекс Алиментариус (b) | E260 | |
| RTECS (b) | AF1225000 | |
| ChEBI | 15366 | |
| Номер ООН (b) | 2789 | |
| ChemSpider (b) | 171 | |
| Безопасность | ||
| Пиктограммы ECB | ||
| NFPA 704 (b) |
 2 3 1 ACID |
|
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | ||
У́ксусная кислота́ (эта́новая кислота, в быту «у́ксус», химическая формула (b) — C2H4O2 или CH3COOH, AcOH) — cлабая (b) органическая кислота (b) , относящаяся к классу предельных карбоновых кислот (b) .
При стандартных условиях (b) уксусная кислота — это одноосновная карбоновая кислота (b) , представляющая собой бесцветную жидкость с характерным запахом и кислым вкусом.
Соли и сложные эфиры уксусной кислоты называются ацета́тами (b) .
История
Уксус (b) является продуктом брожения вина (b) и известен человеку с давних времен.
Первое упоминание о практическом применении уксусной кислоты относится к III веку (b) до н. э. Греческий учёный Теофраст (b) впервые описал действие уксуса на металлы (b) , приводящее к образованию некоторых используемых в искусстве пигментов (b) . Уксус применялся для получения свинцовых белил (b) , а также ярь-медянки (b) (зелёной смеси солей меди, содержащей, помимо прочего, ацетат меди).
В Древнем Риме готовили специально прокисшее вино (b) в свинцовых горшках. В результате получался очень сладкий напиток, который называли «сапа». Сапа содержала большое количество ацетата свинца — очень сладкого вещества, которое также называют свинцовым сахаром (b) или сахаром Сатурна (b) . Высокая популярность сапы была причиной хронического отравления свинцом (b) , распространённого среди римской аристократии[7].
В VIII веке арабский алхимик Джабир ибн Хайян (b) впервые изложил способы получения уксуса.
Во времена Эпохи Возрождения (b) уксусную кислоту получали путём возгонки ацетатов некоторых металлов (чаще всего использовался ацетат меди (II)) (при сухой перегонке (b) ацетатов металлов получается ацетон, вполне промышленный способ до середины XX века).
Свойства уксусной кислоты меняются в зависимости от содержания в ней воды (b) . В связи с этим многие века химики ошибочно считали, что кислота (b) из вина и кислота из ацетатов являются двумя разными веществами. Идентичность веществ, полученных различными способами, была показана немецким алхимиком XVI века Андреасом Либавиусом (нем. (b) Andreas Libavius) и французским химиком Пьером Огюстом Аде (фр. (b) Pierre Auguste Adet)[7].
В 1847 году (b) немецкий химик Адольф Кольбе (b) впервые синтезировал уксусную кислоту из неорганических материалов. Последовательность превращений включала в себя хлорирование сероуглерода (b) до тетрахлорметана с последующим пиролизом (b) до тетрахлорэтилена. Дальнейшее хлорирование в воде привело к трихлоруксусной кислоте, которая после электролитического восстановления превратилась в уксусную кислоту[8].
В конце XIX — начале XX века большую часть уксусной кислоты получали перегонкой древесины (b) . Основным производителем уксусной кислоты являлась Германия (b) . В 1910 году (b) ею было произведено более 10 тысяч тонн кислоты, причем около 30 % этого количества было израсходовано на производство красителя индиго (b) [7][9].
Физические свойства
Уксусная кислота — это одноосно́вная карбоновая кислота, представляющая собой бесцветную жидкость (b) с характерным резким запахом (b) и кислым вкусом (b) . Гигроскопична (b) . Неограниченно растворима в воде (b) . Смешивается со многими растворителями (b) ; в уксусной кислоте хорошо растворимы неорганические соединения и газы, такие как HF (b) , HCl (b) , HBr (b) , HI (b) и другие. Существует в виде циклических и линейных димеров[10].
Абсолютная уксусная кислота называется ледяной, так как при замерзании образует льдовидную массу. Способ получения ледяной уксусной кислоты в 1789 году открыл российский химик немецкого происхождения Товий Егорович Ловиц (b) .
| Давление паров (b) (в мм. рт. ст. (b) ): | Температура(°C) |
|---|---|
| 10 | 17,1 |
| 40 | 42,4 |
| 100 | 62,2 |
| 400 | 98,1 |
| 560 | 109 |
| 1520 | 143,5 |
| 3800 | 180,3 |
- Относительная диэлектрическая проницаемость (b) : 6,15 (+20 °C)
- Динамическая вязкость (b) жидкостей и газов (в мПа·с): 1,155 (+25,2 °C); 0,79 (+50 °C)
- Поверхностное натяжение (b) : 27,8 мН/м (+20 °C)
- Удельная теплоёмкость (b) при постоянном давлении: 2,01 Дж/г·K (+17 °C)
- Стандартная энергия Гиббса (b) образования ΔfG0 (298 К, кДж/моль): −392,5 (ж)
- Стандартная энтропия (b) образования ΔfS0 (298 К, Дж/моль·K): 159,8 (ж)
- Энтальпия плавления ΔHпл: 11,53 кДж/моль
- Температура вспышки в воздухе: +38 °C
- Температура самовоспламенения на воздухе: 454 °C
- Теплота сгорания (b) : 876,1 кДж/моль
Уксусная кислота образует двойные азеотропные смеси (b) со следующими веществами.
| Вещество | tкип, °C | массовая доля уксусной кислоты |
|---|---|---|
| четырёххлористый углерод (b) | 76,5 | 3 % |
| циклогексан (b) | 81,8 | 6,3 % |
| бензол (b) | 88,05 | 2 % |
| толуол (b) | 104,9 | 34 % |
| гептан (b) | 91,9 | 33 % |
| трихлорэтилен (b) | 86,5 | 4 % |
| этилбензол (b) | 114,65 | 66 % |
| о-ксилол (b) | 116 | 76 % |
| п-ксилол (b) | 115,25 | 72 % |
| бромоформ (b) | 118 | 83 % |
- Уксусная кислота образует тройные азеотропные смеси
- с водой и бензолом (b) (tкип +88 °C);
- с водой и бутилацетатом (b) (tкип +89 °C).
- Криоскопическая постоянная (b) : 3,6 К кг/моль
Получение
В промышленности
Ранними промышленными методами получения уксусной кислоты были окисление ацетальдегида (b) и бутана (b) [11].
Ацетальдегид окислялся в присутствии ацетата марганца(II) (b) при повышенной температуре и давлении. Выход уксусной кислоты составлял около 95 % при температуре +50—+60 °С.
Окисление н-бутана (b) проводилось при 150 атм (b) . Катализатором этого процесса являлся ацетат кобальта (b) .
Оба метода базировались на окислении продуктов крекинга нефти (b) . В результате повышения цен на нефть оба метода стали экономически невыгодными, и были вытеснены более совершенными каталитическими процессами карбонилирования метанола[11].
Каталитическое карбонилирование метанола
Важным способом промышленного синтеза уксусной кислоты является каталитическое карбонилирование метанола (b) монооксидом углерода (b) [12], которое происходит по формальному уравнению:
Реакция карбонилирования метанола была открыта учеными фирмы BASF (b) в 1913 году. В 1960 году эта компания запустила первый завод, производящий уксусную кислоту этим методом.[13] Катализатором превращения служил йодид кобальта. Метод заключался в барботаже монооксида углерода при температуре 180 °С и давлениях 200—700 атм через смесь реагентов. Выход уксусной кислоты составляет 90 % по метанолу (b) и 70 % по СО. Одна из установок была построена в Гейсмаре (шт. Луизиана (b) ) и долго оставалась единственным процессом BASF (b) в США[14].
Усовершенствованная реакция синтеза уксусной кислоты карбонилированием метанола была внедрена исследователями фирмы Monsanto (b) в 1970 году (b) .[15][16] Это гомогенный процесс, в котором используются соли родия (b) в качестве катализаторов, а также йодид-ионы в качестве промоторов. Важной особенностью метода является большая скорость, а также высокая селективность (99 % по метанолу и 90 % по CO).[11]
Этим способом получают чуть более 50 % всей промышленной уксусной кислоты.[17]
В процессе фирмы BP в качестве катализаторов используются соединения иридия (b) .
Биохимический способ производства
При биохимическом производстве уксусной кислоты используется способность некоторых микроорганизмов окислять этанол (b) . Этот процесс называют уксуснокислым брожением. В качестве сырья используются этанолсодержащие жидкости (вино (b) , забродившие соки (b) ), либо же просто водный раствор этилового спирта (b) [18].
Реакция окисления (b) этанола до уксусной кислоты протекает при участии фермента (b) алкогольдегидрогеназы (b) . Это сложный многоступенчатый процесс, который описывается формальным уравнением[19]:
Гидратация ацетилена (b) в присутствии ртути (b) и двухвалентных солей ртути
- — реакция Кучерова (b)
Химические свойства
Уксусная кислота обладает всеми свойствами карбоновых кислот (b) , и иногда рассматривается как их наиболее типичный представитель (в отличие от муравьиной кислоты (b) , которая обладает некоторыми свойствами альдегидов (b) ). Связь между водородом и кислородом карбоксильной группы (b) (−COOH) карбоновой кислоты является сильно полярной, вследствие чего эти соединения способны легко диссоциировать и проявляют кислотные свойства.
В результате диссоциации уксусной кислоты образуется ацетат-ион CH3COO− и протон H+. Уксусная кислота является слабой одноосновной кислотой со значением pKa в водном растворе равным 4,75. Раствор с концентрацией 1,0 M (b) (приблизительная концентрация пищевого уксуса) имеет pH (b) 2,4, что соответствует степени диссоциации (b) 0,4 %.
На слабой диссоциации уксусной кислоты в водном растворе основана качественная реакция (b) на наличие солей уксусной кислоты: к раствору добавляется сильная кислота (например, серная (b) ), если появляется запах уксусной кислоты, значит, соль уксусной кислоты в растворе присутствует (кислотные остатки уксусной кислоты, образовавшиеся из соли, связались с катионами водорода от сильной кислоты и получилось большое количество молекул уксусной кислоты)[20].
Исследования показывают, что в кристаллическом состоянии молекулы образуют димеры, связанные водородными связями[21].
Уксусная кислота способна взаимодействовать с активными металлами. При этом выделяется водород (b) и образуются соли — ацетаты (b) :
Уксусная кислота может хлорироваться действием газообразного хлора. При этом образуется хлоруксусная кислота:
Этим путём могут быть получены также дихлоруксусная (CHCl2COOH) и трихлоруксусная (CCl3COOH) кислоты.
Уксусная кислота может быть восстановлена до этанола (b) действием алюмогидрида лития (b) . Она также может быть превращена в хлорангидрид действием тионилхлорида (b) . Натриевая соль уксусной кислоты декарбоксилируется при нагревании со щелочью, что приводит к образованию метана (b) и карбоната натрия (b) .
Взаимодействует с растворимыми гидроксидами (щелочами) и не растворимыми гидроксидами
Уксусная кислота в биохимии организмов
Уксусная кислота образуется в живых организмах в процессе углеводного обмена (b) , в том числе в организме человека в процессе биохимических реакции, в частности в цикле Кребса (b) , утилизации (b) алкоголя (b) .
Применение
Уксусную кислоту, концентрация которой близка к 100 %, называют «ледяной». 70—80%-й водный раствор уксусной кислоты называют «уксусной эссенцией», а 3—15%-й — «уксусом (b) »[22]. Водные растворы уксусной кислоты используются в пищевой промышленности (пищевая добавка (b) E260) и бытовой кулинарии, а также в консервировании и для избавления от накипи. Однако количество уксусной кислоты, используемой в качестве уксуса, очень мало, по сравнению с количеством уксусной кислоты, используемой в крупнотоннажном химическом производстве.
Уксусную кислоту применяют для получения лекарственных и душистых веществ, таких как растворитель (b) (например, в производстве ацетилцеллюлозы (b) , ацетона (b) ). Она используется в книгопечатании и крашении.
Уксусная кислота используется как реакционная среда для проведения окисления различных органических веществ. В лабораторных условиях это, например, окисление органических сульфидов (b) пероксидом водорода (b) , в промышленности — окисление пара-ксилола (b) кислородом воздуха в терефталевую кислоту (b) .
Поскольку пары уксусной кислоты обладают резким раздражающим запахом, возможно её применение в медицинских целях в качестве замены нашатырного спирта (b) для выведения больного из обморочного состояния (что является нежелательным, если только это необходимо для его эвакуации из опасного места его собственными силами).
Токсикология
Безводная уксусная кислота — едкое вещество. Пары уксусной кислоты раздражают слизистые оболочки верхних дыхательных путей. Предельно допустимая концентрация (b) в атмосферном воздухе (b) составляет 0,06 мг/м3, в воздухе рабочих помещений — 5 мг/м3[10][23]. Порог восприятия запаха уксусной кислоты в воздухе по данным [10],[24] составляет 300—500 мг/м3 (т.е. в 100 раз превышает ПДК).
Местное действие уксусной кислоты на биологические ткани зависит от степени её разбавления водой. Опасными считаются растворы, в которых концентрация кислоты превышает 30 %[10]. Концентрированная уксусная кислота способна вызывать химические ожоги, инициирующие развитие коагуляционных некрозов (b) прилегающих тканей (b) различной протяженности и глубины[25].
Токсикологические свойства уксусной кислоты не зависят от способа, которым она была получена[26]. Смертельная разовая доза составляет примерно 20 мл (при энтеральном приёме в перерасчёте на 100 % кислоту).
Последствиями приёма внутрь концентрированной уксусной кислоты являются тяжёлый ожог слизистой оболочки полости рта, глотки (b) , пищевода (b) и желудка (b) ; общетоксические последствия отравления уксусной кислотой — ацидоз (b) , гемолиз (b) , гемоглобинурия (b) , нарушение свёртываемости крови, сопровождающееся тяжёлыми желудочно-кишечными кровотечениями. Характерно значительное сгущение крови из-за потери плазмы через обожжённую слизистую оболочку, что может вызвать шок (b) . К опасным осложнениям отравления уксусной эссенцией относятся острая почечная недостаточность (b) и токсическая дистрофия печени (b) .
В качестве первой помощи при приёме уксусной кислоты внутрь следует выпить большое количество жидкости. Вызов рвоты является крайне опасным, так как вторичное прохождение кислоты по пищеводу усугубит ожог, также кислое содержимое может попасть в дыхательные пути. Допускается в целях нейтрализации кислоты и защиты слизистой приём жжёной магнезии (b) , сырого яичного белка, киселя. Нельзя употреблять в этих целях соду (b) , так как образующийся углекислый газ и вспенивание будет также способствовать забросу кислоты обратно в пищевод, гортань, а также может привести к прободению стенок желудка. Показано промывание желудка через зонд. Необходима немедленная госпитализация.
При ингаляционном отравлении парами требуется ополоснуть слизистые водой или 2 % раствором пищевой соды (b) , приём внутрь молока, слабого щелочного раствора (2 % сода, щелочные минеральные воды) с последующей госпитализацией.
Примечания
- 1 2 3 CRC Handbook of Chemistry and Physics (англ.) / W. M. Haynes — 95 — Boca Raton (b) : CRC Press (b) , 2014. — P. 6—182. — ISBN 978-1-4822-0868-9
- 1 2 3 4 CRC Handbook of Chemistry and Physics (англ.) / W. M. Haynes — 95 — Boca Raton (b) : CRC Press (b) , 2014. — P. 6—232. — ISBN 978-1-4822-0868-9
- 1 2 3 4 http://www.cdc.gov/niosh/npg/npgd0002.html
- ↑ CRC Handbook of Chemistry and Physics (англ.) / W. M. Haynes — 95 — Boca Raton (b) : CRC Press (b) , 2014. — P. 16—19. — ISBN 978-1-4822-0868-9
- ↑ http://www.cdc.gov/niosh/ipcsneng/neng0363.html
- 1 2 CRC Handbook of Chemistry and Physics (англ.) / W. M. Haynes — 95 — Boca Raton (b) : CRC Press (b) , 2014. — P. 6—95. — ISBN 978-1-4822-0868-9
- 1 2 3 Martin, Geoffrey. Industrial and Manufacturing Chemistry (неопр.). — Part 1, Organic. — London: Crosby Lockwood, 1917. — С. 330—31.
- ↑ Goldwhite, Harold. Short summary of the career of the German organic chemist, Hermann Kolbe (англ.) // New Haven Section Bull. Am. Chem. Soc. : journal. — 2003. — September (vol. 20, no. 3). Архивировано 4 марта 2009 года.
- ↑ Schweppe, Helmut. Identification of dyes on old textiles (неопр.) // J. Am. Inst. Conservation. — 1979. — Т. 19, № 1/3. — С. 14—23. — doi (b) :10.2307/3179569. Архивировано 29 мая 2009 года.
- 1 2 3 4 Уксусная кислота. Дата обращения: 8 сентября 2009. Архивировано 5 июня 2008 года.
- 1 2 3 Реутов О. А. Органическая химия. — М.: Изд-во МГУ, 1999. — Т. 4.
- ↑ Advances in Organometallic Chemistry. Дата обращения: 3 октября 2017. Архивировано 17 сентября 2014 года.
- ↑ Acetic Acid Production and Manufacturing Process. Дата обращения: 13 сентября 2009. Архивировано 6 октября 2009 года.
- ↑ Б. Лич. Катализ в промышленности. Том 1. — Москва: Мир, 1986. — 324 с.
- ↑ U.S. Patent 3 769 329
- ↑ Патент США
- ↑ Экологический фактор, или Окружающая среда как стимул эволюции промышленной химии. Дата обращения: 11 сентября 2009. Архивировано 28 января 2010 года.
- ↑ Кандидат биологических наук Н. Кустова. Уксус. Что это такое и как его делают. Интернет-ресурс «Всякая всячина». Дата обращения: 2 сентября 2010. Архивировано из оригинала 20 октября 2009 года.
- ↑ Биотехнология органических кислот и белковых препаратов: Учебное пособие (недоступная ссылка)
- ↑ Ходаков Ю. В., Эпштейн Д. А., Глориозов П. А. § 8. Реакции ионного обмена // Неорганическая химия. Учебник для 9 класса. — 7-е изд. — М.: Просвещение (b) , 1976. — С. 15—18. — 2 350 000 экз.
- ↑ Jones, R.E.; Templeton, D.H. The crystal structure of acetic acid (англ.) // Acta Crystallogr. (англ.) (рус. (b) : journal. — International Union of Crystallography (b) , 1958. — Vol. 11, no. 7. — P. 484—87. — doi (b) :10.1107/S0365110X58001341.
- ↑ Уксус — статья из Большой советской энциклопедии (b) .
- ↑ (Роспотребнадзор). № 2400. Этановая кислота (уксусная кислота) // ГН 2.2.5.3532-18 «Предельно допустимые концентрации (ПДК) вредных веществ в воздухе рабочей зоны» / утверждены А.Ю. Поповой (b) . — Москва, 2018. — С. 162. — 170 с. — (Санитарные правила).Архивная копия от 12 июня 2020 на Wayback Machine (b)
- ↑ Balavoine P. Observatiojns sur les Qualités Olfactifves et Gustatives des Aliments (англ.) // Mitteilungen aus dem Gebiete der Lebensmitteluntersuchung und Hygiene. — Bern: BAG, 1948. — Vol. 39. — P. 342–350. — ISSN (b) 1424-1307. цитируется по: Odor Threshold ValuesАрхивная копия от 11 июля 2020 на Wayback Machine (b) p. 73.
- ↑ Уксусная кислота : Медицинский портал Eurolab. Дата обращения: 8 сентября 2009. Архивировано 15 декабря 2010 года.
- ↑ www.textra-vita.com/technology Глава 17. Уксусная кислота 7. Токсиколого-гигиеническая оценка. Дата обращения: 16 мая 2011. Архивировано из оригинала 25 мая 2012 года.
Ссылки
- Уксусная кислота
- Плотность водных растворов уксусной кислоты в зависимости от концентрации
Уксусная кислота это органическое соединение, относящееся к группе карбоновых кислот. Его формула CH3COOH, где метильная группа присоединена к карбоксильной функциональной группе.
Его название IUPAC-этановая кислота. Уксусная кислота является основным компонентом уксуса и известна с древних времен.
Раствор уксуса содержит уксусную кислоту и воду, где этановая кислота составляет от 5 до 20% по объему. Уксусная кислота в уксусе отвечает за его резкий запах и кислый вкус.
Он также имеет множество других важных применений. Здесь мы также узнаем о физических и химических свойствах уксусной кислоты.
Содержание статьи
- 1 Что такое уксусная кислота
- 2 Молярная масса CHCOOH
- 3 Физические свойства уксусной кислоты
- 4 Температура плавления уксусной кислоты
- 5 Химические свойства уксусной кислоты
- 5.1 Кислотность (Реакция с металлами, щелочами)
- 5.2 Хлориды кислот
- 5.3 Кислотный ангидрид
- 5.4 Эфир
- 5.5 CH3COOH в качестве растворителя
- 6 Получение Уксусной Кислоты
- 6.1 Другие Методы
- 6.1.1 Окисление этилена
- 6.1.2 Окислительная ферментация
- 6.1 Другие Методы
- 7 Реакции с уксусной кислотой
- 7.1 Применение уксусной кислоты
- 8 Часто задаваемые вопросы?
Что такое уксусная кислота
Этановая кислота-вторая по простоте карбоновая кислота.
- Структура этановой кислоты приведена CH3COOH.
- В твердом состоянии уксусной кислоты существует цепочка молекул с отдельными молекулами, соединенными водородными связями.
- В парообразном состоянии его димеры находятся при температуре около 120°C.
- Когда он находится в жидкой фазе, его димеры обнаруживаются в разбавленном растворе.
Структура уксусной кислоты.
Уксусная кислота с химической формулой CH3COOH также известна как этановая кислота. Это бесцветная жидкость с характерным резким запахом.
Это органическое соединение растворимо в воде и более кисло, чем H2О, но менее кисло, чем минеральные кислоты.
5-8% уксусной кислоты в воде называется уксусом и широко используется в качестве консервантов в соленых огурцах.
Структура CH3COOH в твердом состоянии существует в цепочке молекул, и они связаны друг с другом водородными связями.
Неразбавленная его версия также известна как ледяная уксусная кислота, потому что она имеет температуру плавления 16 ° C и, следовательно, часто замерзает зимой, когда погода холодная.
Молярная масса CHCOOH
По расчетам, молярная масса уксусной кислоты составляет 60,05 г/моль. Его можно рассчитать как:
(2 × 12.011) + (4 × 1.00794) + (2×15.999) г/моль = 60,05 г/моль
Физические свойства уксусной кислоты
Некоторые важные физические свойства уксусной кислоты перечислены ниже.
- Этановая или уксусная кислота имеет резкий уксусный запах и кислый вкус.
- Это бесцветная жидкость.
- Он закипает при 391 тыс.
- Его плотность в жидком виде составляет 1,049 г/см3.
- Он может смешиваться с водой, спиртом, эфиром во всех пропорциях.
- В воде он растворяется с выделением тепла и уменьшением объема.
- Он агрессивен по своей природе и вызывает появление волдырей при контакте с кожей.
В нем растворены сера, йод и многие другие органические соединения.
Температура плавления уксусной кислоты
Температура плавления уксусной кислоты составляет 289,5 К или 16,5°С.
При охлаждении ниже этой температуры он образует кристаллы, похожие на лед. Поэтому чистую и безводную кислоту обычно называют ледяной уксусной кислотой, где ледяная означает ледяная.
Химические свойства уксусной кислоты
Уксусная кислота является второй простейшей формой метильной группы, содержащей карбоновую кислоту, с химическим названием CH3 и связана с группой карбоновых кислот (COOH).
Другими словами, мы можем сказать, что это ацетильная группа (CH3CO), связанная с гидроксильной группой (OH).
Структура CH3COOH показывает, что она содержит гибридизацию sp 2. Этановая кислота ведет себя как димер в жидком и парообразном состоянии из-за межмолекулярной водородной связи. На рисунке 2 показана структура.
Кислотность (Реакция с металлами, щелочами)
1. Известно, что этановая кислота вступает в реакцию с активными металлами, такими как Na, с выделением водорода. Эта реакция аналогична реакции этанола.
CH3COOH + Na → CH3COONa+H2
2. Уксусная кислота вступает в реакцию с NaOH с образованием соли и воды.
CH3COOH + NaOH → CH3COONa + H2O
3.CH3COOH также вступает в реакцию с карбонатом натрия и гидрокарбонатом натрия, которые являются более слабыми основаниями и выделяют CO2.
Na2CO3 + 2 CH3COOH → 2 CH3COONa + CO2 + H2O
CH3COOH + NaHCO3 → NaC3COO + H2O + CO2
Хлориды кислот
Он вступает в реакцию с тионилхлоридом и образует ацетилхлорид.
CH3COOH + SOCl2 → CH3COCl + HCl + SO2
Кислотный ангидрид
Уксусная кислота вступает в реакцию с хлоридом кислоты в присутствии основания и высвобождает уксусный ангидрид.
CH3CO2H → CH2 =C=O + H2O
CH3CO2H + CH2=C=O → (CH3CO)2O
Эфир
Когда любой спирт вступает в реакцию с любой карбоновой кислотой, он образует сложные эфиры. Когда уксусная кислота вступает в реакцию с этиловым спиртом, это приводит к образованию этилэтаноата.
CH3COOH + C2H5OH → CH3COOC2H5 + H2O
CH3COOH в качестве растворителя
Уксусная кислота является полярным протонным растворителем. Это кислотный растворитель, так как он может передавать ион H+ растворяемому веществу.
Он часто используется в таких реакциях, как алкилирование Фриделя-Крафта. С его помощью можно получить терефталевую кислоту.
Некоторые важные химические свойства уксусной кислоты приведены ниже:
- Карбоксильная функциональная группа в этановой кислоте вызывает ионизацию соединения, получаемого в результате реакции: CH3COOH ⇌ CH₃COO⁻ + H⁺
- Кислотное качество уксусной кислоты обусловлено высвобождением протона, описанного выше в равновесной реакции.
- В растворе воды константа кислотной диссоциации (pKa) этановой кислоты 4,76.
- CHCOO⁻, ацетат является конъюгированным основанием уксусной кислоты.
- Уксусная кислота не диссоциирует полностью, так как видно, что рН раствора этановой кислоты с концентрацией 1,0 М составляет 2,4.
- Уксусная кислота-полярный протонный растворитель с диэлектрической проницаемостью 6,2 в жидкой форме.
Получение Уксусной Кислоты
Этановая кислота получают промышленным способом главным образом путем карбонилирования. Этот процесс состоит из следующих этапов
1. CH3OH + HI → CH3I + H2O
2. CH3I + CO → CH3COI
3. CH3COI + H2O → CH3COOH + HI
Другие Методы
Окисление ацетальдегида
2 CH3CHO + O2 → 2 CH3CO2Н
При некоторых условиях и с использованием катализаторов может образовываться уксусная кислота. В этой реакции образуется несколько значительных побочных продуктов, например муравьиная кислота, этилацетат и т.д.
Окисление этилена
В присутствии палладиевого катализатора мы можем получить уксусную кислоту из этилена.
C2Н4 + O2 → CH3CO2Н
Окислительная ферментация
В присутствии достаточного количества кислорода уксуснокислые бактерии могут производить этановую кислоту из пищевых продуктов.
C2H5OH + O2 → CH3COOH + H2O
Анаэробное Брожение
C6H12O6 → 3 CH3COOH
Некоторые анаэробные бактерии, такие как ацетобактерии, могут превращать сахар непосредственно в уксусную кислоту.
Помимо этих методов, исследователи также пытаются получить уксусную кислоту путем окисления отходящих газов промышленных процессов
Реакции с уксусной кислотой
Уксусная кислота подвергается почти всем реакциям карбоновой кислоты.
- Уксусная кислота подвергается разложению при нагревании выше 440°C с образованием либо метана и двуокиси углерода, либо воды и этанола, указанных в уравнениях.
CH3COOH + Тепло → CO + CH4
Ch3COOH + Тепло → H2C=C=O + H2O
- При воздействии уксусной кислоты некоторые металлы, такие как магний, железо и цинк, подвергаются коррозии. Эта реакция приводит к образованию ацетатных солей. Когда магний вступает в реакцию с уксусной кислотой, он дает ацетат магния и водород, указанные в уравнении.
2CH3COOH + Mg → Mg(CH3COO)2 (ацетат магния) + H2
- Ацетатные соли образуются, когда уксусная кислота вступает в реакцию со щелочами, как описано в уравнении.
ЧКУХ + КОХ → ЧКУК + Н2О
- Соединения, образующиеся при реакции с карбонатами, представляют собой соли ацетата, воду и диоксид углерода.
2CH3COOH + Na2CO3 (карбонат натрия) → 2CH3COONa +CO2 + H2O
CH3COOH + NaHCO3 (бикарбонат натрия) → CH3COOHNa +CO2 +H2O
Применение уксусной кислоты
- Этановая кислота используется в производстве различных красителей, пластмасс, тканей, шелка и парфюмерии.
- Его проще всего использовать в качестве столового уксуса.
- В медицине он используется как местное раздражающее средство.
- В резиновой промышленности он также используется в качестве коагулянта.
- Он также используется в качестве коагулирующего агента в резиновой промышленности.
- Он полезен при производстве ацетата, ацетона и сложных эфиров, используемых в различных отраслях промышленности.
- Он широко используется в производстве VAM (мономера винилацетата).
- При лечении рака его вводят непосредственно в опухоль.
- Уксусная кислота обладает желательными свойствами растворителя, а также способностью образовывать смешиваемые смеси как с полярными, так и с неполярными соединениями. Следовательно, это очень важный промышленный растворитель. Он широко используется в промышленном производстве диметилтерефталата (ДМТ).
- Это активное бактерицидное дезинфицирующее средство, которое также эффективно против большинства других бактерий.
Часто задаваемые вопросы?
Какие физические свойства у уксусная кислота?
Физические свойства уксусной кислоты. Уксусная кислота в чистом виде – это бесцветная жидкость, которая имеет плотность 1, 05 г/см2. Она способна интенсивно поглощать влагу из воздуха.
Достигая температуры 16,6°С кислота кристаллизуется в бесцветные кристаллы, плотность которых – 1,105 г/см2.
Какая это кислота CH3COOH?
Уксусная кислота (CH3COOH) – это концентрированный уксус, знакомый человечеству с давних времён. Его изготовляли путём брожения вина, т.е. углеводов и спиртов.
Сколько процентов уксусная кислота?
Уксусную кислоту, концентрация которой близка к 100 %, называют ледяной. 70—80%-й водный раствор уксусной кислоты называют уксусной эссенцией, а 3—15%-й — уксусом.
Какова плотность ледяной уксусной кислоты?
100% уксусная кислота («ледяная») имеет плотность около 1,05 кг/л, таким образом при росте концентрации CH3COOH плотность раствора сначала возрастает, но затем (при концентрациях от 80% до 100%) убывает до 1,05 кг/л. С ростом температуры плотность раствора снижается.
Приведите некоторые методы приготовления уксусной кислоты?
В промышленности уксусную кислоту получают карбонилированием метанола. Эти два соединения вступают в реакцию с образованием промежуточного продукта йодистого метила, который затем вступает в реакцию с монооксидом углерода.
Полученное соединение вступает в реакцию с водой с образованием уксусной кислоты. Здесь карбонильный комплекс необходим в качестве катализатора на второй стадии.
Уравнения процесса подготовки являются:
CH3OH (метанол) + HI (йодистый водород) → CH3I (промежуточное соединение йодистого метила) + H2O
CO (монооксид углерода) + CH3I → CH3COI (ацетил иодид)
H2O+CH3COI→ CH3COOH (уксусная кислота) + HI
Другим методом подготовки является :
Он также может быть получен окислением ацетальдегида, где в качестве металлических катализаторов могут быть использованы нафталиновые соли кобальта, хрома и марганца.
2CH3CHO+ O2 → 2CH3COOH.
В чем может заключаться опасность уксусной кислоты?
Хотя уксусная кислота является слабой кислотой, но ее концентрированная форма вызывает коррозию кожи, которая вызывает волдыри и ожоги.
Длительное воздействие паров уксусной кислоты при вдыхании около восьми часов при 10 промилле может вызвать некоторое раздражение глаз, носа и горла.
Раздражение легких и возможное повреждение легких, глаз и кожи могут привести к 100 промилле.
Работники, контактирующие с уксусной кислотой в течение длительного периода, могут страдать бронхитом, фарингитом, эрозией открытых зубов, а также конъюнктивитом. Таким образом, в основном опасность зависит от концентрации кислоты.
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Справочник содержит названия веществ и описания химических формул (в т.ч. структурные формулы и скелетные формулы).
Введите часть названия или формулу для поиска:
Уксусная кислота
Брутто-формула:
C2H4O2
CAS# 64-19-7
Названия
Русский:
- Уксусная кислота [Wiki]
- Этановая кислота(IUPAC)
English:
- Acetasol
- Acetic acid(CAS) [Wiki]
- Ethanoic acid(IUPAC)
- Ethylic acid
- Glacial acetic acid
- Methanecarboxylic acid
- Vinegar acid
Варианты формулы:
H`|C<_(A-170,w+)H><_(A-110,d+)H>/C`|O|OH
Реакции, в которых участвует Уксусная кислота
-
{R}/`|O|OH + HO/CH3 -> {R}/`|O|O/CH3 + H2O
, где R =
H H3C H3C H3C/ -
{R}/`|O|H + 2[Ag(NH3)2]OH -> 2Ag»|v» + {R}/`|O|OH + 4NH3 + H2O
, где R =
H H3C H3C HO/<`|wOH><|dOH>/<`|dOH><|dOH> -
Na2SiO3 + 2CH3COOH -> 2CH3COONa + H2SiO3″|v»
-
2H3C/`|O|H + O2 -> 2H3C/`|O|OH
-
2H3C//CH3 + 5O2 -> 4H3C/`|O|OH + 2H2O
Химические свойства уксусной кислоты

4.2
Средняя оценка: 4.2
Всего получено оценок: 645.
4.2
Средняя оценка: 4.2
Всего получено оценок: 645.
Этановая или уксусная кислота – это слабая карбоновая кислота, которая широко применяется в промышленности. Химические свойства уксусной кислоты определяет карбоксильная группа COOH.
Физические свойства
Уксусная кислота (CH3COOH) – это концентрированный уксус, знакомый человечеству с давних времён. Его изготовляли путём брожения вина, т.е. углеводов и спиртов.
По физическим свойствам уксусная кислота – бесцветная жидкость с кислым вкусом и резким запахом. Попадание жидкости на слизистые оболочки вызывает химический ожог. Уксусная кислота обладает гигроскопичностью, т.е. способна поглощать водяные пары. Хорошо растворима в воде.
Основные физические свойства уксуса:
- температура плавления – 16,75°C;
- плотность – 1,0492 г/см3;
- температура кипения – 118,1°C;
- молярная масса – 60,05 г/моль;
- теплота сгорания – 876,1 кДж/моль.
В уксусе растворяются неорганические вещества и газы, например, бескислородные кислоты – HF, HCl, HBr.
Получение
Способы получения уксусной кислоты:
- из ацетальдегида путём окисления атмосферным кислородом в присутствии катализатора Mn(CH3COO)2 и высокой температуре (50-60°С) – 2CH3CHO + O2 → 2CH3COOH;
- из метанола и угарного газа в присутствии катализаторов (Rh или Ir) – CH3OH + CO → CH3COOH;
- из н-бутана путём окисления в присутствии катализатора при давлении 50 атм и температуре 200°C – 2CH3CH2CH2CH3 + 5O2 → 4CH3COOH + 2H2O.
Уравнение брожения выглядит следующим образом – СН3СН2ОН + О2 → СН3СООН + Н2О. В качестве сырья используется сок или вино, кислород и ферменты бактерий или дрожжей.
Химические свойства
Уксусная кислота проявляет слабые кислотные свойства. Основные реакции уксусной кислоты с различными веществами описаны в таблице.
|
Взаимодействие |
Что образуется |
Пример |
|
С металлами |
Соль, водород |
Mg + 2CH3COOH → (CH3COO)2Mg + H2 |
|
С оксидами |
Соль, вода |
CaO + 2CH3COOH → (CH3COO)2Ca + H2O |
|
С основаниями |
Соль, вода |
CH3COOH + NaOH → CH3COONa + H2O |
|
С солью |
Соль, углекислый газ, вода |
2CH3COOH + K2CO3 → 2CH3COOK + CO2 + H2O |
|
С неметаллами (реакция замещения) |
Органическая и неорганическая кислоты |
– CH3COOH + Cl2 → CH2ClCOOH (хлоруксусная кислота) + HCl; – CH3COOH + F2 → CH2FCOOH (фторуксусная кислота) + HF; – CH3COOH + I2 → CH2ICOOH (иодуксусная кислота) + HI |
|
С кислородом (реакция окисления) |
Углекислый газ и вода |
CH3COOH + 2O2 → 2CO2 + 2H2O |
Эфиры и соли, которые образует уксусная кислота, называются ацетатами.
Применение
Уксусная кислота широко применяется в различных отраслях:
- в фармацевтике – входит в состав лекарственных препаратов;
- в химической промышленности – используется для производства ацетона, красителей, ацетилцеллюлозы;
- в пищевой промышленности – применяется для консервации и вкуса;
- в лёгкой промышленности – используется для закрепления краски на ткани.
Уксусная кислота является пищевой добавкой под маркировкой Е260.
Что мы узнали?
CH3COOH – уксусная кислота, получаемая из ацетальдегида, метанола, н-бутана. Это бесцветная жидкость с кислым вкусом и резким запахом. Из разбавленной уксусной кислоты производят уксус. Кислота обладает слабыми кислотными свойствами и реагирует с металлами, неметаллами, оксидами, основаниями, солями, кислородом. Уксусная кислота широко применяется в фармацевтике, пищевой, химической и лёгкой промышленности.
Тест по теме
Доска почёта

Чтобы попасть сюда — пройдите тест.
-
Александр Балабан
5/5
-
Елизавета Маркова
5/5
Оценка доклада
4.2
Средняя оценка: 4.2
Всего получено оценок: 645.
А какая ваша оценка?