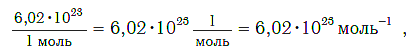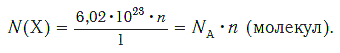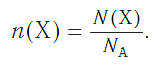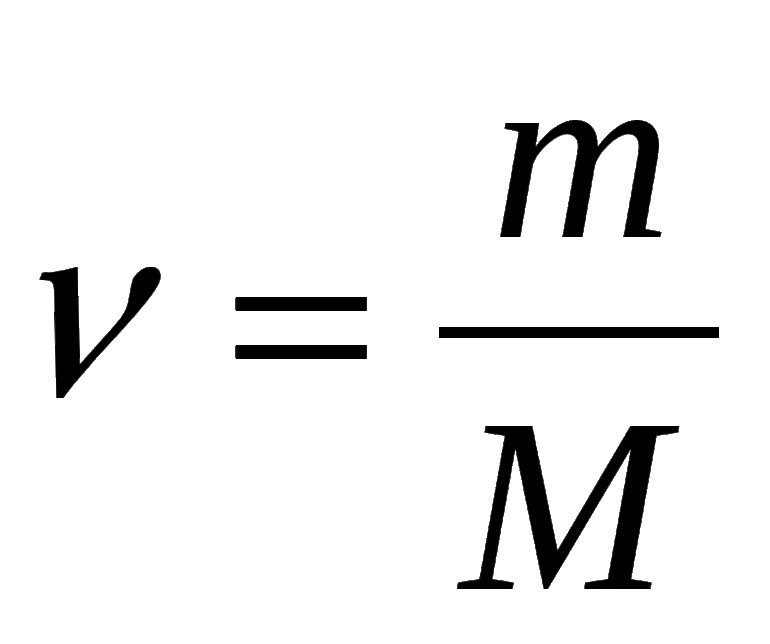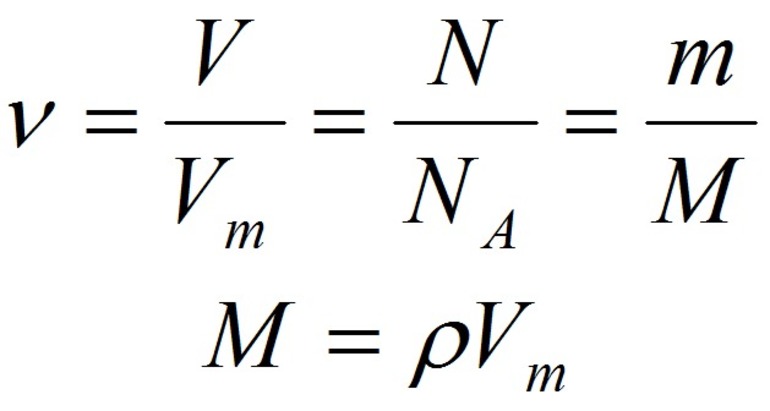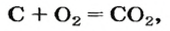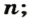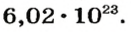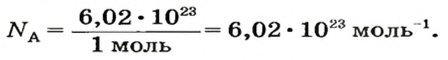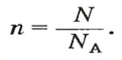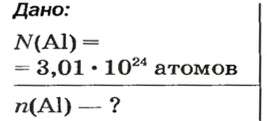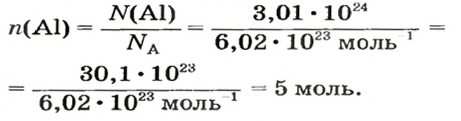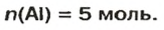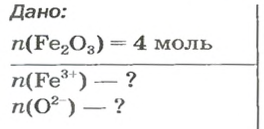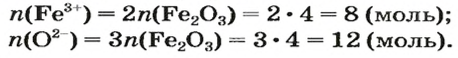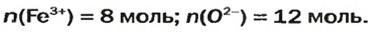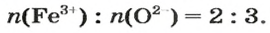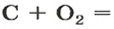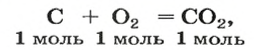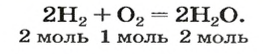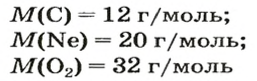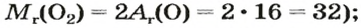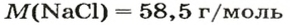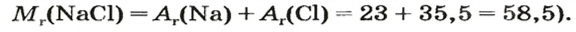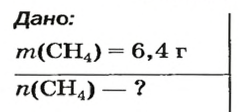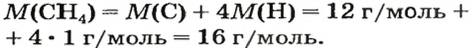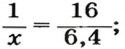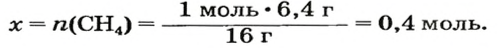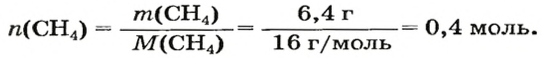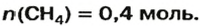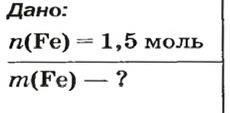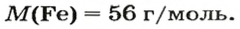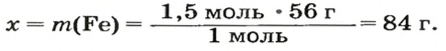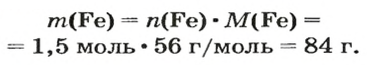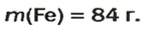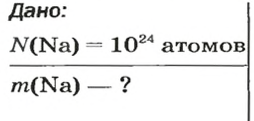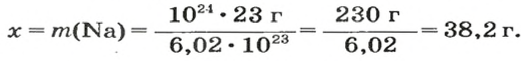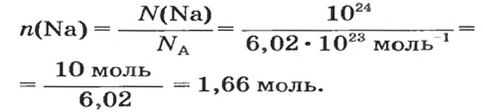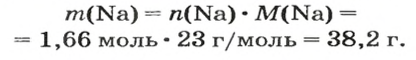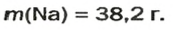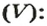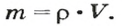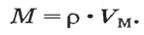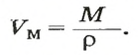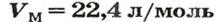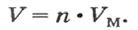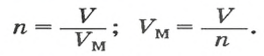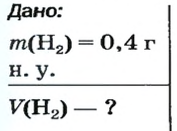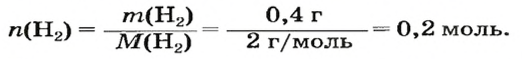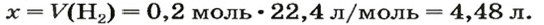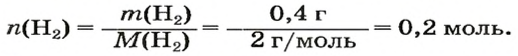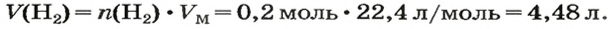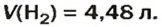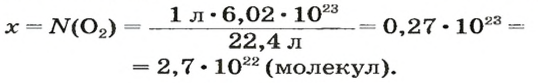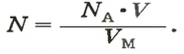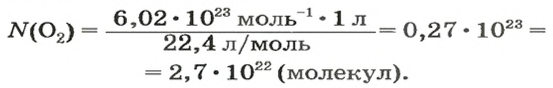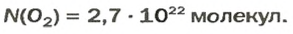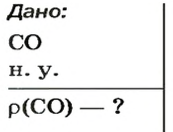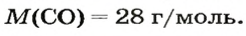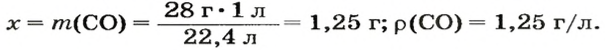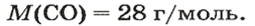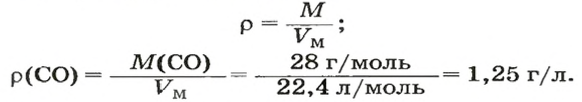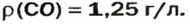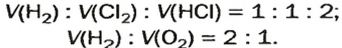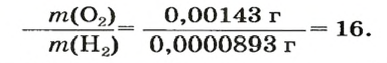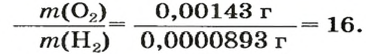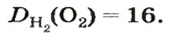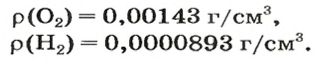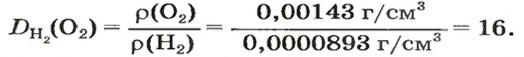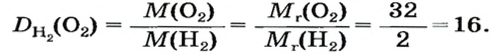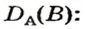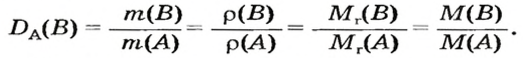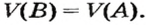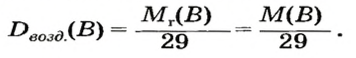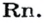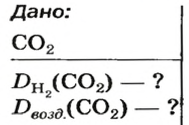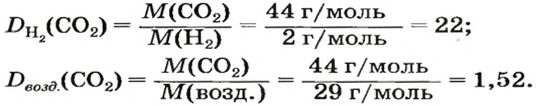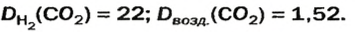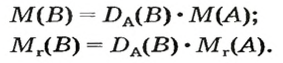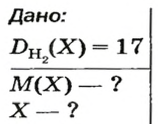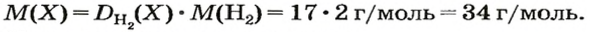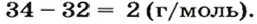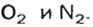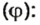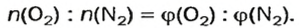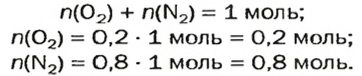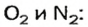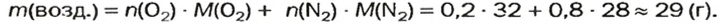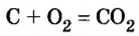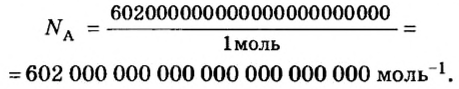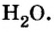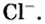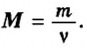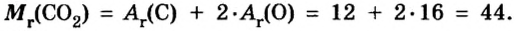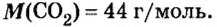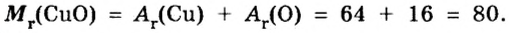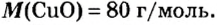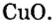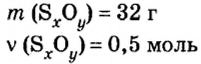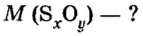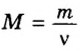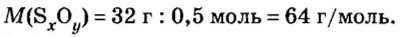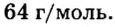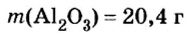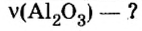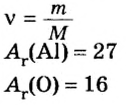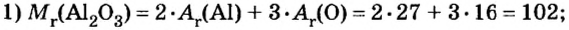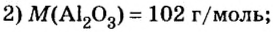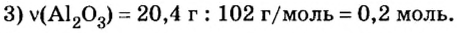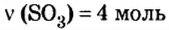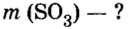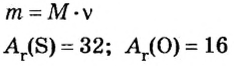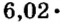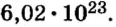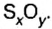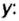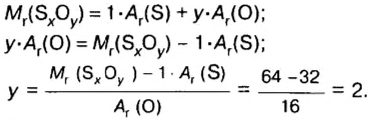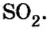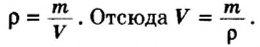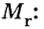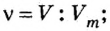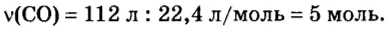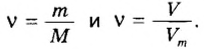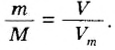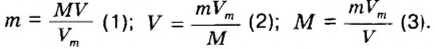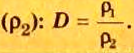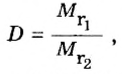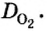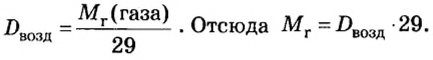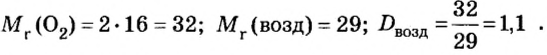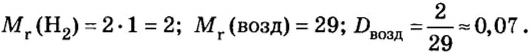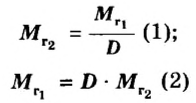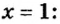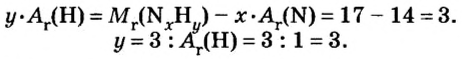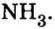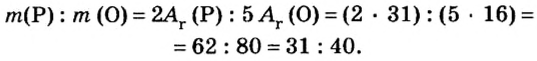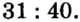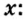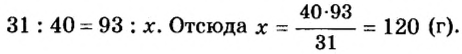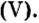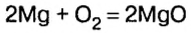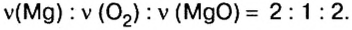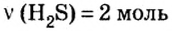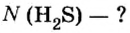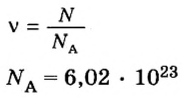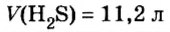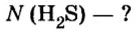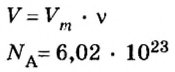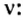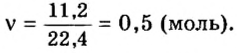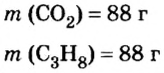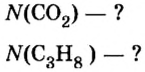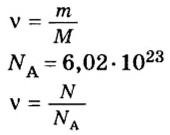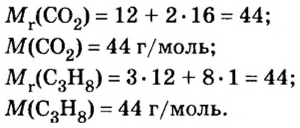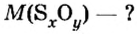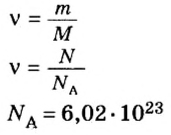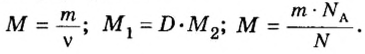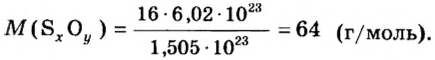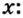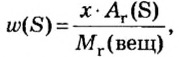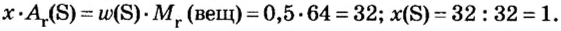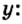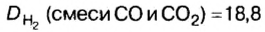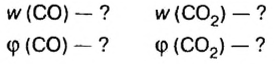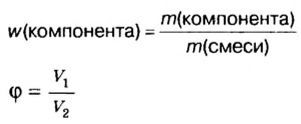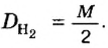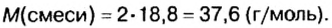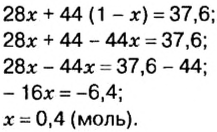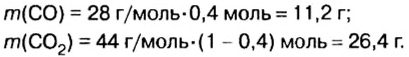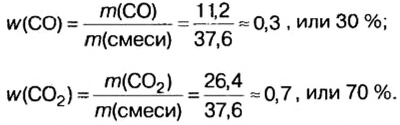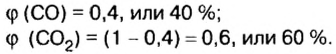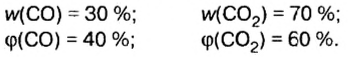В уроке 8 «Химическое количество вещества и моль» из курса «Химия для чайников» выясним, что такое химическое количество вещества; рассмотрим моль в качестве единицы количества вещества, а также познакомимся с постоянной Авогадро. Напоминаю, что в прошлом уроке «Относительная молекулярная и относительная формульная массы» мы научились вычислять относительную молекулярную массу, а также относительную формульную массу веществ; кроме того, выяснили что такое массовая доля и привели формулу для ее вычисления.
Любое чистое вещество имеет свою химическую формулу, т. е. характеризуется определенным качественным и количественным составом.
Если необходима какая-то порция твердого вещества, то для этого следует взять нужную его массу, т. е. взвесить вещество (рис. 43). Нужный объем жидкого вещества обычно отмеряют с помощью мензурки или мерного цилиндра (рис. 44). Для отбора необходимой порции (объема) газообразных веществ применяют специальные емкости — газометры (рис. 45).
Следовательно, объем и масса — это величины, характеризующие данную порцию вещества.
Химическое количество вещества
В жизни мы часто не различаем понятия «масса» и «количество». А это разные понятия. Когда вы говорите: «Я купил 2 кг груш», то здесь речь идет о массе груш. Но если вы говорите: «Я купил 10 груш», то в этом случае речь идет о количестве груш. Массу вещества измеряют в граммах, килограммах, тоннах, а количество — в штуках.
Груши можно пересчитать поштучно, а если это, например, зерна? Тут уже посчитать каждое зернышко даже в небольшой емкости сложно. Поэтому зерно обычно продают мешками, т. е. определенными порциями. В каждой такой порции — мешке (если они равны по массе и все зерна одинаковы) — будет находиться практически одно и то же число зерен. Подобным образом продают многие товары. Например, яйца — десятками, спички — спичечными коробками, в каждом из которых находится по 45 спичек (рис. 46).
В химической практике, помимо массы или объема, необходимо знать число структурных единиц (атомов, молекул, формульных единиц), которые содержатся в данной порции вещества, поскольку именно они участвуют в химических реакциях. Поэтому в химии, как и в других естественных науках, используют физическую величину, характеризующую число частиц в рассматриваемой порции вещества. Эта физическая величина называется количеством вещества или, как следует называть ее при химических расчетах, — химическое количество вещества.
Химическое количество вещества — физическая величина, пропорциональная числу структурных единиц, содержащихся в данной порции вещества.
Другими словами, химическое количество вещества — это порция данного вещества, содержащая определенное число его структурных единиц. Химическое количество вещества обозначают латинской буквой n. Это одна из семи основных физических величин Международной системы единиц (СИ).
Моль — единица химического количества вещества
Каждая из основных физических величин имеет свою единицу. Например, единица длины — метр (м), массы — килограмм (кг), времени — секунда (с). Единицей химического количества вещества является моль.
Моль — порция вещества (т. е. такое его химическое количество), которая содержит столько же структурных единиц, сколько атомов содержится в углероде массой 0,012 кг.
Сокращенное обозначение единицы химического количества записывается, как и полное, — моль. Поэтому, если слово «моль» стоит после числа, то оно не склоняется, так же, как и другие сокращенные единицы величин: 3 кг, 5 л, 8 моль. При чтении вслух и при записи числительного буквами слово «моль» склоняется: три килограмма, пять литров, восемь молей.
На заметку. Термины «молекула» и «моль», как нетрудно заметить, однокоренные. Они действительно произошли от одного и того же латинского слова «moles». Но это слово имеет, по крайней мере, два значения. Первое — «маленькая масса». Именно в этом смысле в XVII в. оно превратилось в термин «молекула». А понятие «моль» (в смысле кучка, порция) появилось значительно позже, в начале ХХ в. Автор этого термина известный немецкий химик и физик Оствальд толковал его смысл как «большая масса», как бы противопоставляя термину «молекула».
Число (N) атомов в порции углерода массой 0,012 кг легко определить, зная массу одного атома углерода (19,94·10-27 кг):
Следовательно, в углероде массой 0,012 кг содержатся 6,02·1023 атомов углерода и эта порция составляет 1 моль. Столько же структурных единиц содержится в 1 моль любого вещества.
Величина, равная:
получила название постоянной Авогадро. Она является одной из важнейших универсальных постоянных и обозначается символом NA:
Единица в числителе дроби (1/моль) заменяет название структурной единицы.
Если структурной единицей вещества (например, меди, углерода) является атом, то в порции этого вещества количеством 1 моль содержатся 6,02·1023 атомов. В случае веществ молекулярного строения (вода, углекислый газ) их порции количеством 1 моль содержат по 6,02·1023 молекул. Если структурными единицами веществ немолекулярного строения (например, NaCl или CuSO4) являются их формульные единицы, то в порциях этих веществ количеством 1 моль содержатся по 6,02·1023 формульных единиц.
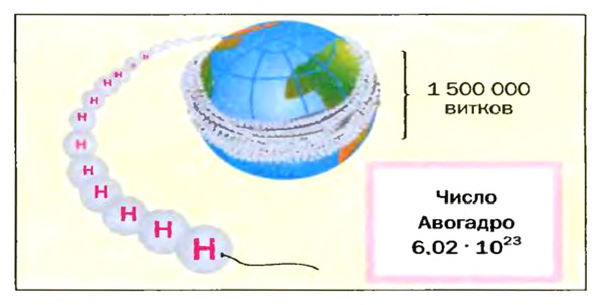
На заметку. Численное значение постоянной Авогадро огромно. О том, насколько велико это число, можно судить по следующему сравнению. Поверхность Земли, включая и водную, равна 510 000 000 км2. Если равномерно рассыпать по всей этой поверхности 6,02·1023 песчинок диаметром 1 мм, то они образуют слой песка толщиной более 1 м.
Зная химическое количество n данного вещества Х, легко рассчитать число молекул (атомов, формульных единиц) N(Х) в этой порции:
если 1 моль вещества содержит 6,02·1023 молекул, то n моль вещества содержат N(Х) молекул.
Отсюда:
И наоборот, по числу структурных единиц можно рассчитать химическое количество вещества:
Пример 1. Определите число молекул, содержащихся в серной кислоте химическим количеством 3 моль.
Спойлер
[свернуть]
Пример 2. Рассчитайте химическое количество CuSO4 в порции, содержащей 36,12·1023 формульных единиц (ФЕ).
Спойлер
[свернуть]
Краткие выводы урока:
- Химическое количество вещества — физическая величина, пропорциональная числу структурных единиц, содержащихся в данной порции вещества.
- Моль — единица химического количества вещества, т. е. такое его количество, которое содержит 6,02·1023 структурных единиц.
Надеюсь урок 8 «Химическое количество вещества и моль» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
In chemistry, the amount of substance n in a given sample of matter is defined as the quantity or number of discrete atomic-scale particles in it divided by the Avogadro constant NA. The particles or entities may be molecules, atoms, ions, electrons, or other, depending on the context, and should be specified (e.g. amount of sodium chloride nNaCl). The value of the Avogadro constant NA has been defined as 6.02214076×1023 mol−1. The mole (symbol: mol) is a unit of amount of substance in the International System of Units, defined (since 2019) by fixing the Avogadro constant at the given value.[1] Sometimes, the amount of substance is referred to as the chemical amount.
Role of amount of substance and its unit mole in chemistry[edit]
Historically, the mole was defined as the amount of substance in 12 grams of the carbon-12 isotope. As a consequence, the mass of one mole of a chemical compound, in grams, is numerically equal (for all practical purposes) to the mass of one molecule of the compound, in daltons, and the molar mass of an isotope in grams per mole is equal to the mass number. For example, a molecule of water has a mass of about 18.015 daltons on average, whereas a mole of water (which contains 6.02214076×1023 water molecules) has a total mass of about 18.015 grams.
In chemistry, because of the law of multiple proportions, it is often much more convenient to work with amounts of substances (that is, number of moles or of molecules) than with masses (grams) or volumes (liters). For example, the chemical fact «1 molecule of oxygen (O
2) will react with 2 molecules of hydrogen (H
2) to make 2 molecules of water (H2O)» can also be stated as «1 mole of O2 will react with 2 moles of H2 to form 2 moles of water». The same chemical fact, expressed in terms of masses, would be «32 g (1 mole) of oxygen will react with approximately 4.0304 g (2 moles of H
2) hydrogen to make approximately 36.0304 g (2 moles) of water» (and the numbers would depend on the isotopic composition of the reagents). In terms of volume, the numbers would depend on the pressure and temperature of the reagents and products. For the same reasons, the concentrations of reagents and products in solution are often specified in moles per liter, rather than grams per liter.
The amount of substance is also a convenient concept in thermodynamics. For example, the pressure of a certain quantity of a noble gas in a recipient of a given volume, at a given temperature, is directly related to the number of molecules in the gas (through the ideal gas law), not to its mass.
This technical sense of the term «amount of substance» should not be confused with the general sense of «amount» in the English language. The latter may refer to other measurements such as mass or volume,[2] rather than the number of particles. There are proposals to replace «amount of substance» with more easily-distinguishable terms, such as enplethy[3] and stoichiometric amount.[2]
The IUPAC recommends that «amount of substance» should be used instead of «number of moles», just as the quantity mass should not be called «number of kilograms».[4]
Nature of the particles[edit]
To avoid ambiguity, the nature of the particles should be specified in any measurement of the amount of substance: thus, a sample of 1 mol of molecules of oxygen (O
2) has a mass of about 32 grams, whereas a sample of 1 mol of atoms of oxygen (O) has a mass of about 16 grams.[5][6]
Derived quantities[edit]
Molar quantities (per mole)[edit]
The quotient of some extensive physical quantity of a homogeneous sample by its amount of substance is an intensive property of the substance, usually named by the prefix molar.[7]
For example, the ratio of the mass of a sample by its amount of substance is the molar mass, whose SI unit is kilograms (or, more usually, grams) per mole; which is about 18.015 g/mol for water, and 55.845 g/mol for iron. From the volume, one gets the molar volume, which is about 17.962 milliliter/mol for liquid water and 7.092 mL/mol for iron at room temperature. From the heat capacity, one gets the molar heat capacity, which is about 75.385 J/K/mol for water and about 25.10 J/K/mol for iron.
Amount concentration (moles per liter)[edit]
Another important derived quantity is the amount of substance concentration[8] (also called amount concentration, or substance concentration in clinical chemistry;[9] which is defined as the amount of a specific substance in a sample of a solution (or some other mixture), divided by the volume of the sample.
The SI unit of this quantity is the mole (of the substance) per liter (of the solution). Thus, for example, the amount concentration of sodium chloride in ocean water is typically about 0.599 mol/L.
The denominator is the volume of the solution, not of the solvent. Thus, for example, one liter of standard vodka contains about 0.40 L of ethanol (315 g, 6.85 mol) and 0.60 L of water. The amount concentration of ethanol is therefore (6.85 mol of ethanol)/(1 L of vodka) = 6.85 mol/L, not (6.85 mol of ethanol)/(0.60 L of water), which would be 11.4 mol/L.
In chemistry, it is customary to read the unit «mol/L» as molar, and denote it by the symbol «M» (both following the numeric value). Thus, for example, each liter of a «0.5 molar» or «0.5 M» solution of urea (CH
4N
2O) in water contains 0.5 moles of that molecule. By extension, the amount concentration is also commonly called the molarity of the substance of interest in the solution. However, as of May 2007, these terms and symbols are not condoned by IUPAC.[10]
This quantity should not be confused with the mass concentration, which is the mass of the substance of interest divided by the volume of the solution (about 35 g/L for sodium chloride in ocean water).
Amount fraction (moles per mole)[edit]
Confusingly, the amount concentration, or «molarity», should also be distinguished from «molar concentration», which should be the number of moles (molecules) of the substance of interest divided by the total number of moles (molecules) in the solution sample. This quantity is more properly called the amount fraction.
History[edit]
The alchemists, and especially the early metallurgists, probably had some notion of amount of substance, but there are no surviving records of any generalization of the idea beyond a set of recipes. In 1758, Mikhail Lomonosov questioned the idea that mass was the only measure of the quantity of matter,[11] but he did so only in relation to his theories on gravitation. The development of the concept of amount of substance was coincidental with, and vital to, the birth of modern chemistry.
- 1777: Wenzel publishes Lessons on Affinity, in which he demonstrates that the proportions of the «base component» and the «acid component» (cation and anion in modern terminology) remain the same during reactions between two neutral salts.[12]
- 1789: Lavoisier publishes Treatise of Elementary Chemistry, introducing the concept of a chemical element and clarifying the Law of conservation of mass for chemical reactions.[13]
- 1792: Richter publishes the first volume of Stoichiometry or the Art of Measuring the Chemical Elements (publication of subsequent volumes continues until 1802). The term «stoichiometry» is used for the first time. The first tables of equivalent weights are published for acid–base reactions. Richter also notes that, for a given acid, the equivalent mass of the acid is proportional to the mass of oxygen in the base.[12]
- 1794: Proust’s Law of definite proportions generalizes the concept of equivalent weights to all types of chemical reaction, not simply acid–base reactions.[12]
- 1805: Dalton publishes his first paper on modern atomic theory, including a «Table of the relative weights of the ultimate particles of gaseous and other bodies».[14]
- The concept of atoms raised the question of their weight. While many were skeptical about the reality of atoms, chemists quickly found atomic weights to be an invaluable tool in expressing stoichiometric relationships.
- 1808: Publication of Dalton’s A New System of Chemical Philosophy, containing the first table of atomic weights (based on H = 1).[15]
- 1809: Gay-Lussac’s Law of combining volumes, stating an integer relationship between the volumes of reactants and products in the chemical reactions of gases.[16]
- 1811: Avogadro hypothesizes that equal volumes of different gases (at same temperature and pressure) contain equal numbers of particles, now known as Avogadro’s law.[17]
- 1813/1814: Berzelius publishes the first of several tables of atomic weights based on the scale of O = 100.[12][18][19]
- 1815: Prout publishes his hypothesis that all atomic weights are integer multiple of the atomic weight of hydrogen.[20] The hypothesis is later abandoned given the observed atomic weight of chlorine (approx. 35.5 relative to hydrogen).
- 1819: Dulong–Petit law relating the atomic weight of a solid element to its specific heat capacity.[21]
- 1819: Mitscherlich’s work on crystal isomorphism allows many chemical formulae to be clarified, resolving several ambiguities in the calculation of atomic weights.[12]
- 1834: Clapeyron states the ideal gas law.[22]
- The ideal gas law was the first to be discovered of many relationships between the number of atoms or molecules in a system and other physical properties of the system, apart from its mass. However, this was not sufficient to convince all scientists of the existence of atoms and molecules, many considered it simply being a useful tool for calculation.
- 1834: Faraday states his Laws of electrolysis, in particular that «the chemical decomposing action of a current is constant for a constant quantity of electricity«.[23]
- 1856: Krönig derives the ideal gas law from kinetic theory.[24] Clausius publishes an independent derivation the following year.[25]
- 1860: The Karlsruhe Congress debates the relation between «physical molecules», «chemical molecules» and atoms, without reaching consensus.[26]
- 1865: Loschmidt makes the first estimate of the size of gas molecules and hence of number of molecules in a given volume of gas, now known as the Loschmidt constant.[27]
- 1886: van’t Hoff demonstrates the similarities in behaviour between dilute solutions and ideal gases.
- 1886: Eugen Goldstein observes discrete particle rays in gas discharges, laying the foundation of mass spectrometry, a tool subsequently used to establish the masses of atoms and molecules.
- 1887: Arrhenius describes the dissociation of electrolyte in solution, resolving one of the problems in the study of colligative properties.[28]
- 1893: First recorded use of the term mole to describe a unit of amount of substance by Ostwald in a university textbook.[29]
- 1897: First recorded use of the term mole in English.[30]
- By the turn of the twentieth century, the concept of atomic and molecular entities was generally accepted, but many questions remained, not least the size of atoms and their number in a given sample. The concurrent development of mass spectrometry, starting in 1886, supported the concept of atomic and molecular mass and provided a tool of direct relative measurement.
- 1905: Einstein’s paper on Brownian motion dispels any last doubts on the physical reality of atoms, and opens the way for an accurate determination of their mass.[31]
- 1909: Perrin coins the name Avogadro constant and estimates its value.[32]
- 1913: Discovery of isotopes of non-radioactive elements by Soddy[33] and Thomson.[34]
- 1914: Richards receives the Nobel Prize in Chemistry for «his determinations of the atomic weight of a large number of elements».[35]
- 1920: Aston proposes the whole number rule, an updated version of Prout’s hypothesis.[36]
- 1921: Soddy receives the Nobel Prize in Chemistry «for his work on the chemistry of radioactive substances and investigations into isotopes».[37]
- 1922: Aston receives the Nobel Prize in Chemistry «for his discovery of isotopes in a large number of non-radioactive elements, and for his whole-number rule».[38]
- 1926: Perrin receives the Nobel Prize in Physics, in part for his work in measuring the Avogadro constant.[39]
- 1959/1960: Unified atomic mass unit scale based on 12C = 12 adopted by IUPAP and IUPAC.[40]
- 1968: The mole is recommended for inclusion in the International System of Units (SI) by the International Committee for Weights and Measures (CIPM).[41]
- 1972: The mole is approved as the SI base unit of amount of substance.[41]
- 2019: The mole is redefined in the SI as «the amount of substance of a system that contains 6.02214076×1023 specified elementary entities».[1]
See also[edit]
- Amount fraction
- International System of Quantities
References[edit]
- ^ a b Bureau International des Poids et Mesures (2019): The International System of Units (SI), 9th edition, English version, p. 134. Available at the BIPM website.
- ^ a b Giunta, Carmen J. (2016). «What’s in a Name? Amount of Substance, Chemical Amount, and Stoichiometric Amount». Journal of Chemical Education. 93 (4): 583–86. Bibcode:2016JChEd..93..583G. doi:10.1021/acs.jchemed.5b00690.
- ^ «E.R. Cohen, T. Cvitas, J.G. Frey, B. Holmström, K. Kuchitsu, R. Marquardt, I. Mills, F. Pavese, M. Quack, J. Stohner, H.L. Strauss, M. Takami, and A.J. Thor, «Quantities, Units and Symbols in Physical Chemistry», IUPAC Green Book, 3rd Edition, 2nd Printing, IUPAC & RSC Publishing, Cambridge (2008)» (PDF). p. 4. Archived from the original (PDF) on 2016-12-20. Retrieved 2019-05-24.
- ^ International Union of Pure and Applied Chemistry (1993). Quantities, Units and Symbols in Physical Chemistry, 2nd edition, Oxford: Blackwell Science. ISBN 0-632-03583-8. p. 4. Electronic version.
- ^ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the «Gold Book») (1997). Online corrected version: (2006–) «amount of substance, n«. doi:10.1351/goldbook.A00297
- ^ International Union of Pure and Applied Chemistry (1993). Quantities, Units and Symbols in Physical Chemistry, 2nd edition, Oxford: Blackwell Science. ISBN 0-632-03583-8. p. 46. Electronic version.
- ^ International Union of Pure and Applied Chemistry (1993). Quantities, Units and Symbols in Physical Chemistry, 2nd edition, Oxford: Blackwell Science. ISBN 0-632-03583-8. p. 7. Electronic version.
- ^ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the «Gold Book») (1997). Online corrected version: (2006–) «amount-of-substance concentration». doi:10.1351/goldbook.A00298
- ^ International Union of Pure and Applied Chemistry (1996). «Glossary of Terms in Quantities and Units in Clinical Chemistry» (PDF). Pure Appl. Chem. 68: 957–1000. doi:10.1351/pac199668040957. S2CID 95196393.
- ^ International Union of Pure and Applied Chemistry (1993). Quantities, Units and Symbols in Physical Chemistry, 2nd edition, Oxford: Blackwell Science. ISBN 0-632-03583-8. p. 42 (n. 15). Electronic version.
- ^ Lomonosov, Mikhail (1970). «On the Relation of the Amount of Material and Weight». In Leicester, Henry M. (ed.). Mikhail Vasil’evich Lomonosov on the Corpuscular Theory. Cambridge, MA: Harvard University Press. pp. 224–33 – via Internet Archive.
- ^ a b c d e «Atome». Grand dictionnaire universel du XIXe siècle. Paris: Pierre Larousse. 1: 868–73. 1866.. (in French)
- ^ Lavoisier, Antoine (1789). Traité élémentaire de chimie, présenté dans un ordre nouveau et d’après les découvertes modernes. Paris: Chez Cuchet.. (in French)
- ^ Dalton, John (1805). «On the Absorption of Gases by Water and Other Liquids». Memoirs of the Literary and Philosophical Society of Manchester. 2nd Series. 1: 271–87.
- ^ Dalton, John (1808). A New System of Chemical Philosophy. Manchester: London.
- ^ Gay-Lussac, Joseph Louis (1809). «Memoire sur la combinaison des substances gazeuses, les unes avec les autres». Mémoires de la Société d’Arcueil. 2: 207. English translation.
- ^ Avogadro, Amedeo (1811). «Essai d’une maniere de determiner les masses relatives des molecules elementaires des corps, et les proportions selon lesquelles elles entrent dans ces combinaisons». Journal de Physique. 73: 58–76. English translation.
- ^ Excerpts from Berzelius’ essay: Part II; Part III.
- ^ Berzelius’ first atomic weight measurements were published in Swedish in 1810: Hisinger, W.; Berzelius, J.J. (1810). «Forsok rorande de bestamda proportioner, havari den oorganiska naturens bestandsdelar finnas forenada». Afh. Fys., Kemi Mineral. 3: 162.
- ^ Prout, William (1815). «On the relation between the specific gravities of bodies in their gaseous state and the weights of their atoms». Annals of Philosophy. 6: 321–30.
- ^ Petit, Alexis Thérèse; Dulong, Pierre-Louis (1819). «Recherches sur quelques points importants de la Théorie de la Chaleur». Annales de Chimie et de Physique. 10: 395–413. English translation
- ^ Clapeyron, Émile (1834). «Puissance motrice de la chaleur». Journal de l’École Royale Polytechnique. 14 (23): 153–90.
- ^ Faraday, Michael (1834). «On Electrical Decomposition». Philosophical Transactions of the Royal Society. 124: 77–122. doi:10.1098/rstl.1834.0008. S2CID 116224057.
- ^ Krönig, August (1856). «Grundzüge einer Theorie der Gase». Annalen der Physik. 99 (10): 315–22. Bibcode:1856AnP…175..315K. doi:10.1002/andp.18561751008.
- ^ Clausius, Rudolf (1857). «Ueber die Art der Bewegung, welche wir Wärme nennen». Annalen der Physik. 176 (3): 353–79. Bibcode:1857AnP…176..353C. doi:10.1002/andp.18571760302.
- ^ Wurtz’s Account of the Sessions of the International Congress of Chemists in Karlsruhe, on 3, 4, and 5 September 1860.
- ^ Loschmidt, J. (1865). «Zur Grösse der Luftmoleküle». Sitzungsberichte der Kaiserlichen Akademie der Wissenschaften Wien. 52 (2): 395–413. English translation Archived February 7, 2006, at the Wayback Machine.
- ^ Arrhenius, Svante (1887). Zeitschrift für Physikalische Chemie. 1: 631.
{{cite journal}}: CS1 maint: untitled periodical (link) English translation Archived 2009-02-18 at the Wayback Machine. - ^ Ostwald, Wilhelm (1893). Hand- und Hilfsbuch zur ausführung physiko-chemischer Messungen. Leipzig: W. Engelmann.
- ^ Helm, Georg (1897). The Principles of Mathematical Chemistry: The Energetics of Chemical Phenomena. (Transl. Livingston, J.; Morgan, R.). New York: Wiley. pp. 6.
- ^ Einstein, Albert (1905). «Über die von der molekularkinetischen Theorie der Wärme geforderte Bewegung von in ruhenden Flüssigkeiten suspendierten Teilchen». Annalen der Physik. 17 (8): 549–60. Bibcode:1905AnP…322..549E. doi:10.1002/andp.19053220806.
- ^ Perrin, Jean (1909). «Mouvement brownien et réalité moléculaire». Annales de Chimie et de Physique. 8e Série. 18: 1–114. Extract in English, translation by Frederick Soddy.
- ^ Soddy, Frederick (1913). «The Radio-elements and the Periodic Law». Chemical News. 107: 97–99.
- ^ Thomson, J.J. (1913). «Rays of positive electricity». Proceedings of the Royal Society A. 89 (607): 1–20. Bibcode:1913RSPSA..89….1T. doi:10.1098/rspa.1913.0057.
- ^ Söderbaum, H.G. (November 11, 1915). Statement regarding the 1914 Nobel Prize in Chemistry.
- ^ Aston, Francis W. (1920). «The constitution of atmospheric neon». Philosophical Magazine. 39 (6): 449–55. doi:10.1080/14786440408636058.
- ^ Söderbaum, H.G. (December 10, 1921). Presentation Speech for the 1921 Nobel Prize in Chemistry.
- ^ Söderbaum, H.G. (December 10, 1922). Presentation Speech for the 1922 Nobel Prize in Chemistry.
- ^ Oseen, C.W. (December 10, 1926). Presentation Speech for the 1926 Nobel Prize in Physics.
- ^ Holden, Norman E. (2004). «Atomic Weights and the International Committee – A Historical Review». Chemistry International. 26 (1): 4–7.
- ^ a b International Bureau of Weights and Measures (2006), The International System of Units (SI) (PDF) (8th ed.), pp. 114–15, ISBN 92-822-2213-6, archived (PDF) from the original on 2021-06-04, retrieved 2021-12-16
In chemistry, the amount of substance n in a given sample of matter is defined as the quantity or number of discrete atomic-scale particles in it divided by the Avogadro constant NA. The particles or entities may be molecules, atoms, ions, electrons, or other, depending on the context, and should be specified (e.g. amount of sodium chloride nNaCl). The value of the Avogadro constant NA has been defined as 6.02214076×1023 mol−1. The mole (symbol: mol) is a unit of amount of substance in the International System of Units, defined (since 2019) by fixing the Avogadro constant at the given value.[1] Sometimes, the amount of substance is referred to as the chemical amount.
Role of amount of substance and its unit mole in chemistry[edit]
Historically, the mole was defined as the amount of substance in 12 grams of the carbon-12 isotope. As a consequence, the mass of one mole of a chemical compound, in grams, is numerically equal (for all practical purposes) to the mass of one molecule of the compound, in daltons, and the molar mass of an isotope in grams per mole is equal to the mass number. For example, a molecule of water has a mass of about 18.015 daltons on average, whereas a mole of water (which contains 6.02214076×1023 water molecules) has a total mass of about 18.015 grams.
In chemistry, because of the law of multiple proportions, it is often much more convenient to work with amounts of substances (that is, number of moles or of molecules) than with masses (grams) or volumes (liters). For example, the chemical fact «1 molecule of oxygen (O
2) will react with 2 molecules of hydrogen (H
2) to make 2 molecules of water (H2O)» can also be stated as «1 mole of O2 will react with 2 moles of H2 to form 2 moles of water». The same chemical fact, expressed in terms of masses, would be «32 g (1 mole) of oxygen will react with approximately 4.0304 g (2 moles of H
2) hydrogen to make approximately 36.0304 g (2 moles) of water» (and the numbers would depend on the isotopic composition of the reagents). In terms of volume, the numbers would depend on the pressure and temperature of the reagents and products. For the same reasons, the concentrations of reagents and products in solution are often specified in moles per liter, rather than grams per liter.
The amount of substance is also a convenient concept in thermodynamics. For example, the pressure of a certain quantity of a noble gas in a recipient of a given volume, at a given temperature, is directly related to the number of molecules in the gas (through the ideal gas law), not to its mass.
This technical sense of the term «amount of substance» should not be confused with the general sense of «amount» in the English language. The latter may refer to other measurements such as mass or volume,[2] rather than the number of particles. There are proposals to replace «amount of substance» with more easily-distinguishable terms, such as enplethy[3] and stoichiometric amount.[2]
The IUPAC recommends that «amount of substance» should be used instead of «number of moles», just as the quantity mass should not be called «number of kilograms».[4]
Nature of the particles[edit]
To avoid ambiguity, the nature of the particles should be specified in any measurement of the amount of substance: thus, a sample of 1 mol of molecules of oxygen (O
2) has a mass of about 32 grams, whereas a sample of 1 mol of atoms of oxygen (O) has a mass of about 16 grams.[5][6]
Derived quantities[edit]
Molar quantities (per mole)[edit]
The quotient of some extensive physical quantity of a homogeneous sample by its amount of substance is an intensive property of the substance, usually named by the prefix molar.[7]
For example, the ratio of the mass of a sample by its amount of substance is the molar mass, whose SI unit is kilograms (or, more usually, grams) per mole; which is about 18.015 g/mol for water, and 55.845 g/mol for iron. From the volume, one gets the molar volume, which is about 17.962 milliliter/mol for liquid water and 7.092 mL/mol for iron at room temperature. From the heat capacity, one gets the molar heat capacity, which is about 75.385 J/K/mol for water and about 25.10 J/K/mol for iron.
Amount concentration (moles per liter)[edit]
Another important derived quantity is the amount of substance concentration[8] (also called amount concentration, or substance concentration in clinical chemistry;[9] which is defined as the amount of a specific substance in a sample of a solution (or some other mixture), divided by the volume of the sample.
The SI unit of this quantity is the mole (of the substance) per liter (of the solution). Thus, for example, the amount concentration of sodium chloride in ocean water is typically about 0.599 mol/L.
The denominator is the volume of the solution, not of the solvent. Thus, for example, one liter of standard vodka contains about 0.40 L of ethanol (315 g, 6.85 mol) and 0.60 L of water. The amount concentration of ethanol is therefore (6.85 mol of ethanol)/(1 L of vodka) = 6.85 mol/L, not (6.85 mol of ethanol)/(0.60 L of water), which would be 11.4 mol/L.
In chemistry, it is customary to read the unit «mol/L» as molar, and denote it by the symbol «M» (both following the numeric value). Thus, for example, each liter of a «0.5 molar» or «0.5 M» solution of urea (CH
4N
2O) in water contains 0.5 moles of that molecule. By extension, the amount concentration is also commonly called the molarity of the substance of interest in the solution. However, as of May 2007, these terms and symbols are not condoned by IUPAC.[10]
This quantity should not be confused with the mass concentration, which is the mass of the substance of interest divided by the volume of the solution (about 35 g/L for sodium chloride in ocean water).
Amount fraction (moles per mole)[edit]
Confusingly, the amount concentration, or «molarity», should also be distinguished from «molar concentration», which should be the number of moles (molecules) of the substance of interest divided by the total number of moles (molecules) in the solution sample. This quantity is more properly called the amount fraction.
History[edit]
The alchemists, and especially the early metallurgists, probably had some notion of amount of substance, but there are no surviving records of any generalization of the idea beyond a set of recipes. In 1758, Mikhail Lomonosov questioned the idea that mass was the only measure of the quantity of matter,[11] but he did so only in relation to his theories on gravitation. The development of the concept of amount of substance was coincidental with, and vital to, the birth of modern chemistry.
- 1777: Wenzel publishes Lessons on Affinity, in which he demonstrates that the proportions of the «base component» and the «acid component» (cation and anion in modern terminology) remain the same during reactions between two neutral salts.[12]
- 1789: Lavoisier publishes Treatise of Elementary Chemistry, introducing the concept of a chemical element and clarifying the Law of conservation of mass for chemical reactions.[13]
- 1792: Richter publishes the first volume of Stoichiometry or the Art of Measuring the Chemical Elements (publication of subsequent volumes continues until 1802). The term «stoichiometry» is used for the first time. The first tables of equivalent weights are published for acid–base reactions. Richter also notes that, for a given acid, the equivalent mass of the acid is proportional to the mass of oxygen in the base.[12]
- 1794: Proust’s Law of definite proportions generalizes the concept of equivalent weights to all types of chemical reaction, not simply acid–base reactions.[12]
- 1805: Dalton publishes his first paper on modern atomic theory, including a «Table of the relative weights of the ultimate particles of gaseous and other bodies».[14]
- The concept of atoms raised the question of their weight. While many were skeptical about the reality of atoms, chemists quickly found atomic weights to be an invaluable tool in expressing stoichiometric relationships.
- 1808: Publication of Dalton’s A New System of Chemical Philosophy, containing the first table of atomic weights (based on H = 1).[15]
- 1809: Gay-Lussac’s Law of combining volumes, stating an integer relationship between the volumes of reactants and products in the chemical reactions of gases.[16]
- 1811: Avogadro hypothesizes that equal volumes of different gases (at same temperature and pressure) contain equal numbers of particles, now known as Avogadro’s law.[17]
- 1813/1814: Berzelius publishes the first of several tables of atomic weights based on the scale of O = 100.[12][18][19]
- 1815: Prout publishes his hypothesis that all atomic weights are integer multiple of the atomic weight of hydrogen.[20] The hypothesis is later abandoned given the observed atomic weight of chlorine (approx. 35.5 relative to hydrogen).
- 1819: Dulong–Petit law relating the atomic weight of a solid element to its specific heat capacity.[21]
- 1819: Mitscherlich’s work on crystal isomorphism allows many chemical formulae to be clarified, resolving several ambiguities in the calculation of atomic weights.[12]
- 1834: Clapeyron states the ideal gas law.[22]
- The ideal gas law was the first to be discovered of many relationships between the number of atoms or molecules in a system and other physical properties of the system, apart from its mass. However, this was not sufficient to convince all scientists of the existence of atoms and molecules, many considered it simply being a useful tool for calculation.
- 1834: Faraday states his Laws of electrolysis, in particular that «the chemical decomposing action of a current is constant for a constant quantity of electricity«.[23]
- 1856: Krönig derives the ideal gas law from kinetic theory.[24] Clausius publishes an independent derivation the following year.[25]
- 1860: The Karlsruhe Congress debates the relation between «physical molecules», «chemical molecules» and atoms, without reaching consensus.[26]
- 1865: Loschmidt makes the first estimate of the size of gas molecules and hence of number of molecules in a given volume of gas, now known as the Loschmidt constant.[27]
- 1886: van’t Hoff demonstrates the similarities in behaviour between dilute solutions and ideal gases.
- 1886: Eugen Goldstein observes discrete particle rays in gas discharges, laying the foundation of mass spectrometry, a tool subsequently used to establish the masses of atoms and molecules.
- 1887: Arrhenius describes the dissociation of electrolyte in solution, resolving one of the problems in the study of colligative properties.[28]
- 1893: First recorded use of the term mole to describe a unit of amount of substance by Ostwald in a university textbook.[29]
- 1897: First recorded use of the term mole in English.[30]
- By the turn of the twentieth century, the concept of atomic and molecular entities was generally accepted, but many questions remained, not least the size of atoms and their number in a given sample. The concurrent development of mass spectrometry, starting in 1886, supported the concept of atomic and molecular mass and provided a tool of direct relative measurement.
- 1905: Einstein’s paper on Brownian motion dispels any last doubts on the physical reality of atoms, and opens the way for an accurate determination of their mass.[31]
- 1909: Perrin coins the name Avogadro constant and estimates its value.[32]
- 1913: Discovery of isotopes of non-radioactive elements by Soddy[33] and Thomson.[34]
- 1914: Richards receives the Nobel Prize in Chemistry for «his determinations of the atomic weight of a large number of elements».[35]
- 1920: Aston proposes the whole number rule, an updated version of Prout’s hypothesis.[36]
- 1921: Soddy receives the Nobel Prize in Chemistry «for his work on the chemistry of radioactive substances and investigations into isotopes».[37]
- 1922: Aston receives the Nobel Prize in Chemistry «for his discovery of isotopes in a large number of non-radioactive elements, and for his whole-number rule».[38]
- 1926: Perrin receives the Nobel Prize in Physics, in part for his work in measuring the Avogadro constant.[39]
- 1959/1960: Unified atomic mass unit scale based on 12C = 12 adopted by IUPAP and IUPAC.[40]
- 1968: The mole is recommended for inclusion in the International System of Units (SI) by the International Committee for Weights and Measures (CIPM).[41]
- 1972: The mole is approved as the SI base unit of amount of substance.[41]
- 2019: The mole is redefined in the SI as «the amount of substance of a system that contains 6.02214076×1023 specified elementary entities».[1]
See also[edit]
- Amount fraction
- International System of Quantities
References[edit]
- ^ a b Bureau International des Poids et Mesures (2019): The International System of Units (SI), 9th edition, English version, p. 134. Available at the BIPM website.
- ^ a b Giunta, Carmen J. (2016). «What’s in a Name? Amount of Substance, Chemical Amount, and Stoichiometric Amount». Journal of Chemical Education. 93 (4): 583–86. Bibcode:2016JChEd..93..583G. doi:10.1021/acs.jchemed.5b00690.
- ^ «E.R. Cohen, T. Cvitas, J.G. Frey, B. Holmström, K. Kuchitsu, R. Marquardt, I. Mills, F. Pavese, M. Quack, J. Stohner, H.L. Strauss, M. Takami, and A.J. Thor, «Quantities, Units and Symbols in Physical Chemistry», IUPAC Green Book, 3rd Edition, 2nd Printing, IUPAC & RSC Publishing, Cambridge (2008)» (PDF). p. 4. Archived from the original (PDF) on 2016-12-20. Retrieved 2019-05-24.
- ^ International Union of Pure and Applied Chemistry (1993). Quantities, Units and Symbols in Physical Chemistry, 2nd edition, Oxford: Blackwell Science. ISBN 0-632-03583-8. p. 4. Electronic version.
- ^ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the «Gold Book») (1997). Online corrected version: (2006–) «amount of substance, n«. doi:10.1351/goldbook.A00297
- ^ International Union of Pure and Applied Chemistry (1993). Quantities, Units and Symbols in Physical Chemistry, 2nd edition, Oxford: Blackwell Science. ISBN 0-632-03583-8. p. 46. Electronic version.
- ^ International Union of Pure and Applied Chemistry (1993). Quantities, Units and Symbols in Physical Chemistry, 2nd edition, Oxford: Blackwell Science. ISBN 0-632-03583-8. p. 7. Electronic version.
- ^ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the «Gold Book») (1997). Online corrected version: (2006–) «amount-of-substance concentration». doi:10.1351/goldbook.A00298
- ^ International Union of Pure and Applied Chemistry (1996). «Glossary of Terms in Quantities and Units in Clinical Chemistry» (PDF). Pure Appl. Chem. 68: 957–1000. doi:10.1351/pac199668040957. S2CID 95196393.
- ^ International Union of Pure and Applied Chemistry (1993). Quantities, Units and Symbols in Physical Chemistry, 2nd edition, Oxford: Blackwell Science. ISBN 0-632-03583-8. p. 42 (n. 15). Electronic version.
- ^ Lomonosov, Mikhail (1970). «On the Relation of the Amount of Material and Weight». In Leicester, Henry M. (ed.). Mikhail Vasil’evich Lomonosov on the Corpuscular Theory. Cambridge, MA: Harvard University Press. pp. 224–33 – via Internet Archive.
- ^ a b c d e «Atome». Grand dictionnaire universel du XIXe siècle. Paris: Pierre Larousse. 1: 868–73. 1866.. (in French)
- ^ Lavoisier, Antoine (1789). Traité élémentaire de chimie, présenté dans un ordre nouveau et d’après les découvertes modernes. Paris: Chez Cuchet.. (in French)
- ^ Dalton, John (1805). «On the Absorption of Gases by Water and Other Liquids». Memoirs of the Literary and Philosophical Society of Manchester. 2nd Series. 1: 271–87.
- ^ Dalton, John (1808). A New System of Chemical Philosophy. Manchester: London.
- ^ Gay-Lussac, Joseph Louis (1809). «Memoire sur la combinaison des substances gazeuses, les unes avec les autres». Mémoires de la Société d’Arcueil. 2: 207. English translation.
- ^ Avogadro, Amedeo (1811). «Essai d’une maniere de determiner les masses relatives des molecules elementaires des corps, et les proportions selon lesquelles elles entrent dans ces combinaisons». Journal de Physique. 73: 58–76. English translation.
- ^ Excerpts from Berzelius’ essay: Part II; Part III.
- ^ Berzelius’ first atomic weight measurements were published in Swedish in 1810: Hisinger, W.; Berzelius, J.J. (1810). «Forsok rorande de bestamda proportioner, havari den oorganiska naturens bestandsdelar finnas forenada». Afh. Fys., Kemi Mineral. 3: 162.
- ^ Prout, William (1815). «On the relation between the specific gravities of bodies in their gaseous state and the weights of their atoms». Annals of Philosophy. 6: 321–30.
- ^ Petit, Alexis Thérèse; Dulong, Pierre-Louis (1819). «Recherches sur quelques points importants de la Théorie de la Chaleur». Annales de Chimie et de Physique. 10: 395–413. English translation
- ^ Clapeyron, Émile (1834). «Puissance motrice de la chaleur». Journal de l’École Royale Polytechnique. 14 (23): 153–90.
- ^ Faraday, Michael (1834). «On Electrical Decomposition». Philosophical Transactions of the Royal Society. 124: 77–122. doi:10.1098/rstl.1834.0008. S2CID 116224057.
- ^ Krönig, August (1856). «Grundzüge einer Theorie der Gase». Annalen der Physik. 99 (10): 315–22. Bibcode:1856AnP…175..315K. doi:10.1002/andp.18561751008.
- ^ Clausius, Rudolf (1857). «Ueber die Art der Bewegung, welche wir Wärme nennen». Annalen der Physik. 176 (3): 353–79. Bibcode:1857AnP…176..353C. doi:10.1002/andp.18571760302.
- ^ Wurtz’s Account of the Sessions of the International Congress of Chemists in Karlsruhe, on 3, 4, and 5 September 1860.
- ^ Loschmidt, J. (1865). «Zur Grösse der Luftmoleküle». Sitzungsberichte der Kaiserlichen Akademie der Wissenschaften Wien. 52 (2): 395–413. English translation Archived February 7, 2006, at the Wayback Machine.
- ^ Arrhenius, Svante (1887). Zeitschrift für Physikalische Chemie. 1: 631.
{{cite journal}}: CS1 maint: untitled periodical (link) English translation Archived 2009-02-18 at the Wayback Machine. - ^ Ostwald, Wilhelm (1893). Hand- und Hilfsbuch zur ausführung physiko-chemischer Messungen. Leipzig: W. Engelmann.
- ^ Helm, Georg (1897). The Principles of Mathematical Chemistry: The Energetics of Chemical Phenomena. (Transl. Livingston, J.; Morgan, R.). New York: Wiley. pp. 6.
- ^ Einstein, Albert (1905). «Über die von der molekularkinetischen Theorie der Wärme geforderte Bewegung von in ruhenden Flüssigkeiten suspendierten Teilchen». Annalen der Physik. 17 (8): 549–60. Bibcode:1905AnP…322..549E. doi:10.1002/andp.19053220806.
- ^ Perrin, Jean (1909). «Mouvement brownien et réalité moléculaire». Annales de Chimie et de Physique. 8e Série. 18: 1–114. Extract in English, translation by Frederick Soddy.
- ^ Soddy, Frederick (1913). «The Radio-elements and the Periodic Law». Chemical News. 107: 97–99.
- ^ Thomson, J.J. (1913). «Rays of positive electricity». Proceedings of the Royal Society A. 89 (607): 1–20. Bibcode:1913RSPSA..89….1T. doi:10.1098/rspa.1913.0057.
- ^ Söderbaum, H.G. (November 11, 1915). Statement regarding the 1914 Nobel Prize in Chemistry.
- ^ Aston, Francis W. (1920). «The constitution of atmospheric neon». Philosophical Magazine. 39 (6): 449–55. doi:10.1080/14786440408636058.
- ^ Söderbaum, H.G. (December 10, 1921). Presentation Speech for the 1921 Nobel Prize in Chemistry.
- ^ Söderbaum, H.G. (December 10, 1922). Presentation Speech for the 1922 Nobel Prize in Chemistry.
- ^ Oseen, C.W. (December 10, 1926). Presentation Speech for the 1926 Nobel Prize in Physics.
- ^ Holden, Norman E. (2004). «Atomic Weights and the International Committee – A Historical Review». Chemistry International. 26 (1): 4–7.
- ^ a b International Bureau of Weights and Measures (2006), The International System of Units (SI) (PDF) (8th ed.), pp. 114–15, ISBN 92-822-2213-6, archived (PDF) from the original on 2021-06-04, retrieved 2021-12-16
Общее понятие
Физическая величина применяется для вычисления количества конструкционных частиц в материальной субстанции. Понятие используется в случае, когда для численного определения количества вещества в химии требуется описание микроскопического строения формы материи.
Представление процессов в этом ключе нужно при проведении электролиза, получении азота и идеального газа, а также в других областях физики, которые рассматривают варианты превращения и передачи энергии.
Количество вещества является удобным понятием при характеристике различных химических процессов в отличие от массы. Это случается из-за того, что структурные электрические частицы реагируют независимо от их массы в объемах, которые являются кратными целым числам.
Примером служит процесс горения водорода, где число кислорода требуется в 2 раза меньше: О 2 + 2Н 2 = 2Н 2 О.
В этой реакции водородная масса меньше кислородной примерно в 8 раз из-за того, что атомная масса водорода меньше в 16 раз аналогичного показателя кислорода. Применение понятия количества элементов снижает неудобство при составлении уравнений. При этом взаимное соотношение между объемом веществ выражается уравнительным коэффициентом.
Формулы, которые применяются:
- Количество вещества закон Авогадро определяет на основании объема: n = V / V m, где V — объем порции газа в нормальном состоянии, а V m означает молярную величину объема субстанции в аналогичных условиях и равняется 22,4 л/моль.
- Другая формула показывает определение количества в зависимости от количества конструктивных элементов с применением постоянной Авогадро: n = N / N a, где N — число звеньев, а N a — постоянная константа Авогадро.
- В зависимости от массы и молярного веса расчет ведется по формуле: n = m / M, где m — масса субстанции, а М представляет его молярную массу.
Непосредственное число молекул не используется при расчете, т. к. это количество в реальности очень большое. Вместо обозначения молекул в штуках, применяется измерение в молях. Фактическое содержание единиц в 1 моле материи носит наименование числа Авогардо, при этом Na = 6,022141 х 1023 шт./моль.
Значение моля
Вес отдельных структурных элементов формы материи отличается, поэтому одинаковые объемы имеют различные массовые показатели. Моль — это количество материи, которое содержит число молекул, являющееся аналогичным количеству углеродных атомов в 12 г углекислого газа.
Массовый показатель не служит мерой количества субстанции, например:
- 1025 водородных молекул весят 33,5 г;
- 1025 кислородных частиц имеют массу 531,5 г.
Один моль составляет столько же нейтральных частиц, сколько их есть в 1 грамме водорода, такое положение принимается для удобства химических расчетов. При использовании наименования конструктивные элементы конкретизируются.
Понятия молекулы и моля взаимосвязаны между собой. Второе слово означает число, осязаемое множество и массу, а нейтральная частица рассматривается в качестве маленькой тяжести. Моль рассматривается в виде такого количества, которое можно отнести к понятию большой массы, состоящей из небольших весов отдельных элементов.
Молярная и молекулярная масса применяются не только к субстанциям, которые в основе конструкции имеют молекулы, но и к ионным и атомарным материальным формам.
Использование массы нейтральных частиц
В прошлом веке обнаружился научный факт, что если 2 газа содержатся в емкостях с одним и тем же объемом, то количество молекул остается одинаковым в этих субстанциях при соблюдении идентичного давления и нормальной температуры. Это значит, что важные характеристики тела определяются количеством структурных частиц, а не общим весом.
Количественное значение молярной массы M и показатели относительного молекулярного веса остаются равными, но первый предел измеряется в г/моль или моль, а вторая записывается в молях. Константа Авогадро обеспечивает пропорциональность и позиционирует переход к молярному соотношению.
Для расчета количества структурных элементов используется понятие молярной массы. Оно означает массу, которую составляет 1 моль вещества и получается от произведения молекулярной массы на количественный состав молекул в моле (число Авогардо). Молярная масса, для измерения которой используется единица грамм/ ммоль, является аналогичной по числу с относительным весом нейтральных частиц.
Примеры отмеривания равных молекулярных пропорций:
- 1 моль воды соответствует 6 х 1023 молекул Н 2 О.
- 1 моль хлора — 6 х 1023 атомов Fe.
- 1 моль ионов хлора — 6 х 1023 ионов Cl.
- 1 моль хлора — 6 х 1023 молекул Cl 2.
- 1 моль электронов е— — 6 х 1023 электронов е—.
Разница между молярной и молекулярной массой заключается в том, что они одинаковы в численном соотношении, но отличаются постоянной размерностью. Используется суммирование молярных масс составляющих элементов смеси для нахождения этой величины у многокомпонентных соединений. Для расчета молярной массы воды применяется калькулятор: М (Н 2 О) = М (О) + М (Н) = (16 + 2.1) = 18 моль.
Показатель относительного веса
Относительная молекулярная масса представляет собой вес молекулы, который выражается в атомных единицах. В расчетах используются не абсолютные веса, а относительные, т. к. масса молекулы очень мала. Например, молекула воды весит 3.10~26 кг, и частицы остальных веществ имеют значения подобного порядка. Нахождение показателя можно провести онлайн в соответствии с международными стандартами, которые сравнивают массы структурных элементов с 1/12 долей веса углеродного атома.
Успешное решение задачи связывается с тем, что углекислый газ является компонентом различных химических веществ. Принимается, что 1 атомная единица (1 а. е. м) соответствует весу водородного атома. Относительный атомный вес рассчитывается как масса неделимой частицы, выраженная в атомных единицах, при этом значение показателя берется из таблицы Д. И. Менделеева.
Относительные молекулярные массы сложных соединений находятся суммированием аналогичных показателей веса составляющих компонентов. Для подсчета требуется знание химической формулы и значение относительных атомных масс входящих элементов.
Например, молекулярный вес метана СН 4 равен 16 а. е. м (4+12), значит, при горении вещества применяется формула 2О + СН 4 = СО 2 + 2Н 2 О. Из 1 моля метана выходит 2 единицы воды, при этом 16 г газа служит для получения 36 г воды (пропорциональное соответствие).
Химические реакции
При реакции горения метана на каждую молекулу вещества требуется использовать 2 частицы кислорода. Но в условиях открытого воздуха содержание кислорода всегда является достаточным для прохождения реакции. В ограниченных условиях подводных или космических работ требуется точное определение количества вещества и молекул реагентов. Например, если в топку космического агрегата попадает больше кислорода, чем требуется, то снижается тяга и перерасходуется топливо.
Примеры использования относительного веса в реакциях:
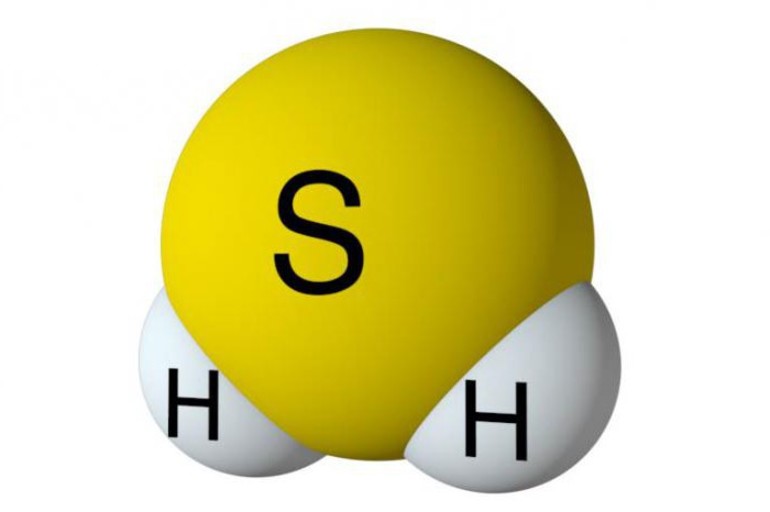
- Сероводород имеет формулу H 2 S. Молекулярная масса его частицы рассчитывается в виде суммы относительных масс атомов, являющихся компонентами M r (H 2 S) = A r (S) + 2· Ar (H). Для расчета молекулярной массы используется уравнение Mr (H 2 S) = 2х1+32 = 2+32 = 34.
- Гелий в нормальных обстоятельствах работает, как идеальный газ, поэтому значение молярной массы рассчитывается по формуле Клайперона — Менделеева pV = mRT /М, где p — давление газа, V — объем, M — масса субстанции, Т — значение абсолютной температуры, R — постоянная константа, составляет 8,3.
- Серная кислота применяется в виде двухосновной сильной кислоты H 2 SO 4. Она отвечает за степень серного окисления. В технических реакциях используется смесь с водой и ангидридом серы S О 3. Молярная масса составляет 98,08 ± 0,006 г/миллимоль.
Химики применяют такие пропорции взаимодействия, которые имеют в составе равное число молекул для удобства работы. Точность весов в лаборатории составляет 1 мг, поэтому получается, что 1 млн молекул не всегда удается взвесить. Значит, выбирается не миллион, а другая порция, в которой число n больше этого количества.
Подсчет количества элементов
Примером простой реакции, когда в результате взаимодействия двух продуктов образовывается третья субстанция, является формула А + Б = В. Остается решить весовое количество веществ А и Б, чтобы хватило для реагирования и не осталось исходных материалов, в ином случае продукт В будет загрязнен одним из начальных компонентов.
В качестве примера подходит реакция с участием кальция: Н 2 О + С а О = С а (ОН) 2. Если простейшие формы А и Б состоят из различных атомных наборов Н 2 О и С а О, которые отличаются по весу. Соответственно, в них содержится неодинаковое число частиц, при реакции часть из них не будет использована. Если берется пропорция С а О с содержанием N молекул и порция воды с N частиц, то после взаимодействия не останется никаких веществ и получится количество N молекул.
Отсчет невидимых молекул можно выполнить с помощью взвешивания вещества, для этого требуется вес одной частицы. На весы помещается определенное количество субстанции в граммах, чтобы отмерить требуемое число молекул. Для определения величины вещества в граммах требуется сложить вес составляющих атомов, показатели которых приводятся в периодической таблице.
Атомный вес кальция составляет 40 а. е. м, кислорода — 16 а. е. м, значит, молекулярный вес Са О будет 56 а. е. м. (40+16). Неудобно брать малые количества, например, по 10 молекул субстанции для проведения реакции, поэтому нужно взвесить по миллиону структурных частиц каждого компонента. Для этого высчитывается вес будущей порции, для удобства делается переход из килограммов в граммы, при этом вес 1 а. е. м составляет 1,67х10-24 г. Для подсчета веса умножается это число на 56, получается 56х (1,67-24г) = 93,5х10-24.
Чтобы получить вес, который должен быть на весах, полученный результат умножается на миллион молекул, возникает результат 93,5х10-18 г. При увеличении количества оксида кальция и воды в одинаковое число раз порции частиц возрастают пропорционально, например, 0,1 моль кальция прореагирует с 0,1 молем воды, увеличение кальция до 10 моль потребует повышения числа моль воды также до 10.
Константа Авогадро для газов
Закон Авогадро всегда точно выполняется как для газов в идеальном состоянии, так и для реальных газообразных смесей. Для последних субстанций понятие моля выражается в том, что любой объем газа всегда соответствует определенному количеству молекул. Примером служит реакция, где из аммиака и хлористого водорода выходит аммония хлорид в форме кристаллической твердой субстанции: NH 3 (газ) + HCL (газ) = NH 4 CL (крист.).
Для реагирования требуются одинаковые объемы газообразных веществ, т. к. после окончания реакции не должно оставаться избытка:
- В результате проведения опыта в замкнутом пространстве выяснилось, что при взрыве нужно 2 части водорода и одна порция кислорода, при этом получается 2 объема водяных паров в газовой консистенции О 2 + 2Н 2 = 2Н 2 О (все субстанции в виде газа).
- Одна порция водорода при реакции с 1 частью хлора преобразовывается в хлористый водород Cl 2 + H 2 = 2 HCL (все компоненты в газообразной форме).
Выводом из этого эксперимента следует то, что газы вступают в реакцию, и требуется объемные отношения с применением целочисленных показателей. Частицы в газе не связываются прочными контактами в отличие от атомов твердых субстанций. Занимаемый объем в похожих условиях зависит от количества молекул, но не от определенного типа газа. Исходя из этого положения, равные объемы газообразных субстанций всегда реагируют друг с другом без остатка.
Количество вещества
Несколько столетий тому назад алхимики, готовясь к различным опытам и после их проведения, нередко взвешивали вещества, определяли их объемы. После открытия М. В. Ломоносовым и А. Л. Лавуазье закона сохранения массы веществ при химических реакциях химия начала быстро развиваться, обретая статус точной науки. Расчеты стали неотъемлемой частью химических исследований.
Вы уже знаете, что вещества могут иметь молекулярное, атомное или ионное строение. Превращение одних веществ в другие происходит в результате соединения атомов в молекулы, распада молекул на атомы, перегруппировки атомов или ионов.
Комментируя реакцию горения углерода
вы скажете, что каждый атом Карбона взаимодействует с молекулой кислорода с образованием молекулы углекислого газа, два атома Карбона взаимодействуют с двумя молекулами кислорода, образуя две молекулы углекислого газа, и т. д.
Чтобы подготовить какой-либо химический опыт, не имеет смысла пересчитывать атомы, молекулы. Да это и невозможно сделать. Химики используют физическую величину, которая определяется количеством частиц вещества в определенной его порции. Название этой величины — количество вещества. Ее обозначают латинской буквой
Единицей измерения количества вещества является моль*.
Ученые установили, что 1 моль любого вещества содержит 602 ООО ООО ООО ООО ООО ООО ООО его формульных единиц (атомов, молекул, совокупностей ионов). Это число можно записать как 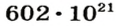
1 моль — это порция вещества, которая содержит 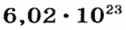
Так, 1 моль углерода (вещество атомного строения) содержит 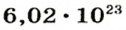
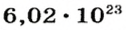
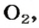
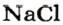
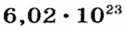
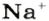
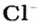
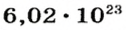
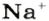
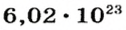
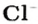
* Термин происходит от латинского слова moles — бесконечное
Понятие «количество вещества» используют не только по отношению к веществам, но и по отношению к частицам — атомам, молекулам, ионам. Например, выражение «1 моль ионов 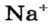
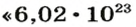
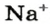
Число 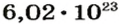
1 моль — это порция вещества, которая содержит столько формульных единиц, сколько атомов Карбона содержится в 12 г углерода.
Представление о порциях различных веществ в 1 моль можно получить из рисунка 1.
Число 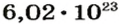
Число Авогадро в миллиарды раз превышает количество волос на головах, в усах, бородах всех живущих на Земле людей. Если покрыть земную поверхность таким количеством (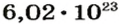
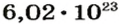
Амедео Авогадро (1776—1856)
Выдающийся итальянский физик и химик. Выдвинул гипотезу о молекулярном строении веществ, в частности газов. Открыл один из законов для газов (1811 год), позже названный его именем. Уточнил атомные массы некоторых элементов, определил состав молекул воды, аммиака, углекислого и угарного газов, метана, сероводорода и др. Разработал экспериментальные методы определения молекулярных масс газообразных веществ.
Числу Авогадро отвечает постоянная Авогадро. Ее обозначение — 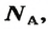
Если порция вещества содержит N частиц (формульных единиц), то можно вывести формулу для вычисления соответствующего количества вещества n:
в 1 моль вещества содержится 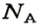
в n моль вещества — N частиц;
Слово «моль» не склоняется, если перед ним есть число, но склоняется, если числа нет.
Примеры словосочетаний: взято 5 моль железа, определение моля.
Решение задач. Решим несколько задач, в которых используется величина «количество вещества».
ЗАДАЧА 1. В каком количестве вещества содержится 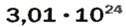
Решение
Воспользуемся формулой, которая отображает связь между количеством вещества и числом частиц (атомов):
Ответ:
В 1 моль какого-либо молекулярного вещества всегда содержится больше чем 1 моль атомов (1 моль элемента). Например, в 1 моль кислорода 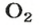

Количества вещества ионов в ионном соединении вычисляют аналогично.
ЗАДАЧА 2. Рассчитать количества вещества ионов в феррум (Ш) оксиде 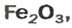
Решение
Формульная единица оксида 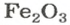
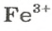
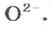
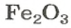
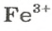
В 4 моль этого соединения количества вещества ионов в четыре раза больше:
Ответ:
По формуле соединения можно определить соотношение в нем количеств вещества атомов (элементов), ионов. Например, в метане
а в феррум(Ш) оксиде 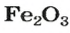
Вернемся к химической реакции 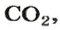
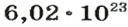
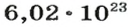
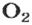
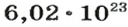
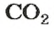
видим, что количества вещества соответствуют коэффициентам. Это справедливо для любой реакции. Приведем еще один пример:
ВЫВОДЫ. Количество вещества в химии определяют числом его частиц. Единица измерения количества вещества — моль. 1 моль содержит 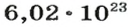
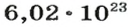
Это интересно. Количество вещества используют для характеристики состава растворов в научных исследованиях.
Молярная масса
Важной величиной, которая связана с количеством вещества, является молярная масса. Ее используют во многих вычислениях — при подготовке к химическому эксперименту, внедрении технологических процессов на заводах, для обработки результатов исследования химических реакций.
Молярная масса — это масса 1 моль вещества.
Молярную массу обозначают латинской буквой М. Ее размерность — г/моль.
Молярная масса численно равна относительной атомной, молекулярной или формульной массе.
Для того чтобы записать молярную массу какого-либо вещества, достаточно указать значение соответствующей относительной атомной, молекулярной или формульной массы и добавить размерность — г/моль. Относительные атомные массы элементов представлены в периодической системе Д. И. Менделеева, а относительные молекулярные и формульные массы веществ вы научились вычислять в 7 классе.
Примеры записи молярных масс простых и сложных веществ:
(расчет относительной молекулярной массы:
(расчет относительной формульной массы:
Поскольку понятие «моль» используют не только по отношению к веществам, но и по отношению к частицам (атомам, молекулам, ионам), то и для них существуют молярные массы. Учитывая, что масса 1 моль атомов Гидрогена составляет 1 г, а 1 моль ионов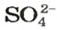
Выведем формулу, которая описывает взаимосвязь между массой, количеством вещества и молярной массой. Если, например, 1 моль атомов Гидрогена имеет массу 1 г, то n моль этих атомов — массу, которая в n раз больше, т. е. n г. Запишем соответствующее математическое выражение:
Общая формула для вычисления массы атомов, ионов, веществ по количеству вещества:
Отсюда
Итак, молярная масса — это отношение массы к количеству вещества.
Решение задач. Рассмотрим два способа решения задач, которые предполагают использование молярной массы. Один из них предусматривает составление пропорции, а другой — вычисления по приведенным выше формулам.
ЗАДАЧА 1. Рассчитать количество вещества метана 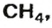
Решение
1-й способ
1. Вычисляем молярную массу соединения:
2. Находим количество вещества метана, составив пропорцию:
1 моль 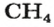
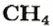
2-й способ
Воспользуемся одной из формул, приведенных в параграфе:
Ответ:
ЗАДАЧА 2. Какая масса железа отвечает количеству вещества 1,5 моль?
Решение
1-й способ
Железо — простое вещество, состоящее из атомов элемента Феррума.
Рассчитываем массу железа с помощью пропорции:
1 моль 
1,5 моль 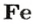
2-й способ
Воспользуемся формулой, приведенной в параграфе:
Ответ:
ЗАДАЧА 3. Вычислить массу 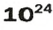
Решение
1-й способ
Поскольку 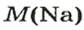
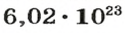
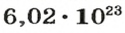
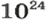
2-й способ
1. Рассчитываем количество вещества Натрия:
2. Вычисляем массу атомов Натрия:
Ответ:
ВЫВОДЫ. Молярная масса — это масса 1 моль вещества. Она численно равна относительной атомной, молекулярной или формульной массе. Молярная масса является отношением массы к количеству вещества.
Молярный объем
Порцию вещества можно охарактеризовать не только ее массой, но и объемом. Поэтому не случайно, что, кроме молярной массы, существует другая физическая величина — молярный, объем.
Молярным объемом называют объем 1 моль вещества.
Обозначение молярного объема — 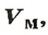
Из курса физики 7 класса вам известна формула, в которую входят масса вещества 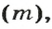
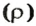
Аналогичная связь существует между молярной массой и молярным объемом:
Из этой формулы получаем другую:
По ней можно вычислять молярный объем любого вещества. Для этого нужно рассчитать молярную массу вещества и найти в справочнике его плотность.
Для каждого твердого и жидкого вещества существует свой молярный объем (например, для алюминия, поваренной соли, воды и спирта — 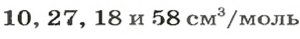
Газы при нагревании или понижении давления заметно расширяются, а при охлаждении или повышении давления сжимаются. Это происходит потому, что расстояния между молекулами в газах очень большие (в отличие от твердых и жидких веществ, где частицы соприкасаются друг с другом).
При изменении условий изменяются также плотность газа и его молярный объем. Поэтому, приводя значения этих физических величин, обязательно указывают соответствующие температуру и давление.
Нормальные условия (н. у.) = О °С; 101,3 кПа
Для газов при н. у.
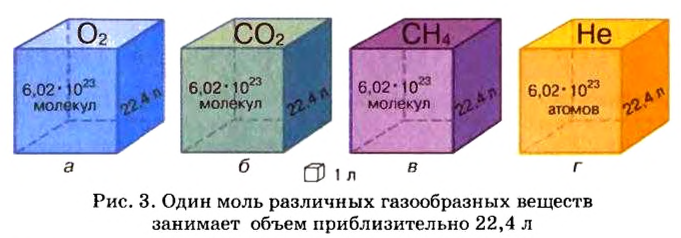
Ученые установили, что молярный объем различных газов при одинаковых условиях один и тот же. В частности, при температуре О °С и давлении 101,3 кПа (или 760 мм рт. ст.) он составляет 22,4 л/моль. Приведенные условия называют нормальными (сокращенно — н. у.).
1 моль любого газа при нормальных условиях занимает объем 22,4 л.
Описывая физические свойства вещества, указывают его агрегатное состояние при обычных условиях. В этом случае речь идет об условиях, которые чаще всего существуют в помещении, где изучают или используют вещество. Это — температура приблизительно +20 °С и давление приблизительно 760 мм рт. ст.
Связь между объемом 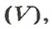
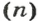
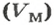
Из нее можно получить две другие:
Итак, молярный объем — это отношение объема к количеству вещества.
Закон Авогадро
Вы уже знаете, что 1 моль водорода, кислорода или углекислого газа занимает при нормальных условиях объем 22,4 л и содержит 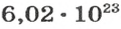
XIX ст. А. Авогадро. Получив впоследствии экспериментальное подтверждение и теоретическое обоснование, эта гипотеза стала законом.
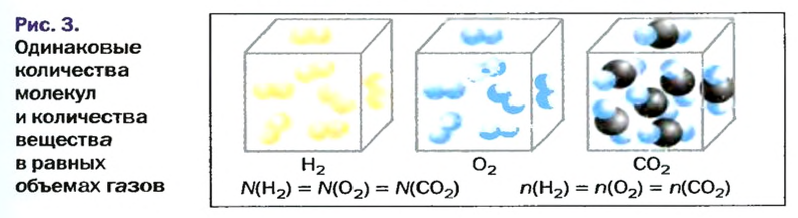
Закон Авогадро формулируют так:
в равных объемах различных газов при одинаковых температуре и давлении содержится одинаковое число молекул*.
Приводим важное следствие закона Авогадро:
в равных объемах различных газов при одинаковых температуре и давлении содержатся одинаковые количества вещества.
* — Для инертных газов — одинаковое число атомов.
Изложенный материал обобщает рисунок 3.
Решение задач. Рассмотрим несколько задач, при решении которых используют молярный объем газа.
ЗАДАЧА 1. Вычислить объем 0,4 г водорода при нормальных условиях.
Решение
1-й способ
1. Находим количество вещества водорода:
2. Вычисляем объем водорода составлением пропорции:
1 моль 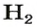
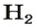
2-й способ
1. Находим количество вещества водорода:
2. Вычисляем объем водорода по соответствующей формуле:
Ответ:
ЗАДАЧА 2. Вычислить количество молекул в 1 л кислорода при нормальных условиях.
Решение
1-й способ
Вычисляем количество молекул кислорода в 1 л газа при нормальных условиях:
в 22,4 л кислорода содержится 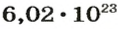
в 1 л кислорода — х молекул;
2-й способ
Вычисляем количество молекул кислорода в 1 л газа при нормальных условиях. Для этого из формулы 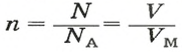
Осуществляем расчет:
Ответ:
Эту задачу можно решить еще одним способом. По соответствующим формулам сначала вычисляют количество вещества кислорода, а затем — количество молекул.
ЗАДАЧА 3. Рассчитать плотность угарного газа СО при нормальных условиях.
Решение
1-й способ
1. Находим молярную массу угарного газа:
2. Вычисляем плотность газа при нормальных условиях:
1 моль угарного газа, т. е.
28 г СО занимает при н. у. объем 22,4 л,
х г СО — 1л;
2-й способ
1. Находим молярную массу угарного газа:
2. Рассчитываем плотность угарного газа при нормальных условиях, преобразовав формулу 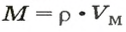
Ответ:
ВЫВОДЫ
Молярный объем — объем 1 моль вещества. Эта физическая величина является отношением объема к количеству вещества.
Молярные объемы твердых и жидких веществ разные, а газов (при одних и тех же температуре и давлении) — одинаковы. При нормальных условиях (температуре О°С и давлении 101,3 кПа, или 760 мм рт. ст.) 1 моль любого газа занимает объем 22,4 л.
В равных объемах различных газов при одинаковых температуре и давлении содержится одинаковое число молекул (закон Авогадро).
Соотношение объемов газов в химических реакциях
Согласно закону Авогадро, равные объемы газов содержат одинаковое число молекул (при одинаковых условиях). Если каждая молекула одного газа реагирует с одной молекулой другого, например, во время реакции
то должны взаимодействовать одинаковые объемы веществ, скажем, 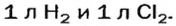
на один объем кислорода должны приходиться два объема реагирующего с ним водорода. Только при таком условии число молекул водорода будет вдвое превышать число молекул кислорода, как того «требует» химическое уравнение.
Обобщением этих выводов является закон объемных соотношений газов, который открыл французский ученый Ж. Гей-Люссак в 1808 г.: объемы газов, которые вступают в реакцию и образуются в результате реакции, соотносятся как небольшие целые числа.
Со временем ученые установили, что эти числа являются соответствующими коэффициентами в химических уравнениях.
Итак, для газов в реакциях (1) и (2)
Использование закона Гей Люссака дает возможность химику или инженеру-технологу определить, какие объемы газов нужно взять для осуществления реакции. Отобрать определенный объем газа значительно легче, чем взвесить его необходимую массу.
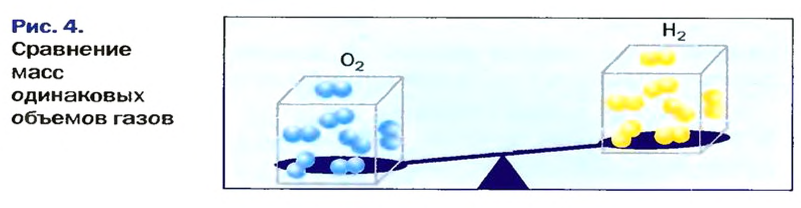
Относительная плотность газа
В равных объемах различных газов содержится одно и то же число молекул*. Поскольку молекулы различных веществ обычно имеют разную массу, то массы одинаковых объемов газов, как правило, разные. Например, масса 1 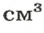
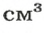
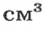
* — При одних и тех же условиях.
Число 16 называют относительной плотностью кислорода по водороду. Ее обозначают буквой D и записывают так:
Относительная плотность газа по другому газу — это отношение массы определенного объема газа к массе такого же объема другого газа (при одинаковых температуре и давлении).
Масса 1 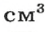
Узнать, во сколько раз кислород тяжелее водорода, можно, разделив плотность кислорода на плотность водорода:
Эта формула объясняет, почему физическую величину, о которой идет речь в параграфе, называют относительной плотностью.
Относительная плотность, как и относительная атомная (молекулярная, формульная) масса, не имеет размерности.
Если взять по 22,4 л кислорода и водорода при нормальных условиях, то массы веществ (в граммах) будут численно равны их молярным массам или относительным молекулярным массам. Отсюда — такие варианты вычисления относительной плотности кислорода по водороду:
Преобразуем все приведенные выше формулы на общие. Более тяжелый газ обозначим буквой В, более легкий — буквой А, а относительную плотность первого газа по второму —
Запомните: соотноы1ение масс газов можно использовать для вычисления относительной плотности лишь при условии, что
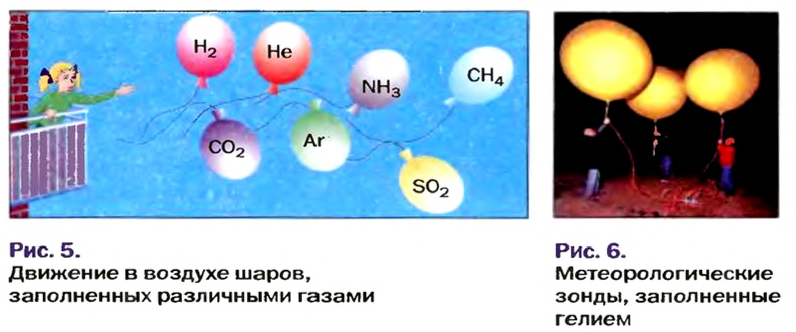
Газы часто сравнивают с воздухом. Хотя воздух является смесью газов, его можно условно считать газом с относительной молекулярной массой 29. Это число называют средней относительной молекулярной массой воздуха. Оно находится в промежутке между числами 32 и 28 — относительными молекулярными массами кислорода 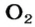
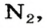
Установить, легче или тяжелее воздуха определенный газ, очень просто. Достаточно заполнить им резиновый шарик и отпустить его (рис. 5, 6).
Формулы для расчета относительной плотности газа В по воздуху имеют такой вид:
Это интересно. Самый легкий среди газов — водород 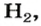
Решение задач. Покажем, как решают задачи с использованием изложенного в параграфе материала.
ЗАДАЧА 1. Рассчитать относительную плотность углекислого газа по водороду и по воздуху.
Решение
Находим относительную плотность углекислого газа по водороду и по воздуху.
Ответ:
В соответствии с полученным результатом углекислый газ в 1,52 раза тяжелее воздуха. Очевидно, что воздух во столько же раз легче углекислого газа.
Если для неизвестного газа В определена его относительная плотность по газу А, то можно вычислить молярную или относительную молекулярную массы газа В по формулам, которые являются производными от приведенных выше:
ЗАДАЧА 2. Относительная плотность газа X (соединение Сульфура) по водороду равна 17. Вычислить молярную массу газа Х и найти формулу соединения.
Решение
1. Вычисляем молярную массу газа X по одной из формул, приведенных в параграфе:
2. Находим формулу соединения. Поскольку 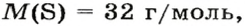
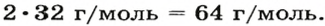
Очевидно, что этим элементом является Гидроген; его атомов в молекуле соединения — два. Формула соединения —
Ответ: 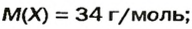
ВЫВОДЫ
Относительная плотность газа по другому газу — это отношение массы определенного объема газа к массе такого же объема другого газа (при одинаковых температуре и давлении). Значение относительной плотности газа показывает, во сколько раз он тяжелее другого газа.
В качестве газа сравнения часто служит воздух. Он ведет себя как газ с относительной молекулярной массой 29.
По относительной плотности газа можно вычислить его молярную массу.
О средней относительной молекулярной массе воздуха.
Почему средняя относительная молекулярная масса воздуха равна 29, а не 30 — среднему арифметическому относительных молекулярных масс кислорода (32) и азота (28)? Потому что в воз духе содержится неодинаковое количество этих газов: кислорода — 21% по объему, азота — 78%.
Вычислим среднюю молярную массу воздуха (она численно равна средней относительной молекулярной массе).
Предположим, что воздух состоит только из кислорода и азота. Тогда средняя молярная масса воздуха будет равна массе 1 моль смеси газов
Количества вещества газов пропорциональны их объемам или объемным долям
Взяв приближенные значения объемных долей газов 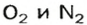
Найдем массу 1 моль воздуха, т. е. 1 моль смеси газов
Таким образом,
Количество вещества
После повторения изученных начальных химических понятий для вас начинается новый этап познания химии. Это — количественные отношения веществ в химических реакциях, связь химических знаний с математическими.
Вы уже знаете, что существуют вещества молекулярного и немолекулярного строения, а их составными частицами могут быть атомы, молекулы, ионы. Абсолютные размеры этих структурных частиц очень малы, тогда как их количественные соотношения в химических уравнениях выражаются небольшими целыми числами, которые равны коэффициентам.
Рассмотрим взаимодействие вещества немолекулярного строения — углерода с веществом молекулярного строения — кислородом:
Как видно из уравнения реакции, 1 атом простого вещества углерода взаимодействует с 1 молекулой простого вещества кислорода и образуется 1 молекула сложного вещества оксида углерода(1У), или углекислого газа. Но для проведения этой реакции никогда не считают атомы углерода и молекулы кислорода, а оперируют такими величинами, как масса углерода и масса или обт/ем кислорода. Как в таких случаях не ошибиться и взять столько каждого из веществ, чтобы их было достаточно для проведения реакции и получения продукта реакции необходимой массы или объема?
Вам известны такие физические величины — время, масса, длина, объем, плотность, температура. С ними в повседневной жизни приходится довольно часто сталкиваться. Однако это не весь перечень характеристик, по которым сравнивают и отличают тела, вещества, явления.
Порция воды объемом 18 мл (приблизительно одна столовая ложка) при комнатной температуре имеет массу 18 г, поскольку плотность воды составляет 1 г/мл. Это привычные для вас числа. А вот приходилось ли вам иметь дело с таким удивительно огромным числом, как 602 000 000 000 000 000 000 000? Именно столько молекул содержится в порции воды объемом 18 мл! Согласитесь, не так уж и удобно отсчитывать число молекул воды (или число любых структурных частиц других веществ) в определенной ее порции, ведь счетчики атомов или молекул еще не сконструированы. Во избежание этих неудобств и была введена физическая величина количество вещества.
Количество вещества — это физическая величина, которая характеризуется числом структурных частиц вещества в определенной ее порции.
Количество вещества обозначают буквой греческого алфавита 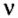
В каких случаях используют эту физическую величину? Прежде всего, когда нужно количественно охарактеризовать реагенты или продукты реакции.
Для каждой физической единицы существует эталон, сравнивая с которым проводят измерения, и способы или приборы для измерений. Вводя ту или иную физическую величину, сразу предлагают и единицы ее измерения. Например, для измерения массы введен кг и производные от него — мг, г, т; для измерения длины — м (мм, см, км). Так, вы можете легко измерить длину медной проволоки или определить массу пакета поваренной соли и не допустить при этом ошибки.
А с чем сравнивать порцию вещества, определяя количество вещества в ней? В каких единицах измеряют эту физическую величину? Существует ли ее эталон?
За единицу измерения количества вещества принят моль. Если единицы большинства физических величин введены в оборот давно, то единицу количества вещества моль ввели лишь в 1971 году. В переводе «моль» означает множественное число.
Моль — это количество вещества, которое содержит столько структурных частиц (атомов, молекул и т. п.) этого вещества, сколько атомов содержится в 12 г более легкой разновидности атома углерода.
Вспомните: изучая в 7 классе атомную единицу массы, вы узнали, что в природе преобладает более легкая разновидность атомов углерода, в ядрах которого есть по 6 протонов и нейтронов. В то же время более тяжелая разновидность углерода представлена атомами, ядра которых состоят из 6 протонов и 7 нейтронов, и в природе их мало.
Из чего состоит 1 моль вещества. Как показали расчеты, 12 г более легкой разновидности атомов углерода содержат 602 204 500 000 000 000 000 000 атомов. С введением физической величины количество вещества было принято, что это число показывает, сколько структурных частиц вещества содержится в одном моле любого вещества. В честь итальянского ученого Амедео Авогадро его назвали числом Авогадро (обозначается 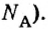
Это — универсальное число, которое указывает на количество структурных частиц в одном моле вещества, независимо от его агрегатного состояния. Число Авогадро 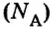
Единица измерения количества вещества моль обозначается так: 1 моль воды, 2 моль сахара, 5 моль углекислого газа и т. п. Обратите внимание, что окончание не изменяется, если слово «моль» пишется после цифры. Если же запись сделана без цифры, то окончание изменяется согласно падежу. Например: «Сколько молей кислорода выделится, если разложить 4 моль перманганата калия?»; «В одном моле воды содержится число Авогадро молекул».
Поупражняемся в применении числа Авогадро относительно конкретных структурных частиц разных веществ — атомов, молекул и др.
Пример 1. Графит 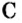
Пример 2. Вода 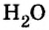
Пример 3. Хлорид натрия 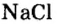
В 7 классе вы записывали химическую формулу поваренной соли, или хлорида натрия 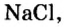
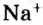
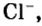
Относительно хлорида натрия число Авогадро означает число формульных единиц вещества в 1 моль этого вещества.
Формульная единица вещества — это совокупность его частиц, которая отображена химической формулой.
Для веществ, структурными частицами которых являются атомы, формульная единица вещества — атом. Для веществ, структурными частицами которых являются молекулы, формульная единица — молекула. А для веществ, структурными частицами которых являются ионы, формульная единица — совокупность ионов, которая отображена в химической формуле вещества. Например, в поваренной соли 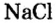
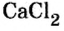
Поэтому правильно говорить, что в 1 моль хлорида натрия насчитывается 1 моль катионов 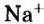
Вы уже умеете оперировать такими физическими величинами, как масса и объем веществ и тел. Умеете пользоваться и приборами для их измерения. Для измерения же количества вещества приборов не существует (рис. 1).
Как же тогда отмерить, например, порцию воды количеством вещества 2 моль? Чтобы получить ответ на этот вопрос, необходимо выяснить сущность понятия «молярная масса».
Итоги:
Амедео Авогадро (1776—1856 гг.) — итальянский химик и физик, первым стал систематически исследовать количественный и качественный состав веществ на основе соотношения объемов газообразных веществ, из которых они образованы. Ему принадлежат правильные записи формул: воды 
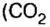
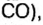
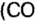
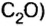
В 1811 г. Авогадро открыл закон, который до сих пор является общепризнанным: в одинаковых объемах различных газов при одинаковых условиях (температуре и давлении) содержится одинаковое число молекул. Закон носит имя своего первооткрывателя.
Ученый первым предсказал, что молекулы водорода, кислорода, азота двухатомны. В его честь число формульных единиц, которое содержится в 1 моль вещества, назвали числом Авогадро.
Один из минералов металлического элемента цезия (в периодической системе находится в ячейке под номером 55) — авогадрит также назван в честь ученого.
Молярная масса
Понятие молярная масса введено для определения соотношения количества вещества 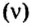
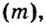
Молярная масса 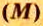
Молярную массу вычисляют по формуле:
То есть, молярная масса — это величина, которая характеризует конкретное вещество и измеряется в килограммах на моль (кг/моль) или в граммах на моль (г/моль). Следует отметить, что в химии преимущественно используют единицу г/моль.
Если взять порции различных веществ, массы которых численно равны их относительным молекулярным массам, например 12 г углерода (С), 18 г воды 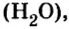
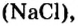
Таким образом, несмотря на разную относительную молекулярную массу веществ 
Масса одного моля любого вещества численно равна его относительной молекулярной массе и содержит число Авогадро структурных частиц (формульных единиц) вещества.
Для определения молярной массы вещества нет необходимости каждый раз делить массу порции вещества на количество вещества в ней. Достаточно вычислить ее относительную молекулярную массу и найденное число выразить в единицах молярной массы, то есть в г/моль.
Пример 1.
Таким образом, один моль углекислого газа — вещества молекулярного строения — имеет массу 44 г и содержит число Авогадро молекул.
Пример 2.
Таким образом, один моль оксида меди 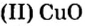
Зная массу порции любого вещества и количество вещества в ней, по формуле 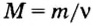
Пример 3. Вычислить молярную массу бинарного соединения серы с кислородом, если в порции массой 32 г количество вещества равно 0,5 моль.
Дано:
Решение:
Ответ: молярная масса соединения равна
Производные формулы 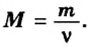
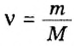
Пример 4. Определить количество вещества в порции оксида алюминия 
Дано:
Решение:
Ответ: количество вещества в порции оксида алюминия массой 20,4 г составляет 0,2 моль.
Формула 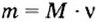
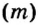
Пример 5. Определить массу порции оксида серы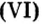
Дано:
Решение:
Ответ: масса порции оксида серы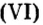
Как вычислить число структурных частиц вещества. Вам известно, что формулы многих веществ содержат индексы. Это дает возможность, характеризуя количественный состав вещества, отмечать число структурных частиц в формульной единице вещества. Число структурных частиц вещества в одном моле вещества принято помечать 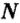
Пример 6. Вычислить, сколько атомов фосфора и сколько атомов кислорода содержится в одном моле оксида фосфора
Анализируя химическую формулу 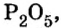
И снова имеем дело с большими числами. На уроках математики вы также будете выполнять действия с очень большими или очень малыми числами. Для удобства их записывают в стандартном виде, то есть в виде 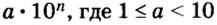
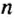
Такими числами удобно пользоваться для обозначения числа Авогадро. Вы легко убедитесь в том, что, умножив 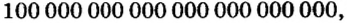
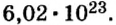
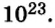
Итоги:
В примере мы ограничились найденным ответом 64 г/моль относительно молярной массы неизвестного вещества. Но вам, наверное, интересно знать, что это за бинарное соединение серы с кислородом? Для этого необходимо установить неизвестные индексы 
Рассуждаем так: если бы 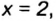
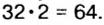
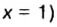
Ответ: формула бинарного соединения —
Молярный объем газов
Как известно, вещества могут находиться в твердом, жидком и газообразном агрегатных состояниях. Особенность газообразного состояния заключается в том, что между структурными частицами (молекулами) газов расстояния в тысячи раз большие, чем расстояния между структурными частицами жидкого, а тем более твердого вещества. Так, один моль воды при комнатной температуре и нормальном атмосферном давлении занимает объем 18 мл (приблизительно 1 столовая ложка). Объем 1 моль мелкокристаллического хлорида натрия втрое больше объема 1 моль воды, а объем 1 моль сахара — больше почти в 20 раз (рис. 2). А для одного моля азота при тех же условиях необходим сосуд приблизительно в 1240 раз вместительнее, чем столовая ложка.
Следовательно, объем одного моля газообразного вещества азота существенно отличается от объема одного моля жидкого или твердого вещества, в то время как разница объемов одного моля жидкости воды и твердого вещества хлорида натрия или сахара незначительная.
Вычислим объем 1 моль азота и некоторых других газообразных веществ в литрах. Для этого воспользуемся такой физической характеристикой вещества, как плотность 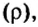
Поскольку давление и температура существенно влияют на объем газообразных веществ, принято проводить определения при температуре 
Температура 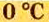
Нормальные условия сокращенно обозначаются их первыми буквами с точкой после каждой в круглых скобках — (н.у.).
Вычисление объема 1 моль азота начнем с нахождения его относительной молекулярной массы
Поскольку молярная масса численно равна относительной молекулярной, то
При нормальных условиях плотность азота 1,25 г/л.
Подставляем значение молярной массы 28 г/моль и плотности азота 1,25 г/л в формулу 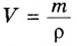
Итак, 1 моль азота при нормальных условиях занимает объем 22,4 л. Заметим, что при других условиях, он будет иметь и другие значения. Так, при 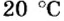
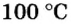
Вычислим молярный объем кислорода при нормальных условиях, если его плотность равна 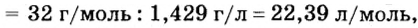
Если бы мы вычисляли молярный объем других газообразных веществ при нормальных условиях, то получили бы значения, близкие к 22,4 л.
Одной из величин, которая характеризует 1 моль любого газообразного вещества при нормальных условиях, является молярный объем газов
Следовательно, 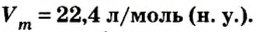
Подумайте и сделайте вывод — одинаковую ли массу они при этом имеют.
Вы, очевидно, обращали внимание на то, что определяющей физической величиной для жидкостей является объем, тогда как для твердых веществ — масса. Это потому, что твердые вещества сохраняют свою форму, а жидкие — нет, они приобретают форму сосуда, в котором содержатся. В этом отношении газы похожи на жидкости, поскольку собственной формы у них также нет.
Рассмотрим примеры вычислений с использованием молярного объема газов.
Пример 1. Вычислить объем азота количеством вещества 0,5 моль при нормальных условиях.
Решение
Воспользуемся формулой
Ответ: объем азота количеством вещества 0,5 моль составляет 11,2 л.
Пример 2. Какому количеству вещества оксида углерода 
Решение
Воспользуемся формулой
Ответ: количество вещества оксида углерода
Итоги:
Теперь вы знаете, что количество вещества 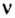
Приравняем их правые части:
Отсюда можно определить массу порции вещества и ее объем, а также молярную массу вещества:
Все три формулы широко применяются в химической практике. Например, если в формулу 1 подставить значение объема известного вещества, то сразу вычислим массу порции этого вещества. Если же в формулу 2 подставить значение массы порции известного вещества, то вычислим объем ее порции. Молярную массу неизвестного вещества можно вычислить с помощью одного действия по формуле 3. Для этого нужно знать массу и объем порции вещества.
Относительная плотность газов
При изучении веществ и явлений не обойтись без сравнений. Их проводят по разным характеристикам — массе, плотности, размерам, зарядам структурных частиц, физическим или химическим свойствам веществ и т. п.
Для газообразных веществ сравнения часто проводят по относительной плотности газов (обозначается буквой латинского алфавита 
Относительная плотность одного газа по другому газу 
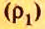
Поскольку плотность — это масса одного объема вещества, а молярный объем всех газов при нормальных условиях одинаков и составляет 22,4 л, делаем вывод, что плотности газов относятся между собой, как и их молярные массы. Вам известно, что молярные массы численно равны относительным молекулярным массам веществ. Отсюда относительная плотность газов может быть вычислена по формуле:
где 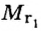
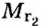
Внизу справа после буквы 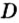
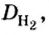
Из формулы для вычисления относительной плотности одного газа по другому следует, что необходимо знать относительные молекулярные массы обоих газообразных веществ. Как и относительная молекулярная масса, относительная плотность газа — величина безразмерная, потому что показывает, во сколько раз один газ легче или тяжелее другого.
Относительную плотность газов можно вычислить по любому газу — водороду, кислороду, углекислому газу и др., а также по газообразным смесям (рис. 4). Чаще всего ее вычисляют по водороду и воздуху. Если говорят о газообразных смесях веществ, то речь идет о средней относительной молекулярной массе смеси, определенной при нормальных условиях в объеме 22,4 л. Так, средняя относительная молекулярная масса воздуха равна 29.
Рассмотрим на примерах, как вычисляется относительная плотность газов и как, воспользовавшись формулой для ее вычисления, находят относительную молекулярную и молярную массы газообразного вещества.
Пример 1. Вычислить относительную плотность кислорода по водороду.
Решение
Ответ: 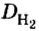
Вычисляя относительную плотность газа по водороду, в знаменателе всегда записывают число 2 (относительная молекулярная масса водорода). Отсюда формулу для вычисления относительной плотности газов по водороду можем подать в таком виде:
На практике часто необходимо определить относительную плотность газа по воздуху. Вспомните: в 7 классе вы выясняли, как необходимо располагать сосуд для собирания газообразного вещества, чтобы наполнить его газом способом вытеснения воздуха.
Поскольку относительная молекулярная масса воздуха составляет 29, то относительную плотность по воздуху вычисляют по формуле:
Пример 2. Вычислить относительную плотность кислорода по воздуху.
Решение
Ответ: относительная плотность кислорода по воздуху равна 1,1.
Таким образом, кислород несколько тяжелее воздуха и потому, чтобы собрать его способом вытеснения воздуха, сосуд располагают книзу дном.
Пример 3. Вычислить относительную плотность водорода по воздуху.
Решение
Ответ: относительная плотность водорода по воздуху равна 0,07.
В рассмотренных примерах кислород тяжелее водорода и воздуха, а водород легче воздуха. Эти и другие примеры доказывают, что если относительная плотность газа больше единицы, то газ тяжелее того газа, с которым его сравнивают. И наоборот, если полученная величина меньше единицы, то газ легче того газа, с которым его сравнивают.
Производными относительной плотности газов являются такие формулы:
Пример 4. Бинарное соединение азота с водородом имеет относительную плотность по водороду 8,5. Установить химическую формулу вещества, если массовая доля азота в ней равна 82 % .
Дано:
Решение
Поскольку относительная атомная масса азота 14, то
Ответ: формула соединения
Итоги:
- Относительная плотность газов — это безразмерная величина, которая показывает, во сколько раз один газ тяжелее или легче другого.
- Для вычисления относительной плотности газа относительную молекулярную или молярную массу одного газа делят на относительную молекулярную или молярную массу другого газа.
- Выбирают способ сбора газов вытеснением воздуха по результатам вычисления относительной плотности газов по воздуху: если она больше единицы, то сосуд для наполнения газом держат книзу дном, а если меньше — вверх дном.
Перенасыщение углекислым газом опасно для организма человека и животного. Установлено, что когда содержание углекислого газа в воздухе превышает 10 %, наступает потеря сознания и даже смерть.
В Италии есть пещера, названная «Собачьей». В нее не рекомендуют заходить с собаками, потому что она почти вполовину человеческого роста заполнена углекислым газом. Если вы определите относительную плотность углекислого газа по воздуху, то поймете, почему человек может находиться в этой пещере определенное время, тогда как собака вскоре начинает задыхаться и может даже погибнуть.
Расчеты по химическим формулам
Изучая химию, вы, наверное, обратили внимание, насколько важная для характеристики вещества информация содержится в его химической формуле. Обобщая эти знания, можно сделать вывод, что химическая формула содержит сведения о молекуле или другой формульной единице вещества, а также о количестве вещества.
Химическая формула информирует о:
- качественном составе вещества (какие элементы его образуют);
- количественном составе вещества (сколько атомов каждого элемента входит в состав его формульной единицы массы);
- принадлежности вещества к простым или сложным.
- Пользуясь химической формулой, можно осуществлять расчеты:
- относительной молекулярной массы вещества;
- молярной массы вещества;
- отношения масс элементов в веществе;
- массовой части элемента в веществе;
- числа структурных частиц вещества в определенной его порции;
- молярной массы, количества и объема вещества;
- относительной плотности газов.
Частью этих расчетов вы уже овладели, ознакомимся с другими расчетами.
Расчеты отношения масс элементов в веществе. Химическая формула, как вам известно, состоит из символов химических элементов и индексов. Индексы являются теми числами, которые передают количественный состав вещества. Это дает возможность по химической формуле вычислять соотношение масс элементов. Рассмотрим такие расчеты на примере.
Пример 1. Вычислить соотношение масс элементов в оксиде фосфора
Решение
Составляем формулу соединения по валентности фосфора: 
Ответ: отношение масс элементов фосфора и кислорода в оксиде фосфора 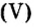
В 7 классе вам демонстрировали горение фосфора в кислороде. Теперь вы знаете, что эти два вещества реагируют полностью, без остатка, если их взять в отношении масс 

Пример 2. Какие вещества образуются в закрытом сосуде после сжигания в нем фосфора массой 93 г в кислороде массой 160 г?
Не будем строить прогнозы, а проведем четкие математические расчеты. Сначала вычислим, сколько кислорода необходимо, чтобы прореагировал весь фосфор. Для этого составим уравнение, в левой части которого запишем отношение масс элементов фосфора и кислорода по формуле, а в правой — по условию задачи, обозначив массу кислорода
Расчеты показали, что для полного взаимодействия порции фосфора массой 93 г достаточно 120 г кислорода. Его же было 160 г. Следовательно, после прекращения реакции в сосуде еще остается: 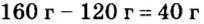
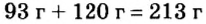
Ответ: после сжигания в сосуде будет 213 г оксида фосфоpa
Итоги:
- Химическая формула вещества отображает ее качественный и количественный состав и дает возможность вычислять количество вещества, относительную молекулярную массу, молярную массу, объем и массу порции вещества, число структурных частиц вещества в определенной его порции.
- По химической формуле вычисляют также массовые доли элементов и отношения масс элементов в веществе.
Химики часто устанавливают не только отношения масс элементов по химической формуле вещества, но и отношения количества вещества реагентов и продуктов реакции. Так, если нужно установить массу или объем продуктов реакции, лучше воспользоваться физической величиной количество вещества. Это потому, что коэффициенты (если их правильно расставить) показывают, сколько молей одного вещества реагирует, а другого — образуется. Из уравнения реакции окисления магния
следует, что 2 моль магния вступают в реакцию соединения с 1 моль кислорода и образуют 2 моль оксида магния.
Для этой реакции отношение количества вещества реагентов и продуктов реакции является таким:
Это значит, что, взяв определенное количество вещества магния, мы получим столько же молей оксида магния , тогда как израсходованное количество вещества кислорода будет вдвое меньшим.
Это учитывают на химических заводах по производству различных веществ и всегда проводят необходимые вычисления.
Вычисления с использованием числа Авогадро
К вычислениям по химическим формулам относятся также определение числа структурных частиц в данном количестве вещества, установление молярной массы вещества, массы или объема определенной порции вещества, по известному числу структурных частиц, из которых оно образовано. Рассмотрим конкретные примеры таких вычислений.
Определение числа атомов (молекул) в данном количестве вещества.
Пример 1. Определить число молекул в порции сульфида водорода 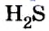
Дано:
Решение
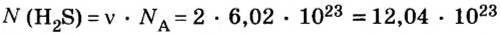
Ответ: в порции сульфида водорода количеством вещества 2 моль содержится 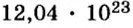
Усложним условие предыдущей задачи.
Пример 2. Определить число молекул в порции сульфида водорода 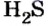
Дано:
Решение
1. Для определения числа молекул необходимо знать количество вещества. Поэтому из формулы 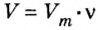
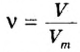
2. Определяем число молекул в порции сульфида водорода количеством вещества 0,5 моль:
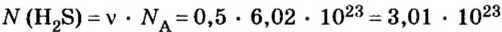
Ответ: в порции сульфида водорода 

Пример 3. Определить, где больше молекул — в порции углекислого газа массой 88 г или в порции газа пропана 
Дано:
Решение
1. Вычислим относительные молекулярные и молярные массы углекислого газа и пропана:
2. Вычислим количество вещества в порции углекислого газа массой 88 г:
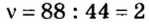
3. Вычислим количество вещества в порции пропана массой 88 г:
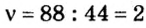
Количество вещества в обеих порциях одинаково, следовательно, число молекул также одинаково.
Ответ: число молекул в порциях углекислого газа и пропана массой 88 г каждая одинаковое.
Пример 4 Вычислить молярную массу соединения серы с кислородом и найти его формулу, если масса 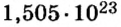
Дано:
Решение
Для вычисления молярной массы соединения нужно знать его химическую формулу. Если же химическая формула неизвестна, можно прибегнуть к вычислениям молярной массы вещества по таким формулам:
1. По формуле 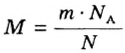
2. По массовой доле серы находим, сколько атомов этого элемента обозначено в формуле буквой
отсюда
3. Находим, сколько атомов кислорода обозначено в формуле буквой
Ответ: молярная масса соединения серы с кислородом равна 64 г/моль, а ее формула —
Итоги:
Используя число Авогадро, определяют числа структурных частиц вещества в данной его порции, устанавливают молекулярную формулу вещества.
Вычисления с применением числа Авогадро проводят по формулам:
Физическую величину количество вещества можно применить не только к индивидуальным веществам, но и к их смесям. Это дает возможность проводить расчеты по более сложным химическим формулам, чем те, которые были приведены в параграфе. В частности, можно вычислять содержимое компонентов в составе газообразной смеси, а также массовые и объемные части газов в смеси.
Пример. Вычислить массовые и объемные доли газов в смеси оксида углерода 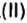
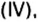
Объемная доля компонента 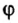
Объемную долю вычисляют в процентах или в долях от единицы.
Дано:
Решая эту задачу, важно помнить, что физическую величину количество вещества 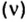
Решение
Вычислим молярную массу смеси по формуле:
Обозначим содержимое оксида углерода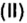
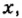
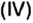
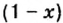
Данными сведениями заполним таблицу:
Составим алгебраическое уравнение и решим его:
Вычислим массу каждого компонента смеси:
Вычислим массовые доли компонентов смеси:
Находим объемные доли компонентов смеси. Поскольку в молярном объеме смеси объемные доли каждого компонента равны его количеству вещества, то:
Ответ: массовые и объемные доли газов в смеси составляют:
- Органические соединения
- Теория химического строения органических соединений А. М. Бутлерова
- Насыщенные углеводороды
- Ненасыщенные углеводороды
- Неметаллы в химии
- Галогены в химии
- Подгруппа кислорода
- Подгруппа азота
В этой статье мы коснемся нескольких краеугольных понятий в химии, без которых совершенно невозможно
решение задач. Старайтесь понять смысл физических величин, чтобы усвоить эту тему.
Я постараюсь приводить как можно больше примеров по ходу этой статьи, в ходе изучения вы увидите множество примеров
по данной теме.

Относительная атомная масса — Ar
Представляет собой массу атома, выраженную в атомных единицах массы. Относительные атомные массы указаны в периодической
таблице Д.И. Менделеева. Так, один атом водорода имеет атомную массу = 1, кислород = 16, кальций = 40.
Относительная молекулярная масса — Mr
Относительная молекулярная масса складывается из суммы относительных атомных масс всех атомов, входящих в состав вещества.
В качестве примера найдем относительные молекулярные массы кислорода, воды, перманганата калия и медного купороса:
Mr (O2) = (2 × Ar(O)) = 2 × 16 = 32
Mr (H2O) = (2 × Ar(H)) + Ar(O) = (2 × 1) + 16 = 18
Mr (KMnO4) = Ar(K) + Ar(Mn) + (4 × Ar(O)) = 39 + 55 + (4 * 16) = 158
Mr (CuSO4*5H2O) = Ar(Cu) + Ar(S) + (4 × Ar(O)) + (5 × ((Ar(H) × 2) +
Ar(O))) = 64 + 32 + (4 × 16) + (5 × ((1 × 2) + 16)) = 160 + 5 * 18 = 250
Моль и число Авогадро
Моль — единица количества вещества (в системе единиц СИ), определяемая как количество вещества, содержащее столько же структурных единиц
этого вещества (молекул, атомов, ионов) сколько содержится в 12 г изотопа 12C, т.е. 6 × 1023.
Число Авогадро (постоянная Авогадро, NA) — число частиц (молекул, атомов, ионов) содержащихся в одном моле любого вещества.

Больше всего мне хотелось бы, чтобы вы поняли физический смысл изученных понятий. Моль — международная единица количества вещества, которая
показывает, сколько атомов, молекул или ионов содержится в определенной массе или конкретном объеме вещества. Один моль любого вещества
содержит 6.02 × 1023 атомов/молекул/ионов — вот самое важное, что сейчас нужно понять.
Иногда в задачах бывает дано число Авогадро, и от вас требуется найти, какое вам дали количество вещества (моль). Количество вещества в химии
обозначается N, ν (по греч. читается «ню»).
Рассчитаем по формуле: ν = N/NA количество вещества 3.01 × 1023 молекул воды и 12.04 × 1023 атомов углерода.

Мы нашли количества вещества (моль) воды и углерода. Сейчас это может показаться очень абстрактным, но, иногда не зная, как найти
количество вещества, используя число Авогадро, решение задачи по химии становится невозможным.
Молярная масса — M
Молярная масса — масса одного моля вещества, выражается в «г/моль» (грамм/моль). Численно совпадает с изученной нами ранее
относительной молекулярной массой.
Рассчитаем молярные массы CaCO3, HCl и N2
M (CaCO3) = Ar(Ca) + Ar(C) + (3 × Ar(O)) = 40 + 12 + (3 × 16) = 100 г/моль
M (HCl) = Ar(H) + Ar(Cl) = 1 + 35.5 = 36.5 г/моль
M (N2) = Ar(N) × 2 = 14 × 2 = 28 г/моль
Полученные знания не должны быть отрывочны, из них следует создать цельную систему. Обратите внимание: только что мы рассчитали
молярные массы — массы одного моля вещества. Вспомните про число Авогадро.
Получается, что, несмотря на одинаковое число молекул в 1 моле (1 моль любого вещества содержит 6.02 × 1023 молекул),
молекулярные массы отличаются. Так, 6.02 × 1023 молекул N2 весят 28 грамм, а такое же количество молекул
HCl — 36.5 грамм.
Это связано с тем, что, хоть количество молекул одинаково — 6.02 × 1023, в их состав входят разные атомы, поэтому и
массы получаются разные.

Часто в задачах бывает дана масса, а от вас требуется рассчитать количество вещества, чтобы перейти к другому веществу в реакции.
Сейчас мы определим количество вещества (моль) 70 грамм N2, 50 грамм CaCO3, 109.5 грамм HCl. Их молярные
массы были найдены нам уже чуть раньше, что ускорит ход решения.

ν (CaCO3) = m(CaCO3) : M(CaCO3) = 50 г. : 100 г/моль = 0.5 моль
ν (HCl) = m(HCl) : M(HCl) = 109.5 г. : 36.5 г/моль = 3 моль
Иногда в задачах может быть дано число молекул, а вам требуется рассчитать массу, которую они занимают. Здесь нужно использовать
количество вещества (моль) как посредника, который поможет решить поставленную задачу.
Предположим нам дали 15.05 × 1023 молекул азота, 3.01 × 1023 молекул CaCO3 и 18.06 × 1023 молекул
HCl. Требуется найти массу, которую составляет указанное число молекул. Мы несколько изменим известную формулу, которая поможет нам связать
моль и число Авогадро.

Теперь вы всесторонне посвящены в тему. Надеюсь, что вы поняли, как связаны молярная масса, число Авогадро и количество вещества.
Практика — лучший учитель. Найдите самостоятельно подобные значения для оставшихся CaCO3 и HCl.
Молярный объем
Молярный объем — объем, занимаемый одним молем вещества. Примерно одинаков для всех газов при стандартной температуре
и давлении составляет 22.4 л/моль. Он обозначается как — VM.
Подключим к нашей системе еще одно понятие. Предлагаю найти количество вещества, количество молекул и массу газа объемом
33.6 литра. Поскольку показательно молярного объема при н.у. — константа (22.4 л/моль), то совершенно неважно, какой газ мы
возьмем: хлор, азот или сероводород.
Запомните, что 1 моль любого газа занимает объем 22.4 литра. Итак, приступим к решению задачи. Поскольку какой-то газ
все же надо выбрать, выберем хлор — Cl2.


Моль (количество вещества) — самое гибкое из всех понятий в химии. Количество вещества позволяет вам перейти и к
числу Авогадро, и к массе, и к объему. Если вы усвоили это, то главная задача данной статьи — выполнена 

Относительная плотность и газы — D
Относительной плотностью газа называют отношение молярных масс (плотностей) двух газов. Она показывает, во сколько раз одно вещество
легче/тяжелее другого. D = M (1 вещества) / M (2 вещества).
В задачах бывает дано неизвестное вещество, однако известна его плотность по водороду, азоту, кислороду или
воздуху. Для того чтобы найти молярную массу вещества, следует умножить значение плотности на молярную массу
газа, по которому дана плотность.
Запомните, что молярная масса воздуха = 29 г/моль. Лучше объяснить, что такое плотность и с чем ее едят на примере.
Нам нужно найти молярную массу неизвестного вещества, плотность которого по воздуху 2.5

Предлагаю самостоятельно решить следующую задачку (ниже вы найдете решение): «Плотность неизвестного вещества по
кислороду 3.5, найдите молярную массу неизвестного вещества»

Относительная плотность и водный раствор — ρ
Пишу об этом из-за исключительной важности в решении
сложных задач, высокого уровня, где особенно часто упоминается плотность. Обозначается греческой буквой ρ.
Плотность является отражением зависимости массы от вещества, равна отношению массы вещества к единице его объема. Единицы
измерения плотности: г/мл, г/см3, кг/м3 и т.д.
Для примера решим задачку. Объем серной кислоты составляет 200 мл, плотность 1.34 г/мл. Найдите массу раствора. Чтобы не
запутаться в единицах измерения поступайте с ними как с самыми обычными числами: сокращайте при делении и умножении — так
вы точно не запутаетесь.

Иногда перед вами может стоять обратная задача, когда известна масса раствора, плотность и вы должны найти объем. Опять-таки,
если вы будете следовать моему правилу и относится к обозначенным условным единицам «как к числам», то не запутаетесь.
В ходе ваших действий «грамм» и «грамм» должны сократиться, а значит, в таком случае мы будем делить массу на плотность. В противном случае
вы бы получили граммы в квадрате 
К примеру, даны масса раствора HCl — 150 грамм и плотность 1.76 г/мл. Нужно найти объем раствора.

Массовая доля — ω
Массовой долей называют отношение массы растворенного вещества к массе раствора. Важно заметить, что в понятие раствора входит
как растворитель, так и само растворенное вещество.
Массовая доля вычисляется по формуле ω (вещества) = m (вещества) / m (раствора). Полученное число будет показывать массовую долю
в долях от единицы, если хотите получить в процентах — его нужно умножить на 100%. Продемонстрирую это на примере.

Решим несколько иную задачу и найдем массу чистой уксусной кислоты в широко известной уксусной эссенции.

© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.