Формула воздуха
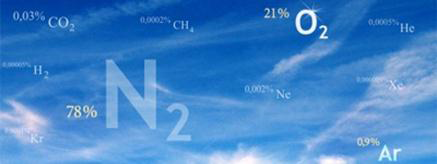
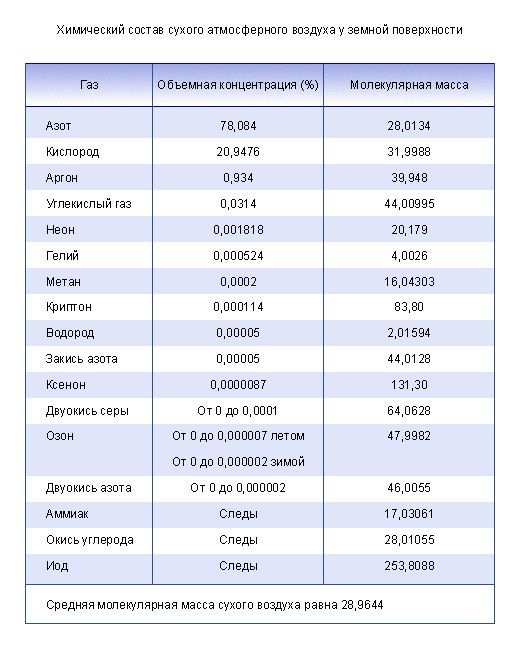
Газовый состав воздуха
От уровня моря до высоты около 11000 м (слой тропосферы) газовый состав воздуха практически не изменяется и выглядит следующим образом:
| Вещество | Формула | Объемная доля, % | Массовая доля, % |
|---|---|---|---|
|
Азот |
N2 |
78,08 |
75,5 |
|
Кислород |
O2 |
20,95 |
23,1 |
|
Аргон |
Ar |
0,93 |
1,29 |
|
Углекислый газ |
CO2 |
0,034 |
0,046 |
|
Неон |
Ne |
0,0018 |
0,0014 |
|
Гелий |
He |
0,000524 |
0,000073 |
|
Метан |
CH4 |
0,0002 |
0,000084 |
|
Криптон |
Kr |
0,0001 |
0,003 |
|
Водород |
H2 |
0,00005 |
0,00008 |
|
Ксенон |
Xe |
0,000008 |
0,00004 |
Средняя молярная масса воздуха: 29,16 г/моль
Воздух в тропосфере практически всегда содержит некоторое количество водяного пара. Влажность воздуха зависит от его температуры и высоты над уровнем моря.
Состав воздуха может незначительно меняться в зависимости от географического положения, времени года, времени суток. В крупных городах обычно повышенное содержание углекислого газа. В горах наблюдается более низкое содержание кислорода, из-за того, что кислород тяжелее азота, поэтому его плотность с высотой уменьшается быстрее.
В нижних слоях атмосферы могут содержаться во взвешенном состоянии некоторые количества мелких частиц пыли и золы, которые образуются в процессе горения различных видов топлива или в результате извержения вулканов. С присутствием в воздухе этих высокодисперсных частиц связана окраска солнечных восходов и закатов, обусловленная рассеянием на них солнечных лучей.
Примеры решения задач по теме «формула воздуха»
| Понравился сайт? Расскажи друзьям! | |
Формула воздуха
ОПРЕДЕЛЕНИЕ
Воздух — это естественная смесь газов (главным образом азота и кислорода), которая образует атмосферу земли.
Газовый состав воздуха
От уровня моря до высоты около 11 000 м (слой тропосферы) газовый состав воздуха остается практически неизменным и выглядит следующим образом:
(
begin{array}{|c|c|c|c|}
hline
Вещество& Формула&Объемная,доля&Массовая,доля\ hline
Азот&mathrm{N}_{2}&78,08&75,5\ hline
Кислород&mathrm{O}_{2}&20,95&23,1\ hline
Аргон&text { Ar }&0,93&1,29\ hline
Углекислый, газ&mathrm{CO}_{2}&0,034&0,046\ hline
Неон&text { Ne }&0,0018&0,0014\ hline
Гелий&text { He }&0,000524&0,000073\ hline
Метан&mathrm{CH}_{4}&0,0002&0,000084\ hline
Криптон&mathrm{Kr}&0,0001&0,003\ hline
Водород&mathrm{H}_{2}&0,00005&0,00008\ hline
Ксенон&text { Xe }&0,000008&0,00004\ hline
end{array}
)
Средняя молярная масса воздуха: 29,16 г / моль
Воздух в тропосфере почти всегда содержит несколько водяных паров. Влажность воздуха зависит от его температуры и высоты над уровнем моря.
Состав воздуха может незначительно варьироваться в зависимости от географического положения, времени года, времени суток. В крупных городах, как правило, высокий уровень углекислого газа. В горах наблюдается более низкое содержание кислорода из-за того, что кислород тяжелее азота, поэтому его плотность уменьшается с высотой быстрее.
В нижних слоях атмосферы могут быть приостановлены определенные количества мелких частиц пыли и золы, которые образуются в процессе сжигания различных видов топлива или в результате вулканических извержений. Присутствие этих мелких частиц в воздухе связано с цветом восходов и закатов из-за рассеяния солнечного света на них.
Примеры решения задач по «воздушной формуле»
ПРИМЕР 1
Плотность некоторого газа в воздухе равна 2. Какова масса этого газа с объемом 5,6 литра (ну)?
Раствор Молекулярная масса воздуха составляет 29 г / моль.
Рассчитайте молекулярную массу этого газа:
(
M(газ) = M(воздух)cdot D(газ) =29 cdot 2=58 г/моль
)
Согласно результату закона Авогадро молярный объем газа в нормальных условиях составляет 22,4 л.
Составьте пропорцию и рассчитайте массу 5,6 литров газа:
58 г газа занимает 22,4 литра
xg-газ занимает 5,6 литров
Отсюда
(
x=58 cdot 5,6 / 22,4=14,5g
)
Масса 5,6 литров газа будет равна 14,5 г.
ПРИМЕР 2
Во время сгорания 5.36 г определенного гомолога бензола потреблялось 56,7 литра воздуха (NU). Определите формулу исходного соединения.
Напишите уравнение для реакции горения:
(
C_{n} H_{2 n-6}+left(frac{3 n-3}{2}right) O_{2}=n C O_{2}+(n-3) H_{2} O
)
Содержание кислорода в воздухе составляет 21%. Рассчитайте объем потребляемого в процессе сгорания кислорода:
(
Vleft(O_{2}right)=V(воздух) cdotomegaleft(O_{2}right) / 100=56,7 cdot 21 / 100=11,9л
)
Количество кислородного вещества будет равно:
(
nleft(O_{2}right)=Vleft(O_{2}right) / V_{M}=11,9 / 22,4=0,531моль
)
Согласно уравнению реакции
(
1моль mathrm{CnH} 2 mathrm{n}-6-(3 mathrm{n}-3) / 2 моль O2
)
(
x моль mathrm{CnH} 2 mathrm{n}-6-0.531 моль O2
)
Следовательно, количество вещества бензольного гомолога, входящего в реакцию, будет равно:
(
x=nleft(C_{n} H_{2 pi-6}right)=frac{2 cdot 0,531}{3 n-3}
)
Молярная масса (
mathrm{CnH} 2 mathrm{n}-6
) равна:
(
Mleft(C_{n} H_{2 n-6}right)=12 n+2 n-6=14 n-6
)
(
nleft(C_{n} H_{2 n-6}right)=frac{mleft(C_{n} H_{2 n-6}right)}{Mleft(C_{n} H_{2 n-6}right)}=frac{5,36}{14 n-6}=frac{2 cdot 0,531}{3 n-3}
)
(
1,062(14 n-6)=5,36(3 n-3)
)
(
1,212 n=9,708
)
(
n=8
)
Следовательно, формула вещества (
mathrm{C} 8 mathrm{H} 10
)
составная формула — (
mathrm{C} 8 mathrm{H} 10
)
Компоненты воздуха в процентах
Итак, основной состав атмосферного воздуха представлен двумя веществами: кислородом (O2) и азотом (N2), с преобладающей долей азота около 78%. На кислород приходится около 21%. Все остальные компоненты содержатся в малых количествах – это инертные газы — аргон (Ar), ксенон (Xe, 8.7*10-6), гелий (He, 4,6*10-4), метан (СН4, 1,7*10-4), водород (Н2, 5*10 -5) и т.д. Представленное процентное соотношение азота и кислорода – оптимально для нормальной деятельности живых организмов. Интересен тот факт, что в составе воздуха присутствует, хотя и в малых количествах, (около 0,03%), углекислый газ CO2. Это химическое соединение, содержащееся в выдыхаемом человеком и живыми организмами воздухе, но необходимое для процесса фотосинтеза в растениях. Азот – один из важных компонентов, входящих в состав аминокислот, белковых молекул. Кислород – основа биохимических процессов и синтезов в природе и организме, входит в состав воды (Рис. 1.).
Смесь воздуха в разных климатических условиях
Следует отметить, что состав воздуха не везде одинаков. Например:
- Высоко в горах, разряженный воздух, с пониженным содержанием кислорода. Поэтому в условиях высокогорья дышится тяжелее, и альпинисты, совершая восхождения на горные вершины, используют кислородные маски. Но в то же время люди, живущие в предгорьях и вдыхающие свежий горный воздух, меньше болеют и дольше живут.
- Морской воздух, с постоянно пополняющимся химическим составом, за счет испарения морской воды содержит фитонциды, отрицательно заряженные аэроны, среди которых ионы йода и другие жизненно важные элементы. Морской воздух полезен тем, кто имеет заболевания дыхательных путей (туберкулез, бронхит и т.д.). Заряженные частицы – ионы, входящие в состав воздуха играют важную роль в процессах обмена веществ, причем наиболее важны отрицательно заряженные частицы. Русский ученый А. Л. Чижевский провел серию экспериментов и определил положительное действие этих частиц на здоровье человека.
- Лесной воздух богат компонентами на основе трав, цветов, эфирных масел сосны, пихты и т.д. Помимо общеукрепляющего действия, он обладает бактерицидным действием. Когда мы дышим в лесу, получаем “порцию лекарства”.
Важно! Следовательно, не существует универсальной формулы химического состава воздуха. Для каждой климатической зоны она будет индивидуальна.
Негативные последствия загрязненного воздуха для человека
Развитие промышленности, побочные продукты технологического цикла заводов и фабрик, уничтожение лесов, автовыбросы и другие сопутствующие факторы оказывают негативное влияние на состав воздуха, как следствие — на организм человека (Рис. 2). Применение в производственных процессах технологий, которые не контролируют выбросы в атмосферу таких компонентов, как оксиды азота, углерода, сероводород, не только видоизменяют состав воздуха, но и способствуют развитию онкологических, сердечно-сосудистых, легочных и других серьезных заболеваний. Традиционно в крупных мегаполисах и промышленных зонах, вблизи оживленных автомагистралей нормы предельно допустимых концентраций (ПДК) указанных веществ превышены в несколько раз.
Негативные последствия грязного воздуха для Земли
Выброс в атмосферу фреонов также негативно влияет на озоновый слой земли, который защищает все живое на планете от ультрафиолетовых солнечных лучей. Попадая в верхние слои атмосферы, они вступают в реакцию с озоном и образуют кислород, тем самым разрушая защитный слой с образованием озоновых дыр.
Меры защиты и профилактики загрязнения воздуха
Чтобы решить проблему загрязнения воздуха:
- Вблизи дорог и предприятий высаживаются лесополосы, на производствах устанавливают специальные фильтры и очистные сооружения.
- В безветренную погоду снижают мощности или останавливают, насколько это возможно, производственные процессы.
- Специальные экологические комиссии постоянно проводят мониторинг воздуха над особо опасными по выбросам зонами.
Но проблема загрязнения окружающей среды в мировом масштабе и воздуха в частности, стоит достаточно остро. Необходимо осуществлять переход на экологически безопасные виды топлива, производства и т.д., беречь здоровье жителей планеты.
Рекомендуем посмотреть интересное видео о составе воздуха:
>
Все категории
- Фотография и видеосъемка
- Знания
- Другое
- Гороскопы, магия, гадания
- Общество и политика
- Образование
- Путешествия и туризм
- Искусство и культура
- Города и страны
- Строительство и ремонт
- Работа и карьера
- Спорт
- Стиль и красота
- Юридическая консультация
- Компьютеры и интернет
- Товары и услуги
- Темы для взрослых
- Семья и дом
- Животные и растения
- Еда и кулинария
- Здоровье и медицина
- Авто и мото
- Бизнес и финансы
- Философия, непознанное
- Досуг и развлечения
- Знакомства, любовь, отношения
- Наука и техника
8
Какая химическая формула воздуха?
Как выглядит химическое соединение — воздух ?
формула воздуха
10 ответов:
9
0
Много людей иногда задается вопросом с чего состоит воздух и какая у него формула. Воздух — это смесь газов, которая окутывает нашу Землю в атмосфере. Так вот основным составляющим является азот и кислород, остальные это газы которые просто немного добавляют воздух
7
0
Воздух это смесь газов. Состав воздуха не является постоянной величиной и меняется в зависимости от местности, региона и даже количества людей находящихся рядом с вами. В основном воздух состоит из Азота примерно на 78% и кислорода на 21%, остальное это примеси различных соединений.
5
0
Владимир! Как таковой химической формулы воздуха не существует..
воздух-ЭТО СМЕСЬ различных газов- кислорода ,окиси углерода,азота и других газов..
точную пропорцию этих газов в атмосфере назвать трудно…
4
0
Со школьной программы помню что атмосферный воздух это смесь газов в котором основные это — азот и кислород на их долю приходится 99% этой смеси сам состав атмосферного воздуха примерно такой:
азот — 78%.
кислород — 21%.
аргон — 1%.
углекислый газ — 0,03%.
далее процент настолько мал но видимо без них мы дышать возможно и сможем но могут возникнуть нарушения:
неон — 0,002%.
метан — 0,0002%.
гелий — 0,0005%.
криптон — 0,0001%.
водород — 0,00005%.
ксенон — 0,000009%.
Но хочу добавить что процент газов на планете Земля не везде одинаков.
4
0
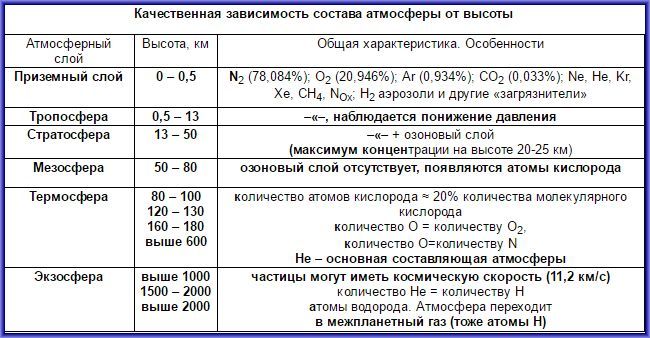
Воздух нельзя назвать химическим соединением, ведь он состоит из смеси разнообразных газов, которая постоянно меняет свой состав. Причем, это изменение носит как качественный, так и количественный характер. Так, если до высоты в 13 километров, состав атмосферы меняется мало, то выше появляется озоновый слой, то есть в атмосфере возникает большое количество трехатомного кислорода. Напротив у поверхности на состав атмосферы оказывают большое влияние загрязнения как техногенного (выбросы предприятий, автомобилей), так и природного характера (вулканическая деятельность). Химическое же соединение как правило постоянно, атомы элементов в нем связаны различными связями и находятся в строгих пропорциях.
Вот состав атмосферы у поверхности:
А вот какие изменения происходят в атмосфере с высотой:
3
0
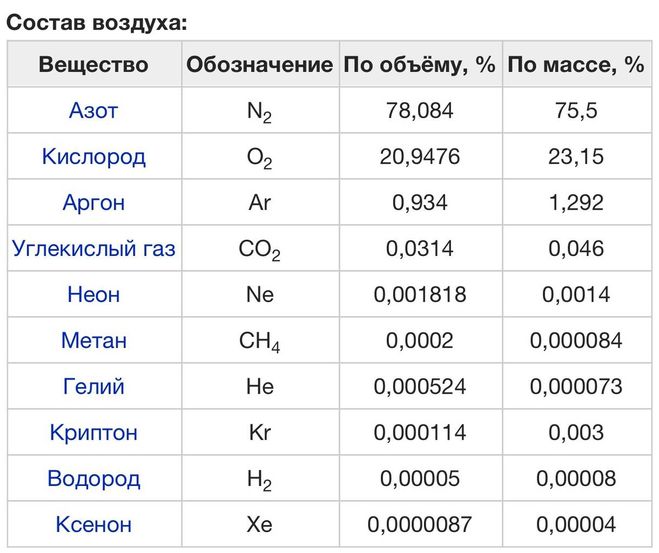
Вы нигде не сможете отыскать какую-то химическую формулу воздуха. Всё дело в том, что воздух в своём составе имеет огромнейшее количество различных примесей газов, поэтому вам можно только предоставить перечень этих примесей с примерным процентным содержанием, а вот и этот перечень:
2
0
Наверное не совсем корректно говорить о воздухе как о химическом соединении. Скорее это смесь газов в которой присутствуют пары воды. Основной состав воздуха это азот-кислород в объемном соотношении 78-21%. Остальное принадлежит водороду, углекислому газу, аргону, гелию и пр. Состав воздуха может меняться в зависимости от географии места (город, лес, горы, море) в пределах 2% для каждого газа.
2
0
Невозможно составить единую цельную формулу для атмосферы Земли. Но можно определить какие газы есть в воздухе:
- Азот N2 — 78.084 %.
- Оксиген (которым мы дышим) О2 — 20.9476 %.
- Аргон Ar — 0.934 %.
- Углекислый газ CO2 — 0.0314%.
- Неон Ne — 0.001818%.
- Метан CH4 — 0.0002%.
- Гелий He — 0.000524%.
- Криптон Kr — 0.000114%.
- Гидроген H2 — 0.00005%.
- Ксенон Xe — 0.0000087%.
- Озон O3 — 0.000007%.
- Нитроген диоксид NO2 — 0.000002%.
- Йод I2 — 0.000001%.
- Количество карбона моноксида CO и аммония NH3 ничтожно мало.
1
0
Воздух по существу представляет собой смесь азота (около 80%) и кислорода (около 20%), другие газы составляют около 1% или меньше. Как таковой химической формулы воздуха не существует, так как это смесь различных соединений в различном процентном соотношении.
1
0
Воздух — это не химическое соединение. Воздух представляет собой смесь газов, причем его состав не постоянен и зависит непосредственно от места, в котором мы будем анализировать состав воздуха, наличия тех или иных загрязнений.
98-99% состава воздуха приходится на азот и кислород. Также в состав воздуха входят
Читайте также
Самый банальный ответ-наверное для дезинфекции.
Мир на данный момент насчитывает 13 различных розеток или вилок. Все это разбросано по планете довольно хаотично, только британская встречается наиболее чаще, много колоний в своё время имела Англия. Но кое где например на Мальдивах, насчитывается в одном месте сразу 6 видов электрического подключения, все связано с прошлым и историей войн на этой территории. Купленное в одной стране в соседней может не работать, инженеры стран модернизировали вилку Хаббелла на свое усмотрение и не задумывались о будущем перемещении товаров между странами.
В 1681 году англичанин по имени Роберт Бойл погрузил лучину, которая была покрыта серой, в раствор серы и фосфора. Таким образом дал толчок в этом направлении.
Судя по ответам собрались одни флудеры,которым все равно что писать,лишь бы букв было побольше а смысл написанного роли абсолютно не играет.В теме вопроса познаний НОЛЬ.
Если судить по симптомам то накрылся магнетрон,генератор ВЧ который собственно и разогревает пищу.Тарелка будет крутиться,свет в камере гореть,магнетрон трещать а толку никакого.Откройте дверцу,сбоку ,на стенке ,есть слюдяная пластинка серого цвета.На ней нет прожженной дыры ?
Магнетрон с заменой ( зависит от производителя и мощности печки) обойдётся в 15-40$.Если печка хорошая и функциональная то есть смысл в ремонте.Если простенькая и дешевая,то лучше купить новую.
Зажгите свечу и внимательно рассмотрите пламя. Вы заметите, что оно неоднородно по цвету. Пламя имеет три зоны (рис.). Темная зона 1 находится в нижней части пламени. Это самая холодная зона по сравнению с другими. Темную зону окаймляет самая яркая часть пламени 2. Температура здесь выше, чем в темной зоне, но наиболее высокая температура – в верхней части пламени 3.
Чтобы убедиться, что различные зоны пламени имеют разную температуру, можно провести такой опыт. Поместите лучинку (или спичку) в пламя так, чтобы она пересекала все три зоны. Вы увидите, что лучинка сильнее обуглилась там, где она попала в зоны 2 и 3. Значит, пламя там более горячее.
Содержание:
- Воздух
- Средства защиты атмосферы
- Горение
- Медленное окисление
- Условия возникновения и прекращения горения
- Образование основных и кислотных оксидов
Химический состав. Воздух состоит из смеси примерно двадцати семи различных газов. Примерно на 99% — это смесь кислорода и азота. В составе оставшегося процента: водяной пар, углекислый газ, метан, водород, озон, инертные газы (аргон, ксенон, неон, гелий, криптон) и другие.
На странице -> решение задач по химии собраны решения задач и заданий с решёнными примерами по всем темам химии.
Воздух
Молекулярная и химическая формула воздуха, в основном азот N₂ и кислород О₂. Воздух – естественная смесь газов, образующая атмосферу Земли.
В 1774 г. французский ученый А. Лавуазье доказал, что воздух — это смесь в основном двух газов: азота и кислорода, содержание азота составляет 4/5 и 1/5 кислорода (по объему).
Качественный состав воздуха можно доказать посредством следующего опыта. Заполненный воздухом колокол опускают в воду. В железную ложечку помешают кусочек фосфора, его зажигают и вносят под колокол. При этом вода в колоколе поднимается на 1/5, так как при горении фосфора расходуется только кислород. Газ, оставшийся под колоколом — азот, он в реакцию не вступает (рис. 16).
Рис. 16. Сжигание фосфора пои колоколом: а — горение фосфора; б — уровень волы поднялся на 1/5 объема
В конце XIX в. было установлено, что в состав воздуха, кроме кислорода и азота, входят пять газообразных веществ: аргон (Аr), ксенон (Хе), криптон (Кг), гелий (Не), неон (Ne). Эти газы называются благородными из-за их химической неактивности.
Кроме того, в воздухе содержатся оксид углерода (IV) и водяные пары. Примерный состав воздуха показан в табл. 6.
Антуан Лоран Лавуазье (1743—1794)
Французский ученый в 1774 г. установил состав воздуха, ввел понятия «химический элемент» и «химическое соединение». Лавуазье был автором первой классификации химических веществ и учебника «Элементарный курс химии».
Содержание углекислого газа (СО2) и водяных паров изменяется в зависимости от условий. Например, при сырой и теплой погоде в воздухе содержится больше водяных паров, а при сухой и прохладной — меньше. Процессы горения увеличивают долю оксида углерода (IV) и уменьшают содержание кислорода.
Таблица 6
Состав воздуха
| Составные части | Содержание газов (в %) | |
| по объему | по массе | |
| Азот | 78,08 | 75,50 |
| Кислород | 20,95 | 23,10 |
| Благородные газы (в основном аргон) | 0,94 | 1,30 |
| Оксид углерода (IV) | 0,03 | 0,046 |
В результате природных явлений и деятельности человека (при землетрясении, вулканических извержениях, при сгорании топлива и выбросах из заводских труб) в атмосферу поступают такие газы, как оксиды азота — NO и NO2, оксиды серы — SO2 и SO3, сероводород — H2S.
В настоящее время на долю автомобильного транспорта приходится больше половины всех вредных выбросов в окружающую среду, которые являются главным источником загрязнения атмосферы, особенно в мегаполисах. В среднем при пробеге 15 тыс. км в год каждый автомобиль сжигает 2 т топлива и около 26—30 т воздуха, в том числе 4,5 т кислорода, что в 50 раз больше потребностей человека.
Атмосферный воздух является одним из основных жизненно важных элементов окружающей среды.
Средства защиты атмосферы
Средства защиты атмосферы должны ограничивать наличие вредных веществ в воздухе на уровне не выше ПДК (предельно допустимой концентрации).
Для очистки газов от частиц широко применяют сухие пылеуловители — циклоны различных типов.
Один из наиболее совершенных видов очистки газов от взвешенных в них частиц пыли и тумана — электрическая очистка (электрофильтр).
Для высокоэффективной очистки выбросов применяют аппараты многоступенчатой очистки.
В крупных городах для снижения вредного влияния загрязнения воздуха на человека применяют специальные градостроительные мероприятия. Построены и строятся автомагистрали в обход городов, принявшие весь поток транзитного транспорта, который раньше нескончаемой лентой тянулся по городским улицам.
Предприятия или их отдельные здания и сооружения, технологические процессы которых являются источником выделения в атмосферный воздух неприятно пахнущих веществ, отделяют от жилой застройки санитарно-защитными зонами.
Для повышения эффективности санитарно-защитных зон на их территории высаживают древесно-кустарниковую и травянистую растительность, снижающую концентрацию промышленной пыли и газов.
Знаешь ли ты?
Атмосфера земного шара весит 5 300 000 000 000 000 т. Если бы, например, потребовалось перевезти из Астаны в Алматы груз, равный весу земной атмосферы, и если бы каждый поезд имел 100 вагонов и проходил весь путь за 10 ч, на перевозку этого груза было бы потрачено почти 4 млрд. лет.
Самое важное
В воздухе содержится (по объему) 78% азота, 21% кислорода, 1% инертных и других газов. Кроме вышеприведенных простых веществ, в составе воздуха находятся углекислым газ и водяные пары, содержание которых может изменяться в зависимости от условии.
Горение
В повседневной жизни мы часто наблюдаем, как горит такое топливо, как природный газ. дрова, уголь. Знаете ли вы, что горение происходит с участием кислорода, входящего в состав воздуха? Кислород при нагревании энергично реагирует со многими веществами, при этом выделяются теплота и свет. Такие реакции называются реакциями горения. При горении атомы простых веществ соединяются с атомами кислорода и образуются оксиды. Общая схема взаимодействия простых веществ с кислородом такова:
простое вещество + кислород = оксид
Горение — это химическая реакция, при которой происходит окисление веществ с выделением теплоты и света.
Реакции взаимодействия веществ с кислородом называются окислением , а их продукты — оксидами.
Оксиды — это сложные вещества, которые состоят из двух элементов, один из которых кислород. При горении веществ в воздухе образуются те же продукты, т. е. оксиды. Однако горение веществ в воздухе происходит медленнее, чем в кислороде, так как последнего в воздухе содержится примерно в пять раз меньше.
Если опустить в сосуд с кислородом О2, тлеющий уголек (рис. 17а), то он раскаляется добела и сгорает, образуя оксид углерода (IV) СО2 (углекислый газ):
углерод — кислород = оксид углерода (IV)
Чтобы определить, какое образовалось вещество, в сосуд наливают известковую воду — она мутнеет. Это доказывает наличие углекислого газа.
В железную ложечку поместим кусочек серы и подожжем над пламенем спиртовки, затем внесем в сосуд с кислородом. Сера S горит в кислороде О2 ярким синим пламенем (рис. 17 б) с образованием газа с резким запахом оксида серы (IV) (опыт проводится под тягой):
сера + кислород = оксид серы (IV)
Фосфор Р сгорает в кислороде О2 ярким пламенем с образованием белого дыма, состоящего из твердых частиц оксида фосфора (V) (рис. 17 в):
фосфор + кислород = оксид фосфора (V)
В кислороде горят и такие вещества (рис. 17 г), которые обычно считают негорючими, например железо. Если к тонкой стальной проволоке прикрепить спичку, зажечь ее и опустить в сосуд с кислородом, то от спички загорится и железо. Горение железа происходит с треском и разбрасыванием ярких раскаленных искр — расплавленных капель железной окалины Fe3O4. Реакцию горения железа в кислороде можно выразить следующим уравнением:
| железо+кислород | железная окалина — (смесь оксидов железа) |
Другие металлы также могут взаимодействовать с кислородом, хотя эти реакции не всегда сопровождаются горением. Если сильно нагреть медь в кислороде, она, не сгорая, превратится в черный порошок — оксид меди (II):
| медь — кислород | оксид меди (II) |
Рис. 17. Горение в кислороде: а — угля; б — серы; в — фосфора; г — железа
Вам уже известно, что при горении простых веществ образуются оксиды, теперь выясним, как происходит горение сложных веществ. При горении парафиновой свечи в химическом стакане на его стенках появляются капельки воды. Если в стакан налить известковую воду, то она мутнеет, что доказывает наличие оксида углерода. Таким образом, при горении сложного вещества образовались оксиды тех элементов, которые входят в состав сложного вещества. Парафин состоит из двух элементов — углерода и водорода.
Медленное окисление
Если какое-либо вещество медленно реагирует с кислородом, то теплота выделяется постепенно. Такой процесс называется медленным окислением.
Это явление наблюдается довольно часто. Например, в процессе гниения (окисления) навоза выделяется теплота, которая может использоваться в парниках.
♦ Вещества, при горении которых выделяется большое количество теплоты, называют топливом. На практике используют топливо трех видов: твердое, жидкое и газообразное.
К твердому топливу относятся антрацит, каменный уголь, бурый уголь, торф и дрова; к жидкому — продукты переработки нефти: бензин, керосин, мазут и др.; к газообразному — природный и попутный нефтяной газы, а также другие промышленные газы.
Условия возникновения и прекращения горения
Огонь возникает, когда есть три составляющие (схема 5). Первая — это топливо, которым может служить дерево, бумага, спирт, газ и т. д Второе, что необходимо, — это кислород, который взаимодействует с топливом, результатом чего является горение. Третья необходимая составляющая — это тепло. Только нагретое до определенной температуры топливо будет гореть в воздухе. Для того чтобы погасить огонь, необходимо или перекрыть доступ кислорода, или максимально понизить температуру, или устранить источник возгорания (то, что горит).
При тушении огня на пламя направляют углекислый газ или пену, которые затрудняют доступ воздуха к горючему веществу. Небольшие очаги пожара можно потушить, накрыв их сверху брезентом или одеялом. Можно также использовать песок. Для тушения угля или горящей древесины используют воду. Она охлаждает их, а образующиеся водяные пары затрудняют доступ воздуха.
Схема 5
Самое важное
Горение — это химическая реакция, при которой происходит окисление веществ с выделением теплоты и света. Горение веществ в воздухе происходит медленнее, чем в кислороде. При горении простых и сложных веществ образуются оксиды. Оксиды — это сложные вещества, состоящие из двух элементов, один из которых кислород.
Образование основных и кислотных оксидов
Изучая горение серы, фосфора и железа, вы убедились, что металлы и неметаллы горят в воздухе, образуя оксиды. Для изучения свойств оксидов проделаем следующие опыты.
Опыт 1
В фарфоровую чашку помещаем немного свежепрокаленного оксида кальция СаО, (жженая известь), обливаем его водой. При этом выделяется большое количество теплоты, что свидетельствует о протекании химической реакции. В результате образуется рыхлый порошок гашеной извести, при растворении которого в воде получается мыльный на ощупь раствор. Изменение окраски лакмуса в синюю подтверждает об образовании основания. Схема реакции оксида кальция с водой следующая:
оксид кальция + вода 
Таким образом, оксидам металлов соответствуют основания. Растворимые основания называются щелочами .
Растворимые в воде основания изменяют цвет индикаторов*.
* Информация индикаторах дана в § 11.
Из этого можно заключить, что оксиды металлов являются основными оксидами.
Опыт 2
Наливаем в химический стакан немного горячей воды, добавляем несколько капель раствора фиолетового лакмуса и сжигаем над водой в металлической ложечке красный фосфор. Образовавшийся в виде белого дыма оксид фосфора постепенно растворяется в воде, и образуется фосфорная кислота. Это подтверждает изменение окраски лакмуса на красную. Как видим, оксидам неметаллов соответствует кислота. Таким образом, оксиды неметаллов являются кислотными оксидами. Схема реакции:
оксид фосфора (V) + вода 
Самое важное
При горении металлов образуется основной оксид. Основным оксидам соответствуют основания. Растворимые основания называются щелочами. При горении неметаллов образуются кислотные оксиды, им соответствуют кислоты. Существуют вещества, которые под действием кислот и щелочей изменяют свой цвет. Эти вещества называются индикаторами.
Услуги по химии:
- Заказать химию
- Заказать контрольную работу по химии
- Помощь по химии
Лекции по химии:
- Основные понятия и законы химии
- Атомно-молекулярное учение
- Периодический закон Д. И. Менделеева
- Химическая связь
- Скорость химических реакций
- Растворы
- Окислительно-восстановительные реакции
- Дисперсные системы
- Атомно-молекулярная теория
- Строение атома в химии
- Простые вещества
- Химические соединения
- Электролитическая диссоциация
- Химия и электрический ток
- Чистые вещества и смеси
- Изменения состояния вещества
- Атомы. Молекулы. Вещества
- Химические реакции
- Закономерности химических реакций
- Периодическая таблица химических элементов
- Относительная атомная масса химических элементов
- Химические формулы
- Движение электронов в атомах
- Формулы веществ и уравнения химических реакций
- Химическая активность металлов
- Количество вещества
- Стехиометрические расчёты
- Энергия в химических реакциях
- Вода
- Необратимые реакции
- Кинетика
- Химическое равновесие
- Разработка новых веществ и материалов
- Зеленая химия
- Термохимия
- Правило фаз Гиббса
- Диаграммы растворимости
- Законы Рауля
- Растворы электролитов
- Гидролиз солей и нейтрализация
- Растворимость электролитов
- Электрохимические процессы
- Электрохимия
- Кинетика химических реакций
- Катализ
- Строение вещества в химии
- Строение твердого тела и жидкости
- Протекание химических реакций
- Комплексные соединения
Лекции по неорганической химии:
- Важнейшие классы неорганических соединений
- Водород и галогены
- Подгруппа кислорода
- Подгруппа азота
- Подгруппа углерода
- Общие свойства металлов
- Металлы главных подгрупп
- Металлы побочных подгрупп
- Свойства элементов первых трёх периодов периодической системы
- Классификация неорганических веществ
- Углерод
- Качественный анализ неорганических соединений
- Металлы и сплавы
- Металлы и неметаллы
- Производство металлов
- Переходные металлы
- Элементы 1 (1А), 2 IIA и 13 IIIA групп и соединения
- Элементы 17(VIIA), 16(VIA) 15(VA), 14(IVA) групп и их соединения
- Важнейшие S -элементы и их соединения
- Важнейшие d элементы и их соединения
- Важнейшие р-элементы и их соединения
- Производство неорганических соединений и сплавов
- Главная подгруппа шестой группы
- Главная подгруппа пятой группы
- Главная подгруппа четвертой группы
- Первая группа периодической системы
- Вторая группа периодической системы
- Третья группа периодической системы
- Побочные подгруппы четвертой, пятой, шестой и седьмой групп
- Восьмая группа периодической системы
- Водород
- Кислород
- Озон
- Водород
- Галогены
- Естественные семейства химических элементов и их свойства
- Химические элементы и соединения в организме человека
- Геологические химические соединения
Лекции по органической химии:
- Органическая химия
- Углеводороды
- Кислородсодержащие органические соединения
- Азотсодержащие органические соединения
- Теория А. М. Бутлерова
- Соединения ароматического ряда
- Циклические соединения
- Карбонильные соединения
- Амины и аминокислоты
- Химия живого вещества
- Синтетические полимеры
- Органический синтез
- Элементы 14(IVA) группы
- Азот и сера
- Растворы кислот и оснований